Результат интеллектуальной деятельности: ОПТИМИЗИРОВАННЫЙ ГЕН, КОДИРУЮЩИЙ РЕКОМБИНАНТНЫЙ БЕЛОК - АНАЛОГ ИНТЕРФЕРОНА БЕТА ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности к получению генетических конструкций, содержащих оптимизированную нуклеотидную последовательность, которая кодирует рекомбинантный белок - аналог интерферона бета.
Нуклеотидная последовательность, кодирующая рекомбинантный белок - аналог интерферона бета, оптимизирована для экспрессии в клетках Е. coli за счет использования кодонов, оптимальных для данной бактерии.
Нуклеотидная последовательность клонирована в плазмиды рЕТ30а и рЕТ32а. Эффективность экспрессии рекомбинантного белка - аналога интерферона бета составила более 50% в обоих случаях.
Биологическая активность выделенного рекомбинантного белка - аналога интерферона бета по уровню активации экспрессии гена-репортера под контролем МхА-промотера сравнима с интерфероном бета 1b.
Рассеянный склероз (PC) - хроническое воспалительное аутоиммунное заболевание, при котором поражается миелиновая оболочка головного и спинного мозга. Болезнь поражает людей в молодом возрасте, пик заболеваемости приходится на 30-35 лет. По данным ВОЗ, среди неврологических заболеваний PC является основной причиной стойкой инвалидизации лиц молодого возраста. Число вновь заболевших увеличивается во всех странах (на 5-6% ежегодно), при этом рост отмечается не только в традиционных для рассеянного склероза областях и этносах, но и в зонах, ранее свободных от него. Насчитывается 2-2,5 млн заболевших в мире, в России около 200 тысяч человек.
Для терапии данного заболевания применяют иммунномодуляторы, изменяющие течение PC, снижающие остроту обострений, увеличивающие протяженность ремиссии и тем самым замедляющие прогрессию заболевания. Одним из первых таких препаратов является интерферон бета, и до сих пор он используются в качестве лекарственного средства первой линии.
На рынке присутствуют интерферон бета 1a (Avonex, Rebif и Cinnovex) и интерферон бета 1b (Betaseron, Ронбетал). Первый является продуктом экспрессии в клетках млекопитающих и близок по структуре олигосахаридного остатка природному человеческому интерферону. Интерферон бета 1b экспрессируется в клетках E. coli, поэтому он, во-первых, не гликозилирован, во-вторых, лишен первого остатка метионина, отщепляемого клеточной протеазой. Дополнительно 25-30 лет назад в изучаемом аналоге интерферона была проведена замена Cys17Ser, что немного улучшило его физико-химические свойства. Оба типа интерферонов 1а и 1b оказывают похожее действие на больных PC, однако интерферона бета 1b необходимо брать в 10 раз большем количестве. Это связано с очень низкой остаточной антивирусной активностью интерферона бета 1b. Высокие дозы (300 мкг подкожно через день) вызывают у 48-52% пациентов, применяющих Betaseron, образование аутоантител в высоком титре. Это приводит к уменьшению эффективности лечения интерфероном бета 1b. Интерферон бета 1a Avonex применяют в дозах 22 мкг раз в неделю, антитела в высоком титре появляются только у 2-6% пациентов. Таким образом, повышение биологической активности и улучшение физико-химических свойств молекулы интерферона бета 1b является актуальной задачей. Поиски путей улучшения свойств интерферона бета 1b как отечественного препарата необходимы и по финансовым причинам. Сложность технологии получения и высокая стоимость препаратов интерферонов 1a (Avonex и Rebif) приводит к тому, что только около 10% страдающих PC проходят лечение интерферонами 1а.
Препарат на основе рекомбинантного белка - аналога интерферона бета представляет большой интерес для терапии PC, т.к. за счет высокого выхода при экспрессии в Е. coli будет иметь низкую себестоимость, а стало быть, будет более доступен для пациентов, нуждающихся в терапии PC, а проведение исследований этого препарата, в том числе доклинических и клинических, является актуальной задачей.
Природный ген, кодирующий интерферон бета человека не приспособлен для эффективной экспрессии в Е. coli. Это связано с наличием редко встречающихся в Е. coli кодонов AGG и AGA для аргинина, а также с наличием последовательностей, гомологичных регуляторным участкам генов Е. coli, что приводит к прерыванию трансляции либо инициации трансляции с внутренних участков гена (SD-сайты). Совокупность этих причин приводит к низкой эффективности экспрессии (не более 5%), что не позволяет разработать коммерчески выгодную технологию получения препаратов на основе интерферона бета.
Наличие неоптимальных для Е. coli кодонов характерно для всех генов, кодирующих интерфероны первого типа. Для преодоления этой проблемы используются оптимизированные гены, кодирующие целевые белки. В патенте RU 2354703 описана оптимизированная последовательность гена, кодирующая IL-21.
В патенте US 7642072 описана оптимизированная нуклеотидная последовательность гена, кодирующая интерферон бета 1b (прототип).
Заявителем разработана и получена нуклеиновая кислота, кодирующая рекомбинантный белок - аналог интерферона бета человека с SEQ ID NO: 2 и характеризующаяся нуклеотидной последовательностью SEQ ID NO: 1. Нуклеотидная последовательность клонирована в плазмиды рЕТ30а и рЕТ32а, в результате получены рекомбинантные плазмиды р30-В и р32-В. Рекомбинантными плазмидами р30-В и р32-В были трансформированы клетки Е. coli штамма BL21(DE3), получены стабильные штаммы-продуценты BL-30-B и BL-32-B.
Технический результат заявленного изобретения заключается в том, что полученная генетическая конструкция - нуклеиновая кислота, представленная SEQ ID NO: 1, позволяет эффективно синтезировать в клетках E. coli рекомбинантный белок интерферон бета с SEQ ID NO: 2 в количестве более 50% от суммарного клеточного белка в обоих случаях - в штаммах-продуцентах Е. coli BL-30-B и BL-32-B. Полученный рекомбинантный белок обладает выраженной IFNβ-активностью, что позволяет использовать его для терапии рассеянного склероза.
Краткое описание чертежей
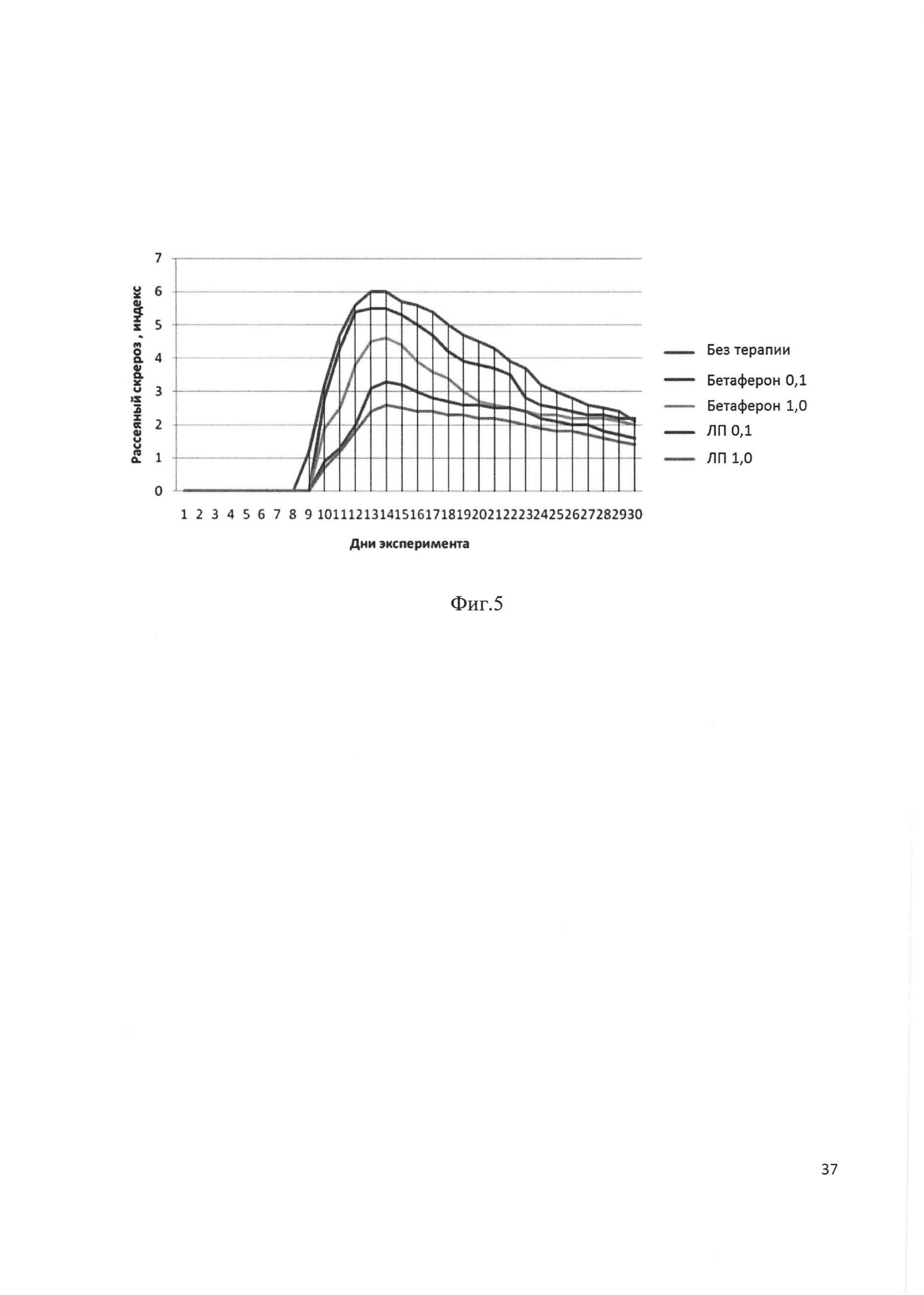
Фиг. 1. Электрофорез клонов E. coli BL21(DE3), трансформированных плазмидой р30-В после индукции. Стрелкой отмечен целевой продукт - рекомбинантный аналог интерферона бета человека. Трек 7 соответствует штамму-продуценту BL-30-B.
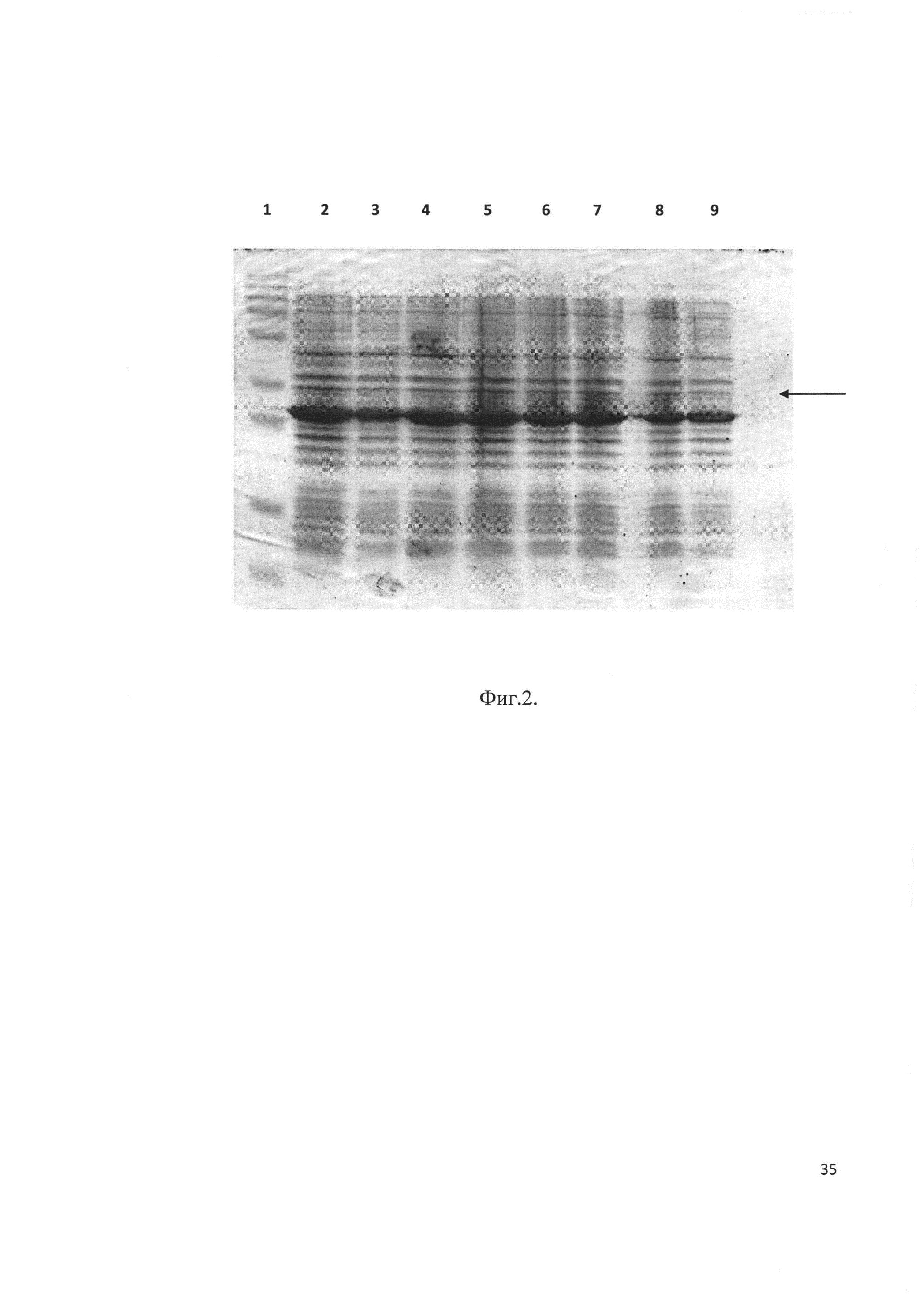
Фиг. 2. Электрофорез клонов E. Coli, трансформированных после индукции. Стрелкой отмечен целевой продукт - рекомбинантный аналог интерферона бета человека, слитый с тиоредоксином. Трек 2 соответствует штамму-продуценту BL-32-B.
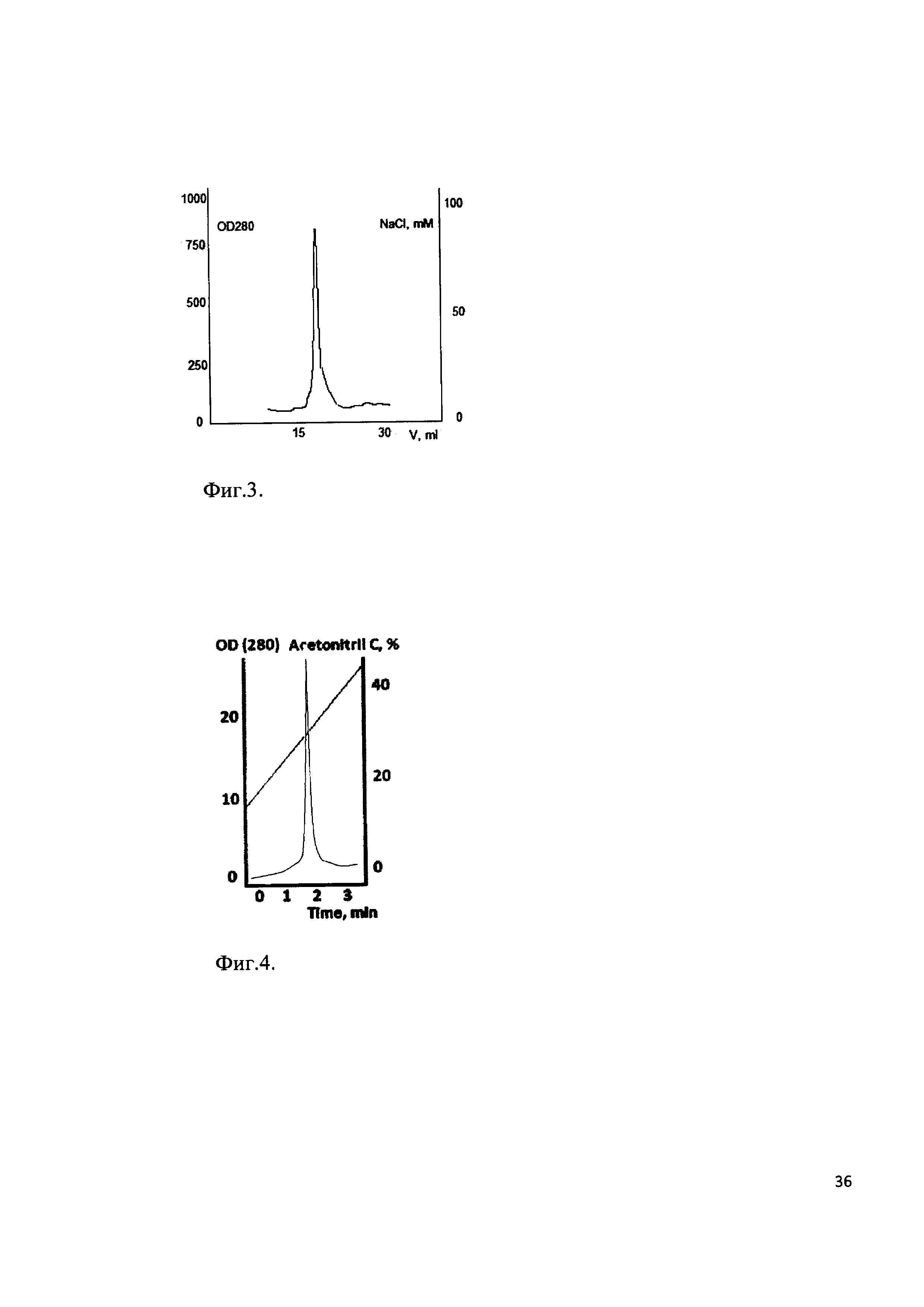
Фиг. 3. Хроматографический профиль прохождения рекомбинантного белка через SP-Sepharose. Мажорный пик соответствует выходу рекомбинантного белка - аналогу интерферона бета человека.
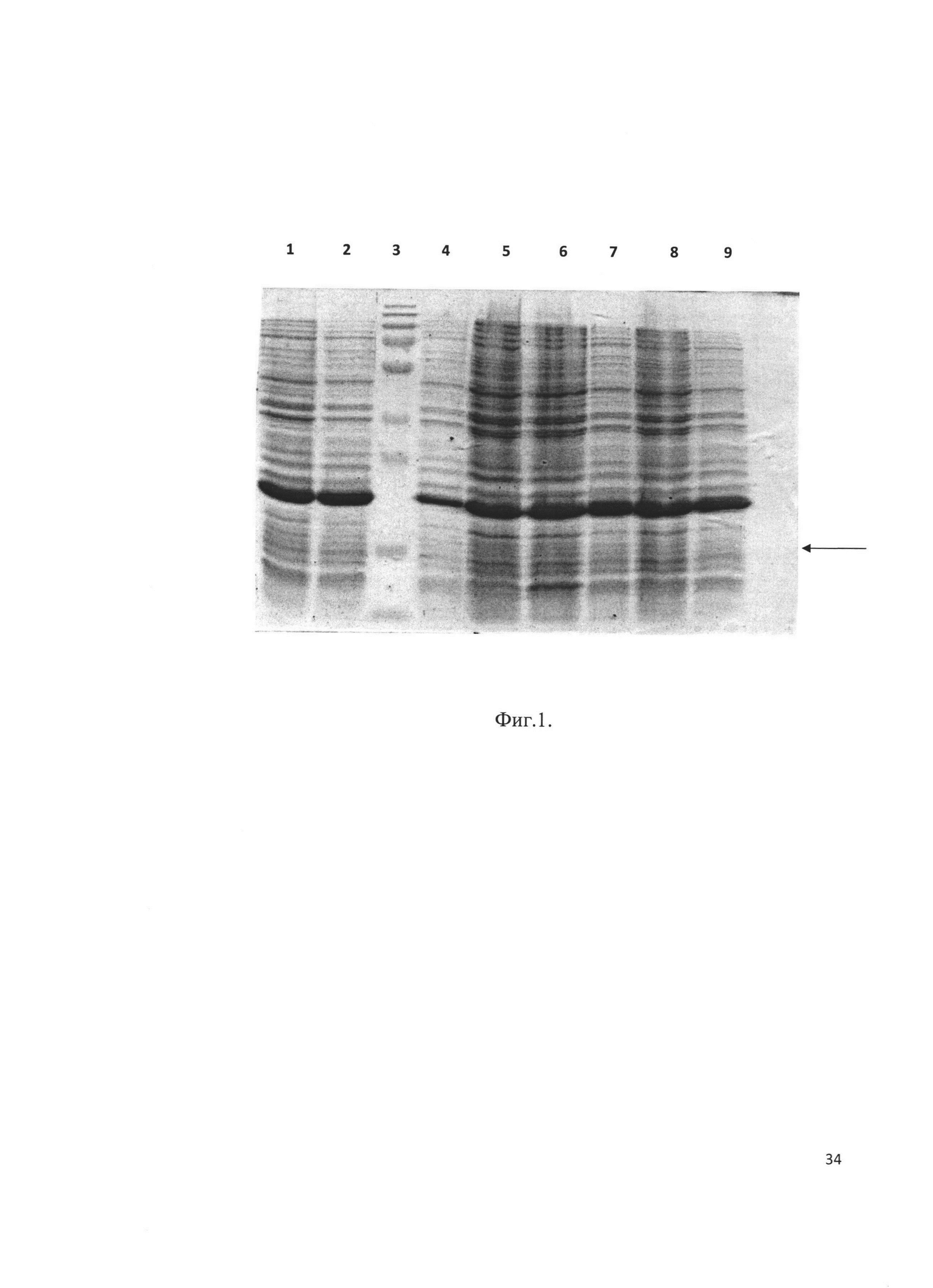
Фиг. 4. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона бета человека с аналитической колонки Kromasil 300-5С18.
Фиг. 5. Оценка эффективности терапии рекомбинантного белка - аналога интерферона бета человека на мышиной модели ЕАЕ (ЛП-рекомбинантный аналог интерферона бета).
Изобретение иллюстрируют примеры.
ПРИМЕР 1. Оптимизация нуклеотидной последовательности
Кодоны нуклеотидной последовательности, кодирующей рекомбинантный белок - аналог интерферона бета, были оптимизированы для экспрессии в клетках Е. coli путем замены на кодоны, часто встречаемые в геноме Е. coli K12. Частота использования кодонов в геноме Е. coli взята из: Y Nakamura, K Wada, Y Wada, Н Doi, S Kanaya, T Gojobori, and T Ikemura. Codon usage tabulated from the international DNA sequence databases. Nucleic Acids Res. 1996 Jan 1; 24(1): 214-215.
Дополнительно часть кодонов CTG, кодирующих лейцин, были заменены на кодоны ТТА или TTG, все кодоны AGC, кодирующие серии, были заменены на кодоны ТСТ или ТСС. Замены были введены для того, чтобы ликвидировать внутренние SD-сайты. Разработанная оптимизированная нуклеотидная последовательность показана на SEQ ID NO: 1.
ПРИМЕР 2. Получение плазмиды р30-В
Оптимизированную нуклеотидную последовательность, кодирующую рекомбинантный белок - аналог интерферона бета, гидролизовали ферментами рестрикции NdeI и HindIII. Коммерческую плазмиду рЕТ30а также гидролизовали ферментами рестрикции NdeI и HindIII. Продукты гидролиза разделяли с помощью электрофореза в 1% агарозе, продукты выделяли из геля, объединяли и лигировали с помощью Т4 ДНК-лигазы. Лигазной смесью трансформировали клетки XL-1, высевали на чашку Петри и инкубировали 16 часов при 37°С. Выросшие клоны анализировали на присутствие целевой плазмиды методом ПЦР. Клоны, содержащие рекомбинантную плазмиду, выращивали, из полученной биомассы выделяли целевой продукт - плазмиду р30-В.
ПРИМЕР 3. Получение плазмиды р32-В
Оптимизированную нуклеотидную последовательность, кодирующую рекомбинантный белок - аналог интерферона бета, гидролизовали ферментами рестрикции KpnI и HindIII. Коммерческую плазмиду рЕТ32а также гидролизовали ферментами рестрикции KpnI и HindIII. Продукты гидролиза разделяли с помощью электрофореза в 1% агарозе, продукты выделяли из геля, объединяли и лигировали с помощью Т4 ДНК-лигазы. Лигазной смесью трансформировали клетки XL-1, высевали на чашку Петри и инкубировали 16 часов при 37°С. Выросшие клоны анализировали на присутствие целевой плазмиды методом ПЦР. Клоны, содержащие рекомбинантную плазмиду, выращивали, из полученной биомассы выделяли целевой продукт - плазмиду р32-В.
ПРИМЕР 4. Получение штаммов-продуцентов
Плазмидами р30-В и р32-В трансформировали клетки Е. coli штамма BL21(DE3), высевали на чашку Петри и инкубировали 16 часов при 37°С. Выросшие клоны анализировали на экспрессию целевого белка методом электрофореза в ПААГ. Клоны, экспрессирующие наибольшее количество белка (Фиг. 1 и Фиг. 2), были отобраны как штаммы-продуценты BL-30-B и BL-32-B. Клетки штаммов-продуцентов выращивали и хранили при -70°С.
ПРИМЕР 5. Выделение рекомбинантного белка
Клетки штамма-продуцента пересевали в культуральную колбу с 200 мл LB, содержащим 25 мг/мл антибиотика канамицина. Культура выращивалась на шейкере при 280 об/мин при температуре 37°С до достижения оптической плотности значения OD585=0,8E. Индукция экспрессии белка проводилась добавлением IPTG до концентрации 1 mM. Культура дополнительно культивировалась 4 часа, далее клетки осаждались центрифугированием при 5000g. Осадок клеток лизировали в 8 М мочевине и обрабатывали на ультразвуковом дезинтеграторе. Лизат клеток центрифугировали при 20000g 2 часа. Супернатант фильтровали через колонку с Q-Sepharose. Фракцию, не связавшуюся с данным сорбентом, хроматографировали на SP-Sepharose в градиенте NaCl (стартовый буфер: 20 mM TrisHCl рН 6,8, 20 mM NaCl, итоговый буфер 20 mM TrisHCl рН 6,8, 400 mM NaCl). Хроматографический профиль представлен на Фиг. 3. Фракции, содержащие целевой продукт объединяли и диализовали в 10 mM уксусную кислоту. Чистоту продукта анализировали методом ВЭЖХ (Фиг. 4). Биологическая активность выделенного рекомбинантного белка - аналога интерферона бета в системе A549/VSV составила 1,8⋅109 Ед/мкмоль.
ПРИМЕР 6. Дизайн экспресс-теста биологической активности полученного рекомбинантного белка-аналога интерферона бета
Для анализа биологической активности полученного рекомбинантного белка используют метод иммуноферментного анализа (ELISA), известный специалисту в данной области техники.
В экспресс-тесте на нитроцеллюлозную мембрану сорбируют антитела к rec-IFNβ (1 мкл) и 1 мкл мышиных антител. Мембрану блокируют ФБСТ и помещают на адсорбирующий носитель. На мембрану в районе нанесения мишени наносят пробы, промывают ФБСТ и наносят цветной реагент. В качестве реагента в тесте использованы антитела, полученные при истощении сыворотки компонентами rec-IFNβ и конъюгированные с кумасси R250, и антимышиные антитела (Sigma), конъгированные с этим же красителем. Если в растворе есть rec-IFNβ, она взаимодействует с мембраной и проявляется цветным конъюгатом. В результате появляются два интенсивных пятна. В противном случае проявляется только пятно контроля проведения теста.
Получение данных для валидации по рекомбинантному аналогу интерферона бета - оценка предела обнаружения
В анализируемом растворе определяли подлинность рекомбинантного аналога интерферона бета (rec-IFNβ). Готовили водные растворы с различной концентрацией rec-IFNβ. Результаты представлены в таблице 1.
Все растворы, до концентрации 1 нг/мл были определены с точностью на 100% как положительные, растворы с концентрацией 200 пг/мл были определены как положительные с точностью 90%, с концентрации от 50 пг/мл и ниже точность определения ниже.
Получение данных для валидации по рекомбинантному белку аналогу интерферона бета - определение специфичности
Готовили раствор, содержащий рекомбинантный белок - аналог интерферона бета в концентрации 1000 мкг/мл в воде. Разбавляя данный раствор, получали растворы с концентрациями: 500 мкг/мл, 50 мкг/мл, 5 мкг/мл, 500 нг/мл, 50 нг/мл и 5 нг/мл. Все растворы тестировались экспресс-методикой. Результаты представлены в таблице 2.
ПРИМЕР 7. Изучение специфической активности и механизмов действия in vitro рекомбинантного белка - аналога интерферона бета
Рекомбинантный аналог интерферона бета (rec-IFNβ) предназначен для лечения рассеянного склероза. Патогенез рассеянного склероза связан с пролиферацией аутореактивных клонов Т- и В-клеток, которые способны взаимодействовать с миелиновой оболочкой нервной ткани спинного и головного мозга и индуцировать воспаление, что в итоге приводит к нарушению функции центральной нервной системы и двигательной функции организма (развитие паралича). Учитывая особенности патогенеза этого заболевания, разрабатываемые препараты для его лечения должны обладать антипролиферативной активностью, т.е. подавлять рост и деление клеток. Поэтому в рамках данного этапа работы было запланировано изучение антипролиферативной активности рекомбинантного аналога интерферона бета и механизмов его действия.
Оценка антипролиферативной активности рекомбинантного аналога интерферона бета в экспериментах in vitro
Обоснование выбора модели
Исследование проведено с использованием следующих клеточных линий: OVCAR3, DAUDI, А549, т.к. они имеют рецепторы к интерферонам и часто используются для проведения исследований антипролиферативной активности интерферонов. Исследование антипролиферативной активности проведено при широком диапазоне концентраций: 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ, 0,01 пМ.
Материалы и методы
Клеточная линия OVCAR3 - это клетки карциномы яичника человека. Данная культура является адгезионной и широко используется в исследованиях in vitro.
Клеточная линия DAUDI - это клетки лимфомы Беркитта. Данная культура является суспензионной, имеет поверхностные маркеры для Fc фрагмента IgG, рецепторов комплемента и поверхностно связанных иммуноглобулинов.
Клеточная линия А549 - это клетки карциномы легкого человека. Данная культура является адгезионой, чувствительна к вирусам (аденовирус, простой герпес, парагрипп 2 и 3, цитомегаловирус, везикулярный стоматит, полиовирусы) и имеет рецепторы к интерферонам.
Клетки OVCAR3, DAUDI и А549 засеивали в 96-луночный планшет в количестве 5 тыс. кл./лунку в объеме 100 мкл/лунку полной среды DMEM, содержащей 10% фетальной сыворотки, 300 мг/л L-глутамина и антибиотик гентамицин 100 мг/л. Инкубировали клетки в течение суток в CO2-инкубаторе при 37°С в 5% атмосфере CO2. После инкубации клетки отмывали от сывороточной среды DMEM, для этого отбирали из лунок старую среду DMEM и, не касаясь монослоя с помощью многоканальной пипетки, вносили по 100 мкл/лунку стерильного физиологического раствора, инкубировали в течение 5 мин, затем отбирали физиологический раствор, не касаясь монослоя клеток. После проведения отмывки вносили образцы исследуемого препарата в следующих разведениях: 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ, 0,01 пМ, в объеме 100 мкл полной среды DMEM. В качестве контроля использовали коммерческий препарат «Бетаферон», который вносили в аналогичных концентрациях. Далее клетки инкубировали 48 часов, в CO2-инкубаторе при 37С в 5% атмосфере CO2. После инкубации определяли жизнеспособность клеток в колориметрическом тесте с использованием красителя МТТ. Для этого к клеткам вносили краситель МТТ (концентрация 4 мг/мл) в количестве 25 мкл/лунку и инкубировали в течение 4 часов в CO2-инкубаторе при 37°С в 5% атмосфере CO2. После инкубации для лизиса клеток вносили SDS в количестве 50 мкл/лунку и проводили инкубацию 24 часа, в CO2-инкубаторе при 37°С в 5% атмосфере CO2. После инкубации измеряли оптическую плотность с помощью спектрофотометра Reader MPR1 (ScoTech, Германия) при длинах волн 570 и 650 нм.
Как уже упомянуто выше, в качестве метода контроля антипролиферативной активности использовали колориметрический тест, основанный на способности живых клеток восстанавливать бледно-желтый краситель МТТ в краситель формазан интенсивного пурпурного цвета. При этом интенсивность окрашивания клеток снижается со снижением их роста (пролиферации). Интенсивность окрашивания клеток оценивали с помощью спектрофотометра Reader MPR1 (ScoTech, Германия) при длинах волн 570 и 650 нм.
Полученные значения интенсивности окрашивания (оптической плотности) клеток, не обработанных каким-либо препаратом (концентрация испытуемых веществ = 0 пМ), принимали за 100% и относительного этого значения выражали в процентах остальные значения интенсивности окрашивания для всех концентраций исследуемых веществ. Затем строили график зависимости интенсивности окрашивания (в процентах) от концентрации тестируемых веществ и рассчитывали значения ЕС50 - концентрацию тестируемого вещества, необходимую для снижения роста клеток на 50%, измеряемую в пикомолях (пМ).
Статистический анализ данных
Статистический анализ полученных данных проводят методом вариационной статистики с помощью простого сравнения средних по двухстороннему t-критерию Стьюдента. Различия определяли при 0,05 уровне значимости.
Расчет выполняют на персональном компьютере с использованием приложения Microsoft Excel 2010 (Microsoft Corp.USA) и пакета статистического анализа данных Statistica 8.0 for Windows (StatSoft Inc., USA).
Результаты
Антипролиферативная активность в сравнении с коммерческим препаратом Бетаферон была изучена в шести десятикратных разведениях. Как и ожидалось, коммерческий препарат сравнения "Бетаферон" проявлял выраженную антиролиферативную активность; ЕС50 составила от 0,3±0,46 до 0,1±0,03 пМ в зависимости от культуры клеток. При этом антипролиферативная активность рекомбинантного аналога интерферона бета превосходит таковую у коммерческого препарата Бетаферон, т.к. требуется меньшая концентрация полученного рекомбинантного белка для аналогичного ингибирования клеточной пролиферации (таблица 3).
Таким образом, рекомбинантный аналог интерферона бета по антипролиферативной активности превосходит активность коммерческого препарата Бетаферон (интерферон бета 1b).
ПРИМЕР 8. Изучение противовирусной активности рекомбинантного белка - аналога интерферона бета в экспериментах in vitro
Помимо изучения антипролиферативной активности необходимо изучение противовирусных свойств, поскольку в международной практике мерилом биологической активности интерфероновых препаратов служит именно противовирусная активность, измеряемая в международных единицах (ME).
Обоснование выбора модели
Для проведения исследований была выбрана клеточная линия А549 (карцинома легкого человека), т.к. она имеет рецепторы к интерферонам и часто применяется для изучения антивирусных свойств различных типов интерферонов, включая разные варианты бета-интерферонов. Кроме того, данная клеточная линия чувствительна к инфекции вирусом везикулярного стоматита (VSV штамм Indiana).
Для изучения механизмов противовирусного действия использована клеточная линия А549 (карцинома легкого человека), т.к. она имеет рецепторы к интерферонам. Известно, что после связывания с рецептором на поверхности клеток интерферон бета 1b индуцирует передачу внутриклеточного сигнала посредством белковых факторов STAT1 и STAT2 в ядро клетки и тем самым запускает экспрессию генов противовирусной защиты, таких как гены MX и ISG56. В связи с этим в рамках данной тест-системы в клетки А549, содержащие на своей поверхности рецепторы к интерферону бета 1b, методом трансфекции внедряют плазмиды, кодирующие репортреный ген галактозидазы Gal под контролем промоторов генов MX и ISG56; соответствующие названия плазмид pMX-Gal и pISG56-Gal. Таким образом, выбранная тест-система позволяет оценить механизм противовирусного действия, в частности оценить, опосредуется ли противовирусная активность активацией генов MX и ISG56, как это описано для природного интерферона бета 1b.
Для исследования противовирусной активности был выбран широкий диапазон концентраций: 10000 пМ, 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ и 0,01 пМ. В качестве препарата сравнения использовали идентичные концентрации коммерческого препарата Бетаферон.
Материалы и методы
Тестирование противовирусной активности проводили с использованием культуры клеток А549. Для этого клетки засеивали в 96-луночный планшет в количестве 20 тыс. кл./лунку в объеме 100 мкл/лунку полной среды Игла-MEM (содержащей 10% фетальной сыворотки 300, мг/л L-глутамина и антибиотик гентамицин 100 мг/мл). Затем инкубировали в течение суток CO2-инкубаторе при 37°С в 5% атмосфере CO2. После инкубации культуру клеток отмывали от сывороточной среды Игла-MEM, для этого снимали старую среду и, не касаясь монослоя, с помощью многоканальной пипетки вносили по 100 мкл/лунку стерильного физиологического раствора, инкубировали в течение 5 мин, затем отбирали физиологический раствор, не касаясь монослоя клеток, и вносили по 100 мкл/лунку безсывороточной среды Игла-MEM.
После отмывки в культуру клеток вносили исследуемый рекомбинантный белок, а также препарат сравнения в десятикратных разведениях (10000 пМ, 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ, 0,01 пМ) с последующим ингибированием в течение 1 суток в CO2-инкубаторе при 37°С в 5% атмосфере CO2. В качестве отрицательного контроля использовали клетки, не обработанные каким-либо препаратом.
После инкубации в культуру клеток вносили вирус VSV, штамм Indiana в дозе 100 LD50 на лунку. После внесения вируса в лунки, клетки инкубировали в течение 2 суток в CO2-инкубаторе при 37°С до появления цитопатического действия. После чего проводили визуальную оценку противовирусной активности препарата с помощью световой микроскопии, а именно подсчитывали количество лунок с клетками, погибшими в результате репродукции вируса.
Противовирусную активность исследуемых препаратов изучали с использованием вируса везикулярного стоматита VSV, штамм Indiana, взятого в дозе 100 LD50/лунку. Результат оценивали с помощью световой микроскопии и выражали в ЕС50 - эффективная концентрация препарата, при которой наблюдается 50% протективный противовирусный эффект.

где ЕС50 - концентрация препарата, дающего 50%-ный противовирусный эффект;
Dmax - двоичный логарифм разведения, выше которого произошла 100%-ная защита;
d - двоичный логарифм шага разведения (1 в случае двоичного титрования);
n - количество лунок на каждую дозу препарата (4);
р - количество лунок, давших защиту в Dmax и в последующих разведениях.
Изучение механизмов противовирусной активности препаратов проводили с использованием культуры клеток А549. Для этого клетки засеивали в 96-луночный планшет в количестве 20 тыс. кл./лунку в объеме 100 мкл/лунку полной среды Игла-MEM. Инкубировали в течение суток в CO2-инкубаторе при 37°С в 5% атмосфере CO2. После инкубации культуру клеток отмывали от сывороточной среды Игла-MEM, для этого снимали старую среду и, не касаясь монослоя, с помощью многоканальной пипетки, вносили по 100 мкл/лунку стерильного физиологического раствора, инкубировали в течение 5 мин, затем отбирали физиологический раствор, не касаясь монослоя клеток, и вносили по 100 мкл/лунку бессывороточной среды Игла-MEM.
После отмывки проводили трансфекцию клеток 300 нг плазмиды pMX-Gal или pISG56-Gal с использованием набора реагентов Escort IV (Sigma) в соответствии с рекомендациями производителя. Трансфецированная культура клеток инкубировалась в течение суток в CO2-инкубаторе при 37°С в 5% атмосфере CO2. Далее повторяли процедуру отмывки и вносили исследуемые препараты и коммерческий препарат сравнения Бетаферон (стандарт) в пяти следующих концентрациях: 10 нM, 1 нM, 100 пM, 10 пM, 1 пM. После внесения проводили инкубацию в течение 18 часов в CO2-инкубаторе при 37°С в 5% атмосфере CO2. После окончания инкубации клетки промывали, как описано выше, и лизировали лизирующим буфером (Sigma), в дальнейшем в лизаты вносили 50 мкл субстрата p-Nitrophenyl β-D-glucopyranoside (Sigma) и измеряли оптическую плотность раствора лизата с помощью микропланшетного фотометра Reader MPR1 (ScoTech, Германия) при длине волны 360 нм. Значения оптической плотности раствора лизата клеток были прямо пропорциональны количеству фермента галактозидазы, которая закодирована плазмидами.
Для изучения механизма противовирусной активности полученного рекомбинантного белка использовали тест-систему на основе клеток А549, которые имеют на своей поверхности рецепторы к интерферону бета 1b, а также на основе двух рекомбинантных плазмид, которые методом химической трансфекции внедряли в данные клетки, несущие репортерный ген галактозидазы Gal, под контролем либо MX- либо ISG56-промотера. В результате данная тест система по степени окрашивания галактозидазой субстрата позволяла оценивать, активируются ли гены MX и ISG56 в ответ на обработку клеток полученным рекомбинантным белком. При этом активность галактозидазы (определяемая по оптической плотности) была прямо пропорциональна степени активации генов MX и ISG56.
Результаты
Было показано, что коммерческий препарат сравнения "Бетаферон" проявлял выраженную противовирусную активность по отношению к модельному вирусу VSV, а значения ЕС50 составили 0,3 пМ. Противовирусная активность rec-IFNβ статистически значимо превосходила таковую у коммерческого препарата Бетаферон, т.к. требуется меньшая концентрация rec-IFNβ для аналогичного ингибирования клеточной пролиферации (Таблица 4).
Для rec-IFNβ и коммерческого препарата Бетаферон был изучен механизм специфического противовирусного действия на культуре клеток А549 с использованием pMX-Gal и pISG56-Gal. Было показано, что коммерческий препарат сравнения, как и ожидалось, активирует промоторы генов противовирусной защиты MX и ISG56, о чем можно судить по дозозависимому увеличению содержания репортерного фермента - галактозидзы; значения оптической плотности возрастали от 0,01 до 0,044 оптических единиц для промотора MX и 0,04 до 0,35 для промотора ISG56.
При этом рекомбинантный аналог интерферона бета проявил более выраженную способность активировать промоторы генов MX (0,82) и ISG56 (1,52) соответственно. Результаты активации промоторов генов MX и ISG56 полученного rec-IFNβ в сравнении с коммерческим препаратом сравнения представлены в таблице 5 и таблице 6.
Таким образом, rec-IFNβ проявляют выраженную противовирусную активность, превосходящую таковую у коммерческого препарата Бетаферон. Механизмы действия рекомбинантного аналога интреферона бета аналогичны механизму действия коммерческого препарата Бетаферон и опосредуются активацией генов противовирусной защиты MX и ISG56.
ПРИМЕР 9. Изучение специфической активности и механизмов действия in vivo рекомбинантного аналога интреферона бета
Помимо исследований in vitro для rec-IFNβ крайне важно было изучить специфическую активность в экспериментах in vivo на лабораторных животных, чтобы оценить, каким образом внутримышечное введение влияет на клинические проявления рассеянного склероза (паралич).
Обоснование выбора модели
В данном исследовании в качестве тест-системы использовали экспериментальную модель аутоиммунного энцефаломиелита (ЕАЕ) на мышах линии C57BL/6, которые являются стандартным объектом для воспроизведения данной патологии. Рассеянный склероз - это аутоиммунное заболевание, связанное с развитием и пролиферацией аутореактивных клонов Т- и В-клеток, направленных против белка миелина спинного и головного мозга. Разрушение миелина приводит к нарушениям в центральной нервной системе и к нарушению двигательной функции организма (к параличу). Модель ЕАЕ у мышей по соответствующим молекулярным механизмам близка патологической картине человека.
Для индукции ЕАЕ мышам в дозе 20-50 мкг/мышь вводили пептид MOG35-55 (MEVGWYRSPFSRWHLYRNGK), который имитирует эпитоп миелина в смеси с 100 мкг/мышь полного адъюванта Фрейнда (ПАФ), усиливающего иммунный ответ на пептид. В итоге у животных развивалась иммунная реакция на пептид, заключающаяся в пролиферации Т- и В-лимфоцитов и продукции антител, специфичных к пептиду. Поскольку данный пептид гомологичен миелину, то пролиферирующие Т- и В-клетки, а также антитела связывались с миелином, индуцировали при этом воспалительную реакцию, что в итоге приводило к нарушению центральной нервной системы мышей и развитию паралича.
Полученный рекомбинантный белок вводили внутримышечно, т.к. данный способ введения рекомендуем для последующего клинического использования. Разрабатываемый препарат исследовали в двух дозах 0,1 и 1 мМоль/мышь, что соответствовало 1 и 10 ТД.
Материалы и методы
Для индукции экспериментального аутоиммунного энцефаломиелита (ЕАЕ) мышам двукратно вводили пептид MOG35-55 (MEVGWYRSPFSRVVHLYRNGK) в дозе 100 мкг, эмульгированый в полном адъюванте Фрейнда (ПАФ), содержащий туберкулин в концентрации 5 мг/мл. Инъекции MOG35-55 на 1-й день производили подкожно в двух точках, вдоль позвоночного столба, а на 3-й день в подошвы задних лап.
Дополнительно в день инъекций MOG35-55, мышам внутрибрюшинно вводили раствор Pertussis toxin (Calbiochem, США) в количестве 500 нг/мышь в 200 мкл ФБС для увеличения проницаемости гематоэнцефалического барьера, чтобы пролиферируюцие аутореактивные клоны Т- и В-клеток достигали головного мозга.
Полученный рекомбинантный белок и контрольный препарат сравнения - Бетаферон вводили животным через день внутримышечно в объеме 100 мкл попеременно в правую и левую заднюю лапу в дозе 0,1 и 1 нМоль/мышь. Экспериментальные группы и дизайн доз вводимых препаратов представлены в таблице 7.
Для оценки специфической активности рекомбинантного аналога интерферона бета у животных определяли неврологический статус. Его оценку проводили ежедневно с момента начала эксперимента, регистрируя продолжительность течения болезни, тяжесть проявления заболевания. Параметр тяжести заболевания оценивается по шкале неврологических нарушений в баллах по клиническим индексам (КИ), приведенным в таблице 8.
Мышей с КИ 1-3 считали легко болеющими, с КИ 4-6 - тяжело болеющими. Мышей с КИ более 7 выводили из эксперимента в соответствии с инструкциями по уходу за животными.
Как уже было упомянуто, патогенез рассеянного склероза (PC) включает в себя опосредованное Т- и В-лимфоцитами повреждение миелиновой оболочки нервных волокон, что приводит к разрушению аксонов и нейронов и потере функций центральной нервной системы, связанной с физическим и психоэмоциональным состоянием больного.
Патофизиология ЕАЕ основана на реакции иммунной системы против мозгоспецифических антигенов. Эта реакция вызывает воспаление и разрушение основных несущих конструкций нервной ткани - аксонов и нейронов, что сопоставимо с нарушениями, наблюдаемыми у больных PC, следовательно, данную модель можно считать адекватной для изучения рассматриваемых нами параметров.
В процессе исследования rec-IFNβ мы получили следующие результаты, представленные на фиг. 5 и в таблице 9. Через неделю после индукции у мышей состояния ЕАЕ мы наблюдали рост КИ у всех экспериментальных групп, однако максимальный рост КИ происходил у животных без терапии (получавших ФСБ), особи, получавшие препарат rec-IFNβ, демонстрировали дозозависимое снижение клинических проявлений заболевания. Максимальный КИ был зарегистрирован у животных без терапии на 13-14 дни эксперимента и составлял 6 единиц. Животные, получавшие терапию Бетафероном, демонстрировали незначительный спад в тяжести течения заболевания (КИ 5,5 и 4,5 единицы в зависимости от дозы). Группы, которым вводился исследуемый rec-IFNβ, показывали самое мягкое течение болезни с максимальным зарегистрированным КИ 3,2 при дозе препарата 0,1 нМ/мышь, что соответствовало 1 ТД, и 2,5 при дозе препарата 1,0 нМ/мышь, что соответствовало 10 ТД.
Полученные на мышиной модели ЕАЕ данные свидетельствуют о том, что разработанный рекомбинантный аналог интерферона проявляет выраженную специфическую активность и более эффективен для терапии рассеянного склероза по сравнению с препаратом Бетаферон.
Таким образом, полученная генетическая конструкция - нуклеиновая кислота, представленная SEQ ID NO: 1, позволяет эффективно синтезировать в клетках E. coli рекомбинантный белок интерферон бета с SEQ ID NO: 2 в количестве более 50% от суммарного клеточного белка в обоих случаях - в штаммах-продуцентах Е. coli BL-30-B и BL-32-B. Полученный рекомбинантный белок обладает выраженной IFNβ-активностью, что позволяет использовать его для для терапии рассеянного склероза.











Перечень последовательностей
<110> ФГБУ "ГНЦ Институт иммунологии" ФМБА России
<120> «Оптимизированный ген, кодирующий рекомбинантный белок-аналог интерферона бета человека»
<160> NUMBER OF SEQ ID NOS: 2
<210> SEQ ID NO 1
<211> 496
<212> DNA
<213> artificial
<400> SEQUENCE 1:
TCTTATAATTTATTAGGATTTTTACAACGTTCTTCTAATTTTCAATCTCAAAAATTATT TGGCAGCTGAACGGTCGTCTGGAATACTGCCTGAAAGATCGTATGAACTTCGATATC CCAGAAGAAATCAAACAGCTGCAACAGTTCCAGAAAGAAGATGCAGCTCTGACCATCTACGAAATGCTGCAGAACATCTTCGCAATCTTCCGTCAAGATAGCTCCTCTACTGGTTGGAACGAAACCATCGTTGAAAATCTGTTAGCTAACGTGTACCATCAGATCAATCATCTGAAAACCGTGCTTGAAGAAAAACTCGAAAAAGAAGATTTCACTCGTGGTAAACTGATGAGTTCTCTGCATCTGAAACGTTACTATGGTCGTATCCTCCACTACCTGAAAGCTAAAGAGTACAGCCATTGCGCATGGACGATCGTGCGTGTTGAAATTCTGCGTAACTTCTACTTTATCAATCGCCTCACCGGCTACCTGCGTAAC
<210> SEQ ID NO 2
<211> 165
<212> AA (amino acid)
<213> artificial
<400> SEQUENCE 2:
SYNLLGFLQRSSNFQSQKLLWQLNGRLEYCLKDRMNFDIPEEIKQLQQFQKEDAALTIYEMLQNIFAIFRQDSSSTGWNETIVENLLANVYHQINHLKTVLEEKLEKEDFTRGKLMSSLHLKRYYGRILHYLKAKEYSHCAWTIVRVEILRNFYFINRLTGYLRN