Результат интеллектуальной деятельности: СЛОЖНОЭФИРНЫЕ ПРОЛЕКАРСТВА [3-(1-(1H-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ)-2-МЕТИЛФЕНИЛ]МЕТАНОЛА
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка претендует на приоритет Временной патентной заявки США №61/383370, поданной 16 сентября 2010 г., полное раскрытие которой включено в данное описание путем ссылки.
УРОВЕНЬ ТЕХНИКИ
1. Область изобретения
Изобретение относится к области фармацевтических соединений, в частности сложноэфирных пролекарств [3-(1-(1Н-имидазол-4-ил)этил)-2-метилфенил]метанола и его энантиомеров. Кроме того, изобретение касается способов получения указанных фармацевтических соединений, содержащих их композиции, и их применения для лечения и предупреждения заболевания.
2. Краткое описание уровня техники
Три альфа-1 и три альфа-2 адренергических рецепторов охарактеризованы молекулярными и фармакологическими методами. Активация указанных альфа-рецепторов вызывает физиологические ответы с полезными терапевтическими эффектами.
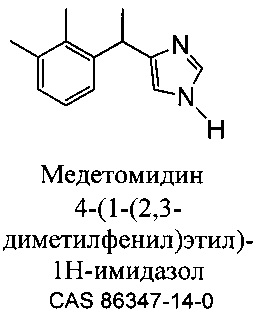
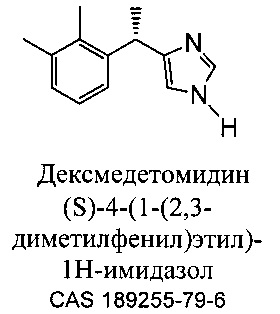
Соединение, 4-[1-(2,3-диметилфенил)этил]-3H-имидазол, в общем известное как медетомидин, является агонист альфа-2 адренергических рецепторов для применения с целью седации у животных. Соль гидрохлорид (S) энантиомера медетомидина, в общем известная как дексмедетомидин, (S) 4-[1-(2,3-диметилфенил)этил]-3H-имидазол, также показана для применения в качестве седативного или анальгетического средства у кошек и собак.
Метаболит дексмедетомидина, представляющий собой (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанол, вместе с его рацемической смесью, [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанолом, описан Hui, Y.-H. с соавт. в литературе в Journal of Chromatography, (1997), 762 (1+2), 281-291.
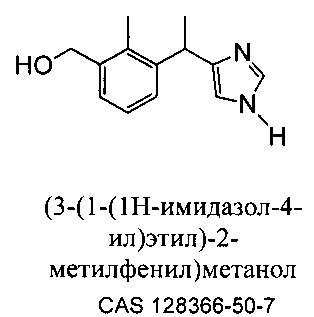
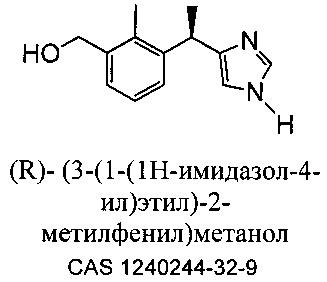
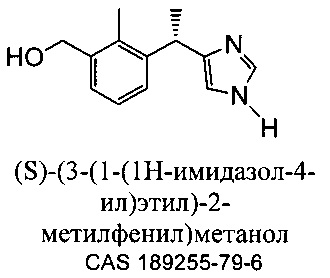
[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанол описан Stoilov с соавт. в "Synthesis of detomidine and medetomidine metabolites: 1,2,3-trisubstituted arenes with 4'(5')-imidazolylmethyl groups" в Journal of Heterocyclic Chemistry (1993), 30 (6), (1645-1651).
Kavanagh с соавт. описали [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанол в "Synthesis of Possible Metabolites of Medetomidine {1-(2,3-dimethylphenyl)-1-[imidazol-4(5)-yl]ethane" в Journal of Chemical Research, Synopses (1993), (4), 152-3. [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил)метанол] описан Salonen с соавт. в "Biotransformation of Medetomidine in the Rat" в Xenobiotica (1990), 20 (5), 471-80. В международной заявке PCT WO 2010093930 A1 раскрыт [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанол и его (S) и (R) энантиомеры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает данные сравнительного исследования длительности действия соединений согласно настоящей заявке и WO 2010093930.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении предлагаются сложноэфирные пролекарства [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, способы их получения, содержащие их фармацевтические композиции и их применение в качестве фармацевтических средств. При гидролитическом и/или ферментном расщеплении сложного эфира высвобождаются функциональные группы исходного соединения, [3-(1-(1Н-имидазол-4-ил)этил)-2-метилфенил]метанола, и действуют как селективный модулятор альфа 2 адренергических рецепторов.
В другом аспекте данного изобретения предлагаются сложноэфирные пролекарства (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, способы их получения, содержащие их фармацевтические композиции и их применение в качестве фармацевтических средств. При гидролитическом и/или ферментном расщеплении сложного эфира высвобождаются функциональные группы исходного соединения, активного метаболита, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, и действуют как селективный модулятор альфа 2 адренергических рецепторов.
В другом аспекте данного изобретения предлагаются сложноэфирные пролекарства (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, способы их получения, содержащие их фармацевтические композиции и их применение в качестве фармацевтических средств. При гидролитическом и/или ферментном расщеплении сложного эфира высвобождаются функциональные группы исходного соединения, (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, и действуют как селективный модулятор альфа 2 адренергических рецепторов.
Указанные новые соединения пригодны для лечения или профилактики у животных, в том числе у человека, ряда заболеваний и состояний, которые облегчаются активацией альфа 2А, 2В, 2С, включая, но не ограничиваясь этим:
лечение или предупреждение глаукомы, повышенного внутриглазного давления, ишемической невропатии, невропатии зрительного нерва, боли, висцеральной боли, боли в роговице, головной боли, мигрени, онкологической боли, боли в спине, боли в результате синдрома раздраженного кишечника, мышечной боли и связанной с диабетической невропатией боли, лечение диабетической ретинопатии, других дегенеративных состояний сетчатки, инсульта, когнитивных дефицитов, нейропсихиатрических состояний, лекарственной зависимости и пристрастия, отмены симптомов, обсессивно-компульсивных расстройств, ожирения, инсулинорезистентности, связанных со стрессом состояний, диареи, диуреза, заложенности носа, спастичности, расстройств с дефицитом внимания, психозов, тревожности, депрессии, аутоиммунного заболевания, болезни Крона, гастрита, болезни Альцгеймера и болезни Паркинсона, амиотрофного латерального склероза, других нейродегенеративных заболеваний, состояний кожи, эритемы (покраснения) кожи и воспаления, акне, возрастной дегенерации желтого пятна, влажной дегенерации желтого пятна, сухой дегенерации желтого пятна, географической атрофии, диабетического отека желтого пятна, опухолей, заживления ран, воспаления и окклюзии вены сетчатки, улучшение зрения у больных со снижением зрения в результате таких состояний как глаукома, пигментный ретинит и вторичный по отношению к рассеянному склерозу неврит, розовые угри (расширения кровеносных сосудов непосредственно под кожей), солнечный ожог, хроническое повреждение под действием солнца, неяркие эритемы, псориаз, розовые угри, связанные с менопаузой приливы, приливы в результате орхиэктомиатопического дерматита, фотостарение, себорейный дерматит, аллергический дерматит, покраснение кожи, телеангиэктазия (расширение ранее существующих маленьких кровеносных сосудов) на лице, ринофимия (гипертрофия носа с расширением фолликул), красный грушевидный нос, акнеподобные повреждения кожи (могут сочиться или покрываться коркой), ощущение жжения или покалывания на лице, раздраженные, налитые кровью и водянистые глаза, кожная эритема, гиперактивность кожи с расширением кровеносных сосудов кожи, синдром Лайелла, синдром Стивенса-Джонсона, малая мультиформная эритема, большая мультиформная эритема и другие воспалительные заболевания кожи.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым соединениям, которые являются сложноэфирными пролекарствами [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола и (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола в качестве полезных для терапевтических целей альфа-2 агонистов.
В предпочтительном варианте воплощения данное изобретение относится к сложноэфирным пролекарствам (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола в качестве полезных для терапевтических целей альфа-2 агонистов. При гидролитическом или ферментном расщеплении сложного эфира функциональные группы исходного соединения, активного метаболита, (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, высвобождаются и действуют как селективный модулятор альфа-2 адренергических рецепторов.
В одном из аспектов изобретение касается фармацевтической композиции, содержащей, в существенной степени состоящей из или состоящей из терапевтически эффективного количества сложноэфирных пролекарств [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или его энантиомеров, диастереомеров, гидратов, сольватов, кристаллических форм и отдельных изомеров, таутомеров или его фармацевтически приемлемых солей.
В другом аспекте изобретение касается фармацевтической композиции, содержащей, в существенной степени состоящей из или состоящей из терапевтически эффективного количества сложноэфирных пролекарств (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или его энантиомеров, диастереомеров, гидратов, сольватов, кристаллических форм и отдельных изомеров, таутомеров или его фармацевтически приемлемых солей.
В другом аспекте изобретение касается фармацевтической композиции, содержащей, в существенной степени состоящей из или состоящей из терапевтически эффективного количества сложноэфирных пролекарств (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или его энантиомеров, диастереомеров, гидратов, сольватов, кристаллических форм и отдельных изомеров, таутомеров или его фармацевтически приемлемых солей.
"Пролекарства" часто обозначают термином "метаболически расщепляемые производные", который обозначает формы соединений, быстро превращающиеся in vivo в исходное соединение согласно изобретению, например, гидролизом в крови. Таким образом, пролекарства являются соединениями, несущими группы, которые удаляются путем биопревращения до того, как проявить свое фармакологическое действие. Такие группы включают фрагменты, которые легко отщепляются in vivo от несущих их соединений, где соединение после расщепления остается или становится фармакологически активным. Такие метаболически отщепляемые группы представляют собой класс, хорошо известный практикующим специалистам в данной области. Они включают, не ограничиваясь этим, такие группы, как алканоил (т.е. ацетил, пропионил, бутирил и т.п.), незамещенный и замещенный карбоциклический ароил (такой как бензоил, замещенный бензоил и 1- и 2-нафтоил), алкоксикарбонил (такой как этоксикарбонил), триалкилсилил (такой как триметил- и триэтилсилил), моноэфиры, образованные с дикарбоновыми кислотами (такие как сукцинил), фосфат, сульфат, сульфонат, сульфонил, сульфинил и т.п. Соединения, несущие метаболически отщепляемые группы, обладают тем преимуществом, что они могут проявлять улучшенную биодоступность как результат повышенной растворимости и/или скорости абсорбции, присущих исходному соединению, благодаря присутствию метаболически отщепляемой группы (Т. Higuchi and V. Stella, "Pro-drugs as Novel Delivery System", Vol. 14 A.C.S. Symposium Series; "Bioreversible Carriers in Drug Design", ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987).
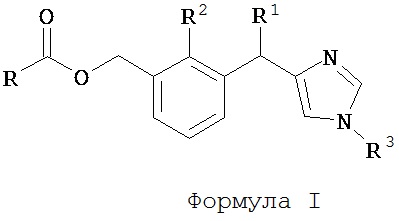
В одном аспекте изобретения, таким образом, предлагается соединение Формулы I, его отдельные энантиомеры, его отдельные диастереоизомеры, его отдельные гидраты, его отдельные сольваты, его отдельные кристаллические формы, его отдельные изомеры, его отдельные таутомеры или его фармацевтически приемлемая соль,
 ,
,
где
R1 является Н или С1-3 алкилом;
R2 является Н или С1-3 алкилом;
R3 является Н, C1-10 алкилом, гетероциклом или арилом; и
R является C1-10 алкилом, гетероциклом или арилом.
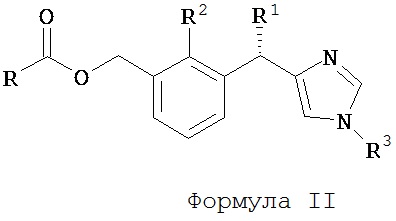
В предпочтительном аспекте изобретения предлагается соединение Формулы II, его отдельные энантиомеры, его отдельные диастереоизомеры, его отдельные гидраты, его отдельные сольваты, его отдельные кристаллические формы, его отдельные изомеры, его отдельные таутомеры или его фармацевтически приемлемая соль,
 ,
,
где
R1 является Н или С1-3 алкилом;
R2 является Н или C1-3 алкилом;
R3 является Н, C1-10 алкилом, гетероциклом или арилом; и
R является C1-10 алкилом, гетероциклом или арилом.
В другом аспекте изобретения, таким образом, предлагается соединение Формулы III, его отдельные энантиомеры, его отдельные диастереоизомеры, его отдельные гидраты, его отдельные сольваты, его отдельные кристаллические формы, его отдельные изомеры, его отдельные таутомеры или его фармацевтически приемлемая соль,
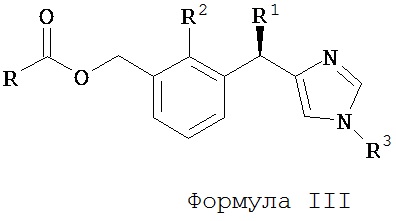 ,
,
где
R1 является Н или C1-3 алкилом;
R2 является Н или C1-3 алкилом;
R3 является Н, C1-10 алкилом, гетероциклом или арилом; и
R является C1-10 алкилом, гетероциклом или арилом.
В следующих абзацах приведены определения различных химических фрагментов, из которых состоят соединения по изобретению, которые предназначены для единого применения в описании и формуле изобретения, если явно не указано иное.
Термин "алкил" при использовании здесь определен как включающий насыщенный одновалентный алкановый фрагмент, имеющий неразветвленные или разветвленные алкановые фрагменты или их комбинации, содержащий 1-10 атомов углерода, предпочтительно 1-8 атомов углерода и более предпочтительно 1-4 атома углерода. Алкильные фрагменты, необязательно, могут быть замещены, не ограничиваясь этим, аминогруппами, арильными группами, атомами галогена. Один метилен (-СН2-) может быть заменен карбонилом, -NH-, карбоксилом, амидом, серой или кислородом. Примеры включают, не ограничиваясь этим, метил, этил, пропил, бутил, втор-бутил, пентил, изо-пентил, нео-пентил, гексил, изо-гексил, 3-метил-бутил, 2-амино-N-изобутилацетамид, изо-бутил, трет-бутил, изо-пропил, этилфенил, метилфенил, 2-амино-3-метил-бутанамид-N-2-метил-1-пропил, 1-амино-2-метил-проп-1-ил.
Термин "гетероцикл" при использовании здесь определен как ароматическое или неароматическое 5-10-членное моноциклическое или бициклическое кольцо, содержащее по меньшей мере один гетероатом, выбранный из О, или N, или S, или их комбинации, прерывающий структуру карбоциклического кольца. Гетероциклы, необязательно, могут быть замещены, не ограничиваясь этим, C1-6 алкилом, амино, галогеном, группами -O(C1-6 алкил), -OC(O)(C1-6 алкил), -C(O)O(C1-6 алкил), -NHC(O)(C1-6 алкил), -C(O)NH(C1-6 алкил), -S(C1-6 алкил). Примеры включают, не ограничиваясь этим, фурил, пиррил, пиридил, пиримидил, тиенил, изотиазолил, имидазолил, пиразинил, бензофуранил, хинолил, изохинолил, бензотиенил, изобензофурил, пиразолил, индолил, изоиндолил, бензимидазолил, пуринил, карбазолил, оксазолил, тиазолил, изотиазолил, 1,2,5-тиадиазолил, 1,2,4-тиадиазолил, изооксазолил, хиназолинил, пиридазинил, циннолинил, фталазинил, хиноксалинил, ксантинил, гипоксантинил, птеридинил, 5-азацитидинил, 5-азаурацилил, триазолопиридинил, имидазолопиридинил, пирролопиримидинил, пиразолопиримидинил, пирролидинил, пиперидинил и пиперазинил.
Термин "арил" при использовании здесь определен как включающий органический фрагмент, полученный из ароматического углеводорода, состоящего из моноциклического или бициклического кольца, содержащего 6-10 атомов углерода, путем удаления одного атома водорода, например фенил или нафтил. Арильные группы, необязательно, могут быть замещены, не ограничиваясь этим, C1-6 алкилом, амино, галогеном, группами -O(C1-6 алкил), -OC(O)(C1-6 алкил), -C(O)O(C1-6 алкил), -NHC(O)(C1-6 алкил), -C(O)NH(C1-6 алкил), -S(C1-6 алкил).
Примеры включают, не ограничиваясь этим, фенил, нафтил.
Термин "Н" при использовании здесь обозначает атом водорода.
Термин "О" при использовании здесь обозначает атом кислорода.
Термин "S" при использовании здесь обозначает атом серы.
Термин "N" при использовании здесь обозначает атом азота.
Термин "амино" при использовании здесь обозначает группу формулы - NH2.
Термин "амид" при использовании здесь обозначает группу формулы -C(O)NH- или -NHC(O)-.
Термин "галоген" при использовании здесь обозначает атом хлора, брома, йода или фтора.
Термин "карбонил" при использовании здесь обозначает группу формулы -С=O.
Термин "карбоксил" при использовании здесь обозначает группу формулы -С(O)O- или -ОС(O)-.
В общем R1 является Н или C1-3 алкилом. Предпочтительный R1 является C1-3 алкилом. Наиболее предпочтительный R1 является метилом.
В общем R2 является Н или С1-3 алкилом. Предпочтительный R2 является С1-3 алкилом. Наиболее предпочтительный R2 является метилом.
В общем R3 является Н, С1-10 алкилом, гетероциклом или арилом.
Предпочтительный R3 является Н, фенилом или C1-10 алкилом. Наиболее предпочтительный R3 является Н.
В общем R является C1-10 алкилом, гетероциклом или арилом. Предпочтительный R является метилом, изо-бутилом, трет-бутилом, изо-пропилом, этилфенилом, фенилом, 2-амино-1-фенилэтилом, 2-(2-амино-3-метил-бутириламино)-2-метил-проп-1-илом, 1-амино-2-метил-проп-1-илом, 2-(2-амино-ацетиламино)-2-метил-проп-1-илом. Наиболее предпочтительные группы R являются трет-бутилом, изо-пропилом.
При использовании здесь "таутомер" обозначает миграцию протонов между смежными одинарными и двойными связями. Процесс таутомеризации является обратимым. Соединения, описанные здесь, могут подвергаться любой возможной таутомеризации, которая находится в пределах физических характеристик соединения. Ниже приведен пример таутомеризации, который встречается в соединениях, описанных здесь:
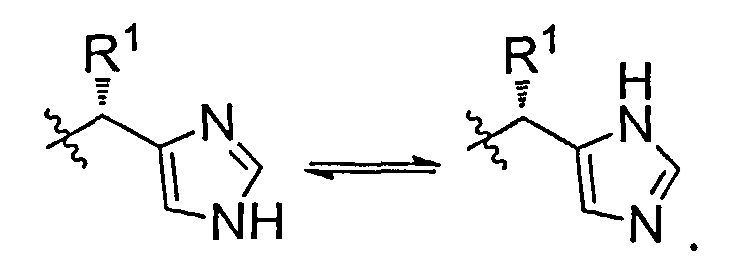
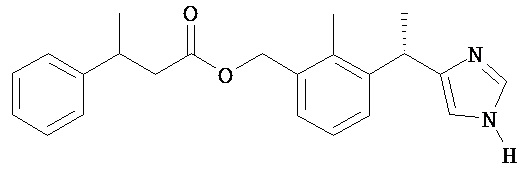
Соединениями по изобретению являются:
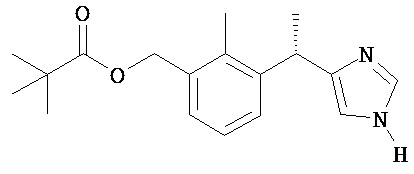
изо-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2,2-диметил-пропионовой кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
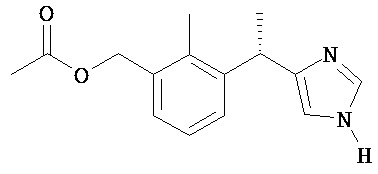
уксусной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
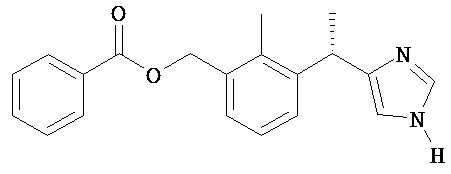
бензойной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
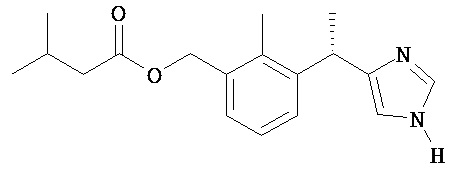
3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
3-фенил-пропионовой кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-амино-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-(2-амино-3-метил-бутириламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-(2-амино-ацетиламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-амино-3-фенил-пропионовой кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир.
Промежуточными соединениями по изобретению являются:
изо-масляной кислоты 3-[(S)-1-(1-изо-бутирил-1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2,2-диметил-пропионовой кислоты 3-{(S)-1-[1-(2,2-диметил-пропионил)-1H-имидазол-4-ил]-этил}-2-метил-бензиловый эфир;
уксусной кислоты 3-[(S)-1-(1-ацетил-1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
бензойной кислоты 3-[(S)-1-(1-бензоил-1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
3-метил-масляной кислоты 2-метил-3-{(S)-1-[1-(3-метил-бутирил)-1H-имидазол-4-ил]-этил}-бензиловый эфир;
фенил-пропионовой кислоты 2-метил-3-{(S)-1-[1-(3-фенил-пропионил)-1H-имидазол-4-ил]-этил}-бензиловый эфир;
2-трет-бутоксикарбониламино-3-метил-масляной кислоты 3-{(S)-l-[1-(2-трет-бутоксикарбониламино-3-метил-бутирил)-1H-имидазол-4-ил]-этил}-2-метил-бензиловый эфир;
2-трет-бутоксикарбониламино-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-(2-трет-бутоксикарбониламино-3-метил-бутириламино)-3-метил-масляной кислоты 3-{(S)-1-[1-(2-трет-бутоксикарбониламино-3-метил-бутирил)-1Н-имидазол-4-ил]-этил}-2-метил-бензиловый эфир;
2-(2-трет-бутоксикарбониламино-3-метил-бутириламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-(2-трет-бутоксикарбониламино-ацетиламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир;
2-трет-бутоксикарбониламино-3-фенил-пропионовой кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир.
Некоторые соединения Формулы I, Формулы II и Формулы III и некоторые из их промежуточных соединений имеют по меньшей мере один стереогенный центр в своей структуре. Этот стереогенный центр может присутствовать в (R) или (S) конфигурации, где указанные обозначения (R) и (S) используются в соответствии с правилами, описанными в Pure Appli. Chem. (1976), 45, 11-13.
Соединения согласно данному изобретению могут существовать в различных полиморфных формах. Хотя в приведенной выше формуле это не указано явно, такие формы считаются включенными в объем данного изобретения.
Соединения Формулы I, Формулы II или Формулы III и их соли могут существовать в форме сольвата, который включен в объем данного изобретения. Такие сольваты включают, например, гидраты, алкоголяты и т.п.
Термин "фармацевтически приемлемые соли" обозначает соли или комплексы, которые сохраняют желательную биологическую активность идентифицированных выше соединений и проявляют минимальные или не проявляют нежелательных токсикологических эффектов. "Фармацевтически приемлемые соли" в соответствии с изобретением включают терапевтически активные, нетоксичные формы соли основания или кислоты, которые могут образовывать соединения Формулы I, Формулы II или Формулы III.
Форма кислотно-аддитивной соли соединения Формулы I, Формулы II или Формулы III, которая встречается в свободной форме как основание, может быть получена обработкой свободного основания с использованием соответствующей кислоты, такой как неорганическая кислота, например, не ограничиваясь этим, хлористоводородная кислота, бромоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и т.п.; или органическая кислота, такая как, не ограничиваясь этим, лимонная кислота, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, аскорбиновая кислота, бензойная кислота, таниновая кислота, пальмитиновая кислота, альгиновая кислота, полиглютаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая и полигалактуроновая кислота, а также основно-аддитивные соли, например, образованные щелочными и щелочно-земельными металлами, такими как натрий, калий и кальций, и т.п. (Handbook of Pharmaceutical Salts, P.Heinrich Stahal & Camille G. Wermuth (Eds), Verlag Helvetica Chemica  , 2002, 329-345).
, 2002, 329-345).
Соединения также могут вводиться в виде фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, которые конкретно включают, не ограничиваясь этим, четвертичную соль аммония формулы -NY+Z-, где Y является водородом, алкилом или бензилом, и Z является противоионом, включая, но не ограничиваясь этим, хлорид, бромид, йодид, -O- алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (например, фумарат, бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, бензоат, циннамат, манделат, бензилат и дифенилацетат).
В другом варианте воплощения изобретения предложены фармацевтические композиции, содержащие по меньшей мере одно соединение по изобретению в фармацевтически приемлемом носителе. Фраза "фармацевтически приемлемый" означает, что носитель, разбавитель или вспомогательное вещество должны быть совместимыми с другими ингредиентами композиции и не должны наносить вреда реципиенту.
Фармацевтические композиции по данному изобретению могут применяться в форме твердого вещества, раствора, эмульсии, суспензии, пластыря, мицеллы, липосомы и т.п., где полученная композиция содержит одно или более соединений по данному изобретению в качестве активного ингредиента, в смеси с органическим или неорганическим носителем или вспомогательным веществом, подходящим для энтерального или парентерального применения. Соединения по изобретению могут быть объединены, например, с обычными нетоксичными, фармацевтически приемлемыми носителями для таблеток, гранул, капсул, суппозиториев, растворов, эмульсий, суспензий и любой другой формы, пригодной для применения. Носители, которые могут быть использованы, включают, не ограничиваясь этим, глюкозу, лактозу, акациевую камедь, желатин, маннит, крахмальную пасту, магния трисиликат, тальк, кукурузный крахмал, кератин, коллоидный кремния диоксид, картофельный крахмал, мочевину, среднецепочечные триглицериды, декстраны и другие носители, пригодные для использования в производстве препаратов в твердой, полутвердой или жидкой форме. Кроме того, могут применяться адъюванты, стабилизаторы, загустители, красители и ароматизаторы. Соединения по изобретению вводят в фармацевтическую композицию в количестве, достаточном для получения желательного эффекта при патологическом процессе или состоянии.
Фармацевтические композиции, содержащие соединения по изобретению, могут быть в форме, подходящей для перорального применения, например таблетки, пастилки, леденцы, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы или сиропы, или эликсиры. Композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым способом, известным в данной области техники для производства фармацевтических композиций, и такие композиции могут содержать один или более агентов, выбранных из группы, состоящей из: подсластителя, такого как сахароза, лактоза или сахарин; ароматизаторов, таких как мята перечная, винтергриновое масло или вишня; красителей и консервантов, для получения изящных с фармацевтической точки зрения композиций с приемлемым вкусом. Таблетки, содержащие соединения по изобретению в смеси с нетоксичными, фармацевтически приемлемыми вспомогательными веществами, также могут быть произведены известными способами. Используемые вспомогательные вещества могут представлять собой, например, (1) инертные разбавители, такие как кальция карбонат, лактоза, кальция фосфат или натрия фосфат; (2) средства для гранулирования и дезинтегранты, такие как кукурузный крахмал, картофельный крахмал или альгиновая кислота; (3) связующие вещества, такие как трагакантовая камедь, кукурузный крахмал, желатин или акациевая камедь, и (4) смазывающие вещества, такие как магния стеарат, стеариновая кислота или тальк. Таблетки могут быть без покрытия, или на них может быть нанесено покрытие известными методами с целью замедления распада и всасывания в желудочно-кишечном тракте, и, таким образом, обеспечения беспрерывного действия на протяжении более длительного периода. Например, может использоваться пролонгирующий материал, такой как глицерилмоностеарат или глицерилдистеарат. В некоторых случаях композиции для перорального применения могут быть в форме твердых желатиновых капсул, где соединения по изобретению смешаны с инертным твердым разбавителем, например кальция карбонатом, кальция фосфатом или каолином. Они также могут быть в форме мягких желатиновых капсул, где изобретение по соединению смешивают с водной или масляной средой, например арахисовое масло, жидкий парафин или оливковое масло.
Фармацевтические композиции могут приобретать форму стерильной инъекционной суспензии. Такая суспензия может быть получена в соответствии с известными способами с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном, приемлемом для перорального введения разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Стерильные, нелетучие масла традиционно используются в качестве растворителя или среды для суспендирования. Для этой цели может использоваться любое прозрачное нелетучее масло, в том числе синтетические моно- или диглицериды, жирные кислоты (в том числе олеиновая кислота), природные растительные масла, такие как кунжутное масло, кокосовое масло, арахисовое масло, хлопковое масло и т.д., или синтетические жирные носители, такие как этилолеат и т.п. Буферы, консерванты, антиоксиданты и т.п. могут быть введены при необходимости.
Данное изобретение также касается применения соединения Формулы I, Формулы II или Формулы III или их фармацевтически приемлемой соли для производства лекарственного средства для терапевтического применения. Данное изобретение также касается способа производства медикамента, предназначенного для терапевтического применения, где используется соединение, имеющее общую Формулу I, Формулу II или Формулу III или его фармацевтически активное производное, или его соль.
Поскольку у отдельных субъектов может присутствовать широкий спектр симптомов, и каждое лекарственное средство обладает собственными уникальными терапевтическими характеристиками, точная схема введения и дозы для каждого субъекта остаются на усмотрение практикующего специалиста. Пациенту будут вводить соединение перорально в любой приемлемой форме, такой как таблетка, жидкость, капсула, порошок и т.п., или другими способами, которые могут быть желательными или необходимыми, в частности, если пациент страдает от тошноты. Такие другие способы могут включать, без исключения, трансдермальный, парентеральный, подкожный, интраназальный, через имплантированный стент, интратекальный, в стекловидное тело, местно в глаз, за глаз, внутримышечный, внутривенный и интраректальный способы введения. Фактическое количество соединения для введения в любом конкретном случае будет определяться врачом с учетом сопутствующих обстоятельств, таких как тяжесть состояния, возраст и вес пациента, общее физическое состояние пациента, причина состояния и способ введения. Дополнительно композиции могут быть разработаны для замедления высвобождения активного соединения на протяжении данного периода времени или для тщательного контроля количества лекарственного средства, высвобожденного в данное время в ходе курса лечения.
Сложноэфирные пролекарства [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола и их фармацевтически приемлемые соли могут быть введены различными способами, включая, но не ограничиваясь этим, местные глазные капли, прямая инъекция, введение за глаз или композиции, которые могут дополнительно усиливать длительность действия, такие как гранула замедленного высвобождения, суспензия, гель или устройства для беспрерывного введения, такие как любая подходящая система доставки лекарственных средств (СДЛС), известная в данной области техники. Хотя местное применение является предпочтительным, указанное соединение также может применяться во внутриглазном импланте, как описано в патенте США 7931909, который включен сюда путем ссылки. Такие биосовместимые внутриглазные импланты содержат сложноэфирные пролекарства [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола и полимер, связанный со сложноэфирными пролекарствами [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, для облегчения их высвобождения в глазу на протяжении длительного периода времени.
Глазные препараты лекарственных продуктов хорошо известны в данной области техники и описаны, например, в публикации Патентной заявки США №20050059583, №20050277584, патентах США №7297679 и №20070015691, а также патентах США под номерами 5474979 и 6582718, раскрытие которых включено в данное описание путем ссылки. Сложноэфирные пролекарства [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола, (S) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола или (R) [3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола могут быть введены в композиции с усиливающими эффективность компонентами, как раскрыто в патенте США №7491383 В2, который включен сюда путем ссылки в полном объеме.
При ссылке на соединение или соединения данное изобретение предназначено включать такое соединение в виде каждого из его возможных изомерных форм и их смесей, если только нет специального указания на конкретную изомерную форму.
Данное изобретение также касается способа получения соединения общей Формулы I, Формулы II или Формулы III.
Схема синтеза показана ниже и иллюстрирует, каким образом соединения согласно изобретению могут быть получены. Специалисты в данной области техники смогут шаблонно модифицировать и/или адаптировать следующую схему для синтеза любого соединения по изобретению, охваченного Формулой I, Формулой II или Формулой III.
Общая схема синтеза сложноэфирных пролекарств (S)-[3-(1-(1H-имидазол-4-ил)-2-метилфенил]метанола
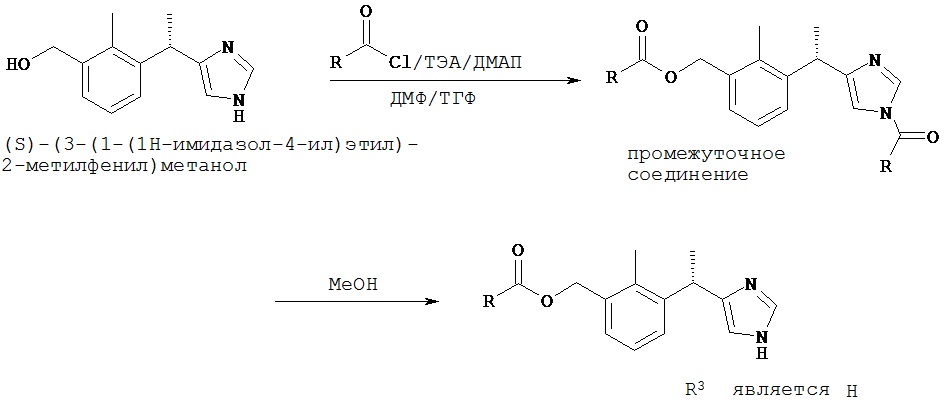
На первой стадии (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанол (CAS 189255-79-6) может реагировать с желательным хлорангидридом кислоты в присутствии N,N-диметилформамида (ДМФА), тетрагидрофурана (ТГФ), триэтиламина (ТЭА) и 4-диметиламинопиридина (ДМАП). После типичной обработки экстракцией остаток может быть очищен жидкостной хроматографией при среднем давлении (ЖХСД) (от 0% до 40% этилацетата в гексане) с получением промежуточного соединения в виде твердого вещества.
На второй стадии промежуточное соединение, полученное в первой реакции, может реагировать с метанолом (МеОН). Остаток может быть очищен ЖХСД (50% этилацетата в гексане, затем 5% 7 н. аммиака/метанол/дихлорметан) с получением целевого соединения в виде твердого вещества.
Следует понимать, что предыдущее общее описание и последующее подробное описание предназначены только для примера и объяснения и не ограничивают заявленное изобретение. В данном описании использование единственного числа включает множественное число, если конкретно не указано иное.
Данное изобретение включает все фармацевтически приемлемые, обогащенные изотопами соединения. Любое соединение по изобретению может содержать один или более атомов, обогащенных изотопами или отличающихся от природного соотношения, таких как дейтерий 2H (или D) вместо протия 1Н (или Н) или использование обогащенного 13С материала вместо 12С и т.п. Подобные замены могут использоваться для N, О и S. Применение изотопов может быть полезным для аналитических, а также терапевтических аспектов изобретения. Например, использование дейтерия может увеличивать период полувыведения in vivo путем изменения метаболизма (скорости) соединения по изобретению. Указанные соединения могут быть получены в соответствии с методами получения, описанными для применения обогащенных изотопами реагентов.
Следующие примеры приведены только для целей иллюстрации и не предназначены, а также не должны интерпретироваться как ограничивающие изобретение каким-либо способом. Специалисты в данной области техники поймут, что вариации и модификации следующих примеров могут быть произведены без отхода от сущности и объема изобретения.
Названия по ИЮПАК соединений, указанных в примерах, были сгенерированы с помощью ACD, версия 8.
Если иное не указано в примерах, соединения охарактеризованы в соответствии со следующими методами:
Спектры ЯМР регистрировали па приборе Varian 300 МГц и получали при комнатной температуре. Значения химических сдвигов приведены в пропромилле со ссылкой на внутренний ТМС или на сигнал остаточного растворителя.
Все реагенты, растворители, катализаторы, синтез которых не описан, были приобретены у химических поставщиков, таких как Sigma Aldrich, Fluka, Lancaster, однако, некоторые известные промежуточные соединения в реакциях, для которых указан регистрационный номер CAS, были получены авторами в соответствии с известными методиками.
Как правило, соединения по изобретению очищали флеш-колоночной хроматографией.
|
Пример 1
Промежуточное соединение 1
изо-Масляной кислоты 3-[(S)-1-(1-изобутирил-1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
К раствору (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола (1,34 г, 6,2 ммоль) в ДМФА (8 мл) и ТГФ (50 мл) добавляют ТЭА (3,5 мл, 24,8 ммоль), ДМАП (780 мг, 6,2 ммоль) и изо-бутирилхлорид (2,18 г, 20,5 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 16 часов, гасят H2O и экстрагируют этилацетатом. Объединенные органические фракции промывают солевым раствором, сушат над Na2SO4 и упаривают при сниженном давлении. Остаток очищают ЖХСД (от 0% до 40% этилацетата в гексане) с получением Промежуточного соединения 1 в виде твердого вещества.
1Н-ЯМР (CD3ОD, δ пропромилле): 1,15 (д, J=7,03 Гц, 6Н), 1,26 (д, 6Н, J=6,74 Гц), 1,56 (д, J=7,03 Гц, 3Н), 2,34 (с, 3Н), 2,58 (гепт, J=7,03 Гц, 1Н), 3,34 (гепт, J=7,74 Гц, 1Н), 4,42 (к, J=7,03 Гц, 1Н), 5,15 (с, 2Н), 7,07-7,10 (м, 2Н), 7,12-7,15 (м, 1Н), 7,31(с, 1Н), 8,35 (с, 1Н).
Промежуточные соединения 2-6 получают способом, сходным со способом, описанным в Примере 1, начиная с (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола. Хлорангидрид использовался в каждом случае, и результаты приведены в табл. 1 ниже.
|
Пример 2
Соединение 1
изо-Масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
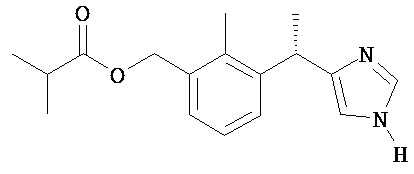
Промежуточное соединение 1 растворяют в МеОН (50 мл), смесь перемешивают при комнатной температуре в течение 24 часов и затем упаривают при сниженном давлении. Остаток очищают ЖХСД (50% этилацетата в гексане, затем 5% 7 н. NH3/МеОН/ДХМ) с получением Соединения 1 в виде твердого вещества.
1Н-ЯМР (CD3OD; δ пропромилле): 1,15 (д, J=7,03 Гц, 6Н), 1,54 (д, J=7,03 Гц, 3Н), 2,33 (с, 3Н), 2,56 (гепт, J=7,03 Гц, 1Н), 4,42 (к, J=7,03 Гц, 1Н), 5,15 (с, 2Н), 6,70 (с, 1Н), 7,07-7,10 (м, 2Н), 7,12-7,15 (м, 1Н), 7,55 (с, 1Н).
Соединения 2-6 по изобретению получают в соответствии с методикой, описанной в Примере 2, реакцией соответствующего промежуточного соединения с метанолом. Результаты приведены в табл. 2 ниже.
Таблица 2
|
|
Пример 3
Промежуточное соединение 7
2-трет-Бутоксикарбониламино-3-метил-масляной кислоты 3-{(S)-1-[1-(2-трет-бутокси карбониламино-3-метил-бутирил)-1H-имидазол-4-ил]-этил}-2-метил-бензиловый эфир
К раствору (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола (216 мг, 1,0 ммоль) в ДМФА (2 мл) и ТГФ (12 мл) добавляют ЭДКИ (671 мг, 3,5 ммоль), ДМАП (427 мг, 3,5 ммоль) и Boc-L-валин (651 мг, 3,0 ммоль). Смесь перемешивают при комнатной температуре в течение 16 часов, гасят H2O и экстрагируют этилацетатом. Объединенные органические фракции промывают Н2О, солевым раствором и сушат над Na2SO4, и упаривают при сниженном давлении. Остаток очищают колоночной хроматографией (30% этилацетата в гексане) с получением Промежуточного соединения 7 в виде твердого вещества белого цвета.
1Н-ЯМР (CD3OD; δ пропромилле): 0,85-1,01 (м, 12Н), 1,20-1,48 (м, 18Н), 1.56 (д, J=7,03 Гц, 3Н), 2,01-2,20 (м, 2Н), 2,35 (с, 3Н), 4,03 (м, 1Н), 4,42 (к, J=7,03 Гц, 1Н), 4,60-4,65 (м, 1Н), 5,15-5,29 (м, 2Н), 7,10-7,20 (м, 2Н), 7,20-7,25 (м, 1Н), 7,33 (с, 1Н), 8,44 (с, 1Н).
Пример 4
Промежуточное соединение 8
2-трет-Бутоксикарбониламино-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
Названное в заголовке соединение получают из Промежуточного соединения 7 (600 мг, 0,98 ммоль) в 30 мл МеОН в соответствии с методикой, описанной в Примере 2.
1Н-ЯМР (CD3OD; δ пропромилле): 0,85-0,95 (м, 6Н), 1,42 (м, 9Н), 1,54 (д, J=7,03 Гц, 3Н), 2,05 (м, 1Н), 2,33 (с, 3Н), 4,00 (д, J=6,15 Гц, 1Н), 4,40 (к, J=7,03 Гц, 1Н), 5,15-5,28 (м, 2Н), 6,67 (с, 1Н), 7,10-7,20 (м, 2Н), 7,20-7,25 (м, 1Н), 7,55 (с, 1Н).
Пример 5
Соединение 7
2-Амино-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
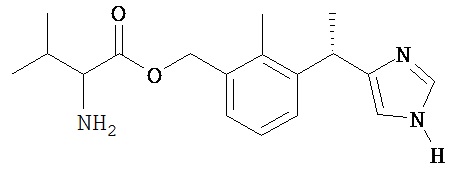
К Промежуточному соединению 8 (390 мг, 0,94 ммоль) добавляют 4 н. HCl в диоксане (8 мл). Полученный раствор перемешивают при комнатной температуре в течение 4 часов, затем гасят Н2О, нейтрализуют насыщенным водным раствором NaHCO3 и экстрагируют 25% изопропилового спирта в хлороформе.
Объединенные органические фракции сушат над Na2SO4 и упаривают при сниженном давлении. Остаток очищают колоночной хроматографией (5% 7 н. NH3/МеОН в ДХМ) с получением Соединения 7 в виде твердого вещества белого цвета.
1Н-ЯМР (CD3OD; δ пропромилле): 0,85 (д, J=6,74 Гц, 3Н), 0,91 (д, J=6,74 Гц, 3Н), 1,54 (д, J=7,03 Гц, 3Н), 1,96 (гепт, J=6,74 Гц, 1Н), 2,33 (с, 3Н), 3,28 (д, J=6,74 Гц, 2Н), 4,42 (к, J=7,03 Гц, 1Н), 5,20-5,25 (м, 2Н), 6,67 (с, 1Н), 7,10-7.12 (м, 2Н), 7,13-7,20 (м, 1Н), 7,55 (с, 1Н).
Пример 6
Промежуточное соединение 9
2-(2-трет-Бутоксикарбониламино-3-метил-бутириламино)-3-метил-масляной кислоты 3-{(S)-1-[1-(2-трет-бутоксикарбониламино-3-метил-бутирил)-1H-имидазол-4-ил]-этил}-2-метил-бензиловый эфир
Названное в заголовке соединение получают из Соединения 7 (490 мг, 1,55 ммоль), Boc-L-валина (1,01 г, 4,67 ммоль), ЭДКИ (1,04 г, 5,42 ммоль) и ДМАП (671 мг, 5,5 ммоль) в соответствии с методикой, описанной в Примере 3.
1H-ЯМР (CD3OD; δ пропромилле): 0,85-0,92 (м, 12Н), 1,43 (с, 9Н), 1,55 (д, J=7,03 Гц, 3Н), 1,97 (м, 1Н), 2,14 (гепт, J=6,60 Гц, 1Н), 2,35 (с, 3Н), 3,88 (д, J=7,30 Гц, 1Н), 4,35 (д, J=6,90 Гц, 1Н), 4,42 (д, J=7,03 Гц, 1Н), 5,18-5,25 (м, 2Н), 6,67 (с, 1Н), 7,10-7,15 (м, 2Н), 7/17-7,20 (м, 1Н), 7,55 (с, 1Н).
Пример 7
Промежуточное соединение 10
2-(2-трет-Бутоксикарбониламино-3-метил-бутириламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
Названное в заголовке соединение получают из Промежуточного соединения 9 (750 мг, 1,05 ммоль) в 30 мл МеОН в соответствии с методикой, описанной в Примере 2.
1H-ЯМР (CD3OD; δ пропромилле): 0,89 (д, д, J=7,03 Гц, 6Н), 1,44 (с, 9Н), 1,54 (д, J=7,33 Гц, 3Н), 2,14 (гепт, J=6,74 Гц, 1Н), 2,33 (с, 3Н), 3,74 (с, 2Н), 4,35-4,55 (м, 2Н), 5,20 (с, 2Н), 6,67 (с, 1Н), 7,10-7,17 (м, 2Н), 7,19-7,23 (м, 1Н), 7,56 (с, 1Н).
Пример 8
Соединение 8
2-(2-Амино-3-метил-бутириламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
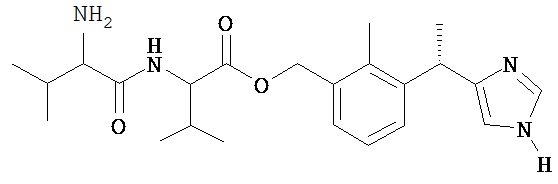
Названное в заголовке соединение получают из Промежуточного соединения 10 (450 мг, 0,87 ммоль) в 8 мл смеси 4 н. HCl/диоксан в соответствии с методикой, описанной в Примере 5.
1Н-ЯМР (CD3OD; δ пропромилле): 0,85 (д, J=7,03 Гц, 3Н), 0,91 (д, J=6,74 Гц, 3Н), 0,92 (д, J=7,3 Гц, 3Н), 1,14 (д, J=6,2 Гц, 3Н), 1,54 (д, J=7,03 Гц, 3Н), 1,94 (гепт, J=5,2 Гц, 1Н), 2,14 (гепт, J=6,2 Гц, 1Н), 2,33 (с, 3H), 3,18 (д, J=5,2 Гц, 1Н), 4,34 (д, J=6,2 Гц, 1Н), 4,42(к, J=7,03 Гц, 1Н), 5,21-5,26 (м, 2Н), 6,67 (с, 1Н), 7,10-7,15 (м, 2Н), 7,18-7,20 (м, 1Н), 7,55 (с, 1Н).
Пример 9
Промежуточное соединение 11
2-(2-трет-Бутоксикарбониламино-ацетиламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
Названное в заголовке соединение получают из Соединения 8 (405 мг, 1,28 ммоль), Вос-глицина (675 мг, 3,86 ммоль), ЭДКИ (859 мг, 4,48 ммоль) и ДМАП (547 мг, 4,48 ммоль) в соответствии с методикой, описанной в Примере 3. Названное в заголовке соединение очищают колоночной хроматографией с использованием 5% 7 н. NH3/МеОН в ДХМ.
1Н-ЯМР (CD3OD; δ пропромилле): 0,89 (д, J=6,74 Гц, 3Н), 0,91 (д, J=6,74 Гц, 3Н), 1,55 (д, J=7,30 Гц, 3Н), 2,14 (гепт, J=6,74 Гц, 1Н), 2,33 (с, 3Н), 4,37 (д, J=5,90 Гц, 1Н), 4,42 (к, J=7,03 Гц, 1Н), 5,20-5,25 (м, 2Н), 6,67 (с, 1Н), 7,10-7,12 (м, 2Н), 7,13-7,20 (м, 1Н), 7,55 (с, 1Н).
Пример 10
Соединение 9
2-(2-Амино-ацетиламино)-3-метил-масляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
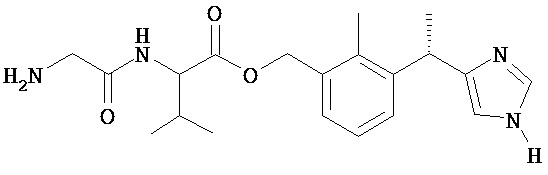
Названное в заголовке соединение получают из Промежуточного соединения 11 (320 мг, 0,68 ммоль) с использованием 10 мл 4 н. HCl/диоксана в соответствии с методикой, описанной в Примере 5.
1Н-ЯМР (CD3OD; δ пропромилле): 0,89 (д, J=6,74 Гц, 3Н), 0,91 (д, J=6,74 Гц, 3Н), 2,14 (гепт, J=6,74 Гц, 1Н), 2,33 (с, 3Н), 4,37 (д, J=5,90 Гц, 1Н), 4,42 (к, J=7,03 Гц, 1Н), 5,20-5,25 (м, 2Н), 6,67 (с, 1Н), 7,10-7,12 (м, 2Н), 7,13-7,20 (м, 1Н), 7,55 (с, 1Н).
Пример 11
Промежуточное соединение 12
2-трет-Бутоксикарбониламино-3-фенил-пропионовой кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
Названное в заголовке соединение получают из (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола (216 мг, 1,0 ммоль), Boc-L-фенилаланина (795 мг, 3,0 ммоль), ЭДКИ (671 мг, 3,5 ммоль) и ДМАП (427 мг, 3,5 ммоль) в соответствии с методикой, описанной в Примере 3. Промежуточное соединение 12 очищают колоночной хроматографией с использованием 35-100% этилацетата в гексане.
1Н-ЯМР (CD3OD; δ пропромилле): 1,36 (с, 9Н), 1,55 (д, J=7,03 Гц, 3Н), 2,28 (с, 3Н), 2,85-2,95 (м, 1Н), 3,05-3,11(м, 1Н), 4,38 (м, 1Н), 4,40 (к, J=7,03 Гц, 1Н), 5,17 (с, 2Н), 6,69 (с, 1Н), 7,08-7,24 (м, 8Н), 7,55 (с, 1Н).
Пример 12
Соединение 10
2-Амино-3-фенил-пропионовой кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
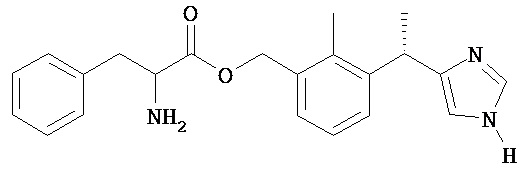
Названное в заголовке соединение получают из Промежуточного соединения 12 (240 мг, 0,52 ммоль) с использованием 8 мл 4 н. HCl/диоксан в соответствии с методикой, описанной в Примере 5.
1Н-ЯМР (CD3OD; δ пропромилле): 1,54 (д, J=7,03 Гц, 3Н), 2,26 (с, 3Н), 2,90-3,00 (м, 2Н), 3,73 (т, J=6,40 Гц, 1Н), 4,40 (к, J=7,03 Гц, 1Н), 5,13-5,18 (м, 2Н), 6,68 (с, 1Н), 7,08-7,12 (м, 5Н), 7,13-7,22 (м, 3Н), 7,55 (с, 1Н).
Следующий анализ был использован для демонстрации активности и селективности соединений в соответствии с изобретением.
Пример 13
Анализ притока FLIPR Са+2
Клетки НЕK 293, стабильно экспрессирующий телячий рецептор α1A, альфа 2А рецептор человека и химерный протеин G Gqi5, помещали на покрытые поли-D-лизином 384-луночные планшеты с плотностью 20000-40000 на лунку и культивировали в течение ночи в модифицированной Дульбекко среде Игла с добавлением 10% сыворотки телячьего эмбриона. Для оценки FLIPR (устройство для чтения флуориметрического изображения на планшетах) клетки дважды промывали буфером HBSS/HEPES (1X буферизованный солевой раствор Хенкса, 20 мМ HEPES, рН 7,4) перед добавлением чувствительного к кальцию красителя Fluo-4-AM (4 мкМ Fluo-4-AM, 0,04% плуроновой кислоты в буфере HBSS/HEPES). Клетки нагружали красителем на 40 мин при температуре 37°С, затем промывали 4 раза буфером HBSS/HEPES. Как для анализа агониста, так и антагониста исследуемые соединения изучали в интервале 0,64 нМ - 10000 нМ.
Для анализа агониста реакцию инициировали добавлением соответствующих разведении соединений и регистрировали временный сигнал кальция. Высоту пика для кривой кальция определяли и использовали для вычисления ЕС50 и эффективности с использованием ActivityBase. Норэпинефрин был стандартом полного агониста, применяемым для оценки активности рецепторов альфа-1 и альфа-2.
Для анализа антагониста добавление лекарственного средства не вызывало временного сигнала кальция. Однако антагонист блокирует временный сигнал кальция стандартного агониста норэпинефрина дозозависимым образом. Высоту пика остаточного норэпинефрина сравнивали с высотой пика норэпинефрина в отсутствие антагониста для определения % антагонизма.
Таблица 3
Фармакология in vitro (S)-[3-(1-(1H-имидазол-4-ил)этил)-2-метилфенил]метанола и его пролекарств на подтипах адренергических рецепторов
|
ЕС50 (эфф) нМ. н/а: не активно.
Пример 14
Анализ продолжительности действия Соединения 1
Соединение 1 (пролекарство): изо-масляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловый эфир
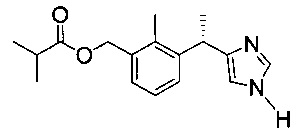
и
метаболит Соединения 1: [3-(1-(1Н-имидазол-4-ил)этил)2-метилфенил]метанол
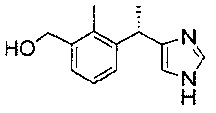
сравнивали по продолжительности их действия при снижении внутриглазного давления (ВГД). Результаты исследования представлены на Фиг. 1.
Как следует из данного исследования, Соединение 1 обладает более длительным и равномерным периодом действия. Метаболит Соединения 1 (соединение согласно WO 2010093930) уже через 8 часов практически перестает действовать, при этом пиковая активность данного соединения составляет не более 30%, что существенно ниже пиковой активности Соединения 1.
ДОПОЛНИТЕЛЬНЫЕ ПРИМЕРЫ
Пример 1. Исследование контроля ВГД
Данное исследование было проведено для демонстрации эффективности и селективности соединений по изобретению.
В качестве подопытных животных в эксперименте использовали самцов голландских кроликов (Myrtle's Rabbitry) с нормальным кровяным давлением, достигших возраста 6 месяцев (n=4/соединение/отобранная доза). Одну каплю (50 мкл) лекарственного препарата, что дает 0,15% или 0,3% активного метаболита после полного гидролиза в 1% полисорбате-80 при рН 5,5, при помощи пипетки местно вводили в правый глаз (обрабатываемый глаз) в течение приблизительно 0700 часов. ВГД кроликов (обработанных и необработанных глаз) измеряли за 0 часов до и после 0,5, 1, 2, 3, 4, 6 и 8 часов после местного введения капли. ВГД во время введения капли (0 ч) использовали в качестве базового значения. До тонометрических измерений в каждый глаз вводили 0,05% пропакаина (50 мкл). Тонометрические измерения ВГД получали при помощи тонометра Mentor Pneumotonometer. Кроме того, все исследования проводились «вслепую». Между введениями для каждого кролика давалась по меньшей мере 1 неделя для выведения препарата. В процессе проведения экспериментов всех животных исследовали на сонливость, раздражение глаз и изменения в диаметре зрачков. Данные, полученные для соединений по настоящему изобретению (значения ВГД), показали, что пролекарство изо-масляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловый эфир в исследованной концентрации обладает равной или сравнимой эффективностью в отношении контроля ВГД по сравнению с препаратом Alphagan Р®, и обладает более длительным периодом контроля внутриглазного давления, нежели Alphagan Р® (см. Фигура 2).
Пример 2. Модель улучшения зрения
Для оценки способности изо-масляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензилового эфира к усилению нейроэффектов использовали шестнадцать окрашенных (голландских) кроликов весом 2-3 кг. Кроликам внутривенно вводили дозировки изомасляной кислоты 3-[(S)-1-(1H-имидазол-4-ил)-этил]-2-метил-бензилового эфира. Остроту зрительного вызванного потенциала (ВП) в технике «sweep» оценивали при помощи программного обеспечения PowerDiva, версия 1.8. Запись производили билатерально у животных, находящихся в сознании. Результаты показывают, что пролекарство изомасляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловый эфир усиливает остроту зрения по прошествии 10-30 минут после введения у нормальных голландских кроликов.
Пример 3. Модель с ультрафиолетовым излучением
Пролекарство изо-масляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловый эфир оценивали в ультрафиолетовой модели дегенерации сетчатки крыс. Лекарство вводили непрерывно посредством капельниц с подкожным введением в дозировке 1 мг/кг/день, начиная за 2 дня до воздействия ультрафиолета. В исследовании использовали двадцать самцов крыс линии Спрег-Доули в возрасте 4 месяцев (массой тела 470-550 г). Животных подвергали воздействию комнатного света циклом 12 часов света/12 часов темноты перед экспериментом. Всех животных адаптировали к темноте в течение ночи (16-20 часов) перед воздействием ультрафиолета. Крыс подвергали воздействию ультрафиолета с интенсивностью 6100-6500 люксов в течение 4 часов. После воздействия ультрафиолета крыс помещали в темноту на 3 дня перед возвращением их к нормальному циклу 12 часов света/12 часов темноты. По прошествии 7 дней после воздействия ультрафиолета производили измерения при помощи оптической когерентной томографии (ОКТ). Результаты демонстрируют, что воздействие ультрафиолета при обработке только физиологическим раствором ведут к сильному уменьшению толщины сетчатки, измеренной при помощи ОКТ, в частности в верхней половине сетчатки. Гистологические исследования показали, что уменьшение толщины сетчатки происходит за счет потери фоторецепторов. Лечение бромидином не предотвратило уменьшения толщины сетчатки, тогда как обработка пролекарством изо-масляной кислоты 3-[(S)-1-(1Н-имидазол-4-ил)-этил]-2-метил-бензиловым эфиром существенно уменьшило повреждения, вызываемые ультрафиолетом.
![СЛОЖНОЭФИРНЫЕ ПРОЛЕКАРСТВА [3-(1-(1H-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ)-2-МЕТИЛФЕНИЛ]МЕТАНОЛА](https://fips.edrid.ru/images/rid/72/c4/fb/0e6e66443363adf0f7c56d8eb214ce17.png)
![СЛОЖНОЭФИРНЫЕ ПРОЛЕКАРСТВА [3-(1-(1H-ИМИДАЗОЛ-4-ИЛ)ЭТИЛ)-2-МЕТИЛФЕНИЛ]МЕТАНОЛА](https://fips.edrid.ru/images/rid/72/c4/fb/c9c5031a812a1ffdeb69f77042a5d475.png)