Результат интеллектуальной деятельности: Способ получения N-(5-гидроксиникотиноил)-L-глутаминовой кислоты
Вид РИД
Изобретение
Изобретение относится к способу получения N-(5-гидроксиникотиноил)-L-глутаминовой кислоты (I) - перспективного лекарственного средства, которое обладает противогипоксической, антиамнестической активностью и может найти применение в медицине в качестве средства с ноотропным типом действия для лечения патологических состояний, связанных с нарушением памяти, мозгового кровообращения, последствий черепно-мозговых травм, а также в гериатрической практике.
До настоящего времени были известны два способа получения N-(5-гидроксиникотиноил)-L-глутаминовой кислоты (I).
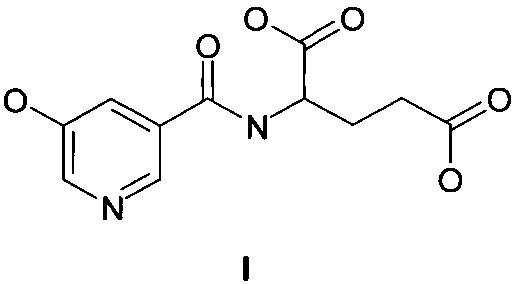
По первому способу (SU 1368314 А1, опубл. 23.01.1988) I получают действием глутаминовой кислоты (II) на азид 5-оксиникотиновой кислоты (III) в присутствии гидроксида натрия в водной среде при 20-23°C.
Способ заключается в том, что 5-оксиникотиновую кислоту (IV) переводят в этиловый эфир кипячением в этиловом спирте в присутствии серной кислоты, который обработкой водным гидразингидратом переводят в гидразид 5-оксиникотиновой кислоты. Из последнего действием нитрита натрия в присутствии водной соляной кислоты получают III, конденсацией которого с II в водно-щелочной среде (pH 8-10) получают I с выходом 35%, считая на IV.
Недостатками данного метода являются низкий выход I, считая на IV, а также необходимость использования неустойчивого, взрывоопасного III, который даже при сушке (40°C) осмоляется и не приемлем в промышленном применении.
Наиболее близким к предложенному является второй способ (RU 2051908 С1, опубл. 10.01.1996), по которому для синтеза I применяют взаимодействие II со смешанным ангидридом 5-оксиникотиновой кислоты. IV обрабатывают метиловым (этиловым, бутиловым или изобутиловым) эфиром хлормуравьиной кислоты для защиты оксигруппы. Полученную 5-метоксикарбонилоксиникотиновую кислоту в присутствии триэтиламина и при температуре от -8 до -16°C обрабатывают бутиловым или изобутиловым эфирами хлормуравьиной кислоты. К полученному смешанному ангидриду добавляют хлоргидрат диэтилового эфира L-глутаминовой кислоты. По окончании реакции снимают защиту с гидроксильной и карбоксильной групп, выделяют целевой продукт и после перекристаллизации из водного спирта получают I с выходом 56-62%, считая на IV.
Недостатками данного способа являются необходимость поддержания низкой температуры от -8 до -16°C на стадии получения смешанного ангидрида 5-оксиникотиновой кислоты, необходимость защиты оксигруппы 5-гидроксиникотиновой кислоты, сложность контроля полноты его образования, а также использование в синтезе дорогостоящих хлорформиатов.
Задачей изобретения является создание более простого способа получения N-(5-гидроксиникотиноил)-L-глутаминовой кислоты (I) без предварительной стадии защиты оксигруппы 5-гидроксиникотиновой кислоты
Задача решается способом получения N-(5-гидроксиникотиноил)-L-глутаминовой кислоты путем взаимодействия производного 5-оксиникотиновой кислоты с производным L-глутаминовой кислоты, в котором в качестве производного 5-оксиникотиновой кислоты используют ее имидазолид, который получают взаимодействием 5-оксиникотиновой кислоты с 1,1'-карбонилдиимидазолом в среде органического растворителя при температуре от 45 до 65°C, в качестве производного L-глутаминовой кислоты используют ее диэтиловый эфир, их взаимодействие проводят в той же среде органического растворителя при температуре от 55 до 85°C и при избытке производного L-глутаминовой кислоты по отношению к производному 5-оксиникотиновой кислоты, выбранном из молярного соотношения от 1,2:1 до 1,5:1, полученный полупродукт гидролизуют щелочным агентом при pH 8-9, подкисляют реакционную массу до pH 3-5 и выделяют целевой продукт.
Кроме того, после гидролиза проводят очистку раствора с помощью сорбента, а выделение целевого продукта осуществляют путем отделения осадка от реакционной массы фильтрацией, суспендирования осадка в воде, подкисления суспензии до pH 3-5, добавления в нее щелочного агента до pH 8-9, очистки полученного раствора с помощью сорбента, подкисления раствора до pH 3-5 и отделения осадка фильтрацией.
Кроме того, используют органический растворитель, выбранный из ряда: диметилформамид, тетрагидрофуран, дихлорметан, толуол.
Кроме того, используют щелочной агент, выбранный из ряда: гидроокись лития, гидроокись натрия, гидроокись калия.
Кроме того, в качестве сорбента используют активированный уголь.
Техническим результатом изобретения является сокращение числа стадий (исключение стадии защиты оксигруппы 5-гидроксиникотиновой кислоты) и исключение необходимости использования низких температур (все стадии проводятся при температурах от +20°C до +85°C)
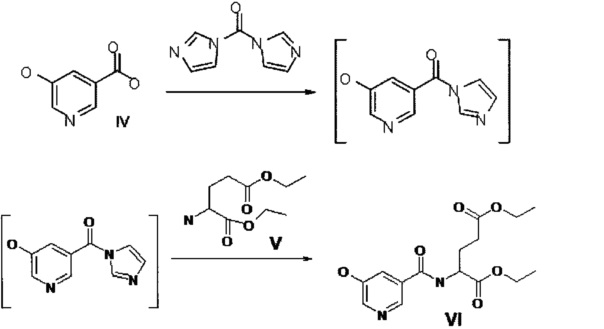
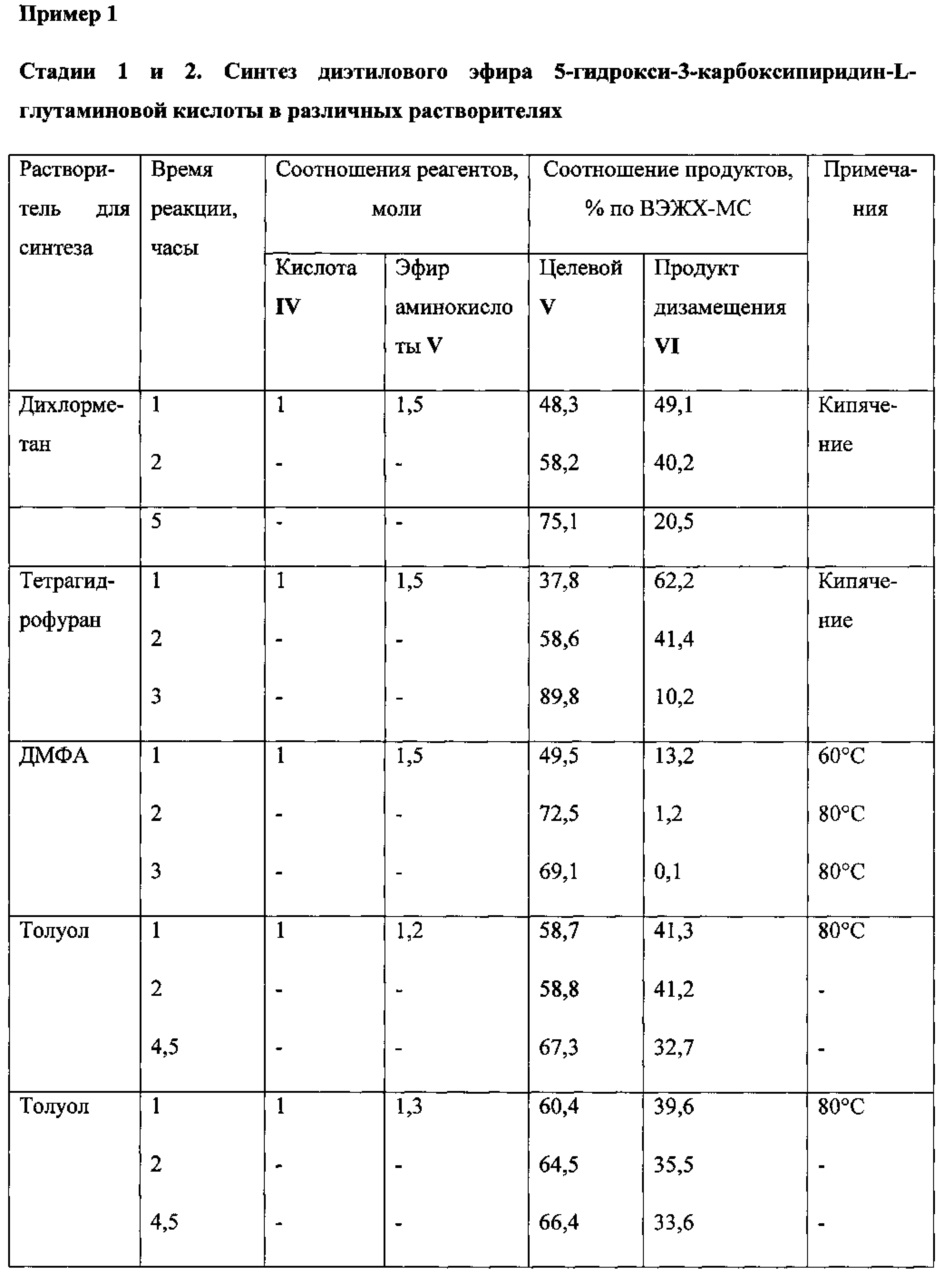
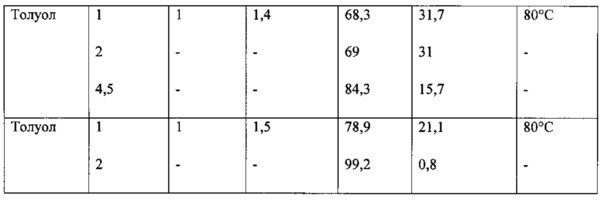
Предлагается способ получения I, при котором 5-гидроксиникотиновая кислота (IV) переводится в имидазолид 5-гидроксиникотиновой кислоты действием 1,1'-карбонилдиимидазола в подходящем растворителе (ДМФА, тетрагидрофуран, дихлорметан, толуол). Имидазолид 5-гидроксиникотиновой кислоты далее без выделения реагирует с диэтиловым эфиром L-глутаминовой кислоты (V). На заключительной стадии снимают защиту с карбоксильных групп и целевой продукт VI получают после очистки с выходом 70%.
В отличие от предыдущих способов получения I в данном случае не требуется защита оксигруппы 5-гидроксиникотиновой кислоты. Тем самым убирается соответствующая стадия.
Первая и вторая стадии проходят друг за другом в одном реакционном сосуде без выделения промежуточного имидазолида 5-гидроксиникотиновой кислоты. Первую стадию проводят предпочтительно при 45-65°C. Более предпочтительно при 60-65°C.
Предпочтительно проводить вторую стадию при 60-85°C. Более предпочтительно при 80-85°C.
Реакционную массу после завершения второй стадии подвергают концентрированию.
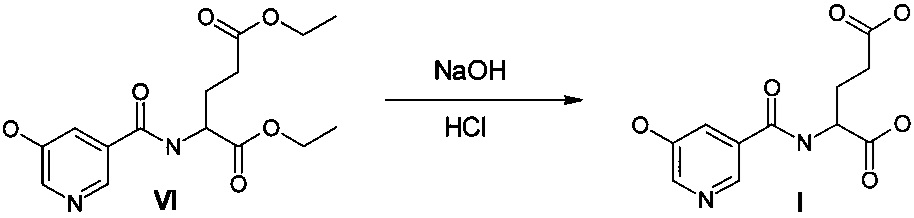
На третьей стадии осуществляют гидролиз сложноэфирных групп с одновременной двухкратной очисткой продукта с использованием активированного угля. Для выделения целевого продукта используют подкисление реакционной массы концентрированной соляной кислотой до pH 3-5. Более предпочтительно подкислять до pH 4.
Стадия получения диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты проходит ступенчато. Первоначально в реакционной массе параллельно образуются и целевой диэтиловый эфир 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты VI (м.в. 324,34) и побочный продукт, содержащий в своей структуре второй фрагмент гидроксиникотиновой кислоты VII (м.в. 445,43):
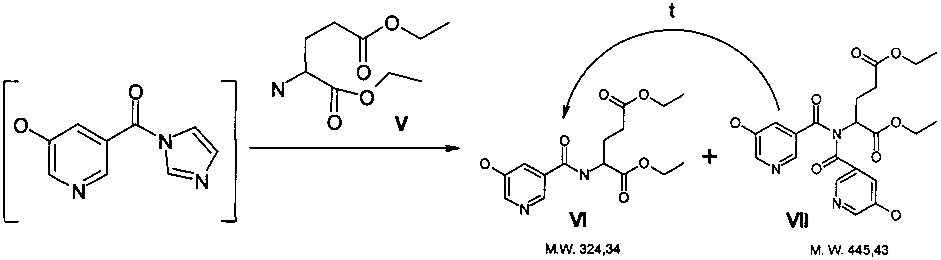
Побочный продукт VII в ходе нагревания до 70-80°C самопроизвольно переходит в целевой продукт VI. Избыток эфира аминокислоты (V) способствует этому процессу. Варьированием соотношения эфира аминокислоты : исходная кислота от 1,1:1 до 1,5:1 было установлено, что соотношение 1,5:1 является оптимальным для прохождения целевой реакции. Длительность выдержки при 80°C составляет от 1 до 2 часов (контроль ВЭЖХ-МС).
Для проведения синтеза предпочтительными растворителями являются ДМФА и толуол. Более предпочтительным является толуол.
Преимуществами предлагаемого способа получения 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты I являются:
1) исключение стадии защиты оксигруппы в 5-оксиникотиновой кислоте;
2) увеличение выхода 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты I в трехстадийном синтезе по данному способу по сравнению с представленным в RU 2051908 на 8-10% (с 60-62% до 70%);
3) технологичность нового способа получения и возможность масштабирования для промышленного производства;
4) снижение себестоимости производства 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты I за счет использования более дешевого реагента (замена дорогостоящих хлорформиатов на дешевый 1,1'-карбонилдиимидазол).
Пример 1
Пример 2
Стадии 1 и 2. Синтез диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты в ДМФА
В колбе на 500 мл при перемешивании на магнитной мешалке приготовили суспензию 20 г (0,144 м) 5-гидроксиникотиновой кислоты в 300 мл ДМФА и прибавили 29,3 г (0,137 м) 1,1'-карбонилдиимидазола (содержание основного вещества 75,5%). Нагревали до 60-65°C (температура бани) и перемешивали при этой температуре 30 минут. Прилили одной порцией раствор 43,8 г (0,216 м) диэтилового эфира L-глутаминовой кислоты в 50 мл ДМФА, подогрели до 80-85°C (температура бани) и перемешивали при этой температуре 4 часа. Растворитель отогнали при 80°C и 20 мм рт.ст. Вес после концентрирования 95,6 г.
Стадия 3. Гидролиз диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты
В 0,5 л стакане при охлаждении на водяной бане и магнитном перемешивании приготовили раствор 57,6 г (1,44 м) гидроксида натрия в 230 мл воды. Раствор охладили до комнатной температуры и вылили в 1 л одногорлую колбу с 95,6 г сырца диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты. Перемешивали на магнитной мешалке при комнатной температуре в течение 2 часов, добавили 8 г активированного угля марки ОУ-А и перемешивали еще 30 минут. Профильтровали от угля на воронке Бюхнера (3 слоя фильтровальной бумаги). Перелили фильтрат в 1 л стакан и при перемешивании механической мешалкой и охлаждении водой со льдом прикапывали концентрированную соляную кислоту до pH 4 (пошло 175 мл). Перемешивали еще 1 час. Осадок отфильтровали на Шотте №3, промыли 3×200 мл водой. Сушили при 55°C и 40 мм рт.ст. в течение 12 часов. Вес 43,2 г (содержание основного вещества 82%, воды 18%). Продукт суспендировали в 0,43 л воды, подкислили при механическом перемешивании до pH 4 (19 мл конц. соляной кислоты). Приготовили раствор 12 г гидроксида натрия в 30 мл воды и подщелочили до pH 8 (пошло 26 мл раствора). К раствору добавили 4 г угля ОУ-А и перемешивали 30 минут. Отфильтровали от угля, промыли водой. Маточник перенесли в стакан с механическим перемешиванием и подкислили конц. соляной кислотой до pH 4. Осадок отфильтровали и промыли на фильтре водой (3×100 мл). Сушили в вакуум-сушильном шкафу при 55°C и 40 мм рт.ст. 24 часов. Вес 31,9 г. Чистота по ВЭЖХ (единичная примесь 0,27%, сумма примесей 0,35%). Тпл. 224,1-224,5°C (лит. 224-226°C).
Суммарный выход на три стадии 66%.
Пример 3
Стадии 1 и 2. Синтез диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты в толуоле
В 2 л колбе, снабженной механическим перемешиванием, термометром, обратным холодильником с хлоркальциевой трубкой, приготовили суспензию 81 г (0,583 м) 5-гидроксиникотиновой кислоты и 118 г (0,550 м) 1,1'-карбонилдиимидазола (содержание основного вещества 75,5%) в 600 мл толуола. Нагревали до 60-65°C (температура бани) и перемешивали при этой температуре 30 минут. Прилили одной порцией раствор 176 г (0,867 м) диэтилового эфира L-глутаминовой кислоты в 200 мл толуола, подогрели до 80-85°C (температура бани) и перемешивали при этой температуре 1 час. Реакционную массу концентрировали при 60°C и 20 мм рт.ст. Вес после концентрирования 345 г.
Стадия 3. Гидролиз диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты
В 2 л стакане при охлаждении на водяной бане и магнитном перемешивании приготовили раствор 233 г (5,83 м) гидроксида натрия в 930 мл воды. Раствор охладили до комнатной температуры и вылили в 3 л одногорлую колбу с 345 г сырца диэтилового эфира 5-гидрокси-3-карбоксипиридин-L-глутаминовой кислоты. Перемешивали на магнитной мешалке при комнатной температуре в течение 2 часов, добавили 30 г активированного угля марки ОУ-А и перемешивали еще 30 минут. Профильтровали от угля на воронке Бюхнера (3 слоя фильтровальной бумаги). Перелили фильтрат в 2 л стакан и при перемешивании механической мешалкой и охлаждении водой со льдом прикапывали концентрированную соляную кислоту до pH 4 (пошло 545 мл). Перемешивали еще 1 час. Осадок отфильтровали на Шотте №3, промыли 3×600 мл водой. Сушили при 55°C и 40 мм рт.ст. в течение 12 часов. Вес 143 г (содержание основного вещества 80%, воды 21%). Продукт суспендировали в 0,75 л воды, подкислили при механическом перемешивании до pH 4 (65 мл конц. соляной кислоты). Приготовили раствор 40 г гидроксида натрия в 100 мл воды и подщелочили до pH 8 (пошло 90 мл раствора). К раствору добавили 13 г угля ОУ-А и перемешивали 30 минут. Отфильтровали от угля, промыли водой. Маточник перенесли в стакан с механическим перемешиванием и подкислили конц. соляной кислотой до pH 4. Осадок отфильтровали и промыли на фильтре водой (3×500 мл). Сушили в вакуум-сушильном шкафу при 55°C и 40 мм рт.ст. 24 часов. Вес 103 г. Чистота по ВЭЖХ (единичная примесь 0,19%, сумма примесей 0,39%). Тпл.. 224,4-224,8°C (лит. 224-226°C).
Суммарный выход на три стадии 70%.

