Результат интеллектуальной деятельности: ИМИНОПРОИЗВОДНЫЕ КАМФОРЫ, СОДЕРЖАЩИЕ АРОМАТИЧЕСКИЙ ИЛИ ГЕТЕРОАРОМАТИЧЕСКИЙ ФРАГМЕНТ, - ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСА ГРИППА (штамм A/California/07/09 (H1N1)pdm09)
Вид РИД
Изобретение
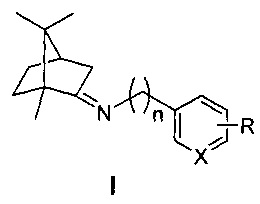
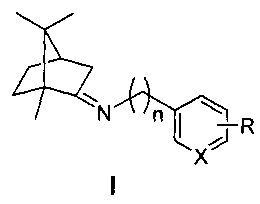
Изобретение относится к медицине и фармацевтике, конкретно к биологически активным веществам, представляющим собой иминопроизводные камфоры общей формулы I
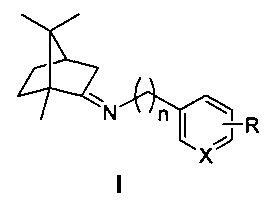
где n=0, 1, 2; X-С или N; R-гидрокси, алкокси группа,
которые могут использоваться в качестве ингибиторов репродукции вируса гриппа (штамм A/California/07/09 (H1N1)pdm09) и могут быть использованы в медицине, вирусологии и фармакологии.
Грипп - острое инфекционное заболевание дыхательных путей, вызываемое РНК-содержащим вирусом, имеющим высокую эпидемиологическую и клиническую значимость с высокой частотой осложнений среди лиц, повышенного уровня риска.
Вирусы гриппа и других острых респираторных вирусных инфекций (ОРВИ) вызывают массовые вспышки заболеваний, принимающие почти ежегодно характер эпидемий. Ежегодно регистрируется от 27 до 41 млн. случаев этих заболеваний, в частности гриппом переболевает от 5 до 15% населения России в год. Грипп и ОРВИ остаются практически неконтролируемыми заболеваниями из-за высокой изменчивости антигенной структуры циркулирующих вирусов гриппа и гетерогенности возбудителей ОРВИ. Кроме того, вирусы гриппа и других ОРВИ способны изменять свои свойства и патогенность. Последним примером таких изменений является возбудитель гриппа H1N1, циркулирующий в эпидемический сезон 2009-2010 гг., получивший название «свиной грипп».
Противовирусные средства для лечения гриппа представляют собой очень ограниченную группу лекарственных препаратов, причем для большинства из них известна лекарственная резистентность. Лекарственные препараты для неспецифической профилактики и терапии гриппа и других ОРВИ можно условно разделить на два основных класса.
1. Неселективные противовирусные средства включают интерфероны и индукторы эндогенного интерферона. Среди наиболее известных препаратов - отечественные средства Арбидол, Кагоцел, Ингавирин, а также дженерики Тилорона. Однако эффективность популярных неселективных средств недостаточно подтверждена клиническими данными. Поэтому для лечения и профилактики пандемического гриппа ВОЗ рекомендует использовать химиопрепараты этиотропного действия.
2. Селективные противовирусные средства (этиотропного действия), оказывающие непосредственное прямое воздействие на размножение вируса. Ингибировать репродукцию вируса гриппа можно на разных стадиях его жизненного цикла, и на этом основана классификация противовирусных, противогриппозных средств по механизму действия (Еропкин М.Ю., Зарубаев В.В., 2012).
Противовирусные препараты, действующие на позднем, конечном этапе вирусной репродукции. Это ингибиторы нейраминидазы - фермента, который способствует выходу вируса из клетки по окончании репродукции, и его ингибирование приводит к агрегации вирусов на внутренней поверхности клетки и замедлению дальнейшего распространения (Ison М.G., 2013). Из зарегистрированных в России препаратов этого класса к ним относятся: осельтамивир (Тамифлю) и занамивир (Реленза). В США зарегистрированы и используются: перамивир (Рапиакта) и ланинамивир (Инавир), которые также действуют на этапе почкования вновь синтезированных вирионов гриппа из оболочки клетки, блокируя отщепление частиц вирусного потомства от поверхности клеток. Практика применения ингибиторов нейраминидазы в лечении гриппа показала, что высокая эффективность этой группы препаратов ограничена ранней стадией инфекции.
Известны противовирусные препараты прямого действия на репликацию вирусов гриппа, например, препарат Ремантадин (α-метил-1-адамантилметиламина гидрохлорид) и Амантадин (1-аминоадамантан) [Davies W.L.; Grunert R.R.; Haff R.F.; McGahen J.W.; Neumayer E.M.; Paulshock M; Watts J.C; Wood T.R.; Hermann E.C; Hoffmann С.E. Antiviral Activity of 1-Adamantanamine (Amantadine) // Science. - 1964. - V. 144. P. 862]. Данные соединения блокируют белок М2 вируса гриппа, препятствуя тем самым процессу расщепления гемагглютинина и слияния мембран вируса и лизосомальной вакуоли [Scholtissek С., Quack G., Klenk H.D., Webster R.G. // Antiviral Res. 1998, V. 37, P. 83-95]. Механизм действия этих препаратов изучен достаточно полно [Cady S.D., Schmidt-Rohr K., Wang J., Soto C.S., DeGrado W.F., Hong M.H. Structure of the amantadine binding site of influenza M2 proton channels in lipid bilayers // Nature. 2010. Vol. 463. P. 689-692]. Белок M2 в виде тетрамера является ионным каналом, функционирующим в качестве протонного насоса. Известно, что данные препараты необратимо ингибируют М2-белок, и тем самым останавливают поток протонов через мембраны вирионов, что необходимо для снижения pH, расщепления гемагглютинина и реализации его функции как фактора слияния вирусной и клеточной мембран. Ремантадин блокирует активность ионных каналов и нарушает тем самым процесс «раздевания» вируса.
Адамантановые препараты значительно дешевле и проще в производстве, чем коммерчески доступные ингибиторы нейраминидазы, что делает их более доступными для лечения и профилактики гриппа среди населения. Однако в настоящее время в результате широкого использования адамантановых препаратов (ремантадин и амантадин) значительно утрачены их противовирусные свойства в отношении вирусов гриппа А. Потерю активности в основном связывают с мутацией в трансмембранном домене белка М2 вируса гриппа. Кроме хорошо известного ремантадина, сравнимой с ним противовирусной активностью обладает достаточно обширный класс соединений. Так, известно средство на основе дейтифорина (2-(1'-аминоэтил)бицикло[2.2.1]гептана, являющееся одним из наиболее интересных препаратов на основе природных бициклических каркасных соединений - борнанов [Патент RU 2448692 С2, оп. 27.04.2012] и введенных в медицинскую практику. Симметричные диимины на основе камфоры, разделенные алифатической цепочкой, обладают сравнительно высокой активностью (индекс селективности от 40 до 89) [Патент РФ 2520967]. Известно производное камфоры и аминоэтанола, обладающее высокой противовирусной активностью [Патент РФ 2530554].
Наиболее близким к заявляемому соединению - прототипом, является дейтифорин, представляющий собой фармацевтические соли (2-(1'-аминоэтил)бицикло[2.2.1]гептана общей формулы II
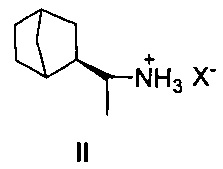
Недостатком известного соединения является невысокая противовирусная активность.
Задачей изобретения является расширение нового класса эффективных ингибиторов репродукции вируса гриппа, которые могут быть синтезированы из доступных природных реагентов в одну стадию и с высоким выходом.
Технический результат: повышение эффективности подавления репродукции вируса гриппа и расширение ассортимента ингибиторов репродукции вируса гриппа для преодоления лекарственной устойчивости современных вирусных штаммов. Поставленная задача решается новыми соединениями общей формулы I, обладающими выраженными свойствами ингибиторов репродукции вируса гриппа.
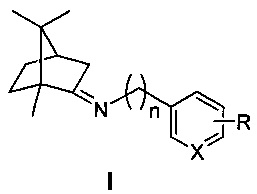
где n=0, 1, 2; X-С или N; R-гидрокси, алкокси группа.
Соединения общей формулы 1, после проведения углубленных фармакологических исследований, могут использоваться как в чистом виде, так и в качестве компонента новых низкотоксичных высокоэффективных протововирусных лекарственных форм.
Исследования биологической активности соединений 1, проведенные в отношении вируса гриппа (штамм A/California/07/09 (H1N1)pdm09), показали их высокую эффективность как ингибиторов репродукции этого вируса. Камфора, будучи бициклическим терпеноидом с жестким типом остова, доступным как в правовращающих, так и в левовращающих энантиомерах, не проявила противовирусной активности в проведенных исследованиях. Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации вируса гриппа в культуре клеток MDCK соединениями 1, превышающую тот же показатель у эталонов сравнения - амантадина и римантадина в 15 и более раз. Использование в качестве препаратов сравнения адамантановых производных обусловлено наличием жестких структурных фрагментов как в полученных соединениях, так и в указанных препаратах. Для соединений Ic, Id, If проведено изучение острой токсичности in vivo. Было показано, что LD50 соединений Id, If превышает 2000 мг на кг, а соединения Ic 1200 мг на кг, что подтверждает низкую токсичность данных соединений.
Синтез соединений проводили без растворителя, в качестве катализатора использовали ZnCl2; очистку реакционных смесей проводили вакуумной перегонкой и, при необходимости, дополнительно колоночной хроматографией. Ход реакций отслеживали отбором проб и анализом хромато-масс-спектров.
Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Величины удельного вращения [α]589 определяли на спектрометре PolAAr 3005. Спектры ЯМР 1Н и 13С регистрировали на спектрометрах Bruker AV-400 (1Н: 400.13 МГц, 13С: 100.61 МГц), DRX-500 (1Н: 500.13 МГц, 13С: 125.76 МГц) и AV-600 (1H: 600.30 МГц, 13С: 150.95 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (δH 7.24, δC 76.90 м.д.). Отнесение сигналов в спектрах ЯМР проводилось с привлечение стандартных одномерных и двумерных экспериментов (COSY, HETCOR, COLOC, НМВС, HSQC). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS Thermo Scientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 μ, Masherey-Nagel). Хромато-масс-спектры записывали на газовом хроматографе Agilent 7890 А с квадрупольным масс-спектрометром Agilent 5975С в качестве детектора, кварцевая колонка HP-5MS 30000×0.25 мм, газ-носитель - гелий. Удельное вращение выражено в (град⋅мл)⋅(г⋅дм)-1, концентрация раствора (г)⋅(100 мл)-1. Растворители перед использованием сушились и перегонялись.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Получение 1,7,7-триметилбицикло [2.2.1] гептан-2-илиден)амино-фенола Ia.
Реакционную смесь, содержащую 1 г (0.0066 моль) камфоры, 0.7 г (0.0066 моль) 4-аминофенола нагревали до 220°С в токе аргона. Смесь охлаждали, растворяли в хлороформе, обрабатывали насыщенным раствором NaCl, масса полученной смеси 1.3 г. Целевой продукт очищали колоночной хроматографией на 20 г SiO2, элюент гексан/этилацетат (100:0→0:100). Получили 0.52 г соединения Ia. Выход 33%. Тпл.=148-150°С.
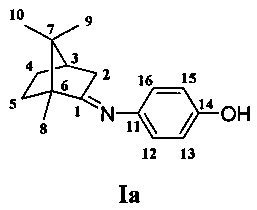
ЯМР 1H (600МГц, CDCl3, δ, м.д., J/Гц): 0.82 (3Н, с, Ме-9), 0.93 (3Н, с, Ме-10), 1.09 (3Н, с, Ме-8), 1.18-1.24 (1H, м, Н-4н), 1.45-1.52 (1H, м, Н-5н), 1.72-1.78 (1H, м, Н-5к), 1.77 (1H, д, 2J=18.0, Н-2н), 1.81-1.88 (2Н, м, Н-4к, Н-3), 2.21 (1Н, ддд, 2J=18.0, J2к,3=4.8, J2к,4к=2.9, Н-2к), 6.55 (2Н, д, J12,13=8.8, Н-12,16), 6.62 (2Н, д, J13,12=8.8, Н-13,15), 8.05 (1H, ш.с, ОН-14). ЯМР 13С (150 МГц, CDCl3, δ, м.д.): 186.77 с (С-1), 152.92 с (С-14), 142.87 с (С-11), 120.82 д (С-12,16), 115.91 д (С-13,15), 54.19 с (С-6), 47.16 с (С-7), 43.61 д (С-3), 36.56 т (С-2), 31.93 т (С-5), 27.25 т (С-4), 19.46 к (С-9), 18.85 к (С-10), 11.16 к (С-8).  =35 (CHCl3, с=0.92). Найдено: m/z 209.1776 [М]+C13H23ON. Вычислено: М=209.1774.
=35 (CHCl3, с=0.92). Найдено: m/z 209.1776 [М]+C13H23ON. Вычислено: М=209.1774.
Пример 2.
Получение 1-фенил-N-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)метанамина Ib.
Реакционную смесь, содержащую 1 г (г (0.0066 моль) камфоры, 1.4 г (0.0132 моль) бензиламина и каталитическое количество ZnCl2, кипятили с обратным холодильником 4 ч. Смесь обрабатывали насыщенным раствором NaCl, затем водой экстрагировали диэтиловым эфиром, масса полученной смеси 1.2 г. Очищали колоночной хроматографией, на 20 г SiO2, элюент гексан/этилацетат (100:0→0:100), выделили 1.1 г соединения Ib. Выход 70%.
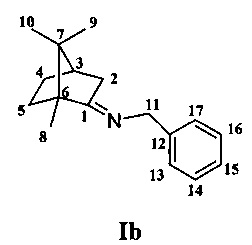
Спектральные данные совпадают с представленными в литературе (Philip С. Bulman Page, Corinne Limousin, Victor L. Murrell. Asymmetric Electrophilic Animation of Various Carbon Nucleophiles with Enantiomerically Pure Chiral N-H Oxaziridines Derived from Camphor and Fenchone. // J. Org. Chem. - 2002. - V. 67. - P. 7787-7796). 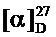 =-12 (CHCl3, c=0.9). Найдено: m/z 241.1822 [M]+C17H23N. Вычислено: M=241.1825.
=-12 (CHCl3, c=0.9). Найдено: m/z 241.1822 [M]+C17H23N. Вычислено: M=241.1825.
Пример 3.
Получение 1-(4-метокси-фенил-N-1,7,7-триметилбицикло [2.2.1]гептан-2-илиден)метанамина Ic.
Реакционную смесь, содержащую 2 г (0.013 моль) камфоры, 3 г (0.022 моль) 3-метоксипропиламина и каталитическое количество ZnCl2 кипятили с обратным холодильником 12 ч. Смесь обрабатывали насыщенным раствором NaCl, затем водой, экстрагировали диэтиловым эфиром, масса полученной смеси 2.3 г. Очищали вакуумной перегонкой Ткип.=105°С (10 мм рт.ст). Получили 1.9 г соединения Ic, выход 54%.
Спектр ЯМР 1Н (400МГц, CDCl3, δ, м. д, J/Гц): 0.74 (3Н, с, Ме-9), 0.92 (3Н, с, Ме-10), 1.00 (3Н, с, Ме-8), 1.19 (1H, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.39 (1H, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.67 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4н=4.2, Н-5к), 1.80-1.91 (1H, м, Н-4к), 1.88 (1Н, д, 2J=16.8, Н-2н), 1.93 (1H, дд, J3,2к=J3,4к=4.5, Н-3), 2.38 (1H, ддд, 2J=16.8, J2к,3=4.5, J2к,4к=3.2, Н-2к), 3.77 (3Н, с, Ме-18), 4.35 и 4.41 (оба 1H, д, 2J=14.6, Н-11), 6.82 (2Н, д, J14,13=8.8, Н-14,16), 7.17 (2Н, д, J13,14=8.8, Н-13,17). ЯМР 13С (100 МГц, CDCl3, δ, м.д.): 183.06 с (С-1), 158.03 с (С-15), 132.53 с (С-12), 128.32 д (С-13, С-17), 113.54 д (С-14, С-16), 55.11 к (С-18), 54.88 т (С-11), 53.72 с (С-6), 46.95 с (С-7), 43.73 д (С-3), 35.66 т (С-2), 32.06 т (С-5), 27.33 т (С-4), 19.49 к (С-9), 18.85 к (С-10), 11.33 к (С-8). 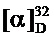 =-5.6 (CHCl3, с=0.82). HRMS: m/z calcd. for C18H25ON: 271.1931. Found: 271.1928.
=-5.6 (CHCl3, с=0.82). HRMS: m/z calcd. for C18H25ON: 271.1931. Found: 271.1928.
Пример 4.
Получение 1-(пиридин-3-ил)-N-((1R,4R)-1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)метанамина Id.
Реакционную смесь, содержащую 2.5 г (0.016 моль) камфоры, 1.3 г (0.016 моль) N-3-аминопропилморфолина и каталитическое количество ZnCl2 кипятили с обратным холодильником 10 ч. Смесь обрабатывали насыщенным раствором NaCl, экстрагировали диэтиловым эфиром, масса полученной смеси 3.47 г. Очищали вакуумной перегонкой Ткип.=145°С (6 мм рт.ст). Получили 2.2 г соединения Id, выход 49%.
ЯМР 1Н (600 МГц, CDCl3, δ, м.д., J/Гц): 0.71 (3Н, с, Ме-9), 0.90 (3Н, с, Ме-10), 0.97 (3Н, с, Ме-8), 1.17 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.35 (1Н, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.66 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4н=4.2, Н-5к), 1.83 (1Н, ддддд, 2J=J4к,5к=12.3, J4к,5н=J4к,3=4.5, J4к,2к=3.2, Н-4к), 1.86 (1H, д, 2J=16.9, Н-2н), 1.93 (1H, дд, J3,2к=J3,4к=4.5, Н-3), 2.36 (1H, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, H-2к), 4.36 и 4.42 (оба 1Н, д, 2J=15.4, Н-11), 7.19 (1Н, ддд, J15,16=7.8, J15,14=4.8, J15,13=0.6, H-15), 7.60 (1H, ддд, J16,15=7.8, J16,13=2.2, J16,14=1.7, H-16), 8.41 (1H, дд, J14,15=4.8, J14,16=1.7, H-14), 8.49 (1H, дд, J13,16=2.2, J13,15=0.6, H-13). ЯМР 13C (150 МГц, CDCl3, δ, м.д.): 184.35 с (С-1), 148.88 д (С-13), 147.66 д (С-14), 135.83 с (С-12), 134.99 д (С-16), 123.14 д (С-15), 53.91 с (С-6), 52.87 т (С-11), 47.00 с (С-7), 43.67 д (С-3), 35.75 т (С-2), 31.98 т (С-5), 27.24 т (С-4), 19.43 к (С-9), 18.76 к (С-10), 11.19 к (С-8). 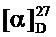 =20 (CHCl3, с=0.86). Найдено: m/z 242.1776 [М]+C16H22N2. Вычислено: М=242.1778.
=20 (CHCl3, с=0.86). Найдено: m/z 242.1776 [М]+C16H22N2. Вычислено: М=242.1778.
Пример 5.
Получение 2-фенил-N-(1,7,7-триметилбицикл о [2.2.1] гептан-2-илиден)этанамина Ie.
Реакционную смесь, содержащую 2 г (0.013 моль) камфоры, 3 г (0.024 моль) фенитиламина и каталитическое количество ZnCl2 кипятили с обратным холодильником 10 ч. Смесь обрабатывали насыщенным раствором NaCl, затем водой, экстрагировали диэтиловым эфиром, масса полученной смеси 2.7 г. Очищали вакуумной перегонкой Ткип.=118-120°С (10 мм рт.ст). Получили 2.1 г соединения Iе, выход 72%.
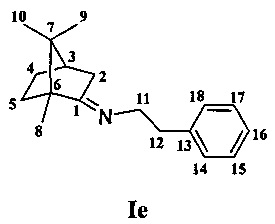
ЯМР 1Н (600 МГц, CDCl3, δ, м.д., J/Гц): 0.58 (3Н, с, Ме-9), 0.86 (3Н, с, Me-10), 0.94 (3Н, с, Ме-8), 0.97 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.25 (1Н, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.54 (1Н, д, 2J=16.9, Н-2н), 1.58 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4н=4.2, Н-5к), 1.74 (1Н, ддддд, 2J=J4к,5к=12.3, J4к,5н=J4к,3=4.5, J4к,2к=3.2, Н-4к), 1.79 (1Н, дд, J3,2к=J3,4к=4.5, Н-3), 2.15 (1Н, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, Н-2к), 2.85-2.83 (2Н, м, Н-12), 3.18 и 3.25 (оба 1Н, дт, 2J=11.9, J11,12=7.3, H-11), 7.13-7.16 (1Н, м, Н-16), 7.16-7.19 (2Н, м, Н-14), 7.21-7.25 (2Н, м, Н-15). ЯМР 13С (150 МГц, CDCl3, δ, м.д.): 182.26 с (С-1), 140.54 с (С-13), 128.91 д (С-14), 128.02 д (С-15), 125.73 д (С-16), 53.95 т (С-11), 53.40 с (С-6), 46.66 с (С-7), 43.57 д (С-3), 36.88 т (С-12), 35.28 т (С-2), 32.04 т (С-5), 27.20 т (С-4), 19.26 к (С-9), 18.79 к (С-10), 11.35 к (С-8). 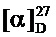 =29 (CHCl3, с=0.9). Найдено: m/z 255.1986 [М]+C18H25N. Вычислено: М=255.1982.
=29 (CHCl3, с=0.9). Найдено: m/z 255.1986 [М]+C18H25N. Вычислено: М=255.1982.
Пример 6.
Получение 2(3,4-диметоксифенил)-N-(1,7,7-триметилбицикло[2.2.1]гептан-2-илиден)этанамина If.
Реакционную смесь, содержащую 3 г (0.019 моль) камфоры, 1.3 г (0.016 моль) 3,4-диметоксифенетиламина и каталитическое количество ZnCl2 кипятили с обратным холодильником 7 ч. Смесь обрабатывали насыщенным раствором NaCl, экстрагировали диэтиловым эфиром, масса полученной смеси 6.1 г. Очищали вакуумной перегонкой Ткип.=165-169°С (10 мм рт.ст). Получили 4.3 г соединения If, выход 73%.
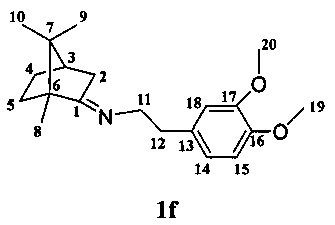
ЯМР 1Н (500МГц, CDCl3, δ, м.д„ J/Гц): 0.57 (3Н, с, Ме-9), 0.84 (3Н, с, Ме-10), 0.92 (3Н, с, Ме-8), 0.99 (1Н, ддд, 2J=12.3, J4н,5н=9.3, J4н,5к=4.2, Н-4н), 1.23 (1H, ддд, 2J=12.3, J5н,4н=9.3, J5н,4к=4.5, Н-5н), 1.57 (1Н, д, 2J=16.9, Н-2н), 1.58 (1Н, ддд, 2J=J5к,4к=12.3, J5к,4н=4.2, Н-5к), 1.73 (1Н, ддддд, 2J=J4к,5к=12.3, J4к,5н=J4к,3=4.5, J4к,2к=3.2, H-4к), 1.79 (1Н, дд, J3,2к=J3,4к=4.5, Н-3), 2.14 (1H, ддд, 2J=16.9, J2к,3=4.5, J2к,4к=3.2, H-2к), 2.77-2.87 (2H, м, H-12), 3.38 и 3.45 (каждый 1H, дт, 2J=12.0, J11,12=7.2, H-11), 3.79 (3Н, c, OMe-19), 3.81 (3Н, c, OMe-20), 6.68-6.78 (3Н, м, H-14, H-17, H-18). ЯМР 13C (125 МГц, CDCl3, δ, м.д.): 182.01 с (C-1), 148.50 с (C-16), 147.15 с (C-15), 133.33 с (C-13), 120.68 д (C-18), 112.46 д (C-14), 111.15 д (C-17), 55.82 к (C-19), 55.61 к (C-20), 54.04 т (C-11), 53.33 с (C-6), 46.60 с (C-7), 43.59 д (C-3), 36.44 т (C-12), 35.26 т (C-2), 32.04 т (C-5), 27.21 т (C-4), 19.21 к (C-9), 18.74 к (C-10), 11.32 к (C-8).
Пример 7.
Изучение цитотоксичности соединений Ia-f.
Токсичность продуктов была изучена в отношении клеток MDCK. Клетки MDCK сеяли в 96-луночные планшеты и культивировали при 37°С в среде MEM с добавлением 10% сыворотки крупного рогатого скота в атмосфере 5% CO2 (в газопроточном инкубаторе Sanyo-175) до состояния монослоя. Из исследуемых соединений Ia-е готовили маточный раствор концентрации 10 мг/мл в диметилсульфоксиде, после чего готовили серию двукратных разведений препаратов в среде MEM от 1000 до 3,75 μg/ml. Растворенный препарат вносили в лунки планшетов и инкубировали 2 сут при 37°С. По истечении этого срока клетки промывали 2 раза по 5 мин фосфатно-солевым буфером, и количество живых клеток оценивали при помощи микротетразолиевого теста (МТТ). С этой целью в лунки планшетов добавляли по 100 мкл раствора (5 мг/мл) 3-(4,5-диметилтиазолил-2) 2,5-дифенилтетразолия бромида (ICN Biochemicals Inc., Aurora, Ohio) на физиологическом растворе. Клетки инкубировали при 37°С в атмосфере 5% CO2 в течение 2 ч и промывали 5 мин фосфатно-солевым буфером. Осадок растворяли в 100 мкл на лунку ДМСО, после чего оптическую плотность в лунках планшетов измеряли на многофункциональном ридере Victor 1420 (Perkin Elmer, Finland) при длине волны 535 нм. По результатам теста для каждого продукта определяли 50% цитотоксическую дозу (CTD50), т.е. концентрацию соединения, вызьшающую гибель 50% клеток в культуре. Результаты приведены в таблице.
Пример 8.
Изучение противовирусной активности препаратов.
Определение противовирусной активности препаратов проводили на клетках MDCK в 96-луночных планшетах для клеточных культур. Соединения растворяли в поддерживающей среде для клеток, вносили в лунки панелей с клеточным монослоем и инкубировали в течение 1 ч при 36°С в атмосфере 5% CO2.
Из вируссодержащей жидкости (штамм A/California/07/09 (H1N1)pdm09) готовили серию десятикратных разведений от 10-1 до 10-7, добавляли в лунки с препаратами и инкубировали при 36°С в течение 48 ч в атмосфере 5% CO2. По окончании срока инкубации 100 мкл культуральной жидкости смешивали с равным объемом 1% куриных эритроцитов в отдельных планшетах с круглым дном. Учет результатов проводили через 60 мин инкубации при 20°С. За титр вируса принимали величину, обратную десятичному логарифму наибольшего разведения исходного вируса, способного вызвать положительную реакцию гемагглютинации в лунке и выражали в количестве 50% инфекционных доз (ID50). Вирусингибирующее действие исследуемых соединений оценивали по снижению титра вируса в опыте по сравнению с контролем. На основании полученных данных рассчитывали 50% ингибирующую дозу ED50, то есть концентрацию препарата, снижающую уровень вирусной репродукции вдвое (на 0,3 lg ID50), и химиотерапевтический индекс или индекс селективности (SI), представляющий собой отношение CTD50 к ED50.
В процессе исследования ингибирования репродукции вируса гриппа соединениями общей формулы I и эталонами сравнения (амантадином, ремантадином и дейтифорином) были получены результаты, приведенные в таблице.
Пример 9.
Исследования острой токсичности соединения Ic выполнены на аутбредных мышах стока CD-1 СПФ статуса. Каждая группа состояла из 5-6 мышей. Исследуемое вещество в дозах 2500 мг/кг, 1250 мг/кг, 625 мг/кг, 312,5 мг/кг, 156,25 мг/кг вводили в объеме 1 мл внутрижелудочно однократно в виде суспензии, носителем являлся водный 0,5% раствор карбоксиметилцеллюлозы. После введения наблюдение за животными проводили в течение 14 дней. Фиксировали смертность и тяжелое состояние. По результатам исследования LD50 составила 1218 мг/кг (per os, мыши, самки).
Пример 10.
Для оценки острой токсичности синтезированных продуктов (Id, If) in vivo использовали белых беспородных мышей (вес 16-20 г). В каждую группу исследования брали по 6 животных. Исследуемые соединения растворяли в физиологическом фосфатном буфере (pH 7.2) и вводили животным внутрибрюшинно однократно в объеме 0,2-0,5 мл. Диапазон доз соединений составил 200-2000 мг/кг веса животных. Смертность животных регистрировали в течение 3 сут после введения. На основании данных по смертности оценивали 50% летальную дозу, т.е. дозу, вызывающую гибель 50% животных в группе. Было показано, что LD50 соединений Id, If превышает 2000 мг/кг.
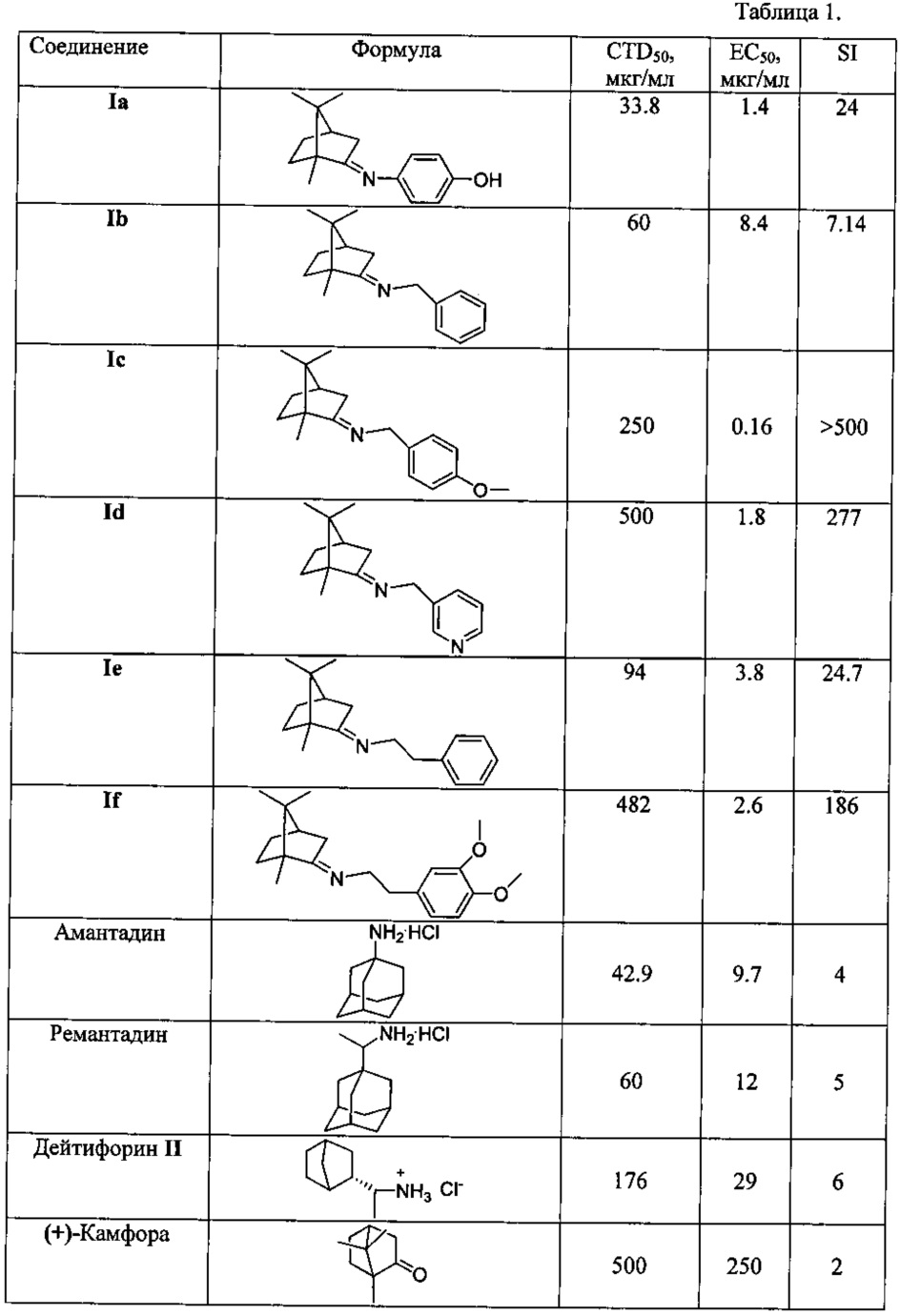
Из таблицы видно, что соединения Ia-f проявляют выраженную противовирусную активность наряду с низкой токсичностью. Химиотерапевтический индекс соединений превышает таковой у препаратов сравнения в 15 и более раз. Преимуществом данных веществ является их активность в отношении ремантадин-устойчивого штамма вируса гриппа A/California/07/09 (H1N1)pdm09, что свидетельствует о перспективности применения их для терапии современных эпидемически актуальных вирусов, подавляющее большинство которых устойчивы к ремантадину.