Результат интеллектуальной деятельности: СПОСОБ ЛЕЧЕНИЯ ОСТРЫХ БАКТЕРИАЛЬНЫХ ПОСЛЕОПЕРАЦИОННЫХ ЭНДОФТАЛЬМИТОВ
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к офтальмологии, и предназначено для лечения острых бактериальных послеоперационных эндофтальмитов путем введения в витреальную полость антибиотиков.
Эндофтальмит - воспаление внутренних оболочек глазного яблока с образованием экссудата в полости глаза. Эндофтальмит может быть экзогенным (инфекционный агент попадает в полость глаза через поврежденные структуры глазного яблока), к ним относится послеоперационный и посттравматический эндофтальмиты. Также эндофтальмит может быть эндогенным (инфекция попадает в полость глаза при сохранности оболочек глазного яблока, например из очагов хронической инфекции в организме). В свою очередь послеоперационный эндофтальмит классифицируется по скорости возникновения на острый (возникает до 6 недель с момента операции) и хронический (возникает после 6 недель). По возбудителям эндофтальмиты классифицируют на бактериальные, грибковые, вирусные, паразитарные.
Изобретение относится к лечению острых бактериальных послеоперационных эндофтальмитов.
Известен способ лечения эндофтальмитов, включающий введение внутривенно антибиотика широкого спектра действия в разовой дозе, получение аутосыворотки и введение ее в полость глаза по завершению витрэктомии. Для ирригации используют озонированный физиологический раствор двукратно по 10 мин, затем полость глаза промывают физиологическим раствором в течение 2-3 мин, а затем в полость глаза вводят сыворотку до восполнения объема (Патент на изобретение РФ №2460501).
Однако при данном способе лечения требуется системное применение антибиотиков, с неполноценным курсом лечения, что оказывает влияние на селекцию резистентных штаммов микроорганизмов, а также системное применение антибиотика может вызывать нежелательные лекарственные реакции. Озонированный физиологический раствор не вызывает гибели резистентной микрофлоры ввиду своей быстрой инактивации. В свою очередь сывороточной концентрации антибиотика в витреальной полости зачастую бывает недостаточно для получения необходимого терапевтического эффекта.
Одним из способов лечения эндофтальмитов является использование озонированного ПФОС (перфторорганическое соединение) при витрэктомии. По завершении витрэктомии проводят обмен жидкости на озонированный ПФОС в концентрации 0,3-6,0 мг/л. Через один из проколов склеры в витреальную полость вводят тупоконечную канюлю диаметром 0,6 мм на шприце и дистальный конец размещают в области зрительного нерва. Далее в полость стекловидного тела вводят 2-3 мл озонированного ПФОС, проводят круговую барьерную аргоновую эндолазеркоагуляцию сетчатки. Операция заканчивается наложением швов на склеральные и конъюнктивальные разрезы с оставлением ПФОС в витреальной полости сроком на 1-2 недели. Удаляют ПФОС методом аспирации с замещением на физиологический раствор (Патент РФ №2187984).
Недостатком данного способа является то, что малый диапазон терапевтических концентраций озонированного ПФОС сохраняет высокий риск токсического повреждения сетчатки при избыточной концентрации и недостаточный эффект при малой концентрации. Также негативным аспектом лечения является необходимость повторной операции по удалению ПФОС из витреальной полости.
Известен способ лечения эндофтальмитов, который заключается в проведении витрэктомии через трехпортовый доступ с тампонадой витреальной полости силиконовым маслом без интравитреального введения антибиотиков (АБ). Силикон из витреальной полости удаляется через 3-4 месяца (Лебедев Я.Б., Егоров В.В., Худяков А.Ю., Жигулин А.В., Руденко В.А., Мащенко Н.А. // Отдаленные результаты применения силиконовой тампонады в лечении эндофтальмита. // Современные технологии лечения витреоретинальной патологии. // 2013 - С. 122-124).
Недостатком данного способа является отсутствие химиотерапевтических агентов, которые обладают бактерицидным действием на возбудителя инфекции. Между пузырем силиконового масла и сетчаткой существует прослойка из внутриглазной жидкости (явление связано с физическими свойствами силиконового масла), в которой после силиконовой тампонады образуется повышенная концентрация микробов, возбудителей инфекции.
На сегодняшний день и у российских витреоретинальных хирургов, и у западных выработан «золотой стандарт» в лечении острых бактериальных послеоперационных эндофтальмитов.
Наиболее близкой технологией лечения острых бактериальных послеоперационных эндофтальмитов, основанной на «золотом стандарте», является технология, состоящая в следующем. На глазах с острым бактериальным послеоперационным эндофтальмитом, в максимально сжатые сроки с момента постановки диагноза (в течение 1 ч), проводят субтотальную трехпортовую витрэктомию с забором содержимого витреальной полости и передней камеры на посев микрофлоры и определение ее чувствительности к антибиотикам. Одномоментно после удаления стекловидного тела осуществляют интравитреальное введение (ИВВ) двух антибиотиков: 1 мг/0,1 мл ванкомицина, который активен в отношении грамположительной микрофлоры, в сочетании с антибиотиком, активным в отношении грамотрицательной микрофлоры: 2-2,25 мг/0,1 мл цефтазидима или 0,4 мг/0,1 мл амикацина, или 0,4 мг/0,1 гентамицина. Таким образом, перекрывается практически весь спектр возможных возбудителей бактериальной инфекции. Однако многие хирурги избегают применения аминогликозидов (амикацин, гентамицин) для эрадикации грамотрицательных бактерий из-за риска ретинальной токсичности (гентамицин в дозе 200 мкг может быть эффективным, а в дозе 400 мкг может вызывать макулярный инфаркт). Поэтому на сегодняшний день первый выбор: 1 мг/0,1 мл ванкомицина в комбинации с 2-2,25 мг/0,1 мл цефтазидимом. Оба антибиотика вводятся на завершающем этапе витрэктомии через один из разрезов склеры с использованием иглы 25-30 G в отдельных шприцах. При необходимости комбинация антибиотиков вводится повторно через 48-72 ч, в зависимости от клинического ответа. По данным EVS (исследование по витрэктомии при эндофтальмите) 1995 года 7% пациентов получали повторную интравитреальную инъекцию антибиотиков в сроки от 36 до 60 ч (Малюгин Б.Э., Шпак А.А., Морозова Т.А. Фармакологическое сопровождение современной хирургии катаракты. - М.: Офтальмология, 2010. - 15 с. - ПРОТОТИП), (Barry P., Cordoves L., Gardner S. ESCRS Guidelines for Prevention and Treatment of Endopthalmitis Following Cataract Surgery. Co Dublin: Temple House, Temple Road, Blackrock, 2013. - P. 21-22.).
Недостаток данной технологии заключается в том, что в ней не учитываются индивидуальные анатомические особенности глазного яблока пациента, в частности длина глазного яблока, которая оказывает непосредственное влияние на объем витреальной полости и соответственно влияет на концентрацию введенных антибиотиков в глазу. Отсутствие учета этих параметров может привести к недостаточной концентрации антибиотиков в глазу и соответственно повлиять на результаты лечения. Также недостатком данной технологии является выжидательная тактика, на протяжении 48-72 ч, которая может оказаться губительной для глаза при отсутствии положительной динамики в более ранние сроки.
Задачей изобретения является разработка более эффективной технологии лечения острых послеоперационных эндофтальмитов, позволяющей хирургу не пассивно наблюдать за реакцией глаза после первичного введения антибиотиков в витреальную полость, а тут же получить информацию о концентрации антибиотика в витреальной полости и оперативно принять решение о необходимости введения дополнительной порции антибиотика, если концентрация недостаточна.
Технический результат, получаемый в результате решения данной задачи, состоит в устранении инфекционного процесса в глазу, сохранении структур глаза и максимальном сохранении зрительных функций глаза.
Указанный технический результат может быть получен, если в способе лечения острого бактериального послеоперационного эндофтальмита, включающем удаление содержимого витреальной полости путем субтотальной витрэктомии с одномоментной заменой стекловидного тела на раствор BSS, забор содержимого витреальной полости и передней камеры глаза на посев микрофлоры и определение чувствительности к антибиотикам, и последующее интравитреальное введение двух антибактериальных препаратов: 1 мг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима, согласно изобретению первым из антибиотиков в витреальную полость вводят ванкомицин и после этого делают забор из витреальной полости содержимого с разведенным ванкомицином в объеме 0,2 мл, затем вводят цефтазидим, а взятую пробу с ванкомицином направляют на проведение спектрофотометрии в ультрафиолетовой области спектра с длиной волны 280 нм для определения концентрации ванкомицина в витреальной полости, и при величине концентрации 130 мкг/мл и более делают вывод о достаточности концентрации антибиотика для уничтожения бактериальной микрофлоры, а при величине концентрации менее 130 мкг/мл делают вывод о недостаточности концентрации антибиотика, и на следующий день выполняют повторное введение 1 мкг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима в витреальную полость, при этом со следующего дня после витрэктомии до получения результатов бактериологического посева в субконъюнктивальное пространство вводят 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима, 2 раза в сутки, а получив на 2-3-й день результаты бактериологического посева, оставляют для послеоперационного субконъюнктивального введения тот антибиотик, который обладает активностью в отношении выявленного возбудителя.
Среди существенных признаков характеризующих способ, отличительными являются:
- первым из антибиотиков в витреальную полость вводят ванкомицин;
- после этого делают забор из витреальной полости содержимого с разведенным ванкомицином в объеме 0,2 мл;
- затем вводят цефтазидим;
- взятую пробу с ванкомицином направляют на проведение спектрофотометрии в ультрафиолетовой области спектра с длиной волны 280 нм для определения концентрации ванкомицина в витреальной полости;
- при величине концентрации 130 мкг/мл и более делают вывод о достаточности концентрации антибиотика для уничтожения бактериальной микрофлоры;
- при величине концентрации менее 130 мкг/мл делают вывод о недостаточности концентрации антибиотика, и на следующий день выполняют повторное введение 1 мкг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима в витреальную полость;
- при этом со следующего дня после витрэктомии до получения результатов бактериологического посева в субконъюнктивальное пространство вводят 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима, 2 раза в сутки;
- получив на 2-3-й день результаты бактериологического посева, оставляют для послеоперационного субконъюнктивального введения тот антибиотик, который обладает активностью в отношении выявленного возбудителя.
Между совокупностью существенных признаков и заявляемым техническим результатом существует причинно-следственная связь.
Известно, что «золотой стандарт» лечения острых эндофтальмитов заключается в интравитреальным введении (после выполненной витрэктомии) двух антибактериальных препаратов в объемах 1 мг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима. Эти нормы удовлетворяют при средней длине глазного яблока (23,4 мм). Однако практика показывает, что такой дозы бывает недостаточно, чтобы купировать воспалительный процесс в ситуации, когда глазное яблоко имеет большую длину глаза (миопия высокой степени). Большая длина ведет к большему объему глазного яблока, следовательно, большей по объему витреальной полости. В большем по объему глазу концентрация антибиотика (если вводим 1 мг/0,1 мл ванкомицина согласно «золотому стандарту») будет меньше, чем в глазу со средними параметрами, действие антибиотика будет слабее, и ожидаемого эффекта получить не удастся. Именно поэтому в нашем способе после введения в витреальную полость антибиотика ванкомицина определяется его концентрация в витреальной полости и по этой величине делается вывод о достаточности или недостаточности количества антибиотика, чтобы устранить воспалительный процесс, либо следует ввести еще одну порцию антибиотиков.
Изначально антибиотиков вводят два, а концентрацию определяют только относительно ванкомицина. Это обусловлено характеристиками одного и другого антибиотика.
Известно, что в 94% случаев возбудителем интраокулярной инфекции является грамположительная бактериальная флора ([No authors Listed]. Results of the Endophthalmitis Vitrectomy Study. A randomized trial of immediate vitrectomy and of intravenous antibiotics for the treatment of postoperative bacterial endophthalmitis. Endophthalmitis Vitrectomy Study Group. Arch Ophthalmol. 1995 Dec; 113(12):1479-96).
Основным антибитиком в лечении острых бактериальных, послеоперационных эндофтальмитов является ванкомицин, т.к. он активен в отношении грамположительной бактериальной микрофлоры.
Ванкомицин является времязависимым гликопептидным антибиотиком. Это значит, что его терапевтическая активность не увеличивается с повышением дозы в растворе, а зависит от стабильной терапевтической концентрации в течение длительного промежутка времени (Piguet В., Chobaz С., Grounauer P.A. Toxic retinopathy caused by intravitreal injection of amikacin and vancomycin. Klin Monbl Augenheilkd. 1996 May; 208(5):358-9). Из этого следует, что повторные интравитреальные инъекции ванкомицина способны наиболее эффективно уничтожать бактериальную флору в глазу. При этом повторные инъекции ванкомицина на следующие сутки являются безопасными, учитывая тот факт, что ванкомицин является катионным препаратом с большим размером молекулы и покидает структуры глазного яблока путем пассивной диффузии через угол передней камеры глаза в течение 24 ч (Coco R.M., 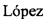 M.I., Pastor J.C., Nozal M.J. Pharmacokinetics of intravitreal vancomycin in normal and infected rabbit eyes. J Ocul Pharmacol Ther. 1998 Dec; 14(6):555-63).
M.I., Pastor J.C., Nozal M.J. Pharmacokinetics of intravitreal vancomycin in normal and infected rabbit eyes. J Ocul Pharmacol Ther. 1998 Dec; 14(6):555-63).
Вторым антибиотиком для интравитреального введения является цефтазидим. Цефтазидим представляет собой анионную молекулу небольшого размера с коротким периодом выведения из глаза (в течение 8 ч) путем активной диффузии трансретинально (Maurice DM. In: Symposium on ocular therapy. Leopold I.H., Burns R.P., editor. Wiley, New York; 1976. Injection of drugs into the vitreous body; pp. 59-72). Повторное интравитреальные введение цефтазидима (одновременно с ванкомицином на следующие сутки) при обнаружении недостаточной концентрации ванкомицина не является опасным для структур глаза (сетчатки). Его введение вместе с ванкомицином позволит перекрыть весь спектр возможных возбудителей интраокулярной инфекции, и это следует делать, так как к этому моменту еще не получен результат посева (он готовится 2-3 дня).
Для полного уничтожения бактериальной микрофлоры необходима определенная концентрация ванкомицина в витреальной полости. Нами определена эта концентрация, она должна быть 130 мкг/мл и более.
В определении чувствительности бактерий к различным антибиотикам используется несколько понятий. Минимально ингибирующая концентрация (МИК) - показатель действия антибиотика на бактериальную культуру, равный его минимальной концентрации, при которой происходит полное угнетение роста бактерий.
Минимально бактерицидная концентрация (МБК) - это наименьшая концентрация антибиотика, которая вызывает гибель 99,9% микроорганизмов от исходного уровня в течение определенного периода времени.
В соответствии с данными литературы для большинства штаммов, в отношении которых ванкомицин обладает умеренной активностью и которые зачастую являются возбудителями острого бактериального послеоперационного эндофтальмита, МИК варьирует между 0,03 и 16 мкг/мл (Белобородова Н.В. Антибиотики гликопептиды: клиническое значение. Российский Медицинский журнал, 1998. - N 13. - С. 832-836). В свою очередь для полного уничтожения бактериальной флоры минимально бактерицидные концентрации (МБК) ванкомицина должны превышать минимально ингибирующие концентрации (МИК) в 2-8 раз (Zeckel M.L. A closer look at vancomycin, teicoplanin, and antimicrobial resistance. J.Chemother 1997 Oct; 9(5):311-31; discussion 332-5).
Из этого следует, что умножение 16 мкг/мл (наибольшая МИК для возбудителей) на 8 (максимальный порог МБК) приводит к величине концентраций, равной 128 мкг/мл. Соответственно величина концентрации ванкомицина в витреальной полости 128 мкг/мл и выше позволит абсолютно точно уничтожить возбудителя внутриглазной инфекции. Учитывая математический расчет и анализируя наш практический опыт, мы, подстраховываясь, немного завышаем эту границу и устанавливаем ее равной 130 мкг/мл. Таким образом, при величине концентрации 130 мкг/мл и более делают вывод о достаточности концентрации антибиотика для уничтожения бактериальной микрофлоры, а при величине концентрации менее 130 мкг/мл делают вывод о недостаточности концентрации антибиотика и на следующий день выполняют повторное введение 1 мкг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима в витреальную полость.
Этими расчетами определена граница достаточности и недостаточности количества антибиотика в витреальной полости, которая определяется по его концентрации.
Сама же концентрация антибиотика конкретно в витреальной полости ранее не определялась и в этом тоже есть новизна и неочевидность технического решения. Известен способ определения концентрации ванкомицина методом спектрофотометрии в ультрафиолетовой (УФ) области в лабораторных условиях, который заключается в нагревании образца на водяной бане в течение 15 мин для формирования the nitroso derivative of the antibiotic, с последующим измерением топтического поглощения с длиной волны 240 нм. Линейность регистрируется в диапазоне 4-32 мкг/мл, а предел обнаружения составляет 2,7 мкг/мл (Belal F., El-Ashry S.M., El-Kerdawy М.М., El-Wasseef D.R. Voltametric determination of vancomycin in dosage forms through treatment with nitrous acid. Arzneimittel-Forschung/Drug Research, 2001, Volume 51, Issue 9, Pages 763-768).
В нашем способе мы имеем дело с гораздо большей концентрацией ванкомицина в витреальной полости, чем в выше названном источнике. Наши исследования и построение калибровочных зависимостей показали, что длина волны 280 нм является более точной для работы с такими концентрациями, как в нашем случае.
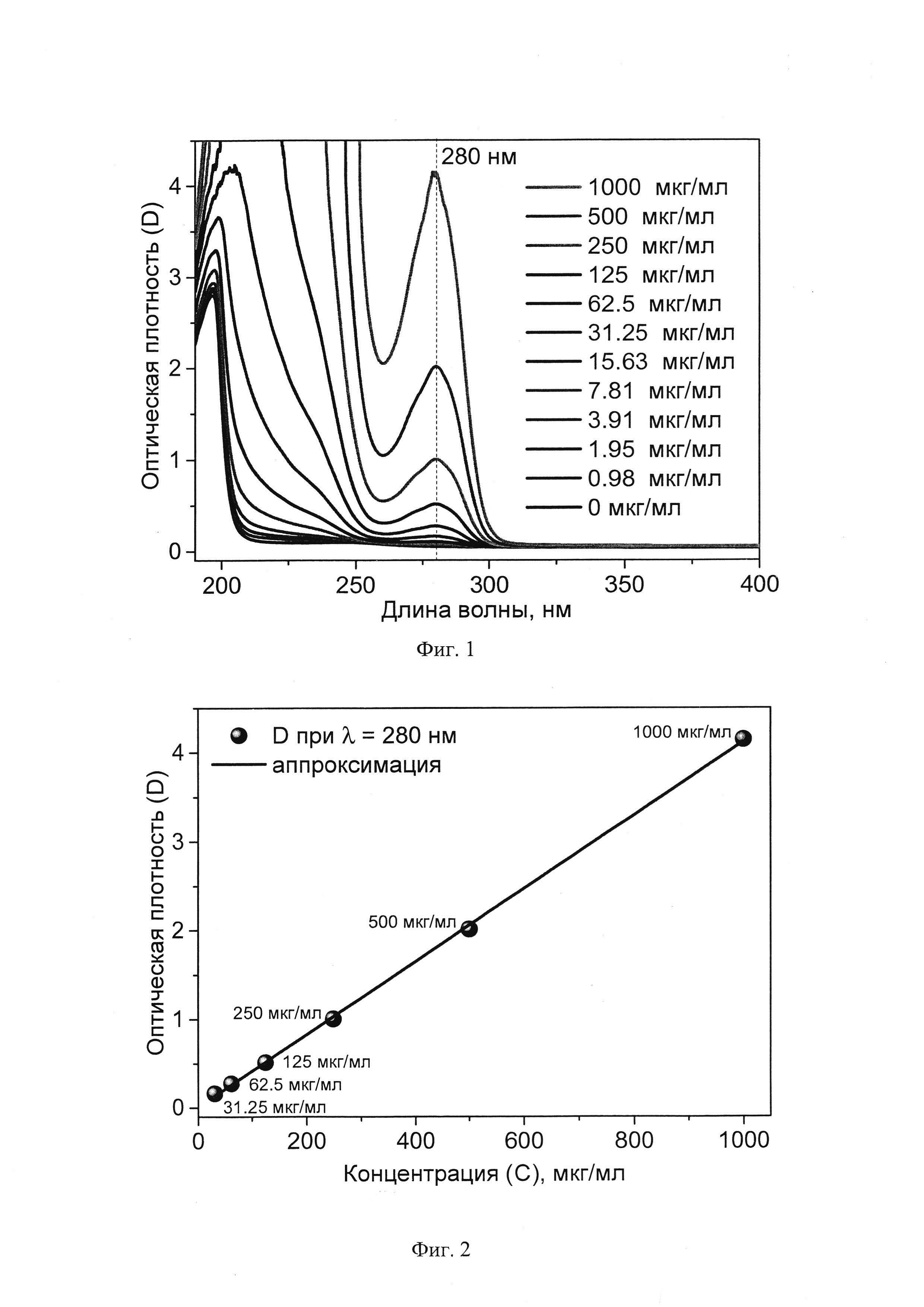
На фиг. 1 представлены экспериментальные спектры оптического поглощения (ОП), измеренные в области 190-400 нм при комнатной температуре. Концентрации ванкомицина в физрастворе изменялась в диапазоне С=0-1000 мкг/мл. Видно, что при увеличении концентрации регистрируется рост оптической плотности D в спектральных областях 270-290 нм. На фиг. 2 приведены калибровочные зависимости D(C) для длины волны 280 нм. Зависимость удовлетворительно описываются уравнением прямой D=k⋅C с коэффициентом детерминации R2>0,999. Параметры аппроксимации приведены в таблице.
Параметры аппроксимации калибровочных зависимостей D(C)

По полученной экспериментальной калибровочной зависимости D(C) (фиг. 2) можно определить неизвестную Cx концентрацию ванкомицина в пробе, взятой из витреальной полости глаза, путем измерения оптической плотности пробы Dx на длине волны 280±10 нм для концентрации ванкомицина Cx=30-1000 мкг/мл. Таким образом, загрузив в прибор-спектрофотометр полученную калибровочную зависимость и поместив в него пробирку с пробой, взятой из витреальной полости, прибор проводит автоматическое определение концентрации ванкомицина и выдает результат.
Таким образом, мы показали, что между совокупностью существенных признаков и заявляемым техническим результатом существует причинно-следственная связь.
Способ осуществляется следующим образом. После установления диагноза - острый бактериальный послеоперационный эндофтальмит, незамедлительно (в течение 1 ч) приступают к выполнению трехпортовой витрэктомии через микродоступы (25G-27G).
Все порты должны иметь клапаны для предотвращения рефлюкса жидкости во время манипуляций, в том числе с антибиотиками. После постановки портов, через парацентез выполнятся забор содержимого передней камеры на посев микрофлоры, содержимое помещается в стерильную пробирку. Далее аспирационная линия отключается от системы витреотома и подключается к шприцу, который держит ассистент. Приступают к этапу забора содержимого из витреальной полости на посев.
Для этого с помощью витреотома удаляют часть стекловидного тела в оптической зоне, а в это время ассистент тянет поршень подключенного шприца на себя и аспирирует фрагментированное стекловидное тело в шприц. Затем содержимое помещается в отдельную пробирку для бактериологического исследования. Витреотом вновь подключается к аспирационной линии прибора. Включается ирригация, приступают к основному этапу - удалению патологически измененного стекловидного тела и замене его на раствор BSS. Манипуляции выполняются под визуальным контролем для снижения риска ятрогенного повреждения сетчатки. Обязательным этапом является выделение задней гиалойдной мембраны и удаление экссудативных мембран.
Затем приступают к этапу интравитреального введения антибиотиков через порт с клапаном. Начинают с ванкомицина. Медленно в центр витреальной полости вводят ванкомицин в дозе 1 мг/0,1 мл. Такой способ введения позволяет препарату быстро и равномерно распределиться по всему объему витреальной полости. Затем осуществляют забор содержимого витреальной полости, то есть забор раствора BSS с разведенным в нем ванкомицином. Эту процедуру выполняют с помощью отдельно взятого шприца объемом 1 мл с иглой 30 G. Иглу вводят в витреальную полость через порт и осуществляют забор содержимого в объеме 0,2 мл. Данный объем является необходимым и достаточным для проведения спектрофотометрии и определения концентрации ванкомицина. В то же время этот объем является безопасным для глаза и не повлечет его гипотонию. Взятый раствор помещают в специально подготовленную стеклянную пробирку спектрофотометра и отправляют на исследование.
Хирург продолжает операцию: осуществляет интравитреальное введение второго антибиотика - цефтазидима в объеме 2,0-2,25 мг/0,1 мл. Цефтазидим вводится в отдельном шприце в центр витреальной полости, медленно.
На завершающем этапе извлекается последний порт, накладывается герметизирующий шов (при эндофтальмите на все микродоступы следует накладывать швы).
Содержимое передней камеры и витреальной полости отправляется в баклабораторию на посев микрофлоры и определение ее чувствительности к антибиотикам
Пробирка с содержимым, взятым из витреальной полости после проведенной витрэктомии, отправляется в лабораторию для определения концентрации ванкомицина. Пробирка устанавливается в спектрофотометр модели Shimadzu UV - 2450 и проводится спектрофотометрический анализ в ультрафиолетовой области спектра с длиной волны 280 нм. Через 4-5 мин прибор выдает концентрацию ванкомицина в пробирке, а следовательно, и в витреальной полости данного пациента. При получении величины концентрации ванкомицина 130 мкг/мл и более делается вывод о достаточности концентрации, чтобы убрать воспалительный процесс в глазу. При концентрации менее 130 мкг/мл, делается вывод о недостаточности концентрации ванкомицина в витреальной полости, и на следующие сутки выполняют повторную интравитреальную инъекцию тех же двух антибиотиков и в той же дозе, не дожидаясь изменения клинической картины.
До получения результатов бактериологического посева пациенту со следующего дня после витрэктомии в субконъюнктивальное пространство ставятся инъекции 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима 2 раза в сутки.
В соответствии со стандартами бактериологических исследований данные посева готовы на 2-3 сутки. Получив результаты посева, делаем вывод о том, какой из 2-х антибиотиков является этиопатогенетически направленными в отношении выявленного возбудителя. Именно этот антибиотик оставляется в схеме консервативного лечения (субконъюнктивальные инъекции), а второй антибиотик отменяется. В том случае, если результаты посева отрицательны (погрешность лаборатории, нарушение транспортировки и т.д.), то оба антибиотика оставляются в схеме консервативного лечения.
Пример 1. Пациент С., 68 лет, прооперирован по поводу незрелой катаракты на правом глазу. В соответствии с дооперационной эмметропичекой рефракцией и аксиальной длиной глазного яблока, равной 23,5 мм (соответствует средней длине глазного яблока у эмметропа), имплантирована ИОЛ с оптической силой 22 D. Операция прошла без осложнений. Пациент выписан из стационара, Vis OD=0,95 с корр.
На 3 сутки после операции пациент обратился с жалобами на снижение остроты зрения и боль в оперированном глазу. Данные обследования: Vis OD = pr/certae, роговица отечная, воспалительный феномен Тиндаля III ст., гипопион 2 мм, по данным ультрасонографии: интенсивная гиперрефлективная взвесь в витреальной полости.
Пациенту выставлен диагноз: острый послеоперационный эндофтальмит правого глаза.
В неотложном порядке проведено лечение заявленным способом: витрэктомия с забором содержимого витреальной полости и передней камеры на посев микрофлоры и определением ее чувствительности к антибиотикам (АБ) с интравитреальным введением (ИВВ) двух АБ: 1 мг/0,1 мл ванкомицина и 2,0 мг/0,1 мл цефтазидима. После введения 1 мг/0,1 мл ванкомицина осуществлен забор содержимого витреальной полости в объеме 0,2 мл для определения концентрации ванкомицина. Затем введено 2,0 мг/0,1 мл цефтазидима. Концентрация ванкомицина определена методом спектрофотометрии в УФ области спектра (длина волны 280 нм). Концентрация составила 200 мкг/мл. Полученная концентрация ванкомицина в витреальной полости у данного пациента больше 130 мкг/мл и согласно изобретению является достаточной для уничтожения бактериальной микрофлоры и получения стойкого терапевтического эффекта.
На следующие сутки отмечена значительная положительная динамика, Vis=0,1. В этот же день выполнено введение в субконъюнктивальное пространство 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима, 2 раза в сутки.
По данным бактериологического исследования, полученного на 2 сутки после витрэктомии, выявлен метициллен резистентный золотистый стафилококк (MRSA), в отношении которого ванкомицин обладает умеренной активностью. Цефтазидим, который не активен в отношении MRSA, убран из схемы лечения. Далее последовало консервативное лечение глаза, состоящее в проведении субконъюнктивальных инъекций: 25 мг/0,5 мл ванкомицина 2 раза в день, до полного выздоровления. Интравитреальных инъекций антибиотиков не требовалось. На 6 сутки пациент выписан из стационара, Vis=0,7. При осмотре через 3 мес, Vis=0,9.
Пример 2. Пациент Д., 71 год, прооперирован по поводу незрелой катаракты на левом глазу. В соответствии с дооперационной миопической рефракцией и аксиальной длиной глазного яблока, равной 29,5 мм (соответствует миопии высокой степени), была имплантирована ИОЛ с оптической силой 3 D. Операция прошла без осложнений. Пациент выписан из стационара, Vis=0,55 с корр.
На 4 сутки после операции пациент обратился с жалобами на снижение остроты зрения и боль в оперированном глазу. Данные обследования: Vis OS = pr/certae, роговица отечная, воспалительный феномен Тиндаля III ст., гипопион 1,5 мм, по данным ультрасонографии: интенсивная гиперрефлективная взвесь в витреальной полости.
Пациенту выставлен диагноз: острый послеоперационный эндофтальмит правого глаза.
В неотложном порядке проведено лечение заявленным способом: витрэктомия с забором содержимого витреальной полости и передней камеры на посев микрофлоры с определением ее чувствительности к антибиотикам с интравитреальным введением двух антибиотиков: 1 мг/0,1 мл ванкомицина и 2,25/0,1 мл цефтазидима. После введения 1 мг/0,1 мл ванкомицина осуществлен забор содержимого витреальной полости в объеме 0,2 мл для определения концентрации ванкомицина. Затем введено 2,25 мг/0,1 мл цефтазидима. Концентрация ванкомицина определена методом спектрофотометрии в УФ-области спектра (длина волны 280 нм). Концентрация составила 85 мкг/мл. Полученная концентрация ванкомицина в витреальной полости у данного пациента меньше 130 мкг/мл, следовательно, согласно изобретению эта концентрация является недостаточной для уничтожения бактериальной микрофлоры и получения стойкого терапевтического эффекта (длина глаза больше средней).
На следующие сутки имеем: положительная клиническая динамика отсутствует, Vis OD = pr/certae, роговица отечная, воспалительный феномен Тиндаля III ст, гипопион 1,5 мм, по данным ультрасонографии: сохраняется интенсивная гиперрефлективная взвесь в витреальной полости.
Учитывая отсутствие положительной клинической динамики после витрэктомии с интравитреальным введением антибиотиков и полученного результата концентрации ванкомицина - 85 мкг/мл (менее 130 мкг/мл), выполнено повторное интравитреальное введение вышеуказанных препаратов в первоначальной дозе.
Также и в первые, и во вторые сутки после витрэктомии до получения результатов бактериологического посева в субконъюнктивальное пространство вводили 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима, 2 раза в сутки.
На третьи сутки отмечена положительная динамика в отношении обратного развития симптомов, Vis=0,05.
По данным бактериологического посева, полученного на 3 сутки после витрэктомии, выявлен MRSA, в отношении которого умеренной активностью обладает ванкомицин. Цефтазидим, который не активен в отношении MRSA, убран из схемы лечения. Последующие консервативное лечение заключалось в субконъюнктивальных инъекциях 25 мг/0,5 мл ванкомицина 2 раза в день, до полного выздоровления. Интравитреальных инъекций антибиотиков больше не проводилось. На 7 сутки пациент выписан из стационара, Vis=0,3. При осмотре через 3 мес, Vis=0,45.
В Екатеринбургском центре заявленным способом прооперировано 11 пациентов с острым послеоперационным бактериальным эндофтальмитом, во всех случаях получены положительные анатомические и функциональные результаты. У 7 пациентов со средней длиной глазного яблока, после интравитреального введения ванкомицина, его концентрация была более 130 мкг/мл и действительно на 2 сутки динамика у этих пациентов была положительной. У 4-х пациентов с длиной глазного яблока выше средней, и, следовательно, с большим объемом витреальной полости, полученная концентрация ванкомицина была меньше 130 мкг/мл. Это потребовало повторных интравитреальных инъекций АБ на вторые сутки (в той же дозе). Повторное введение антибиотиков было проведено на 4-х глазах и был получен положительный результат: устранен инфекционный процесс в глазах, сохранены структуры глаз, максимально сохранены зрительные функции глаз.
Способ лечения острого бактериального послеоперационного эндофтальмита, включающий удаление содержимого витреальной полости путем субтотальной витрэктомии с одномоментной заменой стекловидного тела на раствор BSS, забор содержимого витреальной полости и передней камеры глаза на посев микрофлоры и определение чувствительности к антибиотикам, и последующее интравитреальное введение двух антибактериальных препаратов: 1 мг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима, отличающийся тем, что первым из антибиотиков в витреальную полость вводят ванкомицин и после этого делают забор из витреальной полости содержимого с разведенным ванкомицином в объеме 0,2 мл, затем вводят цефтазидим, а взятую пробу с ванкомицином направляют на проведение спектрофотометрии в ультрафиолетовой области спектра с длиной волны 280 нм для определения концентрации ванкомицина в витреальной полости, и при величине концентрации 130 мкг/мл и более делают вывод о достаточности концентрации антибиотика для уничтожения бактериальной микрофлоры, а при величине концентрации менее 130 мкг/мл делают вывод о недостаточности концентрации антибиотика, и на следующий день выполняют повторное введение 1 мкг/0,1 мл ванкомицина и 2,0-2,25 мг/0,1 мл цефтазидима в витреальную полость, при этом со следующего дня после витрэктомии до получения результатов бактериологического посева в субконъюнктивальное пространство вводят 25 мг/0,25 мл ванкомицина и 100 мг/0,5 мл цефтазидима, 2 раза в сутки, а получив на 2-3-й день результаты бактериологического посева, оставляют для послеоперационного субконъюнктивального введения тот антибиотик, который обладает активностью в отношении выявленного возбудителя.