Результат интеллектуальной деятельности: Способ очистки нитчатого бактериофага М13
Вид РИД
Изобретение
Изобретение относится к методам очистки бактериофагов осаждением для применения их в технологии фагового дисплея, для изготовления медицинских биологических препаратов или в качестве матрицы для наноматериалов [1] и может быть использовано в биотехнологии.
Нитчатые бактериофаги (фаги) - это нелитические вирусы, инфицирующие бактерии и безопасные для человека. Фаги используются в ряде отраслей. Для борьбы с нежелательной бактериальной контаминацией, в том числе как антибактериальные препараты для обработки труднозаживающих ран, как безопасный консервант для пищевых продуктов. Нашли свое использование бактериофаги и в науке: для получения антител и пептидов в технологии фагового дисплея, генной терапии, для генно-инженерных работ и в качестве матрицы для получения наночастиц.
Нитчатый фаг М13 имеет размер около 880 нм в длину и 6,5 нм в ширину [2], кольцевую одноцепочечную ДНК. Капсид бактериофага М13 образован 5 копиями различных минорных оболочечных белков (р3, р6, р7, р9), однако большую часть его капсида составляет мажорный оболочечный белок р8, представленный 2700 копиями. Белок р8 это небольшой, длиной 50 а.о., альфа-спиральный белок. В составе вирусной частицы этот белок уложен в виде трубчатой структуры, при этом N-конец белка направлен в сторону раствора, и С-концевые белки образуют контакт с ДНК бактериофага. Подобная укладка белка приводит к тому, что, фактически, физико-химические свойства целой частицы определяются аминокислотной последовательностью N-конца белка р8 фага М13 - AEGDDPAK. В частности, изоэлектрическую точку (значение рН, при котором суммарный заряд этой молекулы равен нулю) вирусной частицы можно определить, если определить изоэлектрическую точку пептида - AEGDDPAK. Это значение было найдено теоретически, и подтверждено экспериментально, и равно 4,2 [3].
Методы осаждения фага М13 из культуры E. coli, как правило, основаны на использовании полиэтиленгликоля. Осаждение фагов с помощью ПЭГ и NaCl основано на эффекте «высаливания». Добавление больших количеств ПЭГ совместно с высокими концентрациями NaCl экранирует поверхностный заряд вирусной частицы и увеличивает гидрофобность ее поверхности, это приводит к слипанию вирусных частиц и выпадению их в осадок.
Этот подход имеет ряд очевидных недостатков: осаждение происходит длительное время, а в результате в осадке фагов присутствует ПЭГ, NaCl и остатки культуральной среды. Очистка фагов от примесей после такого осаждения весьма затруднена. Процедура диализа проводится в течение недели [4].
В источниках информации опубликованы данные об использовании ионнобменной и гель-проникающей хроматографии [5, 6, 7]. Однако это дорогие и трудоемкие методы для очистки фагов, которые не нашли широкого применения.
Наиболее близким аналогом (прототипом) предлагаемого технического решения является способ очистки нитчатого бактериофага М13, описанный в работе [4] и включающий удаление бактериальной массы после наработки бактериофага М13 путем первого и второго последовательного центрифугирования с последующей первой очисткой супернатанта бактериофага изоэлектрическим осаждением реагентом при pH 4,2. Для изоэлектрического осаждения бактериофага М13 из культуральной среды используют сильную кислоту - HCl. Добавление 5М HCl проводят до значения pH 4,2, контролируя его при помощи pH-метра. После доведения значения pH до нужного, суспензию бактериофагов помещают в холодильник на 1-, 5-2 часа для образования осадка. Далее проводят третье центрифугирование и ресуспендирование осадка с бактериофагом, а также повторной очисткой суспензии бактериофага изоэлектрическим осаждением 5М HCl при pH 4,2 и четвертое центрифугирование осадка с бактериофагом с получением готового продукта.
Однако у этого метода есть ряд недостатков. Основная сложность связана с тем, что многие процедуры при работе с бактериофагами требуют работы с небольшими объемами (500-1500 мкл). Измерение pH таких объемов является сложной процедурой. Используют специализированные электроды (нестандартное оборудование), которые снижают уровень стерильности и чистоты бактериофага или наносят аликвоту образца на специальную индикаторную бумагу, что приводит к потерям искомого продукта. Процедура доведения pH до необходимого значения с помощью кислоты или основания требует добавления их в определенном объеме. Рассчитать добавляемый объем сложно, так как необходимо учесть множество параметров (объем суспензии фага, pH среды, вещества, присутствующие в суспензии и т.д.), а добавление кислоты (щелочи) сопряжено с ошибками.
Техническим результатом заявляемого изобретения является упрощение способа очистки бактериофага, особенно малых его количеств, и обеспечение более высокого уровня стерильности и чистоты бактериофага.
Указанный технический результат достигается тем, что в способе очистки нитчатого бактериофага М13, включающем удаление бактериальной массы после наработки бактериофага путем первого и второго последовательного центрифугирования с последующей первой очисткой супернатанта бактериофага изоэлектрическим осаждением реагентом при pH 4,2, последующих третьего центрифугирования и ресуспендирования осадка с бактериофагом, а также повторной очисткой суспензии бактериофага изоэлектрическим осаждением реагентом при pH 4,2 и четвертого центрифугирования осадка с бактериофагом с получением готового продукта, согласно изобретению для изоэлектрического осаждения в качестве реагента используют натрий-ацетатный буфер со значением pH=4,2 в соотношении с супернатантом бактериофагов не менее 3:1 при первом изоэлектрическом осаждении; осадок с бактериофагами после третьего центрифугирования ресуспендировали в TBS-буфере (Tris Buffer Saline), а при повторной очистке ресуспендированного бактериофага изоэлектрическим осаждением используют натрий-ацетатный буфер со значением pH=4,2 в соотношении с ресуспендированным бактериофагом не менее 1:1.
Причем первое и второе центрифугирование проводят соответственно при 5000 об/мин и 12000 об/мин в течение 10 минут при 20°С, а третье и четвертое центрифугирование осуществляют при 10000 об/мин в течение 10 минут при 4°С.
Изоэлектрическое осаждение фаговых частиц с помощью буфера имеет несколько преимуществ. В первую очередь это простота: для осаждения достаточно добавить определенный объем буферного раствора, при этом нет необходимости измерять значение pH, так как буфер сохраняет необходимое для осаждения бактериофагов значение pH. Осадок бактериофагов, полученный в результате очистки, промывается водой, остатки культуральной среды легко удаляются центрифугированием за минимальное время. Значение pH можно довести добавлением кислоты или щелочи, как это делают в прототипе, но при этом существует высокая вероятность ошибки, а данный метод требует точности. Использование буфера исключает такую ошибку, и даже при больших объемах, остается дешевым способом по сравнению с использованием полиэтиленгликоля.
Важным преимуществом является чистота получаемых таким способом препаратов бактериофагов. Использование буфера в качестве осадителя позволяет избежать попадания в препарат нежелательных примесей, таких как ПЭГ в случае осаждения способом ПЭГ - NaCl. Буферная система в заявляемом способе готовится заранее, автоклавируется и в него больше не вносится никаких реагентов или технических средств контроля pH, например, электроды, а в прототипе для достижения изоэлектрической точки требуется добавление реагентов и введения электродов pH-метра для контроля концентрации ионов водорода.
Бактериофаги обычно стабильны в диапазоне pH от 5 до 8 [8], изоэлектрическая точка бактериофага М13 лежит ниже этих значений, однако, в данной работе было показано, что низкое значение pH используемого буфера не влияет на жизнеспособность фага М13, результат представлен в таблице 5.
Способ очистки нитчатого бактериофага М13 осуществляют следующим образом. Вначале удаляют бактериальную массу после наработки бактериофага путем первого и второго последовательного центрифугирования соответственно при 5000 об/мин и 12000 об/мин в течение 10 минут при 20°С. Далее проводят первую очистку супернатанта бактериофага М13 изоэлектрическим его осаждением натрий-ацетатным буфером со значением pH=4,2 в соотношении с супернатантом бактериофага не менее 3:1. Третье центрифугирование осуществляют при 10000 об/мин в течение 10 минут при 4°С. Осадок бактериофага М13 ресуспендируют в TBS-буфере (Tris Buffer Sa line) и повторно очищают осаждением. Для этого ресуспендированный бактериофаг смешивают с натрий-ацетатным буфером со значением pH=4,2 в соотношении с ресуспендированным бактериофагом не менее 1:1 с последующим четвертым центрифугированием осадка с бактериофагом при 10000 об/мин в течение 10 минут при 4°С с получением чистого продукта бактериофага М13.
Ниже приведены пример 1 и примеры 4-9 конкретного выполнения заявленного способа очистки нитчатого бактериофага М13, а для сравнения воспроизведены способ-аналог (пример 2) и способ-прототип (пример 3).
Пример 1. Наращивание культуры фага М13.
Культуру наращивали в 200 мл среды LB. Состав среды: 10 г/л триптон, 5 г/л дрожжевой экстракт, 5 г/л NaCl, pH 7.0-7.5. В 500-миллиметровую колбу Эрленмейера приливали 200 мл среды LB, добавляли 200 мкл E.coli ER2738 и 10 мкл фаговой суспензии (примерно 1×1010 БОЕ/мл), полученной из одной отдельной колонии. Наращивание проводили при 37°С, 220 об/мин, 16 часов. Бактериальные клетки удаляли двумя последовательными центрифугированиями 5000 об/мин и 12000 об/мин в течение 10 минут при 20°С.
Пример 2. Осаждение бактериофагов с помощью ПЭГ (аналог)
После удаления бактериального осадка (пример 1) 2.5 М NaCl / 20% PEG-8000 добавляли к супернатанту в соотношении 4:1. Осторожно перемешали, оставили на ночь для преципитации при 4°С. Фаги осаждали центрифугированием в течение 10 минут при 4°С, 13000 об/мин. Супернатант удаляли, осадок ресуспендировали в 10 мл деионизированной воды.
Суммарное время, необходимое для очистки фагов выше описанным способом - сутки. Однако в полученном препарате фагов даже после кратных осаждений присутствуют остатки ПЭГ, что подтверждается качественной реакцией с тиоцианатом железа. В работе [4] фаговую суспензию очищали от остатков ПЭГ с помощью диализа в течение 7 суток, но даже после этого качественная реакция с тиоцианатом железа давала положительный результат.
Титр жизнеспособных бактериофагов определяли методом Грациа. Кратное переосаждение с уменьшением объема ПЭГ привело к снижению титра на порядок, таблица 1.
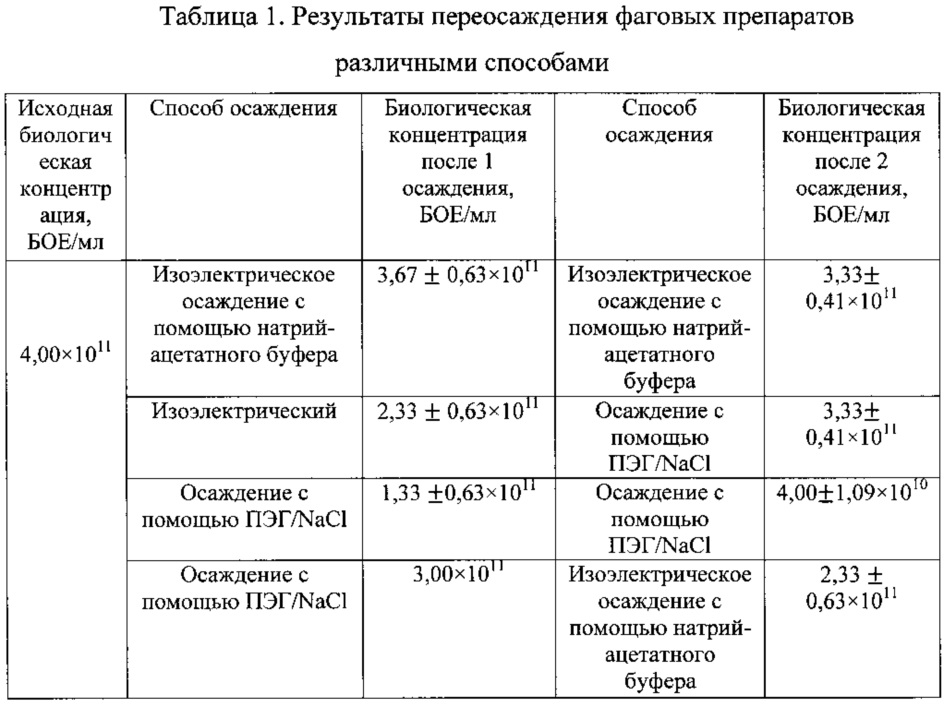
Пример 3. Изоэлектрическое осаждение бактериофагов с помощью HCl (повторение методики прототипа).
После удаления бактериального осадка (Пример 1) pH супернатанта с бактериофагами выровняли до значения 4,2 с помощью 5М HCl. После осторожного перемешивания осадок с бактериофагами осаждали центрифугированием в течение 10 минут при 20°С, 13000 об/мин. Супернатант удаляли, для удаления остатков LB среды осадок промывали 40 мл деионизированной воды, осторожно перемешивая, фаги осаждали центрифугированием в течение 10 минут при 20°С, 13000 об/мин.
Суммарное время, необходимое для очистки фагов выше описанным способом - 2 часа. Очистка полученного препарата фагов от ионов хлора не требуется, но полученный вышеописанным способом препарат содержит остатки бактериальной массы и нуждается в дополнительной очистке.
Титр жизнеспособных бактериофагов определяли методом Грациа, он составил 1011 БОЕ/мл.
Пример 4. Приготовление натрий-ацетатного буфера по заявляемому способу
Для приготовления натрий-ацетатного буфера со значением рН=4,2 использовали 0,2М раствор уксусной кислоты и 0,2М раствор ацетата натрия в пропорции 73,5:26,5 соответственно. 0,2М раствор уксусной кислоты готовили из расчета 1,2 мл ледяной уксусной кислоты на 100 мл воды; 0,2М раствор ацетата натрия готовили, используя тригидрат ацетата натрия из расчета 2,72 г на 100 мл воды.
Для измерения pH использовали pH-метр Sartorius РВ-11.
Пример 5. Определение объема натрий-ацетатного буфера со значением рН=4,2, необходимого для осаждения фагов из культуральной среды LB
Исходная среда LB имела значение рН=7,4. После удаления бактериального осадка (Пример 1) среда LB с бактериофагами имела значение рН=7,38. При добавлении трех объемов буфера значение pH достигало 4,29 - верхнего допустимого значения. При этом значении бактериофаги выпадали в осадок. Результаты осаждения представлены в таблице 2, эксперимент проведен в 14 повторностях.
Таким образом, экспериментально было определено, что для осаждения бактериофагов из культуральной среды LB необходимо добавить не менее трех объемов натрий-ацетатного буфера со значением pH=4,2.
После добавления буфера, бактериофаги охлаждали во льду в течение часа, центрифугировали 10000 об/мин в течение 10 минут при 4°С, осадок ресуспендировали в TBS буфере. Суспензию центрифугировали для удаления остатков бактериальной массы, супернатант с фагами переносили в чистую пробирку.
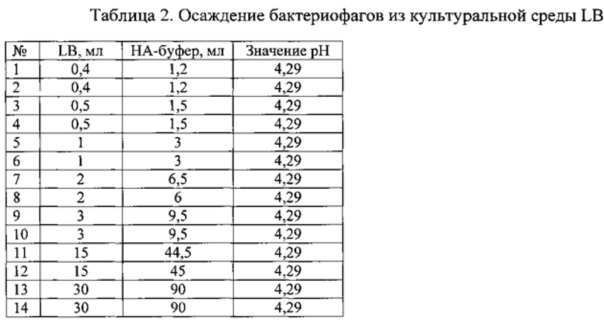
Пример 6. Определение объема натрий-ацетатного буфера со значением pH=4,2, необходимого для осаждения фагов из буфера TBS (Tris-buffered saline)
Исходный буфер TBS для ресуспендирования бактериофагов имел значение pH=7,5. После осаждения фагов из бактериальной массы, описанного в примере 5, суспензия фагов в TBS буфере имела значение pH=6,91. При добавлении одного объема буфера значение pH достигало 4,26 - близкого к верхнему допустимому значению. При этом значении бактериофаги выпадали в осадок. Результаты осаждения представлены в таблице 3, эксперимент проведен в 8 повторностях.
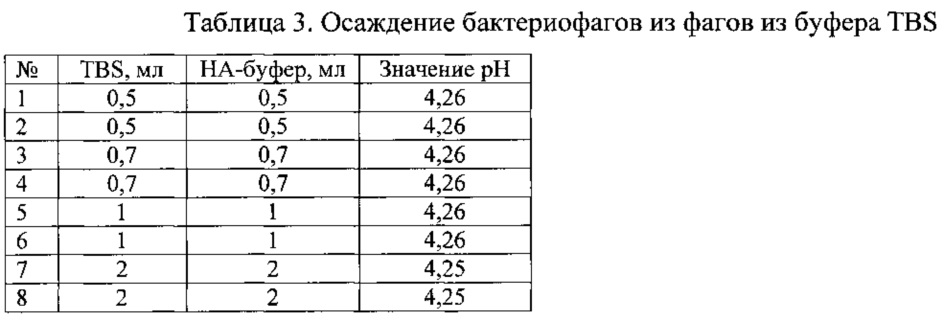
Таким образом, экспериментально было определено, что для осаждения бактериофагов из буфера TBS необходимо добавить не менее 1 объема натрий-ацетатного буфера со значением pH=4,2.
После добавления буфера, бактериофаги центрифугировали при 10000 об/мин в течение 10 минут при 4°С, осадок ресуспендировали в TBS буфере. Суспензию центрифугировали для удаления остатков бактериальной массы, супернатант с фагами переносили в чистую пробирку.
Титр жизнеспособных бактериофагов определяли методом Грациа, он составил 1011 БОЕ/мл.
Пример 7. Изоэлектрическое осаждение бактериофагов с помощью буфера заявляемым способом.
После удаления бактериального осадка (пример 1) к супернатанту с фагами добавляли натрий-ацетатный буфер Бриттона - Вальполя (табл. 4) в количестве не менее трех объемов и осторожно перемешивали. После добавления буфера, бактериофаги центрифугировали при 10000 об/мин в течение 10 минут при 4°С, осадок ресуспендировали в TBS буфере (Tris Buffer Saline). Суспензию центрифугировали для удаления остатков бактериальной массы, супернатант с фагами переносили в чистую пробирку.
Полученный препарат TBS с фагами очищали повторно. Добавляли один объем натрий-ацетатного буфера, бактериофаги центрифугировали 10000 об/мин в течение 10 минут при 4°С, осадок ресуспендировали в TBS буфере. Суспензию центрифугировали для удаления остатков бактериальной массы, супернатант с фагами переносили в чистую пробирку.
Суммарное время, необходимое для очистки фагов выше описанным способом - 2 ч. При необходимости сменить TBS буфер на другой раствор, возможны кратные переосаждения с помощью натрий-ацетатного буфера, титр при этом остается стабильным. Полученный препарат готов к дальнейшему использованию в ИФА, иммунизации лабораторных животных и т.д.
Титр жизнеспособных бактериофагов определяли методом Грациа, он составил 1011 БОЕ/мл.

Пример 8. Проверка жизнеспособности фага М13 в кислой среде
Было проведено изоэлектрическое осаждение бактериофага М13 с помощью натрий-ацетатного буфера с pH=4,2 в трех повторностях, полученные фаги инкубировали 1 час, 2 часа, 4 часа и 8 часов.
Титр жизнеспособных бактериофагов определяли методом Грациа, было показано, что pH=4,2 не влияет на его жизнеспособность, результаты представлены в таблице 5.

Пример 9. Определение выхода нитчатого бактериофага М13 гравиметрическим методом после очистки различными способами
Осадки бактериофагов, полученные в примерах 2 и 4, были высушены в сушильном шкафу при температуре 105°С. Результат представлен в таблице 6.
Препараты бактериофагов, полученные осаждением с помощью ПЭГ, содержат примеси полиэтиленгликоля и составляют около половины массы препарата. Такой вывод можно сделать, сравнивая массу препаратов фагов, полученных осаждением ПЭГ и изоэлектрическим осаждением и имеющих одинаковое количество жизнеспособных частиц.
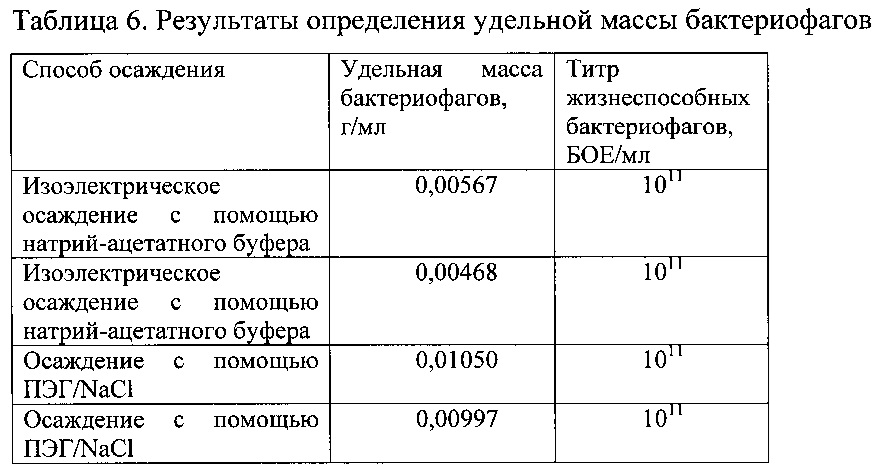
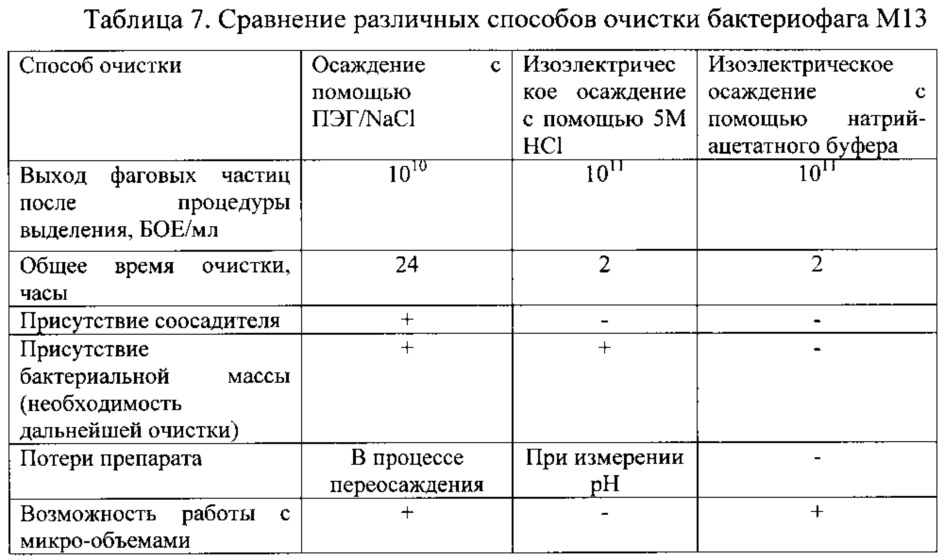
Из вышеприведенных результатов (примеры 1-9) следует, что разработан новый способ очистки бактериофагов, обеспечивающий достижение заявляемого технического результата, который заключается в упрощении способа очистки бактериофага, особенно малых его количеств, и обеспечение более высокого уровня стерильности и чистоты бактериофага.
Источники научно-технической информации
1. Rakonjac J, Bennett NJ, Spagnuolo J, Gagic D, Russel M (2011) Filamentous bacteriophage: biology, phage display and nanotechnology applications. Mol Biol 13: 51-76
2. Chung WJ, Oh JW, Kwak K, Lee BY, Meyer J, Wang E, Hexemer A, Lee SW (2011) Biomimetic self-templating supramolecular structures. Nature 478: 364-368
3. Zimmermann K, Hagedorn H, Heuck CC, Hinrichsen M, Ludwig H (1986) The ionic properties of the filamentous bacteriophages Pf1 and fd. J Biol Chem 261: 1653-1655
4. Dong Dexian et al. A simple and rapid method to isolate purer M13 phage by isoelectric precipitation // Applied microbiology and biotechnology. - 2013. - T. 97. - №. 18. - C. 8023-8029 (прототип).
5. Monjezi R, Теу ВТ, Sieo CC, Tan WS (2010) Purification of bacteriophage M13 by anion exchange chromatography. J Chromatogr В 878: 1855-1859
6. Zakharova MY, Kozyr AV, Ignatova AN, Vinnikov IA, Shemyakin IG, Kolesnikov AV (2005) Purification of filamentous bacteriophage for phage display using size-exclusion chromatography. Biotechniques 38: 194-198
7. Reitinger S, Petriv OI, Mehr K, Hansen CL, Withers SG (2012) Purification and quantitation of bacteriophage M13 using desalting spin columns and digital PCR. J Virol Methods 185: 171-174
8. Каттер Э. Бактериофаги. Биология и практическое применение. / Э. Каттер, А. Сулаквелидзе. - М.: Научный мир, 2012. - С. 63.

