Результат интеллектуальной деятельности: ВЕТЕРИНАРНАЯ КОМПОЗИЦИЯ И СПОСОБ УЛУЧШЕНИЯ ЖИЗНЕСПОСОБНОСТИ ЖИВОТНЫХ, СТИМУЛЯЦИИ ПРИРОСТА ЖИВОЙ МАССЫ МЛЕКОПИТАЮЩИХ И ПТИЦ, ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ИММУНИЗАЦИИ, ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ)
Вид РИД
Изобретение
Изобретение относится к ветеринарии и может быть использовано для улучшения жизнеспособности животных, преимущественно, для повышения прироста живой массы и стимуляции роста млекопитающих и птиц, предпочтительно, сельскохозяйственных животных, повышения эффективности их иммунизации, профилактики и/или лечения широкого круга заболеваний, в том числе и инфекционных заболеваний различной этиологии, а также для повышения продуктивности, воспроизводства и сохранности поголовья.
В течение последних десятилетий, чтобы приспособиться к растущему спросу, мировая индустрия производства мяса претерпевает резкие скачкообразные изменения, при этом научный интерес к органическому производству мяса птицы и млекопитающих существенно возрос.
Чтобы повысить общую продуктивность и иммунный статус, в производстве мяса птицы и млекопитающих используется большое количество непитательных кормовых добавок, преимущественно антибиотиков. Некоторые из них рекомендованы для химиотерапевтических и профилактических целей, другие предназначены для стимуляции роста. Продолжительное использование суб-терапевтических доз таких кормовых добавок в составе корма может привести к накоплению их остаточных количеств в продуктах животного происхождения и развитию устойчивых к препаратам микроорганизмов у человека. В последние годы антибиотики больше не являются основной частью программ большинства компаний-производителей мяса птицы и млекопитающих. Европейский Союз рекомендовал отказаться от использования антибиотиков, в том числе хлортетрациклина, в качестве стимуляторов роста, для увеличения продуктивности и снижения смертности (Perreten V. 2003. Use of antimicrobials in food-producing animals in Switzerland and the European Union (EU). Mitt. Lebensm. Hyg. 94: 155-163). Это необходимо, поскольку устойчивость микроорганизмов к антибиотикам и их фрагментам в мясных продуктах может вредить здоровью потребителей. Запрет на использование синтетических кормовых добавок привел к запуску широкомасштабных исследований с целью поиска и разработки альтернативных способов поддержания здоровья и продуктивности для развивающейся системы производства мясной продукции. Основные усилия селекции направлены на активацию роста, однако подобные изменения негативно коррелируют с иммунологическими параметрами птицы и животных. В настоящее время большинство исследований направлено на создание препаратов, которые были бы способны как стимулировать рост птицы и млекопитающих, так и играть роль в увеличении продуктивности и укреплении иммунитета к различным заболеваниям. В качестве альтернативы антибиотикам-стимуляторам роста, разработаны такие стимуляторы роста, как пробиотики, пребиотики и иммуномодуляторы, при этом птицы и млекопитающие, генотипы которых определяют большую массу тела, развивают более слабый гуморальный иммунный ответ (Miller L.L., Siegel Р.В., and Dunnington Е.A. 1992. Inheritance of antibody response to sheep erythrocytes in lines of chickens divergently selected for fifty-six-day body weight and their crosses. Poult. Sci., 71: 47-52).
Из уровня техники известно использование ветеринарных композиций для профилактики и/или лечения различных, в том числе и инфекционных, заболеваний (RU 20059408 C1, A61K 9/08, 1996; RU 2440121 C1, A61K 31/7016, 2011).
Из уровня техники также известно использование различных биодобавок растительного происхождения, в том числе и включающих различные микроэлементы, ферменты и синтетические препараты (RU 2007456 С1, A23K 1/65, 1994; RU 2105496 C1, A23K 1/16, 1998; RU 2340204 C1, A23K 1/00, 2008; RU 2420089 C1, A23K 1/00, 2011; RU 2450532 C1, A23K 1/00, 2012), которые в значительном количестве вводят в рацион при кормлении животных.
Также известно использование различных стимуляторов роста для повышения прироста живой массы животных (RU 2102063 C1, A23K 1/00, 1998; RU 2268043 С2, A23K 31/41, 2006; КЛЕНОВА И.Ф., ЯРЕМЕНКО Н.А. Ветеринарные препараты в России. Справочник. М., Сельхозиздат, 2001, с. 171-174; ДЕМИДОВ Н.В. Антгельминтики в ветеринарии. М., Колос, 1982, с. 250-298).
Однако вышеуказанные препараты, как правило, многокомпонентные, имеют ограниченный диапазон эффективного воздействия и могут обладать побочным влиянием.
Изобретение направлено на создание эффективного и безопасного средства в виде ветеринарной композиции, обеспечивающего улучшение жизнеспособности животных, в том числе повышение прироста живой массы и стимуляции роста млекопитающих и птиц, преимущественно, сельскохозяйственных животных, эффективную иммунизации, профилактику и/или лечение широкого круга заболеваний, в том числе и инфекционных, различной этиологии, повышение качества жизни животных, а также повышение продуктивности, воспроизводства и сохранности поголовья.
Решение поставленной задачи и достижение заявленного технического результата обеспечивается тем, что ветеринарная композиция содержит активированную - потенцированную форму антител к рецептору инсулина.
Предпочтительно, ветеринарная композиция содержит активированную - потенцированную форму антител к β-субъединице рецептора инсулина или содержит активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Кроме того, ветеринарная композиция может быть выполнена в твердой лекарственной форме и содержать технологически необходимое количество нейтрального носителя, насыщенного активированной - потенцированной формы антител к С-концевому фрагменту β-субъединицы рецептора инсулина, и фармацевтически приемлемые добавки.
При этом водный или водно-спиртовой раствор активированных - потенцированных форм антител к С-концевому фрагменту β-субъединицы рецептора инсулина получен путем многократного последовательного разведения матричного раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в сочетании с внешним воздействием - вертикальным встряхиванием каждого разведения, при этом концентрация матричного раствора составляет 0,5÷5,0 мг/мл.
При этом используют смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, приготовленных по гомеопатической технологии.
При этом фармацевтически приемлемые добавки включают лактозу, целлюлозу микрокристаллическую и магния стеарат.
Кроме того, фармацевтически приемлемые добавки включают изомальт, цикламат натрия, сахарин натрия, лимонную кислоту безводную и магния стеарат.
Ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина, используют для улучшения жизнеспособности животных.
При этом ветеринарная композиция содержит активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
Кроме того, ветеринарную композицию используют для стимуляции прироста живой массы млекопитающих и птиц.
При этом ветеринарная композиция содержит активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
Кроме того, ветеринарную композицию используют для повышения эффективности иммунизации млекопитающих и птиц.
При этом ветеринарная композиция содержит активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
Кроме того, ветеринарную композицию используют для профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц.
При этом ветеринарная композиция содержит активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
Способ улучшения жизнеспособности сельскохозяйственных животных, млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, приготовленных по гомеопатической технологии.
Способ стимуляции прироста живой массы млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, приготовленных по гомеопатической технологии.
Способ повышения эффективности иммунизации млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, приготовленных по гомеопатической технологии.
Способ профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - вертикальным встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, приготовленных по гомеопатической технологии.
Кроме того, ветеринарная композиция дополнительно включает активированную - потенцированную форму антител к гамма-интерферону человека.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и активированную - потенцированную форму антител к гамма-интерферону человека используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Кроме того ветеринарная композиция может быть выполнена в твердой лекарственной форме и содержать технологически необходимое количество нейтрального носителя, насыщенного смесью активированной потенцированной формы антител к С-концевому фрагменту β-субъединицы рецептора инсулина и активированной - потенцированной формы антител к гамма-интерферону человека, и фармацевтически приемлемые добавки.
При этом водные или водно-спиртовые растворы активированных - потенцированных форм антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека получены путем многократного последовательного разведения матричных растворов антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в сочетании с внешним воздействием - встряхиванием каждого разведения, при этом концентрация матричных растворов составляет 0,5÷5,0 мг/мл.
Причем каждый из компонентов используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
При этом фармацевтически приемлемые добавки включают лактозу, целлюлозу микрокристаллическую и магния стеарат.
Кроме того, фармацевтически приемлемые добавки включают изомальт, цикламат натрия, сахарин натрия, лимонную кислоту безводную и магния стеарат.
Как вариант, ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека, используют для улучшения жизнеспособности животных.
Кроме того, активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека используют для стимуляции прироста живой массы млекопитающих и птиц.
Кроме того, активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека используют для повышения эффективности иммунизации млекопитающих и птиц.
Кроме того, активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека используют для профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц.
Способ улучшения жизнеспособности сельскохозяйственных животных, млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека используют в виде активированного потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека, приготовленных по гомеопатической технологии.
Способ стимуляции прироста живой массы млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к гамма-интерферону человека.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека используют в виде активированного потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека, приготовленных по гомеопатической технологии.
Способ повышения эффективности иммунизации млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом, активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека используют в виде активированного потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека, приготовленных по гомеопатической технологии.
Способ профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека используют в виде активированного потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека, приготовленных по гомеопатической технологии.
Как вариант, ветеринарная композиция дополнительно включает активированную - потенцированную форму антител к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, активированную - потенцированную форму антител к гамма-интерферону человека и активированную - потенцированную форму антител к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Кроме того, ветеринарная композиция может быть выполнена в твердой лекарственной форме в виде комплексного препарата и содержать технологически необходимое количество нейтрального носителя, насыщенного смесью активированной - потенцированной формы антител к С-концевому фрагменту β-субъединицы рецептора инсулина, активированной - потенцированной формы антител к гамма-интерферону человека и активированной - потенцированной формой антител к CD4 рецептору, и фармацевтически приемлемые добавки.
При этом водные или водно-спиртовые растворы активированных - потенцированных форм антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору получены путем многократного последовательного разведения матричных растворов антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека в сочетании с внешним воздействием - вертикальным встряхиванием каждого разведения, при этом концентрация матричных растворов составляет 0,5÷5,0 мг/мл.
При этом каждый из компонентов используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
При этом фармацевтически приемлемые добавки включают лактозу, целлюлозу микрокристаллическую и магния стеарат.
Кроме того, фармацевтически приемлемые добавки включают изомальт, цикламат натрия, сахарин натрия, лимонную кислоту безводную и магния стеарат.
Ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору, используют для улучшения жизнеспособности животных.
Кроме того, ветеринарную композицию используют для стимуляции прироста живой массы млекопитающих и птиц.
Кроме того, ветеринарную композицию используют для повышения эффективности иммунизации млекопитающих и птиц.
Кроме того, ветеринарную композицию используют для профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц.
Способ улучшения жизнеспособности сельскохозяйственных животных, млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием -встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ стимуляции прироста живой массы млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к гамма-интерферону человека используют в виде активированного потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ повышения эффективности иммунизации млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина, к гамма-интерферону человека и к CD4 рецептору, приготовленных по гомеопатической технологии.
Как вариант ветеринарная композиция дополнительно включает активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и активированную - потенцированную форму антител к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Ветеринарная композиция может быть выполнена в твердой лекарственной форме и содержать технологически необходимое количество нейтрального носителя, насыщенного смесью активированной потенцированной формы антител к С-концевому фрагменту β-субъединицы рецептора инсулина и активированной - потенцированной формы антител к CD4 рецептору, и фармацевтически приемлемые добавки.
При этом водные или водно-спиртовые растворы активированных - потенцированных форм антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору получены путем многократного последовательного разведения матричных растворов антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору в сочетании с внешним воздействием - встряхиванием каждого разведения, при этом концентрация матричных растворов составляет 0,5÷5,0 мг/мл.
Причем каждый из компонентов используют в виде смеси различных, преимущественно сотенных, разведений, приготовленных по гомеопатической технологии.
При этом фармацевтически приемлемые добавки включают лактозу, целлюлозу микрокристаллическую и магния стеарат.
Кроме того, фармацевтически приемлемые добавки включают изомальт, цикламат натрия, сахарин натрия, лимонную кислоту безводную и магния стеарат.
Как вариант, ветеринарную композицию, содержащую, активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору, используют для улучшения жизнеспособности животных.
Кроме того, ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору, используют для стимуляции прироста живой массы млекопитающих и птиц.
Кроме того, ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору, используют для повышения эффективности иммунизации млекопитающих и птиц.
Кроме того, ветеринарную композицию, содержащую активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору, используют для профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц.
При этом способ улучшения жизнеспособности сельскохозяйственных животных, млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору.
Причем активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
При этом используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ стимуляции прироста живой массы млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединице рецептора инсулина и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ повышения эффективности иммунизации млекопитающих и птиц заключается в том, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору, приготовленных по гомеопатической технологии.
Способ профилактики и/или лечения инфекционных заболеваний млекопитающих и птиц, характеризующийся тем, что в организм вводят активированную - потенцированную форму антител к β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом в организм вводят активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору.
При этом активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору используют в виде активированного - потенцированного водного или водно-спиртового раствора, активность которого обусловлена процессом последовательного многократного разведения матричного - исходного - раствора антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору в водном или водно-спиртовом растворителе в сочетании с внешним механическим воздействием - встряхиванием каждого разведения.
Причем используют приготовленную в виде единого препарата - одной лекарственной формы смесь различных разведений антител к С-концевому фрагменту β-субъединицы рецептора инсулина и к CD4 рецептору, приготовленных по гомеопатической технологии.
Согласно изобретению, для достижения максимального эффекта, направленного на улучшение жизнеспособности сельскохозяйственных животных, млекопитающих и птиц ветеринарную композицию применяют постоянно.
Для стимуляции прироста живой массы млекопитающих и птиц ветеринарную композицию применяют в течение всего периода откорма с первого и до последнего дня жизни.
Для повышения продуктивности, сохранности поголовья, профилактики инфекционных заболеваний и повышения эффективности иммунизации ветеринарную композицию, предпочтительно, применяют 3-4 раза курсом в течение 4-7 дней.
В соответствии с изобретением заявленные водные или водно-спиртовые растворы обладают выраженной активностью, приобретенной в процессе технологической обработки в виде многократного последовательного уменьшения концентрации исходного вещества - антител к β-субъединице рецептора инсулина (С-концевому фрагменту β-субъединицы рецептора инсулина), к гамма-интерферону человека и к CD4 рецептору, которая обусловлена тем, что активированная - потенцированная форма антител к β-субъединице рецептора инсулина (С-концевому фрагменту β-субъединицы рецептора инсулина) активизирует метаболические процессы в клетках, оказывая влияние на углеводный обмен и повышая привесы при снижении затрат корма. Активированная - потенцированная форма антител к гамма-интерферону человека,
воздействуя на различные звенья иммунитета, стимулирует основные параметры системы естественной резистентности организма, влияет на систему эндогенных интерферонов, стимулирует гуморальный и клеточный иммунный ответ и функциональную активность фагоцитов и естественных клеток киллеров (ЕК-клеток), и обладает противовирусной активностью в отношении ДНК- и РНК-содержащих вирусов, в том числе, в отношении вирусов гриппа (H3N2, H3N8, H1N1), включая птичий грипп (H5N1), вируса герпеса II типа, вируса иммунодефицита человека (ВИЧ-1), вируса иммунодефицита кошек (ВИК). Активированная - потенцированная форма антител к гамма интерферону человека обладают антибактериальной активностью в комплексной терапии бактериальных инфекций и в профилактике бактериальных осложнений.
Активированная - потенцированная форма антител к CD4 рецептору регулируют функциональную активность CD4 рецептора, что приводит к повышению функциональной активности CD4 лимфоцитов, нормализуют иммунорегуляторный индекс CD4/CD8, а также субпопуляционный состав иммунокомпетентных клеток (CD3, CD4, CD8, CD16, CD20).
Совместное применение заявленных компонентов ветеринарной композиции сопровождается усилением активности входящих в него компонентов, что обеспечивает эффективное улучшение жизнеспособности животных.
Различные варианты заявленной ветеринарной композиции, предположительно, за счет вышеуказанных механизмов регулируют процессы метаболизма, оказывают противовирусное и антибактериальное действие. Препарат эффективен в отношении возбудителей вирусных, бактериальных и микоплазменных инфекций птиц, ньюкаслской болезни, болезни Гамборо, повышает иммунитет, усиливает гуморальный иммунный ответ на вакцины, благодаря чему повышается эффективность иммунизации и сохранность поголовья, возрастает продуктивность, снижаются затраты корма, что определено экспериментально.
Предложенное использование активированной - потенцированной формы антител к β-субъединице рецептора инсулина (С-концевому фрагменту β-субъединицы рецептора и инсулина), в том числе и в сочетании с активированной - потенцированной формой антител к гамма-интерферону человека и к CD4 рецептору расширяет арсенал средств, предназначенных для улучшения жизнеспособности животных, стимуляции прироста живой массы млекопитающих и птиц, повышения эффективности иммунизации, профилактики и/или лечения инфекционных заболеваний, при высокой сохранности млекопитающих и птиц, не вызывает побочных эффектов не оказывают общетоксического, иммунотоксического, местнораздражающего, аллергизирующего действия, не обладают репродуктивной токсичностью, (что обусловлено, в силу высоких разведений, практическим отсутствием или сверхмалой дозой молекул исходного вещества). Длительное применение ветеринарной композиции не сопровождается развитием таких побочных эффектов, как гипогликемия и ацидоз.
При этом возможно применение заявленной ветеринарной композиции в сочетании с другими биоактивными пищевыми добавками и/или препаратами как для повышения прироста живой массы и стимуляции роста сельскохозяйственных животных, так и для, повышения эффективности иммунизации, профилактики и/или лечения инфекционных заболеваний.
Заявленную ветеринарную композицию приготовляют следующим образом.
Для приготовления активированной - потенцированной формы действующих компонентов используют моноклональные или, преимущественно, поликлональные антитела, которые могут быть получены по известным технологиям - методикам, описанным, например, в книге: Иммунологические методы, под ред. Г. Фримеля, М., «Медицина», 1987, с. 9-33; или, например, в статье Laffly E., Sodoyer R. Hum. Antibodies. Monoclonal and recombinant antibodies, 30 years after. - 2005 - Vol. 14. - N 1-2. P. 33-55.
Для проведения экспериментальных исследований могут быть использованы антитела, приготовленные по заказу специализированной биотехнологической фирмой.
Моноклональные антитела получают, например, с помощью гибридомной технологии. Причем начальная стадия процесса включает иммунизацию, основанную на принципах, уже разработанных при приготовлении поликлональных антисывороток. Дальнейшие этапы работы предусматривают получение гибридомных клеток, продуцирующих клоны одинаковых по специфичности антител. Их выделение в индивидуальном виде проводится теми же методами, что и в случае поликлональных антисывороток.
Поликлональные антитела могут быть получены активной иммунизацией животных. Для этого по специально разработанной схеме животным делают серию инъекций требуемым в соответствии с изобретением веществом - антигеном или конъюгированным антигеном: β-субъединицей рецептора инсулина (С-концевым фрагментом β-субъединицы рецептора инсулина), гамма - интерфероном человека и к CD4 рецептору. В результате проведения такой процедуры получают моноспецифическую антисыворотку с высоким содержанием антител, которую и используют для получения активированной - потенцированной формы. При необходимости проводят очистку антител, присутствующих в антисыворотке, например, методом аффинной хроматографии, путем применения фракционирования солевым осаждением или ионообменной хроматографии.
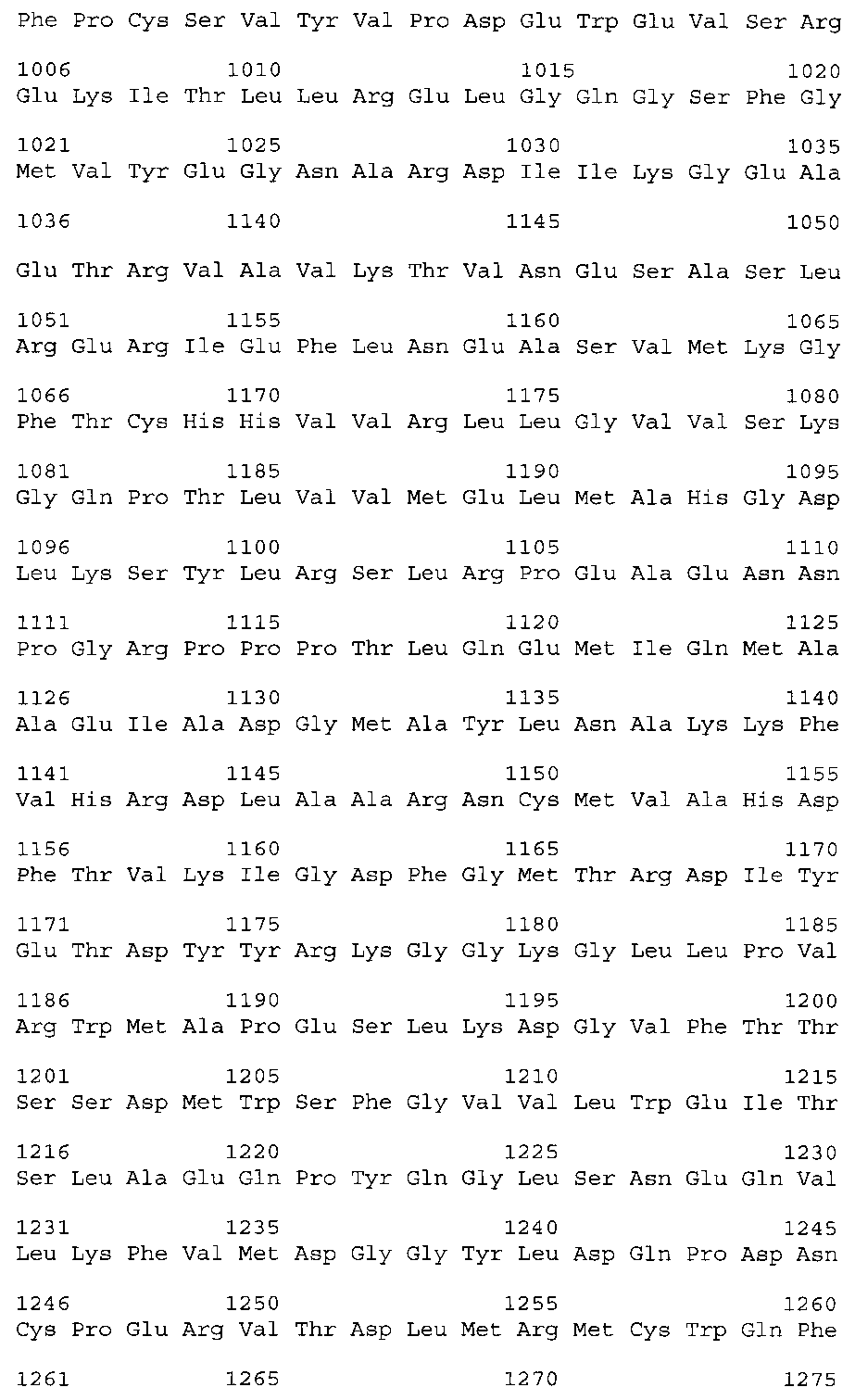
Для получения поликлональных антител к β-субъединице рецептора инсулина в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу рецептора инсулина человека следующей последовательности:





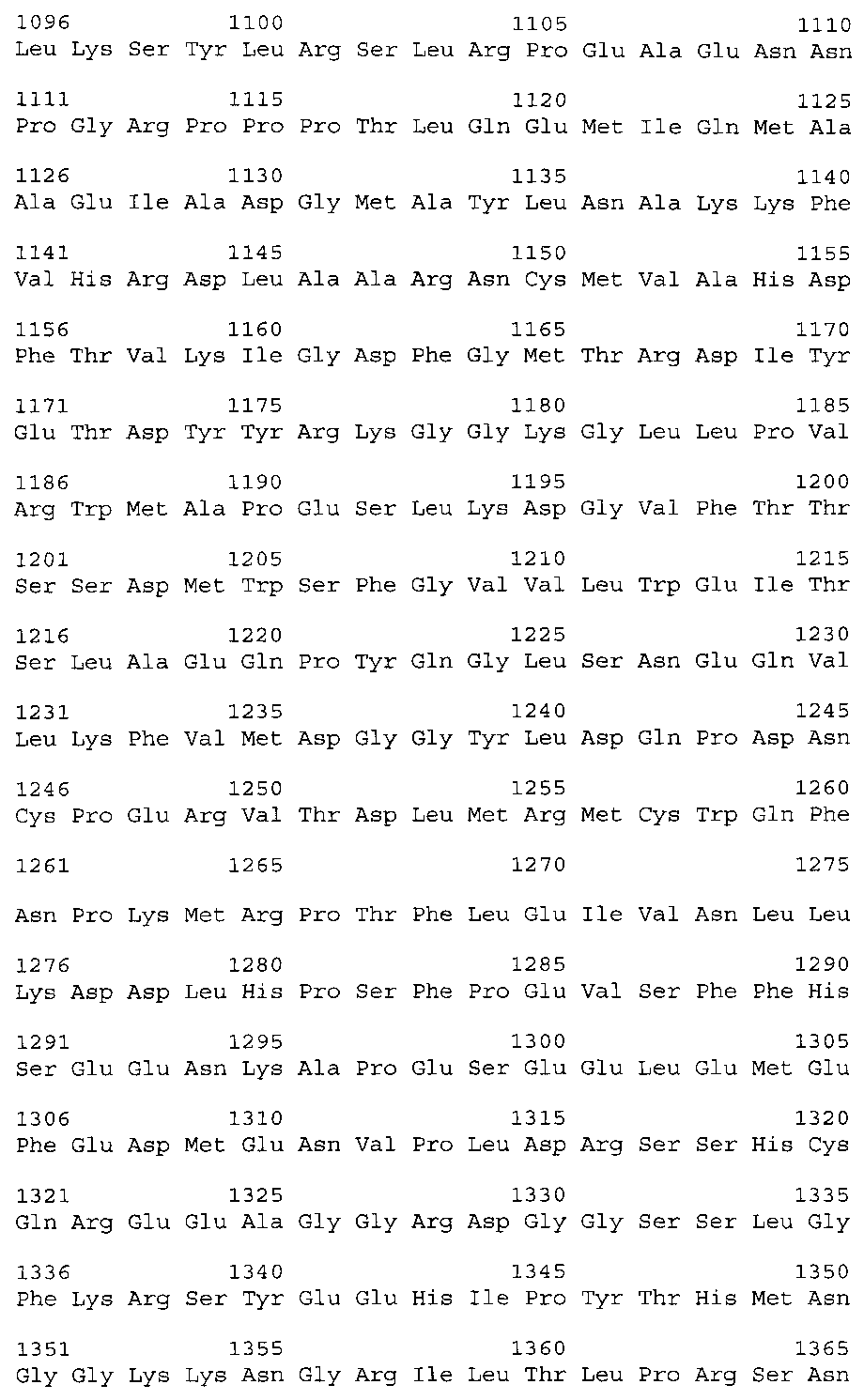
Возможно для получения поликлональных антител к β-субъединице рецептора инсулина в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу бета-субъединица человеческого рецептора инсулина следующей последовательности:



Возможно для получения поликлональных антител к β-субъединице рецептора инсулина в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, полипептидный фрагмент С-концевого фрагмента бета-субъединицы человеческого рецептора инсулина, выбираемый, например, из следующих последовательностей:






Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°С) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Можно добавлять к антисыворотке 20% NaN3 до конечной концентрации 0,02% и хранить до использования в замороженном состоянии при температуре -20°С (или без добавления NaN3 - при температуре -70°). Выделение из антисыворотки антител к β-субъединице рецептора инсулина возможно следующим образом:
1. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 Μ NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°С;
2. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
3. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
4. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Очистку антител производят методом аффинной хроматографии на колонке с антигеном, путем связывания антител к β-субъединице рецептора инсулина с антигеном (β-субъединицей рецептора инсулина), прикрепленным к нерастворимому матриксу колонки, с последующим элюированием антител концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к β-субъединице рецептора инсулина, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (исходного) раствора для последующего приготовления активированной - потенцированной формы.
Для получения поликлональных антител к гамма - интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов используют адъювант и, например, цельную молекулу гамма - интерферона человека следующей последовательности:


Возможно для получения поликлональных антител к гамма -интерферону человека в качестве иммуногена (антигена) для иммунизации кроликов использование адъюванта и, например, одного полипептидного фрагмента гамма - интерферона человека, выбранного из следующих последовательностей::




Поликлональные антитела к гамма-интерферону могут быть получены с использованием молекул рекомбинантного гамма-интерферона следующей последовательности:


Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°С) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета.
Можно добавлять к антисыворотке 20% NaN3 до конечной концентрации 0,02% и хранить до использования в замороженном состоянии при температуре -20°С (или без добавления NaN3 - при температуре -70°). Выделение из антисыворотки антител к гамма-интерферону возможно следующим образом:
5. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 M NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°С;
6. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
7. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
8. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Очистку антител производят методом аффинной хроматографии на колонке с антигеном, путем связывания антител к гамма-интерферону с антигеном (гамма-интерферон), прикрепленным к нерастворимому матриксу колонки, с последующим элюированием антител концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к гамма-интерферону, очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (исходного) раствора для последующего приготовления активированной - потенцированной формы.
Поликлональные антитела к CD4 рецептору получают по вышеуказанному способу, используя в качестве иммуногена (антигена) для иммунизации кроликов адъювант и цельную молекулу или один полипептидный фрагмент CD4 рецептора, выбранный, например, из следующих аминокислотных последовательностей:





Перед отбором крови за 7-9 дней проводят 1-3 внутривенных инъекций для повышения уровня антител. В процессе иммунизации у кроликов отбирают небольшие пробы крови для оценки количества антител. Максимальный уровень иммунного ответа на введение большинства антигенов достигается через 40-60 дней после первой инъекции. После окончания первого цикла иммунизации кроликов в течение 30 дней дают восстановить здоровье и проводят реиммунизацию, включающую 1-3 внутривенные инъекции. Для получения антисыворотки из иммунизированных кроликов собирают кровь в центрифужную пробирку объемом 50 мл. С помощью деревянного шпателя удаляют со стенок пробирки образовавшиеся сгустки и помещают палочку в сгусток, образовавшийся в центре пробирки. Кровь помещают в холодильник (температура 4°С) на ночь. На следующий день удаляют сгусток, прикрепившийся к шпателю, и центрифугируют оставшуюся жидкость при 13000g в течение 10 мин. Супернатант (надосадочная жидкость) является антисывороткой. Полученная антисыворотка должна быть желтого цвета. Можно добавлять к антисыворотке 20% NaN3 до конечной концентрации 0,02% и хранить до использования в замороженном состоянии при температуре -20°С (или без добавления NaN3 - при температуре -70°). Выделение из антисыворотки антител к гамма-интерферону возможно следующим образом:
9. 10 мл антисыворотки кролика разбавляют в 2 раза 0,15 Μ NaCl добавляют 6,26 г Na2SO4, перемешивают и инкубируют 12-16 ч при 4°С;
10. выпавший осадок удаляют центрифугированием, растворяют в 10 мл фосфатного буфера и затем диализуют против того же буфера в течение ночи при комнатной температуре;
11. после удаления осадка центрифугированием раствор наносят на колонку с ДЭАЭ-целлюлозой, уравновешенную фосфатным буфером;
12. фракцию антител определяют, измеряя оптическую плотность элюата при 280 нм.
Очистку антител производят методом аффинной хроматографии на колонке с антигеном, путем связывания антител к гамма-интерферону с антигеном (гамма-интерферон), прикрепленным к нерастворимому матриксу колонки, с последующим элюированием антител концентрированными растворами соли.
Полученный, таким образом, буферный раствор поликлональных кроличьих антитела к CD4 рецептору (например, к CD4 рецептору Т-лимфоцитов), очищенных на антигене, с концентрацией 0,5÷5,0 мг/мл, предпочтительно 2,0÷3,0 мг/мл, используют в качестве матричного (исходного) раствора для последующего приготовления активированной - потенцированной формы.
Активированную - потенцированную форму каждого компонента ветеринарной композиции готовят путем равномерного уменьшения концентрации в результате последовательного разведения 1 части каждого подвергаемого разведению раствора, начиная с упомянутого матричного раствора, в 9 частях (для десятичного разведения D) или в 99 частях (для сотенного разведения С) или в 999 частях (для тысячного разведения М) нейтрального растворителя в сочетании с многократным вертикальным встряхиванием (потенцированием, или "динамизацией") каждого полученного разведения и использованием отдельных емкостей для каждого последующего разведения до получения требуемой потенции - кратности разведения по гомеопатическому методу (см., например, В. Швабе "Гомеопатические лекарственные средства", М., 1967 г., с. 14-29).
Внешнюю обработку в процессе уменьшения концентрации также можно осуществлять ультразвуком, электромагнитным или иным физическим воздействием.
Например, для приготовления 12-го сотенного разведения С12 одну часть матричного (исходного) раствора антител, например, к β-субъединице рецептора инсулина человека, с концентрацией 2,5 мг/мл разводят в 99 частях нейтрального водного (или водно-спиртового) растворителя и многократно (10 и более раз) вертикально встряхивают - потенцируют, получая 1-е сотенное С1 разведение. Из 1-го сотенного С1 разведения приготовляют 2-ое сотенное разведение С2. Данную операцию повторяют 11 раз, получая 12-е сотенное разведение С12. Таким образом, 12-е сотенное разведение С12 представляет собой раствор, полученный разбавлением последовательно 12 раз в разных емкостях 1-ой части исходного матричного раствора антител к β-субъединице рецептора инсулина с концентрацией 2,5 мг/мл в 99-ти частях нейтрального растворителя, т.е. раствор, полученный разведением матричного раствора в 10012 раз. Аналогичные операции с соответствующей кратностью разведения проводят для получения разведений С30 и С50.
При использовании, например, активированной - потенцированной формы антител к β-субъединице рецептора инсулина в виде смеси различных, преимущественно сотенных, разведений каждое разведение (например, С12, С30, С50) приготовляют раздельно по описанной выше технологии до разведения на 3 разведения меньше, чем конечное (соответственно, до получения С9, С27, С47), и затем вносят в соответствии с составом смеси в одну емкость по одной части каждого компонента и смешивают с требуемым количеством растворителя (соответственно, с 97 частями для сотенного разведения). Далее полученную смесь последовательно дважды разводят в соотношении 1 к 100, потенцируя полученный раствор после каждого разведения. При этом получают активированную - потенцированную форму антител, например, к гамма-интерферону человека в сверхмалой дозе, полученной разведением матричного раствора в 10012, 10030, 10050 раз, эквивалентной смеси сотенных разведений С12, С30, С50.
Возможно использование каждого компонента в виде смеси других различных, разведений, например, десятичных и или сотенных, (D20, С30, С100 или С12, С30, С200 и т.д.), приготовленных по гомеопатической технологии, эффективность которых определяют экспериментально.
Для получения заявленной ветеринарной композиции в виде комплексного препарата водные или водно-спиртовые растворы действующих компонентов смешивают, преимущественно, в объемном соотношении 1:1:1 и используют в жидкой лекарственной форме.
Заявленная ветеринарная композиция может быть выполнена и в твердой форме (в виде порошка или таблеток) в виде комплексного препарата, который содержит технологически необходимое (эффективное) количество нейтрального носителя - например, лактозы - насыщенного путем пропитывания до насыщения, например, смесью водных или водно-спиртовых растворов активированной - потенцированной формы антител к β-субъединице рецептора инсулина (антител к С-концевому фрагменту β-субъединицы рецептора инсулина), активированной - потенцированной формы антител к гамма-интерферону человека, активированной - потенцированной формы антител к CD4 рецептору, и фармацевтически приемлемые добавки, включающие, преимущественно, лактозу, целлюлозу микрокристаллическую и магния стеарат.
Для получения твердой формы в виде таблетки в установке кипящего слоя (например, типа «Hüttlin Pilotlab» производства компании Hüttlin GmbH) производят орошение до насыщения вводимых в псевдоожиженный - кипящий слой гранул нейтрального вещества - лактозы (молочного сахара) с размером частиц 50÷500 мкм, предварительно полученным водным или водно-спиртовым раствором активированной - потенцированной формы антител к β-субъединице рецептора инсулина (или, например, антител к β-субъединице рецептора инсулина, к гамма-интерферону человека, к CD4 рецептору), преимущественно, в соотношении 1 кг раствора антител на 5 или 10 кг лактозы (1:5-1:10) с одновременной сушкой в потоке подаваемого под решетку нагретого воздуха при температуре не выше 40°С. Расчетное количество лактозы (10÷91% от таблеточной массы), насыщенной активированной - потенцированной формой антител по вышеуказанной методике, загружают в смеситель и смешивают с лактозой, увлажненной активированной - потенцированной формой антител, в количестве 3÷10% таблеточной массы и с чистой лактозой в количестве не более 84% от таблеточной массы (для снижения стоимости и некоторого упрощения и ускорения технологического процесса без снижения эффективности лечебного воздействия). Затем в эту смесь добавляют микрокристаллическую целлюлозу в количестве 5÷10% от таблеточной массы и стеарат магния в количестве 1% от таблеточной массы. Полученную таблеточную массу равномерно перемешивают и таблетируют прямым сухим прессованием (например, в таблет - прессе Korsch - XL 400) с формированием круглых таблеток массой 150÷500 мг. После таблетирования получают таблетки массой 300 мг, пропитанные водно-спиртовым раствором активированной - потенцированной формой антител к β-субъединице рецептора инсулина (или, например, антител к β-субъединице рецептора инсулина, к гамма-интерферону человека, к CD4 рецептору), в сверхмалой дозе каждого компонента, приготовленной из матричного раствора, разведенного в 10012, в 10030 в 10050, что эквивалентно смеси сотенных разведений С12, С30 и С50, приготовленных по гомеопатической технологии.
Пример 1.
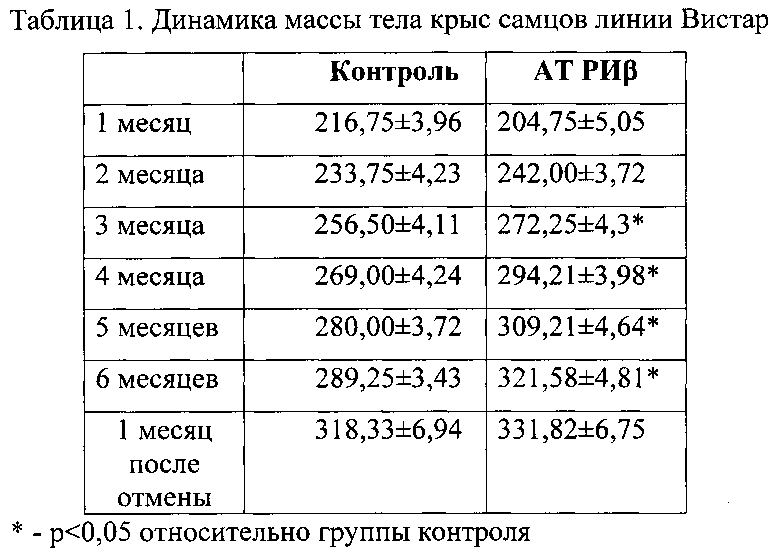
Оценку влияния заявленного средства для стимуляции прироста живой массы млекопитающих и птиц, повышения эффективности иммунизации, профилактики и/или лечения инфекционных заболеваний, приготовленного в виде водного раствора, содержащего активированную - потенцированную форму поликлональных афинно-очищенных на антигене кроличьих антител к бета-субъединице рецептора инсулина человека антител, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 100200 раз эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200) (AT РИβ) на массу тела экспериментальных животных проводили на половозрелых белых крысах самцах линии Вистар. Исследуемый препарат вводили в виде внутрижелудочно (с помощью зонда) один раз в день в дозе 2,5 мл/кг в течение 6-ти месяцев. В контрольной группе аналогичным образом вводили отстоянную воду в дозе 2,5 мл/кг. Общая продолжительность всего эксперимента с учетом периода в 1 месяц после отмены препарата составляла 7 месяцев. Ежемесячно у животных отмечали общее состояние и динамику массы тела.
Различий в общем состоянии животных обеих групп в течение наблюдаемого периода отмечено не было: животные не проявляли беспокойства, не было обнаружено изменений аппетита, выделений, состояния слизистых, шерсти, кожи и т.д. Динамика массы тела при приеме исследуемых препаратов отображена в таблице 1. Уже к концу 2-го месяца введения масса тела в группе РА АТ РИβ была выше (р>0,05), чем в группе контроля. На 3-ий, 4-ый, 5-ый и 6-ой месяц введения препаратов в группе РА АТ РИβ было отмечено достоверное увеличение массы тела крыс по сравнению с контрольной группой. Увеличение массы по сравнению с контрольной группой составило 6,1%, 9,4%, 10,4% и 11,2% на 3-ий, 4-ый, 5-ый и 6-ой месяц введения, соответственно. Через 1 месяц после отмены препарата масса тела крыс в группе РА АТ РИβ также оставалась выше, чем в контроле (р>0,05).
Пример 2.
Оценку влияния заявленного средства (Препарат №1) для стимуляции прироста живой массы млекопитающих и птиц, повышения эффективности иммунизации, профилактики и/или лечения инфекционных заболеваний, приготовленного в виде водного раствора, содержащего активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 100200 раз эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200) и активированную - потенцированную форму антител к гамма-интерферону человека, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 10050 раз эквивалентной смеси сотенных гомеопатических разведений С12, С30, С50), на работоспособность и прирост массы тела проводили с использованием бройлеров кросса «Кобб 500», выращенных в клеточных батареях R-15 по 35 голов в клетке с суточного до 37-дневного возраста, совместно по полу, в условиях вивария ФГУП «Загорское экспериментальное племенное хозяйство ВНИТИП Россельхозакадемии». Половое соотношение курочек и петушков, во всех группах, было определено в конце выращивании птицы - в возрасте 35 и 37 дней.
Эксперименты были проведены в соответствии с Методическими рекомендациями по технологии производства мяса бройлеров (Сергиев Посад, 2008 г.). Схема опыта и группы птиц приведены в таблице 2.

В исследовании сравнивали действие заявленного средства для стимуляции прироста живой массы (Препарат 1) с плацебо (дистиллированная вода - Препарат 2).
При проведении исследований учитывали следующие показатели:
1. Живая масса бройлеров на 1-ые, 7-ые, 14-ые, 28-ые, 35-ые, 37-ые сутки жизни всего изучаемого поголовья;
2. Среднесуточный прирост живой массы бройлеров за 14 и 28 суток выращивания (совместно по полу), за 35 и 37 суток (совместно по полу, а также отдельно по петушкам и курочкам);
3. Сохранность поголовья, путем ежедневного учета павших бройлеров с установлением причин отхода, %;
4. Расход корма по группам учитывался ежедневно, а затраты корма на 1 кг прироста живой массы (кг) рассчитаны за 35 и 37 суток выращивания;
5. Отбор проб крови при убое бройлеров осуществляли в 37-дневном возрасте. Пробы крови отбирались у 15 голов из каждой группы (как в опытных, так и в контрольной группах) и были отправлены для последующего анализа во «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГБУ «ВГНКИ») (г. Москва, Россия).
6. По результатам выращивания бройлеров в каждой группе был рассчитан европейский индекс продуктивности птицы.
Вакцинация бройлеров осуществлялась по следующей схеме:
- в инкубатории в суточном возрасте аэрозольно от Ньюкаслской болезни и Инфекционного бронхита кур, а также от болезни Марека -внутримышечно;
- в 13-суточном возрасте от болезни Гамборо - выпаиванием;
- в 19-суточном возрасте повторно от Ньюкаслской болезни и Инфекционного бронхита - аэрозольно. Полученные в ходе исследования данные обрабатывались методом вариационной статистики. Для каждой выборки Π было вычислено среднее арифметическое (М), стандартная ошибка среднего арифметического (m), стандартное отклонение (σ), коэффициент вариации Cv. Проверка на нормальность распределения проводилась с помощью стандартизированных коэффициентов асимметрии и эксцесса. В случае нормального распределения сравнение выборочных средних осуществлялось по t-критерию Стьюдента (Плохинский Н.А., 1978), среднее значение (М).
Показатели продуктивности цыплят-бройлеров кросса «Кобб 500», полученные в опыте, представлены в таблицах 3-6.
В таблице 10 приведены данные по живой массе цыплят-бройлеров, г.
Из данных, представленных в таблице 3, следует, что живая масса бройлеров в 7-дневном возрасте в двух группах была практически одинаковой.
В 14-дневном возрасте цыплята-бройлеры первой группы превосходили своих сверстников из 2-ой группы по живой массе на 1,16%.
В 28-дневном возрасте цыплята-бройлеры первой группы превосходили своих сверстников из 2-ой группы по живой массе на 3,55%.

В возрасте 35 дней (таблица 4) бройлеры 1-ой группы превосходили своих сверстников из 2-ой группы по живой массе на 3,22%.
В 35-дневном возрасте бройлеры во всех группах были предварительно разделены по полу на курочек и петушков. При анализе показателей бройлеров после деления по половому признаку было отмечено, что изменения в живой массе в группе 1 было связано в большей степени с изменением живой массы курочек (таблица 5), причем увеличение живой массы курочек было статистически значимым (таблица 4). На 37-ой день данная тенденция сохранилась (таблица 4 и 5).

Среднесуточный прирост живой массы у цыплят-бройлеров (таблица 12) в группе 1 за период выращивания 14 дней составил 22,35 г, что было выше, чем у сверстников в группе 2.
По среднесуточному приросту живой массы у цыплят за период выращивания до 28 дней бройлеры в группе 1 превосходили бройлеров в группе 2, на 3,64%.
В возрасте 35 дней по среднесуточному приросту живой массы бройлеры в группе 1 превосходили бройлеров в группе 2 на 3,28%. В возрасте 37 дней по среднесуточному приросту живой массы бройлеры в группе 1 превосходили бройлеров в группе 2 на 1,95%.
Среднесуточный прирост живой массы у петушков в группе 1 и в группе 2 практически не отличался.
Курочки в группе 1 по среднесуточному приросту живой массы превосходили курочек из группы 2.

Сохранность во всех изучаемых группах с суточного до 37-дневного возраста составляла 100% (см. таблицу 16).

Затраты корма (см. таблицу 7) на 1 кг прироста живой массы бройлеров за 35 дней в группе 1 были ниже, чем в группе 2 на 4,88%.

Затраты корма на 1 кг прироста живой массы бройлеров за 37 дней в группе 1 составили 1,64 кг. В группе 1 затраты корма на 1 кг прироста живой массы были меньше, чем в группе 2 на 3,53%.
По результатам, полученным в опыте, был рассчитан Европейский индекс продуктивности бройлеров кросса «Кобб 500» в 35 и 37 дней, который представлен в таблице 8.

Как видно из данных, представленных в таблице 15, индекс продуктивности в 1-ой группе, на 26,32 и 17,37 единиц был выше, чем в контроле на 35-ый и 37-ой день.
Данные общего и биохимического анализа крови цыплят-бройлеров на 37 день не выявили патологических отклонений исследуемых показателей ни в одной группе, что указывает на высокую безопасность применения заявленного средства для стимуляции прироста живой массы млекопитающих и птиц, содержащего активированную - потенцированную форму антител к гамма-интерферону человек человека и активированную - потенцированную форму антител к β-субъединице рецептора инсулина.
Пример 3.
Оценку влияние заявленного средства (комплексного препарата) для стимуляции прироста живой массы млекопитающих и птиц, повышения эффективности иммунизации, профилактики и/или лечения инфекционных заболеваний, приготовленного в виде водного раствора, содержащего активированную - потенцированную форму антител к гамма - интерферону человека, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 10050 раз эквивалентной смеси сотенных гомеопатических разведений С12, С30, С50), и активированную - потенцированную форму антител к С-концевому фрагменту β-субъединицы рецептора инсулина, очищенных на антигене, в сверхмалой дозе, полученной сверхразведением исходного матричного раствора (концентрации 2.5 мг/мл) в 10012, 10030, 100200 раз эквивалентной смеси сотенных гомеопатических разведений С12, С30, С200), на продуктивность цыплят-бройлеров проводили в условиях реального производства, а именно, Новороссийской птицефабрики с использованием цыплят-бройлеров кросса «Кобб 500» с напольным содержанием совместно по полу. Тестирование проводили в 2-х корпусах, первая партия суточных цыплят-бройлеров в количестве 25720 голов была помещена в корпус №1 и получала комплексный препарат, приготовленный из порошка, содержащего антитела к гамма интерферону аффинно очищенные в РА форме** (** нанесенные на лактозы моногидрат в виде смеси трех активных водно-спиртовых разведений субстанции, разведенной соответственно в 10012, 10030, 10050 раз;) (AT к ИФНγ) и антитела к С-концевому фрагменту β-субъединицы рецептора инсулина аффинно очищенные в релиз активной форме * (* нанесенные на лактозы моногидрат в виде смеси трех активных водно-спиртовых разведений субстанции, разведенной соответственно в 10012, 10030, 100200 раз;) (AT к β-РИ)
Вторая партия суточных цыплят - бройлеров в количестве 25900 голов была размещена для выращивания в корпус №2 и получала Плацебо (лактозу моногидрат). Тестируемые препараты давали птице в виде водного раствора с 1-ого дня жизни. Раствор образцов готовили, разводя необходимое количество порошка (в граммах) в объеме воды (в литрах) в соответствии с таблицей 9. Раствор несколько раз встряхивали, обеспечивая равномерное растворение, после чего подключали к системе водоснабжения для выпойки. Получившийся раствор выпаивать не менее 3 часов через медикатор не зависимо от возраста птицы. Все остальное время птица получала чистую водопроводную воду. В дни, когда проводилась плановая вакцинация или дача лекарственных препаратов, выпойка птице препаратов проводилась отдельно, в послеобеденное время, во все остальные дни тестируемые препараты давали в утренние часы. Тестируемые препараты давали цыплятам до убоя/продажи в корпусе препарата по 42 день, а в корпусе плацебо - по 45 день, включительно.

Вакцинация бройлеров осуществлялась по установленной на птицефабрике схеме:
- против инфекционного бронхита - в инкубатории в суточном возрасте и 6-ти дневном возрасте крупно дисперсной аэрозолью (Нобилис IB Ма5, живая, сухая, Интервет Интернешнл Б.В., Голландия) и методом выпаивания (ИБК вакцина из шт. Н-120, живая, сухая, ОАО «Покровский завод биопрепаратов»);
- против болезни Гамборо - в 8-и и в 17-ти дневном возрасте методом выпаивания (сухая, живая, ОАО «Покровский завод биопрепаратов»);
- против Ньюкаслской болезни - в 13-ти дневном возрасте методом выпаивания (НБ вакцина из шт. Ла-Сота, сухая, живая, ОАО «Покровский завод биопрепаратов»).
При проведении тестирования фиксировались следующие показатели:
1. Живая масса бройлеров на 7-е, 14-е, 21-е, 28-е, 35-е и 42 сутки жизни у 100 голов птиц из каждого корпуса. Птица отбиралась случайным образом из всего тестируемого поголовья и взвешивалась индивидуально на электронных весах.
2. Среднесуточный прирост живой массы бройлеров за 42 дня выращивания (совместно по полу). Показатель рассчитывается по данным, полученным при взвешивании 100 птиц каждого корпуса отобранных случайным образом;
3. Сохранность поголовья путем ежедневного учета павших бройлеров с установлением причин отхода (в %) у всего исследуемого поголовья.
4. Расход корма по корпусам учитывали у всего поголовья раз в 2-3 дня по завозу в корпус комбикорма автомобилем
Затраты корма (конверсия корма) на 1 кг прироста живой массы (кг) были рассчитаны за весь период выращивания по формуле: Расход корма (кг)/Прирост живой массы (кг)
5. После убоя птицы были вскрыты 6 голов птицы из каждого корпуса (3 петушка и 3 курочки) и определены следующие показатели: внешний вид внутренних органов, масса полупотрошеной тушки, масса потрошеной тушки, масса и состояние внутренних органов (печень, сердце, мышечный желудок, легкие, почки).
Статистическая обработка результатов основывалась на следующих положениях:
1. мощность статистических критериев «Р=(1-β)» принималась равной 80% (вероятность корректного отвержения нулевой гипотезы равна 0,8);
2. вероятность ошибки первого рода «а» допускалась менее 5% (вероятность ошибочного принятия альтернативной гипотезы - менее 0,05);
3. используемые статистические критерии являлись двухсторонними в силу отсутствия апостериорной информации о превосходстве эффекта одного препарата над другим.
Анализируемая выборка птиц описана с помощью средних значений (М) и стандартного отклонения (SD).
Различие между группами проверено с помощью нескольких критериев:
1. Т-тест в двух вариациях, в зависимости от результата проверки на однородность дисперсий с помощью теста Фишера, для сравнения групп, в случае нормально распределенных данных;
2. Дисперсионный анализ для повторных измерений (Repeated Measures ANOVA) или метод GLMM (Generalized Linear Mixed Models) для сравнения групп с учетом изменения показателей во времени;
3. Критерий Манна-Уитни (Mann-Whitney) в случае ненормально распределенных данных;
Критерий Хи-квадрат, точный критерий Фишера (в случае если одна из наблюдаемых частот была меньше 5) или критерий Кохрана-Мантеля-Хензеля (Cochran-Mantel-Haenszel) для проведения частотного анализа.
Показатели массы 100 бройлеров, выбранных случайным образом представлены в таблице 10. Живая масса бройлеров корпуса препарата на 42-ой день была достоверно выше таковой в корпусе плацебо. Различие в живой массе в корпусах составляло 100,9 грамм или 5,7%.

При подсчете среднесуточного привеса за весь период тестирования по формуле: привес за тур/кормодни (где кормодни - это сумма ежедневного наличия поголовья за весь период откорма (с учетом выбытия - падеж, убой, продажа и т.п.)), было показано, что среднесуточные привесы в корпусе препарата и плацебо были сопоставимы, и составляли 41,58 и 41,64, соответственно.
Тестируемый препарат также показал профилактическую эффективность в отношении бактериальных инфекций кур, что, в том числа, позволило значительно увеличить сохранность поголовья. В ходе тестирования было зафиксировано повышение отхода бройлеров. Максимальный падеж в корпусах был отмечен во 2-ой половине периода выращивания, а именно, в корпусе препарата с 33-его дня по 40-ой включительно среднесуточный падеж составлял 122 птицы, в корпусе плацебо - с 26-ого дня по 42-ой день среднесуточный падеж составлял 136,6 птиц. Кроме того в корпусе плацебо отмечалось увеличение падежа с 10 по 12-ый день включительно, среднесуточный падеж составлял 140 птиц в день. При бактериологическом исследовании в корпусе препарата в общей пробе были обнаружены Proteus mirabilis, Escherichia coli. При бактериологическом исследование патологического материала в корпусе плацебо были обнаружены в общей пробе - Salmonella pullorum, Escherichia coli, Proteus mirabilis, в кишечнике - Streptococcus avium и Escherichia coli, в головном мозге - Escherichia coli, в трубчатых костях - Salmonella pullorum, в сердце, селезенке и печени - Proteus mirabilis. В обоих корпусах были проведены лечебные мероприятия по борьбе с инфекцией. В группе плацебо в связи с высоким уровнем падежа были назначен антибиотик инфлокс в дозе 1 мл/л в течение 7 дней, в группе препарата профилактический прием антибиотика инфлокс в дозе 1 мл/л был ограничен 3 днями вследствие эффективности тестируемого препарата.
В корпусе препарата из 25720 поступивших на откорм бройлеров пало 2068, а в корпусе плацебо из 25900 пало 3764, таким образом, падеж и сохранность в корпусе препарата составили 8,04% и 91,96%, соответственно, а в корпусе плацебо: 14,54% и 85,46%, соответственно. Таки образом, сохранность в корпусе препарата превышала таковую в корпусе плацебо на 6,5%.
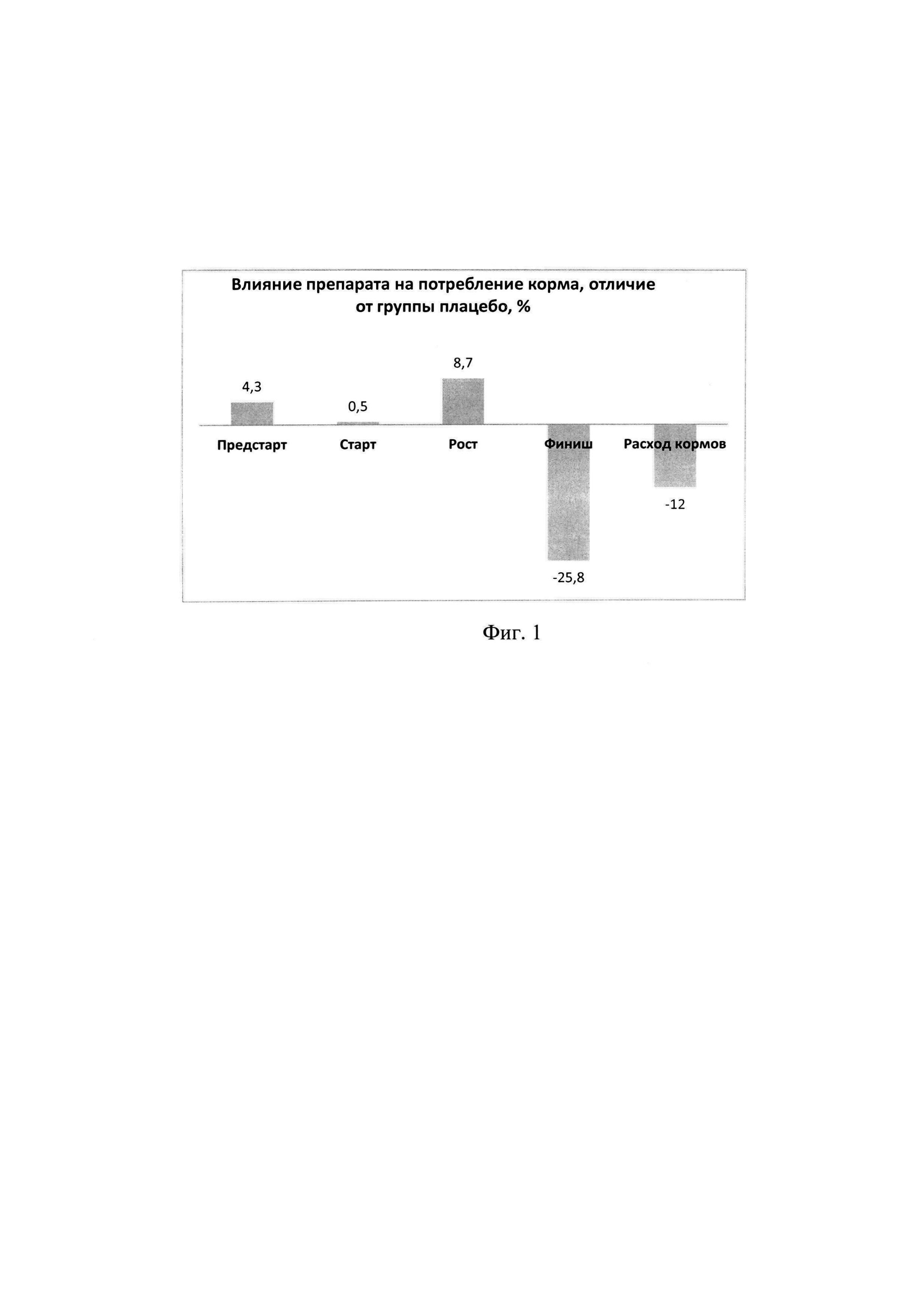
На Фиг. 1 приведены данные по расходу кормов по корпусам. Необходимо отметить, что в корпусах наблюдалось различие в потреблении видов кормов. Общий расход корма в корпусе препарата был ниже, чем в корпусе плацебо на 12830 кг или на 12%.
В корпусе препарата расход корма на привес (конверсия корма) составил 2,2, а в корпусе плацебо - 2,43, что говорит о более эффективном использовании корма в корпусе препарата.
При анализе данных, полученных при вскрытии 6 птиц из группы (3 курицы и 3 петушка), не выявлено достоверных отличий в измеряемых параметрах в обоих корпусах. Состояние внутренних органов было нормальным и не имело патологических изменений. Но выход мяса у курочек и петушков в потрошеном виде в корпусе препарата был на 0,7% и 0,9% выше, соответственно, чем в корпусе плацебо, что является важным экономическим показателем.
Пример 4.
Оценку влияния заявленного средства (комплексного препарата), приготовленного в виде водного раствора, содержащего антитела к гамма интерферону аффинно очищенные в РА форме (AT к ИФНγ), смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 10050 раз, и антитела к С-концевому фрагменту β-субъединицы рецептора инсулина аффинно очищенные в релиз активной форме (AT к β-РИ), смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 100200 раз), на продуктивность цыплят-бройлеров проводили на базе ГНУ ВНИТИП Россельхозакадемии (г. Сергиев Посад). Для проведения производственной проверки использовали бройлеров кросса «Кобб 500», выращенных в клеточных батареях R-15 по 35 голов в клетке с суточного до 37-дневного возраста, совместно по полу.
Эксперименты были проведены в соответствии с «Методическими рекомендациями по технологии производства мяса бройлеров» (Сергиев Посад, 2008 г.) и «Методикой проведения научных и производственных исследований по кормлению сельскохозяйственной птицы» (Сергиев Посад, 2013 г.). Оценку исследуемых показателей в группе препарата проводили по сравнению с группой плацебо, в которой давали дистиллированную воду. Схема производственной проверки приведена в таблице 11.

Вакцинация бройлеров осуществлялась по следующей схеме:
- в инкубатории в суточном возрасте аэрозольно от Ньюкаслской болезни и инфекционного бронхита, а также от болезни Марека -внутримышечно;
- в 13 суточном возрасте от болезни Гамборо - выпаиванием;
- в 19-суточном возрасте повторно от Ньюкаслской болезни и инфекционного бронхита - аэрозольно.
При вакцинации использовали живую сухую вирусвакцину против ньюкаслской болезни птиц (НБ) из штамма «Ла-Сота» производства ГНУ ВНИВИП Россельхозакадемии, живую сухую вирусвакцину против инфекционного бронхита кур (ИБК) из штамма «Н-120» производства ООО «Кронвет», живую сухую вакцину «Абивак-ИББ» против инфекционной бурсальной болезни (ИББ) из штамма «Винтерфилд 2512» или «БК» производства ООО «НПП Авивак».
При проведении исследования учитывали следующие показатели:
1. Живая масса бройлеров на 1-ые, 7-ые и 37-ые сутки жизни всего изучаемого поголовья;
2. Среднесуточный прирост живой массы бройлеров за 37 суток выращивания (совместно по полу, а также отдельно по петушкам и курочкам);
3. Сохранность поголовья, путем ежедневного учета павших бройлеров с установлением причин отхода, %;
4. Расход корма по группам учитывали ежедневно, а затраты корма на 1 кг прироста живой массы (кг) рассчитаны за 37 суток выращивания.
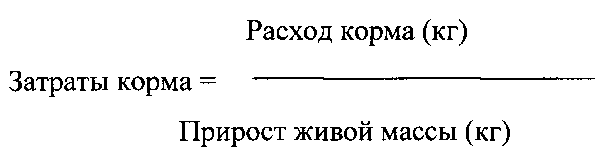
5. По результатам выращивания бройлеров в каждой группе был рассчитан европейский индекс продуктивности птицы.

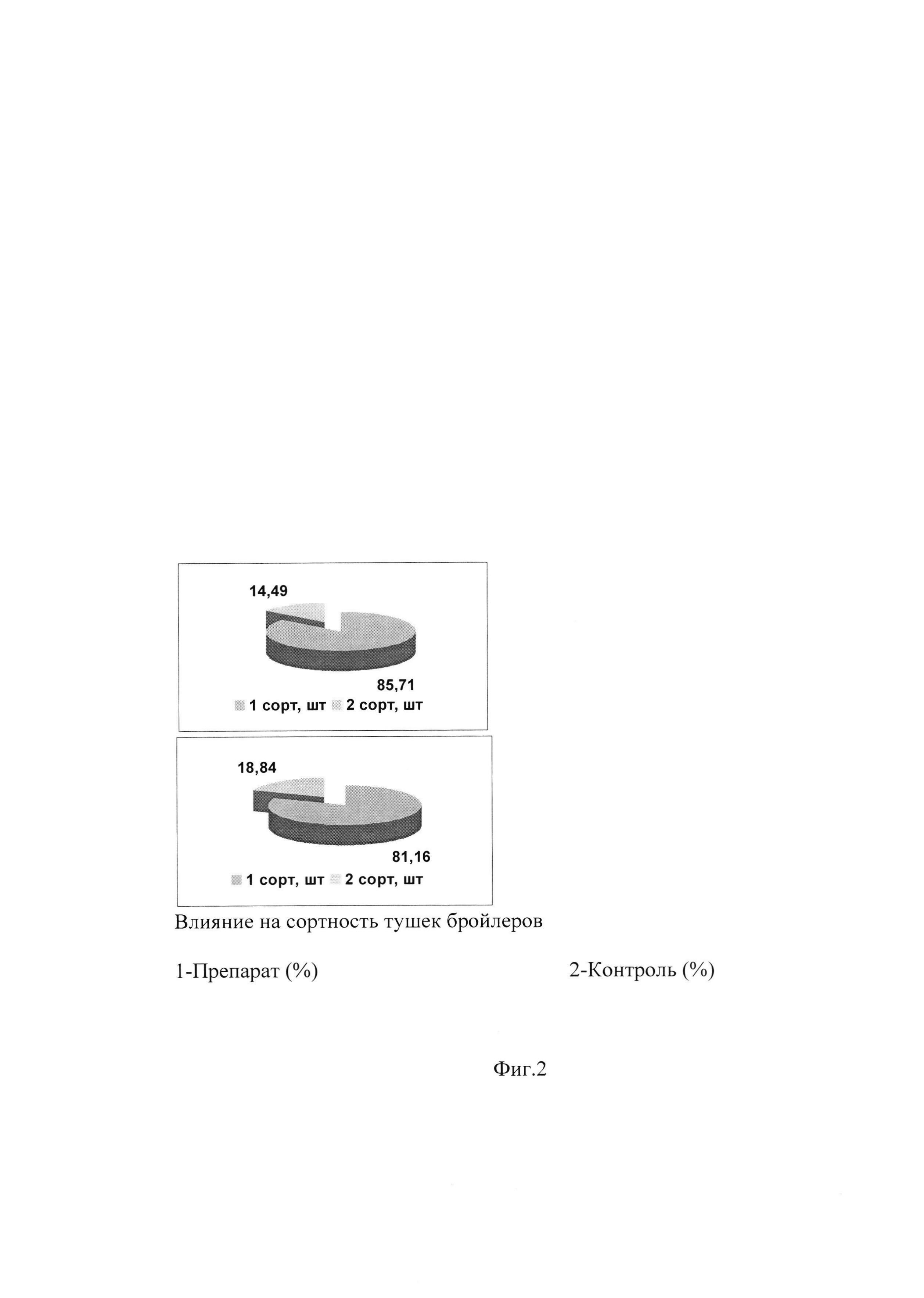
6. После убоя был определен убойный выход мяса в конце выращивания и выход тушек по сортам в соответствии с ГОСТ P 52702-2006.
7. После убоя птицы были вскрыты тушки и определены следующие показатели (по 6 голов из каждой группы, 3 петушка и 3 курочки):
- осмотр внутренних органов;
- масса полу потрошеной тушки;
- масса потрошеной тушки;
- масса и состояние внутренних органов (печень, сердце, мышечный желудок, легкие, почки).
Статистическая обработка результатов исследования основана на следующих положениях:
- мощность статистических критериев «P=(1-β)» принимается равной 80% (вероятность корректного отвержения нулевой гипотезы равна 0,8);
- вероятность ошибки первого рода «а» допускается менее 5% (вероятность ошибочного принятия альтернативной гипотезы - менее 0,05);
- используемые статистические критерии являются двухсторонними в силу отсутствия апостериорной информации о превосходстве эффекта одного препарата над другим.
Анализируемая выборка животных описана с помощью следующих показателей:
- среднее значение (М);
- стандартное отклонение (SD).
Различие между группами проверялись с помощью нескольких критериев:
- Дисперсионный анализ для повторных измерений (Repeated Measures ANOVA) или метод GLMM (Generalized Linear Mixed Models) для сравнения групп с учетом изменения показателей во времени;
- Т-тест в двух вариациях, в зависимости от результата проверки на однородность дисперсий с помощью теста Фишера, для сравнения групп, в случае нормально распределенных данных;
Критерий Манна-Уитни (Mann-Whitney) в случае ненормально распределенных данных;
Проверка на нормальность осуществлялась с помощью критерия Колмогорова-Смирнова-Лиллиефорса (Kolmogorov-Smornov-Lilliefors);
Критерий Хи-квадрат, точный критерий Фишера (в случае если одна из наблюдаемых частот была меньше 5) или критерий Кохрана-Мантеля-Хензеля (Cochran-Mantel-Haenszel) для проведения частотного анализа.
Показатели продуктивности цыплят кросса «Кобб 500», полученные в опыте, представлены в таблице 12.
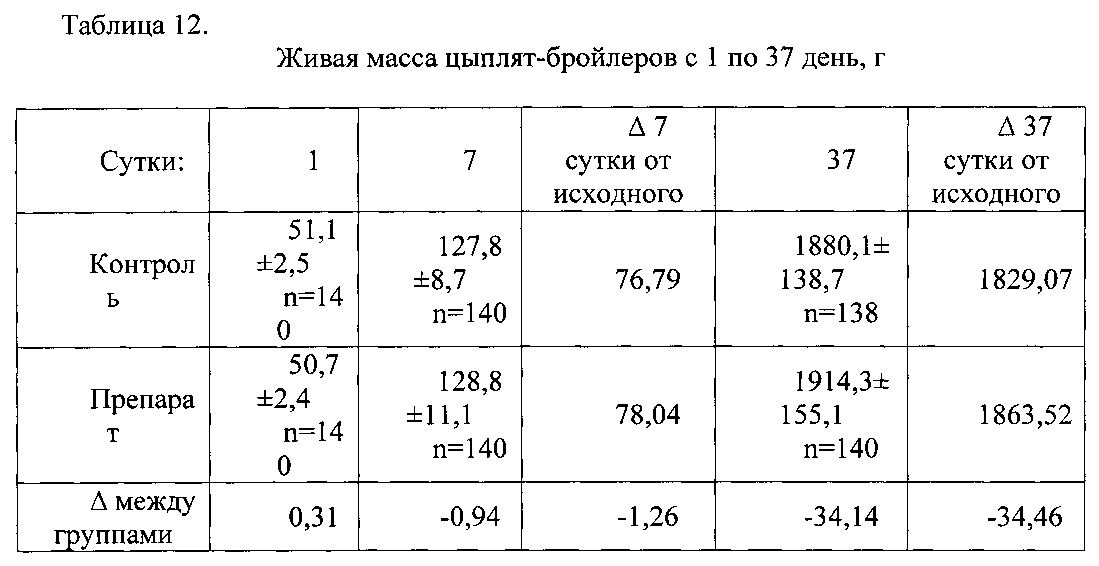
Оценка продуктивности цыплят-бройлеров с помощью двухфакторного дисперсионного анализа (ANOVA; факторы Группа - 2 уровня, и Сутки - 3 уровня) показала:
1. значимое различие по фактору Группа: F(1/832)=3,86; р=0,0498;
2. значимое различие по фактору День: F(2/832)=42076,4; р<0,0001;
3. значимое различие по взаимодействию факторов Препарат - Визит F(2/832)=3,68; р=0,0256.
Кроме того post-hoc анализ с использованием критерия Бонферрони не выявил значимого различия между группами в суточном возрасте (р=1.0) и в возрасте 7 дней (р=1,0), а на 37 день выращивания живая масса цыплят в группе введения препарата, согласно критерию Бонферрони, достоверно превысила контрольное значение (р=0,0127), разница в двух группах составила 34,14 г
Среднесуточный прирост, рассчитанный по формуле разница средней живой массы цыплят в 37-дневном возрасте и средней живой массы цыплят в суточном возрасте, деленная на количество дней откорма (37 дней), в группе введения исследуемого препарата превышал таковой в группе контроля. Среднесуточный прирост в группе контроля составлял 49,41 г., а в группе препарата - 50,37.
Необходимо отметить высокую сохранность птицы в группе исследуемого препарата, все 100% бройлеров дошли до конца эксперимента, в то время как в группе контроля падеж составил 1,4%, т.е. до конца эксперимента дошло 98,6% птиц.
Несмотря на то, что конверсия корма в обеих группах была сопоставима и составляла 1,5 кг корма на 1 кг прироста в массе, Европейский индекс продуктивности бройлеров в группе препарата составил 343,7, а в группе контроля - 336,2, таким образом, различие между группами составило 7,5 единицы или 2,2%.
Влияние исследуемых препаратов на выход мяса и сортность тушек проводили на всем исследуемом поголовье. Результаты исследования представлены в таблице 13.
Общая масса тушек контрольной группы составила 186,28 кг, а масса тушек группы введения препарата - 194,81 кг, соответственно, средняя масса одной тушки по группам составила 1349 г и 1392 г. Таким образом, масса тушки из группы введения препарата превысила на 3,2% массу тушки контрольной группы.
Общий выход мяса в группе введения препарата был выше на 4,6%, чем в контроле. При разделении по сортам тушек 1 сорта в группе введения препарата было на 9% больше, чем в контроле (см. Фиг. 2).
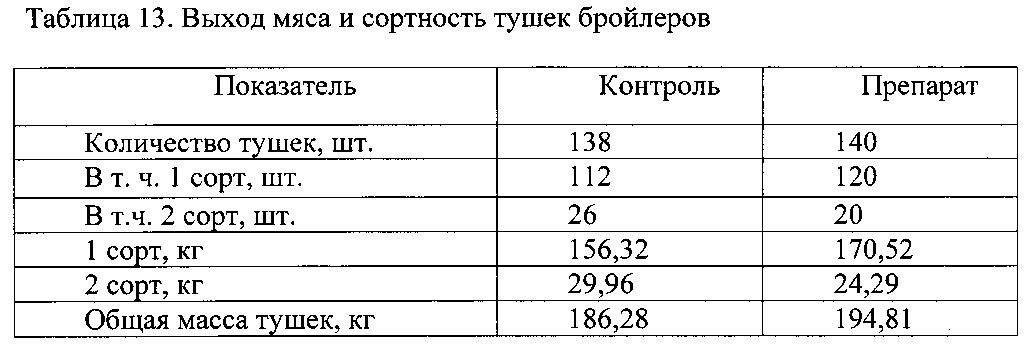
При анализе данных, полученных при вскрытии 6 птиц из группы (3 курицы и 3 петушка), было отмечено, что состояние внутренних органов в группах было нормальным и не имело патологических изменений. Выход мяса в полупотрошеном виде в двух группах не различался достоверно, хотя была отмечена тенденция к увеличению массы полупотрошеной тушки в группе введения препарата по сравнению с контролем (р=0,052). Более важным показателем является выход мяса в потрошеном виде, так как мясо бройлеров в настоящее время реализуется в соответствии с ГОСТ P 527-2006 в виде потрошеных тушек и их частей. Выход мяса в потрошеном виде в группе введения препарата был достоверно на 3,6% выше, чем в контроле. Выход потрошеных тушек в группе введения препарата, относительно живой массы в данной группе, составил 74,2%, что на 1,3% выше, чем в контроле, где этот показатель равнялся 72,9%.
Пример 5.
Оценку влияния заявленного средства (комплексного препарата), приготовленного в виде водного раствора, содержащего антитела к гамма интерферону аффинно очищенные в РА форме (AT к ИФНγ, смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 10050 раз) и антитела к С-концевому фрагменту β-субъединицы рецептора инсулина аффинно очищенные в релиз активной форме (AT к β-РИ, смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 100200 раз), и на иммунологический статус цыплят-бройлеров и эффективность иммунизации проводили на базе ГНУ ВНИТИП Россельхозакадемии (г. Сергиев Посад). Для проведения производственной проверки использовали бройлеров кросса «Кобб 500», выращенных в клеточных батареях R-15 по 35 голов в клетке с суточного до 37-дневного возраста, совместно по полу.
Бройлеров выращивали в соответствии с «Методическими рекомендациями по технологии производства мяса бройлеров» (Сергиев Посад, 2008 г.) и «Методикой проведения научных и производственных исследований по кормлению сельскохозяйственной птицы» (Сергиев Посад, 2013 г.). Оценку исследуемых показателей в группе препарата проводили по сравнению с группой плацебо, в которой давали дистиллированную воду. Схема производственной проверки приведена в таблице 14.

Вакцинация бройлеров осуществлялась по следующей схеме:
- в инкубатории в суточном возрасте аэрозольно от Ньюкаслской болезни и инфекционного бронхита, а также от болезни Марека - внутримышечно;
- в 13 суточном возрасте от болезни Гамборо - выпаиванием;
- в 19-суточном возрасте повторно от Ньюкаслской болезни и инфекционного бронхита - аэрозольно.
При вакцинации использовали живую сухую вирусвакцину против ньюкаслской болезни птиц (НБ) из штамма «Ла-Сота» производства ГНУ ВНИВИП Россельхозакадемии, живую сухую вирусвакцину против инфекционного бронхита кур (ИБК) из штамма «Н-120» производства ООО «Кронвет», живую сухую вакцину «Абивак-ИББ» против инфекционной бурсальной болезни (ИББ) из штамма «Винтерфилд 2512» или «БК» производства ООО «НПП Авивак».
Серологический анализ проводили при убое у бройлеров в 37-дневном возрасте. Пробы крови отбирались у 30 голов из каждой группы и были отправлены для последующего анализа во «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» ФГБУ «ВГНКИ» (г. Москва, Россия).
При проведении серологического анализа было определено: наличие антител к возбудителям инфекционного бронхита кур (ИБК) - методом ИФА; наличие антител к возбудителю ньюкаслской болезни - методом РТГА; наличие антител к возбудителю болезни Гамборо (инфекционная бурасльная болезнь, ИББ) - методом ИФА.
При статистической обработке результатов исследования использовали критерий Манна-Уитни (Mann-Whitney).
Результаты серологического анализа приведены в таблице 15.

Анализ данных вирус-специфических антител в сыворотке крови кур показал, что препарат повышает эффективность иммунизации. Так в группе введения препарата титр вирус-специфических антител в отношении вируса НБ и ИББ превышал контрольные значения, при ИББ различия в среднем титре антител были достоверными. В отношении защиты от вируса инфекционного бронхита препарат продемонстрировал несколько меньшую эффективность.
Пример 6.
Исследование влияния релиз-активных поликлональных афинно-очищенных кроличьих антител к бета-субъединице рецептора инсулина человека (РА АТ РИβ) на массу тела экспериментальных животных проводили на половозрелых белых крысах самцах линии Вистар. Исследуемый препарат вводили внутрижелудочно (с помощью зонда) один раз в день в дозе 2,5 мл/кг в течение 6-ти месяцев. В контрольной группе аналогичным образом вводили отстоянную воду в дозе 2,5 мл/кг. Общая продолжительность всего эксперимента с учетом периода в 1 месяц после отмены препарата составляла 7 месяцев. Ежемесячно у животных отмечали общее состояние и динамику массы тела.
Различий в общем состоянии животных обеих групп отмечено не было. Динамика массы тела при приеме исследуемых препаратов отображена в таблице 16. Уже к концу 2-го месяца введения масса тела в группе РА АТ РИβ была выше (р>0,05), чем в группе контроля. На 3-ий, 4-ый, 5-ый и 6-ой месяц введения препаратов в группе РА АТ РИβ было отмечено достоверное увеличение массы тела крыс по сравнению с контрольной группой. Увеличение массы по сравнению с контрольной группой составило 6,1%, 9,4%, 10,4% и 11,2% на 3-ий, 4-ый, 5-ый и 6-ой месяц введения, соответственно. Через 1 месяц после отмены препарата масса тела крыс в группе РА АТ РИβ также оставалась выше, чем в контроле (р>0,05).

Пример 7.
Изучали влияние заявленного средства (комплексного препарата), приготовленного в виде водного раствора, содержащего антитела к гамма интерферону аффинно очищенные в релиз-активной форме (AT к ИФНγ, смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 10050 раз), антитела к С-концевому фрагменту β-субъединицы рецептора инсулина аффинно очищенные в релиз-активной форме (AT к β-РИ, смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 100200 раз) и антитела к CD4 аффинно очищенные в релиз-активной форме (AT к CD4, смесь трех активных водных разведений субстанции, разведенной соответственно в 10012, 10030, 10050 раз), на продуктивность цыплят-бройлеров.
Препарат вводили выпаиванием периодами с 1 по 5 день, с 17 по 21 день, с 27 по 31 день (группа 1), либо ежедневно с 1 по 37 день (группа 2). Животные контрольной группы (группа 3) получали чистую питьевую воду. Количество птиц в каждой группе составило около 452000 особей.
При проведении исследования регистрировали следующие показатели:
1) Живая масса бройлеров на 7, 14, 21, 28, 35 и 37 сутки;
2) Среднесуточный прирост массы бройлеров;
3) Сохранность поголовья;
4) Расход корма за неделю;
5) Конверсия корма за весь период исследования;
6) Расчет индекса продуктивности птицы и экономической эффективности;
7) Показатели периферической крови на 5, 11, 22 и 35 дни.
По результатам исследования было показано, что как периодическое, так и непрерывное выпаивание цыплятам-бройлерам комбинированного препарата привело к стойкому увеличению их продуктивности (результаты исследования представлены в Таблице 17). Среднесуточный привес птицы составил 59,01 г а первой группе и 59,37 г (в контрольной группе значение данного показателя составило 57,7 г). Кроме того, в группах приема препарата вес птицы на момент окончания эксперимента был в среднем на 80-90 г выше, чем в группе контроля. Конверсия корма (потребление корма в граммах в расчете на 1 кг привеса) было наименьшим в группах приема препарата. Как при введении препарата курсами, так и при непрерывном введении увеличивается сохранность поголовья на 5,07% и 3,32%, соответственно. Существенно возрос и коэффициент продуктивности.
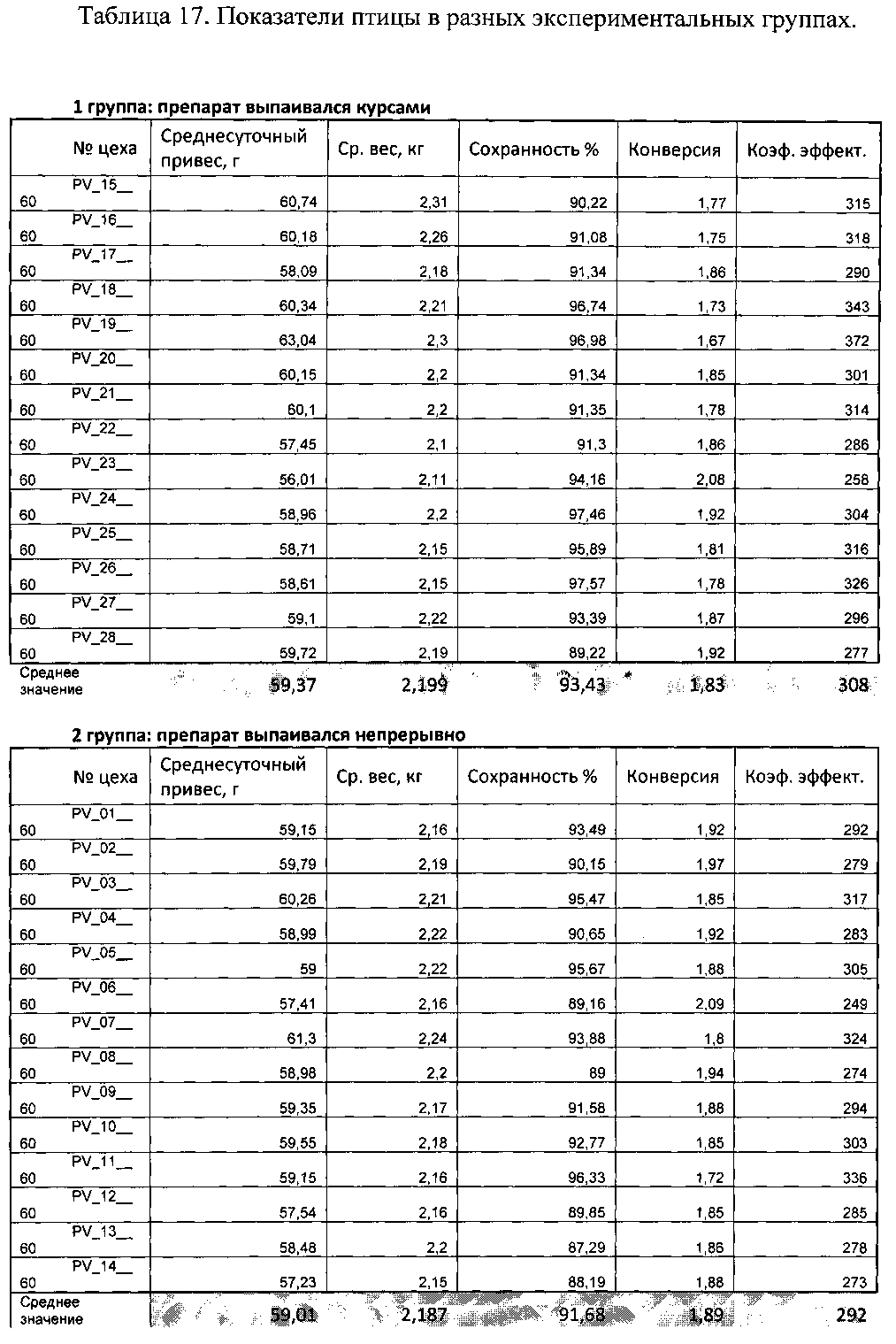
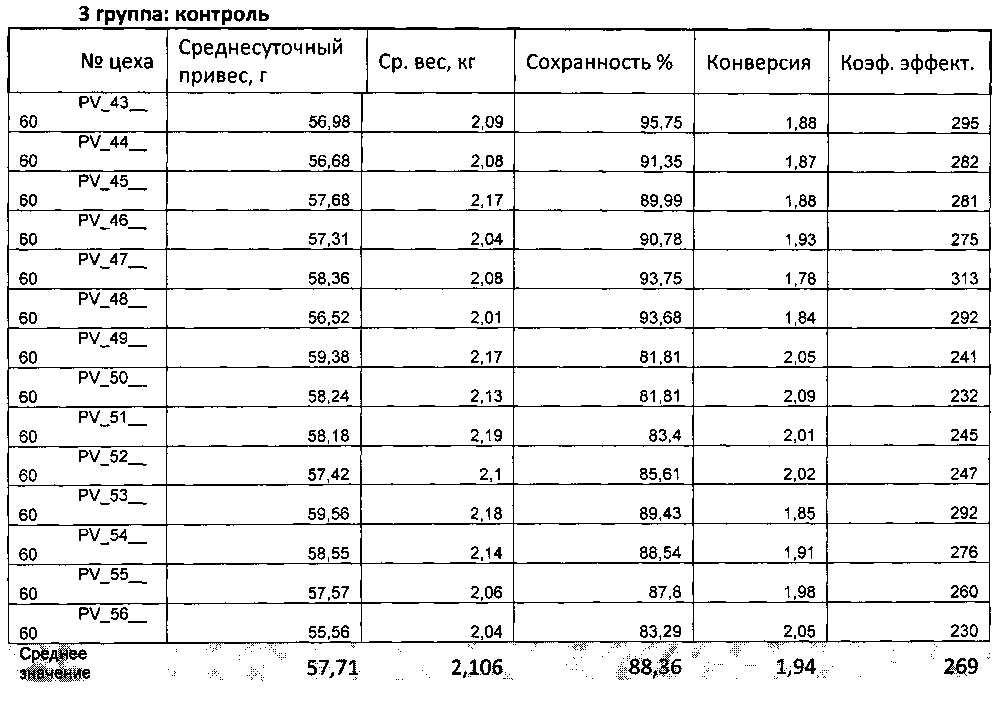
Таким образом, было показано, что курсовое или непрерывное введение цыплятам-бройлерам заявленного комплексного препарата оказывает положительное воздействие на продуктивность цыплят-бройлеров, повышает привесы, сохранность поголовья и снижает затраты корма.