Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ПЕПТИДОВ
Вид РИД
Изобретение
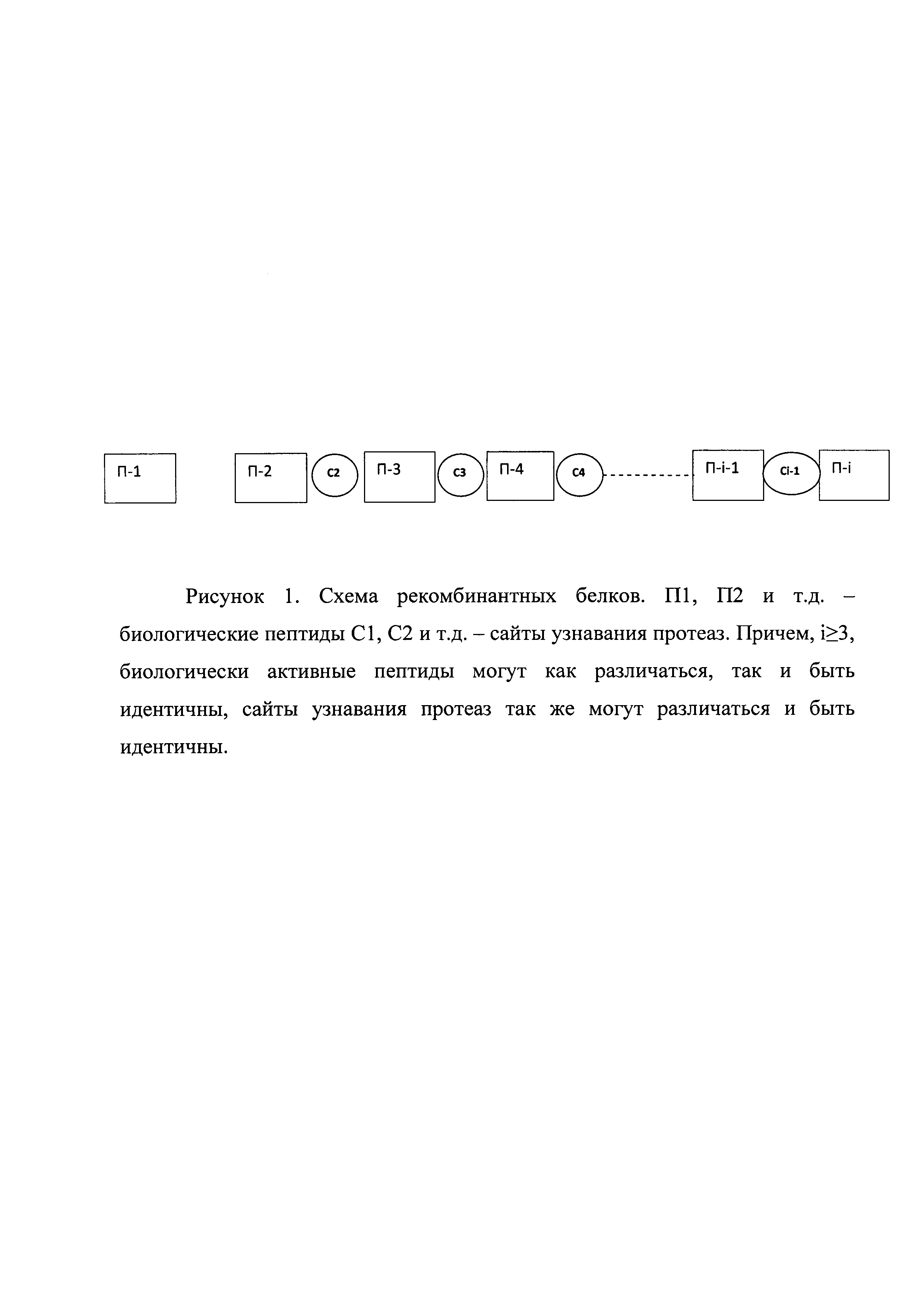
Изобретение относится к области биотехнологии, в частности к способу получения биологически активных пептидов путем экспрессии in vitro в клетках, содержащих генетические конструкции, кодирующие рекомбинантные белки, состоящие из биологически активных пептидов, разделенных сайтами узнавания протеаз (рисунок 1). Биологически активные пептиды представляют собой гормоны, их биологически активные фрагменты и/или продукты протеолиза различных белков организма. Рекомбинантный белок после введения в организм способен гидролизоваться с высвобождением биологически активных пептидов. Предложенный способ позволяет оптимизировать производство и применение лекарственных субстанций на основе смеси различных биологически активных пептидов.
Биологически активные пептиды играют важную роль как медиаторы в огромном количестве регуляторных систем. Одна часть таких пептидов получается классическим путем экспрессии прогормонов с последующим процессингом и секрецией активного компонента - пептида во внеклеточное пространство. Биологические функции таких пептидов хорошо изучены и описаны.
В то же время исследования последних десятилетий выявили вторую группу биологически активных пептидов, представляющую собой продукт протеиназного гидролиза белков различных тканей. К настоящему времени хорошо установлены такие биологически активные фрагменты, происходящие из казеина, гемоглобина, основного меилинового белка, глютена, цитохрома, лактоферина, альбумина и некоторых других [A novel system of peptidergic regulation. Karelin AA1, Blishchenko EYu, Ivanov VT. FEBS Lett. 1998 May 22; 428(1-2):7-12].
Отличительной особенностью таких пептидов является, во-первых, короткая аминокислотная последовательность (не более восьми аминокислот), во-вторых, биологический эффект проявляет смесь нескольких пептидов, выделяемых совместно из одной ткани.
Примером такой смеси пептидов может быть Миелопид, препарат широкого спектра действия. Препарат получают путем экстракции предварительно культивируемых клеток костного мозга свиньи с последующей многоступенчатой очисткой нужной фракции. Выделенная фракция изучена, и структура пептидов определена [патент РФ 2041716].
Представляется очевидным, что при современном уровне развития техники получение коротких пептидов из тканей и клеток животных является очень затратным и плохо воспроизводимым.
Современным и перспективным методом получения пептидов является использование генно-инженерных конструкций, несущих необходимы гены, кодирующие целевые пептиды.
В патенте РФ 2507212 предлагается способ получения рекомбинантных пептидов с использованием штаммов-продуцентов E.coli. Недостатком предложенного метода является экспрессия каждого пептида отдельно. Во-первых, короткие пептиды можно экспрессировать только в составе слитного белка общей массой не менее 10 кД. При среднем весе целевого пептида менее 1 кД это резко понижает выход продукта и увеличивает его стоимость. Во-вторых, как уже отмечалось, препараты содержат несколько пептидов. Следовательно, необходимо получение нескольких отдельных штаммов-продуцентов, производящих нужное число пептидов. Это еще значительно удорожает производство. В итоге в случае реализации предложенного изобретения цена продукта будет значительно выше смеси пептидов, получаемых традиционным методом из тканей животных.
Целью изобретения является создание общего простого воспроизводимого метода получения смеси коротких пептидов, обладающих изученной биологической активностью.
Получен полипептид, представляющий собой чередование коротких активных пептидов из изученной композиции, перемежающихся сайтами узнавания специфических протеаз (рисунок 1). Слитная конструкция с сайтами узнавания протеазами моделирует природную ситуацию, когда пептиды являются продуктами протеиназного гидролиза белков. Это дает возможность высвобождать активные пептиды постепенно, в количествах, достаточных для биологического эффекта без передозировки каждого компонента.
Для получения рекомбинантного белка, обладающего биологической активностью пептидов, входящих в состав миелопида, и представленного последовательностью 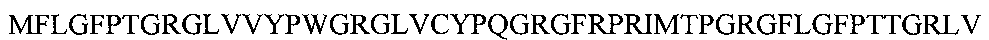
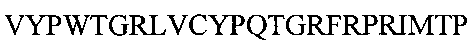 , проводили трансфекцию клеток Escherichia coli BL21 (DE3) плазмидной ДНК рЕТ30а, несущей ген, представленный последовательностью
, проводили трансфекцию клеток Escherichia coli BL21 (DE3) плазмидной ДНК рЕТ30а, несущей ген, представленный последовательностью 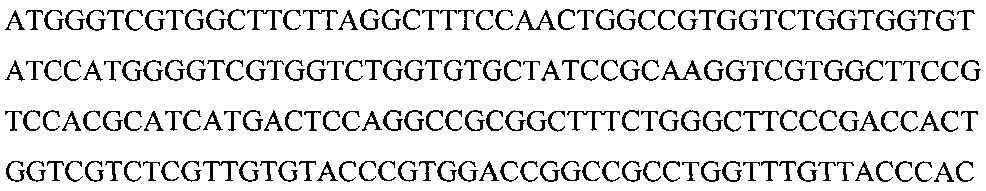
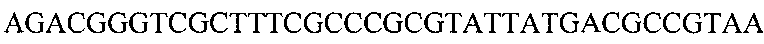 , кодирующий рекомбинантный белок, культивирование полученного штамма с индукцией экспрессии белка добавлением IPTG, лизирование, включающее обработку клеток ультразвуковым дезинтегратором с получением супернатанта, очистку супернатанта на Q-Sepharose и SP-Sepharose, объединение фракций, содержащих целевой продукт.
, кодирующий рекомбинантный белок, культивирование полученного штамма с индукцией экспрессии белка добавлением IPTG, лизирование, включающее обработку клеток ультразвуковым дезинтегратором с получением супернатанта, очистку супернатанта на Q-Sepharose и SP-Sepharose, объединение фракций, содержащих целевой продукт.
Техническим результатом заявленного изобретения является повышение эффективности профилактики и лечения путем повышения биологической активности рекомбинатного белка, на основе пептидов, входящих в состав миелопида, при этом биологически активные пептиды в составе рекомбинантного белка разделены сайтами узнавания протеаз, что дает возможность высвобождать активные пептиды постепенно. Кроме того, использование протяженного полипептида позволяет избегать применения чужеродного белка как компонента слитной конструкции, что повышает выход целевых пептидов. Заявленный рекомбинантный (протяженный полипептид) с представленной последовательностью и содержащий одновременно все короткие пептиды позволяет использовать в качестве источника субстанции единичный штамм-продуцент, что технологически более выгодно. Использование заявленной плазмиды обеспечивает эффективный синтез заявленного рекомбинантного белка.
Краткое описание чертежей
Рисунок 1. Схема рекомбинантных белков. П1, П2 и т.д. - биологические пептиды C1, С2 и т.д. - сайты узнавания протеаз. Причем i≥3, биологически активные пептиды могут как различаться, так и быть идентичны, сайты узнавания протеаз также могут различаться и быть идентичны.
Рисунок 2. Аминокислотная последовательность заявленного рекомбинантного белка на основе пептидов.
Рисунок 3. Нуклеотидная последовательность гена, кодирующего рекомбинантный белок на основе пептидов, входящих в состав Миелопида.
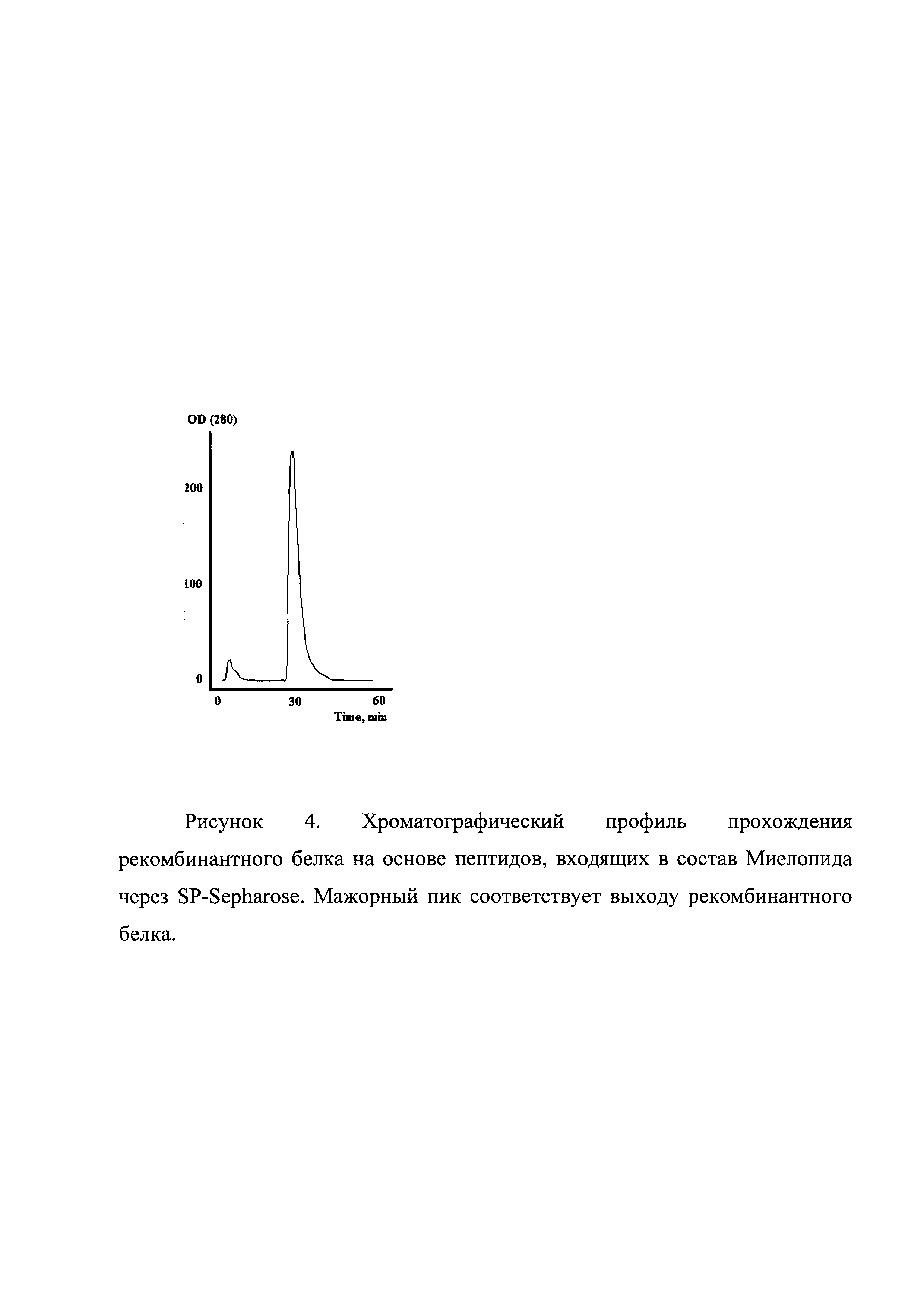
Рисунок 4. Хроматографический профиль прохождения рекомбинантного белка на основе пептидов, входящих в состав Миелопида через SP-Sepharose. Мажорный пик соответствует выходу рекомбинантного белка.
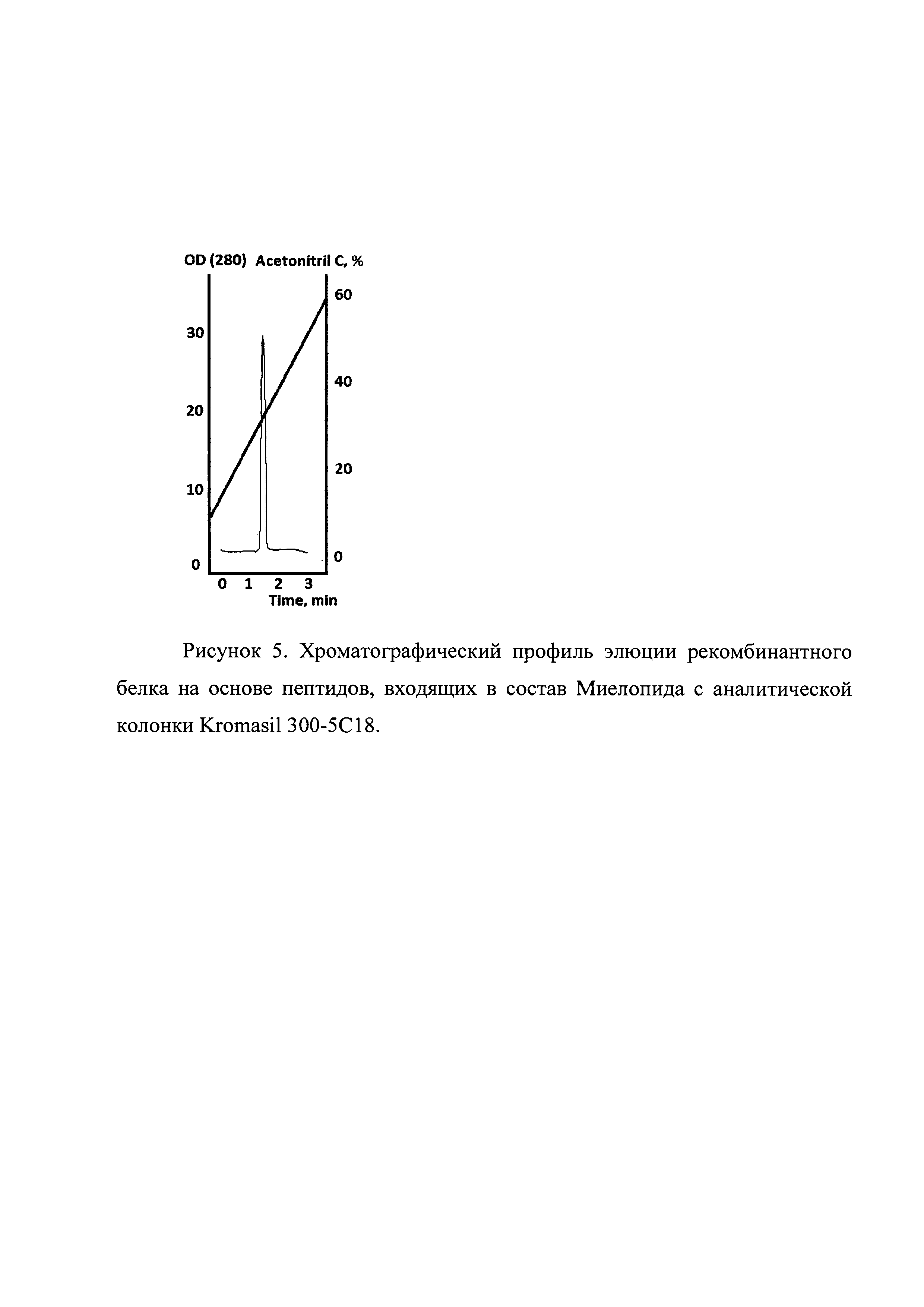
Рисунок 5. Хроматографический профиль элюции рекомбинантного белка на основе пептидов, входящих в состав Миелопида с аналитической колонки Kromasil 300-5С18.
Изобретение иллюстрируют примеры.
ПРИМЕР 1. Получение рекомбинантного белка на основе пептидов, входящих в состав миелопида
Аминокислотная последовательность рекомбинантного белка представлена на рисунке 2.
Для получения рекомбинантного белка была создана генетическая конструкция на основе плазмиды рЕТ30а, которая содержит ген, кодирующий данный рекомбинантный белок. Последовательность гена представлена на рисунке 3.
Плазмидой трансфецировались клетки E.coli штамма BL21(DE3). После трансфекции клетки пересевали в культуральную колбу с бульоном LB и канамицином 25 мкг/мл. Культура выращивалась на шейкере при 280 об/мин при температуре 37°С до достижения оптической плотности значения OD585=0,8E. Индукция экспрессии белка проводилась добавлением IPTG до концентрации 1 mM. Культура дополнительно культивировалась 4 часа, далее клетки осаждались центрифугированием при 5000g. Осадок клеток лизировали в 8 М мочевине и обрабатывали на ультразвуковом дезинтеграторе. Лизат клеток центрифугировали при 20000g 2 часа. Супернатант фильтровали через колонку с Q-Sepharose. Фракцию, не связавшуюся с данным сорбентом, хроматографировали на SP-Sepharose в градиенте NaCl (стартовый буфер: 20 mM TrisHCl рН 6.8, 20 mM NaCl, итоговый буфер 20 mM TrisHCl рН6.8, 400 mM NaCl). Хроматографический профиль представлен на рисунке 4. Фракции, содержащие целевой продукт, объединяли и диализовали в 0,9% NaCl. Чистоту продукта анализировали методом ВЭЖХ (рисунок 5).
ПРИМЕР 2. Влияние рекомбинантного белка на количество клеток, продуцирующих антитела, в лимфатических узлах иммунизированных животных
15 мышей-самок, гибридов первого поколения (CBA×C57BL), весом 20-22 г иммунизировали 5% взвесью эритроцитов барана в физиологическом растворе, подкожно по 0,1 мл в подушечки задних конечностей. Через 14 дней после первой иммунизации была проведена повторная иммунизация той же дозой и тем же способом. На 4-е сутки после второй иммунизации мышей разделили на 3 группы по 5 особей в группе. Первой группе (контрольной) вводили подкожно в подушечки задних лап по 0,1 мл физиологического раствора; второй группе вводили по 0,1 мл физиологического раствора, содержащего 1,5 мкг коммерческого препарата миелопид, и третьей группе - по 0,1 мл физиологического раствора, содержащего 1,5 мкг рекомбинантного белка. Через сутки все мыши были забиты и у них были удалены подколенные лимфоузлы. Лимфоузлы гомогенизировали и в полученной клеточной суспензии определяли методом Ерне количество клеток, продуцирующих антитело класса IgG к эритроцитам барана. Коэффициент стимуляции (К) антителообразования рассчитывали как отношение количества зон гемолиза в опытных чашках к количеству зон гемолиза в контрольных. Достоверность разницы между экспериментальными группами оценивали по t-критерию Стьюдента. Полученные результаты представлены в Таблице 1.
Из полученных данных видно, что коэффициент стимуляции - миелопид/контроль составляет (36,4/25,2)=1,44, а коэффициент стимуляции - рекомбинантный белок/контроль составляет (92,4/25,2)=3,67.
Таким образом, введение экспериментальным животным полученного рекомбинантного белка заявленным способом приводит к значительно более выраженной стимуляции антителообразования (К=3,3), т.е. обеспечивая синергетический эффект действия входящих в него миелопептидов, чем после введения миелопида (К=1,45), что подтверждает повышение биологической активности полученного рекомбинантного белка, содержащего комплекс миелопептидов.


ПРИМЕР 3. Изучение способности рекомбинантного белка восстанавливать гуморальный иммунный ответ при вторичном иммунодефицитном состоянии
10 мышам-самкам, гибридам первого поколения (CBA×C57BL), весом 18-20 г вводили внутрибрюшинно циклофосфамид в дозе 200 мг/кг в физиологическом растворе. 5 мышам вводили физиологический раствор. На следующие сутки всех 15 животных иммунизировали 5% взвесью эритроцитов барана в физиологическом растворе подкожно по 0,1 мл в подушечки задних конечностей. На 2-е и 3-й сутки после иммунизации 5 животным из группы, которая получала циклофосфамид, внутримышечно вводили по 1,5 мкг рекомбинантного белка в 0,1 мл физиологического раствора. На 4 сутки после иммунизации эритроцитами барана все мыши были забиты и у них были удалены подколенные лимфоузлы. Лимфоузлы гомогенизировали и в полученной клеточной суспензии определяли методом Ерне количество клеток, продуцирующих антитело класса IgM к эритроцитам барана. Достоверность разницы между экспериментальными группами оценивали по t-критерию Стьюдента. Полученные результаты представлены в Таблице 2.
Таким образом, введение экспериментальным животным со вторичными иммунодефицитами полученного рекомбинантного белка заявленным способом приводит к восстановлению гуморального иммунного ответа. Таким образом, полученный рекомбинантный слитый полипептид обладает биологической активностью входящих в состав пептидов, что дает возможность его использования для профилактики и лечения ВИД.

В связи с вышеизложенным, использование синтезированной плазмиды обеспечивает эффективный синтез заявленного рекомбинантного белка с биологической активностью. Получение рекомбинантного белка на основе пептидов, входящих в состав миелопида с представленной последовательностью, позволяет не только сохранить функциональную активность входящих в его пептидов, но и повысить его биологическую активность. Поскольку после введения в организм рекомбинантный белок способен гидролизоваться по сайтам узнавания специфических протеаз с высвобождением входящих в него коротких миелопептидов, что дает возможность высвобождать активные пептиды постепенно и обеспечивает синергетический эффект при иммунизации (как отмечено в вышеуказанном примере).
Способ получения рекомбинантного белка, обладающего биологической активностью пептидов, входящих в состав миелопида, и представленного последовательностьюMFLGFPTGRGLVVYPWGRGLVCYPQGRGFRPRIMTPGRGFLGFPTTGRLVVYPWTGRLVCYPQTGRFRPRIMTP, включающий трансфекцию клеток Escherichia coli BL21 (DE3) плазмидной ДНК рЕТ30а, несущей ген, представленный последовательностью ATGGGTCGTGGCTTCTTAGGCTTTCCAACTGGCCGTGGTCTGGTGGTGTATCCATGGGGTCGTGGTCTGGTGTGCTATCCGCAAGGTCGTGGCTTCCGTCCACGCATCATGACTCCAGGCCGCGGCTTTCTGGGCTTCCCGACCACTGGTCGTCTCGTTGTGTACCCGTGGACCGGCCGCCTGGTTTGTTACCCACAGACGGGTCGCTTTCGCCCGCGTATTATGACGCCGTAA, кодирующий рекомбинантный белок, культивирование полученного штамма с индукцией экспрессии белка добавлением IPTG, лизирование, включающее обработку клеток ультразвуковым дезинтегратором с получением супернатанта, очистку супернатанта на Q-Sepharose и SP-Sepharose, объединение фракций, содержащих целевой продукт.