Результат интеллектуальной деятельности: СПОСОБ СОЗДАНИЯ ПЕРСОНАЛИЗИРОВАННОГО ГЕН-АКТИВИРОВАННОГО ИМПЛАНТАТА ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ
Вид РИД
Изобретение
Предшествующий уровень техники
Проблема лечения пациентов с костными дефектами или атрофией костей высокоактуальна в практике травматологии и ортопедии, хирургической стоматологии и челюстно-лицевой хирургии [1-3]. Для устранения костных дефектов малого размера существует множество вариантов остеопластических материалов, доступны методы их оптимизации за счет смешивания с аутокосными фрагментами; плазмой, обогащенной тромбоцитами; плазмой, обогащенной факторами роста, и т.д. [1].
Однако особую актуальность и социальную значимость имеет нерешенная проблема эффективного лечения пациентов с протяженными и (или) объемными костными дефектами (более 1 см3), которые обусловлены врожденными деформациями и аномалиями развития, травмами, воспалительными заболеваниями, онкологической патологией и первыми этапами их хирургического лечения. В этих клинических ситуациях, когда в значительной степени нарушена или полностью утрачена функция кости как органа, в условиях выраженной остеогенной недостаточности восстановление целостности кости с использованием коммерчески доступных остеопластических материалов невозможно. В этих случаях может быть эффективной лишь костная аутотрансплантация (свободная или на сосудистой ножке) - «золотой стандарт» костной пластики [4, 5].
Костная пластика аутотрансплантатами сопряжена с нанесением дополнительной травмы, расширением или созданием нового операционного поля, значительным повышением времени выполнения операции и вероятности осложнений. Кроме того, выполнение костной аутотрансплантации с микрососудистой техникой реализуемо только высококвалифицированными кадрами в условиях хорошо оснащенных специализированных медицинских учреждений, обладающих необходимым оборудованием не только для выполнения таких операций, но и для контроля состоятельности сосудистых анастомозов, своевременного выполнения реваскуляризирующих вмешательств. При этом, несмотря на все сложности, затраченные силы и средства, всегда сохраняется вероятность тромбоза сосудистого анастомоза с потерей аутотрансплантата [6].
Даже в условиях абсолютных показаний для аутокостной пластики, приживления трансплантата и его полной интеграции в области реципиентного ложа, результаты лечения, в том числе долгосрочные, не всегда успешны. Это обусловлено, во-первых, высокой степенью последующей биорезорбции трансплантированного материала (до 40%). Во, вторых, во многих случаях, когда костный дефект или область атрофии костной ткани имеют сложные формы, при использовании в качестве аутотрансплантатов любого из доступных источников - малоберцовая кость, ребро, лопатка, кости черепа - не удается смоделировать трансплантат точно под форму замещаемого дефекта, т.е. таким образом, чтобы диастаз между поверхностью введенного материала и стенками костного дефекта на всем протяжении не превышал 1 мм. Это обусловливает недостаточную консолидацию трансплантированных материалов в зоне реципиентного ложа, а также возникновение послеоперационных деформаций костей или избыточную биорезорбцию аутотрансплантата.
Таким образом, несмотря на то что костные аутотрансплантаты являются «золотым стандартом» костнозамещающих материалов, их применение ограниченно, не всегда эффективно, сопряжено с высокой частотой осложнений. Одним из ключевых недостатков их использования и одной из причин недостаточной эффективности является невозможность их точного моделирования по форме и размерам замещаемого костного дефекта. При этом плотный контакт любого остеопластического материала по всей поверхности костного дефекта или области атрофии кости и полная иммобилизация являются первостепенными канонами костной пластики [1]. В условиях, когда аутокостная трансплантация невыполнима или оказалась неэффективной врачи вынуждены использовать дистракционный остеогенез, протезирование или вообще отказываться от такого вида лечения, что значительно ухудшает качество жизни пациентов.
В этой связи высокоактуальны разработки новых, более эффективных остеопластических материалов, которые способны заменить или как минимум стать сопоставимой по эффективности альтернативой применению аутокостных трансплантатов, в том числе на сосудистой ножке. Согласно результатам наших исследований, данная проблема может быть решена путем создания ген-активированных пористых биосовместимых и биодеградируемых материалов, отличающихся точным соответствием по форме и размерам костным дефектам, для восполнения которых они были изготовлены с применением технологий трехмерной печати.
Уровень техники
Известны многочисленные варианты ординарных остеопластических материалов, такие как ксено- и аллогенные костные матриксы различных вариантов обработки, кальцийфосфатная керамика, биоситаллы, полимеры органических кислот, а также синтетические аналоги или натуральные компоненты органического и минерального веществ костного матрикса. Однако все они обладают лишь остеокондуктивным действием, так как не содержат биологически активных компонентов. В этой связи, применяются только для замещения костных дефектов малого размера (объема), поскольку способны лишь оптимизировать репаративный остеогенез, но не обеспечивают его индукции [7]. Изделия указанной группы в виде персонализированных блоков для замещения протяженных и (или) объемных костных дефектов в клинической практике практически не применяются.
Другую категорию представляют собой активировнные остеопластические материалы, которые могут быть разделены на содержащие факторы роста (белки), живые клетки или генные конструкции (нуклеиновые кислоты).
Остеопластические материалы с факторами роста обладают умеренным остеоиндуцирующим действие, за счет которого способны активировать репаративный остеогенез. Однако факторы роста являются короткождивущими и короткодистантными, быстро распадаются в условиях воспаления в операционной ране, в связи с чем общая эффективность изделий оказалась недостаточна для замещения костных дефектов большого объема. В этой связи, исследования, в которых использовались технологии трехмерной печати для создания остеопластических материалов заданного размера и формы с факторами роста, немногочисленны, и во всех из них изделия создавались малого размера (около 1 см). И даже в этом случае результаты были далеки от оптимальных [8].
Примеры другого, более эффективного подхода, связаны с разработкой персонализированных тканеинженерных костных графтов. С использованием различных технологий создания носителей заданного размера и формы исследователи изготавливают персонализированные матриксы, которые затем совмещают с живыми клетка. Таким образом, носители заданных размеров и формы наделяются остеогенностью и теоретически, способны обеспечить выраженную индукуцию репаративного остеогенеза. Однако реализация живыми клетками, входящими в состав персонализированного костного графта, своего терапевтического потенциала ограничена потребностью в оксигенации. Иными словами, при малых размерах таких изделий (до 1 см3) их эффективность по сравнению с вышеуказанными категориями материалов показана в многочисленных исследованиях. Но при замещении протяженных (объемных) костных дефектов, даже при идеальном моделировании формы и размеров носителя под восполняемый дефект, эффективного результата достичь не удается, так как клетки неизбежно гибнут без адекватного кровоснабжения.
Ближайшим аналогом заявленного изобретения являются ген-активированные остеопластические материалы, состоящие из носителя и нуклеиновых кислот - генных конструкций, кодирующих факторы роста [9].
Ген-активированный остеопластический материал представляет собой комплекс «носитель - нуклеиновая кислота», компоненты которого объединены различными методами: за счет технологий «химического связывания» [7], использования вспомогательных веществ (например, гелевых биополимеров) [11], непосредственного включения нуклеиновых кислот в состав носителей на этапе синтеза матрикса и т.д.
Такие изделия обладают остеоиндуктивным действием, не ограничены потребностью в оксигенации, поскольку не содержат живых клеток. Однако выраженность их остеоиндуктивного действия и, как результат, эффективность использования в замещении костных дефектов, по мнению многих исследователей, ниже, чем в случае тканеинженерных костных графтов. Причиной является низкая эффективность трансфекции клеток реципиентного ложа генными конструкциями, а также использование для индукции восстановительного процесса «терапевтической силы» одного-двух факторов, кодируемых генными конструкциями, тогда как клетки тканеинженерных материалов обладают более широким механизмом действия.
В связи с неэффективностью указанных технологических подходов многие исследовательские группы пошли по пути усложнения изделий, создавая остеопластические материалы, содержащие комплексные, сложные носители, комбинации биологически активных компонентов: генные конструкции и клетки, клетки и факторы роста, факторы роста и генные конструкции, и даже факторы роста, генные конструкции и клетки в едином изделии. Однако создание таких материалов отличается чрезмерной стоимостью, а их эффективность в замещении протяженных костных дефектов остается недостаточной. Перечень иллюстраций:
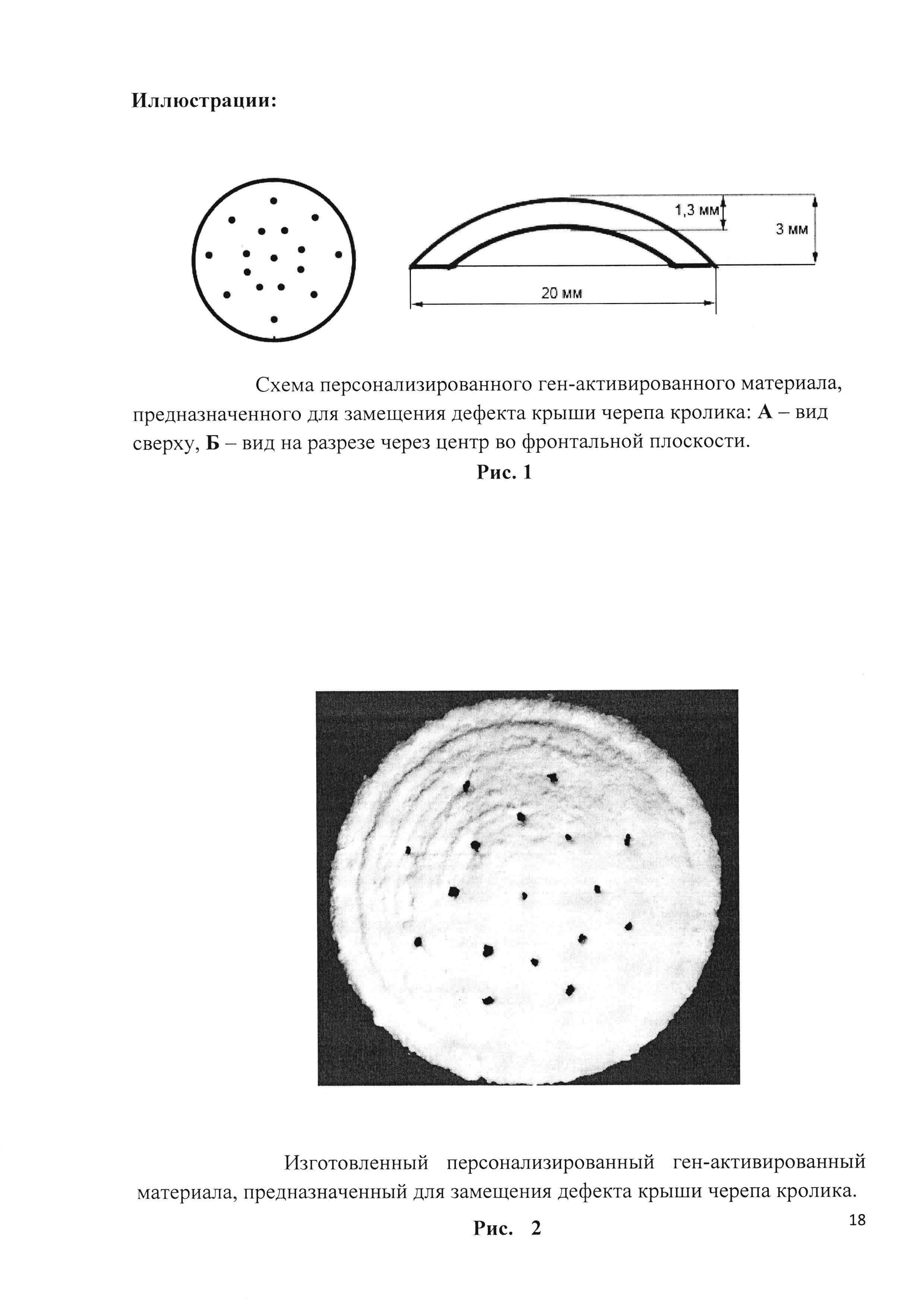
Рис. 1. Схема персонализированного ген-активированного материала, предназначенного для замещения дефекта крыши черепа кролика: А - вид сверху, Б - вид на разрезе через центр во фронтальной плоскости.
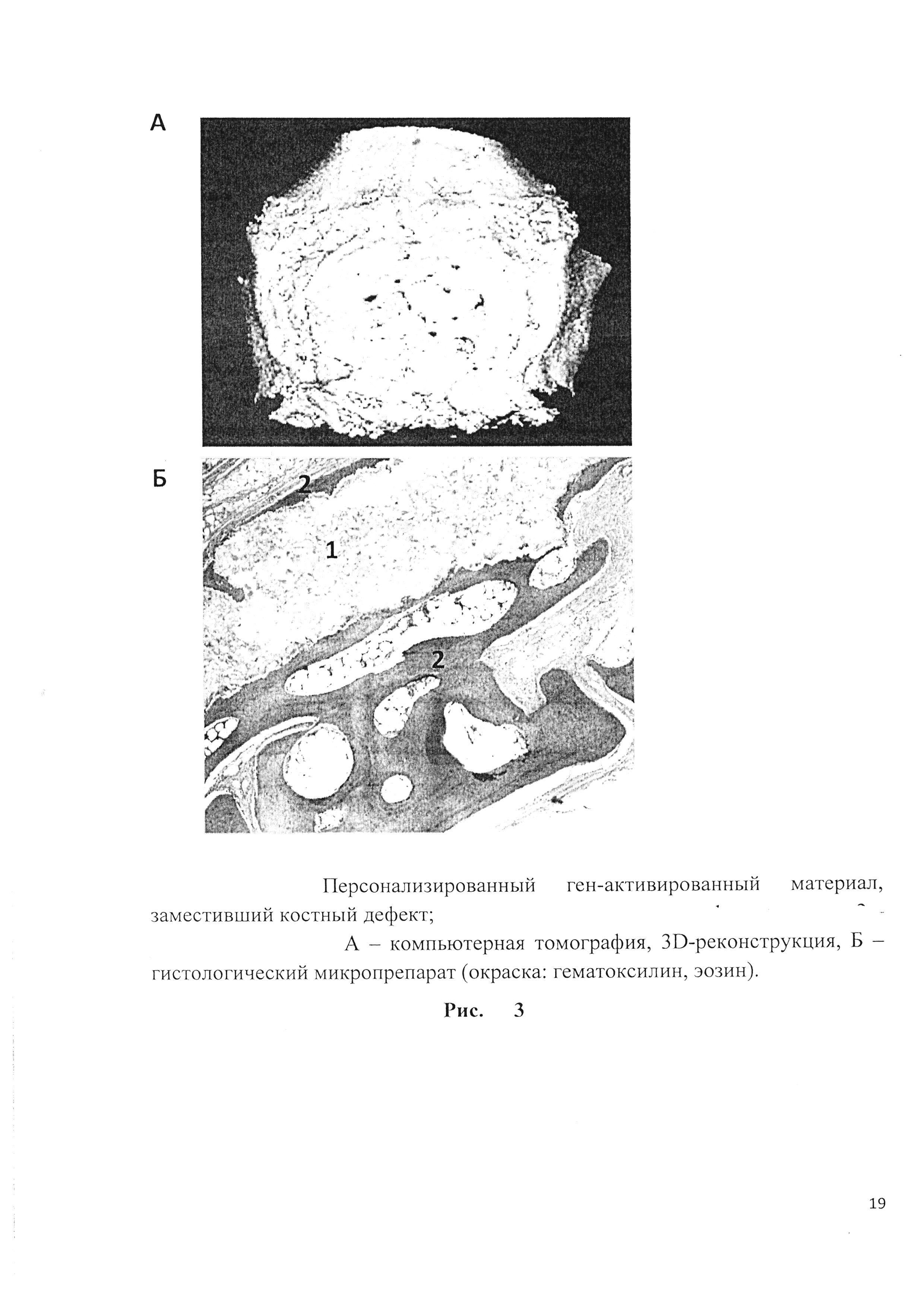
Рис. 2. Изготовленный персонализированный ген-активированный материала, предназначенный для замещения дефекта крыши черепа кролика.
Рис. 3. Персонализированный ген-активированный материал, заместивший костный дефект; 6,5 мес.после имплантации: 1 - имплантат, 2 -костный регенерат. А - компьютерная томография, 3D-реконструкция, Б - гистологический микропрепарат (окраска: гематоксилин, эозин).
Рис. 4. Персонализированный материал, не активированный генными конструкциями, заместивший костный дефект; 6,5 мес. после имплантации: 1 - имплантат, 2 - костный регенерат. Гистологический микропрепарат (окраска: гематоксилин, эозин).
Рис. 5. Схема персонализированного ген-активированного материала с фиксирующими элементами, предназначенного для замещения протяженного дефекта костей голени кролика.
Рис. 6. Персонализированный ген-активированный имплантат, фиксированный в костном дефекте с помощью реконструктивной мини-пластины и мини-винтов.
Рис. 7. Персонализированный ген-активированный материал с фиксирующими элементами, заместивший костный дефект; 3 мес. после имплантации: 1 - имплантат, 2 - костный регенерат. Гистологический микропрепарат (окраска: гематоксилин, эозин).
Подробное описание изобретения
Учитывая опыт других исследователей и известный уровень техники, логично было предположить, что материалы, как ординарные, так и активированные, содержащие либо факторы роста, либо клетки, либо генные конструкции, не могут быть эффективны для пластики протяженных (объемных) костных дефектов в виду вышеуказанных особенностей механизма действия изделий и недостаточной эффективности при замещении дефектов малого или среднего размера.
Однако наша исследовательская группа, вопреки распространенному мнению и трендам в разработках (связанным с усложнением остеопластических материалов и многокомпонентностью), пошла по иному пути - по пути совмещения хирургических и биомедицинских разработок с целью получения оптимального результата.
Суть разработанного нами изделия и технологии его создания состоит в изготовлении персонализированного матрикса из биосовместимых и биорезорбируемых материалов и совмещению его с биологически активным компонентом - генными конструкциями. Ключевым аспектом изобретения, отличающим его от ближайшего аналога [9] является применение технологий трехмерной печати с созданием персонализированного изделия, точное соответствующего по форме и размерам реципиентному ложу - области костного дефекта или атрофии костной ткани. Иными словами, изделие изготовлено таким образом, чтобы после имплантации в область реципиентного ложа диастаз между введенным материалом и костными стенками не превышал 1 мм на всем протяжении. Достижение персонализированных параметров обеспечивается применением технологий трехмерной печати. Дополнительным компонентом изделия может является фиксирующая конструкция (реконструктивные пластины, винты, мини-пластины, мини-винты, спицы, стержни и пр.), которая включается в состав материала еще на этапе его изготовления. Наличие данного компонента является обязательным в случаях, когда в качестве носителя для генных конструкций выбран биорезорбируемый материал с недостаточными прочностными характеристиками, делающими невозможной надежную фиксацию его в реципиентном ложе стандартными методами (металлоконструкциями и пр.).
Технология создания персонализированных ген-активированных материалов, разработанная нами, включает следующие этапы, последовательность которых может быть изменена:
1. Определение точной формы и размеров костного дефекта или области атрофии кости. С этой целью могут использоваться методы лучевой диагностики, такие как компьютерная томография, рентгенография и др.
2. Изготовление персонализированного носителя - заданных формы и размеров - из биорезорбируемых материалов с использованием любых методов трехмерной печати, включая стереолитографию, фотополимеризацию и др.
3. Совмещение носителя с генными конструкциями на этапе изготовления персонализированного носителя, либо после его изготовления.
Первый этап относится к планированию морфометрических параметров изготавливаемого изделия и требует применения тех же методов исследования, которые используются в ходе планирования оперативного вмешательства. Наиболее оптимальный вариант - компьютерная томография, которая является неотъемлемой частью диагностики патологии костей скелета и предоставляет данные для планирования костных реконструктивно-восстановительных операций. Полученные в ходе выполнения стандартной компьютерной томографии данные могут быть использованы для моделирования формы и размеров костного дефекта и, соответственно, формы и размеров персонализированного ген-активированного имплантата - в специализированном программном обеспечении (например, «3D Slicer», NHI, США).
На основе полученных морфометрических данных формируется мастер-файл для 3D-принтера или любого другого аппарата, способного изготовить трехмерный имплантат с заданными параметрами из необходимого биорезорбируемого материала. Учитывая специфику морфофункциональной организации и регенерации костной ткани, наиболее оптимальными материалами для изготовления носителя могут служить фосфаты кальция, гидроксиапатит, коллаген, биоситаллы, полимеры органических кислот и другие, в том числе их комбинации. Агрегатное состояние и физические свойства биорезорбируемых материалов, выбранных для создания персонализированных ген-активированных имплантатов, могут быть любыми, что влияет только на конкретный вариант технологии трехмерной печати.
Трехмерная печать матрикса-носителя может быть реализована двумя принципиально различными способами. Первый состоит в непосредственной печати носителя из выбранного материала. Второй предполагает печать формообразующих элементов (из приемлемых материалов) с последующим их использованием в качестве форм для «отливки» (синтеза) матрикса-носителя заданных формы и размеров.
Критически значимым этапом создания персонализированного ген-активированного материала является совмещение матрикса-носителя и генных конструкций (например, плазмидной ДНК). Эта часть технологии также может быть реализована несколькими способами, отчасти определяющимися природой биорезорбируемого материала, выбранного для создания матрикса-носителя. Если носитель изготавливается из жидкого (гель, золь, раствор) или временно находящегося в жидкой фазе материала, то генные конструкции могут быть внесены в него перед или во время трехмерной печати. Если используется твердый материал (например, в виде гранул), то перед или во время его трехмерной печати генные конструкции могут быть добавлены в составе содержащего их любого гелевого материала. Наиболее простым и реализуемым в большинстве случаев способом является совмещение изготовленного персонализированного материкса-носителя с генными конструкциями уже после трехмерной печати. Для этого генные конструкции в различных концентрациях в виде раствора или в составе геля могут быть инкубированы при различных условиях (температура, время экспозиции, механическое воздействие) с «напечатанным» матриксом-носителем.
Если генные конструкции совмещаются с носителем перед или на этапе его трехмерной печати, то предпочтительно выполнение трехмерной печати в стерильных условиях - чистых помещениях классов А или Б. Если же генные конструкции совмещаются с носителем после его изготовления, то трехмерная печать может быть выполнена в помещениях любого класса с последующими стерилизацией полученного персонализированного матрикса-носителя и совмещением с генными конструкциями в стерильных условиях.
Неожиданным стал тот факт, что, согласно результатам проведенных нами исследований, частично описанных в примерах, именно персонализированный ген-активированный материал, созданный с применением технологии трехмерной печати, позволяет достичь оптимальных результатов даже в случае замещения протяженных (объемных) костных дефектов. Иными словами, именно конгруэнтность и плотное прилежание ген-активированного материала ко всем поверхностям реципиентного ложа обеспечивает его эффективность. При этом аналогичный материал без генных конструкций неэффективен, а неперсонализированный ген-активированный имплантат - изделие унифицированных размеров и формы - недостаточно эффективен.
Вероятно, полученный нами успешный результат связан с тем фактом, что генные конструкции ген-активированного материала стандартных формы и размеров после имплантации в зону протяженного (объемного) костного дефекта не имеют непосредственного контакта с клетками реципиентного ложа, не достигают клеток-мишеней. Более того, наличие диастаза между костными стенками и ген-активированным материалом более 1 мм обусловливает разрушение большего количества высвобождающихся генных конструкций кровяным свертком и воспалительным экссудатом, выполняющими это пространство, и их быструю элиминацию. При этом миграция резидентных клеток недостаточно активна в виду неплотного прилежания изделия к стенкам костного дефекта. В итоге, усчитывая и без того низкую эффективность трансфекции клеток генными конструкциями, особенно в случае плазмидной ДНК, нуклеиновые кислоты не поступают в клетки в количестве, достаточном для обеспечения терапевтического эффекта.
Напротив персонализированный ген-активированный материал имеет плотное сопряжение со всеми поверхностям реципиентного ложа с величиной «свободного пространства» менее 1 мм. Это создает условия, с одной стороны, для более быстрой и массовой миграции клеток в структуру изделия, а с другой, для сокращения дистанции, которую преодолевают генные конструкции на пути к клеткам-мишеням. Сокращение этой дистанции, в виду отсутствия пространства между ген-активированным материалом и стенками костного дефекта, обеспечивает сохранение большего количества генных конструкций, что крайне значимо для реализации терапевтического эффекта.
Таким образом, критическая значимость полного соответствия формы и размеров изделия параметрам реципиентного ложа именно в случае ген-активированного материала имеет определяющее значение для реализации терапевтического эффекта изделия. Установление данного факта стало своего рода открытием, которое позволило нам разработать остеопластические материалы, эффективные для замещения протяженных и объемных (от 1 см3) костных дефектов. Однако детальные механизмы выявленной эффективности именно персонализированных ген-активированных материалов требуют дальнейших исследований и детализации.
Отчасти, решив проблему восполнения протяженных и объемных костных дефектов в аспекте биомедицинских методов, мы столкнулись с другой проблемой - хирургической. Суть ее состоит в том, что для реализации своего остеоиндуктивного действия ген-активированный материал должен не только плотно прилежать ко всем поверхностям реципиентного ложа непосредственно после имплантации, но и сохранять такое положения все время до полной интеграции с окружающей костной тканью. Иными словами, персонализированный остеопластический материал должен быть прочно фиксирован в зоне реципиентного ложа, иначе неизбежны его смещения, с появлением пространств между изделием и поверхностью реципиентного ложа, столь критичных для реализации биологического действия, подвижностью и даже выпадением. Данная проблема легко решаема в случаях, когда носитель состоит из механически прочного материала, в который могут быть вкручены или вставлены элементы фиксации (винты, мини-винты, микровинты, пины, винты) непосредственно в момент операции без деструкции изделия. Однако, зачастую, в том числе в ряде наших исследований, материал носителя является хрупким, непрочным. Такими являются, в частности, пористые матриксы из фосфатов кальция. Фиксация таких материалов непосредственно в ходе операции крайне затруднительна или просто невозможна - при введении фиксирующих элементов изделие неизбежно ломается.
В этой связи, нами были разработаны дополнительные этапы технологии и варианты персонализированных ген-активированных материалов, носители которых не обладают прочными механическими свойствами. Суть решения состоит в том, чтобы в персонализированный ген-активированный остеопластический материал еще на этапе изготовления носителя внедрить элементы фиксации. Это может быть реализовано двумя вариантами. Первый состоит во введении во внутреннюю часть изготавливаемого матрикса специального сердечника из металла или прочного биорезорбируемого материала, который может содержать отверстия под фиксирующие элементы (винты, мини-винты, микровинты, пины, спицы и т.п.). При этом со стороны, с которой планируется выполнение фиксации изделия, формируются каналы в изготавливаемом носителе, ведущие к сердечнику (или отверстиям сердечника в случае их наличия). Второй технологический вариант состоит в позиционировании внешней фиксирующей системы (например, мини-пластины с мини-винтами) в заданном положении и изготовлении носителя заданных формы и размеров уже на фиксирующих элементах. В результате, персонализированный ген-активированный материал может содержать либо внутренние (сердечник), либо внешние (в частности, мини-винты или мини-пластина с мини-винтами) элементы фиксации.
Важно, что уже в ходе первого этапа создания персонализированного ген-активированного имплантата с учетом планирующегося врачом объема оперативного вмешательства на костях скелета, должны быть выбраны элементы фиксации. Для этого изначально может быть изготовлена трехмерная модель кости с областью дефекта, атрофии или патологического процесса, коррекция которого повлечет за собой формирование дефекта. Данная модель должна быть доставлена врачу, планирующему объем оперативного лечения. Врач воспроизводит планирующиеся манипуляции (резекция фрагмента кости, освежение стенок костного дефекта и т.д.) и накладывает на модель элементы фиксации - конструкции из металлов или прочных биорезорбируемых материалов, которыми будет выполнена иммобилизация костных фрагментов и персонализированного ген-активированного имплантата. Модель с закрепленными на ней в правильном положении элементами фиксации используется для расчетов морфометрических параметров персонализированного ген-активированного имплантата и его изготовления.
Примеры
1. Персонализированный ген-активированный материал без «встроенных» фиксирующих элементов.
Прежде, чем переходить к созданию одного из вариантов персонализированного ген-активированного материала без элементов фиксации по разработанному нами способу, было необходимо определиться с адекватной биологической моделью костного дефекта критических размеров. В выборе модели для нашего исследования мы руководствовались следующими критериями: костный дефект должен быть максимальных размеров, при этом позволять надежно фиксировать блок без использования металлоконструкций в области имплантации. С учетом указанных критериев нами была разработана экспериментальная модель краниального дефекта костей кролика диаметром 20 мм. Бором выполнялась остеотомия крыши черепа с формированием костного дефекта диаметром 20 мм без повреждения твердой мозговой оболочки и сохранением в проекциях 1, 5, 7 и 11 часов фрагментов внутренней кортикальной пластинки шириной по 1 мм, выступающих к центру дефекта на 1 мм. Сохранение этих костных фрагментов в указанных позициях в качестве опорных пунктов в сочетании с размерами костного дефекта стало отличительной особенностью модели. Такая модель позволяла оптимально иммобилизировать персонализированный ген-активированный имплантат в пределах костного дефекта без использования дополнительных методов фиксации.
До выполнения операции была выполнена мультиспиральная компьютерная томография черепа кролика. В программе «3D Slicer», (NHI, США) выполнялась ручная сегментация планирующегося костного дефекта, центр которого располагался в проекции сагиттального шва на одинаковом расстоянии от лобно-теменного и теменно-затылочного швов. С учетом рассчитанных морфометрических параметров спланированного костного дефекта, была выполнена трехмерная печать блока из октакальциевого фосфата. Блок имел вид выпуклого диска, толщиной 1,3 мм, диаметром 20 мм и содержал 17 перфораций для декомпрессии головного мозга после замещения крыши черепа (рис. 1, рис. 2).
Совмещение полученного в ходе трехмерной печати матрикса-носителя с генной конструкцией (плазмидная ДНК с геном, кодирующим сосудистый эндотелиальный фактор роста (VEGF)) было выполнено по разработанному ранее лабораторному протоколу, основанном на химическом связывании нуклеиновых кислот с ионами кальция носителя:
1) отмывка матрикса-носителя (инкубирование в 0,5 М фосфатного буфера в объеме 5 мл при температуре 37°С при постоянном встряхивании в течение 12 ч);
2) уравновешивание (обработка 10 мМ фосфатного буфера в объеме 1 мл при температуре 37°С при постоянном встряхивании, 3 раза по 10 мин);
3) высушивание матрикса-носителя (инкубирование при температуре 37°С до полного высыхания - 3 ч).
4) нанесение генных конструкций (инкубирование с раствором плазмидной ДНК в 10 мМ фосфатном буфере в концентрации 1 мкг/мкл при температуре 37°С и постоянном встряхивании в течение 12 ч).
5) отмывка изделия от несвязавщейся плазмидной ДНК (обработка 5 мМ раствором фосфата в объеме 5 мл 3 раза);
6) высушивание (инкубирование при температуре 37°С до полного высыхания - 3 ч).
Через 6,5 мес.после имплантации персонализированного ген-активированного изделия целостность крыши черепа кролика была полностью восстановлена. Имплантат не резорбировался, однако периферические его участки были полностью интегрированы с окружающей костной тканью. Более того, костный регенерат протяженностью 3-6 мм формировался по внутренней и наружной поверхностям персонализированного ген-активированного изделия. Как по данным компьютерной томографии, так и гистологического исследования новообразованная костная ткань плотно прилежала к имплантату, между ними не формировалась соединительно-тканная прослойка или капсула (рис. 3).
В отсутствии ген-активированных конструкций объем новообразованной костной ткани был значительно меньшим, костный регенерат, исходящий с периферии не превышал 1-2 мм (рис. 4).
2. Персонализированный ген-активированный материал со «встроенными» фиксирующими элементами. Для исследования указанного варианта персонализированного ген-активированного материала нами была разработана другая модель: дефект костей голени кролика, длиной 36 мм со ступенчатыми краями проксимального и дистального костных фрагментов.
С применение разработанного способа был изготовлен персонализированный ген-активированный имплантат (рис. 5).
На первом этапе с помощью трехмерной печати были изготовлены формообразующие элементы, в которых позиционированы фиксирующие изделие металлоконструкции (мини-пластина и мини-винты). С использованием полученной формы синтезирован матрикс-носитель из трикальция фосфата, точно соответствующий параметрам формы и содержащий фиксирующие элементы. Выполнено совмещение имплантата с генными конструкциями (плазмидная днк с генами vegf и sdf (кодирует фактор роста стромальных клеток)) по вышеуказанному протоколу. Полученное персонализированное ген-активированное изделие со «встроенными» фиксирующими элементами имплантировано в дефект костей голени кролика, точно соответствующий параметрам изделия (рис. 6).
Через 3 мес.опороспособность конечности была полностью восстановлена. Имплантат не резорбировался к данному сроку, однако его периферические участки прочно интегрировались с костным регенератом (рис. 7).
Таким образом, разработанный нами способ создания персонализированного ген-активированного материала и его технологические варианты позволяют изготовить медицинские изделия, эффективные для замещения костных дефектов, в том числе протяженных (объемных).
Источники информации
1. Кулаков Л.А., Робустова Т.Г., Неробеев Л.И., редакторы. Хирургическая стоматология и челюстно-лицевая хирургия. Национальное руководство. Москва: «ГЭОТАР-Медиа», 2010; 928 с.
2. Pipitone PS, Rehman S. Management of traumatic bone loss in the lower extremity. Orthop Clin North Am. 2014 Oct; 45(4):469-82.
3. Tevlin R, McArdle A, Atashroo D, Walmsley GG, Senarath-Yapa K, Zielins ER, Paik KJ, Longaker MT, Wan DC. Biomaterials for craniofacial bone engineering. J Dent Res. 2014 Dec; 93(12):l 187-95.
4. Al-Nawas B, Schiegnitz E. Augmentation procedures using bone substitute materials or autogenous bone - a systematic review and meta-analysis. Eur J Oral Implantol. 2014 Summer; 7 Suppl 2:S219-34.
5. Nkenke E, Neukam FW. Autogenous bone harvesting and grafting in advanced jaw resorption: morbidity, resorption and implant survival. Eur J Oral Implantol. 2014 Summer;7 Suppl 2:S203-17.
6. Han Z, Li J, Li H, Su M, Qin L. Single versus dual venous anastomoses of the free fibula osteocutaneous flap in mandibular reconstruction: A retrospective study. Microsurgery. 2013 Sep 3. doi: 10.1002/micr. 22176. [Epub ahead of print].
7. Деев P.B., Дробышев А.Ю., Бозо И.Я. и др. Создание и оценка биологического действия ген-активированного остеопластического материала, несущего ген VEGF человека. Клеточная трансплантология и тканевая инженерия 2013; VIII (3): 78-85.
8. Strobel LA, Rath SN, Maier AK et al. Induction of bone formation in biphasic calcium phosphate scaffolds by bone morphogenetic protein-2 andprimaryosteoblasts.J Tissue Eng Regen Med. 2014 Mar; 8(3): 176-85.
9. Гоулдстейн C.A. Способы переноса генов in vivo для заживления ран. Патент №2170104 от 10.07.2001.
10. WegmanF., Bijenhof A., Schuijff L. et al. Osteogenic differentiation as a result of BMP-2 plasmid DNA based gene therapy in vitro and in vivo. Eur. Cell Mater. 2011;21:230-42.