Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pER-TA1 GyrA-AcSer, КОДИРУЮЩАЯ СЕРИНОВУЮ АЦЕТИЛТРАНСФЕРАЗУ, СПОСОБНУЮ in vivo АЦЕТИЛИРОВАТЬ N-КОНЦЕВОЙ СЕРИН ДЕЗАЦЕТИЛТИМОЗИНА α1 И ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К АВТОКАТАЛИТИЧЕСКОМУ РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ ТИМОЗИНА α1 ЧЕЛОВЕКА, ШТАММ Eschrichia coli C3030/pER-TA1GyrA-AcSer - ПРОДУЦЕНТ УКАЗАННЫХ БЕЛКОВ И СПОСОБ ПОЛУЧЕНИЯ ГЕННО-ИНЖЕНЕРНОГО ТИМОЗИНА α1 ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генной и белковой инженерии. Оно может быть использовано для получения рекомбинантного человеческого тимозина альфа 1.
Тимозин альфа 1 - это полипептид, вырабатываемый тимусовой железой, который влияет на клетки иммунной системы, участвующие в противовирусном ответе, а также прямо воздействует на инфицированные вирусом гепатоциты. Иммуномодулирующий эффект тимозина альфа 1 проявляется в повышении количества CD4, CD8 лимфоцитов и NK клеток, а также в приведении иммунного ответа к подтипу Th1. Противовирусное действие выражено в увеличении экспрессии молекул главного комплекса гистосовместимости 1-го класса на инфицированных клетках и прямом подавлении размножения вируса.
Тимозин альфа 1 человека представляет собой 28-членный полипептид, ацетилированный по N-концевой α-аминогруппе (SEQ ID NO 2).
В мировой практике тимозин альфа 1 выделяют из природных источников либо получают химическим синтезом.
Известен способ получения тимозина α1 из тимуса теленка при помощи многостадийной хроматографической очистки
(Goldstein, A.L., Т.L.K. Low, М. Mcadoo, J. Mcclure, G.В. Thurman, J.L. Rossro, C.Y. Lai, D. Chang, S.S. Wang, C. Harvey, A.H. Ramel & J. Meienhofer. 1977. Proc. Nat. Acad. Sci. US 74: 725).
Недостатком метода является сложность очистки и дороговизна получаемого пептида.
Альтернативным способом получения тимозина α1 является биотехнологический путь с использованием экспрессии рекомбинантного гена в бактериях.
Известен способ получения тимозина α1, в котором осуществлен микробиологический синтез гибридного белка, включающего в себя аминокислотную последовательность тимозин альфа 1 и бета-галактозидазу Escherichia coli
(Wetzel, R., Heyneker, H.L., Goeddel, D.V., Jhurani, P., Shapiro, J., Crea, R., Low, T.L.K., McClure, J.E., Thurman, G.В., & Goldstein, A.L. Biochem. 1980. V. 19. P. 6096-6104).
Описанная в этой работе конструкция обладает рядом недостатков. Во-первых, гибридный белок β-галактозидаза - тимозин α1 содержит в своем составе 24 метионина, что приводит после обработки бромцианом к сложной смеси продуктов, выделение из которой целевого продукта практически невозможно. Во-вторых, доля целевого пептида в гибридном белке составляет не более 3%, что обесценивает высокую экспрессию гибридного белка в клетках бактерий.
Известен способ, в котором вместо «носителя» использовался белок небольшого размера - фактор некроза опухолей
(В.Г. Коробко, Е.Ф. Болдырева, С.А. Филиппов, Н.П. Беркова, В.Н. Добрынин, В.А. Шмелев, С.Г. Попов, С.И. Евсегнеев, Л.Ю. Носова. Биоорг. химия 1992. V. 18. N 5 Р. 646-659), (Шмелев В.А., Бунина З.Ф., Кудрявцева Т.Ю. Молекуляр. генетика, микробиология и вирусология. - 1995. V1. С 9-14).
Недостатком данного способа стало уменьшение эффективности расщепления гибридного белка по сравнению с бета-галактозидазой. Расщепление гибридного белка происходило с малым выходом целевого пептида и сопровождалось образованием трудно отделяемых продуктов неспецифических реакций.
Известна более перспективная конструкция гибридного белка с модифицированным интеином Sce VMA, способного к автокаталитическому отщеплению в присутствии тиольного реагента
(Р.С. Есипов, А.И. Гуревич, В.Н. Степаненко, Л.А. Чупова, Д.В. Чувиковский, А.И. Мирошников. Биоорг. химия 2004. V. 30 N5. Р. 481-486).
Недостаток данного способа заключался в том, что процесс расщепления гибридного белка происходил неконтролируемо - на стадии in vivo и последующих стадиях очистки гибридного белка, без добавления тиольного реагента.
Недостатком всех вышеописанных способов была необходимость химического ацетилирования пептида для получения нативной структуры тимозина α1.
Наиболее близкий к заявленному способу получения тимозина α1 описан в работе (YuantaoRen, Xueqin Yao, Hongmei Dai, Shulong Li, Hongqing Fang, Huipeng Chen and Changlin Zhou. Microbial Cell Factories 2011. 10:26). В данной работе ацетилирование N-концевого серина тимозина α1 проводили in vivo аланиновой N-ацетилтрансферазой из E. coli. Для этого в многокопийную плазмиду pET22b(+) клонировали последовательность модифицированного интеина Spl DnaX и тимозина α1, а последовательность аланиновой ацетилтрансферазы (RimJ) - в низкокопийную плазмиду pACYCDuet-1. Затем трансформировали полученными плазмидами штамм E. coli BL21 (DE3).
Недостаток такого способа получения ацетилированного пептида заключается в том, что наличие двух плазмид в штамме-продуценте требует присутствия двух разных антибиотиков, что при масштабировании увеличивает затраты на производство. Также недостаток данного метода заключается в выборе аланиновой ацетилтрансферазы в качестве ацетилирующего фермента, которая неспецифична серину - N-концевой аминокислоте.
Изобретение решает задачу получения высокопродуктивного рекомбинантного бактериального штамма-продуцента, позволяющего получать рекомбинантный человеческий тимозин α1 с высоким выходом и по упрощенной технологии.
Поставленная задача решается за счет того, что:
1. Конструируют экспрессионную плазмиду ДНК pER-TA1GyrA путем клонирования гена тимозина α1 в векторную плазмиду pTWIN1. Участок, кодирующий измененную последовательность Шайна-Дальгарно и нестандартную в качестве старт-кодона аминокислоту валин, синтезируют из двух олигонуклеотидов и клонируют в вектор pER-TA1GyrA. Далее с помощью искусственно синтезированных олигонуклеотидов амплифицируют участок генома Escherichia coli, кодирующий сериновую ацетилтрансферазу, и клонируют в векторную плазмиду pER-TA1GyrA-RBS. Таким образом, получают вектор pER-TA1GyrA-AcSer.
2. Путем трансформации плазмидной ДНК pER-TA1GyrA-AcSer клеток Escherichia coli С3030 получают штамм-продуцент,
3. При индуцированном культивировании полученного штамм-продуцента происходит биосинтез рекомбинантной сериновой ацетилтрансферазы и накопление in vivo ацетилированного по N-концевой α-аминогруппе растворимого гибридного белка TA1GyrA, содержащего наряду с тимозином альфа 1 человека последовательность мини-интеина Мхе Gyr А.
4. Клеточную биомассу разрушают в буферном растворе и выделяют осветленный клеточный лизат, содержащий гибридный белок TA1GyrA. Гибридный белок TA1GyrA наносят на хитиновый сорбент уравновешенный в буфере, содержащем 100 мМ NaCl, промывают буфером, содержащим 2 М мочевину, и уравновешивают в буфере, содержащем 100 мМ ДТТ, тем самым индуцируют автокаталитическое расщепление гибридного белка, затем инкубируют 24 ч при 25°С. Отщепленный тимозин альфа 1 затем элюируют в том же буфере. Дальнейшую очистку и анализ рекомбинантного тимозина α1 человека проводят посредством обращенно-фазовой хроматографии. Идентификацию образующегося рекомбинантного человеческого тимозина α1 проводят с помощью масс-спектрометрии.
Техническим результатом автокаталитического расщепления гибридного белка является образование тимозина α1, выход которого достигает 3% относительно суммарного белка клетки при чистоте препарата не ниже 98%.
Чтобы избежать трудностей, связанных с расщеплением рекомбинантного гибридного белка с помощью различных протеаз, таких как энтерокиназа, фактор X и др., а также с целью удешевления этой стадии используют в составе гибридного белка мини-интеин GyrA из Mycobacterium xenopi (Telenti, A., Southworth, М., Alcaide, F., Daugelat, S., Jacobs, W.R. Jr. and Perler, F.B. (1997). J. Bacteriol.. 179, 6378-6382.) для направленного автокаталитического расщепления гибрида на целевой полипептид и интеин. Для этой цели амплифицируют ген тимозина α1 (SEQ ID NO 1) с помощью ПЦР, используя в качестве матрицы плазмиду с искусственным геном тимозина α1, и клонируют его в векторную плазмиду pTWIN1, содержащую ген интеина из Mycobacterium xenopi GyrA, и участок связывания с хитином (Chitin-Binding Domen) из Bacillus circulans (Telenti, A., Southworth, M., Alcaide, F., Daugelat, S., Jacobs, W.R. Jr. and Perler, F.B. (1997). J. Bacteriol.. 179, 6378-6382; Evans, J, T.C., Bermer, J., Xu, M.-Q., (1999) J. Biol. Chem., 274, 18359-18363), по сайтам рестриктаз NdeI и SapI. Далее для получения полицистронной конструкции участок, кодирующий измененную последовательность Шайна-Дальгарно, нестандартную в качестве старт-кодона аминокислоту валин и сайты эндонуклеаз рестрикции NcoI и XhoI, синтезируют из двух олигонуклеотидов и клонируют в вектор pTWIN1 по сайтам эндонуклеаз рестриции Pst I и BamHI. Далее с помощью искусственно синтезированных олигонуклеотидов амплифицируют участок генома Escherichia coli, кодирующий сериновую ацетилтрансферазу, и клонируют в полученную до этого векторную плазмиду pER-TA1GyrA-RBS по сайтам эндонуклеаз рестрикции NcoI и XhoI. Полученной экспрессионной плазмидой pER-TA1GyrA-AcSer, строение которой приведено на фиг. 1, трансформируют клетки E. coli С3030.
Образующийся при экспрессии рекомбинантного гена гибридный белок TA1GyrA далее in vivo процессируется с отщеплением N-формилметионина и селективно ацетилируется по N-концевому серину. Этот гибридный белок способен к автокаталитическому расщеплению на тимозин α1 человека и интеин. Выход тимозина α1 высокой степени чистоты (98%) после обращенно-фазовой хроматографии достигает 3% относительно суммарного белка клетки.
В предлагаемом техническом решении используют штамм-продуцент Escherichia coli С3030, содержащий плазмидную ДНК pER-TA1GyrA-AcSer для суперпродукции и продукции двух белков: гибридного белка TA1GyrA, содержащего последовательность тимозина α1 человека и интеин Мхе GirA, и фермента - сериновой ацетилтрансферазы E. coli соответственно.
Используют рекомбинантную плазмидную ДНК pER-TA1GyrA-AcSer
- кодирующую аминокислотную последовательность рекомбинантного человеческого тимозина α1;
- состоящую из из BsaBI/NdeI-фрагмента ДНК плазмиды pTWIN-1, содержащего последовательность промотора Т7 и оператора lacO; NdeI/PstI-фрагмента ДНК, содержащего последовательность гибридного белка, включающего в себя адаптированную к этим сайтам последовательность гена рекомбинантного человеческого тимозина α1, последовательность интеина Мхе GyrA и последовательность хитинсвязывающего домена; PstI/NcoI-фрагмента ДНК, кодирующего ослабленную последовательность Шайна-Дальгарно и нестандартную в качестве старт-кодона аминокислоту валин; NcoI/XhoI-фрагмента ДНК, содержащего последовательность сериновой N-ацетилтрансферазы;
- содержащая в качестве генетического маркера ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой pER-TA1GyrA-AcSer клеток E. coli к пенициллиновым антибиотикам; последовательность, кодирующую точку начала репликации; ДНК фрагмент, кодирующий последовательность лактозного репрессора LacI.
Конструкция рекомбинантной плазмидной ДНК pER-TA1GyrA-AcSer обеспечивает высокий уровень экспрессии клонированного в ней гена гибридного белка TA1GyrA, содержащего на 5′-конце ген тимозина альфа 1, соединенного с геном Мхе GyrA. Для конструирования плазмиды используют химический подход, позволяющий использовать для экспрессии клонированного структурного гена оптимальные регуляторные элементы, контролирующие его экспрессию.
Ген человеческого тимозина α1 получают амплификацией участка плазмиды pIntTim3 (Р.С. Есипов, А.И. Гуревич, В.Н. Степаненко, Л.А. Чупова, Д.В. Чувиковский, А.И. Мирошников. Биоорг. химия 2004. V. 30 N5. Р. 481-486). Концевые его участки, содержащие соответствующие вектору сайты эндонуклеаз рестриции, вводят с помощью ПЦР с синтетическими олигонуклеотидными праймерами А1 и B1 (SEQ ID NO 3) и затем ген клонируют в векторную плазмиду pTWIN1.
Предлагаемый штамм-продуцент Escherichia coli С3030/pER-TA1GyrA-AcSer характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки. Клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент E. coli С3030/pER-TA1GyrA-AcSer отличается от штамма-реципиента E. coli С3030 только наличием рекомбинантной плазмидной ДНК pER-TA1GyrA-AcSer, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Штаммы-продуценты получают путем трансформации компетентных клеток E. coli С3030 соответствующей рекомбинантной плазмидной ДНК.
Клетки E. coli С3030/pER-TA1GyrA-AcSer являются одновременно суперпродуцентом и продуцентом. При индукции изопропилтио-β-D-галактозидом происходит эффективный биосинтез гибридного белка TA1GyrA, который накапливается в клетках в количестве 15% суммарного белка клетки в растворимом виде. Продукция фермента составляет 6% по отношению к общим белкам клетки.
Изобретение осуществляют следующим образом. Конструируют рекомбинантную плазмидную ДНК pER-TA1GyrA-AcSer, для чего ген рекомбинантного человеческого тимозина α1 амплифицируют с помощью ПЦР с синтетическими олигонуклеотидными праймерами (SEQ ID NO 3), содержащими сайты рестриктаз NdeI (N-конец гена, праймер А1) и SapI (С-конец гена, праймер В1), полученную ДНК расщепляют соответствующими рестриктазами и затем лигируют с расщепленной по тем же сайтам векторной плазмидой pTWIN1. Далее участок, кодирующий измененную последовательность Шайна-Дальгарно, нестандартную в качестве старт-кодона аминокислоту валин и сайты эндонуклеаз рестриции PstI и BamHI, NcoI и XhoI (SEQ ID NO 6), синтезируют из двух олигонуклеотидов и клонируют в полученную плазмиду pER-TA1GyrA по сайтам рестрикции PstI и BamH1. Ген сериновой ацетилтрансферазы получают амплификацией генома E. coli с помощью ПЦР с праймерами В3 и A3 (SEQ ID NO 5), содержащими сайты эндонуклеаз рестриции NcoI и XhoI. Полученную ДНК расщепляют соответствующими рестриктазами и затем лигируют с расщепленной по тем же сайтам плазмидой pER-TA1GyrA-RBS. Лигазной смесью трансформируют компетентные клетки E. coli С3030 и высевают на LB-агар, содержащий 50 мкг/мл ампициллина или другого пенициллинового антибиотика. Полученные клоны анализируют с помощью секвенирования.
Штамм-продуцент E. coli C3030/pER-TA1GyrA-AcSer выращивают в богатой среде (YT-, LB-бульон и др.) (или индуцируют изопропилтио-β-D-галактозидом и снова выращивают) до достижения максимальной плотности культуры.
На (SEQ ID NO 1) изображена структура гена рекомбинантного человеческого тимозина α1. На (SEQ ID NO 2) изображена аминокислотная последовательность рекомбинантного человеческого тимозина альфа 1.
Изобретение иллюстрируют следующие рисунки.
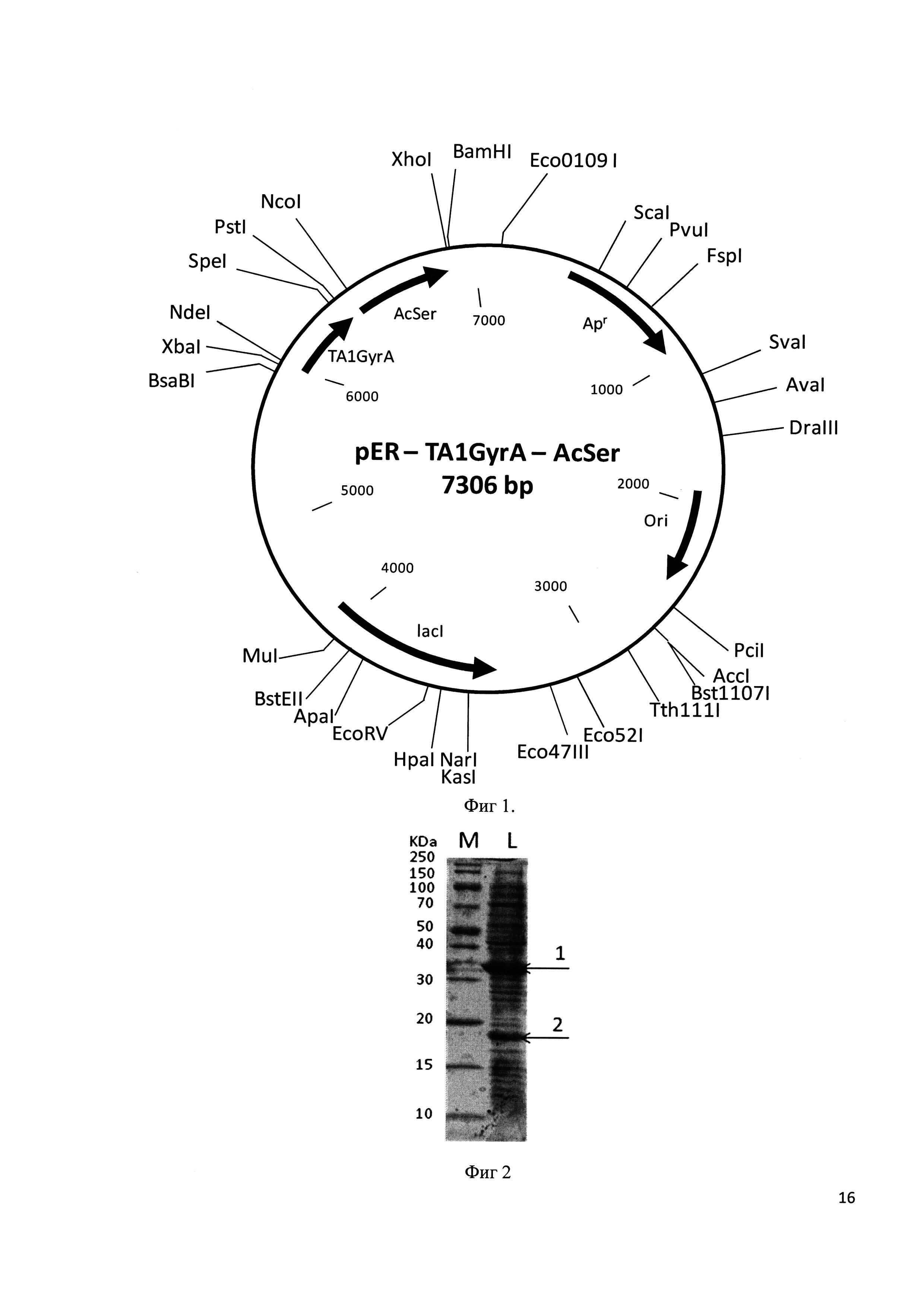
Фиг 1. Физическая карта плазмиды pER-TA1GyrA-AcSer.
Фиг 2. Электрофорграмма лизата клеток штамма-продуцента E. coli C3030/pER-TA1GyrA-AcSer,
Изобретение иллюстрируется нижеследующими примерами.
Пример 1
Конструирование рекомбинантной плазмидной ДНК.
Химический синтез олигонуклеотидов выполняют твердофазным фосфоамидитным методом на ДНК-синтезаторе ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3′-конца к 5′-концу с помощью защищенных фосфамидитов - 5′-диметокситритил-N-ацил-2′-дезоксинуклеозид-3′-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 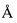 ), к которому через 3′-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Используют синтетический цикл стандартного фосфоамидитного метода.
), к которому через 3′-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Используют синтетический цикл стандартного фосфоамидитного метода.
Для приготовления вектора ДНК плазмиды pTWTN1 (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, рН 7,9, 10 мМ Mg-ацетат, 66 мМ К-ацетат 1, 0,5 мМ ДТТ, 0,1 мг/мл БСА) рестриктазой SapI (10 ед. акт.), а затем - в 40 мкл буфера О (50 мМ трис-HCl, рН 7,5, 10 мМ MgCl2, 100 мМ NaCl, 0,1 мг/мл БСА) рестриктазой NdeI (10 ед. акт.) в течение 1 ч при 37°С. Векторный фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpin Extract II. Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Для приготовления гена тимозина альфа 1 проводят амплификацию с помощью ПЦР, используя в качестве матрицы плазмиду с искусственным геном тимозина α1 (0,01 мкг в образце), а в качестве праймеров - синтетические олигонуклеотиды А1 и В1 (по 60 пмоль каждого). ПЦР проводят в ДНК-амплификаторе, в буферном растворе, состоящем каждый из четырех dNTP в концентрации 0,5 мМ и 5 ед. акт. Taq-ДНК-полимеразы, в следующем режиме: денатурация - 1 мин при 94°С, отжиг - 30 сек при 60°С, элонгация - 40 сек при 72°С, 30 циклов ПЦР. Ген после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpin Extract II. Промывают буфером NT 3 и элюируют 50 мкл буфера NE, затем расщепляют теми же рестриктазами, которые используют при приготовлении вектора, и выделяют целевой фрагмент из агарозного геля.
Полученный синтетический фрагмент с геном рекомбинантного человеческого тимозина α1 в количестве 2 пмоль прибавляют к раствору 1 мкг описанного выше векторного фрагмента в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ рАТФ, 10 мМ дитиотреитол) и лигируют с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
ДНК, содержащую измененную последовательность Шайна-Дальгарно, нестандартную в качестве старт-кодона аминокислоту валин, а также сайты эндонуклеаз рестрикции получают из двух синтетических олигонуклеотидов А2 и В2 (SEQ ID NO 4). Олигонуклеотиды смешивают в эквимольном количестве (по 600 пмоль), денатурируют при 90°С и подвергают отжигу при медленном понижении температуры до 30°С.
Плазмиду pER-TA1GyrA (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера О (50 мМ трис-HCl, рН 7,5, 10 мМ MgCl2, 100 мМ NaCl, 0,1 мг/мл БСА) рестриктазой PstI (10 ед. акт.), а затем - в 40 мкл буфера R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл БСА) рестриктазой BamHII (10 ед. акт.) в течение 1 ч при 37°С. Векторный фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpin Extract II. Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Полученный синтетический фрагмент с измененной последовательностью Шайна-Дальгарно (SEQ ID NO 6) в количестве 2 пмоль прибавляют к раствору 1 мкг описанного выше векторного фрагмента в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреитол) и лигируют с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С. В результате получается плазмида pER-TA1GyrA-RBS.
Плазмиду pER-TA1GyrA-RBS (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера Y (33 мМ трис-ацетат, рН 7,9, 10 мМ Mg-ацетат, 66 мМ К-ацетат 1, 0,5 мМ ДТТ, 0,1 мг/мл БСА) рестриктазой NcoI (10 ед. акт.), а затем - в 40 мкл буфера R (10 мМ трис-HCl, рН 8,5, 10 мМ MgCl2, 100 мМ KCl, 0,1 мг/мл БСА) рестриктазой XhoI (10 ед. акт.) в течение 1 ч при 37°С. Векторный фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpin Extract II. Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Для приготовления гена сериновой ацетилтрансферазы проводят амплификацию с помощью ПЦР, используя в качестве матрицы геномную ДНК E. coli (0,01 мкг в образце), а в качестве праймеров - синтетические олигонуклеотиды A3 и В3 (по 60 пмоль каждого). ПЦР проводят в ДНК-амплификаторе, в буферном растворе, состоящем каждый из четырех dNTP в концентрации 0,5 мМ и 5 ед. акт. Taq-ДНК-полимеразы, в следующем режиме: денатурация - 1 мин при 94°С, отжиг - 30 сек при 60°С, элонгация - 40 сек при 72°С, 30 циклов ПЦР. Фрагмент длиной 564 п.о. после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpin Extract II. Промывают буфером NT 3 и элюируют 50 мкл буфера NE, затем расщепляют рестриктазами, которые используют при приготовлении вектора.
Полученный синтетический фрагмент с последовательностью сериновой ацетилтрансферазы в количестве 2 пмоль прибавляют к раствору 1 мкг описанного выше векторного фрагмента в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ рАТФ, 10 мМ дитиотреитол) и лигируют с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
Аликвоту реакционной смеси используют для трансформации компетентных клеток E. coli С3030. Трансформанты высевают на чашки с LB-агаром, содержащим 50 мкг/мл ампициллина. Из клонов выделяют ДНК плазмиды pER-TA1GyrA-AcSer и анализируют с помощью эндонуклеаз NdeI, SapI, PstI, BamHI, NcoI и XhoI. Скрининг рекомбинантов проводят с помощью секвенирования. Физическая карта плазмиды pER-TA1GyrA-AcSer представлена на фиг. 1. Указаны сайты эндонуклеаз рестрикции. Ori - участок инициации репликации пзамиды. ApR - ген устойчисовсти к ампицилину. LacI - ген репрессора лактозного оперона. TA1GyrA - ген рекомбинантного белка, кодирующий тимозин альфа 1 человека и интеин GyrA. serAc - ген, кодирующий сериновую ацетилтрансферазу.
Пример 2
Получение штамма-продуцента E. coli С3030/pER-TA1GyrA-AcSer и определение его продуктивности.
Штамм-продуцент E. coli С3030/pER-TA1GyrA-AcSer получают трансформацией компетентных клеток E. coli С3030 плазмидой pER-TA1GyrA-AcSer, как описано в примере 1. Клетки E. coli С3030, несущие плазмиду, структура которой подтверждена данными анализа (см. пример 1), являются продуцентами двух белков.
Штамм продуцент E. coli С3030/pER-TA1GyrA-AcSer выращивают при 37°С в 100 мл LB-бульона (рН 7,0) с 50 мкг/мл ампициллина в течение 2 ч на качалке со скоростью вращения 190 об/мин до мутности А550 0,7-0,8, прибавляют изопропилтио-β-D-галактозид до концентрации 0,2 мМ и продолжают процесс еще 6 ч, или продолжают выращивание в отсутствие индуктора в течение 6 ч. Каждый час отбирают пробу по 2 мл, определяют А550 и количество культуры, соответствующее 1 мл с А550 1,0, центрифугируют 5 мин при 6000 об/мин. Осажденные клетки в 100 мкл лизирующего буфера с красителем бромфеноловым синим обрабатывают 20 сек ультразвуком, нагревают 3 мин при 100°С и пробы по 4 мкл используют для электрофореза в 15% SDS-ПААГ. Гель прокрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930. На фиг. 2. представлена электрофорграмма лизата клеток штамма-продуцента E. coli C3030/pER-TA1GyrA-AcSer, где М - стандарт молекулярных масс, L - лизат клеток, 1 - гибридный белок, содержащий тимозин альфа 1, 2 - сериновая ацетилтрансфераза.
Пример 3
Получение гибридного белка TA1GyrA, его автокаталитическое расщепление и выделение рекомбинантного тимозина α1 человека.
После окончания ферментации клетки продуцента гибридного белка TA1GyrA (биомассу) отделяют центрифугированием (5000 g, 20 мин, 4°С), разрушают на ультразвуковом дезинтеграторе в буфере (50 мМ Трис/HCl, 10 мМ ЭДТА, 1 мМ ПМСФ) и выделяют центрифугированием (15000 g, 45 мин) осветленный клеточный лизат. Наносят на хитиновый сорбент уравновешенный в буфере, содержащем 50 мМ Трис/HCl, 100 мМ NaCl, промывают буфером, содержащим 50 мМ Трис/HCl, 100 мМ NaCl, 2 М мочевину, и уравновешивают в буфере, содержащем 50 мМ Трис/HCl, 100 мМ NaCl, 100 мМ ДТТ, тем самым индуцируют автокаталитическое расщепление гибридного белка, затем инкубируют 24 ч при 25°С. Дальнейшую очистку рекомбинантного тимозина α1 человека проводят посредством обращенно-фазовой жидкостной хроматографии. Анализ полученного продукта проводят при помощи ОФ ВЭЖХ. Фракции с содержанием белка ТА1 не менее 98% объединяют и лиофилизуют. Выход рекомбинантного тимозина α1 составляет 3 мг из 100 г клеток или 3% суммарного белка клеток.
Идентификацию образующегося рекомбинантного человеческого тимозина α1 проводят с помощью TOF-ESI-масс-спектрометрии на масс-спектрометре Agilent technologies 6224. Полученный сигнал рекомбинантного тимозина α1 соответствует расчетному значению массы 3108,31 Да.