Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПИРИПИРОПЕНА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] По данной патентной заявке испрашивается приоритет патентной заявки Японии № 14727/2010, поданной 26 января 2010 года и полное описание которой включено в настоящий документ в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
[0002] Область изобретения
Настоящее изобретение относится к способу получения пирипиропена, более конкретно, к способу получения пирипиропенов A, E, O или т.п.
[0003] Предшествующий уровень техники
Как описано в выложенной публикации патента Японии № 360895/1992 (патентный документ 1) и Journal of Antibiotics (1993), 46(7), 1168-9 (непатентный документ 1), пирипиропен A обладает ингибирующей активностью в отношении ACAT (ацил-КоА-холестеринацилтрансферазы), и от него ожидают применений в лечении заболеваний, вызываемых накоплением холестерина или т.п.
[0004] В качестве продуцирующего пирипиропен A гриба в выложенной публикации патента Японии № 360895/1992 (патентный документ 1) описан штамм Aspergillus fumigatus FO-1289; в Applied and Environmental Microbiology (1995), 61(12), 4429-35 (непатентный документ 2) описан штамм Eupenicillium reticulosporum NRRL-3446; в WO2004/060065 (патентный документ 2) описан штамм Penicillium griseofulvum F1959 и в Journal of Technical Disclosure 500997/2008 (патентный документ 3) описан штамм Penicillium coprobium PF1169.
[0005] Кроме того, в качестве пути биосинтеза пирипиропена A в Journal of Organic Chemistry (1996), 61, 882-886 (непатентный документ 3) и в Chemical Review (2005), 105, 4559-4580 (непатентный документ 4) описан предполагаемый путь биосинтеза в штамме Aspergillus fumigatus FO-1289. В этих документах описано, что в штамме Aspergillus fumigatus FO-1289 с синтезом пирипиропена A циклазой связаны подструктуры, отдельно синтезируемые поликетидсинтазой или пренилтрансферазой.
ССЫЛКИ НА ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] [Патентный документ 1] выложенная публикация патента Японии № 360895/1992
[Патентный документ 2] WO2004/060065
[Патентный документ 3] Journal of Technical Disclosure 500997/2008
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0007] [Непатентный документ 1] Journal of Antibiotics (1993), 46(7), 1168-9.
[Непатентный документ 2] Applied and Environmental Microbiology (1995), 61(12), 4429-35.
[Непатентный документ 3] Journal of Organic Chemistry (1996), 61, 882-886.
[Непатентный документ 4] Chemical Review (2005), 105, 4559-4580.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Авторы настоящего изобретения обнаружили, что пирипиропен A или т.п. можно получать, культивируя микроорганизм, в который наряду с промежуточным соединением, необходимым для биосинтеза пирипиропена A, введен конкретный полинуклеотид или содержащий его/их рекомбинантный вектор. Настоящее изобретение сделано на основе такого открытия.
[0009] Таким образом, целью настоящего изобретения является предоставление способа получения пирипиропена A.
[0010] Кроме того, по одному из вариантов осуществления настоящего изобретения предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (I)-(III) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена A через пирипиропен O:
(I) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (a)-(d) ниже:
(a) нуклеотидная последовательность SEQ ID NO: 266,
(b) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266,
(c) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 266, в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266, и
(d) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью SEQ ID NO: 266 и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266;
(II) выделенный полинуклеотид, имеющий нуклеотидную последовательность, кодирующую, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 267-275, или по существу эквивалентную ей аминокислотную последовательность; и
(III) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(i) ниже:
(a) нуклеотидная последовательность от положения 3342 до положения 5158 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 5382 до положения 12777 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(d) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(e) нуклеотидная последовательность от положения 18506 до положения 19296 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(f) нуклеотидная последовательность от положения 19779 до положения 21389 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(g) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(h) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(i) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0011] Также согласно другому варианту осуществления настоящего изобретения предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0012] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0013] Согласно другому варианту осуществления настоящего изобретения предоставлен, по меньшей мере, один выделенный полинуклеотид из указанных выше (I)-(III).
[0014] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен рекомбинантный вектор, выбранный из группы, состоящей из pPP6 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP6: FERM BP-11218), pPP7 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP7: FERM BP-11219) и pPP9 (№ доступа Aspergillus oryzae, трансформированного плазмидой pPP9: FERM BP-11220).
[0015] Кроме того, согласно другому варианту осуществления настоящего изобретения предоставлен трансформант, содержащий один или более векторов, выбранных из группы, состоящей из плазмид pPP6, pPP7 и pPP9.
[0016] Согласно другому варианту осуществления настоящего изобретения предоставлено применение указанного выше рекомбинантного вектора для получения пирипиропена A.
[0017] Согласно другому варианту осуществления настоящего изобретения предоставлено применение указанного выше трансформанта для получения пирипиропена A.
[0018] В соответствии со способом получения по настоящему изобретению пирипиропены A, E, O или т.п. можно получать способами генетической рекомбинации. Таким образом, способ получения по настоящему изобретению вносит значительный вклад в технологию крупномасштабного производства пирипиропенов A, E, O или т.п.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0019] [Фигура 1] На фиг.1 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: M: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 1: праймеры SEQ ID NO: 1 и 2, полоса 2: праймеры SEQ ID NO: 239 и 240, полоса 3: праймеры SEQ ID NO: 237 и 238, полоса 4: праймеры SEQ ID NO: 241 и 242, полоса 5: праймеры SEQ ID NO: 247 и 248, полоса 6: праймеры SEQ ID NO: 251 и 252, полоса 7: праймеры SEQ ID NO: 245 и 246, полоса 8: праймеры SEQ ID NO: 243 и 244, полоса 9: праймеры SEQ ID NO: 249 и 250, полоса 10: праймеры SEQ ID NO: 235 и 236, полоса 11: праймеры SEQ ID NO: 233 и 234, полоса 12: праймеры SEQ ID NO: 227 и 228, полоса 13: праймеры SEQ ID NO: 229 и 230, полоса 14: праймеры SEQ ID NO: 231 и 232.
[Фигура 2] Подобно фиг.1 на фиг.2 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: M: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 1: праймеры SEQ ID NO: 253 и 254, полоса 2: праймеры SEQ ID NO: 257 и 258, полоса 3: праймеры SEQ ID NO: 259 и 260, полоса 4: праймеры SEQ ID NO: 255 и 256, полоса 5: праймеры SEQ ID NO: 261 и 262.
[Фигура 3] Подобно фиг.1 на фиг.3 представлено изображение электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали продукты ПЦР, амплифицированные с использованием следующих праймеров: полоса 1: маркер молекулярной массы (лестничный маркер 100 п.н.), полоса 2: праймеры SEQ ID NO: 264 и 265 (амплифицированный фрагмент 400 п.н.).
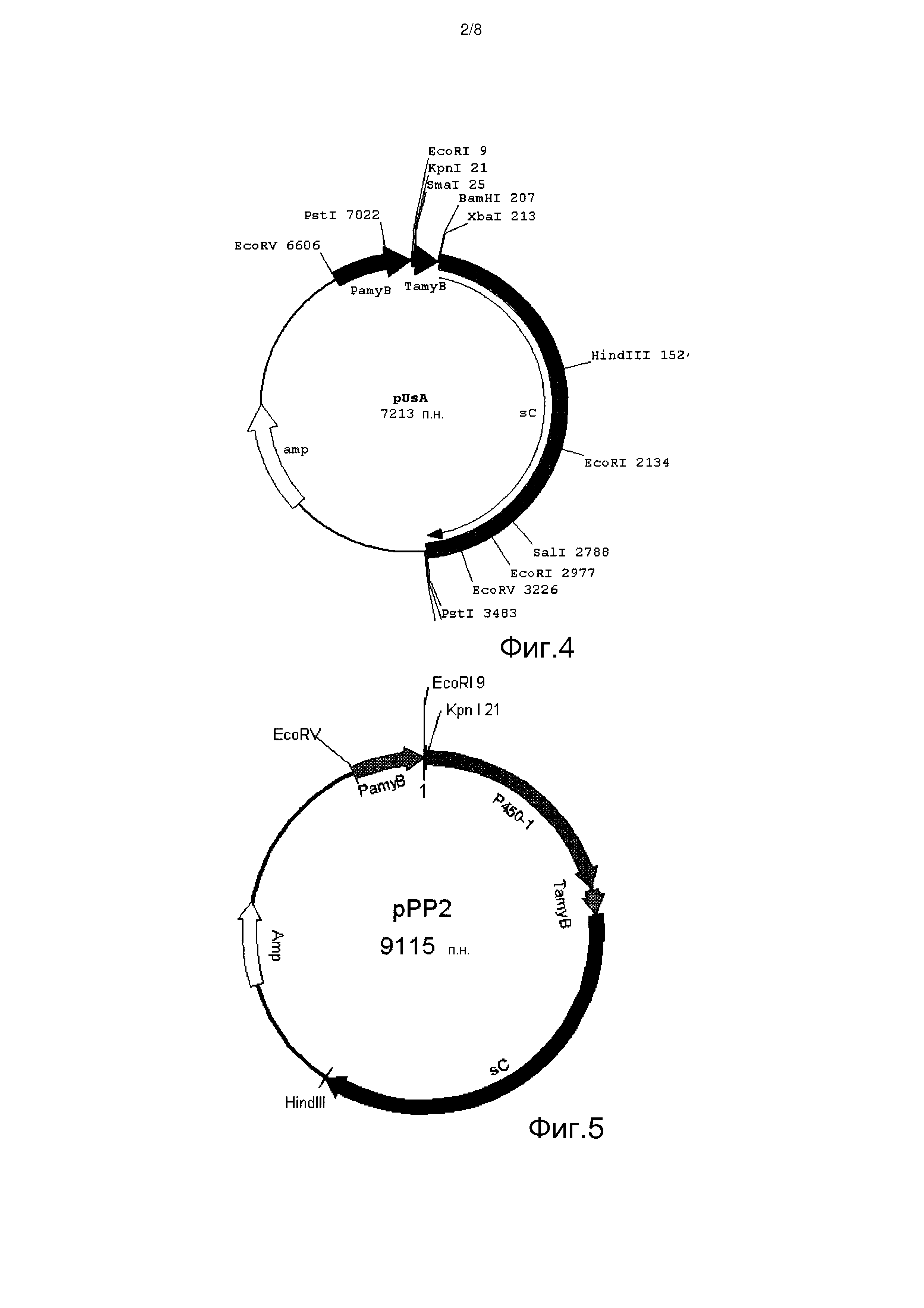
[Фигура 4] На фиг.4 представлена карта плазмиды pUSA.
[Фигура 5] На фиг.5 представлена карта плазмиды pPP2.
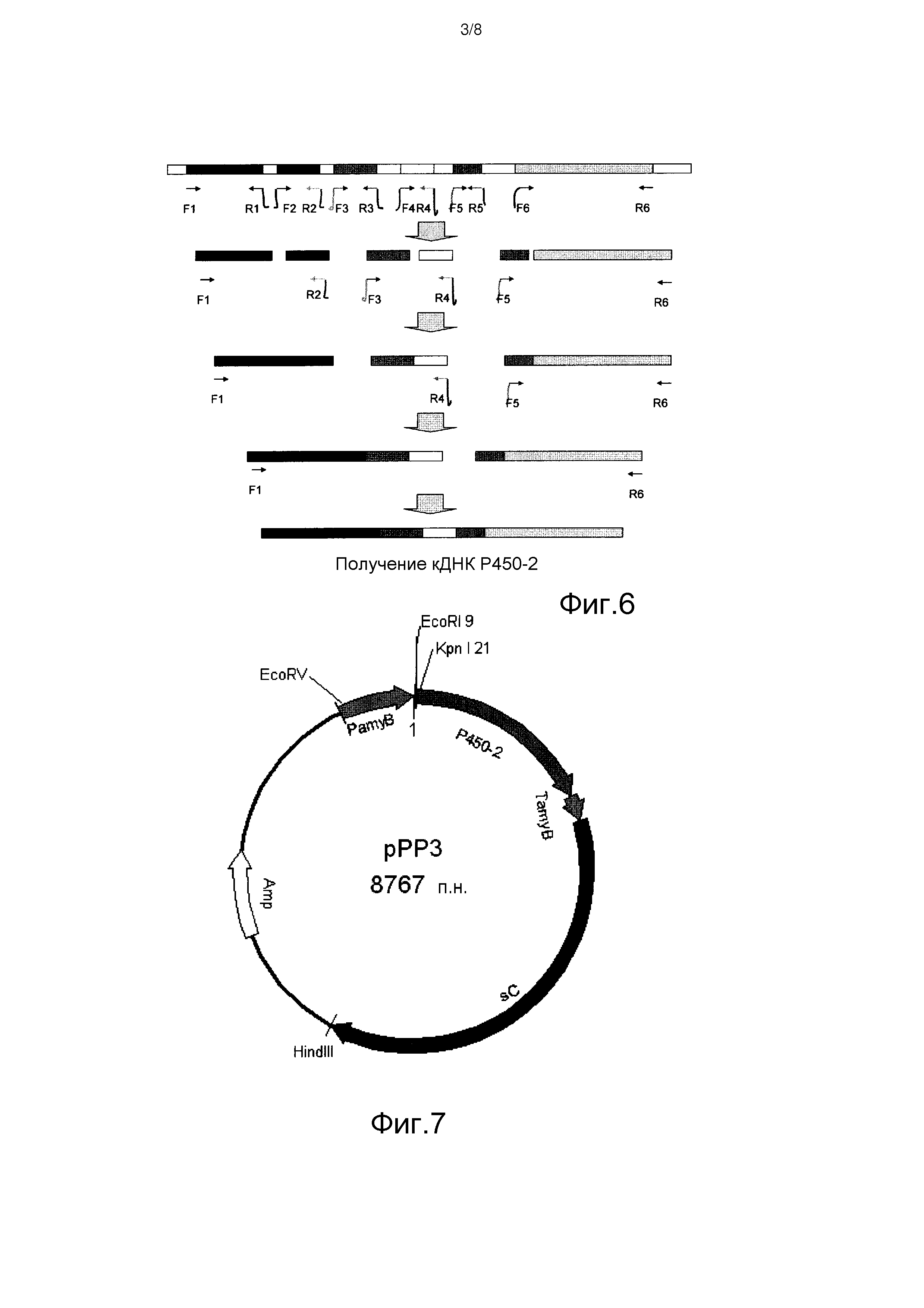
[Фигура 6] На фиг.6 представлена схема амплификации кДНК P450-2.
[Фигура 7] На фиг.7 представлена карта плазмиды pPP3.
[Фигура 8] На фиг.8 представлен спектр 1H-ЯМР пирипиропена E в дейтерированном ацетонитриле.
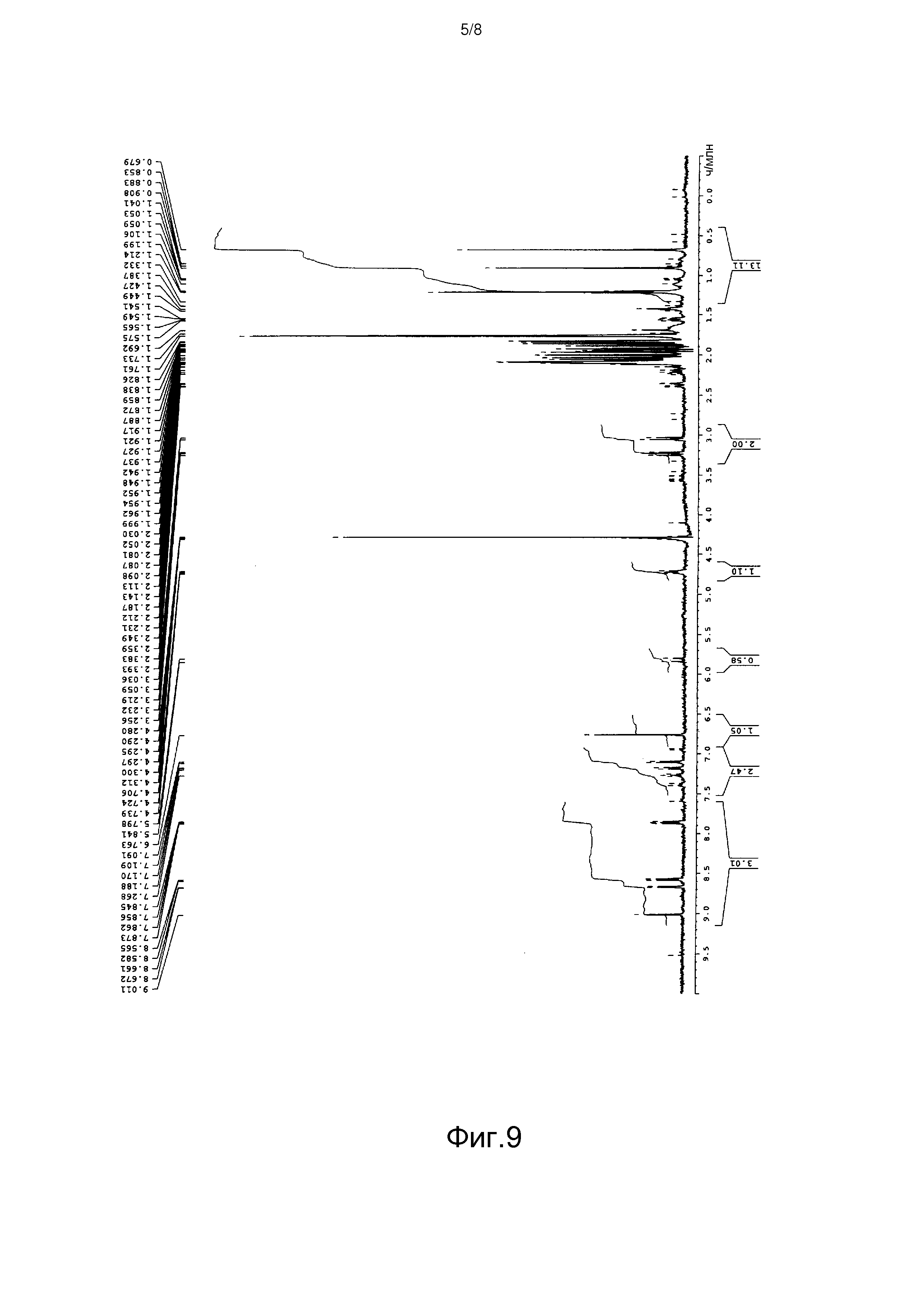
[Фигура 9] На фиг.9 представлен спектр 1H-ЯМР продукта культивирования Aspergillus oryzae, трансформированного плазмидой pPP2, в дейтерированном ацетонитриле.
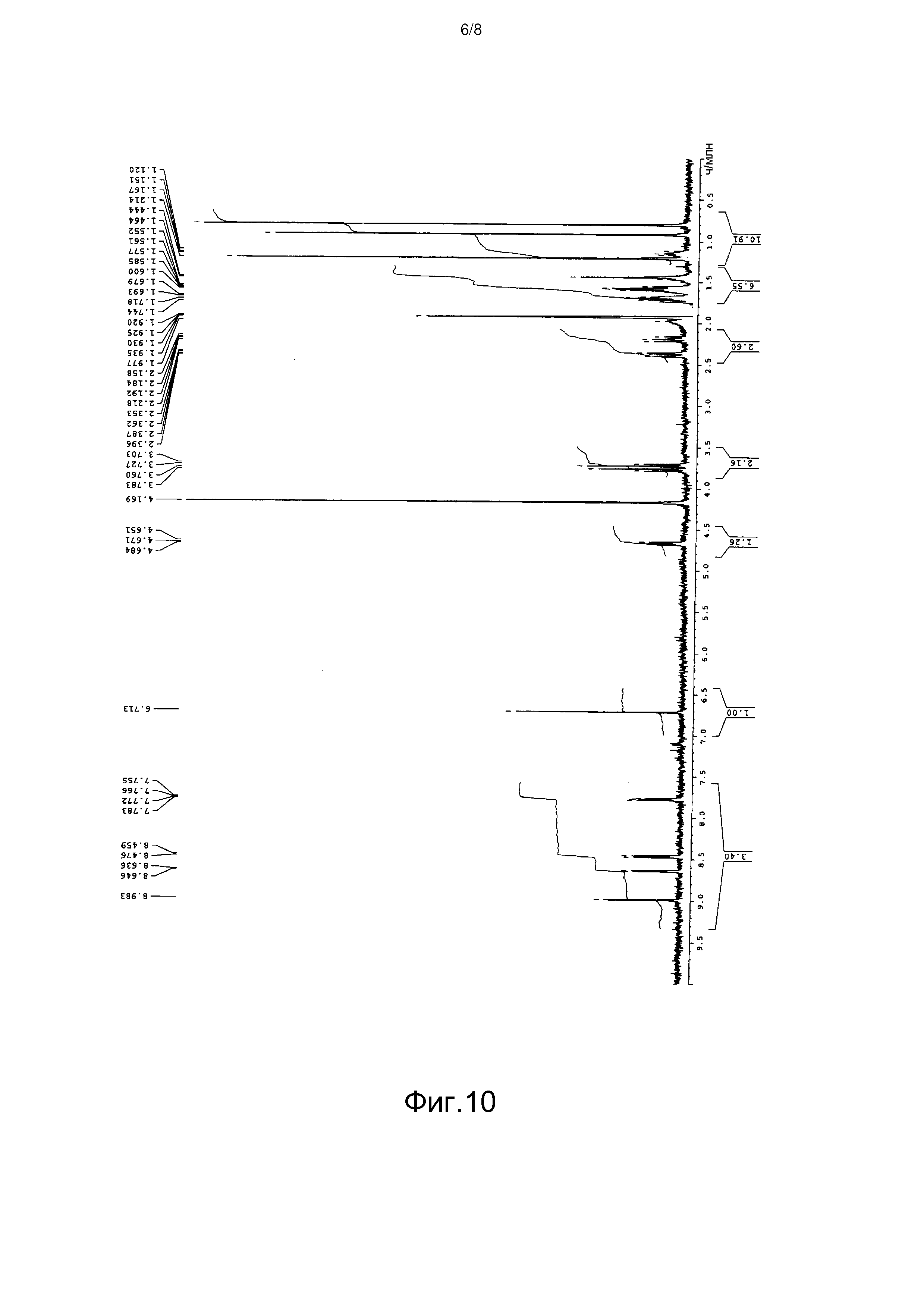
[Фигура 10] На фиг.10 представлен спектр 1H-ЯМР пирипиропена O в дейтерированном ацетонитриле.
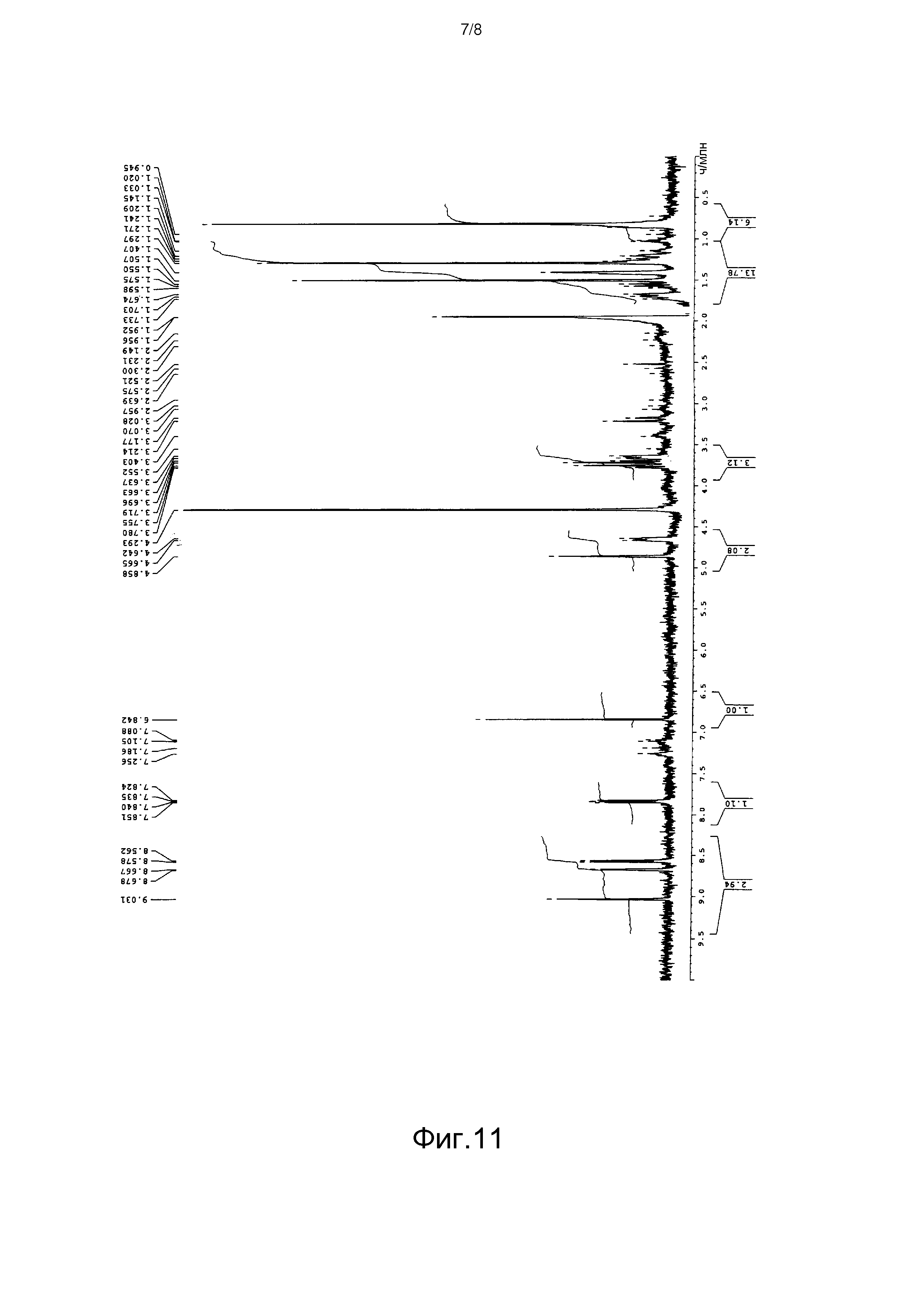
[Фигура 11] На фиг.11 представлен спектр 1H-ЯМР продукта культивирования Aspergillus oryzae, трансформированного плазмидой pPP3, в дейтерированном ацетонитриле.
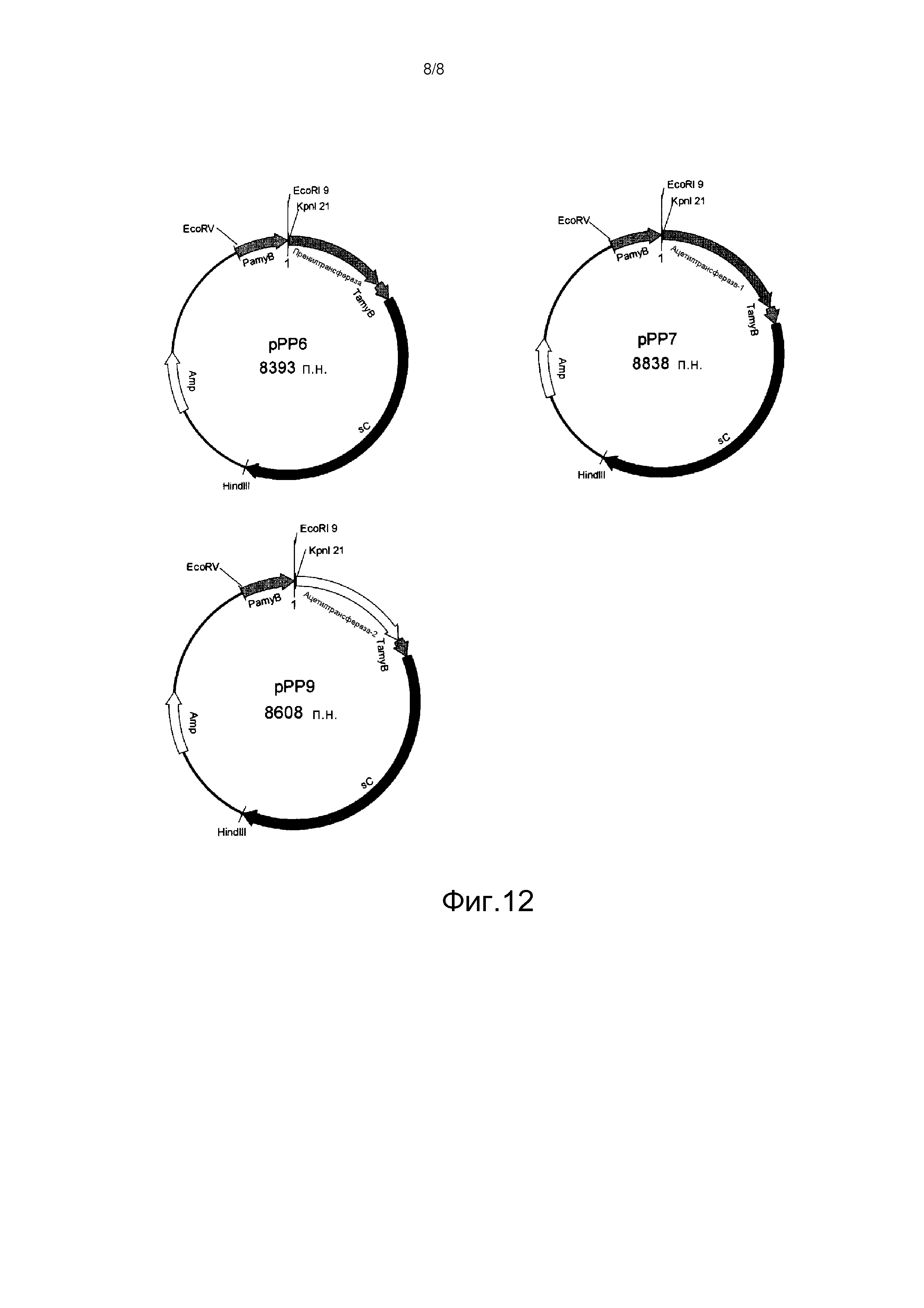
[Фигура 12] На фиг.12 представлена карта плазмид pPP6, pPP7 и pPP9.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] Депонирование микроорганизмов
Escherichia coli (Escherichia coli EPI300TM-T1R), трансформированную плазмидой pCC1-PP1, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566) под № доступа FERM BP-11133 (преобразовано из внутреннего депонента под № доступа FERM P-21704) (ссылка для идентификации от депозиторов: Escherichia coli EPI300™-T1R/pCC1-PP1) 9 октября 2008 года (исходная дата депонирования).
[0021] Aspergillus oryzae, трансформированный плазмидой pPP2, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11137 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP2-1) 23 июня 2009 года.
[0022] Aspergillus oryzae, трансформированный плазмидой pPP3, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11141 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP3-2) 3 июля 2009 года.
[0023] Aspergillus oryzae, трансформированный плазмидой pPP6, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11218 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP6) 21 декабря 2009 года.
[0024] Aspergillus oryzae, трансформированный плазмидой pPP7, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11219 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP7) 21 декабря 2009 года.
[0025] Aspergillus oryzae, трансформированный плазмидой pPP9, депонировали в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под № доступа FERM BP-11220 (ссылка для идентификации от депозиторов: Aspergillus oryzae PP9) 21 декабря 2009 года.
[0026] Способ получения пирипиропена
Настоящее изобретение относится к способу получения пирипиропена, где получают вторичный продукт метаболизма, культивируя микроорганизм, в который введены ген, вовлеченный в биосинтез пирипиропена A, с промежуточным соединением, необходимым для биосинтеза пирипиропена A.
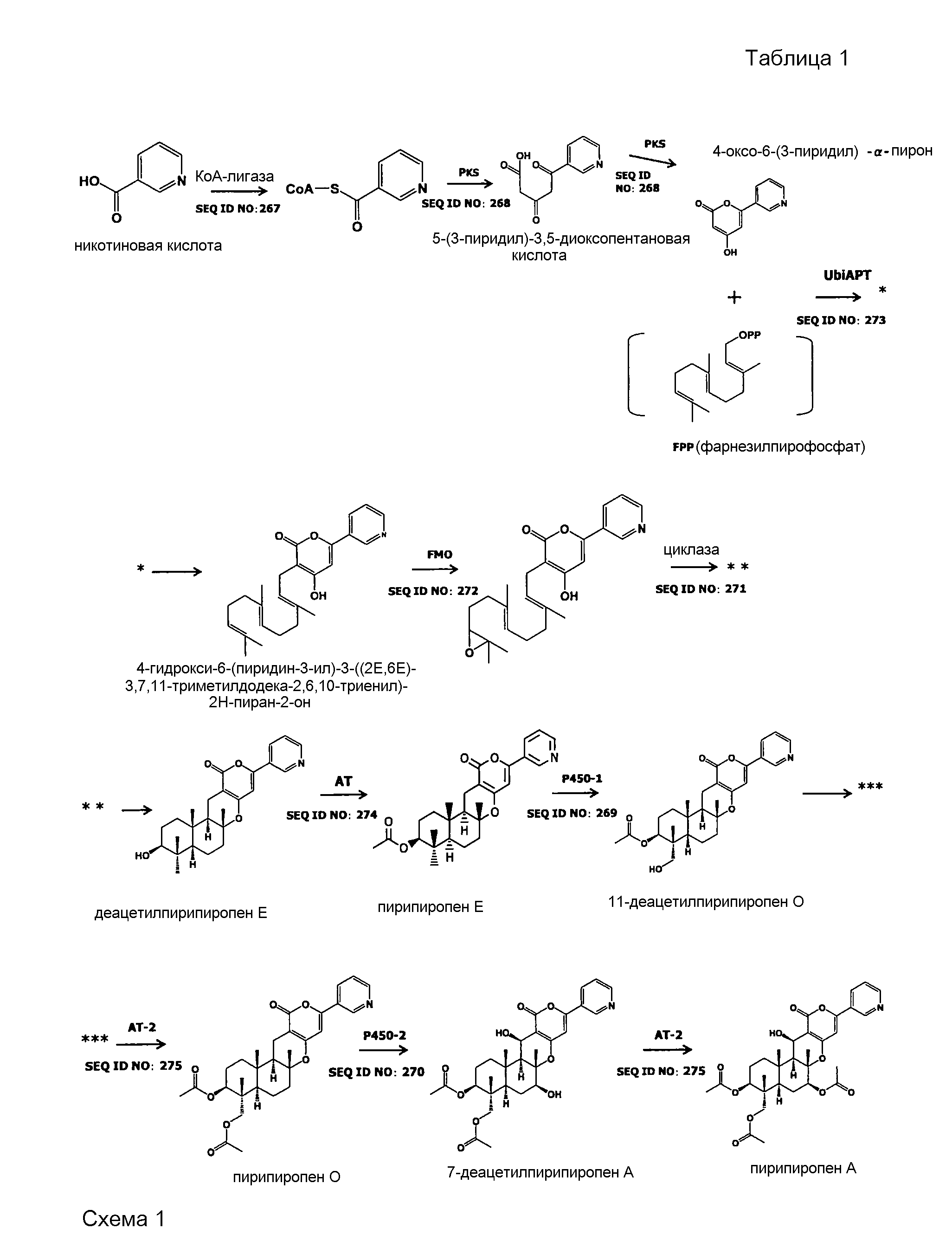
[0027] Пример пути биосинтеза пирипиропена A включает приведенную ниже схему 1.
|
[0028] Ниже будет подробно описан каждый путь биосинтеза указанной выше схемы 1.
1. Проводят реакцию никотиновой кислоты с КоА-лигазой и далее проводят реакцию полученного продукта с LovB-подобной поликетидсинтазой (PKS), таким образом, получая 5-(3-пиридил)-3,5-диоксопентановую кислоту.
2. Проводят реакцию 5-(3-пиридил)-3,5-диоксопентановой кислоты с LovB-подобной поликетидсинтазой (PKS), таким образом, получая 4-оксо-6-(3-пиридил)-α-пирон.
3. Проводят реакцию 4-оксо-6-(3-пиридил)-α-пирона и фарнезилпирофосфата (FPP) с UbiA-подобной пренилтрансферазой (UbiAPT), таким образом, получая 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-он.
4. Проводят реакцию 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она с FAD-зависимой монооксигеназой (FMO), а затем проводят реакцию полученного продукта с циклазой (IMP: интегральный мембранный белок), таким образом, получая деацетилпирипиропен E.
5. Проводят реакцию деацетилпирипиропена E с ацетилтрансферазой (AT), таким образом, получая пирипиропен E.
6. Проводят реакцию пирипиропена E с цитохром P450-зависимой монооксигеназой (1) (P450-1), таким образом, получая 11-деацетилпирипиропен O.
7. Проводят реакцию 11-деацетилпирипиропена O с ацетилтрансферазой-2 (AT-2), таким образом, получая пирипиропен O.
8. Проводят реакцию пирипиропена O с цитохром P450-зависимой монооксигеназой (2) (P450-2), таким образом, получая 7-деацетилпирипиропен A.
9. Проводят реакцию 7-деацетилпирипиропена A с ацетилтрансферазой-2 (AT-2), таким образом, получая пирипиропен A.
[0029] Деацетилпирипиропен E можно синтезировать, например, способом из ссылочного примера 3 ниже.
[0030] Пирипиропен E можно получать, например, способом, описанным в выложенной публикации патента Японии № 239385/1996.
[0031] 11-Деацетилпирипиропен O можно синтезировать, например, способом, описанным в ссылочном примере 4 ниже.
[0032] Пирипиропен O можно получать, например, способом, описанным в J. Antibiot. 1996, 49, 292.
[0033] 7-Деацетилпирипиропен A можно синтезировать, например, способом, описанным в выложенной публикации патента Японии № 259569/1996.
[0034] 4-Оксо-6-(3-пиридил)-α-пирон можно синтезировать, например, способом, описанным в J. Org. Chem. 1983. 48. 3945.
[0035] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0036] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (IV) и (V) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена A через пирипиропен O:
(IV) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269, 270 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(V) Полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(c) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(c) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0037] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2, pPP3 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0038] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2, pPP3 и pPP9, с пирипиропеном E и выделением пирипиропена A через пирипиропен O.
[0039] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0040] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0041] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (VI) и (VII) ниже или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропена O:
(VI) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из полинуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269, 270, 274 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(VII) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(d) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(d) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0042] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2, pPP3, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0043] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2, pPP3, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена A через пирипиропен E и пирипиропен O.
[0044] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она. В этом случае предпочтительно, чтобы в качестве указанного выше микроорганизма использовался микроорганизм, способный к биосинтезу фарнезилпирофосфата (FPP) в клетке организма. Пример таких микроорганизмов включает микроорганизмы, принадлежащие роду Aspergillus.
[0045] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0046] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (VIII) и (IX) ниже или содержащий его/их рекомбинантный вектор, с 4-оксо-6-(3-пиридил)-α-пироном и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она:
(VIII) Выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 273 или по существу эквивалентную ей аминокислотную последовательность;
(IX) Полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже: и
(1) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0047] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 4-оксо-6-(3-пиридил)-α-пироном, предоставлен способ получения 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP6, с 4-оксо-6-(3-пиридил)-α-пироном, и выделением 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она.
[0048] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена E.
[0049] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, c деацетилпирипиропеном E и выделением пирипиропена E.
[0050] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (X) и (XI) ниже или содержащий его/их рекомбинантный вектор, c деацетилпирипиропеном E и выделением пирипиропена E:
(X) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 274 или по существу эквивалентную ей аминокислотную последовательность; и
(XI) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0051] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с деацетилпирипиропеном E, предоставлен способ получения пирипиропена E, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP7, c деацетилпирипиропеном E и выделением пирипиропена E.
[0052] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена O.
[0053] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0054] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XII) и (XIII) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением пирипиропена O:
(XII) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 269 и 275, или по существу эквивалентную ей аминокислотную последовательность; и
(XIII) полинуклеотид, по меньшей мере, с одной нуклеотидной последовательностью, выбранной из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность из (a)-(b) ниже:
(a) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(b) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0055] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP2 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0056] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего плазмиды pPP2 и pPP9, с пирипиропеном E и выделением пирипиропена O.
[0057] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением 11-деацетилпирипиропена O.
[0058] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном E и выделением 11-деацетилпирипиропена O.
[0059] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XIV) и (XV) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном E и выделением 11-деацетилпирипиропена O:
(XIV) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 269 или по существу эквивалентную ей аминокислотную последовательность; и
(XV) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0060] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном E, предоставлен способ получения 11-деацетилпирипиропена O, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP2, с пирипиропеном E и выделением 11-деацетилпирипиропена O.
[0061] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 11-деацетилпирипиропеном O, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 11-деацетилпирипиропеном O и выделением пирипиропена O.
[0062] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 11-деацетилпирипиропеном O, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с 11-деацетилпирипиропеном O и выделением пирипиропена O.
[0063] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 11-деацетилпирипиропеном O, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XIV) и (XV) ниже или содержащий его/их рекомбинантный вектор, с 11-деацетилпирипиропеном O и выделением пирипиропена O:
(XIV) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 275 или по существу эквивалентную ей аминокислотную последовательность; и
(XV) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0064] Согласно более предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 11-деацетилпирипиропеном O, предоставлен способ получения пирипиропена O, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP9, с 11-деацетилпирипиропеном O и выделением пирипиропена O.
[0065] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном O, предоставлен способ получения 7-деацетилпирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с пирипиропеном O и выделением 7-деацетилпирипиропена A.
[0066] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном O, предоставлен способ получения 7-деацетилпирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, с пирипиропеном O и выделением 7-деацетилпирипиропена A.
[0067] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном O, предоставлен способ получения 7-деацетилпирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XIV) и (XV) ниже или содержащий его/их рекомбинантный вектор, с пирипиропеном O и выделением 7-деацетилпирипиропена A:
(XIV) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 270 или по существу эквивалентную ей аминокислотную последовательность; и
(XV) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0068] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с пирипиропеном O, предоставлен способ получения 7-деацетилпирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP3, с пирипиропеном O и выделением 7-деацетилпирипиропена A.
[0069] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 7-деацетилпирипиропеном A, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из указанных выше (I)-(III) или содержащий его/их рекомбинантный вектор, с 7-деацетилпирипиропеном A и выделением пирипиропена A.
[0070] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 7-деацетилпирипиропеном A, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pCC1-PP1, pPP2, pPP3, pPP6, pPP7 и pPP9, c 7-деацетилпирипиропеном A и выделением пирипиропена A.
[0071] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 7-деацетилпирипиропеном A, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, в который введен, по меньшей мере, один полинуклеотид из (XVI) и (XVII) ниже или содержащий его/их рекомбинантный вектор, с 7-деацетилпирипиропеном A и выделением пирипиропена A:
(XVI) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей, кодирующих аминокислотную последовательность SEQ ID NO: 275 или по существу эквивалентную ей аминокислотную последовательность; и
(XVII) полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей из (1)-(4) ниже:
(1) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), в жестких условиях и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1) и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью.
[0072] Согласно предпочтительному варианту осуществления способа получения по настоящему изобретению, где способ включает культивирование с 7-деацетилпирипиропеном A, предоставлен способ получения пирипиропена A, характеризуемый культивированием микроорганизма, содержащего плазмиду pPP9, с 7-деацетилпирипиропеном A и выделением пирипиропена A.
[0073] Полинуклеотид можно вводить в микроорганизм, используемый в настоящем изобретении, используя рекомбинантный вектор, описанный ниже. Однако полинуклеотид можно вводить в микроорганизм, например, способом электропорации, способом с полиэтиленгликолем, способом с Agrobacterium, способом с литием, способом с хлоридом кальция или т.п.
[0074] Микроорганизм, используемый в настоящем изобретении, конкретно не ограничен при условии, что в него можно вводить полинуклеотид или содержащий его/их рекомбинантный вектор. Предпочтительными являются микроорганизмы, принадлежащие роду Aspergillus, а особенно предпочтительным является Aspergillus oryzae.
[0075] По настоящему изобретению культивирование микроорганизмов можно проводить, например, посредством культивирования на твердой среде в аэробных условиях, культивирования со встряхиванием, культивирования с барботированием при перемешивании или глубокого частично аэробного культивирования, в частности, предпочтительным является культивирование со встряхиванием. В качестве среды для культивирования микроорганизмов можно использовать широко используемые компоненты, например, в качестве источников углерода можно использовать глюкозу, сахарозу, крахмальный сироп, декстрин, крахмал, глицерин, молассу, животные и растительные масла или т.п. Также, в качестве источников азота можно использовать соевую муку, зародыши пшеницы, жидкий кукурузный экстракт, муку семян хлопчатника, мясной экстракт, полипептон, мальтоэкстракт, дрожжевой экстракт, сульфат аммония, нитрат натрия, мочевину или т.п. Кроме того, при необходимости эффективным является добавление натрия, калия, кальция, магния, кобальта, хлора, фосфорной кислоты (гидрофосфата дикалия или т.п.), серной кислоты (сульфата магния или т.п.) или неорганических солей, которые могут образовывать другие ионы. Также при необходимости можно добавлять различные витамины, такие как тиамин (тиамингидрохлорид или т.п.), аминокислоты, такие как глутаминовая кислота (глутамат натрия или т.п.) или аспарагин (DL-аспарагин или т.п.), микроэлементы, такие как нуклеотиды или средства для отбора, такие как антибиотики. Кроме того, можно соответствующим образом добавлять органические вещества или неорганические вещества, которые помогают росту гриба и обеспечивают получение пирипиропена A.
[0076] pH среды составляет, например, приблизительно от pH 5,5 до pH 8. Подходящая температура культивирования составляет от 15°C до 40°C и во многих случаях, рост происходит при температурах приблизительно от 22°C до 30°C. Получение 4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она, деацетилпирипиропена E, пирипиропена E, пирипиропена O и пирипиропена A варьирует в зависимости от среды и условий культивирования или от используемого хозяина. В любом способе культивирования накопление достигает пика, как правило, в течение срока от 2 суток до 10 суток. Культивирование завершают в тот момент, когда количество пирипиропена A в культуре достигает пика, и желаемое вещество выделяют из среды и очищают.
[0077] Для выделения 5-(3-пиридил)-3,5-диоксопентановой кислоты, 4-оксо-6-(3-пиридил)-α-пирона, деацетилпирипиропена E, пирипиропена E, пирипиропена O, 7-деацетилпирипиропена A, пирипиропена A или т.п. из культуры, их можно выделять и очищать обычными способами выделения с использованием их свойств, например, способом экстракции растворителем, способом с ионообменной смолой, способом хроматографии с адсорбционной или распределительной колонками, способом гель-фильтрации, диализом, способом осаждения, которые можно использовать отдельно или соответствующим образом использовать в комбинации. Особенно предпочтительным является способ экстракции растворителем.
[0078] Термин "по существу эквивалентная аминокислотная последовательность" в настоящем изобретении означает аминокислотную последовательность, не влияющую на активность полипептида, несмотря на факт изменения посредством замены, делеции, добавления или вставки одной или нескольких аминокислот. Предпочтительно, аминокислотная последовательность, измененная посредством аминокислотных замены, делеции, добавления или вставки на 70% или более, предпочтительно на 80% или более, более предпочтительно на 90% или более, еще более предпочтительно на 95% или более, а еще более предпочтительно на 98% или более идентична аминокислотной последовательности до изменения и т.п. Кроме того, количество измененных аминокислотных остатков предпочтительно составляет от 1 до 40, более предпочтительно от 1 до 20, еще более предпочтительно от 1 до 10, еще более предпочтительно от 1 до 8, а наиболее предпочтительно от 1 до 4.
[0079] Кроме того, пример изменения, не влияющего на активность, включает консервативную замену. Термин "консервативная замена" означает замену предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 1 до 10, еще более предпочтительно от 1 до 8, а наиболее предпочтительно от 1 до 4 аминокислотных остатков другими химически сходными аминокислотными остатками так, что активность полипептида по существу не изменяется. Их примеры включают случаи, когда определенный гидрофобный аминокислотный остаток заменяют другим гидрофобным аминокислотным остатком, и случаи, когда определенный полярный аминокислотный остаток заменяют другим полярным аминокислотным остатком того же заряда. Функционально сходные аминокислоты, пригодные к такой замене, в данной области известны для каждой аминокислоты. Конкретно, примеры неполярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин, метионин и т.п. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин, цистеин и т.п. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин, лизин и т.п. Примеры отрицательно заряженных (кислотных) аминокислот включают аспарагиновую кислоту, глутаминовую кислоту и т.п.
[0080] Термин "жесткие условия" в настоящем изобретении означает условия, когда операцию отмывки мембран после гибридизации проводят при высоких температурах в растворе с низкими концентрациями солей, специалист в данной области может должным образом определить условия, например, условия включают условия отмывки раствора 2×SSC (1×SSC: 15 мМ цитрат тринатрия, 150 мМ хлорид натрия) и 0,5% SDS при 60°C в течение 20 минут и условия отмывки в растворе 0,2×SSC (1×SSC: 15 мМ цитрат тринатрия, 150 мМ хлорид натрия) и 0,1% SDS при 60°C в течение 15 минут.
[0081] Гибридизацию можно проводить известным способом. Также, когда используют коммерчески доступную библиотеку, ее можно проводить способом, описанным в приложенных инструкциях.
[0082] Термин "идентичность" (также обозначаемый как гомология) нуклеотидных последовательностей в настоящем описании означает степень соответствия оснований, составляющих каждую последовательность, у сравниваемых последовательностей. В этот момент учитывают наличие пропуска(ов) и характеристики аминокислот. Любые значения "идентичности", предоставленные в настоящем описании, могут представлять собой значения, рассчитанные с использованием программ поиска гомологии, известных специалистам в данной области. Например, значение можно легко рассчитать используя параметры по умолчанию (исходные установки) в FASTA, BLAST или т.п.
[0083] В настоящем описании "идентичность" нуклеотидных последовательностей составляет 90% или более, предпочтительно 95% или более, более предпочтительно 98% или более, еще более предпочтительно 99% или более.
[0084] В настоящем описании, термин "один или более нуклеотидов в полинуклеотиде удалены, замещены, вставлены или добавлены" означает, что изменение проведено известным способом, таким как способ сайт-специфического мутагенеза или замены или т.п. множества нуклеотидов в той степени, в которой они могут возникать в природе. Количество измененных нуклеотидов составляет один или более нуклеотидов (например, от одного до нескольких нуклеотидов или 1, 2, 3 или 4 нуклеотида).
[0085] Термин "нуклеотидная последовательность, кодирующая белок, по существу эквивалентный белку, кодируемому (каждой) нуклеотидной последовательностью" означает нуклеотидную последовательность, кодирующую белок, с активностью, эквивалентной активности "белка, кодируемого (каждой) нуклеотидной последовательностью".
[0086] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 3342 до положения 5158 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью КоА-лигазы.
[0087] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 5382 до положения 12777 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью LovB-подобной поликетидсинтазы (PKS).
[0088] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью цитохром P450-зависимой монооксигеназы (1) (P450-1).
[0089] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью цитохром P450-зависимой монооксигеназы (2) (P450-2).
[0090] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 18506 до положения 19296 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью циклазы (IMP: интегральный мембранный белок).
[0091] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 19779 до положения 21389 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью FAD-зависимой монооксигеназы (FMO).
[0092] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью UbiA-подобной пренилтрансферазы (UbiAPT).
[0093] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью ацетилтрансферазы (AT).
[0094] Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266, обладал активностью ацетилтрансферазы-2 (AT-2).
[0095] Получение выделенного полинуклеотида
Способ получения выделенного полинуклеотида по настоящему изобретению конкретно не ограничен. Полинуклеотид можно выделять из штамма Penicillium coprobium PF1169 или нитевидного гриба указанным ниже способом. Конкретно, на основе гомологии последовательности, определенной способом из примера 9 ниже или т.п., синтезируют праймеры, обеспечивающие специфическую амплификацию одного или нескольких генов из гена поликетидсинтазы, гена пренилтрансферазы, гена гидроксилазы, гена ацетилтрансферазы или гена аденилатсинтетазы, вовлеченных в синтез пирипиропена A. Проводят ПЦР для фосмидной геномной библиотеки штамма Penicillium coprobium PF1169, которую получают раздельно, а затем проводят гибридизацию колоний, таким образом, получая выделенный полинуклеотид, используемый в настоящем изобретении.
[0096] Согласно предпочтительному варианту осуществления настоящего изобретения предоставлен, по меньшей мере, один выделенный полинуклеотид из указанных выше (I)-(III). В частности, предоставлен, по меньшей мере, один полинуклеотид из следующих (I)-(III):
(I) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей следующих (a)-(d):
(a) нуклеотидная последовательность SEQ ID NO: 266,
(b) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266,
(c) нуклеотидная последовательность SEQ ID NO: 266, в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266, и
(d) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью SEQ ID NO: 266, и кодирующая белок, по существу эквивалентный белку, кодируемому нуклеотидной последовательностью SEQ ID NO: 266;
(II) выделенный полинуклеотид, имеющий нуклеотидную последовательность, кодирующую, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 267-275, или аминокислотную последовательность, по существу эквивалентную ей; и
(III) выделенный полинуклеотид, имеющий, по меньшей мере, одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей следующих (1)-(4):
(1) нуклеотидная последовательность из (a)-(i) ниже:
(a) нуклеотидная последовательность от положения 3342 до положения 5158 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность от положения 5382 до положения 12777 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(d) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(e) нуклеотидная последовательность от положения 18506 до положения 19296 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(f) нуклеотидная последовательность от положения 19779 до положения 21389 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(g) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(h) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(i) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная в жестких условиях гибридизоваться с последовательностью, комплементарной нуклеотидной последовательности из (1), и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида с нуклеотидной последовательностью из (1), в которой один или более нуклеотидов удалены, замещены, вставлены или добавлены, и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, по меньшей мере, на 90% идентичная полинуклеотиду с нуклеотидной последовательностью из (1), и кодирующая белок, по существу эквивалентный белку, кодируемому каждой нуклеотидной последовательностью.
[0097] Согласно более предпочтительному варианту осуществления настоящего изобретения предоставлен выделенный полинуклеотид, выбранный из следующих (a), (b), (c), (d), (e), (f), (g) и (h):
(a) полинуклеотид, имеющий нуклеотидную последовательность SEQ ID NO: 266,
(b) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, выбранной из SEQ ID NO: 269, 270, 273, 274 и 275,
(c) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 269, и кодирующий полипептид, обладающий гидроксилазной активностью,
(d) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 270, и кодирующий полипептид, обладающий гидроксилазной активностью,
(e) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 273, и кодирующий полипептид, обладающий пренилтрансферазной активностью,
(f) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 274, и кодирующий полипептид, обладающий ацетилазной активностью,
(g) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 275, и кодирующий полипептид, обладающий ацетилазной активностью, и
(h) выделенный полинуклеотид c нуклеотидной последовательностью, выбранной из следующих (i), (ii), (iii), (iv) и (v):
(i) нуклеотидная последовательность от положения 13266 до положения 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(ii) нуклеотидная последовательность от положения 16220 до положения 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(iii) нуклеотидная последовательность от положения 21793 до положения 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(iv) нуклеотидная последовательность от положения 23205 до положения 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(v) нуклеотидная последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266.
[0098] Согласно более предпочтительному варианту осуществления настоящего изобретения предоставлен выделенный полинуклеотид, выбранный из следующих (A), (B) и (C):
(A) полинуклеотид, кодирующий полипептид, состоящий из аминокислотной последовательности, выбранной из SEQ ID NO: 275,
(B) полинуклеотид, имеющий аминокислотную последовательность, по существу эквивалентную аминокислотной последовательности, представленной в SEQ ID NO: 275, и кодирующий полипептид с ацетилазной активностью, и
(C) выделенный полинуклеотид, имеющий нуклеотидную последовательность от положения 25824 до положения 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266.
[0099] Согласно еще более предпочтительному варианту осуществления настоящего изобретения предоставлен полинуклеотид из указанных (c), (d), (e), (f) и (g), где аминокислотные последовательности полипептидов, кодируемых полинуклеотидом из указанных (c), (d), (e), (f) и (g), на 90% или более идентичны аминокислотным последовательностям, представленным в SEQ ID NO: 269, 270, 273, 274 и 275, соответственно.
[0100] Согласно еще более предпочтительному варианту осуществления изобретения предоставлен полинуклеотид из указанного (B), где аминокислотная последовательность полипептида, кодируемого полинуклеотидом из указанного (B), на 90% или более идентична аминокислотной последовательности, представленной в SEQ ID NO: 275.
[0101] Рекомбинантный вектор
Рекомбинантный вектор по настоящему изобретению можно получать, модифицируя любые один или более из полинуклеотидов из указанных выше (I)-(III) в подходящую форму в зависимости от объекта и лигируя их в вектор в соответствии с общепринятым способом, например, способами генетической рекомбинации, описанными в [Sambrook, J. et al., "Molecular Cloning: A Laboratory Manual", (USA), 2nd Edition, Cold Spring Harbor Laboratory, 1989].
[0102] Рекомбинантный вектор, используемый в настоящем изобретении, можно соответствующим образом выбирать из вирусных, плазмидных, фосмидных, космидных векторов или т.п. Например, когда клетка-хозяин представляет собой Escherichia coli, их примеры включают бактериофаг на основе фага λ и плазмиды на основе pBR и pUC. В случае Bacillus subtilis примеры включают плазмиды на основе pUB. В случае дрожжей примеры включают плазмиды на основе YEp, YRp, YCp и YIp.
[0103] Предпочтительно, чтобы, по меньшей мере, одна плазмида из используемых плазмид содержала селективный маркер для отбора трансформантов. В качестве селективного маркера можно использовать ген, кодирующий устойчивость к лекарственному средству, и ген, дополняющий ауксотрофию. Их конкретные предпочтительные примеры, когда используемый хозяин представляет собой бактерию, включают гены устойчивости к ампициллину, гены устойчивости к канамицину, гены устойчивости к тетрациклину и т.п.; в случае дрожжей они включают, ген биосинтеза триптофана (TRP1), ген биосинтеза урацила (URA3), ген биосинтеза лейцина (LEU2) и т.п.; в случае гриба они включают, гены устойчивости к гигромицину, гены устойчивости к биалафосу, гены устойчивости к блеомицину, гены устойчивости к ауреобазидину и т.п.; и в случае растений они включают гены устойчивости к канамицину, гены устойчивости к биалафосу и т.п.
[0104] Кроме того, молекулы ДНК, служащие в качестве экспрессирующего вектора, используемые в настоящем изобретении, предпочтительно содержат последовательности ДНК, необходимые для экспрессии каждого гена, например, сигнальной последовательности регуляции транскрипции и сигнальной последовательности регуляции трансляции, такие как промоторы, сигнальной последовательности инициации транскрипции, участки связывания рибосомы, последовательности прерывания трансляции, терминаторы. Предпочтительные примеры промоторов включают промоторы лактозного оперона, триптофанового оперона и т.п. для Escherichia coli; промоторы гена алкогольдегидрогеназы, гена кислой фосфатазы, гена метаболизма галактозы, гена глицеральдегид-3-фосфатдегидрогеназы или т.п. для дрожжей; промоторы гена α-амилазы, гена глюкоамилазы, гена целлобиогидролазы, гена глицеральдегид-3-фосфатдегидрогеназы, гена abp1 или т.п. для грибов; промотор 35S РНК CaMV, промотор 19S РНК CaMV или промотор гена нопалинсинтетазы для растений.
[0105] Рекомбинантный вектор по настоящему изобретению предпочтительно представляет собой рекомбинантный вектор, выбранный из группы, состоящей из плазмид pPP6, pPP7 и pPP9.
[0106] Также согласно предпочтительному варианту осуществления настоящего изобретения в качестве примера приведено применение рекомбинантного вектора, выбранного из группы, состоящей из плазмид pPP6, pPP7 и pPP9, для получения пирипиропена A.
[0107] Трансформант
Хозяина, которому вводят выделенный полинуклеотид по настоящему изобретению, в зависимости от типа используемого вектора можно соответствующим образом выбирать из актиномицет, Escherichia coli, Bacillus subtilis, дрожжей, нитевидных грибов, растительных клеток или т.п.
[0108] Способ введения рекомбинантного вектора хозяину можно выбирать, в зависимости от тестируемой клетки-хозяина из конъюгационного переноса, трансдукции фагом, а также из способов трансформации, таких как способ с ионами кальция, способ с ионами лития, способ электропорации, способ с PEG, способ с Agrobacterium или способ биобаллистической пушки.
[0109] В случаях, когда в настоящем изобретении в клетки-хозяева вводят несколько генов, гены могут находиться в одной молекуле ДНК или отдельно в различных молекулах ДНК. Кроме того, когда клетка-хозяин представляет собой бактерию, каждый ген можно конструировать так, чтобы он экспрессировался в виде полицистронной мРНК и получать в одной молекуле ДНК.
[0110] Трансформант по настоящему изобретению предпочтительно представляет собой трансформант, содержащий один или более векторов, выбранных из группы, состоящей из плазмид pPP6, pPP7 и pPP9.
[0111] Согласно предпочтительному варианту осуществления настоящего изобретения в качестве примера приведено применение трансформанта, содержащего один или более векторов, выбранных из группы, состоящей из плазмид pPP6, pPP7 и pPP9, для получения пирипиропена A.
ПРИМЕРЫ
[0112] Настоящее изобретение далее будет подробно проиллюстрировано приведенными ниже примерами, которые не предназначены для ограничения настоящего изобретения.
[0113] Пример 1: Получение геномной ДНК штамма Penicillium coprobium PF1169
В колбу Эрленмейера (1 л) помещали стерилизованную среду NB (500 мл). В указанную выше среду добавляли штамм Penicillium coprobium PF1169 (Journal of Technical Disclosure No. 500997/2008 (патентный документ 3)), предварительно культивируемый в 1/2 среды с агаром CMMY при 28°C в течение 4 суток и культивировали в жидкой среде при 28°C в течение 4 суток. Проводили фильтрование с применением Miracloth с получением 5 г клеток гриба. Из этих клеток гриба, получали 30 мкг геномной ДНК в соответствии с руководством, прилагаемым к набору для очистки геномной ДНК Genomic-tip 100/G (производимому Qiagen K.K.).
[0114] Пример 2: Вырожденные праймеры для амплификации поликетидсинтазы (PKS) и ее амплифицированный фрагмент
На основе аминокислотной последовательности, консервативной у поликетидсинтаз различных нитевидных грибов, конструировали и синтезировали приведенные ниже праймеры в качестве вырожденных праймеров для амплификации:
LC1: GAYCCIMGITTYTTYAAYATG (SEQ ID NO: 1)
LC2c: GTICCIGTICCRTGCATYTC (SEQ ID NO: 2)
(где R=A/G, Y=C/T, M=A/C, I=инозин).
С использованием этих вырожденных праймеров, проводили реакцию геномной ДНК, полученной в примере 1, и полимеразы ExTaq (производимой Takara Bio Inc.) в соответствии с приложенным руководством. Детектировали амплифицированный фрагмент длиной приблизительно 700 п.н. (фиг.1). Кроме того, затем указанный выше амплифицированный фрагмент анализировали для установления последовательности его внутренних 500 п.н. (SEQ ID NO: 3).
[0115] Пример 3: Крупномасштабное секвенирование геномной ДНК и поиск гомологии аминокислотных последовательностей
Геномную ДНК штамма Penicillium coprobium PF1169, полученную в примере 1, подвергали крупномасштабному секвенированию и поиску гомологии аминокислотных последовательностей. Конкретно, часть 50 мкг геномной ДНК предварительно обрабатывали, а затем подвергали анализу на секвенаторе ДНК Roche 454FLX с получением 103 тысячи последовательностей фрагментов приблизительно 250 п.н. каждая (всего, 49 МБ последовательностей).
[0116] Для этих последовательностей, в качестве известных последовательностей поликетидсинтаз и пренилтрансфераз выбирали приведенные ниже пять последовательностей (последовательности, полученные из поликетидсинтаз: PKS Aspergillus(A.) fumigatus длиной 2146 а.к. и синтетаза 6-метилсалициловой кислоты Penicillium(P.) griseofluvum длиной 1744 а.к.; а также пренилтрансферазы: пренилтрансфераза Aspergillus (A.) fumigatus, пренилтрансфераза (4-гидроксибензоатоктапренилтрансфераза) Aspergillus(A.) fumigatus и пренилтрансфераза Penicillium(P.) marneffei) и проводили поиск с применением программного обеспечения по поиску гомологии последовательностей blastx, таким образом, получая 89, 86, 2, 1 и 3 гомологичных последовательностей, соответственно (см. таблицу 2). Кроме того, на основе гомологии, последовательностей PKS A. fumigatus длиной 2146 а.к. и синтетазы 6-метилсалициловой кислоты P. griseofluvum длиной 1744 а.к., получали, 19 и 23 последовательности контигов, соответственно (последовательности контига PKS A. fumigatus длиной 2146 а.к.: SEQ ID NO: 179-197; последовательности контига синтетазы 6-метилсалициловой кислоты P. griseofluvum длиной 1744 а.к.: SEQ ID NO: 198 до 220) (см. таблицу 2).
[0117]
|
[0118] Пример 4: Амплификация ПЦР геномной ДНК
На основании результатов поиска blastx, полученных в примере 3, для поликетидсинтаз синтезировали 13 типов пар праймеров, представленных в SEQ ID NO: 227-252. Подобным образом для пренилтрансферазы синтезировали 5 типов пар праймеров, представленных в SEQ ID NO: 253-262. Когда проводили ПЦР для геномной ДНК с использованием этих праймеров, амплифицированные фрагменты с ожидаемым размером наблюдали для всех пар праймеров (см. фиг.1 и фиг.2).
[0119] Пример 5: Конструирование фаговой геномной библиотеки
Геномную библиотеку фага λ штамма Penicillium coprobium PF1169 конструировали с использованием набора λBlueSTAR Xho I Half-site Arms Kit (производимого Takara Bio Inc., каталожный номер 69242-3) в соответствии с приложенным руководством. Т.е. геномную ДНК частично расщепляли с использованием рестрикционного фермента, Sau3A1. Фрагмент ДНК длиной приблизительно 20 т.п.н. (0,5 мкг) лигировали с 0,5 мкг ДНК λBlueSTAR, приложенной к набору. Этот раствор после лигирования подвергали пакованию in vitro с использованием набора для упаковки Lambda INN (производимого Nippon Gene Co., Ltd.) на основании приложенного к набору руководства с получением 1 мл раствора. Этим раствором с упакованными фагами (10 мкл) инфицировали 100 мкл штамма E. coli ER1647 и проводили культивировании на бляшкообразующей среде при 37°C в течение ночи, таким образом, получая приблизительно 500 клонов бляшек. Таким образом, конструировали геномную библиотеку, состоящую из приблизительно 50000 клонов фагов, в которые посредством клональной инфекции вводили от 10 до 20 т.п.н. геномной ДНК штамма Penicillium coprobium PF1169.
[0120] Пример 6: Скрининг на основе фаговой библиотеки
Для 10000 клонов фаговой библиотеки, полученной в примере 5, проводили первичный скрининг посредством гибридизации бляшек с использованием в качестве зонда продукта ПЦР, амплифицированного с применением пары праймеров LC1-LC2c, полученной выше. Для мечения и детекции зонда использовали набор AlkPhos Direct Labelling and Detection System with CDP-Star (производимый GE Healthcare, каталожный номер RPN3690). Указанную выше гибридизацию проводили в соответствии с приложенным руководством.
[0121] После первичного скрининга в качестве кандидатов остались 6 клонов. Кроме того, в результате вторичного скрининга посредством гибридизации бляшек, получали 4 клона. Этими положительными клонами инфицировали штамм E. coli BM25.8, и фаги преобразовывали в плазмиды в соответствии с приложенным руководством, таким образом, получая 4 типа плазмид, содержащих желаемую область.
[0122] Пример 7: Получение фосмидной геномной библиотеки
Геномную библиотеку штамма Penicillium coprobium PF1169 конструировали в соответствии с руководством, приложенным к набору CopyControl Fosmid Library Production Kit (производимому EPICENTRE, каталожный номер CCFOS110). Т.е., у 0,25 мкг фрагмента ДНК приблизительно 40 т.п.н. геномной ДНК получали тупые концы, а затем вводили в фосмидный вектор pCCFOS (производимый Epicentre). Этот раствор после лигирования подвергали пакованию in vitro с использованием приложенного к набору MaxPlax Lambda Packaging Extract на основании приложенного к набору руководства. Этим раствором с упакованным вирусом (10 мкл) инфицировали 100 мкл штамма E. coli EPI300™-T1R и проводили культивирование на среде, содержащей хлорамфеникол при 37°C в течение ночи, и отбор, таким образом, получая приблизительно 300 клонов колоний. Таким образом, получали приблизительно 30000 клонов фосмид, в которые посредством инфицирования вводили 40 т.п.н. геномной ДНК штамма Penicillium coprobium PF1169. Их разделяли на аликвоты в 96-луночном планшете так, чтобы получить приблизительно 50 клонов на лунку. Таким образом, конструировали геномную библиотеку, состоящую из 96 пулов, приблизительно 4800 клонов.
[0123] Пример 8: Скрининг фосмидной библиотеки
В соответствии с руководством, приложенным к фосмидам, из 96 пулов библиотеки, полученной в примере 7, получали отдельную плазмидную ДНК. Для 96 пулов этих образцов плазмидной ДНК с использованием вырожденных праймеров для амплификации поликетидсинтазы, синтезированных в примере 2, проводили ПЦР. В результате из 9 пулов амплифицировали фрагменты ДНК длиной приблизительно 700 п.н. Затем из положительных пулов получали чашки Петри, содержащие колонии приблизительно из 300 клонов или более, и проводили повторный скрининг посредством гибридизации колоний. В результате, с использованием пары праймеров LC1-LC2c, получали 9 типов фосмид из приблизительно 4800 клонов.
[0124] Пример 9: Крупномасштабное секвенирование геномной ДНК и поиск гомологии аминокислотных последовательностей
Геномную ДНК штамма Penicillium coprobium PF1169, полученную в примере 1, подвергали крупномасштабному секвенированию и поиску гомологии аминокислотных последовательностей. Конкретно, часть 50 мкг геномной ДНК предварительно обрабатывали, а затем подвергали анализу на секвенаторе ДНК Roche 454FLX с получением приблизительно 1405 последовательностей фрагментов со средней длиной контига 19621 т.п.н. (общая длина последовательности оснований 27,568160 МБ).
Для этих последовательностей, в качестве известных последовательностей поликетидсинтаз и пренилтрансфераз, выбирали приведенные ниже пять последовательностей (последовательности, полученные из поликетидсинтаз: синтетаза 6-метилсалициловой кислоты Penicillium(P.) griseofluvum длиной 1744 а.к. (P22367) и PKS Aspergillus(A.) fumigatus длиной 2146 а.к. (Q4WZA8); а также пренилтрансферазы: пренилтрансфераза Penicillium(P.) marneffei (Q0MRO8), пренилтрансфераза Aspergillus (A.) fumigatus (Q4WBI5) и пренилтрансфераза (4-гидроксибензоатоктапренилтрансфераза) Aspergillus(A.) fumigatus (Q4WLD0)) и проводили поиск с применением программного обеспечения по поиску гомологии последовательностей blastx, таким образом, получая 22 (P22367), 21 (Q4WZA8), 2 (Q0MRO8), 3 (Q4WBI5) и 3 (Q4WLD0) гомологичных последовательностей, соответственно.
[0125] Пример 10: Скрининг фосмидной библиотеки и анализ последовательностей кластерных генов
В соответствии с руководством, приложенным к фосмидному набору (производимому EPICENTRE, CopyControl Fosmid Library Production Kit), отдельно получали плазмидные ДНК из 96 пулов библиотеки, полученной в примере 7. На основе последовательностей оснований, определенных на секвенаторе ДНК Roche 454FLX, проводили поиск гомологии аминокислотных последовательностей с поиском областей, прилежащих к поликетидсинтазе и пренилтрансферазе. На основе последовательности оснований полученной области пренилтрансферазы, синтезировали пару праймеров (№ 27), способных амплифицировать фрагмент ДНК длиной 400 п.н. С использованием этих праймеров проводили ПЦР для этих 48 пулов образцов плазмидной ДНК. В результате в 11 пулах амплифицировали ожидаемые фрагменты ДНК длиной приблизительно 400 п.н. (SEQ ID NO: 263) (см. фиг.3). Затем, из 6 пулов положительных пулов получали чашки Петри, содержащие колонии по приблизительно 300 клонов или более, и проводили повторный скрининг посредством гибридизации колоний. В результате с использованием пары праймеров 27F+27R (праймер 27F: SEQ ID NO: 264, праймер 27R: SEQ ID NO: 265), получали 4 типа фосмид из приблизительно 4800 клонов. Одну из них назвали pCC1-PP1 и определяли полную последовательность вставленного фрагмента (SEQ ID NO: 266).
Полученную pCC1-PP1 трансформировали в штамм Escherichia coli EPI300™-T1R (приложенный к фосмидному набору), таким образом, получая штамм Escherichia coli EPI300™-T1R/pCC1-PP1.
Когда проводили поиск гомологии между указанной выше последовательностью SEQ ID NO: 266 и каждой из КоА-лигазой; LovB-подобной поликетидсинтазой (PKS); цитохром P450-зависимой монооксигеназой, циклазой (IMP: интегральный мембранный белок), FAD-зависимой монооксигеназой (FMO), которые представляют собой гидроксилазы; UbiA-подобной пренилтрансферазой (UbiAPT); ацетилтрансферазой (AT), ацетилтрансферазой-2 (AT-2), которые представляют собой ацетилтрансферазы; и переносящей катионы АТФазой (все указанные выше ферменты получали из штамма Aspergillus fumigatus Af293) при любом поиске наблюдали высокую гомологию, составляющую 70% или более.
Нуклеотиды от 3342 до 5158 SEQ ID NO: 266 кодируют КоА-лигазу, и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 267; нуклеотиды от 5382 до 12777 SEQ ID NO: 266 кодируют LovB-подобную поликетидсинтазу (PKS), и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 268; нуклеотиды от 13266 до 15144 SEQ ID NO: 266 (далее в настоящем документе, белок, кодируемый данной полинуклеотидной последовательностью, обозначают как цитохром P450-зависимая монооксигеназа (1) (P450-1)), и нуклеотиды от 16220 до 18018 (далее в настоящем документе белок, кодируемый данной полинуклеотидной последовательностью, обозначают как цитохром P450-зависимая монооксигеназа (2) (P450-2)) кодируют цитохром P450-зависимые монооксигеназы, и соответствующие полипептиды представлены аминокислотными последовательностями, приведенными в SEQ ID NO: 269 и 270, соответственно; нуклеотиды от 18506 до 19296 SEQ ID NO: 266 кодируют циклазу, и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 271; нуклеотиды от 19779 до 21389 SEQ ID NO: 266 кодируют FAD-зависимую монооксигеназу (FMO), и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 272; нуклеотиды от 21793 до 22877 SEQ ID NO: 266 кодируют UbiA-подобную пренилтрансферазу (UbiAPT), и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 273; нуклеотиды от 23205 до 24773 SEQ ID NO: 266 кодируют ацетилтрансферазу (AT), и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 274; нуклеотиды от 25824 до 27178 SEQ ID NO: 266 кодируют ацетилтрансферазу-2 (AT-2), и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 275; и нуклеотиды от 27798 до 31855 SEQ ID NO: 266 кодируют переносящую катионы АТФазу, и соответствующий полипептид представлен аминокислотной последовательностью, приведенной в SEQ ID NO: 276.
[0126] Пример 11: Функциональный анализ генов посредством трансформации Aspergillus Oryzae
Пирипиропен E, используемый ниже, можно получать способом культивирования микроорганизма на основе способа, описанного в выложенной публикации патента Японии № 239385/1996, WO94/09147 или патенте США № 5597835, или общего способа синтеза, описанного в Tetrahedron Letters, vol. 37, No. 36, 6461-6464, 1996. Также, пирипиропен O, используемый ниже, можно получать способом культивирования микроорганизма на основе способа, описанного в J. Antibiotics 49, 292-298, 1996 или WO94/09147.
[0127] (1) Получение экспрессирующего вектора для введения в нитевидный гриб
pUSA (фиг.4) и pHSG399 (Takara Bio Inc.) отдельно расщепляли KpnI и лигировали, таким образом, получая pUSA-HSG. Эту плазмиду расщепляли SmaI и KpnI в указанном порядке и подвергали очистке на геле, таким образом, получая линейный ДНК-вектор, имеющий липкий конец KpnI и тупой конец SmaI.
[0128] (2) Получение плазмиды pPP2
С использованием фосмиды pCC1-PP1 в качестве матрицы, амплифицировали полинуклеотид указанной выше P450-1 с использованием пары праймеров P450-1 с Kpn F (SEQ ID NO: 277)/P450-1 с Swa R (SEQ ID NO: 278). Очищенный фрагмент ДНК клонировали в pCR-Blunt (Invitorogen, каталожный номер K2700-20). Полученную плазмиду расщепляли KpnI и SwaI. Указанный выше фрагмент P450-1 лигировали в описанный выше вектор pUSA-HSG, таким образом, получая плазмиду pPP2, представленную на фиг.5.
[0129] (3) Получение плазмиды pPP3
С использованием фосмиды pCC1-PP1 в качестве матрицы в соответствии с графом, представленным на фиг.6, сначала отдельно амплифицировали экзоны с использованием пар праймеров F1(SEQ ID NO: 279)/R1(SEQ ID NO: 280), F2(SEQ ID NO: 281)/R2(SEQ ID NO: 282), F3(SEQ ID NO: 283)/R3(SEQ ID NO: 284), F4(SEQ ID NO: 285)/R4(SEQ ID NO: 286), F5(SEQ ID NO: 287)/R5(SEQ ID NO: 288) и F6(SEQ ID NO: 289)/R6(SEQ ID NO: 290), таким образом, получая шесть фрагментов. Затем проводили амплификацию с этими фрагментами в качестве матриц с использованием пар праймеров F1/R2, F3/R4 и F5/R6, таким образом, получая более длинные фрагменты. Затем, повторяя амплификацию с использованием пар праймеров F1/R4 и F1/R6, получали кДНК, не содержащую интронов полинуклеотида указанной выше P450-2. Этот фрагмент кДНК вставляли в pCR-Blunt (Invitorogen, каталожный номер K2700-20) и полученную плазмиду использовали в качестве матрицы для амплификации с парой праймеров, infusion F P450-2-cDNA (SEQ ID NO: 291)/infusion R P450-2-cDNA (SEQ ID NO: 292). С использованием набора In-Fusion Advantage PCR Cloning Kit (Clontech) на основе руководства к набору получали плазмиду pPP3, представленную на фиг.7.
[0130] (4) Получение каждой из плазмид pPP6, pPP7 и pPP9
Каждую из приведенных ниже плазмид, а именно pPP6, pPP7 и pPP9, получали с использованием вектора pUSA-HSG для трансформация нитевидного гриба, полученного в указанном выше примере 11(1).
1) Получение плазмиды pPP6 (UbiA PT)
С использованием фосмиды pCC1-PP1 в качестве матрицы каждый из полинуклеотидов указанной выше UbiA PT амплифицировали с использованием UbiA PT F с Kpn (SEQ ID NO: 293) и UbiA PT R с Swa (SEQ ID NO: 294). Очищенный фрагмент ДНК клонировали в вектор для фрагментов ПЦР, pCR-Blunt (Invitorogen, каталожный номер K2700-20). Полученную плазмиду расщепляли KpnI и SwaI. После очистки каждого фрагмента, их лигировали по участкам KpnI и SmaI указанного вектора pUSA-HSG описанного выше нитевидного гриба, таким образом, получая плазмиду pPP6, представленную на фиг.12.
[0131] 2) Получение плазмиды pPP7 (AT)
С использованием фосмиды pCC1-PP1 в качестве матрицы, каждый из полинуклеотидов AT амплифицировали с использованием пары праймеров AT F с Swa (SEQ ID NO: 295) и AT R с Kpn (SEQ ID NO: 296). Очищенный фрагмент клонировали в вектор для фрагментов ПЦР, pCR-Blunt (Invitorogen, каталожный номер K2700-20). Полученную плазмиду расщепляли KpnI и SwaI. Каждый фрагмент лигировали по участкам KpnI и SmaI указанного вектора pUSA-HSG описанного выше нитевидного гриба, таким образом, получая плазмиду pPP7, представленную на фиг.12.
[0132] 3) Получение плазмиды pPP9 (AT-2)
С использованием фосмиды pCC1-PP1 в качестве матрицы фрагмент токсина амплифицировали с использованием пары праймеров infusion F тиоксина (SEQ ID NO: 297) и infusion R токсина (SEQ ID NO: 298) и вставляли по участкам KpnI и SmaI указанного выше вектора pUSA-HSG описанного выше нитевидного гриба с использованием набора In-Fusion Advantage PCR Cloning Kit (производимого Clontech, каталожный номер 639619), на основе руководства к набору, таким образом, получая плазмиду pPP9, представленную на фиг.12.
[0133] (5) Получение трансформанта Aspergillus Oryzae (A. oryzae)
В среде с агаром CD-Met (содержащей 40 мкг/мл L-метионина) в течение одной недели при 30°C культивировали A. oryzae (штамм HL-1105). Из этой чашки Петри собирали конидии (>108) и высевали в 100 мл жидкой среды YPD в 500 мл колбу. Через 20 час культивирования (30°C, 180 об./мин.), получали клетки гриба с формой шариков мха. Клетки гриба собирали с использованием стеклянного фильтра 3G-1, промывали 0,8 M NaCl и тщательно удаляли воду. Полученное суспендировали в растворе I TF (раствор для формирования протопластов), а затем перемешивали при 30°C при 60 об./мин в течение 2 часов. Через 30 минутные интервалы проводили наблюдение под микроскопом и проверяли наличие протопластов. Затем среду для культивирования фильтровали и центрифугировали (2000 об./мин., 5 минут) для сбора протопластов, которые затем промывали раствором II TF. После промывки добавляли 0,8 объема раствора II TF и 0,2 объема раствора III TF и перемешивали, таким образом, получая суспензию протопластов.
[0134] К 200 мкл этой суспензии, добавляли 10 мкг плазмидной ДНК (pPP2 или pPP3). Смесь оставляли на льду в течение 30 минут и добавляли раствор III TF (1 мл). Полученную смесь осторожно перемешивали, а затем оставляли при комнатной температуре в течение 15 минут. Затем, в указанные выше протопласты вносили плазмидную ДНК. Для этой смеси добавляли раствор II TF (8 мл) и проводили центрифугирование (при 2000 об./мин. в течение 5 минут). Затем протопласты восстанавливали, оставляя от 1 до 2 мл. Затем раствор восстановленных протопластов капельно добавляли в среду для регенерации (нижний слой) и наливали среду для регенерации (верхний слой). Полученное смешивали, переворачивая чашку Петри, а затем культивировали при 30°C в течение периода от 4 до 5 суток. Полученные клоны выделяли в среде для регенерации (нижний слой), субкультивировали и очищали, таким образом, получая трансформант (Aspergillus oryzae PP2-1 и Aspergillus oryzae PP3-2).
[0135] На основе способа, описанного в указанном выше примере 11 (5), получали трансформанты, в которые вводили каждую из указанных выше плазмидных ДНК (pPP6, pPP7 и pPP9) (Aspergillus oryzae PP6, Aspergillus oryzae PP7 и Aspergillus oryzae PP9).
[0136] Указанный выше раствор I TF (раствор для формирования протопластов) получали с приведенным ниже составом.
|
После получения указанного выше состава (pH 5,5) проводили стерилизацию фильтрованием.
[0137] Указанный выше раствор II TF получали с приведенным ниже составом.
|
Затем добавляли воду, доводя общий объем до 200 мл.
После получения указанного выше состава проводили стерилизацию автоклавированием.
[0138] Указанный выше раствор III TF получали с приведенным ниже составом.
|
Затем добавляли воду, доводя общий объем до 10 мл.
После получения указанного выше состава проводили стерилизацию фильтрованием.
[0139] Указанную выше среду для регенерации получали со следующим составом.
|
Затем добавляли воду, доводя общий объем до 1 л.
После получения указанного выше состава (pH 5,5) проводили стерилизацию автоклавированием.
[0140] Кроме того, используемый выше раствор микроэлементов получали со следующим составом.
|
Затем добавляли воду, доводя общий объем до 1 л.
После получения указанного выше состава проводили стерилизацию автоклавированием.
[0141] (6) Функциональный анализ и тест добавления культуры P450-1
К среде YPD (1% (масс./об.) дрожжевой экстракт, 2% (масс./об.) пептон, 2% (масс./об.) декстроза), содержащей 1% (масс./об.) мальтозу, добавляли 1/100 объема раствора 2 мг/мл пирипиропена E в диметилсульфоксиде с получением среды A. Из флоры Aspergillus oryzae PP2-1, культивируемой в среде с агаром Czapek Dox, собирали ее конидии и суспендировали в стерилизованной воде. Эту суспензию конидий доводили до 104 спор/мл. Затем 100 мкл этой доведенной суспензии конидий добавляли в 10 мл среды A и культивировали со встряхиванием при 25°C в течение 96 часов. К этому культуральному раствору добавляли 10 мл ацетона и смесь хорошо смешивали. Затем ацетон удаляли с использованием центрифужного концентратора. К нему добавляли 10 мл этилацетата и полученную смесь хорошо смешивали, а затем выделяли только слой с этилацетатом. Высушенный продукт, полученный при удалении этилацетата с использованием центрифужного концентратора, растворяли в 1000 мкл метанола. Этот раствор использовали в качестве образца и анализировали посредством LC-MS (Waters, Micromass ZQ, 2996PDA, 2695 Separation module, Колонка: Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм)) и LC-NMR (производимого Burker Daltonik, Avance500).
[0142] В качестве результатов указанного выше измерения LC-MS подтверждали, что получаемое соединение представляло собой одно соединение A с молекулярной массой, увеличенной по сравнению с пирипиропеном E на 16. Затем в качестве результатов измерения LC-NMR подтверждали, что это соединение A представляло собой гидроксид пирипиропена E по 11 положению. Это подтверждало, что указанная выше цитохром P450-зависимая монооксигеназа (1) обладала гидроксилазной активностью в отношении 11 положения пирипиропена E с пирипиропеном E в качестве субстрата.
[0143] Ниже приведены физико-химические свойства указанного выше соединение A:
1. Масс-спектр: ES-MS 468 m/z (M+H)+
2. Молекулярная формула: C27H33NO6
3. ВЭЖХ: колонка: Waters XTerra Column C18 (5 мкм, 4,6 мм×50 мм), 40°C, подвижная фаза: от 20% водного раствора ацетонитрила до 100% ацетонитрила за 10 минут (линейный градиент), скорость потока: 0,8 мл/мин, детекция: время удержания 6,696 минут при УФ 323 нм
4. Спектр 1H-ЯМР (CD3CN, 2H: 3,134, 3,157 H-11)
Диаграммы спектра 1H-ЯМР пирипиропена E и спектра 1H-ЯМР соответствующие указанному выше 4, приведены на фиг.8 и фиг.9, соответственно.
[0144] (7) Функциональный анализ и тест добавления культуры P450-2
К среде YPD (1% (масс./об.) дрожжевой экстракт, 2% (масс./об.) пептон, 2% (масс./об.) декстроза), содержащей 1% (масс./об.) мальтозу, добавляли 1/100 объема раствора 2 мг/мл пирипиропена E в диметилсульфоксиде с получением среды A, и подобным образом добавляли 1/100 объема раствора 2 мг/мл пирипиропена O в диметилсульфоксиде с получением среды B. Из флоры Aspergillus oryzae PP3-2, культивируемой в среде с агаром Czapek Dox, собирали ее конидии и суспендировали в стерилизованной воде. Эту суспензию конидий доводили до 104 спор/мл. Затем 500 мкл этой доведенной суспензии конидий добавляли в 50 мл среды A и культивировали со встряхиванием при 25°C в течение 96 часов. К этому культуральному раствору добавляли 50 мл ацетона и смесь хорошо смешивали. Затем ацетон удаляли с использованием центрифужного концентратора. К нему добавляли 50 мл этилацетата и полученную смесь хорошо смешивали, а затем выделяли только слой с этилацетатом. Высушенный продукт, полученный при удалении этилацетата с использованием центрифужного концентратора, растворяли в 1500 мкл метанола. Этот раствор использовали в качестве образца и анализировали посредством LC-MS (производимого Waters, Micromass ZQ, 2996PDA, 2695 Separation module, Колонка: Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм)) и LC-NMR (производимого Burker Daltonik, Avance500). В качестве результатов измерения LC-MS в образце, полученном из среды A, детектировали соединение B с увеличенной по сравнению пирипиропеном E молекулярной массы на 32. Также в образце, полученном из среды B, детектировали соединение C с увеличенной по сравнению пирипиропеном O молекулярной массой на 32. Кроме того, в качестве результатов измерения LC-NMR подтверждали, что соединение C представляло собой гидроксид пирипиропена O в 7 положении и в 13 положении. Подтверждали, что указанная выше цитохром P450-зависимая монооксигеназа (2) обладала гидроксилазной активностью в отношении 7 положения и 13 положения каждого из пирипиропена E или пирипиропена O.
[0145] Ниже приведены физико-химические свойства указанного выше соединения B:
1. Масс-спектр: ES-MS 484 m/z (M+H)+
2. Молекулярная формула: C27H33NO7
3. ВЭЖХ: колонка: Waters XTerra Column C18 (5 мкм, 4,6 мм×50 мм), 40°C, подвижная фаза: от 20% водного раствора ацетонитрила до 100% ацетонитрила за 10 минут (линейный градиент), скорость потока: 0,8 мл/мин, детекция: время удержания 5,614 минут при УФ 323 нм
[0146] Ниже приведены физико-химические свойства указанного выше соединения C:
1. Масс-спектр: ES-MS 542 m/z (M+H)+
2. Молекулярная формула: C29H35NO9
3. ВЭЖХ: колонка: Waters XTerra Column C18 (5 мкм, 4,6 мм×50 мм), 40°C, подвижная фаза: от 20% водного раствора ацетонитрила до 100% ацетонитрила за 10 минут (линейный градиент), скорость потока: 0,8 мл/мин, детекция: время удержания 5,165 минут при УФ 323 нм
4. Спектр 1H-ЯМР (CD3CN, 1H 4,858 H-13), (CD3CN, 1H 3,65 H-7)
Диаграммы спектра 1H-ЯМР пирипиропена O и указанного выше соединения C приведены на фиг.10 и фиг.11, соответственно.
[0147] (8) Функциональный анализ и тест добавления культуры пренилтрансферазы
К среде YPD (1% (масс./об.) дрожжевой экстракт, 2% (масс./об.) пептон, 2% (масс./об.) декстроза), содержащей 1% (масс./об.) мальтозу, добавляли 1/100 объема раствора 2 мг/мл соединения D (4-оксо-6-(3-пиридил)-α-пирона, который используют далее в настоящем документе) (см. ссылочный пример 1) в диметилсульфоксиде с получением среды C. Из флоры Aspergillus oryzae PP6, культивируемой в среде с агаром Czapek Dox, собирали ее конидии и суспендировали в стерилизованной воде. Эту суспензию конидий доводили до 104 спор/мл. Затем 200 мкл этой суспензии добавляли в 20 мл среды C и культивировали со встряхиванием при 25°C в течение 96 часов. К этому культуральному раствору добавляли 20 мл ацетона и смесь хорошо смешивали. Затем ацетон удаляли с использованием центрифужного концентратора. К нему добавляли 20 мл этилацетата и полученную смесь хорошо смешивали, а затем выделяли только слой с этилацетатом. Высушенный продукт, полученный при удалении этилацетата с использованием центрифужного концентратора, растворяли в 1000 мкл метанола. Этот раствор применяли в качестве образца и анализировали посредством LC-MS (Waters, Micromass ZQ, 2996PDA, 2695 Separation module, Колонка: Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм)).
[0148] В качестве результатов измерения LC-MS детектировали соединение F (4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-он, которое используют далее в настоящем документе), в котором к соединению D добавлена фарнезильная группа. Подтверждали, что это соединение обладало таким же временем удержания, пиками молекулярных ионов и поглощением в УФ при LC-MS как соединение F, описанное в ссылочном примере 2. На основании этого подтверждали, что пренилтрансфераза обладает пренилтрансферазной активностью, состоящей в добавлении фарнезильной группы к соединению D.
[0149] (9) Функциональный анализ и тест добавления культуры ацетилтрансферазы-1
К среде YPD (1% (масс./об.) дрожжевой экстракт, 2% (масс./об.) пептон, 2% (масс./об.) декстроза), содержащей 1% (масс./об.) мальтозу, добавляли 1/100 объема раствора 2 мг/мл деацетилпирипиропена E (см. ссылочный пример 3) в диметилсульфоксиде с получением среды D; добавляли 1/100 объема раствора 2 мг/мл 11-деацетилпирипиропена O в диметилсульфоксиде (см. ссылочный пример 4) с получением среды E и добавляли 2 мг/мл раствор 7-деацетилпирипиропена A в диметилсульфоксиде (см. ссылочный пример 5) с получением среды F. Из флоры Aspergillus oryzae PP7, культивируемой в среде с агаром Czapek Dox, собирали ее конидии и суспендировали в стерилизованной воде. Эту суспензию конидий доводили до 104 спор/мл. Затем 200 мкл этой суспензии добавляли в 20 мл среды D, среды E или среды F и культивировали со встряхиванием при 25°C в течение 96 часов. К этому культуральному раствору добавляли 20 мл ацетона и смесь хорошо смешивали. Затем ацетон удаляли с использованием центрифужного концентратора. К нему добавляли 20 мл этилацетата и полученную смесь хорошо смешивали, а затем выделяли только слой с этилацетатом. Высушенный продукт, полученный при удалении этилацетата с использованием центрифужного концентратора, растворяли в 1000 мкл метанола. Этот раствор использовали в качестве образца и анализировали посредством LC-MS (Waters, Micromass ZQ, 2996PDA, 2695 Separation module, Колонка: Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм)).
[0150] В качестве результатов измерения LC-MS в среде D детектировали одно соединение с увеличенной по сравнению c деацетилпирипиропеном E молекулярной массой на 42. Подтверждали, что это соединение обладало таким же временем удержания, пиками молекулярных ионов и поглощением в УФ при LC-MS как пирипиропен E (см. ссылочный пример 6). При этом вновь образуемых соединений в среде E и среде F не выявляли. На основании этого подтверждали, что ацетилтрансфераза-1 обладает активностью ацетилтрансферазы, специфически ацетилирующей положение 1 деацетилпирипиропена E.
[0151] (10) Функциональный анализ и тест добавления культуры ацетилтрансферазы-2
К среде YPD (1% (масс./об.) дрожжевой экстракт, 2% (масс./об.) пептон, 2% (масс./об.) декстроза), содержащей 1% (масс./об.) мальтозу, добавляли 1/100 объема раствора 2 мг/мл деацетилпирипиропена E (см. ссылочный пример 3) в диметилсульфоксиде с получением среды D; добавляли 1/100 объема раствора 2 мг/мл 11-деацетилпирипиропена O в диметилсульфоксиде (см. ссылочный пример 4) с получением среды E и добавляли 2 мг/мл раствор 7-деацетилпирипиропена A в диметилсульфоксиде (см. ссылочный пример 5) с получением среды F. Из флоры Aspergillus oryzae PP9, культивируемой в среде с агаром Czapek Dox, собирали ее конидии и суспендировали в стерилизованной воде. Эту суспензию конидий доводили до 104 спор/мл. Затем 200 мкл этой суспензии добавляли в 20 мл среды D, среды E или среды F и культивировали со встряхиванием при 25°C в течение 96 часов. К этому культуральному раствору добавляли 20 мл ацетона и смесь хорошо смешивали. Затем ацетон удаляли с использованием центрифужного концентратора. К нему добавляли 20 мл этилацетата и полученную смесь хорошо смешивали, а затем выделяли только слой с этилацетатом. Высушенный продукт, полученный при удалении этилацетата с использованием центрифужного концентратора, растворяли в 1000 мкл метанола. Этот раствор использовали в качестве образца и анализировали посредством LC-MS (Waters, Micromass ZQ, 2996PDA, 2695 Separation module, Колонка: Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм)).
[0152] В качестве результатов измерения LC-MS в среде E детектировали одно соединение с увеличенной по сравнению c 11-деацетилпирипиропеном O молекулярной массой на 42. Подтверждали, что это соединение обладало таким же временем удержания, пиками молекулярных ионов и поглощением в УФ при LC-MS как пирипиропен O (см. ссылочный пример 7). Кроме того, в среде F детектировали одно соединение с увеличенной по сравнению c 7-деацетилпирипиропеном A молекулярной массой на 42. Подтверждали, что это соединение обладало таким же временем удержания, пиками молекулярных ионов и поглощением в УФ при LC-MS как пирипиропен A (см. ссылочный пример 8). При этом вновь образуемых соединений в среде D не обнаруживали. На основании этого подтверждали, что ацетилтрансфераза-2 обладало активностью ацетилтрансферазы, специфически ацетилирующей положение 11 11-деацетилпирипиропена O и положение 7 7-деацетилпирипиропена A.
[0153] Ссылочный пример 1: Синтез соединения D (4-оксо-6-(3-пиридил)-α-пирона)
Указанное выше соединение D получали способом, описанным в J. Org. Chem. 1983. 48. 3945.
[0154] Ссылочный пример 2: Получение и структурный анализ соединения F (4-гидрокси-6-(пиридин-3-ил)-3-((2E,6E)-3,7,11-триметилдодека-2,6,10-триенил)-2H-пиран-2-она)
Культуральный бульон, содержащий пирипиропены, полученный способом, описанным в Journal of Technical Disclosure 500997/2008 (патентный документ 3), экстрагировали бутилацетатом, а затем фильтровали с использованием целита. Целит (2,5 г), используемый при фильтрации удаляли и добавляли метанол (30 мл). Полученное перемешивали при комнатной температуре в течение 23 часов. Нерастворимое вещество удаляли посредством фильтрации и метанол выпаривали при пониженном давлении, таким образом, получая соединение F (191 мг).
ESI-MS; m/z 394 (M+H)+
1H-ЯМР (ДМСО) δ (ч/млн) 1,48 (3H, с), 1,51 (3H, с), 1,55 (3H, 35 с), 1,69 (3H, с), 1,85 (2H, т, J=7,5 Гц), 1,91-1,95 (4H, м), 2,01 (2H, дт, J=6,9, 6,9 Гц), 3,03 (2H, д, J=7,1 Гц), 4,98 (1Н, т, J=7,0 Гц), 5,02 (1H, т, J=6,9 Гц), 5,13 (1H, т, J=7,0 Гц), 6,75 (1H, с), 7,54 (1H, дд, J=4,8, 8,2 Гц), 8,09 (1H, ддд, J=1,4, 1,9, 8,2 Гц), 8,66 (1H, дд, J=1,4, 4,8 Гц), 8,91 (1H, д, J=1,9 Гц).
[0155] Ссылочный пример 3: Синтез и структурный анализ деацетилпирипиропена E
Пирипиропен E (29 мг) растворяли в смеси метанол-вода (19:1, 1 мл) и в раствор добавляли карбонат калия (53 мг). Полученное перемешивали в течение 44 часов. Затем растворитель выпаривали при пониженном давлении и добавляли смешанный растворитель хлороформ-метанол (10:1). Нерастворимое вещество удаляли посредством фильтрации и растворитель выпаривали при пониженном давлении, таким образом, получая неочищенный продукт. Неочищенный продукт очищали посредством препаративной тонкослойной хроматографии (силикагель Merck 60F254, 0,5 мм, хлороформ:метанол=10:1), таким образом, получая деацетилпирипиропен E (18 мг).
ESI-MS; m/z 410 (M+H)+
1H-ЯМР (CDCl3) δ (ч/млн) 0,82 (3H, с), 0,92 (3H, с), 1,00-1,03 (1H, м), 1,04 (3H, с), 1,12 (1H, дт, J=4,0, 13,2 Гц), 1,27 (3H, с), 1,41-1,53 (2H, м), 1,59-1,75 (3H, м), 1,80-1,84 (2H, м), 2,15 (1H, дт, J=3,2, 12,4 Гц), 2,18-2,29 (1H, м), 2,54 (1H, дд, J=3,2, 17,6 Гц), 3,25 (1H, дд, J=4,4, 11,2 Гц), 6,43 (1H, с), 7,39 (1H, дд, J=4,8, 8,0 Гц), 8,11 (1H, д, J=8,0 Гц), 8,65 (1H, д, J=4,8 Гц), 8,99 (1H, д, J=1,6 Гц).
[0156] Ссылочный пример 4: Синтез и структурный анализ 11-деацетилпирипиропена O
Пирипиропен O (30 мг) растворяли в смеси метанол-вода (19:1, 2 мл) и к раствору добавляли карбонат калия (20 мг). Полученное перемешивали в течение 22 часов, а затем добавляли уксусную кислоту (0,1 мл) и растворитель выпаривали при пониженном давлении. Добавляли этилацетат и воду, а затем проводили экстракцию этилацетатом. Слой этилацетата отмывали насыщенным раствором хлорида натрия и сушили безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении, таким образом, получая неочищенный продукт 1,11-дидеацетилпирипиропена O (30 мг).
Неочищенный продукт 1,11-дидеацетилпирипиропена O (23 мг) растворяли в N,N-диметилформамиде (0,4 мл) и триэтиламине (8 мг) и в раствор добавляли ангидрид уксусной кислоты (7 мг). После перемешивания полученной смеси при комнатной температуре в течение 23 часов, добавляли воду, а затем проводили экстракцию этилацетатом. Слой этилацетата отмывали раствором насыщенного хлорида натрия и сушили безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, таким образом, получая неочищенный продукт 1-деацетилпирипиропена O (28 мг).
Неочищенный продукт 1-деацетилпирипиропена O (28 мг) растворяли в толуоле и добавляли 1,8-диазабицикло[5,4,0]-7-ундецен (20 мг). Смесь перемешивали при 70°C в течение 20 часов и оставляли охлаждаться. Добавляли этилацетат и воду, а затем проводили экстракцию этилацетатом. Слой этилацетата отмывали раствором насыщенного хлорида натрия и сушили безводным сульфатом магния. Растворитель выпаривали при пониженном давлении, таким образом, получая неочищенный продукт 11-деацетилпирипиропена O (20 мг).
После растворения в метаноле, этот продукт применяли в качестве образца и повторяли ВЭЖХ (SHIMADZU, LC-6AD, SPD-M20A PDA, CBM-20A, колонка; Waters XTerra C18 (Φ 4,5×50 мм, 5 мкм, подвижная фаза 30% водный раствор ацетонитрила до 55% водного раствора ацетонитрила за 25 минут (линейный градиент), скорость потока: 1,0 мл/мин, время удержания от 18 до 19 минут) с препаративным разделением, таким образом, получая 11-деацетилпирипиропен O (4,0 мг).
ESI-MS; m/z 468 (M+H)+
1H-ЯМР (CDCl3) δ (ч/млн) 0,68 (3H, с), 0,95 (3H, с), 1,21-2,21 (10H, м), 1,25 (3H, с), 2,05 (3H, с), 2,20 (1H, дд, J=4,63, 17,3 Гц), 2,50 (1H, дд, J=4,63, 17,3 Гц), 2,94 (1H, д, J=35, 12,5 Гц), 3,33 (1H, д, J=12,5 Гц), 4,87 (1H, дд, J=4,6, 12,2 Гц), 6,48 (1H, с), 7,57 (1H, дд, J=5,1, 8,1 Гц), 8,29 (1H, д, J=8,3 Гц), 8,68 (1H, д, J=4,6 Гц), 9,04 (1H, с).
[0157] Ссылочный пример 5: Синтез 7-деацетилпирипиропена A
7-Деацетилпирипиропен A синтезировали способом, описанным в выложенной публикации патента Японии № 259569/1996.
[0158] Ссылочный пример 6: Получение пирипиропена E
Пирипиропен E получали способом, описанным в выложенной публикации патента Японии № 239385/1996
[0159] Ссылочный пример 7: Получение пирипиропена O
Пирипиропен O получали способом, описанным в J. Antibiot. 1996, 49, 292.
[0160] Ссылочный пример 8: Синтез пирипиропена A
Пирипиропен A получали способом, описанным в WO94/09147.
[Номера доступа]