Результат интеллектуальной деятельности: МИКРООРГАНИЗМ ИЗ РОДА Escherichia, ОБЛАДАЮЩИЙ УСИЛЕННОЙ СПОСОБНОСТЬЮ К ПРОДУКЦИИ L-ТРИПТОФАНА, И СПОСОБ ПОЛУЧЕНИЯ L-ТРИПТОФАНА С ЕГО ИСПОЛЬЗОВАНИЕМ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к микроорганизму из рода Escherichia, обладающему усиленной способностью к продукции L-триптофана, и к способу получения L-триптофана с его использованием.
Предпосылки создания изобретения
L-триптофан, как незаменимая аминокислота, широко используется в качестве кормовой добавки, исходного материала при получении лекарственных средств, таких как растворы для инфузии, а также в качестве материала, применяемого в системе здорового питания, и получают ее путем химического синтеза, за счет энзиматической реакции, в ходе ферментационного процесса и т.п.
В последнее время производство L-триптофана осуществляется в основном с использованием микробной ферментации. На начальной стадии производственного процесса в основном применяют штаммы резистентных аналогов, получаемые путем химической мутации. При этом, поскольку в 1990-ые быстро развивалась техника, основанная на генной рекомбинации, и на молекулярном уровне были понятны определенные регуляторные механизмы, в основном использовали рекомбинатные штаммы E.coli и Corynebacterium, полученные методами генной инженерии.
Продукция триптофана микроорганизмами начинается с DAHP (3-дезокси-D-арабино-гептулозонат-7-фосфата), получаемого при полимеризации PEP (фосфоэнолпируват), который представляет собой промежуточный продукт гликолиза, с E4P (эритрозо-4-фосфат), который является промежуточным продуктом пентозофосфатного пути. Затем идет биосинтез триптофана из хоризмата по общему пути синтеза ароматических соединений. Конкретно, триптофан синтезируется с использованием антранилатсинтазы (ЕС 4.1.3.27), кодируемой геном trpE, антранилатсинтазы (ЕС 4.1.3.27) и антранилат-PRPP-трансферазы (ЕС 2.4.1.28), кодируемой геном trpD, индол-3-глицеролфосфатсинтазы (ЕС 4.1.1.48) и фосфорибозилантранилатизомеразы (ЕС 5.3.1.24), кодируемой геном trpC, и триптофансинтазы (ЕС 4.2.1.20), кодируемой геном trpB и геном trpA. Генный кластер trpEDCBA, который вовлекается в ход этой реакции, находится в хромосоме и характеризуется соответствующей структурой оперона, в котором имеется одна регуляторная область.
Триптофановый оперон активно транскрибируется для целей продукции необходимого для клетки количества триптофана. Однако, если уровень триптофана в клетке высокий, репрессор связывается с триптофаном, и далее происходит инактивация триптофанового оперона путем связывания репрессора с регуляторной областью оперона, в результате чего ингибируется транскрипция.
Кроме того, опероны, функционирующие на пути биосинтеза аминокислот, таких как треонин, фенилаланин, лейцин, триптофан и гистидин, имеют другой регуляторный механизм, известный как аттенюирование (J. Bacteriology (1991) 173, 2328-2340). Что касается процесса аттенюирования, то в настоящее время известно, что в условиях дефицита аминокислот, структура мРНК, соответствующей специфической последовательности в зоне между промотором и первым геном оперона на хромосоме, меняется на структуру, подходящую для процесса трансляции, что способствует экспрессии генов на пути биосинтеза, тогда как в условиях, обогащенных аминокислотами, короткая транскрибированная мРНК образует трехмерную структуру, известную как «шпилечная» структура, что приводит к ингибированию процесса трансляции (J Biol Chem, (1988) 263: 609-612).
На начальной стадии разработки L-триптофан-продуцирующих штаммов, в качестве основной цели стояла задача увеличить эффективность продукции путем повышения ферментативной активности либо за счет снятия ингибирования ферментов на пути биосинтеза триптофана конечным продуктом, триптофаном, по механизму обратной связи, либо за счет увеличения числа копий генов триптофанового оперона на хромосоме или путем использования вектора, способствующего усилению экспрессии ферментов биосинтеза триптофана (Appl. Environ Microbiol., (1982), 43: 289-297; Appl. Microbiol. Biotechnol., (1993), 40: 301-305; Trends Biotechnol., (1996), 14: 250-256).
Методы, усиливающие способность микроорганизмов синтезировать триптофан, включают метод создания резистентности к аналогам триптофана или к антранилату как промежуточному продукту, путем химической мутации, или метод, включающий модификацию микроорганизма согласно стратегии генетической инженерии. Примеры метода химической мутации включают, в частности, методы, описанные в патенте Кореи (регистрационный No. 1987-0001813), в патенте Кореи (регистрационный No. 0949312 и др., и примера метода модификации, основанного на генетической инженерии, включают различные стратегии, в которых используется штамм, полученный при активировании tktA гена, кодирующего транскетолазу, или гена galP, кодирующего галактоза-пермеазу, на пути биосинтеза ароматических аминокислот, для усиления поступления E4P (эритрозо-4-фосфат) или PEP (фосфоэнолпируват) и ослабления ингибирования по типу обратной связи DAPH (3-дезокси-D-арабино-гептулозонат-7-фосфата) с целью активизации пути биосинтеза ароматических кислот (Trends Biotechnol., (1996) 14: 250-256; Microbial Cell Factories (2009), 8:19) или с использованием штамма, полученного при дополнительном введении в вектор или хромосому генов триптофанового оперона (Appl. Environ Microbiol., (1982), 43:289-297; Appl. Microbiol. Biotechnol., (1993), 40: 301-305).
Однако, даже при введении триптофанового оперона, в котором снято ингибирование по типу обратной связи ферментов биосинтеза, эти подходы не позволяли добиться повышения выхода триптофана из-за действия регуляторных механизмов, таких как ингибирование или аттенюирование генов оперона на уровне транскрипции.
Раскрытие изобретения
Техническая проблема
Авторы настоящего изобретения разработали способ, позволяющий снять ингибирование или аттенюирование генов триптофанового оперона на уровне транскрипции в L-триптофан-продуцирующем штамме, а также метод активизации ферментов биосинтеза триптофана, достижимый в рамках указанного способа. Кроме того, для решения проблемы, которая заключается в том, что продукция триптофан-продуцирующего штамма не растет из-за того, что происходит накопление антранилата при активизации триптофанового оперона, авторы настоящего изобретения сконструировали триптофан-продуцирующий штамм, который характеризуется повышенной продукцией и низким уровнем накопления антранилата, при экспрессии кластера генов, исключающего ген, кодирующий антранилатсинтазу (trpE), в числе генов триптофанового оперона, в качестве формы, которая ослабляет регуляторный механизм, такой как ингибирование по типу обратной связи или другой механизм ингибирования.
Настоящее изобретение относится к получению микроорганизма из рода Escherichia, который обладает повышенной продуктивностью в отношении триптофана, путем модификации, направленной на ослабление чувствительности триптофанового оперона к ингибированию или аттенюированию и снижение накопления антранилата.
Другой целью настоящего изобретения является разработка способа получения L-триптофана с использованием микроорганизма из рода Escherichia.
Решение технической проблемы
Для достижения указанных выше целей, в рамках одного варианта настоящего изобретения, был получен рекомбинантный микроорганизм из рода Escherichia, обладающий усиленной способностью к продукции L-триптофана, который был модифицирован с целью удаления, части или полностью, лидерного пептида, имеющего нуклеотидную последовательность SEQ ID NO: 2, в регуляторной области экспрессии с нуклеотидной последовательностью SEQ ID NO: 1 на эндогенном триптофановом опероне.
В другом варианте своего осуществления настоящее изобретение также относится к способу получения L-триптофана, включающему культивирование указанного выше рекомбинантного микроорганизма из рода Escherichia.
Благоприятные эффекты
Рекомбинантный микроорганизм, получаемый по способу настоящего изобретения, устраняет избыточное накопление антранилата и может с успехом использоваться для получения L-триптофана с высоким выходом.
Описание графического материала
На фиг. 1 показан схематический вид генов триптофанового оперона, регуляторной области для генов в хромосоме E.coli и формы гена с делецией по настоящему изобретению.
А) Гены триптофанового оперона и их регуляторная область в хромосоме E.coli (Ptrp);
В) Форма Ptrp;
С) Форма, в которой ген trpL, кодирующий лидерный пептид, делетирован (DtrpL); и
D) Форма, в которой делетированы ген trpL, кодирующий лидерный пептид, и аттенюатор (Dtrp_att).
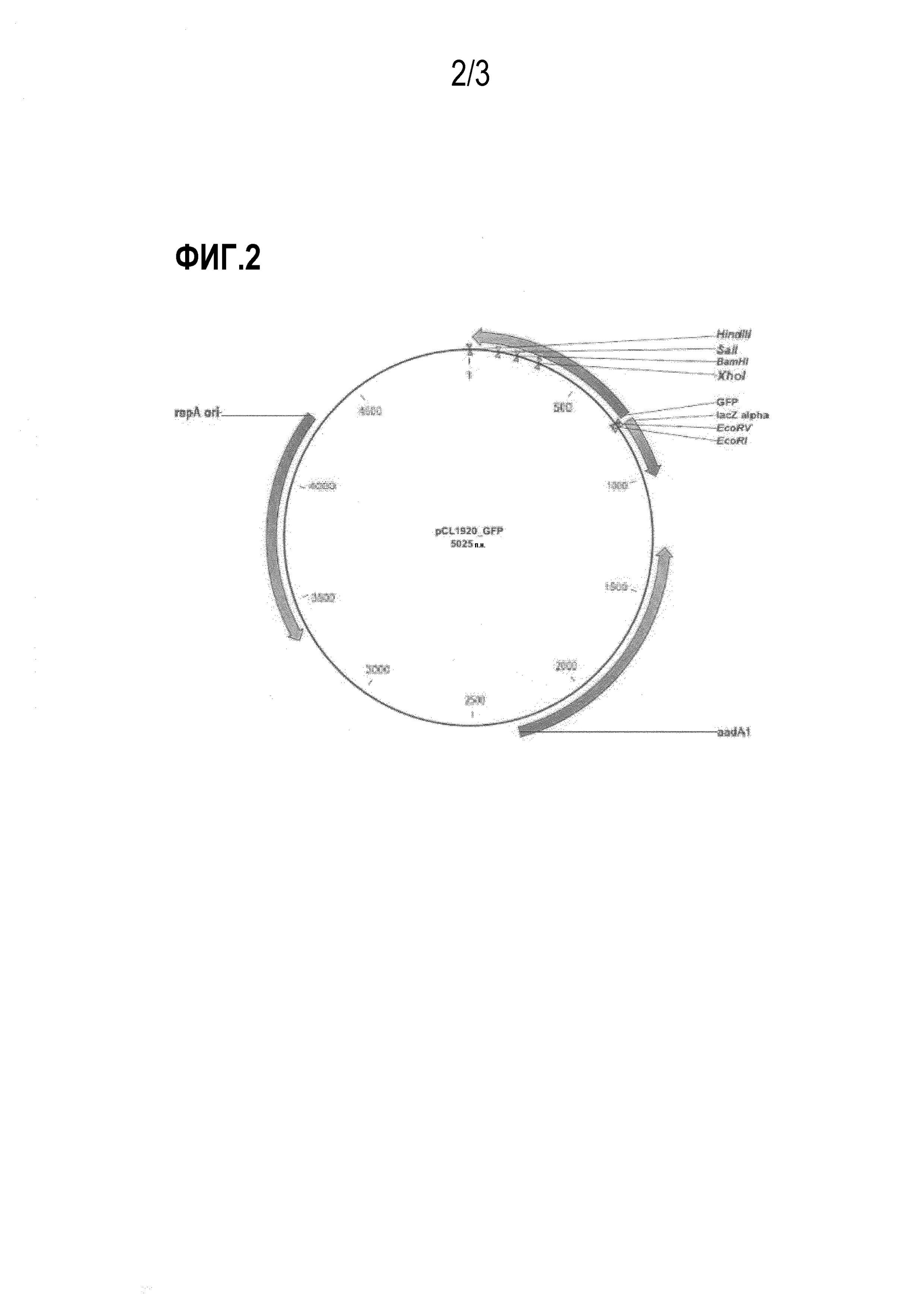
На фиг. 2 показан вектор PCL-GFP, применяемый для оценки интенсивности экспрессии регуляторной области триптофанового оперона.
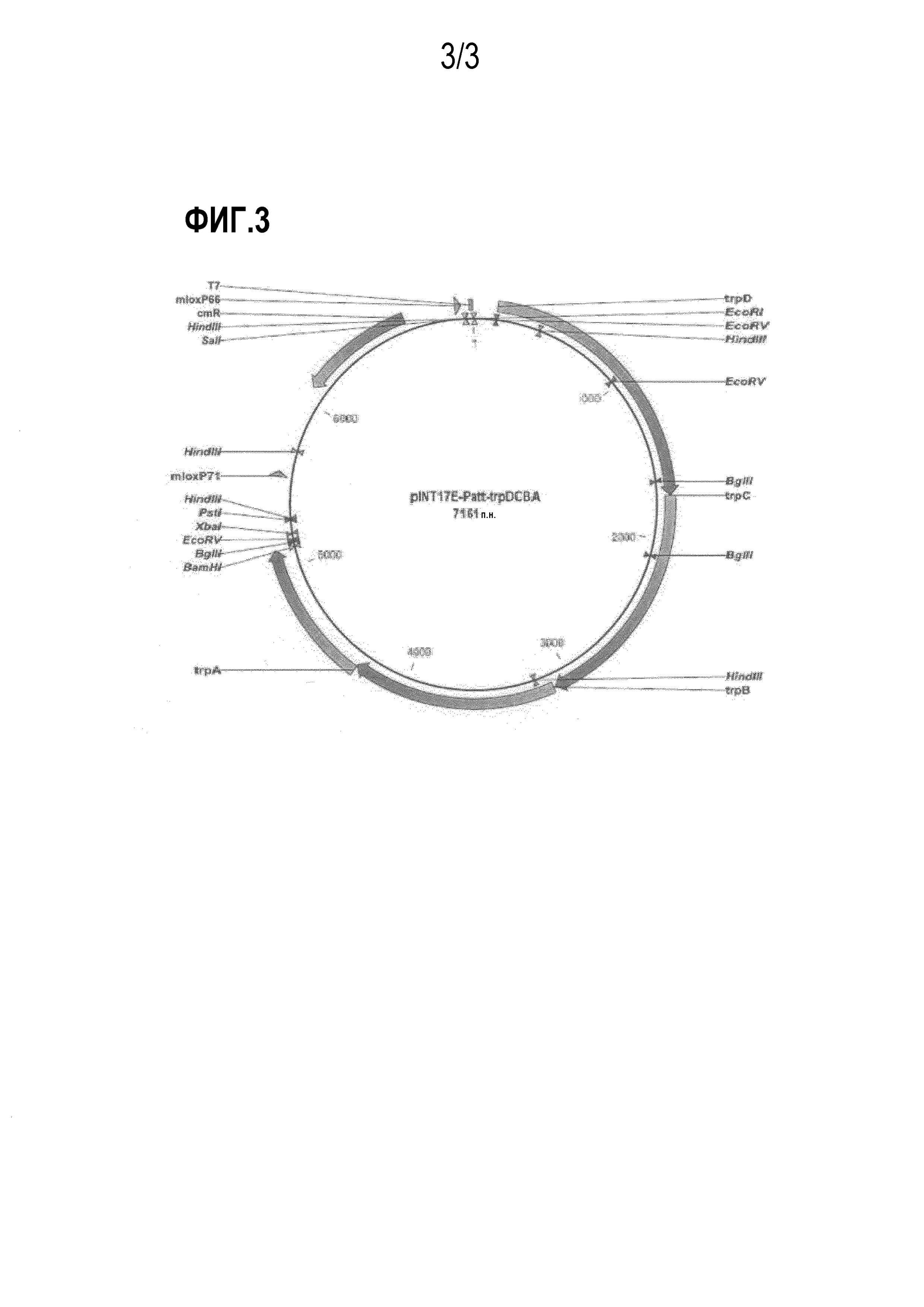
На фиг.3 показан вектор pIMT17E-Patt-trpDCBA, используемый для введения генов trpDCBA биосинтеза триптофана в хромосому с целью повышения числа копий генов.
Способ осуществления настоящего изобретения
Ниже приводится подробное описание настоящего изобретения.
Один вариант осуществления настоящего изобретения относится к рекомбинантному микроорганизму из рода Escherichia, обладающему усиленной способностью к продукции L-триптофана, который был модифицирован с целью удаления, части или полностью, лидерного пептида, имеющего нуклеотидную последовательность SEQ ID NO: 2, в регуляторной области экспрессии с нуклеотидной последовательностью SEQ ID NO: 1 на эндогенном триптофановом опероне.
В контексте настоящего описания, термин «триптофановый оперон» или «Trp оперон» обозначает полный оперон, включающий все trpEDCBA гены. Триптофановый оперон имеет нуклеотидную последовательность SEQ ID NO: 9.
L-триптофан-продуцирующий микроорганизм, который может использоваться в настоящем изобретении, может представлять собой любой прокариотический или эукариотический микроорганизм, главное, чтобы он обладал способностью продуцировать L-триптофан. Примеры такого микроорганизма могут включать микроорганизмы из рода Escherichia, из рода Erwinia, из рода Serratia, из рода Providentia. из рода Corynebacterium и рода Brevibacterium. Конкретно, рассматриваемый микроорганизм относится к роду Escherichia и более конкретно, к Escherichia coli. И еще более точно, штамм E.coli по настоящему изобретению может представлять собой штамм, полученный за счет повышения активностей ферментов биосинтеза триптофана, таких как антранилатсинтаза (TrpE), антранилат-PRPP-трансфераза (TrpD), фосфорибозилантранилатизомераза (TrpC) или триптофансинтаза (TrpA, TrpB), при сохранении активности 3-дезокси-D-арабино-гептулозонат-7-фосфатсинтазы (aroG), которая оказывает ингибирование по типу обратной связи, путем усиления активностей ферментов на пути биосинтеза ароматических аминокислот, таких как 3-дегидрохинатсинтетаза (AroB), шикиматдегидрогеназа (AroE) или хоризматсинтаза (AroC), усиления активности фосфоглицератдегидрогензы (SerA) или транскетолазы (TktA) с целью увеличения притока интермедиатов, серина и PRPP на пути биосинтеза триптофана. Кроме того, штамм E. coli по настоящему изобретению может представлять собой штамм, полученный путем инактивации ферментов префенатдегидратазы и хоризматмутазы (PheA) на пути биосинтеза ароматических соединений или инактивации ферментов префенатдегидрогенатазы, хоризматмутазы (tyrA), триптофаназы (tnaA) и переносчика триптофана (tnaB, mtr).
Более конкретно, рекомбинантный микроорганизм по настоящему изобретению представляет собой рекомбинантный штамм E. coli CA04-2004 (номер доступа: KCCM11246P).
В контексте настоящего описания, термин "регуляторная область экспрессии" эндогенного триптофанового оперона обозначает область, включающую промотор, лидерный пептид и эндогенный аттенюатор. Конкретно, регуляторная область экспрессии содержит нуклеотидную последовательность SEQ ID NO: 1.
В контексте настоящего описания, термин "лидерный пептид" обозначает низкомолекулярный пептид, который кодируется лидерной последовательностью, локализованной в направлении считывания информации от стартового кодона гена. Конкретно, указанный лидерный пептид описывается нуклеотидной последовательностью SEQ ID NO: 2, a полипептид, который экспрессируется на основе сигнальной последовательности указанного лидерного пептид, имеет нуклеотидную последовательность SEQ ID NO: 4. Указанный лидерный пептид участвует в формировании шпилечной структуры, когда концентрация триптофана становится высокой, что способствует созданию структуры эндогенного аттенюатора, действующего в направлении терминации транскрипции генов биосинтеза триптофана.
В контексте настоящего описания, термин "делеция/делетировать" обозначает удаление, части или полностью, любой нуклеотидной последовательности на участке от стартового кодона до стоп-кодона целевого гена или нуклеотидной последовательности в соответствующей для него регуляторной области, из хромосомы.
Настоящее изобретение, в одном своем аспекте, также относится к рекомбинантному микроорганизму из рода Escherichia, который также был модифицирован путем делетирования, части или полностью, эндогенного аттенюатора, имеющего нуклеотидную последовательность SEQ ID NO: 3, для целей усиления его способности к продукции L-триптоофана.
В контексте настоящего описания, термин "эндогенный аттенюатор" обозначает область с нуклеотидной последовательностью SEQ ID NO: 3, где в регуляторной области экспрессии отсутствуют промотор и лидерный пептид, с целью ослабления функции данного механизма.
Настоящее изобретение, в одном своем аспекте, также относится к микроорганизму из рода Escherichia, который также был модифицирован с целью повышения активностей белков, кодируемых триптофановым опероном.
Настоящее изобретение, в одном своем аспекте, также относится к микроорганизму из рода Escherichia, который был дополнительно модифицирован с целью повышения активностей белков, кодируемых кластером генов биосинтеза триптофана trpDCBA, за исключением гена trpE, кодирующего антранилатсинтазу.
В тексте настоящего описания, термин "кластер генов биосинтеза триптофана" обозначает кластер генов, состоящий из двух или более генов из числа указанных ниже: trpD, trpC, trpB и trpA, относящихся к генам триптофанового оперона. Конкретно, кластер генов биосинтеза триптофана может представлять собой генный кластер trpDCBA, имеющий нуклеотидную последовательность SEQ ID NO: 10. Согласно настоящему описанию, ген trpD кодирует белок с аминокислотной последовательностью SEQ ID NO: 37; ген trpC кодирует белок с аминокислотной последовательностью SEQ ID NO: 38; ген trpB кодирует белок с аминокислотной последовательностью SEQ ID NO: 39; и ген trpA кодирует белок с аминокислотной последовательностью SEQ ID NO: 40.
Повышение активности кластера генов биосинтеза триптофана, за исключением антранилатсинтазы, которая кодируется геном trpE из триптофанового оперона, осуществляется с целью решения проблемы, которая заключается в том, что выход продуцируемого триптофана не возрастает из-за накопления антранилата, при усилении функции триптофанового оперона.
Способы усиления экспрессии генов включают:
1) способ повышения числа копий хромосомальных или внутриклеточных генов; или 2) способ замещения хромосомального промотора в генах сильным экзогенным промотором или модификации хромосомального промотора сильным промотором.
Примеры способа, основанного на повышении числа копий генов, включают способ введения гена в вектор для усилении экспрессии гена. Примеры вектора, который может использоваться согласно настоящему изобретению, включают плазмидные векторы, такие как pBR, pUC, pBluescriptII, pGEM, pTZ, pCL и плазмиды типа pET. Векторы, которые могут использоваться в настоящем изобретении, конкретно не ограничиваются, и могут использоваться любые известные векторы экспрессии. В частности, могут использоваться pACYC177, pACYC184, pCL, pECCG117, pUC19, pBR322 или pMW118 векторы. Более конкретно, могут использоваться pACYC177, pCL и pCC1BAC векторы.
Примеры экзогенного промотора, который может использоваться в настоящем изобретении, включают без ограничения известные промоторы, такие как trc, lac и tac промоторы. Кроме того, может проводиться модификация хромосомального промотора сильным промотором путем делетирования, части или полностью, лидерного пептида и/или дополнительно делетирования, части или полностью, эндогенного аттенюатора, описанного выше, но не ограничивается указанным вариантом.
В конкретном варианте осуществления настоящего изобретения рекомбинантный L-триптофан-продуцирующий микроорганизм из рода Escherichia получают путем делетирования, части или полностью, лидерного пептида, имеющего нуклеотидную последовательность SEQ ID NO: 2, в регуляторной области экспрессии, имеющей нуклеотидную последовательность SEQ ID NO: 1, на эндогенном триптофановом опероне, и делетирования, части или полностью, эндогенного аттенюатора, имеющего нуклеотидную последовательность SEQ ID NO: 3, с целью усиления способности к продукции L-триптофана. Кроме того, рекомбинантный L-триптофан-продуцирующий микроорганизм получают дополнительно путем повышения активностей белков, имеющих аминокислотные последовательности SEQ ID NO: 37, 38, 39 и 40, которые кодируются кластером генов биосинтеза триптофана trpDCBA, за исключением trpE гена, кодирующего антранилатсинтазу. Полученный рекомбинантный микроорганизм был депонирован в депозитарии с номером доступа KCCM11246P.
Другой аспект осуществления настоящего изобретения относится к способу получения L-триптофана, включающему культивирование рекомбинантного L-триптофан-продуцирующего микроорганизма из рода Escherichia, обладающего усиленной способностью к продукции L-триптофана.
В конкретном аспекте, настоящее изобретение относится к способу, включающему культивирование рекомбинантного L-триптофан-продуцирующего микроорганизма из рода Escherichia, обладающего усиленной способностью к продукции L-триптофана, который был модифицирован путем делетирования, части или полностью, лидерного пептида, имеющего нуклеотидную последовательность SEQ ID NO: 2, в регуляторной области экспрессии, имеющей нуклеотидную последовательность SEQ ID NO: 1, на эндогенном триптофановом опероне, и делетирования, части или полностью, эндогенного аттенюатора, имеющего нуклеотидную последовательность SEQ ID NO: 3, с целью усиления способности указанного микроорганизма к продукции L-триптофана, и дополнительно за счет повышения активностей белков, которые кодируются триптофановым опероном, путем усиления экспрессии кластера генов биосинтеза триптофана trpDCBA, за исключением trpE гена, кодирующего антранилатсинтазу.
Состав среды и условия культивирования, используемые для культивирования микроорганизма по настоящему изобретению, могут соответствовать любым такого рода вариантам, используемым при культивировании микроорганизмов из рода Escherichia, которые будут отвечать потребностям микроорганизма по настоящему изобретению. Конкретно, микроорганизм по настоящему изобретению может культивироваться в стандартной среде, содержащей подходящие источники азота, аминокислот, витаминов и т.п., в аэробных условиях, при соответствующей корректировке значений температуры, рН и т.п.
Источники углерода, которые могут использоваться согласно настоящему изобретению, включают углеводы, такие как глюкоза, фруктоза, сахароза, мальтоза, маннит, сорбит; спирты, такие как сахарный спирт, глицерин, пировиноградную кислоту, молочную кислоту и лимонную кислоту; и аминокислоты, такие как органическая кислота, глютаминовая кислота, метионин и лизин. Кроме того, могут использоваться природные органические питательные источники, гидролизаты крахмала, меласса, сырая меласса, рисовые отруби, маниок, жом сахарного тростника и жидкий кукурузный экстракт. Конкретно, могут использоваться углеводы, такие как глюкоза и стерильная обработанная меласса (т.e., меласса, превращенная в редуцирующие сахара). Кроме того, могут использоваться без ограничения соответствующие количества других источников углерода.
Источники азота, которые могут использоваться согласно настоящему изобретению, включают источники неорганического азота, такие как аммиак, сульфат аммония, хлорид аммония, ацетат аммония, карбонат аммония и нитрат аммония; аминокислоты, такие как глютаминовая кислота, метионин и глютамин; и источники органического азота, такие как пептон, NZ-амин, мясной экстракт, дрожжевой экстракт, солодовый экстракт, жидкий кукурузный экстракт, гидролизат казеина, рыбная мука или продукт ее переваривания, обезжиренный соевый жмых или продукт его переваривания и т.п. Указанные источники азота могут использоваться по отдельности или в сочетании.
Среда может содержать, в качестве источника фосфора, одноосновный фосфат калия, двухосновный фосфат калия и соответствующие натрийсодержащие соли. Неорганические соединения, которые могут использоваться согласно настоящему изобретению, включают хлорид натрия, хлорид кальция, хлорид железа, сульфат магния, сульфат железа, сульфат марганца и карбонат кальция. Кроме того, указанная среда может содержать аминокислоты, витамины и соответствующие предшественники. Указанные источники или предшественники могут добавляться к среде периодически или непрерывно.
К среде в ходе культивирования, в соответствующем режиме, могут добавляться такие соединения, как гидроксид аммония, гидроксид калия, аммиак, фосфорная кислота и серная кислота, для коррекции pH в культуральной среде. Кроме того, в процессе культивирования может использоваться пеногаситель, такой как сложный эфир полигликоля и жирной кислоты, для подавления образования пузырьков газа. Дополнительно, для поддержания культуральной среды в аэробном состоянии, в указанную культуральную среду может инъецироваться кислород или кислородсодержащий газ.
Соответственно, для поддержания культуральной среды в анаэробном или неаэробном состоянии, газ либо не инъецируют, либо может проводиться инъекция газообразного азота, водорода или диоксида углерода в культуральную среду.
В типичном случае, культуральная среда поддерживается при температуре от 27°C до 37°C, и в частности, в диапазоне значений от 30°C до 35°C. Культивирование микроорганизма может продолжаться до достижения желательного уровня нужного вещества. В частности, длительность культивирования может составлять 10-100 часов.
Способ по настоящему изобретению может также включать очистку или выделение L-аминокислоты, полученной на стадии культивирования. Указанный процесс очистки или выделения может проводиться путем очистки или выделения нужной L-аминокислоты из культуральной среды с использованием соответствующего способа, например, периодического, непрерывного культивирования или в условиях культивирования с подпиткой.
Далее, настоящее изобретение будет описано более подробно, со ссылкой на соответствующие примеры. В этой связи следует отметить, что приведенные примеры даны лишь для целей пояснения и никоим образом не ограничивают область настоящего изобретения.
Примеры
Пример 1: Конструирование вектора слияния, включающего GFP и регуляторную область экспрессии, из которой был удален лидерный пептид, с тем чтобы ослабить регуляцию экспрессии при биосинтезе триптофана
Как показано на фиг. 1, для амплификации регуляторной области экспрессии, включающей делецию trpL гена, кодирующего лидерный пептид (L) (регуляторная область экспрессии далее обозначается как "DtrpL", в соответствии с фиг. 1С) в регуляторной области экспрессии триптофанового оперона, которая состоит из промотора (P), лидерного пептида (L) и аттенюатора (A), проводят полимеразно-цепную реакцию (далее обозначаемую как "ПЦР") с использованием, в качестве матрицы, хромосомной ДНК из E. coli, штамм W3110 (полученный из Американской Коллекции типовых культур (American Type Culture Collection) (ATCC); номер доступа в GenBank AC000091).
Конкретно, проводят амплификацию фрагмента размером 155 п.н, содержащего сайт рестрикции для KpnI рестриктазы на 5'-участке, в рамках ПЦР, Pfu-полимеразой с использованием праймеров 1 и 2, в следующих условиях: 30 циклов, каждый из которых включает: денатурацию при температуре 94°C в течение 1 минуты, отжиг при температуре 58°C в течение 30 секунд и расширение при температуре 72°C в течение 30 секунд. Тогда как фрагмент размером 105 н.п., содержащий сайт рестрикции для рестриктазы EcoRV на 3'-участке, амплифицируют в ходе ПЦР с использованием праймеров 3 и 4, в указанных выше условиях. Полученные фрагменты ДНК выделяют с использованием набора GeneAllR Expin™ GEL SV (Seoul, Korea) и затем используют в качестве матрицы для перекрестной ПЦР.
Для создания DtrpL, проводят перекрестную ПЦР с использованием двух фрагментов ДНК, в качестве матрицы, и праймеров 1 и 4. Конкретно, проводят амплификацию фрагмента размером 245 н.п. (SEQ ID NO: 5) в рамках ПЦР, в указанных выше условиях. Амплифицированный фрагмент обрабатывают рестриктазами KpnI и EcoRV и затем лигируют с использованием pCL1920GFP (SEQ ID NO: 8), который был обработан теми же рестриктазами, что приводит к получению pCL-DtrpL_GFP.
Для амплификации регуляторной области экспрессии, включающей делецию генов, кодирующих лидерный пептид (L) и аттенюатор (A) (регуляторная область экспрессии далее называется как "Dtrp_att") в регуляторной области экспрессии триптофанового оперона, проводят амплификацию фрагмента размером 148 н.п. (SEQ ID NO: 6), содержащего сайт рестрикции для KpnI рестриктазы на 5'-участке и сайт рестрикции для рестриктазы EcoFV на 3'-участке, путем ПЦР, с использованием хромосомальной ДНК из E. сoli, штамм W3110, в качестве матрицы, и праймеров 1 и 5. Амплифицированные фрагменты обрабатывают рестриктазами KpnI и EcoRV, после чего лигируют с использованием pCL1920GFP, который был обработан теми же рестриктазами, что приводит к получению pCL-Dtrp_att-GFP.
Кроме того, для создания вектора экспрессию, имеющего регуляторную область экспрессии дикого типа, с целью использования его в последующих экспериментах, проводят амплификацию фрагмента размером 290 н.п., содержащего сайт рестрикции для KpnI рестриктазы на 5'-участке и сайт рестрикции для рестриктазы EcoRV на 3'-участке, путем ПЦР с использованием хромосомальной ДНК из E. сoli, штамм W3110, в качестве матрицы, и праймеров 1 и 4. Амплифицированный фрагмент обрабатывают рестриктазами KpnI и EcoRV, после чего лигируют с использованием pCL1920GFP, который был обработан теми же рестриктазами, что приводит к получению pCL-Ptrp-GFP.
Праймер 1: 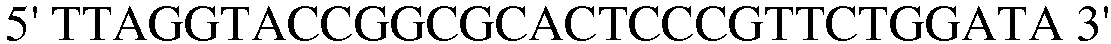 (SEQ ID NO: 11);
(SEQ ID NO: 11);
Праймер 2: 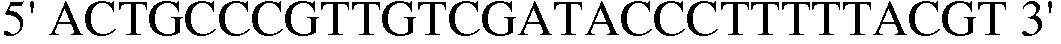 (SEQ ID NO: 12);
(SEQ ID NO: 12);
Праймер 3: 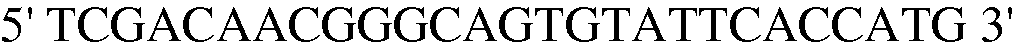 (SEQ ID NO: 13);
(SEQ ID NO: 13);
Праймер 4: 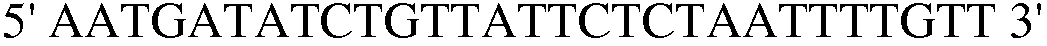 (SEQ ID NO: 14);
(SEQ ID NO: 14);
Праймер 5: 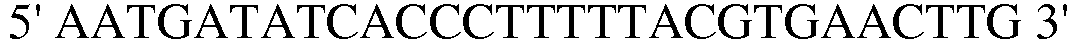 (SEQ ID NO: 15).
(SEQ ID NO: 15).
Пример 2: Определение уровня экспрессии GFP
Каждый из векторов: pCL-DtrpL_GFP, pCL-Dtrp_att-GFP и pCL-Ptrp_GFP, полученных в примере 1, трансформировали в E. сoli штамм W3110, дикий тип, и в триптофан-продуцирующий штамм E.coli KCCM10812P, после чего измеряли интенсивность GFP в этих штаммах.
В данном примере использовали родительский штамм E. coli KCCM10812P (патент Кореи, регистрационный номер No. 10-0792095), который представляет собой штамм, полученный из E.coli variant, обладающего способностью к продукции L-фенилаланина (KFCC 10066, публикация по патенту Кореи No. 1985-0001232). Конкретно, штамм KCCM10812P представляет собой рекомбинантный штамм E. coli, обладающий способностью к продукции L-триптофана, где указанный штамм был модифицирован для восстановления ауксотрофности по триптофану, с тем чтобы инактивировать гены pheA, trpR, mtr и tnaAB, а также с целью мутации генов aroG и trpE.
Конкретно, каждый из указанных штаммов инокулировали в 25 мл среды M9 (содержащей 0,5% глюкозы + 2 г/л дрожжевого экстракта и содержащей дополнительно 0,1 г/л тирозина и 0,1 г/л фенилаланина, в случае KCCM10812) в колбе на 250 мл, при соотношении объемов 1/100 (объем/объем), и культивировали при температуре 37°C до достижения заданного значения OD. Полученные в результате культивирования штаммы отделяли центрифугированием и промывали с использованием 1×TE, после чего измеряли уровень GFP с использованием счетчика для микропланшетов Synergy HT Multi-Mode Microplate Reader (Biotek, USA).
Ниже, в Таблице 1 показаны результаты проведенных измерений. Показатели OD1 и OD3 в Таблице 1 указывают значения OD, полученные при длине волны 600 нм с использованием УФ спектрофотометра mini-1240 (Shimadzu), после разбавления каждого из культуральных продуктов до соответствующей концентрации.
Как показано на фиг. 1, в случае штамма дикого типа W3110, относительно показателя для Ptrp, принятого за 1, относительная интенсивность Dtrp_att (включающего делецию лидерного пептида и аттенюатора) превышала в 7 раз значение OD для 1 (OD1) и в 10 раз превышало значение OD для 3 (OD3), b относительная интенсивность DtrpL, включающего делецию только лидерного пептида, была в 1,5-2 раза выше таковой для регуляторной области дикого типа (Ptrp). Тогда как, в сравнении с этим вариантом, в случае L-триптофан-продуцирующего штамма KCCM10812P, относительно значения для Ptrp, принятого за 1, относительная интенсивность Dtrp_att (включающего делецию лидерного пептида и аттенюатора) примерно в 19 раз превышала значение OD для 1 (OD1) и в 27 раз превышала значение OD для 3 (OD3), а относительная интенсивность DtrpL, включающего делецию только лидерного пептида, была примерно в 4 раза выше таковой для регуляторной области дикого типа (Ptrp). Таким образом, полученные результаты показывают, что делеция лидерного пептида или аттенюатора ведет к повышению уровня экспрессиии, хотя это повышение уровня экспрессии в штамме дикого типа слабее, чем в L-триптофан-продуцирующем штамме.
|
Пример 3: Конструирование векторов, содержащих триптофановый оперон (trpEDCBA), в котором регуляторная область экспрессии содержит замещение
На основании результатов, полученных в примере 2, с целью конструирования штамма E. coli, в котором гены триптофанового оперона были усилены за счет использования вектора, проводили амплификацию фрагмента размером 6564 н.п. (SEQ ID NO: 9) с использованием хромосомальной ДНК родительского штамма E. coli KCCM10812P, в качестве матрицы, и праймеров 6 и 7, в рамках ПЦР в описанных выше условиях.
Амплифицированный фрагмент ДНК выделяют с использованием набора GeneAllR Expin™ GEL SV (Seoul, Korea), после чего расщепляют рестриктазами EcoRV и HindIII. Для клонирования полученного фрагмента ДНК, каждый из векторов: pCL-Dtrp_att-GFP, pCL-DtrpL_GFP и pCL-Ptrp_GFP, обрабатывают рестриктазами EcoRV и HindIII, с тем чтобы удалить область GFP, что приводит к получению фрагментов размеров 4291 п.н. Далее, проводят лигирование каждого из полученных векторов с инсерционным сегментом и вводят путем трансформации в E. coli DH5a, получая таким образом конструкции pCL-Dtrp_att-trpEDCBA, pCL-DtrpL_trpEDCBA и pCL-Ptrp_trpEDCBA векторов.
Праймер 6: 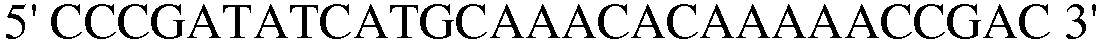 (SEQ ID NO: 16);
(SEQ ID NO: 16);
Праймер 7: 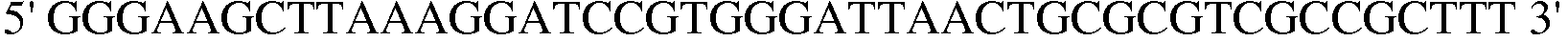 (SEQ ID NO: 17).
(SEQ ID NO: 17).
Пример 4: Конструирование векторов, в которых была замещена регуляторная область экспрессии и которые содержат кластер генов биосинтеза триптофана (trpDCBA), за исключением trpE
Для конструирования векторов путем замещения GFP области в pCL-Dtrp_att-GFP, pCL-DtrpL_GFP и pCL-Ptrp_GFP векторах, полученных по процедуре примера 1 на основе trpDCBA, каждый из векторов: pCL-Dtrp_att-GFP, pCL-DtrpL_GFP и pCL-Ptrp_GFP, обрабатывают рестриктазами EcoRV и HindIII для удаления области GFP, получая в итоге фрагменты размером 4291 п.н.
Далее, с целью конструирования штаммов E. сoli, в которых trpDCBA гены в триптофановом опероне были усилены, используя вектор, фрагмент размером 5002 п.н. (SEQ ID NO: 10) амплифицируют с использованием ДНК из родительского штамма E.coli KCCM10812P, в качестве матрицы, и праймеров 7 и 8.
Амплифицированный фрагмент ДНК выделяют с использованием набора GeneAllR Expin™ GEL SV (Seoul, Korea), после чего обрабатывают рестриктазами EcoRV и HindIII. Полученные векторы и инсерционный сегмент лигируют друг с другом и вводят путем трансформации в E. coli DH5a, получая конструкции векторов pCL-Dtrp_att-trpDCBA, pCL-DtrpL_trpDCBA и pCL-Ptrp_trpDCBA.
Праймер 8:
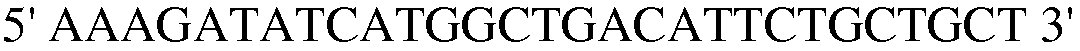 (SEQ ID NO: 18).
(SEQ ID NO: 18).
Пример 5: Конструирование векторов, содержащих низкое число копий генов триптофанового оперона, включающих различные регуляторные области экспрессии
Типичным вектором, который экспрессируется с низким числом копий в E. coli, является вектор pCC1BAC (Epicentre, USA). С целью экспрессии генов триптофанового оперона с низким числом копий при использовании данного вектора, векторы pCL-Dtrp_att-trpEDCBA, pCL-DtrpL_trpEDCBA, pCL-Ptrp_trpEDCBA, pCL-Dtrp_att-trpDCBA, pCL-DtrpL_trpDCBA и pCL-Ptrp_trpDCBA, полученные по процедурам примеров 3 и 4, расщепляют рестриктазой HindIII.
Полученные фрагменты ДНК разделяют электрофорезом на агарозном геле и затем вырезают, в соответствии с размером каждого из них, и выделяют с использованием набора GeneAllR Expin™ GEL SV (Seoul, Korea). Далее, каждый из полученных фрагментов лигируют с вектором pCC1BAC (расщепленным по сайту HindIII), после чего вводят в E. coli DH5a по методу трансформации.
Каждый из трансформированных штаммов наносят мазком на твердую среду LB Cm (агаровая пластина LB + хлорамфеникол) и отбирают штаммы, демонстрирующие Cm-резистентность (резистентность к хлорамфениколу), получая конструкции векторов pBAC-Dtrp_att-trpEDCBA, pBAC-DtrpL_trpEDCBA, pBAC-Ptrp_trpEDCBA, pBAC-Dtrp_att-trpDCBA, pBAC-DtrpL_trpDCBA и pBAC-Ptrp_trpDCBA.
Пример 6: Конструирование штамма E. coli, в котором инактивирован ген pheA
Для конструирования штамма, близкого к триптофан-продуцирующему штамму, на основе дикого штамма E. coli W3110, ген pheA (NCBI ген ID: 12934467), кодирующий хоризматмутазу/префенатдегидратазу (CM-PDT), инактивировали путем делеции, создаваемой по методу гомологичной рекомбинации. CM-PDT представляет собой фермент, функционирующий на первой стадии образования фенилаланина из хоризмата, и делеция гена pheA была использована для ингибирования пути биосинтеза фенилаланина. Для создания такой делеции, использовали одностадийный метод мутагенеза (разработанный Datsenko KA et al.), включающий использование red-рекомбиназы из лямбда вируса (One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products, Datsenko KA, Wanner BL., Proc Natl Acad Sci USA. 2000 Jun 6; 97 (12):6640-5). В качестве маркера, подтверждающего вставку в гены, использовали хлорамфеникол-резистентный ген из pUCprmfmloxC (выложенная публикация по патенту Кореи No. 2009-0075549).
Генный фрагмент размером примерно 1200 п.н. амплифицировали методом ПЦР с использованием вектора pUCprmfmloxP, в качестве матрицы, и праймеров 9 и 10, которые представляют собой часть гена pheA и часть нуклеотидной последовательности хлорамфеникол-резистентного гена из вектора pUCprmfmloxP.
Праймер 9:
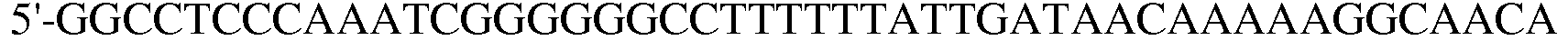
 (SEQ ID NO: 19);
(SEQ ID NO: 19);
Праймер 10:
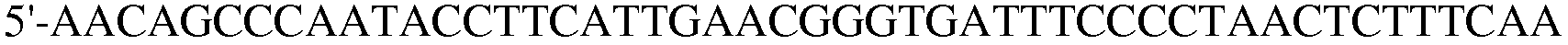
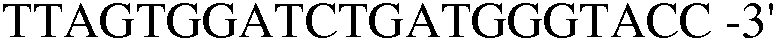 (SEQ ID NO: 20).
(SEQ ID NO: 20).
Фрагмент ДНК, полученный путем ПЦР-амплификации, разделяли электрофорезом на 0,8% агарозном геле, затем элюировали и использовали в качестве матрицы для вторичной ПЦР. Вторичную ПЦР проводили таким образом, чтобы 5'- и 3'- участки в первичном фрагменте ДНК содержали по 5 пар комплементарных нуклеотидных оснований. Кроме того, по процедуре ПЦР амплифицировали генный фрагмент размером примерно 1300 п.н. с использованием, в качестве матрицы, продукта, элюированного после проведения первичной ПЦР, и праймеров 11 и 12, которые включают 5'- и 3'-участки гена pheA. Полученный фрагмент ДНК разделяли электрофорезом на 0,8% агарозном геле и затем элюировали и использовали для рекомбинации.
Праймер 11:
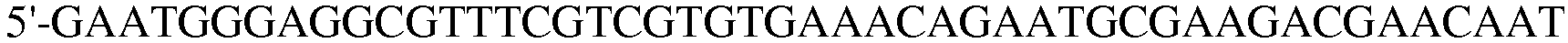
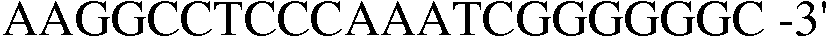 (SEQ ID NO: 21);
(SEQ ID NO: 21);
Праймер 12:
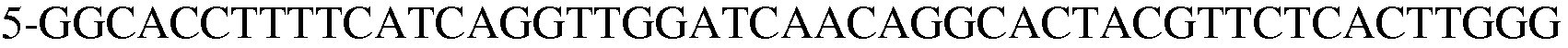
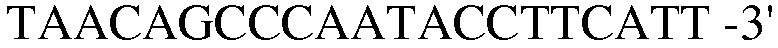 (SEQ ID NO: 22).
(SEQ ID NO: 22).
В соответствии со способом, разработанным Datsenko KA et al., был получен в компетентном состоянии штамм W3110 E. coli, трансформированный вектором pKD46, который затем трансформировали генным фрагментом размером 1300 п.н., полученным методом ПЦР. Штамм, резистентный к хлорамфениколу, был отобран на среде LB. Далее, проводили ПЦР с использованием праймеров 13 и 14, и продукт ПЦР-амплификации имел размер примерно 2500 п.н, что указывало на делецию гена pheA в этом штамме.
Праймер 13:
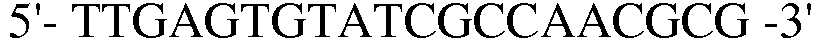 (SEQ ID NO: 23);
(SEQ ID NO: 23);
Праймер 14:
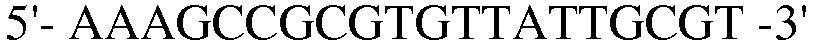 (SEQ ID NO: 24).
(SEQ ID NO: 24).
Вектор pKD46 был удален из первичного рекомбинантного штамма, обладающего резистентностью к хлорамфениколу, и затем в этот штамм был встроен вектор pJW168, и маркерный ген для хлорамфеникола был удален из этого штамма (Gene, (2000) 247,255-264). Указанный штамм представлял собой продукт, полученный путем ПЦР-амплификации с использованием праймеров 13 и 14, размер которого, равный примерно 500 п.н., указывал на делецию целевого гена. Сконструированный таким образом штамм был назван как "E. coli W3110 trpΔ1".
Пример 7: Конструирование штамма E. coli с инактивированным геном tnaAB
Из штамма E. coli W3110 trpΔ1, сконструированного в примере 6, tnaAB оперон (NCBI ген ID: 12933600, 12933602), состоящий из tnaA гена, кодирующего триптофаназу, и tnaB гена, кодирующего переносчик триптофана, был удален гомологичной рекомбинацией. В результате этой делеции, путь разложения триптофана после его образования может быть блокирован, и приток триптофана, который секретируется в среду и в клетки, может быть перекрыт, что придаст клеткам свойства триптофан-продуцирующих штаммов. Для проведения этой делеции, генный фрагмент размером примерно 1200 п.н. амплифицировали в рамках ПЦР по тому же способу, который был описан в примере 6, с использованием вектора pUCprmfmloxP, в качестве матрицы, в сочетании с праймерами 15 и 16, которые представляют собой часть гена tnaAB и часть нуклеотидной последовательности хлорамфеникол-резистентного гена из pUCprmfmloxP. Кроме того, фрагмент ДНК, полученный путем ПЦР-амплификации, далее подвергали амплификации посредством ПЦР, которую проводили по способу, описанному в примере 6, с использованием праймеров 17 и 18, получая таким образом генный фрагмент размером 1300 п.н.
Праймер 15:
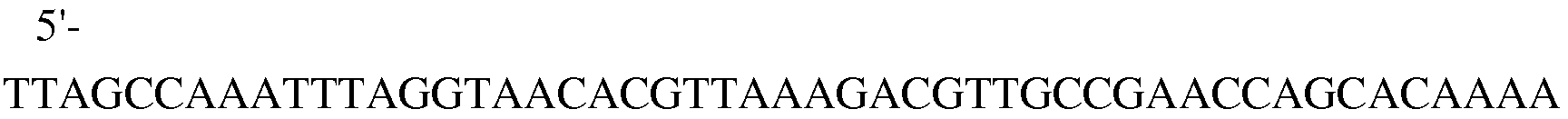
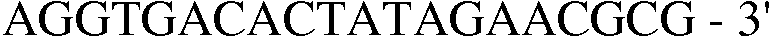 (SEQ ID NO: 25);
(SEQ ID NO: 25);
Праймер 16:

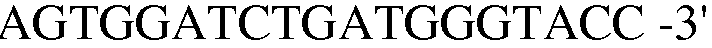 (SEQ ID NO: 26);
(SEQ ID NO: 26);
Праймер 17:
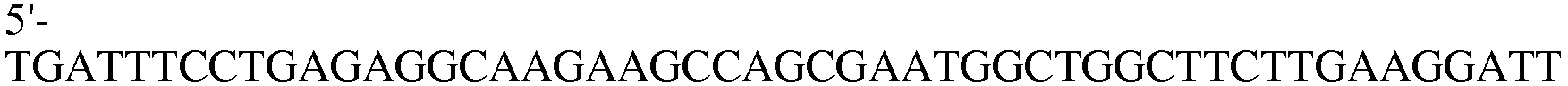
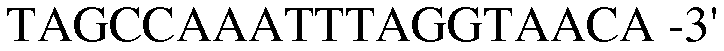 (SEQ ID NO: 27);
(SEQ ID NO: 27);
Праймер 18:

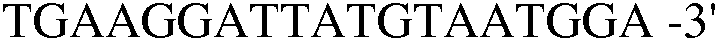 (SEQ ID NO: 28).
(SEQ ID NO: 28).
Для делетирования генов tnaAB, конструируют согласно способу, описанному в примере 6, компетентный штамм E. coli W3110 trpΔ1 со встроенным в него вектором pKD46, и далее полученный в результате ПЦР генный фрагмент размером 1300 п.н., трансформируют в штамм E. coli. Резистентный к хлорамфениколу штамм отбирали на LB среде. Затем, проводили ПЦР с использованием праймеров 19 и 20, и полученный в результате ПЦР-амплифкации продукт имел размер примерно 5400 п.н., что указывало на делецию генов tnaAB в этом штамме.
Праймер 19: 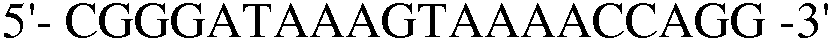 (SEQ ID NO: 29);
(SEQ ID NO: 29);
Праймер 20: 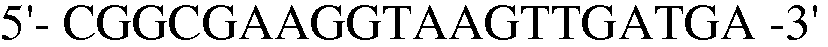 (SEQ ID NO: 30).
(SEQ ID NO: 30).
Вектор pKD46 был удален из первичного рекомбинантного штамма с резистентностью к хлорамфениколу, как было описано в примере 6, и затем маркерный ген для хлорамфеникола был удален из этого штамма. Указанный штамм представлял собой продукт, полученный путем ПЦР-амплификации, с использованием праймеров 19 и 20, размером примерно 550 п.н., что указывало на делецию целевого гена. Сконструированный таким образом штамм был назван как "E. coli W3110 trpΔ2".
Пример 8: Идентификация способности к продукции L-триптофана для штаммов, содержащих триптофановый оперон с различными характеристиками экспрессии
Штаммы E. coli трансформировали векторами, полученными согласно процедурам, описанным в примерах 3, 4 и 5. Эффекты в вариациях штамма E. сoli оценивали с использованием W3110 trpΔ2, полученного в примерах 6 и 7, в качестве родительского штамма и глюкозы в качестве источника углерода для данного штамма.
Для оценки титра, каждый штамм инокулировали платиновой петлей на твердую культуральную среду LB и растили в течение ночи. Затем одну платиновую петлю каждого штамма инокулировали в 25 мл среды, содержащей глюкозу, где состав указанной среды приведен ниже, в таблице 2. После инокуляции, каждый штамм инкубировали при температуре 37°C и 200 об/мин в течение 48 часов. Результаты показаны ниже в таблице 3. Все результаты представлены в виде среднего значения данных, полученных для трех отдельных колб.
|
|
|
Как видно из представленных выше в таблице 3, результатов, в том случае, когда родительский штамм E. coli W3110 trpΔ2 трансформировали сочетанием разных векторов, и если имело место только усиление одного триптофанового оперона, не наблюдалось положительного эффекта по выходу триптофана, поскольку происходило накопление антранилата. Тогда как штамм, модифицированный таким образом, чтобы усилить и Trp оперон, и trpDCBA, демонстрировал позитивный эффект на уровень продукции триптофана, в сравнении со штаммом, в котором был усилен только триптофановый оперон. Таким образом, было подтверждено, что снижение накопления антранилата представляет собой эффективный подход для увеличения выхода продукции L-триптофана в триптофан-продуцирующих штаммах.
Пример 9: Идентификация способности к продукции L-триптофана для штаммов, содержащих триптофановый оперон с разными характеристками экспрессии
Векторы, сконструированные по методам, описанным в примерах 3, 4 и 5, вводили в L-триптофан-продуцирующий родительский штамм E. coli KCCM10812P, с использованием сочетания, проиллюстрированного ниже в таблице 5. Титры штаммов оценивали с использованием глюкозы в качестве источника углерода. В результате выяснилось, что важно не только усиление trpDCBA, но также усиление триптофанового оперона, аналогично тому, что было показано в примере 8. Таким образом, была проведена оценка различных эффектов на триптофан-продуцирующие штаммы.
Для оценки титра каждый штамм инокулировали платиновой петлей на твердую культуральную среду LB и растили в течение ночи. Затем одну платиновую петлю каждого штамма инокулировали в 25 мл среды, содержащей глюкозу, композиция указанной среды показана ниже в таблице 4. После инокуляции каждый штамм инкубировали при температуре 37°C и 200 об/мин в течение 48 часов. Результаты показаны ниже в таблице 5. Все результаты представлены в виде среднего значения данных для трех отдельных колб.
|
|
Как видно из представленных выше в таблице 5 результатов, в том случае, когда родительский штамм E.coli KCCM10812P трансформировали сочетанием разных векторов, если имело место постоянное усиление только триптофанового оперона, не наблюдалось положительного эффекта на выход продукции трипитофана, поскольку происходило накопление антранилата. С другой стороны, оказалось, что штамм, модифицированный путем усиления триптофанового оперона с использованием вектора pCL и усиления trpDCBA с использованием вектора pBAC, демонстрирует позитивный эффект на выход продукции триптофана, в сочетании со снижением накопления антранилата, по сравнению со штаммом, в котором был усилен только триптофановый оперон. Таким образом, было подтверждено, что снижение накопления антранилата представляет собой эффективный подход для увеличения выхода продукции L-триптофана в триптофан-продуцирующих штаммах.
Пример 10: Конструирование штамма, в котором число копий в кластере генов биосинтеза триптофана trpDCBA на хромосоме увеличено и снижено накопление антранилата
На основании результатов, полученных в примере 9, с целью повышения числа копий в кластере генов биосинтеза триптофана trpDCBA на хромосоме был сконструирован вектор.
Конкретно, вектор pCL-Dtrp_att-trpDCBA, описанный в примере 5, расщепляли рестриктазами EcoRI и BamHI с получением Dtrp_att-trpDCBA, после чего проводили лигирование с pINT17E, обработанным теми же рестриктазами, с получением pINT17E-Patt-trpDCBA. Для встраивания pINT17E-Patt-trpDCBA в триптофан-продуцирующий родительский штамм E. coli KCCM10812P, с целью повышения числа копий для кластера генов биосинтеза триптофана trpDCBA, использовали pKD46, который применялся в одностадийном методе инактивации (разработанный Datsenko KA et al.), технологии мутагенеза, проводимой с использованием ред-рекомбиназы лямбда вируса, в соответствии с примером 6. В качестве маркера для подтверждения факта встраивания в гены, использовали хлорамфеникол-резистентный ген из pUCprmfmloxC. Конкретно, родительский штамм с уже встроенным в него pKD46 трансформировали с использованием pINT17E-Patt-trpDCBA и далее культивировали при температуре 37°C в течение 1-2 дней с получением колоний. Для подтверждения того, что pINT17E-Patt-trpDCBA был корректно встроен в хромосому полученных колоний, фрагмент размером примерно 2000 п.н. амплифицировали путем ПЦР с использованием праймеров 21 и 22.
Праймер 21:
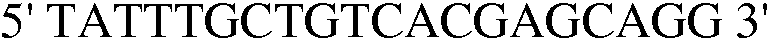 (SEQ ID NO: 31);
(SEQ ID NO: 31);
Праймер 22:
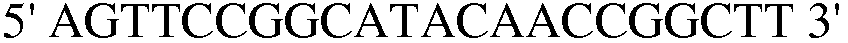 (SEQ ID NO: 32).
(SEQ ID NO: 32).
Далее pKD46 удаляли из первичного рекомбинантного штамма, обладающего резистентностью к хлорамфениколу, после чего вводили плазмиду pJW168 для удаления из штамма маркерного гена на хлорамфеникол (Gene, (2000) 247, 255-264). Продукт амплификации размером примерно 5000 п.н., полученный путем ПЦР с использованием праймеров 23 и 24, а также продукт амплификации размером примерно 6500 п.н., полученный путем ПЦР, проводимой с использованием праймеров 25 и 26, указывает на то, что во всех этих случаях trpDCBA расположен за триптофановым опероном на хромосоме. Этот штамм был назван как "KCCM10812P/trpDCBA".
Праймер 23:
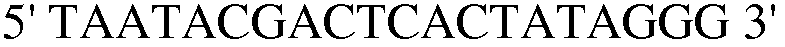 (SEQ ID NO: 33);
(SEQ ID NO: 33);
Праймер 24:
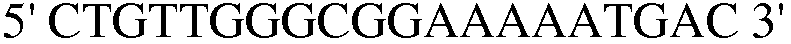 (SEQ ID NO: 34);
(SEQ ID NO: 34);
Праймер 25:
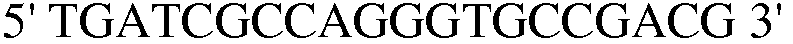 (SEQ ID NO: 35);
(SEQ ID NO: 35);
Праймер 26:
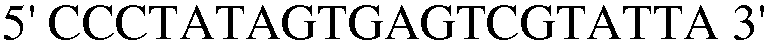 (SEQ ID NO: 36).
(SEQ ID NO: 36).
Для того чтобы встроить еще одну копию в описанный выше штамм, в котором повышено число копий trpDCBA, вводили pKD46 в полученный, как описано выше, штамм KCCM10812P/trpDCBA. После этого встраивали вектор pINT17E-Patt-trpDCBA в KCCM10812P/trpDCBA/pKD46, с получением конструкции штамма, содержащей две копии trpDCBA, встроенных в хромосому. Сконструированный таким образом штамм был назван как "KCCM10812P/2trpDCBA". Этот штамм был депонирован в Корейском Центре культур микроорганизмов (Korean Culture Center of Microorganisms; 361-221, Hongje 1-dong, Seodaemun-gu, Seoul, Korea), в отделении международного депозитария, 29 декабря 2011 г., с номером доступа KCCM11246P.
Пример 11: Оценка эффекта L-триптофан-продуцирующего штамма с повышенной активностью белков, которые кодируются кластером генов биосинтеза триптофана trpDCBA
Согласно процедуре способа, описанного в примере 10, оценивали титр штамма KCCM10812P/trpDCBA с использованием глюкозы в качестве источника углерода. Штамм KCCM10812P/trpDCBA был получен при дополнительном встраивании trpDCBA в триптофан-продуцирующий штамм E. coli KCCM10812P с целью усиления активности ряда ферментов на пути биосинтеза триптофана.
Для определения титра указанный штамм инокулировали платиновой петлей на твердую культуральную среду LB и культивировали в течение ночи. После этого инокулировали одну платиновую петлю культуры данного штамма в колбу на 25 мл со средой, используемой в данной методике оценки титра, где композиция среды описана выше в таблице 4. После инокуляции штамм культивировали при температуре 37°C и 200 об/мин в течении 48 часов. Результаты приведены ниже в таблице 6. Все результаты представлены в виде среднего значения данных, полученных для трех отдельных колб.
|
Как следует из данных приведенной выше таблицы 6, в том случае, когда одну копию кластера генов биосинтеза триптофана trpDCBA встраивали в хромосому, концентрация антранилата снижалась на 39% по сравнению с данным показателем в родительском штамме. Однако, когда две копии встраивали в хромосому, концентрация антранилата снижалась на 69% по сравнению с его значением в родительском штамме.
Кроме того, концентрация L-триптофана в двух исследованных штаммах повышалась на 10% и 13%, соответственно. Как показано выше в таблице 6, при увеличении числа копий trpDCBA уровень потребления глюкозы в некоторых случаях несколько снижается, но усиление кластера генов биосинтеза триптофана оказывало позитивный эффект в плане повышения концентрации L-триптофана и снижения концентрации антранилата.
Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные репрезентативные варианты его осуществления, специалисты в той области, к которой относится настоящее изобретение, могут выбрать и использовать другие конкретные формы его осуществления, без отступления от технических принципов или существенных характеристик настоящего изобретения. В этой связи все описанные выше варианты осуществления настоящего изобретения следует рассматривать как иллюстративные, поясняющие, во всех аспектах, но не ограничивающие. При этом область настоящего изобретения определяется прилагаемой формулой изобретения, а не его подробным описанием, и следует понимать, что все модификации или вариации, полученные на основе принципов и соответствующие области настоящего изобретения, а также их эквиваленты включаются в область прилагаемой формулы изобретения.
Номер доступа в международном отделе депозитария: Корейский Центр культур микроорганизмов (международный отдел депозитария) (Korean Culture Center of Microorganisms (international)) Номер доступа (Accession Number: KCCM1124 6P Дата депонирования: 29 декабря 2011 г.