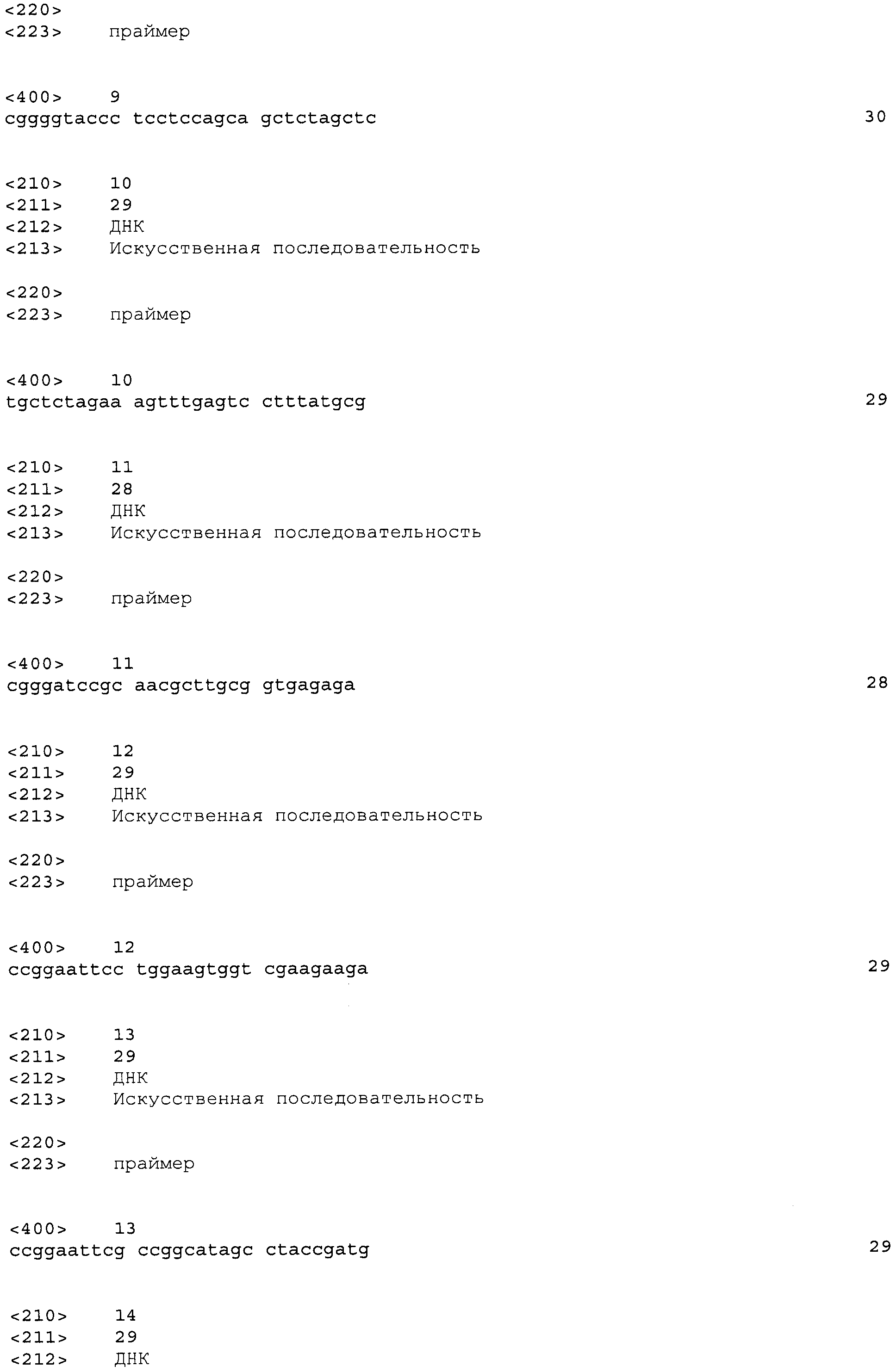
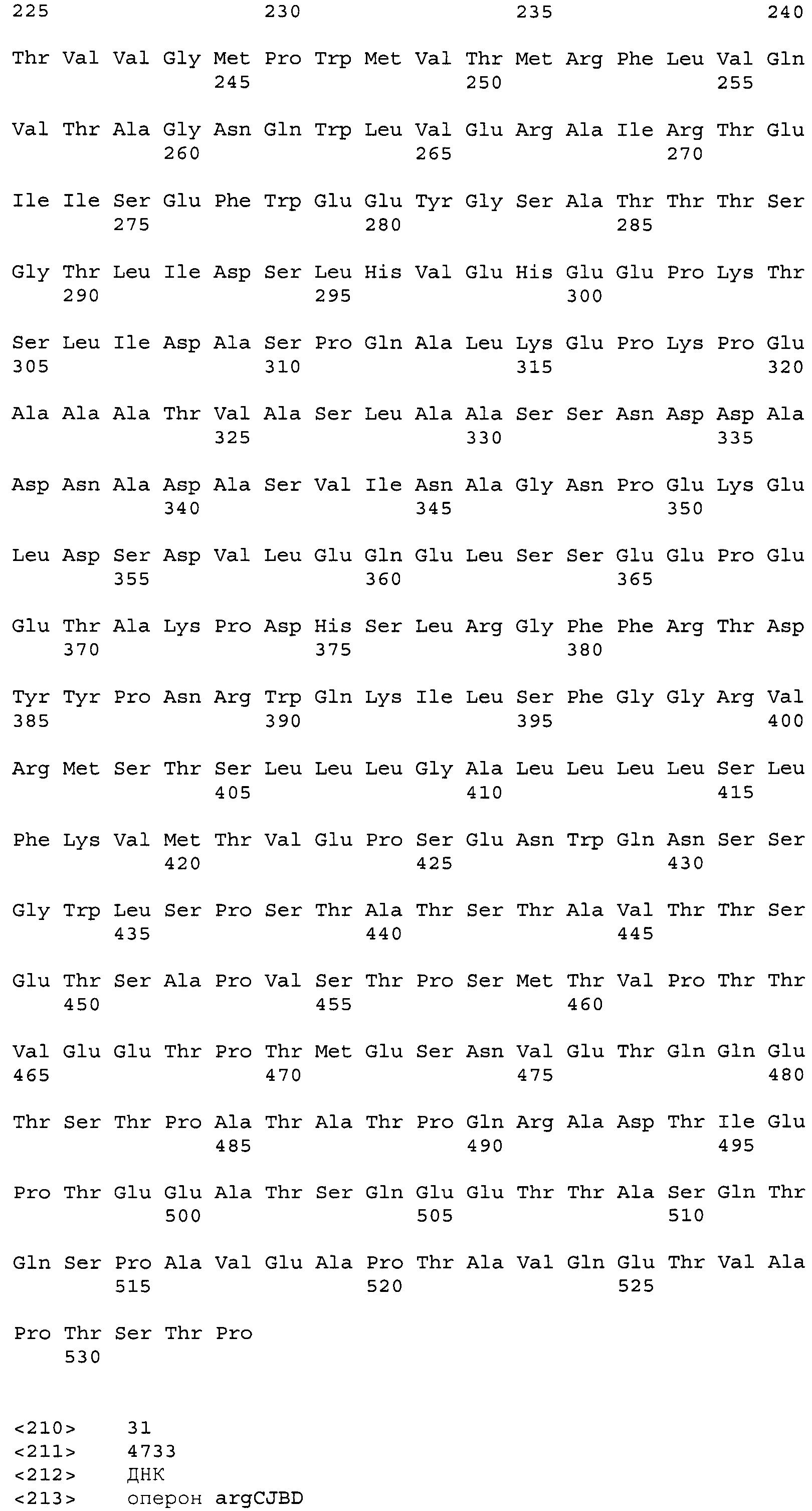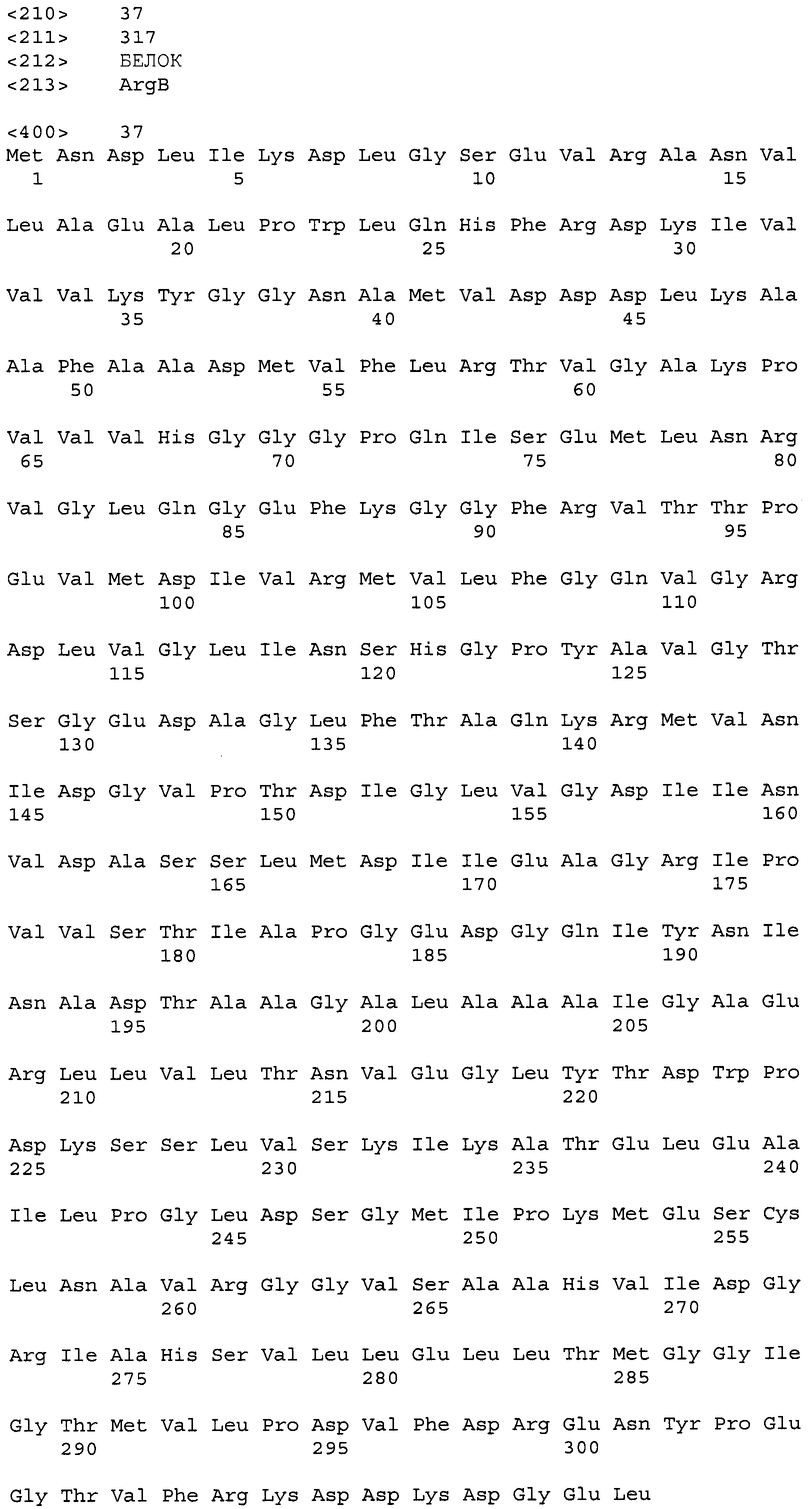Результат интеллектуальной деятельности: МИКРООРГАНИЗМЫ ДЛЯ ПОЛУЧЕНИЯ ПУТРЕСЦИНА И СПОСОБ ПОЛУЧЕНИЯ ПУТРЕСЦИНА С ИХ ИСПОЛЬЗОВАНИЕМ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к путресцин-продуцирующему микроорганизму и способу получения путресцина с его использованием.
Уровень техники
Полиамин является веществом, присутствующим в большинстве живых клеток. Спермидин или спермин, принадлежащие к полиамину, обнаружены в различных видах, таких как бактерии, грибы и животные. Путресцин или 1,4-бутандиамин, который является предшественником в метаболизме спермидина и спермина, обнаружен в грамотрицательных бактериях или грибах, и он присутствует в широком диапазоне концентрации в различных видах, что позволяет предполагать, что он играет важную роль в метаболическом пути.
Путресцин является элементом структуры в синтезе полиамина найлона-4,6, который получают реакцией путресцина с адипиновой кислотой. Для использования в производстве обрабатываемого пластика в качестве исходного материала путресцин обычно получают химическим синтезом, включающим преобразование пропилена в акрилонитрил и сукцинонитрил. Этот химический синтез состоит из трехступенчатого процесса, включающего реакцию каталитического окисления, которая потребляет большое количество энергии, причем реакция использует токсичный химикат, такой как цианид, и реакцию гидрогенизации, которая использует водород высокого давления. Получение путресцина химическим синтезом не является благоприятным для окружающей среды, а также потребляет большое количество энергии, приводя к истощению нефтяных ресурсов. Таким образом, необходимым является развитие более благоприятного для окружающей среды и энергетически эффективного способа, включающего утилизацию биомассы, для получения путресцина.
В микроорганизме биосинтетический путь путресцина является тем же самым, что и биосинтетический путь L-аргинина из стадии синтеза от глутамата в орнитин. Путресцин может быть синтезирован двумя путями, такими как декарбоксилирование орнитина или декарбоксилирование аргинина. Эти два пути производят энергию, требуемую для метаболизма, или позволяют клетке иметь устойчивость к окислительному стрессу. Был описан способ получения путресцина в высокой концентрации трансформацией E. coli и Corynebacterium. Получение путресцина в E. coli может достигаться увеличением уровня экспрессии орнитиндекарбоксилазы и глутаматацетилтрансферазы. Путресцин также может быть получен при высокой концентрации синтетическими путями удаления спермидина и ацетилпутресцина, которые деградируют или утилизируют путресцин (Qian. ZD. et al., Biotechnol. Bioeng. 104:4, 651-662, 2009, International Patent Publication No. WO06/005603, International Patent Publication No. WO09/125924). Между тем, в штамме Corynebacterium sp., который лишен синтетического пути путресцина, путресцин может быть получен из орнитина путем встраивания гена орнитиндекарбоксилазы, происходящего из E. coli, или путресцин может быть получен из L-аргинина путем встраивания гена L-аргининдекарбоксилазы и агаматиназы, происходящих из E. coli. Путь орнитина фактически может давать приблизительно в 50 раз более высокое количество путресцина, чем путь L-аргинина (Schneider et al., Appl. Microbial. Biotechnol. 88:4, 859-868, 2010).
Между тем, было обнаружено, что E. coli может расти нормально в присутствии 44 г/л путресцина, тогда как Corynebacterium glutamicum может расти нормально в присутствии 66 г/л путресцина. Таким образом, кажется более эффективным использование штамма Corynebacterium sp., который может выживать при более высокой концентрации путресцина, чем E. coli, в развитии микроорганизма для получения путресцина.
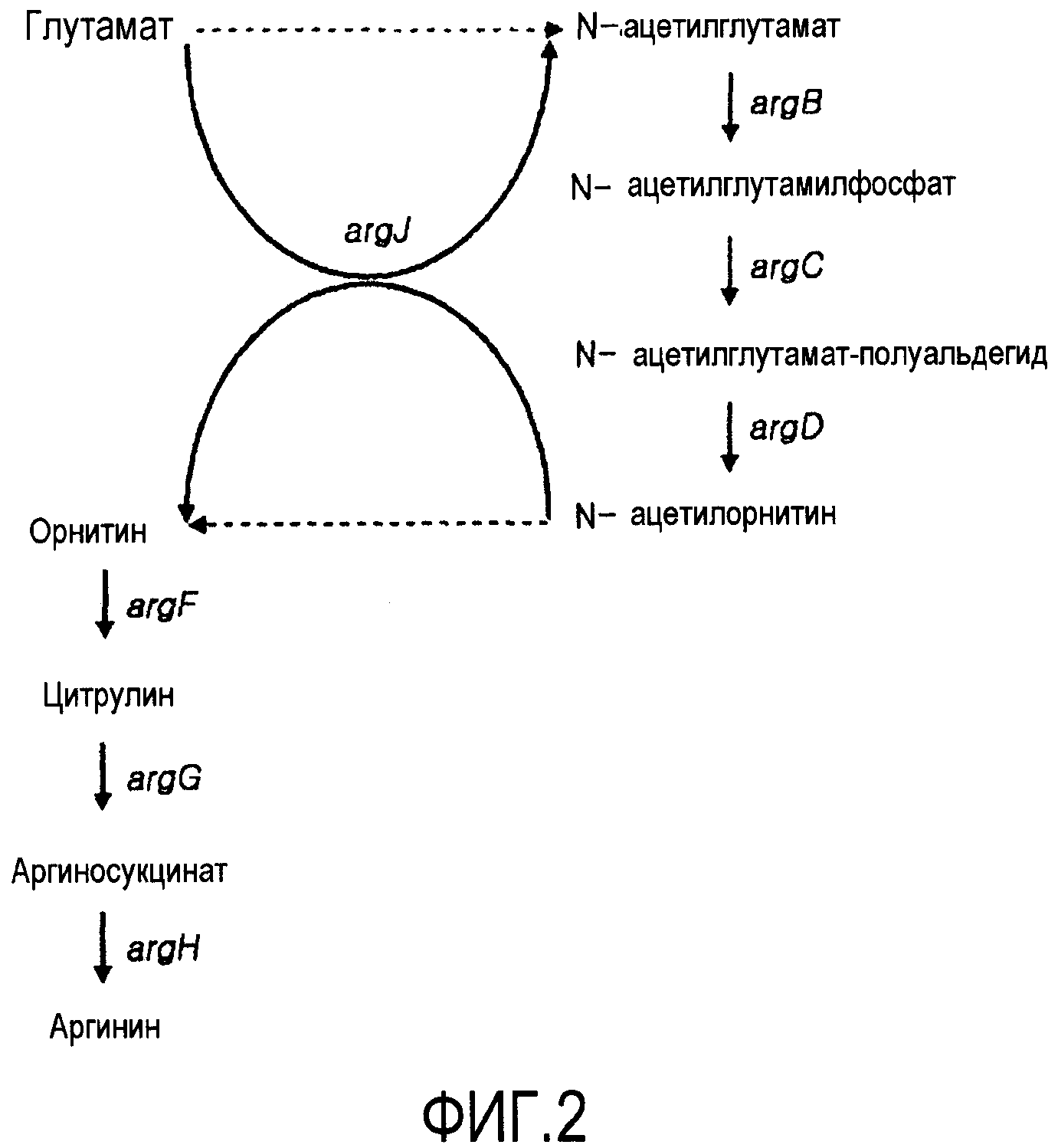
Штаммы Corynebacterium sp. являются коммерчески используемым микроорганизмом, который широко применяется для получения аминокислот, нуклеиновых кислот, ферментов и антибиотических аналогов. В штамме Corynebacterium sp. L-аргинин синтезируется из глутамата ферментами, экспрессируемыми из гена оперона аргинина, состоящего из argCJBDFRGH. Гены оперона аргинина, которые имеют наиболее важную роль в биосинтезе L-аргинина, используют внутриклеточно синтезируемый L-глутамат в качестве субстрата для синтеза аргинина. Фигура 2 показывает схематическую диаграмму синтетического пути аргинина из глутамата в штамме Corynebacterium sp. В синтетическом пути аргинина ArgJ преобразует глутамат в N-ацетилглутамат, ArgB преобразует N-ацетилглутамат в N-ацетилглутамилфосфат, ArgC преобразует N-ацетилглутамилфосфат в N-ацетилглутамат-полуальдегид, ArgD преобразует N-ацетилглутамат-полуальдегид в N-ацетилорнитин, ArgJ преобразует N-ацетилорнитин в орнитин, ArgF преобразует орнитин в L-цитруллин, ArgG преобразует L-цитруллин в аргининосукцинат и ArgH преобразует аргининосукцинат в аргинин.
Известные ранее аргинин-продуцирующие штаммы были развиты увеличением уровня экспрессии фермента, участвующего в биосинтезе аргинина, путем введения мутации в оперон аргинина или мутированием промотора. Среди генов в опероне аргинина, argR, который регулирует и супрессирует экспрессию гена оперона аргинина, и argB, который ингибирует концентрацию аргинина, был мишенями во многих исследованиях для увеличения уровня продукции аргинина (публикация патента Кореи № 2010-0060909).
Биосинтетический путь путресцина является таким же, что и биосинтетический путь аргинина от стадии синтеза глутамата в орнитин. Затем путресцин продуцируется из синтезированного орнитина орнитиндекарбоксилазой (ODC). Таким образом, для получения штамма, способного давать высокое количество путресцина, сначала должно быть получено достаточное количество орнитина. При добавлении глутамата к argF- и argR-делетированному штамму E. coli W3110 дикого типа, уровень продукции орнитина увеличивался на 20%. Кроме того, наряду с путем из глутамата в орнитин, когда путь синтеза из глутамата в пролин был блокирован нокаутом гена proB, который кодирует γ-глутамилкиназу, участвующую в его первой стадии, увеличивался также хорошо уровень продукции орнитина. Это предполагает, что при увеличении внутриклеточного уровня глутамата, он оказывает положительные действия на продукцию орнитина в клетке. В исследовании получения высокого уровня глутамата, который является предшественником орнитина, в течение продолжительного времени исследовалась Corynebacterium glutamicum. В этом отношении, сообщалось, что активность экспорта глутамата Corynebacterium glutamicum увеличивается, когда клетка лишена биотина или когда клетка обработана пенициллином G, или поверхностно-активным веществом, содержащим эфир жирной кислоты. Этот результат предполагает, что при повреждении клеточной стенки глутамат может экспортироваться лучше через цитоплазму.
Известно, что белок NCgl1221, полученный из штамма дикого типа Corynebacterium glutamicum (АТСС 13032), стимулирует экспорт бетаина и имеет аминокислотную последовательность, сходную с последовательностью yggB, которая кодирует механочувствительный белок канала (публикация патента Кореи № 2010-0017581).
ОПИСАНИЕ
Техническая проблема
В попытке развития штамма, способного давать более высокий выход путресцина, авторы настоящего изобретения получали штамм, продуцирующий высокий уровень путресцина, блокированием биосинтетического пути из орнитина в аргинин, увеличением внутриклеточного уровня глутамата, усилением биосинтетического пути из глутамата в орнитин и введением экзогенного гена орнитиндекарбоксилазы, которая может синтезировать путресцин из орнитина, что послужило основанием для настоящего изобретения.
Техническое решение
Одной из целей настоящего изобретения является обеспечение микроорганизма, получившего способность продуцировать путресцин.
Другой целью настоящего изобретения является обеспечение способа получения путресцина с использованием микроорганизма.
Преимущество изобретения
Микроорганизм по настоящему изобретению, получивший способность продуцирования путресцина, может широко использоваться для более эффективного получения путресцина.
Краткое описание чертежей
Фигура 1 показывает биосинтетический путь путресцина и относящиеся к нему гены трансформированной Corynebacterium glutamicum по изобретению;
Фигура 2 показывает известный биосинтетический путь аргинина в Corynebacterium glutamicum; и
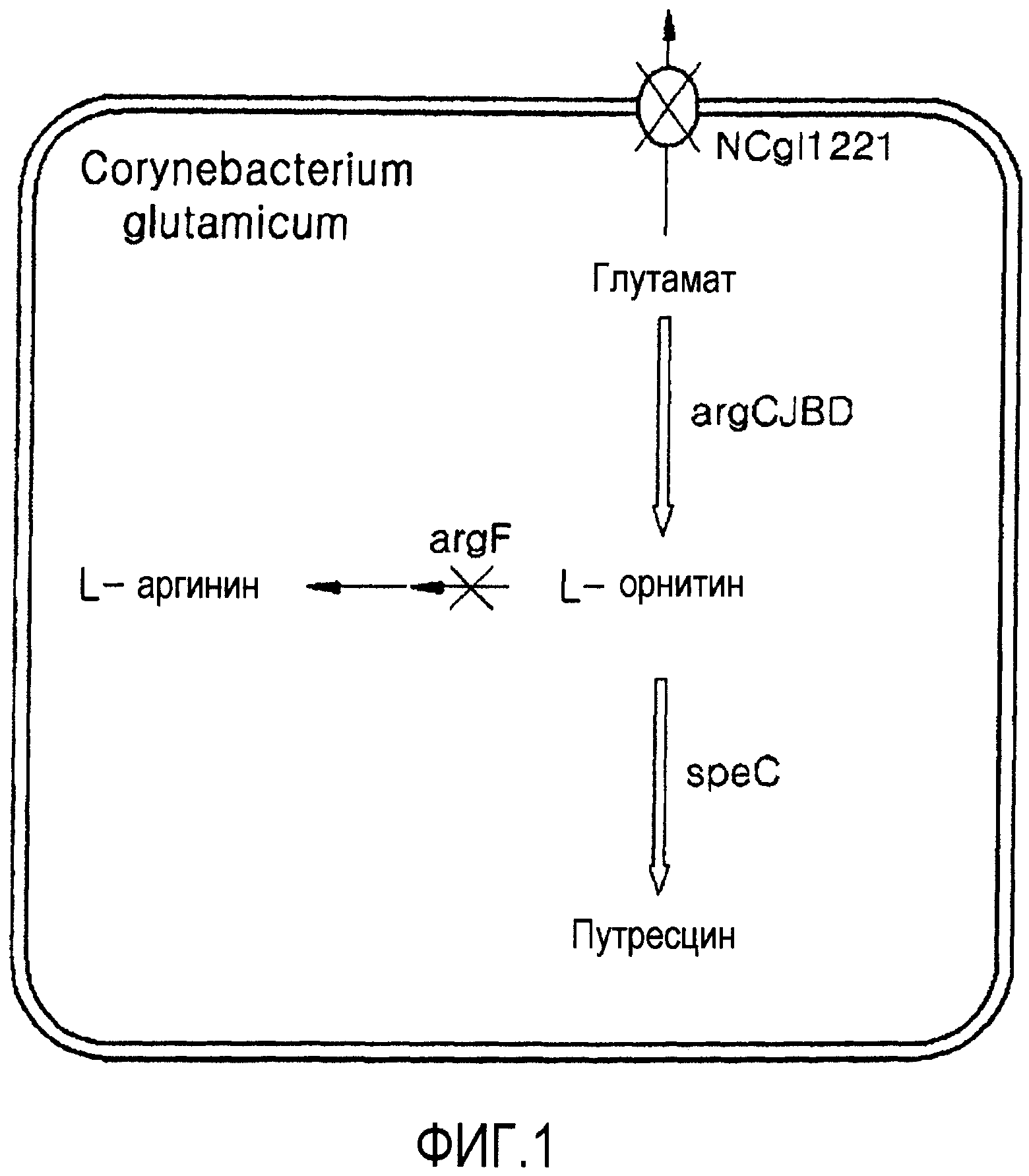
Фигура 3 показывает вектор pDZ для встраивания в хромосому штамма Corynebacterium sp.
Лучший вариант осуществления изобретения
В одном из аспектов для достижения цели изобретение относится к путресцин-продуцирующему микроорганизму, где этот микроорганизм модифицирован так, что имеет уменьшенную активность орнитинкарбамоилтрансферазы и белка, участвующего в экспорте глутамата, т.е. NCgl1221, по сравнению с его эндогенной активностью, и активность орнитиндекарбоксилазы (ODC) введена в этот микроорганизм.
Как используется в настоящем документе, “орнитинкарбамоилтрансфераза (OCT)” относится к каталитическому ферменту, который опосредует реакцию между карбамоилфосфатом и орнитином для синтеза цитруллина и фосфорной кислоты. OCT присутствует в печени мочевина-экскретирующих животных, а также в растении и микроорганизме, и в микроорганизме он участвует в синтезе аргинина. Фермент OCT содержит каталитический домен и регуляторный домен, и при связывании орнитина с регуляторным доменом активность фермента ингибируется.
Штамм E. coli K12 имеет два типа OCT (ArgF и ArgI) и кишечный микроорганизм, включающий В- и W-штаммы E. coli, имеет белок OCT, сходный с ArgI. OCT, кодируемые argF и argI, имеют различные аминокислотные последовательности по сравнению друг с другом, но они рассматриваются как изоферменты, имеющие одну и ту же функцию. (EMBO J. (1982) 1:853-857). Штамм Corynebacterium sp. имеет только OCT, кодируемый геном argF. OCT действует только в синтетическом пути от орнитина к аргинину, и, следовательно, если активность OCT ослабляется, уровень продукции внутриклеточного орнитина может быть увеличен.
Настоящее изобретение относится к штамму Corynebacterium sp., где синтетический путь от орнитина к аргинину блокирован для ингибирования преобразования предшественника путресцина, т.е. орнитина, в аргинин. Для этой цели получали штамм-трансформант делецией гена, кодирующего орнитинкарбамоилтрансферазу.
Орнитинкарбамоилтрансфераза может быть белком, имеющим аминокислотную последовательность SEQ ID NO:28 или аминокислотную последовательность, которая на 70% или более гомологична ей, и, предпочтительно, 80% или более, более предпочтительно, 90% или более гомологена ей, но не ограничивающуюся ими.
Как используется в настоящем документе, “гомология” относится к сходству в нуклеотидных последовательностях гена, кодирующего белок или аминокислотные последовательности. При достаточно высокой гомологии, продукты соответствующего гена могут быть одинаковыми или могут иметь сходную активность.
Как используется в настоящем документе, “белок, участвующий в экспорте глутамата” относится к типу механочувствительных каналов, которые функционируют для экспорта внутриклеточно продуцируемого глутамата во внеклеточную среду.
Настоящее изобретение относится к микроорганизмам Corynebacterium sp., имеющим способность продуцирования путресцина. Для этой цели, трансформированный штамм, который может поддерживать высокий уровень внутриклеточного глутамата, получали делетированием гена, кодирующего белок, участвующий в экспорте глутамата, который является субстратом для предшественника путресцина, т.е. орнитина.
Путем увеличения внутриклеточного уровня глутамата, т.е. предшественника орнитина, может быть стимулирован биосинтетический путь орнитина. В настоящем изобретении экспорт глутамата может быть уменьшен или ингибирован уменьшением активности NCgl1221.
Удаляемый белок, участвующий в экспорте глутамата, может быть белком, имеющим аминокислотную последовательность SEQ ID NO:30 или аминокислотную последовательность, которая на 70% или более гомологична ей и, более предпочтительно, на 80% или более гомологична, даже более предпочтительно, на 90% или более гомологична ей, но не ограничивающуюся ими.
Активность орнитинкарбамоилтрансферазы и белка, участвующего в экспорте глутамата, может быть уменьшена способом, выбранным из группы, состоящей из (1) частичной или полной делеции гена, кодирующего белок, (2) модификации регуляторной последовательности экспрессии для супрессии экспрессии гена, (3) модификации нуклеотидной последовательности на хромосоме для уменьшения активности белка и (4) их комбинации, но не ограничивающейся ими.
Частичная или полная делеция полинуклеотида, кодирующего белок, может выполняться введением вектора для хромосомной инсерции в микроорганизм, с заменой тем самым полинуклеотида, кодирующего эндогенный белок-мишень на хромосоме, частично удаленным полинуклеотидом или маркерным геном. Эта “частичная” длина может варьироваться в зависимости от типа полинуклеотида, но, конкретно, этот термин относится к длине 1-300 нуклеотидов, предпочтительно, 1-100 нуклеотидов и, более предпочтительно, к длине 1-50 нуклеотидов.
Модификация регуляторной последовательности экспрессии для уменьшения экспрессии полинуклеотида может также выполняться индуцированием модификации на регуляторной последовательности экспрессии с помощью делеции, инсерции, неконсервативной или консервативной замены нуклеотидной последовательности, или их комбинации для уменьшения активности регуляторной последовательности экспрессии, или заменой регуляторной последовательности экспрессии нуклеотидной последовательностью, имеющей более слабую активность. Регуляторная последовательность экспрессии включает промотор, операторную последовательность, последовательность, кодирующую сайт связывания рибосом, и последовательность, регулирующую терминацию транскрипции и трансляции.
Кроме того, модификация полинуклеотидной последовательности на хромосоме, которая кодирует фермент по настоящему изобретению, может быть получена индуцированием мутации на этой последовательности путем делеции, инсерции, неконсервативной или консервативной замены полинуклеотидной последовательности, или их комбинацией для уменьшения ферментативной активности, или заменой последовательности полинуклеотидной последовательностью, которая модифицирована таким образом, что она имеет более слабую активность.
Микроорганизм-трансформант, в котором предшественник путресцина, орнитин, накапливается в клетке, получают способом, отличающимся от прежних способов для генерирования орнитин-продуцирующего штамма (публикация патента Кореи № 2010-0060909), т.е. способом увеличения получения орнитина элиминированием или уменьшением функции ArgR, который является ингибитором транскрипции биосинтетического пути аргинина, и дополнительно делетированием гена орнитинкарбамоилтрансферазы и введением нерегулируемой N-ацетилглутаматсинтазы.
Как используется в настоящем документе, “эндогенная активность” относится к активности фермента, которую микроорганизм имеет в его нативном состоянии. В настоящем изобретении эндогенная активность относится к активности орнитинкарбамоилтрансферазы и белка, участвующего в экспорте глутамата, т.е. NCgl1221, который природно содержит микроорганизм. Кроме того, как используется в настоящем документе, “модифицированный для приобретения более слабой активности, чем эндогенная активность” относится к состоянию, в котором орнитинкарбамоилтрансфераза и белок, участвующий в экспорте глутамата, т.е. NCgl1221, не функционируют должным образом вследствие делеции гена или мутации и, следовательно, активность орнитинкарбамоилтрансферазы и белка, участвующего в экспорте глутамата, т.е. NCgl1221, который природно имеет микроорганизм, является ослабленной.
Как используется в настоящем документе, “орнитиндекарбоксилаза (ODC)” относится к ферменту, который производит путресцин с использованием орнитина. ODC требует пиридоксаль-5'-фосфата (PLP) в качестве кофермента. ODC присутствует в большинстве грамотрицательных бактерий, но он может присутствовать в некоторых кишечных бактериях, таких как Lactobacillus, среди грамположительных бактерий. E. coli имеет два типа генов, кодирующих ODC. Одним из них является speC, который конститутивно экспрессируется при постоянной концентрации, а другим геном является speF, экспрессия которого индуцируется только при определенных условиях (уровне орнитина, более высоком, чем определенная концентрация, и низком рН). В зависимости от вида, некоторые виды имеют два типа ферментов ODC, подобно E. coli, или имеют только один тип ODC. Конкретно, виды, включающие Escherichia sp, Shigela sp., Citrobacter sp., Salmonella sp., Enterobacter sp., имеют два типа ODC (т.е., speC и speF), тогда как виды, включающие Yersinia sp., Klebsiella sp. и Erwinia sp., имеют только один тип ODC (speC). В Lactobacillus, ODC экспрессируется из одного типа гена (speF), который индуцируется низким рН или высокой концентрацией орнитина и гистидина.
ODC может быть белком, кодируемым аминокислотной последовательностью SEQ ID NO:41 или аминокислотной последовательностью, которая на 70% или более гомологична, более предпочтительно, на 80% или более гомологична, даже более предпочтительно, на 90% или более гомологична ей, но не ограничивающуюся ими. Как описано выше, активность орнитиндекарбоксилазы (ODC) может быть введена с использованием различных способов, известных в данной области, например, путем встраивания полинуклеотида, содержащего ODC-кодирующую нуклеотидную последовательность, в хромосому, путем встраивания полинуклеотида в векторную систему для введения в микроорганизм, путем встраивания промотора с улучшенной активностью на левой части ODC-кодирующей нуклеотидной последовательности или путем встраивания ODC-кодирующего гена с модифицированным промотором и путем встраивания варианта ODC-кодирующей нуклеотидной последовательности. Более предпочтительно, при встраивании ODC-кодирующей нуклеотидной последовательности, промотор CJ7 SEQ ID NO:42 может быть использован в качестве промотора для регуляции экспрессии ODC.
В примере настоящего изобретения обеспечен микроорганизм Corynebacterium sp. с приданной ему способностью продуцировать путресцин. Для получения трансформанта, способного продуцировать путресцин, микроорганизм инсертировали нуклеотидной последовательностью, кодирующей орнитиндекарбоксилазу, в хромосоме, которая может синтезировать путресцин из орнитина.
Путресцин, продуцируемый микроорганизмом, может быть деградирован в E. coli путем внутриклеточной деградации, в спермидин, ацетилпутресцин и гамма-аминомасляную кислоту (GABA). Известно, что ODC присутствует в большинстве грамотрицательных штаммов, но не в видах Corynebacterium. Таким образом, при использовании видов Corynebacterium sp. для генерирования путресцин-продуцирующего штамма требуется введение экзогенных ODC.
Как используется в настоящем документе, термин “микроорганизм с приданной ему способностью продуцировать путресцин” или “путресцин-продуцирующий микроорганизм” относится к микроорганизму, генерированному приданием путресцин-продуцирующей способности материнскому штамму, который не имел внутренней способности продуцирования путресцина. Микроорганизм с приданной ему способностью продуцировать путресцин или путресцин-продуцирующий микроорганизм может быть, но не ограничивается им, микроорганизмом, в котором активности ацетилглутаматсинтазы, которая преобразует глутамат в N-ацетилглутамат, орнитинацетилтрансферазы (ArgJ), которая преобразует ацетилорнитин в орнитин, ацетилглутаматкиназы (ArgB), которая преобразует ацетилглутамат в N-ацетилглутамилфосфат, N-ацетил-гамма-глутамилфосфатредуктазы (ArgC), которая преобразует ацетилглутамилфосфат в N-ацетилглутамат-полуальдегид, и ацетилорнитинаминотрансферазы (ArgD), которая преобразует ацетилглутамат-полуальдегид в N-ацетилорнитин, являются увеличенными по сравнению с присущей им активностью, для усиления биосинтетического пути синтеза из глутамата в орнитин, с увеличением путем этого получения орнитина, который используется в качестве стартового материала для синтеза путресцина, и микроорганизму, который трансформирован для введения гена, кодирующего орнитиндекарбоксилазу (speC), с приобретением посредством этого способности получать путресцин из орнитина.
В настоящем документе N-ацетил-гамма-глутамилфосфатредуктаза (ArgC), ацетилглутаматсинтаза или орнитинацетилтрансфераза (ArgJ), ацетилглутаматкиназа (ArgB) и ацетилорнитинаминотрансфераза (ArgD) могут, предпочтительно, иметь, но ими не ограничиваются, аминокислотные последовательности SEQ ID NO:33, 35, 37 и 39, соответственно, или аминокислотную последовательность, которая на 70% или более гомологична, более предпочтительно, на 80% или более гомологична, и, даже более предпочтительно, на 90% или более гомологична им. Активность ArgC, ArgJ, ArgB и ArgD может быть увеличена способом, выбранным из группы, состоящей из 1) увеличения числа копий полинуклеотида, кодирующего белок, 2) модификации регуляторной последовательности экспрессии для увеличения экспрессии этого полинуклеотида, 3) модификации последовательности полинуклеотида на хромосоме для увеличения активности фермента и 4) их комбинации.
Конкретно, различные способы могут быть использованы обычно для увеличения ферментативной активности в микроорганизме. Например, уровень экспрессии полинуклеотида может быть увеличен увеличением числа копий этого полинуклеотида путем трансформации, включающей встраивание плазмиды, гомологичную рекомбинацию, конъюгацию и транслокацию; модификацией регуляторной последовательности экспрессии этого полинуклеотида; амплификацией гена, кодирующего регуляторный фактор, который стимулирует экспрессию этого полинуклеотида; или делетированием или ингибированием гена, кодирующего регуляторный фактор, который супрессирует экспрессию этого полинуклеотида. Более конкретно, уровень экспрессии полинуклеотида может быть увеличен функциональным связыванием фрагмента гена, содержащего этот полинуклеотид, с мультикопийным вектором, который может реплицироваться в штаммах Corynebacterium sp., введением одной или множественных копий этого полинуклеотида в хромосому, или заменой регуляторной последовательности экспрессии, содержащей промотор полинуклеотида, последовательностью имеющей улучшенную активность.
Например, группа генов argCJBD может быть трансформирована в микроорганизм с использованием вектора рНС139Т для получения микроорганизма со значимо улучшенной способностью продуцирования орнитина по сравнению со штаммом дикого типа. Альтернативно, микроорганизм, в котором биосинтетический путь орнитина является усиленным, может быть получен улучшением области промотора, регулирующего экспрессию гена argCJBD, в хромосоме микроорганизма для усиления ее или заменой области промотора промотором с более сильно улучшенной активностью. В частности, способ для улучшения области промотора может включать замену промотора в хромосоме, получение фрагмента гена, содержащего нуклеотидные последовательности обоих концевых сайтов, смежных с сайтом-мишенью на этой хромосоме, и встраиванием последовательности промотора в той же самой форме, что и в исходной хромосоме, и с использованием того же самого способа делетирования с использованием вектора pDZ, опубликованного патента Кореи № 2009-0082702, но ими не ограничивается. В настоящем описании улучшенным промотором может быть, предпочтительно, но не ограничивается им, промотор pcj7 (или P(CJ7)), имеющий нуклеотидную последовательность SEQ ID NO:42 (патент Кореи с регистрационным № 0620092). Вектор pDZ может быть, предпочтительно, но им не ограничивается, вектором, представленным картой расщепления Фигуры 3.
Как используется в настоящем документе, “вектор” относится к ДНК-конструкту, содержащему нуклеотидную последовательность гена, который функционально связан с подходящей регуляторной последовательностью экспрессии для экспрессии гена-мишени в подходящей клетке-хозяине. Регуляторная последовательность экспрессии содержит промотор, который может инициировать транскрипцию, необязательную операторную последовательность для регуляции транскрипции, последовательность, кодирующую подходящий мРНК-сайт связывания рибосом, и последовательность, регулирующую терминацию транскрипции и трансляции. Примеры общепринятых векторов включают природную или рекомбинантную плазмиду, космиду, вирус и бактериофаг. Например, pWE15, M13, λEMBL3, λEMBL4, λFIXII, λDASHII, λZAPII, λgt10, λgt11, Charon4A и Charon21A могут быть использованы в качестве фагового вектора или космидного вектора. В качестве плазмидного вектора могут быть использованы вектор pDZ, pBR-тип, pUC-тип, pBluescriptII-тип, pGEM-тип, pTZ-тип, pCL-тип и pET-тип. Используемый вектор не имеет конкретных ограничений, и может быть использован любой известный вектор экспрессии, предпочтительно, вектор pDZ.
Между тем, микроорганизмом по настоящему изобретению может быть, но им не ограничивается, микроорганизм, полученный трансформацией микроорганизма, принадлежащего к Escherichia sp, Shigella sp., Citrobacter sp., Salmonella sp., Enterobacter sp., Yersinia sp., Klebsiella sp., Erwinia sp., Corynebacterium sp., Brevibacterium sp., Lactobacillus sp., Selenomanas sp., или Vibrio sp., который не имеет метаболического пути путресцина, имея активность орнитинкарбамоилтрансферазы и белка, участвующего в экспорте глутамата, т.е. NCgl1221.
Предпочтительно, микроорганизм по настоящему изобретению может быть трансформантом, в котором орнитин накапливается уменьшением или инактивацией активности орнитинкарбамоилтрансферазы, внутриклеточный уровень глутамата увеличивается уменьшением или инактивацией активности белка, участвующего в экспорте глутамата, орнитин сверхпродуцируется увеличением уровня экспрессии группы генов argCJBD, которая участвует в биосинтезе аргинина, и вводится экзогенный ген, кодирующий орнитиндекарбоксилазу (ODC), которая преобразует орнитин в путресцин, делая эту клетку способной к продуцированию путресцина.
Предпочтительно, путресцин-продуцирующим микроорганизмом по настоящему изобретению может быть штамм Corynebacterium sp. и, более предпочтительно, Corynebacterium glutamicum. Более конкретно, могут быть использованы штамм Corynebacterium glutamicum АТСС 13032 или глутамат-сверхэкспрессирующий штамм КССМ-10785Р (публикация патента Кореи № 2008-0034334), но без ограничения ими. Штамм КССМ-10785Р является глутамат-сверхэкспрессирующим штаммом, генерированным делетированием генов cg2624 (NCBI LOCUS ID_226636) и cg2115 (NCBI LOCUS ID YP_226173) в глутамат-продуцирующем штамме (KFCC-11074), который генерировали с использованием мутагена, такого как N-метил-N'-нитро-N-нитрозогуанидин (NTG).
Хотя сверхпродуцирование глутамата делетированием cg2624 и cg2115 не было идентифицировано ранее относительно приведенной выше публикации, cg2624 идентифицирован как pcaR, который является регуляторным белком семейства IclR, а cg2115 идентифицирован как sugR, который является регулятором транскрипции метаболизма сахара.
Как показано в синтетическом пути орнитина Фигуры 2, для увеличения уровня продукции орнитина, требуется увеличение количества исходного материала, глутамата, блокирование пути, в котором синтезированный орнитин преобразуется в аргинин, и увеличение количества фермента, участвующего в биосинтезе орнитина, или усиление его активности. Подобным образом трансформированный микроорганизм с приданной ему способностью продуцирования путресцина может быть получен увеличением продуктивности орнитина, введением гена, кодирующего орнитиндекарбоксилазу (ODC), которая может синтезировать путресцин из орнитина для микроорганизма, лишенного метаболического пути путресцина, с индуцированием посредством этого сверхпродуцирования орнитина.
Согласно примерам изобретения, получали следующие штаммы: argF-делетированный штамм Corynebacterium glutamicum (ATCC 13032 ΔargF и KCCM-10785P ΔargF) (Пример 1), argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum (ATCC 13032 ΔargF ΔNCgl1221 и KCCM-10785P ΔargF ΔNCgl1221) (Пример 2), argF- и NCgl1221-делетированный и argCJBD-индуцированный штамм Corynebacterium glutamicum (ATCC 13032 ΔargF ΔNCgl1221/pHC139T-argCJBD (Cgl) и KCCM-10785P ΔargF ΔNCgl1221/pHC139T-argCJBD (Cgl)) (Пример 3-1), argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum с заменой промотора группы генов argCJBD в хромосоме (ATCC 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD и KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD) (Пример 3-2), argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum, инсертированный ODC-кодирующим геном speC в хромосоме (ATCC 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec) и KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec)), argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum, инсертированный ODC-кодирующим геном speC и группой генов argCJBD в хромосоме (ATCC 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec)/pHC139T-argCJBD (Cgl) и KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC (Ec)/pHC139T-argCJBD (Cgl)) и argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum с заменой промотора группы генов argCJBD и инсерцией гена speC в хромосоме (ATCC 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec) и KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec)). При сравнении продуктивности этих штаммов было обнаружено, что argF- и NCgl1221-делетированный штамм Corynebacterium glutamicum с заменой промотора группы генов argCJBD и встраиванием гена speC в хромосоме (ATCC 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec) и KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec)) показали превосходную продуктивность путресцина (Таблицы 7 и 8).
В результате, авторы изобретения назвали путресцин-продуцирующий штамм с наивысшей продуктивностью “CC01-0064 (ATCC 13032 ΔargF NCgl1221 Р(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec))” и депонировали пробу штамма в соответствии с Будапештским договором в Корейский Центр Культур Микроорганизмов, который имеет адрес Hongje-1-dong, Seodaemun-gu, Seoul, Korea 24 ноября 2010 с Номером доступа No. KCCM11138P.
В другом аспекте для достижения цели изобретения, настоящее изобретение относится к способу получения путресцина, предусматривающему стадии (i) получения клеточной культуры культивированием путресцин-продуцирующего микроорганизма; и (ii) выделения путресцина из культивируемого микроорганизма или клеточной культуры.
В способе получения путресцина культивирование микроорганизма может выполняться, предпочтительно, с использованием периодической культуры, непрерывной культуры и культуры с подпиткой, известных в данной области, но ими не ограничивающихся. Кроме того, что касается условий культивирования, может поддерживаться оптимальный рН 5-9, предпочтительно, рН 6-8 и, наиболее предпочтительно, рН 6,8 с использованием щелочного химиката (например, гидроксида натрия, гидроксида калия или аммиака) или кислотного химиката (например, фосфорной кислоты или серной кислоты). Кроме того, аэробные условия могут поддерживаться добавлением кислорода или смеси кислородсодержащих газов в клеточную культуру. Температура культивирования может поддерживаться при 20°С-45°С и, предпочтительно, при 25°С-40°С. Кроме того, предпочтительным является культивирование в течение приблизительно 10-160 часов. Полученный вышеописанным культивированием путресцин может экскретироваться в культуральную среду или оставаться внутри клетки.
Кроме того, среда для культивирования может содержать сахар и углевод (например, глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал и целлюлозу), масло и жир (например, соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло), жирную кислоту (например, пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту), спирт (например, глицерин и этанол) и органическую кислоту (например, уксусную кислоту), по отдельности или в комбинации в качестве источника углерода; азотсодержащее органическое соединение (например, пептон, дрожжевой экстракт, мясной сок, экстракт солода, кукурузный раствор, порошок соевой муки и мочевину) или неорганическое соединение (например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония), по отдельности или в комбинации в качестве источника азота; дигидрофосфат калия, дикалийфосфат или натрийсодержащую соль, соответствующую этим солям, по отдельности или в комбинации в качестве источника фосфора; другие незаменимые стимулирующие рост вещества, в том числе соли металлов (например, сульфат магния или сульфат железа), аминокислоты и витамины.
Способ по изобретению
После этого настоящее изобретение будет описано более подробно со ссылкой на Примеры. Однако эти Примеры приводятся только для иллюстративных целей и не предполагается, что это изобретение ограничивается этими Примерами.
Пример 1: Получение argF-делетированного штамма Corynebacterium glutamicum
В этом примере, argF-делетированный штамм получали из штамма АТСС 13032 Corynebacterium glutamicum дикого типа и глутамат-сверхпродуцирующего штамма КССМ-10785Р, который генерировали делетированием генов cg2624 и cg2115 в глутамат-продуцирующем штамме KFCC-110074, генерированном с использованием мутагена, такого как NTG (публикация патента Кореи № 2008-0034334), для блокирования синтетического пути аргинина из орнитина. Биосинтетические гены аргинина Corynebacterium glutamicum АТСС 13032 являются организованными в опероне, имеющем форму argCJBDFRGH, и делеционный ген-мишень argF (SEQ ID NO:27) присутствует смежно с генами, кодирующими ферменты, участвующие в синтетическом пути орнитина на хромосоме. Таким образом, плазмиду для делетирования гена argF получали на основе нуклеотидной последовательности argD и argR, которые локализованы смежно с делеционным геном-мишенью argF.
Конкретно, на основе нуклеотидной последовательности argD и argR штамма АТСС 13032, конструировали фрагмент гомологичной рекомбинации смежно с N-концевой последовательностью argF и фрагмент гомологичной рекомбинации смежно с С-концевой последовательностью argF. Для этого фрагмент, смежный с N-концевой последовательностью argF получали при помощи ПЦР с использованием геномной ДНК из штамма АТСС 13032 в качестве матрицы, и праймеров (SEQ ID NO:1 и 2) (28 циклов денатурации в течение 30 секунд при 95°С, отжиг в течение 30 секунд при 55°С и удлинение в течение 30 секунд при 72°С). Подобным образом фрагмент, смежный с С-концевой последовательностью argF, получали при помощи ПЦР с использованием геномной ДНК из штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:3 и 4) при тех же самых условиях ПЦР (Таблица 1).
|
Полученный, как описано выше, фрагмент гомологичной рекомбинации, смежный с N-концевой последовательностью argF, расщепляли рестрикцией BamHI и SalI и фрагмент гомологичной рекомбинации, смежный с С-концевой последовательностью argF, расщепляли рестрикцией SalI и XbaI. Затем каждый из этих расщепленных фрагментов встраивали в вектор pDZ, который был также расщеплен рестрикцией BamHI и XbaI, с получением с помощью этого плазмиды pDZ-argF(K/O).
Полученную, как описано выше, плазмиду pDZ-argF(K/O) трансформировали в штамм АТСС 13032 и штамм КССМ-10785Р. Затем трансформированные штаммы высевали и культивировали на чашке BHIS (инфузионный раствор для головного мозга/сердца 37 г/л, сорбит 91 г/л, агар 2%), которая содержит канамицин (25 мкг/мл) и Х-gal(5-бром-4-хлор-3-индолин-β-D-галактозид), давая колониям расти на этой чашке. Среди колоний, образованных на этой чашке, колонии синего цвета собирали для селекции штамма, инсертированного плазмидой pDZ-argF(K/O).
Отобранные, как описано выше, штаммы культивировали со встряхиванием в СМ-среде (глюкоза 10 г/л, полипептон 10 г/л, дрожжевой экстракт 5 г/л, мясной бульон 5 г/л, NaCl 2,5 г/л, мочевина 2 г/л, рН 6,8) при 30°С в течение 8 часов. Затем каждую клеточную структуру серийно разводили от 10-4 до 10-10. Затем эти разведенные пробы высевали и культивировали на Х-gal-содержащей твердой среде, давая этим колониям расти. Среди колоний, образованных на чашке, только белые колонии, которые появляются при относительно низкой частоте, собирали для селекции argF-делетированных штаммов.
Успешное встраивание плазмиды pDZ-argF(K/O) в отобранные, как описано выше, штаммы, подтвержали выполнением ПЦР с использованием хромосомной ДНК из отобранного, как описано выше, штамма в качестве матрицы и праймеров SEQ ID NO:1 и 4. Посредством этого ПЦР-подтверждения, было подтверждено, что отобранный, как описано выше, штамм является argF-делетированным штаммом (например, АТСС 13032 ΔargF и KCCM-10785P ΔargF).
Пример 2: Получение argF- и NCgl1221-делетированного штамма Corynebacterium glutamicum
Ген NCgl1221, кодирующий белок, участвующий в экспорте глутамата, дополнительно делетировали в штамме АТСС 13032 ΔargF и штамме КССМ-10785P, полученных в Примере 1, для увеличения внутриклеточного уровня глутамата, который является предшественником орнитина.
Конкретно, на основе нуклеотидной последовательности (SEQ ID NO:29) NCgl1221 штамма АТСС 13032, конструировали фрагмент гомологичной рекомбинации, смежный с N-концевой последовательностью NCgl1221, и фрагмент гомологичной рекомбинации, смежный с С-концевой последовательностью NCgl1221. Для этого фрагмент, смежный с N-концевой смежной последовательностью NCgl1221, генерировали при помощи ПЦР с использованием геномной ДНК из штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:5 и 6), и фрагмент, смежный с С-концевой последовательностью NCgl1221, генерировали при помощи ПЦР с использованием геномной ДНК из штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:7 и 8) при тех же самых условиях, что и условия в Примере 1 (Таблица 2).
|
Полученный, как описано выше, фрагмент гомологичной рекомбинации, смежный с N-концевой последовательностью NCgl1221, расщепляли рестрикцией BamHI и SalI. Подобным образом, фрагмент гомологичной рекомбинации, смежный с С-концевой последовательностью NCgl1221, расщепляли рестрикцией SalI и XbaI. Затем каждый из этих расщепленных рестрикцией фрагментов встраивали в вектор pDZ, который был расщеплен BamHI и XbaI, с получением посредством этого плазмиды pDZ-NCgl1221 (K/O).
Полученную, как описано выше, плазмиду pDZ-NCgl1221 (K/O) трансформировали в штамм АЕСС 13032 ΔargF и штамм KCCM-10785P ΔargF. Затем эти трансформированные штаммы высевали и культивировали на чашке BHIS (инфузионный раствор для головного мозга/сердца 37 г/л, сорбит 91 г/л, агар 2%), которая содержит канамицин (25 мкг/мл) и Х-gal(5-бром-4-хлор-3-индолин-β-D-галактозид), давая колониям расти на этой чашке. Среди колоний, образованных на этой чашке, колонии синего цвета собирали для селекции штамма, инсертированного плазмидой pDZ-NCgl1221 (K/O).
Отобранные, как описано выше, штаммы культивировали со встряхиванием в СМ-среде при 30°С в течение 8 часов. Затем каждую клеточную структуру серийно разводили от 10-4 до 10-10. Затем эти разведенные пробы высевали и культивировали на Х-gal-содержащей твердой среде, давая этим колониям расти. Среди колоний, образованных на этой чашке, только белые колонии, которые появляются при относительно низкой частоте, собирали для селекции NCgl1221-делетированных штаммов.
Успешное встраивание плазмиды pDZ-NCgl1221(K/O) в отобранные, как описано выше, штаммы подтверждали выполнением ПЦР с использованием хромосомной ДНК из отобранного, как описано выше, штамма в качестве матрицы и праймеров SEQ ID NO:5 и 8. Отобранные NCgl1221-делетированные штаммы были названы АТСС 13032 ΔargF ΔNCgl1221 или KCCM-10785P ΔargF ΔNCgl1221 соответственно.
Пример 3: Получение argCJBD-инсертированного штамма Corynebacterium glutamicum
Пример 3-1: Клонирование гена argCJBD и получение трансформанта
В этом примере получали вектор, инсертированный генами argC, argJ, argB и argD (SEQ ID NO:32, 34, 36 и 38 соответственно), и трансформант получали введением его для усиления синтетического пути орнитина увеличением числа копий оперона argCJBD (SEQ ID NO:31, содержащая область промотора), который кодирует ферменты, участвующие в синтетическом пути орнитина из глутамата.
Сначала выполняли ПЦР для получения гена argCJBD с использованием хромосомы штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:9 и 10) (30 циклов денатурации в течение 40 секунд при 95°С, отжиг в течение 40 секунд при 55°С и удлинение в течение 150 секунд при 70°С), с получением посредством этого фрагмента гена, имеющего размер 4900 т.п.н.
|
|
Полученный, как описано выше, фрагмент гена подвергали гель-электрофорезу на 0,8% агарозном геле и полосу этого размера-мишени вырезали и выделяли из нее пробу ДНК. Выделенную ДНК расщепляли рестрикцией KpnI и XbaI для получения фрагмента, затем расщепленный фрагмент клонировали в вектор pH139T-gfp (публикация патента Кореи № 2008-0074286), с получением посредством этого вектора экспрессии pHC139T-argCJBD(Cgl).
Затем вектор экспрессии pHC139T-argCJBD(Cgl), полученный для увеличения уровня продукции орнитина в клетке, вводили в штамм АТСС 13032 ΔargF ΔNCgl1221 и KCCM-10785P ΔargF ΔNCgl1221 электропорацией. Затем успешный трансформант отбирали посевом трансформированных клеток на чашку BHIS, содержащую 25 мкг/мл канамицина. Наконец, каждый из отобранных трансформантов был назван АТСС 13032 ΔargF ΔNCgl1221/pHC139T-argCJBD (Cgl) и KCCM-10785P ΔargF ΔNCgl1221/pHC139T-argCJBD(Cgl) соответственно.
Пример 3-2: Замена промотора гена argCJBD в хромосоме
В этом примере промотор argCJBD заменяли промотором CJ7, который был недавно разработан автором настоящего изобретения в хромосоме, для увеличения уровня экспрессии удалением регуляции гена argCJBD, который кодирует ферменты, участвующие в синтетическом пути орнитина из глутамата.
Сначала получали фрагмент гомологичной рекомбинации, содержащий промотор CJ7 и нуклеотидную последовательность обоих концевых сайтов этого промотора.
Конкретно, нуклеотидную последовательность 5'-концевого сайта промотора CJ7 получали выполнением ПЦР с использованием геномной ДНК из штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:11 и 12) (28 циклов денатурации в течение 30 секунд при 94°С, отжиг в течение 30 секунд при 55°С и удлинение в течение 30 секунд при 72°С). Подобным образом нуклеотидную последовательность области промотора CJ7 получали при помощи ПЦР с использованием праймеров (SEQ ID NO:13 и 14) при тех же самых условиях ПЦР, и нуклеотидную последовательность 3'-концевого сайта промотора CJ7 получали при помощи ПЦР с использованием праймеров (SEQ ID NO:15 и 16) при тех же самых условиях ПЦР.

Полученный, как описано выше, фрагмент 5'-концевого сайта промотора (argC-L) расщепляли рестрикцией BamHI и EcoRI, фрагмент области промотора CJ7 расщепляли рестрикцией EcoRI и XbaI и фрагмент 3'-концевого сайта промотора (argC-R) расщепляли рестрикцией XbaI и SalI. Затем каждый из расщепленных ПЦР-продуктов клонировали в вектор pDZ, который был также расщеплен рестрикцией BamHI и SalI, с получением посредством этого вектора экспрессии pDZ-CJ7(arg), в котором промотор argCJBD был заменен промотором CJ7.
Полученный, как описано выше, вектор экспрессии pDZ-CJ7(arg) трансформировали в штамм АТСС 13032 ΔargF ΔNCgl1221 и штамм KCCM-10785P ΔargF ΔNCgl1221 путем электропорации. Затем трансформанты культивировали со встряхиванием в среде СМ (30°С, 8 часов) и культуру клеток серийно разводили от 10-4 до 10-10. Затем эти разведенные пробы высевали и культивировали на чашке BHIS, содержащей 25 мкг/мл канамицина и Х-gal, давая этим колониям расти.
Белые колонии, которые проявляются при низкой частоте, выделяли из большинства голубых колоний, с отбором с помощью этого только штамма, в котором промотор arg был успешно заменен промотором CJ7 через двойной кроссинговер. Успешную замену промотора argCJBD в хромосоме путем введения вектора экспрессии pDZ-CJ7(arg) подтверждали выполнением ПЦР с использованием геномной ДНК из вышеотобранных штаммов в качестве матрицы и праймеров (SEQ ID NO:13 и 16) (28 циклов денатурации в течение 30 секунд при 94°С, отжиг в течение 30 секунд при 55°С и удлинение в течение 60 секунд при 72°С). Наконец, подтвержденные штаммы были названы АТСС 13032 ΔargF ΔNCgl1221 Р(CJ7)-argCJBD и KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD соответственно.
Пример 4: Штамм Corynebacterium glutamicum с введенным геном speC
Ген speC, кодирующий ODC E. coli, который синтезирует путресцин из орнитина, вводили в связанном с инактивированным синтезом биотина гене в хромосоме штамма Corynebacterium glutamicum.
Пример 4-1: Получение вектора экспрессии, содержащего фрагмент гена ODC
Для введения гена speC, полученного из E. coli (SEQ ID NO:40), в штамм Corynebacterium glutamicum, ген speC клонировали в вектор вместе с промотором CJ7, имеющим SEQ ID NO:42, так что speC экспрессируется от промотора CJ7.
Сначала нуклеотидную последовательность области промотора CJ7 получали выполнением ПЦР с использованием р117-CJ7-gfp (Корейский патент с регистрационным номером 106200092) в качестве матрицы и праймеров (SEQ ID NO:17 и 18) (30 циклов денатурации в течение 40 секунд при 94°С, отжиг в течение 40 секунд при 55°С и удлинение в течение 60 секунд при 72°С), и нуклеотидную последовательность peC-кодирующей области получали выполнением ПЦР с использованием хромосомы штамма E. coli W3110 дикого типа в качестве матрицы и праймеров (SEQ ID NO:19 и 20) при тех же самых условиях ПЦР.
Нуклеотидные последовательности области промотора CJ7 и кодирующей области speC-гена расщепляли рестрикцией KpnI и XbaI и клонировали в вектор pHC139T-gfp, который также обрабатывали KpnI и XbaI, с генерированием посредством этого вектора экспрессии pHC139T-Р(CJ7)-speC(Ec), который содержит гены для промотора CJ7 и ODC-кодирующей области справа от него.
Пример 4-2: Получение трансформанта
Поскольку связанные с синтезом биотина гены частично делетированы в штамме Corynebacterium sp, в этом примере ген speC, полученный из E. coli, вводили между генами синтеза биотина bioA и bioD.
Конкретно, для применения обоих концевых сайтов фрагмента гена P(CJ7)-speC(Ec), содержащихся в векторе экспрессии pHC139T-Р(CJ7)-speC(Ec), полученном в Примере 4-1, в виде сайтов гомологичной рекомбинации в хромосоме Corynebacterium sp., каждый из этих концевых сайтов P(CJ7)-speC(Ec) клонировали для присутствия нуклеотидной последовательности bioA и bioD. Для этого фрагмент гена bioA получали выполнением ПЦР с использованием генома штамма АТСС 13032 в качестве матрицы и праймеров (SEQ ID NO:21 и 22) (28 циклов денатурации в течение 40 секунд при 94°С, отжиг в течение 30 секунд при 55°С и удлинение в течение 60 секунд при 72°С). Подобным образом, фрагмент гена bioD получали выполнением ПЦР при тех же самых условиях ПЦР с использованием той же самой матрицы, но с другими праймерами (SEQ ID NO:25 и 26). Затем фрагмент гена P(CJ7)-speC(Ec) получали при помощи ПЦР с использованием вектора экспрессии pHC139T-P(CJ7)-speC(Ec) в качестве матрицы и праймеров (SEQ ID NO:23 и 24) при тех же самых условиях ПЦР.
Полученный, как описано выше, фрагмент гена bioA расщепляли рестрикцией BamHI и ScaI, фрагмент гена P(CJ7)-speC(Ec) расщепляли рестрикцией ScaI и EcoRI и фрагмент гена bioD расщепляли рестрикцией EcoRI и XbaI. Затем эти расщепленные продукты ПЦР клонировали в вектор pDZ, который также был обработан BamHI и XbaI, с получением путем этого вектора экспрессии pDZ-bioAD-P(CJ7)-speC(Ec) для встраивания гена speC в хромосому.
Полученный, как описано выше, вектор экспрессии pDZ-bioAD-P(CJ7)-speC(Ec) трансформировали в штамм АТСС 13032 ΔargF ΔNCgl1221, штамм АТСС 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD, штамм KCCM-10785P ΔargF ΔNCgl1221 и штамм KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD с помощью электрофореза, с генерированием посредством этого трансформанта каждого штамма.
Каждый из этих трансформантов культивировали со встряхиванием в среде СМ (30°С 8 часов) и эту клеточную культуру серийно разводили от 10-4 до 10-10. Затем эту разведенную клеточную культуру высевали и культивировали на чашке BHIS, содержащей 25 мкг/мл канамицина и Х-gal, давая расти колониям.
Белые колонии появляются при относительно низкой частоте по сравнению с большим количеством колоний, которые имеют синий цвет. Посредством отбора белых колоний, только штаммы, в которых P(CJ7)-speC был встроен в хромосому двойным кроссинговером, могли быть отобраны. Успешное встраивание гена P(CJ7)-speC между bioA и bioD в хромосоме вектором экспрессии pDZ-bioAD-P(CJ7)-speC(Ec) подтверждали выполнением ПЦР с использованием геномной ДНК, полученной из каждого из этих отобранных штаммов, в качестве матрицы и праймеров (SEQ ID NO:21 и 26) (28 циклов денатурации в течение 30 секунд при 94°С, отжиг в течение 30 секунд при 55°С и удлинение в течение 120 секунд при 72°С). Наконец, отобранные штаммы были названы АТСС 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec), АТСС 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec), KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec) или KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec) соответственно.
Кроме того, вектор pHC139T-argCJBD (Cgl), полученный в Примере 3-1, трансформировали в штамм ATCC 13032 ΔargF ΔNCgl1221 bioAD::P (CJ7)-speC(Ec) и штамм KCCM-10785P ΔargF ΔNCgl1221 bioAD::P (CJ7)-speC(Ec). Полученные трансформанты были названы ATCC 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec)/pHC139T-argCJBD (Cgl) и KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC (Ec)/pHC139T-argCJBD (Cgl) соответственно.
Пример 5: Действие делеции argF и NCgl1221, увеличения уровня экспрессии argCJBD и инсерции гена speC в улучшении продуктивности путресцина
Пример 5-1: Анализ продуктивности путресцина в АТСС 13032 Corynebacterium glutamicum
Для подтверждения действия делеции argF, делеции NCgl1221, увеличения уровня экспрессии argCJBD и инсерции гена speC в продуктивности путресцина штамма АТСС 13032 Corynebacterium glutamicum сравнивали продуктивности путресцина штаммов, которые были получены в Примерах 2-4.
Конкретно, каждый из штаммов, полученных в Примерах 2-4 (ATCC 13032 ΔargF ΔNCgl1221 (тест-группа 1), ATCC 13032 ΔargF ΔNCgl1221/pHC139T-argCJBD (Cgl) (тест-группа 2), ATCC 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD (тест-группа 3), ATCC 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec) (тест-группа 4), ATCC 13032 ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec)/HC139T-argCJBD (Cgl) (тест-группа 5) и ATCC 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec) (тест-группа 6)), распределяли на агаре с кукурузной мукой (СМА), содержащем 11,8% (мас./об.) агар, и культивировали при 37°С в течение 24 часов. Затем каждый из этих культивированных штаммов инокулировали в 25 мл среды для титрования, содержащей 1 мМ аргинин, (2% (мас./об.) глюкозу, 1% (мас./об.) полипептон, 0,5% (мас./об.) дрожжевой экстракт, 0,5% (мас./об. (NH4)2SO4, 0,15% (мас./об.) мочевину, 0,4% (мас./об.) KH2PO4, 0,8% (мас./об.) K2HPO4, 0,05% (мас./об.) (MgSO4), 100 мкг/л биотина и 1 мг/л тиамина), и дополнительно культивировали со встряхиванием при 30°С и 200 об/мин в течение 72 часов. Затем концентрации орнитина и путресцина, полученные из них, измеряли и сравнивали (Таблица 7). Кроме того, штамм АТСС 13032 без геномной модификации использовали в качестве контрольной группы.
|
Как показано в Таблице 7, при делетировании генов argF и NCgl1221 или при делетировании генов argF и NCgl1221 и увеличении уровня экспрессии гена argCJBD, наблюдали только продуцирование орнитина, а путресцин не продуцировался в этой клетке. Это может быть обусловлено отсутствием гена speC, который кодирует фермент ODC, который синтезирует путресцин из орнитина в штамме Corynebacterium glutamicum.
С другой стороны, в трех типах штаммов, которые инсертировали полученным из E. coli геном speC, как описано в Примере 4-2, орнитин редко присутствовал в этой клетке, хотя наблюдали продуцирование путресцина. Этот результат позволяет предположить, что путем встраивания полученного из E. coli гена speC, который экспрессирует ODC, путресцин мог синтезироваться из орнитина ферментом ODC.
Кроме того, при сравнении уровня продукции орнитина в штаммах из Тест-групп 1-3 с уровнем продукции путресцина в штаммах из тест-групп 4-6, которые были генерированы встраиванием гена speC в штаммы тест-групп 1-3, было очевидно, что уровень продукции путресцина был сравним с уровнем продукции орнитина. Кроме того, по сравнению с вариантом, в котором встраивали экзогенный ген argCJBD, при увеличении уровня экспрессии эндогенного гена argCJBD уровни продукции орнитина и путресцина улучшались.
Пример 5-2: Исследование продуктивности путресцина глутамат-продуцирующего штамма Corynebacterium glutamicum KCCV-10785P
Для подтверждения действия делеции argF, делеции NCgl1221, улучшения уровня экспрессии argCJBD и инсерции гена speC в продуктивности путресцина глутамат-сверхпродуцирующего штамма Corynebacterium glutamicum КССМ-10795Р сравнивали продуцирование путресцина каждого из штаммов, полученных в Примерах 2-4.
Конкретно, каждый из штаммов, полученных в Примерах 2-4 (KCCM-10785P ΔargF ΔNCgl1221 (Тест-группа 1), KCCM-10785P ΔargF ΔNCgl1221/pHC139T-argCJBD(Cgl) (Тест-группа 2), KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD (Тест-группа 3), KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec) (Тест-группа 4), KCCM-10785P ΔargF ΔNCgl1221 bioAD::P(CJ7)-speC(Ec)/HC139T-argCJBD (Cgl) (Тест-группа 5) и KCCM-10785P ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec) (Тест-группа 6)), инокулировали при тех же самых условиях, которые описаны в Примере 5-1, и культивировали со встряхиванием при 30°С и 200 об/мин в течение 48 часов. Затем концентрацию орнитина, продуцируемого в каждой клеточной культуре, измеряли и сравнивали (Таблица 6). В качестве контрольной группы использовали также штамм КССМ-10785Р без геномной модификации.
|
Как показано в Таблице 8, при делетировании генов argF и NCgl1221 даже в глутамат-сверхпродуцирующем штамме или при делетировании генов argF и NCgl1221 и увеличении уровня экспрессии гена argCJBD наблюдали только продуцирование орнитина, а путресцин не продуцировался в этой клетке.
Между тем, продуцирование путресцина наблюдали только в трех типах штаммов, в которые вводили полученный из E. coli ген speC, как показано в Примере 4-2. Этот результат позволяет предположить, что путем введения полученного из E. coli ген speC, фермент ODC, экспрессируемый из него, мог синтезировать путресцин из орнитина.
При сравнении уровней продукции глутамата и орнитина в штаммах Тест-групп 1-3 наблюдали, что количество получения глутамата уменьшалось, количество получения орнитина увеличивалось относительно друг друга. Кроме того, при сравнении уровня продукции орнитина в штаммах Тест-групп 1-3 с уровнем продукции путресцина в штаммах Тест-групп 4-6, которые генерировали путем встраивания гена speC в штаммы Тест-групп 1-3, уровень продукции путресцина был сравним с уровнем продукции орнитина. Кроме того, по сравнению с вариантом, в котором встраивали экзогенный ген argCJBD, при увеличении уровня экспрессии эндогенного гена argCJBD уровни орнитина и путресцина увеличивались. Таким образом, было подтверждено, что когда уровень продукции глутамата в клетках увеличивается, количество орнитина также увеличивается, что, в свою очередь, увеличивает уровень продукции путресцина в конечном счете.
В целом, авторы настоящего изобретения назвали штамм, полученный в Примере 4-2, который показал, что он имеет превосходную способность продуцирования путресцина, “СС01-0064 (АТСС 13032 ΔargF ΔNCgl1221 P(CJ7)-argCJBD bioAD::P(CJ7)-speC(Ec)”, и депонировали его в соответствии с Будапештским договором в Корейском центре культур микроорганизмов (КССМ), имеющем адрес Hongje-1-dong, Seodaemun-gu, Seoul, Korea, 24 ноября 2010 года с номером доступа No. KCCM11138P.
На основе приведенного выше описания, квалифицированным в данной области специалистам должно быть понятно, что различные альтернативы в отношении вариантов настоящего изобретения, описанных в настоящем документе, могут быть использованы для применения на практике настоящего изобретения без отклонения от технической идеи или важных признаков настоящего изобретения, определенных в следующей формуле изобретения. В этом отношении, вышеописанные примеры приведены только для иллюстративных целей, и настоящее изобретение не предназначено для ограничения этими примерами. Должно быть понятно, что объем настоящего изобретения включает все из модификаций или модифицированную форму, полученную из идеи и объема следующей формулы изобретения или ее эквивалентных концепций.