Результат интеллектуальной деятельности: АНТИТЕЛО К CD38 И ЛЕНАЛИДОМИД ИЛИ БОРТЕЗОМИБ ДЛЯ ЛЕЧЕНИЯ МНОЖЕСТВЕННОЙ МИЕЛОМЫ И NHL
Вид РИД
Изобретение
Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет преимущество предварительной заявки на патент США с серийным номером 61/486814, поданной 17 мая 2011 года, предварительной заявки на патент США с серийным номером 61/468607, поданной 29 марта 2011 года, предварительной заявки на патент США с серийным номером 61/437696, поданной 31 января 2011 года, и предварительной заявки на патент США с серийным номером 61/386619, поданной 27 сентября 2010 года, которые включены ссылкой в своей полноте.
Предпосылки изобретения
Множественная миелома представляет собой В-клеточную неоплазию, характеризующуюся скрытым накоплением в костном мозге секреторных плазмацитов с низким пролиферативным индексом и увеличенной продолжительностью жизни. Заболевание в конечном итоге поражает кости и костный мозг, приводя в результате к множественным опухолям и повреждениям по всей костной системе.
Приблизительно 1% всех форм рака и чуть более чем 10% всех гемобластозов мот быть связаны с множественной миеломой (ММ). Заболеваемость ММ возрастает у стареющего населения, причем медианный возраст на момент диагностирования составляет приблизительно 61 год. Доступные в настоящее время терапевтические средства для множественной миеломы включают химиотерапию, трансплантацию стволовых клеток, Thalomid® (талидомид), Velcade® (бортезомиб), Aredia® (памидронат) и Zometa® (золедроновая кислота). Современные протоколы лечения, которые включают сочетание химиотерапевтических средств, таких как винкристин, BCNU, мелфалан, циклофосфамид, адриамицин и преднизон или дексаметазон, дают показатель полной ремиссии только приблизительно 5%, и медиана выживаемости составляет приблизительно 36-48 месяцев от времени диагностирования. Недавние достижения с применением высокодозовой химиотерапии с последующей трансплантацией аутогенного костного мозга или мононуклеарных клеток периферической крови повысили показатель полной ремиссии и длительность ремиссии. Тем не менее, обтай выживаемость продлилась лишь незначительно, и не было получено доказательства излечения. В конечном счете, у пациентов с ММ часто возникают рецидивы даже при поддерживающей терапии интерфероном-альфа (IFN-α) самим по себе или в сочетании со стероидами.
Неходжкинская лимфома представляет собой широкую классификационную группу лимфом, которые представляют собой формы рака, происходящие из лимфатической системы, когда лимфоциты (В-клетки или Т-клетки) становятся злокачественными и бесконтрольно пролиферируют с образованием опухолевой массы. В совокупности NHL включает около 30 различных подтипов лимфомы, включая диффузную В-крупноклеточную лимфому (DLBCL) и фолликулярную лимфому (FL). Заболеваемость NHL достигнет более 140000 на основных рынках к 2019. Доступные методы лечения включают Rituxan/MabThera, их комбинации, такие как, R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон), R-CVP (Rituxan, циклофосфамид, винкристин и преднизон) и химиотерапию. К тому же можно предусматривать трансплантацию гемопоэтических клеток после ремиссии или после рецидива. Несмотря на современные методы лечения, однако, показатели выживаемости в пределах групп повышенного риска агрессивной NHL могут составлять только 30% за 5 лет. Следовательно, остается сильная неудовлетворенная потребность в эффективных средствах лечения и средствах комплексного лечения.
CD38 представляет собой пример антигена, экспрессированного на таких злокачественных плазмацитах и других лимфоцитах. Функции, приписываемые CD38, включают как роль рецепторного опосредования в адгезии и передаче сигнала, так и (экто)ферментативную активность. Как экзофермент CD38 использует NAD+ в качестве субстрата для образования циклической ADP-рибозы (cADPR) и ADPR, а также никотинамида и никотиновой кислоты-аденин динуклеотид фосфата (NAADP). Было показано, что cADPR и NAADP действуют как вторичные мессенджеры для мобилизации Са2+. Превращая NAD+ в cADPR, CD38 контролирует концентрацию внеклеточного NAD+ и, следовательно, выживание клеток путем модуляции индуцируемой NAD клеточной смерти (NCID). В дополнение к передаче сигнала через Са2+ передача сигнала CD38 происходит посредством взаимодействия (cross-talk) с комплексами антиген-рецептор на Т- и В-клетках или другими типами рецепторных комплексов, например, молекулы МНС, и является таким образом вовлеченной в несколько клеточных ответов, а также в переключение и секрецию IgG.
Антитела, специфичные к CD38, описаны в WO 1999/62526 (Mayo Foundation); WO 200206347 (Crucell Holland); US 2002164788 (Jonathan Ellis), которые включены по ссылке в своей полноте; WO 2005/103083 (MorphoSys AG), заявке на патент США с серийным номером 10/588568, которая включена по ссылке в своей полноте, WO 2006/125640 (MorphoSys AG). заявке на патент США с серийным номером 11/920830, которая включена по ссылке в своей полноте, и WO 2007/042309 (MorphoSys AG), заявке на патент США с серийным номером 12/089806, которая включена по ссылке в своей полноте; WO 2006099875 (Genmab), заявке на патент США с серийным номером 11/886932, которая включена по ссылке в своей полноте: и WO 08/047242 (Sanofi-Aventis), заявке на патент США с серийным номером 12/441466, которая включена по ссылке в своей полноте.
Комбинации антител, специфичных к CD38, и других средств описаны в WO 200040265 (Research Development Foundation); WO 2006099875 и WO 2008037257 (Genmab); и WO 2010061360, WO 2010061359, WO 2010061358 и WO 2010061357 (Sanofi Aventis), все из которых включены по ссылке в своей полноте. Ясно, что, несмотря на недавний прогресс в исследовании и разработке противораковых средств, многие формы рака, включающие экспрессирующие CD38 опухоли, все еще имеют неблагоприятный прогноз. Таким образом, существует потребность в улучшенных способах лечения таких форм рака.
Краткое описание
В одном аспекте настоящее раскрытие относится к синергической комбинации антитела, специфичного к CD38, и талидомида или его аналога, например, леналидомида. В другом аспекте настоящее раскрытие относится к синергической комбинации, содержащей антитело, специфичное к CD38, и бортезомиб или другой ингибитор протеасом. Такие комбинации являются применимыми при лечении форм рака, таких как множественная миелома и/или неходжкинская лимфома.
In vitro и in vivo модели рассматривают как прогностические для того, чтобы определить как определенное соединение или комбинация соединений будет вести себя у людей. В рамках настоящего документа комбинации антитела, специфичного к CD38, и леналидомида исследовали на клеточных линиях множественной миеломы и выявляли синергизм. Кроме того, комбинацию антитела, специфичного к CD38, и леналидомида, и комбинацию антитела, специфичного к CD38, и бортезомиба исследовали в мышиных моделях против как клеток множественной миелома, так и клеток лимфомы Беркитта (формы NHL) и выявляли синергизм. Следовательно, комбинации будут эффективны при лечении людей с множественной миеломой и/или неходжкинской лимфомой. К тому же антитело, специфичное к CD38, иллюстрируемой в настоящем описании, вступает в клинические испытания, где такие комбинации можно подтвердить у людей.
Если соединения объединяют либо in vitro, либо in vivo, специалист предположит, что комбинация проявляет лишь аддитивные эффекты. Авторы изобретения обнаружили, что комбинация конкретного антитела к CD38 и леналидомида опосредовала синергический уровень антителозависимой клеточно-опосредованной цитотоксичности (ADCC) как в АМО-1, так и NCI-Н929 клеточных линиях множественной миеломы. К тому же конкретное антитело к CD38 при объединении с леналидомидом или при объединении с бортезомибом опосредовано синергический уровень снижения разрушения кости NCI-H929 в модели на SCID мышах и синергично увеличивало количество дней медианы выживаемости с RAMOS в модели на SCID мышах.
Следовательно, как комбинация иллюстрируемого антитела, специфичного к CD38, и леналидомида и иллюстрируемого антитела, специфичного к CD38, и бортезомиба вела себя синергично в моделях in vitro и/или in vivo, соответствующих множественной миеломе и/или неходжкинской лимфоме.
В аспекте настоящее раскрытие включает комбинацию, где антитело, специфичное к CD38, содержит HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6) и талидомид, или его аналог, представляющий собой леналидомид. В предпочтительных аспектах комбинацию применяют для лечения множественной миеломы и/или неходжкинской лимфомы.
Аспект настоящего изобретения включает комбинацию, где антитело, специфичное к CD38, содержит HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и ингибитор протеасом представляет собой бортезомиб. В предпочтительных аспектах комбинацию применяют для лечения множественной миеломы и/или неходжкинской лимфомы.
Описание графических материалов
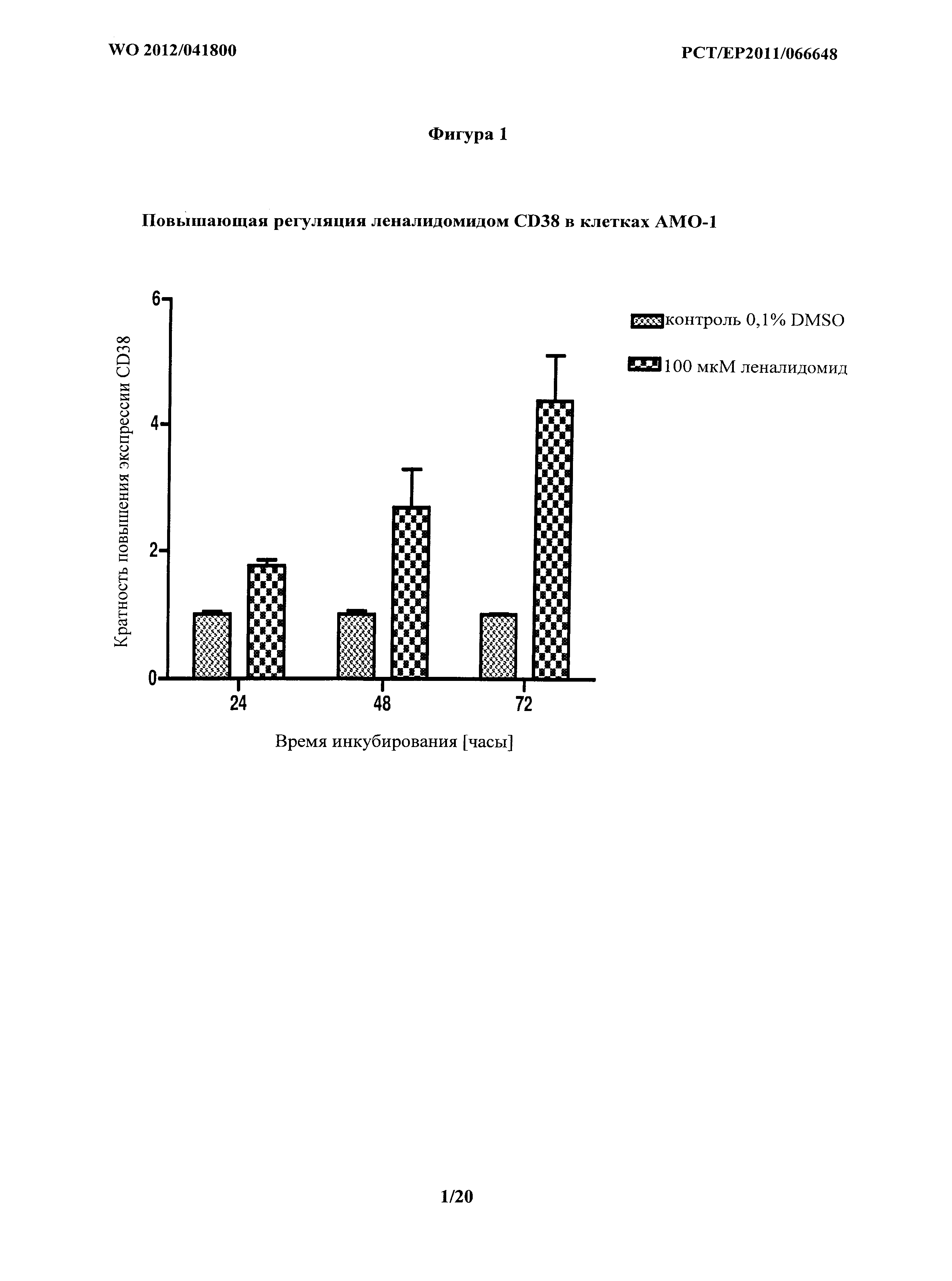
На фигуре 1 показаны воздействия леналидомида самого по себе на экспрессию CD38 в клетках АМО-1.
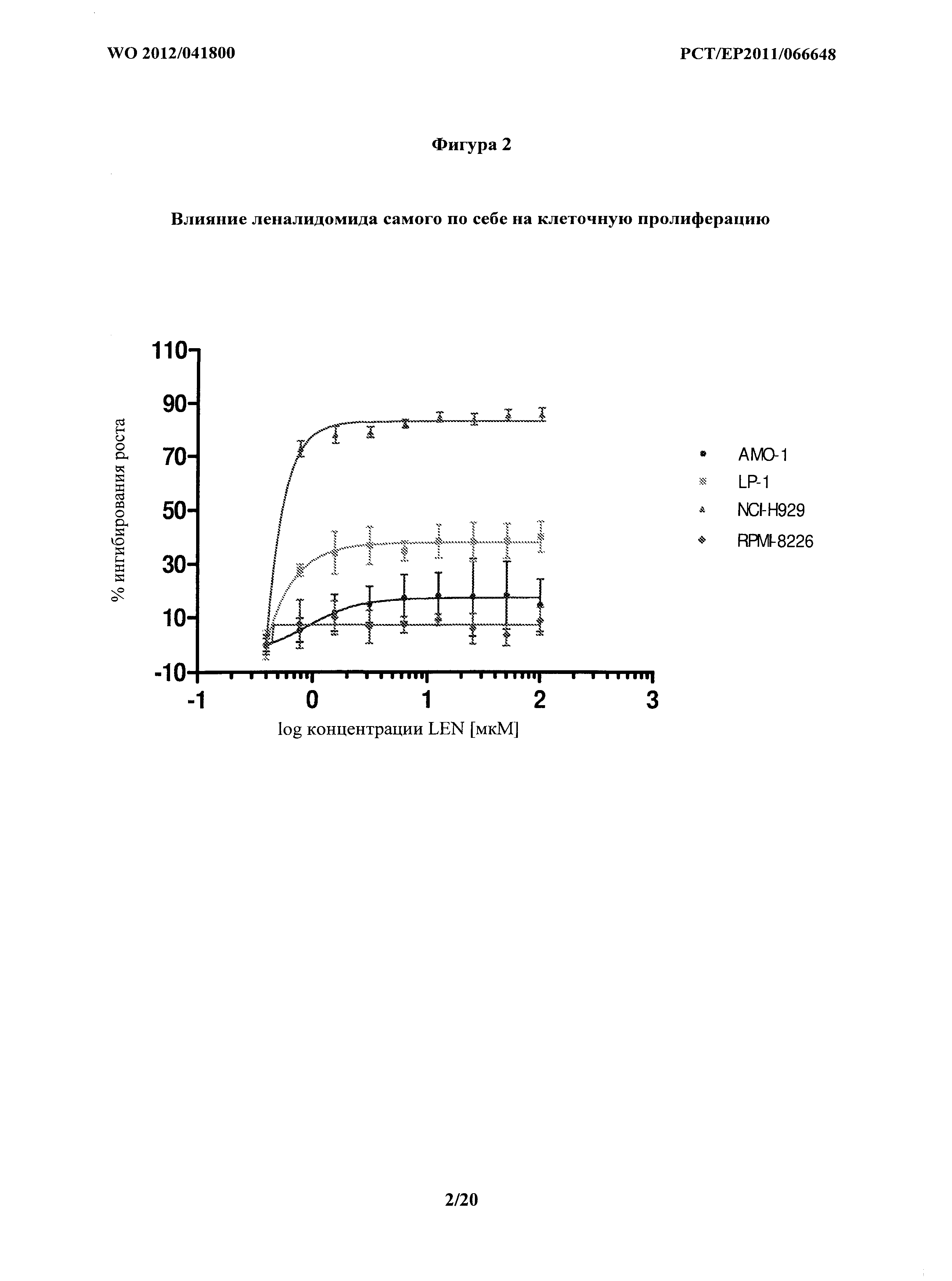
На фигуре 2 показаны воздействия леналидомида самого по себе на пролиферацию клеток различных клеточных линий множественной миеломы. Эти измерения представляют относительную цитотоксичность леналидомида в отношении каждой клеточной линии.
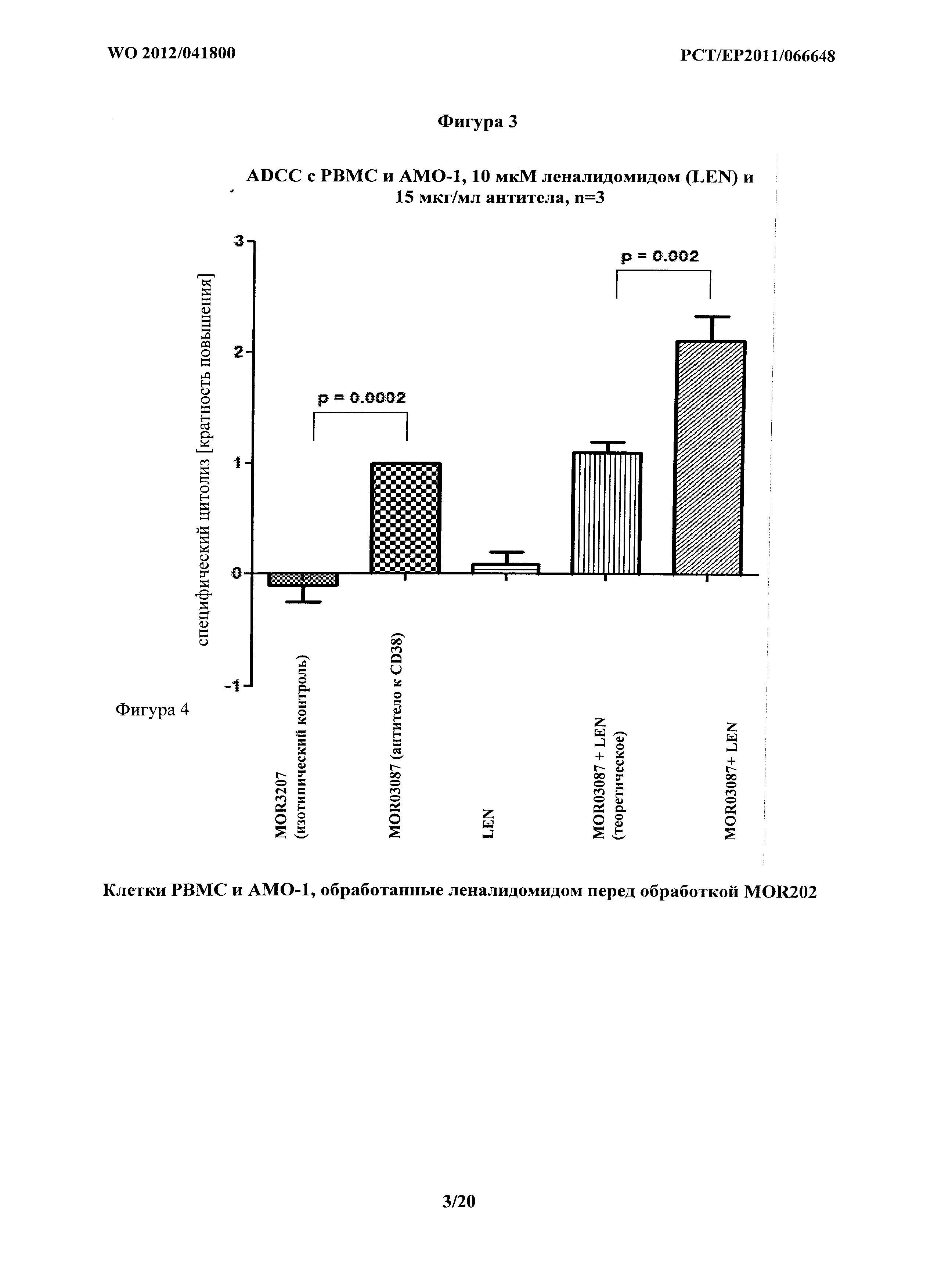
На фигуре 3 показано опосредование ADCC на клетках АМО-1 комбинацией MOR03087 и леналидомида. Клетки РВМС и АМО-1 обрабатывали леналидомидом перед обработкой MOR03087. MOR03207 связывает лизоцим и применяется в качестве изотипического контроля, так как оно представляет собой IgG1. LEN представляет леналидомид. "Теоретическое" представляет сумму значения для MOR03087 самого по себе и значение для LEN самого по себе. Показанные данные представляют собой средние величины из Таблицы 3b.
На фигуре 4 показано опосредованно ADCC на клетках АМО-1 комбинацией MOR03087 и леналидомида. Только РВМС обрабатывали леналидомидом перед обработкой MOR03087. MOR03207 связывает лизоцим и применяется в качестве изотипического контроля, так как оно представляет собой IgG1. LEN представляет леналидомид. "Теоретическое" представляет сумму значения для MOR03087 самого по себе и значения для LEN самого по себе. Показанные данные представляют собой средние величины из Таблицы 4b.
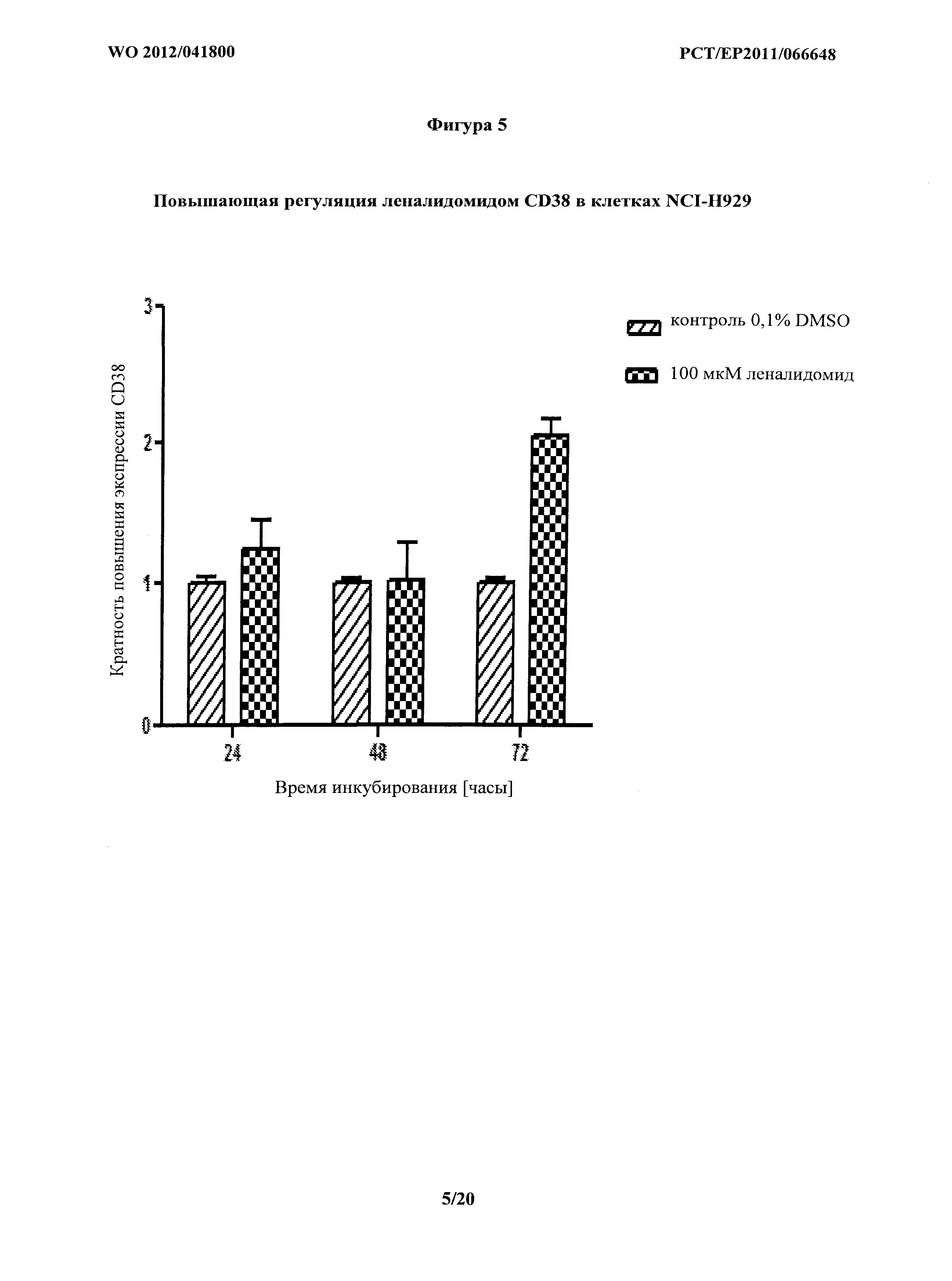
На фигуре 5 показаны воздействия леналидомида самого по себе на экспрессию CD38 в клетках NCI-H929.
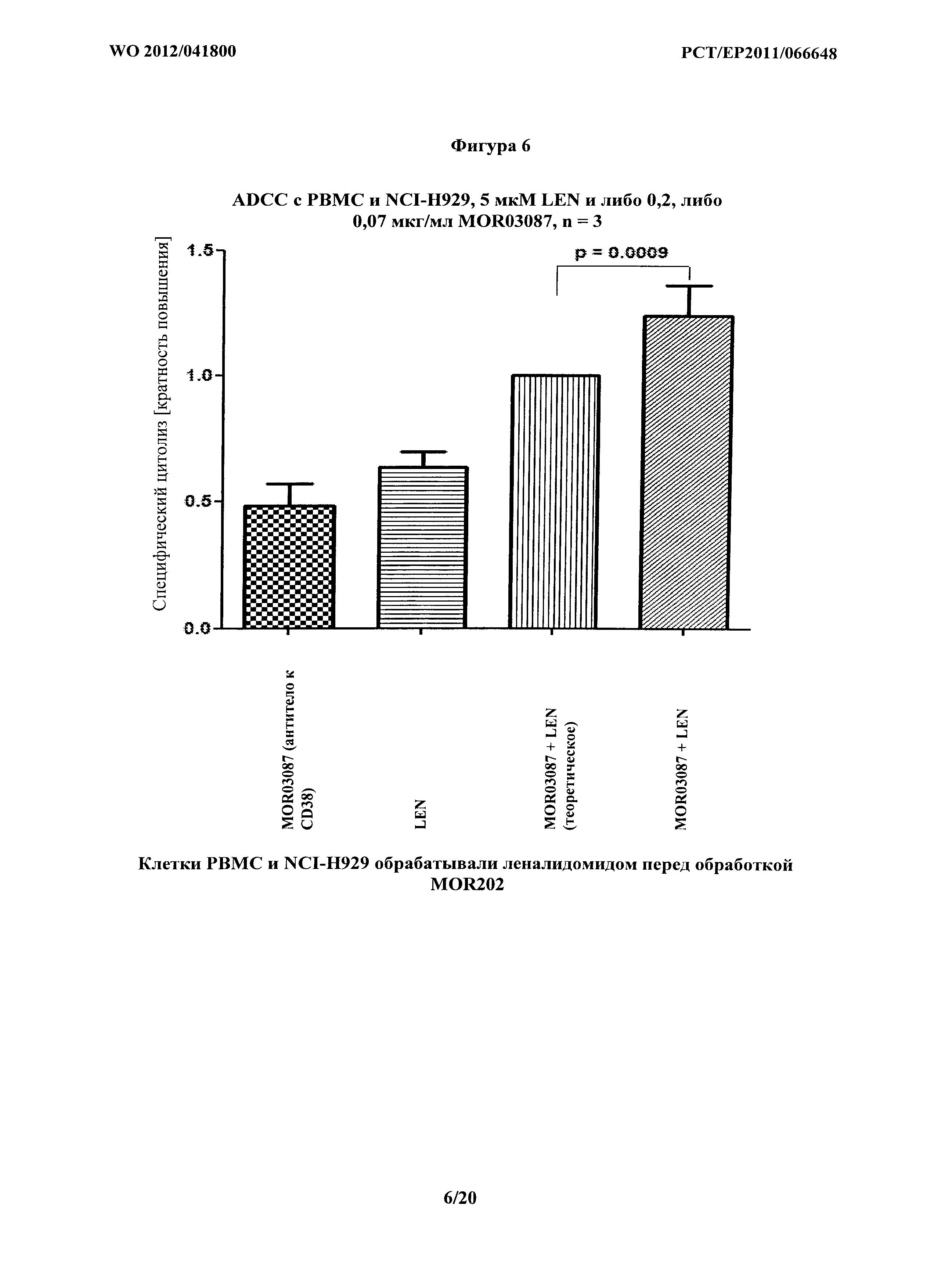
На фигуре 6 показано опосредование ADCC на клетках NCI-H929 комбинацией MOR03087 и леналидомида. Клетки РВМС и NCI-H929 обрабатывали леналидомидом перед обработкой MOR03087. Теоретическое представляет комбинацию, рассчитанную с применением метода дольного продукта по Chou и соавт. Показанные данные представляют собой средние величины из Таблицы 7b.
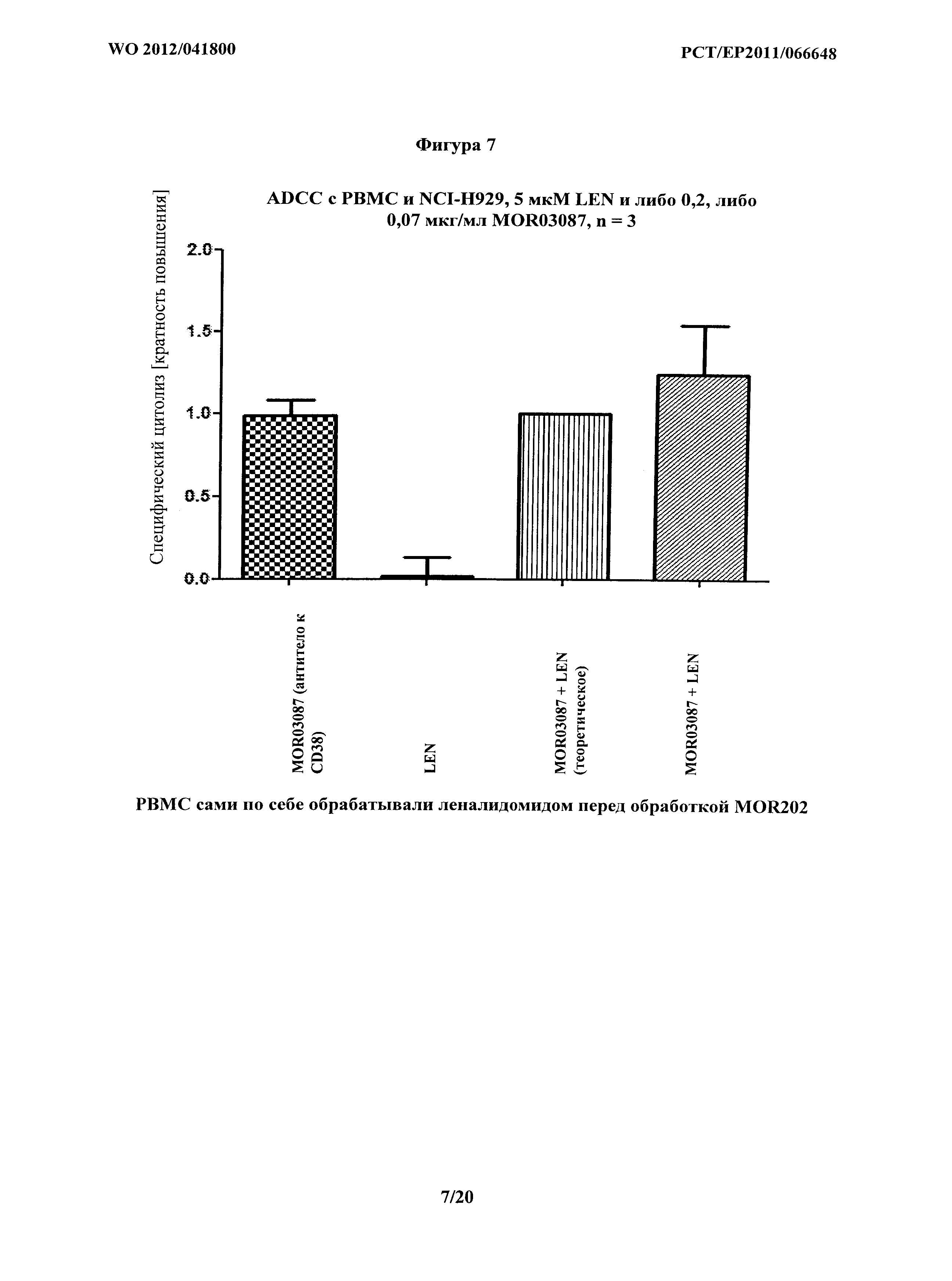
На фигуре 7 показано опосредование ADCC на клетках NCI-H929 комбинацией MOR03087 и леналидомида. Только РВМС обрабатывали леналидомидом перед обработкой MOR03087. Теоретическое представляет комбинацию, рассчитанную с применением метода дольного продукта по Chou и соавт. Показанные данные представляют собой средние величины из Таблицы 8b.
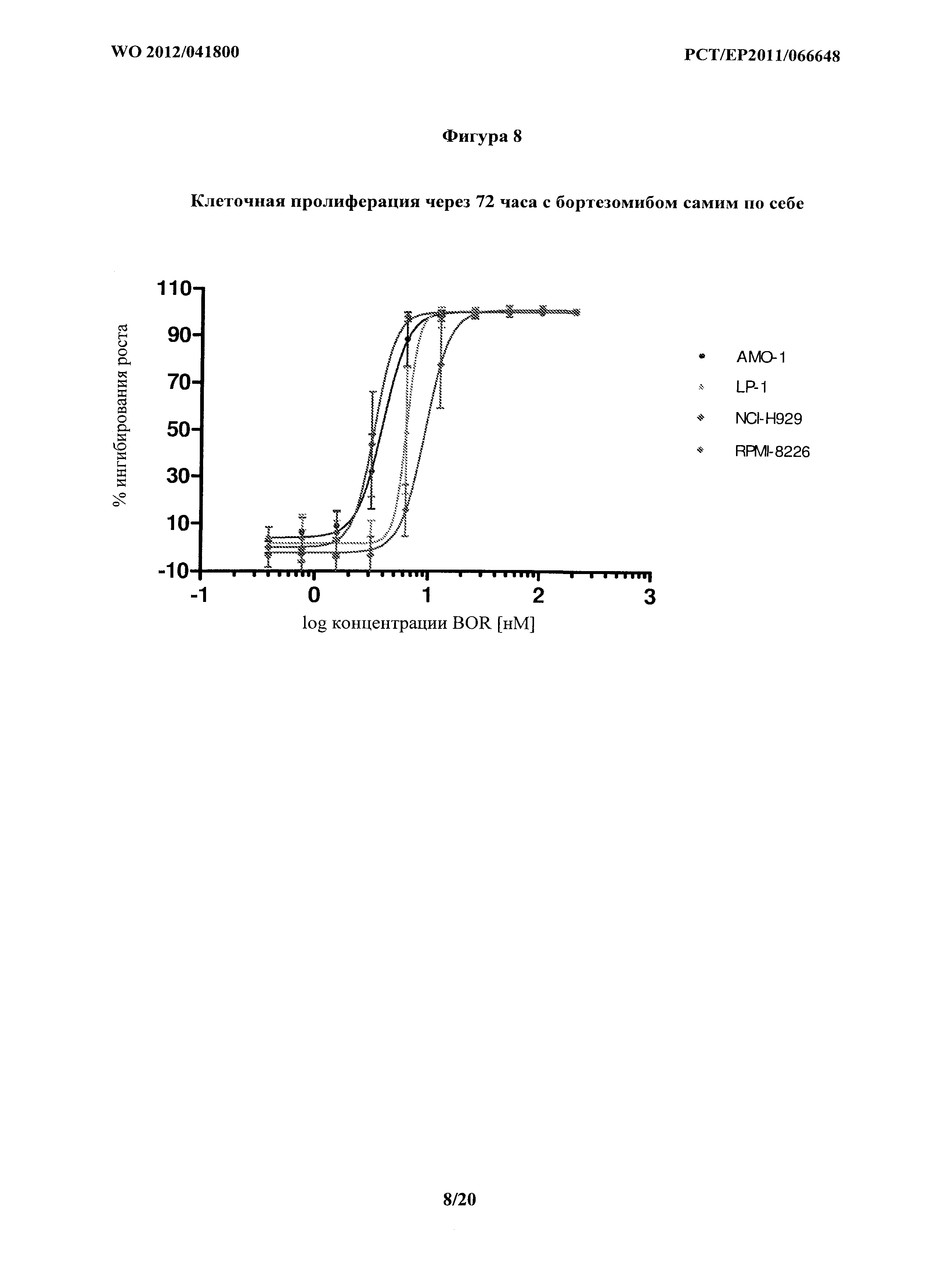
На фигуре 8 показано ингибирование роста различных клеточных линий множественной миеломы, вызванное бортезомибом самим по себе. IC50 на клетках АМО-1 составляла 3,9 нМ. IC50 на клетках LP-1 составляла 6,1 нМ. IC50 на клетках NCI-H929 составляла 3,3 нМ. IC50 на клетках RPMI-8226 составляла 9,0 нМ.
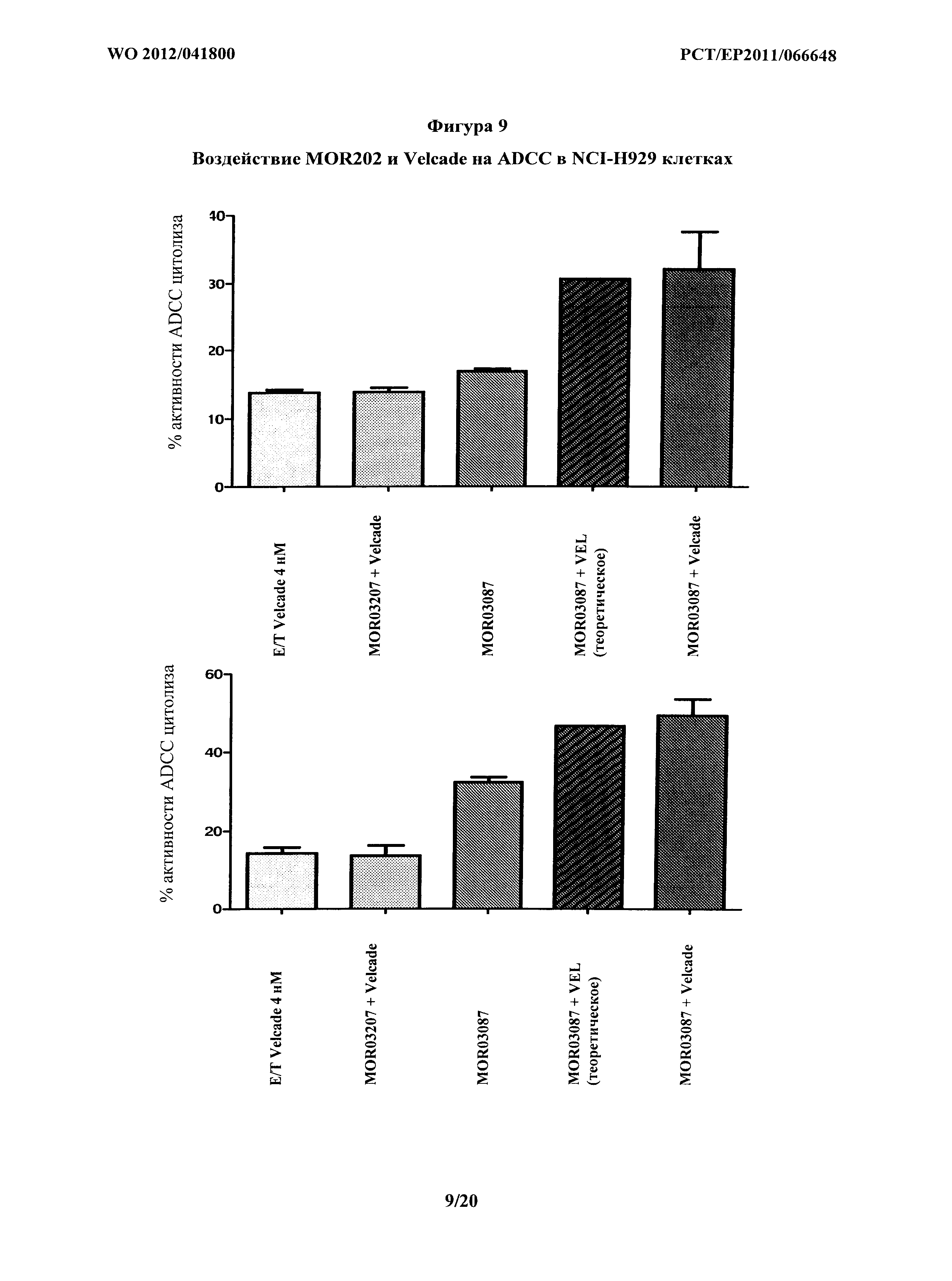
На фигуре 9 показано опосредование ADCC на клетках NCI-H929 комбинацией MOR03087 при 15 мкг/мл и Velcade® (бортезомиб). Две диаграммы представляют двух разных доноров.
На фигуре 10 показано опосредование ADCC на клетках LP-1 комбинацией MOR202 при 15 мкг/мл и Velcade® (бортезомиб). Две диаграммы представляют двух разных доноров.
На фигуре 11 показана аминокислотная последовательность MOR202.
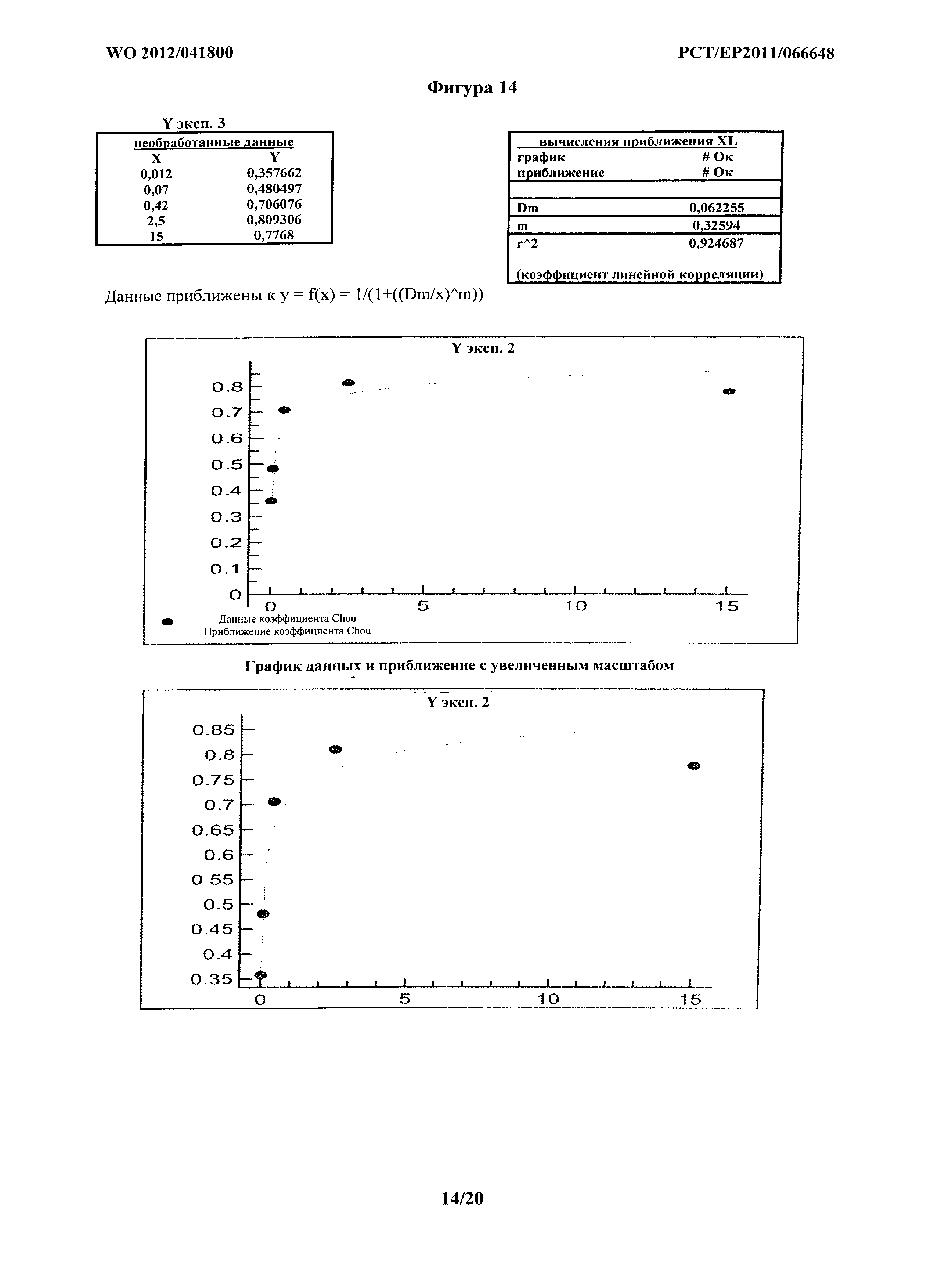
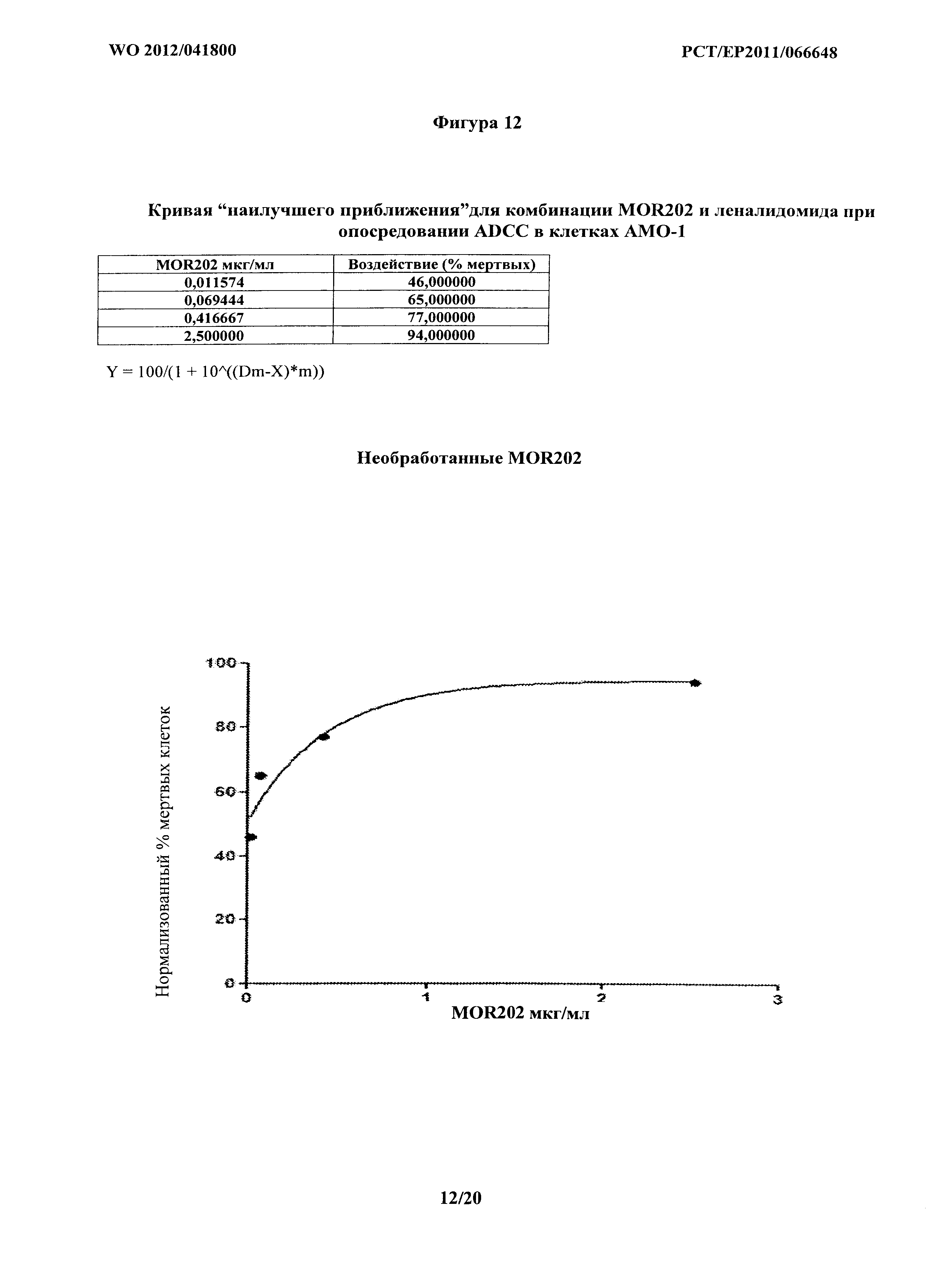
На фигуре 12 показана кривая наилучшего приближения, как описано в Chou и соавт., для комбинации MOR202 и леналидомида при опосредовании ADCC на клетках АМО-1, и она также является типичной для кривой наилучшего соответствия, генерируемой для анализа опосредования ADCC на клетках NCI-H929.
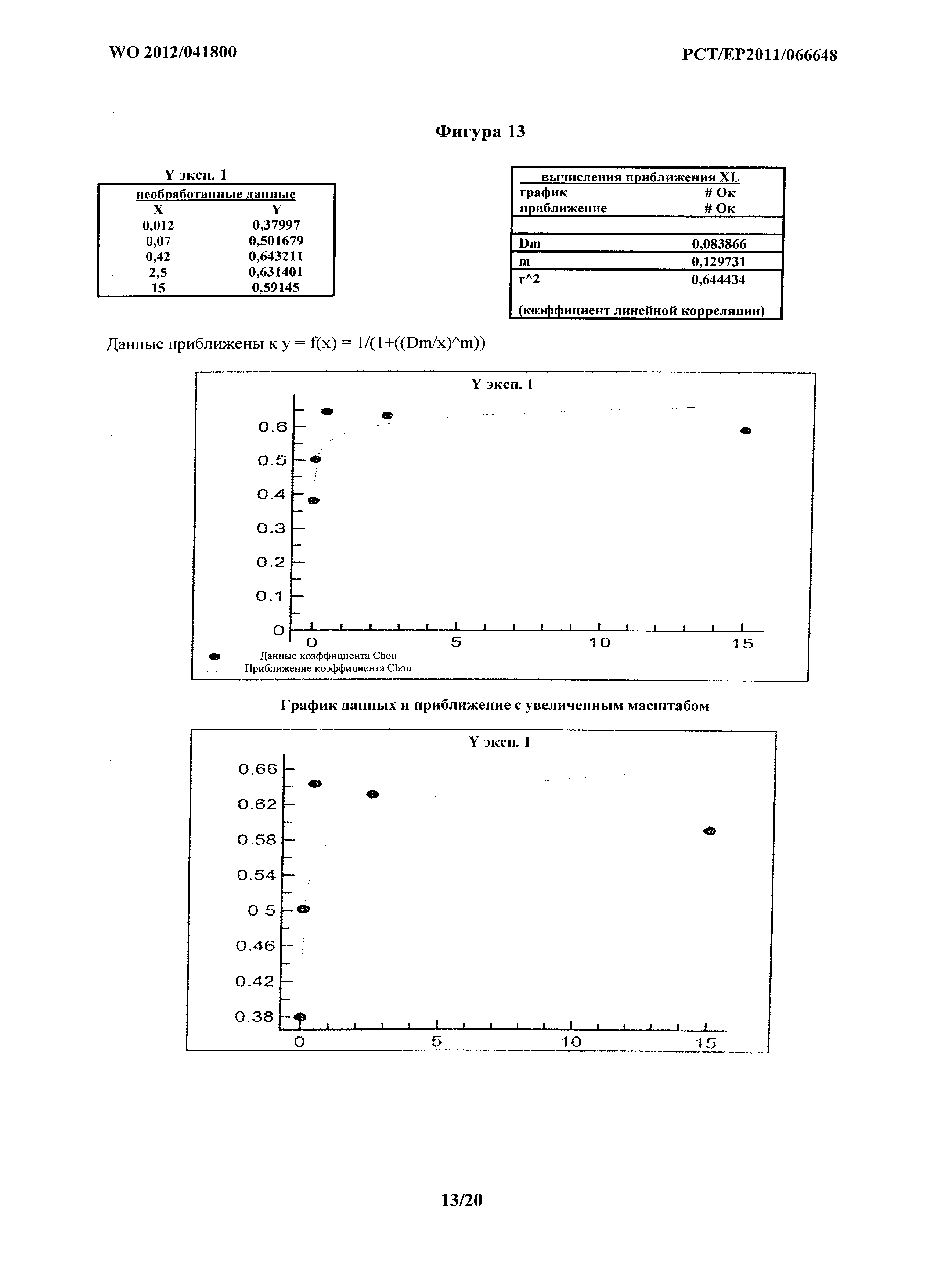
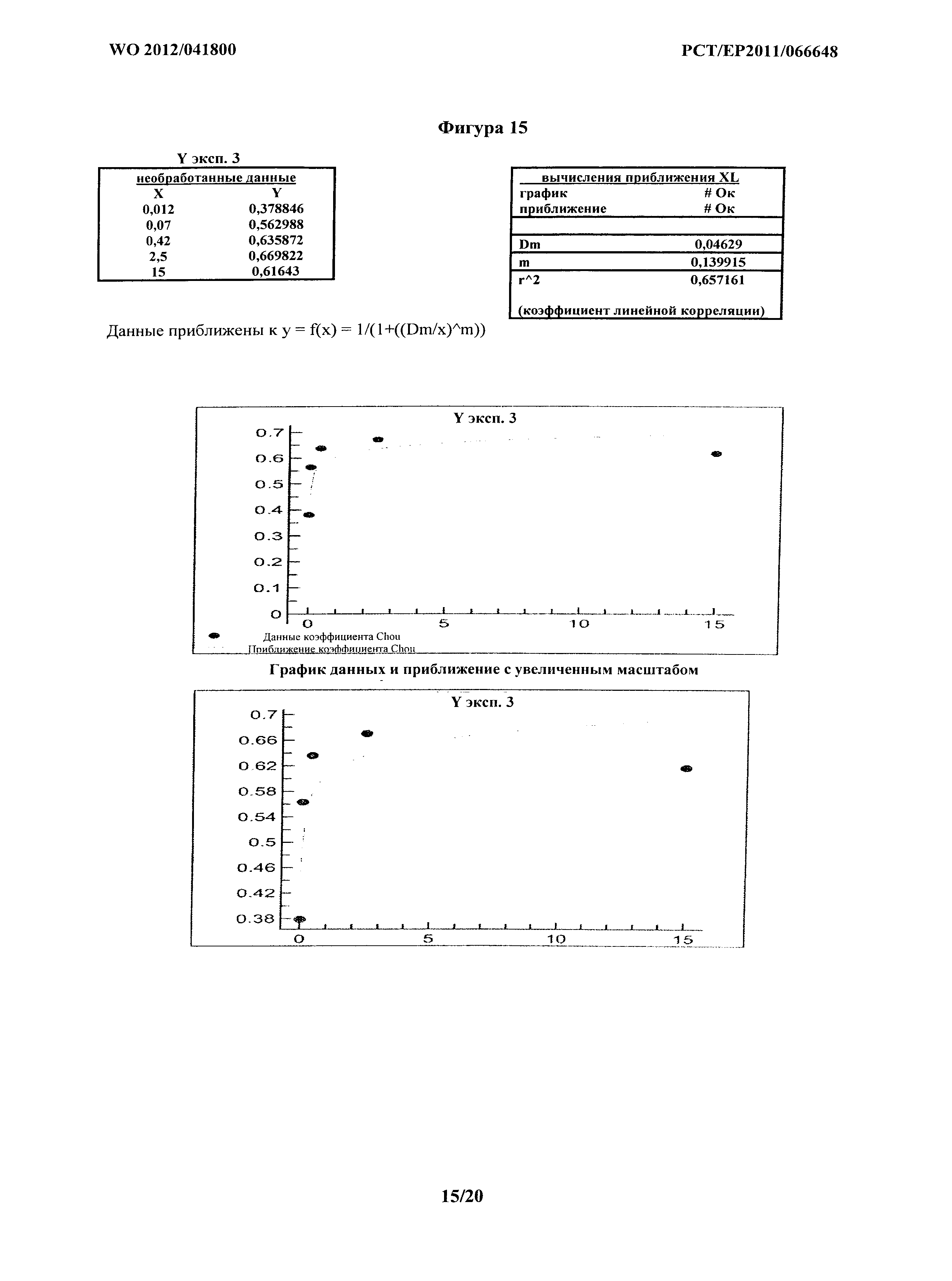
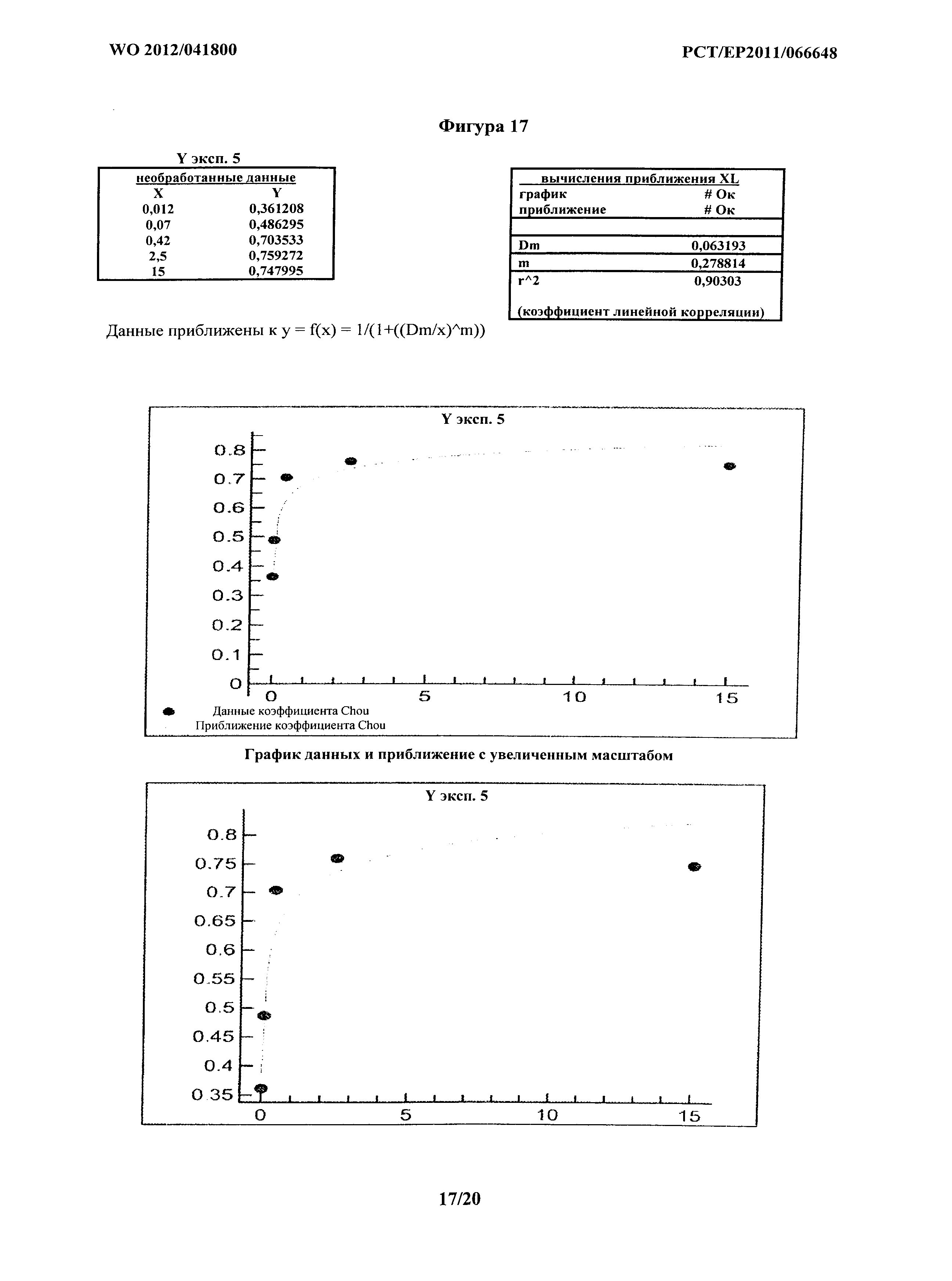
На фигурах 13-18 показан факторный анализ синергизма по Chou для шести отдельных экспериментов с применением комбинации MOR202 и леналидомида при опосредовании ADCC на клетках АМО-1. На фигуре 13 показан эксперимент 1. На фигуре 14 показан эксперимент 2. На фигуре 15 показан эксперимент 3. На фигуре 16 показан эксперимент 4. На фигуре 17 показан эксперимент 5. На фигуре 18 показан эксперимент 6. Фигуры 13-15 получали из трех экспериментов, показанных в Таблицах 3а-с и на фигуре 3. Фигуры 16-18 получали из трех экспериментов, показанных в Таблицах 4а-с и на фигуре 4.
На фигуре 19 показано полученное с помощью компьютерной микротомографии изображение среднего общего объема кости каждой из исследуемых групп, описанных в Примере 7, где результаты показаны в Таблице 11.
На фигуре показано полученное с помощью компьютерной микротомографии изображение среднего общего объема кости каждой из исследуемых групп, описанных в Примере 11, где результаты показаны в Таблице 17.
Подробное описание изобретения
"Синергия", "синергизм" или "синергический" означает больше, чем ожидаемый аддитивный эффект комбинации. "Синергия", "синергизм" или "синергический" эффект комбинации определяют в данном документе способами по Chou и соавт. и/или Clarke и соавт. Смотри, Ting-Chao Chou, Theoretical Basis, Experimental Design, and Computerized Simulation of Synergism and Antagonism in Drug Combination Studies, Pharmacol Rev 58: 621-681 (2006), которая включена по ссылке в своей полноте. В Chou и соавт. раскрыты многие способы определения синергизма и по меньшей мере один из этих способов применяют в данном документе. Смотри также, Clarke et al., Issues in experimental design and endpoint analysis in the study of experimental cytotoxic agents in vivo in breast cancer and other models. Breast Cancer Research and Treatment 46: 255-278 (1997), которая включена по ссылке в своей полноте.
Выражение "антитело" означает моноклональные антитела, включая любой изотип, такой как IgG, IgM, IgA, IgD и IgE. IgG-антитело состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей, которые соединены дисульфидными связями. Каждая тяжелая и легкая цепь содержит константный участок и вариабельный участок. Каждый вариабельный участок содержит три сегмента, называемые "участками, определяющими комплементарность" ("CDR") или "гипервариабельные участки", которые преимущественно отвечают за связывание эпитопа антигена. Их называют CDR1, CDR2 и CDR3, пронумерованные последовательно от N-конца. Более высококонсервативные части вариабельных участков вне CDR называют "каркасными участками". "Фрагмент антитела" означает Fv-, scFv-, dsFv-, Fab-, Fab', F(ab')2-фрагмент или другой фрагмент, который содержит по меньшей мере один вариабельный участок тяжелой или вариабельный участок легкой цепи, каждая из которых содержит CDR и каркасные участки.
THALOMID® (талидомид) в комбинации с дексаметазоном показан для лечения пациентов с впервые выявленной множественной миеломой и поставляемый на рынок Celgene.
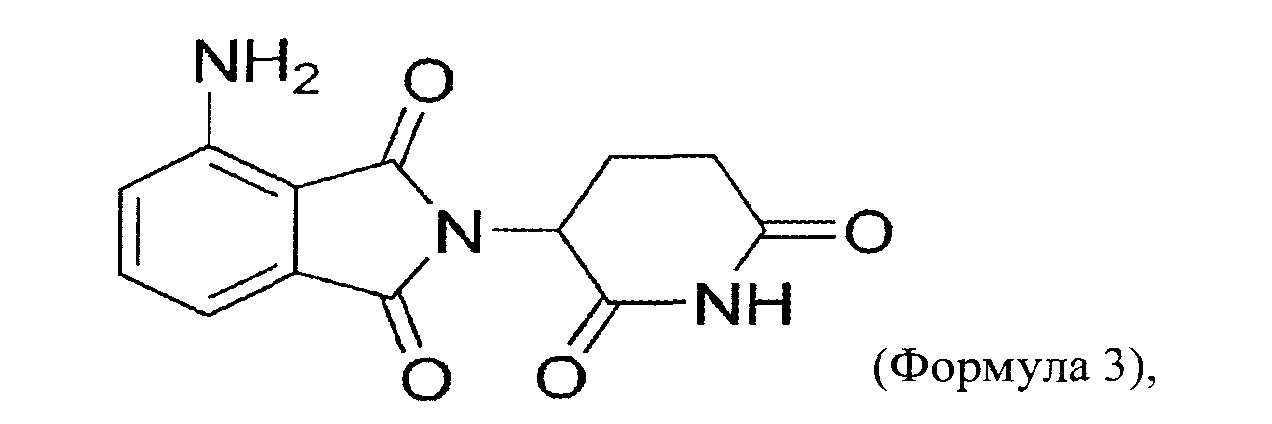
"Аналог талидомида" включает без ограничения сам талидомид, леналидомид (СС-5013, Revlimid™), помалидомид (СС4047, Actimid™) и соединения, раскрытые в WO 2002068414 и WO 2005016326, которые включены по ссылке в своей полноте. Выражение относится к синтетическому химическому соединению, использующему структуру талидомида в качестве скелета (например, были присоединены боковые группы или такие группы были удалены из исходной структуры). Аналог отличается по структуре от талидомида и его соединений-метаболитов, как, например, различием по длине длина алкильной цепи, фрагменту молекулы, по одной или нескольким функциональным группам или изменению при ионизации. Выражение "аналог талидомида" также включает метаболиты талидомида. Аналоги талидомида включают рацемическую смесь S- и R-энантиомера соответствующего соединения и S-энантиомер или R-энантиомер отдельно. Рацемическая смесь является предпочтительной. Аналоги талидомида включают соединения следующей структуры:
(А) Леналидомид
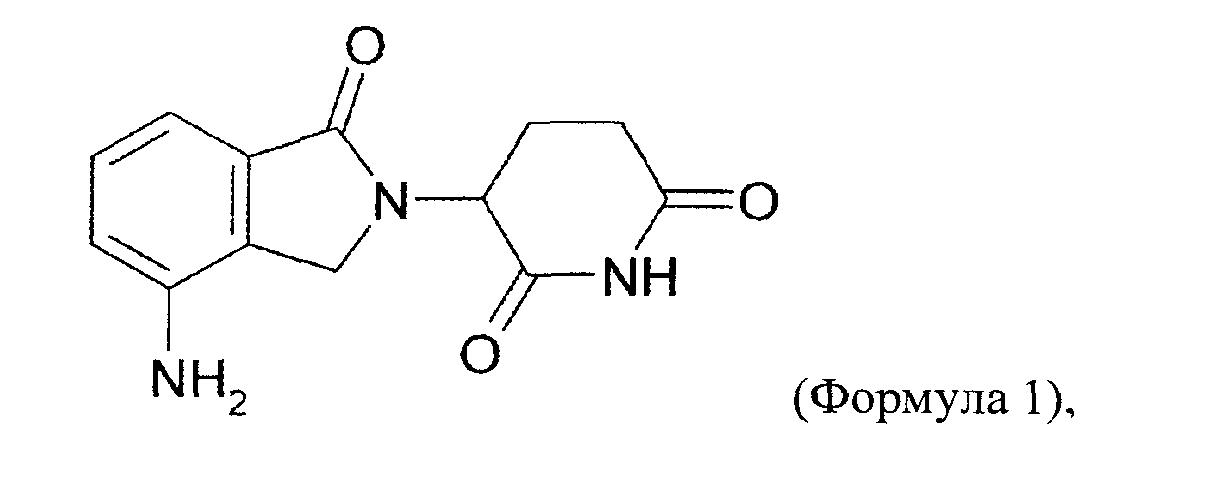
(В) Талидомид
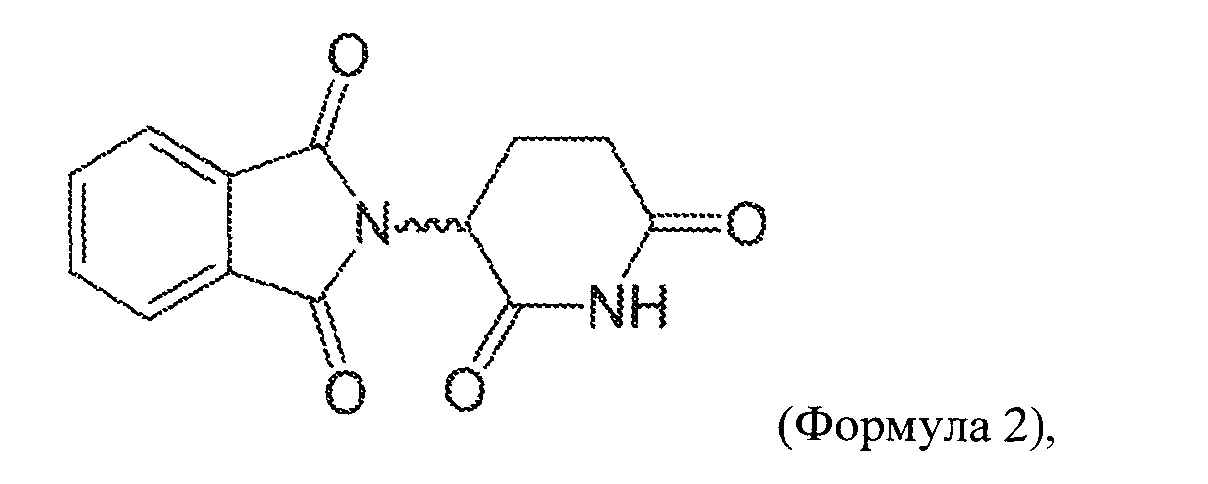
(С) Помалидомид
(D)
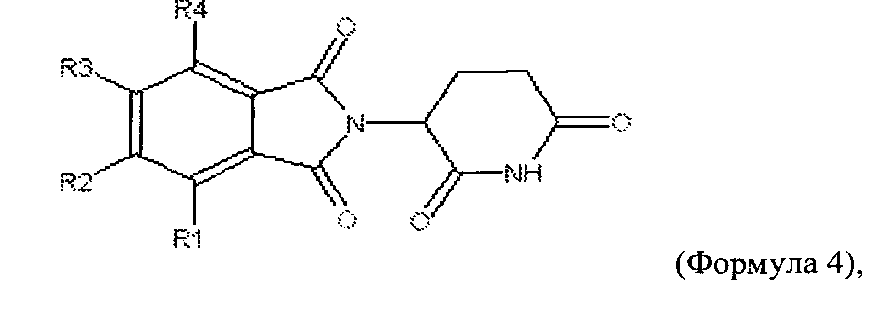
где каждый из R21, R22, R23 и R24 независимо представляет собой Н, алкокси, амино или алкиламин, и
(Е)
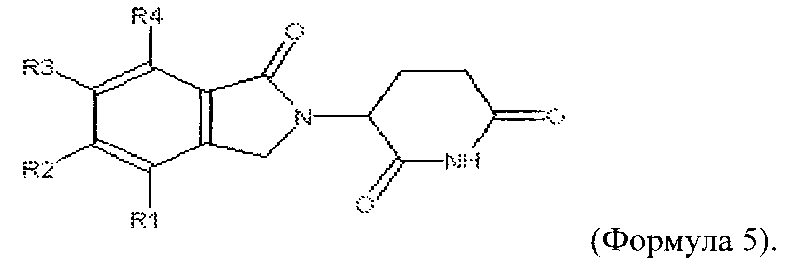
где каждый из R21, R22, R23, и R24 независимо представляет собой Н, алкокси, амино или алкиламин.
Леналидомид в настоящее время поставляется на рынок как Revlimid® or Celgene для лечения множественной миеломы. Леналидомид описан, как обладающий в отношении лечения опухолей по меньшей мере следующими свойствами: а) цитотоксичный к опухолевым клеткам, Gandhi et al., Lenalidomide inhibits proliferation of Namalwa CSN.70 cells and interferes with Gab1 phosphorylation and adaptor protein complex assembly, Leuk Res., 30(7): 849-58 (2006), которая включена по ссылке в своей полноте; b) активирует естественные клетки-киллеры (Nk), Gandhi et al., Dexamethasone synergizes with lenalidomide to inhibit multiple myeloma tumor growth, but reduces lenalidomide-induced immunomodulation of Т and NK cell function, Curr Cancer Drug Targets, 1; 10(2): 155-67 (March 2010), которая включена по ссылке в своей полноте; и с) повышающе регулирует экспрессию CD38 на опухолевых клетках, смотри, Lapalombella et al., Lenalidomide down-regulates the CD20 antigen and antagonizes direct and antibody-dependent cellular cytotoxicity of rituximab on primary chronic lymphocytic leukemia cells. Blood, 112:13, 5180-5189 (15 December 2008), которая включена по ссылке в своей полноте. "LEN" применяют для описания леналидомида.
Как описано, аналоги талидомида повышающе регулируют экспрессию CD38 на опухолевых клетках. Другие средства, которые повышающе регулируют экспрессию CD38 на поверхности опухолевых клеток, описаны в международной заявке WO 00/40265, заявке на патент США с серийным номером 09/226895, которая включена по ссылке в своей полноте (Research Development Foundation).
"Ингибитор протеасом" относится к соединению, которое блокирует действие протеасом, т.е. клеточных комплексов, которые разрушают белки, такие как, например, белок р53. Известно несколько классов ингибиторов протеасом. Класс пептид-боронатов включает бортезомиб (INN, PS-341; Velcade®), соединения, которые одобрены в США для лечения рецидивирующей множественной миеломы. Другим пептид-боронатом является СЕР-18770. Другие классы ингибиторов протеасом включают пептид-альдегиды (например, MG132), пептид-винилсульфоны, пептид-эпоксикетоны (например, эпоксомицин, карфилзомиб), ингибиторы на основе β-лактона (например, лактацистин, MLN 519, NPI-0052, салиноспорамид А), соединения, которые образуют дитиокарбаматные комплексы с металлами (например, дисульфирам, лекарственное средство, которое также применяют для лечения хронического алкоголизма), и некоторые антиоксиданты (например, эпигаллокатехин-3-галлат), катехин-3-галлат и салиноспорамид А.
"VH" относится к вариабельному участку тажелой цепи иммуноглобулина из анттела или фрагмента антитела. "VL" относится к вариабельному участку легкой цепи иммуноглобулина из антитела или фрагмента антитела.
Выражение "CD38" относится к белку, известному как CD38, имеющему следующие синонимы: ADP-рибозилциклаза 1, cADPr-гидролаза 1, гидролаза 1 циклической ADP-рибозы, Т10. CD38 человека имеет аминокислотную последовательность:

"MOR202" является антителом к CD38, чья аминокислотная последовательность представлена на фигуре 11. "MOR202" и "MOR03087" используют как синонимы для описания антитела, показанного на фигуре 11.
Последовательность ДНК, кодирующая вариабельный домен тяжелой цепи MOR202, представляет собой:
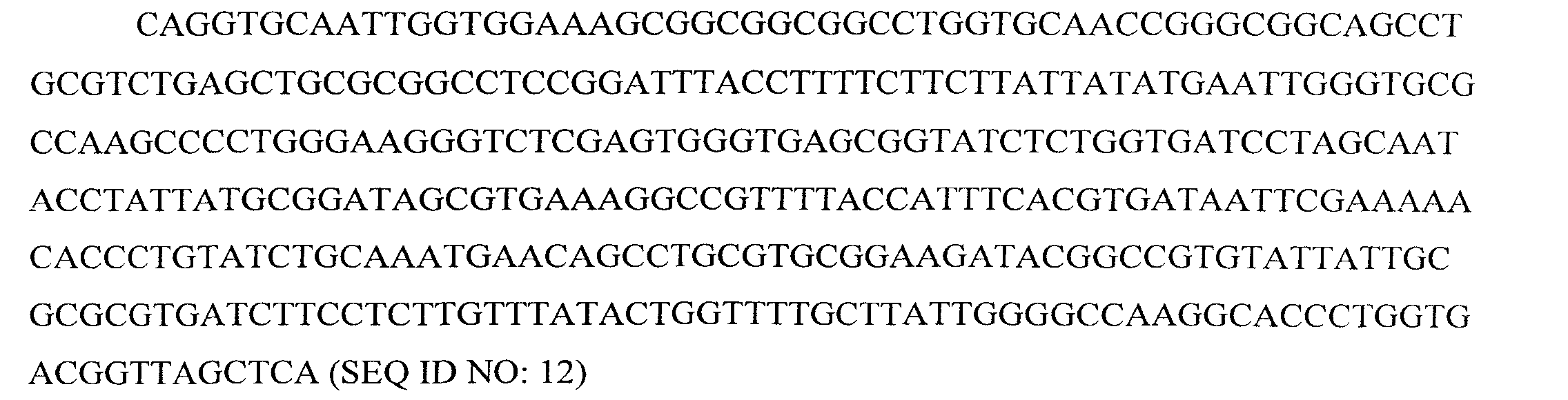
Последовательность ДНК, кодирующая вариабельный домен легкой цепи MOR202, представляет собой:
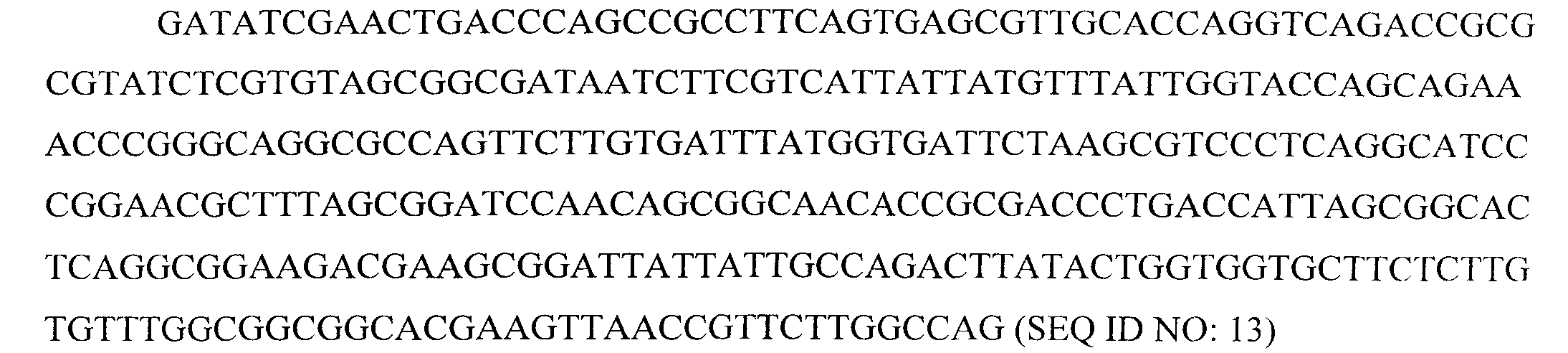
Антитело "Ref mAB5" представляет собой антитело к CD38, чья аминокислотная последовательность представлена ниже (CDR выделены полужирным шрифтом и подчеркнуты):
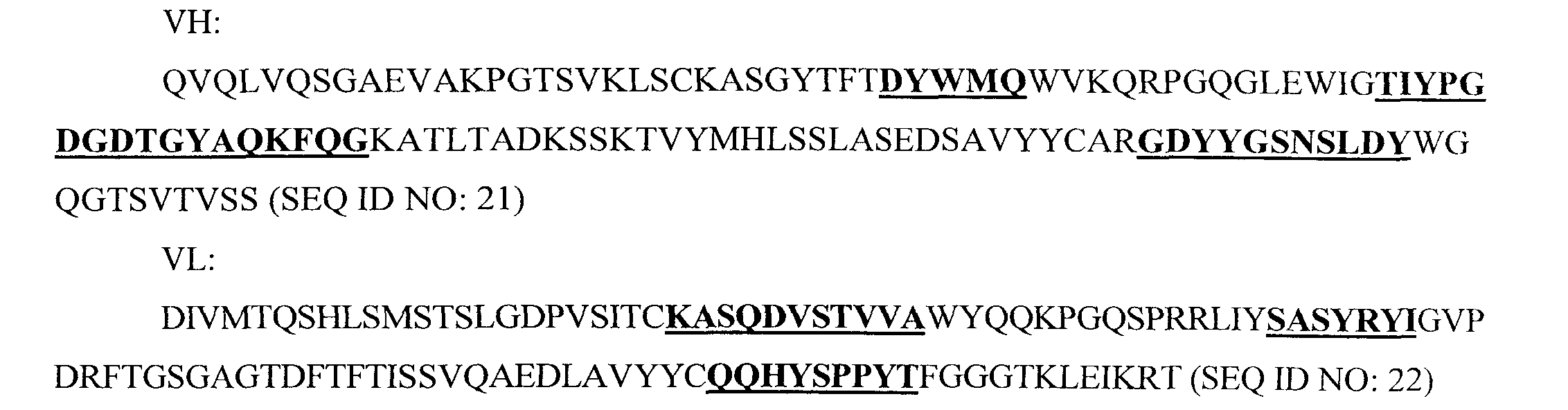
CDR Ref mAB5 определены Kabat и соавт. и антитело, имеющее такие же CDR, как Ref mAB5, описано в WO 2008/047242, заявке на патент США 12/441466, которая включена по ссылке в своей полноте.
"Fc-участок" означает константный участок антитела, которое у людей может быть из подкласса IgG1, 2, 3, 4 или других. Последовательности человеческих Fc-участков доступны в IMGT, Human IGH C-REGION, http://www.imgt.org/IMGTrepertoire/Proteins/protein/human/IGH/IGHC/Hu_IGHCallgenes.html (загруженная 16 мая 2011 г.).
"Усиливает активность ADCC" означает повышение при опосредовании антителозависимой клеточно-опосредованной цитотоксичности. Аминокислотные модификации в пределах Fc-участка, которые приводят в результате к усилению активности ADCC, раскрыты в WO 200042072, Genentech, WO 2004029207A2, Xencor, и WO 2004063351A2, Macrogenics, которые все включены по ссылке в своей полноте.
"MOR03207" представляет собой антитело, чья аминокислотная последовательность представляет собой:
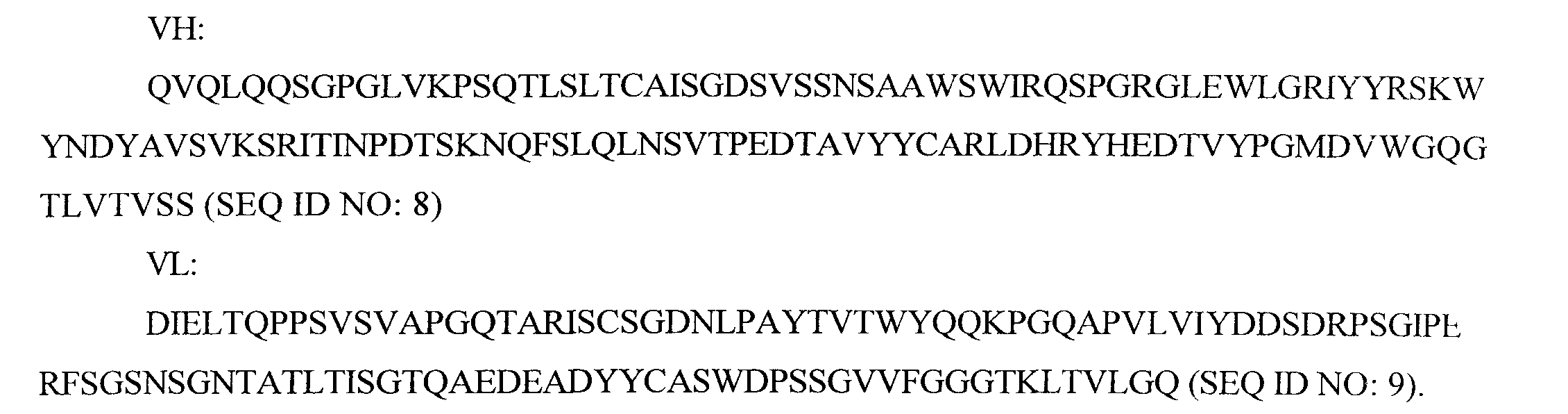
MOR03207 связывает лизоцим и применяется в качестве изотипического контроля, гак как оно представляет собой IgG1.
"Комбинация" означает более чем один элемент, например, соединение, такое как антитело и леналидомид.
Настоящее раскрытие также относится к комбинациям, фармацевтическим препаратам и фармацевтическим композициям, содержащим описанные комбинации. Два компонента синергической комбинации настоящего изобретения, например, антитело, специфичное к CD38, и леналидомид, можно вводить вместе или раздельно. При введении вместе два компонента можно составить вместе в одну фармацевтическую композицию, которая может включать фармацевтический приемлемый носитель или вспомогательное вещество Альтернативно, два компонента можно также составить в разных фармацевтических композициях. В данном случае два компонента можно вводить одновременно или последовательно. В варианте осуществления талидомид или его аналог, например, леналидомид, вводят перед и/или раздельно с введением антитела, специфичного к CD38, например, MOR202. В еще одном варианте осуществления леналидомид вводят по меньшей мере за 72 часа до введения антитела, специфичного к CD38, например, MOR202. Этот период времени позволяет опосредованную леналидомидом повышающую регуляцию CD38 в целевых клетках.
Фармацевтическая композиция включает активное средство, например, антитело для терапевтического применения у людей. Фармацевтическая композиция может включать приемлемые носители или вспомогательные вещества.
"Введенный" или "введение" включает без ограничения доставку с помощью инъекционной формы, такую как, например, внутривенный, внутримышечный, внутрикожный или подкожный путь, или мукозальный путь, например, в виде назального спрея или аэрозоля для ингаляции, или в виде инъекционного раствора, капсулы или таблетки.
"Терапевтически эффективное количество" соединения или комбинации относится к количеству, достаточному для излечения, ослабления или частичной подавления клинических проявлений данного заболевания или расстройства и его осложнений. Количество, которое является эффективным для конкретного терапевтического результата, будет зависеть от тяжести заболевания или повреждения, а также от веса и общего состояния субъекта и т.д. Будет понятно, что определение соответствующей дозировки можно достичь с помощью обычного экспериментирования путем построения матрицы значений и определения различных точек в матрице, все из этого находится в рамках обычных навыков обученного врача или ученого-клинициста.
Было обнаружено, что комбинация конкретного антитела к CD38 и леналидомида опосредовала синергический уровень антителозависимой клеточно-опосредованной цитотоксичности (ADCC) как у АМО-1, так и у NCI-H929 клеток множественной миеломы. К тому же конкретное антитело к CD38 при объединении с леналидомидом опосредовало синергический уровень снижения разрушения кости NCI-H929 в модели на SCID мышах и синергично увеличивало количество дней медианы выживаемости с RAMOS в модели на SCID мышах. Следовательно, комбинация проиллюстрированного антитела, специфичного к CD38, и леналидомида вела себя синергично как в in vitro, так и in vivo моделях, соответствующих множественной миеломе и/или неходжкинской лимфоме. Следовательно, эта комбинация дает синергические результаты при лечении множественной миеломы и/или неходжкинской лимфомы у людей.
Леналидомид представляет собой аналог талидомида, следовательно, ожидается, что другие аналоги талидомида, такие как помалидомид или талидомид сам по себе, также ведут к синергическим эффектам при применении в комбинации с антителом к CD38. К тому же, поскольку талидомид или его аналог повышающе регулируют экспрессию CD38 в клеточных линиях множественной миеломы, следовательно, ожидается, что синергизм должен получаться в результате, когда в комбинации применяют другие средства, которые повышающе регулирую г экспрессию CD38 на поверхности опухолевых клеток, например, транс-ретиноевая кислота, и антитела к CD38.
Было обнаружено, что комбинация конкретного антитела к CD38 и бортезомиба опосредовала высокий уровень антителозависимой клеточно-опосредованной цитотоксичности (ADCC) в клеточных линиях множественной миеломы NCI-H929 и LP-1. К тому же, было обнаружено, что комбинация конкретного антитела к CD38 и бортезомиба опосредовала синергический уровень снижения разрушения кости NCI-H929 в модели на SCID мышах и синергично повышала количество дней медианы выживаемости с RAMOS в модели на SCID мышах. Следовательно, комбинация проиллюстрированного антитела, специфичного к CD38, и бортезомиба вела себя синергично в in vivo моделях, соответствующей множественной миеломе и/или неходжкинской лимфоме. Следовательно, эта комбинация дает синергические результаты при лечении множественной миеломы и/или неходжкинской лимфомы у людей.
Ожидается, что другие ингибиторы протеасом, такие как, дисульфирам, эпигаллокатехин-3-галлат и салиноспорамид А будут приводить к подобным эффектам при применении в комбинации с антителом к CD38.
"CDR" в данном документе определены либо по Chothia и соавт., Kabat и соавт., либо по правилам внутренней нумерации. Смотри, Chothia С, Lesk AM. (1987) Canonical structures for the hypervariable regions of immunoglobulins. J Mol Biol., 196(4): 901-17, которая включена по ссылке в своей полноте. Смотри, Kabat Е.А, Wu T.T., Perry H.M., Gottesman K.S. and FoellerC. (1991) Sequences of Proteins of Immunological Interest. 5th edit., NIH Publication no. 91-3242, US Dept. of Health and Human Services, Washington, DC, которая включена по ссылке в своей полноте.
Варианты осуществления
Аспект настоящего описания включает синергическую комбинацию антитела, специфичного к CD38, и (а) талидомида или его аналога или (b) ингибитора протеасом, для применения при лечении множественной миеломы и неходжкинской лимфомы.
Аспект настоящего изобретения включает комбинацию антитела, специфичного к CD38, и талидомида или его аналога. В вариантах осуществления комбинация является синергической.
В вариантах осуществления антитело, специфичное к CD38, содержит HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6).
В вариантах осуществления антитело, специфичное к CD38, содержит HCDR1 участок с последовательностью DYWMQ (SEQ ID NO: 15), HCDR2 участок с последовательностью TIYPGDGDTGYAQKFQG (SEQ ID NO: 16), HCDR3 участок с последовательностью GDYYGSNSLDY (SEQ ID NO: 17), LCDR1 участок с последовательностью KASQDVSTVVA (SEQ ID NO: 18), LCDR2 участок с последовательностью SASYRYI (SEQ ID NO: 19) и LCDR3 участок с последовательностью QQHYSPPYT (SEQ ID NO: 20).
В аспекте комбинацию применяют для лечения множественной миеломы и/или неходжкинской лимфомы. Варианты осуществления включают комбинацию, где аналог талидомида представляет собой леналидомид.
Аспект относится к фармацевтическим композициям, содержащим комбинации. В вариантах осуществления композиция содержит приемлемый носитель. В вариантах осуществления композицию вводят в эффективном количестве.
Аспект настоящего раскрытия включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомида для лечения множественной миеломы и/или неходжкинской лимфомы.
Дополнительный вариант осуществления включает комбинацию, где антитело содержит вариабельный участок тяжелой цепи с последовательностью QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYYMNWVRQAPGKGLEWVSGISGDPSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLPLVYTGFAYWGQGTLVTV SS (SEQ ID NO: 10) и вариабельный участок легкой цепи с последовательностью DIELTQPPSVSVAPGQTARISCSGDNLRHYYVYWYQQKPGQAPVLVIYGDSKRPSGIPERFSGSNSGNTATLTISGTQAEDEADYYCQTYTGGASLVFGGGTKLTVLGQ (SEQ ID NO: 11).
Аспект настоящего описания включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью DYWMQ (SEQ ID NO: 15), HCDR2 участок с последовательностью TIYPGDGDTGYAQKFQG (SEQ ID NO: 16), HCDR3 участок с последовательностью GDYYGSNSLDY (SEQ ID NO: 17), LCDR1 участок с последовательностью KASQDVSTVVA (SEQ ID NO: 18), LCDR2 участок с последовательностью SASYRYI (SEQ ID NO: 19) и LCDR3 участок с последовательностью QQHYSPPYT (SEQ ID NO: 20), и леналидомида для лечения множественной миеломы и/или неходжкинской лимфомы.
Дополнительный вариант осуществления включает комбинацию, где антитело содержит вариабельный участок тяжелой цепи с последовательностью QVQLVQSGAEVAKPGTSVKLSCKASGYTFTDYWMQWVKQRPGQGLEWIGTIYPGDGDTGYAQKFQGKATLTADKSSKTVYMHLSSLASEDSAVYYCARGDYYGSNSLDYWGQGTSVTV SS (SEQ ID NO: 21) и вариабельный участок легкой цепи с последовательностью DIVMTQSHLSMSTSLGDPVSITCKASQDVSTVVAWYQQKPGQSPRRLIYSASYRYIGVPDRFTGSGAGTDFTFTISSVQAEDLAVYYCQQHYSPPYTFGGGTKLEIKRT (SEQ ID NO: 22).
В вариантах осуществления антитело имеет Fc-участок IgG1. В вариантах осуществления антитело содержит модифицированный Fc-участок, где указанная модификация усиливает активность ADCC.
В другом аспекте компоненты комбинации, антитело, специфичное к CD38, и леналидомид, вводят раздельно. В варианте осуществления леналидомид вводят до введения антитела, специфичного к CD38. В еще одном варианте осуществления леналидомид вводят по меньшей мере за 72 часа до введения антитела, специфичного к CD38.
В другом аспекте синергическая комбинация антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомида способна опосредовать цитолиз экспрессирующих CD38 клеток АМО-1 и/или клеток NCI-H929 посредством ADCC в присутствии выделенных РВМС человека с эффективностью по меньшей мере в два раза, три раза, четыре раза, пять раз лучшей, чем леналидомид сам по себе.
В другом аспекте синергическая комбинация антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомида способна снижать разрушение кости с эффективностью по меньшей мере в два раза, три раза, четыре раза, пять раз лучшей, чем леналидомид сам по себе.
Другой аспект включает способ лечения множественной миеломы и/или неходжкинской лимфомы у лица, нуждающегося в этом, при этом способ включает введение антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомида лицу с множественной миеломой или неходжкинской лимфомой. В вариантах осуществления комбинацию вводят в эффективном количестве.
Другой аспект включает комбинацию, содержащую антитело, специфичное к CD38, содержащей HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомид. В варианте осуществления комбинацию применяют для лечения рака. В еще одном варианте осуществления рак выбран из множественной миеломы и неходжкинской лимфомы.
Другой аспект включает комбинацию антитела, специфичного к CD38, и ингибитора протеасом. В вариантах осуществления комбинация является синергической. В вариантах осуществления антитело, специфичное к CD38, содержит HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6).
В аспекте комбинацию применяют для лечения множественной миеломы и/или неходжкинской лимфомы. В вариантах осуществления комбинация содержит ингибитор протеасом, который представляет собой бортезомиб. Аспект относится к фармацевтическим композициям, содержащим комбинации. В вариантах осуществления композиция содержит приемлемый носитель. В вариантах осуществления композицию вводят в эффективном количестве.
Аспект настоящего раскрытия включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиб для лечения множественной миеломы и/или неходжкинской лимфомы.
Дополнительный вариант осуществления содержит комбинацию, где ан гит ело содержит вариабельный участок тяжелой цепи с последовательностью QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYYMNWVRQAPGKGLEWVSGISGDPSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLPLVYTGFAYWGQGTLVTVSS (SEQ ID NO: 10) и вариабельный участок легкой цепи с последовательностью DIELTQPPSVSVAPGQTARISCSGDNLRHYYVYWYQQKPGQAPVLVIYGDSKRPSGIPERFS GSNSGNTATLTISGTQAEDEADYYCQTYTGGASLVFGGGTKLTVLGQ (SEQ ID NO. 11).
В вариантах осуществления антитело имеет Fc-участок IgG1. В вариантах осуществления антитело содержит модифицированный Fc-участок, где указанная модификация усиливает активность ADCC.
В варианте осуществления комбинацию применяют для лечения рака. В еще одном варианте осуществления рак выбран из множественной миеломы и неходжкинской лимфомы.
В другом аспекте компоненты комбинации, антитело и ингибитор протеасом, вводят раздельно.
В другом аспекте синергическая комбинация антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиба способна опосредовать цитолиз экспрессирующих CD38 клеток LP-1 и/или клеток NCI-H929 посредством ADCC в присутствии выделенных РВМС человека с эффективностью по меньшей мере в два раза, три раза, четыре раза, пять раз лучшей, чем бортезомиб сам по себе.
В другом аспекте синергическая комбинация антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5), и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиба способна снижать разрушение кости с эффективностью по меньшей мере в два раза, три раза, четыре раза, пять раз лучшей, чем бортезомиб сам по себе.
В другом аспекте настоящее раскрытие включает способ лечения множественной миеломы и/или неходжкинской лимфомы у лица, нуждающегося в этом, причем способ включает введение антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиба лицу с множественной миеломой или неходжкинской лимфомой.
В вариантах осуществления комбинацию вводят в эффективном количестве.
Другой аспект включает комбинацию, содержащую антитело, специфичное к CD38, содержащее HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиб.
Аспект включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и
(a) талидомида или его аналога или
(b) ингибитора протеасом для применения при лечении множественной миеломы и неходжкинской лимфомы.
Варианты осуществления включают комбинацию, где антитело содержит вариабельный участок тяжелой цепи с последовательностью
QVQLVESGGGLVQPGGSLRLSCAASGFTFSSYYMNWVRQAPGKGLEWVSGISGDPSNTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDLPLVYTGFAYWGQGTLVTVSS (SEQ ID NO: 10) и вариабельный участок легкой цепи с последовательностью
DIELTQPPSVSVAPGQTARISCSGDNLRHYYVYWYQQKPGQAPVLVIYGDSKRPSGIPERFSGSNSGNTATLTISGTQAEDEADYYCQTYTGGASLVFGGGTKLTVLGQ (SEQ ID NO: 11).
Варианты осуществления включают комбинацию, где антитело содержит Fc-участок IgG1. Варианты осуществления включают комбинацию, где антитело содержит модифицированный Fc-участок, где указанная модификация усиливает активность ADCC.
Варианты осуществления включают комбинацию, где указанное антитело, специфичное к CD38, и указанный талидомид или его аналог или ингибитор протеасом вводят раздельно.
Варианты осуществления включают комбинацию, которая способна снижать разрушение кости с эффективностью по меньшей мере в два раза лучшей, чем леналидомид и/или бортезомиб сам по себе.
Варианты осуществления включают комбинацию, где указанное антитело, специфичное к CD38, объединено с талидомидом или его аналогом. Варианты осуществления включают комбинацию, где аналог талидомида включает леналидомид. Варианты осуществления включают комбинацию, где леналидомид вводят до введения антитела, специфичного к CD38. Варианты осуществления включают комбинацию, где леналидомид вводят по меньшей мере за 72 часа до введения антитела, специфичного к CD38.
Варианты осуществления включают комбинацию антитела, специфичного к CD38, и леналидомида, которая способна опосредовать цитолиз экспрессирующих CD38 клеток АМО-1 и/или NCI-H929 посредством ADCC в присутствии выделенных РВМС человека с эффективностью по меньшей мере в два раза лучшей, чем леналидомид сам по себе.
Варианты осуществления включают комбинацию, содержащую указанное антитело, специфичное к CD38, и ингибитор протеасом. В некоторых вариантах осуществления ингибитор протеасом представляет собой бортезомиб. Варианты осуществления включаю г комбинацию антитела, специфичного к CD38, и бортезомиба, которая способна опосредовать цитолиз экспрессирующих CD38 клеток LP-1 и/или NCI-H929 посредством ADCC в присутствии выделенных РВМС человека с эффективностью по меньшей мере в два раза лучшей, чем бортезомиб сам по себе.
Аспект включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и леналидомида или другого аналога талидомида для применения при лечении множественной миеломы и неходжкинской лимфомы.
Аспект включает синергическую комбинацию антитела, специфичного к CD38, содержащего HCDR1 участок с последовательностью GFTFSSYYMN (SEQ ID NO: 1) или с последовательностью SYYMN (SEQ ID NO: 14), HCDR2 участок с последовательностью GISGDPSNTYYADSVKG (SEQ ID NO: 2), HCDR3 участок с последовательностью DLPLVYTGFAY (SEQ ID NO: 3), LCDR1 участок с последовательностью SGDNLRHYYVY (SEQ ID NO: 4), LCDR2 участок с последовательностью GDSKRPS (SEQ ID NO: 5) и LCDR3 участок с последовательностью QTYTGGASL (SEQ ID NO: 6), и бортезомиба или другого ингибитора протеасом для применения при лечении множественной миеломы и неходжкинской лимфомы.
Примеры
Пример 1: Экспрессия CD38 на поверхности различных клеточных линий
Клеточные линии из Таблицы 1 исследовали в отношении уровней экспрессии CD38.
|
|
Образцы костного мозга (4-10 мл пунктата) от пациентов с множественной миеломой и образцы экстрамедуллярной опухоли плазмацитомы получали после информированного согласия из Klinikum rechts der Isar ("Krdl") (Мюнхен, Германия). Образцы подвергали центрифугированию и дальнейшего обогащения плазмацитами достигали посредством магнито-активированного клеточного сортинга.
Клетки окрашивали антителами QuantiBRITETM к CD38, непосредственно меченными РЕ, (Becton Dickinson GmbH, клон НВ7, кат. №342371), которое является специфичным к CD38. "Количество связанных антител на клетку" (АВС) определяли с применением системы QuantiBRITETM на основе проточной цитометрии, которая измеряет среднее геометрическое (GeoMean) на клетку. Преобразование измеренного GeoMean в соответствующее количество АВС на клетку выполняли с помощью программного обеспечения GraphPad PRISMTM. Предполагают, что значения АВС соответствуют количеству молекул CD38 на клетку, поскольку QuantiBRITE™ CD38-PE несет одну молекулу РЕ на антитело. Результаты показаны в Таблице 2.
Пример 2: Оценка воздействия леналидомида на повышающую регуляцию CD38 у различных клеточных линий
Чтобы определить: вызывал ли леналидомид повышающую регуляцию CD38 в клетках множественной миеломы и плазмацитомы из Таблицы 1, клеточные линии инкубировали с 100 мкМ леналидомидом и, затем, экспрессию CD38 на поверхности анализировали с помощью FACS.
Материалы и способы
Около 2×105 клеток каждой из клеточных линий из Таблицы 1 высевали на 48-луночные чашки в стандартную среду RPMI. Леналидомид, приобретенный у Selleck Chemicals (LLC S1029, CAS №191732-6; партия: S 10290), вносили в соответствующие лунки до конечной концентрации 100 мкМ в объеме 750 мкл, содержащем 20% FCS и 0,1% DMSO. В качестве отрицательного контроля применяли 0,1% DMSO в дополненной FCS среде и планшеты инкубировали в течение 24 часов, 48 часов и 72 часов при 37°С и 5% СО2 в увлажняемом инкубаторе.
Клетки ресуспендировали аккуратным пипетированием и 250 мкл суспензии клеток на период инкубирования переносили в лунку 96-луночного круглодонного планшета. Клетки отмывали центрифугированием в течение 1 мин. при 700×g и ресуспендировали в 150 мкл холодного буфера для FACS (1×PBS, дополненный 3% FCS). Клетки вновь осаждали центрифугированием и ресуспендировали в 150 мкл буфера для FACS, содержащей 15 мг/мл антитела к CD38 (MOR202, IgG1) или контрольного антитела MOR03207, и инкубировали в течение 1 часа на льду. Клетки затем отмывали 3 раза центрифугированием и ресуспендировали в буфере для FACS, дополненного меченным РЕ вторичным антителом (РЕ-Fab2-фрагмент, антитело козы к IgG человека, специфичное к Fc-фрагменту; Jackson Immuno Research; кат.: 109-116-098; лот: 80938). Клетки инкубировали в течение 45 минут на льду, затем отмывали 3 раза центрифугированием и ресуспендировали в буфере для FACS. Суспензии клеток затем подвергали FACS анализу с применением устройства FACS array.
Базальная экспрессия CD38 каждой клеточной линией и влияние леналидомида на экспрессию CD38 показаны в Таблице 2. Дополнительно, влияние леналидомида на экспрессию CD38 клетками АМО-1, показано на фигуре 1 и влияние леналидомида на экспрессию CD38 клетками NCI-H929 показано на фигуре 5.
|
|
Пример 3: Ингибирование пролиферации клеток АМО-1 с применением леналидомида самого по себе
Цитотоксичность леналидомида исследовали на клетках АМО-1. Клетки собирали и распределяли в 96-луночных планшетах при 5000 клеток на лунку. Возрастающие количества леналидомида добавляли в лунки и планшеты инкубировали в течение 24 часов, 48 часов и 72 часов при 37°С в увлажняемом инкубаторе (5% СО2).
После инкубирования планшеты анализировали в отношении клеточной пролиферации в количественном колориметрическом анализе на основе ХТТ с применением набора для изучения клеточной пролиферации II (ROCHE, Cell Proliferation Kit II, кат. №:11465015001). Для дальнейшего измерения планшеты считывали на планшет-ридере Tecan Genios и определяли поглощение при 492 нм. Результаты показаны на фигуре 2.
Пример 4: Синергическая комбинация MOR0202 и леналидомида в клетках АМО-1
Клетки АМО-1 выбирали для исследования с комбинацией MOR202 и леналидомида. клетки АМО-1 являются сходными с клетками плазмацитомы у людей в том, что как те, так и другие имеют низкую базальную экспрессию CD38, и CD38 существенно повышаюше регулируется как у одних, так и у других при обработке леналидомидом, как показано в Таблице 2.
РВМС выделяли центрифугированием в градиенте плотности из свежевыделенной крови человека. Выделенную кровь от разных доноров наслаивали на определенный объем Biocoll (Biochrome AG; кат №: L6115; лот No.: 1050Т) в пробирке Falcon и центрифугировали при 380 g. РВМС выделяли и дополняли средой RPMI.
Через 72 часа клетки подсчитывали и РВМС доводили до концентрации 6,6×106/мл, тогда как клетки АМО-1 доводили до конечной концентрации 2,5×105/мл. Для последующей идентификации проточной цитометрией клетки АМО-1 окрашивали в течение 3 мин. 0,1 мкг/мл кальцеином AM (кальцеин: 1 мг/мл маточный раствор, Invitrogen, кат. №: С3099) и отмывали три раза аккуратным центрифугированием. 100 мкл суспензии целевых клеток смешивали со 100 мкл РВМС с достижением соотношения 1:30. Антитело MOR202 или антитело MOR03207 (отрицательный контроль) добавляли до конечной концентрации 15 мкл/мл. Клеточные суспензии дополнительно инкубировали в течение 4 часов при 37°С. Для выявления мертвых клеток АМО-1 на клеточные суспензии воздействовали пропидий-йодидом (PI) и затем анализировали проточной цитометрией. Целевые клетки отделяли посредством гейтирования положительных по кальцеину AM клеточных популяций и количественно определяли клетки, погибшие вследствие ADCC.
В сумме осуществляли шесть экспериментов с тем, чтобы определить опосредование ADCC на клетках АМО-1 комбинацией MOR202 и леналидомида. В трех экспериментах клетки РВМС и АМО-1 обрабатывали леналидомидом перед обработкой MOR202, результаты показаны в Таблицах 3а-с и на фигуре 3. В трех дополнительных экспериментах только РВМС обрабатывали леналидомидом перед обработкой MOR202, результаты показаны в Таблицах 4а-с и на фигуре 4.
Таблица 3: Как эффекторные, так и клетки АМО-1 обрабатывали леналидомидом перед обработкой MOR202. Применяли отдельные и комбинированные дозы 10 мкМ LEN и 15 мкг/мл MOR03207 и MOR202.
Данные представлены следующими тремя способами: как а) необработанные данные (% мертвых клеток), b) нормализованные данные специфичного цитолиза, где группа обработки MOR202 принята за 1 (100%), и с) нормализованные данные специфичного цитолиза, где теоретическая комбинация принята за 1 (100%). Таблица 3а представляет необработанные данные.
|
Единицы перечисленных значений представляют % мертвых клеток Группы с DMSO, MOR03207, MOR03207 + DMSO, LENO, LEN10 без РВМС и DMSO без РВМС являются контролями.
В Таблице 3b представлены данные из Таблицы 3а, но нормализованные, где группа обработки MOR202 принята за 1 (100%).
|
Для Таблиц 3b-с "теоретическое комбинации" представляет сумму значений для MOR202 самого по себе и значений для LEN самого по себе. Нормализованные данные из Таблицы 3b рассчитывают следующим образом. Таблица 3а представляет количество мертвых клеток. Следовательно, значения специфичного цитолиза из Таблицы 3b рассчитывают путем вычитания значений контролей. Затем значения специфичного цитолиза сравнивают с MOR202 группой, которую принимают за 1. Средние результатов в Таблице 3b показаны на фигуре 3.
1. Определение синергизма
1.1 Chou и соавт.
Способы по Chou-Talalay применяли для определения синергизма. Смотри. Chou TC, Talalay P, Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regul 22: 27-55 (1984), которая включена по ссылке в своей полноте. Анализ синергизма проводят с помощью CI-изоболограммного способа.
Уравнение медианного эффекта
Уравнение медианного эффекта моделирует воздействие ингибитора (такого как лекарственное средство) как Fa/Fu=(D/D50)^m, где D представляет собой дозу, Fa и Fu представляет собой часть системы, на которую влияет или не влияет доза D (Fa+Fu=1); D50 представляет собой дозу, дающую медианный эффект (например, IC50, ED50, LD50). Постоянная m определяет форму кривой доза-эффект. Было применено программное обеспечение Excel Fit для выполнения расчета линейной регрессии для оценки параметров m и D50.
Воздействия комбинации на клетки АМО-1 измеряют как % мертвых клеток, как описано выше. Часть Fu определяют, как соотношение % мертвых клеток обработанной клеточной линии к % мертвых клеток клеточной линии, на которую воздействуют контролем. То есть:
Fu = % мертвых клеток (обработанная клеточная линия)/% мертвых клеток (необработанная клеточная линия)
Тогда % мертвых клеток клеточной линии выражают постоянной D50 в уравнении медианного эффекта, который можно приблизительно рассчитать с помощью линейной регрессии, описанной выше.
CI-изоболограммный способ
CI-изоболограммный способ обеспечивает количественную оценку синергизма между лекарственными средствами. Комбинаторный индекс (CI) оценивают из данных доза-эффект от обработок отдельным лекарственным средством или комбинированных обработок лекарственными средствами. Значение CI менее 1 указывает на синергизм; CI=1 указывает на аддитивный эффект; и CI>1 указывает на антагонизм. Диапазоны синергизма дополнительно определены Chou и Talahay для значений CI<0,1 как очень сильный синергизм, значений CI от 0,1 до 0,3 как сильный синергизм, значений CI 0,3-0,7 как синергизм, значений CI 0,7-0,9 как умеренный-слабый синергизм. Взаимодействие лекарственных средств (синергизм или антагонизм) тем более выражено, чем более значение CI отдалено от 1.
Формально комбинаторный индекс (CI) комбинированной обработки лекарственными средствами определяется как
CI=D1/Dx1+D2/DX2
В настоящем уравнении D1 и D2 представляют дозы лекарственного средства 1 и лекарственного средства 2, соответственно, в комбинации; каждое из Dx1 и Dx2 представляем собой дозу обработки только лекарственным средством 1 и лекарственным средством 2, которая будет давать такой же эффект, как у комбинации, соответственно. Дозы Dx1 и Dx2 нужно приблизительно рассчитать из данных доза-эффект обработок отдельным лекарственным средством. По существу, в уравнение медианного эффекта подставляют данные каждого лекарственного средства. Из уравнения медианного эффекта для лекарственного средства можно приблизительно рассчитать дозу (т.е. D), необходимую для получения эффекта (т.е. Fa, Fu). Чем дальше точка лежит от линии аддитивной активности, тем больше разница между 1 и ее CI, таким образом, и тем более сильным является (синергический или антагонистический) эффект.
Приведенный выше способ описан в Chou TC, Talalay P, Quantitative analysis of dose-effect relationships: the combined effects of multiple drugs or enzyme inhibitors. Adv Enzyme Regul 22: 27-55 (1984), которая включена по ссылке в своей полноте. Дополнительный обзор приведенного выше способа по Chou также представлен в Ting-Chao Chou, Theoretical Basis, Experimental Design, and Computerized Simulation of Synergism and Antagonism in Drug Combination Studies, Pharmacol Rev 58: 621-681 (2006), которая включена по ссылке в своей полноте.
Кривые, построенные для расчетов синергии на основе способа Chou, показаны на фигурах 12-18. На фигуре 12 кривую наилучшего соответствия определяли путем удаления экспериментальных точек на графике, а) где концентрация MOR202 была слишком низкой для какого-либо эффекта, и b) где концентрация была близкой к насыщению. В соответствующих экспериментальных точках на графике приблизительно 80% цитолиз значение CI составляет менее 1, подтверждая явную синергию. Фиг.13-18 представляют шесть экспериментов из Таблиц 3 и 4, и в каждом Dx1 (доза MOR202), необходимая для достижения 100% эффекта комбинации MOR 202 и леналидомида, стремится к бесконечности; таким образом, D1/Dx1 составляет менее 1, и поскольку леналидомид не оказывает на клетки АМО-1 воздействия, относящегося к цитолизу, значение Dx2 также стремится к бесконечности, так что D2/Dx2 приближается к 0, таким образом, значения CI для каждого из шести экспериментов составляют менее 1, подтверждая явную синергию.
Таблица 3с представляет нормализацию данных, где теоретическое комбинации принято за 1 (100%), и включает расчеты CI по Chou.
|
Данные, показанные в Таблице 3с, отличаются от Таблиц 3а и 3b. Таблица 3с основывается на разных необработанных точках данных, которые показаны в Таблице 3а, поскольку концентрации, выбранные в Таблице 3с, более близки к ЕС50 антитела (необработанные данные не показаны). "Теоретическое комбинации" представляет сумму значений для MOR202 самого по себе и значений для LEN самого по себе.
Таблица 4: Эффекторные клетки обработанные только леналидомидом перед обработкой MOR202. Применяли отдельные и комбинированные дозы 10 мкМ LEN и 15 мкг/мл MOR03207 и MOR202.
Данные представлены следующими тремя способами: как а) необработанные данные (% мертвых клеток), b) нормализованные данные специфического цитолиза, где группа обработки MOR202 принята за 1 (100%), и с) нормализованные данные специфического цитолиза, где теоретическое комбинации принято за 1 (100%). Таблица 4а представляет необработанные данные.
|
Единицы перечисленных значений выражают % мертвых клеток. DMSO, MOR03207, MOR03207 + DMSO, LENO, LEN10 без РВМС и DMSO без РВМС являются контролями.
|
В Таблице 4b представлены данные из Таблицы 4а, но нормализованные, где группа обработки MOR202 принята за 1 (100%). Для Таблиц 4b-с "Теоретическое комбинации" представляет значения для MOR202 самого по себе плюс значения для LEN самого по себе.
Нормализацию данных, которые показаны в Таблице 4b, рассчитывают, как описано в Таблице 3b, путем вычитания контролей. Средние результатов из Таблицы 4b показаны на фигуре 4.
|
|
В Таблице 4с представлена нормализация данных, где теоретическое комбинации принято за 1 (100%), и она включает расчеты CI по Chou и соавт. с применением методики, описанной выше в Примере 4.
Таблица 4с отличается от Таблиц 4а и 4b. Таблица 4с основывается на разных необработанных точках данных, которые показаны в Таблице 4а, поскольку концентрации, выбранные в Таблице 4с более близки к ЕС50 для антитела (необработанные данные не показаны).
1. Определение синергизма
1.2 Синергизм по Clarke и соавт.
Там где одно лекарственное средство имеет низкую активность, как в данном случае, где лепалидомид сам по себе обладает низкой цитотоксичностью в отношении клеток АМО-1, синергию можно определить по статистическим данным, что комбинация существенно отличается от лекарственного средства-ингибитора самого по себе. Смотри, Clarke et al., Issues in experimental design and endpoint analysis in the study of experimental cytotoxic agents in vivo in breast cancer and other models. Breast Cancer Research and Treatment 46: 255-278 (1997), которая включена по ссылке в своей полноте. В данном случае при определении синергизма применяли как способ по Chou и соавт., который показан выше, так и способ по Clarke и соавт.
Данные анализировали следующим образом:
Антагонистический (АВ)/С<(А/С)×(В/С)
Аддитивный (АВ)/С=(А/С)×(В/С)
Синергический (АВ)/С>(А/С)×(В/С),
где А представляет собой обработку LEN самим по себе; В представляет собой обработку MOR202 самим по себе; С представляет реакцию на обработку носителем; АВ представляет собой комбинацию обработок А и В.
Таблица 5: Значения необработанных данных, показанные в этой таблице, являются такими же, как показанные в Таблице 3а, поскольку они получены из тех же трех экспериментов, где как эффекторные клетки, так и клетки АМО-1 обрабатывали леналидомидом перед обработкой MOR202 и применяли отдельные и комбинированные дозы 10 мкМ LEN и 15 мкг/мл MOR03207 и MOR202. Различие состояло лишь в том, что данные анализировали с применением способа по Clarke и соавт., а не Chou и соавт.
|
В каждом эксперименте (АВ)/С было большим, чем (А/С)×(В/С), показывая явную синергию.
Таблица 6: Значения необработанных данных, показанные в этой таблице, являются такими же, как показанные в Таблице 4а, поскольку они получены из тех же трех экспериментов, где только эффекторные клетки обрабатывали леналидомидом перед обработкой MOR202 и применяли отдельные и комбинированные дозы 10 мкМ LEN и 15 мкг/мл MOR03207 и MOR202. Различие состояло лишь в том, что данные анализировали с применением способа но Clarke и соавт., а не Chou и соавт.
|
В каждом эксперименте (АВ)/С было большим, чем (А/С)×(В/С), показывая явную синергию.
Результаты
С применением анализа по Clarke и соавт. установлено, что LEN синергически усиливал активность ADCC MOR202 в клетках АМО-1 во всех 6 экспериментах. С применением анализа по Chou и соавт. установлено, что LEN синергически усиливал активность ADCC MOR202 в клетках АМО-1 в 6 из 6 экспериментов. Это усиление активности, как было определено, происходит посредством нескольких механизмов, включая непосредственную цитотоксичность, активацию эффекторных клеток и повышающую регуляцию уровней экспрессии CD38 на клетках ММ.
Эксперименты согласно примеру 4 также проводят с другими антителами, специфичными к CD38, например, антитело "RefmAB5".
Пример 5: Ингибирование пролиферации клеток NCI-H929 с применением леналидомида самого по себе
Цитотоксичность леналидомида исследовали на NCI-H929 с применением способов, описанных в Примере 3. Результаты показаны на фигуре 2. Вкратце, воздействие леналидомидом самим по себе существенно ингибировало клеточную пролиферацию у клечок NCI-H929.
Пример 6: Синергическая комбинация MOR202 и леналидомида в клетках NCI-H929
Клетки NCI-H929 выбирали для исследования с комбинацией MOR202 и леналидомида. Клетки NCI-H929 экспрессируют более высокие уровни CD38, чем клетки АМО-1, следовательно, являются иллюстративными для определенных типов клеток, обнаруживаемых у пациентов-людей с множественной миеломой или неходжкинской лимфомой.
В сумме проводили шесть экспериментов с применением способов, описанных в Примере 4, чтобы определить опосредование ADCC на клетках NCI-H929 комбинацией MOR202 и леналидомида. В трех экспериментах клетки РВМС и NCI-H929 обрабатывали леналидомидом перед обработкой MOR202, результаты показаны в Таблицах 7а-b и на фигуре 6. В трех дополнительных экспериментах только РВМС обрабатывали леналидомидом перед обработкой MOR202, результаты показаны в Таблицах 8а-b и на фигуре 7.
Таблица 7: Как эффекторные клетки, так и клетки NCI-H929 обрабатывали леналидомидом перед обработкой MOR202. Применяли отдельные и комбинированные дозы 5 мкМ LEN и 15 мкг/мл MOR03207 и 0,2 или 0,07 мкг/мл MOR202.
Данные представлены следующими способами: как а) необработанные данные (% мертвых клеток), и b) нормализованные данные специфического цитолиза, где комбинация дольных продуктов принята за 1 (100%). Таблица 7а представляет необработанные данные.
|
Единицы перечисленных значений представляют собой % мертвых клеток. DMSO, MOR03207, MOR03207 + DMSO, LENO, LEN10 без РВМС и DMSO без РВМС представляют собой контроли.
Таблица 7b представляет нормализованные данные, где комбинация дольных продуктов принята за 1 (100%).
|
Комбинацию дольных продуктов рассчитывают с помощью следующей формулы 1-[(1-А)*(1-В)]=fpc(%), как описано в Ting-Chao Chou, Theoretical Basis, Experimental Design, and Computerized Simulation of Synergism and Antagonism in Drug Combination Studies, Pharmacol Rev 58: 621-681 (2006), которая включена по ссылке в своей полноте. Таблица 7b основывается на необработанных данных, показанных в Таблице 7а. Нормализацию данных, которые показаны в Таблице 7b, рассчитывают, как описано для Таблицы 3b, путем вычитания контролей. В Таблице 7b, там, где комбинация LEN и MOR202 является большей, чем комбинация, основанная на методе дольного продукта, существует явная синергия. К тому же, значения комбинаторного индекса рассчитывали с применением способов по Chou и соавт., как описано в Примере 4. Средние результатов из Таблицы 7b показаны на фигуре 6.
Таблица 8: Эффекторные клетки, обработанные только леналидомидом перед обработкой MOR202. Применяли отдельные и комбинированные дозы 5 мкМ LEN и 15 мкг/мл MOR03207 и 0,2* или 0,07 мкг/мл MOR202.
Данные представлены следующими способами: как а) необработанные данные (% мертвых клеток) и b) нормализованные данные специфического цитолиза, где комбинация дольных продуктов принята за 1 (100%). Таблица 8а представляет необработанные данные.
|
Единицы перечисленных значений представляют собой % мертвых клеток. DMSO, MOR03207, MOR03207 + DMSO, LENO, LEN10 без РВМС и DMSO без РВМС представляют собой контроли. Таблица 8b представляет нормализованные данные, где комбинация дольных продуктов принята за 1 (100%).
|
Таблица 8b основывается на необработанных данных, показанных в Таблице 8а. Нормализацию данных, которые показаны в Таблице 8а, рассчитывали, как описано в Таблице 3b, путем вычитания контролей. В Таблице 8b, там, где комбинация LEN и MOR202 является большей, чем комбинация, основанная на методе дельного продукта, существует явная синергия. К тому же, значения комбинаторного индекса рассчитывали с применением способов по Chou и соавт., как описано в Примере 4. Средние результатов из Таблицы 8b показаны на фигуре 7.
Определение синергизма
1.3 Метод дольного продукта
Оценка данных в этом примере отличается от применяемой при анализе воздействия комбинации MOR202 и LEN на клетки АМО-1 в Примере 4. В данном случае, исследуют клетки NCI-H929, и LEN сам по себе оказывает существенное воздействие на пролиферацию клеток NCI-H929, как показано в Примере 5, таким образом, используют метод дольного продукта. Метод дольного продукта был описан в Ting-Chao Chou, Theoretical Basis, Experimental Design, and Computerized Simulation of Synergism and Antagonism in Drug Combination Studies, Pharmacol Rev 58: 621-681 (2006), который включена по ссылке в своей полноте. В том документе Chou и соавт. утверждают: если каждый из А и В ингибирует на 60%, то при упрощении аддитивный эффект представляет собой 84% ингибирование. На основании рассуждений Webb (1963) проблему такого рода можно разрешить (1-0,6)(1-0,6)=0,16, 1-0,16-=0,84. Chou и Talalay (1984) назвали это метод дольного продукта. Этот метод не будет приводить к эффекту комбинации, превышающему 100% ингибирование. Chou и Talalay (1984), однако, также доказали, что этот способ имеет ограниченную достоверность, поскольку он принимает во внимание силу (например, частичное ингибирование), но не обращает внимания на форму кривой доза-эффект (например, гиперболическую или сигмовидную). Важность "формы" в анализе доза-эффект показана на фиг.1. Chou и Talalay (1984) показывали, что способ по Webb является достоверным только тогда, когда оба лекарственных средства имеют гиперболические кривые (т.е. при простой кинетике Михаэлиса-Ментен, когда кривые доза-эффект являются гиперболическими, т.е. m=1 на графике медианного эффекта) и не является достоверным, когда m не равно 1, как, например, для сигмовидной (m>1) или плоской сигмовидной (m<1) кривых Кроме того, способ по Webb является достоверным, когда эффекты двух лекарственных средств являются взаимно неисключающими (например, полностью независимые), и не является достоверным для взаимоисключающих (например, сходные механизмы или способы действия, как предполагается для классической изоболограммы, смотри ниже).
Clarke и соавт. не использовали, поскольку Clarke является наиболее подходящим когда одна монотерапия оказывает слабое воздействие.
Смотри Фигуру 12, кривую наилучшего соответствия определяли посредством удаления экспериментальных точек на графике, а) где концентрация MOR202 была слишком низкой чтобы оказывать какое-либо воздействие, и b) где концентрация была близкой к насыщению. В соответствующих экспериментальных точках на графике, приблизительно 80% цитолиз, значение CI составляет менее 1, подтверждая явную синергию.
Результаты
С применением анализа согласно методу дольного продукта было установлено, что LEN синергично усиливал активность MOR202 в клетках NCI-H929 в 6 из 6 экспериментов. С применением анализа по Chou и соавт. было установлено, что LEN синергически усиливал активность MOR202 в клетках NCI-H929 в 6 из 6 экспериментов. Смотри Таблицы 7а-b и 8а-b.
Пример 7: MOR202 и LEN сам по себе и в комбинации при разрушении кости NCI-H929 в модели ММ на SCID мышах
Материалы
Леналидомид (SYNthesis med chem; Шанхай, Китай; лот №: ZHM-066-051).
MOR202 (MorphoSys AG, лот 100706-5KLE18). Среда-контроль: Ora-Plus:Ora-Sweet SF (Paddock Laboratories, Миннеаполис, Миннесота, США, лот №9499528). SCID мыши (Университет Аделаиды, Уэйт кампус, Еррбро, Южная Австралия, Австралия, линия C.B.-17-lgh-lb-Prkdcscid).
Клетки NCI-H929 множественной миеломы человека (смотри Таблицу 1). Среда культивирования клеток RPMI 1640, фетальная бычья сыворотка (FBS), меркаптоэтанол, сбалансированный солевой раствор Хенкса (HBSS) и пенициллин-стрептомицин от Invitrogen Australia (Маунт Уэверли, Виктория, Австралия); и трипановый синий и глюкоза от Sigma-Aldrich (Касл Хилл, Новый Южный Уэллс, Австралия).
Способы
63 SCID мыши инокулировали в День (-7) ортотопически в правую большеберцовую кость 2,5×106 NCI-H929 клеток ММ (в 5 мкл) с целью вызвать разрушение кости. Через трое суток после инокуляции (День -4) 60 из SCID мышей рандомизировали по массе тела на группы, показанные в Таблице 13, 10 мышей на группу. Схема дозирования представлена в Таблице 9. Обработки леналидомидом (группы А и D) и средой-контролем (Группа С) начались в День (-1). Обработки MOR202 (группы В и D) начинались в День 0. Обработки продолжались в течение 6 недель.
|
|
Изображения, полученные с помощью компьютерной микротомографии, применяли для оценки разрушения кости, и они включали трехмерный анализ, включающий общий объем кости (TBV), объем трабекулярной структуры кости (Tb.BV), трабекулярный коэффициент (Tb.Pf) и индекс модельной структуры (SMI). Таблица 10 определяет каждый из этих параметров. Результаты для каждого из параметров изображения, полученного с помощью компьютерной микротомографии, показаны в Таблице 11. Результаты общего объема кости (TBV) показаны на фигуре 19.
|
|
|
Анализ каждого параметра в отношении синергической активности осуществляли согласно теореме по Clarke и соавт. В Таблице 12 показаны расчеты, выполненные для определения синергии комбинации MOR202 и леналидомида.
|
Численные значения, показанные в Таблице 12, взяты непосредственно из средних, показанных в Таблице 11 для каждого из параметров в каждой из групп. Группы, описанные как А, В, С и АВ, представляют собой те же самые группы обработки во всех Таблицах 9, 11 и 12.
По общему объему кости (АВ)/С является большим, чем (А/С)×(В/С), показывая явный синергизм. По трабекулярному коэффициенту и индексу модельной структуры, которые описаны в Таблице 10, более низкое значение представляет меньшее разрушение кости (эффективность лечения), следовательно, (АВ)/С меньше, чем (А/С)×(В/С) показывает явный синергизм по обоим параметрам.
Результаты
Инокуляция клетками множественной миеломы NCI-H929 вызывала значительное разрушение кости в большеберцовых костях самок SCID мышей в этом исследовании что показано измерением разрушения кости посредством компьютерной микротомографии. Степень разрушения кости значительно уменьшалась в большеберцовых костях мышей, обрабатываемых комбинацией MOR202 и леналидомида, как показано с помощью компьютерной микротомографии. По каждому из параметров изображения, полученного с помощью компьютерной микротомографии: общему объему кости (TBV), объему трабекулярной структуры кости (Tb.BV), трабекулярному коэффициенту (Tb.Pf) и индексу модельной структуры (SMI), комбинация MOR202 и леналидомида (группа АВ) показывала явную синергию при снижении разрушения кости, вызванного клетками множественной миеломы NCI-H929.
Если значения в Таблице 11 скорректированы с тем, чтобы контрольную группу (неинокулированная располагающаяся с противоположной стороны большеберцовая кость без опухоли) рассматривать как 0% разрушение кости и группу С (среда-контроль (инъекционный раствор 0,9% хлорида натрия)) рассматривать как 100% разрушение кости, тогда MOR202 само по себе снижало разрушение кости дозозависимо на до 55% при 12 мг/кг по сравнению с средой-контролем. LEN сам по себе при 50 мг/кг ингибировал разрушение кости на 20%. Комбинация 3 мг/кг MOR202 и 50 мг/кг LEN полностью прекращала разрушение кости. Эти результаты подтверждают синергический эффект комбинированной терапии. К тому же присутствовало снижение (>90%) уровней М-белка в сыворотке в группе с комбинацией, показывая существенное уменьшение опухолевой нагрузки.
Пример 8
MOR202 и леналидомид сами по себе и в комбинации против опухоли, вызванной неходжкинской RAMOS человека у самок SCID мышей, модель выживаемости
Материалы
Циклофосфамид (Fluka, Бухс, Швейцария, лот №07551661). Леналидомид (SYNthesis Med Chem; Шанхай, Китай; лот №2НМ-066-051). MOR202 (MorphoSys AG, лот 100706-5KLE18). Среда-контроль: Ora-Plus:Ora-Sweet SF, 1:1, объем/объем (SYNthesis Med Chem; Шанхай, Китай). SCID мыши (Университет Аделаиды, Уэйт кампус, Еррбро, Южная Австралия, Австралия, линия C.B.-17-lgh-1b-Prkdcscid).
Клетки RAMOS (Oncodesign, Dijon Cedex, Франция) культивировали в RPMI1640 + 20% инактивированной нагреванием FBS из другого источника + 1% Glutamax (среда #2). Реактивы для культуры клеток неходжкинской лимфомы RAMOS получали от следующих поставщиков: среда культивирования клеток RPMI 1640, FBS, Glutamax, HEPES, пируват натрия, HBSS и пенициллин-стрептомицин от Invitrogen Australia (Маунт Уэверли, Виктория, Австралия) и трипановый синий и глюкоза от Sigma-Aldrich (Касл Хилл, Новый Южный Уэльс, Австралия).
Способы
Шестьдесят восемь самок SCID мышей предварительно обрабатывали циклофосфамидом (75 мг/кг, внутрибрюшинно, дважды в сутки) в течение двух суток перед инокуляцией клетками RAMOS (День -5 и -4). В день инокуляции (День -3) всех мышей инокулировали 1×106 клетками RAMOS каждую внутривенно в хвостовую вену. Шестьдесят четыре из мышей рандомизировали по массе тела на восемь групп по восемь. Схема дозирования для каждой группы показана в Таблице 13.
|
Исследование продолжалось в течение 98 суток, и измеряемым конечным показателем была выживаемость. Результаты из каждой группы показаны в Таблице 14.
|
|
Анализ в отношении синергической активности осуществляли согласно теореме по Clarke и соавт., как описано в Примере 4. В Таблице 15 показаны расчеты, выполненные при определении синергии комбинации MOR202 и леналидомида.
|
Численные значения, показанные в Таблице 15, взяты из количества дней медианы выживаемости, показанного в Таблице 14 для каждой из групп. Группы, описанные как А, В, С и АВ, представляют собой те же самые группы обработки в Таблицах 13-15.
Инокуляция клетками RAMOS была летальной в пределах медианного времени 20 суток в контрольной группе. Комбинация MOR202 и леналидомида, однако, показывала явную синергию при увеличении количества дней медианы выживаемости.
Пример 9: Бортезомиб сам по себе ингибирует пролиферацию различных клеточных линий множественной миеломы.
Ингибирующее воздействие бортезомиба на пролиферацию клеток множественной миеломы анализировали на нескольких клеточных линиях. Возрастающие количества бортезомиба (Velcade®, лот №9AZSY00) применяли к клеткам АМО-1, LP-1, NCI-H929 и RPMI-8226 и инкубировали в течение 24 часов, 48 часов и 72 часов. После периода инкубирования планшеты анализировали в отношении клеточной пролиферации в количественном колориметрическом анализе на основе ХТТ с применением набора для изучения клеточной пролиферации II (ROCHE, Cell Proliferation Kit II, кат. №11465015001). Для последующего измерения планшеты считывали на планшет-ридере Tecan Genios и определяли поглощение при 492 нм.
Пролиферацию клеток всех исследуемых клеточных линий ингибировали бортезомибом с концентрацией IC50 3,9 нмоль для клеток АМО-1, 6,1 нмоль для клеток LP-1, 3,3 нмоль для клеток NCI-H929 и 9,0 нмоль для клеток RPMI-8226, соответственно, как показано на Фигуре 8.
Пример 10: ADCC с применением комбинации MOR202 и бортезомиба
С помощью способов, описанных в примере 4, анализировали ADCC эффект объединения бортезомиба и MOR202. В данном случае, целевые клетки обрабатывали бортезомибом перед обработкой MOR202. Исследовали обе линии целевых клеток, клетки NCI-H929 и LP-1. Результаты показаны на фигурах 9 и 10. Усиление активности MOR202 бортезомибом опосредовалось через прямое цитотоксическое воздействие на клетки MM.
Пример 11: MOR202 и BOR сами по себе и в комбинации модели разрушения кости NCI-H929 множественной миеломы человека на SCID мышах
Материалы
Бортезомиб (SYNthesis med chem., Шанхай, Китай, лот № ZHM-066-054).
Бортезомиб составляли в стерильном 0,9% растворе хлорида натрия для дозирования. MOR202 (MorphoSys AG, лот 100706-5KLE18). Среда-контроль: 0,9% инъекционный раствор хлорида натрия.
SCID Мыши (Университет Аделаиды, Уэйт кампус, Еррбро, Южная Австралия, Австралия, линия C.B.-17-lgh-1b-Prkdcscid).
Способы
63 SCID мышам инокулировали в День (-7) внутрь большеберцовой кости 2,5×106 NCI-Н929 клеток ММ для того, чтобы вызвать разрушение кости. Через трое суток после инокуляции (День -4) 60 из SCID мышей рандомизировали по массе тела на группы, показанные в Таблице 16, 10 мышей на группу. Схема дозирования представлена в Таблице 16. Обработки бортезомибом (группы А и АВ) и средой-контролем (группа С) начинали в День (-1). Обработки MOR202 (группы В и АВ) начинали в День 0. Обработки продолжались в течение 6 недель.
|
Изображения, полученные с помощью компьютерной микротомографии, применяли для оценки разрушения кости, и она включала 3-мерный анализ, включающий общий объем кости (TBV), объем трабекулярной структуры кости (Tb.BV), трабекулярный коэффициент (Tb.Pf) и индекс модельной структуры (SMI). В Таблице 10 выше определен каждый из этих параметров. Результаты по каждому из параметров изображений, полученных с помощью компьютерной микротомографии, показаны в Таблице 17. Результаты по общему объему кости (TBV) показаны на фигуре 20.
|
|
|
Анализ каждого параметра в отношении синергической активности осуществляли согласно теореме по Clarke и соавт., как описано в Примере 4. В Таблице 18 показаны расчеты, выполненные при определении синергии комбинации MOR202 и бортезомиба.
|
Численные значения, показанные в Таблице 18, взяты непосредственно из средних, показанных в Таблице 17, для каждого из параметров в каждой из групп. Группы, описанные как А, В, С и АВ, представляют собой те же самые группы обработки в Таблицах 16-18.
По общему объему кости и объему трабекулярной структуры кости (АВ)/С является большим, чем (А/С)×(В/С), показывая явный синергизм. По трабекулярному коэффициенту и индексу модельной структуры, которые описаны в Таблице 10, более низкое значение представляет меньшее разрушение кости (эффективность лечения), следовательно, (АВ)/С меньше, чем (А/С)×(В/С), подтверждает явный синергизм по обоим параметрам.
Результаты
Инокуляция клетками множественной миеломы NCI-H929 вызывала значительное разрушение кости в большеберцовых костях самок SCID мышей в этом исследовании, как показано с помощью измерения разрушения кости посредством компьютерной микротомографии. Степень разрушения кости значительно уменьшалась в большеберцовых костях мышей, обработанных комбинацией MOR202 и бортезомиба, как показано с помощью компьютерной микротомографии. По каждому из параметров изображения, полученного с помощью компьютерной микротомографии: общий объем кости (TBV), объем трабекулярной структуры кости (Tb.BV), трабекулярный коэффициент (Tb.Pf) и индекс модельной структуры (SMI), комбинация MOR202 и бортезомиба (группа АВ) показывала явную синергию при снижении разрушения кости, вызванного клетками множественной миеломы NCI-H929.
Если значения в Таблице 17 скорректированы с тем, чтобы контрольную группу (неинокулированная располагающаяся с противоположной стороны большеберцовая кость без опухоли) рассматривать как 0% разрушение кости и группу С (среда-контроль (инъекционный раствор 0,9% хлорида натрия)) рассматривать как 100% разрушение кости, тогда MOR202 само по себе снижало разрушение кости дозозависимо на до 55% при 12 мг/кг по сравнению со средой-контролем, BOR сам по себе при 0,6 мг/кг ингибировал разрушение кости на 40% и комбинация более низкой дозы 3 мг/кг MOR202 и 0,6 мг/кг BOR полностью прекращала разрушение кости. Эти результаты подтверждают синергический эффект комбинированной терапии. К тому же присутствовало снижение (>90%) уровней М-белка в сыворотке в группе с комбинацией, показывая существенное уменьшение опухолевой нагрузки.
Пример 12 MOR202 и бортезомиб сами по себе и в комбинации против опухоли, вызванной неходжкинской RAMOS человека у самок SCID мышей, модель выживаемости
Материалы
Циклофосфамид (Fluka, Бухс, Швейцария, WB 10468). Бортезомиб (SYNthesis med chem., Шанхай, Китай, лот № ZHM-066-054). Бортезомиб составляли в стерильном 0,9% растворе хлорида натрия для дозирования. MOR202 (MorphoSys AG, лот 100706-5KLE18). Среда-контроль: 0,9% инъекционный раствор хлорида натрия. SCID мыши (Университет Аделаиды, Уэйт кампус, Еррбро, Южная Австралия, Австралия, линия C.B.-17-lgh-1b-Prkdcscid).
Клетки RAMOS (Oncodesign, Dijon Cedex, Франция) культивировали в RPMI1640 + 20% инактивированной нагреванием FBS из другого источника + 1% Glutamax (среда #2). Реактивы для культуры клеток неходжкинской лимфомы RAMOS получали от следующих поставщиков: среда культивирования клеток RPMI 1640, FBS, Glutamax, HEPES, пируват натрия, HBSS и пенициллин-стрептомицин от Invitrogen Australia (Маунт Уэверли, Виктория, Австралия) и трипановый синий и глюкоза от Sigma-Aldrich (Касл Хилл, Новый Южный Уэльс, Австралия).
Способы
Пятьдесят пять самок SCID мышей предварительно обрабатывали циклофосфамидом (75 мг/кг, внутрибрюшинно, дважды в сутки) в течение двух суток до инокуляции клетками RAMOS (День -5 и -4). В день инокуляции (День -3) всех пятьдесят пять мышей инокулировали 1×106 клеток RAMOS каждую (в 100 мкл) внутривенно в хвостовую вену. Сорок восемь из мышей рандомизировали по массе тела на шесть групп по восемь. Схема дозирования для каждой группы показана в Таблице 19.
|
Исследование продолжалось в течение 98 суток, и измеряемым конечным показателем была выживаемость. Результаты из каждой группы показаны в Таблице 20.
|
|
Анализ в отношении синергической активности осуществляли согласно теореме по Clarke и соавт. В Таблице 21 показаны расчеты, выполненные при определении синергии комбинации MOR202 и бортезомиба.
|
Численные значения, показанные в Таблице 21, взяты непосредственно из количества дней медианы выживаемости, показанного в Таблице 20 для каждой из групп. Группы, описанные как А, В, С и АВ, представляют собой те же самые группы обработки в Таблицах 19-21.
Инокуляция клетками RAMOS была летальной в пределах медианного времени 20,5 суток в контрольной группе. Комбинация MOR202 и бортезомиба, однако, показывала явную синергию при увеличении количества дней медианы выживаемости. Важно, с комбинацией MOR202 и бортезомиба (Группа АВ), 2 из 5 мышей выживали в течение срока исследования. Это убедительно подтверждает синергический результат комбинации MOR202 и бортезомиба.
Следует понимать, что описание, конкретные примеры и данные, хотя и указывают на иллюстративные варианты осуществления, даны для иллюстрации и не предназначены для ограничения настоящего изобретения. Различные изменения и модификации в пределах настоящего изобретения станут очевидными специалисту в данной области из обсуждения, раскрытия и данных, содержащихся в данном документе, и, таким образом, рассматриваются как часть настоящего изобретения.