Результат интеллектуальной деятельности: ПРОТИВООПУХОЛЕВЫЙ АГЕНТ И СПОСОБ ПРЕДСКАЗАНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ДЛЯ ПАЦИЕНТОВ С РАКОМ ОБОДОЧНОЙ И ПРЯМОЙ КИШКИ С МУТАЦИЕЙ ГЕНА KRAS
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу предсказания терапевтического эффекта химиотерапии, которая использует противоопухолевый агент (далее упоминаемый как TAS-102), содержащий α,α,α-трифтортимидин (FTD) и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид (TPI) при молярном отношении 1:0,5, а также относится к противоопухолевому агенту, который должен вводиться пациенту, у которого предсказана достаточная реакция на химиотерапию с использованием противоопухолевого агента.
Уровень техники
Осуществляют стандартную терапию для лечения пациента с раком ободочной и прямой кишки, как правило, с помощью химиотерапии, с использованием противоопухолевого агента на основе фторпиримидина (например, сочетания 5-фторурацила (5-FU) и лейковорина (LV)), и необязательно, с помощью сочетанной лекарственной химиотерапии (FOLFIRI, FOLFOX или что-либо подобное), которая дополнительно использует иринотекан или оксалиплатин. Такие способы достигают определенного терапевтического эффекта (непатентный документ 1).
Однако когда пациент с раком ободочной и прямой кишки становится стойким или невосприимчивым к этим стандартным видам терапии, с использованием 5-FU, иринотекана или оксалиплатина, выбор противоопухолевого агента, который может существенно продлить его выживание, является очень ограниченным. Кроме того, хотя цетуксимаб, который представляет собой химерное антитело, нацеленное на рецептор эпителиального фактора роста (EGFR), и панитумумаб, который представляет собой цельное моноклональное антитело человека, часто выбирают для таких пациентов с раком ободочной и прямой кишки, которые являются стойкими или невосприимчивыми к стандартной терапии, сообщается, что эти противоопухолевые агенты не оказывают эффекта, когда пациенты имеют рак ободочной и прямой кишки с мутацией гена KRAS (непатентные документы 2 и 3).
Как объясняется выше, несмотря на бурное развитие химиотерапии для пациентов с раком ободочной и прямой кишки, ее терапевтический эффект по-прежнему является недостаточным. В частности, по существу не установлена эффективная химиотерапия для пациента с раком ободочной и прямой кишки с мутацией гена KRAS. Кроме того, поскольку эффект химиотерапии сильно зависит от генетических факторов пациентов, нет способа оценки эффекта противоопухолевых агентов до их реального введения.
Список цитирований
Непатентные документы
Непатентный документ: NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines™); Colon Cancer (Version 3, 2011), Rectal Cancer (Version 4, 2011).
Непатентный документ 2: N Engl J Med. 2008; 359 (17):1757-65.
Непатентный документ 3: J Clin Oncol. 2008; 26 (10): 1626-34.
Сущность изобретения
Техническая проблема
Целью настоящего изобретения является создание химиотерапии для пациентов с раком ободочной и прямой кишки, которая обеспечивает значительный эффект увеличения продолжительности выживания и меньшее количество побочных эффектов.
Решение проблемы
Авторы настоящего изобретения осуществили широкие исследования различных видов химиотерапии для пациентов с раком ободочной и прямой кишки и обнаружили, что пациенты с раком ободочной и прямой кишки с мутацией гена KRAS с большей вероятностью реагируют на TAS-102, чем пациенты с геном дикого типа; и что, по этой причине, становится возможной оценка адекватности терапевтического эффекта химиотерапии с использованием TAS-102 на пациента посредством детектирования присутствия/отсутствия мутации гена KRAS в качестве индикатора. На основе этих данных автор завершил настоящее изобретение.
Конкретно, настоящее изобретение предлагает следующие способы и противоопухолевые агенты.
Пункт 1. Способ предсказания терапевтического эффекта химиотерапии, которая использует противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, у пациента с раком ободочной и прямой кишки,
способ включает стадии:
(1) детектирования присутствия или отсутствия мутации гена KRAS в биологическом образце, полученном от пациента; и
(2) предсказания того, что пациент, как ожидается, будет иметь достаточную реакцию на химиотерапию, когда детектируется мутация гена KRAS на стадии (1).
Пункт 2. Способ в соответствии с пунктом 1, где мутация гена KRAS представляет собой мутацию кодона 12 и/или кодона 13.
Пункт 3. Способ в соответствии с пунктом 1 или 2, где пациент с раком ободочной и прямой кишки представляет собой пациента с раком ободочной и прямой кишки, который является стойким или невосприимчивым по отношению к стандартной терапии.
Пункт 4. Противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, для применения при лечении пациента с раком ободочной и прямой кишки, который, как считается, будет иметь достаточную реакцию на химиотерапию, которая использует противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, в соответствии со способами по пунктам 1-3.
Пункт 5. Способ лечения рака ободочной и прямой кишки, включающий осуществление химиотерапии с использованием противоопухолевого агента, содержащего α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, у пациента с раком ободочной и прямой кишки, который, как считается, будет иметь достаточную реакцию на химиотерапию, которая использует противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2- иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, в соответствии со способами по пунктам 1-3.
Пункт 6. Применение противоопухолевого агента, содержащего α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)-метил)урацил гидрохлорид при молярном отношении 1:0,5, для осуществления лечения пациента с раком ободочной и прямой кишки, который, как считается, будет иметь достаточную реакцию на химиотерапию, которая использует противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, в соответствии со способами по пунктам 1-3.
Пункт 7. Противоопухолевый агент для лечения пациента с раком ободочной и прямой кишки с мутацией гена KRAS, противоопухолевый агент содержит α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5.
Пункт 8. Способ лечения рака ободочной и прямой кишки, включающий осуществление химиотерапии, которая использует противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5, у пациента с раком ободочной и прямой кишки с мутацией гена KRAS.
Пункт 9. Применение противоопухолевого агента, содержащего α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)-метил)урацил гидрохлорид при молярном отношении 1:0,5, для лечения пациента с раком ободочной и прямой кишки с мутацией гена KRAS.
Преимущественные эффекты изобретения
При использовании способа предсказания по настоящему изобретению становится возможным получение химиотерапии, которая обеспечивает более значительные эффекты увеличения продолжительности выживания по отношению к пациентам с раком ободочной и прямой кишки (в частности, по отношению к пациентам с раком ободочной и прямой кишки, которые являются стойкими или невосприимчивыми по отношению к стандартной терапии, то есть к пациентам, на которых противоопухолевые агенты имеют малый эффект и которые таким образом имеют небольшой выбор относительно противоопухолевых агентов для значительного увеличения продолжительности их выживаемости).
В дополнение к этому, хотя сообщается, что TAS-102 обладает терапевтическим эффектом на твердые раковые опухоли, включая раковые заболевания ободочной и прямой кишки (Cancer Invest. 2008; 26 (8):794-9), не наблюдается превосходного терапевтического эффекта TAS-102, в частности, на пациентов с раком ободочной и прямой кишки, относящихся к типу с мутацией гена KRAS. Кроме того, поскольку известно, что выживание пациентов с раком ободочной и прямой кишки, относящихся к типу с мутацией гена KRAS, короче, чем для пациентов с раком ободочной и прямой кишки с геном дикого типа, эффект значительного увеличения продолжительности выживания TAS-102 на пациентов с раком ободочной и прямой кишки, принадлежащих к типу с мутацией гена KRAS, представляет собой неожиданный эффект.
Краткое описание чертежей
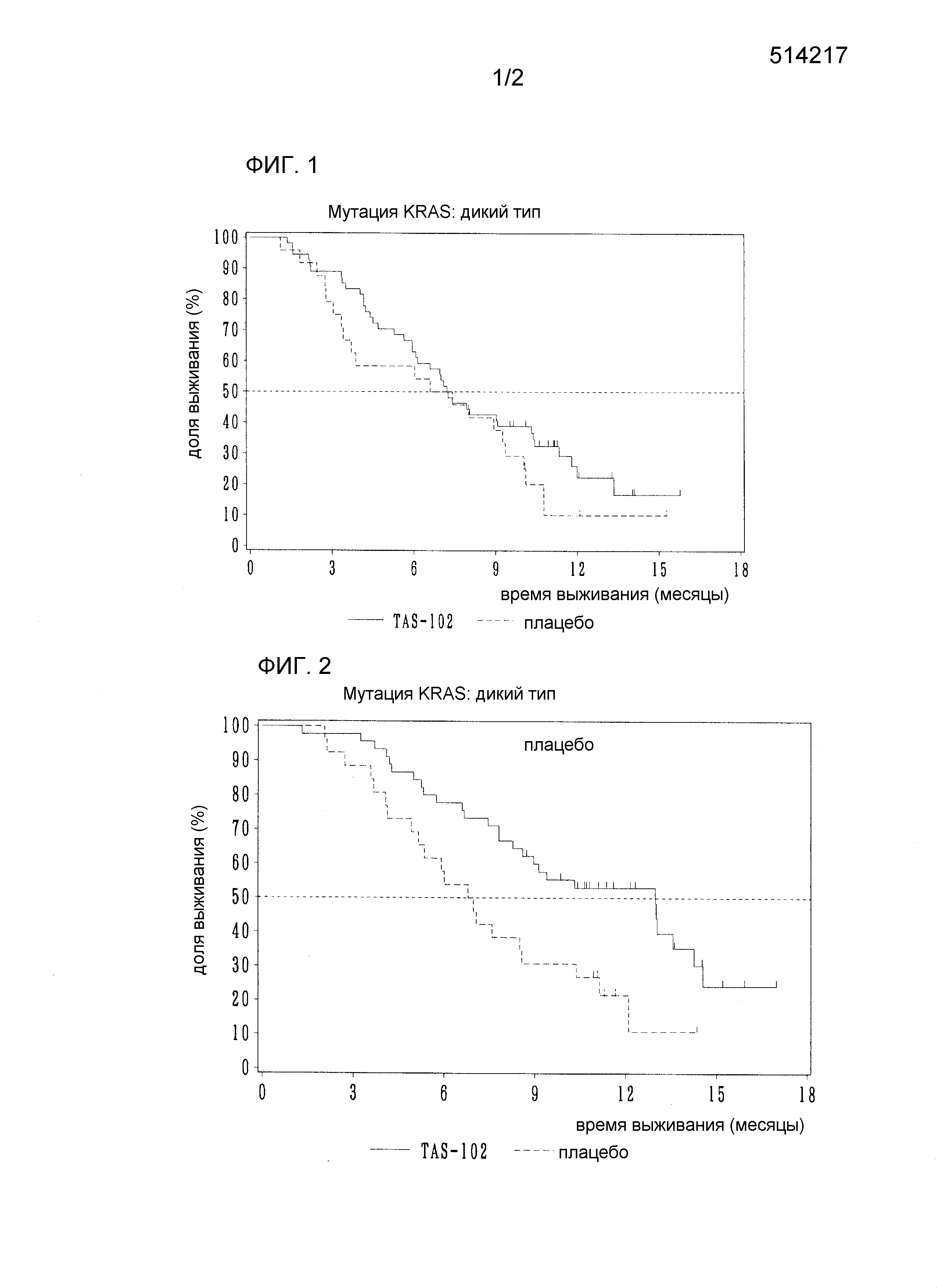
Фиг.1 показывает кривые выживания Каплана-Майера для пациентов с геном KRAS дикого типа.
Фиг.2 показывает кривые выживания Каплана-Майера для пациентов, принадлежащих к типу с мутацией гена KRAS.
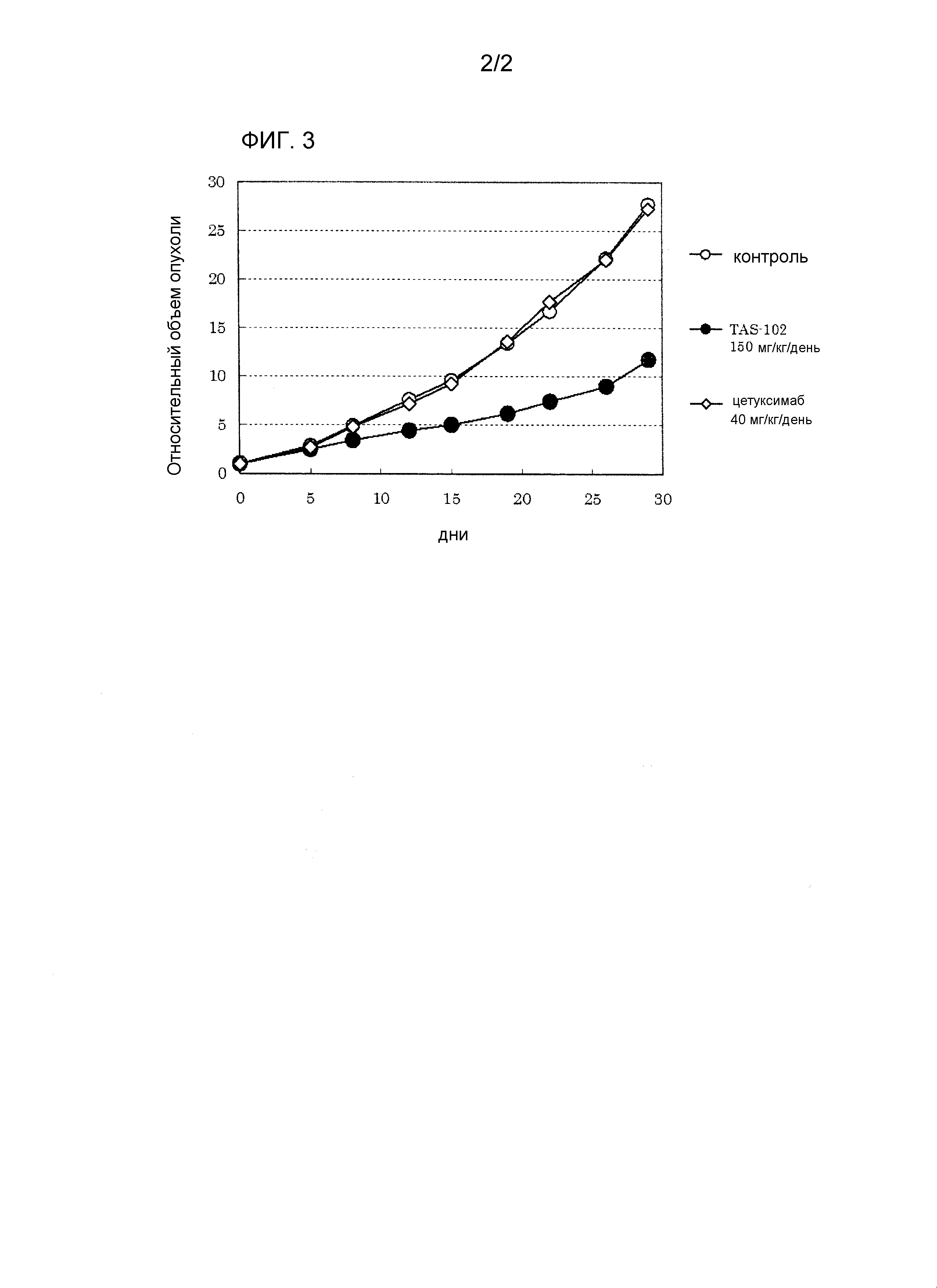
Фиг.3 представляет собой график, показывающий относительные объемы опухолей для нескольких групп "голых" мышей, которым имплантируют штамм рака ободочной и прямой кишки и вводят различные агенты.
TAS-102: перорально, дни 1-14 (дважды в день).
Цетуксимаб: внутрибрюшинно, дни 1, 5, 8, 12.
Описание вариантов осуществления
Способ предсказания по настоящему изобретению предсказывает, имеет ли химиотерапия, использующая TAS-102, достаточный терапевтический эффект на пациента с раком ободочной и прямой кишки, на основе присутствия или отсутствия мутации гена KRAS у пациента.
Белок гена KRAS, который используют в качестве индикатора в настоящем изобретении, принадлежит к типу G белка, имеющему молекулярную массу 21000, локализованного в клеточной мембране, и который, как известно, вовлечен в пролиферацию клеток посредством передачи сигналов эпидермального фактора роста ядру. В дополнение к этому, имеются сообщения о том, что мутация кодона 12 и/или 13 в гене KRAS вызывает стойкую передачу сигналов EGFR.
Целевые пациенты для настоящего изобретения представляют собой пациентов с раком ободочной и прямой кишки. В настоящем изобретении "рак ободочной и прямой кишки" относится к злокачественной опухоли, генерируемой в ободочной или прямой кишке, включая первичные раковые заболевания ободочной и прямой кишки, локальные рецидивы раковых заболеваний ободочной и прямой кишки и метастатические раковые заболевания ободочной и прямой кишки, которые распространяются в другие ткани (например, печень). "Пациенты с раком ободочной и прямой кишки" включают не только пациентов, имеющих опухолевые ткани рака ободочной и прямой кишки в настоящее время, но также и пациентов, которые подвергались резекции опухолевых тканей рака ободочной и прямой кишки. Следовательно, в настоящем описании терапевтический эффект химиотерапии охватывает уменьшение размеров опухолей при раковых заболеваниях ободочной и прямой кишки, подавление пролиферации, увеличение продолжительности выживания, а также подавление рецидива раковых заболеваний после резекции опухолевых тканей ободочной и прямой кишки.
Кроме того, история лечения пациента с раком ободочной и прямой кишки по настоящему изобретению не является как-либо ограниченной постольку, поскольку пациенты могут переносить введение TAS-102; однако целевые пациенты предпочтительно представляют собой пациентов с раком ободочной и прямой кишки, которые являются стойкими или невосприимчивыми по отношению к стандартной терапии, с точки зрения точности предсказания настоящего изобретения. В настоящем изобретении "стандартная терапия" относится к химиотерапии, которая использует противоопухолевый агент на основе фторпиримидина (например, сочетание 5-фторурацила (5-FU) и лейковорина (LV)) или сочетанную химиотерапию (FOLFIRI, FOLFOX, или что-либо подобное), которая использует иринотекан или оксалиплатин, в дополнение к противоопухолевому агенту на основе фторпиримидина. В настоящем документе, состояние "стойкий или невосприимчивый по отношению к стандартной терапии" относится к состоянию, при котором пациент не реагирует на стандартную терапию (включая случаи, когда наблюдается развитие (PD) в течение стандартной терапии, случаи, когда обнаруживается рецидив рака в течение или в пределах 6 месяцев после осуществления стандартной терапии в качестве послеоперационной вспомогательной химиотерапии, и тому подобное), состояние, в котором пациент не может выдерживать введения стандартного количества противоопухолевого агента из-за обострения заболевания или побочных эффектов, или что-либо подобное.
В настоящем изобретении "TAS-102" относится к противоопухолевому агенту, содержащему α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5. Противоопухолевый агент известен своим противоопухолевым эффектом в основном на раковые заболевания с твердыми опухолями, такие как раковые заболевания ободочной и прямой кишки, посредством перорального введения (описание W096/30346).
"α,α,α-трифтортимидин" представляет собой известное производное нуклеиновой кислоты, в котором метильная группа в 5-положении тимидина замещена трифторметильной группой, и оно известно его противоопухолевым эффектом благодаря ингибиторной активности по отношению к синтезу ДНК (J. Am. Chem. Soc. 84:3597-3598, 1962; J. Med. Chem., 7:1-5, 1964; Biochemistry, 33:15086-15094, 1994).
"5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид" представляет собой известное соединение, имеющее активность относительно ингибирования активности тимидинфосфорилазы, и оно является известным своим эффектом увеличения противоопухолевого эффекта (описание W096/30346), эффектом ингибирования метастазирования (описание W098/13045), эффектом ослабления желудочно-кишечных побочных эффектов противоопухолевых агентов (описание WO00/56337), эффектом против ВИЧ (описание WO01/34162), эффектом улучшения лечения облучением (описание W02008/001502) и терапевтическим эффектом на воспалительное заболевание кишечника (описание W02009/047904).
TAS-102 может быть получен в виде сочетанного лекарственного средства (препарата, содержащего множество активных ингредиентов), получаемого посредством приготовления α,α,α-трифтортимидина и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацила гидрохлорида в виде единичной дозированной формы (тип объединенного препарата), или он может быть получен как препараты с единственным активным ингредиентом, посредством приготовления каждого из активных ингредиентов в виде множества дозированных форм. Среди них, предпочтительным является сочетанное лекарственное средство из α,α,α-трифтортимидина и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацила гидрохлорида.
Дозированная форма противоопухолевых агентов не является как-либо ограниченной и может выбираться соответствующим образом в зависимости от цели лечения. Ее конкретные примеры включают пероральные препараты (такие как таблетки, таблетки с покрытием, порошки, гранулы, капсулы и текучие среды), препараты для инъекций, суппозитории, пластыри и мази. Среди них, сочетанное лекарственное средство, содержащее α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид, предпочтительно находится в форме перорального препарата. Каждый противоопухолевый агент может быть приготовлен с помощью повсеместно известного способа, используя один или несколько фармакологически приемлемых носителей в соответствии с каждой дозированной формой. Примеры носителей включают те, которые широко используют в обычных лекарственных средствах, например наполнители, связующие вещества, разрыхлители, смазывающие вещества, разбавители, солюбилизирующие агенты, суспендирующие агенты, агенты для установления тоничности, агенты для установления pH, буферы, стабилизаторы, красители, подслащивающие агенты и ароматизирующие агенты.
"Химиотерапия, при которой используют противоопухолевый агент, содержащий α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5", относится к химиотерапии, при которой вводят, по меньшей мере, TAS-102; она включает химиотерапию с использованием одного только TAS-102 и химиотерапию с использованием TAS-102 и других противоопухолевых агентов.
Временной график введения химиотерапии выбирают соответствующим образом в соответствии с такими условиями как возраст, пол пациента, стадия заболевания, присутствие или отсутствие метастаз и история лечения. Например, предпочтительно повторять следующий 4-недельный курс введения. В каждом курсе, TAS-102 вводят от Дня 1 до Дня 5 и от Дня 8 до Дня 12, 2-4 раза в день при количестве FTD (α,α,α-трифтортимидина) 20-80 мг/м2 (на площадь поверхности тела)/день, предпочтительно, 2-3 раз в день, при количестве FTD 50-70 мг/м2 (на площадь поверхности тела)/день, более предпочтительно, 2 раза в день при количестве FTD 70 мг/м2 (на площадь поверхности тела)/день.
Химиотерапия по настоящему изобретению может представлять собой предоперационную вспомогательную химиотерапию, при которой химиотерапию осуществляют перед резекцией опухоли, или послеоперационную вспомогательную химиотерапию, при которой химиотерапию осуществляют после резекции опухоли.
В настоящем изобретении "терапевтический эффект" может оцениваться на основе эффекта как уменьшения объема опухоли, эффекта подавления рецидива, эффекта увеличения продолжительности выживания и тому подобное. Эффект подавления рецидива может быть представлен увеличением продолжительности выживания без развития заболевания или степенью улучшения доли возникновения рецидивов. "Выживание" может быть представлено с помощью степени увеличения медианного значения общего выживания или выживания без развития заболевания. "Достаточно реагирующий на химиотерапию с использованием противоопухолевого агента, содержащего α,α,α-трифтортимидин и 5-хлор-6-(1-(2-иминопирролидинил)метил)урацил гидрохлорид при молярном отношении 1:0,5" означает превосходный терапевтический эффект посредством введения TAS-102, включая значимое увеличение продолжительности выживания и значимое подавление рецидивов по сравнению с лечением без введения TAS-102.
Способ предсказания по настоящему изобретению включает Стадии (1) и (2), описанные ниже.
Стадия (1) представляет собой стадию детектирования присутствия или отсутствия мутации гена KRAS в биологическом образце, полученном от пациента.
Биологический образец не является как-либо ограниченным постольку, поскольку его получают от пациента, больного раком, и он содержит раковые клетки. Их примеры включают телесную жидкость (такую как кровь и моча), ткани, их экстракты и культуры полученных тканей. Способ получения биологического образца может соответствующим образом выбираться в соответствии с типом биологического образца.
В настоящем изобретении, примеры "мутации гена KRAS" включают мутации кодонов 12, 13 и 61. С точки зрения точности предсказания настоящего изобретения мутации кодонов 12 и 13 являются предпочтительными. Более конкретно, примеры включают мутацию, при которой глицин кодона 12 преобразуется в серин, аспарагиновую кислоту, валин, цистеин, аланин или аргинин из-за точечной мутации первого или второго основания кодона 12 гена KRAS, и мутацию, при которой глицин кодона 13 преобразуется в аспарагиновую кислоту из-за точечной мутации второго основания кодона 13 гена KRAS (Clin Cancer Res. 17(14):4901-4914, 2011; J Mol Diagn. 12(1):43-50, 2010).
Способ детектирования мутации гена KRAS по настоящему изобретению не является как-либо ограниченным постольку, поскольку указанные выше мутации могут быть обнаружены и может использоваться известный способ детектирования. Примеры способов детектирования включают способ прямого секвенирования и способ Scorpion-ARMS (RT-PCR) (Nature Biotech 17:804-807, 1999). Способ Scorpion-ARMS является предпочтительным с точки зрения чувствительности детектирования. Кроме того, можно использовать коммерчески доступные наборы для детектирования, такие как TheraScreen: KRAS (производится DxS Limited).
Биологический образец приготавливают с помощью соответствующей обработки в соответствии с этими способами измерения. Кроме того, реагенты, содержащие один или несколько праймеров или зондов, используемых для детектирования, могут быть приготовлены с помощью обычных способов в соответствии с этими способами измерения.
Стадия (2) представляет собой стадию предсказания того, что пациент, как ожидается, имеет достаточную реакцию на химиотерапию, которая использует TAS-102, когда на стадии (1) детектируется мутация гена KRAS.
ПРИМЕРЫ
Ниже приводятся Примеры для более подробной иллюстрации настоящего изобретения. Нет необходимости говорить, что настоящее изобретение не ограничивается этими Примерами.
Пример 1
Пациенты с прогрессирующими рецидивами рака ободочной и прямой кишки (169 случаев), которые являются стойкими или невосприимчивыми к стандартной терапии, включающей 5-FU, иринотекан и оксалиплатин, и которые имеют историю лечения, по меньшей мере, из 2 режимов, разделены на группу с введением TAS-102 (112 случаев) и группу плацебо (57 случаев). Нет значительных исходных различий между этими двумя группами (включая процент пациентов мужского пола (группа с введением TAS-102, 57,1%; группа плацебо, 49,1%), средний возраст (группа с введением TAS-102, 63; группа плацебо, 62), ECOG PS0 (группа с введением TAS-102, 64,3%; группа плацебо, 61,4%) и процент пациентов, имеющих историю лечения из 3 или более режимов (группа с введением TAS-102, 84,8%; группа плацебо, 77,2%)). В группе с введением TAS-102 в течение 4-недельного курса введения, TAS-102 вводят дважды в день при количестве FTD 70 мг/м2 (на площадь поверхности тела)/день от Дня 1 до Дня 5 и от Дня 8 до Дня 12. Это временной график введения рассматривается как один курс, и этот курс осуществляют многократно. С другой стороны, группе плацебо не дают никакого противоопухолевого агента, включая TAS-102.
Общее выживание (OS) оценивают во всех случаях. Кроме того, поврежденные ткани получают от 149 случаев (группа с введением TAS-102: 99 случаев, группа плацебо: 50 случаев) от всех случаев, и присутствие или отсутствие мутации кодонов 12 и 13 гена KRAS детектируют в соответствии со способом Scorpion-Arms, используя TheraScreen: KRAS (DxS Limited).
Соотношение между общим выживанием и мутацией гена KRAS анализируют в группе с введением TAS-102 и в группе плацебо. Таблица 1 показывает результаты. Кроме того, Фиг.1 и 2 показывают кривые выживания типа с мутацией гена KRAS и с геном дикого типа в соответствии со способом Каплана-Майера.
|
Среди пациентов с мутацией гена KRAS медианное значение (13,0 месяцев) общего выживания в группе с введением TAS-102 является статистически значимо более продолжительным по сравнению со значением для группы плацебо (6,9 месяц). Это подтверждает беспрецедентный превосходный эффект увеличения продолжительности выживания TAS-102 на пациентов с мутацией гена KRAS (HR=0,44, [95% CI: 0,25-0,80], p=0,006).
Известно, что пациенты с мутацией гена KRAS, как правило, имеют более короткое выживание, чем пациенты с геном дикого типа. Однако, эффект увеличения продолжительности выживания TAS-102 для пациентов с мутацией KRAS больше, чем для пациентов с геном KRAS дикого типа (тип с мутациями: 13,0 месяцев, дикий тип: 7,2 месяца). Такой эффект является неожиданным для специалистов в данной области.
В эксперименте, по отношению ко всем случаям, то есть ко всем случаям, независимо от типа гена KRAS, медианное значение общего выживания группы с введением TAS-102 также является статистически значимо более высоким (9,0 месяцев) по сравнению с группой плацебо (6,6 месяца), подтверждая таким образом, что TAS-102 дает превосходный эффект увеличения продолжительности выживания для пациентов с прогрессирующими рецидивами рака ободочной и прямой кишки, которые являются стойкими или невосприимчивыми к стандартной терапии (HR=0,56, [95% CI: 0,39-0,81], p=0,0011).
Пример 2
Затем, для проверки пригодности для использования TAS-102 по отношению к пациентам с раком ободочной и прямой кишки, принадлежащим к типу с мутацией гена KRAS, осуществляют исследования эффективности in vivo на голых мышах, которым подкожно трансплантируют штамм рака ободочной и прямой кишки человека.
TAS-102 вводят перорально "голым" мышам, которым трансплантируют штамм рака ободочной и прямой кишки человека HCT-116, который известен как тип, имеющий мутацию KRAS, дважды в день в течение 14 последовательных дней при количестве FTD 150 мг/кг/день с помощью обычного способа (TAS-102 Administration Group). Кроме того, в качестве сравнительной группы, цетуксимаб, который часто клинически используют для пациентов с раком ободочной и прямой кишки, которые являются стойкими или невосприимчивыми к стандартной терапии, включающей 5-FU, иринотекан и оксалиплатин, вводят внутрибрюшинно в количестве 40 мг/кг/день в День 1, День 5, День 8 и День 12 (для этого вводимого количества подтверждается противоопухолевый эффект при других видах рака). В противоположность этому, контрольной группе лекарственных средств не вводят. Противоопухолевый эффект оценивают для каждой из этих групп введения.
Большую ось и малую ось каждой опухоли измеряют дважды в неделю с помощью цифрового микрометра для определения объема опухоли (TV). В это же время измеряют массы тела в качестве индикатора побочных эффектов. В соответствии с объемами опухолей, полученными таким образом, вычисляют относительный объем опухоли (RTV) и долю ингибирования роста опухоли (IR) в соответствии со следующими уравнениями.
RTVn=(TV в День n)/(TV в День 0)
IR(%)=[1-(среднее значение RTVn в группе с введением лекарственного средства)/(среднее значение RTVn в контрольной группе)]x100
Фиг.3 показывает результаты. Доля ингибирования роста опухоли в конечный день измерений (День 29) для группы с введением TAS-102 составляет 57,7%, показывая статистически значимый противоопухолевый эффект. С другой стороны, доля ингибирования роста опухоли в группе введения цетуксимаба составляет 1,7%; противоопухолевый эффект не демонстрируется в достаточной степени. Кроме того, во всех группах не наблюдают сильных потерь массы.
Соответственно, показано, что TAS-102 является клинически пригодным для использования пациентов с раком ободочной и прямой кишки независимо от присутствия/отсутствия мутации гена KRAS и что такой терапевтический эффект TAS-102 является особенно значительным для пациентов с мутацией гена KRAS.