Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ РЕВМАТОИДНОГО АРТРИТА С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ IL-17
Вид РИД
Изобретение
Для настоящей заявки испрашивается на приоритет на основании предварительной заявки на выдачу патента США № 61/410533, поданной 5 ноября 2010, описание которой включено в данный документ посредством ссылки в полном объеме.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к новым способам лечения ревматоидного артрита, в которых используют терапевтически эффективное количество молекулы, связывающей IL-17, например, IL-17-антитело, такое как антитело AIN457 (которое также называют «секукинумабом»).
УРОВЕНЬ ТЕХНИКИ
Ревматоидный артрит (РА) является хроническим воспалительным системным аутоиммунным заболеванием неизвестной этиологии. Оно характеризуется симметричным синовитом, приводящим к повреждению хряща и разрушению суставов, и может быть осложнено многочисленными внесуставными проявлениями. Учитывая присутствие аутоантител, таких как ревматоидный фактор (РФ) и антитело против цитруллинированного белка (ACPA), РА считают аутоиммунным заболеванием. РА обычно является прогрессирующим заболеванием со снижением функционального статуса, значительной частотой заболеваемости и преждевременной смертностью, наблюдаемыми при развившемся РА. Заболевание может возникать в любом возрасте, при этом пик заболеваемости наблюдается от сорока до шестидесяти лет. Целью длительного лечения РА является ремиссия заболевания.
Модифицирующие заболевание противоревматические средства (DMARD), гетерогенный набор средств, сгруппированных по применению и поведению, представляют собой первую линию лечения пациентов с РА. DMARD применяют для уменьшения опухания суставов и боли, снижения уровня маркеров острой фазы, ограничения прогрессирования повреждения суставов и улучшения функции суставов. DMARD, чаще всего метотрексат (MTX), назначают после диагностирования заболевания (т.е., раннего РА), обычно до развития эрозивного заболевания и деформаций, наблюдаемых в случае развившегося РА. Терапию MTX начинают, если персистирует боль и синовит (особенно, если нарушается функция), и могут быть добавлены дополнительные DMARD (со стероидами или без стероидов), чтобы добиться контроля заболевания. К сожалению только примерно 2/3 пациентов отвечают на DMARD, и DMARD только частично контролируют развившееся заболевание РА.
По радиологическим данным прогрессирование продолжается даже у 5-20% пациентов с РА, подвергнутых лечению DMARD, у которых достигается ремиссия или клиническое улучшение, которое приближает ремиссию. DMARD также вызывают неблагоприятные эффекты (например, повреждение печени, подавление костного мозга и тяжелую инфекцию легких), что ограничивает их длительное применение.
Вследствие неадекватных ответов и опасностей, ассоциированных с длительным лечением DMARD, биологические препараты были введены для лечения РА второй линии. В общем, средства против TNF (Cimzia®, Enbrel®, Humira®, Remicade®, Simponi®) являются первыми биологическими препаратами, применяемыми при неудачном лечении DMARD и у пациентов, неадекватно отвечающих на DMARD, и ингибитор TNF часто сочетают с MTX (или другим DMARD) для агрессивного лечения развившегося РА. К сожалению, 30-40% пациентов с развившимся РА не могут отвечать на антагонисты TNF-α, и большинство пациентов, которые исходно отвечают, не достигают полной ремиссии или утрачивают реакцию с течением времени. Также возникли вопросы по поводу кратковременной и долговременной переносимости и безопасности хронического биологического лечения, в частности реактивации серьезных инфекций (например, инфекций туберкулеза), печеночной токсичности, усиления сердечнососудистого заболевания, индукции (или обострения) демиелинизирующих состояний и повышенной частоты злокачественных заболеваний вследствие антагонизма TNF-альфа. M. Khraishi (2009) J. Rheumatol. Suppl. 82: 25-32; Salliot с соавторами (2009) Ann. Rheum. Dis. 68: 25-32. Однако ингибитор TNF обычно продолжают принимать, за исключением случаев, когда он становится неэффективным или возникает нежелательное явление, и в такой момент клиницист может перевести пациента на любой другой ингибитор TNF или биологическое средством с другим механизмом действия (например, Kineret® [антагонист IL-1R], MabThera® [антагонист CD20], Orencia® [слитый белок CTLA4] или Actemra® [антагонист рецептора IL-6]). Scott с соавторами (2010) The Lancet 376: 1095-1108.
С учетом указанных выше проблем современной терапии РА понятно, что существует необходимость в разработке новых средств лечения пациентов с РА.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Секукинумаб, новое биологическое средство для РА, находящееся в клинической разработке, является высоко аффинным полностью человеческим моноклональным антителом, которое ингибирует активность интерлейкина-17A человека. В исследовании РА для подтверждения концепции (PoC) пациентам с активным РА, которые находились на стабильной дозе MTX, вводили возрастающие одну и затем две (с интервалом в 21 день) дозы секукинумаба 1 мг/кг, 3 мг/кг и 10 мг/кг внутривенно. Hueber с соавторами (2010) Sci. Transl. Med. 2(52): 52-72. Лечение секукинумабом приводило к быстрому улучшению клинических проявлений РА у многих пациентов по сравнению с плацебо. Полученные данные являются свидетельством того, что нейтрализация IL-17A вероятно является эффективной у РА-пациентов с активным РА. Однако, поскольку ответ пациента на биологическое лечение является вариабельным, и желательно избегать назначения лекарственного средств пациентам, которые будут к нему резистентными, авторы изобретения нашли способы лечения РА, которые сначала позволяют идентифицировать таких пациентов, которые наиболее вероятно соответствующим образом отвечают на антагонизм IL-17. Авторы идентифицировали подгруппу пациентов, имеющих РА, у которых наблюдается повышенная вероятность ответа на антагонизм IL-17, которых авторы назвали «пациентами с РА высокого риска».
Таким образом, одной задачей изобретения является предоставление способов идентификации и лечения «пациентов с РА высокого риска» с использованием терапевтически эффективного количества антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента).
Другой задачей изобретения является предоставление способов определения вероятности того, что пациент с РА будет отвечать на лечение антагонистом IL-17, например, молекулой, связывающей IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом, например, секукинумабом) или молекулой, связывающей рецептор IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом), благодаря определению того, является ли данный пациент пациентом с РА высокого риска.
Другой задачей изобретения является предоставление способов лечения воспалительного артрита, например, АС, РА и ПсА, с использованием терапевтически эффективного количества антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента), посредством доставки такого антагониста IL-7 в виде части терапевтической схемы, например, во время осуществления схемы индукции и поддерживающей схемы.
Соответственно, в настоящем описании раскрыты способы лечения ревматоидного артрита (PA), включающие введение терапевтически эффективного количества антагониста IL-17 пациентам с РА высокого риска.
В настоящем описании также раскрыты способы лечения ревматоидного артрита (РА), включающие: a) отбор пациента для лечения на основе того, что пациент является пациентом с РА высокого риска; и b) введение пациенту терапевтически эффективного количества антагониста IL-17.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие: a) анализ образца от пациента в отношении: i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA), или РФ и ACPA; и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ), или обоих показателей СРБ и СОЭ; и b) затем введение пациенту антагониста IL-17, если пациент является РФ+, ACPA+ или РФ+ и ACPA+, и пациент имеет высокий уровень СРБ, высокую СОЭ или высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие введение пациенту терапевтически эффективного количества антагониста IL-17, при условии, что пациент выбран для лечения на основе того, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах стадия введения включает: a) введение антагониста IL-17 пациенту во время осуществления схемы индукции; и b) затем введение антагониста IL-17 пациенту во время осуществления поддерживающей схемы.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие: a) введение пациенту с РА высокого риска трех доз приблизительно по 10 мг/кг антагониста IL-17, при этом каждую из трех доз доставляют через неделю; и b) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 каждый месяц, начиная с первого месяца после доставки третьей внутривенной дозы.
В настоящем описании раскрыты терапевтические схемы для лечения ревматоидного артрита (РА), включающие: a) отбор пациента, имеющего РА, на основе следующих критериев: i) пациент является РФ+, ACPA+, или одновременно и РФ+ и ACPA+; и ii) пациент имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ; и b) введение пациенту трех доз приблизительно по 10 мг/кг an антагониста IL-17, при этом первую дозу доставляют в нулевую неделю, вторую дозу доставляют во вторую неделю, и третью дозу доставляют в четвертую неделю; и c) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели.
В настоящем описании раскрыты способы определения вероятности того, что пациент с РА будет отвечать на лечение антагонистом IL-17, включающие анализ образца от пациента в отношении: a) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA) или РФ и ACPA; и b) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ), или одновременно и СРБ и СОЭ, при этом пациент вероятно отвечает на лечение РА антагонистом IL-17, если пациент является РФ+, ACPA+ или РФ+ и ACPA+: и пациент имеет высокий уровень СРБ, высокую СОЭ, или высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающегося тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающегося тем, что антагонист IL-17 следует вводить пациенту, выбранному для лечения на основе того, что пациент является пациентом с РА высокого риска.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении пациента с РА высокого риска. В некоторых вариантах пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+), или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ), или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах высокий уровень СРБ составляет ≥10 мг/л, измеряемый по вчСРБ. В некоторых вариантах высокая СОЭ ≥28 мм/час.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающегося тем, что антагонист IL-17 следует вводить пациенту, при условии, что пациент выбран для лечения на основе того, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA +; и b) имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающегося тем, что антагонист IL-17 следует: a) вводить пациенту с РА высокого риска в виде трех доз приблизительно по 10 мг/кг, при этом каждую из трех доз доставляют через неделю; и b) затем вводить пациенту в виде дозы приблизительно от 75 мг до приблизительно 150 мг каждый месяц, начиная с первого месяца после доставки третьей внутривенной дозы.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающегося тем, что: a) образец от пациента анализируют в отношении: i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA), или РФ и ACPA; и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) или одновременно и СРБ и СОЭ; и b) антагонист IL-17 вводят пациенту, если пациент является РФ+, ACPA+ или РФ+ и ACPA+и пациент имеет высокий уровень СРБ, высокую СОЭ, или высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты применения антагониста IL-17 для производства лекарственного средства для лечения РА, отличающиеся тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска.
В настоящем описании раскрыты применения антагониста IL-17 для производства лекарственного средства для лечения РА, отличающиеся тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска во время осуществления схемы индукции с последующей поддерживающей схемой.
В настоящем описании раскрыта фармацевтическая композиция для лечения РА, содержащая в качестве активного ингредиента антагонист IL-17, при этом антагонист IL-17 следует вводить пациенту с РА высокого риска.
В настоящем описании раскрыта фармацевтическая композиция для лечения РА, содержащая в качестве активного ингредиента антагонист IL-17, при этом антагонист IL-17 следует вводить пациенту с РА высокого риска во время осуществления схемы индукции с последующей поддерживающей схемой.
В настоящем описании раскрыты терапевтические схемы лечения РА, включающие: a) отбор пациента с РА высокого риска; b) введение пациенту приблизительно 10 мг/кг антагониста IL-17 в 0, 2 и 4 неделю; и c) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 ежемесячно, начиная с 8 недели.
В настоящем описании раскрыты способы лечения пациента с РА или пациента с РА высокого риска, включающие: a) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в таком введении, во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, составляющую приблизительно 360 мкг/мл; и b) затем введение пациенту молекулы, связывающей IL-17, во время осуществления поддерживающей схемы, что обеспечивает: i) средний минимальный уровень молекулы, связывающей IL-17, в стационарном состоянии приблизительно от 8 мкг/мл до приблизительно 30 мкг/мл; и/или ii) среднюю AUGtau в стационарном состоянии приблизительно от 331 мг*сутки/л до приблизительно 1323 мг*сутки/л.
В настоящем описании раскрыты молекулы, связывающие IL-1, для применения при лечении пациента с РА или пациента с РА высокого риска, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 360 мкг/мл; и b) затем следует вводить пациенту во время осуществления поддерживающей схемы, что обеспечивает: i) средний минимальный уровень молекулы, связывающей IL-17, в стационарном состоянии приблизительно от 8 мкг/мл до приблизительно 30 мкг/мл; и/или ii) среднюю AUCtau в стационарном состоянии приблизительно от 331 мг*сутки/л до приблизительно 1323 мг*сутки/л.
В настоящем описании раскрыты способы лечения пациента с РА высокого риска, включающие: a) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в таком введении, во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 401 мкг/мл; и b) затем введение пациенту молекулы, связывающей IL-17, во время осуществления поддерживающей схемы, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл; и/или ii) среднюю AUGtau в стационарном состоянии приблизительно от 314 мг*сутки/л до приблизительно 1256 мг*сутки/л.
В настоящем описании раскрыта молекула, связывающая IL-17, для применения при лечении псориаза, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 401 мкг/мл; и b) затем следует вводить пациенту во время осуществления поддерживающей схемы, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17 приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл; и/или ii) среднюю AUGtau в стационарном состоянии приблизительно от 314 мг*сутки/л до приблизительно 1256 мг*сутки/л.
В некоторых вариантах поддерживающая схема обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 9,4 мкг/мл до приблизительно 17,3 мкг/мл. В некоторых вариантах поддержание обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно 9,4 мкг/мл или приблизительно 17,3 мкг/мл. В некоторых вариантах схема индукции включает в себя внутривенное введение молекулы, связывающей IL-17, раз в две недели. В некоторых вариантах поддерживающая схема включает в себя ежемесячное подкожное введение молекулы, связывающей IL-17.
В настоящем описании раскрыты наборы, содержащие: a) фармацевтическую композицию, содержащую антагонист IL-17, для применения при лечении ревматоидного артрита (РА) у пациента; и b) инструкции, описывающие, как вводить указанную фармацевтическую композицию пациенту при этом пациент характеризуется как: i) пациент, являющийся РФ+, ACPA+ или одновременно и РФ+ и AGFA+; и ii) имеющий высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 в препарате лекарственного средства для лечения RA, при условии, что пациент отобран для лечения на основе: a) того, что он является РФ+, ACPA+, или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения РА у пациента, характеризуемого тем, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят так, что они содержатся в емкостях, каждая емкость содержит достаточное количество антагониста IL-17, чтобы обеспечить доставку, по меньшей мере, приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения РА у пациента, характеризуемого тем, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят так, что они содержатся в емкостях, каждая емкость содержит достаточное количество антагониста IL-17, чтобы обеспечить доставку, по меньшей мере, приблизительно 10 мг/кг на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения пациента с РА, характеризуемого тем, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят в дозе, обеспечивающей возможность внутривенной доставки приблизительно 10 мг/кг на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения пациента с РА, характеризуемого тем, что: a) он является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят в дозе, обеспечивающей возможность доставки приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 на стандартную дозу.
В настоящем описании раскрыты способы тестирования in vitro для отбора пациента для лечения РА, включающие в себя определение того: i) является ли пациент РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) имеет ли пациент высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах раскрытых способов тестирования in vitro пациент имеет улучшенный терапевтический ответ на следующую схему лечения: a) введение пациенту трех доз приблизительно 10 мг/кг антагониста IL-17, при этом первую дозу доставляют в нулевую неделю, вторую дозу доставляют во вторую неделю и третью дозу доставляют в четвертую неделю; и a) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели.
В настоящем описании раскрыты способы получения передаваемой формы информации о пациенте, имеющем РА, включающие: a) анализ образца от пациента в отношении: i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA), или РФ и ACPA: и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) или одновременно и СРБ и СОЭ; и b) перевод результата, полученного на стадии a) в форму передаваемой информации.
В настоящем изобретении также предлагаются способы лечения воспалительного артрита, включающие введение трех индукционных доз (например, внутривенных индукционных доз) приблизительно 10 мг/кг или нескольких (например, 1, 2, 3, 4 или 5) индукционных доз приблизительно 150 мг (например, подкожных индукционных доз) антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) пациенту, имеющему воспалительный артрит, выбранный из группы, состоящей из ревматоидного артрита (РА), спондилоартропатии, анкилозирующего спондилита (спондилоартрита) и псориатического артрита. В некоторых вариантах индукционные дозы доставляют раз в две недели и затем пациенту ежемесячно вводят поддерживающие дозы (например, подкожные поддерживающие дозы) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17 (например, секукинумаба), например, начиная через месяц после доставки последней индукционной дозы.
В настоящем изобретении также предлагаются способы лечения RA, включающие в себя отбор пациента с РА (например, пациента с РА высокого риска) или пациента, имеющего повышенных исходные уровни СРБ, введение пациенту приблизительно 10 мг/кг (например, внутривенным путем) антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) раз в две недели (например, в 0, 2 и 4 недели) и затем введение пациенту приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) (например, подкожным путем) антагониста IL-17 ежемесячно (например, начиная с 8 недели).
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+) или одновременно и РФ+ и ACPA+: и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ), или одновременно и высокий уровень СРБ и высокую СОЭ.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем антагонистом IL-17 является молекула, связывающая IL-17, или молекула, связывающая рецептор IL-17. В некоторых вариантах молекулой, связывающей IL-17, или молекулой, связывающей рецептор IL-17, является молекула, связывающая IL-17 (например, IL-17-антитело), выбранная из группы, состоящей из: a) секукинумаба; b) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro 126, Ile127, Val128, His129; c) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Tyr43, Tyr44, Arg46, Ala79, Asp80; d) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющего две цепи зрелого IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи; e) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющего две цепи зрелого белка IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro 126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи, при этом молекула, связывающая IL-17, имеет KD приблизительно 100-200 пМ, и при этом молекула, связывающая IL-17, имеет время полужизни in vivo приблизительно 4 недель; и f) IL-17-антитела, которое включает антитело, выбранное из группы, состоящей из: i) вариабельного домена тяжелой цепи иммуноглобулина (VH), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8; вариабельного домена легкой цепи иммуноглобулина (VL), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iii) домена VH иммуноглобулина, содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8, и домена VL иммуноглобулина, содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iv) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3; v) домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; vi) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13; vii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; и viii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
В предпочтительных вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем молекулой, связывающей IL-17, является антитело человека. В еще более предпочтительных вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем молекулой, связывающей IL-17, является секукинумаб.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
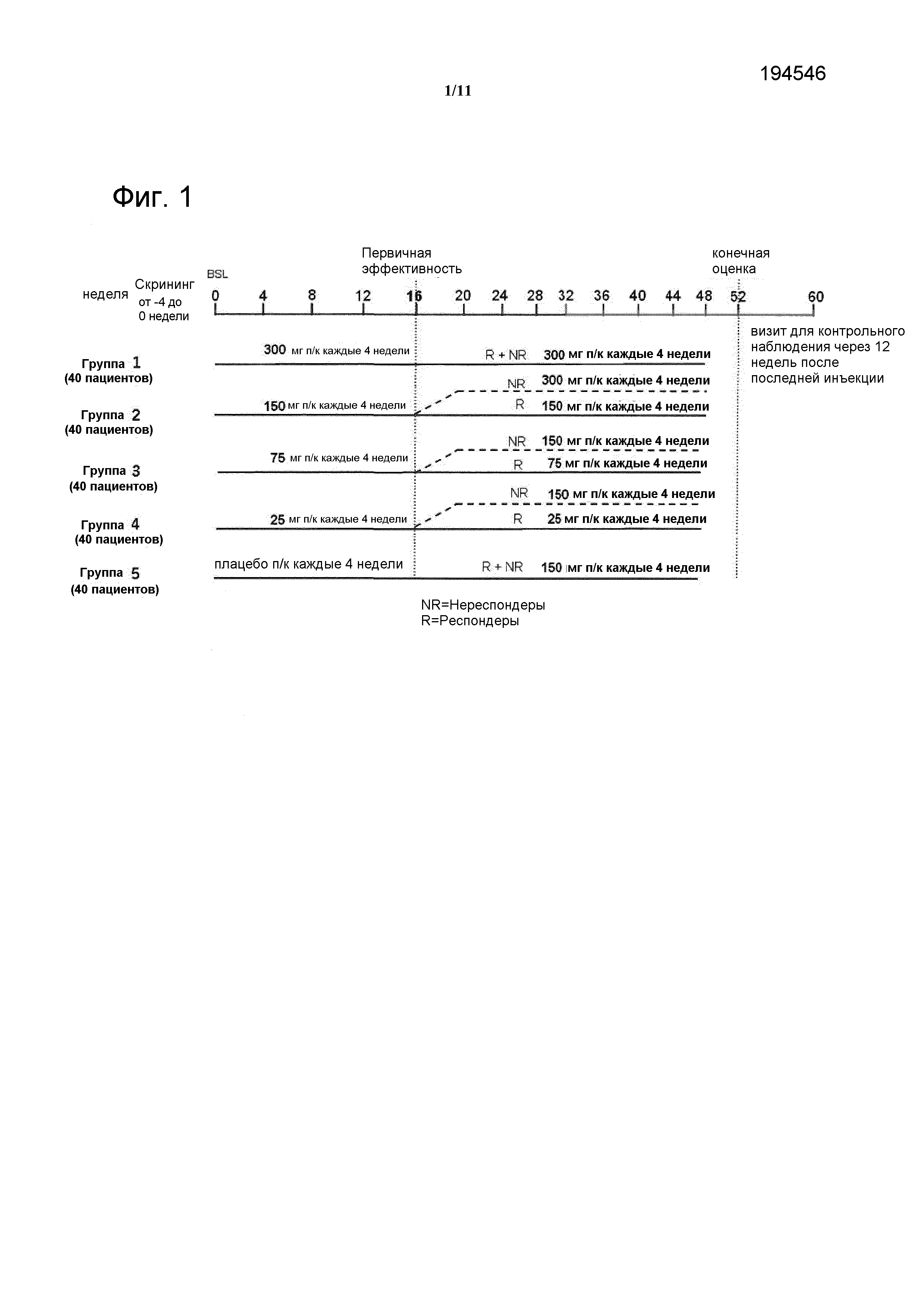
На фигуре 1 показан дизайн исследования CAIN457F2201.
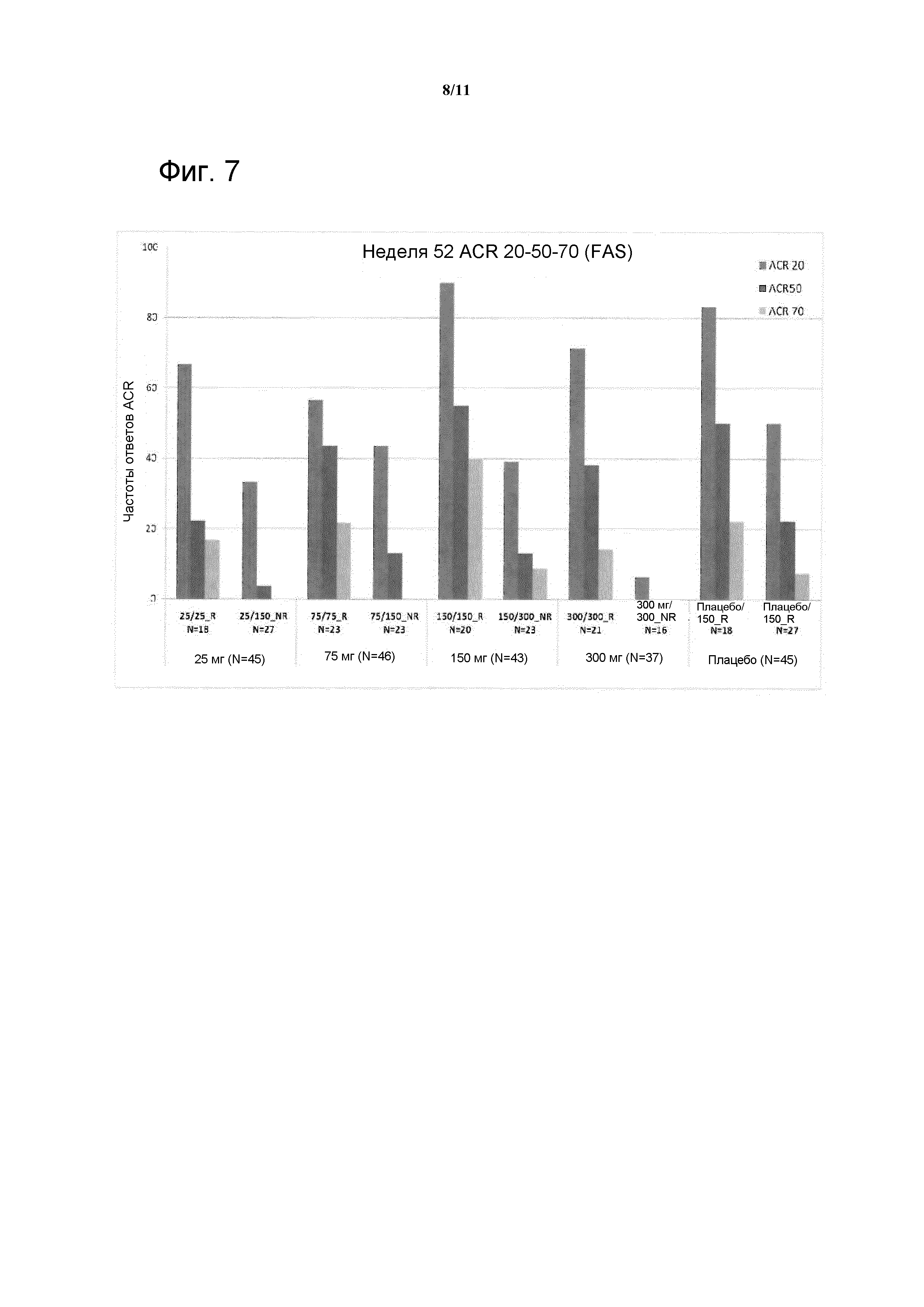
Фигура 2: На фигуре A показан ответ ACR20 c переносом данных последнего наблюдения (LOCF) при лечении до 16 недели в исследовании CAIN457F2201 в полной популяции для анализа (FAS); на фигуре B показан ответ ACR20 (LOCF) при лечении до 16 недели у пациентов с РА высокого риска; на фигуре показан ответ ACR20 в течение времени до 52 недели у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR) в FAS.
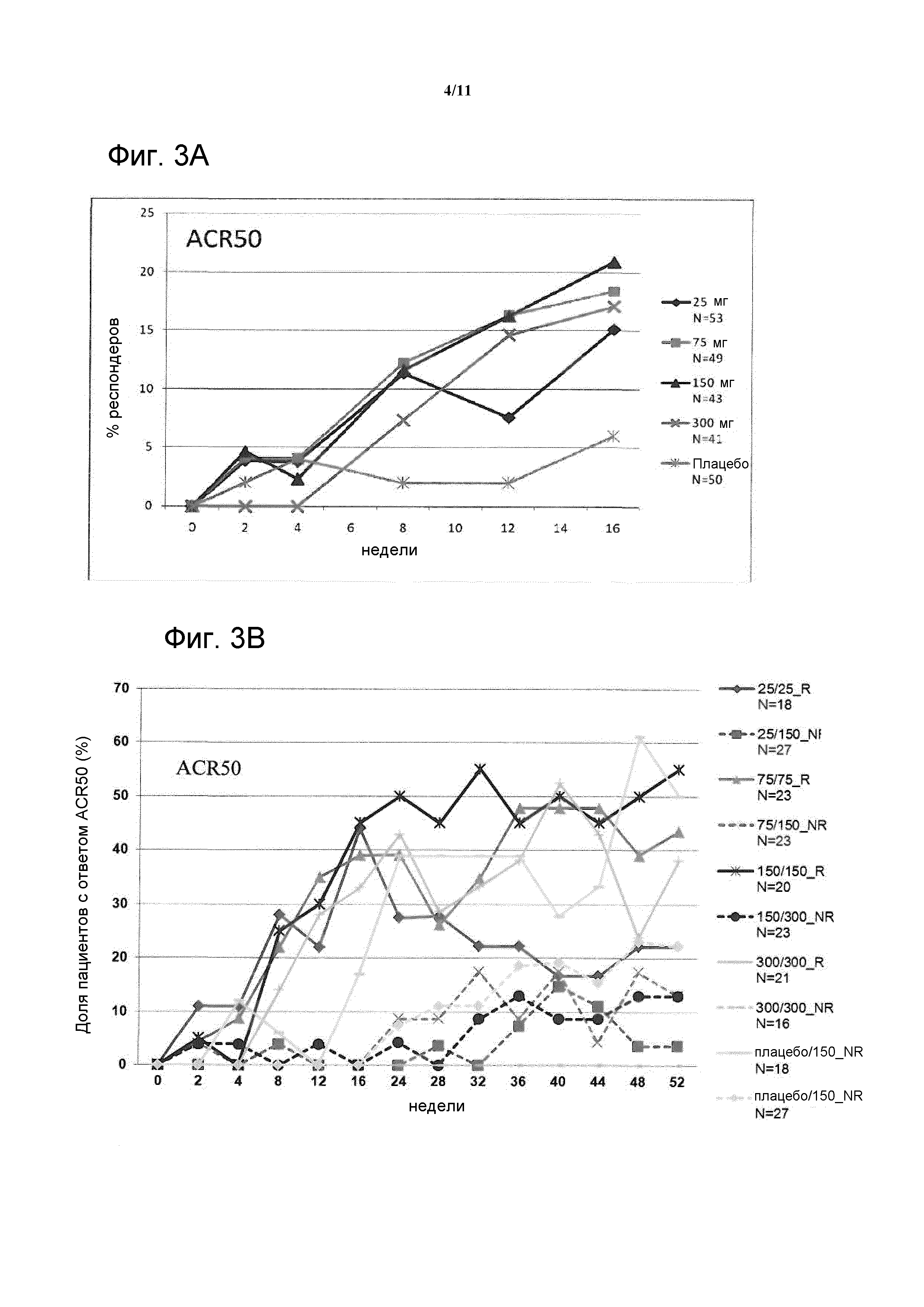
Фигура 3: На фигуре A показан ответ ACR50 (LOCF) при лечении до 16 недель в исследовании CAIN457F2201 в полной популяции для анализа (FAS); на фигуре B показан ответ ACR50 с течением времени до 52 недели у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR), в FAS.
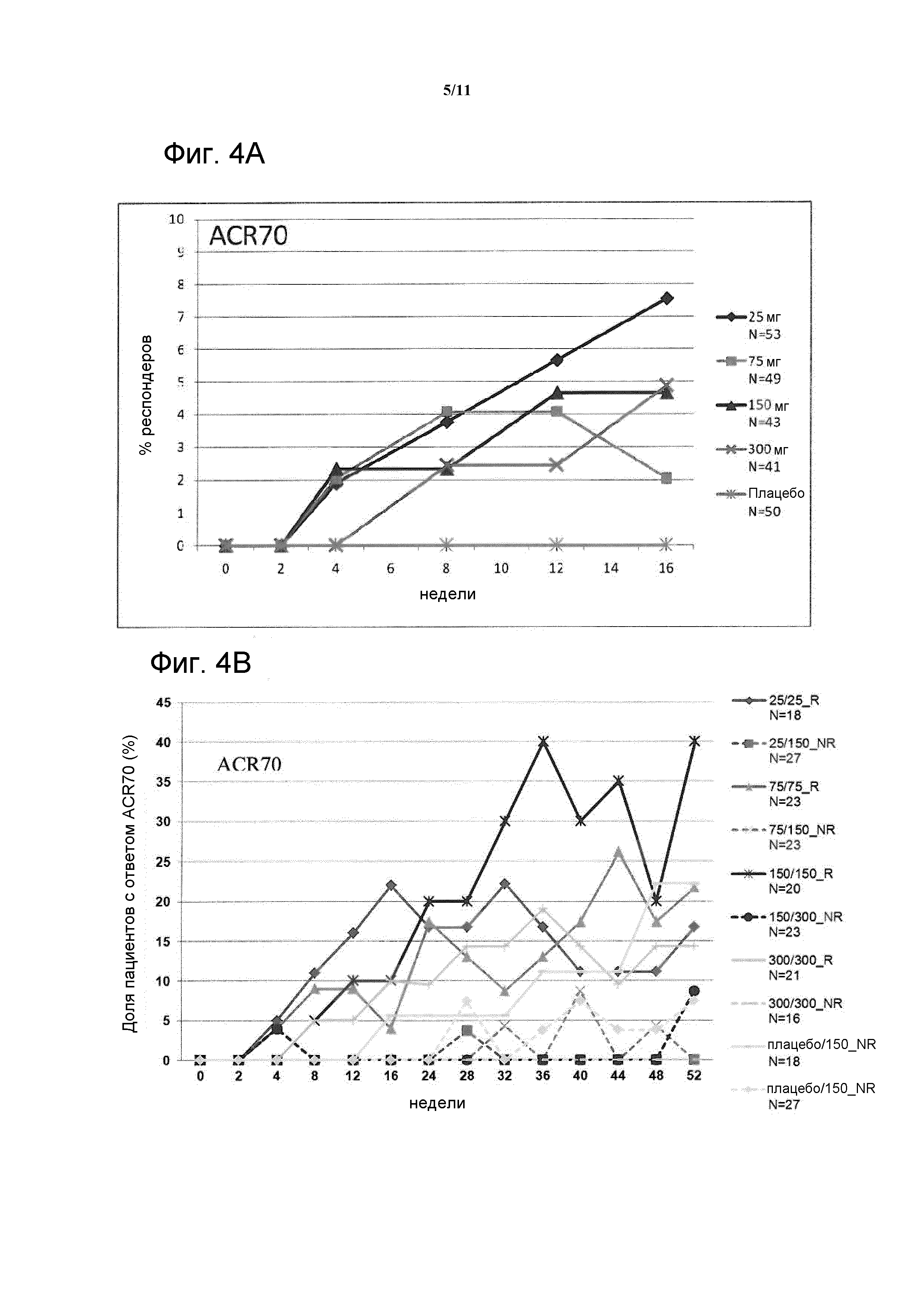
Фигура 4: На фигуре A показан ответ ACR70 (LOCF) при лечении до 16 недели в исследовании CA1N457F2201 в полной популяции для анализа (FAS); на фигуре B показан ответ ACR70 с течением времени до 52 недели у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR) в FAS.
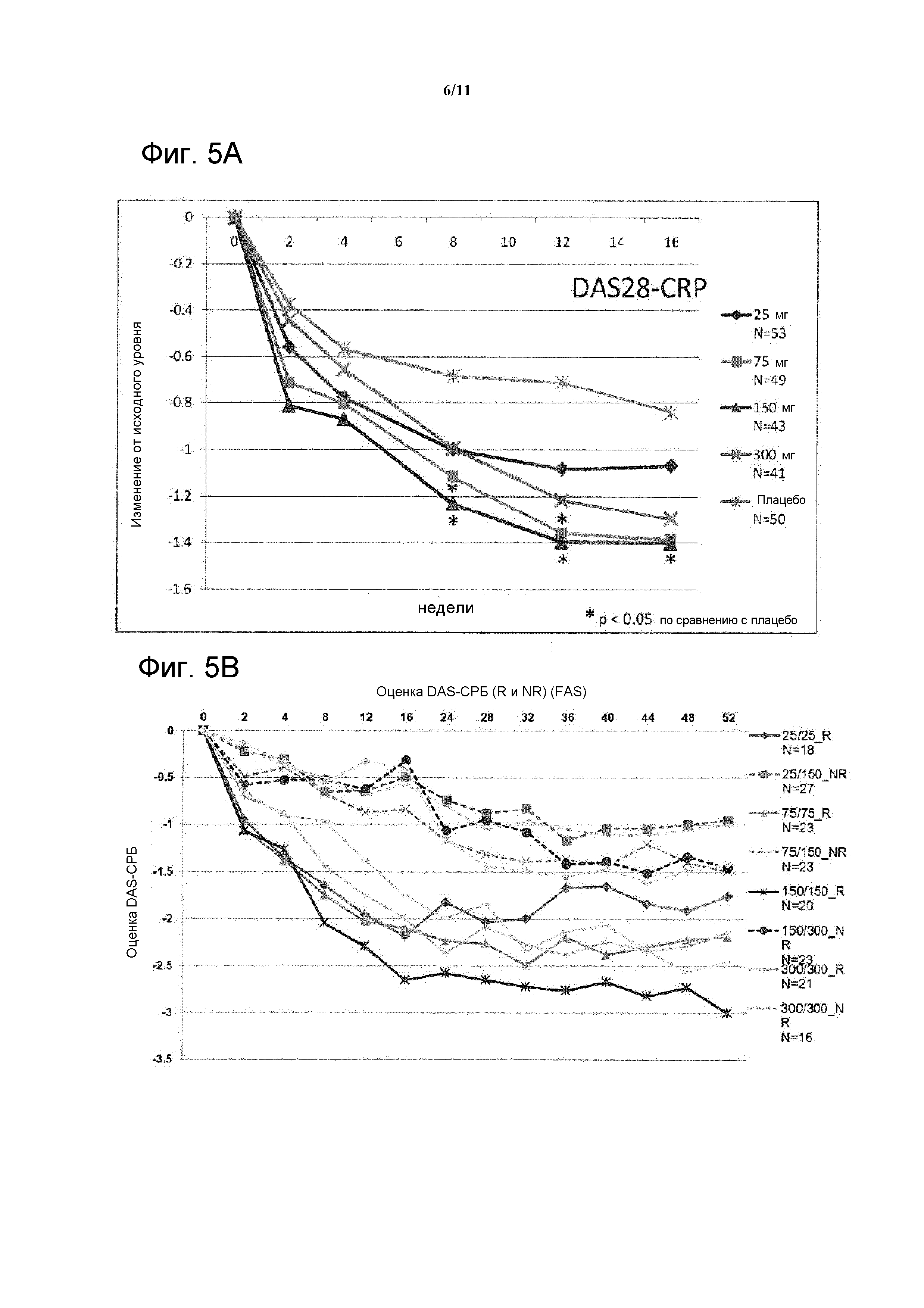
Фигура 5: На фигуре A показано изменение DAS28-СРБ по сравнению с исходным уровнем (LOCF) при лечении до 16 недели в исследовании CAIN457F2201 в FAS; на фигуре B показан ответ DAS28-СРБ с течением времени до 52 недели у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR), в FAS.
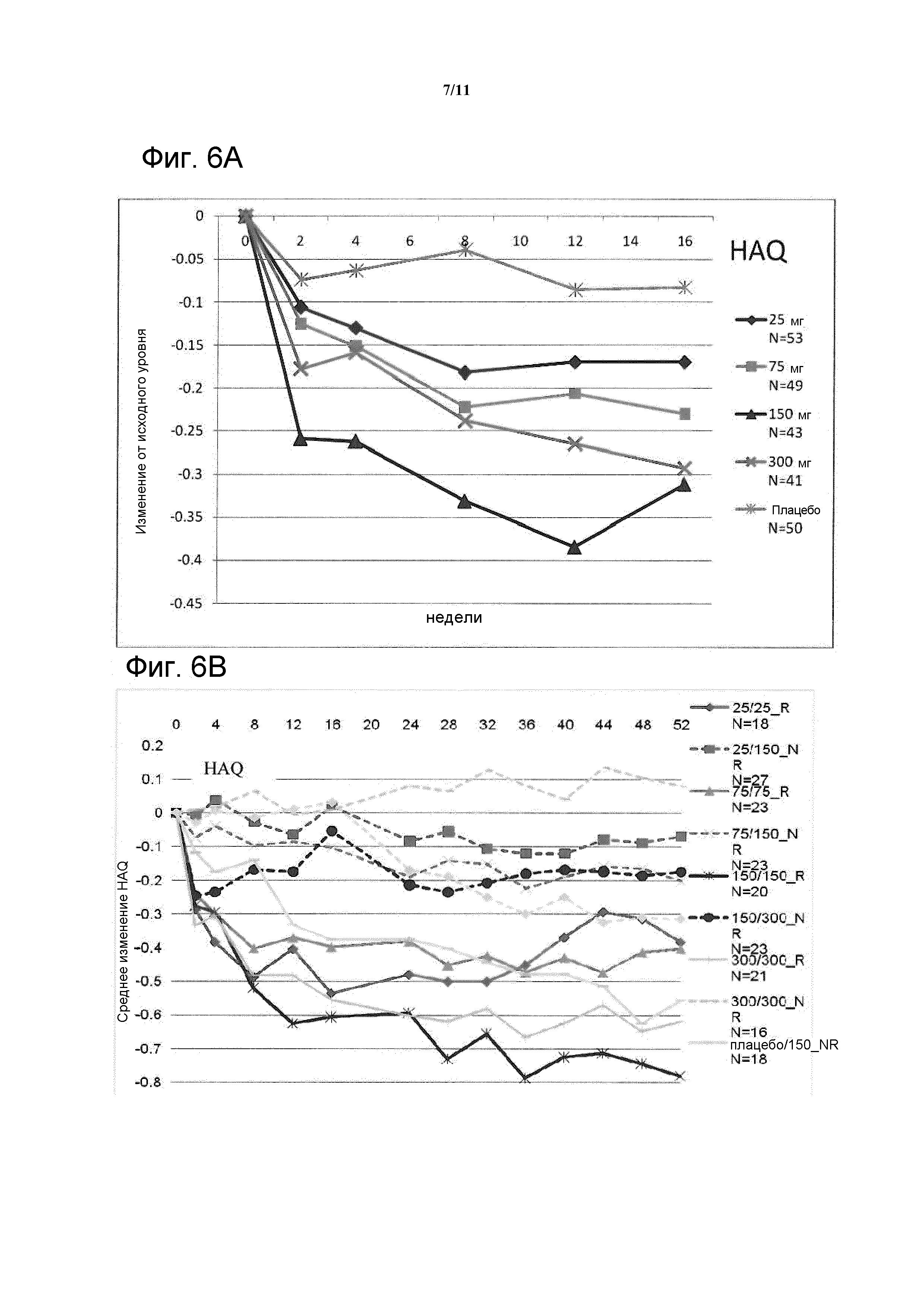
Фигура 6: На фигуре A показано изменение оценок HAQ© по сравнению с исходным уровнем (LOCF) при лечении до 16 недели в исследовании CAIN457F2201 в FAS; на фигуре B показан ответ HAQ© с течением времени до 52 недели у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR), в FAS.
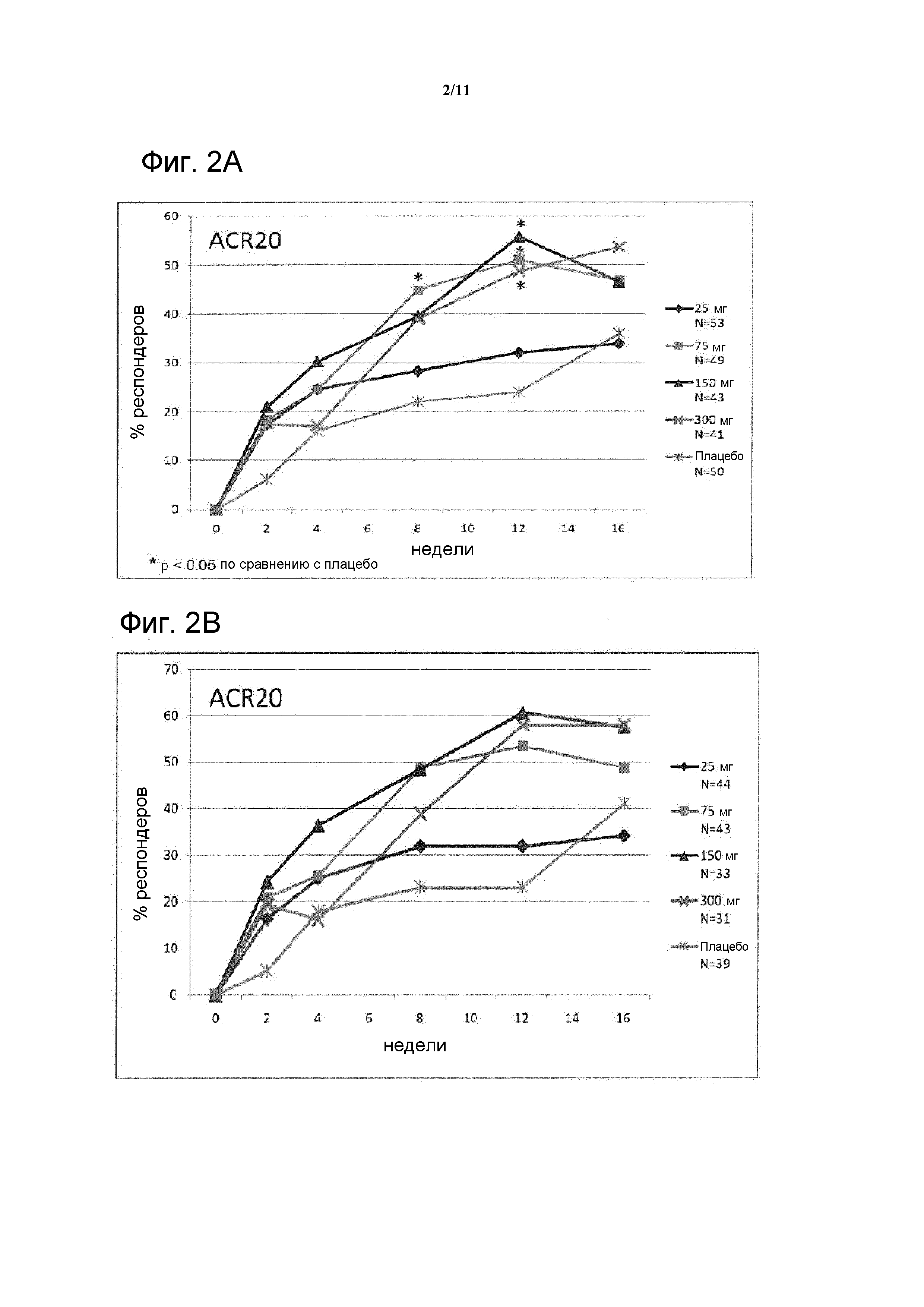
На фигуре 7 показан ответ ACR20/50/70 на 52 неделе у пациентов, отвечающих на лечение (R), и пациентов, не отвечающих на лечение (NR), в FAS.
Фигура 8: На фигуре A показан ответ ACR20/50/70 в % на 16 неделе у пациентов с РА высокого риска и пациентов, не являющихся пациентами с РА высокого риска. На фигуре B показан ответ DAS28-СРБ на 16 неделе у пациентов с РА высокого риска и пациентов, не являющихся пациентами РА высокого риска.
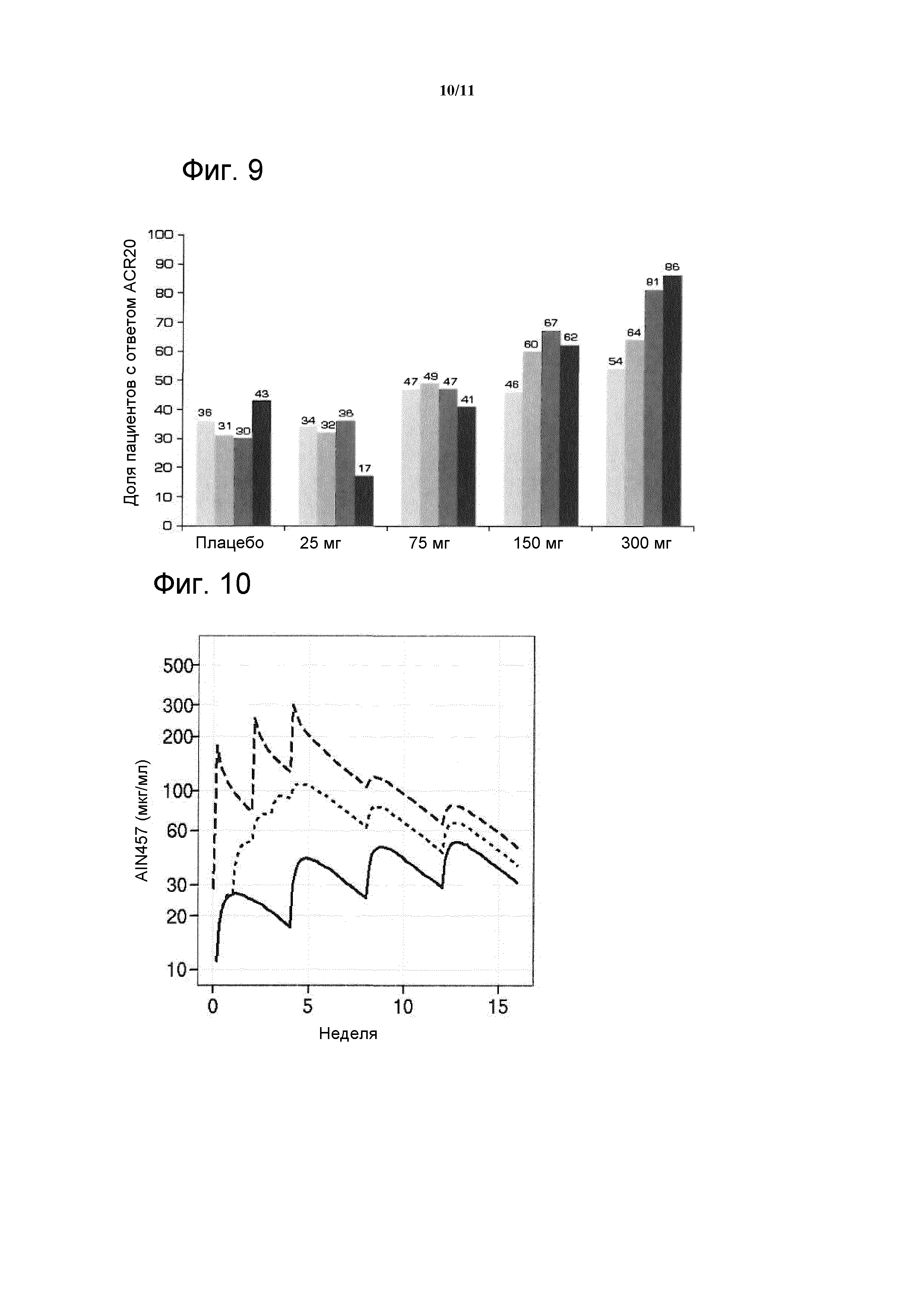
На фигуре 9 показаны доли пациентов с ответом ACR20 в зависимости от группы дозирования и исходных уровней СРБ в исследовании CAIN457F2201. Колонки представляют слева направо всех пациентов, пациентов с исходным уровнем СРБ выше 10 мг/л, выше 20 мг/л и выше 30 мг/л, соответственно.
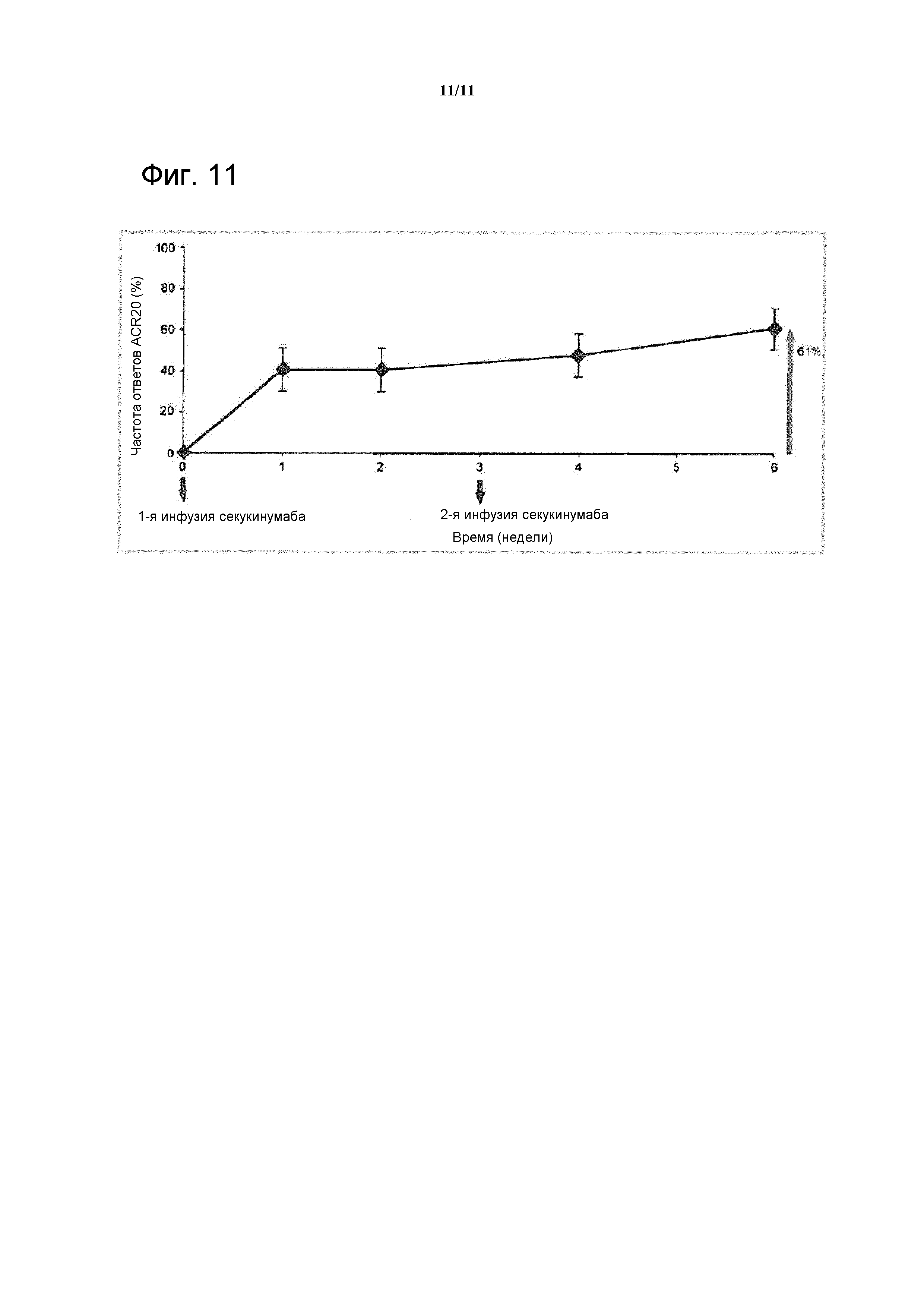
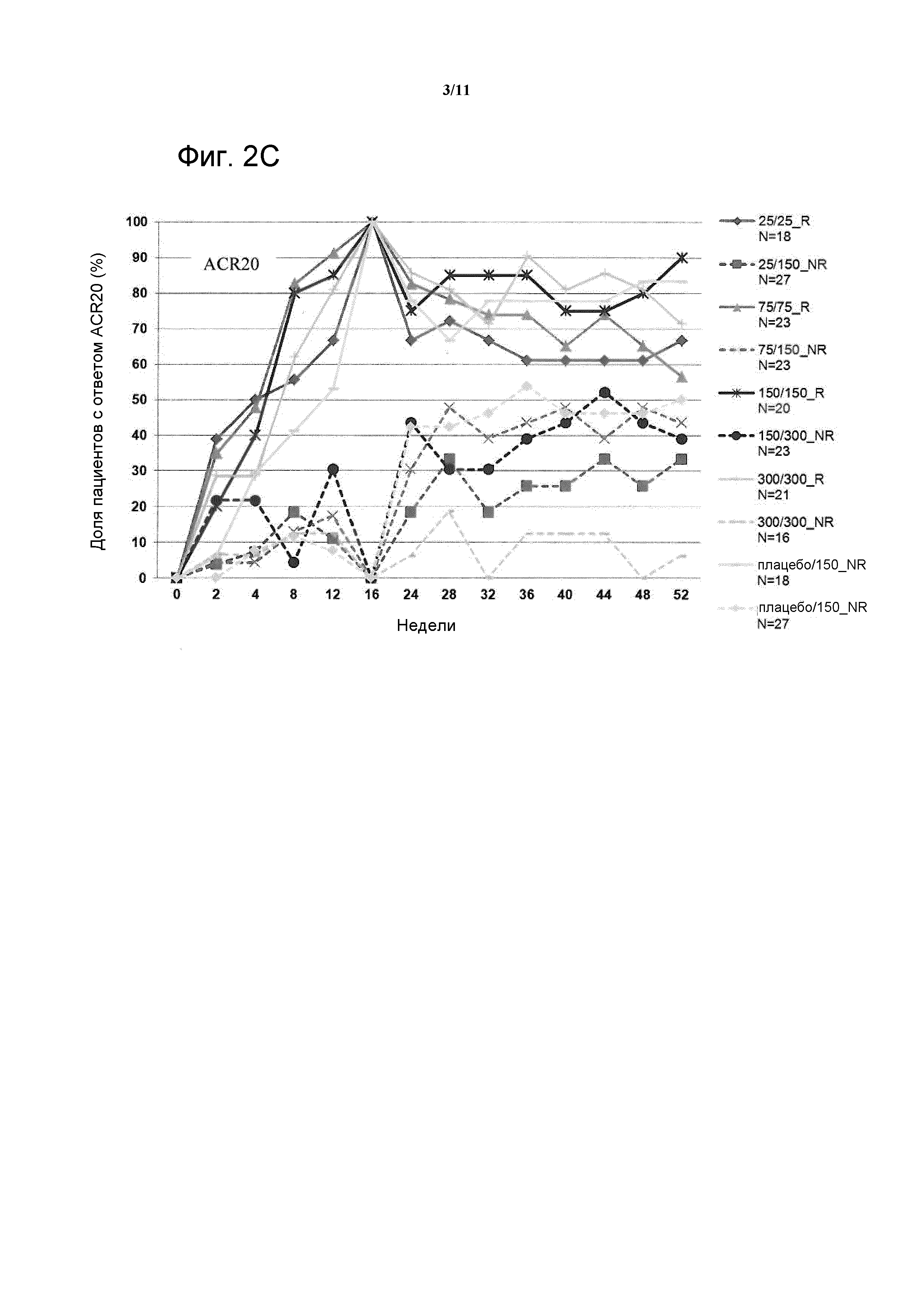
На фигуре 10 показана имитация фармакокинетики (ФК) секукинумаба у пациентов с ревматоидным артритом. Сплошной линией показана ФК без методики индукции (одна дозы 300 мг подкожно в 0 неделю), Точечная линия показывает ФК в случае применения методики подкожной индукции (300 мг подкожно в 0, 1, 2, 3 и 4 неделю), и пунктирная линия показывает ФК в случае применения методики внутривенной индукции (10 мг/кг внутривенно в 0, 2 и 4 неделю). После каждого из трех вариантов следовало введение 300 мг подкожно раз в 4 недели для поддерживания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Критерии классификации РА Американской коллегии ревматологии (ACR) 1987 года позволяют отличать пациентов с развитым РА от людей с сочетанием других определенных ревматологических диагнозов. Такие критерии были бесполезны для идентификации пациентов с ранним заболеванием РА, которые могли бы получить пользу в результате раннего вмешательства. В 2010 году ACR представила новую систему классификации, которая сфокусирована на признаках РА на ранних стадиях заболевания, которые ассоциированы с персистирующим и/или эрозивным заболеванием (далее «критерии ACR/EULAR 2010»). Aletaha с соавторами (2010) Ann. Rheum. Dis. 69: 1580-1588. Система классификации ACR/EULAR 2010 сфокусирована на шести критериях; первые два критерия определяют, кого следует тестировать в отношении РА, тогда как остальные четыре критерия являются оценочными (таблица 1). Оценка в шесть баллов или выше является показателем определенного РА.
|
При поиске показателей, которые являются прогностическими в отношении ответа пациента с РА на лечение молекулой, связывающей IL-17, например, IL-17-антителом, таким как секукинумаб, авторы изобретения проанализировали два из четырех оцениваемых баллами критерия ACR/EULAR 2010 года, чтобы определить, влияют ли такие критерии на ответ на лечение молекулой, связывающей IL-17, такой как секукинумаб. Во-первых, авторы проводили серологический анализ пациента, чтобы определить, является ли пациент РФ+ и/или ACPA+. Во-вторых, авторы анализировали наличие реактантов острой фазы, чтобы определить, имеет ли пациент имеет высокий уровень C-реактивного белка (СРБ) и/или высокую скорость оседания эритроцитов (СОЭ). При осуществлении такого способа авторы обнаружили, что пациенты: 1) которые являются РФ+ или ACPA+ (или и то и другое); и 2) которые имеют высокий уровень СРБ или СОЭ (или и то и другое), более вероятно имеют хороший ответ на лечение молекулой, связывающей IL-17, например, IL-17-антителом, таким как секукинумаб. Такие пациенты (называемые в настоящем описании «пациентами с РА высокого риска»") являются пациентами с наиболее заметными признаками РА (смотри, например, Yildirim с соавторами (2004) Annals Clin. Lab. Sci 34: 423). Соответственно, в настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя введение терапевтически эффективного количества молекулы, связывающей IL-17, пациенту с РА высокого риска.
Кроме того, авторы определили, что повышенные исходные уровни СРБ (например, приблизительно >10 мг/л) также ассоциированы со способностью отвечать на секукинумаб. Соответственно, в настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя введение терапевтически эффективного количества молекулы, связывающей IL-17, пациенту с РА, имеющему повышенные исходные уровни СРБ (например, выше чем приблизительно 10 мг/л, выше чем приблизительно 20 мг/л, выше чем приблизительно 30 мг/л).
Кроме того, авторы обнаружили, что схему лечения, применимые при лечении пациентов с РА высокого риска, дополнительно применимы при лечении РА у пациентов с невысоким риском и пациентов, имеющих другой воспалительный артрит, например, анкилозирующий спондилит (АС) или псориатический артрит (ПсАА). Соответственно, в настоящем описании раскрыты дозы и схемы лечения, направленного на воспалительные артриты (например, РА, АС, ПсА), включающие в себя введение терапевтически эффективного количества молекулы, связывающей IL-17, пациенту, имеющему воспалительный артрит.
Термин «содержащий» охватывает «включающий в себя», а также «состоящий», например, композиция, «содержащая» X, может состоять исключительно из X или может включать в себя какое-либо дополнение, например, X+Y.
Термин «приблизительно» в отношении к числовому значению x означает +/-10%, если контекст не диктует иное. Термин «приблизительно» при использовании в отношении фармакокинетического (ФК) параметра (например, AUC, Cmax, tmax, минимальные уровни и т.д.), указывает на параметр лечения (например, дозу и/или схему дозирования), которые специалист в данной области может считать биологически эквивалентным эталонному параметру лечения. В случае биологической эквивалентности стандартный способ, используемый для того, чтобы показать биологическую эквивалентность, заключается в том, чтобы статистически доказать, что соотношение указанных ФК-параметров (например, AUC, Cmax) для двух обработок (т.е., эталонной обработки и тестируемой обработки) составляет 0,8-1,25, что показывают с использованием 90% доверительного интервала (ДИ) вокруг отношения (нижний предел ДИ выше 0,8 и верхний предел ДИ ниже 1,25). Таким образом, например, если во время испытания, в котором сравнивают профили ФК при эталонной обработке и тестируемой обработке, получают эталонную Cmax 10 мкг/мл, то при тестируемой обработке значение могло бы считаться составляющим «приблизительно 10 мкг/мл», если специалист в данной области полагал бы, что тестируемая обработка является биологически эквивалентной. В используемом в настоящем описании смысле фармакокинетические термины, например, tmax, t1/2, AUC, AUC(0-tau) (AUC к концу заданного периода дозирования, далее «AUCtau»), Cmax имеют свои принятые в данной области значения.
Термин «введение» в связи с соединением, например, молекулой, связывающей IL-17, или противоревматическим средством, используют по отношению к доставки такого соединения любым путем.
Фраза «активный ревматоидный артрит» или «активный РА» используют для обозначения РА с видимыми признаками и симптомами (например, опуханием, затрудненным сгибанием и т.д.).
Термин «анализ» используют по отношению к действию с целью выявления, идентификации, скрининга или определения, и такое действие может быть осуществлено любыми обычными способами. Например, образец можно анализировать в отношении присутствия конкретного маркера с использованием анализа ELISA, Нозерн-блота, визуализации и т.д., чтобы выявить, присутствует ли такой маркер в образце.
Слово «по существу» не исключает «полностью», например, композиция, которая «по существу не содержит» Y, может быть полностью свободна, т.е. может совсем не содержать Y. При необходимости слово «по существу» может быть опущено из определения в описании.
В используемом в настоящем описании смысле «мг/кг» относится к миллиграмма лекарственного средства на килограмм массы тела пациента, которому вводят лекарственное средство.
«Антагонист IL-17» в используемом в настоящем описании смысле относится к молекуле, способной антагонизировать (например, уменьшать, ингибировать, снижать, блокировать, замедлять) функцию, экспрессию и/или передачу сигнала IL-17 (например, посредством блокирования связывания IL-17 с рецептором IL-17). Не ограничивающие примеры антагонистов IL-17 включают молекулы, связывающие IL-17, и молекулы, связывающие рецептор IL-17. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций применяют антагонист IL-17.
Под «молекулой, связывающей IL-17» подразумевают любую молекулу, способную связываться с антигеном IL-17 человека либо отдельно, либо когда он ассоциирован с другими молекулами. Реакция связывания может быть показана стандартными способами (качественными анализами), включая, например, анализ связывания, анализ конкуренции или биоанализ для определения ингибирования связывания IL-17 с его рецептором, или любой вид анализа связывания по отношению к тестированию негативного контроля, в котором используют антитело неродственной специфичности, но такого же изотипа, например, анти-CD25-антитело. Не ограничивающие примеры молекул, связывающих IL-17, включают малые молекулы, рецепторные ловушки IL-17 и антитела, которые продуцированы B-клетками или гибридомами, и химерные, CDR-привитые или человеческие антитела или любой их фрагмент, например, F(ab')2- и Fab-фрагменты, а также одноцепочечные или однодоменные антитела. Предпочтительно молекула, связывающая IL-17, антагонизирует (например, уменьшает, ингибирует, снижает, замедляет) функцию, экспрессию и/или передачу сигнала IL-17. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций используют молекулу, связывающую IL-17.
Под «молекулой, связывающей рецептор IL-17» подразумевают любую молекулу, способную связываться с рецептор IL-17 человека либо отдельным, либо ассоциированным с другими молекулами. Реакц3ия связывания может быть показана стандартными способами (качественными анализами), включая, например, анализ связывания, анализ конкуренции или биоанализ для определения ингибирования связывания рецептора IL-17 с IL-17, или любой вид анализов связывания по отношению к тестированию негативного контроля, в котором используют антитело неродственной специфичности, но такого же изотипа, например, анти-CD25-антитело. Не ограничивающие примеры молекул, связывающих рецептор IL-17, включают малые молекулы, IL-17-ловушки и антитела к рецептору IL-17, которые продуцированы B-клетками или гибридомами, и химерные, CDR-привитые или человеческие антитела или любой их фрагмент, например, F(ab')2- и Fab-фрагменты, а также одноцепочечные или однодоменные антитела. Предпочтительно молекула, связывающая рецептор IL-17, антагонизирует (например, уменьшает, ингибирует, снижает, замедляет) функцию, экспрессию и/или передачу сигнала IL-17. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применения и композиций используют молекулу, связывающую рецептор IL-17.
Термин «антитело», как указано в настоящем описании, включает целые антитела и любую их антигенсвязывающую часть или отдельные цепи. Встречающееся в природе антитело представляет собой гликопротеид, содержащий, по меньшей мере, две тяжелых (H) цепи и две легких (L) цепи, связанных между собой дисульфидными связями. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно называемой в настоящем описании VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно называемой VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. Области VH и VL можно дополнительно разделить на области гипервариабельности, называемые определяющими комплементарность областями (CDR), между которыми находятся области, которые являются более консервативными, называемые каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций, используют антитело к IL-17 или рецептор IL-17.
Термин «антигенсвязывающая часть» антитела в используемом в настоящем описании смысле относится к фрагментам антитела, которые сохраняют способность специфично связываться с антигеном (например, IL-17). Было показано, что антигенсвязывающая функция антитела может быть осуществлена фрагментами полноразмерного антитела. Примеры связывающих фрагментов, входящих в объем термина «антигенсвязывающая часть» антитела, включают Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидной связью в шарнирной области; Fd-фрагмент, состоящий из доменов VH и CH1; Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546), который состоит из домена VH; и изолированную определяющую комплементарность область (CDR). Примеры антигенсвязывающих участков включают CDR секукинумаба, которые указаны в SEQ ID NO: 1-6 и 11-13 (таблица 4), предпочтительно CDR тяжелой цепи. Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно связать, используя способы рекомбинации, синтетическим линкером, который позволяет получить их в виде одной белковой цепи, в которой области VL и VH спарены с образованием моновалентных молекул (известных как одноцепочечный Fv (scFv); смотри, например, публикации Bird с соавторами (1988) Science 242: 423-426; и Huston с соавторами (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Также подразумевается, что такие одноцепочечные антитела входят в объем термина «антитело». Одноцепочечные антитела и антигенсвязывающие части получают, используя обычные методики, известные специалистам в данной области. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций, используют одноцепочечное антитело или антигенсвязывающую часть антитела против IL-17 (например, секукинумаб) или рецептор IL-17.
Термин «фармацевтически приемлемый» означает нетоксичное вещество, которое не мешает эффективности биологической активности активного ингредиента(ов).
«Изолированное антитело» в используемом в настоящем изобретении смысле, относится к антителу, которое по существу не содержит других антител, имеющих другие антигенные специфичности (например, изолированное антитело, которое специфично связывает IL-17, по существу не содержит антител, которые специфично связывают другие антигены, отличные от IL-17). Изолированное антитело по существу может не содержать другого клеточного материала и/или химических веществ. Однако изолированное антитело, которое «специфично связывает» IL-17, может обладать перекрестной реактивностью по отношению к другим антигенам, таким как молекулы IL-17 других видов. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций антагонистом IL-17 является изолированное антитело.
Термины «моноклональное антитело» или «композиция моноклонального антитела» в используемом в настоящем описании смысле относятся к препарату молекул антитело молекул одномолекулярной композиции. Композиция моноклонального антитела имеет одну специфичность связывания и обладает аффинностью по отношению к конкретному эпитопу. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций антагонистом IL-17 является моноклональное антитело.
Предполагается, что термин «антитело человека» в используемом в настоящем изобретении смысле охватывает антитела, имеющие вариабельные области, в которых и каркасные области и области CDR получены из последовательностей, происходящих из молекул человека. Кроме того, если антитело содержит константную область, то константная область также получена из таких человеческих последовательностей, например, из последовательностей зародышевой линии человека или мутантных вариантов последовательностей зародышевой линии человека или антитела, содержащего консенсусные последовательности, полученного в результате анализа каркасных последовательностей человека, который описан Knappik с соавторами (2000, J. Mol. Biol. 296, 57-86). «Антитело человека» не должно быть обязательно продуцировано в организме человека, в ткани человека или клетке человека. Антитела человека согласно изобретению могут включать в себя аминокислотные остатки, не кодируемые последовательностями человека (например, мутации, введенные в результате случайного или сайт-специфичного мутагенеза in vitro или в результате соматической мутации in vivo). Однако термин «антитело человека» в используемом в настоящем изобретении смысле не предназначен для определения антител, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающих, такого как мышь, были привиты в каркасные последовательности человека. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций антагонистом IL-17 является антитело человека.
Термин «IL-17» относится к IL-17A, ранее известному как CTLA8, и термин включает IL-17A дикого типа разных видов (например, человека, мыши и обезьяны), полиморфные варианты IL-17A и функциональные эквиваленты IL-17A. Функциональные эквиваленты IL-17A согласно настоящему изобретению предпочтительно имеют, по меньшей мере, приблизительно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% идентичность общей последовательности с IL-17A дикого типа (например, IL-17A человека) и по существу сохраняет способность индуцировать продукцию IL-6 фибробластами кожи человека.
Подразумевается, что термин «KD» относится к константе диссоциации, которую получают из отношения Kd к Ka (т.е., Kd/Ka) и выражают в виде молярной концентрации (М). Значения KD для антител могут быть определены с использованием способов, хорошо разработанных в данной области. Одним из способов определения KD антитело является способ, основанный на использовании резонанса поверхностного плазмона или использовании биосенсорной системы, такой как система Biacore®. В некоторых вариантах осуществления изобретения антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекула, связывающая рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) связывает IL-17 человека с KD, приблизительно составляющей 100-250 пМ.
В используемом в настоящем описании смысле термин «аффинность» относится к силе взаимодействия между антителом и антигеном в отдельных антигенных участках. В пределах каждого антигенного участка вариабельная область «плеча» антитела взаимодействует за счет слабых нековалентных сил с антигеном в многочисленных сайтах; чем больше взаимодействий, тем выше аффинность. Стандартные анализы аффинности связывания антител с IL-17 разных видов известны в данной области, включая, например, ELISA, Вестерн-блоты и РИА. Кинетику связывания (например, аффинность связывания) антител также можно оценить в стандартных анализах, известных в данной области, таких как анализ Biacore. Анализы для оценки влияния антител на функциональные свойства IL-17 (например, связывание рецептора, предотвращение или ослабление остеолиза) более подробно описаны в разделе «Примеры».
В используемом в настоящем описании смысле термины «субъект» и «пациент» включают любого человека или животное, отличное от человека. Термин «животное, отличное о человека» включает всех позвоночных, например, млекопитающих и животных, отличных от млекопитающих, таких как приматы, отличные от человека, овцы, собаки, кошки, лошади, коровы, куры, амфибии, рептилии и т.д.
Будет понятно, что антитело, которое «ингибирует» одно или несколько функциональных свойств IL-17 (например, биохимические, иммунохимические, клеточные, физиологические или другие биологические активности или тому подобное), которые определены согласно методикам, известным в данной области и описанным в настоящей публикации, относится к статистически значимому снижению конкретной активности по сравнению с активностью, наблюдаемой в отсутствие антитела (или в случае присутствия контрольного антитела с нерелевантной специфичностью). Антитело, которое ингибирует активность IL-17, приводит к статистически значимому снижению, например, к уменьшению, по меньшей мере, на 10% измеряемого параметра, по меньшей мере, на 50%, 80% или 90%, и в некоторых вариантах антитело согласно изобретению может ингибировать больше чем на 95%, 98% или 99% функциональную активность IL-17.
Термин «производное», если не указано иное, используют для определения вариантов аминокислотной последовательности и ковалентных модификаций антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) согласно настоящему изобретению, например, с указанной последовательностью. «Функциональное производное» включает молекулу, обладающую такой же качественной биологической активностью, что и раскрытые антагонисты IL-17, например, молекулы, связывающие IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулы, связывающие рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент). Функциональное производное включает фрагменты и пептидные аналоги антагониста IL-17, который описан в настоящей публикации. Фрагменты содержат области из последовательности полипептида согласно настоящему изобретению, например, с указанной последовательностью. Функциональные производные антагонистов IL-17, раскрытых в настоящем описании, предпочтительно содержат домены VH и/или VL, которые имеют, по меньшей мере, приблизительно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% идентичность общей последовательности с последовательностями VH и/или VL молекул, связывающих IL-17, раскрытых в настоящем описании (например, последовательностями VH и/или VL, указанными в таблице 4), или содержат CDR, которые, по меньшей мере, приблизительно на 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% идентичность общей последовательности с CDR антагонистов IL-17 (например, секукинумаба), раскрытых в настоящем описании (например, имеют 1, 2 или 3 отличия по аминокислотам от CDR, указанных в таблице 4), и по существу сохраняют способность связывать IL-17 человека, или, например, ингибировать продукцию IL-6 в индуцированных IL-17 фибробластах кожи человека.
«Ингибировать IL-6» в используемом в настоящем описании смысле относится к способности антагониста IL-17 (например, секукинумаба) снижать продукцию IL-6 первичными фибробластами кожи человека. Продукция IL-6 первичными фибробластами (кожи) человека зависит от IL-17 (Hwang SY с соавторами, (2004) Arhtritis Res. Ther.; 6: R 120-128. Коротко, фибробласты кожи человека стимулируют рекомбинантным IL-17 в присутствии различных концентраций молекулы, связывающей IL-17 или рецептор IL-17 человека, с Fc-частью. Химерное анти-CD25-антитело Simulect® (базиликсимаб) может быть в обычных случаях использовано в качестве негативного контроля. Собирают надосадок через 16 часов после стимуляции и анализируют в отношении IL-6 в ELISA. Антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекула, связывающая рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент), которая раскрыта в настоящем описании, обычно имеет IC50 для ингибирования продукции IL-6 (в присутствии 1 нМ IL-17 человека) приблизительно 50 нМ или меньше (например, приблизительно от 0,01 до приблизительно 50 нМ) при тестировании, как описано выше, т.е., когда указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека. В некоторых вариантах раскрытых способов, схем, наборов, процессов, применений и композиций, антагонисты IL-17, например, молекулы, связывающие IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекулы, связывающие рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) и их функциональные производные имеют IC50 для ингибирования продукции IL-6, как определено выше, приблизительно 20 нМ или меньше, более предпочтительно приблизительно 10 нМ или меньше, более предпочтительно приблизительно 5 нМ или меньше, более предпочтительно приблизительно 2 нМ или меньше, более предпочтительно приблизительно 1 нМ или меньше.
Термин «ковалентная модификация» включает модификации полипептида согласно настоящему изобретению, например, имеющего указанную последовательность; или его фрагмента органическим белковым или небелковым дериватизирующим агентом, слияния с гетерологичными полипептидными последовательностями и посттрансляционные модификации. Ковалентно модифицированные полипептиды, например, полипептиды с указанной последовательностью, все еще обладают способностью связывать IL-17 человека или, например, ингибировать продукцию IL-6 индуцированными IL-17 фибробластами кожи человека, при поперечном связывании. Ковалентные модификации обычно вводят посредством взаимодействия целевых аминокислотных остатков с органическим дериватизирующим агентом, то есть агентом, способным взаимодействовать с выбранными боковыми или концевыми остатками, или посредством имеющихся механизмов посттрансляционных модификаций, которые функционируют в выбранных рекомбинантных клетках-хозяевах. Некоторые посттрансляционные модификации являются результатом действия рекомбинантных клеток-хозяев на экспрессированный полипептид. Остатки глутаминила и аспарагинила часто подвергаются посттрансляционному дезамидированию до соответствующих остатков глутамила и аспартила. Альтернативно такие остатки подвергаются дезамидированию в слабокислых условиях. Другие посттрансляционные модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серила, тирозина или треонила, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина, смотри, например, T. E. Creighton, Proteins: Structure and Molecular Properties, W. H. Freeman and Co., San Francisco, pp. 79-86 (1983). Ковалентные модификации, например, включают слитые белки, содержащие полипептид согласно настоящему изобретению, например, имеющий указанную последовательность, и варианты аминокислотной последовательности, такие как иммуноадгезины, и N-концевые слияния с гетерологичными сигнальными последовательностями.
Фраза «по существу идентичный» означает, что соответствующая аминокислотная или нуклеотидная последовательность (например, CDR, домен VH или VL) будет идентична или будет иметь несущественные отличия (например, в результате консервативных аминокислотных замен) по сравнению с конкретной эталонной последовательностью. Несущественные отличия включают небольшие изменения аминокислот, такие как 1 или 2 замены в состоящей из 5 аминокислот последовательности конкретной области. В случае антител имеющее замены антитело обладает такой же специфичностью и имеет, по меньшей мере, 50% аффинность антитела. Последовательности, по существу идентичные (например, имеющие, по меньшей мере, приблизительно 85% идентичность последовательности) последовательностям, раскрытым в настоящем описании, также составляют часть настоящей заявки. В некоторых вариантах идентичность последовательностей может составлять приблизительно 90% или выше, например, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше.
«Идентичность» в отношении нативного полипептида и его функционального производного определяют в настоящем описании в виде процента аминокислотных остатков в выбранной для исследования последовательности, которые являются идентичными остаткам соответствующего нативного полипептида после выравнивания последовательностей и введения пробелов, если они необходимы, чтобы добиться максимальной идентичности в процентах, не считая при этом консервативные замены частью идентичности последовательностей. Ни N- или C-концевые удлинения, ни инсерции не следует считать снижающими идентичность. Способы и компьютерные программы для выравнивания хорошо известны. Идентичность в процентах можно определить, используя стандартные алгоритмы выравнивания, например, используя средство поиска основного локального выравнивания (BLAST), описанный Altshul с соавторами ((1990) J. Mol. Biol., 215; 403-410); алгоритм, описанный Needleman с соавторами ((1970) J. Mol. Biol, 48: 444-453); или алгоритм, описанный Meyers с соавторами ((1988) Comput. Appl. Biosci., 4: 11-17). Набор параметров может представлять собой матрицу для подсчета Blosum 6.2 с использованием штрафа за открытие пробела 1,2, штрафа для расширение пробела 4 и штраф за пробел сдвига рамки 5. Идентичность в процентах между двумя аминокислотными или нуклеотидными последовательностями также можно определить с помощью алгоритма E. Meyers и W. Miller ((1989) CABIOS, 4: 11-17), который был включен в программу ALIGN (версия 2.0), используя таблицу весов остатков PAM120, штраф за длину пробела 12 и штраф за пробел 4.
Термин «аминокислота (аминокислоты)» относится, например, ко всем встречающимся в природе L-α-аминокислотам, и включает D-аминокислоты. Аминокислоты указывают либо хорошо известными однобуквенными, либо трехбуквенными обозначениями.
Термин «вариант аминокислотной последовательности» относится к молекулам с некоторыми отличиями в их аминокислотных последовательностях по сравнению с последовательностями согласно настоящему изобретению. Варианты аминокислотной последовательности полипептида согласно настоящему изобретению, например, имеющего указанную последовательность, все еще обладают способностью связывать IL-17 человека или, например, ингибировать продукцию IL-6 индуцированными IL-17 фибробластами кожи человека. Варианты с заменами представляют собой варианты, в которых, по меньшей мере, один аминокислотный остаток удален и другая аминокислота встроена на его место в то же самое положение в полипептиде согласно настоящему изобретению, например, имеющем указанную последовательность. Такие замены могут быть одиночными, когда только одна аминокислота в молекуле была заменена, или они могут быть множественными, когда были заменены две или больше аминокислот в одной и той же молекуле. Варианты с инсерциями представляют собой варианты с одной или несколькими аминокислотами, встроенными непосредственно рядом с определенной аминокислотой в конкретном положении в полипептиде согласно настоящему изобретению, например, имеющем указанную последовательность. Непосредственно рядом с определенной аминокислотой означает связь с функциональной α-карбоксильной или α-аминогруппой аминокислоты. Делеционные варианты представляют собой варианты, в которых одна или несколько аминокислот в полипептиде согласно настоящему изобретению, например, имеющем указанную последовательность, были удалены. Обычно делеционные варианты будут иметь делеции одной или двух аминокислот в конкретной области молекулы.
В используемом в настоящем описании смысле «терапевтически эффективное количество» относится к количеству антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента), которое является эффективным при введении однократной или многократных доз субъекту (такому как больной человека) для лечения, профилактики, предотвращения появления, излечения, замедления, снижения тяжести, ослабления, по меньшей мере, одного симптома расстройства или рецидива расстройства или для продления жизни субъекта сверх периода, ожидаемого в отсутствие такого лечения. В случае применения по отношению к отдельному активному ингредиенту (например, антагонисту IL-17, например, молекуле, связывающей IL-17 (например, IL-17-антителу или его антигенсвязывающему фрагменту, например, секукинумабу) или молекуле, связывающей рецептор IL-17 (например, IL-17-антителу или его антигенсвязывающему фрагменту)), вводимому отдельно, термин относится к такому ингредиенту отдельно. В случае применения по отношению к сочетанию термин относится к объединенным количествам активных ингредиентов, которые приводят к терапевтическому эффекту в случае введения в сочетании, последовательно или одновременно.
Термины «лечение» или «лечить» относятся как к профилактическому или превентивному лечению, так и к куративному или модифицирующему заболевание лечению, включая лечение пациента, для которого существует риск заболеть данным заболеванием, или предполагают, что он заболел данным заболеванием, а также лечение пациентов, которые больны или у которых было диагностировано, что они страдают от заболевания или медицинского состояния, и включает подавление рецидивов заболевания. Можно проводить лечение субъекта, имеющего медицинское расстройство, или субъекта, который в конце концов может приобрести расстройство, чтобы предотвратить, излечить, задержать появление, уменьшить тяжесть или ослабить один или несколько симптомов расстройства или рецидив расстройства, или чтобы увеличить продолжительность жизни субъекта сверх того периода, который ожидается в отсутствие такого лечения.
В используемом в настоящем описании смысле фраза «воспалительный артрит» относится к различным состояниям суставов, в которые вовлечена иммунная система и воспаление, и включает аутоиммунные расстройства, например, ревматоидный артрит. Не ограничивающие примеры включают серонегативные спондилоартропатии, такие как АС, синдром Рейтера, ПсА, энтеропатический артрит и другие артропатии, такие как РА, ювенильный ревматоидный артрит и системный ревматоидный артрит, кристаллический артрит (подагра, псевдоподагра, апатитная болезнь), ревматическая полимиалгия, амилоидный артрит, пигментный виллонодулярный синовит, синовиальный хондроматоз, гемофилический артрит и реактивный синовит. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет воспалительный артридит.
В используемом в настоящем описании смысле фразы «анкилозирующий спондилит», «АС» и «спондилоартропатия» относятся к воспалительному артридиту, характеризуемому хроническим воспалением суставов, которое может включать позвоночник и крестцово-подвздошное сочленение в области таза, и которое может вызывать возможный артродез позвонков. Модифицированные Нью-Йоркские классификационные критерии диагноза АС или критерии аксиального спондилоартрита ASAS (2009) можно использовать для диагностики пациента, имеющего АС. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет АС.
В используемом в настоящем описании смысле фраза «псориатический артрит» и «ПсА» относится к воспалительному артридиту, который часто ассоциирован с псориазом кожи. Можно использовать различные критерии, например, критерии Moll и Wright, модифицированные критерии ESSG, критерии McGonagle, классификационные критерии псориатического артрита (CASPAR) и т.д., для диагностирования пациента как пациента, имеющего ПсА. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет ПсА.
В используемом в настоящем описании смысле «ревматоидный артрит» или «РА» относится к хроническому системному воспалительному артридиту, который может поражать многие ткани и органы, но главным образом поражает синовиальные сочленения. Критерии ACR/EULAR 2010 года можно использовать для диагностирования пациента как пациента, имеющего РА. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет РА.
В используемом в настоящем описании смысле фраза «критерии ACR/EULAR 2010 года» относится к критериям классификации РА Американской коллегии ревматологии/Европейской лиги против ревматизма 2010 года, которые можно найти в публикации Aletaha с соавторами (2010) Ann. Rheum. Dis. 69: 1580-1588. Такие критерии, которые используют для классификации пациента как пациента, имеющего ревматоидный артрит, указаны в таблице 1.
В используемом в настоящем описании смысле «C-реактивный белок» и «СРБ» относится к C-реактивному белку, белку плазмы, обычно используемому в качестве индикатора ответа острой фазы на воспаление. Уровень СРБ в плазме может быть представлен в любых единицах концентрации, например, мг/дл, нмоль/л. Уровни СРБ можно измерять несколькими хорошо известными способами, например, используя радиальную иммунодиффузию, электроиммуноанализ, иммунотурбидиметрию, ELISA, турбидиметрические способы, поляризационный флуоресцентный иммуноанализ и лазерную нефелометрию. При тестировании в отношении СРБ можно использовать стандартный тест на СРБ или высокочувствительный тест на СРБ (вчСРБ) (т.е., высокочувствительный тест, в котором можно измерять низкие уровни СРБ в образце, используя лазерную нефелометрию). Наборы для регистрации уровней СРБ могут быть приобретены из различных компаний, например, Calbiotech. Inc. Cayman Chemical, Roche Diagnostics Corporation, Abazyme. DADE Behring, Abnova Corporation. Aniara Corporation, Bio-Quant Inc., Siemens Healthcare Diagnostics, etc.
В используемом в настоящем описании смысле «высокий уровень СРБ» определяют по отношению к указанному выше нормальному уровню СРБ, который определен в критериях ACR/EULAR 2010 года (Aletaha с соавторами (2010) Ann. Rheum. Dis. 69: 1580-88). Согласно критериям ACR/EULAR 2010 года нормальный/аномальный СРБ основан на местных лабораторных стандартах. Каждая местная лаборатория может использовать значение предела отсечения для аномального (высокого) СРБ на основе лабораторного правила вычисления нормального максимального СРБ. Лечащий врач обычно поручает проведение теста СРБ в местной лаборатории и местная лаборатория сообщает нормальный или аномальные (низкие или высокие) уровни СРБ, используя правило, которое конкретная лаборатория применяет для вычисления нормального уровня СРБ. Таким образом, если контекст не диктует иное, в используемом в настоящем описании смысле «высокий уровень СРБ» не означает, что указывают конкретное числовое значение, так как считается, что нормальные значения СРБ будут отличаться в разных лабораториях и разных анализах. В некоторых вариантах осуществления изобретения «высокий уровень СРБ» составляет > приблизительно 10 мг/л (например, 10 мг/л), > приблизительно 20 мг/л (например, 20 мг/л) или > приблизительно 30 мг/л (например, 30 мг/л). Уровень СРБ, который оценивают в исходной точке, называют «исходным СРБ». Высокий уровень СРБ в исходной точке может быть назван «повышенным исходным СРБ» или «высоким исходным СРБ». В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет высокий исходный СРБ (или вчСРБ) или высокий уровень СРБ (или вчСРБ). Термин «вчСРБ» относится к уровню СРБ в крови, который измеряют, используя высокочувствительное тестирование СРБ.
В используемом в настоящем описании смысле термины «скорость оседания эритроцитов», «СОЭ», «скорость оседания» и «ск. осед» относятся к скорости оседания эритроцитов в образце от пациента (например, в образце плазмы). СОЭ отражает вязкость плазмы и присутствие белков острой фазы, и в норме показатель указывают в «мм/час». СОЭ получают, измеряя расстояние, на которое красные кровяные клетки оседают в пробирке с течением времени. В обычных способах проверки СОЭ используют тест Вестергрена, тест на основе дзета-потенциала оседания (ZSR) и тест Винтроба (смотри Moseley and Bull (1982) Clin. Lab Haematol. 4: 169-78; Miller с соавторами (1983) Br. Med. J. (Clin. Res. Ed.) 286 (6361 ): 266. Wetteland P. с соавторами (1996) J. Intern. Med. 240 (3): 125-310, все указанные публикации включены в настоящее описание в виде ссылки в полном объеме). Коммерческие наборы для измерения СОЭ доступны, например, из ARKRAY USA, BD Diagnostic Systems, и Polymedco Inc. Приборы для измерения СОЭ можно найти, например, в патенте США 6974701, и приобрести из разных компаний, таких как Steellex Scientific, Nicesound Electronics Co., Globe Scientific Inc., Alifax, AnalysisInstrument AB, Streck Laboratories. PolyMed Co, Inc., и Quantimetrix.
В используемом в настоящем описании смысле «высокуюя СОЭ» определяют по отношению к указанной выше нормальной СОЭ, которая определена в критериях ACR/EULAR 2010 года (Aletaha с соавторами (2010) Ann. Rheum. Dis. 69: 1580-88). Согласно критериям ACR/EULAR 2010 года нормальная/аномальная СОЭ основана на местных лабораторных стандартах. Каждая местная лаборатория может использовать значение предела отсечения для аномальной (высокой) СОЭ на основе лабораторного правила вычисления нормальной максимальной СОЭ. Лечащий врач обычно поручает проведение теста СОЭ в местной лаборатории, и местная лаборатория сообщает о нормальном или высоком СОЭ, используя правило, которое конкретная лаборатория применяет для вычисления нормальной СОЭ. Таким образом, если контекст не диктует иное, в используемом в настоящем описании смысле «высокая СОЭ» не означает, что указывают конкретное числовое значение, так как считается, что нормальные значения СОЭ будут отличаться в разных лабораториях и разных анализах. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент имеет высокую СОЭ.
В используемом в настоящем описании смысле термин «ревматоидный фактор» или «РФ» относится к аутоантителам против Fc-части IgG-антител, которые часто присутствуют у пациентов с РА. В используемом в настоящем описании смысле «РФ» включает РФ любого изотипа, например, IgG, IgE, IgM и IgA. РФ можно анализировать, используя различные хорошо известные способы, которые доступны для определения присутствия или отсутствия конкретного антитела, например, анализ ELISA, проба на агглютинацию, тест с использованием нефелометрии и т.д. Уровни РФ могут быть указаны лабораториями различным образом, например, в виде МЕ/мл, единиц/мл и титра (с использованием способа разведения для измерения того, насколько образец крови от пациента может быть разбавлен, чтобы РФ больше нельзя было выявить, например, титр 1:80 свидетельствует о наличии большего количества регистрируемого РФ, чем титр 1:20). Наборы для определения РФ коммерчески доступны, например, из IBL - America (Immuno-Biological Laboratories).
Пациента, который является серопозитивным в отношении РФ, называют «РФ+». Подобным образом, если образец от пациента содержит РФ, то такой образец называют «РФ+». Каждая местная лаборатория может использовать значение предела отсечения от нормальных уровней РФ на основе лабораторного правила вычисления максимального нормального РФ. Как указано в публикации Aletaha с соавторами (2010) Ann.. Rheum. Dis. 69: 1580-1588, пациента можно считать РФ+ исходя из верхнего предела нормы [ULN] для соответствующего лабораторного теста и анализа; пациент является РФ+, если определено значение выше чем ULN для соответствующего лабораторного теста и анализа. Соответственно, если контекст не диктует иное, в используемом в настоящем описании смысле «РФ+» не означает указание конкретного числового значения, так как ULN будет отличаться в разных лабораториях и анализах. В качестве не ограничивающего примера, во время тестирования лаборатория X дает нормальный диапазон РФ в крови 14-60 единиц/мл. Во время тестирования лаборатория Y дает нормальный диапазон РФ в крови ≤ 40 МЕ/мл. Во время тестирования лаборатория Z дает нормальный диапазон РФ в крови в виде титра от 1:20 до 1:80. Таким образом, пациент будет РФ+, если лаборатория X даст ответ, что уровень РФ выше 60 единиц/мл, если лаборатория Y даст ответ, что значение РФ выше чем 40 МЕ/мл, или если лаборатория Z даст ответ, что титр РФ выше 1:80. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент является РФ+.
Используемый термин «серопозитивный» означает присутствие конкретного вещества (например, РФ) в сыворотке крови пациента.
В используемом в настоящем описании смысле термины «антитело против цитруллинированного белка», «ACPA», «антитело против циклического цитруллинированного пептида» и «анти-CCP» относятся к аутоантителам, которые связывают цитруллинированные аминокислотные остатки на белках, которые встречаются в суставах пациентов с РА. Циклические цитруллинированные пептиды используют в тестах in vitro (например, в анализах ELISA), чтобы определить присутствие ACPA в крови пациента; в результате, ACPA также называют «анти-CCP»-антителом. Уровни ACPA можно анализировать, используя различные хорошо известные способы, которые имеются для определения присутствия или отсутствия конкретного антитела, например, анализ агглютинации, анализ ELISA и т.д. Наборы для ACPA коммерчески доступны, например, тест на анти-CCP DIASTAT® из Axis-Shield Diagnostics, Ltd. (UK) и набор AxSYM Anti-CCP® из Abbot Diagnonstics (Germany).
Пациента, который является серопозитивным в отношении ACPA, называют в настоящем описании «ACPA+». Подобным образом, если образец от пациент имеет ACPA, то такой образец является «ACPA+». Каждая местная лаборатория может использовать значение предела отсечения от нормальных уровней ACPA на основе лабораторного правила вычисления максимального нормального ACPA. Как указано в публикации Aletaha с соавторами (2010) Ann. Rheum. Dis. 69: 1580-1588, пациента можно считать ACPA+, исходя из верхнего предела нормы [ULN] для соответствующего лабораторного теста и анализа; пациент является ACPA+, если определено значение выше чем ULN для соответствующего лабораторного теста и анализа. Соответственно, если контекст не диктует иное, в используемом в настоящем описании смысле «ACPA+» не означает указание конкретного числового значения, так как ULN будет отличаться в разных лабораториях и анализах. В качестве не ограничивающего примера, во время тестирования лаборатория A дает эталонный диапазон ACPA в крови в виде < 20 МЕ (условные единицы в ELISA). Во время тестирования лаборатория B дает эталонный диапазон ACPA в крови в виде < 5 единиц/мл. Таким образом, пациент может быть ACPA +, если лаборатория A даст ответ, что значение ACPA выше 20 МЕ, или если лаборатория B даст ответ, что значение ACPA выше, чем 5 единиц/мл. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент является ACPA+.
Описание того, как выбрать нормальные/аномальные и эталонные диапазоны для ACPA, СОЭ, РФ и СРБ можно найти, например, в публикации Fischbach and Dunning (2009) «A Manual of Laboratory and Diagnositc Tests» (8th Edition) Wolters Kluwer/Lippincott Williams and Williams, которая включена в настоящее описание в виде ссылки в полном объеме.
В используемом в настоящем описании смысле фразу «пациент с РА высокого риска» используют для определения пациента, который: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ (или вчСРБ), высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент является пациентом с РА высокого риска. В некоторых вариантах у пациента обнаружено вовлечение, по меньшей мере, одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти небольших суставов. В некоторых вариантах у пациента обнаружено вовлечение, по меньшей мере, одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или десяти крупных суставов. В некоторых вариантах у пациента обнаружено вовлечение более десяти суставов, при этом, по меньшей мере, один из суставов является мелким суставом. В некоторых вариантах у пациента продолжительность симптомов составляет, по меньшей мере, шесть месяцев.
«Вовлечение суставов» относится к любому опухшему или болезненному суставу при обследовании, что может быть подтверждено полученными при визуализации доказательствами синовита. Категории распределения суставов классифицируют в соответствии с положением и количеством вовлеченных суставов, при этом отнесение к наивысшей категории возможно основано на картине вовлечения суставов. Термин «крупные суставы» относится к плечевым, локтевым, тазобедренным, коленным и голеностопным. Термин «мелкие суставы» относится к метакарпофалангеальным, проксимальным межфаланговым, второму-пятому метатарсофалангеальным суставам, межфаланговым суставам большого пальца и суставам запястья. В некоторых вариантах раскрытых способов, схем, применений, наборов и композиций пациент имеет ≥6 из 28 болезненных суставов и ≥6 из 28 опухших суставов и вчСРБ >10 мг/л.
«Продолжительность симптомам» относится к сообщениям самих пациентов о продолжительности признаков или симптомов синовита (например, боли, опухания, болезненности) суставов, которые клинически поражены во время оценки, независимо от статуса лечения.
В используемом в настоящем описании смысле «отбор пациента с РА высокого риска для лечения» и «отбор пациент для лечения на основе того, что пациент является пациентом с РА высокого риска» и «выбранный для лечения» используют, подразумевая, что конкретный пациент с РА выбран из a) большей группы или пациентов с РА на основании того, что конкретный пациент удовлетворяет критериям РА высокого риска (т.е., пациент является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и пациент имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ).
В используемом в настоящем описании смысле фразу «ранее подвергался лечению по поводу РА» используют, подразумевая, пациента, который ранее подвергался лечению РА с использованием противоревматического средства, например, пациента, который не способен отвечать или неадекватно отвечает на лечение, или не переносит применяемую ранее терапию РА, противоревматическое средство или схему лечения. Такие пациенты включают пациентов, которых ранее лечили MTX, DMARD, и/или биологическими средствами, такими как антагонисты TNF-альфа и т.д. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент ранее подвергался лечению по поводу РА.
В используемом в настоящем описании смысле фразу «ранее не подвергался лечению по поводу РА» используют, подразумевая пациента, который ранее не подвергался лечению РА с использованием противоревматических средств, т.е. пациент «не подвергался воздействию». В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент ранее не подвергался лечению по поводу РА.
В используемом в настоящем описании смысле «не способен» в отношении предыдущей терапии РА относится к: (1) пациенту, у которого нет значимого клинического результата (первичное отсутствие эффективности); (2) пациенту, у которого наблюдается измеряемый и значимый ответ, но у которого ответ может быть лучше, например, не была достигнута низкая активность РА или ремиссия РА (также называемый «неадекватным ответом»); (3) пациенту, у которого после начальной хорошей реакции ответ ухудшается (вторичная утрата эффективности); и (4) пациенту с хорошей реакций, но с прерванным лечением вследствие побочного эффекта (ответ также называют «непереносимостью»). Пациенты, у которых наблюдают неадекватный ответ TNF (TNF-IR) или непереносимость TNF, можно считать неспособными отвечать на TNF. Пациенты, у которых наблюдают неадекватный ответ на метотрексат (MTX-IR) или непереносимость MTX, можно считать неспособными отвечать на MTX. Пациенты, у которых наблюдают неадекватный ответ на DMARD (DMARD-IR) или непереносимость DMARD можно считать неспособными отвечать на DMARD. В некоторых вариантах раскрытых способов, схем, применений, наборов и фармацевтических композиций пациент является неспособным отвечать TNF, неспособным отвечать на MTX или неспособным отвечать на DMARD.
Под «терапевтической схемой» подразумевают схему лечения заболевания, например, схему дозирования, используемых при лечении РА. Терапевтическая схема может включать в себя схему индукции и поддерживающую схему. Примеры терапевтических схем лечения РА приведены в таблице 2, ни одна из которых не обеспечивает лечение пациента с РА высокого риска.
|
Фраза «схема индукции» или «период индукции» относится к схеме лечения (или части схемы лечения), которую используют для начального лечения заболевания. В некоторых вариантах в раскрытых способам, применениях, наборах, процессах и схемах (например, в способах лечения воспалительного артридита, например, РА, например, пациента с РА высокого риска) применяют схему индукции. Обще целью схемы индукции является обеспечение высокого уровня лекарственного средства в организме пациента во время начального периода схемы лечения. В схеме индукции можно использовать (в виде части или в целом) введение более высоких доз лекарственного средства, чем врач может применять во время осуществления поддерживающей схемы, введение лекарственного средства более часто, чем врач может вводить лекарственное средство во время осуществления поддерживающей схемы, или и то и другое. В некоторых вариантах раскрытых способов, применений, наборов, процессов и схем индуцирующая доза может быть доставлена при осуществлении схемы индукции в виде однократной инфузии высокой дозы (например, приблизительно 30 мг/кг). Альтернативно индуцирующая доза может быть доставлена в виде нескольких (например, двух или трех) инфузий (например, приблизительно 10 мг/кг). Альтернативно, индуцирующая доза может быть доставлена в виде нескольких (например, 1, 2, 3, 4, 5, 6 или больше) подкожных инъекций (например, приблизительно 75-300 мг). Доставка лекарственного средства во время фазы индукции может быть осуществлена подкожным (п/к) путем, например, доставка доз приблизительно от 75 мг до приблизительно 300 мг п/к (например, приблизительно 75 мг п/к, приблизительно 150 мг п/к, приблизительно 300 мг п/к), или внутривенным (в/в) путем, например, доставка доз приблизительно от 1 мг/кг до приблизительно 30 мг/кг в/в (например, приблизительно 1 мг/кг, приблизительно 3 мг/кг, приблизительно 10 мг/кг, приблизительно 30 мг/кг) или любым другим путем введения (например, внутримышечным, в/м). В некоторых вариантах раскрытых способов, композиций, наборов, применений и схем антагонист IL-17 (например, секукинумаб) доставляют посредством внутривенного введения во время осуществления, по меньшей мере, части схемы индукции. В некоторых вариантах схема индукции включает в себя введение дозы приблизительно от 1 мг/кг до приблизительно 30 мг/кг, приблизительно от 1 мг/кг до приблизительно 10 мг/кг, предпочтительно приблизительно 10 мг/кг антагониста IL-17 (например, секукинумаба). В следующих вариантах индуцирующие дозы доставляют еженедельно, раз в две недели, через неделю или ежемесячно, предпочтительно через неделю. В следующих вариантах в схеме индукции используют 1-10 доз антагониста IL-17 (например, секукинумаба), предпочтительно три дозы антагониста IL-17 (например, секукинумаба).
Схема индукции для доставки антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17) также может быть составлена с использованием информации о ФК (смотри таблицу 10), а не конкретных доз. В случае раскрытых применений, схем и способов (например, способов лечения воспалительного артрита, например, РА, например, пациента с РА высокого риска), специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы индукции, чтобы обеспечить среднюю Cmax приблизительно от 360 мкг/мл до приблизительно 401 мкг/мл. Альтернативно специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб) или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы индукции, чтобы обеспечить среднюю Cmax приблизительно 401 мкг/мл с варьированием между пациентами приблизительно до 30%-40% [+ или -] в расчете на человека средней массы 90 кг. Альтернативно специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб) или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы индукции, чтобы обеспечить среднюю Cmax приблизительно 360 мкг/мл для среднего человека массой 75 кг. Альтернативно специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы индукции, чтобы обеспечить минимальные уровни более 80 мкг/мл в течение 10-недельного периода для среднего человека массой 75 кг. В некоторых вариантах антагонист IL-17 доставляют в 0, 2 и 4 неделю внутривенно во время осуществления схемы индукции, чтобы обеспечить среднюю Cmax приблизительно 401 мкг/мл с варьированием между пациентами приблизительно до 30%-40% [+ или -] в расчете на среднего человека массой 90 кг. В некоторых вариантах антагонист IL-17 доставляют в 0, 2 и 4 неделю внутривенно во время осуществления схемы индукции, чтобы обеспечить среднюю среднюю Cmax приблизительно 360 мкг/мл для среднего человека массой 75 кг. В других вариантах антагонист IL-17 доставляют в 0, 2 и 4 неделю внутривенно во время осуществления схемы индукции, чтобы обеспечить наименьшие уровни выше 80 мкг/мл в течение 10-недельного периода для среднего человека массой 75 кг.
Фраза «поддерживающая схема» или «период поддержания» относится к схеме лечения (или части схемы лечения), которую используют для поддержания пациента во время лечения заболевания, например, чтобы поддержать ремиссию у пациента в течение длительных периодов времени (месяцев или лет). В некоторых вариантах в раскрытых способах, применениях и схемах (например, в способах лечения воспалительного артридита, например, РА, например, пациента с РА высокого риска) используют поддерживающую схему. В случае поддерживающей схемы можно применять непрерывную терапию (например, введение лекарственного средства с регулярными интервалами, например, еженедельно, ежемесячно, ежегодно и т.д.) или терапию с перерывами (например, прерывистое лечение, периодическое лечение, лечение при рецидиве или лечение при достижении конкретных предварительно определяемых критериев [например, боли, проявления заболевания и т.д.]). Доставку антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента), во время осуществления схемы поддержания можно осуществлять подкожным путем, например, доставку доз приблизительно от 75 мг до приблизительно 300 мг п/к (например, приблизительно 75 мг п/к, приблизительно 150 мг п/к, приблизительно 300 мг п/к). или внутривенным путем, например, доставку доз приблизительно от 1 мг/кг до приблизительно 30 мг/кг в/в (например, приблизительно 1 мг/кг, приблизительно 3 мг/кг, приблизительно 10 мг/кг, приблизительно 30 мг/кг), или другим путем введения (например, внутримышечным, в/м). В некоторых вариантах раскрытых способов, применений и схем, антагонист IL-17 (например, секукинумаб) доставляют посредством п/к-введения во время осуществления поддерживающей схемы. В некоторых вариантах поддерживающая схема включает в себя введение дозы приблизительно от 75 мг до приблизительно 300 мг, приблизительно от 75 мг до приблизительно 150 мг, предпочтительно приблизительно 75 мг или приблизительно 150 мг антагониста IL-17 (например, секукинумаба). В некоторых вариантах поддерживающая схема включает в себя введение дозы антагониста IL-17 (например, секукинумаба) в ежемесячном режиме.
Поддерживающая схема для доставки антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17 антитела, такого как секукинумаб) или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17) также может быть рассчитана с использованием информации о ФК (смотри таблицу 9), а не конкретных доз. В случае раскрытых применений, схем и способов (например, способов лечения воспалительного артридита, например, РА, например, пациента с РА высокого риска), специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы поддержания, чтобы обеспечить средний минимальный уровень в стационарном состоянии приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл (например, приблизительно 9,4 мкг/мл, приблизительно 17,3 мкг/мл, приблизительно 31 мкг/мл), с варьированием между пациентами приблизительно до 30% [+ или -] в расчете на среднего человека массой 75 кг (например, 71-79 кг). Альтернативно, специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления схемы поддержания, чтобы обеспечить средний минимальный уровень в стационарном состоянии приблизительно от 8,0 мкг/мл до приблизительно 30,0 мкг/мл (например, приблизительно 8,0 мкг/мл, приблизительно 17 мкг/мл, приблизительно 30 мкг/мл) для среднего человека массой 75 кг. В некоторых вариантах антагонист IL-17 доставляют ежемесячно во время осуществления схемы поддержания, чтобы обеспечить средний минимальный уровень в стационарном состоянии приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл (например, приблизительно 9,4 мкг/мл, приблизительно 17,3 мкг/мл, приблизительно 31 мкг/мл), с варьированием между пациентами приблизительно до 30% [+ или -] в расчете на среднего человека массой 70 кг. В других вариантах антагонист IL-17 доставляют ежемесячно во время осуществления схемы поддержания, чтобы обеспечить средний минимальный уровень в стационарном состоянии приблизительно от 8,0 мкг/мл до приблизительно 30,0 мкг/мл (например, приблизительно 8,0 мкг/мл, приблизительно 17 мкг/мл, приблизительно 30 мкг/мл) в расчете на среднего человека массой 75 кг. Альтернативно, специалист в данной области может доставлять антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) во время осуществления поддерживающей схемы, чтобы обеспечить среднюю AUCtau в стационарном состоянии приблизительно от 314 мг*сутки/л до приблизительно 1323 мг*сутки/л (например, приблизительно от 314 мг*сутки/л до приблизительно 1256 мг*сутки/л, например, приблизительно от 331 мг*сутки/л до приблизительно 1323 мг*сутки/л).
Время дозирования обычно измеряют от дня введения первой дозы секукинумаба (который также известен как «исходный уровень»). Однако разные поставщики медицинских услуг используют разные условные наименования, которые показаны в таблице 3 ниже.
|
А именно, нулевая неделя может быть названа неделей один в некоторых условных наименованиях, и нулевой день может быть назван в случае некоторых условных наименований. Таким образом, возможно, что разные лечащие врачи могут указывать, например, дозу как дозу, вводимую на 3 неделе/в 21 день, на 3 неделе/в 22 день, на 4 неделе/в 21 день, на 4 неделе/в 22 день, и при этом имея в виду одну и ту же схему дозирования. С целью единообразия в используемом в настоящем описании смысле первая неделя дозирования будет называться нулевой неделей, тогда как первый день введения дозы будет называться днем 1. Таким образом, в качестве примера четыре индуцирующих дозы секукинумаба, вводимых еженедельно во время осуществления схемы индукции, могут быть введены во время недели 0 (например, примерно в 1 день), во время недели 1 (например, примерно на 8 день), во время недели 2 (например, примерно на 15 день) и во время недели 3 (например, примерно на 22 день). Индуцирующие дозы можно вводить каждые две недели (т.е., через неделю), например, в время недели 0, во время недели 2, во время недели 4 и т.д. Индуцирующие дозы можно вводить каждые три недели, например, во время недели 0, во время недели 3, во время недели 6 и т.д. Индуцирующие дозы можно вводить ежедневно в течение одной недели, например, в 1-7 дни. Однако необходимо отметить, что такое условное наименование используется только для ясности, и его не следует рассматривать как ограничивающее.
В используемом в настоящем описании смысле фразу «средства для введения» используют, чтобы указать любое доступное средство для системного введения биологического средства, включая без ограничения предварительно заполняемый шприц, флакон и шприц, шприц-ручку, автоинжектор, капельницу и пакет для в/в-введения, насос и т.д. С использованием таких средств пациент может самостоятельно вводить лекарственное средство (т.е., вводить лекарственное средство лично себе) или лекарственное средство может вводить лечащий врач.
Различные аспекты изобретения описаны более подробно в следующих подразделах. Все патенты, заявки на выдачу патентов, справочные документы и другие публикации включены в настоящее описание в виде ссылки в полном объеме.
Антагонисты IL-17
В различных раскрытых фармацевтических композициях, схемах, процессах, применениях, способах и наборах применяют антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент).
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий последовательно расположенные гипервариабельные области CDR1, CDR2 и CDR3, при этом указанная CDR1 имеет аминокислотную последовательность SEQ ID NO: 1 (N-Y-W-M-N), указанная CDR2 имеет аминокислотную последовательность SEQ ID NO: 2 (A-I-N-Q-D-G-S-E-K-Y-Y-V-G-S-V-K-G), и указанная CDR3 имеет аминокислотную последовательность SEQ ID NO: 3 (D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L).
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, один вариабельный домен легкой цепи иммуноглобулина (VL), содержащий последовательно расположенные гипервариабельные области CDR1', CDR2' и CDR3', при этом указанная CDR1' имеет аминокислотную последовательность SEQ ID NO: 4 (R-A-S-Q-S-V-S-S-S-Y-L-A), указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5 (G-A-S-S-R-A-T) и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6 (Q-Q-Y-G-S-S-P-C-T).
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, один вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий последовательно расположенные гипервариабельные области CDR1-x, CDR2-x и CDR3-x, при этом указанная CDR1-x имеет аминокислотную последовательность SEQ ID NO: 11 (G-F-T-F-S-N-Y-W-M-N), указанная CDR2-x имеет аминокислотную последовательность SEQ ID NO: 12 (A-I-N-Q-D-G-S-E-K-Y-Y), и указанная CDR3-x имеет аминокислотную последовательность SEQ ID NO: 13 (C-V-R-D-Y-Y-D-I-L-T-D-Y-Y-I-H-Y-W-Y-F-D-L-W-G).
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, один VH-домен иммуноглобулина и, по меньшей мере, один VL-домен иммуноглобулина, wherein: a) VH-домен иммуноглобулина содержит: i) гипервариабельные области CDR1, CDR2 и CDR3, при этом указанная CDR1 имеет аминокислотную последовательность SEQ ID NO: 1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO: 2, и указанная CDR3 имеет аминокислотную последовательность SEQ ID NO: 3; или ii)гипервариабельные области CDR1-x, CDR2-x и CDR3-x, при этом указанная CDR1-x имеет аминокислотную последовательность SEQ ID NO: 11, указанная CDR2-x имеет аминокислотную последовательность SEQ ID NO: 12, и указанная CDR3-x имеет аминокислотную последовательность SEQ ID NO: 13; и b) VL-домен иммуноглобулина содержит гипервариабельные области CDR1', CDR2' и CDR3', при этом указанная CDR' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6.
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, один VH-домен иммуноглобулина и, по меньшей мере, один VL-домен иммуноглобулина, при этом: a) по меньшей мере, один VH-домен иммуноглобулина содержит последовательно расположенные гипервариабельные области CDR1, CDR2 и CDR3, при этом указанная CDR1 имеет аминокислотную последовательность SEQ ID NO: 1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO: 2, и указанная CDR3 имеет аминокислотную последовательность SEQ ID NO: 3; и b) по меньшей мере, один VL-домен иммуноглобулина содержит последовательно расположенные гипервариабельные области CDR1', CDR2' и CDR3', при этом указанная CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6.
В одном варианте, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит, по меньшей мере, один VH-домен иммуноглобулина и, по меньшей мере, один VL-домен иммуноглобулина, при этом: a) по меньшей мере, один VH-домен иммуноглобулина содержит последовательно расположенные гипервариабельные области CDR1-x, CDR2-x и CDR3-x, при этом указанная CDR1-x имеет аминокислотную последовательность SEQ ID NO: 11, указанная CDR2-x имеет аминокислотную последовательность SEQ ID NO: 12, и указанная CDR3-x имеет аминокислотную последовательность SEQ ID NO: 13: и b) по меньшей мере, один VL-домен иммуноглобулина содержит последовательно расположенные гипервариабельные области CDR1', CDR2' и CDR3', при этом указанная CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6.
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), содержит: a) вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий аминокислотную последовательность, указанную в виде SEQ ID NO: 8; b) вариабельный домен легкой цепи иммуноглобулина (VL), содержащий аминокислотную последовательность, указанную в виде SEQ ID NO: 10; c) VH-домен иммуноглобулина, содержащий аминокислотную последовательность, указанную в виде SEQ ID NO: 8, и VL-домен иммуноглобулина, содержащий аминокислотную последовательность, указанную в виде SEQ ID NO: 10; d) VH-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3; e) VL-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; f) VH-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13; g) VH-домен иммуноглобулина, содержащий гипервариабельные области, указанный в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3, и VL-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; или h) VH-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и VL-домен иммуноглобулина, содержащий гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
Для удобства пользования аминокислотные последовательности гипервариабельных областей моноклональных антител секукинумаба, основанные на определении Кабата, и как определено в рентгеновском анализе и с использованием способа Chothia и соавторов, приведены в таблице 4 ниже.
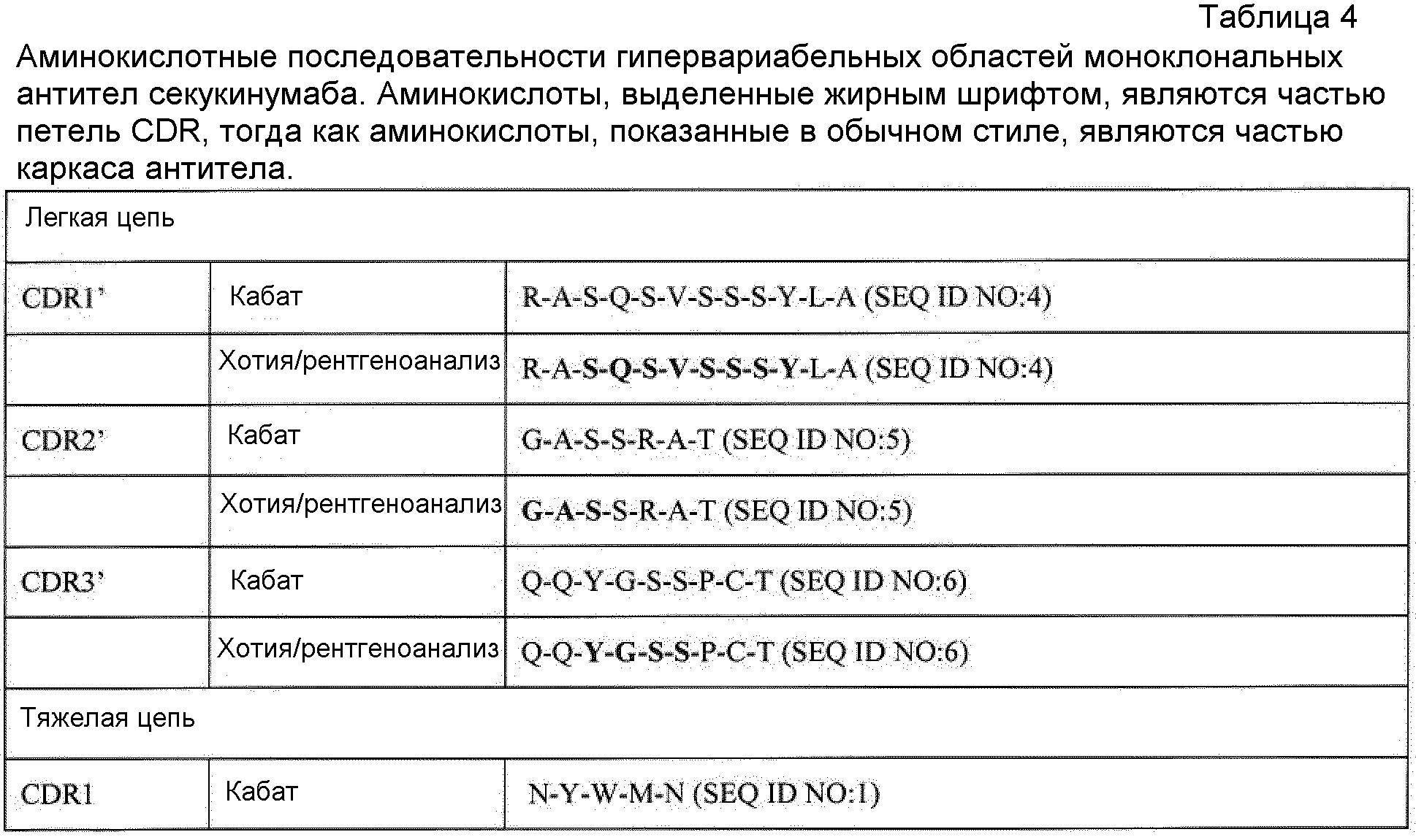

В предпочтительных вариантах вариабельные домены тяжелой и легкой цепей имеют человеческую природу, например, являются вариабельными доменами антитела секукинумаба, которые показаны в SEQ ID NO: 10 (= вариабельный домен легкой цепи, т.е. аминокислоты 1-109 последовательности SEQ ID NO: 10) и SEQ ID NO: 8 (= вариабельный домен тяжелой цепи, т.е. аминокислоты 1-127 последовательности SEQ ID NO: 8). Домены константной области предпочтительно также содержат подходящие домены константной области человека, например домены, описанные в публикации «Sequences of Proteins of Immunological Interest», Kabat E.A. с соавторами, US Department of Health and Human Services, Public Health Service, National Institute of Health.
В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит вариабельный домен легкой цепи SEQ ID NO: 10. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит вариабельный домен тяжелой цепи SEQ ID NO: 8. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит вариабельный домен легкой цепи SEQ ID NO: 10 и вариабельный домен тяжелой цепи SEQ ID NO: 8. В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 10. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 8. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 10 и три CDR последовательности SEQ ID NO: 8. CDR последовательностей SEQ ID NO: 8 и SEQ ID NO: 10 согласно определениям Хотиа и Кабата можно найти в таблице 4.
В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит домен легкой цепи последовательности SEQ ID NO: 15. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит домен тяжелой цепи последовательности SEQ ID NO: 17. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит домен легкой цепи последовательности SEQ ID NO: 15 и домен тяжелой цепи последовательности SEQ ID NO: 17. В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 15. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 17. В других вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) содержит три CDR последовательности SEQ ID NO: 15 и три CDR последовательности SEQ ID NO: 17. CDR последовательностей SEQ ID NO: 15 и SEQ ID NO: 17 согласно определениям Хотиа и Кабата можно найти в таблице 4.
Гипервариабельные области могут быть ассоциированы с любым видом каркасных областей, хотя предпочтительно имеют человеческое происхождение. Подходящие каркасные области описаны Kabat E.A. с соавторами, там же. Предпочтительным каркасом тяжелой цепи является каркас тяжелой цепи человека, например, каркас антитела секукинумаба. Он состоит, например, из расположенных последовательно областей FR1 (аминокислоты 1-30 SEQ ID NO: 8), FR2 (аминокислоты 36-49 SEQ ID NO: 8), FR3 (аминокислоты 67-98 SEQ ID NO: 8) и FR4 (аминокислоты 117-127 SEQ ID NO: 8). В случае рассмотрения определенных в результате рентгеновского анализа гипервариабельных областей секукинумаба другой предпочтительный каркас тяжелой цепи состоит из расположенных последовательно областей FR1-x (аминокислоты 1-25 SEQ ID NO: 8), FR2-x (аминокислоты 36-49 SEQ ID NO: 8), FR3-x (аминокислоты 61-95 SEQ ID NO: 8) и FR4 (аминокислоты 119-127 SEQ ID NO: 8). Подобным образом каркас легкой цепи состоит из расположенных последовательно областей FR1' (аминокислоты 1-23 SEQ ID NO: 10), FR2' (аминокислоты 36-50 SEQ ID NO: 10), FR3' (аминокислоты 58-89 SEQ ID NO: 10) и FR4' (аминокислоты 99-109 SEQ ID NO: 10).
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, 1L-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) выбран из анти-IL-17-антитела человека, которое содержит, по меньшей мере: a) тяжелую цепь иммуноглобулина или ее фрагмент, который содержит вариабельный домен, содержащий последовательно расположенные гипервариабельные области CDR1, CDR2 и CDR3 и константную часть или ее фрагмент тяжелой цепи человека; при этом указанная CDR1 имеет аминокислотную последовательность SEQ ID NO: 1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO: 2, и указанная CDR3 имеет аминокислотную последовательность SEQ ID NO: 3; и b) легкую цепь иммуноглобулина или ее фрагмент, который содержит вариабельный домен, содержащий последовательно расположенные гипервариабельные области CDR1', CDR2' и CDR3' и константную часть или ее фрагмент легкой цепи человека, при этом указанная CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6.
В одном варианте антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) выбран из одноцепочечной связывающей молекулы, которая содержит антигенсвязывающий участок, содержащий: a) первый домен, который содержит последовательно расположенные гипервариабельные области CDR1, CDR2 и CDR3, при этом указанная CDR1 имеет аминокислотную последовательность SEQ ID NO: 1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO: 2, и указанная CDR3 имеет аминокислотную последовательность SEQ ID NO: 3; и b) второй домен, который содержит гипервариабельные области CDR1', CDR2' и CDR3', при этом указанна CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, и указанная CDR3' имеет аминокислотную последовательность SEQ ID NO: 6; и c) пептидный линкер, который связан либо с N-концом первого домена и с C-концом второго домена, либо с C-концом первого домена и с N-концом второго домена.
Альтернативно, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) может содержать, по меньшей мере, один антигенсвязывающий участок, содержащий, по меньшей мере, один вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно: a) гипервариабельные области CDR1 (SEQ ID NO: 1), CDR2 (SEQ ID NO: 2) и CDR3 (SEQ ID NO: 3); или b) гипервариабельные области CDR1i, CDR2i, CDR3i, при этом указанная гипервариабельная область CDR1i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR1, которая показана в SEQ ID NO: 1, указанная гипервариабельная область CDR2i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR2, которая показана в SEQ ID NO: 2; и указанная гипервариабельная область CDR3i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR3, которая показана в SEQ ID NO: 3; и указанная молекула, связывающая IL-17, способна ингибировать активность приблизительно 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше или более предпочтительно приблизительно 1 нМ или меньше указанной молекулы на 50%, при этом указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека.
Подобным образом, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) может содержать, по меньшей мере, один антигенсвязывающий участок, содержащий, по меньшей мере, один вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно: a) гипервариабельные области CDR1-x (SEQ ID NO: 11), CDR2-x (SEQ ID NO: 12) и CDR3-x (SEQ ID NO: 13); или b) гипервариабельные области CDR1i-x, CDR2i-x, CDR3i-x, при этом указанная гипервариабельная область CDR1i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR1-x, которая показана в SEQ ID NO: 11, указанная гипервариабельная область CDR2i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR2-x, которая показана в SEQ ID NO: 12; и указанная гипервариабельная область CDR3i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR3-x, которая показана в SEQ ID NO: 13; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше или более предпочтительно приблизительно 1 нМ или меньше указанной молекулы на 50%, при этом указанная ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека.
Подобным образом, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) может содержать, по меньшей мере one, один антигенсвязывающий участок, содержащий, по меньшей мере, один вариабельный домен легкой цепи иммуноглобулина (VL). который содержит последовательно: a) гипервариабельные области CDR'1 (SEQ ID NO: 4), CDR'2 (SEQ ID NO: 5) и CDR'3 (SEQ ID NO: 6); или b) гипервариабельные области CDR1'i, CDR2'i, CDR3'i, при этом указанная гипервариабельная область CDR'1i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'1, которая показана в SEQ ID NO: 4, указанная гипервариабельная область CDR'2i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'2, которая показана в SEQ ID NO: 5; и указанная гипервариабельная область CDR'3i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'3, которая показана в SEQ ID NO: 6; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше или более предпочтительно приблизительно 1 нМ или меньше указанной молекулы на 50%, при этом указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека.
Альтернативно, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) может содержать вариабельные домены как тяжелой (VH), так и легкой цепи (VL), и указанная молекула, связывающая IL-17, имеет, по меньшей мере, один антигенсвязывающий участок, содержащий: a) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные области CDR1 (SEQ ID NO: 1), CDR2 (SEQ ID NO: 2) и CDR3 (SEQ ID NO: 3); и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные области CDR1' (SEQ ID NO: 4), CDR2' (SEQ ID NO: 5) и CDR3' (SEQ ID NO: 6); или b) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные области CDR1i, CDR2i и CDR3i, при этом указанная гипервариабельная область CDR1i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR1, которая показана в SEQ ID NO: 1, указанная гипервариабельная область CDR2i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR2, которая показана в SEQ ID NO: 2; и указанная гипервариабельная область CDR3i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR3, которая показана в SEQ ID NO: 3; и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные области CDR1'i, CDR2'I, CDR3'i, при этом указанная гипервариабельная область CDR'1i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'1, которая показана в SEQ ID NO: 4, указанная гипервариабельная область CDR'2i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'2, которая показана в SEQ ID NO: 5; и указанная гипервариабельная область CDR'3i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'3, которая показана в SEQ ID NO: 6; и указанная молекула, связывающая IL-17, способна ингибировать активность 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше или более предпочтительно приблизительно 3 нМ или меньше указанной молекулы на 50%, при этом указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека.
Альтернативно, антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17 антитело или его антигенсвязывающий фрагмент, например, секукинумаб) может содержать вариабельные домены как тяжелой (VH), так и легкой цепи (VL), и указанная молекула, связывающая IL-17, содержит, по меньшей мере, один антигенсвязывающий участок, содержащий: a) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные области CDR1-x (SEQ ID NO: 11), CDR2-x (SEQ ID NO: 12) и CDR3-x (SEQ ID NO: 13); и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные области CDR1' (SEQ ID NO: 4), CDR2' (SEQ ID NO: 5) и CDR3' (SEQ ID NO:6); или b) вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательно расположенные гипервариабельные области CDR1i-x, CDR2i-x и CDR3i-x, при этом указанные гипервариабельные области CDR1i-x, CDR2i-x, CDR3i-x: указанная гипервариабельная область CDR1i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR1-x, которая показана в SEQ ID NO: 11, указанная гипервариабельная область CDR2i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR2-x, которая показана в SEQ ID NO: 12; и указанная гипервариабельная область CDR3i-x отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR3-x, которая показана в SEQ ID NO: 13; и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательно расположенные гипервариабельные области CDR1'i, CDR2'i, CDR3'i, при этом указанная гипервариабельная область CDR'1i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'1, которая показана в SEQ ID NO: 4, указанная гипервариабельная область CDR'2i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'2, которая показана в SEQ ID NO: 5; и указанная гипервариабельная область CDR'3i отличается 3, предпочтительно 2, более предпочтительно 1 аминокислотой от гипервариабельной области CDR'3, которая показана в SEQ ID NO: 6; и указанная молекулы, связывающая IL-17, способна ингибировать активность 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше или более предпочтительно приблизительно 1 нМ или меньше указанной молекулы на 50%, при этом указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека.
IL-17-антитело человека, раскрытое в настоящем описании, может содержать тяжелую цепь, которая по существу идентична тяжелой цепи, указанной в виде SEQ ID NO: 17, и легкую цепь, которая по существу идентична легкой цепи, указанной в виде SEQ ID NO: 15. IL-17-антитело человека, раскрытое в настоящем описании, может содержать тяжелую цепь, которая содержит последовательность SEQ ID NO: 17, и легкую цепь, которая содержит последовательность SEQ ID NO: 15.
Человеческое IL-17-антитело, раскрытое в настоящем описании, может содержать: a) одну тяжелую цепь, которая содержит вариабельный домен, имеющий аминокислотную последовательность, по существу идентичную последовательности, показанной в SEQ ID NO: 8, и константную часть тяжелой цепи человека; и b) одну легкую цепь, которая содержит вариабельный домен, имеющий аминокислотную, по существу идентичную последовательности, показанной в SEQ ID NO: 10, и константную часть легкой цепи человека.
Ингибирование связывания IL-17 с его рецептором можно обычным образом тестировать в различных анализах, включая такие анализы, которые описаны в WO 2006/013107. Под термином « в такой же степени»» подразумевают, что талонная и производная молекулы проявляют, на основе статистических расчетов, по существу идентичную ингибирующую IL-17 активность в одном из анализов, указанных в настоящем описании (смотри пример 1 в WO 2006/013107). Например, молекулы, связывающие IL-17, раскрытые в настоящем описании, обычно имеют IC50 для ингибирования IL-17 человека в отношении продукции IL-6, индуцированной IL-17 человека в фибробластах кожи человека, которая меньше, чем приблизительно 10 нМ, более предпочтительно приблизительно 9, 8, 7, 6, 5, 4, 3, 2 или приблизительно 1 нМ, предпочтительно по существу такая же, как IC50 соответствующей эталонной молекулы при анализе, который описан в примере 1 в WO 2006/013107. Альтернативно, используемым анализом может быть анализ конкурентного ингибирования связывания IL-17 растворимыми рецепторами IL-17 (например, конструкциями IL-17R/Fc человека согласно примеру 1 WO 2006/013107) и молекулами, связывающими IL-17 согласно изобретению.
Изобретение также относится к антагонистам IL-17, например, молекулам, связывающим IL-17 (например, IL-17-антителу или его антигенсвязывающему фрагменту, например, секукинумабу), в которых один или несколько аминокислотных остатков CDR1, CDR2, CDR3, CDR1-x, CDR2-x, CDR3-X, CDR1', CDR2' или CDR3' или каркасов, обычно только несколько (например, 1-4), изменены; например, в результате мутации, например, посредством сайт-специфичного мутагенеза соответствующих последовательностей ДНК. Изобретение включает ДНК-последовательности, кодирующие такие измененные молекулы, связывающие IL-17. В частности, изобретение включает молекулы, связывающие IL-17, в которых один или несколько остатков CDR1' или CDR2' были изменены по сравнению с остатками, показанными в SEQ ID NO: 4 (в случае CDR1') и SEQ ID NO: 5 (в случае CDR2').
Изобретение также относится к антагонистам IL-17, например, молекулам, связывающим IL-17 (например, IL-17-антителу или его антигенсвязывающему фрагменту, например, секукинумабу), которые обладают специфичностью связывания по отношению к IL-17 человека, в частности, к IL-17-антителам, способным ингибировать связывание IL-17 с его рецептором, и IL-17-антителам, способным ингибировать активность 1 нМ (= 30 нг/мл) IL-17 человека в концентрации приблизительно 50 нМ или меньше, приблизительно 20 нМ или меньше, приблизительно 10 нМ или меньше, приблизительно 5 нМ или меньше, приблизительно 2 нМ или меньше, или более предпочтительно приблизительно 1 нМ или меньше указанной молекулы на 50% (при этом указанную ингибирующую активность измеряют по продукции IL-6, индуцированной hu-IL-17 в фибробластах кожи человека).
Изобретение относится к способам лечения РА, включающим в себя введение терапевтически эффективного количества антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) субъекту, страдающему от РА, например, пациенту с РА высокого риска. В некоторых вариантах IL-17-антитело, например, секукинумаб, связывается с эпитопом зрелого IL-17 человека, содержащим Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129. В некоторых вариантах IL-17-антитело, например, секукинумаб, связывается с эпитопом зрелого IL-17 человека, содержащим Tyr43, Tyr44, Arg46, Ala79, Asp80. В некоторых вариантах IL-17-антитело, например, секукинумаб, связывается с эпитопом гомодимера IL-17, имеющим две цепи зрелого IL-17 человека, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи. Схема нумерации остатков, используемая для определения таких эпитопов основана на использовании остатка один, являющегося первой аминокислотой зрелого белка (т.е., IL-17A, в котором отсутствует состоящий из 23 аминокислот N-концевой сигнальный пептид и который начинается с глицина). Последовательность незрелого IL-17A указана в Swiss-Prot, доступ Q16552.
В некоторых вариантах IL-17-антитело имеет KD приблизительно 100-200 пМ. В некоторых вариантах IL-17-антитело имеет IC50 приблизительно 0,4 нМ для нейтрализации in vitro биологической активности приблизительно 0,67 нМ IL-17A человека. В некоторых вариантах абсолютная биодоступность подкожно (п/к) вводимого IL-17-антитела имеет диапазон приблизительно от 60 до приблизительно 80%, например, приблизительно 76%. В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекула, связывающая рецептор IL-17 (например, антитело к рецептору IL-17) имеет время полуэлиминации приблизительно 4 недели (например, приблизительно от 23 до приблизительно 30 суток, например, приблизительно 30 суток). В некоторых вариантах антагонист IL-17, например, молекула, связывающая IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекула, связывающая рецептор IL-17 (например, антитело к рецептору IL-17) имеет Tmax приблизительно 7-8 суток.
В некоторых вариантах раскрытых способов, применений, фармацевтических композиций, наборов, анализов и схем лечения антагонист IL-17 выбран из группы, состоящей из: a) молекулы, связывающей IL-17, или молекулы, связывающей рецептор IL-17; b) секукинумаба; c) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His 129; d) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Tyr43, Tyr44, Arg46, Ala79, Asp80; e) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющего две цепи зрелого белка IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи; f) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющего две цепи зрелого белка IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи, при этом молекула, связывающая IL-17, имеет KD приблизительно 100-200 пМ, и при этом молекула, связывающая IL-17, имеет авремя полужизни in vivo, составляющее приблизительно 4 недели; и g) IL-17-антитела, которое включает антитело, выбранное из группы, состоящей из: i) вариабельного домена тяжелой цепи иммуноглобулина (VH), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8; ii) вариабельного домена легкой цепи иммуноглобулина (VL), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iii) домена VH иммуноглобулина, содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8, и домена VL иммуноглобулина, содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iv) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3; v) домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; vi) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13; vii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2, и SEQ ID NO: 3 и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; и viii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
Особенно предпочтительными антагонистами IL-17, например, молекулами, связывающими IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекулами, связывающими рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) для применения в раскрытых способах, применениях, наборах и т.д. являются антитела человека, особенно секукинумаб, который описан в примерах 1 и 2 в WO 2006/013107. Секукинумаб (AIN457) является рекомбинантным высоко аффинным полностью человеческим моноклональным антителом против интерлейкина-17A человека (IL-17A, IL-17) изотипа IgG1/каппа. Секукинумаб (смотри, например, WO 2006/013107 и WO 2007/117749) имеет очень высокую аффинность по отношению к IL-17, т.е. KD приблизительно 100-200 пМ и IC50 для нейтрализации in vitro биологической активности приблизительно 0,67 нМ IL-17A человека приблизительно 0,4 нМ. Таким образом, секукинумаб ингибирует антиген в молярном соотношении приблизительно 1:1. Такая высокая аффинность связывания делает антитело секукинумаб особенно подходящим для терапевтических применений. Кроме того, было определено, что секукинумаб имеет очень длительное время полужизни, т.е., приблизительно 4 недели, что обеспечивает возможность использования более длительных периодов между введениями, исключительно важное свойство при лечении хронических длительных расстройств, таких как ревматоидный артрит (РА).
Схемы лечения, способы лечения, фармацевтические композиции и применения
Раскрытые антагонисты 1L-17, например, молекулы, связывающие IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или Молекулы, связывающие рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) применимы для лечения, профилактики или ослабления воспалительного артрита (например, ревматоидного артрита (РА), спондилоартропатии, анкилозирующего спондилита и псориатического артрита). Таким образом, такие молекулы применимы для индукции изменений признаков и симптомов артрита и структурных изменений, предотвращения дальнейшего разрушения суставов, улучшения структуры суставов и т.д. В некоторых вариантах пациентом, имеющим воспалительный артрит, является пациент с РА, например, пациент с РА высокого риска.
Антагонисты IL-17, например, молекулы, связывающие IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулы, связывающие рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) можно применять in vitro, ex vivo или включенными в фармацевтические композиции и вводимыми индивидуумам (например, людям) in vivo для лечения, ослабления или профилактики РА, например, у пациентов с РА высокого риска. Фармацевтическая композиция должна быть приготовлена так, чтобы она была совместима с предполагаемым путем введения (например, пероральные композиции обычно содержат инертный разбавитель или съедобный носитель). Другие не ограничивающие примеры путей введения включают парентеральное (например, внутривенное), интрадермальное, подкожное, пероральное (например, в результате проглатывания), трансдермальное (местное), трансмукозальное и ректальное введение. Фармацевтические композиции, совместимые с каждым из предполагаемых путей, хорошо известны в данной области.
Антагонисты IL-17, например, молекулы, связывающие IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекулы, связывающие рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) можно применять в виде фармацевтической композиции в сочетании с фармацевтически приемлемым носителем. Такая композиция может содержать кроме носителей антагониста IL-17 (например, секукинумаба) различные разбавители, наполнители, соли, буферы, стабилизаторы, солюбилизаторы и другие вещества, хорошо известные в данной области. Характеристики носителя будут зависеть от пути введения.
Фармацевтические композиции для применения в раскрытых способах также могут содержать дополнительные терапевтические средства для лечения конкретного целевого расстройства. Например, фармацевтическая композиция также может содержать противовоспалительные средства. Такие дополнительные факторы и/или средства могут быть включены в фармацевтическую композицию для получения синергетического эффекта, вызываемого вместе с антагонистом IL-17 (например, секукинумабом), или для минимизации побочных эффектов, вызываемых молекулами, связывающими IL-17.
Фармацевтическая композиция согласно изобретению может быть в форме липосомы, в которой антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) объединяют в дополнение к другим фармацевтически приемлемым носителям с амфипатическими средствами, такими как липиды, которые существуют в агрегированной форме в виде мицелл, нерастворимых монослоев, жидких кристаллов или ламеллярные слои в водном растворе. Подходящие липиды для образования липосом включают без ограничения моноглицериды, диглицериды, сульфатиды, лизолецитин, фосфолипиды, сапонин, желчные кислоты и т.д.
При практическом осуществлении способов лечения, схем, применений и т.д. согласно настоящему изобретению терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) вводят субъекту, например, млекопитающему (например, человеку). Антагонист IL-17 (например, секукинумаб) можно вводить способом согласно изобретению либо отдельно, либо в сочетании с другими средствами терапии, таком как, например, сочетание с дополнительными средствами терапии воспаления. При совместном введении с одним или несколькими средствами антагонист IL-17 (например, секукинумаб) можно вводить либо одновременно с другим средством, либо последовательно. В случае последовательного введения лечащий врач будет принимать решение о подходящей последовательности введения антагониста IL-17 (например, секукинумаба) в сочетании с другими средствами.
Когда терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) вводят перорально, связывающее средство будет в форме таблетки, капсулы, порошка, раствора или эликсира. При введении в форме таблетки фармацевтическая композиция согласно изобретению дополнительно может содержать твердый носитель, такой как желатин или адъювант. При введении в жидкой форме может быть добавлен жидкий носитель, такой как вода, керосин, масла животного или растительного происхождения, такие как арахисовое масло (необходимо соблюдать осторожность в отношении аллергии на арахис), минеральное масло, соевое масло или кунжутное масло или синтетические масла. Жидкая форма фармацевтической композиции может дополнительно содержать такие компоненты, как физиологический раствор соли, раствор декстрозы или других сахаридов или гликоли, такие как этиленгликоль, пропиленгликоль или полиэтиленгликоль.
Когда терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) вводят посредством внутривенной, кожной или подкожной инъекции, молекула, связывающая IL-17, может быть в форме апирогенного парентерально приемлемого раствора. Фармацевтическая композиция для внутривенной, кожной или подкожной инъекции может содержать в дополнение к антагонисту IL-17 (например, секукинумабу) изотонический наполнитель, такой как хлорид натрия, раствор Рингера, декстрозы, декстрозы и хлорида натрия, лактированный раствор Рингера или другие наполнители, которые известны в данной области.
Фармацевтические композиции для применения в раскрытых способах могут быть получены обычным способом. В одном варианте фармацевтическая композиция предпочтительно представлена в лиофилизированной форме. Для немедленного введения ее растворяют в подходящем водном носителе, например, стерильной воде для инъекции или стерильном забуференном физиологическом растворе соли. Если считается желательным получение раствора в большем объеме для введения посредством инфузии, а не с помощью болюсной инъекции, то может быть полезным введение сывороточного альбумина человека или собственной гепаринизированной крови пациента в физиологический раствор во время приготовления. Присутствие избытка такого физиологически инертного белка предотвращает потерю антитела за счет адсорбции на стенках емкости и трубок, используемых в случае применения раствора для инфузии. Если используют альбумин, то подходящая концентрация составляет от 0,5 до 4,5% масс. от физиологического раствора соли. Другие препараты включают жидкие или лиофилизированные препараты.
Подходящая доза, конечно, будет варьировать в зависимости, например, от конкретного применяемого антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента), хозяина, способа введения и природы и тяжести состояния, подвергаемого лечению, и от характера предыдущего лечения, которому был подвергнут пациент. В конечном итоге лечащий медицинский работник будет решать вопрос о количестве антагониста IL-17 (например, секукинумаба), с использованием которого следует лечить каждого отдельного субъекта. В некоторых вариантах лечащий медицинский работник может вводить низкие дозы молекулы, связывающей IL-17, и наблюдать ответ субъекта. В других вариантах начальная доза (дозы) антагониста IL-17 (например, секукинумаба), вводимого субъекту, является высокой, и затем титруют, уменьшая дозу вплоть до появления признаком рецидива. Более высокие дозы антагониста IL-17 (например, секукинумаба) можно вводить вплоть до получения оптимального для субъекта терапевтического эффекта, и в этой точке дозу обычно больше не увеличивают.
Антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб) или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) обычно вводят парентерально, внутривенно, например, в локтевую или другую периферическую вену, внутримышечно или подкожно. Продолжительность внутривенной (в/в) терапии с использованием фармацевтической композиции согласно настоящему изобретению будет варьировать в зависимости от тяжести заболевания, подвергаемого лечению, и состояния и персонального ответа каждого отдельного пациента. Также предполагается подкожная (п/к) терапия с использованием фармацевтической композиции согласно настоящему изобретению. Медицинский работник будет решать вопрос о продолжительности в/в- или п/к-терапии и времени проведения терапии с использованием фармацевтической композиции согласно настоящему изобретению.
Показано, что удовлетворительные результаты (лечение, профилактики, задержка появления симптомов) обычно получают в дозах приблизительно от 0,05 мг до приблизительно 30 мг на килограмм массы тела, чаще приблизительно от 0,1 мг до приблизительно 20 мг на килограмм массы тела. Частота дозирования может быть в диапазоне приблизительно от одного раза в сутки до приблизительно одного раза каждые три месяца, например, в диапазоне приблизительно от одного раза каждые 2 недели до приблизительно одного раза каждые 12 недель, например, один раз каждые четыре-восемь недель. Частота дозирования будет зависеть наряду с прочим от фазы схемы лечения.
Применение антител в качестве активного ингредиента фармацевтических препаратов в настоящее время широко распространено, включая продукты HerceptinTM (трастузумаб), RITUXANTM (ритуксимаб), SYNAGISTM (паливизумаб) и т.д. Способы очистки антител до фармацевтической чистоты хорошо известны в данной области. Антитела, например, антитела к IL-17, обычно готовят либо в водной форме, готовой для парентерального введения, либо в виде лиофилизатов для перерастворения подходящим разбавителем перед введением. В некоторых вариантах раскрытых способов и применений антагонист IL-17, например, IL-17-антитело, например, секукинумаб, готовят в виде лиофилизата. Подходящие лиофилизированные препараты могут быть перерастворены в небольшом объеме жидкости (например, 2 мл или меньше), чтобы обеспечить подкожное введение, и могут давать растворы с низкими уровнями агрегации антител. Композиция, как правило, будет стерильной, по меньшей мере, во время ее приготовления. Композиция, как правило, будет апирогенной, например, содержащей <1 EU (единицы эндотоксина, стандартной меры) на дозу, и предпочтительно <0,1 EU на дозу. Композиция предпочтительно не содержит глютена. В препаратах, раскрытых в настоящем описании, антитела предпочтительно составляют, по меньшей мере, 80% масс. (например, по меньшей мере, 90%, 95%, 97%, 98%, 99% или больше) от общего белка в препарате. Таким образом, антитело находится в очищенной форме.
Лиофилизаты
Способы лиофилизации антител хорошо известны в данной области, например, смотри Rey and May (2004) Freeze-Drying/Lyophilization of Pharmaceutical and Biological Products ISBN 0824748689, WO 92/15331, заявку на выдачу патента США 2008/0286280, WO 03/041637, WO 2008/116103, WO 2008/029908, WO 2007/074880, WO 03/009817 и WO 98/022136. Например, продукты антител SYNAGISTM, REMICADETM, RAPTIVATM, SIMULECTTM, XOLAIRTM и HERCEPTINTM поставляют в виде лиофилизатов. Такие антитела перерастворяют до разных конечных концентраций, например, SIMULECTTM перерастворяют до концентрации 4 мг/мл антитела, REMICADETM перерастворяют до концентрации 10 мг/мл. HERCEPTINTM до 21 мг/мл, SINAGISTM и RAPTIVATM до 100 мг/мл и XOLAIRTM до 125 мг/мл.
Лиофилизаты согласно изобретению можно перерастворять, получая водные композиции с концентрацией анти-IL-17-антитела, составляющей, по меньшей мере, приблизительно 15 мг/мл. Концентрация антитела может быть намного выше, чем приблизительно 15 мг/мл, например, > приблизительно 15 мг/мл, > приблизительно 20 мг/мл, > приблизительно 25 мг/мл, > приблизительно 50 мг/мл, > приблизительно 75 мг/мл, > приблизительно 100 мг/мл, > приблизительно 125 мг/мл, > приблизительно 150 мг/мл, > приблизительно 300 мг/мл или выше.
Лиофилизат может содержать кроме анти-IL-17-антитела дополнительные компоненты, такие как один или несколько из следующих компонентов: (i) сахар; (ii) буферное средство; (iii) поверхностно-активное вещество; и (iv) стабилизатор. Включение каждого из дополнительных компонентов (i), (ii) и (iii) является обычным и может приводить к получению композиции с низкой агрегацией анти-IL-17-антитела. Включение компонента (iv) является полезным, так как было показано, что он дополнительно уменьшает агрегацию после хранения.
В случае присутствия компоненты (i)-(iv) должны быть перед лиофилизацией в концентрации, достаточной для поддержания анти-IL-17-антитела в форме, которая является активной и растворимой после хранения (в нормальных условиях) и перерастворения. Компоненты также будут присутствовать после перерастворения.
Подходящие сахара для применения согласно изобретению включают без ограничения моносахариды, дисахариды и трисахариды. Например, сахаром может быть сахароза, трегалоза, раффиноза, мальтоза, сорбит или маннит. Сахаром может быть сахарный спирт или аминосахар. Особенно применимы сахароза и трегалоза (например, в концентрации приблизительно от 175 мМ до приблизительно 300 мМ, например, приблизительно 175 мМ, приблизительно 180 мМ, приблизительно 185 мМ, приблизительно 190 мМ, приблизительно 195 мМ, приблизительно 200 мМ, приблизительно 225 мМ, приблизительно 250 мМ, приблизительно 275 мМ, приблизительно 300 мМ).
Подходящие буферные средства для применения в изобретении включают без ограничения гистидиновый буфер, цитратный буфер, фосфатный буфер, сукцинатный буфер, ацетатный буфер или трис-буфер. Особенно применим гистидиновый буфер (например, в концентрации приблизительно от 5 мМ до приблизительно 50 мМ, например, приблизительно 5 мМ, приблизительно 10 мМ, приблизительно 15 мМ, приблизительно 20 мМ, приблизительно 25 мМ, приблизительно 30 мМ, приблизительно 35 мМ, приблизительно 40 мМ, приблизительно 45 мМ, приблизительно 50 мМ).
Подходящие поверхностно-активные вещества для применения в изобретении включают без ограничения неионогенные поверхностно-активные вещества, ионогенные поверхностно-активные вещества и цвиттерионные поверхностно-активные вещества. Типичные поверхностно-активные вещества для применения в изобретении включают без ограничения сложные эфира жирных кислот и сорбитана (например, монокаприлат сорбитана, монолаурат сорбитана, монопальмитат сорбитана), триолеат сорбитана, сложные эфиры глицерина и жирных кислот (например, монокаприлат глицерина, мономиристат глицерина, моностеарат глицерина), сложные эфиры полиглицерина и жирных кислот (например, декаглицерилмоностеарат, декаглицерилдистеарат, декаглицерилмонолинолеат), сложные эфира полиоксиэтиленсорбитана и жирных кислот (например, монолаурат полиоксиэтиленсорбитана, моноолеат полиоксиэтиленсорбитана, моностеарат полиоксиэтиленсорбитана, монопальмитат полиоксиэтиленсорбитана, триолеат полиоксиэтиленсорбитана, тристеарат полиоксиэтиленсорбитана), сложные эфиры полиоксиэтиленсорбита (например, тетрастеарат полиоксиэтиленсорбита, тетраолеат полиоксиэтиленсорбита), сложные эфира полиоксиэтиленглицерина и жирных кислот (например, моностеарат полиоксиэтиленгдицерина), сложные эфиры полиэтиленгликоля и жирных кислот (например, дистеарат полиэтиленгликоля), полиоксиэтиленалкиловые эфиры (например, полиоксиэтиленлауриловый эфир), полиоксиэтилен-полиоксипропиленалкиловые эфиры (например, полиоксиэтилен-полиоксипропиленгликоль, полиоксиэтилен-полиоксипропиленпропиловый эфир, полиоксиэтилен-полиоксипропиленцетиловый эфир), полиоксиэтиленалкилфениловый эфиры (например, полиоксиэтиленнонилфениловый эфир), полиоксиэтиленовые производные гидрогенизированного касторового масла (например, полиоксиэтилен-касторовое масло, полиоксиэтилен-гидрогенизированное касторовое масло), полиоксиэтиленовые производные пчелиного воска (например, полиоксиэтиленсорбит пчелиного воска), полиоксиэтиленовые производные ланолина (например, полиоксиэтиленланолин) и полиоксиэтиленовые производные амидов жирных кислот (например, полиоксиэтиленовое производное амида стеариновой кислоты); C10-C18-алкилсульфаты (например, цетилсульфат натрия, лаурилсульфат натрия, олеилсульфат натрия), сульфат полиоксиэтилен-C10-C18-алкиловых простых эфиров со средним числом молей добавляемых единиц этиленоксида от 2 до 4 (например, полиоксиэтиленлаурилсульфат натрия) и соли C1-C18-алкилсульфосукцинатного сложного эфира (например, натриевая соль лаурилсульфосукцинатного эфира); и природные поверхностно-активные вещества, такие как лецитин, глицерофосфолипид, сфингофосфолипиды (например, сфингомиелин), и сложные эфиры сахарозы и C12-C18-жирных кислот. Композиция может содержать один или несколько из таких поверхностно-активных веществ. Предпочтительными поверхностно-активными веществами являются сложные эфиры полиоксиэтиленсорбитана и жирных кислот, например, полисорбат 20, 40, 60 или 80. Особенно применимым является полисорбат 80 (твин 80) (например, в концентрации приблизительно от 0,01% до приблизительно 0,1%, например, приблизительно 0,02%, приблизительно 0,04%, приблизительно 0,06%, приблизительно 0,08%, приблизительно 0,1%).
Лиофилизат может содержать кроме антитела активные ингредиенты. Например, могут быть включены дополнительные фармакологические средства, такие как химиотерапевтические соединения. Например, может быть включен метотрексат, и известно включение метотрексата натрия в лиофилизаты.
Значение pH в водном препарате антитела перед лиофилизацией может быть в диапазоне 4,0-8,0, и типичным является значение pH в диапазоне приблизительно от 5,5 до приблизительно 7,4, например, приблизительно 5,5, приблизительно 5,6, приблизительно 5,7, приблизительно 5,8, приблизительно 5,9, приблизительно 6, приблизительно 6,2, приблизительно 6,4, приблизительно 6,6, приблизительно 6,7, приблизительно 6,8, приблизительно 6,9, приблизительно 7,0, приблизительно 7,1, приблизительно 7,2, приблизительно 7,3, приблизительно 7,4.
Раскрыты лиофилизаты антител, содержащие приблизительно 25 мг, 50 мг, 75 мг, 150 мг или 300 мг анти-IL-17-антитела, предпочтительно 75 мг-150 мг (например, 75 мг или 150 мг) анти-IL-17-антитела. Также раскрыты лиофилизаты, содержащие: IL-17-антитело, например, секукинумаб; сахар; буферное средство и поверхностно-активное вещество. Композиция также может содержать стабилизатор.
Также раскрыты способы получения лиофилизата, включающие в себя стадии: (i) получения водного раствора, содержащего IL-17-антитело, например, секукинумаб, сахар, буферное средство, поверхностно-активное вещество и необязательно стабилизатор; и (ii) лиофилизации водного раствора.
Перерастворенные композиции
Перед тем как лиофилизат может быть введен пациенту, его необходимо перерастворить в жидком средстве для перерастворения (например, в водном растворе), чтобы получить жидкую композицию (далее «перерастворенная композиция»).
Лиофилизаты можно перерастворять в разных объемах (например, 0,25 мл, 0,5 мл, 1,0 мл, 1,5 мл и т.д.) средства для перерастворения (например, водного средства, например, воды). Указанная стадия позволяет снова растворять антитело и другие компоненты лиофилизата с получением раствора, подходящего для инъекции пациенту. Объем водного средства, используемого для перерастворения, определяет концентрацию антитела в получаемой фармацевтической композиции и также может определять путь введения. При перерастворении с использованием объема средства для перерастворения меньшего, чем объем перед лиофилизацией, получают композицию, которая является более концентрированной, чем перед лиофилизацией. Как указано выше, лиофилизаты согласно изобретению можно перерастворять, получая водные композиции с концентрацией анти-IL-17-антитела, составляющей, по меньшей мере, приблизительно 75 мг/мл (или выше), и соответственно необходимо выбирать объем средства для перерастворения.
В настоящем описании раскрыты перерастворенные композиции, содержащие анти-IL-17 антитело, при этом перерастворенная композиция имеет концентрацию антитела, по меньшей мере, приблизительно 25 мг/мл, 50 мг/мл, 75 мг/мл, 150 мг/мл или 300 мг/мл, предпочтительно 75 мг/мл-150 мг/мл (например, 75 мг/мл или 150 мг/мл). В идеальном варианте объем перерастворенной композиции меньше, например, 0,25-2,0 мл, чтобы облегчить подкожное введение антагониста IL-17.
Типичные средства для перерастворения лиофилизированных антител содержат стерильную воду или буфер, необязательно содержащие консервант. Если лиофилизат содержит буферное средство, то средство для перерастворенная может содержать дополнительное буферное средство (которое может быть таким же или может отличаться от буферного средства в лиофилизате) или вместо этого оно может не содержать буферного средства (например, WFI, физиологический раствор). Средство для перерастворения может содержать фармакологические средства, такие как химиотерапевтические средства, сто способствует их совместной доставке с антителом.
В случае присутствия компоненты (i)-(iv), указанные выше, будут в концентрации, достаточной для поддержания анти-IL-17-антитела в активной растворимой форме после перерастворения в нормальных условиях хранения при сохранении фармацевтической приемлемости в момент применения.
В дополнение к антителу и воде перерастворенные композиции могут содержать дополнительные компоненты, полученные из лиофилизата и/или средства для перерастворения. Такие компоненты включают без ограничения буферы, соли, стабилизаторы, глицерин, спирты, консерванты, поверхностно-активные вещества и т.д. Подробное обсуждение таких фармацевтических ингредиентов имеется в публикации Gennaro (2000) Remington: The Science and Practice of Pharmacy, 20th edition, ISBN: 0683306472.
Раскрыты перерастворенные фармацевтические композиции, содержащие: IL-17-антитело, например, секукинумаб; сахар; буферное средство и поверхностно-активное вещество. Композиция также может содержать стабилизатор. Также раскрыты способы получения перерастворенной композиции, включающие в себя смешивание лиофилизата с водным средством для перерастворения, при этом лиофилизат содержит IL-17-антитело, например, секукинумаб, сахар, буферное средство, поверхностно-активное вещество и необязательно стабилизатор.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя введение терапевтически эффективного количество антагониста IL-17 пациенту с РА высокого риска.
В настоящем описании также раскрыты способы лечения ревматоидного артрита (РА), включающие в себя: a) отбор пациента для лечения на основе того, что пациент является пациентом с РА высокого риска: и b) введение пациенту терапевтически эффективного количества антагониста IL-17.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя: a) анализ образца от пациента в отношении: i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA), или и РФ и ACPA; и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) или и СРБ и СОЭ; и b) затем введение пациенту антагониста IL-17, если пациент является РФ+, ACPA+ или одновременно и РФ+ и ACPA+ и пациент имеет высокий уровень СРБ, высокую СОЭ, или и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя введение терапевтически эффективного количества антагониста IL-17 пациенту, при условии, что пациент выбран для лечения на основе того, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA +; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах стадия введения включает в себя: a) введение пациенту антагониста IL-17 во время осуществления схемы индукции; и b) затем введение пациенту антагониста IL-17 во время осуществления схемы поддержания.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя: a) введение пациенту с РА высокого риска три дозы приблизительно по 10 мг/кг антагониста IL-17, при этом каждую из трех доз доставляют через неделю; и b) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 каждый месяц, начиная с первого месяца после доставки третьей внутривенной дозы.
В настоящем описании раскрыты терапевтические схемы лечения ревматоидного артрита (РА), включающие в себя: a) отбор пациента, имеющего РА, на основе следующих критериев: i) пациент является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) пациент имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ; и b) введение пациенту трех доз приблизительно по 10 мг/кг антагониста IL-17, при этом первую дозу доставляют в нулевую неделю, вторую дозу доставляют на второй неделе и третью дозу доставляют на четвертой неделе; и c) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели.
В настоящем описании раскрыты IL-17-антагонисты для применения при лечении ревматоидного артрита (РА), отличающиеся тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска. В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающиеся тем, что антагонист IL-17 следует вводить пациенту, выбранному для лечения на основе того, что пациент является пациентом с РА высокого риска.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении пациента с РА высокого риска. В некоторых вариантах пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+), или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ) или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах высокий уровень СРБ ≥ 10 мг/л на основании измерения с использованием вчСРБ. В некоторых вариантах высокая СОЭ составляет ≥ 28 мм/час.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающиеся тем, что антагонист IL-17 следует вводить пациенту, при условии, что пациент выбран для лечения на основе того, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA +; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающиеся тем, что антагонист IL-17 следует: a) вводить пациенту с РА высокого риска в виде трех доз приблизительно по 10 мг/кг, при этом каждую из трех доз доставляют через неделю; и b) затем вводить пациенту в дозе приблизительно от 75 мг до приблизительно 150 мг каждый месяц, начиная с первого месяца после доставки третьей внутривенной дозы.
В настоящем описании раскрыты антагонисты IL-17 для применения при лечении ревматоидного артрита (РА), отличающиеся тем, что: a) образец от пациент анализируют в отношении: i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA) или одновременно и РФ и ACPA; и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ), или одновременно и СРБ и СОЭ; и b) антагонист IL-17 вводят пациенту, если пациент является РФ+, ACPA+ или одновременно и РФ+ и ACPA+, и пациент имеет высокий уровень СРБ, высокую СОЭ, или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты применения антагониста IL-17 для производства лекарственного средства для лечения РА, отличающиеся тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска.
В настоящем описании раскрыты применения антагониста IL-17 для производства лекарственного средства для лечения РА, отличающиеся тем, что антагонист IL-17 следует вводить пациенту с РА высокого риска во время осуществления схемы индукции с последующей поддерживающей схемой.
В настоящем описании раскрыта фармацевтическая композиция для лечения РА, содержащая в качестве активного ингредиента антагонист IL-17, при этом антагонист IL-17 следует вводить пациенту с РА высокого риска.
В настоящем описании раскрыта фармацевтическая композиция для лечения РА, содержащая в качестве активного ингредиента антагонист IL-17, при этом антагонист IL-17 следует вводить пациенту с РА высокого риска во время осуществления схемы индукции с последующим осуществлением поддерживающей схемы.
В настоящем описании раскрыты терапевтические схемы лечения РА, содержащие: a) отбор пациента с РА высокого риска; b) введение приблизительно 10 мг/кг антагониста IL-17 пациенту в 0, 2 и 4 неделю; и c) затем введение приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 пациенту ежемесячно, начиная с 8 недели.
В настоящем описании раскрыты способы лечения пациента с РА или пациента с РА высокого риска, включающим в себя: a) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в таком введении, во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 360 мкг/мл; и b) затем введение молекулы, связывающей IL-17, пациенту во время осуществления схемы поддержания, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 8 мкг/мл до приблизительно 30 мкг/мл; и/или ii) среднюю AUCtau в стационарном состоянии приблизительно от 331 мг*сутки/л до приблизительно 1323 мг*сутки/л.
В настоящем описании раскрыты молекулы, связывающие IL-17, для применения при лечении пациента с РА или пациента с РА высокого риска, отличающиеся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 360 мкг/мл; и b) затем следует вводить пациенту во время осуществления схемы поддержания, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 8 мкг/мл до приблизительно 30 мкг/мл; и/или ii) среднюю AUCtau в стационарном состоянии приблизительно от 331 мг*сутки/л до приблизительно 1323 мг*сутки/л.
В настоящем описании раскрыты способы лечения пациента с РА высокого риска, включающие в себя: a) введение молекулы, связывающей IL-17, пациенту, нуждающемуся в таком введении, во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 401 мкг/мл; и b) затем введение молекулы, связывающей IL-17, пациенту во время осуществления схемы поддержания, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл; и/или ii) среднюю AUCtau в стационарном состоянии приблизительно от 314 мг*сутки/л до приблизительно 1256 мг*сутки/л.
В настоящем описании раскрыта молекула, связывающая IL-17, для применения при лечении псориаза, отличающаяся тем, что молекулу, связывающую IL-17: a) следует вводить пациенту во время осуществления схемы индукции, что обеспечивает среднюю максимальную концентрацию в плазме (Cmax) молекулы, связывающей IL-17, приблизительно 401 мкг/мл; и b) затем следует вводить пациенту во время осуществления схемы поддержания, что обеспечивает: i) средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 9,4 мкг/мл до приблизительно 31 мкг/мл; и/или ii) среднюю AUCtau в стационарном состоянии приблизительно от 314 мг*сутки/л до приблизительно 1256 мг*сутки/л.
В некоторых вариантах поддерживающая схема обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 9,4 мкг/мл до приблизительно 17,3 мкг/мл. В некоторых вариантах поддержание обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно 9,4 мкг/мл или приблизительно 17,3 мкг/мл. В некоторых вариантах схема индукции включает в себя внутривенное введение молекулы, связывающей IL-17, через неделю. В некоторых вариантах поддерживающая схема включает в себя ежемесячное подкожное введение молекулы, связывающей IL-17.
В настоящем описании раскрыты антагонисты IL-17 в препарате лекарственного средства для лечения РА, при условии, что пациент выбран для лечения на основе того, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения пациента с РА, характеризуемого тем, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят так, чтобы оно содержало емкости, при этом каждая емкость имела достаточное количество антагониста IL-17, чтобы обеспечить доставку, по меньшей мере, приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения пациента с РА, характеризуемого тем, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят так, чтобы оно содержало емкости, при этом каждая емкость имела достаточное количество антагониста IL-17, чтобы обеспечить доставку, по меньшей мере, приблизительно 10 мг/кг на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения РА у пациента, характеризуемого тем, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA +; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят в дозе, обеспечивающей возможность внутривенной доставки приблизительно 10 мг/кг на стандартную дозу.
В настоящем описании раскрыты антагонисты IL-17 для производства лекарственного средства для лечения пациента с РА, характеризуемого тем, что он: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ, при этом лекарственное средство готовят в дозе, обеспечивающей возможность подкожной доставки приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 на стандартную дозу.
В настоящем описании раскрыты способы тестирования in vitro для отбора пациента для лечения РА, включающие в себя определение того: i) является ли пациент РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) имеет ли пациент высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах раскрытых способов тестирования in vitro у пациента наблюдают улучшенный терапевтический ответ на следующую схему: a) введение пациенту трех доз приблизительно по 10 мг/кг антагониста IL-17, при этом первую дозу доставляют в нулевую неделю, вторую дозу доставляют во время второй недели, и третью дозу доставляют во время четвертой недели; и a) затем введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+), или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ) или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах высокий уровень СРБ ≥ 10 мг/л, судя по измерения с использованием вчСРБ. В некоторых вариантах высокая СОЭ ≥ 28 мм/час.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем, стадия введения включает в себя внутривенное введение трех доз приблизительно по 10 мг/кг антагониста IL-17 указанному пациенту, при этом каждую из указанных доз вводят через неделю. В некоторых вариантах стадия введения включает в себя подкожное введение доз, составляющих приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 указанному пациенту, при этом каждую из указанных доз вводят ежемесячно. В некоторых вариантах стадия введения включает в себя: a) введение антагониста IL-17 пациенту с РА высокого риска во время осуществления схемы индукции; и b) затем введение антагониста IL-17 пациенту во время осуществления схемы поддержания.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем схема индукции включает в себя введение пациенту трех доз приблизительно по 10 мг/кг антагониста IL-17. В некоторых вариантах первую дозу приблизительно 10 мг/кг доставляют во время нулевой недели, вторую дозу приблизительно 10 мг/кг доставляют во время второй недели, и третью дозу приблизительно 10 мг/кг доставляют во время четвертой недели.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем поддерживающая схема включает в себя введение пациенту приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно 75 мг или приблизительно 150 мг антагониста IL-17 ежемесячно, начиная с восьмой недели.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем перед введением антагониста IL-17 пациент получал предшествующее лечение РА, включающее в себя введение, по меньшей мере, одного противоревматического средства, выбранного из группы, состоящей из иммунодепрессанта, модифицирующего заболевание противоревматического лекарственного средства (DMARD), обезболивающего лекарственного средства, стероида, нестероидного противовоспалительного лекарственного средства (НПВС), антагониста цитокина, анаболическое средство для роста костей, средства против резорбции костей и их сочетания. В некоторых вариантах перед введением антагониста IL-17 у пациента наблюдался неадекватный ответ, неспособность отвечать или непереносимость лечения с использованием DMARD, антагониста TNF-альфа или метотрексата.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем пациенту дополнительно вводят терапевтически эффективное количество, по меньшей мере, одного противоревматического средства, выбранного из группы, состоящей из иммунодепрессанта, DMARD, обезболивающего лекарственного средства, стероида, НПВС, антагониста цитокина, анаболического средства для роста костей, средства против резорбции костей и их сочетаний.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем антагонист IL-17 вводят в виде трех доз приблизительно по 10 мг/кг, при этом каждую из указанных доз вводят через неделю. В некоторых вариантах антагонист IL-17 вводят в дозах приблизительно от 75 мг до приблизительно 300 мг, при этом каждую из указанных доз вводят ежемесячно.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем антагонист IL-17 следует вводить пациенту во время осуществления схемы индукции, и затем вводить пациенту во время осуществления схемы поддержания. В некоторых вариантах схема индукции включает в себя введение пациенту трех доз приблизительно по 10 мг/кг антагониста IL-17. В некоторых вариантах первую дозу приблизительно 10 мг/кг доставляют во время нулевой недели, вторую дозу приблизительно 10 мг/кг доставляют во время второй недели, и третью дозу приблизительно 10 мг/кг доставляют во время четвертой недели.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем поддерживающая схема включает в себя введение пациенту приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно от 75 мг до приблизительно 150 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с восьмой недели. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно 75 мг или приблизительно 150 мг антагониста IL-17 ежемесячно, начиная с восьмой недели.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+) или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ) или одновременно и высокий уровень СРБ и высокую СОЭ.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем схема индукции поддерживает минимальный уровень молекулы, связывающей IL-17, выше 80 мкг/мл в течение 10-недельного периода. В некоторых вариантах поддерживающая схема обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно от 8 мкг/мл до приблизительно 17 мкг/мл. В некоторых вариантах поддержание обеспечивает средний минимальный уровень в стационарном состоянии молекулы, связывающей IL-17, приблизительно 8 мкг/мл или приблизительно 17 мкг/мл.
В некоторых вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем антагонистом IL-17 является молекула, связывающая IL-17, или молекула, связывающая рецептор IL-17. В некоторых вариантах молекула, связывающая IL-17, или молекула, связывающая рецептор IL-17, представляет собой молекулу, связывающую IL-17 (например, IL-17-антитело) выбранную из группы, состоящей из: a) секукинумаба; b) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129; c) IL-17-антитела, которое связывается с эпитопом IL-17, содержащим Tyr43, Tyr44, Arg46, Ala79, Asp80; d) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющим две цепи зрелого белка IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи; e) IL-17-антитела, которое связывается с эпитопом гомодимера IL-17, имеющим две цепи зрелого белка IL-17, при этом указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 в одной цепи и Tyr43, Tyr44, Arg46, Ala79, Asp80 в другой цепи, при этом молекула, связывающая IL-17, имеет KD приблизительно 100-200 пМ, и при этом молекула, связывающая IL-17, имеет время полужизни in vivo приблизительно 4 недели; и f) IL-17-антитела, которое включает антитело, выбранное из группы, состоящей из: i) вариабельного домена тяжелой цепи иммуноглобулина (VH), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8; ii) вариабельного домена легкой цепи иммуноглобулина (VL), содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iii) домена VH иммуноглобулина, содержащего аминокислотную последовательность, указанную в виде SEQ ID NO: 8, и домена VL иммуноглобулина, содержащий аминокислотную последовательность, указанную в виде SEQ ID NO: 10; iv) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3; v) домена VL иммуноглобулина, содержащего гипервариабельные области, указанный в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; vi) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13; vii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 1, SEQ ID NO: 2 и SEQ ID NO: 3 и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6; и viii) домена VH иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13, и домена VL иммуноглобулина, содержащего гипервариабельные области, указанные в виде SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6.
В предпочтительных вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем, молекула, связывающая IL-17, представляет собой антитело человека. В еще более предпочтительных вариантах раскрытых способов, наборов, применений, фармацевтических композиций и схем, молекулой, связывающей IL-17, является секукинумаб.
В используемом в настоящем описании смысле фраза «емкость, содержащая достаточное количество антагониста IL-17, чтобы обеспечить возможность доставки [указанной дозы]» используют для обозначения того, что в данную емкость (например, флакон, шприц-ручку, шприц) был помещен определенный объем антагониста IL-17 (например, в виде части фармацевтической композиции), который можно использовать для получения требуемой дозы. В качестве примера, если требуемая доза составляет 75 мг, то врач может использовать 2 мл из емкости, которая содержит препарат IL-17-антитела в концентрации 37,5 мг/мл, 1 мл из емкости, которая содержит препарат IL-17-антитела в концентрации 75 мг/мл, 0,5 мл из емкости, которая содержит препарат IL-17-антитела в концентрации 150 мг/мл и т.д. В каждом таком случае такие емкости содержит достаточное количество антагониста IL-17, чтобы обеспечить возможность доставки требуемой дозы 75 мг.
В используемом в настоящем описании смысле фраза «приготовленный в дозе, обеспечивающей возможность [путь введения] доставку [указанной дозы]», используют для указания того, что данная фармацевтическая композиция может быть использована для обеспечения требуемой дозы антагониста IL-17, например, IL-17-антитела, например, секукинумаба, требуемым путем введения (например, п/к или в/в). В качестве примера, если требуемая подкожная доза составляет 75 мг, то врач может использовать 2 мл препарата IL-17-антитела, имеющего концентрацию 37,5 мг/мл, 1 мл препарата IL-17-антитела, имеющего концентрацию 75 мг/мл, 0,5 мл препарата IL-17-антитела, имеющего концентрацию 150 мг/мл и т.д. В каждом таком случае такие препараты IL-17-антител имеют достаточно высокую концентрацию, чтобы обеспечить возможность подкожной доставки IL-17-антитела. Подкожная доставка обычно требует доставки объемом меньше чем приблизительно 2 мл, предпочтительно объема, составляющего приблизительно 1 мл или меньше.
В некоторых вариантах схема индукции включает в себя введение 1, 2, 3, 4, 5, 6 или больше в/в-доз антагониста IL-17 (например, секукинумаба), например, секукинумаба, предпочтительно одной, двух или трех (наиболее предпочтительно трех) доз секукинумаба, доставляемых каждую неделю, через неделю, каждые три недели или каждые четыре недели (ежемесячно). В некоторых вариантах схема индукции включает в себя введение 10 мг/кг в/в антагониста IL-17 (например, секукинумаба), например, секукинумаба.
В некоторых вариантах индуцирующие дозы антагониста IL-17 (например, секукинумаба) можно вводить в виде трех в/в-инфузий (например, 10 мг/кг) через неделю, т.е., во время нулевой недели (например, в 1 день), во время второй недели (например, приблизительно на 15 день) и во время четвертой недели (например, приблизительно на 29 день). В некоторых вариантах индуцирующие дозы можно вводить в виде трех в/в-инфузий (например, 10 мг/кг) каждые три недели, т.е., во время нулевой недели (например, приблизительно в 1 день), во время третьей недели (например, приблизительно на 22 день) и во время шестой недели (например, приблизительно на 43 день). В некоторых вариантах индуцирующие дозы можно вводить в виде трех в/в-инфузий (например, 10 мг/кг) каждые четыре недели (ежемесячно), т.е., во время нулевой недели (например, приблизительно в 1 день), во время четвертой недели (например, приблизительно на 29 день) и во время восьмой недели (например, приблизительно на 57 день).
В некоторых вариантах индуцирующие дозы антагониста IL-17 (например, секукинумаба) можно вводить в виде двух в/в-инфузий (например, 10 мг/кг) через неделю, т.е., во время нулевой недели (приблизительно в 1 день) и во время второй недели (например, приблизительно на 15 день). В некоторых вариантах индуцирующие дозы можно вводить в виде двух в/в-инфузий (например, 10 мг/кг) каждые три недели, т.е., во время нулевой недели (например, приблизительно в 1 день) и во время третьей недели (например, приблизительно на 22 день). В некоторых вариантах индуцирующие дозы можно вводить в виде двух в/в-инфузий (например, 10 мг/кг) каждые четыре недели (ежемесячно), т.е., во время нулевой недели (например, приблизительно в 1 день) и во время четвертой недели (например, приблизительно на 29 день).
В некоторых вариантах индуцирующие дозы антагониста IL-17 (например, секукинумаба) можно вводить в виде одной инфузии высокой дозы, например, 30 мг/кг.
В следующих вариантах схема индукции включает в себя введение 1, 2, 3, 4, 5, 6 или больше ежедневных или еженедельных п/к-доз антагониста IL-17 (например, секукинумаба), предпочтительно от трех до пяти (например, четырех) еженедельных доз секукинумаба. В некоторых вариантах индуцирующая доза, которую можно вводить ежедневно или еженедельно, составляет приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17 (например, секукинумаба), доставляемого п/к (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг).
В некоторых вариантах схема индукции включает в себя введение ежедневно п/к-доз антагониста IL-17 (например, секукинумаба), например, ежедневных п/к-доз секукинумаба (например, приблизительно от 75 мг до приблизительно 300 мг, например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг), доставляемого в 1-7 дни. В некоторых вариантах схема индукции включает в себя введение еженедельно п/к-доз антагониста IL-17 (например, секукинумаба), например, еженедельных п/к-доз секукинумаба, доставляемых во время нулевой, первой, второй и третьей недели.
В других вариантах доза (дозы) секукинумаба, вводимые субъекту, могут быть выше и более частыми (т.е., еженедельно в первый месяц лечения) во время осуществления схемы индукции и затем пациента можно поддерживать, используя более низкую дозу.
В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно 75 мг или приблизительно 150 мг молекулы, связывающей IL-17, если масса пациента составляет менее 90 кг. В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно 150 мг или приблизительно 300 мг молекулы, связывающей IL-17, если масса пациента больше или равна 90 кг.
В случае поддерживающей схемы дозу антагониста IL-17 (например, секукинумаба) можно вводить дважды в месяц (т.е., каждые две недели, дважды в месяц или через неделю, т.е., приблизительно каждые 14 дней), каждый месяц (т.е., каждые 4 недели, т.е., приблизительно каждые 28 дней), каждые два месяца (т.е., через месяц или каждые 8 недель, т.е., приблизительно каждые 56 дней) или каждые три месяца (т.е., каждые 12 недель, т.е., приблизительно каждые 84 дня). В используемом в настоящем описании смысле дату первой дозы в поддерживающей схеме следует определять от последней дозы в схеме индукции. Таким образом, в качестве примера, если последнюю дозу в схеме индукции вводят во время четвертой недели, то первую дозу в качестве части поддерживающей схемы, осуществляемой с частотой введения два раз в месяц, можно доставлять во время шестой недели (приблизительно на 43 день), первую дозу в качестве поддерживающей схемы на основе ежемесячного введения можно доставлять во время восьмой недели (приблизительно на 57 день), первую дозу в виде части поддерживающей схемы на основе введения раз в два месяца можно доставлять во время двенадцатой недели (приблизительно на 85 день), первую дозу в виде части поддерживающей схемы на основе введения каждые три месяца можно доставлять во время шестнадцатой недели (приблизительно 113 дней) и т.д. В некоторых вариантах первую дозу поддерживающей схемы доставляют каждый месяц (ежемесячно, приблизительно каждые четыре недели), начиная с первого месяца (т.е., приблизительно четыре недели) после доставки последней индуцирующей дозы (например, п/к- или в/в-индуцирующей дозы). В некоторых вариантах первую дозу поддерживающей схема доставляют каждый месяц (ежемесячно, приблизительно каждые четыре недели), начиная с момента через месяц (т.е., приблизительно четыре недели) после доставки третьей индуцирующей в/в-дозы.
В некоторых вариантах поддерживающая схема включает в себя введение антагониста IL-17 (например, секукинумаба), например, приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг), доставляемого два раза в месяц, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах антагонист IL-17 (например, секукинумаб) доставляют п/к во время осуществления поддерживающей схемы. В предпочтительном варианте поддерживающую дозу доставляют ежемесячно. В некоторых вариантах первую поддерживающую дозу доставляют во время шестой недели (например, приблизительно на 43 день), седьмой недели (например, приблизительно на 50 день), восьмой недели (например, приблизительно на 57 день), девятой недели (например, приблизительно на 64 день), десятой недели (например, приблизительно на 71 день), одиннадцатой недели (например, приблизительно на 78 день), двенадцатой недели (например, приблизительно на 85 день) или тринадцатой недели (например, приблизительно на 92 день) схемы лечения и затем ежемесячно (например, приблизительно каждые 4 недели или приблизительно каждые 28 дней). В некоторых вариантах поддерживающая схема включает в себя подкожное введение пациенту приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17 (например, секукинумаба) дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца, начиная с четвертой, пятой, шестой, седьмой, восьмой, девятой, десятой, одиннадцатой или двенадцатой недели, предпочтительно с восьмой недели.
Предпочтительные схемы для лечения пациентов с РА (например, пациентов с РА высокого риска) и пациентов, имеющих другой воспалительный артрит, например, спондилоартропатию, анкилозирующий спондилит (АС) и псориатический артрит (ПсА) приведены в таблице 5:
|
Будет понятно, что доза необязательно должна быть дана в точный момент времени, например, доза, назначенная на 29 день, может быть дана, например, на 24-34 день.
В некоторых вариантах доза антагониста IL-17 (например, секукинумаба), используемая в раскрытых схемах индукции и/или поддерживающих схемах (в зависимости от конкретного случая) основана на массе пациента (например, тот факт, имеет ли пациент массу ниже или выше 75 кг, 80 кг, 85 кг, 90 кг, 95 кг, 100 кг, 105 кг и т.д., можно использовать для определения дозы антагониста IL-17, например, секукинумаба, для доставки пациенту). В одном варианте пациенту вводят приблизительно 75 мг или приблизительно 150 мг (например, доставляемых п/к), если масса пациента меньше или равна приблизительно 80 кг. В одном варианте пациенту вводят приблизительно 75 мг или приблизительно 150 мг (например, доставляемых п/к), если масса пациента меньше или равна приблизительно 90 кг. В одном варианте пациенту вводят приблизительно 75 мг или приблизительно 150 мг (например, доставляемых п/к), если масса пациента меньше или равна приблизительно 100 кг. В другом варианте пациенту вводят приблизительно 150 мг или приблизительно 300 мг (например, доставляемых п/к), если масса пациента больше чем приблизительно 80 кг. В другом варианте пациенту вводят приблизительно 150 мг или приблизительно 300 мг (например, доставляемых п/к), если масса пациента больше чем приблизительно 90 кг. В другом варианте пациенту вводят приблизительно 150 мг или приблизительно 300 мг (например, доставляемых п/к), если масса пациента больше чем приблизительно 100 кг.
Будет понятно, что может требоваться повышение дозы (например, в фазе индукции и/или поддержания) для некоторых пациентов, например, пациентов, у которых наблюдают неадекватный ответ на лечение антагонистом IL-17 (например, секукинумабом). Таким образом, п/к-дозы антагониста IL-17 (например, секукинумаба) могут быть больше чем приблизительно от 75 мг до приблизительно 300 мг п/к, например, приблизительно 80 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 175 мг, приблизительно 200 мг, приблизительно 250 мг, приблизительно 350 мг, приблизительно 400 мг, и т.д.; подобным образом, в/в-дозы могут быть больше чем приблизительно 10 мг/кг, например, приблизительно 11 мг/кг, 12 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг и т.д. Также будет понятно, что также может требоваться уменьшение дозы (например, в фазе индукции и/или поддержания) для некоторых пациентов, например, пациентов, у которых наблюдают неблагоприятные явления или неблагоприятный ответ на лечение антагонистом IL-17 (например, секукинумабом). Таким образом, дозы антагониста IL-17 (например, секукинумаба) могут быть меньше, чем приблизительно от 75 мг до приблизительно 300 мг п/к, например, приблизительно 25 мг, приблизительно 50 мг, приблизительно 80 мг, приблизительно 100 мг, приблизительно 125 мг, приблизительно 175 мг, приблизительно 200 мг, 250 мг и т.д.; подобным образом, в/в-дозы могут быть меньше чем приблизительно 10 мг/кг, например, приблизительно 9 мг/кг, 8 мг/кг, 5 мг/кг, 4 мг/кг, 3 мг/кг, 2 мг/кг, 1 мг/кг и т.д.
В некоторых вариантах указанных выше способов, применений, фармацевтических композиций, наборов и схем лечения уровень СРБ ≥ приблизительно 3 мг/л (например, 3 мг/л), ≥ приблизительно 5 мг/л (например, 5 мг/л), ≥ приблизительно 10 мг/л (например, 10 мг/л), ≥ приблизительно 15 мг/л (например, 15 мг/л) считают высоким уровнем СРБ. В некоторых вариантах уровень СРБ ≥ 200 нмоль/л или ≥ 240 нмоль/л считают высоким уровнем СРБ. В предпочтительном варианте уровень СРБ выше или равен (≥) приблизительно 10 мг/л (например, 10 мг/л), например, судя по измерениям в анализе СРБ высокой чувствительности, считают высоким уровнем СРБ. В некоторых вариантах высокий уровень СРБ > приблизительно 10 мг/л, > приблизительно 20 мг/л или > приблизительно 30 мг/л.
В некоторых вариантах указанных выше способов, применений, фармацевтических композиций, наборов и схем лечения «высокая СОЭ» может быть определена на основе следующего правила: нормальная максимальная СОЭ (мм/час)≤(возраст (годы)+10 (в случае женского пола))/2. В результате «высокая СОЭ» > (возраст (годы)+10 (в случае женского пола))/2. В некоторых вариантах «высокая СОЭ» может быть определена на основе следующего правила: нормальная максимальная СОЭ (мм/час)≤(возраст (годы)+5 (в случае женского пола))/2. В результате «высокая СОЭ» > (возраст (годы)+5 (в случае женского пола))/2. В некоторых вариантах СОЭ of ≥20 мм/час является высокой СОЭ для женщин. В некоторых вариантах СОЭ≥15 мм/час является высокой СОЭ для мужчин. В предпочтительном варианте СОЭ больше или равная (≥) 28 мм/час является высокой СОЭ.
В некоторых вариантах указанных выше способов, применений, фармацевтических композиций, наборов и схем лечения, пациент является РФ+, если значение РФ пациента выше 20 МЕ/мл или выше 30 МЕ/мл. В некоторых вариантах пациент является РФ+, если значение РФ пациента выше 40 единиц/мл или выше 60 единиц/мл при измерении в тесте на основе нефелометрии. В некоторых вариантах пациент является РФ+, если титр РФ пациентов выше чем 1:20 или выше чем 1:80 при измерении в тесте на основе разведения. В предпочтительном варианте пациент является РФ+, если значение РФ пациента больше или равно (≥) 12 кЕд./л (килоединиц/литр), например, при измерении с помощью нефелометрии.
В некоторых вариантах указанных выше способов, применений, фармацевтических композиций, наборов и схем лечения пациент является ACPA+, если значение ACPA пациента больше 1 единицы/мл, больше 3 единиц/мл или больше 5 единиц/мл, например, при определении в тесте ELISA с использованием анти-CCP. В предпочтительном варианте пациент является ACPA+, если значение ACPA пациента больше 20 единиц/мл (20 единиц).
В настоящем описании также раскрыты способы лечения ревматоидного артрита (РА), включающие в себя: a) введение (например, подкожное введение) пациенту с РА высокого риска четырех или пяти доз приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающий фрагмента), при этом каждую из четырех или пяти доз доставляют еженедельно; и b) затем введение приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17 (например, секукинумаба) пациенту дважды в месяц, каждый месяц, каждые два месяца или каждые три месяца.
В настоящем описании также раскрыты терапевтические схемы лечения РА, включающие в себя: a) отбор пациента, имеющего ревматоидный артрит на основе следующих критериев: i) пациент является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) пациент имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ; и b) введение (например, подкожное введение) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба) или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) пациенту еженедельно в течение четырех или пяти недель; и c) затем введение (например, подкожное введение) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) молекулы, связывающей IL-17, пациенту дважды в месяц, каждый месяц, каждые два месяца или каждые три месяца.
В настоящем описании раскрыты способы лечения ревматоидного артрита (РА), включающие в себя введение терапевтически эффективного количества антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) пациенту с РА, у которого наблюдают повышенные исходные уровни СРБ (например, выше чем приблизительно 10 мг/л, выше чем приблизительно 20 мг/л, выше чем приблизительно 30 мг/л).
В настоящем описании также раскрыты терапевтические схемы лечения РА, включающие в себя: a) отбор пациента, имеющего ревматоидный артрит на основе следующих критериев: i) пациент имеет повышенные исходные уровни СРБ (например, выше чем приблизительно 10 мг/л, выше чем приблизительно 20 мг/л, выше чем приблизительно 30 мг/л); и b) либо i) введение (например, подкожное введение) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) пациенту еженедельно в количестве четырех или пяти доз, либо ii) введение (например, в/в-введение) приблизительно 10 мг/кг антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) пациенту через неделю в количестве трех доз; и c) затем введение (например, подкожное введение) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17 (например, секукинумаба) пациенту дважды в месяц, каждый месяц, каждые два месяца или каждые три месяца, предпочтительно ежемесячно.
В настоящем описании также предлагаются способы лечения воспалительного артрита, включающие в себя схему индукции, например, введение (например, внутривенное введение) двух или трех индуцирующих доз приблизительно по 10 мг/кг антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) (предпочтительно три индуцирующих дозы) пациенту, имеющему артрит, при этом артрит выбран из группы, состоящей из ревматоидного артрита (РА), спондилоартропатии, анкилозирующего спондилита (АС) и псориатического артрита (ПсА). В некоторых вариантах первую дозу доставляют во время нулевой недели, вторую дозу доставляют во время второй недели и третью дозу доставляют во время четвертой недели. В некоторых вариантах первую дозу доставляют во время нулевой недели, вторую дозу доставляют во время недели три и третью дозу доставляют во время шестой недели. В некоторых вариантах способ дополнительно включает в себя поддерживающую схему, например, введение (например, подкожное введение) приблизительно от 75 мг до приблизительно 300 мг (например, приблизительно от 75 мг до приблизительно 150 мг, например, приблизительно 75 мг или приблизительно 150 мг) антагониста IL-17 (например, секукинумаба) пациенту, при этом молекулу, связывающую IL-17, вводят пациенту дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца. В некоторых вариантах пациент является пациентом с РА высокого риска, например, серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+) или одновременно и РФ+ и ACPA+; и имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ) или одновременно и высокий уровень СРБ и высокую СОЭ). В некоторых вариантах высокий уровень СРБ ≥ 10 мг/дл. В некоторых вариантах высокая СОЭ ≥ 28 мм/час. В следующих вариантах воспалительный артрит выбран из ревматоидного артрита (РА), спондилоартропатии, анкилозирующего спондилита и псориатического артрита. В некоторых вариантах пациент имеет РА. В следующих вариантах пациент с РА является пациентом с РА высокого риска. В следующих вариантах пациент с РА высокого риска: a) является серопозитивным в отношении ревматоидного фактора (РФ+), антитела против цитруллинированного белка (ACPA+) или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень C-реактивного белка (СРБ), высокую скорость оседания эритроцитов (СОЭ) или одновременно и высокий уровень СРБ и высокую СОЭ.
В некоторых вариантах антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент) применяют в сочетании с метотрексатом для лечения взрослых пациентов с активным ревматоидным артритом от умеренной до тяжелой степени, у которых имел место неадекватный ответ на терапию одним или несколькими антагонистами TNF. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют отдельно или в сочетании с метотрексатом или другими модифицирующими заболевание противоревматическими лекарственными средствами (DMARD), чтобы уменьшить признаки и симптомы (например, опухание, ограниченное движение), индуцировать основной клинический ответ, ингибировать прогрессирование структурного повреждения и улучшить функциональный статус взрослых пациентов с активным заболеванием от умеренной до тяжелой степени. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют отдельно или в сочетании с метотрексатом, чтобы уменьшить признаки и симптомы, индуцировать основной клинический ответ, ингибировать прогрессирование структурного повреждения и улучшить функциональный статус пациентов с активным ревматоидным артритом (РА) от умеренной до тяжелой степе ни. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют в сочетании с метотрексатом для уменьшения признаков и симптомов, ингибирования прогрессирования структурного повреждения и улучшения функционального статуса пациентов с активным ревматоидным артритом от умеренной до тяжелой степени. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют для лечения взрослых с активным ревматоидным артритом (РА) от умеренной до тяжелой степени. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют для лечения активного ревматоидного артрита (РА) от умеренной до тяжелой степени у взрослых в сочетании с метотрексат. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют для уменьшения признаков и симптомов и замедления прогрессирования структурного повреждения при активном ревматоидном артрите от умеренной до тяжелой степени у пациентов, у которых было неудачным лечение 1 или несколькими модифицирующими заболевание противоревматическими средствами (DMARD). В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют в виде монотерапии или одновременно с модифицирующими заболевание противоревматическими средствами (DMARD) для уменьшения признаков и симптомов, индукции основного клинического ответа, ингибирования прогрессирования структурного повреждения и улучшения функционального статуса у взрослых пациентов с активным ревматоидным артритом от умеренной до тяжелой степени. В некоторых вариантах антагонист IL-17 (например, секукинумаб) применяют отдельно или в сочетании с метотрексатом или другими DMARD для лечения взрослых пациентов с активным ревматоидным артритом от умеренной до тяжелой степени, у которых имел место неадекватный ответ на терапию одним или несколькими антагонистами TNF.
Комбинированная терапия для лечения артрита
При практическом осуществлении способов лечения или применений согласно настоящему изобретению терапевтически эффективное количество антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) вводят субъекту, например, млекопитающему (например, человеку). Антагонист, связывающий IL-17 (например, секукинумаб) можно вводить способом согласно изобретению либо отдельно, либо в сочетании с другими средствами и способами терапии для лечения РА, например, в сочетании, по меньшей мере, с одним противоревматическим средством, таким как иммунодепрессант, модифицирующее заболевание противоревматическое лекарственное средство (DMARD), обезболивающее лекарственное средство, стероид, нестероидное противовоспалительное лекарственное средство (НПВС), антагонист цитокина, анаболическое средство для роста костей, средство против резорбции костей и их сочетания (например, двойная и тройная терапия). При совместном введении с один или несколькими дополнительными средствами антагонист IL-17 (например, секукинумаб) можно вводить либо одновременно с другим средством, либо последовательно. При последовательном введении лечащий врач будет решать вопрос о подходящей последовательности введения антагониста IL-17 (например, секукинумаба) в сочетании с другими средствами.
Нестероидные противовоспалительные лекарственные средства и обезболивающие средства, применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают производное пропионовой кислоты, производное уксусной кислоты, производные эноловой кислоты, производные фенамовой кислоты, ингибиторы ЦОГ, например, лумиракоксиб, ибупрофен, фенопрофен, кетопрофен, флурбипрофен, оксапрозин, индометацин, сулиндак, этодолак, кеторолак, набуметон, аспирин, напроксен, валдекоксиб, эторикоксиб, MK0966; рофекоксиб, ацетаминофен, целекоксиб, диклофенак, трамадол, пироксикам, мелоксикам, теноксикам, дроксикам, лорноксикам, изоксикам, мефанамовую кислоту, меклофенамовую кислоту, флуфенамовую кислоту, толфенамовую кислоту, валдекоксиб, парекоксиб, этодолак, индометацин, аспирин, ибупрофен, фирококсиб.
Модифицирующие заболевание противоревматические средства (DMARD), применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают метотрексат (MTX), противомалярийные лекарственные средства (например, гидроксихлорохин и хлорохин), сульфасалазин, лефлуномид, азатиоприн, циклоспорин, соли золота, миноциклин, циклофосфамид, D-пеницилламин, миноциклин, ауранофин, такролимус, миокризин, хлорамбуцил.
Биологические средства, применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают адалимумаб (Humira®), этанерцепт (Enbrel®), инфликсимаб (Remicade®; TA-650), цертолизумаб пегол (Cimzia®; CDP870), голимумаб (Simponi®; CNT0148), анакинра (Kineret®), ритуксимаб (Rituxan®; MabThera®), абатацепт (Orencia®), тоцилизумаб (RoActemra/Actemtra®).
Другие биологические средства, применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают, например, антагонист интегрина (TYSABRI® (натализумаб)), антагонисты IL-1 (ACZ885 (марис)), анакинра (Kineret®)), антагонисты CD4, антагонисты IL-17 (LY2439821, RG4934, AMG827, SCH900117, R05310074, MEDI-571, CAT-2200), антагонисты IL-23, антагонисты IL-20, антагонисты IL-6, антагонисты TNF-альфа (например, антагонисты TNF-альфа или антагонисты рецептора TNF-альфа, например, пегсунерцепт и т.д.), антагонисты BLyS (например, атацицепт, Benlysta®/LimphoStat-B® (белимумаб)), ингибиторы P38, антагонисты CD20 (окрелизумаб, офатумумаб (Arzerra®)), антагонисты интерферона гамма (фонтолизумаб).
Стероиды (например, глюкокортикоиды), применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают преднизолон, преднизон, дексаметазон, кортизол, кортизон, гидрокортизон, метилпреднизолон, бетаметазон, триамцинолон, беклометазон, флудрокоттизон, дезоксикортикостерон, альдостерон.
Другие средства, применимые в сочетании с антагонистом IL-17 (например, секукинумабом) для лечения пациентов с РА, например, пациентов с РА высокого риска, включают SB-681323, Rob 803, AZD5672, AD 452, SMP 114, HZT-501, CP-195543, доксициклин, ванкомицин, CRx-102, AMG108, пиоглитазон, SBI-087, SCIO-469, Cura- 100, онкоксин+виусид, TwHF, PF-04171327, AZD5672, метоксален, ARRY-438162, витамин D - эргокальциферол, милнаципран, паклитаксел, GW406381, росиглитазон, SC12267 (4SC-101); LY2439821, BTT-1023, ERB-041, ERB-041, KB003, CF101, ADL5859, MP-435, ILV-094, GSK706769, GW856553, ASK8007, MOR103, HE3286, CP-690,550 (тасоцитиниб), REGN88 (SAR153191), TRU-015, BMS-582949, SBI-087, LY2127399, E-551S-551, H-551, GSK3152314A, RWJ-445380, такролимус (Prograf®), RAD001, рапамун, рапамицин, фостаматиниб, фентанил, XOMA 052, CNTO 136, JNJ 38518168, иматиниб, ATN-103, ISIS 104838, фолиевую кислоту, фолат, TNFa-киноид, MM-093, коллаген типа II, VX-509, AMG 82770, маситиниб (AB1010), LY2127399, циклоспорин, SB-681323, MK0663, NNC 0151-0000-0000, ATN-103, CCX 354-C, CAM3001, LX3305, цетрореликс, MDX-1342, TMI-005, MK0873, CDP870, траниласт, CF101, микофеноловую кислоту (и ее сложные эфиры), VX-702, GLPG0259, SB-681323, BG9924, ART621, LX3305, T-614, фостаматиниб динатрия (R935788), CCI-779, ARRY-371797, CDP6038, AMG719, BMS-582949, GW856553, росиглитазон, CH-4051, CE-224535, GSK1827771, GW274150, BG9924, PLX3397, TAK-783, INCB028050, LY2127399, LY3009104, R788, куркумин (LongvidaTM), росувастатин, PR0283698, AMG 714, MTRX1011A, маравирок, MEDI-522, MK0663, STA 5326 мезилат, CE-224535, AMG108, BG00012, рамиприл, VX-702, CRx-102, LY2189102, SBI-087, SB-681323, CDP870, милнаципран, PD 0360324, PH-797804, AK106-001616, PG-760564, PLA-695, MK0812, ALD518, кобипростон, соматропин, вектор для генной терапии tgAAC94, MK0359, GW856553, эзомепразол, эверолимус, трастузумаб, анаболические средства для роста костей и средства против резорбции костей (например, PTH, бифосфонаты (например, золедроновую кислоту), ингибиторы JAK1 и JAK2, пан-ингибиторы JAK, например, тетрациклический пиридон 6 (P6), 325, PF-956980, антагонисты склеростина (например, раскрытые в WO 09047356, WO 2000/32773, WO 2006102070, US 20080227138, US 20100028335, US 20030229041, WO 2005003158, WO 2009039175, WO 2009079471, WO 03106657, WO 2006119062, WO 08115732, WO 2005/014650, WO 2005/003158, WO 2006/119107, WO 2008/061013, WO 2008/133722, WO 2008/115732, US 7592429, US 7879322, US 7744874, содержание которых включено в настоящее описание в виде ссылки в полном объеме [предпочтительны антитела против склеростина и их антигенсвязывающие фрагменты для применения в раскрытых способах, фармацевтических композициях, наборах и применениях можно найти в WO 09047356 (эквивалент US 7879322), WO 06119107 (эквивалент US 7872106 и US 7592429) и WO 08115732 (эквивалент US 7744874]), деносумаб, антагонисты IL-6, антагонисты CD20, антагонисты CTLA4, антагонисты IL-17, антагонисты IL-8, антагонисты IL-21, антагонист IL-22, антагонисты интегрина (Tysarbri® (натализумаб)), антагонисты склеростина, антагонисты VGEF, антагонисты CXCL, антагонисты MMP, антагонисты дефензина, антагонисты IL-1 (включая антагонисты IL-1 бета) и антагонисты IL-23 (например, рецепторные ловушки, антагонистические антитела и т.д.).
В некоторых вариантах антагонист IL-17 (например, секукинумаб) вводят в сочетании, по меньшей мере, с одним противоревматическим средством, выбранным из группы, состоящей из иммунодепрессанта, DMARD, обезболивающего лекарственного средства, стероида, НПВС, антагониста цитокина, анаболического средства для роста костей, средства против резорбции костей и их сочетаний. В некоторых вариантах антагонист IL-17 (например, секукинумаб) вводят в сочетании с антагонистом TNF, DMARD (например, MTX, например, ежедневными дозами 7,5-30 мг)), стероидом или их сочетаниями.
Специалист в данной области сможет определить соответствующие дозы указанных выше средств для совместной доставки с антагонистом IL-17 (например, секукинумабом).
Наборы и изделия производства
В настоящем описании раскрыты наборы (т.е., изделие производства), применимые для получения антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) для лечения РА. Такие наборы могут содержать антагонист IL-17 (например, секукинумаб) (например, в жидкой или лиофилизированной форме) или фармацевтическую композицию, содержащую антагонист IL-17 (например, секукинумаб). Кроме того, такие наборы могут содержать средства для введения антагониста IL-17 (например, секукинумаба) (например, шприц или предварительно заполненную шприц-ручку) и инструкции по применению. Такие наборы могут содержать дополнительные терапевтические средства (описанные выше) для лечения РА, например, для доставки в сочетании с имеющимся в наборе антагонистом IL-17 (например, секукинумабом).
В настоящем описании раскрыты наборы, содержащие: a) антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент); b) инструкции по введению антагониста IL-17 (например, секукинумаба) пациенту с РА высокого риска; c) средства для введения антагониста IL-17 (например, секукинумаба) пациенту; и d) необязательно терапевтически эффективное количество, по меньшей мере, одного противоревматического средства, выбранного из группы, состоящей из иммунодепрессанта, модифицирующего заболевание противоревматического лекарственного средства (DMARD), обезболивающего лекарственного средства, стероида, нестероидного противовоспалительного лекарственного средства (НПВС), антагониста цитокина, анаболического средства для роста костей, средства против резорбции костей и их сочетаний. В некоторых вариантах пациент с РА высокого риска: a) является РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и b) имеет высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ.
В настоящем описании раскрыты наборы, содержащие a) антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент, например, секукинумаб), или молекулу, связывающую рецептор IL-17 (например, IL-17-антитело или его антигенсвязывающий фрагмент), или фармацевтическую композицию, содержащую антагонист IL-17, для применения при лечении ревматоидного артрита (РА) у пациента; и b) инструкции, описывающие как вводить указанную фармацевтическую композицию пациенту, при этом пациент характеризуется как: i) являющийся РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) имеющий высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ.
Также раскрыты настоящем описании способы тестирования in vitro для отбора пациента для лечения РА, включающие в себя определение того: i) является ли пациент РФ+, ACPA+ или одновременно и РФ+ и ACPA+; и ii) имеет ли пациент высокий уровень СРБ, высокую СОЭ или одновременно и высокий уровень СРБ и высокую СОЭ. В некоторых вариантах способа тестирования предполагают, что пациент имеет улучшенный терапевтический ответ на следующую схему: a) либо i) введение пациенту трех доз приблизительно по 10 мг/кг антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента), при этом первую дозу доставляют во время нулевой недели, вторую дозу доставляют во время второй недели, и третью дозу доставляют во время четвертой недели, либо ii) введение пациенту еженедельных доз приблизительно 75 мг или приблизительно 150 мг антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента, например, секукинумаба), или молекулы, связывающей рецептор IL-17 (например, IL-17-антитела или его антигенсвязывающего фрагмента) в виде четырех или пяти (предпочтительно пяти) доз; и b) затем введение пациенту приблизительно от 75 мг до приблизительно 300 мг антагониста IL-17 дважды в месяц, ежемесячно, каждые два месяца или каждые три месяца (предпочтительно ежемесячно), начиная с восьмой недели. Такие способы in vitro можно осуществлять на биологических образцах (например, крови, хряща, кости, сыворотки и т.д.), выделенных из организма пациента, и можно использовать для определения способа или хода лечения для конкретного пациента, например, вводить ли пациенту антагонист IL-17 (отдельно или в сочетании с другим соединением, например, таким как метотрексат), или выбрать альтернативную терапию (например, лечение с использованием анти-TNF).
Диагностические способы и способы получения информации, пригодной для передачи
В настоящем описании раскрыты способы определения (прогнозирования) вероятности того, что пациент с РА будет отвечать соответствующим образом (например, уменьшенными признаками и симптомами, уменьшенным повреждением суставов, улучшенным качеством жизни и т.д.) на лечение антагонистом IL-17, например, молекулой, связывающей IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом, например, секукинумабом), или молекулой, связывающей рецептор IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом). Такие способы помогут лечащим врачам определять ход лечения для конкретного пациента с РА.
В настоящем описании также раскрыты также способы определения вероятности того, что пациент с РА будет отвечать на лечение антагонистом IL-17, например, молекулой, связывающей IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом, например, секукинумабом), или молекулой, связывающей рецептор IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом), включающие в себя анализ образца, полученного от пациента, в отношении: a) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA) или РФ и ACPA; и b) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) или одновременно и СРБ и СОЭ, при этом пациент, вероятно, будет отвечать на лечение РА антагонистом IL-17 (например, секукинумабом), если пациент является РФ+, ACPA+ или РФ+ и ACPA+; и пациент имеет высокий уровень СРБ, высокую СОЭ или высокий уровень СРБ и высокую СОЭ. В некоторых вариантах перед стадией анализа сначала получают образец от пациента (например, посредством забора крови или другой биологической ткани из организма пациента).
В настоящем описании также раскрыты способы прогнозирования вероятности того, что пациент с РА будет отвечать на лечение антагонистом IL-17, например, молекулой, связывающей IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом, например, секукинумабом), или молекулой, связывающей рецептор IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом), включающие в себя определение того является ли пациент: a) РФ+ и/или ACPA; и 2) имеет ли он высокий уровень СРБ и/или высокую СОЭ, при этом пациент имеет повышенную вероятность или ответ на лечение антагонистом IL-17, если пациент является РФ+, ACPA+ или РФ+ и ACPA+; и имеет высокий уровень СРБ, a высокую СОЭ или высокий уровень СРБ и высокую СОЭ. В некоторых вариантах перед стадией определения сначала получают образец от пациента (например, посредством забора крови или другой биологической ткани из организма пациента).
В настоящем описании также раскрыты способы определения вероятности того, что пациент с РА будет отвечать на лечение антагонистом IL-17, например, молекулой, связывающей IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом, например, секукинумабом), или молекулой, связывающей рецептор IL-17 (например, IL-17-антителом или его антигенсвязывающим фрагментом), включающие в себя анализ образца, полученного от пациента, в отношении исходного уровня C-реактивного белка (СРБ), при этом пациент вероятно будет отвечать на лечение РА антагонистом IL-17 (например, секукинумабом), если пациент имеет повышенный исходный уровень СРБ. В некоторых вариантах перед стадией анализа сначала получают образец от пациента (например, посредством забора крови или другой биологической ткани из организма пациента).
В случае таких диагностических и прогностических способов образец от пациента можно анализировать обычными способами выявления фактора (РФ, ACPA, СРБ, СОЭ) или уровня фактора, например, с использованием радиальной иммунодиффузии, электроиммуноанализа, иммунотурбидиметрии, Вестерн-блота, Нозерн-блота, ELISA, турбидиметрических способов, иммуноанализа на основе поляризации флуоресценции, лазерной нефелометрии, реакции агглютинации, нефелометрического теста, измерения расстояния, которое эритроциты проходят при преципитации в пробирке с течением времени (например, в случае СОЭ) и т.д. Термины «анализ» и «определение» предполагают преобразование материала, например, переход биологического образца, например, образца крови или образца другой ткани из одного состояния в другое благодаря тому, что такой образец подвергают физическому испытанию. Кроме того, в используемом в настоящем описании смысле термины «анализ» и «определение» используют для обозначения тестирования и/или измерения. Фразу «анализ образца от пациента в отношении...» и тому подобные используют для обозначения того, что образец можно тестировать (либо прямо, либо опосредованно) в отношении либо наличия, либо отсутствия данного фактора или в отношении уровня конкретного фактора. Будет понятно, что в ситуации, когда присутствие вещества указывает на одну возможность, а отсутствие вещества указывает на другую возможность, то либо присутствие, либо отсутствие такого вещества можно использовать для принятия терапевтического решения. В некоторых вариантах перед лечением антагонистом IL-17 специалист-медик будет определять, является ли пациент пациентом с РА высокого риска.
Обычно после выявления присутствия или отсутствия конкретного фактора или определения уровня конкретного фактора лечащие врачи или консультанты по генетическим вопросам или пациенты или другие исследователи могут быть получить информацию о результате. В частности, результат может быть представлен в передаваемой форме информации, которую можно сообщать или передавать другим исследователям или лечащим врачам или консультантам по генетическим вопросам или пациентам. Такая форма может варьировать и может быть материальной и нематериальной. Результат, свидетельствующий о присутствии или отсутствии РФ и/или ACPA и/или об уровне СРБ и/или СОЭ у испытуемого может быть воплощен в виде письменных заключений, диаграмм, фотографий, таблиц, изображений или в любых других визуальных формах. Например, изображения гель-электрофореза ПЦР-продуктов можно использовать для объяснения результатов. Заключения и визуальные формы могут быть записаны на материальных носителях, таких как бумага, машинно-читаемые носители, такие как гибкие диски, компакт-диски и т.д., или на нематериальных носителях, например, в электронном виде в форме электронной почты или веб-сайта в сети Интернет или Интранет. Кроме того, результат, свидетельствующий о присутствии или отсутствии РФ и/или ACPA и/или уровня СРБ и/или СОЭ у испытуемого также может быть записан в звуковой форме и передан с использованием любого подходящего носителя, например, аналоговых или цифровых кабельных линий, оптико-волоконных кабелей и т.д., посредством телефона, факса, беспроводного мобильного телефона, Интернет-телефонии и тому подобного. Все такие формы (материальные и нематериальные) могут представлять собой «передаваемую форму информации». Таким образом, информация и данные результатов тестирования могут быть получены в любой точке мира и переданы в другое место. Например, когда проводят анализ для генотипирования за рубежом, информация и данные результатов тестирования могут быть получены и представлены в передаваемой форме, описанной выше. Таким образом, результат тестирования в передаваемой форме может быть импортирован в США. Соответственно, настоящее изобретение также охватывает способ получения передаваемой формы информации о присутствии или отсутствии РФ и/или ACPA и/или об уровне СРБ и/или СОЭ у индивидуума.
В настоящем описании раскрыты способы получения передаваемой формы информации о пациенте, имеющем РА, включающие в себя: a) анализ образца от пациента в отношении; i) ревматоидного фактора (РФ), антитела против цитруллинированного белка (ACPA) или одновременно и РФ и ACPA; и ii) C-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) или одновременно и СРБ и СОЭ; и b) преобразование результата, полученного на стадии анализа, в передаваемую форму информации. В некоторых вариантах после стадии преобразования поставщик медицинских услуг (например, лечащий врач) использует передаваемую форму информации для вынесения решения о назначении одной из схем лечения, раскрытых в настоящем описании, с применением антагонистов IL-17, раскрытых в настоящем описании. В некоторых вариантах после стадии преобразования поставщик медицинских услуг (например, лечащий врач) вводит антагонист IL-17 пациенту, если в передаваемой форме информации пациент идентифицирован как пациент с РА высокого риска.
Общая информация
Все патенты, опубликованные заявки на выдачу патентов, публикации, ссылки и другие материалы, упоминаемые в настоящем описании, включены в описание в виде ссылки в полном объеме. Подробности одного или нескольких вариантов изобретения приведены в сопровождающем описании выше. Хотя на практике или при проверке настоящего изобретения можно применять любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в настоящей публикации, здесь описаны предпочтительные способы и материалы. Другие признаки, цели и преимущества изобретения будут очевидны из описания и формулы изобретения. В описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если контекст ясно не диктует иное. Если не указано иное, то все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое обычно подразумевает специалист в области, к которой относится настоящее изобретение. Все патенты и публикации, цитируемые в описании, включены в виде ссылки. Следующие примеры представлены для того, чтобы более полно проиллюстрировать предпочтительные варианты изобретения. Такие примеры никоим образом нельзя считать ограничивающими объем объекта изобретения, который определен прилагаемой формулой изобретения.
ПРИМЕРЫ
Пример 1: Применение секукинумаба для лечения ревматоидного артрита (РА) (CAIN457F2201)
Пример 1.1 - Дизайн исследования
Популяция для исследования состоит из репрезентативной группы пациентов (мужчин или небеременных нелактирующих женщин), по меньшей мере, 18-летнего возраста, удовлетворяющих переработанным классификационным критериям ACR 1987 для РА в течение, по меньшей мере, 3 месяцев. У соответствующих критериям пациентов должен быь иметь место активный РА, определяемый по ≥6 из 28 болезненных суставов и ≥6 из 28 опухших суставов и вчСРБ≥10 мг/л или СОЭ≥28 мм/1-й час (мм/час) во время рандомизации, чтобы гарантировать возможность выявлять ответ на лечение с использованием критериев ACR. Удовлетворяющие критериям кандидаты принимали MTX, по меньшей мере, в течение 3 месяцев и на момент отбора подвергались лечению стабильной еженедельной дозой MTX (≥7,5 мг/неделю-≤25 мг/неделю) в течение, по меньшей мере, 4 недель.
Взрослых пациентов с РА (n=237) на метотрексате равномерно рандомизировали для получения ежемесячных подкожных инъекций секукинумаба 25 мг, 75 мг, 150 мг, 300 мг или плацебо. Пациентов, ранее подвергнутых воздействию биологических средств, включали во все когорты (18-22%). Основной конченой точкой была доля пациентов, достигающих критерия Американской коллегии ревматологии (ACR) 20 на 16 неделе. На 20 неделе (визит 8) пациенты, которые при случайном распределении попадали в группу на неделе 0, или которые были случайным образом распределены в группу лечения секукинумабом, но не достигали ответа ACR20 на 16 неделе, повторно распределяли для получения двойного слепого лечения до 48 недели с конечной оценкой эффективности, осуществляемой на 52 неделе, и визитом для контрольного наблюдения на 60 неделе, как указано далее, начиная с 20 недели (фигура 1):
- пациенты, находящиеся на лечении активным веществом, которые отвечали на терапию, продолжали лечение по своей схеме дозирования;
- всех пациентов, принимающих плацебо, переводили на лечение активным веществом с использованием 150 мг п/к каждую 4 неделю (ежемесячно), независимо от активности заболевания;
- всех пациентов, которых лечили с использованием 25 мг или 75 мг секукинумаба каждую 4 неделю, у которых отсутствовал ответ, переводили на 150 мг п/к каждую четвертую неделю;
- пациентов, не отвечающих на лечение в группе получающих 150 мг, переводили на следующую самую высокую дозу - 300 мг п/к каждую 4 неделю;
- всех пациентов в группе получающих 300 мг оставляли на той же дозе, чтобы оценить, будет ли воздействие длительнее чем 16 недель индуцировать клинический ответ у таких пациентов.
Оценки эффективности представляют собой показатели ACR20, 50, 70 (Felson с соавторами (1995) Arthritis Rheum., 38(6): 27-35) и ответ/ремиссия DAS28 (Fransen с соавторами (2003) Ann. Rheum. Dis. 62 (Suppl. 1): 10; Prevoo с соавторами (1995) Arthritis Rheum: 38(1): 44-48). Основной переменной эффективности является клинический ответ на лечение на основании улучшения активности заболеваний у индивидуумов ACR20 на 16 неделе. Результаты оценивают по доле пациентов, достигающих критериев ответа ACR20 на 16 неделе. Пациента можно считать отвечающим согласно критерию ACR20, если он/она имеет:
A) по меньшей мере, 20% улучшение двух из следующих показателей;
- количества болезненных суставов из 28 суставов;
- количества распухших суставов из 28 суставов; и
B) по меньшей мере, 20% улучшение, по меньшей мере, по 3 из следующих 5 показателей:
- оценка РА-боли пациентом (шкала ВАШ 100 мм);
- глобальная оценка активности заболевания пациентом (шкала ВАШ 100 мм);
- глобальная оценка активности заболевания лечащим врачом (шкала ВАШ 100 мм);
- самооценка нетрудоспособности пациентом (оценка согласно анкете оценки состояния здоровья [HAQ©])
- реактант острой фазы (C-реактивный белок [вчСРБ] или скорость оседания эритроцитов (СОЭ)).
Дополнительные показатели включают: ACR50 (50% улучшение по пункту B (выше), по меньшей мере, 3 из 5 показателей и 50% улучшение по количеству опухши и болезненных суставов) и ACR70 (70% улучшение по пункту B (выше), по меньшей мере, 3 из 5 показателей и 70% улучшение по количеству опухших и болезненных суставов).
DAS28 (оценка активности заболевания - 28) является общепринятым показателем активности заболевания при РА. Оценку вычисляют с использованием сложной математической формулы, в которую включены количество болезненных и опухших суставов (всего из 28), скорость оседания эритроцитов (СОЭ) или вчСРБ, и глобальную оценку пациентом общего состояния здоровья (указываемую пометкой на линии длиной 100 мм между очень хорошим и очень плохим самочувствие). Оценка DAS28 выше 5,1 свидетельствует об активном заболевании, меньше 3,2 о хорошо контролируемом заболевании и меньше 2,6 о ремиссии.
Для вычисления DAS28 необходима информация о следующих переменных заболевания:
- количество опухших суставов и болезненных суставов следует оценивать, используя подсчет, исходя из 28 суставов (болезненных 28 и опухших 28);
- скорость оседания эритроцитов (СОЭ) следует измерять в мм/час;
- необходимо получить данные об общем состоянии здоровья пациента (GH) или общей активности заболевания, измеренной по визуальной аналоговой шкале (ВАШ) длиной 100 мм (оба показателя применимы для такой цели).
Используя указанные данные DAS28 можно вычислить с помощью следующей формулы:
DAS28=0,56*квадратный корень(болезненных 28)+0,28*квадратный корень(опухших 28)+0,70*ln(СОЭ)+0,014*GH
C-реактивный белок (СРБ) можно использовать в качестве альтернативы СОЭ в расчетах DAS или DAS28, используя формулы, приведенные ниже. СРБ является более прямой мерой воспаления, чем СОЭ, и он более чувствителен к кратковременным изменениям. Продукция СРБ ассоциирована с выявляемым рентгенологически прогрессированием РА и считается, по меньшей мере, так же пригодным, как и СОЭ, для измерения активности заболевания РА. Другое преимущество определения СРБ заключается в том, что время ожидания лабораторного результата короче, и что в случае многоцентровых исследований можно использовать центральную лабораторию. Следующие формулы для вычисления DAS28 с использованием СРБ (мг/л) дают хорошие оценки исходных значений DAS28 на уровне группы.
DAS28-4(СРБ)=0,56*квадратный корень(TJC28)+0,28*квадратный корень(SJC28)+0,36*ln(СРБ+1)+0,014*GH+0,96
TJC28: количество болезненных суставов из 28; SJC28: количество опухших суставов из 28; СРБ: C-реактивный белок; GH: общее состояние здоровья по визуальной аналоговой шкале длиной 100 мм.
HAQ® является проверенным показателем физической нетрудоспособности и функционального статуса. Он имеет четыре показателя: нетрудоспособность, боль, побочные эффекты лекарственного средства и затраты в долларах, хотя последние три редко используют в клинических испытаниях. В данном испытании использовали только показатель нетрудоспособности. Показатель нетрудоспособности состоит из анкеты с множественным выбором из 20 вопросов, касающихся затруднений в осуществлении восьми универсальных активностей в ежедневной жизни; одевание и уход за внешностью, подъем, прием пищи, ходьба, передача предметов, персональная гигиена, цепкость пальцев и другие виды деятельности. Субъекты выбирают из четырех категорий ответов в диапазоне от «без каких-либо затруднений» до «неспособности сделать». Комитет ревматологии ACR по оценкам результатов in RA рекомендует использование такой анкеты в клинических испытаниях. HAQ© оценивают в баллах в соответствии с рекомендациями разработчиков, изложенными в «HAQ PACK», Stanford University, California.
Пример 1.2 - Статистический анализ
Чтобы проверить превосходство лечения в группах, принимающих секукинумаб, по сравнению с плацебо, сравнивали частоту (долю) достигающих ответа ACR20 в каждой группе лечения секукинумабом с частотой в группе плацебо на основе логистической регрессионной модели, используя лечение, центр и исходный уровень в качестве ковариат. Изменение DAS28-СРБ по сравнению с исходным уровнем анализировали, используя ковариационный анализ (ANCOVA, SAS PROC MIXED) модели с фиксированными эффектами с использованием лечения в качестве основного эффекта и корректируя по коваритам: центр и исходный уровень. Все статистические тесты для попарных сравнений группы лечения секукинумабом с группой плацебо осуществляли при уровне значимости двустороннего критерия 5%. Способ переноса данных последнего наблюдения (LOCF) использовали для пропущенных значений переменных эффективности. Представлены фигуры, на которых изображен ответ с течением времени или в конкретных временных точках вплоть до 16 недели (или 52 недели в соответствующем случае). Следует отметить, что на фигурах, представляющих результаты до 52 недели, включены данные только для пациентов, продолжающих лечение на 24 неделе.
Полную популяцию для анализа (FAS) использовали для отчетов о результатах эффективности. FAS включала всех пациентов, которым было назначено исследуемое лекарственное средство. Следуя принципу анализа в соответствии с назначенным лечением (ITT), пациентов анализировали в соответствии с лечением и группой, в которую они были определены при рандомизации.
Пример 1.3 - Результаты на 16 неделе
Демографические характеристики и характеристики исходного уровня сравнивали во всех группах. Пациентов с ответом ACR20 на 16 неделе было больше в группах, получающих дозы секукинумаба 75 мг, 150 мг и 300 мг (46,9%, 46,5% и 53,7%, соответственно) по сравнению с плацебо (36,0%) и по сравнению с 25 мг секукинумаба (34%) (фигура 2A). Однако такие результаты не достигали статистической значимости вследствие заметного и необъяснимого увеличения ACR20 в группе плацебо с 12 недели (24%) по 16 неделю (36%). Клинически значимые снижения DAS28-СРБ наблюдали в группах лечения секукинумабом 75-300 мг по сравнению с плацебо (фигура 5A). Уровни СРБ в сыворотке на 16 неделе заметно снижались в группах лечения секукинумабом 75-300 мг по сравнению с плацебо (p=0,0012, 0,0081 и 0,0241) (данные не показаны). ACR50 и ACR70 показали соответствующие еще большие улучшения при дозах секукинумаба 75-300 мг по сравнению с плацебо в течение 16 недель (фигуры 3A и 4A). Имело место приблизительно 4-кратное среднее снижение по сравнению с исходным уровнем в оценке HAQ© на 16 неделе в группах, получающих дозы 150-300 мг по сравнению с плацебо (фигура 6A).
Пример 1.4 - Результаты на 24 недели
На 24 неделе ответы ACR20 сохранялись и ответы DAS28 СРБ дополнительно улучшались в группах лечения секукинумабом, получающих 75-300 мг, с 16 по 24 неделю. Оценки HAQ© либо сохранялись, либо дополнительно снижались в группах лечения секукинумабом в дозах 75-300 мг с 16 по 24 неделю. В группах лечения пациентов дозами 75-300 мг с ответом ACR20 наблюдали раннее улучшение оценок HAQ© с течением времени до 24 недели. Ответы ACR50 дополнительно улучшались с 19 до 24% (75 мг), с 21 до 25% (150 мг) и с 19 до 24% (300 мг) у пациентов, исходно случайным образом распределенных в группы приема соответствующих доз, для части из которых повышали дозу на 20 неделе; сходное улучшение наблюдали у пациентов с ответом ACR70 в группах 75 мг-150 мг. Также можно отметить повышение ответа ACR20/50/70 с 16 по 24 неделю у пациентов, случайным образом попавших в группу плацебо. Всех пациентов, получавших плацебо до 16 недели, переводили на 150 мг секукинумаба на 20 неделе.
Пример 1.5 - Результаты на 52 неделе
Что касается эффективности секукинумаба с течением времени, то у пациентов, которые отвечали на лечение на 16 неделе, обычно сохраняли свои ответы по показателю ACR20 (фигура 2C), ACR50 (фигура 3B) и ACR70 (фигура 4B), при этом наилучшие ответы наблюдали в когорте отвечающих на дозу 150 мг. Тот же вывод также верен в отношении оценок ответов DAS28-СРБ и HAQ, которые сохранялись у пациентов, отвечающих на 16 неделе, с течением времени до 52 недели и при этом снова наилучшие ответы наблюдали в когорте отвечающих на дозу 150 мг (фигура 5B, 6B). Ответы ACR20, 50 и 70 на 52 неделе показаны на фигуре 7, при этом снова самые высокие ответы наблюдали по всем указанным параметрам в группе отвечающих на дозу 150 мг.
Пациенты, у которых отсутствовал ответ на биологическое средство, составляли 18-22% в каждой когорте в начале исследования. Из пациентов, ранее подвергнутых воздействию биологических средств, которым вводили дозу 150 мг секукинумаба после 20 недели, 62% (8 из 13) достигали ACR20, 38% (5 из 13) достигали ACR50 и 23% достигали ACR70 на 52 неделе. Полученные данные являются доказательством того, что секукинумабом можно лечить РА у пациентов, у которых была неудачной анти-TNF-терапия и терапия другими биологическими средствами.
Пример 2: Анализ подгруппы пациентов с РА высокого риска в CAIN457F2201
Пример 2.1 - Статистический анализ
При скрининге показателей, которые являются прогностическими в отношении ответа пациента РА на лечение секукинумабом, авторы анализировали два из четырех оцениваемых в баллах критериев ACR/EULAR 2010 года (смотри таблицу 1), чтобы определить каким образом такие критерии могут влиять (и влияют ли) на ответ на лечение секукинумабом, используя данные из базы данных испытаний CAIN457F2201. Во-первых, авторы анализировали серологию, чтобы определить, является ли пациент РФ+ и/или анти-CCP+ (т.е., ACPA+). Во-вторых, авторы анализировали присутствие реактантов острой фазы, чтобы определить, имеет ли пациент высокий уровень C-реактивного белка (СРБ) и/или высокую скорость оседания эритроцитов (СОЭ).
Анализ осуществляют, главным образом, с использованием сводной статистики (доли для бинарных переменных ответа и среднее значение для непрерывных переменных), получаемой во времени, чтобы наблюдать ответы до 16 недели (или 52 недели в случае пациентов, которые продолжали лечение на 24 неделе). Способ переноса данных последнего наблюдения (LOCF) использовали для пропущенных значений переменных эффективности. Получали данные, представляющие ответ с течением времени или в конкретных временных точках до 16 недели (или 52 недели в соответствующих случаях). Следует отметить, что в случае данных, показывающих результаты до 52 недели, включали только данные для пациентов, продолжающих лечение на 24 неделе.
Пример 2.2 - Анализ ответов на секукинумаб у пациентов с РА высокого риска
Анализ подгруппы пациентов с «высоким риском» (т.е., «пациентов с РА высокого риска») в отношении прогрессирования заболевания (на основании высокого СРБ и/или СОЭ и позитивности по РФ и/или ACPA) показал многообещающие результаты у пациентов, подвергаемых лечению секукинумабом, по сравнению с результатами общего испытания CAIN457F2201, тогда как ответы в группе плацебо не имели сходной тенденции к повышению. В показателях ACR20 в популяции FAS наблюдали ответ 46,9, 46,5, 53,7 и 36% на 16 неделе в группах лечение секукинумабом 75, 150, 300 мг и плацебо (фигура 2A и таблица 6), соответственно, тогда как в подгруппе высокого риска наблюдали ответы 48,8. 57,6, 58,1 и 41,0% на 16 неделе в подгруппе высокого риска (фигура 2B и таблица 6). Подобным образом, повышенные степени ответа наблюдали на 16 и 52 неделе в подгруппе высокого риска по сравнению с FAS и в случае других переменных, таких как ACR50/70 (таблица 6), DAS28-СРБ (таблица 7) и HAQ© (данные не показаны).
Суммарные данные, касающиеся ответов ACR20/50/70% и DAS28-СРБ на 16 и 52 неделе в популяции FAS у пациентов с РА высокого риска и пациентом, не являющихся пациентами с РА высокого риска, приведены в таблице 6 (ACR) и таблице 7 (DAS28-СРБ). Графическое изображение ответов ACR20/50/70% и DAS28-СРБ на 16 неделе у пациентов с РА высокого риска и пациентов, не являющихся пациентами с РА высокого риска, приведены на фигурах 8A и 8B.
|
|
Следует отметить, что в случае таблиц 6 и 7 данные для 52 недели представлены по исходно назначенному лечению. Титрование осуществляли для не имеющих ответа ACR20 (и всех пациентов на плацебо), начиная с 16 недели. 18/45 пациентов, «исходно» получавших 25 мг, оставались на дозе 25 мг, тогда как для 27 пациентов дозу повышали до 150 мг. Подобным образом, 23/46 пациентов «исходно» получавших 75 мг, оставались на дозе 75 мг, тогда как для 23 пациентов дозу повышали до 150 мг. 20/43 пациентов «исходно» получавших 150 мг, оставались на дозе 150 мг и для 23 дозу повышали до 300 мг. Все 44 пациента, исходно получавших плацебо, переводили на 150 мг и все пациенты «исходно» получавшие 300 мг, оставались на дозе 300 мг.
Как можно видеть в таблицах 6 и 7, а также на фигурах 8A и 8B, у пациентов с РА высокого риска обычно наблюдают улучшенный ответ на ингибирование IL-17 по сравнению с пациентами с РА не высокого риска. Сравнивая ответ ACR20% и ACR50% между пациентами с РА высокого риска и пациентами с РА не высокого риска на 16 неделе (таблица 6 и фигура 8A), можно видеть ответ на дозу у пациентов с РА высокого риска в ответ на ингибирование IL-17 секукинумабом. Сходный ответ на дозу наблюдали на основании оценки DAS28-СРБ у пациентов с РА высокого риска на 16 и 52 неделе (таблица 7 и фигура 8B). Кроме того, ответы ACR20% на 16 неделе в подгруппе пациентов с РА высокого риска улучшены при всех дозах секукинумаба выше 25 мг по сравнению с ответами ACR20%, наблюдаемыми у пациентов с РА не высокого риска (таблица 6 и фигура 8A). Кроме того, ответ ACR50/70% на 16 и 52 неделе у пациентов с РА высокого риска, которых лечили с использованием 150 мг секукинумаба, выше, чем ответ ACR50/70% у пациентов с РА не высокого риска, которых лечили такой же дозой секукинумабом. Сходный результат наблюдали в отношении оценки DAS28-СРБ в случае 150 мг секукинумаба на 16 неделе и при всех дозах секукинумаба на 52 неделе (таблица 7 и фигура 8B).
Пример 3: Польза от секукинумаба для пациентов с повышенным исходным уровнем СРБ
Пример 3.1 - Дизайн исследования
Исследование проводили для того, чтобы оценить зависимость между дозой и ответом в случае ответов DAS28 и ACR на 16 неделе при разных исходных уровнях СРБ, оцениваемых посредством высокочувствительного (вч) анализа, у пациентов с РА, которых лечили разными дозами секукинумаба по сравнению с плацебо.
Как описано ранее, в исследовании CAIN457F2201 взрослых пациентов с РА (n=237), которых лечили метотрексатом, рандомизировали для получения ежемесячно п/к-инъекций секукинумаба 25 мг, 75 мг, 150 мг, 300 мг или плацебо. Авторы оценивали зависимость от дозы ответов DAS28 и ACR на 16 неделе при разных исходных уровнях вчСРБ (≥ 0 мг/л, ≥10мг/л, ≥20мг/л и ≥ 30мг/л).
Пример 3.2 - Результаты
Демографические характеристики и характеристики исходного уровня были сравнимы во всех группах. Быстрое снижение DAS28-СРБ наблюдали уже на 2 неделе у пациентов, в группах, принимавших 75 мг, 150 мг, 300 мг секукинумаба. На 12 неделе такие пациенты достигали клинически значимого снижения DAS28>1,2 по сравнению с пациентами, принимавшими плацебо (P<0,05). Такие ответы поддерживались до 16 недели (таблица 8). Как видно из таблицы 8 и на фигуре 9, существует зависимая от дозы зависимость ответов DA528-СРБ, ACR20 и ACR50 на 16 неделе на основе исходных уровней вчСРБ для когорт, получавших дозы секукинумаба 150 мг и 300 мг по сравнению с группами на плацебо или 25 мг и 75 мг секукинумаба. Профиль безопасности секукинумаба вплоть до 20 недели был сравним с плацебо. Большинство неблагоприятных явлений были слабыми или умеренными по тяжести и не приводили к прекращению применения исследуемого лекарственного средства.
|
Результаты показывают, что секукинумаб обеспечивает быстрое снижение активности заболевания, при этом самое большое улучшение наблюдали у пациентов, получавших по 150 мг или 300 мг, у которых были признаки высокой воспалительной нагрузки, что подтверждалось исходными уровнями вчСРБ. Полученные результаты свидетельствуют о том, что секукинумаб полезен для пациентов с РА, включая пациентов с факторами, подвергающими их высокому риску прогрессирования заболевания.
Пример 4: Моделирование и имитация: Дизайн схемы индукции при ревматоидном артрите
Зависимость между дозой/схемой секукинумаба, концентрацией секукинумаба в плазме и ответом ACR20 моделировали, используя способ ФК/ФД, описывающий данные длительного наблюдения. Такие модели использовали для создания дизайна фазы III испытания секукинумаба при лечении ревматоидного артрита.
Пример 4.1 - Способы
Моделирование фармакокинетики секукинумаба
Для фармакокинетической (ФК) модели (фигура 10) объединяли данные различных клинических исследований (CAIN457A1101, CAIN457A2101, CAIN457A2102, CAIN457A2103, CA1N457A2104, CA1N457A2206, CA1N457A2208, CAIN457A2209 и CAIN457F2201). Популяционный способ с применением двухкамерной модели использовали для описания ФК секукинумаба. Параметры популяции оценивали вместе с межиндивидуальной вариабельностью. Оценивали следующие параметры: объемы распределения V1=2,96 л и V2=2,52 л, клиренс первого порядка из первого объема CL=0,169 л/сутки, коэффициент межкамерного обмена Q=0,784 л/сутки и скорость всасывания и абсолютную биодоступность в случае подкожного введения составляли KA=0,192 л/сутки и F=76%, соответственно. Массу тела определяли как ковариату клиренса секукинумаба и объемов.
Моделирование доли пациентов с ответом ACR20 в группах лечения плацебо и секукинумабом
Для моделирования ACR20 использовали данные о пациентах с неадекватным ответом на метотрексат (таблица 9), данные из двух клинических исследований (CAIN457A2101 и CA1N47F2201). Долю пациентов с ответом ACR20 моделировали, используя способ на основе зависимости концентрация - вероятность отвечающих пациентов для групп, получающих плацебо и лечение. Предположение заключалось в том, что доля ответов ACR20 монотонно возрастала вплоть до 16 недели для групп, получающих плацебо и получающих лечение. Монотонно возрастающая кривая зависела от логарифма времени и квадратного корня концентрации секукинумаба. Наблюдаемый ACR20 (LoCF) на 4 неделе (29 день), 8 неделе (57 день), 12 неделе (86 день) и 16 неделе (113 день) моделировали в две стадии для группы плацебо и группы, получающей лечение.
Модель временного профиля ACR20 для группы плацебо
Наблюдаемый ACR20 в момент времени ti (i=1, 2, 3, 4 означает неделю 4, 8, 12 и 16) для j-ого пациента в группе плацебо записывали в виде:
ACR200j(ti)~биномиальный(l,p0(ti))
Логит p0(ti)=α+β log(ti)/log(t4)
Таким образом, логит частоты ответов ACR20 в группе плацебо на 16 неделе составлял α+β и в момент времени 0 он составлял -∞, что соответствует вероятности ответа 0 в нулевой временной точке.
Модель временного профиля ACR20 для группы лечения секукинумабом
Наблюдаемый ACR20 в момент времени ti для j-ых пациентов в группе лечения секукинумабом записывали в виде:
ACR20j(ti)~биномиальный(1,p(ti))
Логит(p(ti))=логит(p0(ti))+γ(ti)h(конц.j(ti)), где h() означал квадратный корень прогнозируемой концентрации в индивидуальной модели. В данном случае γ означает изменение чувствительности доли пациентов с ответом ACR20 к концентрации в момент времени ti.
γ(ti)=γ0log(ti)/log(t4).
Таким образом, эффект секукинумаба описывали в виде γ(ti)h(конц.j(ti)). Функциональную форму γ выбирали, так чтобы она представляла собой log дня исследования, так же, как в случае временных эффектов плацебо, другими словами предполагали пропорциональные шансы в h(конц.).
Для оценки использовали способ обобщенного оценочного уравнения и полагали, что корреляция наблюдаемых у пациентов ответов ACR20 подчинялась требованиям составной симметрии.
Пример 4.2 - Результаты
Пример 4.2.1 - Результаты моделирования ФК
Как можно видеть на фигуре 10, модель предсказывает, что более высокая концентрация секукинумаба в плазме может быть достигнута с использованием схемы либо внутривенной, либо подкожной индукции по сравнению с отсутствием схемы индукции. Кроме того, модель дополнительно предсказывает, что схема индукции, в которой используют 10 мг/кг секукинумаба, доставляемого внутривенно в 0, 2 и 4 неделю, может обеспечить более высокую концентрацию секукинумаба в плазме (и с более высокой скоростью), чем схема индукции, в которой используют 300 мг секукинумаба, доставляемого подкожно в 0, 1, 2, 3 и 4 неделю. Смоделированные схемы подкожной и внутривенной индукции дают улучшенный ответ по сравнению со схемой дозирования, в которой отсутствует фаза индукции.
Пример 4.2.4 - Результаты имитации ACR20
Результаты моделирования ответов ACR20 представлены в таблице 9. Имитация ACR20 прогнозирует, что более высокая частота ответов ACR20 может быть достигнута с использованием схемы либо внутривенной (63%), либо подкожной (57%) индукции по сравнению с условием отсутствия схемы индукции (35%). Кроме того, модель дополнительно прогнозирует, что схема индукции, в которой используют 10 мг/кг секукинумаба, доставляемого внутривенно в 0, 2 и 4 неделю, может обеспечивать более высокую частоту ответов ACR20, чем в случае схемы индукции, в которой используют 300 мг секукинумаба, доставляемого подкожно в 0, 1, 2, 3 и 4 неделю. Смоделированные схемы подкожной и внутривенной индукции обеспечивали улучшенный ответ по сравнению со схемой дозирования, в которой отсутствовала фаза индукции.
|
Пример 5: В случае секукинумаба наблюдали хорошую безопасность и эффективность при лечении активного анкилозирующего спондилита
Пример 5.1 - Дизайн исследования CAIN457A2209
CAIN457A2209 представляет собой многоцентровое рандомизированное, двойное слепое, проводимое в параллельных группах, плацебо-контролируемое исследование фазы II для проверки концепции на пациентах с АС от умеренной до тяжелой степени. Популяция для исследования представляет собой пациентов 18-65-летнего возраста с АС, диагностированным согласно модифицированным Нью-Йоркским критериям с оценкой боли в спине и ночных болей ≥4 (шкала с 0-10 точками), оценкой BASDAI ≥4 (шкала с 0-10 точками) и неадекватным ответом на настоящее или предыдущее применение, по меньшей мере, одного НПВС, получаемого в течение, по меньшей мере, 3 месяцев в максимальной рекомендуемой дозе. Пациентам, при лечении которых ранее применяли блокатор TNF-α, давали возможность вступить в исследование после соответствующего периода вымывания. Пациентам позволяли продолжать лечение с использованием НПВС, метотрексата (MTX), сульфасалазина и преднизолона в стабильных дозах во время исследования. Однако пациентов с признаками активного туберкулеза исключали.
Тридцать (30) пациентов рандомизировали в соотношении 4:1 для получения двух внутривенных инфузий либо секукинумаба (AIN457) 10 мг/кг в/в, либо плацебо в/в, вводимых с интервалом в 3 недели. За пациентами будут следить в отношении безопасности до 28 недели. Осуществляли байесовский анализ частот ответов ASAS20 на 6 неделе в случае AIN457 и плацебо. Априорные распределения частот ответов определены как бета-распределения, и полагали наличие биномиального распределения для наблюдаемого количества отвечающих пациентов в каждой группе. Прогнозируемое распределение частоты ответа на плацебо в результате мета-анализа 8 рандомизированных плацебо-контролируемых испытаний анти-TNF-альфа-лечения АС использовали в качестве априорного распределения частоты ответа на плацебо. Такая априорная вероятность была эквивалентна наблюдению 11 из 43 отвечающих пациентов (т.е., частоте ответа 26%). Низкую априорную вероятность использовали для частоты активного ответа (эквивалентную наблюдению 0,5 из 1,5 отвечающих пациентов).
Основным конечным результатом была доля пациентов, достигающих оценки ответа согласно критериям международного общества по спондилоартритам (ASAS) 20 на 6 неделе.
Пример 5.2 - Результаты
Демографические характеристики и характеристики исходного уровня были сравнимы между группами. Среднее значение (SD) BASDAI исходного уровня составляло 7,1 (1,4) в случае пациентов, которых лечили секукинумабом, и 7,2 (1,8) в случае пациентов, которых лечили плацебо. Три пациента на плацебо и 2 пациента на AIN457 прервали исследование до достижения основного конечного результата, главным образом вследствие неудовлетворительного терапевтического эффекта. Данные об эффективности для 1 пациента были недоступны вследствие нарушения протокола после рандомизации. На 6 неделе 14/23 пациентов, подвергаемых лечению секукинумабом, которые вошли в анализ эффективности, достигали ответов ASAS20 по сравнению с 1/6 пациентов, которых лечили плацебо (61% по сравнению с 17%, вероятность положительной разницы лечения=99,8%, доверительный интервал 11,5%, 56,3%). Ответы ASAS40 и ASAS5/6 у пациентов, которых лечили секукинумабом, составляли 30% и 35%, соответственно, и среднее (диапазон) изменение BASDAI составляло -1,8 (от -5,6 до 0,8). У большинства пациентов с ответом ASAS20 секукинумаб индуцировал ответы в течение недели лечения. Фармакокинетический профиль был таким, как предполагали для IgG1-мАт и сравним с секукинумабом, принимаемым в случае других показаний.
Основной конечный результат такого исследования был достигнут, так как секукинумаб индуцировал значимо более высокие ответы ASAS20, чем плацебо на 6 неделе. Не отмечено ранних сигналов в отношении безопасности в такой исследуемой популяции. Предварительные данные, представленные в настоящей публикации, свидетельствуют, что секукинумаб применим для лечения активного анкилозирующего спондилита.
Пример 6 - Секукинумаб снижает признаки и симптомы псориатического артрита в 24-недельном многоцентровом, двойном слепом, рандомизированном, плацебо-контролируемом испытании
Пример 6.1 - Дизайн исследования и демография
Сорок два пациента с активным псориатическим артритом (ПсА), удовлетворяющих критериям CASPAR, распределяли 2:1 для получения двух инъекций секукинумаба (10 мг/кг) или плацебо, вводимых с интервалом в три недели. Основным конечным результатом для эффективности была доля пациентов с ответом ACR20 на 6 неделе среди пациентов принимающих активное вещество по сравнению с пациентами, принимающими плацебо (p-значение одностороннего теста <0,1). В соответствии с протоколом не проводили восстановление пропущенных данных (выбывания обрабатывали как пропущенные данные).
Двадцать пять (89%) пациентов на секукинумабе и 10 (71%) на плацебо завершали исследование. Пять пациентов (4 на секукинумабе и 1 на плацебо) исключали из анализа эффективности из-за нарушений протокола. Три (11%) пациента на секукинумабе и 4 (29%) на плацебо преждевременно прерывали лечение в связи с отсутствие эффективности или отзывом согласия. Демографические показатели и характеристики исходного уровня были сбалансированы между группами по возрасту, полу и параметрам, включая среднее значение (SD) SJC (секукинумаб по сравнению с плацебо): 8,3 (5,6) по сравнению с 9,5 (5,4); TJC 23,5 (19,4) по сравнению с 22,6 (11,0); DAS28 4,8 (1,2) по сравнению с 4,8 (1,2); MASES 3,0 (4,1) по сравнению с 3,4 (2,3). Одновременное наличие псориаза перед воздействием TNFi и совместное лечение DMARD имело место у 23 (98%), 11 (46%) и 2 (88%) пациентов на секукинумабе и у 1 (89%), 5 (38%) и 10 (70%) на плацебо, соответственно.
Пример 6.2 - Результаты
Частота ответа ACR20 на 6 неделе составляла 39% (9/23) на секукинумабе по сравнению с 23% (3/13) на плацебо (P=0,27). Частоты ответов ACR20 составляли 39% (9/23) по сравнению с 15% (2/13) на 12 неделе и 43% (10/23) по сравнению с 18% (2/11) на 28 неделе в случае секукинумаба по сравнению с плацебо, соответственно. Частоты ответов ACR50 и ACR70 на 6 неделе на секукинумабе по сравнению с плацебо составляли 17% по сравнению с 8% и 9% по сравнению с 0%, соответственно. Снижение СРБ на 6 неделе по сравнению с исходным уровнем наблюдали при лечении секукинумабом (медианное значение [диапазон] 5,0 [0,3, 43,0] на исходном уровне по сравнению с 3,0 [0,2, 15,2] на 6 неделе, но не плацебо (3,9 [1,3, 39,7] на исходном уровне по сравнению с 5,0 [0,8, 29,6] на 6 неделе). Сходное снижение наблюдали в отношении СОЭ, и снижение параметров острой фазы сохранялось вплоть до 28 недели. Общая частота неблагоприятных явлений (AE) была сравнима в случае секукинумаба и плацебо: 26 (94%) по сравнению с 11 (79%). Одно тяжелое неблагоприятное явление (воспаление подкожной клетчатки руки) наблюдали при лечении секукинумабе, и исследователи полагали, что оно не связано с исследуемым лекарственным средством. Сообщали о семи тяжелых AE у 4 пациентов на секукинумабе (разрыв сухожилия/синдром запястного канала/воспаление подкожной клетчатки, ожирение, падение, рак молочной железы [диагностирован перед введением дозы и включением в исследование, что являлось нарушением протокола]) и у 1 пациента на плацебо (полиартрит). Сообщалось об инфекциях у 16 (57%) пациентов на секукинумабе и 7 (50%) пациентов на плацебо.
Профиль безопасности секукинумаба был достаточно полным. Хотя основной конечный результат не был достигнут, у значительной доли пациентов наблюдали быстрое и длительное улучшение клинических оценок и параметров острой фазы вплоть до 28 недели. Тенденции к благоприятному клиническому эффекту подтверждают целесообразность дальнейших клинических испытаний, предназначенных для оценки клинической эффективности.
Пример 7 - Фармакокинетическая (ФК) информация о секукинумабе
На основании данных, полученных в различных исследованиях, включая исследований, обсуждаемые в приведенных выше примерах, была получена следующая ФК-информация в отношении секукинумаба (таблица 10).
|
Кроме того, было определено, что секукинумаб имеет Tmax приблизительно 7-8 суток и период полуэлиминациия приблизительно 30 суток. Полученная ФК-информация может быть использована для планирования различных схем дозирования для лечения артрита, например, РА, например, РА высокого риска. Используя полученную ФК-информацию, можно доставлять другую дозу антагониста IL-17, например, молекулы, связывающей IL-17 (например, IL-17-антитела, такого как секукинумаб), или молекулы, связывающей рецептор IL-17 (например, антитела к рецептору IL-17), отличной от доз, используемых в примерах, или доставлять такую же дозу, которая использована в примерах, но которую вводят в другой временной точке, отличной от временных точек, используемых в примерах. Предполагается, что при поддерживании такого же ФК-профиля, даже если схема дозирования или доза может быть изменена, специалист в данной области сможет использовать антагонист IL-17, например, молекулу, связывающую IL-17 (например, IL-17-антитело, такое как секукинумаб), или молекулу, связывающую рецептор IL-17 (например, антитело к рецептору IL-17) для лечения артрита, включая лечение пациентов с РА высокого риска.
Пример 8: Фармацевтические композиции/лекарственные средства, содержащие антагонист IL-17
Исследование приготовления препарата с использованием лекарственного вещества секукинумаба начинали с целью разработки продукта с высокой эффективностью, например, во флаконе, содержащем стандартную дозу 150 мг секукинумаба. Четыре основанных на сахарозе препарата в сочетании с разными стабилизаторами (маннит, глицин, аргинин HCl) включали в программу исследования стабильности в реальных, усиленных и стрессовых условиях в течение 12 месяцев (таблица 11).
|
Все препараты помещали в стеклянные флаконы типа 1 объемом 6 мл по 3,6 мл (переполнение 20%), которые закрывали, используя пробки для лиофилизации, покрытые Flurotec® B2, и лиофилизировали, используя консервативный цикл лиофилизации (таблица 12).
|
Стабильность секукинумаба наблюдали в препаратах посредством определения появления осадка, pH, времени перерастворения, остаточной влаги по методу Карла Фишера, агрегатов и продуктов разложения с использованием эксклюзионной ВЭЖХ, примесей с использованием SDS-ПААГ в восстанавливающих условиях, средней молекулярной массы с использованием лазерного светорассеяния (LLS), продуктов разложения с использованием ОФ-ВЭЖХ и теоретической активности с использованием цистамина/катионообменной хроматографии (CEX). Осмоляльность и вязкость определяли после перерастворения 3:1 водой для инъекции в начальной временной точке (таблица 13).
|
Значения осмоляльности были в пределах критериев соответствия ЕвроФарм выше 240 мосмоль/кг, и результаты вязкости в приемлемом диапазоне 10 мПа*сек. Данные 12-месячного исследования стабильности образцов, хранимых в реальных температурных условиях, показали отсутствие различия в профиле чистоты между препаратами с разными стабилизаторами. Не наблюдали значимого различия между препаратами в появлении осадка лиофилизата и pH при хранении, однако в случае препарата, содержащего маннит, наблюдали немного более продолжительное время перерастворения по сравнению с другими (6 минут по сравнению с 3 минутами). Содержание влаги возрастало примерно от 0,2% до 0,4% независимо от препарата (данные не показаны). Доля агрегатов при эксклюзионной ВЭЖХ увеличивалась примерно с 0,9% до 1,4%, тогда как продукты разложения были ниже предела количественного определения (данные не показаны). Средняя молекулярная масса AIN457 оставалась неизменной после хранения, приблизительно 155 кД. Исходные суммарные уровни видов, наблюдаемых при ОФ-ВЭЖХ, составляли приблизительно 8,5-10% со значимым увеличением до 14,6% после 12-месячного хранение при 5°C (данные не показаны). Следует подчеркнуть, что такие уровни достигали плато, начиная с 1 месяца хранения и далее. Активность AIN457, определяемая с использованием цистамина/катионообменной хроматографии (CEX), сохранялась на уровне 98-99% (данные не показаны). Данные о 6-месячной стабильности образцов, которые хранили в условиях повышенной и стрессовой температуры показали, что препарат, содержащий сахарозу+маннит, явно отличался от других самым длительным временем перерастворения (6 минут по сравнению с 3 минутами), самым высоким уровням продуктов агрегации и образованием продуктов разложения, определяемых посредством ОФ-ВЭЖХ, при хранении. Не наблюдали значимых отличий препаратов в появлении осадка лиофилизата и pH при хранении. Содержание влаги возрастало примерно с 0,2% до 0,6-0,7% независимо от композиции после 6-месячного хранения при 40°C (данные не показаны). В препарате, содержащем сахарозу, наблюдали более низкий уровень агрегации, чем в других препаратах, содержащих дополнительно маннит, глицин и аргинин HCl (5,2% по сравнению с 5,8-6,8% по данным эксклюзионной ВЭЖХ). В случае всех препаратов уровень продуктов распада был ниже предела количественного определения (данные не показаны). Средняя молекулярная масса AIN457 сохранялась неизменной после 6-месячного хранения при 40°C, примерно 160 кД. Суммарное уровни продуктов распада по данным ОФ-ВЭЖХ было немного ниже в препарате, основанном только на сахарозе или с аргинином HCl, до 31,0% и 31,4% по сравнению с 32,8 и 35,6% в двух других препаратах после 6-месячного хранения при 40°C (данные не показаны). Активность AIN457, определяемая с использованием цистамина-CEX сохранялась на уровне 94-95% (данные не показаны).
Результаты исследования показали, что препарат, который перед лиофилизации был получен на основе 90 мМ сахарозы в концентрации 50 мг/мл в 10 мМ гистидине, 0,02% полисорбате 80, pH 5,8, был наиболее подходящим кандидатом для продаваемого на рынке препарата, содержащего 150 мг/мл AIN457, 30 мМ L-гистидиновый буфер, pH 5,8, 270 мМ сахарозу и 0,06% полисорбат 80, после перерастворения 3:1 в 1,0 мл воды для инъекций.