Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА, ОБЛАДАЮЩЕГО АДАПТОГЕННЫМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
Изобретение относится к области фармации и касается способа получения средства из растительного сырья, обладающего адаптогенным действием.
Известны способы получения жидких экстрактов из астрагала эспарцетолистного и астрагала серпоплодного, обладающих стимулирующим действием на ЦНС [1, 2]. Недостатками известных методов являются использование в качестве носителя фармакологических свойств малоконцентрированных лекарственных форм из растительных объектов (жидких экстрактов), что обуславливает значительно более низкую выраженность фармакологических эффектов. Более того, для производства жидких лекарственных форм характерна значительная длительность технологического процесса (5-14 дней), а применение жидких экстрактов не позволяет использовать их для создания комбинированных препаратов вследствие отсутствия возможности точного дозирования и хранения. Следует также отметить, что для указанных видов астрагала характерна более низкая концентрация действующих веществ (тритерпенов, аминокислот, флавоноидов), чем для широко распространенного в России астрагала перепончатого, что, в свою очередь, также оказывает влияние на активность конечных препаратов.
Задачей изобретения является повышение адаптогенного, стимулирующего действия средства за счет более высокого содержания действующих веществ (тритерпенов, аминокислот, флавоноидов).
Технический результат изобретения (получение сухого экстракта из корней астрагала перепончатого - Astragalus membranaceus (Fisch.) Bunge, семейство Бобовые) достигается за счет использования в ходе технологического процесса ультразвуковой экстракции растительного сырья.
Для достижения указанного технического результата измельченный растительный материал (корни астрагала перепончатого) заливают 60% этанолом в соотношении сырье : экстрагент 1:(8-10) и подвергают смесь ультразвуковой обработке частотой 50 кГц в течение 20-30 мин. Далее к смеси приливают 55-65% этанол до соотношения сырье : экстрагент 1:(18-20) и экстрагируют при температуре 85-90°C в течение 80-100 мин. Извлечение фильтруют в сборник. Экстракцию повторяют в тех же условиях еще один раз. Спиртовые извлечения объединяют и концентрируют до 1/40 от первоначального объема. Сгущенный экстракт высушивают в вакуум-сушильном шкафу и измельчают на мельнице пропеллерного типа. Выход готового продукта (сухого экстракта) составляет 23-25% от массы растительного сырья.
Выявленные отличительные признаки позволяют сделать вывод о соответствии предлагаемого технологического решения критерию “новизна”.
Предложенный способ позволяет получить сухой экстракт (далее - средство) в виде рассыпчатого негигроскопичного порошка желтовато-коричневого цвета со сладковатым вкусом и специфическим приятным запахом. Потеря массы при высушивании - 6-7%.
Способ иллюстрируется нижеследующими примерами.
Пример 1. 1.1 кг корней астрагала перепончатого измельчают на мельнице до размера частиц диаметром 2-3 мм. 1 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 10 л 60% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме в течение 15 мин. После этого ультразвуковой процессор удаляют и загружают в аппарат еще 10 л 60% этанола. Экстрагируют при температуре 85-90°C и периодическом помешивании в течение 90 мин. Извлечение фильтруют в сборник. Проводят еще одну экстракцию в тех же условиях, подавая в экстрактор 60% этанол в количестве, равном объему слитого (1 слив - 17.2 л, 2 слив - 17.1 л). Объединенные спиртовые извлечения упаривают примерно до 1/40 от первоначального объема и сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 5 часов и измельчают на мельнице пропеллерного типа. Получают 0.253 кг готового продукта, что составляет 25.3% экстрактивных веществ от массы исходного сырья. Сухой экстракт представляет собой рассыпчатый негигроскопичный порошок, цвет от светло-коричневого до коричневого, запах специфический, приятный, вкус - сладковатый. Потеря массы при высушивании составляет 6.27%.
Пример 2. 1.1 кг корней астрагала перепончатого измельчают на мельнице до размера частиц диаметром 2-3 мм. 1 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 9 л 65% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме в течение 20 мин. После этого ультразвуковой процессор удаляют и загружают в аппарат еще 11 л 65% этанола. Экстрагируют при температуре 85-90°C и периодическом помешивании в течение 100 мин. Извлечение фильтруют в сборник. Проводят еще одну экстракцию в тех же условиях, подавая в экстрактор 65% этанол в количестве, равном объему слитого (1 слив - 17.0 л, 2 слив - 16.8 л). Объединенные спиртовые извлечения упаривают примерно до 1/40 от первоначального объема и сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 5 часов и измельчают на мельнице пропеллерного типа. Получают 0.231 кг готового продукта, что составляет 23.1% экстрактивных веществ от массы исходного сырья. Потеря массы при высушивании составляет 6.70%.
Пример 3. 1.1 кг корней астрагала перепончатого измельчают на мельнице до размера частиц диаметром 2-3 мм. 1 кг измельченного сырья загружают в экстракционный аппарат с мешалкой и внешним паровым обогревателем и заливают 10 л 55% этанола. Полученную смесь перемешивают, вносят стержневой ультразвуковой процессор и обрабатывают смесь ультразвуком мощностью 50 кГц в импульсном режиме в течение 20 мин. После этого ультразвуковой процессор удаляют и загружают в аппарат еще 8 л 55% этанола. Экстрагируют при температуре 85-90°C и периодическом помешивании в течение 80 мин. Извлечение фильтруют в сборник. Проводят еще одну экстракцию в тех же условиях, подавая в экстрактор 55% этанол в количестве, равном объему слитого (1 слив - 15.5 л, 2 слив - 15.7 л). Объединенные спиртовые извлечения упаривают примерно до 1/40 от первоначального объема и сушат в вакуум-сушильном шкафу при температуре 55°C и давлении 0.1 атм в течение 5 часов и измельчают на мельнице пропеллерного типа. Получают 0.245 кг готового продукта, что составляет 24.5% экстрактивных веществ от массы исходного сырья. Потеря массы при высушивании составляет 6.23%.
Химический состав средства
Для проведения качественного и количественного анализа средства был использован комплекс спектральных (спектрофотометрия) и хроматографических методов (ВЭЖХ, ВЭТСХ). Экспериментальные условия приведены ниже.
Тритерпеновые соединения. ВЭЖХ. 1 г средства переносили в пробирку с притертой пробкой, приливали по 5 мл воды и бутанола, сильно встряхивали смесь до полного распределения средства между фазами. Органический слой отбирали, концентрировали в вакууме досуха, сухой остаток растворяли в 3 мл метанола и выливали по каплям в 20 мл охлажденной (0°C) смеси диэтилового эфира и ацетона (1:1). Выпавший осадок центрифугировали, растворяли в 1 мл метанола, фильтровали через кварцевый фильтр Millipore (ø0.45 мкм) и использовали для анализа методом микроколоночной ВЭЖХ-УФ. Условия ВЭЖХ-УФ: жидкостный хроматограф Милихром А-02 (Эконова); колонка ProntoSIL-120-5-C18 AQ (2×75 мм, ø5 мкм; Metrohm AG); подвижная фаза: (4.1 М LiClO4 в 0.1 М HClO4):H2O 5:95 (A), MeCN (В); градиентный режим B в A: 10% (0-2.5 мин), 10-20% (2.5-7.5 мин), 20-25% (7.5-12.5 мин), 25-33% (12.5-17.5 мин), 33-35% (17.5-22.5 мин), 35-60% (22.5-30 мин); ν 100 мкл/мин; Тколонки 40°C; Vпробы 2 мкл; детектор при 210 нм. В качестве внешних стандартов использовали растворы индивидуальных соединений с известной концентрацией. Чистота соединений по данным ВЭЖХ составляла не менее 95%. Суммарная погрешность измерений не превышала 5%. ВЭТСХ. Использовали пластины Сорбфил ПТСХ-АФ-В (Имид Ltd.) размером 15×10 см. Исследуемый раствор и растворы стандартных образцов тритерпенов (2 мкл) наносили микрошприцем на стартовую линию полосами длиной 8 мм. Далее хроматограмму помещали в предварительно насыщенную в течение 20 мин в системе растворителей (этилацетат - метанол - вода 10:1.35:1) вертикальную хроматографическую камеру и хроматографировали при 20°C на высоту 60 мм, после чего пластины просушивали в потоке холодного воздуха в течение 10 мин. Полученные хроматограммы обрабатывали методом погружения 1% раствором ванилина в смеси 95% спирт этиловый - кислота серная (10:1) и высушивали на термостолике при 105°C в течение 10 мин.
Изофлавоны. ВЭЖХ. Условия ВЭЖХ аналогичны таковым для тритерпенов, кроме длины волны детектора - 270 нм. ВЭТСХ. 200 мг средства переносили в колбу со шлифом вместимостью 50 мл, приливали 10 мл этилацетата, перемешивали и обрабатывали ультразвуком в импульсном режиме с частотой 50 кГц в течение 20 мин. После этого извлечение отфильтровывали и концентрировали в вакууме досуха. Сухой остаток растворяли в 300 мкл метанола и использовали для анализа. Общие условия анализа аналогичны таковым для тритерпенов, кроме системы растворителей - толуол - этилацетат - 85% кислота муравьиная (5:4:1), а также детектора - 0.5% раствор 2-аминоэтилдифенилборината в этилацетате и 5% раствор полиэтиленгликоля 400 в 1,2-дихлорэтане.
Аминокислоты. ВЭЖХ. Пробоподготовку проводили согласно аттестованной методике [3]. Условия ВЭЖХ-УФ: микроколоночный жидкостный хроматограф Милихром А-02 (Эконова); колонка ProntoSIL-120-5-C18 AQ (2×75 мм, ø5 мкм; Metrohm AG); подвижная фаза: (1 М CH3COONH4, pH 5.25):H2O 5:95 (А), (1 М CH3COONH4, pH 6.50):MeCN:H2O 1:7:12 (В); градиентный режим: 0-12 мин линейный градиент 0-6 мин 0-12% В, 6-21 мин 12-65% В, изократический режим 21-30 мин 100% В; ν 150 мкл/мин; Тколонки 60°C; Vпробы 2 мкл, λ 246 и 260 нм.
Углеводы. Состав свободных углеводов определяли методом микроколоночной ВЭЖХ [4], количественное содержание - антроновым методом [5].
Согласно данным ВЭЖХ и ВЭТСХ в составе средства обнаружено присутствие тритерпенов - астрагалозидов I, II, III и IV, изофлавонов - каликозина, каликозин-7-O-глюкозида и формононетина. Суммарное содержание тритерпенов в средстве составляет 52-98 мг %, изофлавонов - 28-49 мг %. Исследование состава аминокислот показало наличие 23 соединений, в т.ч. доминирующих аспарагина (5.67%), пролина (2.94%), глицина (1.22%), глутамина (1.04%), аргинина (0.95%), аланина (0.67%), и минорных (менее 0.2%) аспарагиновой кислоты, бетаина, цистеина, гамма-аминомасляной кислоты, глутаминовой кислоты, гистидина, изолейцина, лейцина, лизина, метионина, гидроксипролина, фенилаланина, серина, треонина, триптофана, тирозина и валина. Свободные углеводы средства представлены четырьмя доминирующими соединениями - сахарозой (27-32%), глюкозой (2-4%), фруктозой (0.5-0.7%) и галактозой (0.22-0.24%).
Количественный анализ и показатели качества средства
Для проведения количественного анализа средства разработана методика определения суммарного содержания аминокислот с применением спектрофотометрической методики, использующей модифицированный нингидриновый метод. Методика основана на способности ациклических аминокислот в нейтральной среде образовывать окрашенный комплекс с нингидрином (пурпурный Руэмана), обладающий максимумом поглощения в видимой области спектра при 568 нм. Для определения содержания гетероциклических аминокислот (пролин, гидроксипролин, триптофан, гистидин), дающих комплексы иного состава (максимумы поглощения 400-420 нм), предложено проведение реакции в кислой среде, в которой образование пурпурного Руэмана не происходит, что позволяет определять содержание только данной группы аминокислот. В качестве рабочих стандартных образцов (РСО) выбраны аспарагин и пролин - доминирующие компоненты в составе групп ациклических и гетероциклических аминокислот.
Методика. Около 0.1 г (точная навеска) средства помещают в колбу со шлифом вместимостью 50 мл, приливают 5 мл 95% этанола и 20 мл воды, присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 15 мин. После охлаждения содержимое колбы фильтруют в мерную колбу вместимостью 10 мл и доводят объем раствора до метки водой (раствор A). По 0.5 мл раствора A переносят в 2 пробирки вместимостью 25 мл, приливают 1 мл воды и 1 мл реактива. В первую пробирку вносят 0.2 мл воды, во вторую - 0.2 мл кислоты уксусной концентрированной. Обе пробирки нагревают на водяной бане при 90°C в течение 30 мин. После охлаждения реакционные смеси переносят в мерные колбы вместимостью 25 мл водой (первая пробирка) и 95% этанолом (вторая пробирка) и доводят до метки теми же растворителями (растворы Б1 и Б2). Оптическую плотность раствора Б1 измеряют при длине волны 568 нм, раствора Б2 - при 410 нм. В качестве раствора сравнения используют воду (первая пробирка) и 70% этанол (вторая пробирка).
Суммарное содержание ациклических аминокислот в пересчете на аспарагин в средстве в процентах (Х1) вычисляют по формуле:
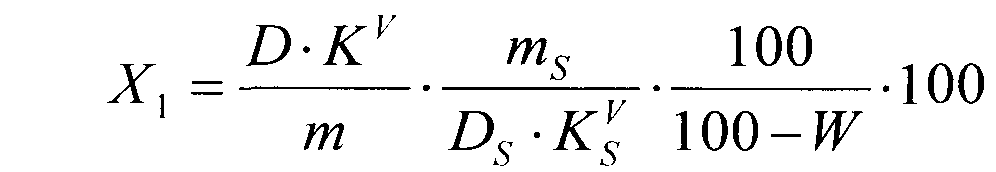 ,
,
где D - оптическая плотность раствора Б1; KV - коэффициент разбавления исследуемого раствора (1250); m - масса навески средства, г; DS - оптическая плотность раствора РСО аспарагина; 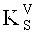 - коэффициент разбавления раствора РСО аспарагина (625); mS - масса навески РСО аспарагина, г; W - потеря в массе при высушивании средства, %.
- коэффициент разбавления раствора РСО аспарагина (625); mS - масса навески РСО аспарагина, г; W - потеря в массе при высушивании средства, %.
Суммарное содержание гетероциклических аминокислот в пересчете на пролин в средстве в процентах (Х2) вычисляют по формуле:
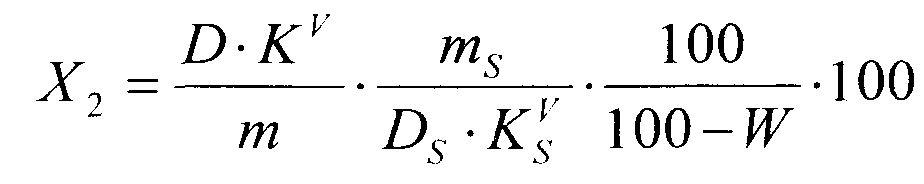 ,
,
где D - оптическая плотность раствора Б2; KV - коэффициент разбавления исследуемого раствора (1250); m - масса навески средства, г; DS - оптическая плотность раствора РСО пролина; 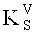 - коэффициент разбавления раствора РСО пролина (625); mS - масса навески РСО пролина, г; W - потеря в массе при высушивании средства, %.
- коэффициент разбавления раствора РСО пролина (625); mS - масса навески РСО пролина, г; W - потеря в массе при высушивании средства, %.
Суммарное содержание аминокислот в средстве в процентах (X) вычисляют по формуле: X=X1+X2.
Приготовление РСО аспарагина. 10 мг аспарагина (точная навеска) переносят в мерную колбу вместимостью 25 мл, растворяют в 10 мл воды и доводят объем раствора до метки тем же растворителем (раствор А). 1 мл раствора А переносят в пробирку вместимостью 10 мл, приливают 1 мл воды, 1 мл реактива и нагревают на водяной бане при 90°C в течение 30 мин. После охлаждения реакционную смесь переносят в мерную колбу вместимостью 25 мл водой и доводят объем раствора до метки водой (раствор Б). Оптическую плотность раствора Б измеряют при длине волны 568 нм.
Приготовление РСО пролина. 20 мг пролина (точная навеска) переносят в мерную колбу вместимостью 25 мл, растворяют в 10 мл воды и доводят объем раствора до метки тем же растворителем (раствор A). 1 мл раствора A переносят в пробирку вместимостью 10 мл, приливают 1 мл воды, 1 мл реактива, 100 мкл кислоты уксусной концентрированной и нагревают на водяной бане при 90°C в течение 30 мин. После охлаждения реакционную смесь переносят в мерную колбу вместимостью 25 мл водой и доводят объем раствора до метки 70% этанолом (раствор Б). Оптическую плотность раствора Б измеряют при длине волны 410 нм.
Приготовление реактива. 1 г нингидрина переносят в мерную колбу вместимостью 100 мл, растворяют в 20 мл 95% этанола и доводят объем раствора до метки тем же растворителем.
В таблице 1 приведены результаты метрологического анализа разработанной методики.

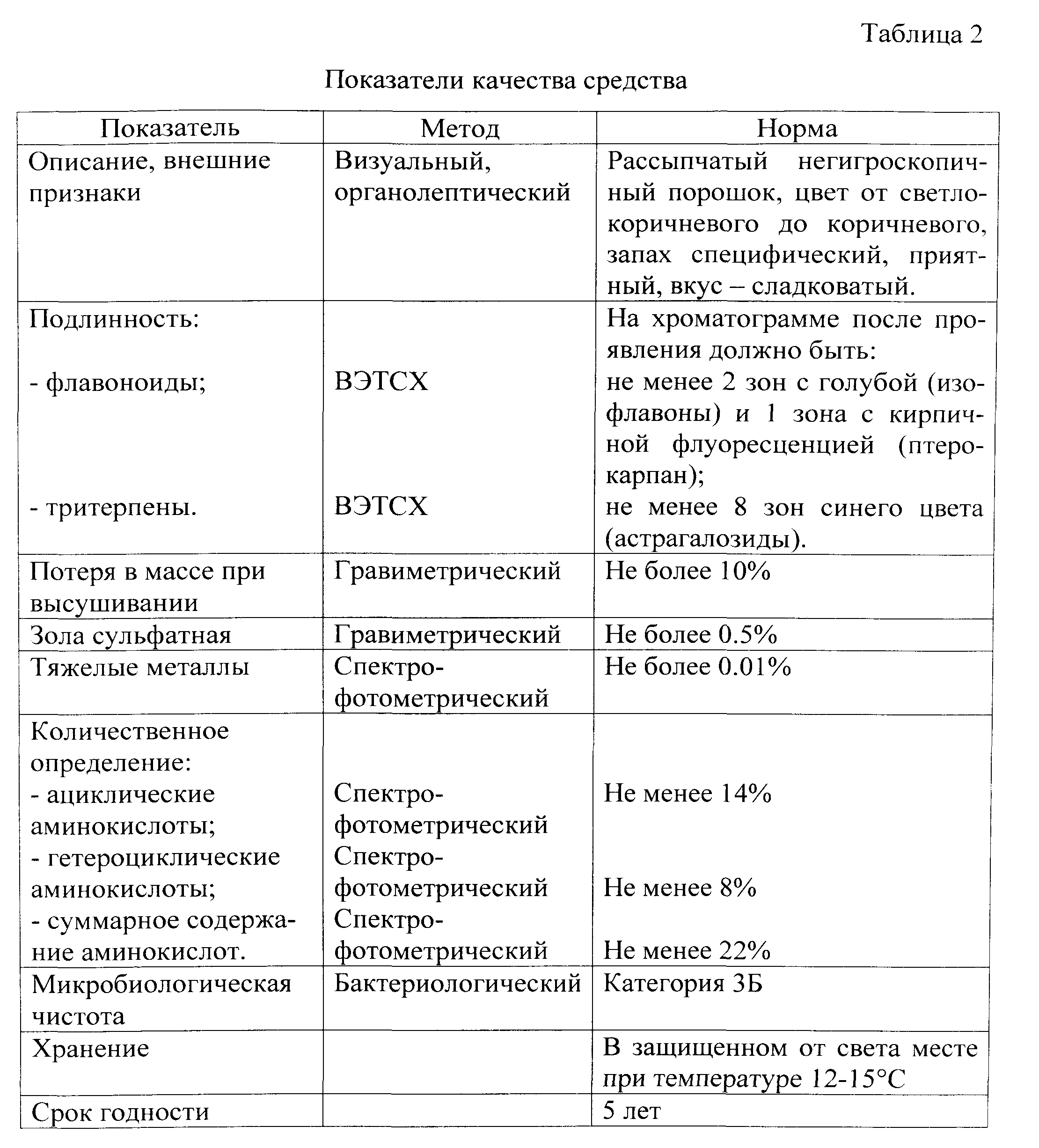
Исследования 10 серий средства показали, что содержание ациклических аминокислот может составлять 15.19-19.35%, гетероциклических аминокислот - 8.93-10.68%, суммарное содержание аминокислот - 22.98-28.54%. В таблице 2 приведены показатели качества средства.
Предлагаемый способ, по сравнению с известным, позволяет получить препарат постоянного состава с более выраженной активностью за счет более высокого содержания действующих веществ (тритерпенов, аминокислот, флавоноидов).
Рассчитать экономическую целесообразность предлагаемого способа в настоящее время не представляется возможным, однако вышеуказанные преимущества в сочетании с простой схемой получения способствуют рациональному использованию лекарственного растительного сырья и определяют перспективность внедрения данного способа в фармацевтическую промышленность.
Фармакотерапевтические свойства средства
Острая токсичность средства. Опыты проведены на крысах-самцах линии Wistar массой 180-190 г. Острую токсичность средства оценивали с использованием метода Кербера [6] при однократном внутрибрюшинном введении в дозах 500-5000 г/кг и внутрижелудочном введении в дозах 1000-6000 мг/кг. Все испытанные дозы доводили дистиллированной водой до конечного объема, составляющего 1.0 мл / 100 г массы животного. Наблюдение за общим состоянием подопытных крыс и их поведением осуществляли в течение 14 дней. При этом в первый день после введения указанных средств животные находились под постоянным наблюдением. Регистрировали наблюдаемые признаки интоксикации: общее состояние животных, поведение, двигательную активность, характер дыхательных движений, состояние волосяного и кожного покрова, окраску слизистых оболочек, потребление корма и воды, количество и консистенцию фекальных масс, частоту мочеиспускания и окраску мочи. Также регистрировали сроки развития интоксикации и гибели животных. На 14 сутки эксперимента осуществляли эвтаназию под эфирным наркозом и проводили макроскопический осмотр внутренних органов с помощью бинокулярной лупы, а также осуществляли патоморфологическое исследование жизненно важных органов.
Установлено, что при внутрижелудочном и внутрибрюшинном введении средства во всех исследованных дозах гибели животных в течение всего периода наблюдения не отмечалось. При внутрибрюшинном введении наиболее высоких доз испытуемого средства (2000-5000 мкг/кг) в течение 1-2 суток наблюдали видимые признаки интоксикации животных в виде гиподинамии, снижения аппетита, учащения дыхания. Вскрытие животных, осуществленное через 14 суток, показало, что визуально внутренние органы не отличались от таковых у интактных крыс; при патоморфологическом исследовании у животных, получавших средство в высоких дозах, отмечали нарушения гемодинамики в виде полнокровия сосудов, а также единичные мелкоточечные кровоизлияния в слизистой оболочке желудка.
Таким образом, полученные данные позволяют отнести испытуемое средство к группе малотоксичных веществ по классификации К.К. Сидорова [7].
Влияние средства на поведенческую активность животных. Эксперименты проведены на крысах линии Wistar массой 160-180 г. Влияние средства на ориентировочно-исследовательскую реакцию и поведенческую активность исследовали с использованием метода «открытое поле» [8]. Животным опытных групп средство вводили внутрижелудочно в дозах 50, 100 и 150 мг/кг объеме 10 мл/кг в течение 7 дней до тестирования. Крысам контрольной группы вводили эквиобъемное количество дистиллированной воды. В качестве препарата сравнения использовали деалкоголизированный раствор экстракта элеутерококка в объеме 5.0 мл/кг. С целью оценки ориентировочно-исследовательской активности и эмоционального поведения животных регистрировали горизонтальную активность (число пересеченных квадратов), вертикальную активность (число подъемов на задние лапки), норковый рефлекс (число заглядываний в норки), дефекацию (количество фекальных шариков), груминг (количество умывающих движений), количество выходов в центральную зону. Об общей двигательной активности судили по сумме вертикального, горизонтального компонентов и норковому рефлексу.
Установлено, что помещение животных в экспериментальную камеру «открытое поле» приводило к повышению общей двигательной активности с преимущественным увеличением горизонтального компонента и пребыванием в периферических квадратах, что свидетельствует о высоком уровне эмоциональной активности в новых незнакомых условиях (табл.3). По мере освоения животные начинали посещать центральные квадраты камеры, причем на 3-й минуте тестирования у животных существенно возрастала вертикальная активность и норковый рефлекс. Достаточно высокое число болюсов (фекальных шариков) указывает на высокую эмоциональную реакцию, выраженное чувство страха, переживаемого животным.
У животных, получавших средство в дозах 50 и 100 мг/кг, при помещении их в незнакомые условия отмечалось существенное повышение общей двигательной активности (почти в три раза по сравнению с контролем). При этом повышение двигательной активности у животных этих групп происходило, преимущественно, за счет увеличения вертикальной активности и норкового рефлекса (соответственно на 119 и 85%; 436 и 274% по сравнению с аналогичными показателями в контроле), что свидетельствует о том, что средство стимулирует ориентировочно-исследовательскую активность животных. На ускорение процесса адаптации под влиянием испытуемого средства и повышение исследовательской реакции указывает также существенное возрастание количества выходов животных в центральную зону камеры.
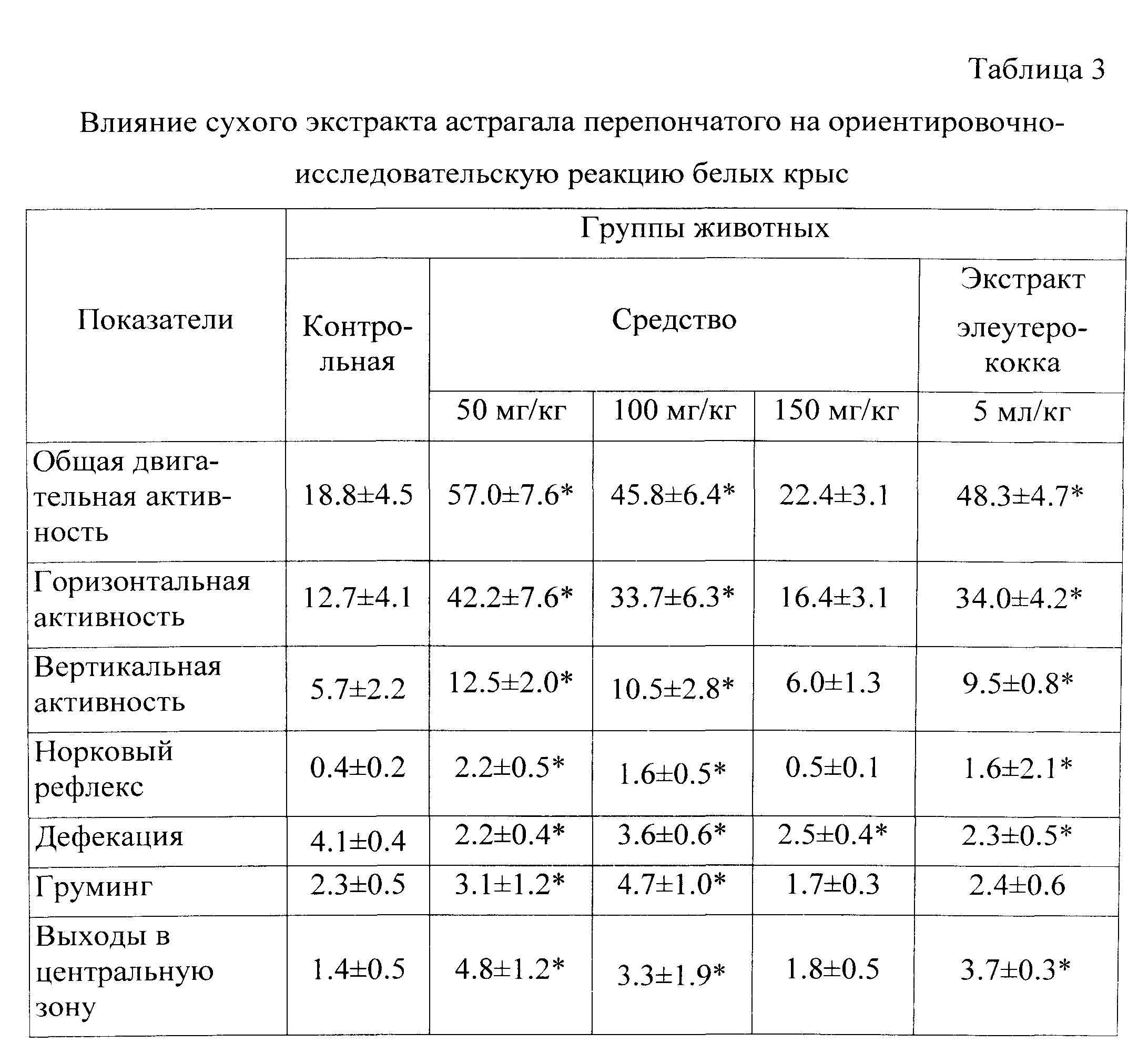
Наряду с этим, под влиянием средства в дозах 50 и 100 мг/кг отмечалось уменьшение числа болюсов (на 50 и 40%, соответственно), а также увеличение актов груминга (на 35 и 106%, соответственно), что указывает на ускорение периода адаптации к новым условиям, снижение уровня тревожности и возрастание приверженности к гигиеническим навыкам у животных опытной группы. При этом стимулирующая активность средства в дозе 50 мг/кг превышала действие экстракта элеутероккока, а использование его в дозе 100 мг/кг было аналогичным таковому у препарата сравнения. На фоне введения средства в дозе 150 мг/кг отмечалась несколько иная поведенческая картина: под его влиянием достоверно уменьшалось количество актов дефекации, тогда как все остальные показатели были на уровне данных животных контрольной группы.
Влияние средства на устойчивость животных к гипоксии. Эксперименты проведены на крысах линии Wistar массой 160-180 г. Антигипоксическую активность средства исследовали с использованием на моделях острой гемической, гистотоксической и нормобарической гипоксии с гиперкапнией. Модель гемической гипоксии воспроизводили путем однократного внутрибрюшинного введения нитрита натрия в дозе 70 мг/кг (LD50); гистотоксической гипоксии - однократным введением нитропруссида натрия 20 мг/кг (DL100); нормобарической гипоксии с гиперкапнией - путем помещения животных в герметически закрытые банки объемом 200 см3 [8]. Животным опытных групп средство вводили внутрижелудочно в дозах 50, 100 и 150 мг/кг в объеме 10 мл/кг профилактически в течение 7 дней до тестирования. Крысам контрольной группы вводили эквиобъемное количество дистиллированной воды. В качестве препарата сравнения использовали деалкоголизированный раствор экстракта элеутерококка в объеме 5.0 мл/кг. С целью оценки антигипоксической активности регистрировали латентный период, резервное время жизни и количество выживших животных в условиях гипоксии. Общая продолжительность наблюдения за животными составила две недели; в первые сутки после введения гипоксантов животные находились под непрерывным наблюдением.
Установлено, что средство обладает выраженным антигипоксическим действием, повышая выживаемость животных при гипоксиях различного генеза. Так, при гемической гипоксии курсовое введение испытуемого средства в дозе 50 мг/кг сопровождалось 100% выживаемостью животных при 50% гибели в контроле; а при введении его в дозах 100 и 150 мг/кг количество выживших крыс увеличилось в среднем на 80% по сравнению с показателями у животных контрольной группы (табл.4).
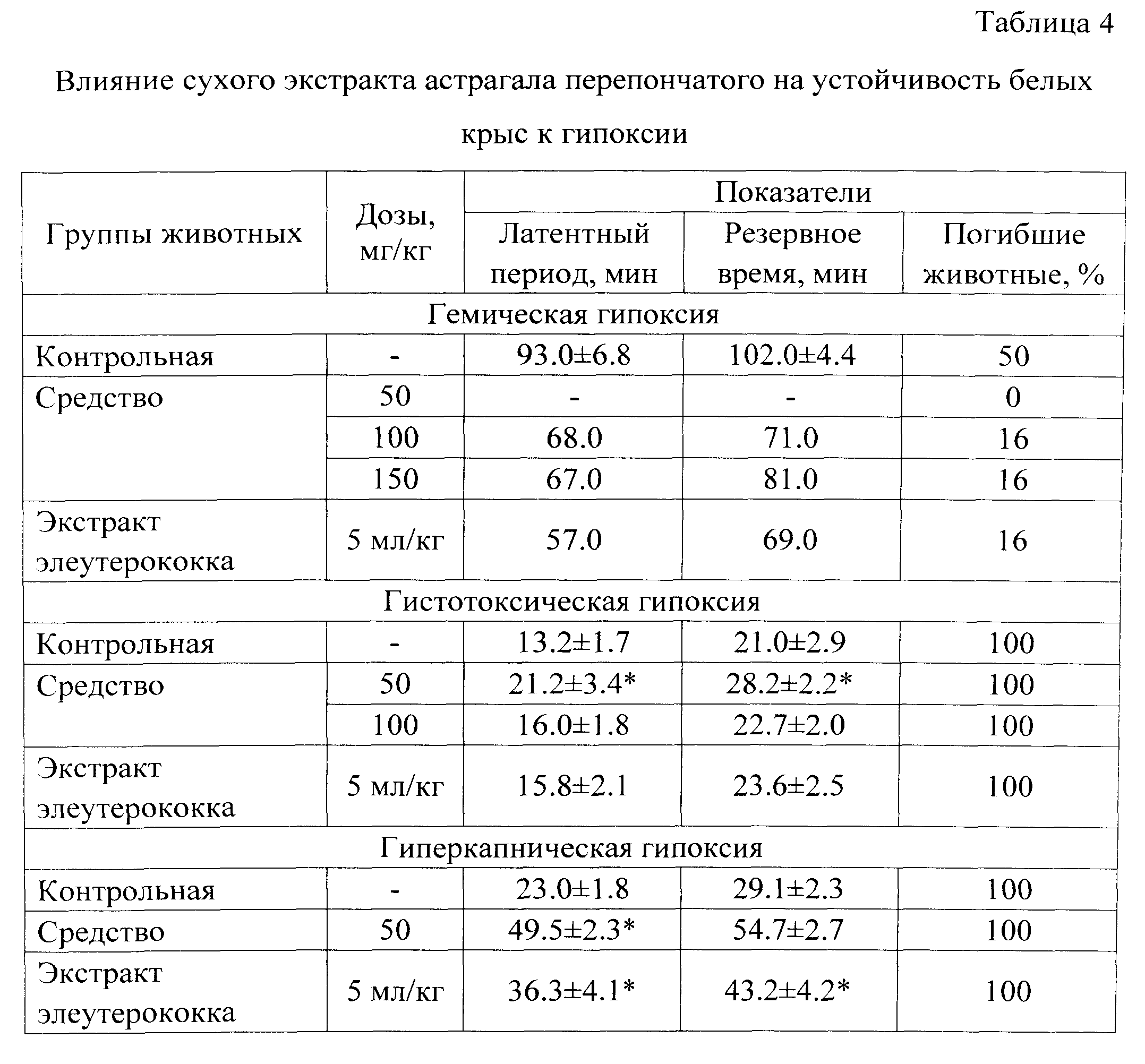
При гистотоксической гипоксии у крыс, получавших средство в дозе 50 мг/кг, отмечали увеличение длительности латентного периода жизни и резервного времени соответственно на 60 и 35% по сравнению с аналогичными данными крыс контрольной группы. При этом введение средства в дозе 100 мг/кг не оказывало статистически значимого влияния на указанные показатели. При нормобарической гипоксии с гиперкапнией введение средства сопровождалось двукратным увеличением латентного периода и продолжительности жизни животных.
Таким образом, установлено, что курсовое введение средства значительно повышает устойчивость лабораторных животных к гемической, гистотоксической гипоксии. Наиболее выраженные антигипоксические свойства средство проявляет в дозе 50 мг/кг при гемической гипоксии. При этом антигипоксическая активность средства в указанной дозе значительно превышает таковую у препарата сравнения. Кроме того, полученное средство обладает стимулирующей активностью, превышающей или равной (в зависимости от дозы) таковой препарата сравнения, и ускоряет процессы адаптации у подопытных животных, выражающиеся в повышении исследовательской реакции, снижении уровня тревожности и возрастании приверженности к гигиеническим навыкам.
Источники информации
1. Пшуков Ю.Г., Гужва Н.Н. Способ получения экстракта астрагала эспарцетолистного жидкого по ресурсосберегающей технологии. RU 2189240 МПК 7 A61K 35/78, B01D 11/02. Опубл. 20.09.2002. Бюлл. №32. 2003 г. - прототип.
2. Гужва Н.Н. Технология жидкого экстракта астрагала серпоплодного // Фармация. 2008. №6. С.40-42. - прототип.
3. ГСИ. Массовая концентрация основных аминокислот в водном растворе. Методика выполнения измерений методом высокоэффективной жидкостной хроматографии. МВИ №02-2002. Иркутск, 2002. 12 с.
4. Olennikov D.N., Tankhaeva L.M., Stolbikova A.V., Rokhin A.V. Glucofructanes from Saussurea lappa roots // Chemistry of Natural Compounds. 2011. Vol.47. №3. P.339-342.
5. Olennikov D.N., Tankhaeva L.M., Samuelsen A.B. Quantitative analysis of polysaccharides from Plantago major leaves using the Dreywood method // Chemistry of Natural Compounds. 2006. Vol.42. №3. P.265-268.
6. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М., 2000. 678 с.
7. Требования по доклиническому изучению общетоксического действия новых фармакологических веществ. М., 1984. 49 с.
8. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. МЗ РФ. Департамент контроля качества, эффективности и безопасности фармакологических средств. Фармакологический комитет МЗ РФ. 2 изд. перераб. и доп. М., 2005. С.138-145.
Способ получения средства, обладающего адаптогенным действием, из корней астрагала перепончатого путем экстрагирования растительного материала, отличающийся тем, что предварительно проводят ультразвуковую экстракцию измельченного растительного материала 55-65% этиловым спиртом в соотношении сырье:экстрагент 1:(8-10) в течение 20-30 мин, далее растительный материал экстрагируют дважды тем же экстрагентом в соотношении сырье:экстрагент 1:(18-20) при температуре 85-90°С в течение 80-100 мин, затем спиртовые извлечения объединяют и концентрируют до 1/40 от первоначального объема, сгущенный экстракт высушивают и измельчают.
