Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДА рСрG-СytDA/upp ДЛЯ ЭКСПРЕССИ ГИБРИДНОГО БЕЛКА ЦИТОЗИНДЕЗАМИНАЗА-УРАЦИЛФОСФОРИБОЗИЛ ТРАНСФЕРАЗА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА рСрG-СytDA/upp/VP22 ДЛЯ ЭКСПРЕССИИ ГИБРИДНОГО БЕЛКА ЦИТОЗИНДЕЗАМИНАЗА-УРАЦИЛФОСФОРИБОЗИЛ ТРАНСФЕРЕЗА-VP22, ЛЕЧЕБНАЯ КОМПОЗИЦИЯ ДЛЯ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Уровень техники
Несмотря на постоянный прогресс в области разработки новых антираковых средств и технологий их использования, существует целый ряд онкологических заболеваний, эффективность лечения которых с применением существующих методов остается крайне низкой, в частности, рак легкого, поджелудочной железы, пищевода, а также глиомы. Например, рак легкого является ведущей причиной смерти среди мужчин и женщин вследствие онкологических заболеваний. Наряду с совершенствованием классических подходов антираковой терапии существует острая необходимость поиска и проверки эффективности принципиально новых методов лечения раковых заболеваний. В экспериментальной генной терапии онкологических заболеваний одним из наиболее часто применяемых подходов является так называемая «суицидальная генная терапия». Она основана на использовании генов, кодирующих ферменты, которые превращают относительно нетоксичные для клеток организма субстраты в продукты, характеризующиеся высокой токсичностью, в том числе и для раковых клеток. К числу таких генов принадлежат тимидинкиназа, цитозиндезаминаза, и некоторые другие. При условии попадания экспрессирующих эти гены терапевтических конструкций в раковые клетки и одновременном введении соответствующего субстрата наступает гибель несущих эти конструкции клеток. Важно, что при этом гибнут также и соседние клетки (так называемый «эффект соседства» (bystander effect)).
Несколько лет назад было открыто новое важное свойство соматических стволовых клеток взрослого организма (далее - СК) - избирательный тропизм, то есть направленная миграция, к злокачественных новообразованиям и накопление в них (Aboody K.S., Brown A., Rainov N.G. et al. Neural stem cells display extensive tropism for pathology in adult brain: evidence from intracranial gliomas. Proc. Natl. Acad. Sci. USA. 2000 23: 12846-12851; Nakamizo A, Marini F, Amano T, et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 2005 65(8): 3307-18; Nakamizo A, Marini F, Amano T, Khan et al. Human bone marrow-derived mesenchymal stem cells in the treatment of gliomas. Cancer Res. 2005 65(8): 3307-18). Это свойство открывает перспективы создания новой стратегии антираковой терапии, основанной на использовании СК как средств доставки терапевтических молекул.
В литературе описано применение стволовых клеток с введенными в них генетическими конструкциями, экспрессирующими цитозиндезаминазу, для экспериментальной терапии опухолей. Хотя значительная часть этих работ выполнена с использованием нейральных стволовых клеток (Aboody K.S., Brown A., Rainov N.G. et al. Neural stem cells display extensive tropism for pathology in adult brain: evidence from intracranial gliomas. Proc. Natl. Acad. Sci. USA. 2000 23: 12846-12851), с точки зрения использования в практической медицины мезенхимальные стволовые/стромальные клетки (МСК) являются значительно более перспективным средством, так как их, в отличие от нейральных стволовых клеток, достаточно легко получать из пациентов, например, из костного мозга и жировой ткани, что делает возможным применение аутотрансплантации. Кроме того, в культуре эти клетки хорошо размножаются, что позволяет нарабатывать их в больших количествах, достаточных для их использования в качестве средства доставки цитозиндезаминазы или других белков с антираковой активностью в опухоли. Международным Обществом Клеточной Терапии рекомендован ряд признаков, определеяющих МСК человека (Dominici М, Le Blanc К, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006 8: 315-317.). Несколько работ в литературе описывают использование МСК, экспрессирующих цитозиндезаминазу, для экспериментальной терапии опухолей (Cavarretta IT, Altanerova V, Matuskova M et al. Adipose tissue-derived mesenchymal stem cells expressing prodrug-converting enzyme inhibit human prostate tumor growth. Mol Ther. 2010 18(1): 223-31). В этих работах для экспрессии цитозиндезаминазы были использованы интегрирующие ретровирусные или лентивирусные конструкции. Серьезными недостатками этих вирусных конструкций, однако, являются, во-первых, технологическая сложность получения инфекционных препаратов, во-вторых, риски трансформации клеток, связанные с интеграцией этих конструкций в геном, в-третьих, возможность возникновения иммунного ответа против вирусных компонентов, серьезно ограничивающая возможности повторного применения препаратов МСК, несущих такие конструкции, для терапии. В литературе есть примеры использования цитозиндезаминазы, слитой с белком вируса герпеса человека VP22, для которого описано свойство способствовать распространению слитых с ним белков между клетками, для генной терапии опухолей (Lee КС, Hamstra DA, Bullarayasamudram S, et al. Gene Ther. 2006 13(2): 127-37), однако не описано ни одного случая использования для терапии МСК, экспрессирующих слитый белок цитозиндезаминаза-VP22.
В качестве ближайшего по технической сущности аналога принята работа (You МН, Kim WJ, Shim W, Lee SR, Lee G, Choi S, Kim DY, Kim YM, Kim H, Han SU. Cytosine deaminase-producing human mesenchymal stem cells mediate an antitumor effect in a mouse xenograft model. J Gastroenterol Hepatol. 2009 24(8): 1393-400), в которой для экспрессии цитозиндезаминазы Е. coli в МСК использовалась плазмида на основе вектора pCDNA3.1(-) (Invitrogen). Введение плазмиды в этой работе проводилось с помощью трансфекции Липофектамином 2000, что, как известно специалистам в данной области, дает очень низкую эффективность трансфекции, не превышающую 5%. Кроме того, при использовании плазмид на основе вектора pCDNA3.1(-) и им подобных происходит быстрое падение во времени экспрессии нужных генов в МСК. Также, в названной работе МСК, содержащие экспрессирующую цитозиндезаминазу плазмиду, вводились непосредственно в кровоток. При данном способе введения МСК эффективность достижения ими опухоли невелика, поскольку подавляющая их часть задерживается в легких (Lee RH, Pulin АА, Seo MJ et al.. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6. Stem Cell. 2009 5: 54-63).
Технической задачей, решаемой авторами настоящего изобретения, являлось повышение эффективности и безопасности использования МСК, экспрессирующих цитозиндезаминазу, для терапии опухолей различных этиологий.
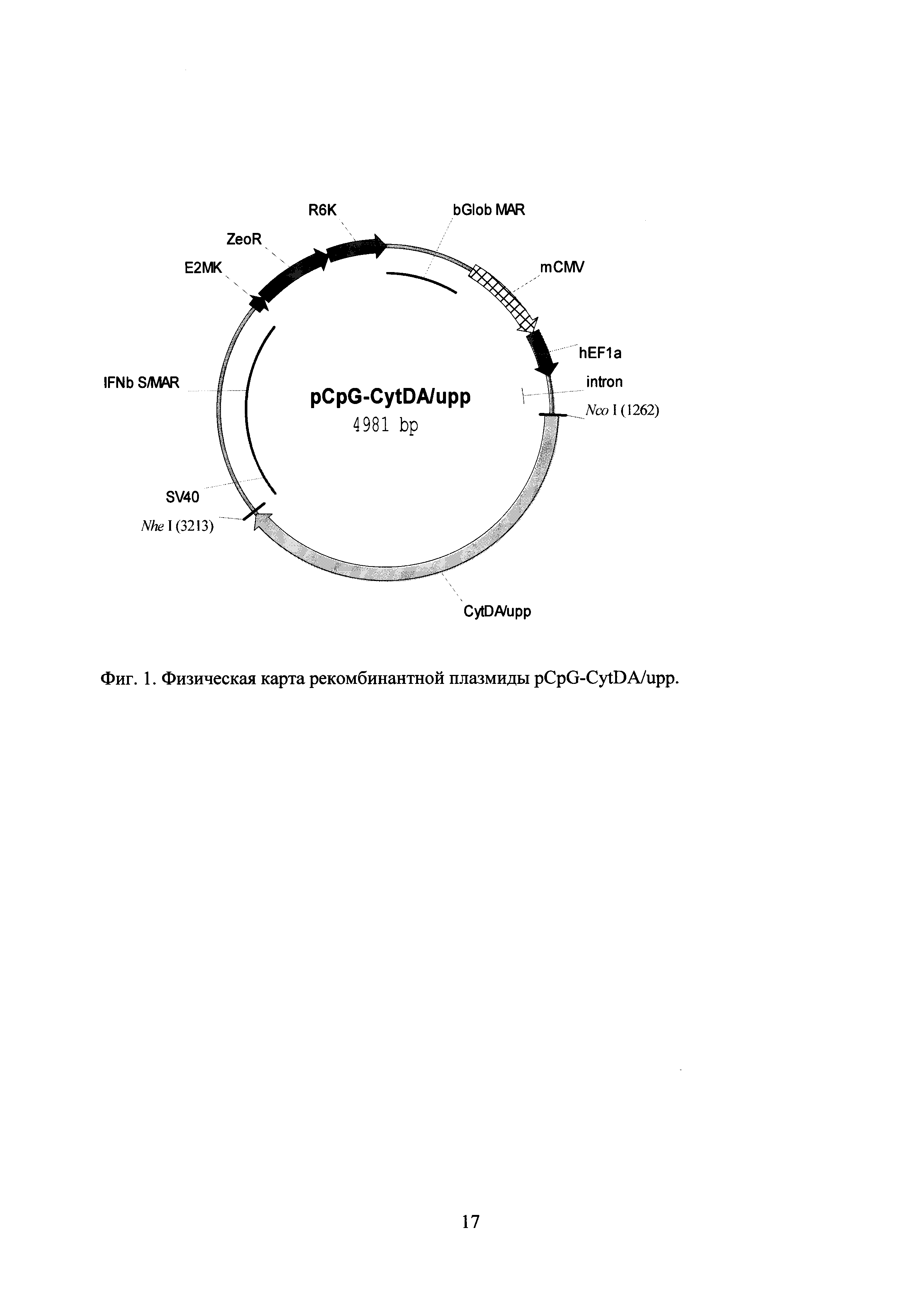
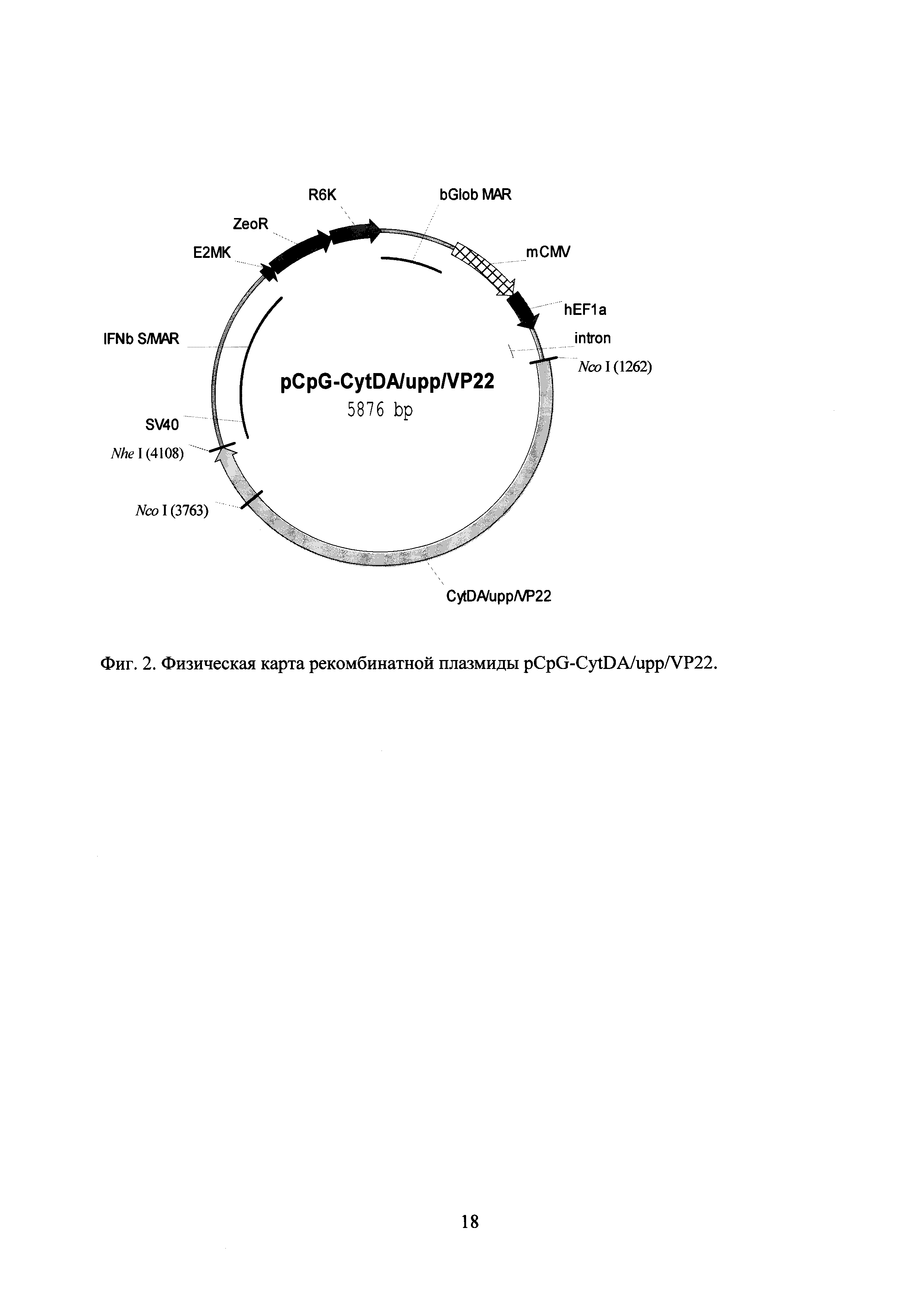
Технический результат достигается применением плазмиды pCpG-CyDA/upp для экспрессии в МСК гибридного белка цитозиндезаминазы Е. coli, слитой с урацилфосфорибозил трансферазой (далее - слитой цитозиндезаминазы), последовательность которой приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 1, а физическая карта - на фиг. 1. В другом варианте исполнения задача была решена применением плазмиды pCpG-CyDA/upp/VP22 для экспрессии в МСК гибридного белка слитой цитозиндезаминазы, слитой с белком VP22. Последовательность этой плазмиды приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 2, а физическая карта - на фиг. 2. Также задача была решена применением электропорации для более эффективного введения плазмиды в МСК. Кроме того, задача была решена применением введения МСК непосредственно в опухоли (интратуморальное введение). В результате было достигнута значительная эффективность применения МСК, экспрессирующих слитую цитозиндезаминазу, на экспериментальных моделях меланомы В16 мышей и аденокарциномы легких Льюис мышей. Еще более высокая эффективность была достигнута для МСК, экспрессирующих слитую цитозиндезаминазу-VP22.
Несмотря на то, что решение технической задачи изобретения было продемонстрировано только на примерах меланомы В16 и аденокарциномы Льюис мышей, данное решение применимо ко многим другим видам рака мышей и человека. Основанием для этого является универсальный механизм действия слитой цитозиндезаминазы, которая превращает вводимое в организм нетоксичное вещество 5-фторцитозин в высокотоксичный продукт 5-фторурацил, который необратимо ингибирует тимидилатсинтазу - фермент, необходимый для синтеза ДНК, что, в свою очередь, вызывает гибель быстроделящихся раковых клеток. 5-фторурацил, в частности, используется при химотерапии раков кожи, включая меланому, рака молочной железы, раков пищеварительного тракта, включая рак пищевода, рак желудка, рак поджелудочной железы и рак толстой и прямой кишки. Кроме того, 5-фторурацил применяется для химиотерапии таких онкологических заболеваний, как первичный рак печени, рак легкого, рак мочевого пузыря, предстательной железы, яичников, шейки матки, карцинома эндометрия и злокачественные опухоли головы и шеи, а также некоторые другие, менее распространенные виды онкологических заболеваний. Применение 5-фторурацила для терапии глиобластом затруднено наличием гематоэнцефалического барьера, однако в литературе описана эффективность использования для терапии глиобластом клеток, экспрессирующих цитозиндезаминазу, в варианте внутричерепного введения (Aboody KS, Najbauer J, Metz MZ et al. Neural stem cell-mediated enzyme/prodrug therapy for glioma: preclinical studies. Sci Transl Med. 2013 5: 184ra59), в том числе и в случае продолжительного внутричерепного введения 5-фторцитозина) (Altaner С, Altanerova V, Cihova М et al. Complete regression of glioblastoma by mesenchymal stem cells mediated prodrug gene therapy simulating clinical therapeutic scenario. Int J Cancer. 2014 134: 1458-65). Таким образом, возможность применения предложенного решения технической задачи изобретения для многочисленных других видов онкологических заболеваний человека является очевидной для специалиста.
Из литературы известны многочисленные примеры альтернативных путей введения МСК, в том числе и генетически модифицированных МСК, в организм, в том числе внутривенный, внутрибрюшинный и подкожный (например, Antitumor effects of TRAIL-expressing mesenchymal stromal cells in a mouse xenograft model of human mesothelioma. Lathrop MJ, Sage EK, Macura SL et al. Cancer Gene Ther. 2015 22: 44-54; Zou Z, Cai Y, Chen Y et al. Bone marrow-derived mesenchymal stem cells attenuate acute liver injury and regulate the expression of fibrinogen-like-protein 1 and signal transducer and activator of transcription 3. Mol Med Rep. 2015 12: 2089-97; Bahrambeigi V, Ahmadi N, Salehi R, Javanmard SH. Genetically modified murine adipose-derived mesenchymal stem cells producing interleukin-2 favor B16F10 melanoma cell proliferation. Immunol Invest. 2015 44: 216-36).
Таким образом, возможность применения сочетания интратуморального введения и вышеперечисленных альтернативных способов введения МСК в организм является очевидной для специалиста. Такое сочетание может дополнительно повысить эффективность использования МСК, экспрессирующих слитую цитозиндезаминазу, для терапии опухолей.
Эффективность предложенного технического решения зависит от того, какая доля МСК содержит вводимую плазмиду для экспрессии слитой цитозиндезаминазы, и может быть увеличена за счет повышения этой доли. Одним из способов достижения этой цели является осуществление селекции клеток, которые содержат вводимую плазмиду. В литературе имеются многочисленные примеры применения так называемой ко-трансфекции клеток двумя плазмидами, одна из которой экспрессирует маркер селекции (например, Kurtz DT. Hormonal inducibility of rat alpha 2u globulin genes in transfected mouse cells. Nature. 1981 291: 629-31). Этот подход основан на известном факте, что вероятность одновременного продуктивного (то есть приводящего к экспрессии трансгенов) попадания двух плазмид в одну клетку велика и значительно выше, чем теоретическая вероятность в случае случайного распределения плазмид после трансфекции. Ко-трансфекция упаковочных клеток двумя и более плазмидами используется постоянно при получении инфекционных вирусных частиц для дальнейшей трансдукции ими целевых клеток. Кроме того, способ ко-трансфекции клеток двумя плазмидами, одна из которых экспрессирует поверхностный белок, служащий для магнитной селекции трансфецированных клеток с помощью антител, конъюгированных с магнитными частицами, используется в коммерческом наборе MacSelect фирмы Miltenyi Biotec (Германия). Фирма Clontech (США) также производит плазмиды для ко-трансфекции и селекции клеток. Таким образом, для специалиста очевидна возможность одновременного введения в МСК вместе с плазмидой pCpG-CytDA/upp или плазмидой pCpG-CytDA/upp/VP22 другой плазмиды, обеспечивающей возможность селекции трансфецированных клеток.
Применение изобретения иллюстрировано на следующих примерах.
Пример 1. Создание плазмиды pCpG-CytDA/upp, экспрессирующей слитую цитозиндезаминазу.
Из плазмиды pCpG-mSEAP (InvivoGen) был вырезан фрагмент с помощью рестрикционных эндонуклеаз Xba I и Nhe I, и замещен двухцепочечным фрагментом, полученным отжигом олигонуклеотидов Ad#pCpG-S1 (CTAGACAATTGTACTAACCTTCTTCTCTTTCCTCTCCT), Ad#pCpG-Al (CAACCTGTCAGGAGAGGAAAGAGAAGAAGGTTAGTACAATTGT), Ad#pCpG-S3 (GACAGGTTGGTGTACAGGTACCATGGTACTTAG) и Ad#pCpG-A3 (CTAGCTAAGTACCATGGTACCTGTACAC). Отсутствие ошибок во встроенном фрагменте было проверено секвенированием. В полученную таким образом плазмиду по сайтам Nco I и Nhe I встроили кодирующий слитую цитозиндезаминазу фрагмент, вырезанный из плазмиды pORF-codA/upp (InvivoGen) с помощью рестрикционных эндонуклеаз Nco I и Nhe I. Нуклеотидная последовательность плазмиды pCpG-CytDA/upp приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 1.
Физическая карта этой плазмиды приведена на фиг. 1.
Пример 2. Создание плазмиды pCpG-CytDA/upp/VP22, экспрессирующей слитую цитозиндезаминазу-VP22.
Для создания промежуточной конструкции, содержащей кодирующую слитую цитозиндезаминазу последовательность без стоп-кодона, 3′-концевой участок открытой рамки слитой цитозиндезаминазы был амплифицирован из плазмиды pORF-codA/upp (InvivoGen) с помощью олигонуклеотидов CytDA/upp-S1 (GGAGCCGGTACCGTACTT) и CytDA/upp-A1 (ACATAGCTAGCGGATCCTTTCGTACCAAAGATTTTGTC). Этот фрагмент был далее встроен в плазмиду pCpG-CytDA/upp по сайтам Age I и Nhe I с заменой исходного 3′-концевого участка. Отсутствие ошибок во встроенном фрагменте было проверено секвенированием.
Для создания промежуточной конструкции, содержащей кодирующую белок VP22 последовательность, его открытая рамка была амплифицирована из плазмиды pVP22/myc-His (Invitrogen) с помощью олигонуклеотидов VP22-S2 (ACATAAGATCTGGATCCATGACCTCTCGCCGCTCC) и VP22-A2 (ACATAGCTAGCTCACTCGACGGGCCGTCTGGG), и встроена в плазмиду pSP73m, полученную модификацией плазмиды pSP73 (Promega), по сайтам Bg1 II и Nhe I. Отсутствие ошибок во встроенном фрагменте было проверено секвенированием. Для создания целевой плазмиды pCpG-CytDA/upp/VP22, фрагмент, кодирующий VP22 был вырезан из промежуточной плазмиды с помощью рестрикционных эндонуклеаз BamH I и Nhe I, и встроен в промежуточную плазмиду, содержащую слитую цитозиндезаминазу без стоп-кодона по тем же сайтам. Нуклеотидная последовательность плазмиды pCpG-CytDA/upp/VP22 приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 2.
Физическая карта этой плазмиды приведена на фиг. 2.
Пример 3. Получение и культивирование МСК из жировой ткани мышей.
МСК выделяли из подкожной жировой ткани мышей С56В16 в стерильных условиях. Для этого измельченную жировую ткань подвергали ферментной обработке в 0,2% растворе коллагеназы типа IV (Invitrogen) в течение 20-30 минут при 37°C при встряхивании. Полученную суспензию фильтровали через 100 мкм нейлоновое ситечко, 2 раза промывали в PBS. Клетки осаждали центрифугированием при 1200 об/мин в течение 20 минут и осадок ресуспендировали в ростовой среде. Осажденные клетки подсчитывали, переносили в чашки Петри и культивировали в среде DMEM/low glucose (Dulbecco), 10% телячья эмбриональная сыворотка, 2 мМ глутамина, 100 мкг/мл стрептомицина, 100 МЕ/мл пенициллина при 37°C, 5% СО2 и 21% О2. В опытах использовали 1-3 пассаж МСК.
Пример 4. Введение плазмиды в МСК с помощью электропорации.
Для проведения электропорации МСК культивировали до достижения монослоем 80% конфлюэнтности, после чего клетки снимали в 10% растворе трипсина-ЭДТА и 2 раза промывали в фосфатно-солевом буфере. Клетки подсчитывали и ресуспендировали в количестве 106 клеток в 200 мкл среды Opti-MEM (Gibco), содержащей 5 мкг плазмиды в ТЕ-буфере. Смесь инкубировали 20 минут и переносили в электропорационную кювету с зазором 2 мм. Электропорацию проводили с помощью электропоратора (BioRad) в экспоненциальном режиме с параметрами: напряжение - 90 В, емкость - 500 мкФ, сопротивление - бесконечность. Эффективность электропорации оценивали через сутки после электропорации на проточном цитофлуориметре по уровню экспрессии EGFP в контрольных МСК. В опыте использовали МСК, эффективность электропорации которых составляла не менее 25%.
Пример 5. Анализ противоопухолевой эффективности МСК, экспрессирующих слитую цитозиндезаминазу и слитую цитозиндезаминазу мыши-VP22, на модели меланомы В16 мышей и аденокарциномы легких Льюис мышей
Для трансплантации перевиваемых опухолей использовали мышей-самок линии С57В16 массой тела 18-22 г. Животных содержали в виварии с естественным освещением на брикетированном корме и постоянном доступе к воде. Меланому В16 перевивали на самках С57В16 подкожно взвесью опухолевых клеток по 30-60 мг в 0,3-0,5 мл питательной среды 199 (ПанЭко) на мышь. В опытах использовали 3 пассаж меланомы В16. Аденокарциному Льюис перевивали внутримышечно по 40 мг суспензии, и для эксперимента вводили самцам в количестве 50 мг на мышь.
Перед лечением мышей распределяли на группы. Одну группу оставляли без специфического лечения и считали контрольной. МСК вводили интратуморально по 106 клеток в смеси с 50 мкл стерильного фосфатно-солевого буфера на 6-7 сутки после трансплантации меланомы и на 8 сутки после трансплантации аденокарциномы Льюис после достижения объемов опухолей в среднем 400 мм. Субстрат для цитозиндезаминазы 5-фторцитозин (InvivoGen) начинали вводить в тот же день, через 4-8 часов после введения МСК, внутрибрюшинно в дозе 50 мг на 1 кг веса, и потом 1 раз в день в такой же дозе в течение 7-10 дней.
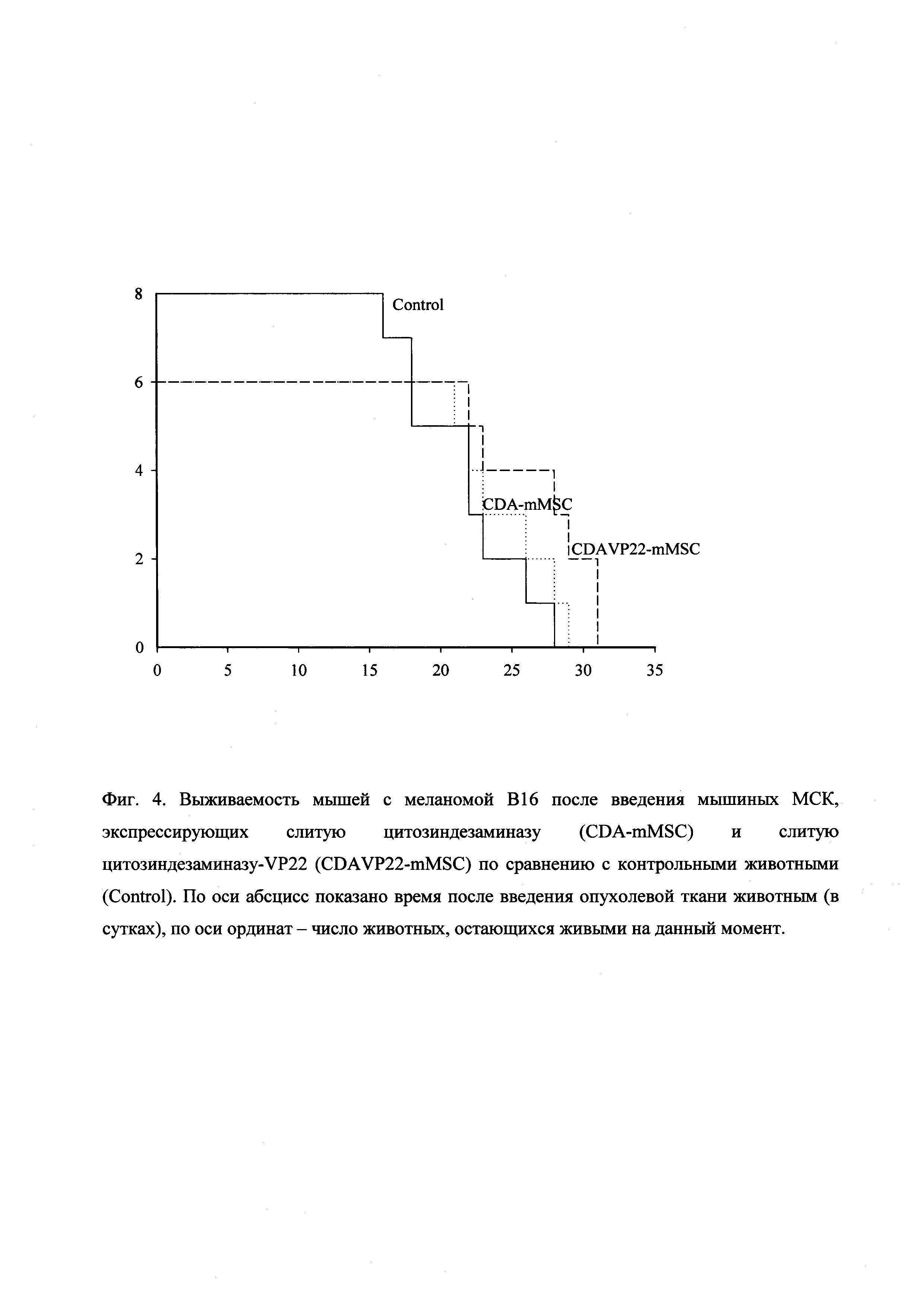
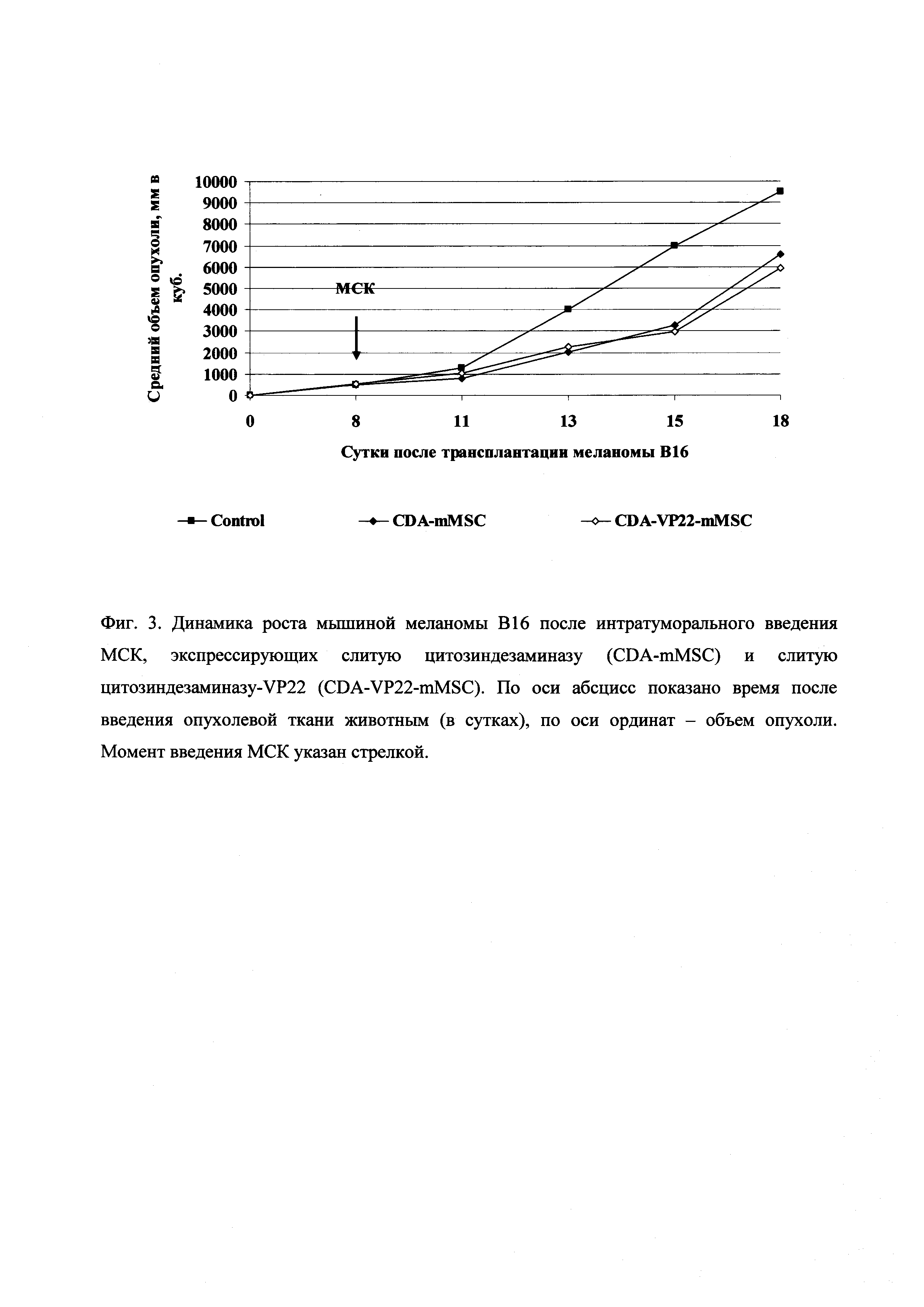
Эффективность лечения мышей с подкожно перевитой меланомой В16 и внутримышечно перевитой аденокарциномой Льюис оценивали по стандартным критериям: торможению роста опухоли (ТРО%), увеличению продолжительности жизни (УПЖ%) и излечению животных. Значимыми считали ТРО≥50%, УПЖ≥25%. Показатели эффективности определяли в сравнении с контрольными группами мышей. Эффект МСК, экспрессирующих слитую цитозиндезаминазу и слитую цитозиндезаминазу-VP22, на торможение роста меланомы В16 показан на фиг. 3, а их эффект на выживаемость мышей с меланомой В16 показан на фиг. 4. Количественные данные по эффектам МСК, экспрессирующих слитую цитозиндезаминазу и слитую цитозиндезаминазу-VP22, на меланому В16 показаны в Таблице 1. Количественные данные по эффектам МСК, экспрессирующих слитую цитозиндезаминазу и слитую цитозиндезаминазу-VP22, на аденокарциному Льюис показаны в Таблице 2.


Перечень последовательностей нуклеотидов
SEQ ID NO 1
<110> Karshieva S.S., Krasikova L.S., Belyavsky A.V.
<120> Рекомбинантная плазмида pCpG-CytDA/upp для экспрессии гибридного белка цитозиндезаминаза-урацилфосфорибозил трансфераза, рекомбинантная плазмида pCpG-CytDA/upp/VP22 для экспрессии гибридного белка цитозиндезаминаза-урацилфосфорибозил трансфераза-VP22, композиция для терапии онкологических заболеваний, и способ ее применения
160> 1
<210> 1
<211> 4981
<212> ДНК
<213> Искусственная последовательность
<400> 1



SEQ ID NO 2
<110> Karshieva S.S., Krasikova L.S., Belyavsky A.V.
<120> Рекомбинантная плазмида pCpG-CytDA/upp для экспрессии гибридного белка цитозиндезаминаза-урацилфосфорибозил трансфераза, рекомбинантная плазмида pCpG-CytDA/upp/VP22 для экспрессии гибридного белка цитозиндезаминаза-урацилфосфорибозил трансфераза-VP22, композиция для терапии онкологических заболеваний, и способ ее применения
<160> 2
<210> 2
<211> 5876
<212> ДНК
<213> Искусственная последовательность
<400> 1