Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 4-МЕТОКСИБИФЕНИЛА РЕАКЦИЕЙ СУЗУКИ-МИЯУРА
Вид РИД
Изобретение
Изобретение относится к тонкому органическому синтезу и может быть использовано в химической и фармацевтической промышленностях для получения биарилов, которые являются важными полупродуктами в синтезе фармацевтических препаратов, лигандов и полимеров.
Изобретение описывает процесс синтеза 4-метоксибифенила с помощью реакции кросс-сочетания Сузуки-Мияура с использованием палладиевого катализатора на основе сверхсшитого полистирола (СПС), функционализированного аминогруппами.
Реакцию Сузуки-Мияура проводят при температуре от 10 до 200°C и давлении до 100 бар (чаще всего давление варьируется от атмосферного до 40 бар (US 20120116118, кл. C07C 51/353, C07C 51/363, C07C 51/377, 10.05.2012).
В качестве оснований используют первичные, вторичные и третичные амины (например, алкиламины, диалкиламины, триалкиламины), которые могут быть циклическими или открытыми; соли щелочных и щелочноземельных металлов алифатических и/или ароматических карбоксильных кислот (например, ацетаты, пропионаты или бензоаты); карбонаты щелочных и щелочноземельных металлов, бикарбонаты, фосфаты, гидрофосфаты и/или гидроокиси; алкоксиды металлов (особенно алкоксиды щелочных и щелочноземельных металлов, такие, как метоксид натрия, этоксид натрия, метоксид калия, метоксид магния, этоксид кальция, и др.). Предпочтение отдают карбонатам, гидроксидам или фосфатам лития, натрия, калия, кальция, магния или цезия, в особенности - NaOH, KOH, K2CO3 и Na2CO3. Также в реакционную смесь могут добавляться фториды, например CaF, NaF, KF, LiF, CsF и др. (US 20120116118, кл. C07C 51/353, C07C 51/363, C07C 51/377, 10.05.2012).
Важным является выбор растворителя. Особое предпочтение отдают следующим растворителям и их смесям: тетрагидрофуран, диоксан, диэтиловый эфир, диглим, метил-трет-бутиловый эфир, метил-трет-амиловый эфир, диметиловый эфир, 2-метилтетрагидрофуран, ацетонитрил, бутиронитрил, толуол, ксилол, анизол, этилацетат, изопропилацетат, метанол, этанол, пропанол, бутанол, этиленгликоль, этилен карбонат, пропилен карбонат, N,N-диметилацетамид (ДМА), N,N-диметилформамид (ДМФ), N-метилпирролидон (НМП), вода (US 20030181748, кл. С07В 37/04 25.09.2003). Предпочтительно использование смесей органический растворитель/вода в соотношениях, варьируемых от 2:3 до 20:1 в зависимости от типа катализатора и условий проведений реакции (US 20030181748, кл. C07B 37/04, 25.09.2003; Liu С, Ni Q., Bao F., Qiu J., Green chemistry, 13 (2011) 1260; Heidenreich R.G., Kohler K., Krauter J.G.E., Pietsch J., Synlett, 7 (2002) 1118; US 20040254066, кл. C07C 13/28, C07C 25/18, C07C 49/84, B01J 31/18, B01J 35/08, 16.12.2004; US 20090227740, кл. C08F 226/06, 10.09.2009; Phan N.T.S., Brown D.H., Styring P., Tetrahedron Letters, 45 (2004) 7915; US 20040192542. кл. C07C 15/54, C07B 61/00, B01J 23/44, C07C 15/14, 30.09.2004; Choi K.-H., Shokouhimehr M., Sung Y.-E., Bulletin of the Korean Chemical Society, 34 (2013) 1477). С точки зрения обеспечения экологической безопасности производства предпочтительным растворителем является вода (Huang L., Chen F., Wang Y., Wong P.K., Physical chemistry, 3 (2013) 21), а также ее смеси с этанолом, предпочтительно в соотношении 1:1 (Colacot T.J., Gore E.S., Kuber A., Organometallics, 21 (2002) 3301; US 20130211106, кл. B01J 23/44, 15.08.2013; Shokouhimehr M., Lee J.E., Han S.I., Hyeon Т., Chemical Communications, 49 (2013) 4779).
Для создания инертной атмосферы, чтобы предотвратить разрушение катализатора в ходе реакции, применяют азот или аргон (US 20030181748, кл. C07B 37/04, 25.09.2003).
В качестве источника палладия могут использоваться палладиевые комплексы, содержащие лиганды на основе соединений фосфора и азота, соли Pd (ацетат палладия, пропионат палладия, ацетилацетонат палладия, хлорид палладия, бромид палладия, нитрат палладия, бис(дибензилиденацетон) палладия, трис(дибензилиденацетон) дипалладия, бис(ацетонитрил)дихлорид палладия, бис(бензонитрил)палладий дихлорид, тетрахлоропалладат(II)лития), гидроксид палладия. При этом к соли может быть добавлен лиганд (система «Pd + лиганд»). Такая система может быть получена предварительно, незадолго до реакции, либо лиганд добавляют отдельно непосредственно в реакционную смесь (US 20120116118, кл. C07C 51/353, C07C 51/363, C07C 51/377, 10.05.2012).
В случае отсутствия лигандов принято говорить о безлигандных каталитических системах (Pan С. [et al.], Catalysis communication, 9 (2008) 321). Наиболее часто для проведения реакции Сузуки-Мияура в промышленности используется Pd/C (Sołoducho J. [et al.], Advances in Chemical Engineering and Science, 3 (2013) 19).
Известен способ проведения реакции Сузуки-Мияура с применением коммерческого Pd/C (Е 105 О/W 5 мас.% Pd, Degussa-Hüls AG). Реакция проводится в толуоле, НМП, ДМА, а также в смеси толуол/вода (1:1), при температуре 120°C, в качестве основания используется NaOH, а в качестве субстрата - бромбензол, продолжительность реакции 1 ч, концентрация катализатора 0.2 мол.%. Конверсия составляет 2-95% (US 20030181748, кл. C07B 37/04, 25.09.2003).
Недостатком способа является высокое содержание палладия в катализаторе и полная потеря катализатором первоначальной структуры после однократного применения, что приводит к невозможности его повторного использования в реакции Сузуки-Мияура.
Известен способ проведения реакции кросс-сочетания 4-бромтолуола и фенилбороновой кислоты в присутствии катализатора Pd/C-LSS (5.4 мас.% Pd). Условия реакции: инертная атмосфера (азот), растворитель ДМФ, температура 95°C, основание K2CO3, pH 10.6, продолжительность реакции 6 мин, концентрация катализатора 1 мол.%. Конверсия 4-бромтолуола составляет не менее 95% (US 2013289321, кл. C07C 1/26, 30.10.2013).
Недостатком способа является высокое содержание палладия в катализаторе.
Известен способ проведения реакции кросс-сочетания бромбензола и фенилбороновой кислоты с использованием катализатора Pd(II)/MgO. Условия реакции: растворитель смесь ДМА/вода (1:1), температура 50°C, инертная атмосфера (аргон), продолжительность реакции 1 ч, концентрация катализатора 0.2 мол.%. Конверсия составляет более 80% в первых четырех реакционных циклах (Huang L., Chen F., Wang Y., Wong P.K., Physical chemistry, 3 (2013) 21).
Недостатком способа является низкая конверсия бромбензола (не более 88%).
Известен способ проведения реакции Сузуки-Мияура с применением Pd/TiO2 (5.2 мас.% Pd), синтезированного методом импрегнации. Условия реакции: субстрат - 4-бромтолуол, инертная атмосфера (азот), растворитель ДМФ, основание K2CO3, температура 95°C, pH 10.6, скорость перемешивания 210 об/мин, продолжительность реакции 10 мин, концентрация катализатора 1 мол.%. Конверсия 4-бромтолуола составляет 100% (US 2014163283, кл. C07C 1/32, 14.05.2014).
Недостатком способа является высокое содержание палладия в катализаторе.
Прототипом заявляемого изобретения является способ получения 4-метоксибифенила реакцией Сузуки-Мияура между 4-броманизолом и фенилбороновой кислотой в присутствии катализатора Pd/MN100 (3.75 мас.% Pd). Катализатор синтезирован методом импрегнации сверхсшитого полистирола марки MN100 водным раствором прекусрора PdCl2 с последующей обработкой раствором основания при нагревании до 80°C с целью осаждения наночастиц палладия. Количество катализатора составляет 2 мол.% по отношению к 4-броманизолу. Реакция проводится в газовой атмосфере аргона при температуре 100°C. Мольный избыток фенилбороновой кислоты по отношению 4-броманизолу составляет 1.5. Продолжительность реакции 5 ч. В качестве растворителей используются N,N-диметилформамид (ДМФ), толуол или вода. В реакционную смесь вносят агент фазового переноса - тетра-н-бутиламмонийбромид (Bu4NBr). В качестве основания используется K3PO4 или CS2CO3 (1 ммоль). Наиболее высокая конверсия 4-броманизола (99%) достигается в случае растворителя ДМФ и основания K3PO4, а также растворителя H2O и основания Cs2CO3 (Lyubimov S.E. [et al.], Reactive and Functional Polymers, 69 (2009) 755).
Основными недостатками прототипа являются высокая продолжительность реакции при высокой температуре и высоком процентном содержании катализатора по отношению к 4-броманизолу, высокое содержание палладия в катализаторе, а также необходимость использования агента фазового переноса.
Задачей изобретения является разработка способа получения 4-метоксибифенила реакцией Сузуки-Мияура между 4-броманизолом и фенилбороновой кислотой в присутствии Pd/MN100 катализатора, обеспечивающего снижение температуры проведения реакции, сокращение длительности реакции, снижение процентного содержания катализатора по отношению к 4-броманизолу, снижение содержания палладия в катализаторе и отсутствие необходимости использования агента фазового переноса.
Техническим результатом изобретения является повышение технологичности и эффективности процесса получения 4-метоксибифенила.
Поставленная задача и указанный технический результат достигаются тем, что в способе получения 4-метоксибифенила реакцией Сузуки-Мияура, включающем взаимодействие 4-броманизола и фенилбороновой кислоты в растворителе в присутствии основания и катализатора Pd/MN100, синтезированного методом импрегнации сверхсшитого полистирола марки MN100 прекурсором, нагревание реакционной смеси в газовой атмосфере при мольном избытке фенилбороновой кислоты по отношению 4-броманизолу 1.5, согласно изобретению, для процесса импрегнации в качестве прекурсора используют раствор (CH3CN)2PdCl2 в тетрагидрофуране, импрегнацию проводят при температуре от 20 до 40°С, при этом содержание палладия в катализаторе составляет от 0.5 до 2 мас.% с использованием MN100, предварительно измельченного, количество катализатора составляет от 0.5 до 1.5 мол.% по отношению к 4-броманизолу, в качестве растворителя реакции Сузуки-Мияура применяют смесь этанол/вода в соотношении от 1:0 до 1:2, а в качестве основания - NaOH, K2CO3 и Na2CO3 в количестве от 1 до 2 ммоль при температуре от 50 до 75°С в течение от 10 мин до 1 ч в газовой атмосфере азота или воздуха.
Применение (CH3CN)2PdCl2 обусловлено большим сродством данного соединения к полимерной матрице MN100 по сравнению с PdCl2. Сочетание прекурсора (CH3CN)2PdCl2 и температуры импрегнации от 20 до 40°С позволяет избежать формирования наночастиц и использовать катализатор Pd/MN100 в реакции Сузуки-Мияура непосредственно после проведения импрегнации. В случае проведения предварительного восстановления катализатора в токе водорода при температуре от 250 до 300°С, приводящего к формированию наночастиц палладия, активность катализатора снижается, продолжительность реакции возрастает в 1.5 раза.
Предварительное измельчение MN100 перед проведением импрегнации необходимо, чтобы повысить площадь поверхности катализатора, доступную для реагентов, и снять внутридиффузионные ограничения.
При снижении содержания палладия в катализаторе менее 0.5 мас.% происходит резкое снижение степени конверсии 4-броманизола (конверсиясоставляет менее 60% за более чем 5 ч реакции), а увеличение содержания палладия выше 2 мас.% нецелесообразно, так как не позволяет существенно повысить степень конверсии 4-броманизола за время реакции (от 10 мин до 1 ч).
Количество катализатора менее 0.5 мол.% также приводит к увеличению продолжительности реакции и резкому снижению степени конверсии 4-броманизола. Повышение концентрации катализатора более 1.5 мол.% является нецелесообразным.
При сокращении продолжительности реакции менее 10 мин происходит снижение конверсии 4-броманизола менее 70%, тогда как увеличение продолжительности реакции более 1 ч не требуется, так как после достижения этого времени реакция практически останавливается (конверсия 4-броманизола остается почти постоянной).
При снижении температуры менее 50°C наблюдается снижение конверсии 4-броманизола. Температура выше 75°C неприемлема, так как процесс проводится при атмосферном давлении, а температура кипения этанола составляет 78.4°C.
Применение в качестве оснований K2CO3, Na2CO3 или NaOH в количестве от 1 до 2 ммоль приводит к достижению степени конверсии 4-броманизола выше 75%. Предпочтительным является использование NaOH в количестве 1.5 ммоль, что позволяет достичь конверсии 4-броманизола выше 97%. Уменьшение количества NaOH ниже 1 ммоль приводит к снижению степени конверсии 4-броманизола до 79%. Увеличении количества NaOH до 2 ммоль нецелесообразно, так как не приводит к дальнейшему повышению степени конверсии 4-броманизола по сравнению с количеством NaOH 1.5 ммоль.
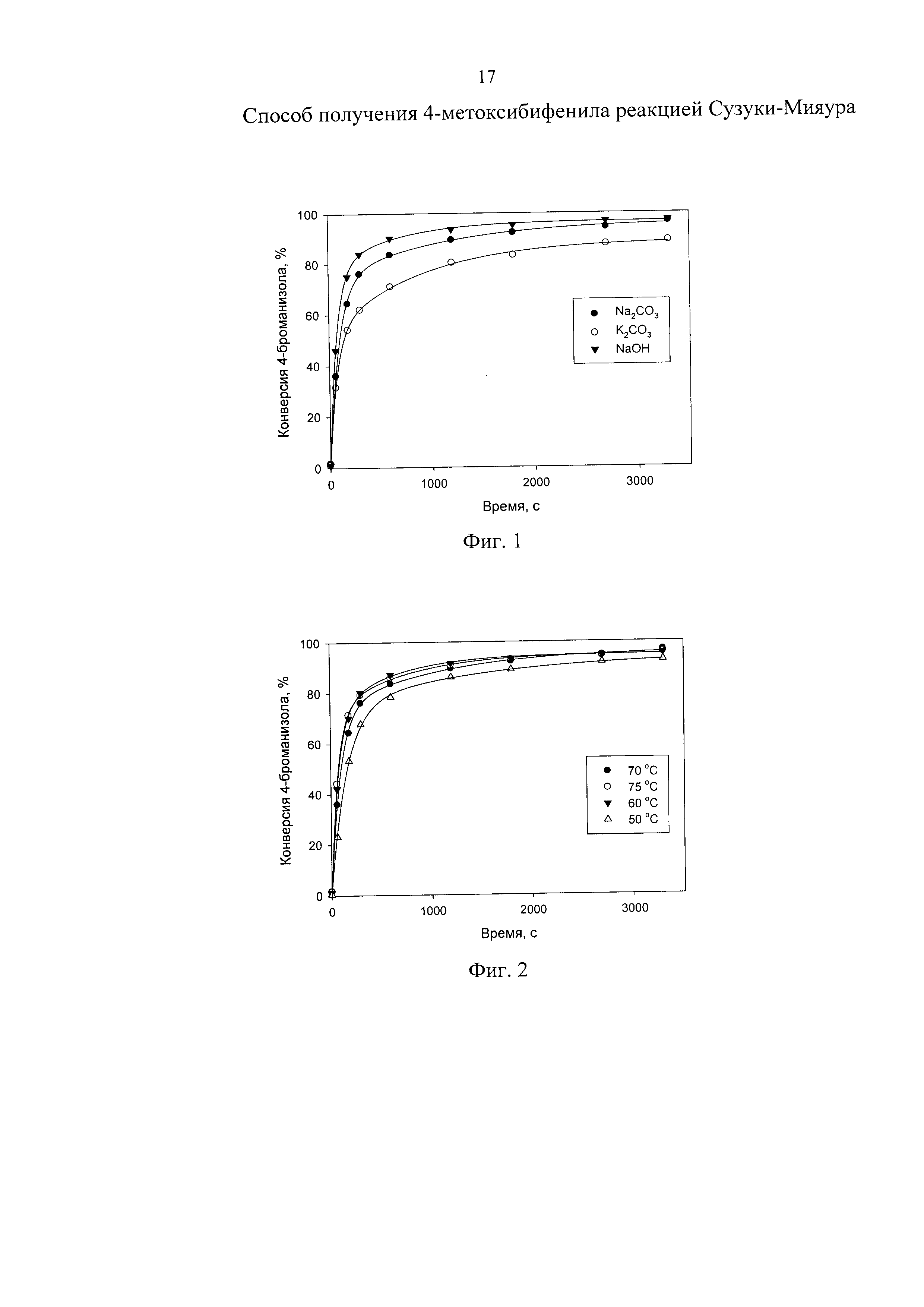
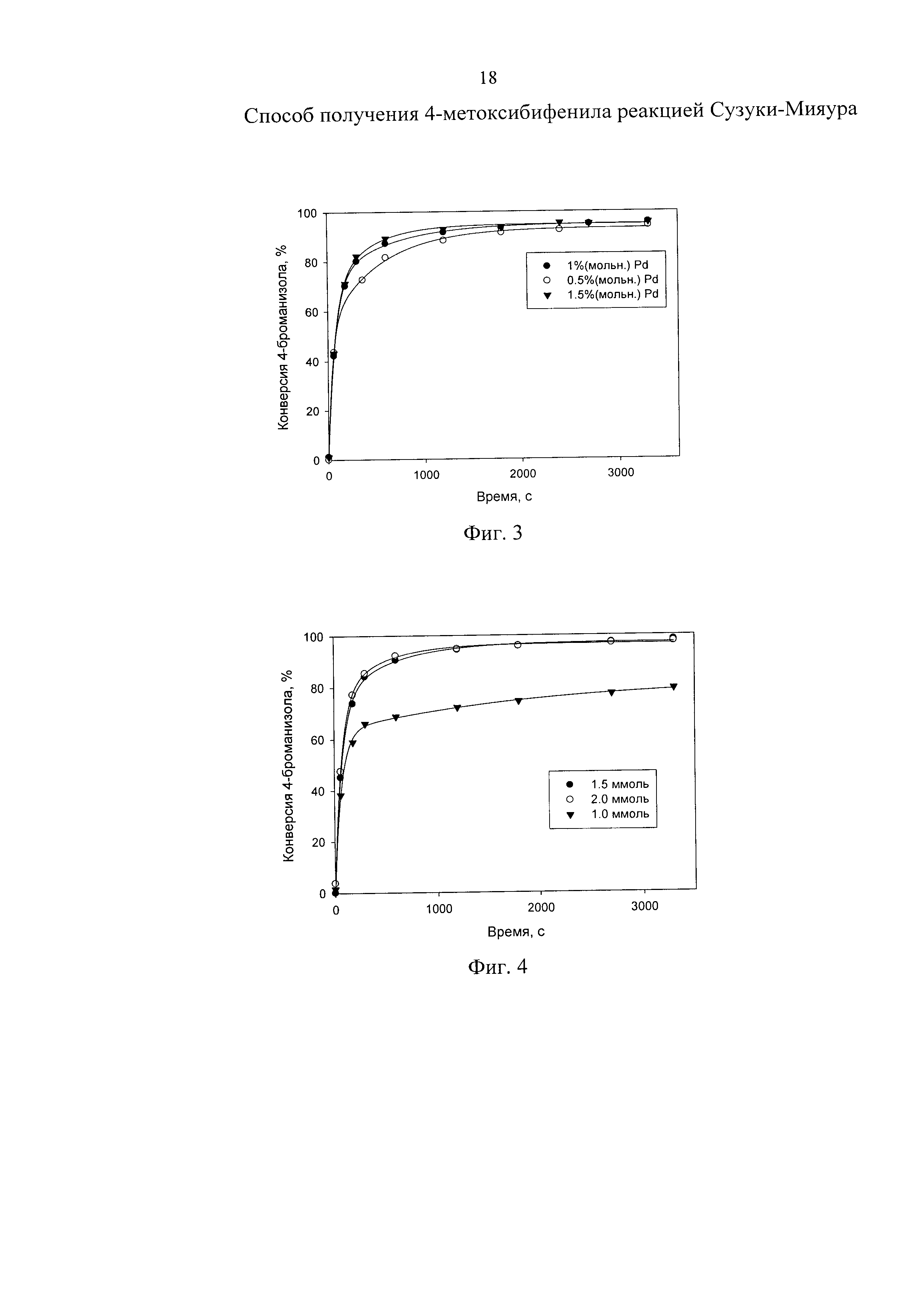
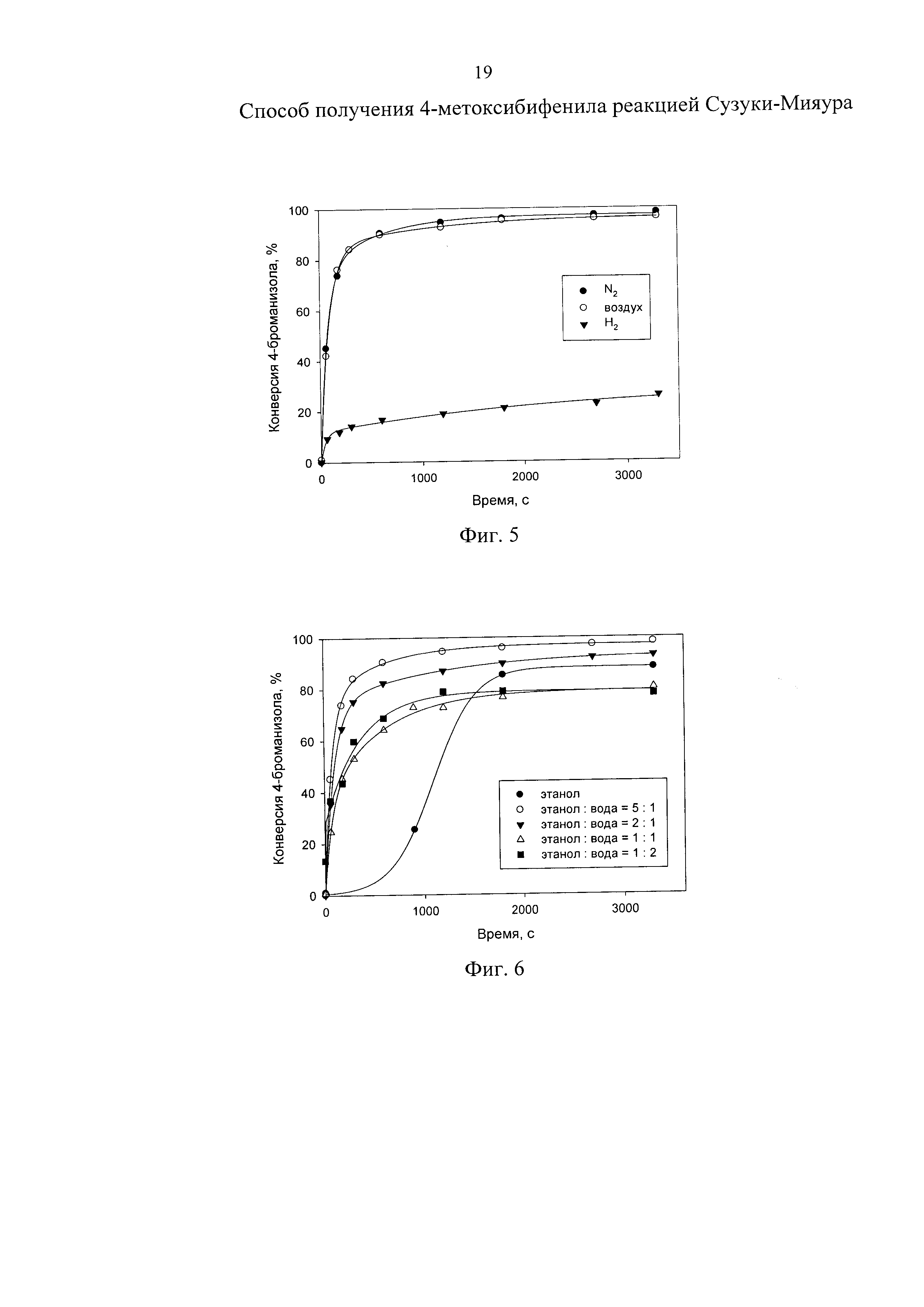
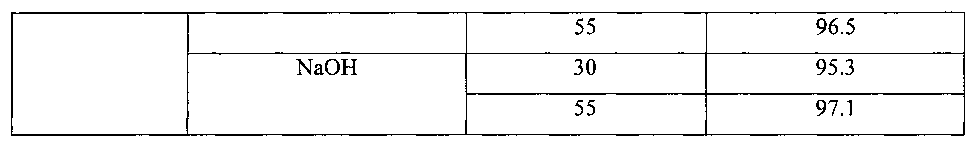
Изобретение поясняется чертежами, где на фиг. 1 представлен зависимость конверсии 4-броманизола от времени при варьировании природы основания, на фиг. 2 - зависимость конверсии 4-броманизола от времени при варьировании температуры проведения реакции, на фиг. 3 -зависимость конверсии 4-броманизола от времени при варьировании концентрации катализатора, на фиг. 4 - зависимость конверсии 4-броманизола от времени при варьировании концентрации основания, на фиг. 5 - зависимость конверсии 4-броманизола от времени при варьировании состава газовой фазы, на фиг. 6 - зависимость конверсии 4-броманизола от времени при варьировании состава растворителя.
Способ получения 4-метоксибифенила реакцией Сузуки-Мияура поясняется следующими примерами.
Пример 1
Реакцию Сузуки-Мияура между 4-броманизолом (1 ммоль) и фенилбороновой кислотой (1.5 ммоль) с использованием в качестве катализатора Pd(II)/MN100 (2 мас.% Pd), синтезированного методом импрегнации предварительно измельченного сверхсшитого полистирола марки MN100 раствором (CH3CN)2PdCl2 в тетрагидрофуране при температуре от 20 до 40°C с последующей обработкой водным раствором основания. В термостатируемый реактор вносили 50 мг катализатора, что соответствует 1 мол.% концентрации по отношению к 4-броманизолу, 30 мл смеси этанол/вода при соотношении 5:1, а также K2CO3, Na2CO3 или NaOH в количестве 1.5 ммоль. Нагревание реакционной смеси проводили в газовой атмосфере азота при температуре 70°C. Продолжительность реакции составила 55 мин.
В таблице 1 и на фиг. 1 приведены данные зависимости конверсии 4-броманизола от времени при варьировании природы основания.

На основании таблицы 1 и фиг. 1 можно сделать вывод, что с увеличением силы основания происходит увеличение степени конверсии 4-броманизола. Максимальная степень конверсии 4-броманизола (97.1%) достигается за время реакции 55 мин в случае использования NaOH в качестве основания.
Это объясняется тем, что основание играет множественную роль, ускоряя две лимитирующие стадии (транс-металлирование и восстановительное элиминирование) и, в то же время, ограничивая образование нереакционноспособных анионов. Таким образом, увеличивая концентрацию ОН-, можно повысить полноту конверсии 4-броманизола.
Таким образом, использование сильного основания (NaOH) позволяет в более мягких условиях (70°C) с использованием в два раза меньшей концентрации катализатора с меньшим содержанием палладия по сравнению с прототипом за относительно короткое время достичь степени конверсии 4-броманизола более 97%.
Пример 2
Пример осуществляли аналогично приведенному выше примеру, но варьировали содержание палладия в катализаторе от 0.5 до 2.0% (при этом количество катализатора составляло 50 мг во всех случаях). В качестве основания добавляли Na2CO3 в количестве 1.5 ммоль.
В таблице 2 приведены данные зависимости конверсии 4-броманизола при варьировании содержания палладия в катализаторе.

На основании таблицы 2 можно сделать вывод, что с увеличением содержания палладия степень конверсии 4-броманизола возрастает.
Пример 3
Пример осуществляли аналогично приведенному выше примеру, но варьировали температуру от 50 до 75°С. В качестве основания добавляли Na2CO3 в количестве 1.5 ммоль, а в качестве катализатора - Pd(II)/MN100 (2 мас.% Pd).
В таблице 3 и на фиг. 2 приведены данные по влиянию температуры на степень конверсии 4-броманизола в 4-метоксибифенил.

На основании таблицы 3 и фиг. 2 можно сделать вывод, что при снижении температуры до 50°C наблюдается заметное снижение степени конверсии 4-броманизола, тогда как повышение температуры до 60°C и выше позволяет достичь конверсии >95% за время реакции 55 мин. Причем поведение катализатора в выбранном диапазоне температур 60-75°C остается практически неизменным, что позволяет рекомендовать 60°C в качестве оптимальной температуры (достигается степень конверсии 4-броманизола равная 96.5%).
Таким образом, использование синтезированного катализатора Pd(II)/MN100 (2 мас.% Pd) обеспечивает технический результат изобретения посредством снижения температуры реакции синтеза 4-метоксибифенила на 40°C по сравнению с прототипом.
Пример 4
Пример осуществляли аналогично приведенному выше примеру, но реакцию проводили при температуре 60°C. Концентрацию катализатора варьировали от 0.5 до 1.5 мол.% по отношению к 4-броманизолу.
В таблице 4 и на фиг. 3 приведены данные по влиянию концентрации катализатора на степень конверсии 4-броманизола в 4-метоксибифенил.

На основании таблицы 4 и фиг. 3 можно сделать вывод, что при увеличении концентрации катализатора с 0.5 до 1 мол.% наблюдается повышение степени конверсии 4-броманизола с 94% до 95.5%. Дальнейшее увеличение концентрации катализатора до 1.5 мол.% не приводит к повышению степени конверсии 4-броманизола и поэтому не является целесообразным.
Таким образом, достигается двукратное снижение концентрации катализатора по сравнению с прототипом, что полностью соответствует задачам изобретения.
Пример 5
Пример осуществляли аналогично приведенному выше примеру, но в качестве основания добавляли NaOH в количестве от 1 до 2 ммоль. Концентрация катализатора составляла 1 мол.% по отношению к 4-броманизолу.
В таблице 5 и на фиг. 4 приведены данные по влиянию концентрации NaOH на степень конверсии 4-броманизола в 4-метоксибифенил.

На основании таблицы 5 и фиг. 4 можно сделать вывод, что при снижении количества NaOH с 1.5 до 1.0 ммоль наблюдается снижение степени конверсии 4-броманизола с 98.1% до 79.3%. Повышение количества NaOH до 2 ммоль не вызывает существенного увеличения скорости конверсии 4-броманизола. Таким образом, 1.5 ммоль NaOH можно считать оптимальным количеством.
Пример 6
Пример осуществляли аналогично приведенному выше примеру, но варьировали состав атмосферы: использовались азот, водород, воздух. В качестве основания добавляли NaOH в количестве 1.5 ммоль.
В таблице 6 и на фиг. 5 приведены данные по влиянию состава газовой атмосферы на степень конверсии 4-броманизола в 4-метоксибифенил.
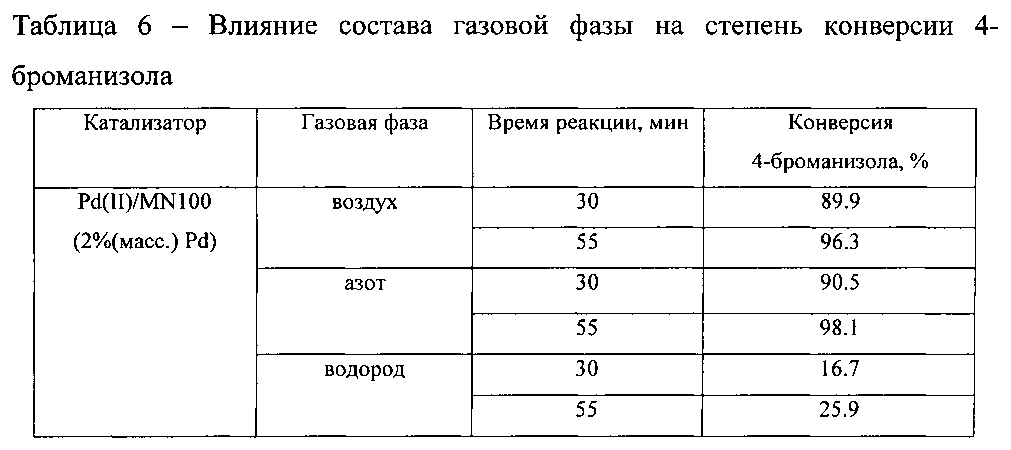
На основании таблицы 6 и фиг. 5 можно сделать вывод, что при замене инертной атмосферы азота на воздух наблюдается незначительное снижение степени конверсии 4-броманизола с 98.1% до 96.3%. Тогда как использование восстанавливающей атмосферы водорода приводит к резкому снижению степени конверсии 4-броманизола почти в 4 раза по сравнению с инертной атмосферой. Это связано с тем, что использование водорода приводит к быстрому восстановлению палладия и его осаждению в виде наночастиц, то есть к снижению стабильности в растворе молекулярных форм палладия, образованных in situ, которые отвечают за наблюдаемую каталитическую активность в реакции синтеза 4-метоксибифенила.
Пример 7
Пример осуществляли аналогично приведенному выше примеру, но варьировали состав растворителя. В качестве растворителя использовали смесь этанол/вода в соотношении от 1:0 до 1:2. Реакция проводилась в инертной атмосфере (азот).
В таблице 7 и на фиг. 6 приведены данные по влиянию состава растворителя на степень конверсии 4-броманизола в 4-метоксибифенил.

На основании таблицы 7 и фиг. 6 можно сделать вывод, что использование чистого этанола в качестве растворителя приводит к резкому снижению степени конверсии 4-броманизола, тогда как добавление воды в незначительном количестве (соотношение этанол/вода = 5:1) позволяет повысить степень конверсии 4-броманизола до 98.1%. При этом дальнейшее увеличение содержания воды в смеси отрицательно сказывается на степени конверсии 4-броманизола. Важно отметить, что вода и ее смеси с этанолом предпочтительны с точки зрения обеспечения экологической безопасности производства. Кроме того, использование смешанного растворителя позволяет избежать необходимости добавления в реакционную смесь агента фазового переноса.
Представленные примеры выполнения заявляемого способа подтверждают, что предложенный способ получения 4-метоксибифенила реакцией Сузуки-Мияура позволяет повысить технологичность и эффективность процесса получения 4-метоксибифенила за счет двукратного снижения концентрации катализатора при меньшем содержании палладия в нем, снижения температуры реакции синтеза на 40°C, существенном сокращении времени проведения процесса (в 5 раз) по сравнению с прототипом при практически тех же значениях степени конверсии 4-броманизола. Кроме того, снижение содержания металла в катализаторе и возможность его многократного использования приводит к удешевлению получаемого продукта.
В настоящее время способ находится на стадии лабораторных экспериментов.
Способ получения 4-метоксибифенила реакцией Сузуки-Мияура, включающий взаимодействие 4-броманизола и фенилбороновой кислоты в растворителе в присутствии основания и катализатора Pd/MN100, синтезированного методом импрегнации сверхсшитого полистирола марки MN100 прекурсором, нагревание реакционной смеси в газовой атмосфере при мольном избытке фенилбороновой кислоты по отношению к 4-броманизолу 1.5, отличающийся тем, что для процесса импрегнации в качестве прекурсора используют раствор (CHCN)PdCl в тетрагидрофуране, импрегнацию проводят при температуре от 20 до 40°С, при этом содержание палладия в катализаторе составляет от 0.5 до 2 мас.% с использованием MN100, предварительно измельченного, количество катализатора составляет от 0.5 до 1.5 мол.% по отношению к 4-броманизолу, в качестве растворителя реакции Сузуки-Мияура применяют смесь этанол/вода в соотношении от 1:0 до 1:2, а в качестве основания - NaOH, KCO и NaCO в количестве от 1 до 2 ммоль при температуре от 50 до 75°С в течение от 10 мин до 1 ч в газовой атмосфере азота или воздуха.