Результат интеллектуальной деятельности: БИОРЕЗОРБИРУЕМЫЙ ПЕРЕВЯЗОЧНЫЙ МАТЕРИАЛ ДЛЯ РАН
Вид РИД
Изобретение
Изобретение относится к новым нетканым материалам, содержащим белки фактора роста и дифференцировки. Указанные материалы разработаны специально для ускорения процессов регенерации тканей и заживления ран тканей млекопитающих. Кроме того, это изобретение обеспечивает повязки для ран, прокладки и имплантаты, содержащие эти новые нетканые материалы.
GDF-5 (Hotten et al. 1994, Biochem. Biophys Res. Commun. 204, 646-652) является морфогеном, который, как было показано, усиливает пролиферацию, дифференцировку клеток и/или образование тканей в нескольких тканях. Этот белок известен также как морфогенный белок MP52, костный морфогенетический белок-14 (BMP-14) или произведенный из хряща морфогенетический белок-1 (CDMP-1). GDF-5 является близкородственным относительно GDF-6 и GDF-7. Эти три белка образуют отдельную подгруппу суперсемейства TGF-β, проявляя таким образом сравнимые биологические свойства и экстраординарную высокую степень идентичности аминокислотной последовательности (см. Wolfman et al. 1997, J. Clin. Invest. 100, 321-330). Все члены семейства первоначально синтезируются в виде более крупных белков-предшественников, которые затем подвергаются протеолитическому расщеплению в кластере основных остатков приблизительно 110-140 аминокислот от С-конца, высвобождая таким образом части С-концевого зрелого белка от их N-концевого продомена. Эти зрелые полипептиды являются структурно родственными и содержат консервативный биоактивный домен, содержащий шесть или семь канонических остатков цистеина, которые являются ответственными за характерный трехмерный мотив "цистин-узел" этих белков. Нативные GDF-5-родственные белки являются гомодимерными молекулами и действуют в основном через взаимодействие со специфическими рецепторными комплексами, которые состоят из серин/треонин-рецепторных киназ типа I и типа II. Эти рецепторные киназы активируют затем белки Smad, которые затем размножают эти сигналы в ядро для регуляции экспрессии генов-мишеней.
Неоднократно демонстрировалось, что члены подгруппы GDF-5/-6/-7 являются важными индукторами и регуляторами костей и хряща (Cheng et al. 2003, J. Bone & Joint Surg. 85A, 1544-1552; Settle et al. 2003, Developm. Biol. 254, 116-130). GDF-5 является природным фактором роста в нервной системе (см., например, WO 97/03188; Krieglstein et al., (1995) J. Neurosci Res. 42, 724-732; Sullivan et al., (1997) Neurosci Lett 233, 73-76; Sullivan et al. (1998), Eur. J. Neurosci 10, 3681-3688). Кроме того, он является, например, полезным для модуляции роста относящейся к коже ткани (WO 02/076494; Battaglia et al. 2002, Trans. Orthop. Res. Soc. 27, 584), и для индуцирования ангиогенных процессов (Yamashita et al. 1997, Exp. Cell Res. 235, 218-26).
После раскрытия их уникальных тканеиндуцирующих активностей белки факторов роста, такие как GDF-5, успешно применяли в терапевтическом исследовании и регенеративной хирургии, в которой они усиливают природный процесс заживления и способствуют процессу заживления различных поврежденных тканей, отдельно или в комбинации с конкретными матриксными материалами. Хотя некоторые фармацевтические композиции, содержащие биологически активные зрелые GDF-5-родственные белки, были разработаны (см., например, WO96/33215), приготовление и использование GDF-5 являются тем не менее проблематичными, так как этот зрелый белок имеет тенденцию взаимодействия в виде спаривания с твердыми веществами и обнаруживает необычайно слабую растворимость в физиологических условиях. pH-зависимый профиль растворимости зрелого GDF-5/MP52 (показанный, например, в EP 1 462 126) обнаруживает, что этот белок начинает осаждаться в водных растворах с pH более 4,25 и становится почти нерастворимым между рН 5 и рН 9.
Для целей заживления ран, были разработаны лосьон-подобные и твердые хирургические формы перевязочных материалов разных форм, размеров и материалов, которые разрабатываются прежде всего для гарантии закрытия ран при полустерильных условиях. Некоторые из этих перевязочных материалов готовят из органических материалов, таких как, например, коллагены, тогда как другие приспособления состоят из синтетических компонентов, таких как, например, аморфные термопластичные полимеры. Некоторые повязки для ран наиболее продвинутой генерации описывают дополнительные функции доставки лекарственных средств; они способны вводить биоактивные вещества, такие как антибиотики или цитокины, такие как эпидермальный фактор роста (EGF) или тромбоцитарный фактор роста (PDGF/Becaplermin). Например, генетически сконструированный PDGF является коммерчески доступным под товарным названием Regranex® в виде местного (0,01%) заживляющего рану геля, который был одобрен для лечения диабетических язв стоп, которые распространяются в подкожную ткань или далее.
Особенно желательными для заживления ран и других целей регенерации тканей являются новые материалы, посредством которых белки фактора роста и дифференцировки доставляются в тело человека. Таким образом, целью данного изобретения является улучшение терапевтической применимости GDF-5 и родственных белков посредством обеспечения новых заживляющих раны материалов и устройств.
Биодеградируемые перевязочные материалы описаны в EP 2 042 199. Этот описанный перевязочный материал изготовляют из нетканого материала, содержащего волокна волокнистого сырьевого материала, где эти волокна включают по меньшей мере одно биологически активное вещество. В качестве биологически активных веществ предлагаются, в частности, противомикробные вещества или антибиотики.
Во время их исследований для улучшения терапевтической применимости GDF-5 и родственных белков, авторы данной заявки неожиданно обнаружили, что нетканый материал, содержащий волокна сырьевого волокнистого материала, описанного в EP 2 042 199, является особенно подходящим для доставки белков фактора роста и дифференцировки в тело человека. Комбинация GDF-5 и биорезорбируемых нетканых материалов показала неожиданные эффекты, благоприятные для применения GDF-5. Биодеградируемые нетканые материалы обеспечивали субстрат для GDF-5, обнаруживающий увеличенное выделения зрелого белка, вместе с хорошими свойствами манипулирования. Эта комбинация позволяет контролировать введение GDF-5 локальным образом и, следовательно, обеспечивает действие фактора роста в желаемом участке фармакологического действия. Наряду с этим пространственным контролем, увеличенные выходы биоактивного GDF-5 элюируются из этого биодеградируемого нетканого материала на протяжении желаемого периода времени, например, нескольких дней. Вследствие включения GDF-5 в этот нетканый материал, преодолеваются pH-зависимые эффекты осаждения и минимизируется взаимодействие с твердыми материалами.
Таким образом, предметом этого изобретения является нетканый материал, содержащий волокна волокнистого сырьевого материала, содержащего биорезорбируемые полимеры (способные к рассасыванию), причем эти волокна включают по меньшей мере одно биологически активное вещество, которое является GDF-5-родственным белком, распределенное в этих волокнах.
Определения:
Во избежание неправильного понимания и двусмысленностей, некоторые часто встречаемые здесь термины объясняются здесь и приводятся в качестве примеров следующим образом:
Термин "домен цистин-узла" означает в данном контексте хорошо известный и консервативный богатый цистеином аминокислотный район, который присутствует в зрелых частях белков суперсемейства TGF-beta, таких как, например, GDF-5 человека, и образует трехмерную белковую структуру, известную как цистин-узел. В этом домене соответствующее местоположение остатков цистеина относительно друг друга является важным и может только слегка варьироваться, чтобы не потерять биологической активности. Было продемонстрировано, что этот домен цистин-узла является достаточным для биологической функции этого белка (Schreuder et al. (2005), Biochem Biophys Res Commun. 329, 1076-86). Консенсусные последовательности для доменов цистин-узла хорошо известны в состоянии этой области. Согласно определению, представленному здесь, домен цистин-узел белка начинается с первого остатка цистеина, участвующего в этом цистин-узле соответствующего белка, и заканчивается остатком, который следует за последним цистеином, участвующим в цистин-узле соответствующего белка. Например, домен цистин-узел белка-предшественника GDF-5 человека (SEQ ID NO: 2) состоит из аминокислот 400-501 (см. также ФИГ.1).
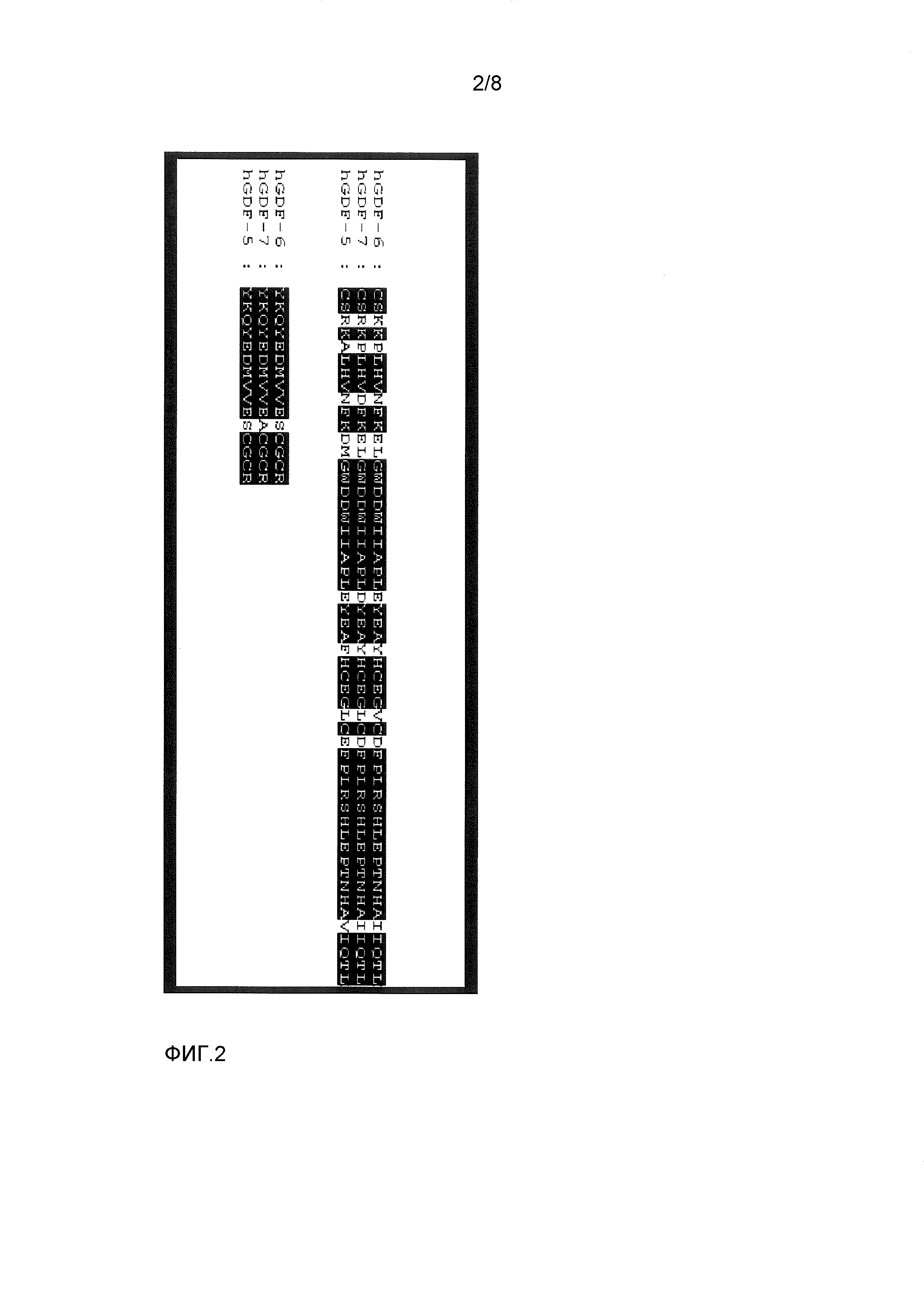
Термин "GDF-5-родственный белок" обозначает в данном контексте любой природно встречающийся или искусственно созданный белок, который является очень близко родственным фактору 5 роста/дифференцировки человека (hGDF-5). Общим признаком всех GFD-5-родственных белков является наличие цистин-узел-домена с идентичностью аминокислот по меньшей мере 60% относительно 102-аминокислотного (аа) цистин-узел-домена GDF-5 человека (аминокислоты 400-501 SEQ ID NO: 2), который является достаточным для биологической функции этого белка. Термин "GDF-5-родственные белки" включает белки, принадлежащие к группе GDF-5, GDF-6 и GDF-7 из видов позвоночных или млекопитающих, а также их рекомбинантные варианты, пока эти белки обнаруживают вышеупомянутый процент идентичности с цистин-узел-доменом GDF-5 человека. Эта ограничивающая величина 60% является подходящей для отделения членов группы белков GDF-5/-6/-7 от дополнительных белков, таких как более далеко родственные GDF и BMP. Сравнение 102 аа-цистин-узел-доменов GDF-5 человека, GDF-6 человека и GDF-7 человека (см. ФИГ.2) выявляет высокую степень идентичности аминокислот между этими белками. GDF-6 человека имеет общие 87 (85%) и GDF-7 человека имеет общие 83 (81%) идентичных остатков с цистин-узел-доменом GDF-5 человека. Соответствующие домены GDF-5/-6/-7-молекул из других видов позвоночных и млекопитающих, которые были идентифицированы до сих пор, также обнаруживают очень высокие проценты идентичности по меньшей мере 75% (между 79% и 99%), в сравнении с GDF-5 человека. В отличие от этого, GDF и BMP, не принадлежащие к подгруппе GDF-5/-6/-7, обнаруживают гораздо меньшие величины идентичности ниже 60% (см. ФИГ.3).
Определение соответствующих положений аминокислот в родственных аминокислотных последовательностях, а также расчет процента идентичности могут легко выполняться при помощи хорошо известных алгоритмов сопоставления и необязательно компьютерных программ с использованием этих алгоритмов. Например, идентичности аминокислот в этой заявке на патент (т.е. ФИГ.2) рассчитывали сопоставлениями последовательностей с бесплатно распространяемой программой ClustalX (Version 1.81) с параметрами по умолчанию и затем подсчетом идентичных остатков вручную. Установки по умолчанию для парного сопоставления (с медленной выборкой) являются следующими: параметр открывания гэпа: 10,00; параметр удлинения гэпа 0,10; Взвешенная матрица белка: Gonnet 250. Программа ClustalX описана подробно в Thompson.J.D., Gibson, T.J., Plewniak.F., Jeanmougin.F. and Higgins.D.G. (1997): The ClustalX windows interface: гибкие стратегии для сопоставления множественных последовательностей обеспечивались инструментами анализа высокого качества. Nucleic Acids Research 24:4876-4882. ClustalX является оконным интерфейсом для программы сопоставления множественных последовательностей и доступна, например, из различных источников, т.е. посредством анонимных ftp из ftp-igbmc.u-strasbg.fr, ftp.embl-heidelberg.de, ftp.ebi.ac.uk или посредством загрузки из следующей web-страницы: http://www-igbmc.u-strasbg.fr/BioInfo/. Программа и алгоритм ClustalW также подробно описана в Thompson, J.D., Higgins, D.G. and Gibson, T.J. (1994): CLUSTALW: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice. Nucleic Acids Research 22:4673-4680.
Особенно предпочтительные GDF-5-родственные белки обнаруживают аминокислотные идентичности по меньшей мере 70%, 80%, 90% или 95% относительно 102 (aa)-цистин-узел-домена GDF-5 человека.
Неограничивающими примерами для GDF-5-родственных белков позвоночных и млекопитающих являются предшественники и зрелые белки GDF-5 человека (описанные как MP52 в WO95/04819 и как GDF-5 человека в Hotten et al. 1994, Biochem. Biophys Res. Commun. 204, 646-652), рекомбинантные белки (rh) человека GDF-5/MP52 (W096/33215), MP52 Arg (WO97/06254); HMW MP52 человека (WO97/04095), CDMP-1 (W096/14335), GDF-5 мыши (Mus musculus) (US 5,801,014), GDF-5 кролика (Oryctolagus cuniculus) (Sanyal et al. 2000, Mol Biotechnol. 16, 203-210), GDF-5 курицы (Gallus gallus) (NCBI accession no. NP_989669), GDF-5 африканской шпорцевой лягушки (Xenopus laevis) (NCBI accession no. AAT99303), мономерного GDF-5 (WO 01/11041 и WO 99/61611), GDF-6/BMP-13 человека (US 5,658,882), GDF-6 мыши (NCBI accession no NP_038554), GDF-6/CDMP-2 (WO96/14335), GDF-7/BMP-12 человека (US 5,658,882), GDF-7 мыши (NCBI accession no AAP97721), GDF-7/CDMP-3 (WO96/143335). Данное изобретение включает также GDF-5-родственные белки, имеющие дополнительные мутации, такие как замены, добавления и делеции, пока эти дополнительные мутации не уничтожают активность этого биологического белка. Некоторые предпочтительные варианты являются мутантами GDF-5-родственных белков с улучшенной биологической активностью. Например, один или несколько остатков, которые в норме присутствуют в белке-предшественнике GDF-5 человека (см. ФИГ.1), заменены в этих мутантах другими аминокислотами: аргинин в положении 438 предшественника GDF-5 человека заменен глицином, аланином, валином, лейцином, изолейцином, метионином или аспарагином; и/или серин 439 заменен аспарагиновой кислотой, глутаминовой кислотой, глицином, лейцином или изолейцином; и/или аспарагин 445 заменен серином или треонином. В другом высокоактивном мутанте, метионин 453 и/или метионин 456 заменены аланином, валином или изолейцином. Особый интерес представляют также мутанты, в которых лейцин 441 заменен пролином.
Термин "вариант” обозначает в данном контексте любые из следующих полипептидов:
a) биологически активные фрагменты белка, предпочтительно по меньшей мере содержащие цистин-узел-домен;
b) биологически активные конструкты белков, которые содержат дополнительные последовательности (с добавлением или без добавления дополнительных биологических функций), превышающие исходную последовательность этого белка или конструкта, которые содержат аминокислотные замены);
c) любую комбинацию a) и b).
Термин "биологическая активность" обозначает в данном контексте активность соединений, в том числе, например, GDF-5-родственного белка, измеренную обычно анализом in vitro щелочной фосфатазы (ALP), например, как описано в примере 8 или в Takuwa et al. (1989), Am. J. Physiol. 257, E797-E803). Подходящими клеточными линиями, которые могут быть использованы в таком анализе ALP, являются клетки ATDC-5 или MCHT 1/26.
Нетканый материал данного изобретения может иметь различные формы, очертания, стили или дизайны. Например, этот нетканый материал может быть повязкой для раны, прокладкой для раны, имплантатом или материалом (прокладкой) для тампонады.
Предметом этого изобретения является нетканый материал, содержащий волокна волокнистого сырьевого материала, содержащие биорезорбируемые и/или биосовместимые полимеры, причем эти волокна включают по меньшей мере одно биологически активное вещество, где этим биологически активным веществом является GDF-5-родственный белок. Этот GDF-5-родственный белок распределен в этих волокнах. Необязательно, дополнительный GDF-5-родственный белок может присутствовать на этих волокнах.
Авторы этого изобретения неожиданно обнаружили, что GDF-5-родственные белки, несмотря на их относительно высокую гидрофобность, могут быть включены внутри этих волокон. Даже негликозилированные GDF-5-родственные белки могут быть неожиданно хорошо включенными в волокна волокнистого сырьевого материала, содержащего биорезорбируемые или биосовместимые полимеры.
Включением GDF-5-родственных белков во внутреннюю часть этих волокон увеличивается стабильность этого белка. Этот белок является особенно защищенным, если эти волокна затем подвергают процессу стерилизации, например, с использованием γ-облучения. Вследствие его положения во внутренней части волокна, этот белок защищен также против деградации протеазами. Кроме того, увеличивается способность к долгосрочному хранению. Например, особенно при более высоких температурах, например, при комнатной температуре, способность хранения этого белка увеличивается в сравнении с волокнами, включающими в себя GDF-5-родственный белок на их поверхности. Кроме того, посредством выбора подходящих полимеров для сырьевого материала, может контролироваться высвобождение GDF-5-родственных белков из внутренней части этих волокон, например, для быстрого высвобождения активного вещества или более медленного высвобождения.
Согласно этому изобретению, волокнистые сырьевые материалы выбирают предпочтительно из группы, состоящей из природных полимеров, синтетических полимеров и полимеров, произведенных из консервативных сырьевых материалов. Каждый их этих материалов может быть модифицированным или немодифицированным.
"Природными полимерами” в данном контексте могут быть полимеры, которые произведены из биологических источников, таких как материалы на основе растения, животного, грибков или бактерий. Этот термин включает пост-обработанные и химически модифицированные полимеры. Согласно предпочтительному варианту этого изобретения, природные полимеры выбирают из группы, состоящей из полипептидов, полисахаридов, полигидроксиэфиров и полинуклеотидов.
Особенно подходящими в качестве полипептидов являются природные полимеры, такие как коллаген, желатин, фибрин, казеин, или полисахариды декстран, целлюлоза, крахмал, хитин, хитозан, гиалуроновая кислота и альгинат, а также синтетические полимеры, такие как полилактид (PLA), полигликолид (PGA), поликапролактон (PCL), а также любые их комбинации.
Согласно одному предпочтительному варианту этого изобретения, нетканый материал является "биорезорбируемым". Это означает, что этот нетканый материал деградируется в теле или на теле. Такие материалы предпочтительно не должны удаляться после полной ресорбции и часто являются хорошо совместимыми с телом.
"Биосовместимые" материалы в контексте данного изобретения являются материалами, которые способны выполнять подходящую реакцию хозяина в конкретном применении. Такие материалы предпочтительно вызывают низкую иммунную реакцию или не вызывают иммунной реакции в конкретном организме или могут быть способны интегрироваться в конкретный тип клетки или ткани.
В дополнительном предпочтительном варианте осуществления, этот нетканый материал является биорезорбируемым и/или биосовместимым.
Биодеградируемые или биорезорбируемые полимеры являются например, альгинатами из водорослей, природными полисахаридами, подобными декстрану, полимерами крахмалом и целлюлозой из растений, полимерами животных, такими как коллаген, желатин, хитин, казеин, полидепсипептидами, бактериальными полимерами, такими как полигидроксиэфир, в частности, полигидроксибутиратами и -валератами, синтетическими полимерами на основе растительных масел, такими как, например, полимолочная кислота, полигликолевая кислота, полиамид и полиуретан, а также консервативными сырьевыми материалами, такими как поли-ε-капролактон, поливиниловый спирт, сложный полиэфир, полиэтиленсукцинат и -оксалат, полиэфирамид и полидиоксанон.
Кроме того, нерастворимые вещества могут быть диспергированы в полимерный матрикс. В частности, неорганические вещества, такие как частицы гидроксилапатита и/или b-трикальцийфосфата, оказались подходящими для этой цели.
Материалы согласно этому изобретению являются неткаными материалами. Предпочтительно, они не являются прессуемыми.
Диаметр этих волокон может быть установлен в тесном распределении посредством спин-вращательного способа, описанного в EP 2 042 199. Могут быть получены волокна, имеющие диаметр в среднем 0,1-500 мкм, предпочтительно 3-300 мкм и даже более предпочтительно 5-100 мкм, которые образуют частичную сеть друг с другом. Это тесное распределение диаметра волокон делает возможной гомогенную и стабильную структуру нетканого материала без дорогостоящих дополнительных мер связывания и в то же самое время позволяет контролируемое высвобождение биоактивного вещества, подобного GDF-5 (который гомогенно распределен на этих волокнах или в этих волокнах).
Некоторые волокна могут быть скрученными или переплетенными друг с другом или могут иметь скрученную структуру. Эти скручивания или переплетения дополнительно усиливают прочность и характер растяжения этого нетканого материала.
Некоторые волокна могут быть переплетены друг с другом и могут образовывать один или несколько пучков волокон. Посредством переплетений отдельных волокон они объединяются в пучки волокон и могут быть обратимо вытеснены относительно друг друга. В результате этого, этот нетканый материал может растягиваться без разрушения. Вследствие этого растяжения отдельные волокна фактически вытаскиваются и замещаются другими волокнами. Эти скручивания и переплетения даже усиливают возврат этих волокон в их положение перед скручиванием. Таким образом, этот нетканый материал обнаруживает высокую размерную стабильность даже во влажном состоянии.
Эти материалы могут быть модифицированы, либо химическим способом, облучением, либо физическими обработками, такими как дегидротермальные обработки (DHT), для изменения характеристик материала. Такая модификация могла бы включать сшивание волокон или полимера для контроля признаков материала, таких как стабильность, деградация или биорезорбция.
GDF-5-родственный белок может быть гомогенно распределен в этих волокнах. В результате этого, может быть установлено постепенное выделение GDF-5-родственного белка с долгосрочным действием.
Этот GDF-5-родственный белок может присутствовать в этих волокнах на наномасштабном уровне. Под наномасштабными структурами имеют в виду районы любой морфологии, которые имеют размеры в диапазоне нанометров, по меньшей мере в одном направлении в пространстве. Вследствие этого, GDF-5-родственный белок приобретает высокую мобильность. Один GDF-5-родственный белок, присутствующий на наномасштабном уровне, обнаруживает особенно высокую реактивность. Кроме того, этот нетканый материал выделяет GDF-5-белок очень легко в среды, которые приходят в контакт с ним. Вплоть до этой степени, этот нетканый материал отличается высокой способностью выделения относительно GDF-5-родственного белка.
Согласно другому варианту осуществления этого изобретения, дополнительный GDF-5-родственный белок может быть распределен на этих волокнах. Это позволяет распыление на нетканый материал GDF-5-родственного белка для гарантии быстрого высвобождения в тело человека. Особенно предпочтительным является то, что этот GDF-5-родственный белок присутствует в этих волокнах и на этих волокнах.
В одном предпочтительном варианте осуществления данного изобретения, GDF-5-родственный белок включен в нетканый материал в комбинации с подходящими носителями, стабилизаторами или дополнительными добавками, описанными здесь ниже.
По меньшей мере часть этих волокон может находиться в форме нановолокон. Нетканый материал этой формы может быть изготовлен особенно легким и тонким.
Этот нетканый материал может иметь структуру с открытыми порами, имеющую проницаемость между 0,01 и 100 л/мин × см2 этого параметра, определяемую в соответствии с DIN 9237. Такой нетканый материал является особенно подходящим в качестве перевязочного материала, так как он позволяет коже выделять жидкость и дышать.
Получение нетканого материала этого изобретения выполняют предпочтительно в соответствии со спин-вращательным способом, описанным в качестве примера в EP 2 042 199. Для выполнения этого спин-вращательного способа используют устройство или контейнер, как описано в Заявке на патент Германии DE 102 005 048 939.
Нетканые материалы этого изобретения, включающие GDF-5-родственный белок, являются особенно подходящими для использования в медицинском секторе, так как они являются очень легко модифицируемыми относительно структуры ткани и состава материала. Таким образом, другим вариантом осуществления данного изобретения является нетканый материал, предпочтительно повязка для ран, прокладка или имплантат, содержащие нетканый материал в соответствии с данным изобретением.
Обычно, ткань данного изобретения может применяться во всех ситуациях, в которых является применимым хранение и/или доставка вышеуказанных рекомбинантных форм GDF-5 и форм GDF-5 дикого типа в комбинации с устройствами, выполненными из нетканого материала, содержащего волокна волокнистого сырьевого материала, содержащего биорезорбируемые полимеры. Таким образом, данное изобретение может быть использовано для облегчения регенерации различных тканей и органов. Например, считается, что GDF-5 является очень эффективным усилителем образования костей и хряща, а также образования соединительных тканей (см. например, WO 95/04819, Hotten et al. 1996, Growth Factors 13, 65-74; Storm et al. 1994, Nature 368, 639-643; Chang et al. 1994, J. Biol. Chem. 269, 28227-28234) и образования присоединения соединительных тканей (EP 0 831 884). В данном контексте, GDF-5 является используемым для применений, касающихся сочленений между скелетными элементами (см. например, Storm & Kingsley 1996, Development 122, 3969-3979). Одним примером соединительной ткани является сухожилие и связка (Wolfman et al. 1997, J. Clin. Invest. 100, 321-330; Aspenberg & Forslund 1999, Acta Orthop Scand 70, 51-54; WO 95/16035). Этот белок является полезным для репарации мениска и позвоночного/межпозвонкового диска (Walsh et al. 2004, Spine 29, 156-63) и применений для позвонковых слияний (Spiro et al. 2000, Biochem Soc Trans. 28, 362-368). GDF-5 может быть с пользой использован для применений в отношении зубов (зубных и периодонтальных) (см., например, WO 95/04819; WO 93/16099; Morotome et al. 1998, Biochem Biophys Res Comm 244, 85-90), таких как регенерация дентина или периодонтальной связки. GDF-5 является также полезным в репарации ран любого типа. Он также является полезным для стимуляции роста тканей в нервной системе и выживания, например, допаминергических нейронов. В этом контексте, GDF-5 может быть использован для лечения нейродегенеративных нарушений, таких как болезнь Паркинсона и, возможно, также болезни Альцгеймера или тканей хореи Гентингтона (см., например, WO 97/03188; Krieglstein et al., (1995) J. Neurosci Res. 42, 724-732; Sullivan et al., (1997) Neurosci Lett 233, 73-76; Sullivan et al. (1998), Eur. J. Neurosci 10, 3681-3688). GDF-5 позволяет поддерживать нервную функцию или сохранять нервную функцию в уже поврежденных тканях. Таким образом, считается, что GDF-5 является обычно применяемым нейротрофическим фактором. Он применим также для заболеваний глаз, в частности, сетчатки, роговицы и зрительного нерва (см., например, WO 97/03188; You et al. (1999), Invest Opthalmol V is Sci 40, 296-311), для роста волос и лечения и диагностики связанных с кожей нарушений (WO 02/076494; Battaglia et al. 2002, Trans. Orthop. Res. Soc. 27, 584), и для индукции ангиогенеза (Yamashita et al. 1997, Exp. Cell Res. 235, 218-26).
Таким образом, предпочтительным показанием, в котором может применяться данное изобретение, является заживление ран. Это изобретение особенно пригодно для облегчения лечения ожогов, поражений кожи, травм кожи или кожных трансплантатов, диабетических ран и диабетических язв, например, диабетической язвы стоп.
Дополнительными неограничивающими примерами, в которых может быть применимо данное изобретение, являются предотвращение или терапия заболеваний, ассоциированных с повреждением кости и/или хряща, или обычно ситуаций, в которых является желательным образование хряща или кости, или повреждающего кость и/или хрящ заболевания, или для артродеза позвонков, предотвращение или терапия поврежденной и болезненной ткани, ассоциированной с соединительной тканью, включающей в себя сухожилие и/или связку, периодонтальной или зубной ткани, включающей в себя зубные имплантанты, нервной ткани, включающей в себя ткани CNS, и нейропатологических ситуаций, тканей сенсорной системы, печени, поджелудочной железы, ткани сердца, кровеносного сосуда, почки, матки и щитовидной железы, слизистых оболочек, эндотелия, эпителия, для стимуляции или индукции роста нервов, регенерации ткани, ангиогенеза, индукции пролиферации клеток-предшественников и/или клеток костного мозга, для поддержания состояния пролиферации или дифференцировки для лечения или предохранения тканей или клеток для трансплантации органа или ткани, для целостности выстилки желудочно-кишечного тракта, для лечения нарушений в фертильности, контрацепции или беременности. Заболевания, касающиеся органов чувств, таких как глаз, также включены в предпочтительное показание фармацевтической композиции в соответствии с данным изобретением. Что касается нервных заболеваний, в качестве примеров могут быть опять упомянуты болезни Паркинсона и Альцгеймера.
Эти биологические активности GDF-5-родственных белков могут быть легко определены при помощи установленных тест-систем. Наиболее применимым и предпочтительным является обычный тест in vitro, известный как анализ щелочной фосфатазы (ALP) (Takuwa et al. 1989, Am. J. Physiol. 257, E797-E803). Было продемонстрировано, что GDF-5-родственные белки увеличивают активность щелочной фосфатазы, например, в клетках ROB-C26 (Yamaguchi et al. 1991, Calcif. Tissue Int. 49, 221-225), как описано в W095/04819, в эмбриональных клетках ATDC5 (Riken Gene Bank, ROB 0565), в стромальных мышиных клетках MCHT-1/26 и в клетках HPDL, как показано в Nakamura et al. 2003, J. Periodontal Res. 38,597-605.
Концентрации GDF-5-родственных белков в композициях этого изобретения должны выбираться в зависимости от способа и периода применения. В основном, GDF-5-родственные белки являются высоко эффективными цитокинами, которые способны индуцировать эффекты даже в незначительных количествах. Как можно легко определить при помощи различных систем биологических анализов, таких как, например, анализ щелочной фосфатазы, описанный здесь, концентрация 0,1 пг GDF-5 на мл соответствующего раствора является достаточной для вызывания биологических действий. Таким образом, низкие концентрации, т.е. находящиеся в диапазоне от 0,1 пг/мл до 1 нг/мл или менее, являются предпочтительными при повторном введении композиций этого изобретения. Однако, максимальные эффекты являются достигаемыми с более высокими концентрациями фактора роста 1-100 нг/мл. Независимый от дозы анализ реакции действия GDF-5, использующий широкий диапазон серийных разведений (0,3-80 нг/мл, Farkas et al. 1997, Neurosci. Lett. 236, 120-122), давал оптимальные результаты при концентрации 20 нг GDF-5 на мл. In vivo кожные модели обычно используют высокие дозы 1-10 мкг/мл. Таким образом, в одном предпочтительном варианте этого изобретения, композиции этого изобретения содержат GDF-5-родственные белки в концентрациях между 0,1 пг/мл и 10 мкг/мл. Предпочтительные общие дозы GDF-5-родственных белков в случае одноразового введения находятся в диапазоне от 10 нг до 10 мкг.
Следующий аспект этого изобретения относится к дополнительным ингредиентам и компонентам, описанным здесь.
Кроме того, эти ткани могут содержать природные и синтетические липиды. Все типы природных и синтетических масел/липидов могут быть использованы, пока они являются биосовместимыми, например, синтетические масла или насыщенные эфиры, такие как этилпальмитат, изопропилпальмитат, алкилмиристаты, такие как изопропил-, бутил- и цетилмиристаты, гексилстеарат, триглицериды (т.е. октановая или декановая кислоты, триглицериды со средней цепью, такие как Miglyol® 812), цетилрицинолеат, стеарилоктаноат (пурцеллиновое масло) и гидрогенизированный полиизобутен, или природные масла, такие как, например, хлопковое, соевое, кунжутное, подсолнечное, сафлоровое, оливковое масло, масло авокадо, арахисовое масло, ореховое масло, миндальное масло и масло лесного ореха.
Эти ткани могут также содержать эмульгирующие агенты, такие как, например, фосфолипиды, такие как фосфатидилсерин, фосфатидилхолин или фосфатидилэтаноламин, дистиллированные моноглицериды, моно- и диглицериды, эфиры уксусной кислоты моноглицеридов, органические эфиры моноглицеридов, эфиры жирных кислот сорбитана, эфиры жирных кислот пропиленгликоля и эфиры жирных кислот полиглицерина.
Другой биоактивный белок(белки), наряду с GDF-5-родственными белками, может также быть частью тканей данного изобретения. Было показано, что TGF-β увеличивает размер регенированной дермы и стабилизирует дермо-эпителиальное соединение (Fitzpatrick and Rosen, J. Cosmet. Laser Ther, 5: 25-34 (2003)). Коктейль (TNS Recovery Complex, SkinMedica, Inc. Carlsbad, CA, USA), содержащий семь цитокинов (VEGF, IL-6 и -8, HGF, PDGF-a, GCSF и TGF-β1), приготовленный из фибробластов крайней плоти, тестировали в многоцентровом исследовании. Оценка показала улучшение структуры кожи и уменьшение появления морщин (Rokhsar, C.K. et at., Dermatol. Surg. 31: 1166-1178 (2005)). Рекомбинантный эпидермальный фактор роста (ReVive Skincare); и фактор роста растений N-фурфуриладенин (кинетин) также являются доступными в продаже. Все эти белки могут быть использованы вместе с GDF-5-родственными белками этого изобретения. Другие белки, которые действуют синергически при объединении с GDF-5-родственными белками, описаны в литературе/патентах, например, в WO 99/15191. Предпочтительными являются нейротрофины, белки hedgehog и белки семейства трансформирующих факторов роста, включающих, но не ограничивающихся ими, TGF-альфа, TGF-бета, активины, BMP и GDF. Особенно предпочтительной является комбинация с любым из EGF, TGF-β1, TGF-β2, TGF-β3, NGF и/или GDNF.
Другими приемлемыми компонентами в этих тканях являются:
- Ретиноиды (производные витамина A), которые сохраняют целостность слизистых/эпителиальных поверхностей;
- Гидроксикислоты (органические карбоновые кислоты, дополнительно классифицируемые в альфа-гидроксикислоты (AHA) и бета-гидроксикислоту (BHA)), которые усиливают эпидермальное отшелушивание, т.е. гликолевая кислота, молочная кислота, лимонная кислота, миндальная кислота, яблочная кислота и винная кислота;
- Антиоксиданты, которые противодействуют вредным эффектам свободных радикалов, т.е. витамин С, витамин Е, пантенол, липоевая кислота, убихинон, ниацинамид, диметиламиноэтанол, спиновые ловушки, мелатонин, каталаза, глутатион, супероксиддисмутаза, пероксидаза, глюкопиранозиды, полифенолы, цистеин, аллантоин, фурфуриладенин, мочевая кислота и карнозин;
- Депигментирующие агенты, которые ослабляют гиперпигментацию, т.е. N-ацетил-4-S-цистеанимилфенол, койевая кислота, арбутин, азалеиновая кислота, paper-mulberry соединение, агенты химического отшелушивания (резорцинол, салициловая кислота), рецептура (формула) Kligman, рецептура Pathak и рецептура Westerhof;
- Ботанические агенты, т.е. ромашка, женьшень, Gingko biloba, куркумин, глицирризин, капсаицин и алоэ древовидное;
- Гликозаминогликаны, которые поддерживают эпидермальную регенерацию, т.е. гиалуроновая кислота;
- Антицеллюлиты, которые опосредуют липолиз, т.е. бета-адренергические стимуляторы, такие как теобромин, теофиллин, аминофиллин, кофеин, эпинефрин и альфа-1-адренергические стимуляторы, такие как иохимбин, пипероксан и фентоламин;
- Гормоны, т.е. эстрогены, прогестерон, тестостерон и гормон роста;
- Противомикробные агенты, т.е. триклозан, хлоргексидин, повидон-иод, пероксид водорода, противоперхотные препараты, цинк-пиритион;
- Химические УФ-фильтры, т.е. 3-бензилиден-камфора (3-BC) или 4-метилбензилиден-камфора (4-MBC);
- Кроме того, буферы, стабилизаторы, консерванты, восстанавливающие агенты, антиоксидант-хелатирующие агенты, агенты, которые модифицируют изотоничность, дезодоранты, анестетики, адъюванты и увеличивающие растворимость агенты.
Они являются только неограничивающими примерами возможных добавок, и квалифицированный в данной области исследователь может легко добавлять другие эксципиенты, которые используются в настоящее время и обычно считаются безопасными. В отношении большей информации о способах для приготовления фармацевтической композиции и отбора фармацевтически приемлемых веществ см., например, Remington's Pharmaceutical Sciences (Iuth ed.; Mack Publishing Company, Eaton, Pennsylvania, 1990), Wang et al. (1980), J. Parent. Drug Assn. 34 (6): 452-462 (1980); Wang et al. (1988), J. Parent. Sci. and Tech. 42: 4-26; Lachman et al. (1968), Drug and Cosmetic Industry 102(1): 36-38, 40 and 146-148; and Akers (1988) J. Parent. Sci. and Tech. 36 (5): 222-228.
Предпочтительно между 1% и 100% этого биологически активного вещества элюируются из нетканого материала в течение 3-7 дней в контакте с жидкостями организма, плазмой, средой или буферным раствором. Наиболее предпочтительно между 10% и 100% биоактивного вещества выделяется при физиологических условиях (ЗФР-буфер, 10% фетальная телячья сыворотка, 37°С).
Следующие фигуры, примеры и протоколы последовательности предназначены для дополнительной иллюстрации этого изобретения.
SEQ ID NO: 1 показывает ДНК-последовательность и SEQ ID NO: 2 показывает последовательность белка-предшественника GDF-5 человека.
SEQ ID NO: 3 показывает ДНК-последовательность и SEQ ID NO: 4 показывает последовательность белка зрелого мономерного GDF-5 человека.
Фигуры
ФИГ.1 показывает дополнительные признаки белка-предшественника GDF-5 человека в соответствии с SEQ ID NO:2:
aa 001-381 пре-продомен (жирные буквы)
aa 001-027 сигнальный пептид (жирные и подчеркнутые буквы)
aa 382-501 часть зрелого белка
aa 400-501 цистин-узел-домен (подчеркнутый)
ФИГ.2 показывает сравнение 102 aa-доменов цистин-узел GDF-5 человека (SEQ ID NO:2), GDF-6 человека (последовательность 26 из U.S. Pat. No. 5,658,882) и GDF-7 человека (последовательность 2 из U.S. Pat. No. 5,658,882). Аминокислотные остатки, которые являются идентичными во всех трех молекулах, выделены границами.
ФИГ.3 показывает таблицу с идентичностями последовательностей цистин-узел-доменов нескольких известных BMP и GDF относительно цистин-узел-домена GDF-5 человека.
ФИГ.4 показывает микроскопическое изображение нетканого материала гамма-стерилизованный желатин/гиалуроновая кислота с rhGDF-5 (масштабная шкала 200 мкм).
ФИГ.5 показывает микроскопическое изображение нетканого материала гамма-стерилизованный желатин/гидроксилапатит (масштабная шкала 200 мкм).
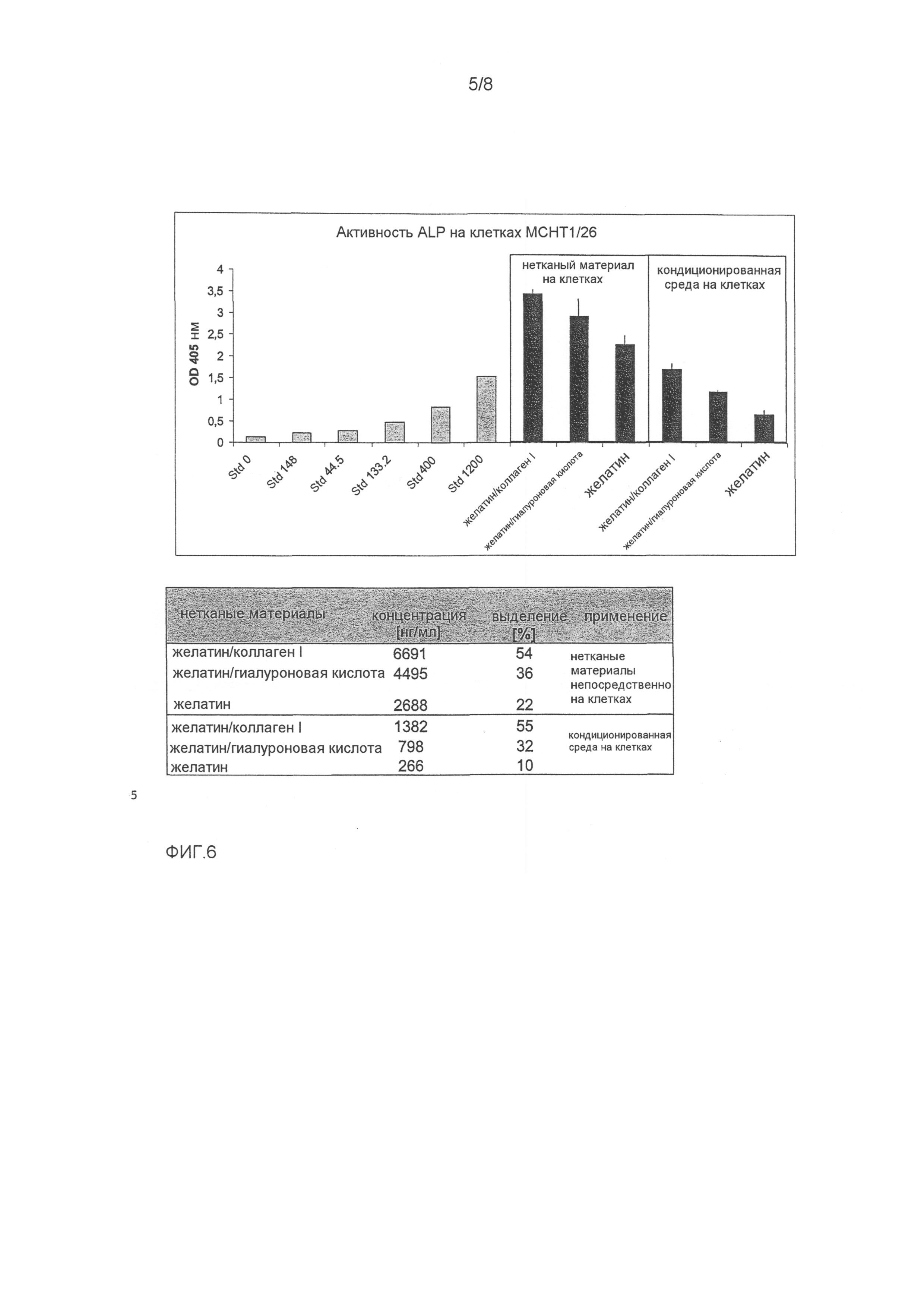
ФИГ.6 показывает биологическую активность GDF-5, выделяемого из нетканых материалов быстрого выделения желатина, желатина/гиалуроновой кислоты и желатина/коллагена I. Биологическую активность GDF-5 измеряли с использованием анализа активности щелочной фосфатазы на мышиных стромальных клетках MCHT1/26, как описано в примере 1. Клетки MCHT1/26 стимулировались с 4,8-1200 нг/мл GDF-5, растворенного в 10 мМ HCl (стандартная кривая).
Выделение GDF-5 из нетканых материалов анализировали помещением нетканых материалов непосредственно на клетки MCHT1/26 и параллельно с кондиционированной средой, полученной высвобождением GDF-5 в среде для культивирования клеток в течение 3 дней при 37°C. Активность ALP измеряли превращением п-нитрофенолфосфата в п-нитрофенолят при 405 нМ. Эти данные являются средними величинами трех независимых измерений.
Присоединенная таблица показывает рассчитанные концентрации выделенного GDF-5 (нг/мл) из соответствующих нетканых материалов, и это извлечение GDF-5 приводится в %. Для расчета предполагалось, что 2 мкг GDF-5, нанесенных на нетканый материал, полностью выделялись в 160 мкл среды для культивирования клеток, и это соответствует концентрации GDF-5 12500 нг/мл (100% величине выделения для анализа с неткаными материалами, непосредственно тестированной на этих клетках). В случае количественного определения этой кондиционированной среды на этих клетках, 40 мкл выделения среды для культивирования клеток соответствует концентрации GDF-5 2500 нг/мл (100% величине выделения для анализа с кондиционированной средой для культивирования клеток, тестируемой на этих клетках).
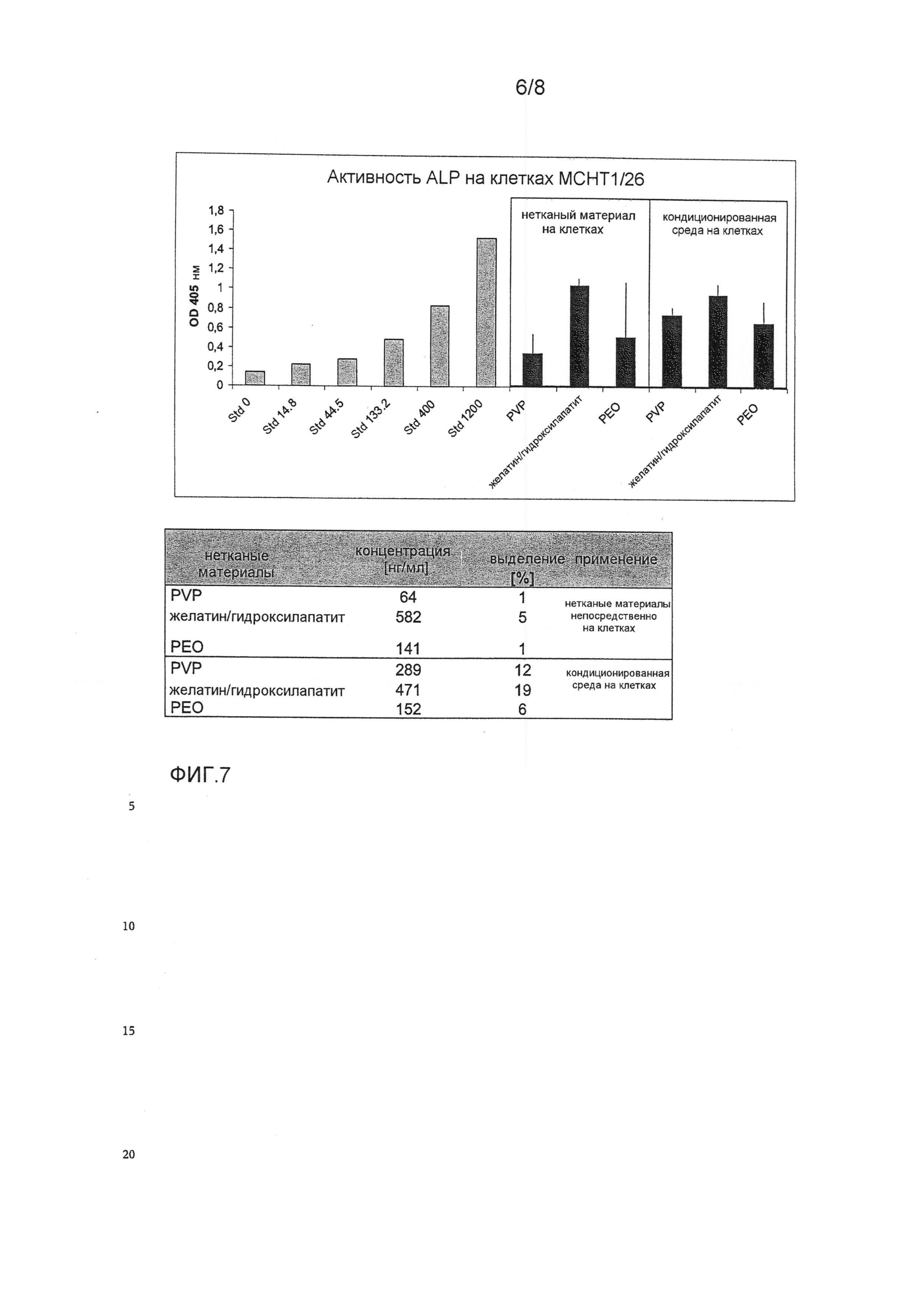
ФИГ.7 показывает биологическую активность GDF-5, выделяемого из нетканых материалов медленного выделения поливинилпирролидона, полиэтиленоксида и желатина/гидроксилапатита. Биологическую активность GDF-5 измеряли с использованием анализа активности щелочной фосфатазы на мышиных стромальных клетках MCHT1/26, как описано в примере 1. Клетки MCHT1/26 стимулировали 4,8-1200 нг/мл GDF-5, растворенного в 10 мМ HCl (стандартная кривая).
Выделение GDF-5 из нетканых материалов анализировали помещением нетканых материалов непосредственно на клетки MCHT1/26 и параллельно с кондиционированной средой, полученной высвобождением GDF-5 в среде для культивирования клеток в течение 3 дней при 37°C. Активность ALP измеряли превращением п-нитрофенолфосфата в п-нитрофенолят при 405 нМ. Эти данные являются средними величинами трех независимых измерений.
Присоединенная таблица показывает рассчитанные концентрации выделенного GDF-5 (нг/мл) из соответствующих нетканых материалов, и это извлечение GDF-5 приводится в %. Для расчета предполагалось, что 2 мкг GDF-5, нанесенных на нетканый материал, полностью выделялись в 160 мкл среды для культивирования клеток, и это соответствует концентрации GDF-5 12500 нг/мл (100% величине выделения для анализа с неткаными материалами, непосредственно тестированной на этих клетках). В случае количественного определения этой кондиционированной среды на этих клетках, 40 мкл выделения среды для культивирования клеток соответствует концентрации GDF-5 2500 нг/мл (100% величине выделения для анализа с кондиционированной средой для культивирования клеток, тестируемой на этих клетках).
ФИГ.8 показывает биологическую активность и извлечение GDF-5 из нетканых материалов GDF-5 перед и после стерилизации гамма-облучением. Биологическую активность измеряли с использованием анализа активности щелочной фосфатазы на мышиных стромальных клетках MCHT1/26. Извлечение выделенного GDF-5 из нетканых материалов определяли количественно при помощи GDF-5-специфического сэндвич-ELISA. Выделение GDF-5 из нетканых материалов анализировали помещением нетканых материалов в среде для культивирования клеток в течение 24 часов при 37°C. Равное количество GDF-5 без нетканого материала инкубировали в среде для культивирования клеток при идентичных условиях, и оно служило в качестве положительного контроля. Активность ALP измеряли превращением п-нитрофенолфосфата в п-нитрофенолят при 405 нМ. Эти данные являются средними величинами трех независимых измерений. Для ELISA, извлечение GDF-5 определяли количественно по количеству связанной со стрептавидином пероксидазы хрена с биотинилированным вторичным антителом. Детектирование проводили ферментативным превращением субстрата дигидрохлорида тетраметилбензидина, с последующей фотометрией при 450 нм.
Эта таблица показывает рассчитанную биологическую активность, измеренную с использованием анализа активности ALP, приведенной в % (величину OD положительного контроля устанавливали на 100%). Для данных ELISA, эта таблица показывает извлечение GDF-5 из нетканого материала, приведенное в %. Для расчета предполагается, что 200 нг GDF-5, включенные в этот нетканый материал, полностью выделялись в 200 мкл среды для культивирования, что соответствует концентрации GDF-5 1000 нг/мл (100% величине).
ФИГ.9 показывает результаты исследования стабильности стерилизованного GDF-5, включенного в нетканые материалы, хранимые при комнатной температуре, 4°C и -80°C в течение периода времени 1 день - 3 месяца. День 0 является стартовой точкой этого исследования стабильности. Стабильность GDF-5 исследовали измерением извлечения GDF-5, выделенного из стерилизованных нетканых материалов посредством GDF-5-специфического сэндвич-ELISA. Выделение GDF-5 из нетканых материалов анализировали помещением нетканых материалов в среду для культивирования клеток в течение 24 часов при 37°C. Определенное количество среды выделения переносили в систему ELISA, где извлечение GDF-5 определяли количественно по количеству связанной со стрептавидином пероксидазы хрена с биотинилированным вторичным антителом. Детектирование проводили ферментативным превращением субстрата дигидрохлорида тетраметилбензидина, с последующей фотометрией при 450 нм. Эта таблица показывает извлечение GDF-5 из нетканого материала, приведенное в %, рассчитанное из выделенного GDF-5.
Примеры
Пример 1. Нетканые материалы, показывающие профиль быстрого выделения GDF-5
Нетканые материалы, обнаруживающие быстрое выделение GDF-5, состоящие из чистого желатина, желатина и гиалуроновой кислоты, или желатина и коллагена I, получали следующим образом:
22,5% (масс/масс) водный раствор желатина типа А PIGSKIN (Gelita AG, Eberbach, Germany) готовили смешиванием желатина и воды. Эту смесь хранили в течение одного часа при комнатной температуре для набухания. После этого, раствор желатина обрабатывали в течение одного часа ультразвуком при 60°C и нагревали до 80°C. Раствор оставляли стоять при 80°C в течение 2 часов и опять охлаждали до 60°C. В зависимости от желаемой нетканой композиции, 12,5% (масса на массу желатина) гиалуроновую кислоту (cristalhyal, Soiiance, France) или гель коллагена I (DM04, Devro Medical, Australia) примешивали в этот раствор и перемешивали шпателем для растворения или диспергирования. Этот раствор на основе желатина подавали шприцевым насосом во вращательное устройство, описанное в DE 10 2005 048 939 A.
В случае включения фактора роста в эти волокна, раствор GDF-5 (1200 мкг/мл 5 мМ натрий-ацетатный буфер) примешивали в этот раствор непосредственно перед вхождением в контейнер на вращательном устройстве. Контейнер нагревали до 50°C и вращали при 3500 об/мин. Вследствие центростремительной силы жидкий материал выталкивался в виде струй жидкости из отверстий и образовывались волокна. Эти волокна растягивались механизмом разрежения ниже контейнера этого вращательного устройства и собирались в виде нетканого материала. Этот нетканый материал собирали и штамповали до конечного размера пробы (3 × 3 мм). Получали нетканые пробы, обнаруживающие быстрые выделения GDF-5, которые после этого гамма-стерилизовали (доза облучения 25 кГр).
Выделение GDF-5 из этих нетканых проб измеряли с использованием анализа активности GDF-5-чувствительной щелочной фосфатазы (ALP) на стромальных клетках MCHT1/26 мыши (Hoechst Japan Ltd., Kawagoe, Japan). Свойства выделения и клеточную совместимость этих нетканых материалов тестировали a) непосредственно на этих клетках и b) с кондиционированной средой. Для получения кондиционированной среды, нетканые пробы инкубировали в течение трех дней при 37°C, 5% CO2 в 200 мкл среде для культивирования клеток (альфа-MEM, дополненной 2 мМ L-глутамином и 10% фетальной телячьей сывороткой) без клеток. После этого периода инкубации кондиционированную среду и нетканые пробы анализировали на клетках MCHT1/26.
Клетки MCHT1/26 высевали при 4,5 × 103 клеток на лунку в 96-многолуночные планшеты в среде для культивирования клеток (альфа-MEM, (Sigma, Taufkirchen, Germany), дополненной 2 мМ L-глутамином, (Invitrogen, Karlsruhe, Germany) и 10% фетальной телячьей сывороткой (Invitrogen, Karlsruhe, Germany). После 24 часов клетки инкубировали с 40 мкл кондиционированной среды для выделения, дополненной 120 мкл свежей среды для культивирования клеток. Параллельно нетканые пробы помещали непосредственно на клетки с 160 мкл среды для культивирования клеток. После 72 часов, клетки промывали забуференным фосфатом солевым раствором (PBS) и экстрагировали щелочным фосфатным буфером 1, содержащим 1% Nonidet P40, 0,1 M глицин pH 9,6 (Sigma, Taufkirchen, Germany), 1 мМ MgCl2 и 1 мМ ZnCl2 (Merck, Darmstadt, Germany). Для достижения полного лизиса клеток эти клетки инкубировали 15-18 часов при 37°C. Активность щелочной фосфатазы анализировали с 10 мМ п-нитрофенилфосфатом (Pierce, Bonn, Germany) в качестве субстрата в 0,1 M глицине pH 9,6, 1 мМ MgCl2 и 1 мМ ZnCl2. После 30 минут инкубирования при 37°C, оптическую плотность измеряли автоматическим микропланшет-ридером (Tecan Spectra Rainbow, TECAN, Crailsheim, Germany) при 405 нМ с учетом вычитания холостых величин. Результаты показаны на Фигуре 6.
Все нетканые пробы хорошо переносились маркерной клеточной линией MCHT1/26. Нетканые пробы с GDF-5 показывали быстрое высвобождение желатинового материала, 22% при помещении непосредственно на клетки и 10% для кондиционированной среды. Для нетканой комбинации желатин/гиалуроновая кислота высвобождение GDF-5 непосредственно на клетках было равно 36%, с кондиционированной средой это высвобождение было равно 32%. Для нетканой комбинации желатин/коллаген I, высвобождение GDF-5 непосредственно на клетках было равно 54%, с кондиционированной средой это высвобождение было равно 55%.
Такие пробы, показывающие быстрое выделение GDF-5, могут быть использованы для заживления ран, нейропротекции и ангиогенеза, когда высокие дозы этого активного фактора роста высвобождаются в окружение раны во время первых трех дней.
Пример 2. Нетканые материалы, обнаруживающие профиль медленного выделения GDF-5
Нетканые материалы, обнаруживающие медленное выделение GDF-5, состоящие из поливинилпирролидона (A.), полиэтиленоксида (B.) или желатина и гидроксилапатита (C.), получали следующим образом.
Сначала готовили жидкие растворы-предшественники.
A.) 40 г поливинилпирролидона (Kollidon F 90, BASF AG., Germany) помещали в химический стакан и добавляли стержень магнитной мешалки и 160 г воды. После этого смесь перемешивали при комнатной температуре в течение 24 часов и нагревали до 80°C. Наконец раствор обрабатывали в течение одного часа ультразвуком перед охлаждением обратно до 60°C.
B.) 15 г полиэтиленоксида (молекулярная масса 1000 кДа, BASF AG., Germany) растворяли в 185 г воды при комнатной температуре и нагревали до 60°C.
C.) 22,5% (масс/масс) водный раствор желатина типа А PIGSKIN готовили смешиванием желатина и воды. Смесь выдерживали в течение одного часа при комнатной температуре для набухания. После этого, раствор желатина обрабатывали в течение одного часа ультразвуком при 60°C. Наночастицы 2,5% гидроксилапатита (номер продукта 677418, Sigma-Aldrich Chemie GmbH, Germany) (масса на массу желатина) примешивали в раствор при помощи шпателя. После этого, смесь нагревали до 80°C и оставляли в течение 2 часов при этой температуре перед охлаждением опять до 60°C.
Растворы или дисперсии подавали шприцевым насосом во вращательное устройство, описанное в DE 10 2005 048 939 A. В случае включения фактора роста в эти волокна, раствор GDF-5 (1200 мкг/мл 5 мМ натрий-ацетатный буфер) примешивали в раствор непосредственно перед введением в контейнер вращательного устройства. Контейнер нагревали до 60°C и вращали при 4500 об/мин. Вследствие центростремительной силы жидкий материал выталкивался в виде струй жидкости из отверстий и образовывались волокна. Эти волокна растягивались механизмом разрежения ниже контейнера этого вращательного устройства и собирались в виде нетканого материала. Эти нетканые материалы собирали и штамповали до конечного размера пробы (3×3 мм). Получали нетканые пробы, обнаруживающие медленные выделения GDF-5, которые после этого гамма-стерилизовали (доза облучения 25 кГр).
Измерение нетканых проб с GDF-5 выполняли, как описано в примере 1. Выделение GDF-5 из нетканых проб измеряли с использованием анализа активности щелочной фосфатазы на стромальных клетках MCHT1/26 мыши. Свойства выделения и клеточную совместимость этих нетканых прототипов тестировали a) непосредственно на этих клетках и b) с кондиционированной средой. Результаты для нетканых проб медленного выделения поливинилпирролидона, полиэтиленоксида и желатин/гидроксилапатита показаны на Фигуре 7.
Нетканые материалы с GDF-5 обнаруживали медленное выделение с поливинилпирролидоном (PVP) 1%, когда нетканые пробы помещали непосредственно на клетки, и 12% для кондиционированной среды. Для нетканого материала полиэтиленоксида (PEO) выделение GDF-5 непосредственно на этих клетках было равно 1%, с кондиционированной средой это выделение было равно 6%. Для нетканой комбинации желатин/гидроксилапатит, выделение GDF-5 непосредственно на этих клетках было равно 5%, с кондиционированной средой это выделение было равно 19%.
Такие пробы, обнаруживающие медленное выделение GDF-5, могут быть использованы для регенерации кости или хряща, так как только малые количества активного фактора роста выделяются в течение первых трех дней.
Пример 3. Нетканая технология защищает включенный GDF-5 от дестабилизации условий стерилизации
Исследовали влияние стерилизации на стабильность включенного в нетканый материал GDF-5. Таким образом, извлечение и биологическую активность GDF-5, включенного в нетканые материалы, тестировали до и после процесса стерилизации. Для этой цели, нетканые материалы с включенным GDF-5 получали, как описано в примере 1. Вкратце, раствор GDF-5 200 мкг/мл 5 мМ натрий-ацетатного буфера примешивали в смесь желатин/коллаген I, с получением нетканых материалов 200 нг GDF-5/3×3 мм. Эти нетканые материалы штамповали до размера проб 3×3 мм и гамма-стерилизовали (доза облучения 25 кГр).
Извлечение выделенного GDF-5 из нетканых материалов определяли количественно при помощи ELISA и биологическую активность GDF-5 измеряли по индукции щелочной фосфатазы (анализ активности ALP).
Измерение биоактивности GDF-5 нестерилизованных и стерилизованных нетканых материалов с использованием анализа ALP описано в примере 1. Количество GDF-5, высвобождаемого из нетканых материалов до и после стерилизации, определяли следующим образом: нетканые материалы с включенным GDF-5 инкубировали в течение 24 часов при 37°C, 5% CO2 в 200 мкл среды для культивирования клеток (альфа-MEM, дополненной 2 мМ L-глутамином и 10% фетальной телячьей сывороткой). В качестве положительного контроля, 200 нг GDF-5 без нетканого материала инкубировали при идентичных условиях. После этого периода инкубации среду выделения и положительный контроль разводили 1:2500 и 1:4000 и переносили в GDF-5-специфический сэндвич-ELISA (Biopharm, Heidelberg, Germany). Анализ ELISA основывался на двух моноклональных антителах к GDF-5. Фермент стрептавидин-пероксидаза хрена связывали с биотинилированным вторичным антителом. Детектирование проводили ферментативным превращением этого субстрата дигидрохлорида тетраметилбензидина, которое определяли фотометрией при 450 нм. Пробы выделения с GDF-5 и положительный контроль определяли количественно с использованием тест-серий стандартов CDF-5 в диапазоне от 50 до 500 пг/мл. Результаты показаны на Фигуре 8.
После гамма-стерилизации (доза облучения 25 кГр) нетканых материалов с включенным GDF-5, более 95% GDF-5 были биологически активными, что демонстрировалось посредством анализа активности ALP на клетках MCHT1/26. Кроме того, извлечение включенного GDF-5 из нетканого материала после стерилизации было равно 95%, при количественном определении GDF-5-специфическим способом ELISA.
Пример 4. GDF-5, включенный в нетканые материалы, показывает долгосрочную стабильность при низких и высоких температурах хранения
Исследовали влияние продолжительности хранения и температуры хранения на стабильность включенного GDF-5 в нетканый материал. Нетканые материалы с включенным GDF-5 хранили при комнатной температуре, 4°С и -80°C в течение периода времени до 3 месяцев.
Для тестирования стабильности GDF-5, включенного в нетканых материалах, нетканые пробы готовили в день 0 и хранили при комнатной температуре, 4оС и -80°C. После периода хранения 1 день, 3 дня, 2 недели, 4 недели и 3 месяца пробы соответствующих условий температуры анализировали на стабильность с использованием способа ELISA.
Нетканые материалы с включенным GDF-5 получали, как описано в примере 1. Вкратце, раствор GDF-5 200 мкг/мл 5 мМ натрий-ацетатного буфера примешивали в смесь желатин/коллаген I, с получением нетканых материалов 200 нг GDF-5/3×3 мм. Нетканые материалы штамповали до размера проб 3×3 мм и гамма-стерилизовали (доза облучения 25 кГр). Стабильность GDF-5 анализировали измерением извлечения выделенного активного GDF-5 из этих нетканых материалов в среду для культивирования клеток. Нетканые материалы с включенным GDF-5 инкубировали в течение 24 часов при 37°C, 5% CO2 в 200 мкл среды для культивирования клеток (альфа-MEM, дополненной 2 мМ L-глутамином и 10% фетальной телячьей сывороткой). После периода инкубации среду выделения разбавляли 1:2500 и 1:4000 и переносили в GDF-5-специфический сэндвич-ELISA (Biopharm, Heidelberg, Germany). Выделение проб с GDF-5 определяли количественно с использованием тест-серий стандартов GDF-5 в диапазоне от 50 до 500 пг/мл. Результаты для ELISA показаны на Фигуре 9.
Извлечение GDF-5 из стерилизованных нетканых материалов в день 0 (стартовая точка исследования стабильности) было более 90%. Стабильность GDF-5, включенного в нетканых материалах, была почти идентична для некоторых температурных условий (при комнатной температуре, 4°C и -80°C). После периода хранения 3 месяцев при комнатной температуре не была обнаружена потеря стабильности.