Результат интеллектуальной деятельности: ОПТИМИЗИРОВАННЫЙ СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ФАКТОРА РОСТА
Вид РИД
Изобретение
Это изобретение относится к усовершенствованному способу эффективного продуцирования в прокариотах и очистки рекомбинантных белков фактора роста. Более конкретно, изобретение касается модификаций способа, приводящих к более высокому выходу белка, к большей чистоте продукта и к улучшенной промышленной применимости упомянутого способа.
Факторы Роста и Дифференциации (GDF) являются гомодимерными цитокинами, промотирующими клеточную пролиферацию/дифференциацию и регенерацию тканей. Среди всех факторов роста/дифференциации наиболее полезным в широком диапазоне медицинских применений является Фактор Роста/Дифференциации 5 (GDF-5). Ранее наиболее успешно применялись остеогенные свойства GDF-5, например, при оказании помощи при лечении локальных переломов кости. GDF-6 и GDF-7 являются наиболее родственными к GDF-5 белками, с похожими биологическими функциями и чрезвычайно высокой аминокислотной гомологией. Группа GDF-5/-6/-7 консервативна среди млекопитающих, но не имеет ортологов у беспозвоночных (Ducy and Karsenty 2000, Kidney Int. 57, 2207-2214).
In vivo, представители этого белкового семейства изначально синтезируются в виде больших белков-предшественников, которые последовательно подвергаются протеолитической деградации в состоящем из основных аминокислотных остатков кластере, находящемся на расстоянии в 110-140 аминокислотных остатков от С-конца белка; таким образом, от N-концевого продомена отделяются C-концевые биоактивные зрелые белковые фрагменты. Все зрелые полипептиды структурно похожи и содержат консервативные биоактивные домены, содержащие шесть или семь канонических цистеинов. Дисульфидные мостики между этими аминокислотными остатками создают типичный для этого белкового семейства трехмерный мотив "цистиновый узел".
Ранее уже была достигнута экспрессия зрелого GDF-5 в прокариотических клетках-хозяевах (см., например, Biochem. Biophys. Res. Commun., 204, pp.646-652, 1994). Однако эти белки сложно получить в очищенном виде. При их экспрессии в Е. coli в больших объемах, искомый белок часто состоит из мономерного и неактивного белка с молекулярной массой равной 14 кДа, который накапливается в тельцах включения. С целью получения димерного биоактивного фактора роста (28 кДа), мономерный белок из телец включения должен быть солюбилизирован, очищен и ренатурирован с образованием гомодимера с типичной структурой цистеинового узла. Эта процедура часто называется "рефолдингом".
Из-за крайне низкой растворимости в водных растворах при значениях pH от 4 до 9, а также из-за других редких белковых свойств, в способы очистки и рефолдинга продуцируемых в прокариотах GDF-5-подобных белков необходимо включать несколько специально подобранных этапов. Например, поскольку после рефолдинга GDF-5-подобные белки, как правило, адсорбируются хроматографическим носителем, становится очевидным, что очистка искомого белка в больших объемах не может быть осуществлена в соответствии со стандартными протоколами очистки с помощью водных хроматографических компонентов. После рефолдинга белка применимыми являются первичные способы очистки на основе органических растворителей (такие как, обратнофазная хроматография).
Недавно разработанный способ получения и очистки рекомбинантных GDF-5-подобных белков раскрыт в WO 96/33215. Способ основан на очистке перед процедурой рефолдинга мономерного белка и содержит следующие существенные этапы:
1. Выращивание бактериальной культуры, разрушение клеток и высвобождение телец включения,
2. Обработка денатурирующими агентами для получения солюбилизированного мономера,
3. Разделение ионообменной хроматографией,
4. Сульфирование (этап сульфирования не является обязательным),
5. Разделение гель-фильтрацией,
6. Рефолдинг,
7. Разделение изоэлектрической преципитацией,
8. Разделение обратнофазной хроматографией.
Хотя описанный выше способ, в общем, применим, в данном случае на первых двух этапах обработки имеются некоторые трудности, влияющие как на выход, так и на чистоту целевого белка. Достижимый выход GDF-5-подобного белка значительно ниже теоретически ожидаемого, в основном, за счет случаев частичной деградации в связи с необычной мутностью/вязкостью раствора, полученного при солюбилизации белка из телец включения. Таким образом, очевидно, что указанные параметры и условия способа должны быть улучшены.
Цели этого изобретения заключаются в преодолении вышеупомянутых проблем и в оптимизации выхода и чистоты рекомбинантных GDF5-подобных белков.
Эти цели решены путем разработки раскрытых далее усовершенствованных способов для получения рекомбинантных GDF5-подобных белков в Е.coli.
Наиболее часто используемые термины должны быть определены и представлены следующим образом до подробного описания изобретения:
Используемый здесь термин «домен цистинового узла», означает хорошо известный, консервативный, богатый цистеином аминокислотный участок, присутствующий в зрелой части белков суперсемейства TGF-beta, таких как человеческий GDF-5, и формирует трехмерную белковую структуру, известную как цистиновый узел. В этом домене важным является соответствующее расположение относительно друг друга цистеиновых остатков и в нем, в целях сохранения биологической активности, позволены лишь незначительные изменения. Было продемонстрировано, что домен цистинового узла сам по себе достаточен для биологической активности белка (Schreuder et al. (2005), Biochem Biophys Res Commun. 329, 1076-86). Консенсусные последовательности для доменов цистинового узла хорошо известны в данной области. Согласно определению, определенный здесь белковый домен цистинового узла начинается с первого цистеинового остатка, участвующего в цистиновом узле соответствующего белка, и заканчивается на аминокислотном остатке, следующем после последнего цистеина, участвующего в цистиновом узле соответствующего белка. Например, домен цистинового узла белка-предшественника человеческого GDF-5 (SEQ ID NO:1) состоит из аминокислотных остатков 400-501 (см. также фиг.1).
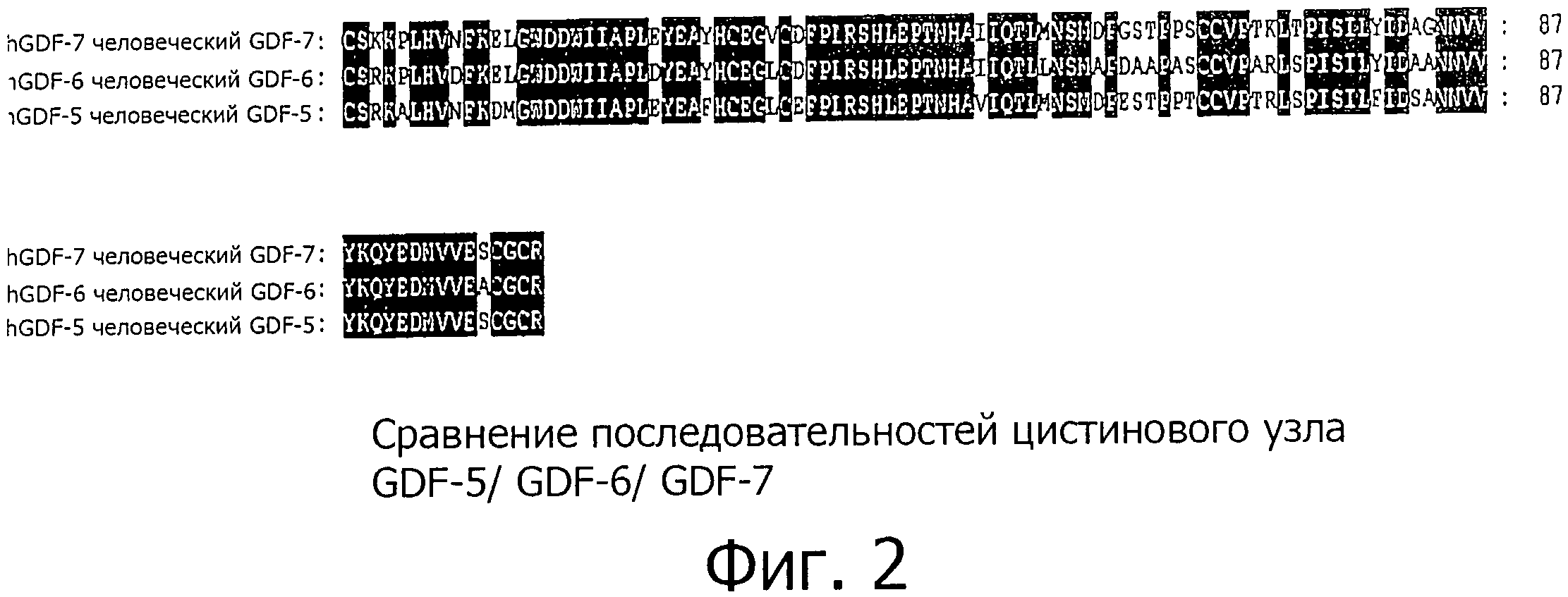
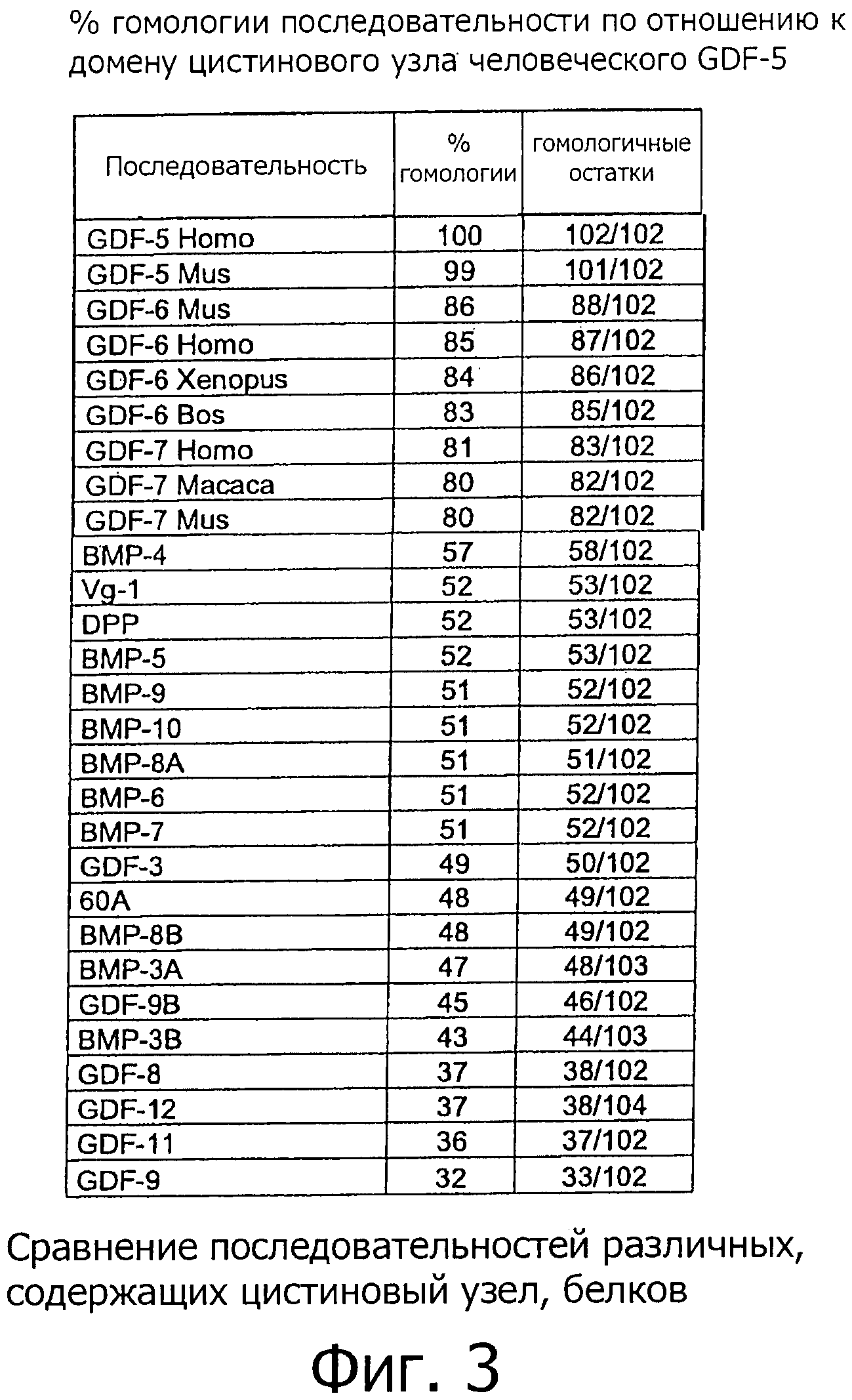
Использованный здесь термин "GDF-5-подобный белок" означает любой естественно или искусственно полученный белок, который содержит домен цистинового узла, гомологичный по аминокислотным остаткам, по меньшей мере, 60% из 102 АК домена цистинового узла человеческого GDF-5 (аминокислоты 400-501 последовательности SEQ ID NO:1). Этот термин включает в себя белки с аналогичными биофизическими свойствами, принадлежащие к группе белков GDF-5, GDF-6 и GDF-7 позвоночных или млекопитающих, а также их рекомбинантные варианты, поскольку последние демонстрируют упомянутый выше процент гомологии с доменом цистинового узла человеческого GDF-5. Равное 60-ти % предельное значение хорошо подходит для отделения представителей группы белков GDF-5/-6/-7, а также их вариантов от других белков таких, как другие GDF и BMP белки. Сравнение состоящих из 102 АК доменов цистинового узла человеческого GDF-5 и человеческого GDF-7 (см. фиг.2) выявило высокую степень аминокислотной гомологии между этими белками. Человеческий GDF-6 совпадает в 87 аминокислотных остатках (85%), а человеческий GDF-7 - в 83 (81%) аминокислотных остатках с доменом цистинового узла человеческого GDF-5. Соответствующие домены молекул GDF-5/-6/-7 из других позвоночных и млекопитающих, определенных на данный момент, также показывают высокий процент гомологии, составляющий, по меньшей мере, 75% (от 79% до 99%) при сравнении с человеческим GDF-5. В отличие от них, GDF и BMP, не принадлежащие к подгруппе GDF-5/-6/-7, демонстрируют гораздо меньшую степень гомологии, ниже 60% (см. фиг.3).
Определение соответствующих позиций аминокислот в соответствующих аминокислотных последовательностях, а также расчет процента гомологии между ними может легко осуществлено с помощью хорошо известных алгоритмов выравнивания, а также с помощью использующих эти алгоритмы компьютерных программ. Например, аминокислотная гомология в этой заявке на патент (например, фиг.2) была рассчитана на выровненных последовательностях с помощью свободно-распространяемой программы ClustalX (Версия 1.81) с оставленными по умолчанию настройками, и с последующим подсчетом идентичных остатков вручную. Настройками по умолчанию для попарного (медленно-точного) выравнивания являются: штраф за открытие делеции: 10; штраф за продолжение делеции: 0,10; матрица сравнения аминокислот: Gonnet 250. Программа ClustalX детально описана в работе Thompson.J.D., Gibson.T.J., Plewniak.F., Jeanmougin.F. and Higgins.D.G. (1997):
The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools.
Nucleic Acids Research 24:4876-4882.
ClustalX является портированной в ОС Windows программой множественного выравнивания последовательностей ClustalW, т.е. доступна из различных источников, например, доступна по анонимным FTP-адресам ftp-igbmc.u-strasbg.fr, ftp.emblheidelberg.de, ftp.ebi.ac.uk или доступна путем загрузки со следующей вэб-страницы: http://www-igbmc.u-strasbg.fr/Biolnfo/. Программа ClustalW и алгоритм также детально описаны в работе Thompson, J. D., Higgins, D. G. and Gibson, T.J. (1994):
CLUSTALW: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice.
Nucleic Acids Research 22:4673-4680.
Используемый здесь термин "вариант", относится к следующим полипетидам:
а) к биологически активным фрагментам белка,
б) к биологически активным белковым конструкциям, содержащим дополнительные последовательности сверх исходной последовательности белка,
в) к любой комбинации а) и б).
Термины "буфер для растворения" или "буфер для солюбилизации" телец включения означают растворы, которые используют для солюбилизации телец включения и денатурации белков из упомянутых телец включения.
Термин "биологическая активность" обозначает активность терапевтических соединений, включающих, например, GDF-5-подобный белок, измеренную обычным in vitro анализом щелочной фосфатазы, например, как описано в примере 5 или в работе Takuwa et al. (1989), Am. J. Physiol. 257, E797-E803. Клеточные линии ATDC-5 или MCHT 1/26 подходят для использования в таком анализе щелочной фосфатазы.
Подробное описание изобретения
Способ производства рекомбинантных GDF-5-подобных белков и особенно человеческого рекомбинантного GDF-5 состоит из следующих начальных этапов: этапа культивирования Е. coli; этапа сбора биомассы; этапа разрушения клеток; этапа сбора/отмывки телец включения и этапа растворения телец включения в денатурирующих условиях. Далее денатурированный белок на последующих этапах подвергается очистке и рефолдингу как, например, описано в WO 96/33215.
Упомянутый этап разрушения клеток обычно производится с помощью гомогенизатора высокого давления. После этого, обычно, тельца включения (ТВ) собираются центрифугированием и (опционально) несколько раз промываются. Тщательное растворение (солюбилизация) белка из телец включения перед последующими этапами очистки достигается за счет образования суспензии в буфере для солюбилизации, содержащем высокие количества денатурированной мочевины.
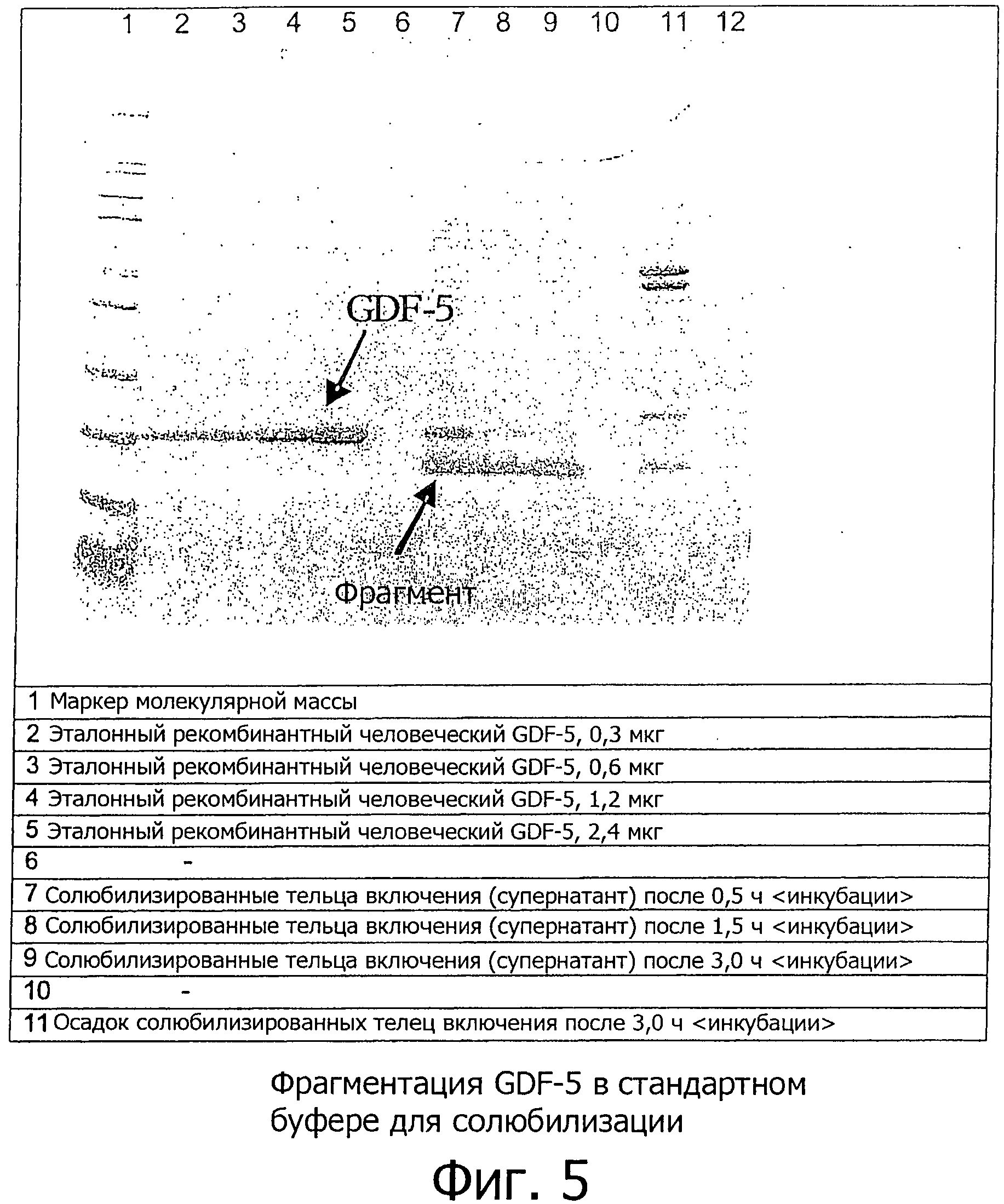
Примечательно, что раствор для солюбилизации, содержащий мономерный и денатурированный белок из телец включения, является крайне мутным и вязким, даже после предварительных этапов фильтрации или центрифугирования. В то же время, происходит время-зависимая фрагментация мономерного GDF-5 (см. фиг.5), процесс, который, в конечном счете, приводит к разрушению/изменению массы значительной доли мономеров GDF-5. Менее чем за 1,5 часа масса зрелого мономерного белка в растворе для растворения значительно уменьшается от первоначальных 14 кДа, до, примерно, 10 кДа. Эта нежелательная и быстрая деградация, по-видимому, является зависимой от аминокислотной последовательности/конформации белка и происходит исключительно на этапе солюбилизации телец включения. Процесс время-зависимой деградации особенно мешает производству белка в больших/промышленных масштабах т.к. производственные периоды из-за повышенных объемов обычно увеличены, что, как следствие, приводит к значительному сокращению выхода и чистоты GDF-5-подобного белка, полученного в конце всей процедуры очистки.
В целях преодоления описанных проблем изобретатели провели многочисленные исследования с помощью различных подходов, приведших, в конце концов, к модификации способа очистки. Эти опыты включали: вариации процедуры разрушения клеток; эксперименты по инактивации протеаз в целях борьбы с потенциальным энизматическим/протеолитическим загрязнением; коррекцию концентраций критических компонентов буферов для солюбилизации и/или отмывки; и добавление различных химических соединений в буфер для солюбилизации.
Принимая во внимание тот факт, что различные подходы для проверки и инактивации предполагаемой, способствующей наблюдаемой деградации белков, протеолитической активности потерпели неудачу (см. пример 3: Химическое ингибирование и термическая инактивация), изобретатели обнаружили, что уменьшение фрагментации белков и более высокие выход/чистота белка могут, тем не менее, быть достигнуты путем введения либо по отдельности, либо (что предпочтительней) вместе, двух важных, связанных со способом, модификаций. Эти модификации являются конкретными воплощениями раскрытого изобретения и относятся к 1) адаптации процедуры разрушения клеток и к 2) оптимизации состава буфера для солюбилизации.
Далее они иллюстрируются более подробно:
1) Модификация разрушения клеток гомогенизацией при высоком давлении
Было обнаружено, что необычно высокие мутность и вязкость раствора для солюбилизации (содержащего солюбилизированные тельца включения) являются пагубными для последующих этапов очистки GDF-5-подобных белков и их следует избегать. Принимая во внимание то, что ни фильтрация, ни дополнительные этапы центрифугирования перед солюбилизацией телец включения, не могут решить эту проблему, неожиданно было обнаружено, что ее решение может быть найдено путем крайне избирательной модификации прилагаемого для разрушения клеток давления. Принимая во внимание то, что давление обычно изменяется в широком диапазоне (например, от 100 до 2000 бар) без драматических последствий для солюбилизации телец включения, крайне важно ограничить это давление в узком диапазоне при очистке GDF-5-подобных белков. Точнее, если для разрушения применяется давление между 800-900 бар, то получается значительно более прозрачный раствор солюбилизированных телец включения и увеличивается выход продукта после первой части способа очистки GDF-5-подобных белков. Кроме того, соотношение рекомбинантный GDF-5 к общему белку существенно улучшилось при высоком давлении для разрушения. Из-за лучшей фильтруемости общее время обработки становится меньше и, следовательно, время-зависимая фрагментация уменьшается. Давления разрушения выше и ниже этого диапазона являются пагубными и ведут к значительному уменьшению выхода белка (см., например, фиг.6).
2) Модификации композиции буфера для солюбилизации
Следующие модификации компонентов буфера для солюбилизации покрываются этим изобретением:
Мочевина/добавка с L-аргинином.
Хотя пагубный эффект мочевины на стабильность первичной структуры факторов роста и дифференциации ранее не был описан для данного уровня техники, изобретателями было обнаружено, что фрагментация GDF-5-подобных белков не происходит, если мочевина полностью удаляется из всех контактирующих с тельцами включения растворов (например, из буферов для отмывки и солюбилизации). Однако, удаление денатурирующего агента из буфера для солюбилизации невозможно из-за необходимости поддержания требуемого эффекта денатурации. К сожалению, замена мочевины на гуанидин гидрохлорид в качестве альтернативного денатурирующего агента не рекомендуется при использовании в оборудовании промышленного производства из-за коррозийных свойств солей гуанидина (которые в некоторых случаях могут приводить к уменьшению экономически целесообразного ресурса труб и танков). Кроме того, гуанидин гидрохлорид очень дорог и может повысить связанные со способом затраты.
Поэтому изобретатели искали альтернативный способ для устранения вышеупомянутого, связанного с протеазами, распада GDF-5. В результате тщательных экспериментов было обнаружено, что упомянутую фрагментацию GDF-5-подобных белков можно устранить в буферах для солюбилизации, содержащих мочевину, если упомянутые растворы в качестве защитной добавки дополнить L-аргинином в определенной концентрации.
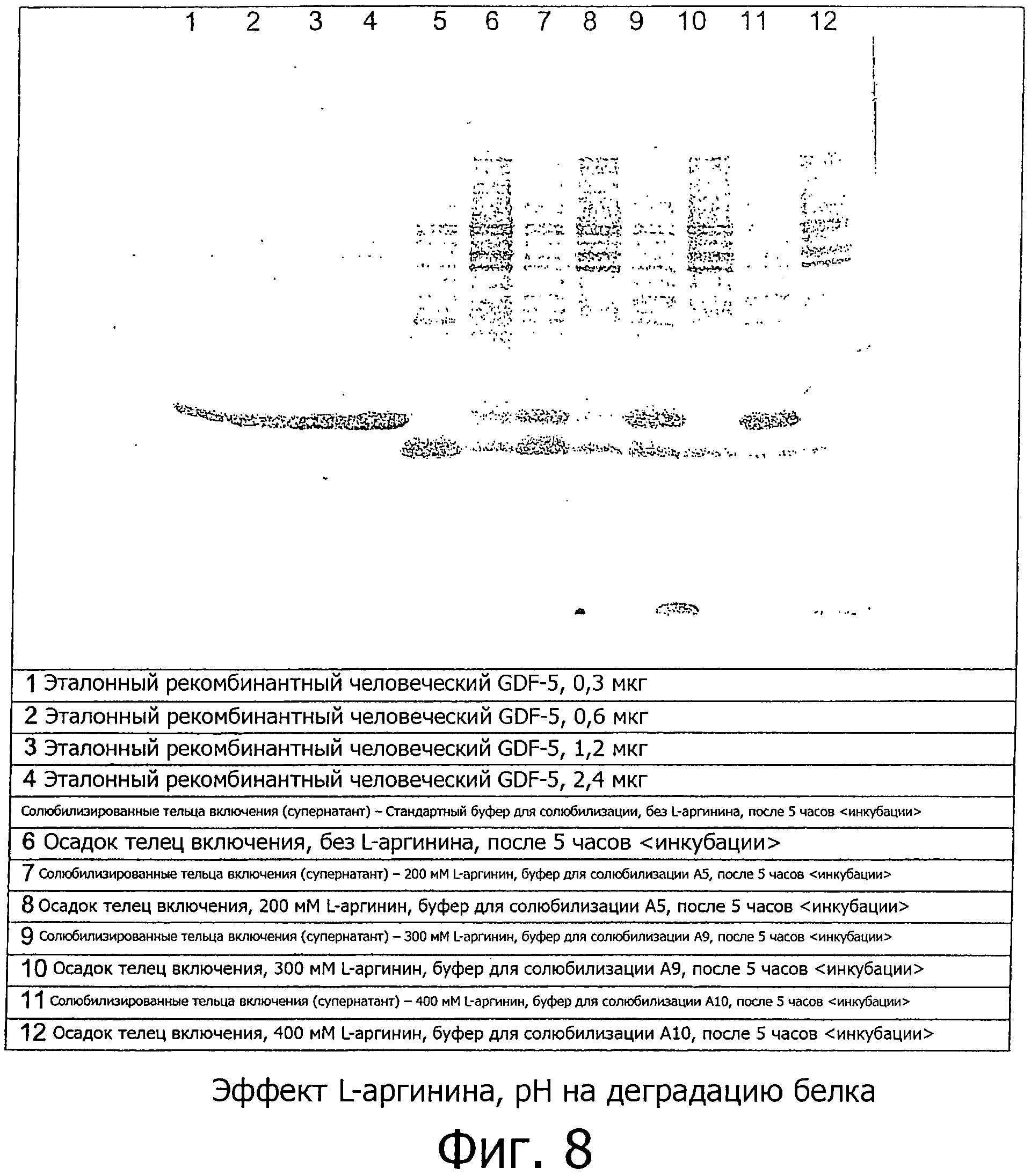
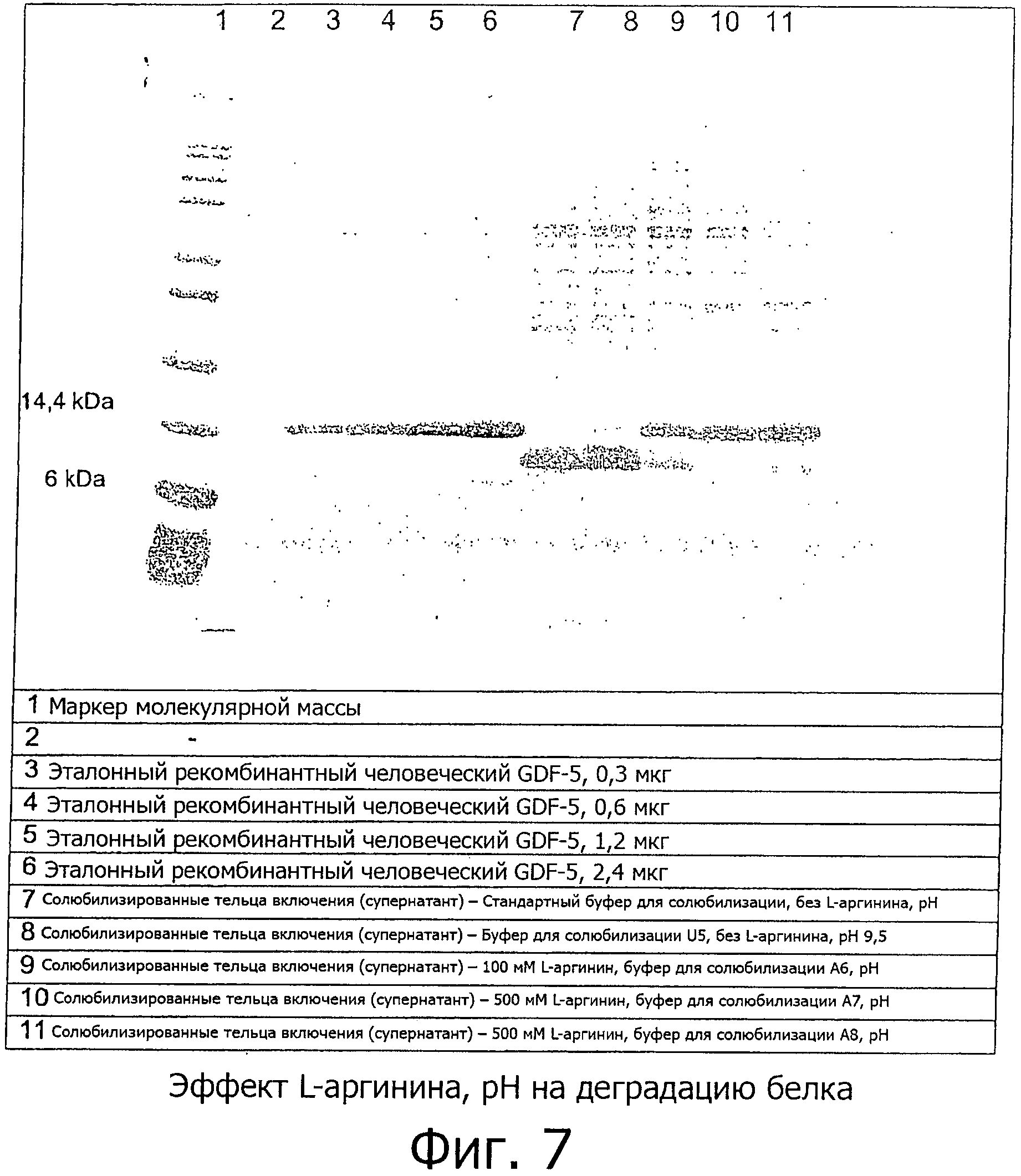
В примере 3/фиг.7 и 8 продемонстрировано, что добавление L-аргинина в содержащие мочевину растворы уменьшает или устраняет деградацию GDF-5 в зависимости от концентрации. Деградация может быть уменьшена примерно на 50 процентов с буферами, содержащими, по меньшей мере, 100 мМ L-аргинина, и может быть полностью остановлена при использовании буферов для растворения, содержащих 500 мМ (или более) L-аргинина. Даже незначительные концентрации L-аргинина (например, 1 мМ L-аргинин в буфере А4 из примера 3) демонстрируют детектируемый, ингибирующий фрагментацию, эффект.
Использование L-аргинина имеет несколько преимуществ при использовании в качестве дополнительного ингредиента мочевина-содержащих буферов для солюбилизации телец включения с GDF-5-подобными белками. Во-первых, L-аргинин является сравнительно недорогим химикатом и экономическая эффективность способа очистки белка сохраняется, несмотря на добавление этого вещества. Во-вторых, комбинация мочевины и L-аргинина значительно менее коррозионна, чем денатурирующий раствор с гуанидин гидрохлоридом. В-третьих, L-аргинин является более экологически чистым химическим соединением по сравнению с солями гуанидина, которые требуют специальной утилизации. Это преимущество делает изобретение особенно полезным для промышленных установок с состоящими из металла устройствами. К тому же L-аргинин может легко быть удален в процессе очистки с помощью простого этапа диафильтрации, например, непосредственно после солюбилизации телец включения. Это особенно важно, поскольку предлагаемое добавление L-аргинина к буферу для солюбилизации мешает последующему связыванию GDF-5-подобных белков на ионобменной хроматографической колонке (см. пример 4). Проведение диафильтрации и ионообменной хроматографии упрощается, если после солюбилизации телец включения в целях удаления высокомолекулярных примесей, таких как клеточный дебрис, применяются (по необходимости) дополнительные этапы очистки (например, центрифугирование, объемная фильтрация и/или стерилизующая фильтрация). Возможные параметры размеров пор для объемной фильтрации составляют 0,1-0,7 мкм, для стерилизующей фильтрации, например, 0,22 мкм.
Таким образом, в соответствии с предпочтительным воплощением изобретения и в целях предотвращения белковой фрагментации/деградации, буфер для солюбилизации телец включения с GDF-5-подобными белками должен содержать L-аргинин. Предпочтительная концентрация этой добавки находится в диапазоне от 100 до 1000 мМ L-аргинина в буферах для солюбилизации по изобретению. Наиболее предпочтительная концентрация равна 400-500 мМ L-аргинина. Однако также возможно использование более высоких концентраций L-аргинина (например, до 2000 мМ), которые могут быть полезны в случае чрезвычайно длительных периодов инкубации/обработки.
Буферам для солюбилизации по изобретению свойственно содержание мочевины в качестве денатурирующего агента в концентрации от 2 до 10 М. Предпочтительно, если концентрация мочевины находится в диапазоне от 4 М до 8 М. Наиболее предпочтительным является буфер для солюбилизации содержащий 6 М мочевину.
Другие части изобретения связаны с дальнейшими модификациями упомянутых буферов для солюбилизации, имеющих менее сильное, но, тем не менее, значительное влияние на производительность способа.
pH:
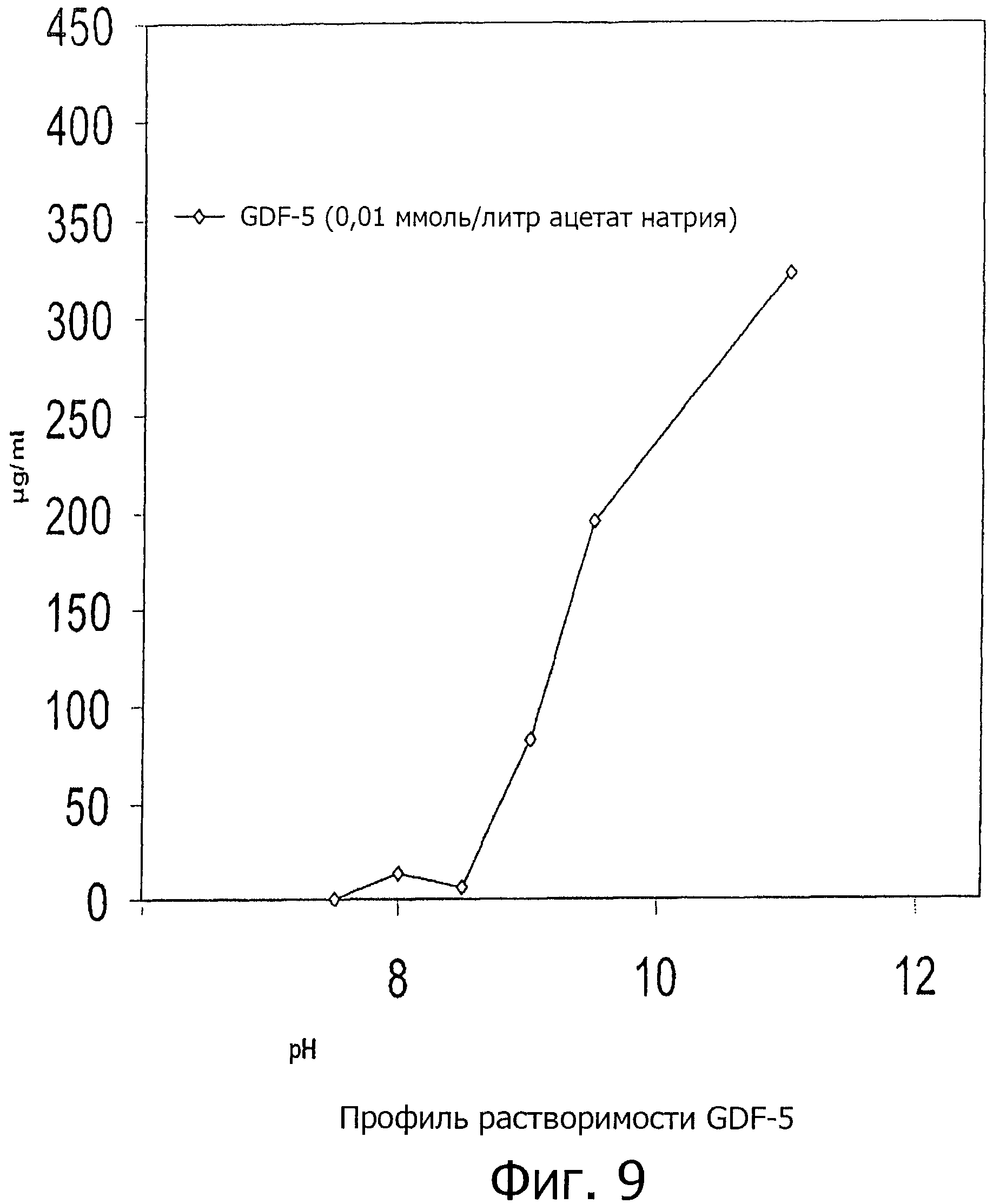
В соответствии со способом очистки рекомбинантного GDF-5, раскрытого в WO 1996/033215, значение pH, равное 8,3, описывается в качестве пригодного для буферов для солюбилизации GDF-5-подобных белков. Однако в настоящее время обнаружено (см. также пример 3 /фиг.7), что использование буферов для солюбилизации с более высокими значениями pH в диапазоне от 9,0 до 11,0 уменьшает деградацию и увеличивает количество общего белка полученного в процессе очистки. Этот факт может быть объяснен с помощью профиля pH-зависимой растворимости GDF-5, который показан на фиг.9. Его растворимость низка при pH 8,3, но значительно увеличивается при более высоких значениях pH. Таким образом, pH в диапазоне между 9.0 и 11,0 также полезна для буферов для солюбилизации по изобретению.
Хелаторы:
Также может быть модифицирована концентрация хелаторов в буферах для солюбилизации. Хелаторы используются для безопасного связывания металлов, таких как ртуть, мышьяк и свинец. Наиболее часто используемым синтетическим хелатором является EDTA, который используется в буферах солюбилизации по изобретению (например, в форме Na2EDTA или Na3EDTA). По данным экспериментов, описанных в примере 3, выгодно увеличивать концентрацию хелаторов от изначально описанной 1 ммоль/литр (см. WO/1996/033215) до 5-100 ммоль/л, предпочтительно до 5-50 ммоль/л.
Наиболее предпочтительные буферы для солюбилизации содержат следующие компоненты: 20 мМ Tris-HCl
6 М мочевина
64 мМ DTT
500 мМ L-аргинин
5 мМ Na3EDTA
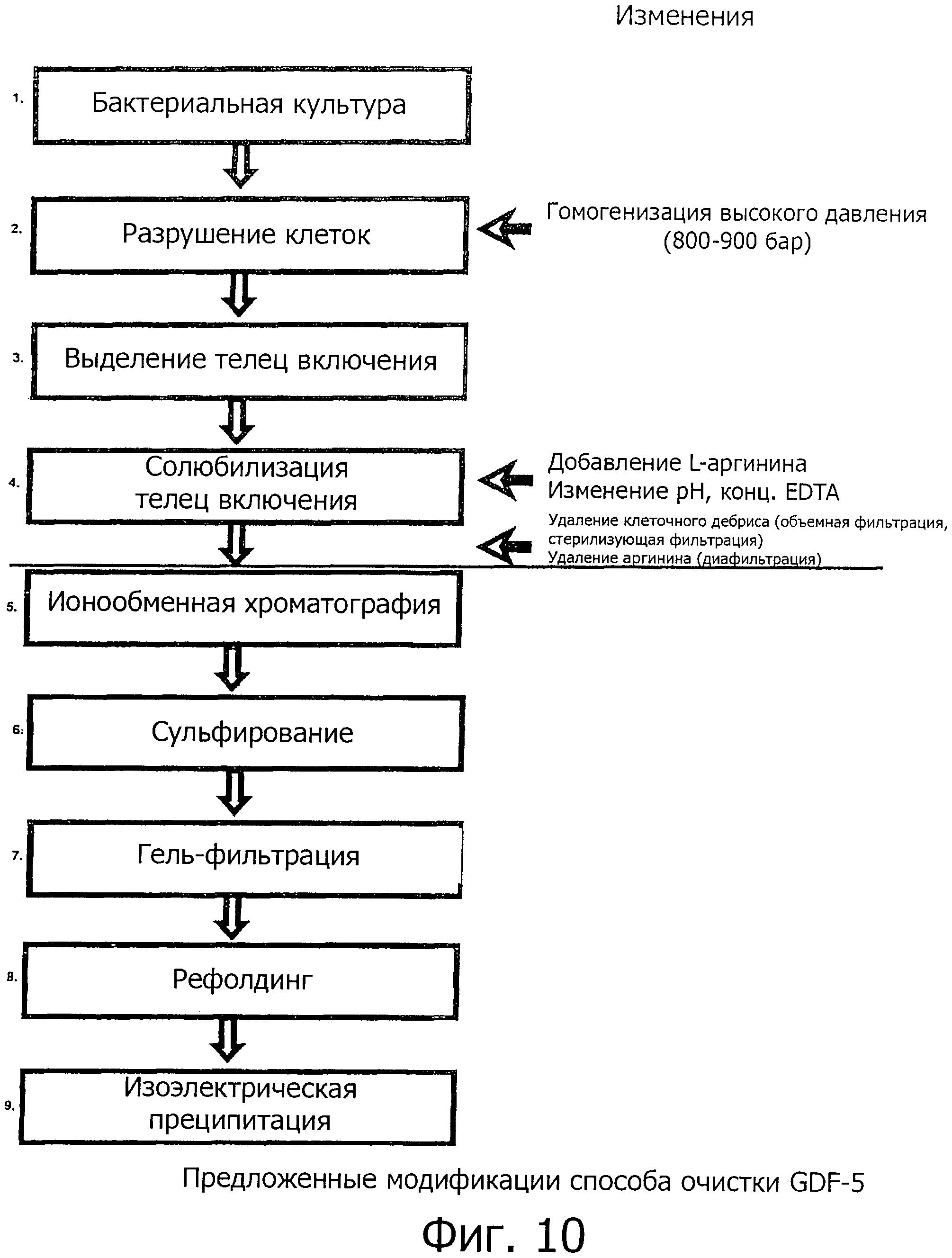
Основные модификации способа по изобретению показаны на фиг.10. Следует отметить, в виде меры предосторожности, что предлагаемая схема очистки представляет собой предпочтительное воплощение изобретения, но при этом изобретение ни в коей мере не ограничивается этим порядком или количеством этапов обработки (особенно в отношении этапов с 5 по 9 на фиг.10). Одиночные этапы могут быть опущены, заменены или дополнены другими способами очистки, при условии, если вся процедура очистки содержит следующие начальные этапы: 1. бактериальная клеточная культура (предпочтительным бактериальным хозяином является Е.coli, особенно предпочтительными штаммами-хозяевами являются W3110 и D1210), 2. разрушение клеток, 3. высвобождение телец включения и 4. солюбилизация телец включения.
Раскрытое изобретение было подтверждено примером с рекомбинантным GDF-5 в качестве тестового вещества. Однако в связи с необычайно высокой гомологией последовательности (см. фиг.2) способы очистки могут также применяться для очистки других GDF-5-подобных белков. Термин "GDF-5 подобные белки" включает в себя функционально подобные белки, принадлежащие к группе белков позвоночных состоящей из GDF-5, GDF-6 и GDF-7, а также их рекомбинантные варианты. Общей чертой всех GDF-5-подобных белков является наличие биологически активного домена цистинового узла с аминокислотной гомологией равной, по меньшей мере, 60% из 102 аминокислот домена цистинового узла человеческого GDF-5, и являющейся достаточной для биологической функции белка. Как видно на фиг.3, равное 60% предпочтительное предельное значение отделяет членов группы GDF-5/-6/-7 от более отдаленных белков GDF и BMP. Особенно предпочтительные белки демонстрируют аминокислотную гомологию равную, по меньшей мере, 75%, 80%, или 90% из 102 АК домена цистинового узла человеческого GDF-5.
Неограничивающими примерами GDF-5-подобных белков позвоночных и млекопитающих являются предшественники и зрелые белки человеческого GDF-5 (раскрытого как МР52 в WO 95/04819 и как человеческий GDF-5 in Hotten et al. 1994, Btochem. Biophys Res. Commun. 204, 646-652), рекомбинантный человеческий GDF-5/МР52 (WO 96/33215), МР52 Arg (WO 97/06254); высокомолекулярный человеческий MP52s (WO 97/04095), CDMP-1 (WO 96/14335), мышиный (Mus musculus) GDF-5 (US 5,801,014), кроличий (Oryctolagus cuniculus) GDF-5 (Sanyal et al. 2000, Mol Biotechnol. 16, 203-210), куриный (Gallus gallus) GDF-5 (NCBI accession no. NP_989669), GDF-5 шпорцевой лягушки (Xenopus laevis)(NCBI accession no. AAT99303), мономерный GDF-5 (WO 01/11041 and WO 99/61611), человеческий GDF-6/BMP-13 (US 5,658,882), мышиный GDF-6 (NCBI accession no NP_038554), GDF-6/CDMP-2 (WO96/14335), человеческий GDF-7/BMP-12 (US 5,658,882), мышиный GDF-7 (NCBI accession no AAP97721), GDF-7/CDMP-3 (WO96/143335). Изобретением также охватываются GDF-5-подобные белки, имеющие дополнительные мутации, такие, как замены, вставки и делеции, при условии, что эти дополнительные мутации не нарушают полностью биологическую активность белка. Некоторыми предпочтительными вариантами являются мутанты GDF-5-подобных белков с улучшенной биологической активностью. В которых, например, один или более остатков, обычно присутствующих в белке-предшественнике человеческого GDF-5 (см. фиг.1) заменяются на другие аминокислоты: аргинин в позиции 438 предшественника человеческого GDF-5 заменяется глицином, аланином, валином, лейцином, изолейцином, метионином или аспарагином; и/или серин 439 заменяется аспарагиновой кислотой, глутаминовой кислотой, глицином, лейцином или изолейцином; и/или аспарагин 445 заменяется серином или треонином. В другом высокоактивном мутанте, метионин 453 и/или метионин 456 заменяется аланином, валином или изолейцином. Также особый интерес представляют мутанты, в которых лейцин 441 заменяется на пролин.
Биологическая активность GDF-5-подобных белков легко может быть определена с помощью общепризнанных тестовых систем. Наиболее пригодным и предпочтительным является общепризнанный in vitro тест известный как анализ щелочной фосфатазы (Takuwa et al. 1989, Am. J. Physiol. 257, E797-E803), который также описан в примере 5. GDF-5-подобные белки демонстрируют увеличение активности щелочной фосфатазы, например, в ROB-C26 клетках (Yamaguchi et al. 1991, Calcif. Tissue Int. 49, 221-225) как описано в WO 95/04819, в эмбриональных клетках ATDC5 (Riken Gene Bank, ROB 0565), в мышиных стромальных клетках МСНТ-1/26 и в клетках HPDL, как показано в работе Nakamura et al. 2003, J. Periodontal Res. 38, 597-605.
Следующие нелимитирующие примеры вместе с фигурами и протоколами последовательностей предназначены для дальнейшей иллюстрации изобретения.
Последовательности:
SEQ ID NO:1 является белковой последовательностью предшественника человеческого GDF-5.
SEQ ID NO:2 является последовательностью ДНК предшественника человеческого GDF-5.
SEQ ID NO:3 является белковой последовательностью зрелого человеческого GDF-5, состоящей из 120 аминокислотных остатков. Рекомбинантно-полученные белки могут также состоять из 119 аминокислотных остатков, и начинаться, таким образом, со второй аминокислоты (пролина) последовательности SEQ ID NO:3.
SEQ ID NO:4 является белковой последовательностью из 120 аминокислотных остатков мономерного зрелого человеческого GDF-5. Белок может также состоять из 119 аминокислот, и начинаться, таким образом, со второй аминокислоты (пролина) последовательности SEQ ID NO:4.
Фигуры
На фиг.1 показаны дополнительные особенности белка-предшественника человеческого GDF-5 в соответствии с последовательностью SEQ ID NO:1:
аминокислотные остатки 001-381 - пре-продомен (жирный шрифт)
аминокислотные остатки 001-027 - сигнальный пептид (подчеркнутый жирный шрифт)
аминокислотные остатки 382-501 - фрагмент зрелого белка
аминокислотные остатки 400-501 - домен цистинового узла (подчеркнутый шрифт).
На фиг.2 показано сравнение 102 аминокислот домена цистинового узла человеческого GDF-5 (SEQ ID NO:1), человеческого GDF-6 (последовательность 2 из патента US 5,658,882) и человеческого GDF-7 (последовательность 26 из патента US 5,658,882). Аминокислотные остатки, которые являются идентичными во всех трех молекулах, выделены.
На фиг.3 показана таблица гомологии последовательностей доменов цистинового узла нескольких известных белков BMP и GDF с доменом цистинового узла человеческого GDF-5.
На фиг.4 показана карта плазмиды для экспрессии рекомбинантного зрелого человеческого GDF-5, как описано в примере 1 и (более подробно) в WO 1996/033215.
На фиг.5 показан ДСН-ПААГ электрофорез, отображающий время-зависимую фрагментацию рекомбинантного зрелого GDF-5 в течении солюбилизации в буфере для солюбилизации (8 М мочевина, 20 мМ Tris, 10 мМ ДТТ, 1 мМ Na2EDTA, pH 8.3). Мономерный GDF-5 уменьшается от 14 кДа до 10 кДа (фрагмент). Фрагментация почти полностью заканчивается после трех часов солюбилизации.
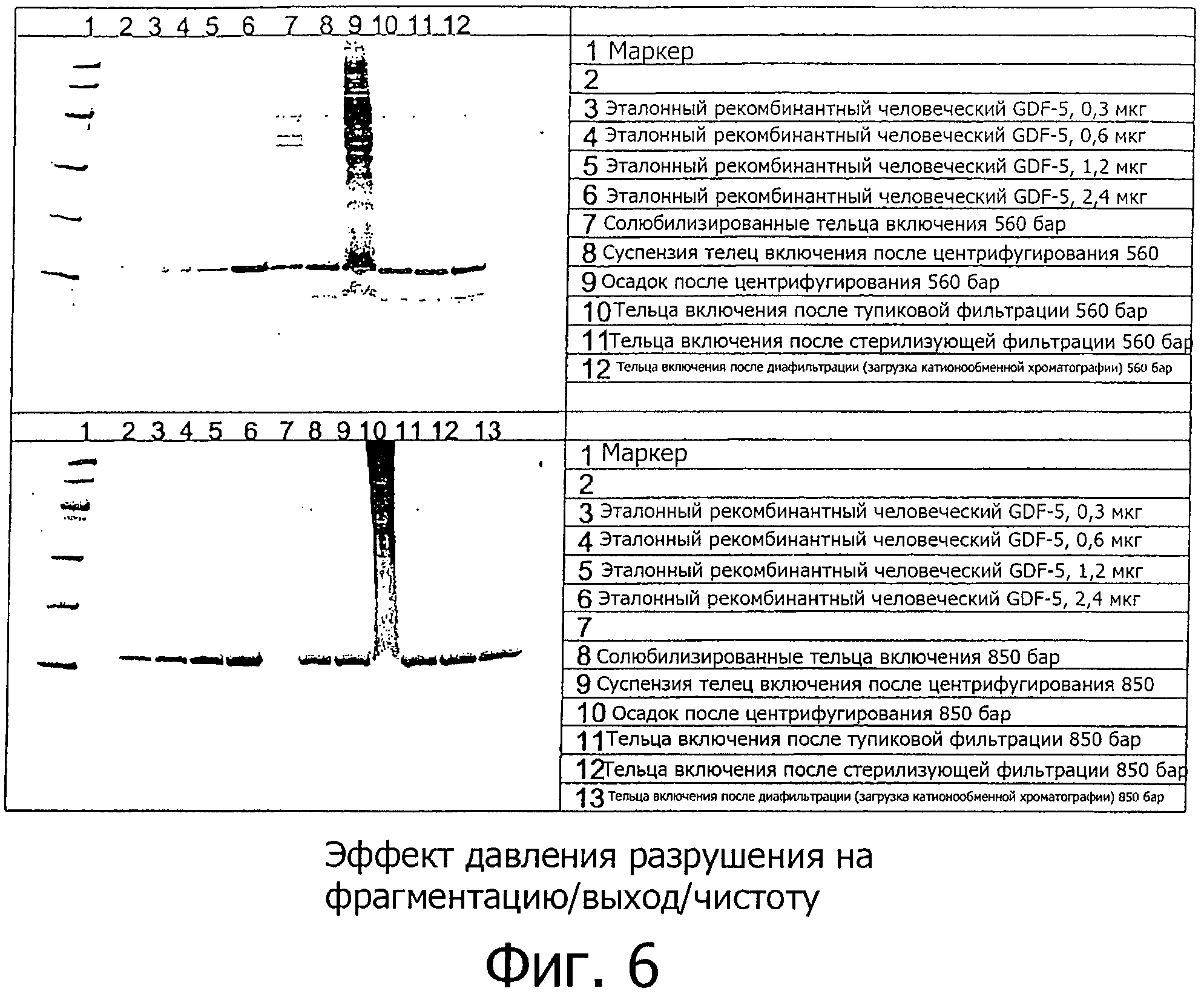
На фиг.6 показан ДСН-ПААГ электрофорез, демонстрирующий эффект модификации давления разрушения клеток на фрагментацию белка, выход и чистоту в соответствии с примером 2. В этой группе экспериментов, давление разрушения равное 560 бар (верхняя картинка) сравнивается с давлением разрушения равным 850 бар (нижняя картинка). Более высокое давление, равное 860 бар, ведет к значительному уменьшению фрагментации белков и к более высоким выходу/чистоте белка.
На фиг.7 и 8 показан ДСН-ПААГ электрофорез, демонстрирующий эффекты различных буферов для солюбилизации на фрагментацию мономерного GDF-5, растворенного в буфере для солюбилизации. Составы буферов приведены в примере 3.
На фиг.9 показан профиль зависимости растворимости зрелого GDF-5 от pH.
На фиг.10 показаны модификации способа получения GDF-5 в соответствии с изобретением.
Сведения, подтверждающие возможность осуществления изобретения
Пример 1. Получение и очистка рекомбинантного GDF-5
(1) Конструирование экспрессирующего вектора и трансформация Е. coli
Конструирование системы плазмидных векторов для получения зрелого рекомбинантного человеческого GDF-5 (аминокислотные остатки с 1 по 119 последовательности Seq ID No. 3) и трансформация штамма-хозяина Е. coli W3110 (W3110M) проводили, как описано в примере 1 WO 1996/033215.
(2) Культивирование в Е. coli.
Е. coli, экспрессирующие белок изобретения, прекультивировали в модифицированной среде SOC (20 г/л Бактотриптона, 5 г/л Бактодрожжевого экстракта, 0,5 г/л NaCl, 2,03 г/л MgCl2×6H2O, 3,6 г/л глюкозы). 100 мл бактериальной суспензии инокулировали 5 литров среды для продуцирования (5 г/л Бактотриптона, 4.3 г/л Лимонной кислоты, 4,675 г/л K2HPO4, 1,275 г/л KH2PO4, 0,865 г/л NaCl, 100 мг/л FeSO4×7H2O, 1 мг/л CuSO4×5H2O, 0,5 мг/л MnSO4·×nH2O, 2 мг/л CaCl2×2H2O, 0,225 мг/л Na2B4O7×10H2O, 0,1 мг/л (NH4)6Mo7O24×4H2O, 2,25 мг/л ZnSO4×7H2O, 6 мг/л CoCl2×6H2O, 2,2 г/л MgSO4×7H2O, 5,0 мг/л Тиамин HCl, 3 г/л глюкозы), которую культивировали в 10-литровом ферментере с аэрацией-перемешиванием, и затем, по достижении ранней стадии логарифмической фазы роста (OD 550=5.0), добавляли изопропил-бета-D-тио-галактопиранозид в конечной концентрации 1 мМ и продолжали культивирование до достижения OD 550=150. В процессе культивирования температура поддерживали на уровне 32°C, а pH поддерживали с помощью аммиака на уровне 7.15. В целях предотвращение снижения концентрации растворенного кислорода, перемешивание проводилось при повышенной скорости, для того чтобы удержать уровень концентрации растворенного кислорода равным 50% от его содержания в атмосфере. Продолжили культивирование с добавлением 50% раствора глюкозы до уровня 0,2% для получения высокой плотности клеток, с указанием резкого увеличения концентрации растворенного кислорода.
(3) Приготовление телец включения из Е. coli
Культуральную жидкость, полученную способом, описанным выше, отцентрифугировали для сбора клеток, которые затем ресуспендировали в 25 мМ Tris-HCl, содержащем 10 мМ этилендиаминтетрауксусную кислоту (pH 7.3). Клетки разрушали гомогенизатором высокого давления и центрифугировали снова для сбора содержащего тельца включения преципитата.
(4) Отмывка и солюбилизация телец включения из Е. coli
После 3-кратной отмывки (например, с помощью 1% Тритона Х-100) тельца включения E. coli центрифугировали при 3000 g 30 минут при 4°С, и затем полученный преципитат солюбилизировали ультразвуком в буфере для солюбилизации (20 мМ Tris-HCl буфер, 8 М мочевина, 10 мМ DTT, and 1 мМ Na2EDTA, pH 8,3). В связи с наблюдаемой частичной деградацией белка GDF-5 из телец включения в содержащих мочевину буферах (см. фиг.5) также были протестированы различные дополнительные буферы для солюбилизации, описанные в примере 3.
(5) Приготовление мономеров
Солюбилизированный раствор центрифугировали при 20000 g 30 минут, при 4°С и образовавшийся супернатант собирали. Полученный супернатант нанесли на колонку с SP-Sepharose FF (Pharmacia AB), уравновешенную буфером, содержащим 20 мМ Tris-HCl, pH 8.3, 6М мочевину и 1 мМ EDTA, и затем, после отмывки таким же раствором, искомое элюировали таким же раствором, содержащим 0,5 М NaCl. Белок в элюате сульфировали путем добавления Na2SO3 и Na2S4O6 до конечной концентрации соответственно 111 мМ и 13 мМ и инкубировали при 4°C а течении 15 часов. Сульфированный раствор подвергали гель-фильтрации на колонке с Sephacryl S-200 HR (Pharmacia AB), уравновешенной буфером, содержащим 20 мМ Tris-HCl, рН 8,3, 6 М мочевину, 0.2 М NaCl, and 1 мМ EDTA для получения очищенных, сульфированных мономеров белка изобретения.
(6) Рефолдинг
Раствор сульфонированных мономеров добавляли к девяти объемам буфера, содержащего 50 мМ натриевой соли глицина, pH 9,8, 0,2 М NaCl, 16 мМ CHAPS, 5 мМ EDTA, 2 мМ GSH (восстановленная форма глутатиона) и 1 мМ GSSG (окисленная форма глутатиона) при помешивании и затем инкубировались 24 часа при 4°С для окисления и рефолдинга белка изобретения.
(7) Приготовление гомодимеров
Раствор для рефолдинга разбавляли таким же объемом очищенной воды и затем добавлением 6 N NaCl корректировали значение pH до примерно 7,4 и подвергали изоэлектрической преципитации. Преципитат, собранный центрифугированием при 3000 g в течение 20 минут, солюбилизировали в растворе 30% ацетонитрила, содержащем 0,1% TFA. Раствор разбавляли таким же объемом очищенной воды и наносили на колонку RESOURCE RPC (Pharmacia AB) для обратнофазной ВЭЖХ заранее уравновешенную 25% ацетонитрилом, содержащим 0,05% TFA и затем элюировали линейным градиентом 25-45% ацетонитрила, содержащего 0,05% TFA. Элюат отслеживали по поглощению при 280 нм. Фракции очищенного гомодимерного белка собирали и лиофилизировали с помощью SpeedVac Concentrator (Servant Co.). Опционально, очищенный белок подвергали конечному этапу ультра-/диафильтрации.
Пример 2. Вариант I - Модификация давления разрушения клеток
Было проведено несколько экспериментов с различными давлениями разрушения клеток, для того, чтобы оценить эффект разрушения клеток на выход/деградацию белка, чистоту и фильтруемость, Биомассу после каждого культивирования ресуспендировали в буфере для гомогенизации (25 мМ Tris, 10 мМ Na2EDTA, pH 7,3), гомогенизировали и перемешивали в течение от 30 до 60 минут с помощью магнитной мешалки. Далее, суспензию биомассы трижды разрушали в гомогенизаторе высокого давления при различных давлениях разрушения. Полученные тельца включения промывали промывочным буфером (20 мМ Tris, 5 мМ Na2EDTA pH 8,3) и хранили при <-70°C. После оттаивания в течение ночи при +4°C, тельца включения растворяли в предварительно охлажденном буфере для солюбилизации, содержащем 6 М мочевину и 0.5 М L-аргинин, гомогенизированы и снова перемешаны с помощью магнитной мешалки в течение от 30 до 60 минут. После этого раствор телец включения центрифугировали в течение 30 минут при 10°C, при динамической нагрузке 10000 g (=7500 оборотов в минуту). Супернатант декантировали для отделения телец включения от нерастворимых компонентов, фильтровали через объемный фильтр (CUNO Zeta Plus BC0030A90ZA08A). Затем фильтрат фильтровали снова через стерилизующий фильтр (Nalgene Bottle Top Filter 0.2 мкм). Стерильный фильтрат сконцентрировали и дифильтровали против катионообменного буфера А (6 М мочевина, 20 мМ Tris, 1 мМ Na2EDTA, 50 мМ NaCl, 10 мМ DTT, pH 8,3) перед загрузкой в катионообменную колонку. Тестовые образцы, полученные на различных этапах, анализировали с помощью известных аналитических тестовых методов, таких как ДСН-ПААГ электрофорез, окраска красителем Coomassie-Brilliant-Blue, и основанных на ИФА методов для определения белков Е. coli.
Результаты этого исследования (см. фиг.6) показывают, что значительные улучшения первичного способа очистки могут быть достигнуты в случае, если разрушение клеток проводится при давлении разрушения между 800 и 900 бар. Таким образом, получаются тельца включения улучшенного качества, что приводит к более высокому соотношению рекомбинантного GDF-5 к общему белку (например, 57% при 850 бар, против 35% при 560 бар) и уменьшению содержания белков Е. coli в конечном продукте (например, <30 мкг/мг при 850 бар, против >50 мкг/мг при 560 бар). Эти улучшения также полезны для фильтруемости. Необходимая площадь фильтра для производственных масштабов может быть сокращена (например, с теоретической 2,6 м2 при 560 бар, до <1 м2 при 850 бар) в больших масштабах. Это приводит к сокращению времени способа, уменьшенной фрагментации белка и сокращению соответствующих издержек при получении рекомбинантного GDF-5.
Пример 3. Вариант II - Солюбилизация телец включения
В целях предотвращения деградации GDF-5 и подобных белков, стандартный этап солюбилизации телец включения такой как, например, описан в примере 1, изменили в различных аспектах. Усилия были направлены на эксперименты для выявления/ингибирования потенциальной протеолитической активности, а также на поправки композиции буфера для солюбилизации как описано в примере 1 (например, pH, мочевины, Na2EDTA and DTT, гуанидин HCl, аминокислот, таких как L-аргинин).
(3.1) Эксперименты по ингибированию протеаз
(3.1.1) Химическое ингибирование
В этой серии экспериментов использовали коктейль протеазных ингибиторов. В подгруппе, тельца включения дополнительно ресуспендировали в течение 20 минут в 25% HCl (pH 2,7) в целях инактивации протеаз, связанных с внешней клеточной стенкой. После 3-х кратной отмывки, 8 г телец включения с рекомбинантным человеческим GDF-5 растворяли в 50 мл стандартного буфера для солюбилизации, содержащего 8 М мочевину. 2 таблетки, содержащие смесь протеазных ингибиторов (Roche Diagnostics Protease Inhibitor Cocktail Tablets Cat. No. 11 697 498 001), добавляли и тщательно смешивали с раствором телец включения. После 1,5 ч и 3 ч инкубации при комнатной температуре, образцы центрифугировали и анализировали. Рекомбинантный GDF-5 обнаружили в значительной степени деградированным во всех группах, демонстрируя тем самым, что химическое ингибирование белковой деградации с помощью HCl и ингибиторов протеаз не эффективно.
(3.1.2) Термическая инактивация
После 3-кратной отмывки 15 г телец включения с рекомбинантным человеческим GDF-5 растворяли в 100 мл буфера, содержащего 10 мМ Na2EDTA, 25 мМ Tris (pH 7,3). Термическая инактивация проводили с помощью инкубации при 65°C в течение различных периодов времени (от 20 мин до 2 часов). Затем, образцы подвергли стандартному этапу солюбилизации, описанному в примере 1. Результаты: несмотря на термическую инактивацию протеаз, рекомбинантный GDF-5 деградировал в во всех этих образцах.
(2) Коррекция композиций буферов для солюбилизации.
Попытки уменьшить фрагментацию GDF-5-подобных белков модификацией используемого буфера для солюбилизации были успешными. Некоторые из протестированных буферов для солюбилизации перечислены ниже:
Буферы с мочевиной:
Стандартный: 8 М мочевина, 20 мМ Tris, 10 мМ DTT 1 мМ Na2EDTA, pH 8,3
Буфер U1: 8 М мочевина, 20 мМ Tris, 64 мМ DTT, 50 мМ Na2EDTA, pH 8,3
Буфер U2: 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 50 мМ Na2EDTA, pH 8,3
Буфер U3: 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8,3
Буфер U4: 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA 50 мМ NaCl, pH 8,3
Буфер U5: 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 9,5
Буферы с L-аргинином:
Буфер А1: 100 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8,3
Буфер А2: 30 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, рН8,3
Буфер A3: 10 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8,3
Буфер А4: 1 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8,3
Буфер А5: 200 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8,3
Буфер А6: 100 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 9,5 Buffer A7: 500 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 9.5 Buffer A8: 500 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8.3 Buffer A9: 300 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8.3
Буфер А10: 400 мМ аргинин, 6 М мочевина, 20 мМ Tris, 64 мМ DTT, 5 мМ Na2EDTA, pH 8.3
Для проверки деградации, 0,1 г телец включения с GDF-5 смешали с 0,9 мл буфера для солюбилизации. Деградация проверяли после 4-5 часов инкубации телец включения, растворенных в буфере для солюбилизации. Результаты анализировали с помощью ДСН-ПААГ электрофореза и последующей окраски Coomassie Brilliant Blue.
Результаты: Среди прочего, были достигнуты следующие результаты в ходе тестов на деградацию:
- Na2EDTA: увеличение концентрации от 1 до 5-50 мМ ведет к незначительному уменьшению деградации
- pH: изменение от 8,3 до более высоких значений (между 9,0 и 11,0) ведет к уменьшению деградации, а также к увеличению общего количества белка. Например, повышение pH от 8,3 до 9,5 в буферах для солюбилизации (см., например, буферы A7 и A8 на фиг.7) улучшило и общее количество белка и степень деградации. Даже если тельца включения растворить в буферах с малым количеством L-аргинина, то после 5 часов инкубации при комнатной температуре при повышенном pH эти буферы все еще содержат рекомбинантный GDF-5 (см., например, буфер А6 на фиг.7).
- DTT: Неэффективные изменения
- Аминокислоты, особенно L-аргинин: Следующие первоначальные результаты были получены с буферами для солюбилизации, содержащими от 0 до 100 мМ L-аргинина (pH 8.3):
|
В последующих экспериментах использовали повышенную концентрацию L-аргинина. Время инкубации было увеличено до 5 часов. В рамках этого эксперимента тестировали влияние а) повышенной концентрации L-аргинина в буфере для растворения и б) смещения pH в сторону более щелочных условий на деградацию рекомбинантного GDF-5. Были получены результаты:
|
В соответствии с количественной оценкой, уровень деградации четко уменьшается с увеличением концентрации аргинина в буферах для солюбилизации (таблица выше и фиг.7 и 8). Однако остается еще некоторый уровень деградации рекомбинантного GDF-5 при использовании 400 мМ аргинина (в буфере для растворения) А10. Почти никакого (деградированного) рекомбинантного GDF-5 не найдено в гранулах телец включения, если судить визуально по ДСН-ПААГ электрофорезу и по количественной оценке. Таким образом, растворимость рекомбинантного GDF-5 в содержащих аргинин буферах для солюбилизации хороша. Доля рекомбинантного GDF-5 увеличилась с повышением концентрации L-аргинина в буферах для солюбилизации. Наилучшая доля рекомбинантного GDF-5, составляющая 62%, может быть достигнута с помощью аргинин-содержащего буфера для растворения А8 (500 мМ L-аргинина). Концентрация равная, по меньшей мере, 500 мМ L-аргинина в буфере для солюбилизации телец включения считается оптимальной для получения рекомбинантного GDF-5 и подобных ему белков.
Пример 4. Влияние L-аргинина на ионообменную хроматографию
Цель данного эксперимента заключалась в проверке влияния содержания L-аргинина в буфере для солюбилизации телец включения на последующую очистку белка ионообменной хроматографией.
Различные образцы телец включения, полученных культивированием, после солюбилизации наносили на катионообменную колонку, состоящую из хроматографического носителя SP Sepharose FF упакованного в колонку ХК 16/20 (CV=28 мл). Тестируемые буферы содержали (помимо других описанных компонентов) 8 М мочевину без L-аргинина (стандартный буфер для солюбилизации) или 6 М мочевину с 500 мМ L-аргинином (модифицированный буфер для солюбилизации).
Тельца включения получали разрушением продуцирующих GDF-5 клеток Е. coli с помощью гомогенизатора высокого давления (три цикла, 850 бар) и последующей двукратной отмывкой. 10,37 г полученных телец включения растворяли в 100 мл модифицированного буфера для солюбилизации (буфер с 6 М мочевиной, содержащий 0,5 М аргинин). 80 мл раствора с тельцами включения осталось после центрифугирования, тупиковой фильтрации и стерилизующей фильтрации телец включения. 40 мл фильтрованного раствора с тельцами включения наносили в неразбавленном виде на катионообменную колонку (примерно 172,4 мг общего белка). Анализировали содержание общего белка и рекомбинантного GDF-5 в элюате, отмывке и фракциях обоих запусков катионообменной хроматографии.
Результаты: Из-за измененной проводимости модифицированного буфера для солюбилизации (18 mS/cm вместо 5 mS/cm стандартного буфера для солюбилизации), связывание с носителем катионообменной колонки в модифицированном буфере не является полным. С модифицированным буфером для солюбилизации возможно только неполное связывание с носителем катионообменной колонки (выход белка 10% вместо 60%). Следовательно, необходимы дополнительные этапы для замены буфера (например, диафильтрация через 5 кДа целлюлозную мембрану) перед катионообменной хроматографией.
Пример 5. Тестирование биологической активности по щелочной фосфатазе
Биологическая активность GDF-5-подобных белков и их коллоидных композиций может быть легко определена с помощью общепризнанных тестовых систем. Самым удобным и предпочтительным является обычный анализ щелочной фосфатазы (Takuwa et al. 1989, Am. J. Physiol. 257, E797-E803). В этой in vitro тестовой системе, биологическая активность GDF-5-подобных ростовых факторов измеряется после кокультивации различных концентраций белка с остеогенными/хондрогенными клетками. GDF-5 и подобные белки с остео/хондрогенным потенциалом повышают экспрессию щелочной фосфатазы в таких клетках, например, в клетках ATDC-5, ROB-C26 или МСНТ-1/26. Активность щелочной фосфатазы в этих клеточных лизатах определяется колориметрическим анализом. Реакция основана на гидролизе р-Нитрофенилфосфата (PNPP) и превращении его в р-Нитрофенол, который становится видимым в щелочных условиях, в виде желтого р-Нитрофениланиона. Цель заключалась в измерении активности тестируемых LMP-композиций и сравнении с активностью щелочной фосфатазы, вызванной известными концентрациями эталонного GDF-5.
В стандартизованном анализе щелочной фосфатазы, 1×104 клеток клеточных линий ATDC-5, МСНТ 1/26 инкубировали в течение ночи в 96-лучном планшете в культуральной среде (альфа-МЕМ, Пенициллин/Стрептомицин, 2 мМ L-глутамин, 10% ФТС) при 37°С, 5% СО2, в насыщенной водой атмосфере). На следующий день клетки стимулировали GDF-5-подобными белками или их композициями в течение 72 часов с указанными концентрациями лигандов. Клетки впоследствии отмывали фосфатно-солевым буферным раствором. Лизис клеток проводили в 100 мкл щелочного буфера для лизиса 1 (0,1 М глицин, pH 9,6, 1% NP-40, 1 мМ MgCl2, 1 мМ ZnCl2) в течение 1 часа при комнатной температуре. Затем добавляли 100 мкл щелочного буфера для лизиса 2 (0.1 М глицин, pH 9,6, 1 мМ MgCl2, I мМ ZnCl2+2 мг/мл PNPP). Планшеты инкубировали при 37°С, 5% CO2, в насыщенной водой атмосфере. Затем реакция щелочной фосфатазы останавливали с помощью 100 мкл раствора 30 г/л NaOH и, наконец, оптическая плотность измеряли с помощью автоматического планшетного ридера при длине волны 405 им с вычитанием холостой пробы.