Результат интеллектуальной деятельности: СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ДОБРОКАЧЕСТВЕННОЙ ГИПЕРПЛАЗИИ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к медицине, в частности к урологии - к способам для профилактики и лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).
Уровень техники
Доброкачественная гиперплазия предстательной железы (ДГПЖ) - наиболее частая патология предстательной железы (ПЖ) и серьезная медико-социальная проблема мужчин. К 60 годам жизни гистологически ДГПЖ выявляют у 50% мужчин, а к 85 годам - у 90%; признаки заболевания в виде симптомов нижних мочевых путей (СНМП) возникают в среднем у половины мужчин с ДГПЖ; около 30% мужчин в возрасте старше 65 лет имеют умеренные или выраженные СНМП, обусловленные ДГПЖ [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152]. Основные цели лечения ДГПЖ - улучшение качества жизни больных, страдающих от расстройств мочеиспускания, обусловленных СНМП, и предотвращение прогрессирования заболевания [Практическая урология. Руководство для врачей / под ред. П.В. Глыбочко, Ю.Г. Аляева. - М.: Медфорум, 2012. - 352 с.]. Медикаментозная терапия ДГПЖ должна проводиться длительно, иногда в течение всей жизни пациента. Поэтому одним из требований, предъявляемым к фармакологическим средствам для лечения ДГПЖ, является низкая токсичность и отсутствие серьезных побочных эффектов.
В настоящее время основными лекарственными препаратами для лечения ДГПЖ являются α1-адреноблокаторы и ингибиторы 5α-редуктазы, которые применяются в виде монотерапии или в комбинации, а также фитопрепараты [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152; Клинические рекомендации Европейской ассоциации урологов. - М.: ООО «ИД АБВ-пресс», 2011. С.8-35; Silva J., Silva C.M., Cruz F. Current medical treatment of lower urinary tract symptoms / BPH: do we have a standard? // Curr. Opin, Urol. - 2014. - Vol. 24. - P. 21-28.].
Среди α1-адреноблокаторов выделяют неселективные препараты, которые связываются со всеми α1-адренорецепторами: доксазозин, теразозин, алфузозин, и селективные, которые связываются со специфическими α1А-адренорецепторами, расположенными в гладких мышцах ПЖ, шейке мочевого пузыря и простатической части уретры: тамсулозин, силодозин [Yuan J., Liu Y., Yang Z. et al. The efficacy and safety of alpha-1 blockers for benign prostatic hyperplasia: an overview of 15 systematic reviews // Curr. Med. Res. Opin. - 2013. - Vol. 29. - P. 279-287]. Механизм действия α1-адреноблокаторов заключается в блокировании стромальных адренорецепторов ПЖ, что способствует расслаблению гладкой мускулатуры органа и уменьшению динамического компонента инфравезикальной обструкции; данные препараты уменьшают степень выраженности СНМП на 20-50% [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152].
Недостатками всех α1-адреноблокаторов являются: 1) только симптоматический эффект на СНМП у больных ДГПЖ и отсутствие влияния на патогенетические механизмы развития ДГПЖ, что обусловлено вышеназванным механизмом действия; 2) невысокая эффективность, приблизительно у трети больных ДГПЖ они оказываются неэффективными, и если в течение 2 месяцев прием α1-адреноблокаторов не привел к уменьшению степени выраженности СНМП, лечение данными препаратами рекомендуют прекратить; 3) побочные эффекты в виде головокружения, головной боли, ортостатической гипотензии, астении, сонливости, заложенности носа, ретроградной эякуляции [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152]. Большинство побочных эффектов α1-адреноблокаторов обусловлены вазодилатирующими эффектами. Доксазозин, теразозин и алфузозин изначально разрабатывались как антигипертензивные препараты, в связи с чем, их побочные эффекты обусловлены влиянием на артериальное давление и частоту сердечных сокращений, которые наиболее часто наблюдаются при титровании дозы данных неселективных α1-адреноблокаторов до их полной дозы [O′Leary M.P. Treatment and pharmacologic management of BPH in the context of common comorbidities // Am. J. Manag. Care. - 2006. - Vol. 12 (5 Suppl.). - P. 129-140]. Алфузозин переносится лучше, чем доксазозин и теразозин. При приеме данного препарата реже отмечаются побочные эффекты со стороны сердечно-сосудистой системы [17]. Селективный α1А-адреноблокатор тамсулозин практически лишен побочных эффектов, связанных с вазодилатацией, однако тамсулозин в большей степени негативно влияет на сексуальную функцию по сравнению с другими α1-адреноблокаторами [van Dijk M.M., de la Rosette J.J., Michel M.C. Effects of alpha(1)-adrenoceptor antagonists on male sexual function // Drugs. - 2006. - Vol. 66. - P. 287-301; Wilt T.J., Mac Donald R., Rutks I. Tamsulosin for benign prostatic hyperplasia // Cochrane Database Syst. Rev. - 2003. - Vol. 1. - CD002081]. Новый суперселективный α1A-адреноблокатор силодозин является наиболее эффективным препаратом данной группы [Capitanio U., Salonia A., Briganti A., Montorsi F. Silodosin in the management of lower urinary tract symptoms as a result of benign prostatic hyperplasia: who are the best candidates // Int. J. Clin. Pract. 2013 - Vol. 67. - P. 544-551]. Однако у силодозина выявлена способность повышать риск развития ретроградной эякуляции, частота которой составляет 22-28%; также более чем у 5% больных развиваются инфекции верхних дыхательных путей, жажда, жидкий стул, диарея, недержание мочи и головокружение, что заставляет еще раз провести анализ соотношения “риск-польза” для этого препарата [Rossi М., Roumeguère Т. Silodosin in the treatment of benign prostatic hyperplasia // Drug Des. Devel. Ther. - 2010. - Vol. 4. - P. 291-297]. Обнаружено неблагоприятное действие α1-адреноблокаторов на глаза в виде синдрома интраоперационной вялости радужной оболочки, в связи с этим, начинать лечение данными препаратами не следует при планировании хирургического удаления катаракты [Клинические рекомендации Европейской ассоциации урологов. - М.: ООО «ИД АБВ-пресс», 2011. С. 8-35].
Из ингибиторов 5α-редуктазы для лечения ДГПЖ назначают финастерид (ингибитор 5α-редуктазы II типа) и дутастерид (ингибитор 5α-редуктазы как I, так и II типа). Механизм действия ингибиторов 5α-редуктазы заключается в блокировании фермента 5α-редуктазы, за счет чего нарушается преобразование тестостерона в его активную форму - дегидротестостерон, что способствует активации апоптоза в ПЖ; данные препараты уменьшают суммарный балл IPSS (International Prostatic Symptom Score, Международная шкала оценки простатических симптомов) в среднем на 15% и снижают объем ПЖ в среднем на 20-30% [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152]. У больных ДГПЖ ингибиторы 5α-редуктазы оказывают не только симптоматический, но и патогенетический лечебный эффект, уменьшая объем простаты, что обусловлено вышеназванным механизмом действия данных препаратов.
Недостатком ингибиторов 5α-редуктазы является более медленная регрессия СНМП, чем при лечении α1-адреноблокаторами; максимальный клинический эффект от использования препаратов этой группы у больных ДГПЖ развивается через 6-12 месяцев от начала приема [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152; Oelke М., Bachmann A., Descazeaud A. et al. EAU guidelines on the treatment and follow-up of non-neurogenic male lower urinary tract symptoms including benign prostatic obstruction // Eur. Urol. - 2013. - Vol. 64. - P. 118-140]. Кроме того, наблюдается зависимость между выраженностью эффектов и изначальным объемом простаты: при большем изначальном объеме простаты улучшение таких показателей как сумма баллов по шкале IPSS и скорость мочеиспускания были более выраженными, а разница с группой плацебо была значимой при объеме простаты более 40 см3 [Boyle P., Gould A.L., Roehrborn C.G. Prostate volume predicts outcome of treatment of benign prostatic hyperplasia with Finasteride: metaanalysis of randomized clinical trials // Urology. 1996. - Vol. 48. - P. 398-405.]. Ингибиторы 5α-редуктазы имеют значимые побочные эффекты, обусловленные их антиандрогенным действием, а также возрастными особенностями организма мужчины. Среди основных побочных эффектов, которые вызывают дутастерид и финастерид, имеется эректильная дисфункция (7% и 8% больных, соответственно), уменьшение либидо (5% и 6%), эякуляторные расстройства (1% у обоих) и гинекомастия (также 1%); к числу других нежелательных эффектов относятся повышение в крови уровней лютеинизирующего гормона и фолликулостимулирующего гормона, аллергические реакции [Велиев Е.И., Охриц В.Е. Ингибиторы 5-альфа-редуктазы в современной урологической практике // Эффективная фармакотерапия. Урология. - 2011. - №. 4. - С. 10-17; Rick F.G., Saadat S.H., Szalontay L. et al. Hormonal manipulation of benign prostatic hyperplasia // Curr. Opin. Urol - 2013. - Vol. 23. - P. 17-24]. Подозревается даже, что ингибиторы 5-альфа-редуктазы могут вызывать рак молочной железы у мужчин [Bird S.T., Brophy J.M., Hartzema A.G. et al. Male breast cancer and 5α-reductase inhibitors finasteride and dutasteride // J. Urol. - 2013. - Vol. 190. P. 1811-1814].
Комбинация α1-адреноблокаторов и ингибиторов 5α-редуктазы является более эффективной по сравнению с приемом этих препаратов по отдельности [Практическая урология. Руководство для врачей / под ред. П.В. Глыбочко, Ю.Г. Аляева. - М.: Медфорум, 2012. - 352 с.; Клинические рекомендации Европейской ассоциации урологов. - М.: ООО “ИД АБВ-пресс”, 2011. С. 8-35]. У больных ДГПЖ с объемом простаты больше 30-40 мл и/или уровнем простат-специфического антигена (ПСА) в выше 1,5 нг/мл комбинация α1-адреноблокатора с ингибитором 5α-редуктазы рекомендуется в качестве терапии первой линии [Marberger М. Medical management of lower urinary tract symptoms in men with benign prostatic enlargement // Adv. Ther. - 2013. - Vol. 30. - P. 309-319]. Однако комбинированное лечение α1-адреноблокаторами и ингибиторами 5α-редуктазы сопровождается увеличением риска нежелательных побочных эффектов [Füllhase С., Chapple С., Cornu J.N. et al. Systematic review of combination drug therapy for non-neurogenic male lower urinary tract symptoms // Eur. Urol. - 2013. - Vol. 64. - P. 228-243]. Например, в группе больных ДГПЖ, получавших комбинацию препаратов финастерид + доксазозин, частота нарушения эякуляции, периферическая эдема и одышка встречались достоверно чаще, чем в группах, принимавших один из препаратов [McConnell J.D., Roehrborn C.G., Bautista O.M. et al. The long-term effect of doxazosin, finasteride, and combination therapy on the clinical progression of benign prostatic hyperplasia // N. Engl. J. Med. - 2003. - Vol. 349. - P. 2387-2398].
Фитотерапия является одной из неотъемлемых частей медикаментозной терапии ДГПЖ на ранних стадиях заболевания. Фитотерапия способна ингибировать прогрессию ДГПЖ, а также уменьшать выраженность СНМП, связанных с ДГПЖ на ранних стадиях, при отсутствии значимых побочных эффектов. В настоящее время наиболее широкое распространение получили лекарственные растительные препараты, представляющие собой экстракты из плодов пальмы ползучей Serenoa repens и экстракт коры сливы африканской Pygeum africanum, которые в некоторых клинических исследованиях продемонстрировали эффективность, сравнимую с ингибиторами 5α-редуктазы и α1-адреноблокаторами [Болезни предстательной железы /Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126 -152].
Общими недостатками фитопрепаратов, применяемых в лечении ДГПЖ, являются сложность стандартизации и контроля качества, разные серии одного препарата могут отличаться по количественному составу действующих веществ; трудность определения механизмов действия из-за многокомпонентного состава растительных комплексов; нестабильность клинических эффектов; произрастание сырья за пределами России. Лекарственные препараты из экстракта Serenoa repens (простамол Уно, пермиксон, простаплант и др.) и экстракта Pygeum africanum (таденан, трианол и др.) также производятся за рубежом в Германии, Франции, Словении и других странах, что, безусловно, отражается на их цене.
Наиболее близким аналогом к изобретению по совокупности общих существенных признаков является растительный экстракт плодов пальмы ползучей Serenoa repens (оригинальный лекарственный препарат “Простамол Уно” в капсулах по 320 мг). Экстракт Serenoa repens оказывает антиандрогенный, антипролиферативный, противоотечный и противовоспалительный эффекты; показания к применению - ДГПЖ I и II стадии; применяют по 320 мг 1 раз в сутки, длительность курса лечения не ограничена по времени, рекомендуемая продолжительность курса терапии - не менее трех месяцев [Болезни предстательной железы / Под ред. Ю.Г. Аляева. - М.: ГЭОТАР-Медиа, 2009. - С. 126-152].
Данный аналог имеет ряд существенных недостатков. Экстракт Serenoa repens обладает нестабильным клиническим эффектом. Результаты клинических исследований экстракта Serenoa repens у больных ДГПЖ противоречивые. Мета-анализы, проведенные в 2004 г., показали эффективность экстракта Serenoa repens в отношении СНМП, ассоциированных с ДГПЖ [Boyle P., Robertson С., Lowe F., Roehrborn С. Updated meta-analysis of clinical trials of Serenoa repens extract in the treatment of symptomatic benign prostatic hyperplasia // BJU Int. - 2004. - Vol. 93. - P. 751-756; Gerber G.S., Fitzpatrick J.M. The role of a lipido-sterolic extract of Serenoa repens in the management of lower urinary tract symptoms associated with benign prostatic hyperplasia // BJU Int. - 2004. - Vol. 94. - P. 338-344]. Однако мета-анализ 17 рандомизированных клинических исследований, опубликованный в 2012 г., свидетельствует об отсутствии у экстракта Serenoa repens, применяемого в режиме монотерапии, эффектов в отношении СНМП по сравнению с плацебо [MacDonald R., Tacklind J.W., Rutks I., Wilt T.J. Serenoa repens monotherapy for benign prostatic hyperplasia (BPH): an updated Cochrane systematic review // BJU Int. - 2012. - Vol. 109. - P. 1756-1761]. Экстракт Serenoa repens имеет многокомпонентный состав, что затрудняет стандартизацию и контроль качества; какие из компонентов экстракта отвечают за механизмы действия - не определено. Лекарственное растительное сырье для получения препаратов из экстракта Serenoa repens произрастает, в основном, в США, поэтому является экзотическим, дорогостоящим и малодоступным для переработки в России. На отечественном фармацевтическом рынке как оригинальный, так и воспроизведенные препараты (дженерики), представлены средствами, производимыми за рубежом (Германия Франция и др.), что делает лекарственный препарат из экстракта Serenoa repens более дорогим для отечественного потребителя. Кроме того, в целом безопасный, экстракт Serenoa repens имеет в небольшом числе случаев специфические побочные эффекты, ограничивающие его применение. Мета-анализ 21 рандомизированного клинического исследования, включавших более 3000 пациентов в возрасте от 40 до 88 лет, показал, что частота побочных эффектов у пациентов, принимавших экстракт Serenoa repens, была сравнима с таковой в группе плацебо: 8,9% - в группе Serenoa repens, 7,1% - в группе плацебо; однако специфические побочные эффекты экстракта Serenoa repens описаны в 11 исследованиях чаще, чем в группе плацебо: импотенция в 1,1% случаев; желудочно-кишечные расстройства в 1,3% случаев [Wilt Т., Ishani A., Stark G. et al. Serenoa repens for benign prostatic hyperplasia // Cochrane Database Syst. Rev. - 2000. - Vol. (2). - CD001423].
Сущность изобретения
Задачей настоящего изобретения является создание нового эффективного и безопасного средства для профилактики или лечения ДГПЖ и способов для профилактики или лечения ДГПЖ, расширение перечня препаратов на растительной основе вместо синтетических лекарственных средств для профилактики или лечения ДГПЖ без побочных эффектов с возможностью длительного применения. Кроме того, появилась возможность наиболее эффективно использовать доступное растительное сырье, полученное из отходов лесоразработок.
В настоящем изобретении впервые предлагается применять в качестве средства для профилактики или лечения ДГПЖ концентрат провитаминный хвойный (КПХ), выпускаемый лесохимическими предприятиями в соответствии с ОСТ 56-32-78.
Вторым объектом настоящего изобретения является средство для профилактики или лечения доброкачественной гиперплазии предстательной железы на основе растительного экстракта, в котором в качестве растительного экстракта использован концентрат провитаминный хвойный. Средство для профилактики ДГПЖ может быть выполнено в виде биологически активной добавки к пище. Средство для профилактики или лечения ДГПЖ может быть выполнено в виде лекарственного средства.
Третьим объектом настоящего изобретения является фармацевтическая композиция для профилактики или лечения ДГПЖ, которая в качестве активной субстанции содержит КПХ в эффективном количестве и фармацевтически приемлемые носители, вспомогательные вещества и/или растворители - в качестве остального до 100%. Фармацевтическая композиция может быть выполнена в виде лекарственной формы для перорального применения, масляного раствора, суспензии, геля, капсулы, таблетки, липосомы или ректальных суппозиториев. Фармацевтическая композиция предназначена мужчинам любого возраста, страдающим ДГПЖ I и II стадии.
Четвертым объектом настоящего изобретения является способ профилактики или лечения ДГПЖ, поскольку у КПХ были выявленные положительные лечебные эффекты в отношении ДГПЖ. Для чего были подобраны дозы КПХ и схемы его применения, необходимые и достаточные для получения профилактического и лечебного эффекта. Способ профилактики ДГПЖ включает прием мужчиной старше 40 лет, не имеющего патологии простаты, упомянутого выше средства в эффективном количестве и достаточном по продолжительности курсом. Способ профилактики предусматривает, чтобы суточная доза упомянутого выше средства составляла от 0,3 до 0,6 г, а его прием осуществляли бы один или два или три раза в сутки в течение установленного курса, который составляет не менее 6 месяцев и до 10 лет, препарат может приниматься без перерывов или с перерывами между курсами на 1-2 месяца.
Способ лечения ДГПЖ включает прием мужчиной любого возраста, страдающим ДГПЖ I и II стадии, упомянутого выше средства в эффективном количестве и достаточном по продолжительности курсом. Способ лечения предусматривает, чтобы суточная доза упомянутого выше средства составляла от 0,3 до 1,2 г, а его прием осуществляли бы один или два или три раза в сутки в течение установленного курса, который составляет не менее 3 месяцев и до 5 лет, препарат может приниматься без перерывов или с перерывами между курсами на 1-2 месяца.
Раскрытие изобретения
КПХ получают из хвои (хвойной лапки) сосны и ели. Измельченную хвою загружают в реактор с обратным холодильником и нагревающей рубашкой, туда же заливают бензин экстракционный марки БР-1 или БР-2 (температура кипения 80-120°C), проводят процесс экстракции при температуре кипения в течение 4-6 часов при жидкостном модуле 4-6. Горячий экстракт сливают через фильтр, охлаждают для вымораживания восков, отделяют от восков декантацией и фильтрацией, затем обрабатывают водным раствором гидроокиси натрия для удаления водно-щелочной фазы омыляемых веществ в виде натриевых солей. Бензиновый экстракт неомыляемых веществ в том же реакторе промывают водой до нейтральной реакции промывных вод для удаления остатков гидроокиси натрия. Неомыляемые вещества (КПХ) получают в виде кубового остатка при отгонке растворителя. Для удаления следов растворителя КПХ обрабатывают глухим и острым паром, затем в горячем виде сливают в тару и анализируют на соответствие ОСТ 56-32-78. Выход КПХ составляет 6-7% от загруженной хвойной лапки.
КПХ содержит неомыляемые вещества хвои сосны и ели. В КПХ определены фитол, стерины, каротиноиды, витамин E, сквален, пренолы. КПХ - густой маслянистый продукт от желтого до оранжевого цвета, со специфическим хвойным запахом, массовая доля, %: летучих веществ - не более 3, воды - не более 9, фитола - 12-25, фитостерина - 2-3, витамина E - 0,5-0,6, каротиноидов - 0,4-0,6 [Ягодин В.И. Основы химии и технологии переработки древесной зелени. - Л.: ЛГУ, 1981. - С. 116].
Основными компонентами КПХ являются высокомолекулярные спирты (стерины, алифатические спирты) - более 50% - и их сложные эфиры с высокомолекулярными жирными кислотами - более 30%. Остальные компоненты, %: полиоксисоединения - 8,7; углеводороды - 4,9 (алканы, терпены); альдегиды - 2,8; оксиды - 0,2. Химический состав основных ингредиентов КПХ [Рощин В.И. Состав, строение и биологическая активность терпеноидов из древесной зелени хвойных растений: Автореф. дис. д-ра хим. наук. - СПб., 1995. - 35 с.; Рощин В.И. Химический состав липидной фракции хвои сосны и ели // Изучение и применение лечебно-профилактических препаратов на основе природных биологически активных веществ / Под ред. В.Г. Беспалова и В.Б. Некрасовой. - СПб.: Эскулап, 2000. - С. 114-116] приведен в таблице 1.

Наиболее ценными биологически активными в составе КПХ являются фитостерины (β-ситостерин, кампестерин, стигмастерин); витамин Е (α-токоферол, бета-, гамма-, дельта-токоферолы, альфа-, бета-, гамма-, дельта- токотриенолы); каротиноиды (β-каротин, α-каротин, лютеин, ксантофилы); полипренолы, фитол, сквален, витамин K.
С середины прошлого века КПХ применяется в качестве полезной добавки в парфюмерно-косметической промышленности [Ягодин В.И. Основы химии и технологии переработки древесной зелени. - Л.: ЛГУ, 1981. - С. 116]. На основе КПХ создана биологически активная добавка к пище (БАД) “Провитам” (Свидетельство государственной регистрации №77.99.11.3.У.2379.4.10 от 16.04.2010). Провитам на основе КПХ применяется в кардиологии в качестве ингибитора перекисного окисления липидов (RU 2408382 С1). Известно применение Провитама на основе КПХ для предупреждения канцерогенеза легких [Беспалов В.Г., Некрасова В.Б. Лечебно-профилактические средства из биомассы дерева. - СПб.: Изд-во Политехн. ун-та, 2007. - С. 112-117]. Известны противогельминтные свойства КПХ и созданного на его основе средства (RU 2493864 C1, 27.09.2013).
Однако до настоящего времени не была известна возможность применения КПХ для профилактики или лечения ДГПЖ.
Теперь авторами изобретения получены доказательства эффективности применения КПХ в качестве средства для профилактики или лечения ДГПЖ. Возможность применения КПХ для профилактики или лечения ДГПЖ никогда ранее и никем не рассматривалась и не была очевидной. Достоинством этого состава является то, что сырьем для производства КПХ является хвоя - отход лесозаготовительной промышленности, поставляющей древесину для целлюлозно-бумажной, мебельной, строительной индустрии. Мировые запасы сырья - хвои сосны и ели сосредоточены именно в России и являются практически неисчерпаемыми возобновляемыми ресурсами. Это является предпосылкой для создания достаточного количества КПХ, а из него - средства для профилактики или лечения ДГПЖ.
Следующие преимущества заявленной группы изобретений были выявлены в результате научных и практических исследований:
1. КПХ имеет более богатый состав действующих веществ, чем экстракт Serenoa repens. Как сказано выше, действующими веществами КПХ являются фитостерины, полипренолы, витамин E, каротиноиды, фитол, сквален, витамин K, тогда как аналог представляет из себя липостериновый экстакт из плодов пальмы ползучей Serenoa repens, основными действующими веществами которого являются лауриновая, миристиновая, олеиновая жирные кислоты и фитостерины [Sosnowska J., Balslev H. American palm ethnomedicine: a meta-analysis // J. Ethnobiol. Ethnomed. - 2009. - 5:43].
2. КПХ имеет более выраженные лечебно-профилактические эффекты в отношении ДГПЖ, чем экстракт Serenoa repens. Специфические фармакологические эффекты экстракта Serenoa repens в отношении ДГПЖ мало известны, предполагается, что лечебно-профилактическая активность экстракта Serenoa repens проявляется, в основном, в результате антипролиферативного и противовоспалительного действия соответственно на клетки и ткань простаты [Magri V., Trinchieri A., Perletti G., Marras Е. Activity of Serenoa repens, lycopene and selenium on prostatic disease: evidences and hypotheses // Arch. Ital. Urol. Androl. - 2008. - Vol. 80. - P. 65-78]. За счет более богатого состава КПХ имеет, кроме антипролиферативного и противовоспалительного действия на простату, еще несколько специфических лечебно-профилактических механизмов действия на ДГПЖ. Анализ результатов четырех рандомизированных плацебо-контролируемых клинических исследований, включавших в общей сложности 519 мужчин, показал, что β-ситостерин (основной представитель фитостеринов) вызывает регрессию СНМП у пациентов с ДГПЖ [Wilt Т., Ishani A., MacDonald R. et al. Beta-sitosterols for benign prostatic hyperplasia // Cochrane Database Syst. Rev. - 2000. - No. 2. - CD001043]. При анализе результатов семи контролируемых и неконтролируемых клинических исследований выявлено положительное влияние фитостеринов на качество жизни пациентов с ДГПЖ в шести исследованиях [Coleman C.I., Hebert J.H., Reddy P. The effect of phytosterols on quality of life in the treatment of benign prostatic hyperplasia // Pharmacotherapy. - 2002. - Vol. 22. - P. 1426-1432]. Фитол является лигандом для клеточных ядерных рецепторов PPAR (proliferator-activated receptor) и активирует данные рецепторы; активация рецепторов PPAR в клетках является антипролиферативным и антиангиогенным сигналом [Ondrey F. Peroxisome proliferator-activated receptor gamma pathway targeting in carcinogenesis: implications for chemoprevention // Clin. Cancer Res. - 2009. - Vol. 15. - P. 2-8], что уменьшает гиперплазию ткани ПЖ. β-каротин - соединение с известными антиоксидантными свойствами. ПЖ чувствительна к оксидативному стрессу, ввиду того, что последний играет важную роль в развитии хронического интрапростатического воспаления [De Marzo A.M., Coffey D.S., Nelson W.G. New concepts in tissue specificity for prostate cancer and benign prostatic hyperplasia // Urology. - 1999. - Vol. 53. - P. 29-42]. Потребление β-каротина ассоциируется со снижением риска развития ДГПЖ и ее симптоматики [Rohrmann S., Giovannucci E., Willett W.C., Platz E.A. Fruit and vegetable consumption, intake of micronutrients, and benign prostatic hyperplasia in US men // Am. J. Clin. Nutr. - 2007. - Vol. 85. - P. 523-529; Tavani A., Longoni E., Bosetti C. et al. Intake of selected micronutrients and the risk of surgically treated benign prostatic hyperplasia: a case-control study from Italy // Eur. Urol. - 2006. - Vol. 50. - P. 549-554]. Еще одним известным антиоксидантом является витамин E, что объясняет его положительное влияние на ДГПЖ и СНМП. Комплекс препаратов, в состав которого входил витамин E, у 144 пациентов с ДГПЖ уменьшал ноктурию и частоту мочеиспускания по сравнению с пациентами, принимавшими плацебо [Preuss H.G., Marcusen С., Regan J. et al. Randomized trial of a combination of natural products (cernitin, saw palmetto, B-sitosterol, vitamin E) on symptoms of benign prostatic hyperplasia (BPH) // Int. Urol. Nephrol. - 2001. - Vol. 33. - P. 217-225]. У полипренолов и их 2,3-дигидропроизводных (долихолов) выявлены многообразные эффекты, которые положительно влияют на ДГПЖ. Полипренолы, попадаемые в животный организм, метаболизируются в печени в активные долихолы. Функции полипренолов и долихолов связаны с транспортом гидрофильных молекулярных фрагментов через мембраны клеток в процессе синтеза полисахаридов, глюкопротеинов и других биополимеров; долихолы стереохимически взаимодействуют с витамином E, образуя транспортные цепи по удалению свободных радикалов; полипренолы стимулируют синтез коэнзима Q, который является сильным антиоксидантом, нормализуют липидный обмен, стимулируют репарацию клеток [Surmacz L., Swiezewska E. Polyisoprenoids - secondary metabolites or physiologically important superlipids? // Biochem. Biophys. Res. Commun. - 2011. - Vol. 22. - P. 627-632].
3. По сравнению с экстрактом Serenoa repens, КПХ обладает более выраженным и более широким лечебно-профилактическим действием на ДГПЖ. Лечебное действие экстракта Serenoa repens на ДГПЖ доказано в экспериментах на моделях ДГПЖ, индуцированных у крыс сульпиридом [Van Coppenolle F., Le Bourhis X., Carpentier F., Delaby G., Cousse H., Raynaud J.P., Dupouy J.P., Prevarskaya N. Pharmacological effects of the lipidosterolic extract of Serenoa repens (Permixon) on rat prostate hyperplasia induced by hyperprolactinemia: comparison with finasteride // Prostate. - 2000. - Vol. 43. - P. 49-58] или тестостероном [Talpur N., Echard В., Bagchi D., Bagchi M., Preuss H.G. Comparison of Saw Palmetto (extract and whole berry) and Cernitin on prostate growth in rats // Mol. Cell. Biochem. - 2003. - Vol. 250. - P. 21-26]. Сравнительные исследования, проведенные авторами, доказали, что на моделях ДГПЖ, индуцированных у крыс сульпиридом или тестостероном, лечебные эффекты КПХ более выраженные, чем у экстракта Serenoa repens; кроме того у КПХ выявлены профилактические эффекты в отношении ДГПЖ, а у экстракта Serenoa repens профилактических эффектов не выявлено. При клиническом применении КПХ у больных ДГПЖ его лечебная активность была сравнима с ингибиторами 5α-редуктазы и α1-адреноблокаторами.
4. По сравнению с экстрактом Serenoa repens, КПХ имеет лучший профиль безопасности. Как природный комплекс, экстракт Serenoa repens имеет не частые и не очень выраженные побочные эффекты [MacDonald R., Tacklind J.W., Rutks I., Wilt T.J. Serenoa repens monotherapy for benign prostatic hyperplasia (BPH): an updated Cochrane systematic review // BJU Int. - 2012. - Vol. 109. - P. 1756-1761], однако их перечень довольно большой: экстракт Serenoa repens вызывает боли в животе, понос, тошноту, слабость, головные боли, риниты, снижает либидо [Agbabiaka T.B., Pittler M.H., Wider В., Ernst Е. Serenoa repens (saw palmetto): a systematic review of adverse events // Drug Saf. - 2009. - Vol. 32. - P. 637-647]. КПХ - натуральный продукт в любой товарной/препаративной форме не дает побочных действий за исключением индивидуальной непереносимости компонентов хвои [Беспалов В.Г., Некрасова В.Б. Лечебно-профилактические средства из биомассы дерева. - СПб.: Изд-во Политехн. ун-та, 2007. - С. 112-117], что является неоспоримым преимуществом продукта изобретения перед экстрактом Serenoa repens, а тем более перед синтетическими лекарственными препаратами ингибиторами 5α-редуктазы и α1-адреноблокаторами. При клиническом применении КПХ у больных ДГПЖ не зарегистрировано побочных эффектов.
5. По сравнению с экстрактом Serenoa repens, для производства КПХ имеется значительно более доступное и экономически более выгодное сырье. Serenoa repens - экзотическое растение юга США [Sosnowska J., Balslev H. American palm ethnomedicine: a meta-analysis // J. Ethnobiol. Ethnomed. - 2009. - 5:43]. КПХ производят из хвои сосны и ели, широко доступного сырья, полученного из отходов лесоразработок.
Все выявленные свойства КПХ выгодно отличают его от ближайшего аналога - экстракта Serenoa repens. По сравнению с растительным экстрактом плодов пальмы ползучей Serenoa repens, КПХ имеет более богатый состав активно действующих веществ и более выраженные специфические лечебно-профилактические эффекты в отношении ДГПЖ, обладает более выраженным и более широким лечебно-профилактическим действием на ДГПЖ, имеет лучший профиль безопасности, для производства КПХ имеется значительно более доступное и экономически более выгодное сырье.
Эти свойства и преимущества КПХ обеспечивают решение задачи с достижением технического результата настоящего изобретения: создание эффективного и безопасного растительного средства для профилактики и лечения ДГПЖ, хорошо переносимого мужчинами в течение длительного времени приема, без побочных эффектов многих синтетических и растительных лекарственных средств, недорогого, экономически выгодного в производстве, из дешевого экологически чистого сырья - отходов лесопереработки.
Осуществление изобретения
Ниже заявитель представляет примеры воплощения изобретения, которые будут понятны для специалистов, работающих в области создания и применения средств для лечения ДГПЖ, прежде всего, урологов, андрологов и фармакологов, но они вовсе не предназначены для ограничения объема притязаний.
Авторами впервые выявлена и показана способность лечить и предупреждать ДГПЖ с помощью КПХ.
Исследования были проведены на базе ФГБУ НИИ онкологии им. Н.Н. Петрова Минздрава России. Эксперименты проведены на крысах-самцах Вистар разводки питомника лабораторных животных “Рапполово” РАМН. В исследовании использованы следующие препараты.
Концентрат провитаминный хвойный (КПХ) в виде пасты зеленовато-оранжевого цвета получен от фирмы «Фитолон-Мед» (Санкт-Петербург, Россия).
Смесь эфиров тестостерона (СЭТ) - Омнадрен 250 в виде стерильного масляного раствора по 1 мл, тестостерон (смесь эфиров), в 1 мл тестостерона пропионат (30,0 мг), тестостерона фенилпропионат (60,0 мг), тестостерона изокапронат (60,0 мг), тестостерона капронат (100,0 мг), бензиловый спирт (50,0 мг), арахисовое масло для инъекций.
Сульпирид, раствор для парэнтерального введения, 50 мг/мл, в ампулах по 2 мл (ООО “Органика”, Россия).
Экстракт плодов Serenoa repens, капсулы по 320 мг (Простамол Уно, Берлин-Хеми АГ, Германия).
Пример 1. Лечение ДГПЖ, индуцированной сульпиридом, с помощью КПХ в сравнении с экстрактом Serenoa repens в популяции из 44 животных.
Эксперимент проведен на 44 половозрелых крысах самцах Вистар с начальной массой 250-300 г. Индукция ДГПЖ проводилась ежедневным введением сульпирида. Животные были рандомизированы и распределены на 4 группы: 1-я группа - интактный контроль, 10 крыс не получали никаких воздействий до конца эксперимента; 2-я группа - ДГПЖ-контроль, 12 крысам ежедневно вводили сульпирид в физиологическом растворе внутрибрюшинно в дозе 40 мг/кг массы тела в течение 40 дней и носитель (растительное масло) внутрижелудочным зондом перорально по 0,5 мл на крысу; 3-я группа - ДГПЖ-КПХ, 12 крысам ежедневно вводили сульпирид, так же как во 2-й группе, и КПХ в растительном масле внутрижелудочным зондом перорально в дозе 400 мг/кг массы тела; 4-я группа - ДГПЖ-Serenoa repens, 10 крысам ежедневно вводили сульпирид, так же как во 2-й группе, и спиртовой экстракт плодов Serenoa repens, предварительно смешанный с растительным маслом, внутрижелудочным зондом перорально в дозе 200 мг/кг массы тела. Выбор дозы КПХ был сделан, исходя из результатов предварительных доклинических испытаний его эффективности на модели ДГПЖ и оценки токсикологического профиля. Выбор дозы экстракта Serenoa repens основывался на литературных данных [Duborija-Kovacevic N., Jakovljevic V., Sabo A., Tomic Z., Pajovic В., Perovic D. Tolerability and toxicity of lipidosterolic extract of American dwarf palm Serenoa repens in Wistar rats: well-known extract, new insight // Eur. Rev. Med. Pharmacol. Sci. - 2011. - Vol. 15. - P. 1311-1317]. Длительность эксперимента составила 40 дней. По окончании эксперимента животные подвергались эвтаназии парами хлороформа и взвешивались. При аутопсии ПЖ крыс извлекалась в виде комплекса дорсолатерального отдела (ДЛП), двух вентральных долей (ВП), двух семенных пузырьков с тесно прилежащими к ним передними долями или коагуляционными железами (ПП). Вычисляли объем дорсолатерального отдела ПЖ по формуле: V=а×b2, где a - больший линейный размер ПЖ; b - меньший линейный размер ПЖ. Отделы ПЖ взвешивались, для каждого из отделов и для всей ПЖ рассчитывали простатический индекс (ПИ) как отношение массы отдела ПЖ или всей ПЖ (в мг) к 100 г массы тела животного. Результаты подвергались статистической обработке с использованием стандартного набора функций программы STATISTICA. Числовые данные приводятся в виде М±m, где М - среднее арифметическое; m - стандартная ошибка среднего арифметического. Для оценки статистической достоверности использовали критерий Стьюдента и Фишера с 95% уровнем значимости.
В таблице 2 приведены данные о влиянии тестируемых средств на объем ДЛП и ПИ различных отделов и всей ПЖ крыс.
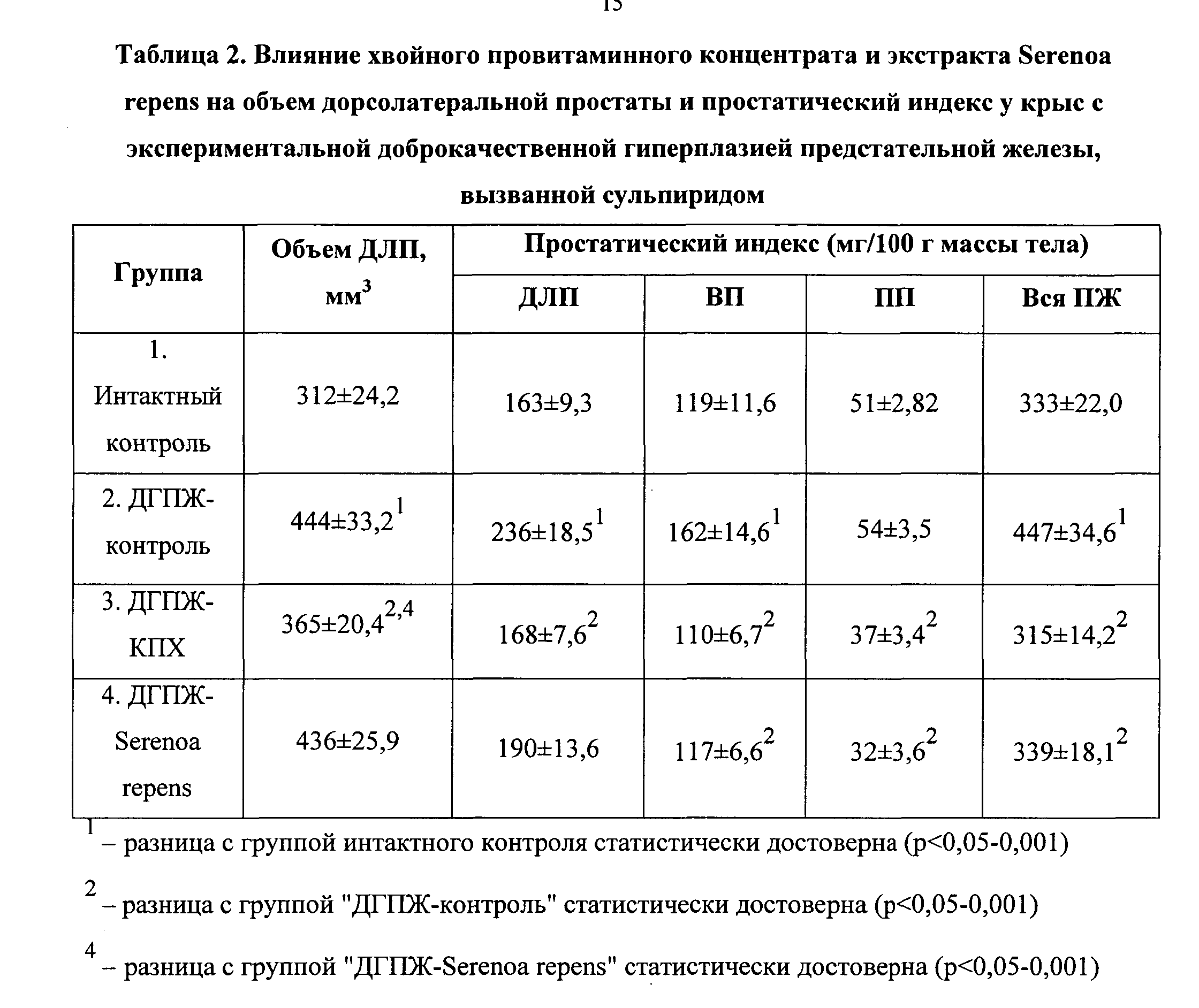
Как видно из таблицы 2, субхроническое внутрибрюшинное введение сульпирида вызывает ДГПЖ у самцов крыс. По сравнению с интактным контролем, у крыс из группы “ДГПЖ-контроль” наблюдали достоверное увеличение объема ДЛП на 42%, ПИ ДЛП - на 44,7%, ВП - на 36,4% и для всех отделов ПЖ - на 34,5%; увеличение ПИ ПП на 6,9% было недостоверным. По сравнению с ДГПЖ-контролем, экстракт Serenoa repens достоверно снижал ПИ ВП, ПП и всей ПЖ соответственно на 27,9, 40,5 и 24,2%; уменьшение объема ДЛП на 1,6%, ПИ ДЛП на 19,6% было статистически недостоверным. КПХ, в отличие от экстракта Serenoa repens, достоверно снижал ПИ всех отделов простаты и ПЖ в целом, а также объем ДЛП. По сравнению с ДГПЖ-контролем, КПХ достоверно снижал объем ДЛП на 17,7%, ПИ ДЛП, ВП, ПП и всей ПЖ соответственно на 28,9, 31,8, 32,7 и 29,7% (таблица 2). Таким образом, и КПХ и экстракт Serenoa repens оказывали лечебное действие на ДГПЖ у самцов крыс, индуцированную сульпиридом, но лечебные эффекты КПХ на ДГПЖ, особенно на гиперлазию ДЛП, были более выраженными, чем у экстракта Serenoa repens.
Пример 2. Лечение и профилактика ДГПЖ, индуцированной тестостероном, с помощью КПХ в сравнении с экстрактом Serenoa repens в популяции из 44 животных.
Эксперимент проведен на 71 половозрелом крысе самце Вистар с начальной массой 450-550 г. Индукция ДГПЖ проводилась по следующему протоколу: хирургическая кастрация, на 7-й день после кастрации начиналось введение смеси эфиров тестостерона подкожно в дозе 0,1 мл (25 мг)/кг массы тела, через день (каждый второй день) в течение 20 дней. Препараты вводили ежедневно перорально внутрижелудочным зондом. Животные были рандомизированы и распределены на 6 групп: 1-я группа - интактный контроль, 6 крыс не получали никаких воздействий до конца эксперимента; 2-я группа - ДГПЖ-контроль, 13 крыс, введение рафинированного растительного масла в течение 6 недель, 0,5 мл на крысу, через 2 недели кастрация и индукция ДГПЖ; 3-я группа - ДГПЖ-КПХ в лечебном режиме, 14 крыс, введение КПХ в рафинированном растительном масле в течение 4 недель, 400 мг/кг массы тела, кастрация и индукция ДГПЖ, начало введения КПХ - в день 1-й инъекции омнадрена; 4-я группа - ДГПЖ-КПХ в лечебно-профилактическом режиме, 15 крыс, введение КПХ в рафинированном растительном масле в течение 6 недель, 400 мг/кг массы тела, через 2 недели кастрация и индукция ДГПЖ; 5-я группа - ДГПЖ-Serenoa repens в лечебном режиме, 11 крыс, введение спиртового экстракта плодов Serenoa repens, предварительно смешанного с растительным маслом, 200 мг/кг массы тела, в течение 4 недель, кастрация и индукция ДГПЖ, начало введения Serenoa repens - в день 1-й инъекции омнадрена; 5-я группа - ДГПЖ-Serenoa repens в лечебно-профилактическом режиме; 12 крыс, введение спиртового экстракта плодов Serenoa repens, предварительно смешанного с растительным маслом, 200 мг/кг массы тела, через 2 недели кастрация и индукция ДГПЖ. По окончании введения препаратов животные всех групп подвергались эвтаназии парами хлороформа, результаты оценивали так же, как в примере 1.
В таблице 3 приведены данные о влиянии тестируемых средств на объем ДЛП и ПИ различных отделов и всей ПЖ крыс.
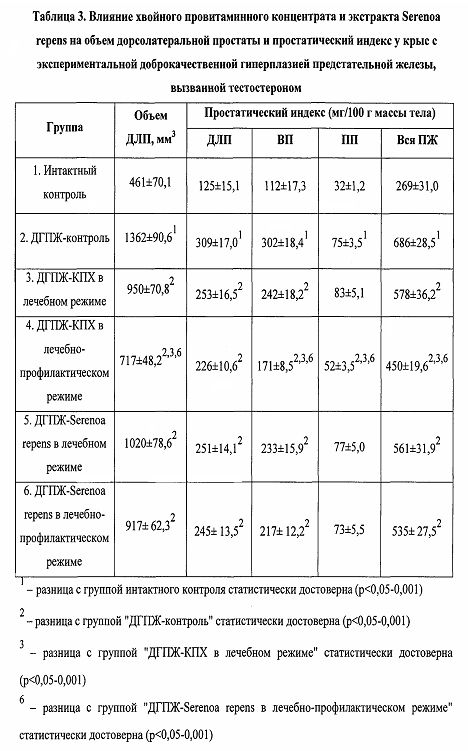
Как видно из таблицы 3, введение пролонгированной формы тестостерона вызывает ДГПЖ у кастрированных самцов крыс, причем значительно более выраженное, чем на модели индукции ДГПЖ сульпиридом. По сравнению с интактным контролем, у крыс из группы “ДГПЖ-контроль” наблюдали достоверное увеличение объема ДЛП на 195,6%, ПИ ДЛП - на 147,6%, ВП - на 170,5%, ПП - на 133,1%, всех отделов ПЖ - на 155,4%. По сравнению с ДГПЖ-контролем, КПХ, вводимый в лечебном режиме, достоверно снижал объем ДЛП на 30,2%, ПИ ДЛП - на 18,4%, ВП - на 19,9%, всех отделов ПЖ - на 15,9%, но не влиял значимо на ПИ ПП. Такие же лечебные эффекты наблюдали и у экстракта Serenoa repens. По сравнению с ДГПЖ-контролем, экстракт Serenoa repens, вводимый в лечебном режиме, достоверно снижал объем ДЛП на 25,1%, ПИ ДЛП - на 18,8%, ВП - на 22,9%, всех отделов ПЖ - на 18,3%, но не влиял значимо на ПИ ПП. Значимой разницы между лечебными эффектами КПХ и экстракта Serenoa repens ни по одному показателю не было. В результате воздействия КПХ в лечебно-профилактическом режиме наблюдали существенное увеличение эффективности препарата. По сравнению с группами “ДГПЖ-контролем” и “ДГПЖ-КПХ в лечебном режиме”, КПХ, вводимый в лечебно-профилактическом режиме, достоверно снижал соответственно объем ДЛП на 47,4 и 24,6%, ПИ ДЛП - на 26,9 и 10,5% (только этот показатель был недостоверный), ВП - на 43,3 и 29,2%, ПП - на 30,3 и 37,1%, всех отделов ПЖ - на 34,5 и 22,1%. Тогда как эффекты экстракта Serenoa repens, вводимого в лечебно-профилактическом режиме, не отличались значимо от эффектов данного препарата, вводимого в лечебном режиме. Причем, по сравнению с группой “ДГПЖ-Serenoa repens в лечебно-профилактическом режиме”, КПХ, вводимый в лечебно-профилактическом режиме, достоверно снижал объем ДЛП на 21,8%, ПИ ВП - на 21,1%, ПП - на 28,4%, всех отделов ПЖ - на 16,0%, хотя снижение ПИ ДЛП на 7,8% было статистически незначимо (таблица 3). Таким образом, и КПХ и экстракт Serenoa repens оказывали лечебное действие на ДГПЖ у самцов крыс, индуцированную тестостероном, лечебные эффекты КПХ и экстракта Serenoa repens были одинаковыми, но КПХ оказывал профилактическое действие на развитие ДГПЖ, а экстракт Serenoa repens - не оказывал.
Пример 3. Лечебный эффект лекарственного средства, содержащего в качестве активной фармацевтической субстанции КПХ, у больных ДГПЖ.
Под наблюдением находилось 10 мужчин, имеющих симптоматическую ДГПЖ, возрастом от 55 до 68 лет, средний возраст - 61,9±1,36 лет. Все пациенты ранее никогда не лечили ДГПЖ, мирились с постепенно развивающимися СНМП. Анамнез заболевания, со слов пациентов, составлял от 3 до 10 лет. При первом опросе и осмотре врача у всех пациентов выявлены СНМП. Все пациенты заполнили анкету Международной шкалы IPSS. Пациенты жаловались на ощущение неполного опорожнения мочевого пузыря после мочеиспускания; потребность мочиться чаще, чем через 2 часа после последнего мочеиспускания; прерывистое мочеиспускание; трудность временно воздержаться от мочеиспускания; слабую струя мочи; необходимость натуживаться, чтобы начать мочеиспускание. У всех пациентов объем простаты, по данным трансректальной ультрасонографии ПЖ, был выше нормы. Бал симптоматики заболевания простаты по Международной шкале IPSS у 4 пациентов составлял от 5 до 7 (слабо выраженная симптоматика), у 6 пациентов - от 11 до 19 (умеренная симптоматика). По классификации Гюйона, 7 пациентам был поставлен диагноз ДГПЖ I стадии (компенсация), 3 пациентам - ДГПЖ II стадии (декомпенсация). Всем пациентам было назначено лекарственное средство, содержащее в 1 таблетке 0,1 г КПХ, по 2 таблетки 3 раза в день, курс приема 3 месяца. Все пациенты находились на амбулаторном наблюдении, приходили на визит к врачу 1 раз в месяц. Через 3 месяца приема лекарства на основе КПХ все пациенты повторно заполнили анкету Международной шкалы IPSS, части пациентов была проведена повторная трансректальная ультрасонография ПЖ. В результате проведенного лечения все 10 пациентов с ДГПЖ, получавшие лекарство на основе КПХ в течение 3 месяцев, отметили положительный эффект, приведенный в таблице 4.
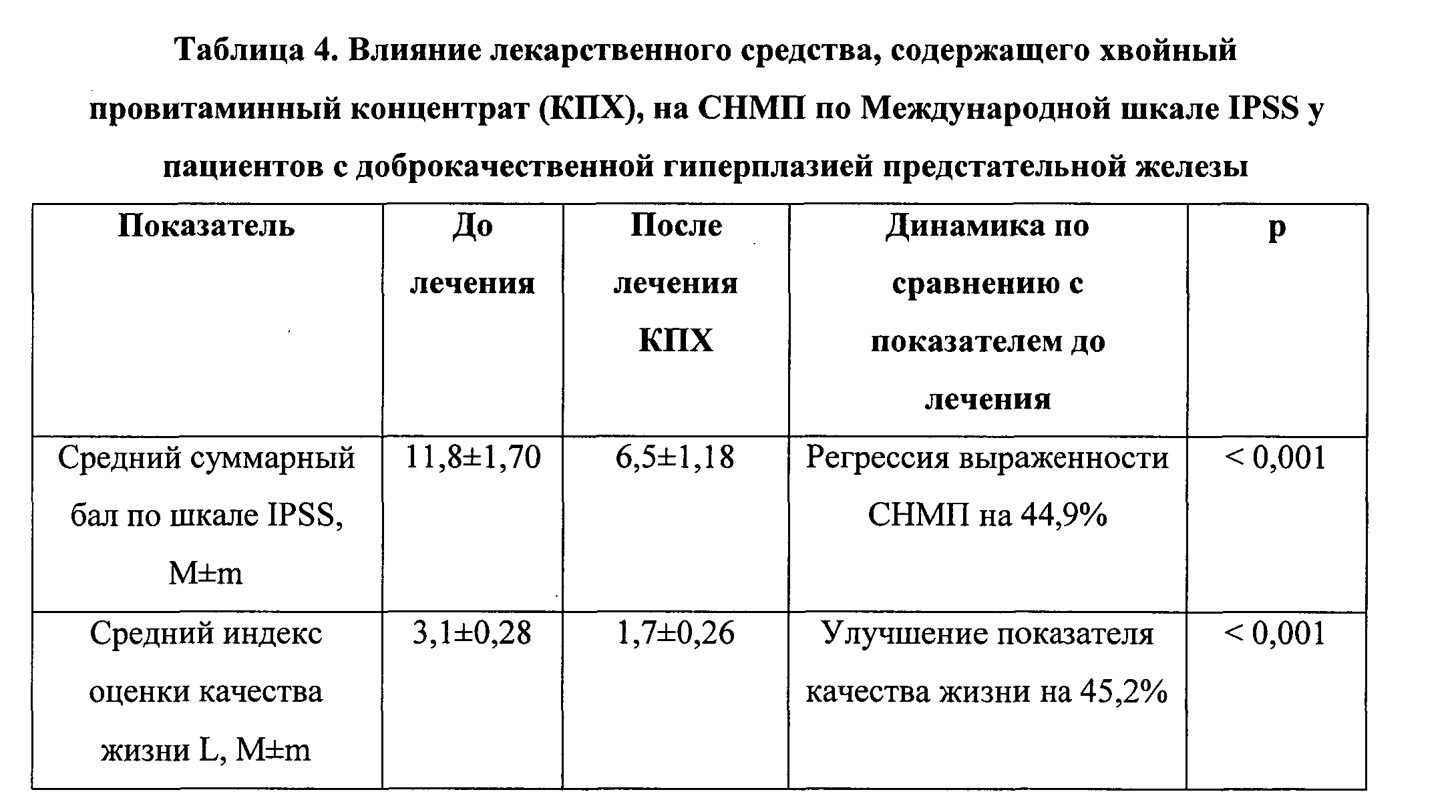
Как видно из таблицы 4, у больных ДГПЖ 1-11 стадии средний балл симптоматики заболевания ПЖ по Международной шкале IPSS через 3 месяца лечения лекарством на основе КПХ достоверно снизился с 11,8±1,70 до 6,5±1,18 (на 44,9%), а индекс оценки качества жизни L - достоверно снизился с 6,5±1,18 до 1,7±0,26 (на 45,2%, снижение индекса L свидетельствует о повышении качества жизни). Ни у одного из 10 наблюдаемых больных в процессе лечения лекарством на основе КПХ не было отмечено нежелательных побочных эффектов, что свидетельствует о хорошей переносимости и безопасности препарата.
Пример 4. Лечебный эффект лекарственного средства, содержащего в качестве активной фармацевтической субстанции КПХ, у больного ДГПЖ II стадии.
Пациент А-в А.Н., 68 лет. При первичном обращении к врачу при анамнезе предъявляет жалобы на СНМП. Впервые стал замечать СНМП около 8 лет назад, симптомы постепенно прогрессировали. К врачам по этому поводу не обращался, лечения болезней простаты не проходил. При заполнении анкеты Международной шкалы IPSS суммарный балл симптоматики заболевания составил 19, индекс оценки качества жизни L - 4 (неудовлетворительно). Проведена трансректальная ультрасонография ПЖ, по данным которой объем простаты 49 см3. На основании обследования поставлен диагноз ДГПЖ II стадии с умеренной симптоматикой заболевания. Из сопутствующих заболеваний: атеросклероз, ишемическая болезнь сердца, гипертоническая болезнь, хронический холецистит. Наблюдается и проходит лечение у кардиолога. Пациенту назначено лекарство на основе КПХ по 2 таблетки 3 раза в день в течение 3 месяцев. В процессе лечения лекарством на основе КПХ 3 раза приходил на прием к врачу, отмечал постепенную регрессию СНМП, хорошую переносимость препарата. Через 3 месяца приема лекарства на основе КПХ пациент повторно заполнил анкету Международной шкалы IPSS; была проведена повторная трансректальная ультрасонография ПЖ. Суммарный балл симптоматики заболевания снизился до 13, индекс оценки качества жизни L - до 3 (смешанное чувство), объем простаты снизился до 44 см3.
Пример 5. Лечебный эффект лекарственного средства, содержащего в качестве активной фармацевтической субстанции КПХ, у больного ДГПЖ I стадии.
Пациент К-в С.А., 59 лет. При первичном обращении к врачу при анамнезе предъявляет жалобы на СНМП. Впервые стал замечать СНМП около 4 лет назад, симптомы постепенно прогрессировали. К врачам по этому поводу не обращался, лечения болезней простаты не проходил. При заполнении анкеты Международной шкалы IPSS суммарный балл симптоматики заболевания составил 18, индекс оценки качества жизни L - 4 (неудовлетворительно). Проведена трансректальная ультрасонография ПЖ, по данным которой объем простаты 45 см3. На основании обследования поставлен диагноз ДГПЖ I стадии с умеренной симптоматикой заболевания. Из сопутствующих заболеваний: хронический гастрит, хронический панкреатит. Лечение не проходит, каких-либо лекарственных препаратов не принимает. Пациенту назначено лекарство на основе КПХ по 2 таблетки 3 раза в день в течение 3 месяцев. В процессе лечения лекарством на основе КПХ 3 раза приходил на прием к врачу, отмечал постепенную регрессию СНМП, хорошую переносимость препарата. Через 3 месяца приема лекарства на основе КПХ пациент повторно заполнил анкету Международной шкалы IPSS; была проведена повторная трансректальная ультрасонография ПЖ. Суммарный балл симптоматики заболевания снизился до 8, индекс оценки качества жизни L - до 2 (удовлетворительно), объем простаты снизился до 38 см3.
Пример 6. Лечебный эффект лекарственного средства, содержащего в качестве активной фармацевтической субстанции КПХ, у больного ДГПЖ I стадии.
Пациент Н-к В.И., 57 лет. При первичном обращении к врачу в процессе прохождения диспансеризации при анамнезе предъявляет жалобы на СНМП. Впервые стал замечать СНМП около года назад. К врачам по этому поводу не обращался, лечения болезней простаты не проходил. При заполнении анкеты Международной шкалы IPSS суммарный балл симптоматики заболевания составил 7, индекс оценки качества жизни L - 2 (удовлетворительно). На основании обследования поставлен диагноз ДГПЖ I стадии со слабо выраженной симптоматикой заболевания. В остальном практически здоров, каких-либо лекарственных препаратов не принимает. Пациенту назначено лекарство на основе КПХ по 2 таблетки 3 раза в день в течение 3 месяцев. В процессе лечения лекарством на основе КПХ 3 раза приходил на прием к врачу, отмечал постепенную регрессию СНМП, хорошую переносимость препарата. Через 3 месяца приема лекарства на основе КПХ пациент повторно заполнил анкету Международной шкалы IPSS. Суммарный балл симптоматики заболевания снизился до 4, индекс оценки качества жизни L - до 1 (хорошо).
Таким образом, по данным клинических наблюдений (примеры 3-6), лекарственное средство, содержащее в качестве активной фармацевтической субстанции КПХ, оказывает лечебное действие у больных ДГПЖ 1-11 стадии с умеренно и слабо выраженными СНМП уже через 3 месяца лечения. Лечебная эффективность лекарства на основе КПХ сравнима с применяемыми сегодня для лечения ДГПЖ α1-адреноблокаторами и ингибиторами 5α-редуктазы и превышает таковую экстракта Serenoa repens (об эффективности данных средств сказано выше), при КПХ выгодно отличается от α1-адреноблокаторов и ингибиторов 5α-редуктазы более высокой безопасностью и низким риском нежелательных побочных эффектов.
Ниже приведены примеры фармацевтических композиций на основе КПХ.
Пример 7. Из КПХ получают таблетки (лекарственный препарат, биологически активная добавка к пище) по рецептуре, указанной в таблице 5.

Пример 7. Из КПХ получают капсулы массой 0,3-0,4 г. Капсулы имеют тот же состав гранулята, что и таблетки. Но с учетом меньшей массы содержимого капсул, суточная доза приема капсул должна быть удвоена по отношению к таблеткам.
Пример 8. Из КПХ получают масляный раствор. КПХ растворяют в растительном масле (персиковом, косточковом, кукурузном, подсолнечном и/или другом пищевом масле) при соотношении КПХ : масло = 1:8-10).
Пример 9. Из КПХ изготавливают свечи путем растворения КПХ в масле какао при нагревании до 45-50°C и перемешивании при соотношении КПХ : масло какао = 5-10:90, розливе в формочки и последующем охлаждении массы непосредственно в формочках до комнатной температуры. Содержание КПХ в 1 свече от 0,3 до 0,6 г.
Способ лечения ДГПЖ применяется у мужчин любого возраста, преимущественно 50-65 лет на ранних стадиях развития ДГПЖ, страдающих ДГПЖ I и II стадии с умеренно и слабо выраженными СНМП. КПХ применяется в суточной дозе 0,3 г до 1,2 г. КПХ назначают в виде таблеток по 0,1 г активной субстанции по 1-3 таблетки 2-3 раза в день; в виде капсул по 0,05 г активной субстанции по 2-8 капсул 2-3 раза в день; в виде масляного раствора по 0,03 г активной субстанции в капле по 3-14 капель 2-3 раза в день; в виде свечей по 0,3 или 0,6 г активной субстанции 2 раза в день утром и вечером, или по 2 свечи, содержащей 0,3 или 0,6 г активной субстанции, вечером на ночь. Прием КПХ осуществляют один или два или три раза в сутки в течение установленного курса, который составляет не менее 3 месяцев и до 5 лет, препарат может приниматься без перерывов или с перерывами между курсами на 1-2 месяца.
Способ профилактики ДГПЖ применяется у мужчин старше 40 лет, не имеющих патологии простаты. КПХ применяется в суточной дозе 0,3 г до 0,6 г. КПХ назначают в виде таблеток по 0,1 г активной субстанции по 1-2 таблетки 2-3 раза в день; в виде капсул по 0,05 г активной субстанции по 1-4 капсулы 2-3 раза в день; в виде масляного раствора по 0,03 г активной субстанции в капле по 2-7 капель 2-3 раза в день; в виде свечей по 0,3 активной субстанции 2 раза в день утром и вечером, или по 1 свече, содержащей 0,3 или 0,6 г активной субстанции, вечером на ночь. Прием КПХ осуществляют один или два или три раза в сутки в течение установленного курса, который составляет не менее 6 месяцев и до 10 лет, препарат может приниматься без перерывов или с перерывами между курсами на 1-2 месяца.
Способ профилактики и лечения доброкачественной гиперплазии предстательной железы у мужчин, предусматривающий прием средства на основе концентрата провитаминного хвойного один, или два, или три раза в сутки; в суточной дозе концентрата от 0,3 до 1,2 г в течение не менее 3 месяцев до 10 лет; средство принимается без перерывов или с перерывами между курсами на 1-2 месяца.
