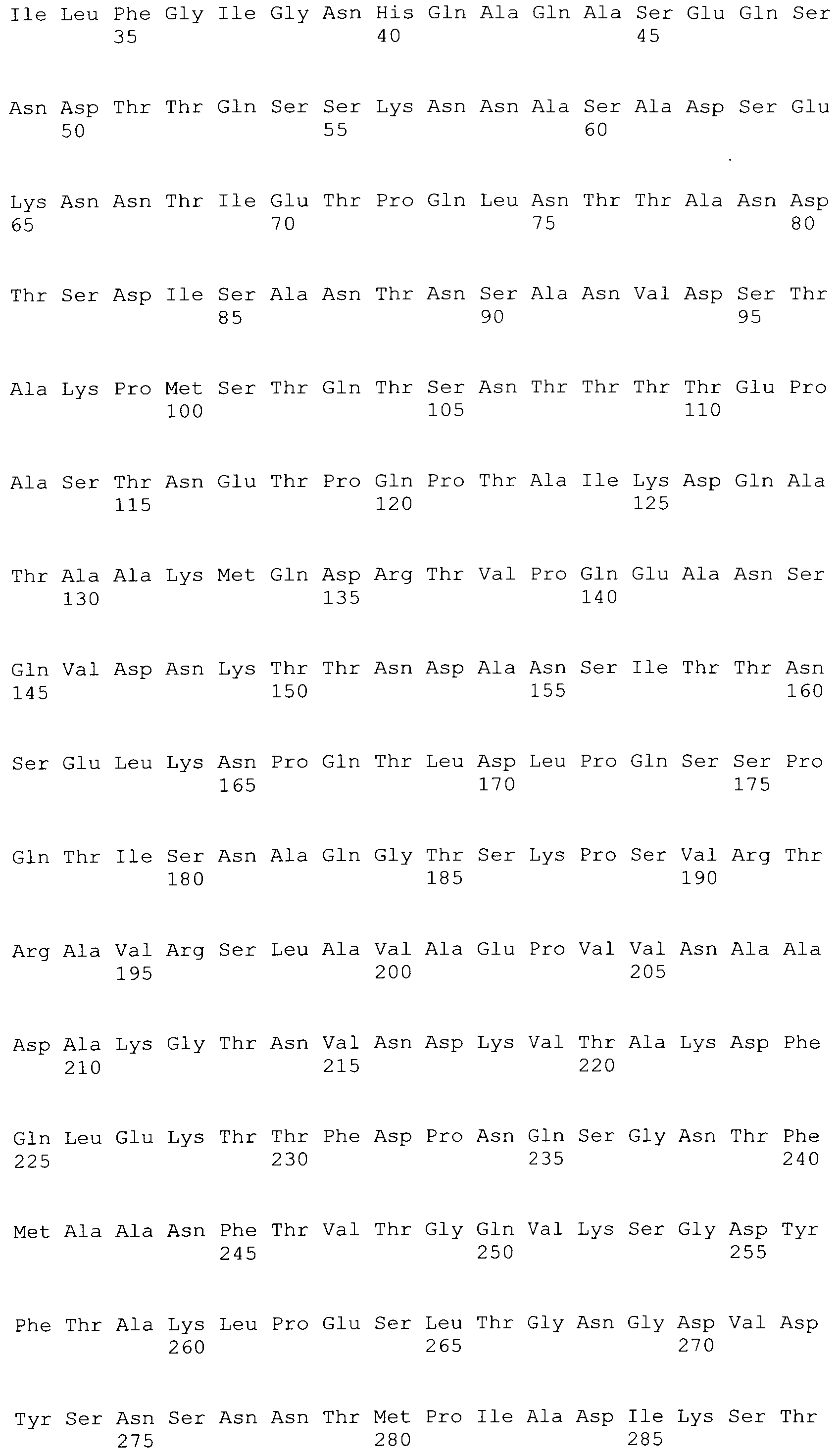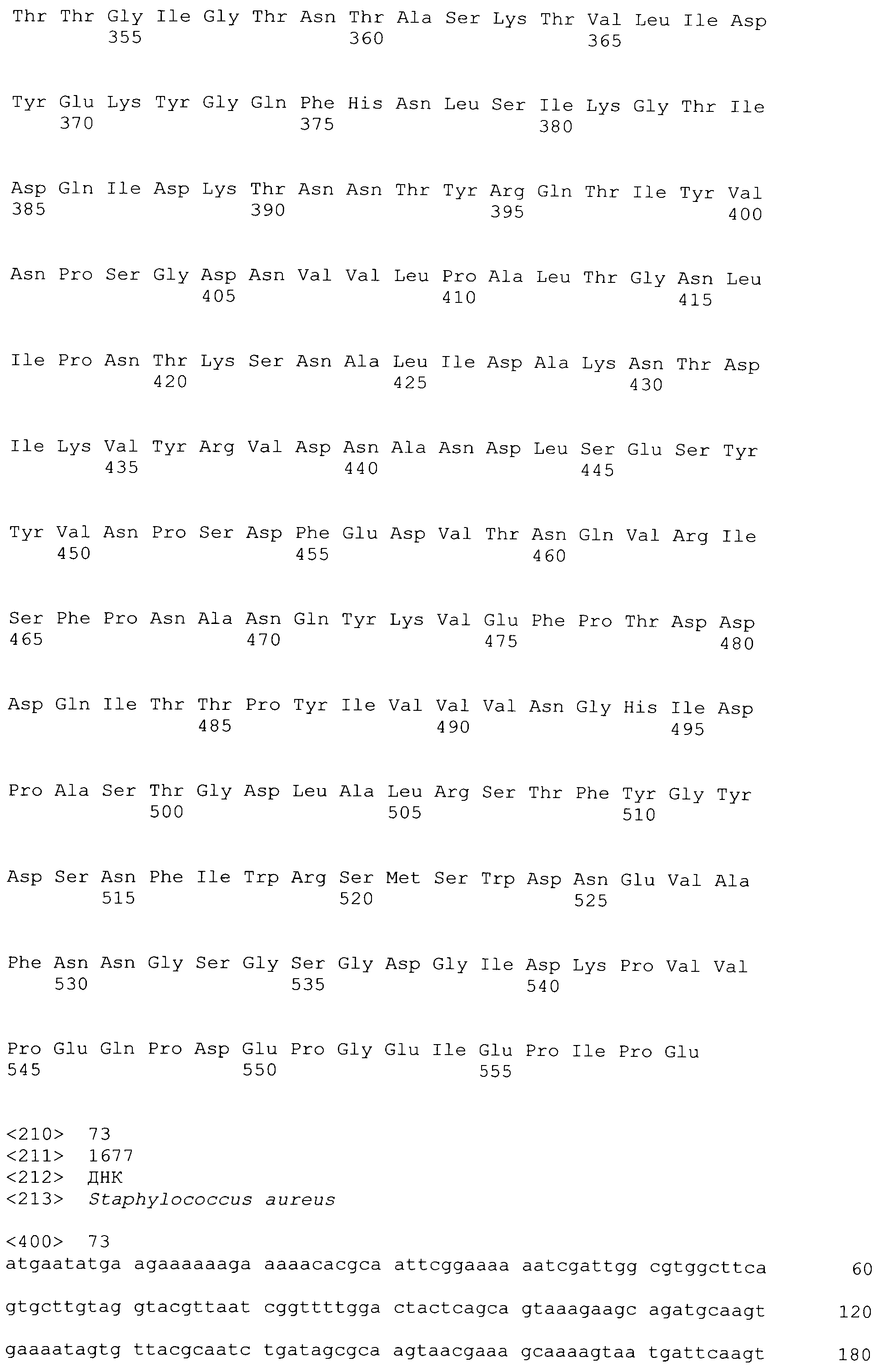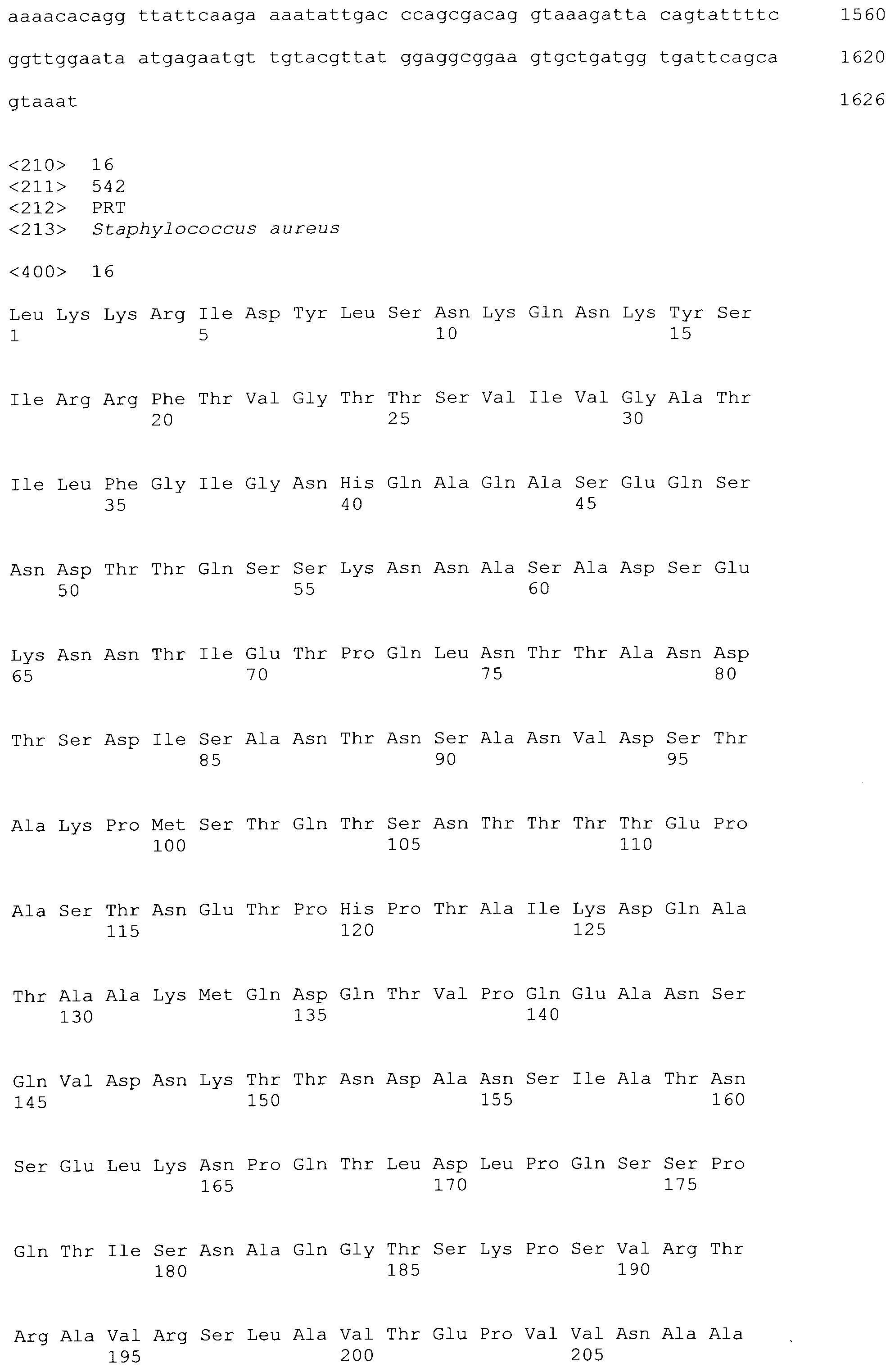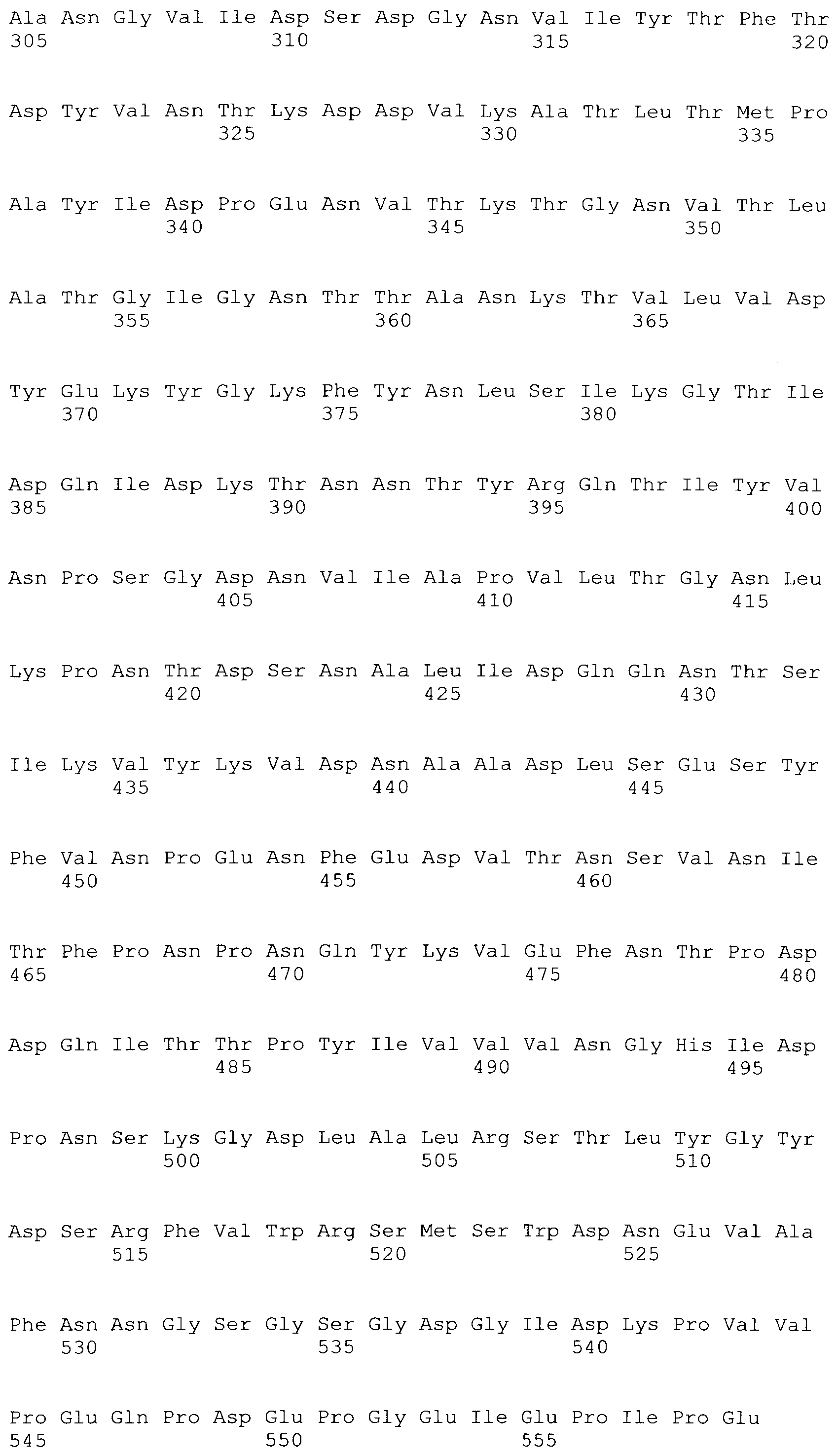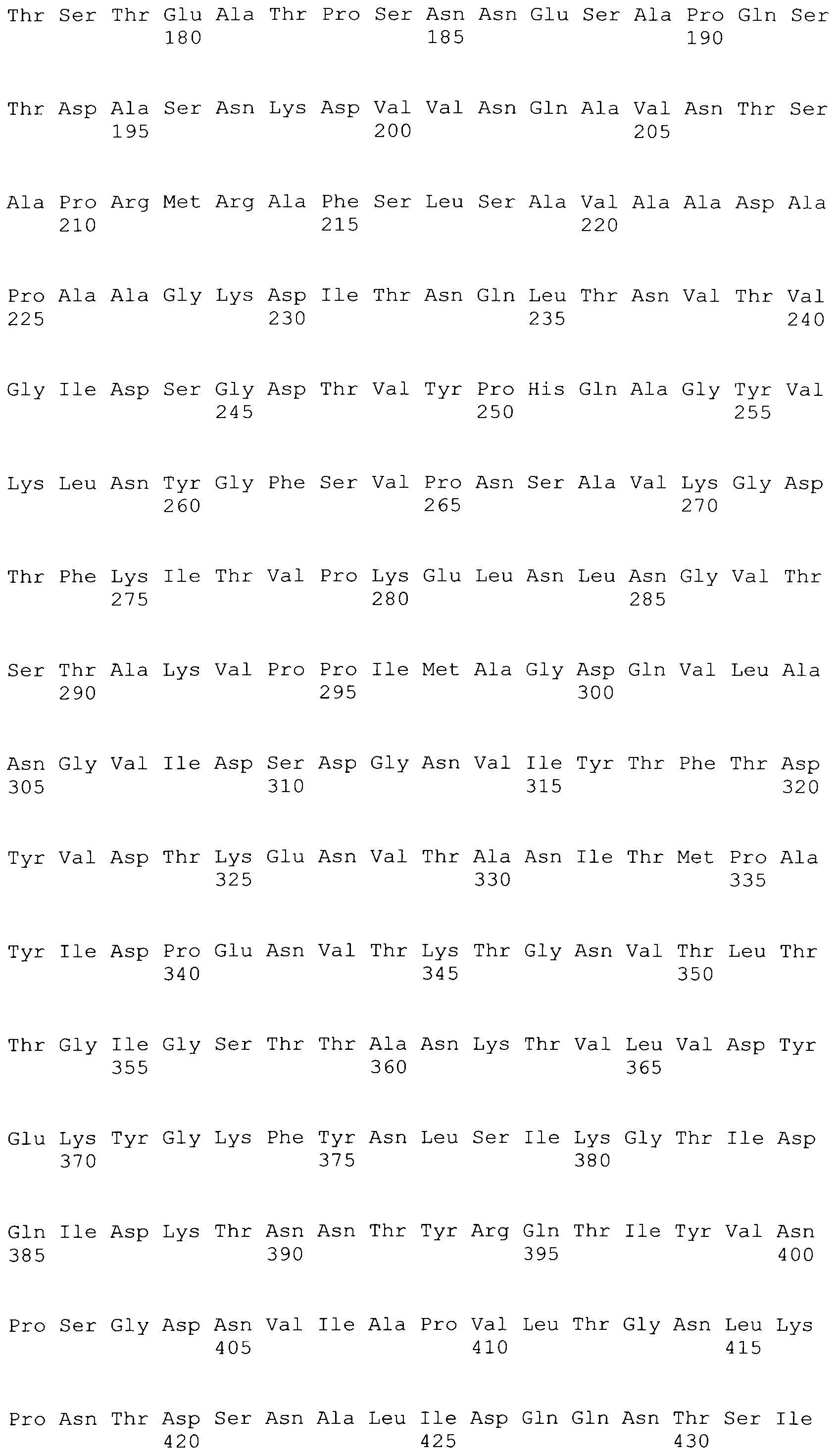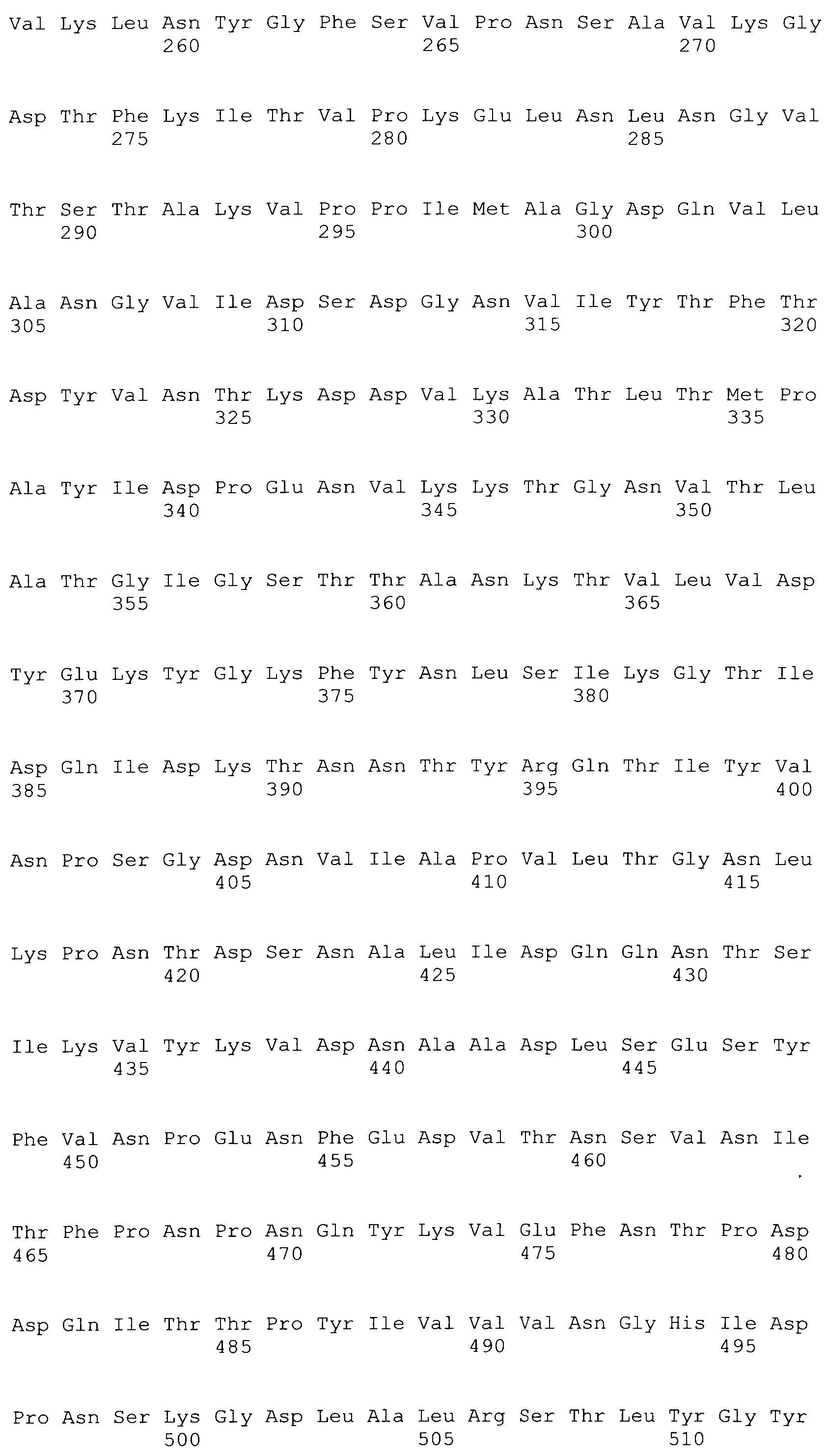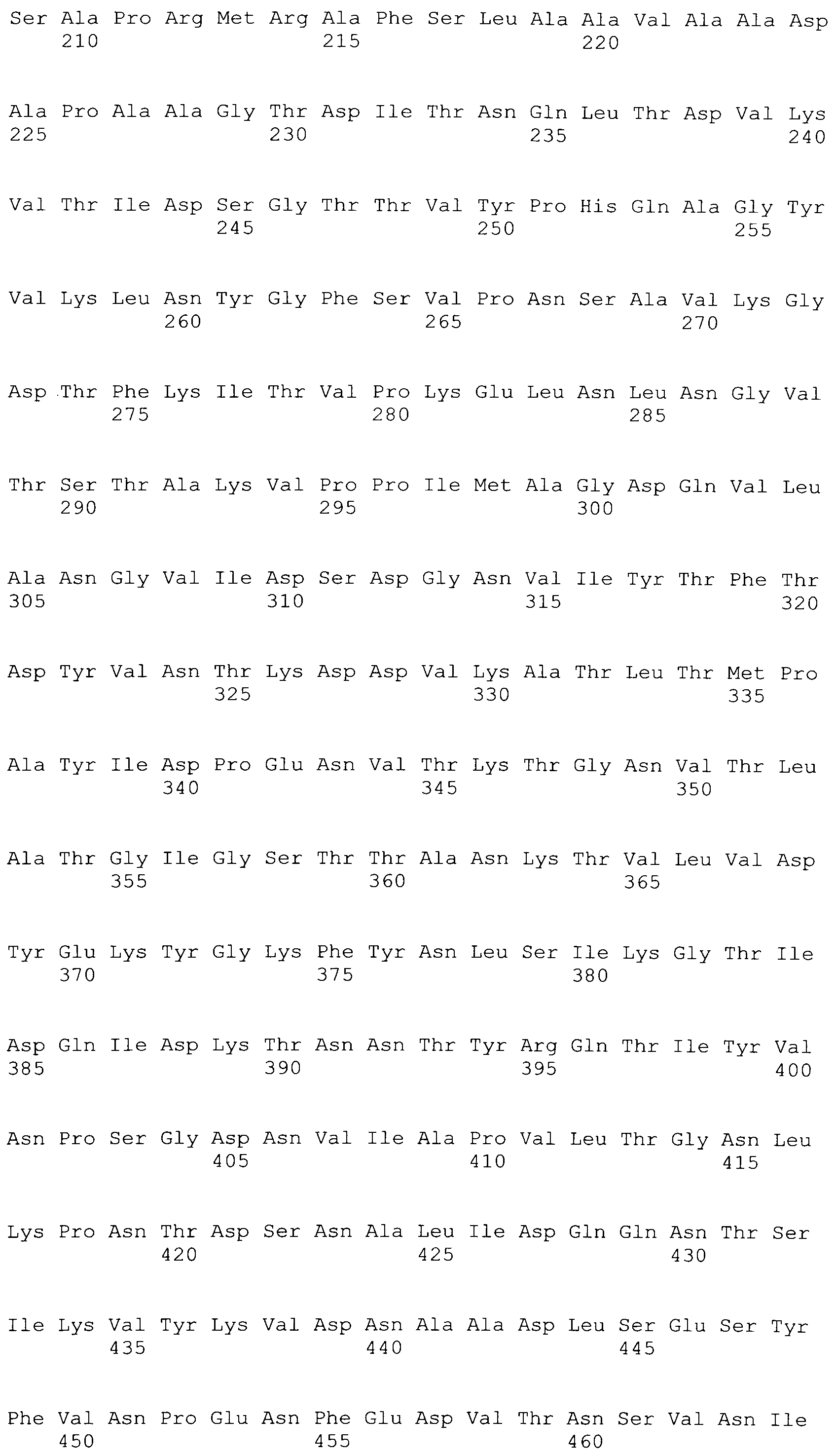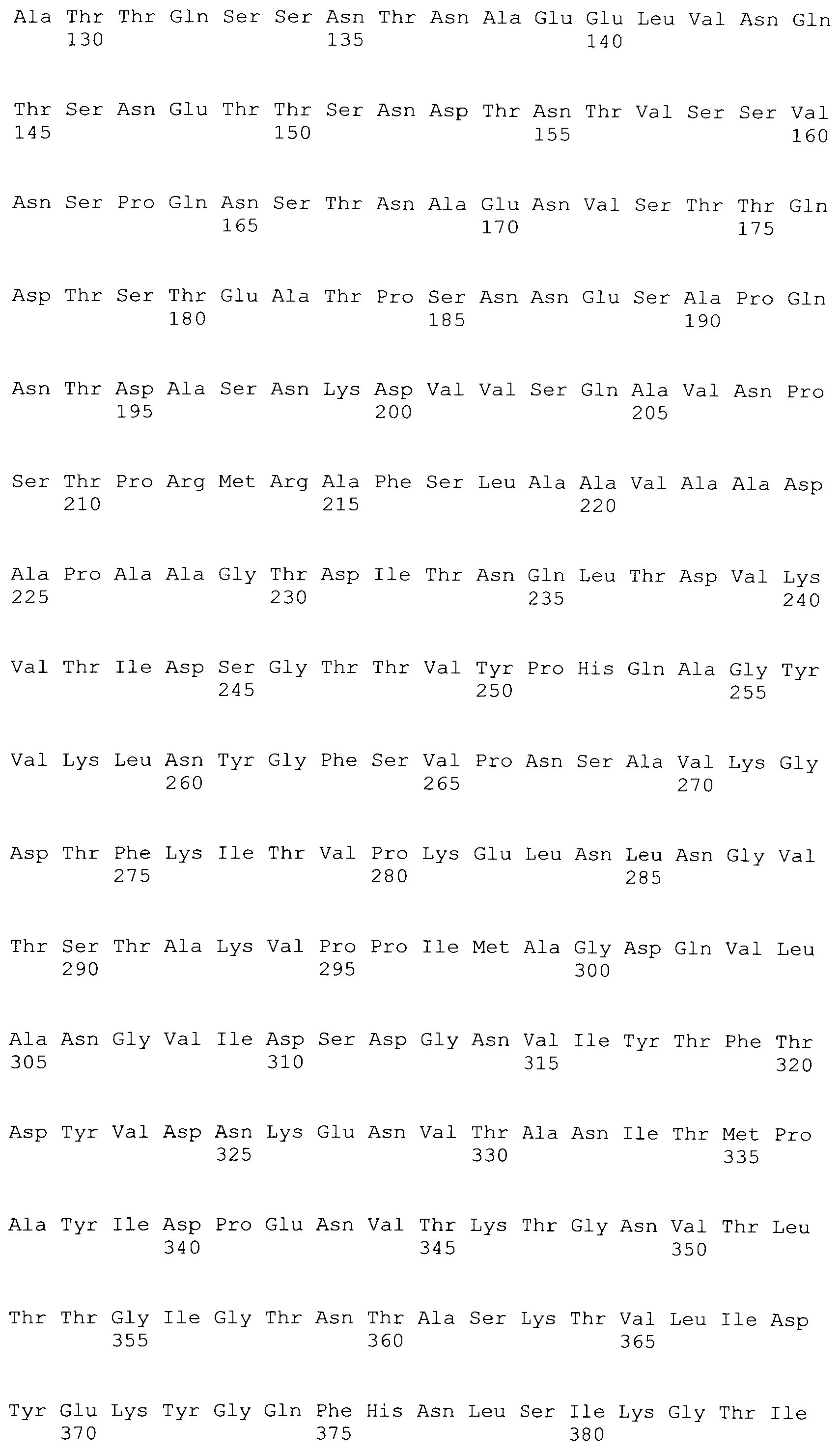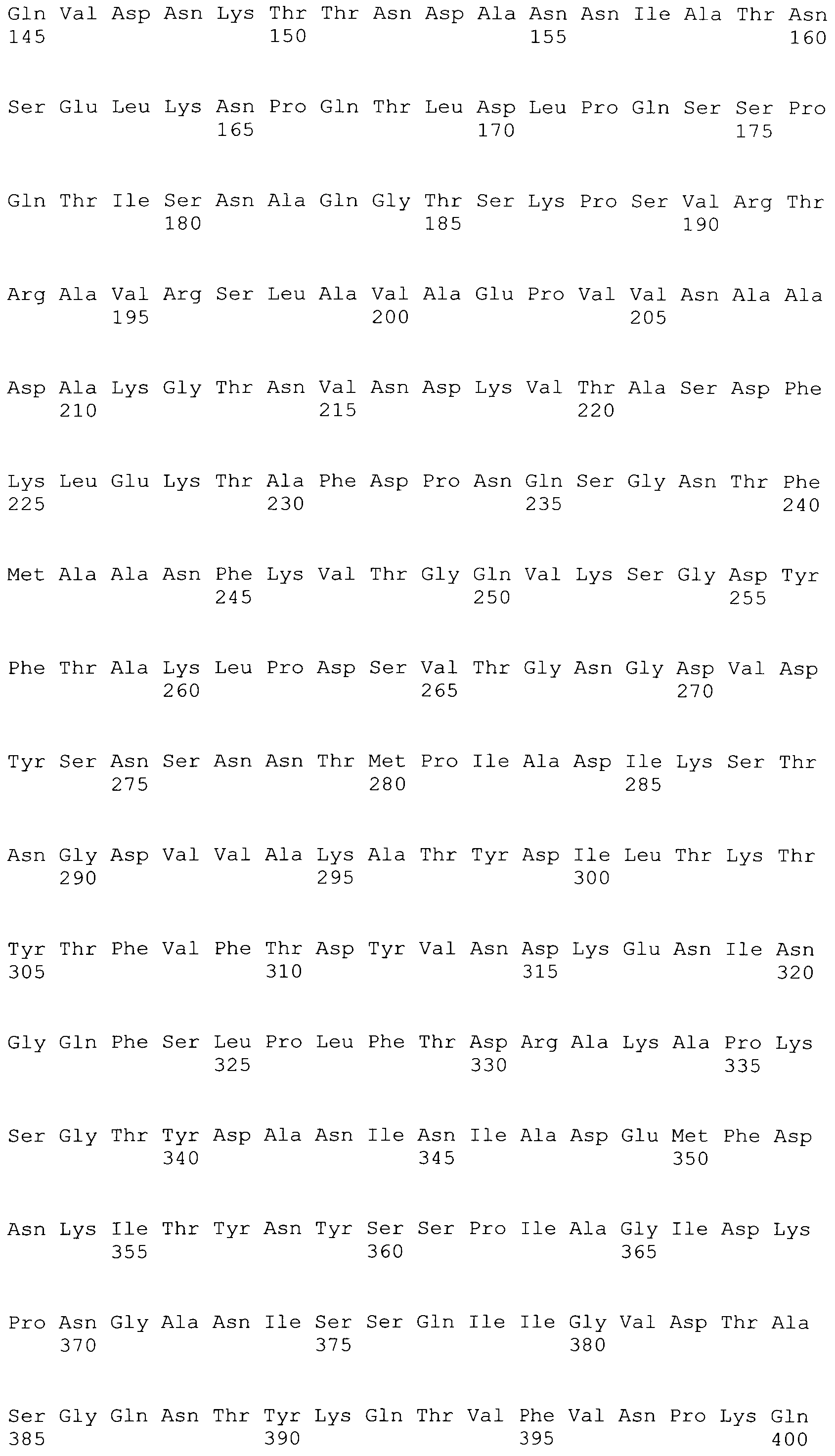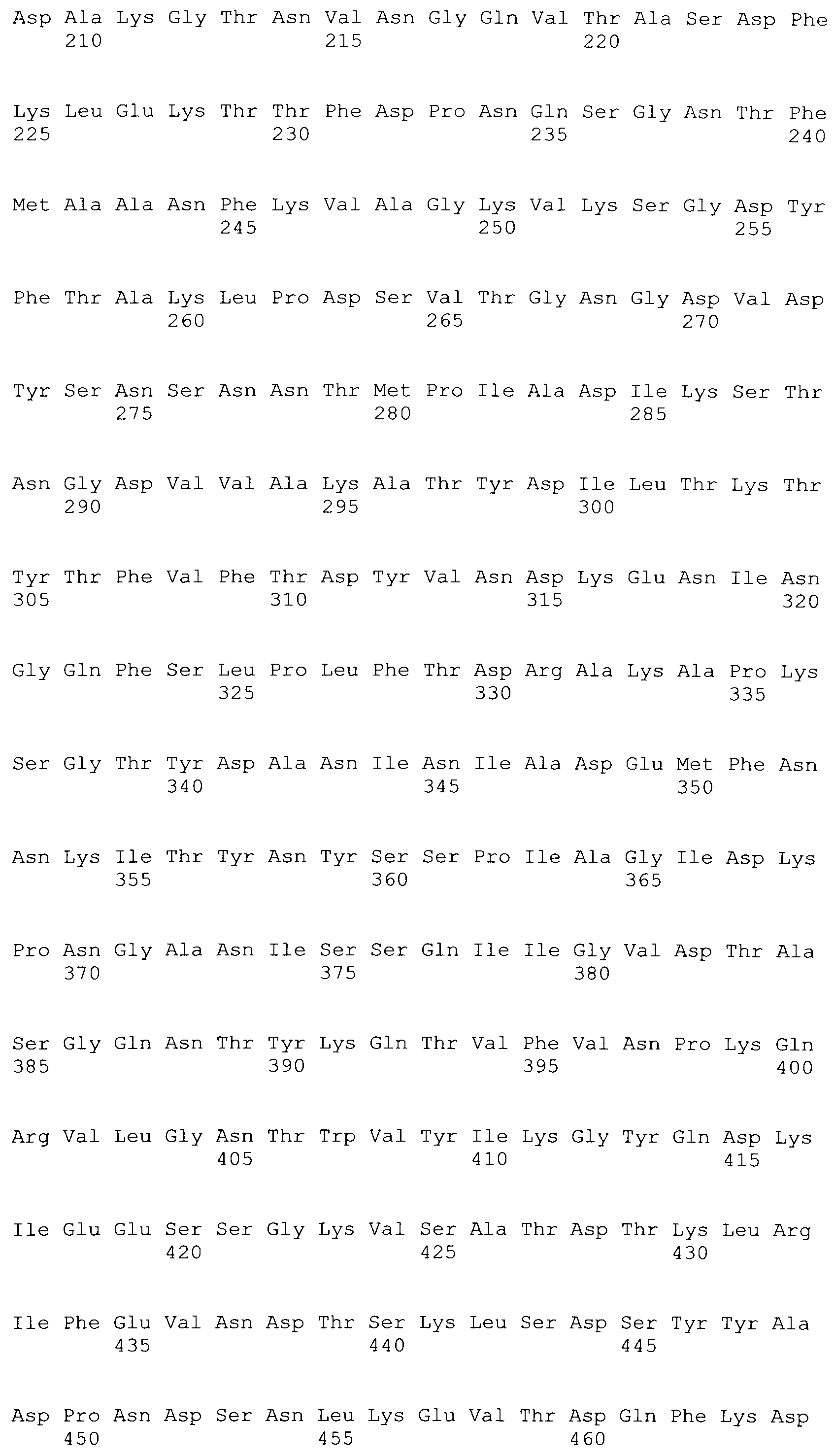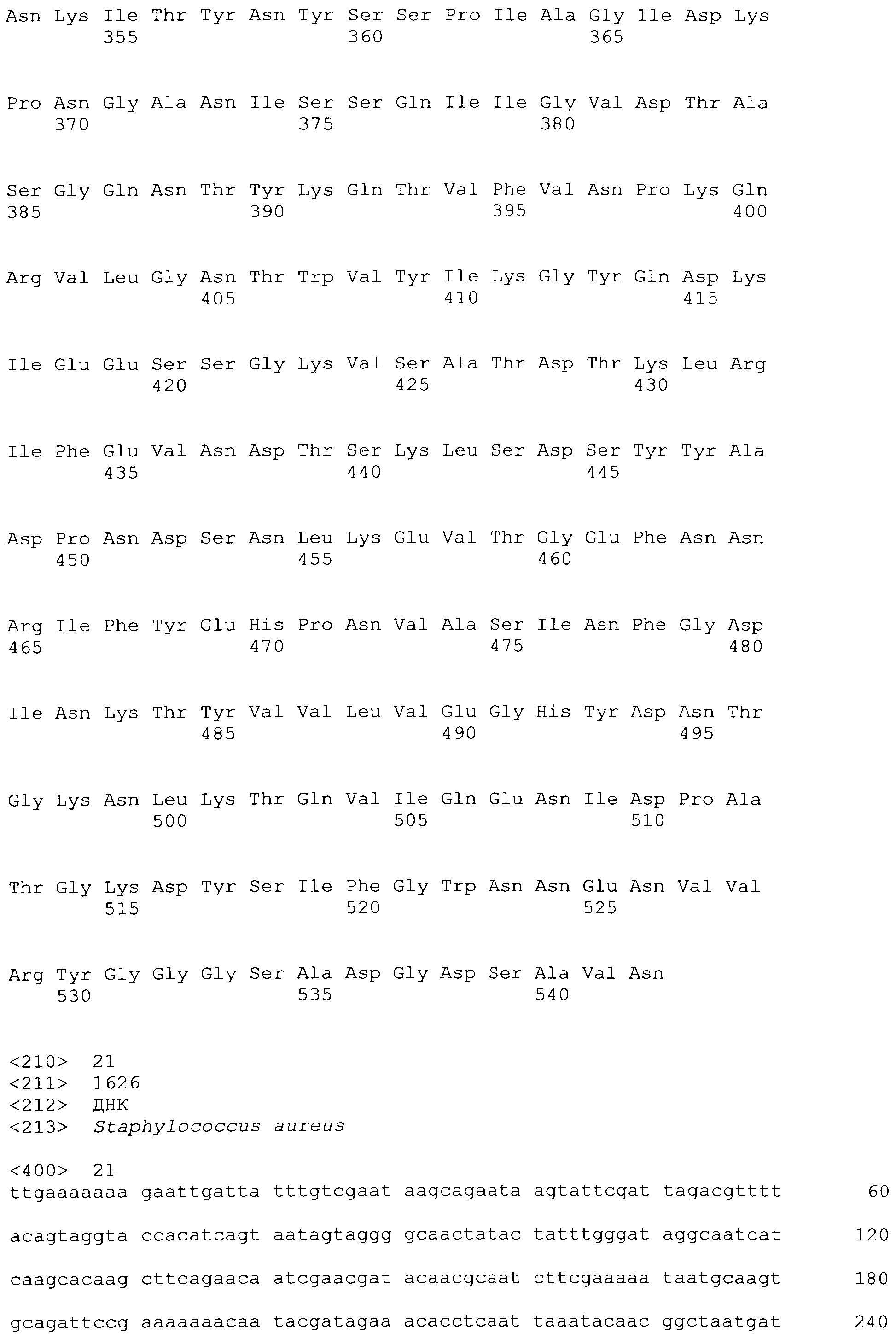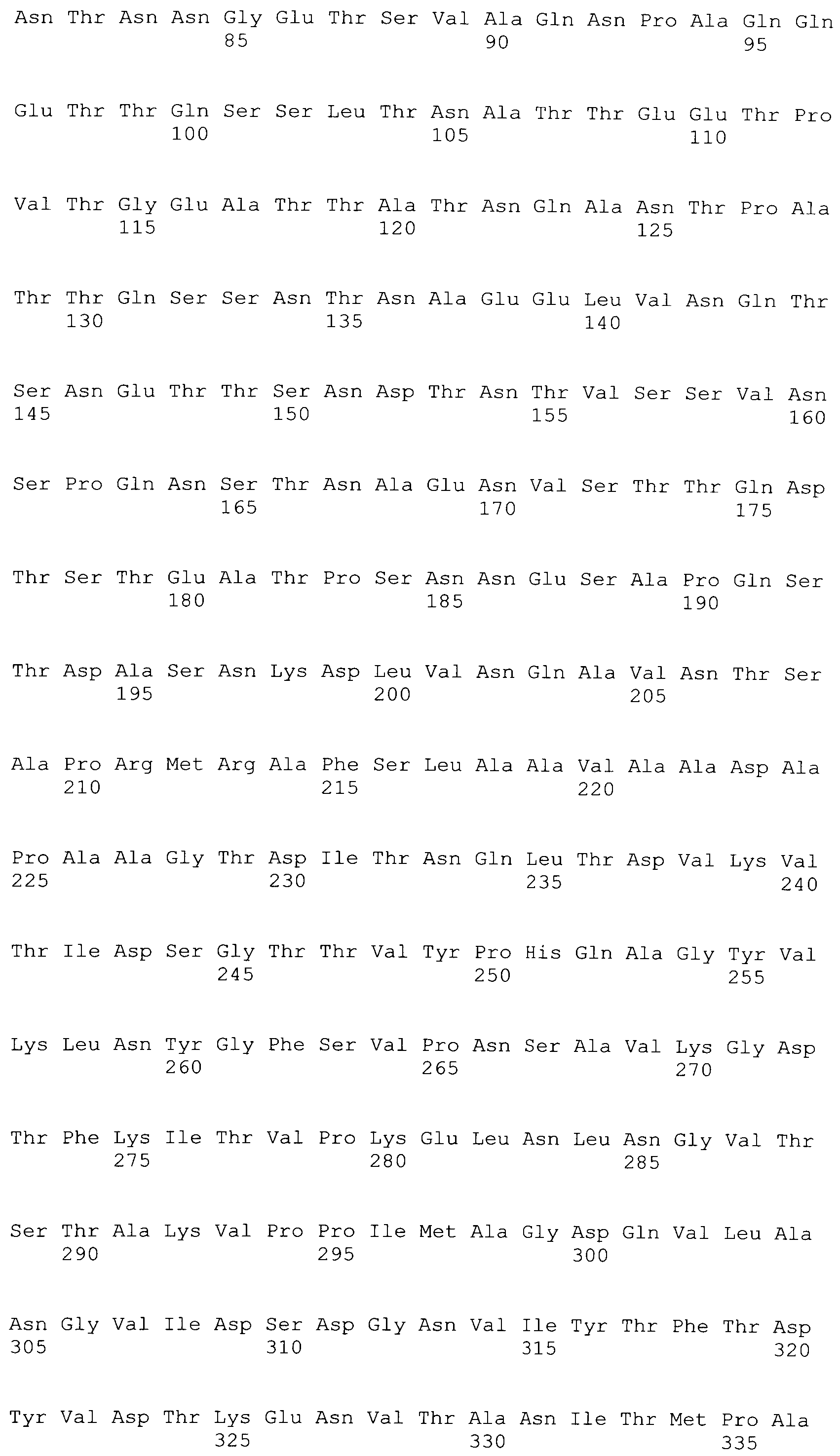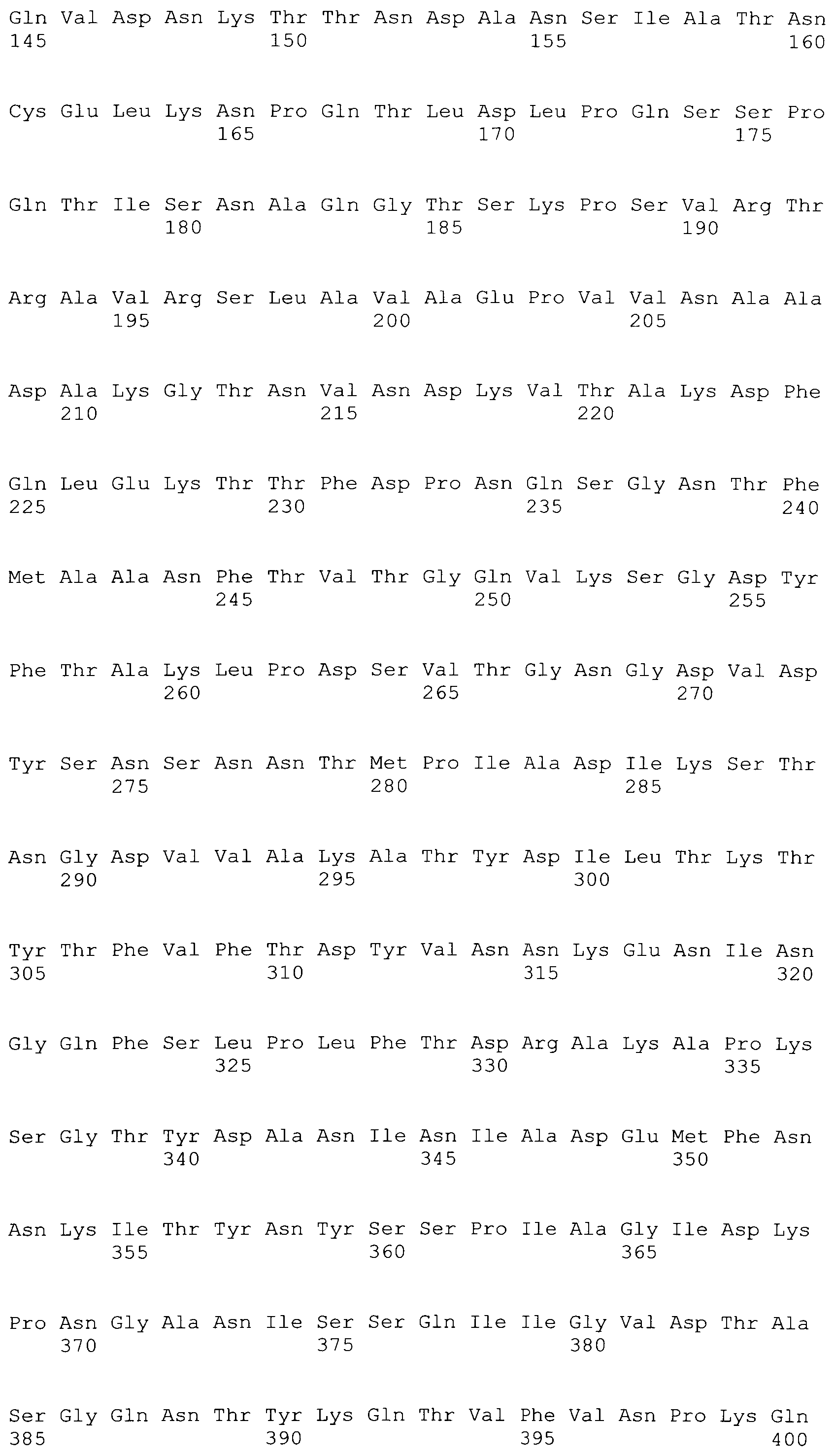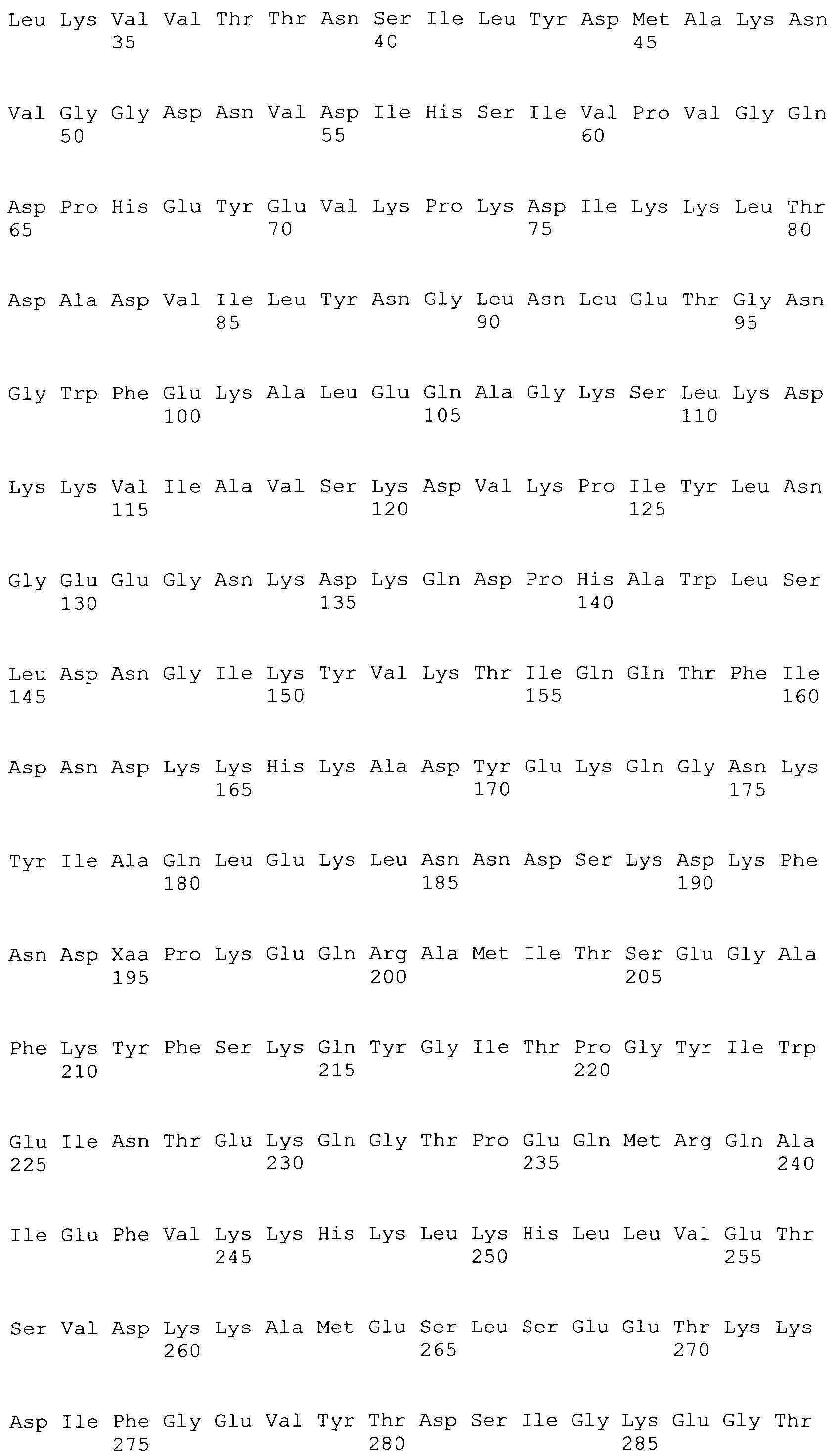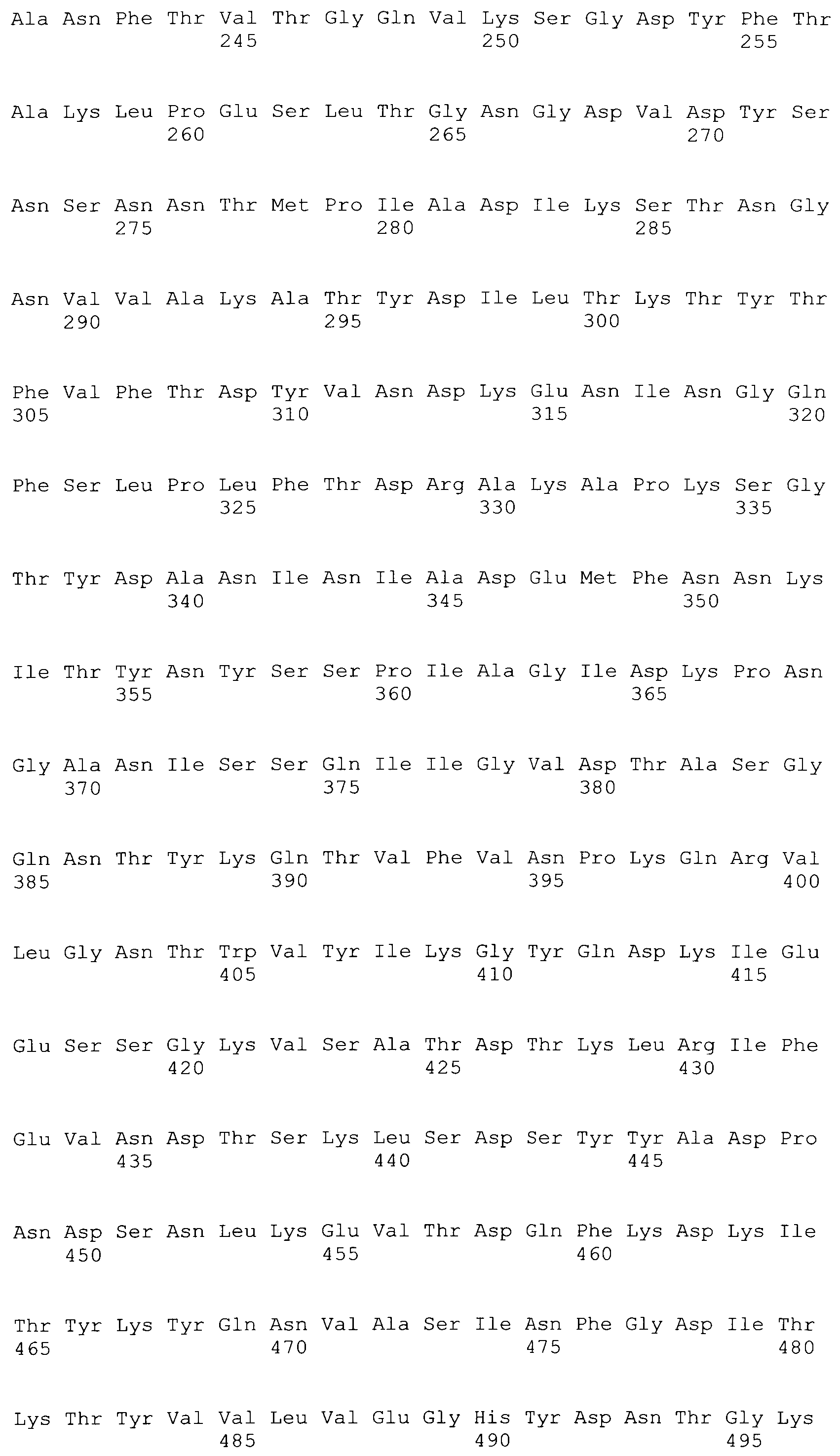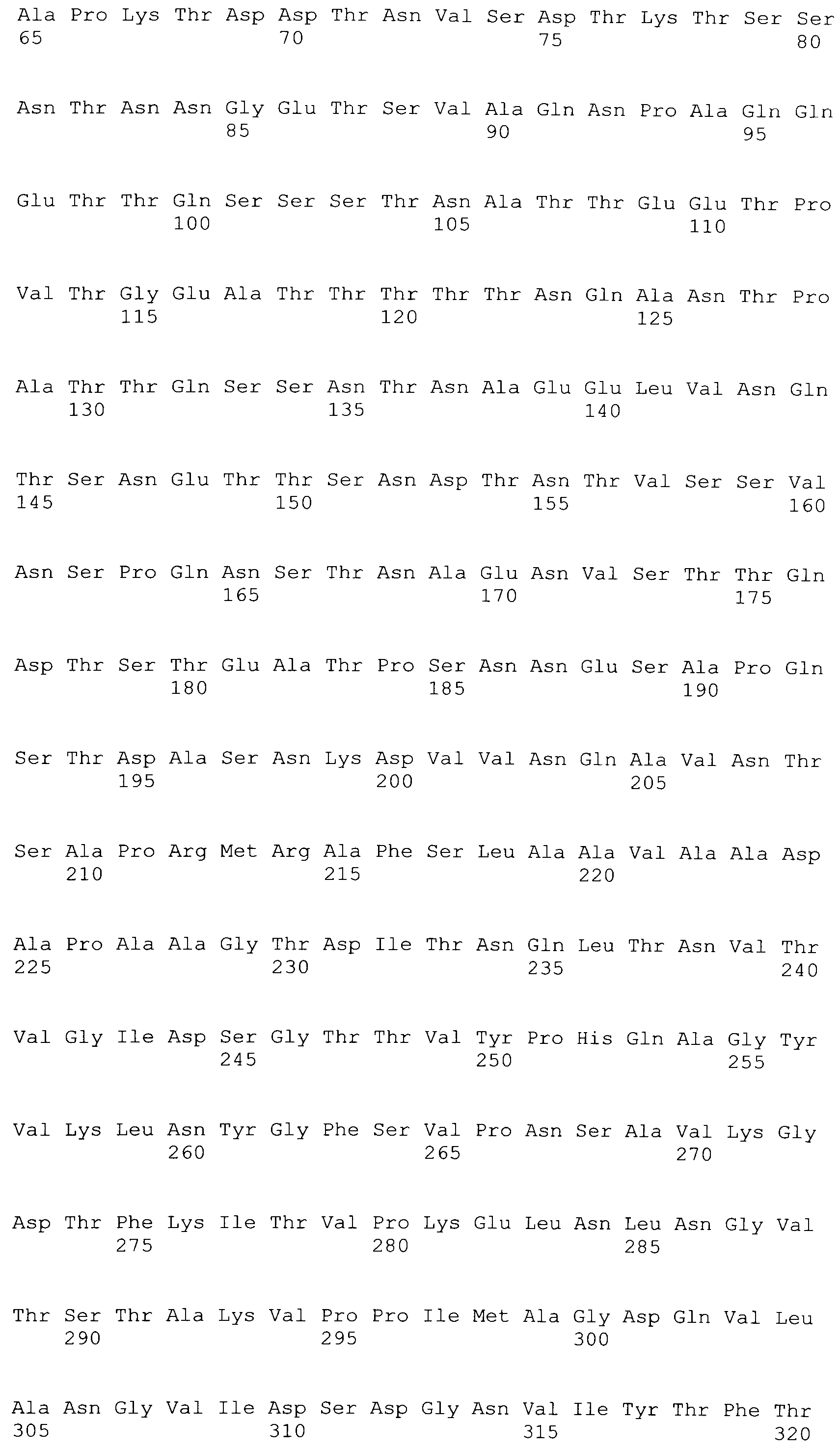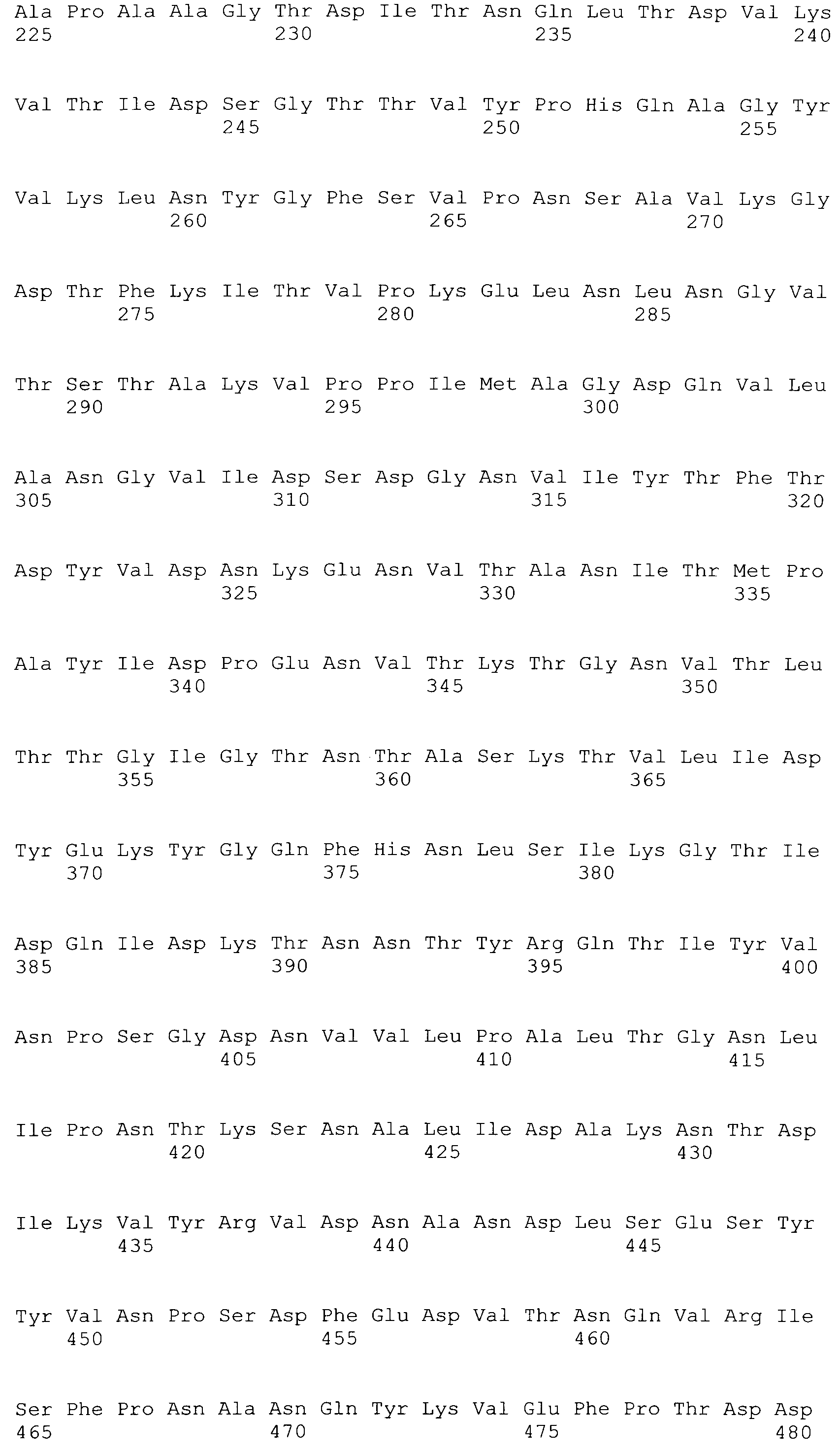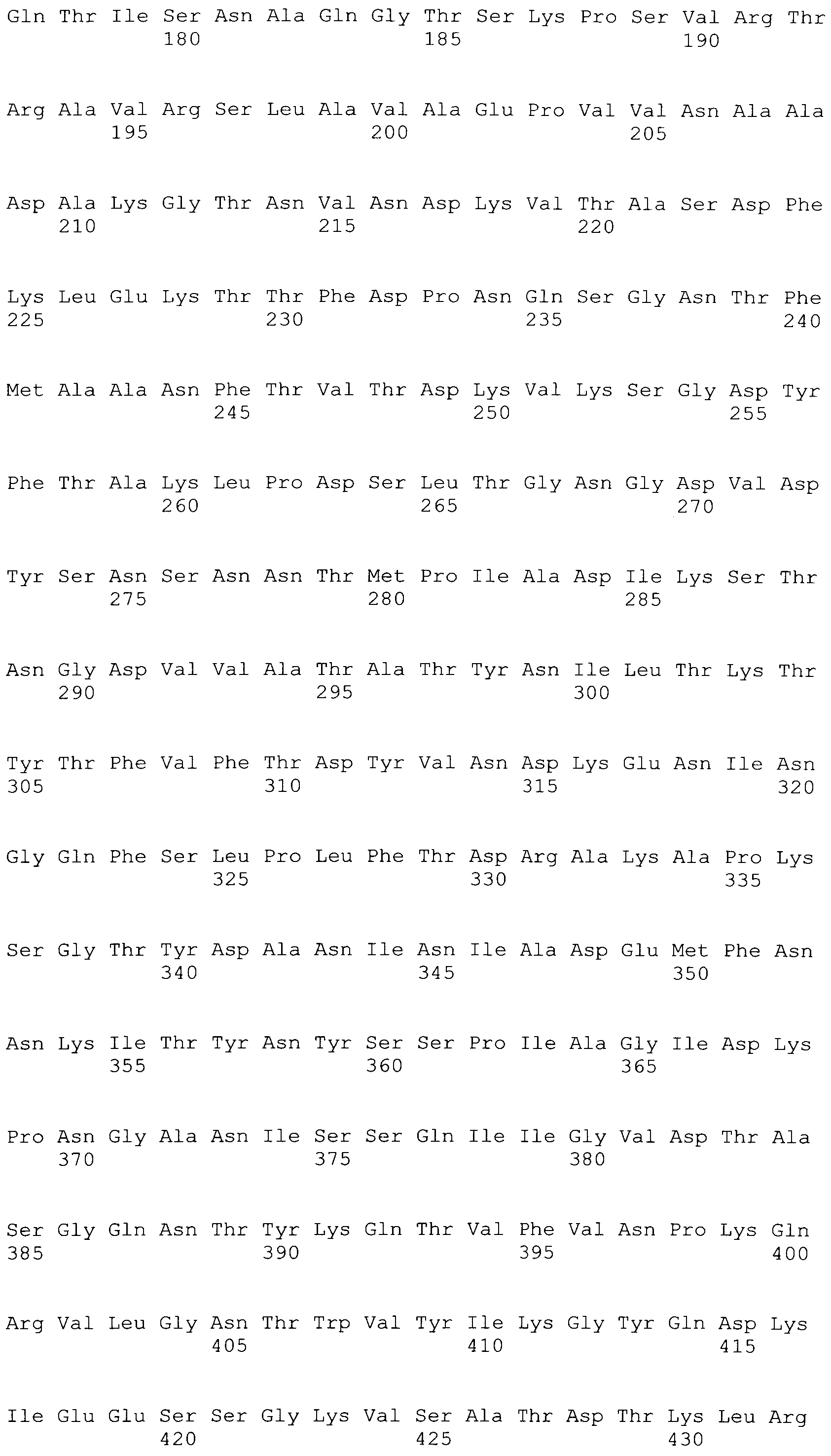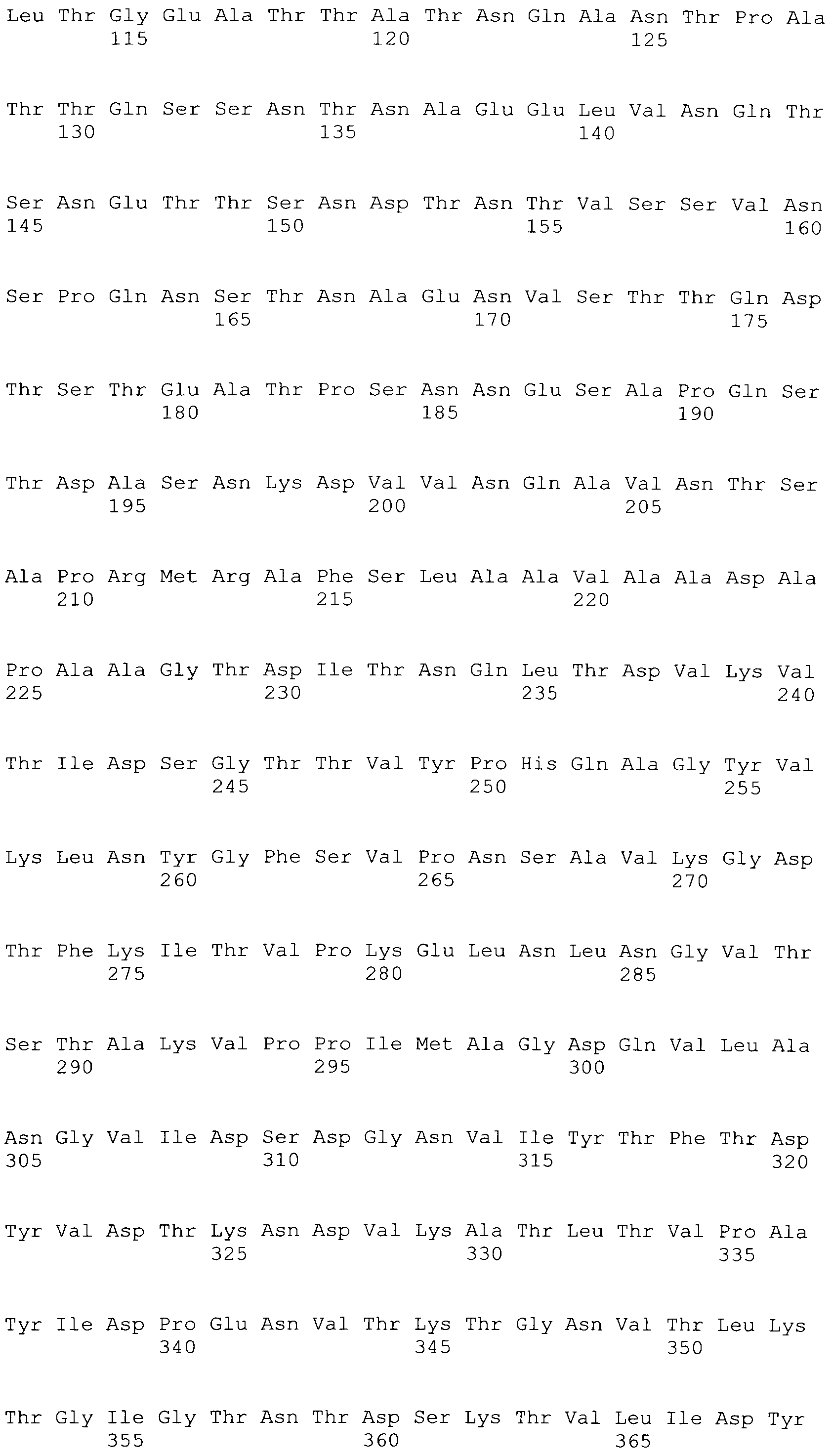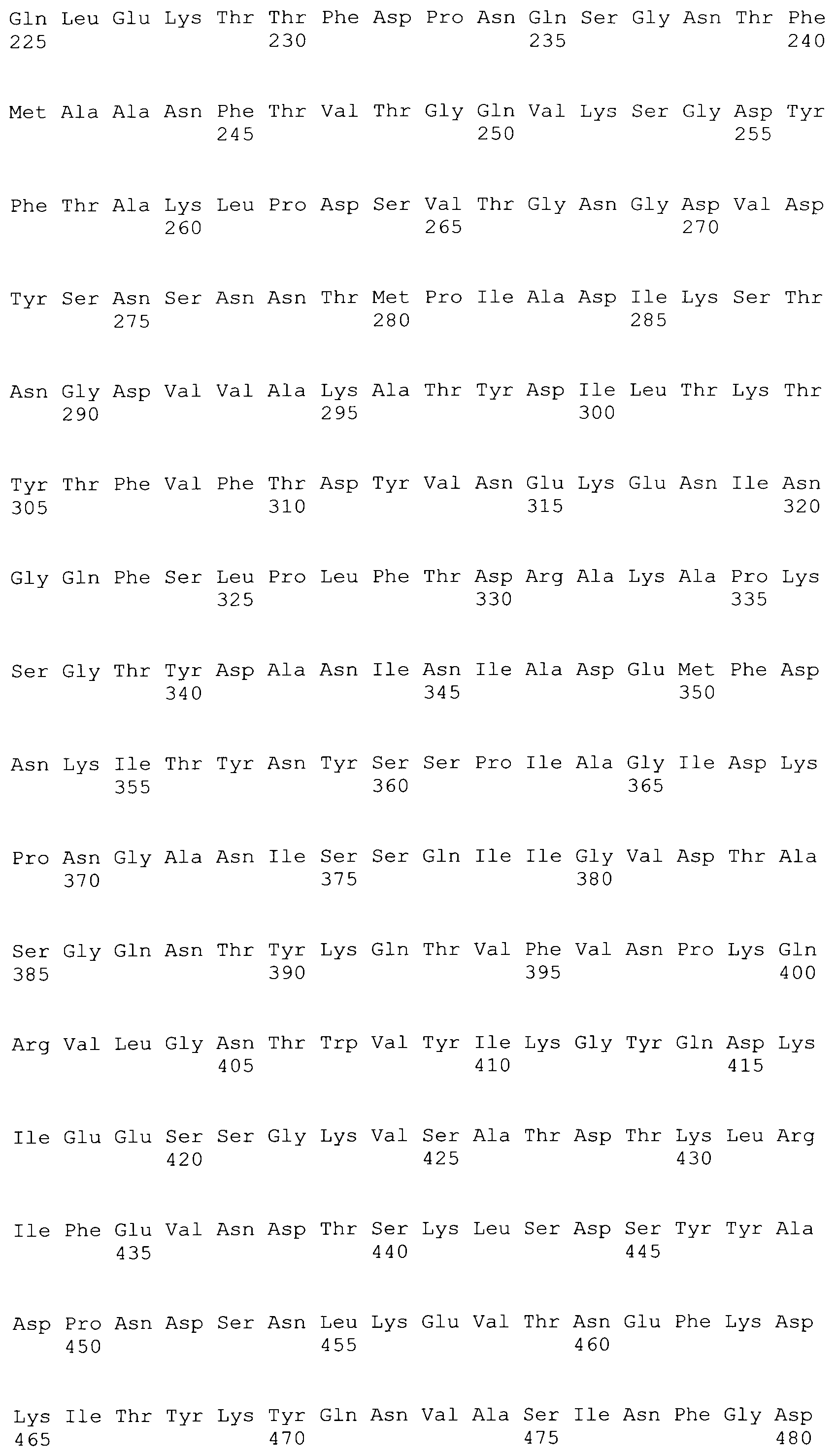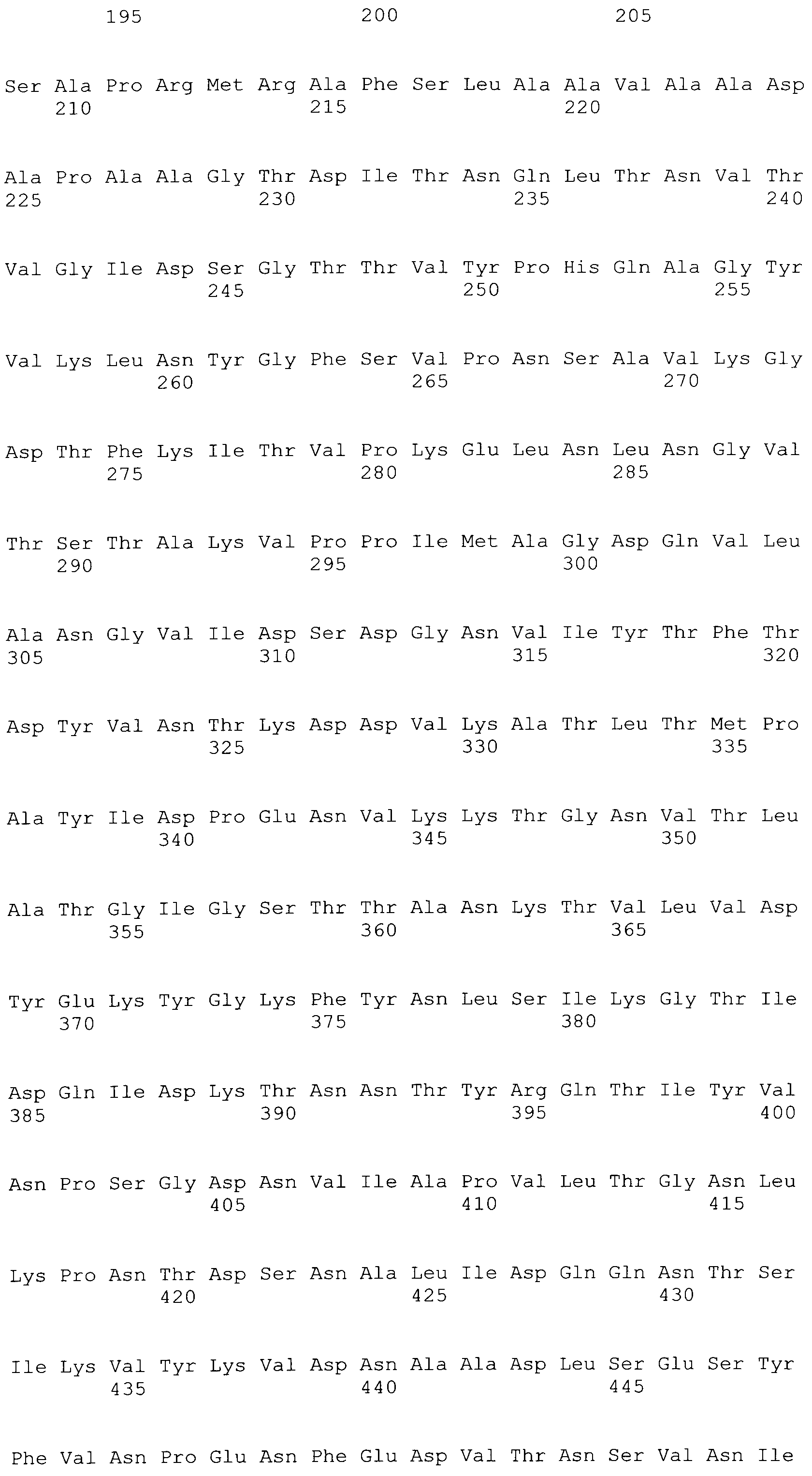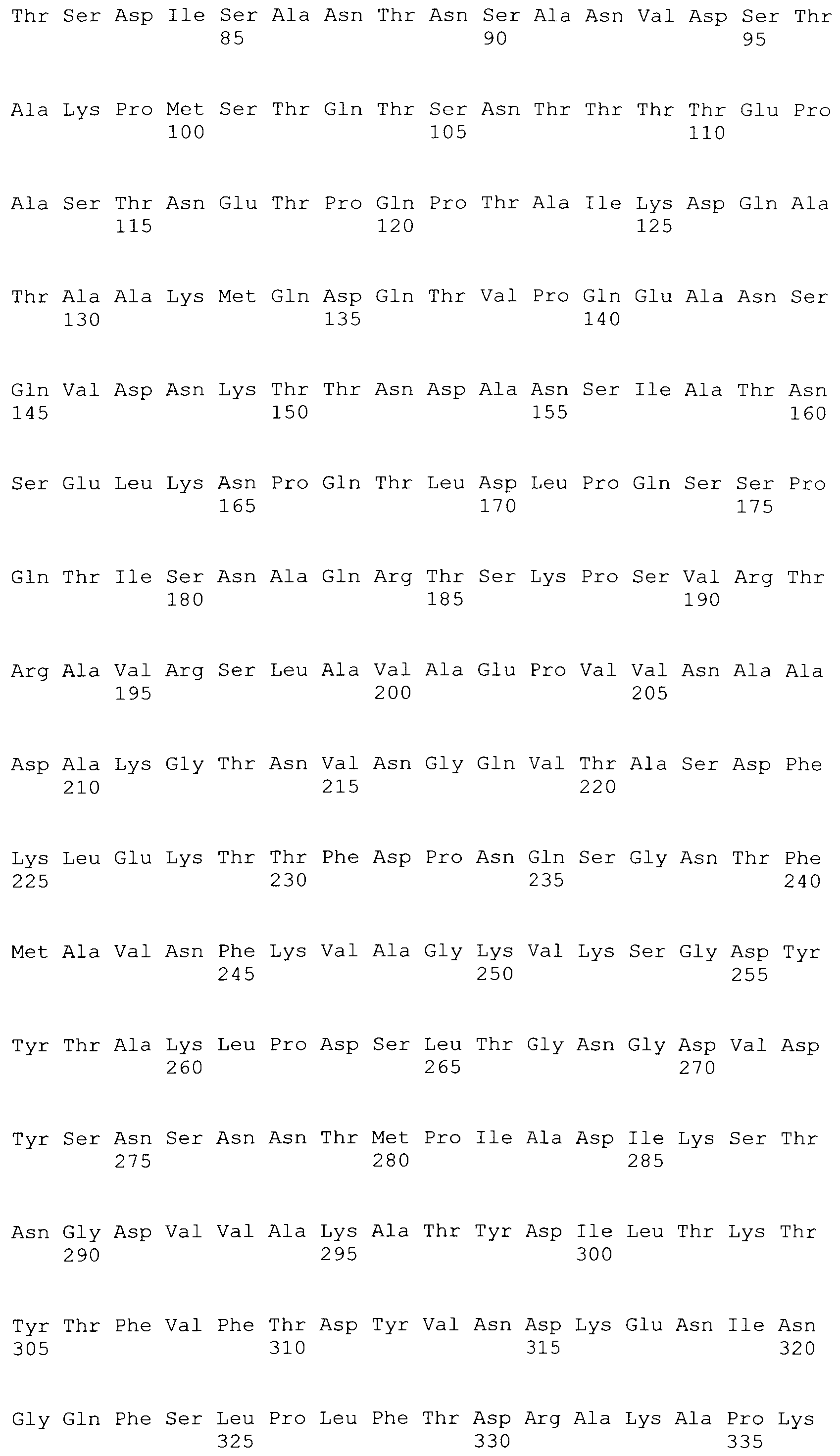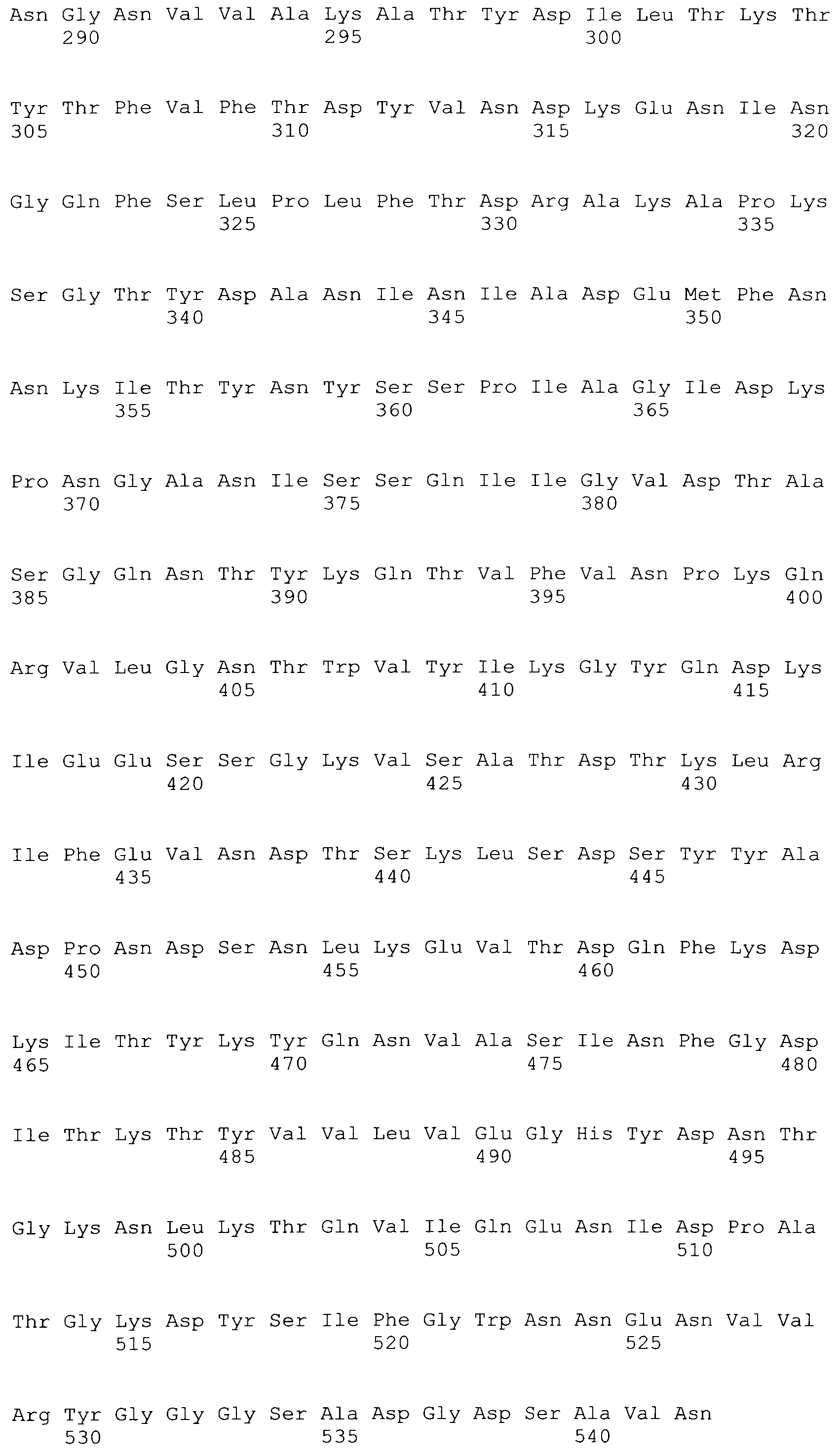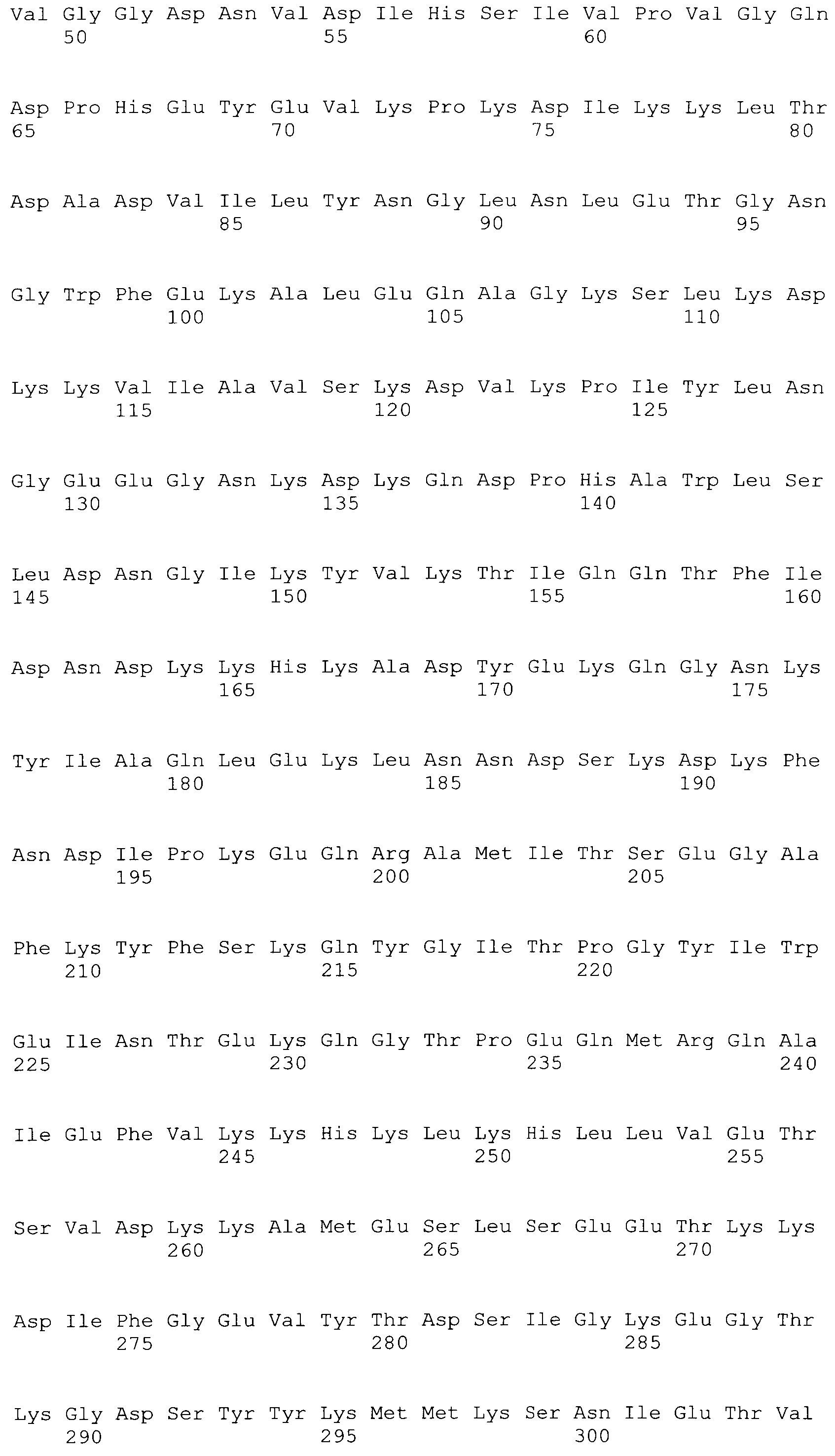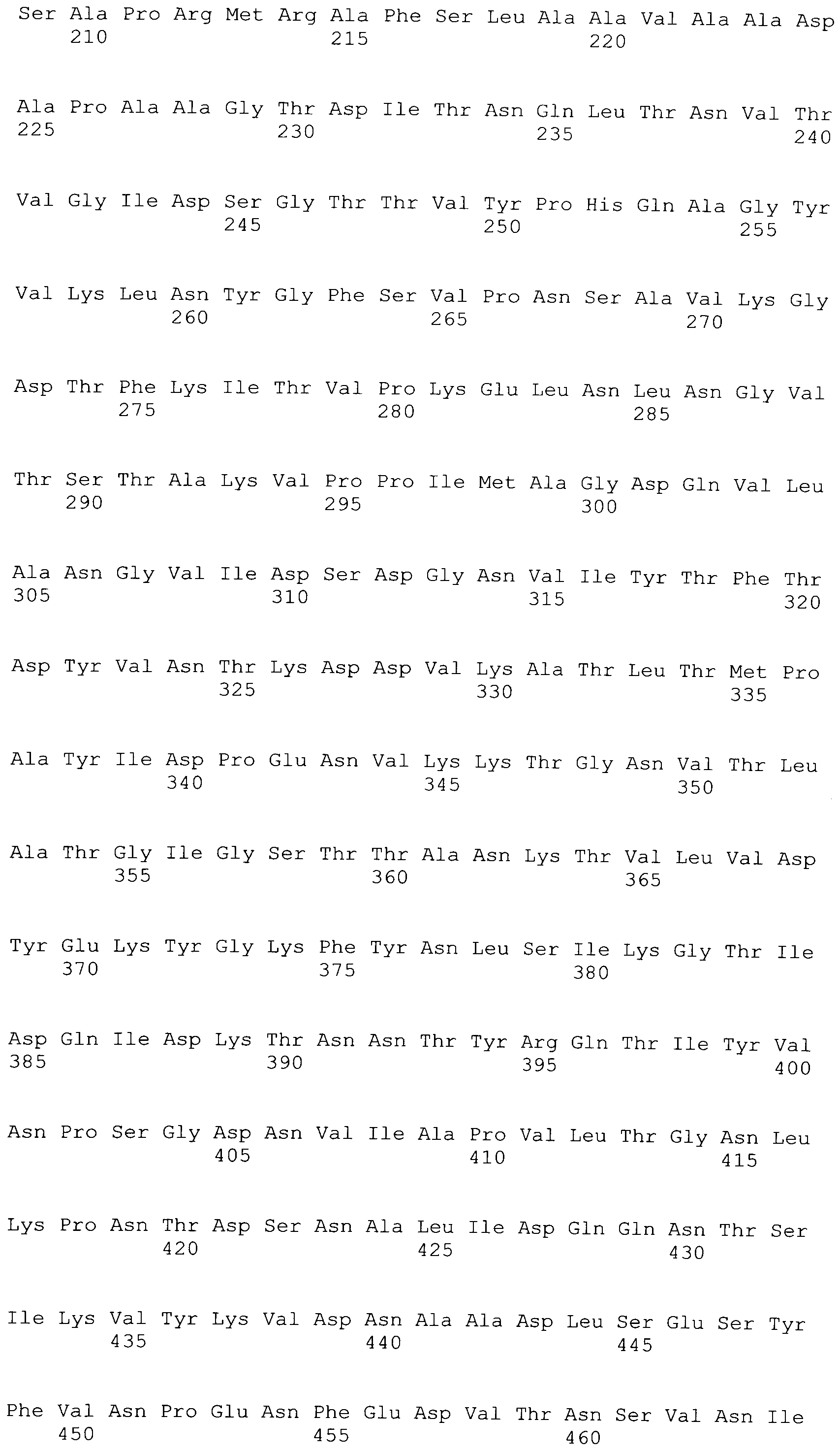Результат интеллектуальной деятельности: СТАБИЛЬНЫЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ АНТИГЕНОВ STAPHYLOCOCCUS AUREUS
Вид РИД
Изобретение
Предпосылки создания изобретения
[0001] Люди являются естественным вместилищем для Staphylococcus aureus (S.aureus) (золотистого стафилококка). Здоровые индивидуумы могут быть заселены S.aureus на коже, в ноздрях и горле или постоянно (10-35%), периодически (20-75%) или находится в состоянии носительства (5-70%) не связанным с заболеванием. Смотри Vandenbergh et al., J. Clin. Micro. 37:3133-3140 (1999). Заболевание проявляется впоследствии, когда у индивидуумов становятся ослабленным иммунитет в результате брешей в иммунном барьере, таких как во время операций, установке постоянно присутствующих катетеров или других устройств, при травме или ранениях. В результате чего инфекция S.aureus может служить причиной широкого спектра заболеваний от слабых кожных инфекций до эндокардита, остеомиелита, бактериемии, сепсиса и других форм заболевания, которые сопровождаются высокими уровнями смертности. Большое вместилище человека увеличивает благоприятную возможность для развития и распространения подходящих патогенных клональных типов.
[0002] Инвазивные стафилококковые инфекции из грамположительных кокков S.aureus и S.epidermidis имеет особо важное значение, потому что они являются возрастающей проблемой общественного здравоохранения во всем мире. В частности, S.aureus является ответственным за большинство внутрибольничных (нозокомиальных) инфекций, и его распространение в сообществе проявление инфекций возрастает. Например, заболеваемость от инвазивного устойчивого к метициллину S.aureus (MRSA) оценивалась в 31,8 на 100000 человек, включая 18 650 смертельных исходов в Соединенных Штатах в 2005 году. Смотри Klevens R.M. et al., JAMA, 298:1763-71 (2007).
[0003] За последние 20 лет наблюдается резкое увеличение стафилококковый заболеваний, такое увеличение соответствует использованию внутрисосудистых устройств и проведению инвазивных процедур. Возрастание частоты заболеваний становится более тревожным из-за параллельного возрастания устойчивости к антибиотикам, и поэтому существует настоятельная необходимость в иммуногенных композициях для использования в вакцинах, или чтобы выявлять поликлональные или моноклональные антитела для предоставления пассивного иммунитета как средства для предотвращения или лечения стафилококковой инфекции и связанной с ней заболеваниями.
[0004] Агглютинирующий фактор A (ClfA) представляет собой клеточную стенку S.Aureus, связанную с адгезином, который является посредником стафилококкового связывания с фибриногеном и тромбоцитами. Он экспрессирует на поверхности клетки бактерии, где предполагается, что активизируется патогенез путем связывания с фибриногеном и фибрином, который депонируется в месте повреждения ткани. ClfA хорошо сохраняется, и даже наиболее отличающаяся форма (~85% идентичности) демонстрирует экстенсивную перекрестную реактивность как к моноклональным, так и к поликлональным антителам. Таким образом, ClfA является приемлемым кандидатом на компонент вакцины против S.aureus. Однако, принимая во внимание структурную неустойчивость ClfA, формулирование ClfA является проблематичным, поскольку он может легко разлагаться с течением времени при хранении.
[0005] Полноразмерный ClfA включает несколько участков и доменов: N-терминальный секреторный домен ("S" домен); следующий за ним лигандсвязывающий участок A, который содержит три домена (N1, N2, который содержит мотив спираль-петля-спираль (EF-плечо), и N3); следующий за ним R участок, который содержит серин-аспартат дипептидные повторения; следующий за ним участок связывания с клеточной стенкой ("W" участок), содержащий LPXTG мотив; гидрофобный трансмембранный домен ("M" участок); и заряженный C-конец ("C" участок), содержащий положительно заряженные аминокислоты. Участок N1 содержит сайт чувствительный к протеазе. Значительную часть нестабильности ClfA приписывают клиппированию ClfA на N1, которое в результате приводит к фрагментам, содержащим N1 и N2N3. Структура и функции ClfA раскрыты в заявке на патент США No. 20070087014 A1 (Pavliak et al., April 19, 2007), которая включена в настоящий документ в качестве ссылки в полном объеме.
[0006] Стафилококковые микроорганизмы, способные вызвать инвазивное заболевание, как правило, также способны к продуцированию капсульного полисахарида (CP), который инкапсулирует бактерию и повышает его устойчивость по отношению к клиренсу за счет врожденной иммунной системы хозяина. CP служит для покрытия бактериальной клетки защитной капсулой, которая делает бактерии устойчивыми к фагоцитозу и внутриклеточному уничтожению. Бактерии, испытывающие недостаток в капсуле, являются более чувствительными к фагоцитозу. Капсульные полисахариды часто представляют собой важный фактор вирулентности для многих бактериальных патогенов, включая Haemophilus influenzae, Streptococcus pneumoniae и стрептококки группы B.
[0007] Большинство клинических штаммов S.aureus являются инкапсулированными с или серотипом 5, или 8. Тип 5 (CP5) и тип 8 (СР8) капсульных полисахаридов имеют подобные три-сахаридные повторяющиеся единицы, состоящие из N-ацетилманнозаминуроновой кислоты, N-ацетил-L-фукозамина и N-ацетил-D-фукозамина. Смотри Fournier, J.M. et al., Infect. Immun. 45:97-93 (1984) и Moreau, M., et al., Carbohydrate Res. 201:285-297 (1990). Два CP, которые имеют одинаковые сахара, но различаются в связях сахаров и по сайтам O-ацетилирования, каждый продуцирует серологически индивидуальные модели иммунореактивности.
[0008] Белок S.aureus MntC (также известный как белок 305, Р305, Р305А и ORF305) является компонентом ABC переносчиком марганца. Данный белок экспрессируется in vivo. S.aureus использует марганец как кофактор для фермента, который повышает выживаемость S.aureus в нейтрофилах. MntC, таким образом, является важным для выживания S.aureus in vivo во время инфекции. Подобно ClfA, данный белок также нестабильный в растворе. Однако, в отличие от ClfA, который может агрегировать или сокращаться за счет гидролиза, первичный механизм деградации MntC представляет собой дезамидирование под воздействием щелочного pH и/или температуры близкой к комнатной температуре (около 25°C) или выше.
[0009] Таким образом, существует острая необходимость не только в вакцинах против инфекции S.aureus, но, в частности, в вакцинах с повышенной стабильностью антигена.
Краткое описание сущности изобретения
[0010] Представленное изобретение касается лиофилизированной или восстановленной мульти-антигенной или многокомпонентной иммуногенной композиции, содержащей, по меньшей мере, один антиген, выделенный из стафилококковой бактерии. Антигены, которые являются полипептидами и полисахаридами, могут быть получены, среди прочего прямо из бактерии, используя процедуры выделения, известные квалифицированному специалисту в данной области с уровня техники, или они могут быть получены, используя синтетические протоколы, или они могут быть рекомбинантно получены, используя генетические инжиниринговые процедуры также известные квалифицированному специалисту в данной области с уровня техники, или посредством комбинирования каких-либо из вышеизложенных. В конкретных вариантах осуществления, лиофилизированная или восстановленная иммуногенная композиция изобретения содержит выделенный агглютинирующий фактор A (ClfA) S.aureus. В конкретных вариантах осуществления, лиофилизированная или восстановленная иммуногенная композиция изобретения содержит три или более антигенов, выбранных из выделенного полипептида агглютинирующего фактора A (ClfA) S.aureus, выделенного полипептида агглютинирующего фактора B (ClfB) S.aureus, выделенного капсульного полисахарида типа 5 (CP5) S.Aureus, конъюгированного с белком-носителем, выделенного капсульного полисахарида типа 8 (СР8) S.Aureus, конъюгированного с белком-носителем, и выделенного MntC белка S.aureus. Кроме того, представленное изобретение предусматривает способы индуцирования иммунного ответа против стафилококковой бактерии; способы предупреждения, уменьшение тяжести, или замедления проявления заболевания, вызванного стафилококковой бактерией.
[0011] Соответственно, в одном варианте осуществления, изобретение предусматривает лиофилизированную или восстановленную иммуногенную композицию, содержащую: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный капсульный полисахарид типа 5 (СР5) S.Aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S.Aureus, конъюгированный с белком-носителем.
[0012] В одном варианте осуществления, изобретение предусматривает лиофилизированную или восстановленную иммуногенную композицию, содержащую: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный капсульный полисахарид типа 5 (СР5) S.aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S.aureus, конъюгированный с белком-носителем.
[0013] В одном варианте осуществления, изобретение предусматривает лиофилизированную или восстановленную иммуногенную композицию, содержащую: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный MntC белок S.aureus, выделенный капсульный полисахарид типа 5 (СР5) S.aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S.aureus, конъюгированный с белком-носителем.
[0014] В одном варианте осуществления, изобретение предусматривает лиофилизированную или восстановленную иммуногенную композицию, содержащую: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный MntC белок S.aureus, выделенный капсульный полисахарид типа 5 (СР5) S.aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S.aureus, конъюгированный с белком-носителем.
[0015] В одном варианте осуществления, изобретение предусматривает лиофилизированную или восстановленную иммуногенную композицию, содержащую: выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный капсульный полисахарид типа 5 (СР5) S.aureus, конъюгированный с белком-носителем, и выделенный капсульный полисахарид типа 8 (СР8) S.aureus, конъюгированный с белком-носителем.
[0016] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (а) по меньшей мере, три компонента, выбранные из группы, состоящей из выделенного полипептида агглютинирующего фактора A ("ClfA") золотистого стафилококка, выделенного полипептида агглютинирующего фактора B ("ClfB") золотистого стафилококка, капсульного полисахарида типа 5 (СР5), конъюгированного с белком, капсульного полисахарида типа 8 (СР8), конъюгированного с белком, и выделенного MntC полипептида золотистого стафилококка; (b) буфера, имеющего рКа равный 6,0±0,6, и (c) объемообразующего агента. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившимся в течение, по меньшей мере, 1 месяца при 37°C.
[0017] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (а) выделенный полипептид агглютинирующего фактора A ("ClfA") золотистого стафилококка, (b) капсульный полисахарид типа 5 (СР5), конъюгированный с белком, (c) капсульный полисахарид типа 8 (СР8), конъюгированный с белком, (d) буфер, имеющий рКа равный 6,0±0,6, и (e) объемообразующий агент. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившимся в течение, по меньшей мере, 1 месяца при 37°C.
[0018] В одном варианте осуществления, лиофилизированная иммуногенная композиция содержит воду меньше, чем 3 процента по массе от общей массы иммуногенной композиции (% масс./масс.), где ClfA полипептид составляет от 0,09%±0,027% до 0,85%±0,26% масс./масс., СР5, конъюгированный с белком, составляет от 0,04%±0,013% до 0,42±0,13% масс/масс, СР8, конъюгированный с белком, составляет от 0,04%±0,013% до 0,42±0,13% масс./масс., и буфер составляет от 2,54%±0,76% масс./масс.
[0019] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (a) ClfA полипептид; (b) СР5, конъюгированный с белком; (c) СР8, конъюгированный с белком; (d) гистидиновый буфер, pH 6,0±0,5; (е) сахарозу; (f) полисорбат 80; и (g) воду. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившимся в течение, по меньшей мере, 3 месяцев при 37°C.
[0020] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (a) ClfA полипептид от 0,09%±0,027% до 0,85%±0,26% масс./масс.; (b) СР5, конъюгированный с белком, от 0,04%±0,013% до 0,42±0,13% масс./масс.; (c) СР8, конъюгированный с белком, от 0,04%±0,013% до 0,42±0,13% масс./масс.; (d) гистидиновый буфер, pH 6,0±0,5-2,54%±0,76% масс./масс.; (e) сахарозу - 97%±2,0% масс./масс.; (f) полисорбат 80 - 0,21%±0,04% масс./масс.; и (g) воду - 2%±1% масс./масс.
[0021] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную три-антигенную композицию, изготовляемую путем восстановления лиофилизированной иммуногенной композиции изобретения в водном разбавителе, причем указанная восстановленная композиция имеет конечное значение pH 6,0±0,5.
[0022] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, изготовляемую путем восстановления лиофилизированной иммуногенной композиции изобретения, содержащую: (a) ClfA полипептид с концентрацией от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (b) СР5, конъюгированный с белком, с концентрацией от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (c) СР8, конъюгированный с белком, с концентрацией от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (d) гистидиновый буфер с концентрацией от 10 мМ ± 5 мМ; (e) полисорбат 80 с концентрацией от 0,1%±0,05% по массе к объему (масс./об.); и (f) сахарозу с концентрацией от 9%±4,5% масс./об. В другом варианте осуществления, концентрация полисорбата 80 составляет 0,01%±0,005% по массе к объему (масс./об.) и концентрация сахарозы составляет 4,5%±±1,5% масс/об.
[0023] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, содержащую: (a) восстановленный лиофилизированный ClfA полипептид; (b) СР5, конъюгированный с белком; (c) СР8, конъюгированный с белком; (d) гистидиновый буфер, pH 6,0±0,5; (e) полисорбат 80; (f) сахарозу; и (g) водный разбавитель.
[0024] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, изготовляемую путем восстановления лиофилизированной иммуногенной композиции изобретения, содержащую: (a) восстановленный лиофилизированный ClfA полипептид с концентрацией от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (b) СР5, конъюгированный с белком, с концентрацией от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (c) СР8, конъюгированный с белком, с концентрацией от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (d) гистидиновый буфер с концентрацией от 10 мМ ± 5 мМ; (e) полисорбат 80 с концентрацией от 0,1%±0,05% по массе к объему (масс./об.); (f) сахарозу с концентрацией от 9%±4.5% масс./об.; и (g) водный разбавитель. В другом варианте осуществления, концентрация полисорбата 80 составляет 0,01%±0,005% по массе к объему (масс./об.), и концентрация сахарозы составляет 4,5%±1,5% масс./об.
[0025] В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, включающий стадии: (a) комбинирования водного раствора, содержащего: (i) ClfA полипептид, (ii) СР5, конъюгированный с белком, (iii) СР8, конъюгированный с белком, (iv) буфер, имеющий рКа 6,0±0,6, и (v) объемообразующий агент; и (b) лиофилизации комбинации со стадии (a) для получения таблетки, содержащей меньше, чем 3 процента воды по массе. В конкретных вариантах осуществления, процесс дополнительно включает комбинирование (vi) поверхностно-активного вещества на стадии (a). В конкретных вариантах осуществления, процесс дополнительно включает стадию стерилизующей фильтрации композиции со стадии (a) перед лиофилизацией стадии (b). В конкретных вариантах осуществления, водный раствор содержит 10 мМ ± 1 мМ гистидина, pH 6,0±0,5, сахарозы 9%±4,5% масс./об. и полисорбат 80 0,1%±0,05% масс./об. В другом варианте осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,005% масс./об., и сахароза присутствует в концентрации 4,5%±1,5% масс./об.
[0026] В конкретных вариантах осуществления, стадия лиофилизации (b) включает стадии: (i) замораживания стерилизованной композиции со стадии (a) со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C при давлении 400 миллибар±40 миллибар; и затем выдерживания композиции при -50°C±5°C в течение 60 минут ± 6 минут; (ii) ренатурации композиции путем повышения температуры до -10°C±5°C со скоростью 0,3°C±0,03°C в минуту; впоследствии выдерживая при температуре -10°C±5°C в течение 120 минут±12 минут, с последующим понижением температуры со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C, и выдерживание при температуре -50°C±5°C в течение 180 минут ± 18 минут; (iii) высушивания композиции путем понижения давления до 50 миллиторр (мТорр) и выдерживания в течение 30 минут, с последующим повышением температуры до -30°C±5°C со скоростью 0,2°C±0,02°C в минуту, и впоследствии выдерживая при температуре -30°C±5°C в течение 1 920 минут ± 192 минуты; (iv) дополнительное высушивание композиции путем повышения температуры до 30°C±5°C со скоростью 0,2°C±0,02°C в минуту и повышения давления до 200 мТорр, и впоследствии выдерживая при температуре 30°C±5°C в течение 720 минут ± 72 минуты; и (v) понижение температуры до 5°C±5°C со скоростью 0,5°C±0,05°C в минуту. В некоторых вариантах осуществления, лиофилизацию проводят во флаконах. В некоторых вариантах осуществления, флаконы закупоривают после лиофилизации. В конкретных вариантах осуществления, флаконы заполняют газообразным азотом перед закупориванием флакона. В конкретных вариантах осуществления, процесс дополнительно включает стадию: (c) восстановления лиофилизированной композиции со стадии (b) в водной среде. В конкретных вариантах осуществления, осмоляльность восстановленной композиции со стадии (c) составляет от 250 мосмоль ± 25 мосмоль до 300 мосмоль ± 30 мосмоль. В конкретных вариантах осуществления, иммуногенную композицию изобретения изготовляют в соответствии с каким-либо процессом производства иммуногенной композиции изобретения.
[0027] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (а) по меньшей мере, четыре компонента, выбранные из группы, которая состоит из выделенного полипептида агглютинирующего фактора A (ClfA) Staphylococcus aureus, выделенного полипептида агглютинирующего фактора B (ClfB) Staphylococcus aureus, СР5, конъюгированного с белком, СР8, конъюгированного с белком, и выделенного MntC полипептида Staphylococcus aureus, (b) буфер, имеющий рКа 6,0±0,6, и (c) объемообразующий агент. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 1 месяца при 37°C.
[0028] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (а) выделенный полипептид агглютинирующего фактора A (ClfA) Staphylococcus aureus; (b) капсульный полисахарид типа 5, конъюгированный с CRM197 (CP5-CRM197); (c) капсульный полисахарид типа 8, конъюгированный с CRM197 (CP8-CRM197); (d) выделенный MntC полипептид; (e) буфер, имеющий рКа 6,0±0,6, и (f) объемообразующий агент. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 1 месяца при 37°C.
[0029] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: воду меньше, чем 3 массовых процента к общей массе иммуногенной композиции (% масс./масс.), в которой ClfA полипептид составляет от 0,09%±0,027% до 0,84%±0,25% масс/масс, СР5-CRM197 составляет от 0,04%±0,013% до 0,42±0,13% масс/масс, CP8-CRM197 составляет от 0,04%±0,013% до 0,42±0,13% масс./масс., MntC составляет от 0,09%±0,027% до 0,84%±0,25% масс./масс., и буфер составляет 3,3%±0,99% масс/масс.
[0030] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (a) ClfA полипептид; (b) конъюгат CP5-CRM197; (c) конъюгат CP8-CRM197; (d) MntC полипептид; (е) гистидиновый буфер; (f) сахарозу; (g) полисорбат 80; и (h) воду. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 3 месяцев при 37°C.
[0031] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (a) ClfA полипептид от 0,09%±0,027% до 0,84%±0,25% масс/масс; (b) конъюгат CP5-CRM197 от 0,04%±0,013% до 0,42±0,13% масс/масс; (с) конъюгат CP8-CRM197 от 0,04%±0,013% до 0,42±0,13% масс/масс; (d) MntC полипептид от 0,09%±0,027% до 0,84%±0,25% масс/масс; (e) гистидиновый буфер 3,3%±0,99% масс/масс; (f) сахарозу 95%±2% масс./масс.; (g) полисорбат 80 0,21%±0,063% масс/масс; и (h) воду 2%±1% масс./масс. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 3 месяцев при 37°C.
[0032] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную четырех антигенную композицию, изготовленную путем восстановления лиофилизированной иммуногенной композиции изобретения в водном разбавителе, где упомянутая восстановленная композиция имеет конечное значение pH 6,5±0,5.
[0033] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, содержащую: (a) ClfA полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (b) конъюгат CP5-CRM197 в концентрации от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (c) конъюгат CP8-CRM197 в концентрации от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (d) выделенный MntC полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (е) гистидиновый буфер в концентрации от 10 мМ±5 мМ; (f) полисорбат 80 в концентрации от 0,01%±0,005% массы к объему (масс/об.); и (g) сахарозу в концентрации от 4,5%±1,5% масс./об. В другом варианте осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,005% масс./об. и сахароза присутствует в концентрации 4,5%±1,5% масс./об.
[0034] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, содержащую: (а) восстановленный лиофилизированный ClfA полипептид; (b) конъюгат CP5-CRM197; (c) конъюгат CP8-CRM197; (d) MntC полипептид; (d) гистидиновый буфер; (е) полисорбат 80; (f) сахарозу; и (g) водный разбавитель.
[0035] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, содержащую: (а) восстановленный лиофилизированный ClfA полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (b) конъюгат CP5-CRM197 в концентрации от 20 мкг/мл ± 2 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (c) конъюгат CP8-CRM197 в концентрации от 20 мкг/мл ± 20 мкг/мл до 400 мкг/мл ± 40 мкг/мл; (d) выделенный MntC полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл; (e) гистидиновый буфер в концентрации 10 мМ ± 5 мМ; (f) полисорбат 80 в концентрации 0,1%±0,05% массы к объему (масс./об.); и (g) сахарозу в концентрации 9%±4,5% масс./об.; и (h) водный разбавитель. В другом варианте осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,005% масс/об. и сахарозу присутствует в концентрации 4,5%±1,5% масс/об.
[0036] В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, включающий стадии: (а) формуляции водного раствора: (i) ClfA полипептид, (ii) конъюгат CP5-CRM197, (iii) конъюгат CP8-CRM197, (iv) MntC полипептид, (v) буфер, имеющий рКа 6,0±0,6, и (vi) объемообразующий агент; и (b) лиофилизации композиции стадии (a), чтобы сформировалась таблетка, содержащая меньше, чем 3 процента воды по массе. В конкретных вариантах осуществления, процесс дополнительно включает комбинирование с (vi) поверхностно-активным веществом на стадии (a). В конкретных вариантах осуществления, процесс дополнительно включает стадию стерилизующей фильтрации композиции со стадии (a) перед лиофилизацией стадии (b). В конкретных вариантах осуществления, водный раствор содержит 10 мМ±5 мМ гистидина, pH 6,0±0,5, сахарозу в концентрации 9%±1% масс./об. и полисорбат 80 в концентрации 0,1%±0,02% масс./об. В других вариантах осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,001% масс./об., и сахароза присутствует в концентрации 4,5%±0,45% масс./об. В конкретных вариантах осуществления, стадия лиофилизации (b) включает стадии: (i) замораживания стерилизованной композиции со стадии (a) со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C при давлении 400 миллибар ± 40 миллибар; и затем выдерживания композиции при -50°C±5°C в течение 60 минут ± 6 минут; (ii) ренатурации композиции путем повышения температуры до -10°C±5°C со скоростью 0,3°C±0,03°C в минуту; затем выдерживания при температуре -10°C±5°C в течение 120 минут ± 12 минут; затем снижения температуры со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C; и затем выдерживания при температуре -50°C±5°C в течение 180 минут ± 18 минут; (iii) высушивания композиции путем снижения давления до 50 миллиторр (мТорр) и выдерживания в течение 30 минут; затем повышения температуры до -30°C±5°C со скоростью 0,2°C±0,02°C в минуту; и затем выдерживания при температуре -30°C±5°C в течение 1 920 минут ± 192 минут; (iv) высушивания композиции путем повышения температура до 30°C±5°C со скоростью 0,2°C±0,02°C в минуту; и затем повышения давления до 200 мТорр и выдерживания при температуре 30°C±5°C в течение 720 минут ± 72 минут; (v) понижения температуры до 5°C±5°C со скоростью 0,5°C±0,05°C в минуту. В некоторых вариантах осуществления, лиофилизацию проводят во флаконах. В некоторых вариантах осуществления, флаконы закупоривают после лиофилизации. В конкретных вариантах осуществления, флаконы заполняют газообразным азотом перед закупориванием флаконов. В конкретных вариантах осуществления, процесс дополнительно включает стадию: (c) восстановления лиофилизированной композиции со стадии (b) в водной среде. В конкретных вариантах осуществления, осмоляльность восстановленной композиции со стадии (c) составляет от 250 мосмоль ± 25 мосмоль до 300 мосмоль ± 30 мосмоль. В конкретных вариантах осуществления, иммуногенную композицию изобретения изготовляют в соответствии с каким-либо процессом производства иммуногенной композиции изобретения.
[0037] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (а) выделенный полипептид агглютинирующего фактора A (ClfA) Staphylococcus aureus, включающий фибриногеновый домен, (b) буфер, имеющий рКа 6,0±0,6, и (c) объемообразующий агент. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 1 месяца при 37°C. В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую воду в количестве меньшем, чем 3 массовых процента от общей массы иммуногенной композиции (% масс./масс), в которой ClfA полипептид составляет 0,52 процента ± 0,46% масс./масс., и буфер составляет 0,28%±0,065% масс./масс. В конкретных вариантах осуществления, объемообразующим агентом является сахароза - 97%±2,0% масс./масс.
[0038] В одном варианте осуществления, изобретение предусматривает лиофилизированную иммуногенную композицию, содержащую: (a) ClfA полипептид - 0,52%±0,46% масс./масс, (b) сукцинатный буфер - 0,28%±0,065% масс./масс, (c) сахарозу - 97%±0,57% масс./масс, (d) полисорбат 80 - 0,20%±0,042% масс./масс., и (e) воду -2,5%±0,5% масс./масс. В конкретных вариантах осуществления, ClfA полипептид сохраняется в значительной степени неразложившийся в течение, по меньшей мере, 1 месяца при 37°C.
[0039] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную ClfA композицию, изготовленную путем восстановления лиофилизированной иммуногенной композиции изобретения в водном разбавителе, где упомянутая восстановленная композиция имеет конечное значение pH 6,0±0,3.
[0040] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную ClfA композицию, изготовленную путем восстановления лиофилизированной иммуногенной композиции изобретения в водном разбавителе, где упомянутая восстановленная композиция имеет конечное значение pH 6,5±0,3.
[0041] В одном варианте осуществления, изобретение предусматривает жидкую иммуногенную композицию, содержащую: (a) ClfA полипептид в концентрации от 20 мкг/мл±2 мкг/мл до 600 мкг/мл±60 мкг/мл; (b) гистидиновый буфер в концентрации 10 мМ±5 мМ; (c) полисорбат 80 в концентрации 0,1%±0,05% по массе к объему (масс./об.); и (d) сахарозу в концентрации 9%±4,5% масс./об. В другом варианте осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,005% масс./об., и сахароза присутствует в концентрации 4,5%±1,5% масс./об.
[0042] В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, включающий стадии: (a) формуляции водного раствора, (i) рекомбинантного полипептида агглютинирующего фактора A (rClfA), (ii) буфера, имеющего рКа 6,0±0,6, и (iii) объемообразующего агента, (b) лиофилизации композиции со стадии (a), чтобы сформировать таблетку, содержащую меньше, чем 3% воды по массе. В конкретных вариантах осуществления, процесс дополнительно включает комбинирование с (vi) поверхностно-активным веществом на стадии (a). В конкретных вариантах осуществления, процесс дополнительно включает стадию стерилизующей фильтрации композиции со стадии (a) перед лиофилизацией на стадии (b). В конкретных вариантах осуществления, водный раствор содержит 10 мМ ± 1 мМ гистидина, pH 6,0±0,5, сахарозу - 9%±1% масс./об. и полисорбат 80-0,1%±0,02% масс./об. В других вариантах осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,001% масс./об., и сахароза присутствует в концентрации 4,5%±0,45% масс./об. В конкретных вариантах осуществления, стадия лиофилизации (b) включает стадии: (i) замораживания стерилизованной композиции со стадии (а) со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C при давлении 400 миллибар ± 40 миллибар; и затем выдерживания композиции при -50°C±5°C в течение 60 минут ± 6 минут; (ii) ренатурации композиции путем повышения температуры до -10°C±5°C со скоростью 0,3°C±0,03°C в минуту; затем выдерживания при температуре -10°C±5°C в течение 120 минут ± 12 минут; затем снижения температуры со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C; и затем выдерживания при температуре -50°C±5°C в течение 180 минут ± 18 минут; (iii) высушивания композиции путем понижения давления до 50 миллиторр (мТорр) и повышения температуры до -25°C±5°C со скоростью 0,2°C±0,02°C в минуту; и затем выдерживания при температуре 25°C±5°C в течение 1 320 минут ± 132 минут; (iv) высушивания композиции путем повышения температуры до 30°C±5°C со скоростью 0,2°C±0,02°C в минуту; и затем повышения давления до 200 мТорр и выдерживания при температуре 30°C±5°C в течение 720 минут ± 72 минут; (v) понижения температуры до 5°C±5°C со скоростью 0,5°C±0,05°C в минуту. В некоторых вариантах осуществления лиофилизацию проводят во флаконе. В некоторых вариантах осуществления, флакон закупоривают после лиофилизации. В конкретных вариантах осуществления, флакон заполняют газообразным азотом перед закупориванием флакона. В конкретных вариантах осуществления, процесс дополнительно включает стадию: (c) восстановления лиофилизированной композиции со стадии (b) в водной среде. В конкретных вариантах осуществления, осмоляльность восстановленной композиции со стадии (c), воспроизводимой из высушенной композиции со стадии (b) в водном разбавителе, в которой осмоляльность восстановленной композиции составляет 300 мосмоль ± 30 мосмоль. В конкретных вариантах осуществления, водная среда содержит, по меньшей мере, два компонента, выбранные из группы, которая состоит из: (a) полипептида агглютинирующего фактора B (ClfB) Staphylococcus aureus, (b) капсульного полисахарида типа 5 (СР5), конъюгированного с белком, (c) капсульного полисахарида типа 8 (СР8), конъюгированного с белком, и (d) MntC полипептида Staphylococcus aureus. В конкретных вариантах осуществления, водный раствор содержит СР5, конъюгированного с белком, и СР8, конъюгированного с белком. В конкретных вариантах осуществления, водный раствор содержит СР-5, конъюгированного с белком, СР8, конъюгированного с белком, и MntC полипептид. В конкретных вариантах осуществления, иммуногенную композицию изобретения производят в соответствии с каким-либо процессом изготовления иммуногенной композиция изобретения.
[0043] В конкретных вариантах осуществления, ClfA полипептид содержит N домен. В конкретных вариантах осуществления, ClfA полипептид содержит N1, N2 или N3 домен. В конкретных вариантах осуществления, ClfA полипептид содержит N1, N2 и N3 домен. В конкретных вариантах осуществления, ClfA полипептид содержит фибриноген-связывающий домен. В конкретных вариантах осуществления, фибриноген-связывающий домен является видоизмененным для того, чтобы связываться с фибриногеном на пониженном уровне по сравнению со связыванием с фибриногеном, которое наблюдали с нативным фибриноген-связывающим доменом ClfA. В конкретных вариантах осуществления, фибриноген-связывающий домен демонстрирует пониженное связывание с фибриногеном посредством имеющегося аминокислотного замещения при одном или более из Tyr 338, Tyr 256, Pro 336, Lys 389, Ala 254 и Ile 387. В конкретных вариантах осуществления, аминокислотное замещение при одном или более из Tyr 338, Tyr 256, Pro 336, Lys 389, Ala 254 и Ile 387 происходит на Ala или Ser. В конкретных вариантах осуществления, Tyr 338 замещается на Ala.
[0044] В конкретных вариантах осуществления, СР5, конъюгированный с белком, представляет собой CP5-CRM197, СР5-пневмолизин или СР5-стрептококковую C5a пептидазу (SCP). В конкретных вариантах осуществления, СР8, конъюгированный с белком, представляет собой CP8-CRM197, СР8-пневмолизин или СР8-стрептококковую C5a пептидазу (SCP).
[0045] В конкретных вариантах осуществления, буфер лиофилизированной иммуногенной композиции содержит сукцинат при pH 6,0±0,3. В конкретных вариантах осуществления, буфер содержит гистидин при pH 6,5±0,5. В конкретных вариантах осуществления, буфер содержит гистидин при pH 6,0±0,3. В конкретных вариантах осуществления, объемообразующий агент выбирают из группы, состоящей из сахарозы, трегалозы, маннита, глицина или сорбита. В конкретных вариантах осуществления, объемообразующим агентом является сахароза. В конкретных вариантах осуществления, объемообразующим агентом является сахароза с содержанием 96%±0,2% масс./масс. В конкретных вариантах осуществления, лиофилизированная иммуногенная композиция дополнительно содержит поверхностно-активное вещество. В конкретных вариантах осуществления, поверхностно-активное вещество выбирают из группы, состоящей из полоксамера, полиоксиэтиленалкилового простого эфира и полиоксиэтиленовый сложный эфир сорбита и жирной кислоты. В конкретных вариантах осуществления полиоксиэтиленовым сложным эфиром сорбита и жирной кислоты является полисорбат 80. В конкретных вариантах осуществления, полисорбат 80 присутствует в концентрации 0,20%±0,041% масс./масс., для ClfA и три-антигенных композиций. В конкретных вариантах осуществления, полисорбат 80 присутствует в концентрации 0,1%±0,05% масс./масс., для четырех- антигенных композиций. В других вариантах осуществления, полисорбат 80 присутствует в концентрации 0,01%±0,005% масс./об.
[0046] В конкретных вариантах осуществления, лиофилизированная иммуногенная композиция дополнительно содержит вспомогательное вещество. В конкретных вариантах осуществления, вспомогательным веществом является ISCOMATRIX™.
[0047] В конкретных вариантах осуществления, водным разбавителем жидкой композиции является вода. В конкретных вариантах осуществления, водным разбавителем является слабый солевой раствор. В конкретных вариантах осуществления, слабый солевой раствор содержит 60 мМ ± 10 мМ хлорида натрия. В конкретных вариантах осуществления, водный разбавитель содержит полисорбат 80. В конкретных вариантах осуществления, водный разбавитель содержит вспомогательное вещество. В конкретных вариантах осуществления, вспомогательным веществом является ISCOMATRIX™.
Краткое описание фигур
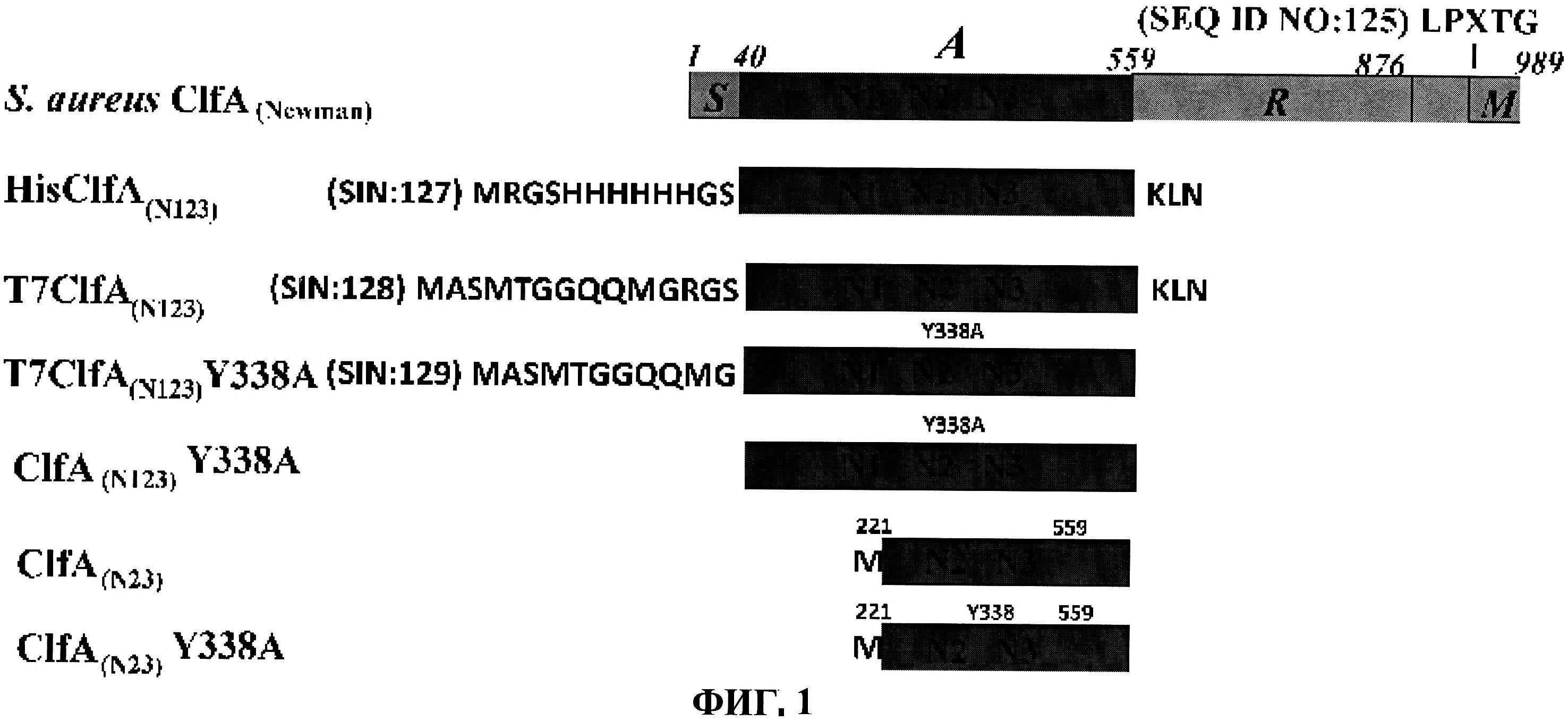
[0048] Фигура 1 представляет схематическую диаграмму различных форм рекомбинантного ClfA полипептида и раскрывает SEQ ID No: 125 и 127-129.
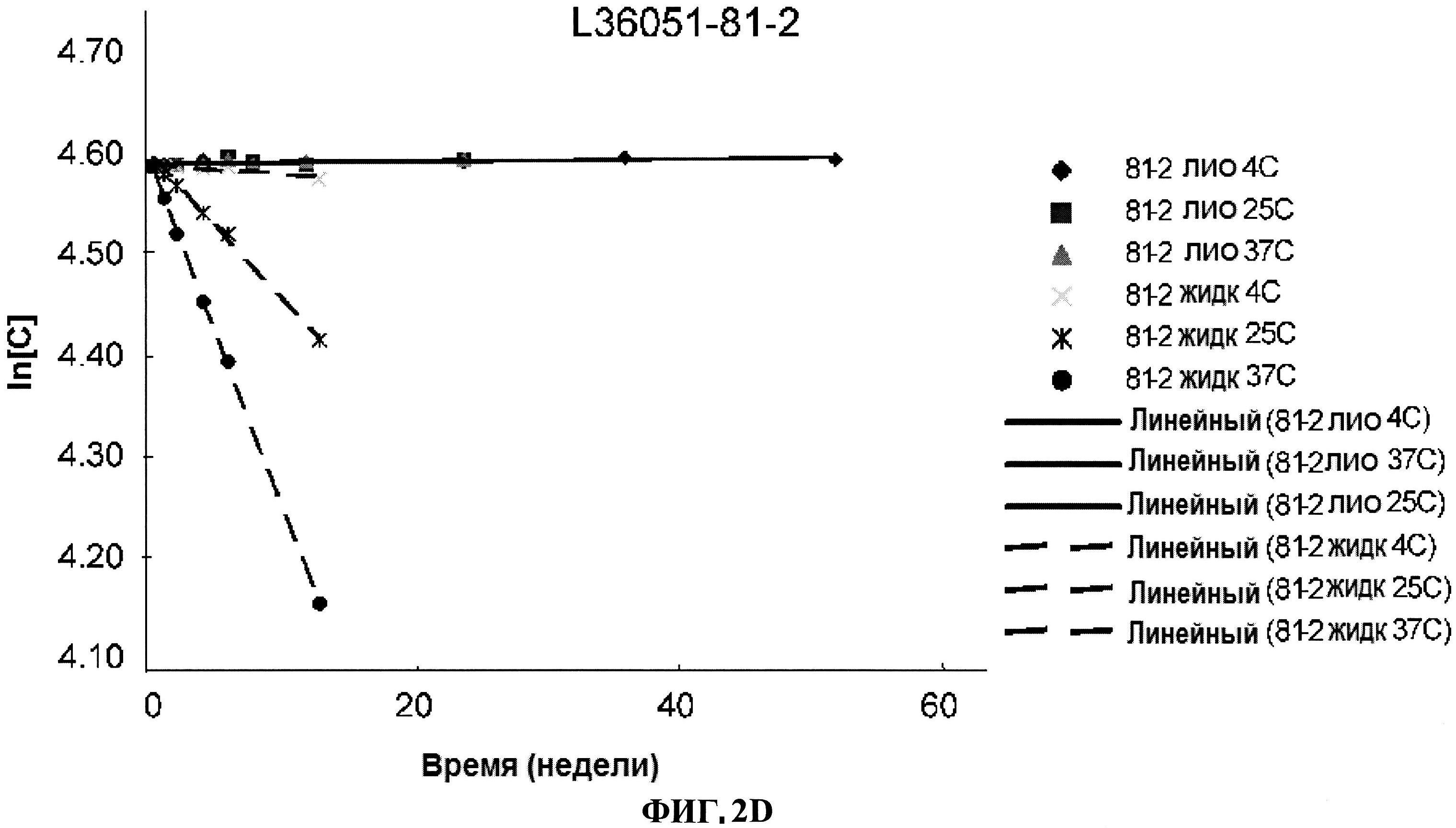
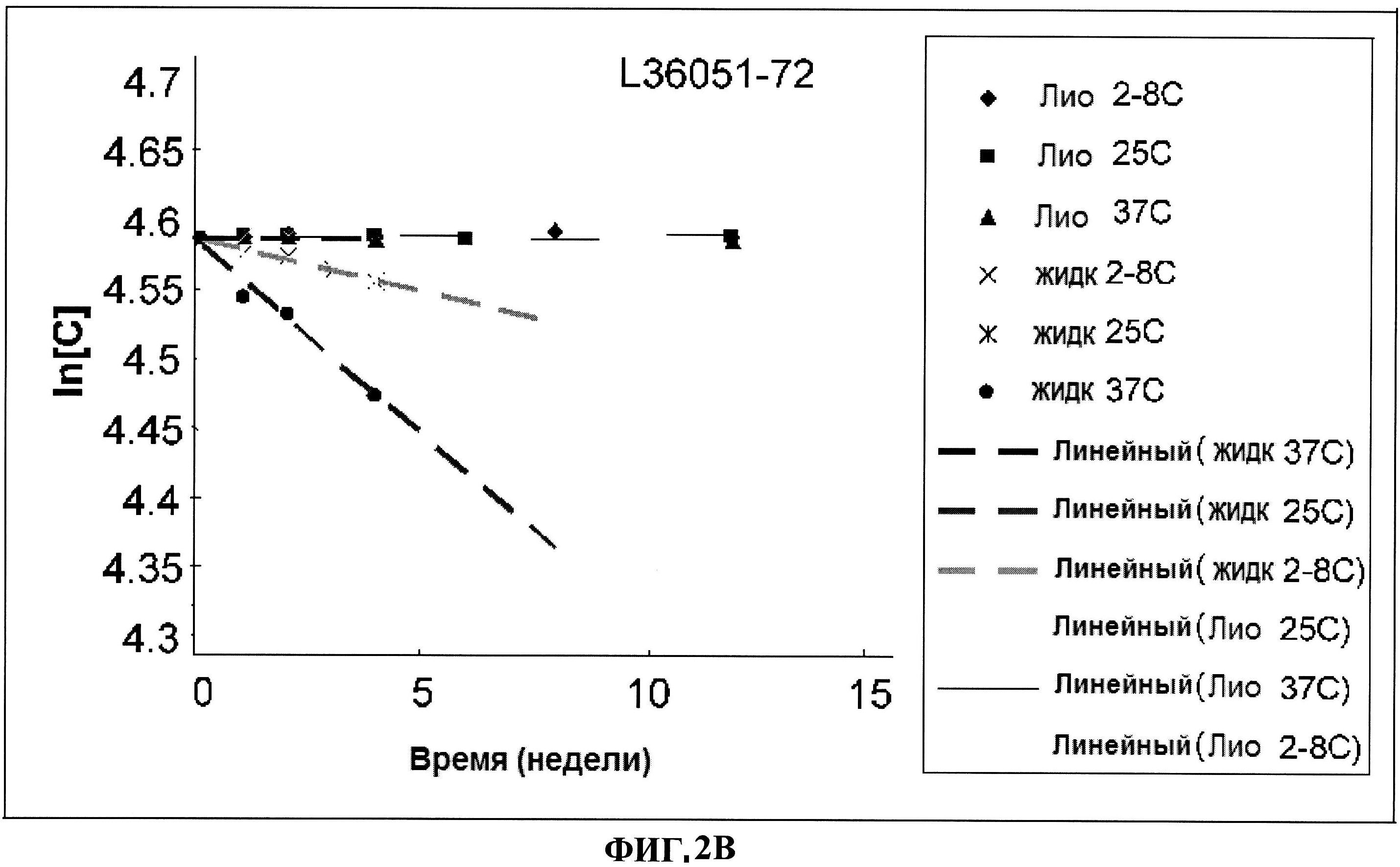
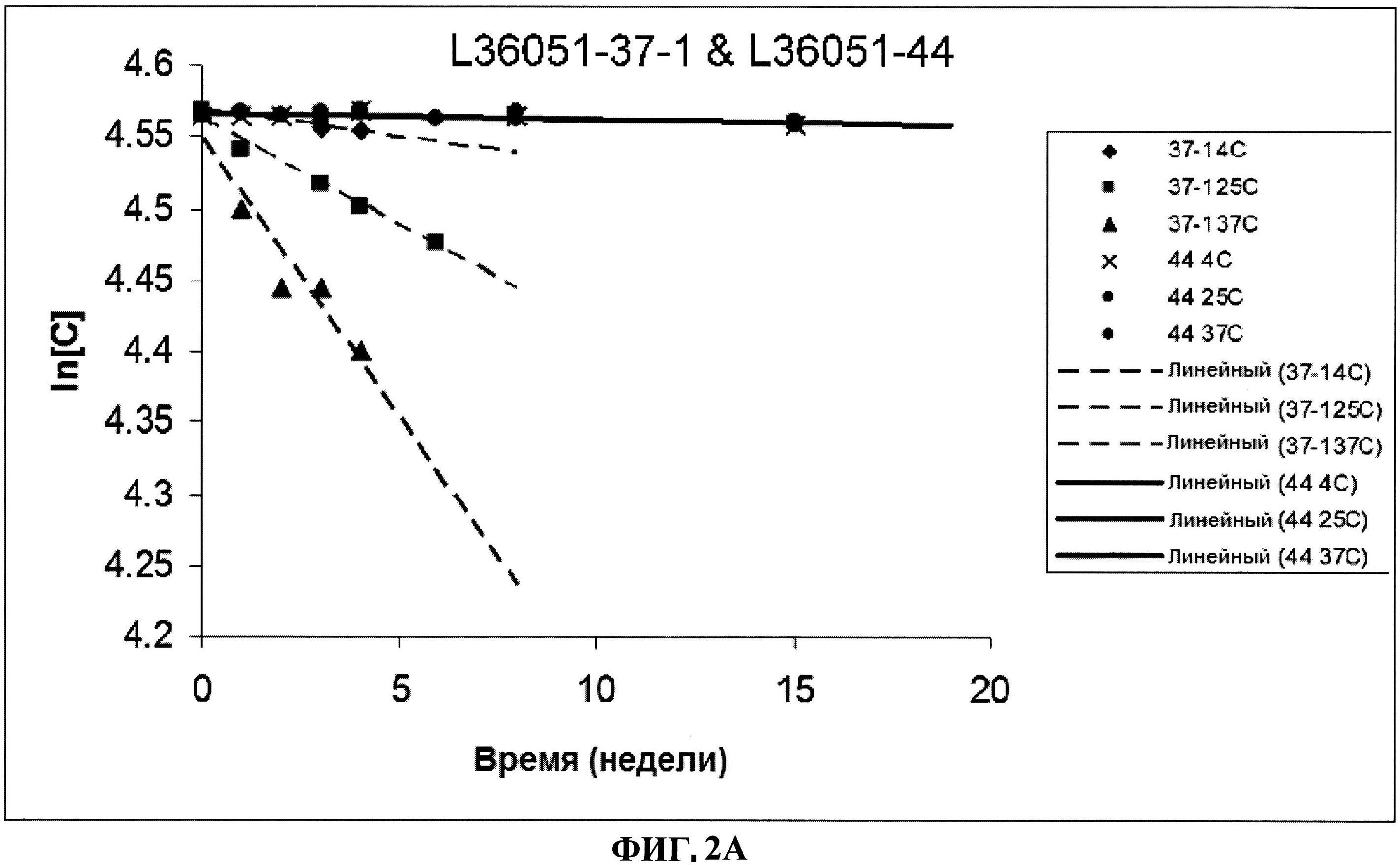
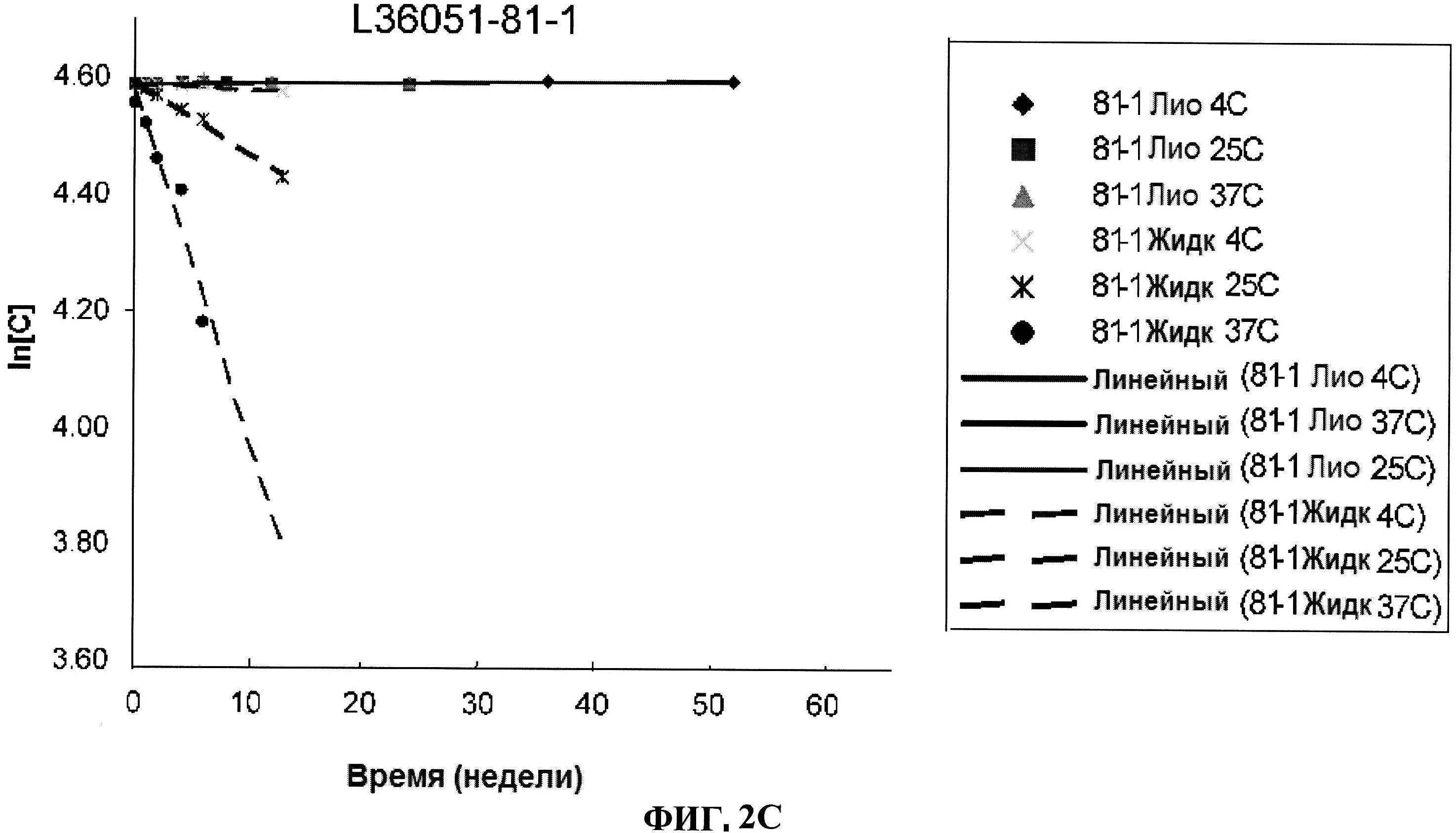
[0049] Фигура 2 представляет изменение в концентрации различных серий лиофилизированного ClfA белка по сравнению с их жидкими аналогами, выраженное как In[C], в течение времени при различных условиях. Панель A: номера серий L36051-37-1 и L36051-44. Панель B: номер серии L36051-72. Панель C: номер серии L36051-81-1. Панель D: номер серии 36051-81-2.
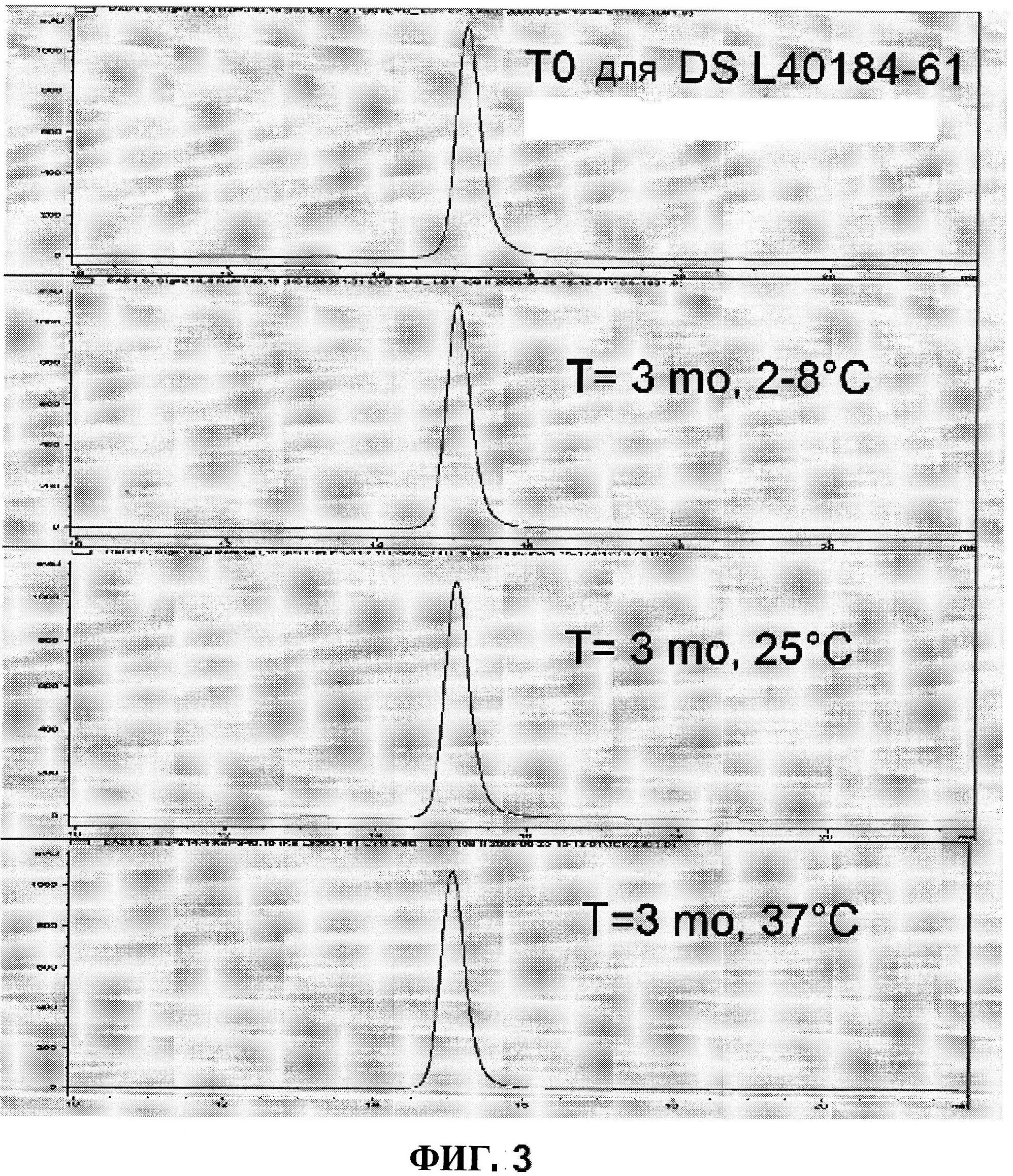
[0050] На фигуре 3 изображены гельпроникающие хроматограммы лиофилизированного DS L40184-61 при t=0 по сравнению с таблетками, которые хранились при 2-8°C, 25°C, и 37°C в течение трех месяцев.
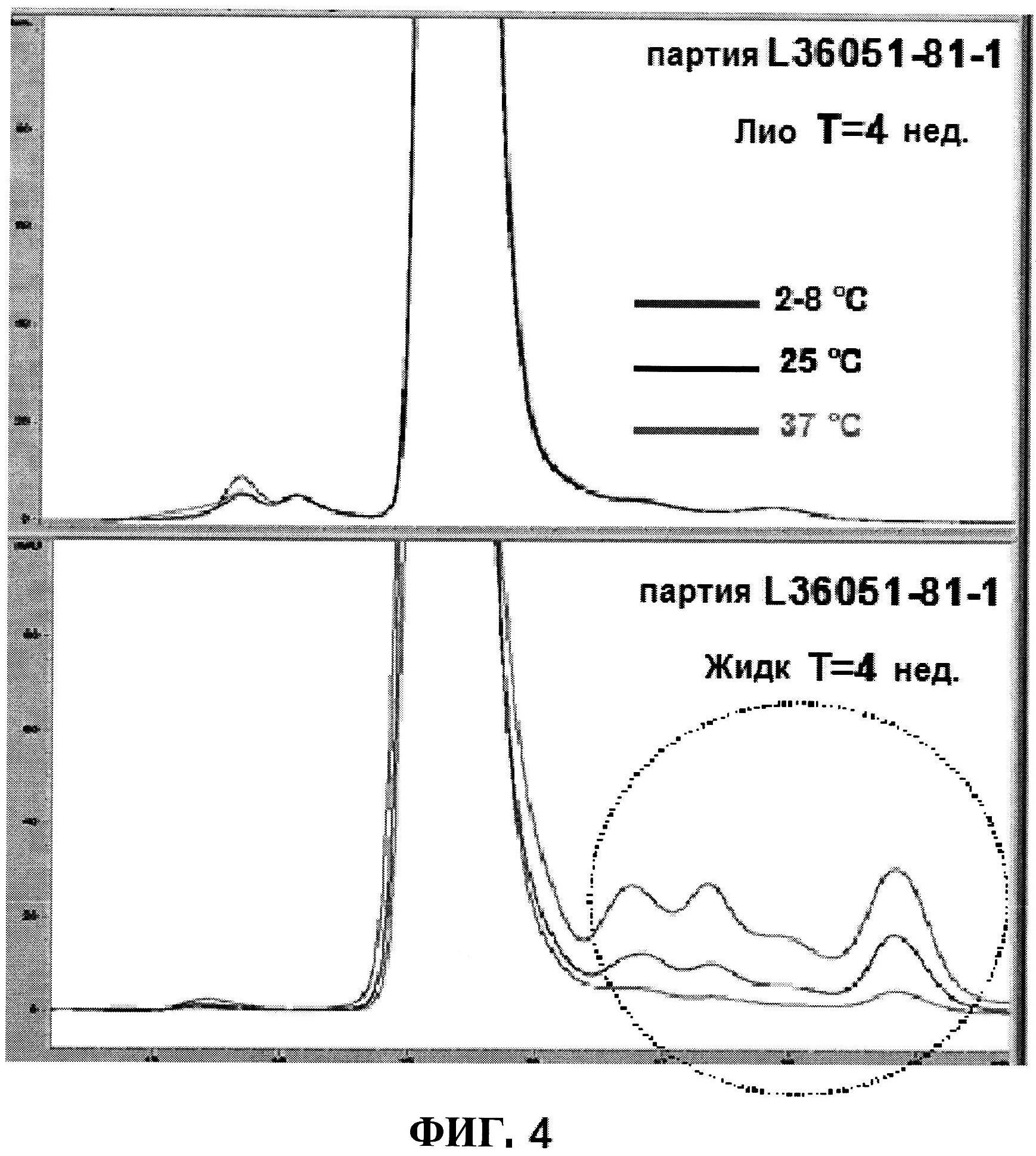
[0051] На фигуре 4 изображены гельпроникающие хроматограммы, сравнивающие лиофилизированную композицию с жидкостью перед лиофилизацией ClfA серии L36051-81-1.
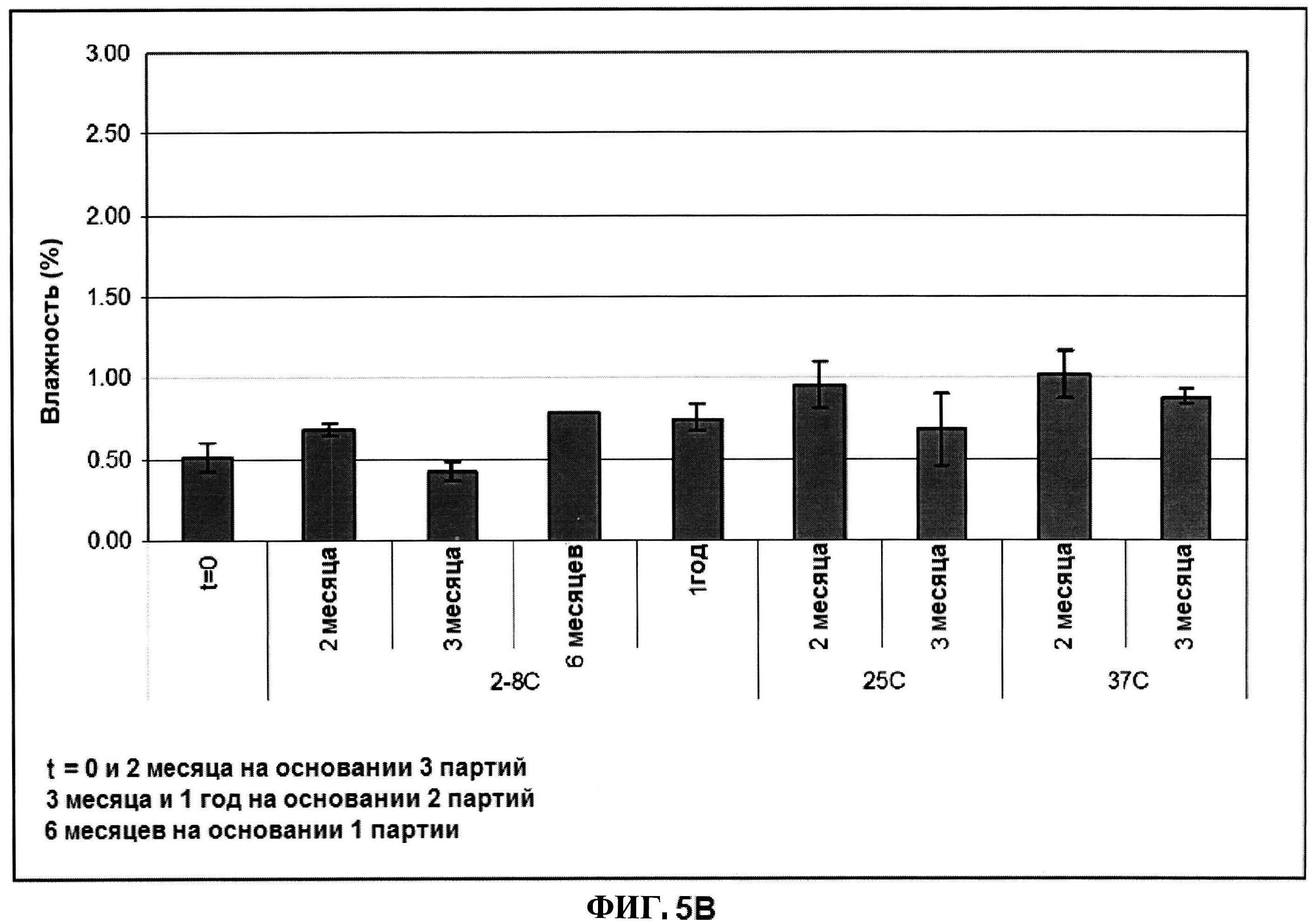
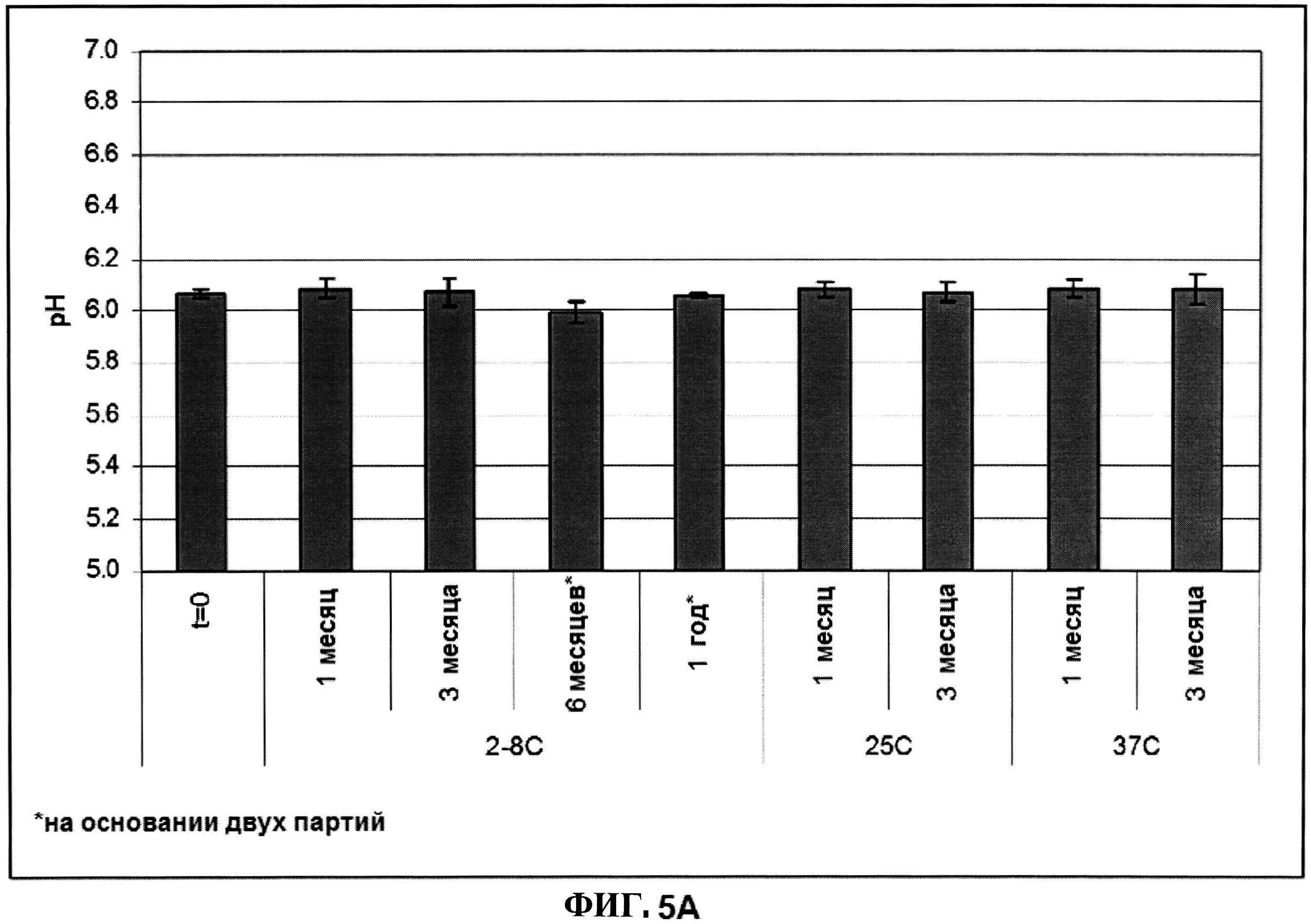
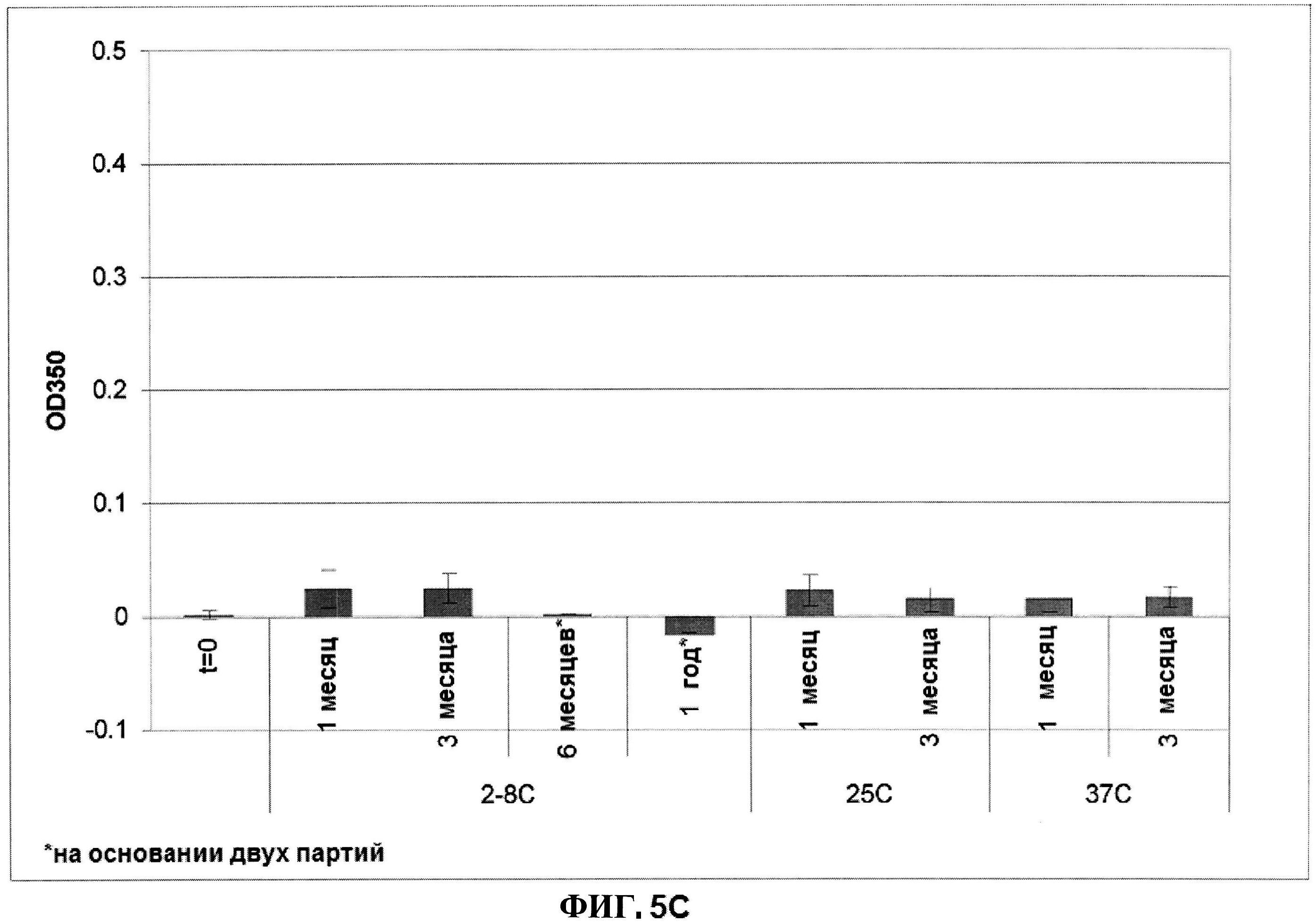
[0052] На фигуре 5 изображены гистограммы pH (панель A), процентной влажности (панель B) и оптической плотности (панель C), которая представляет собой критерий агрегации, лиофилизированного ClfA при различных временах и температурных условиях.
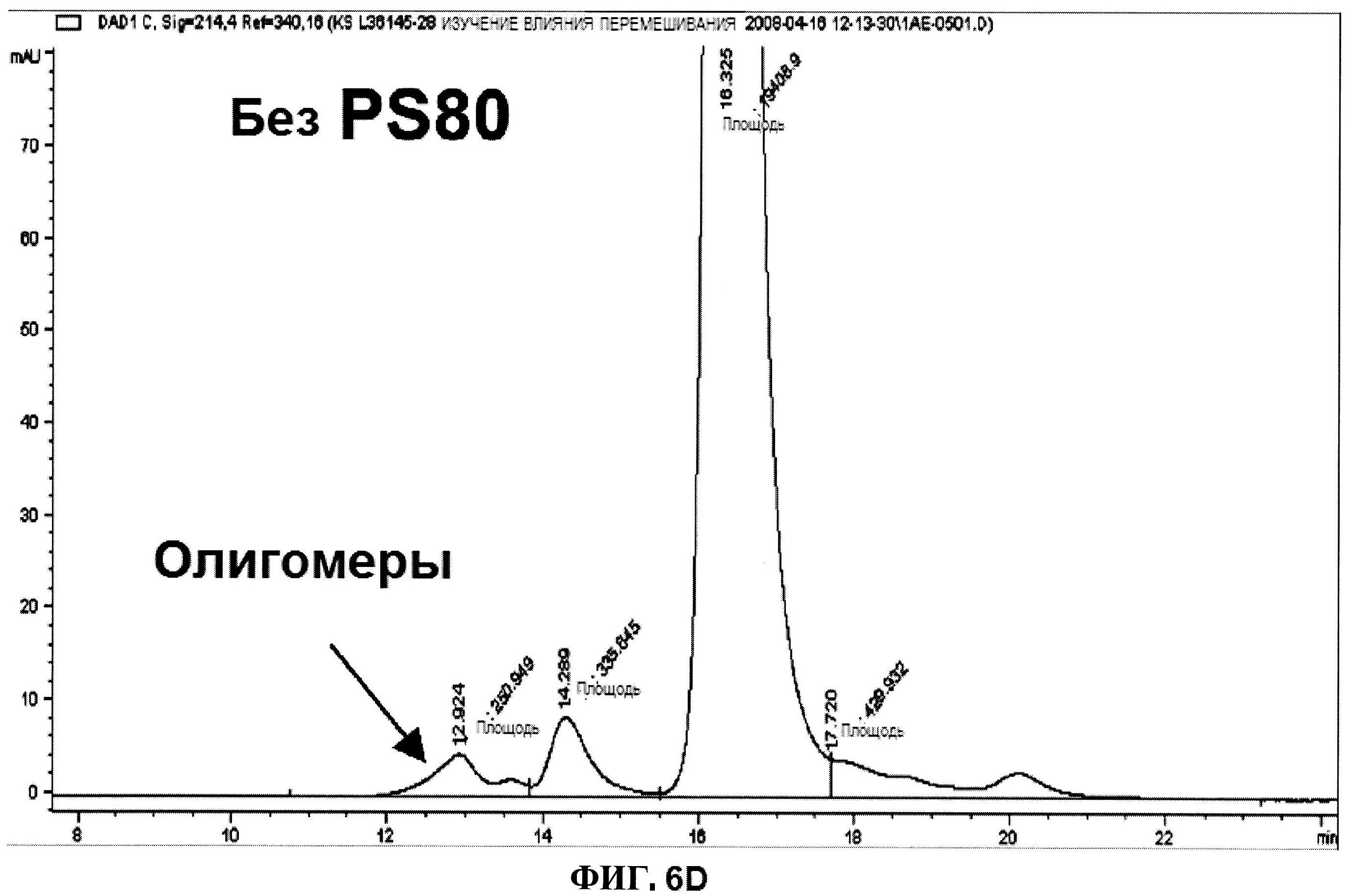
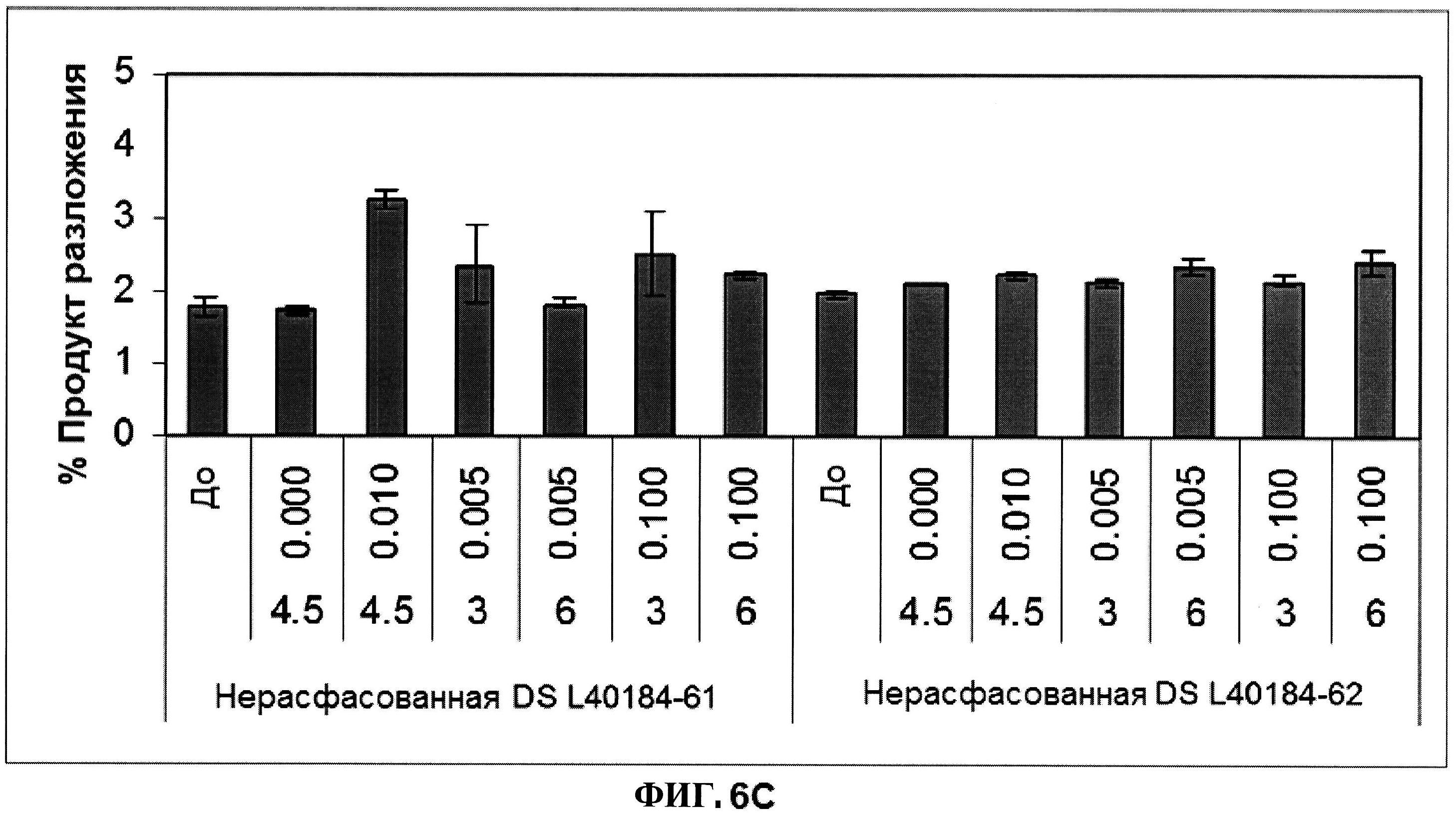
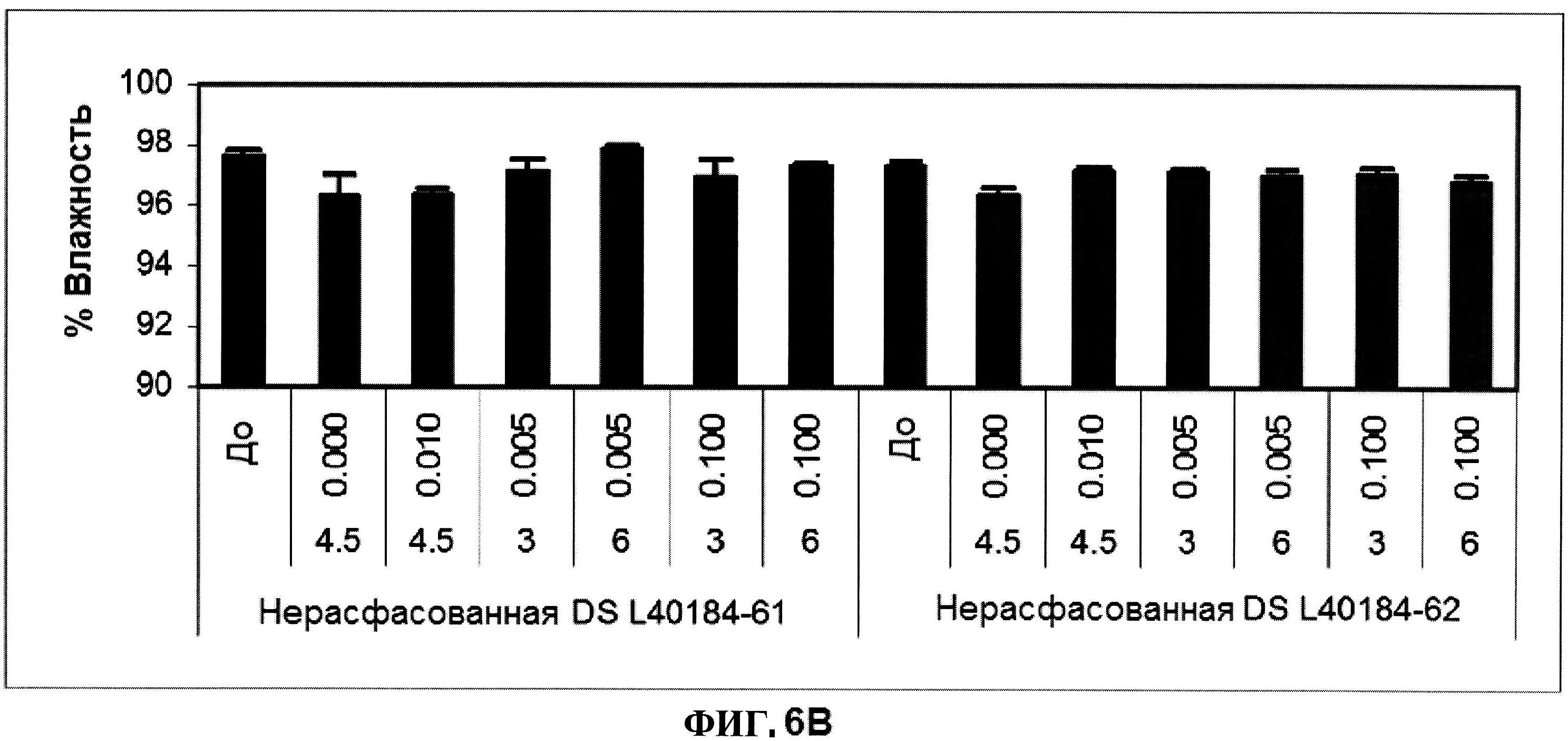
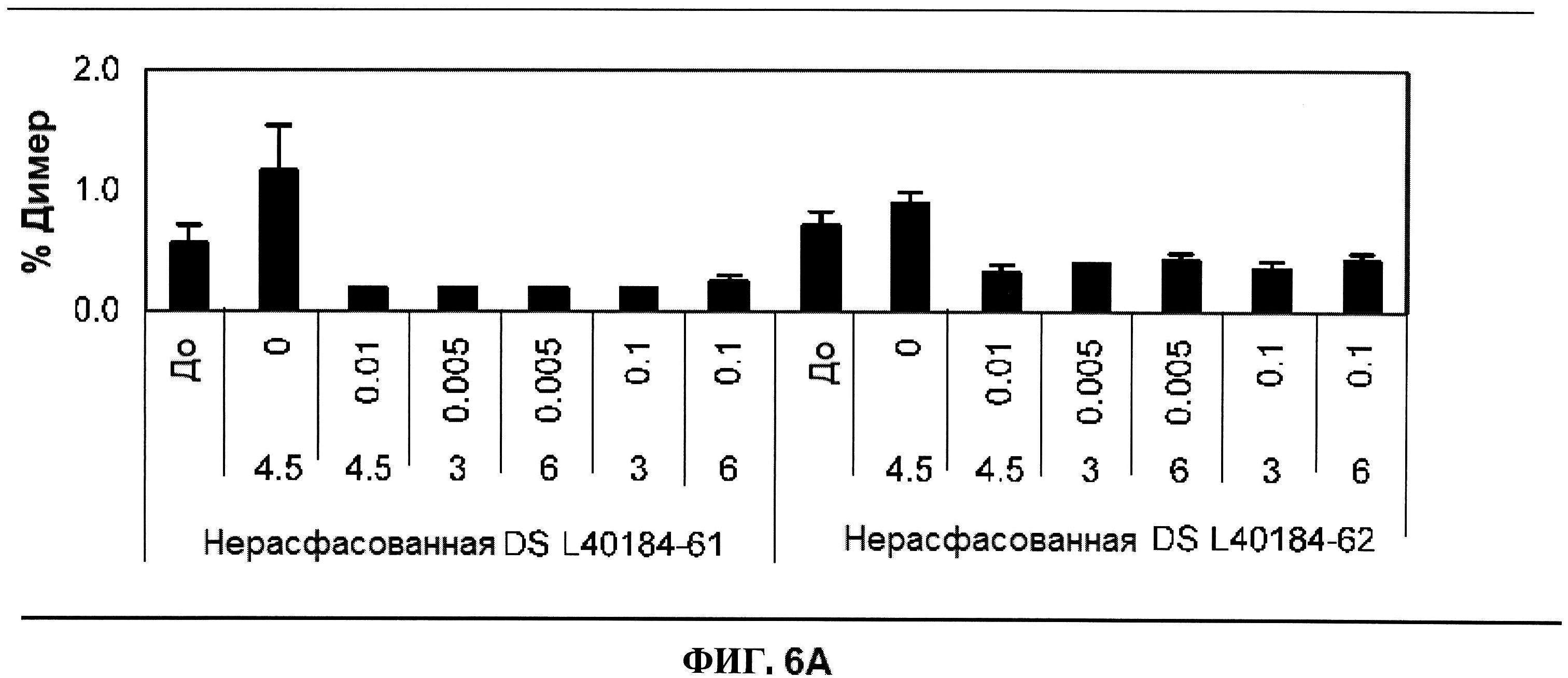
[0053] На фигуре 6 изображены гистограммы процентного содержания димера (панель A), процентного содержания мономера (панель B) и процентного содержания продукта разложения (расщепления) (панель C) ClfA, как определено с помощью эксклюзионной ВЭЖХ через 24 часа после перемешивания при комнатной температуре. Х-ось отображает составы, содержащие различные концентрации полисорбата 80 (0,000, 0,0100, 0,005 и 0,100% масс/масс.) и сахарозы (3, 4,5 и 6% масс./масс.). Состав, который не содержит PS 80, продемонстрировал возрастание процентного содержания образовавшегося димера после перемешивания (панель D).
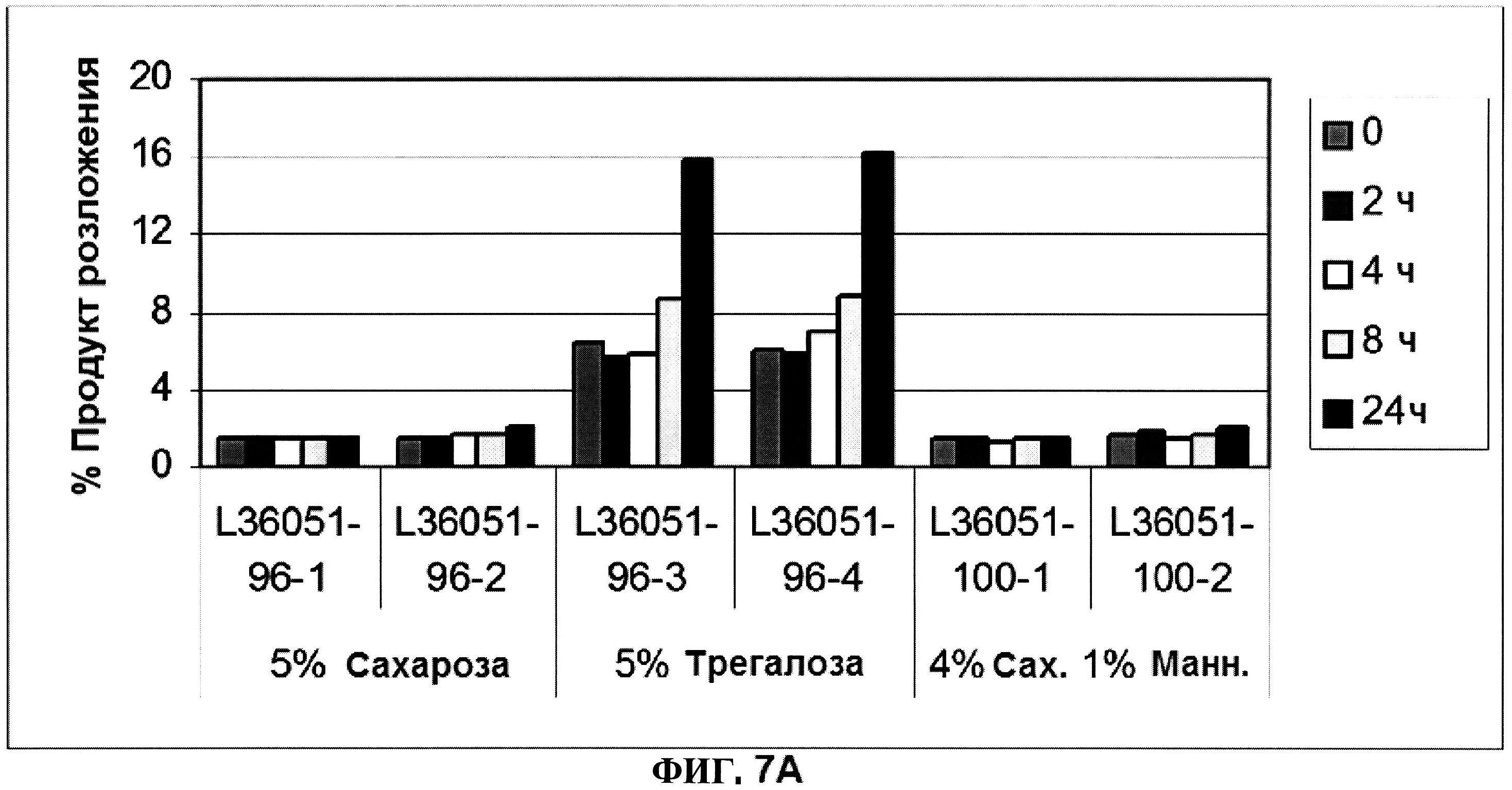
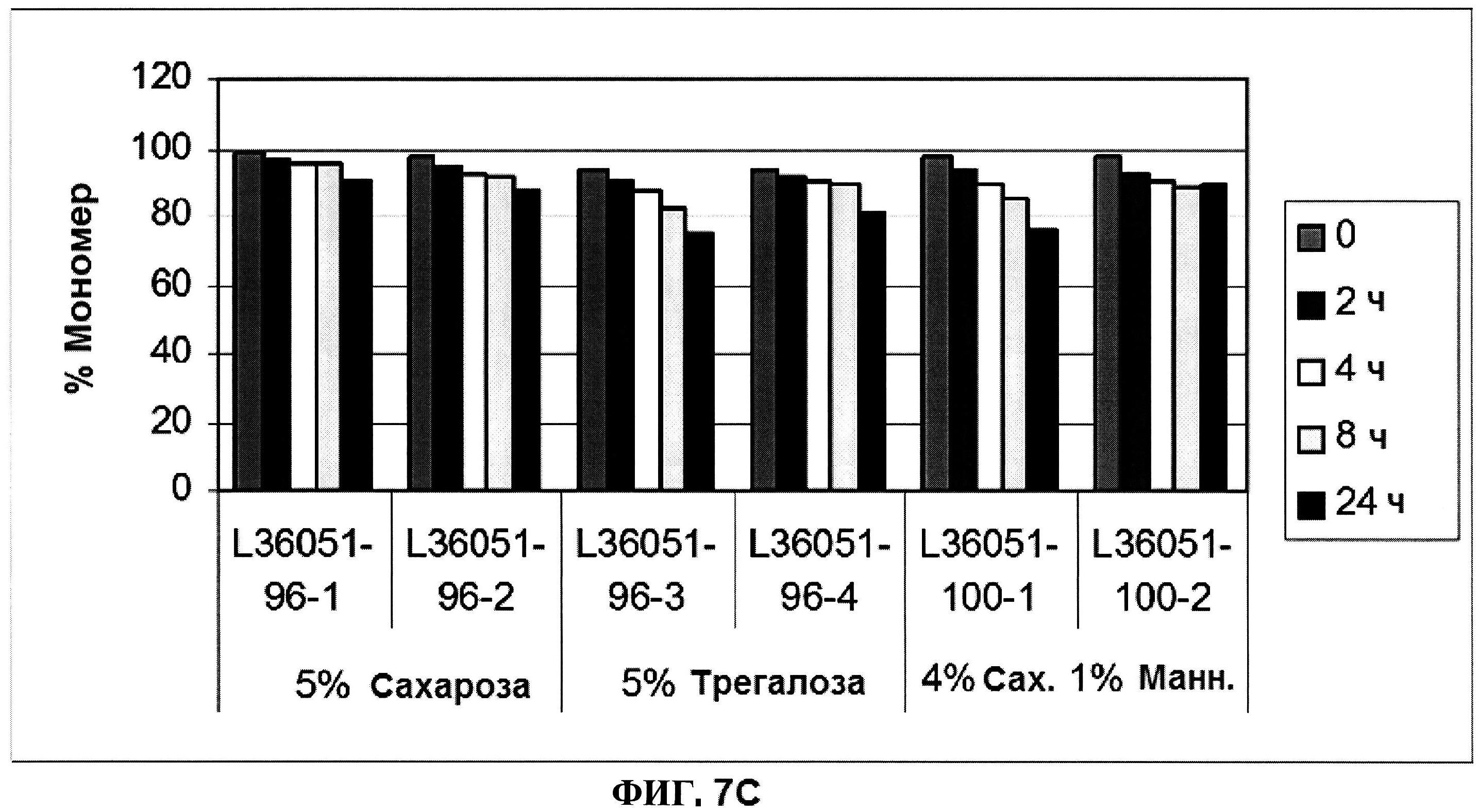
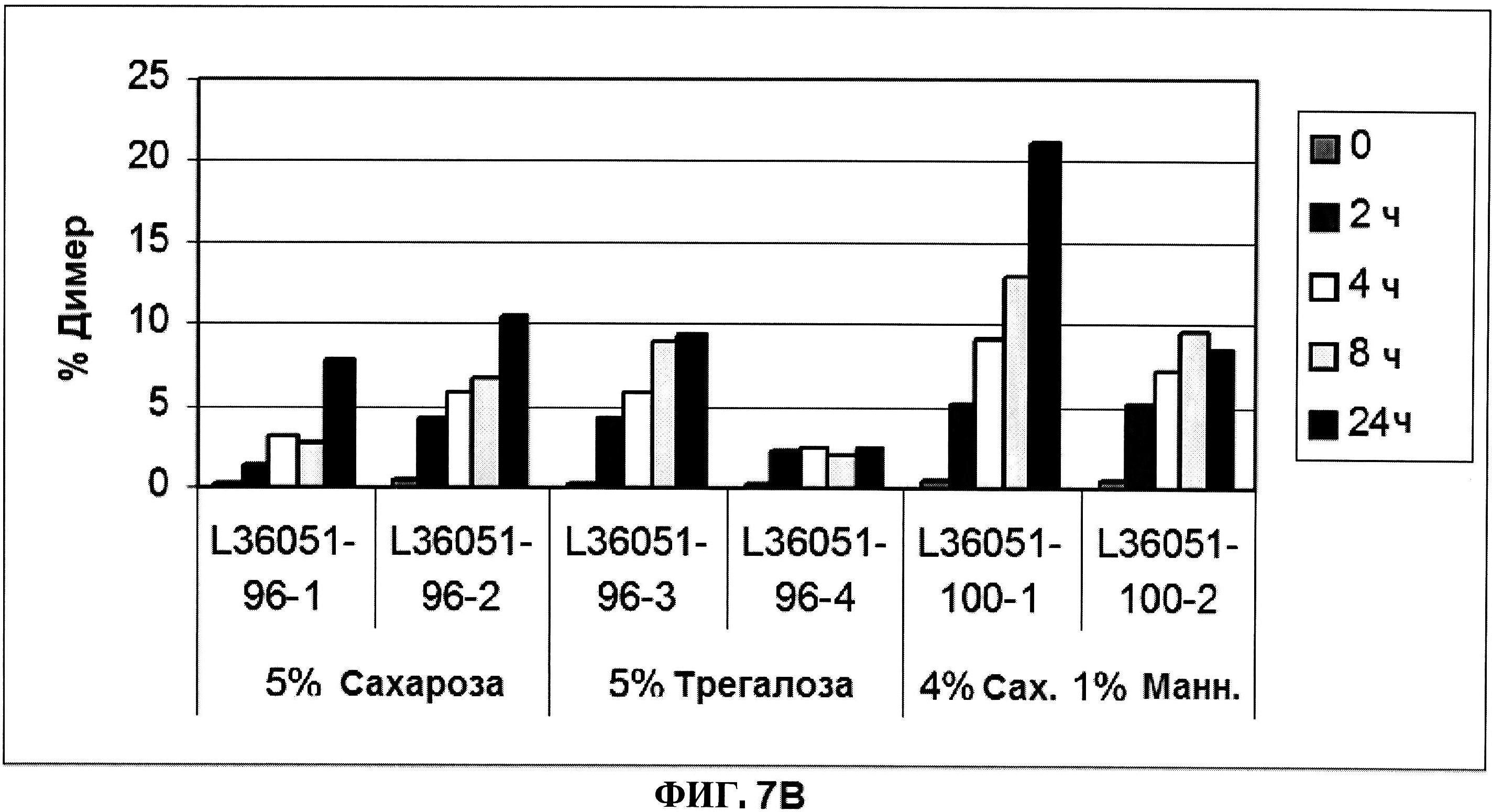
[0054] На фигуре 7 изображены гистограммы процентного содержания продукта разложения (расщепления) (панель A), процентного содержания димера (панель В) и процентного содержания мономера (панель C) ClfA, как определено с помощью эксклюзионной ВЭЖХ для составов с различным объемообразующим агентом в течение времени.
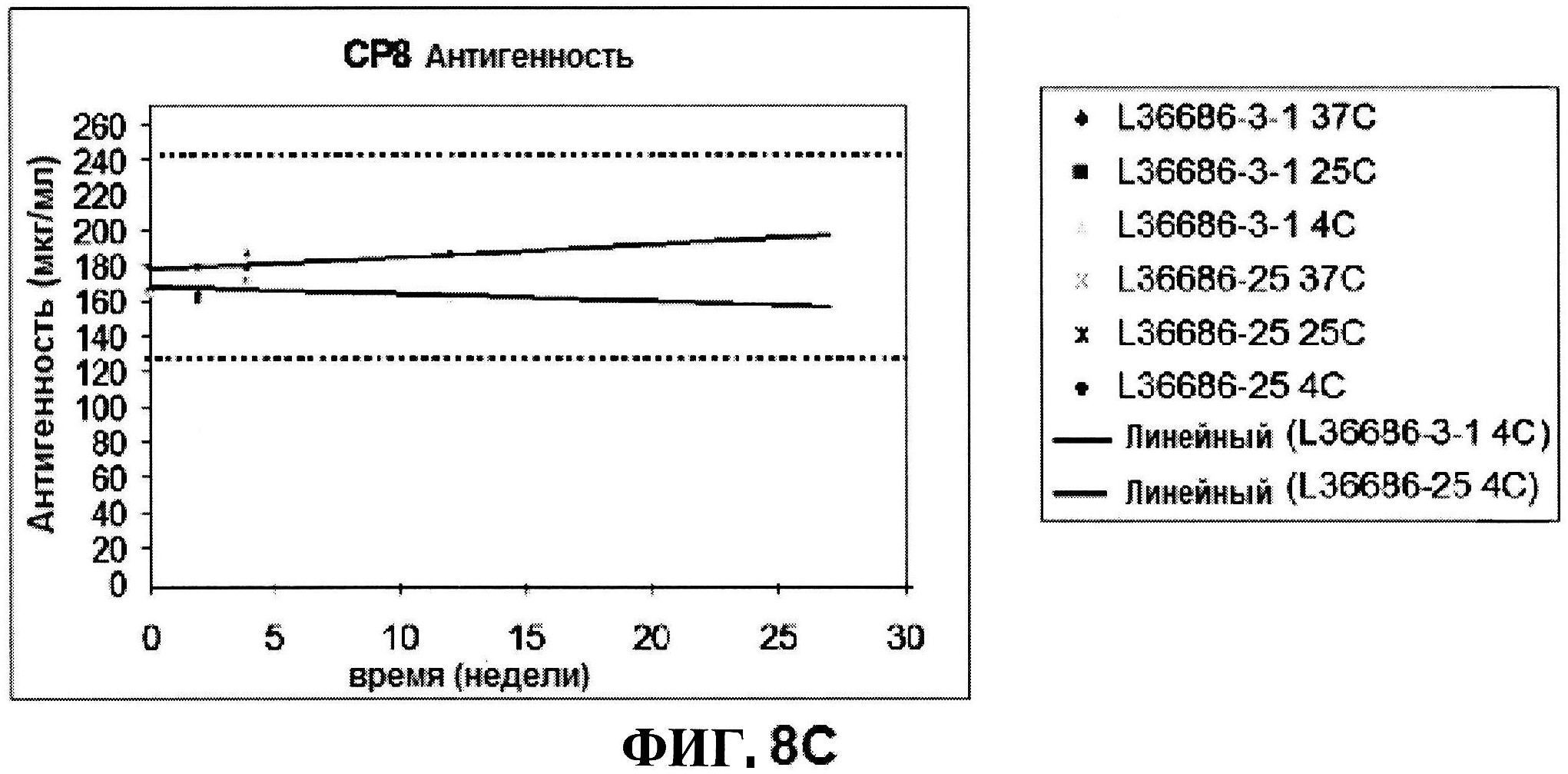
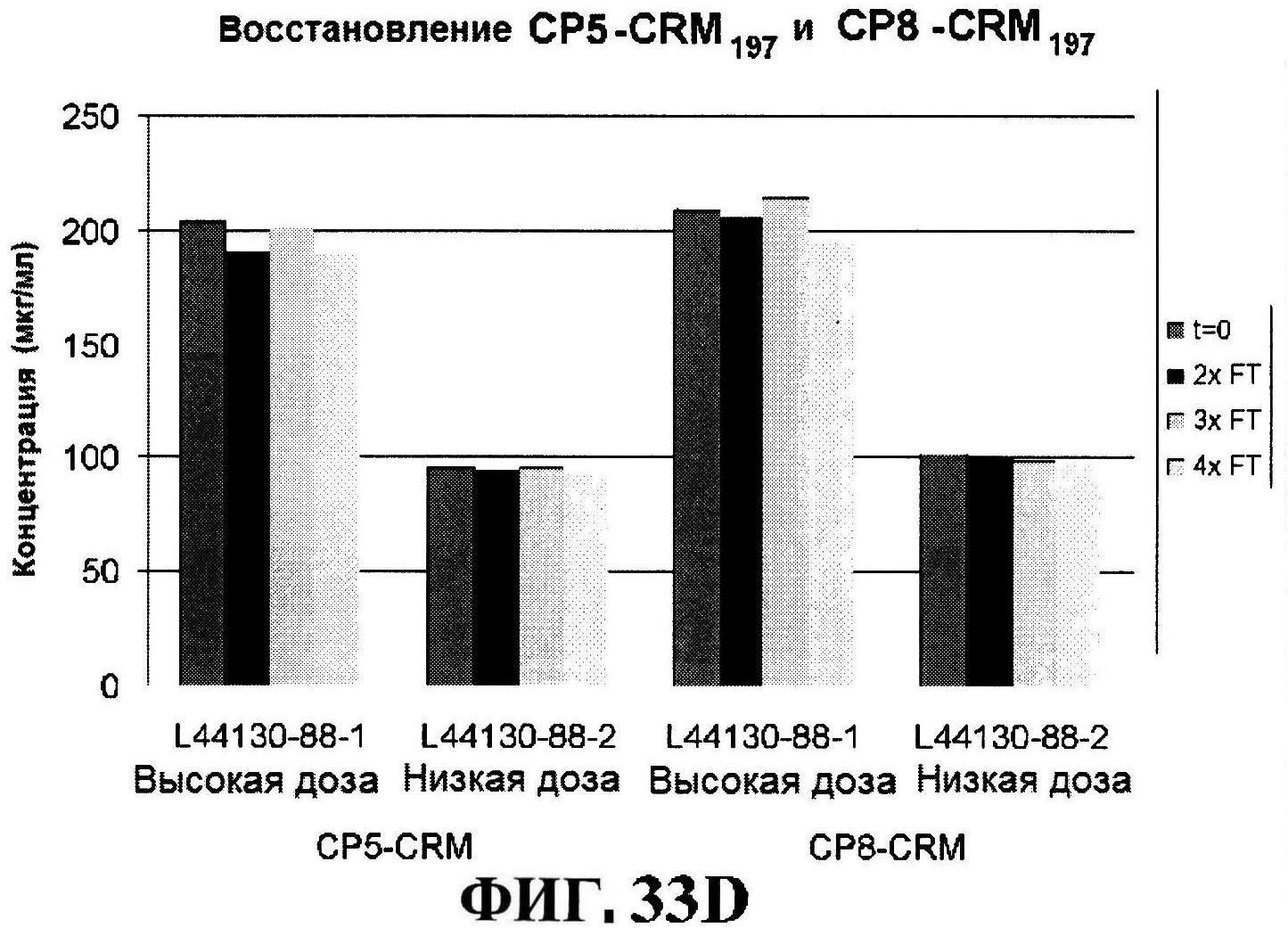
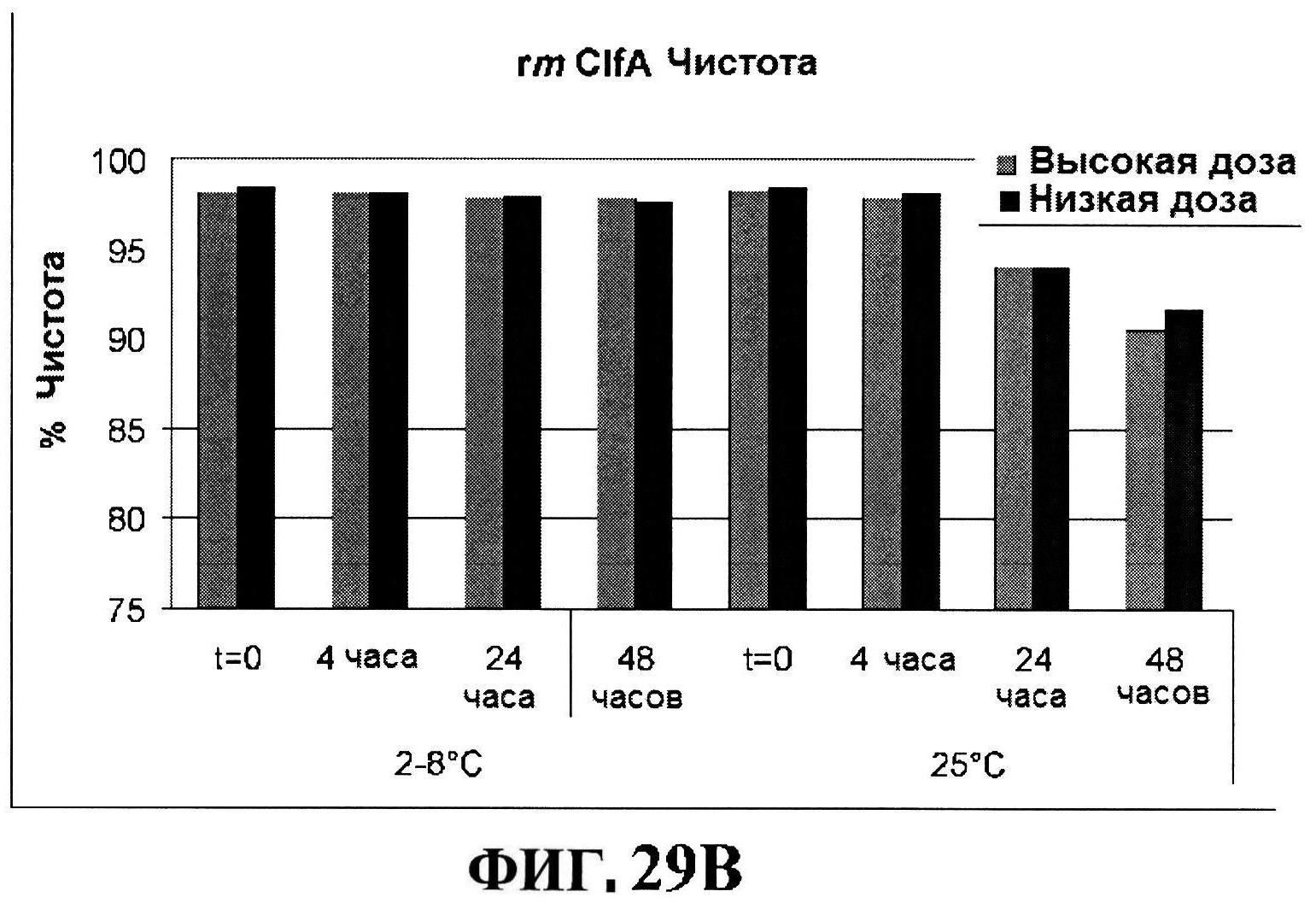
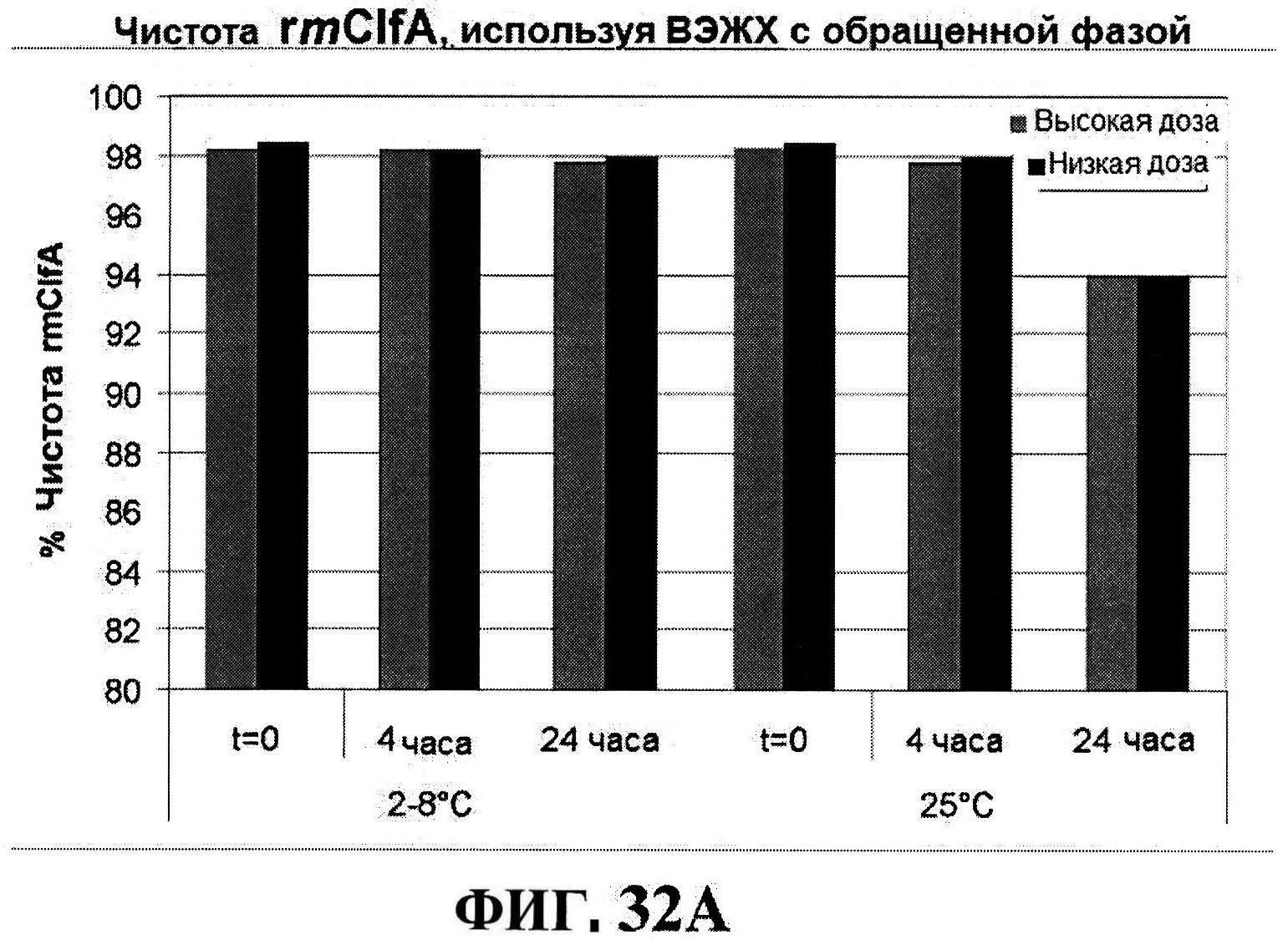
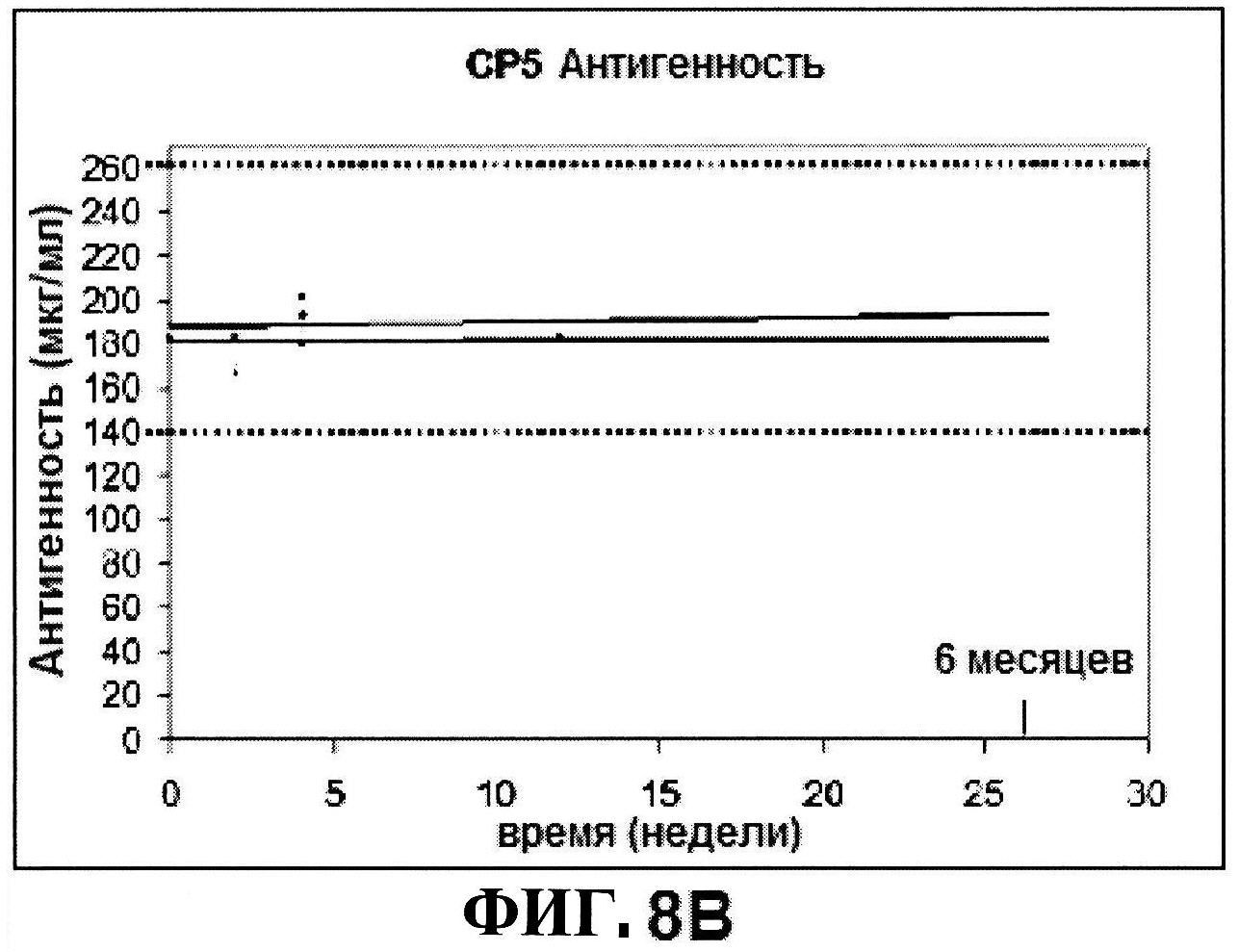
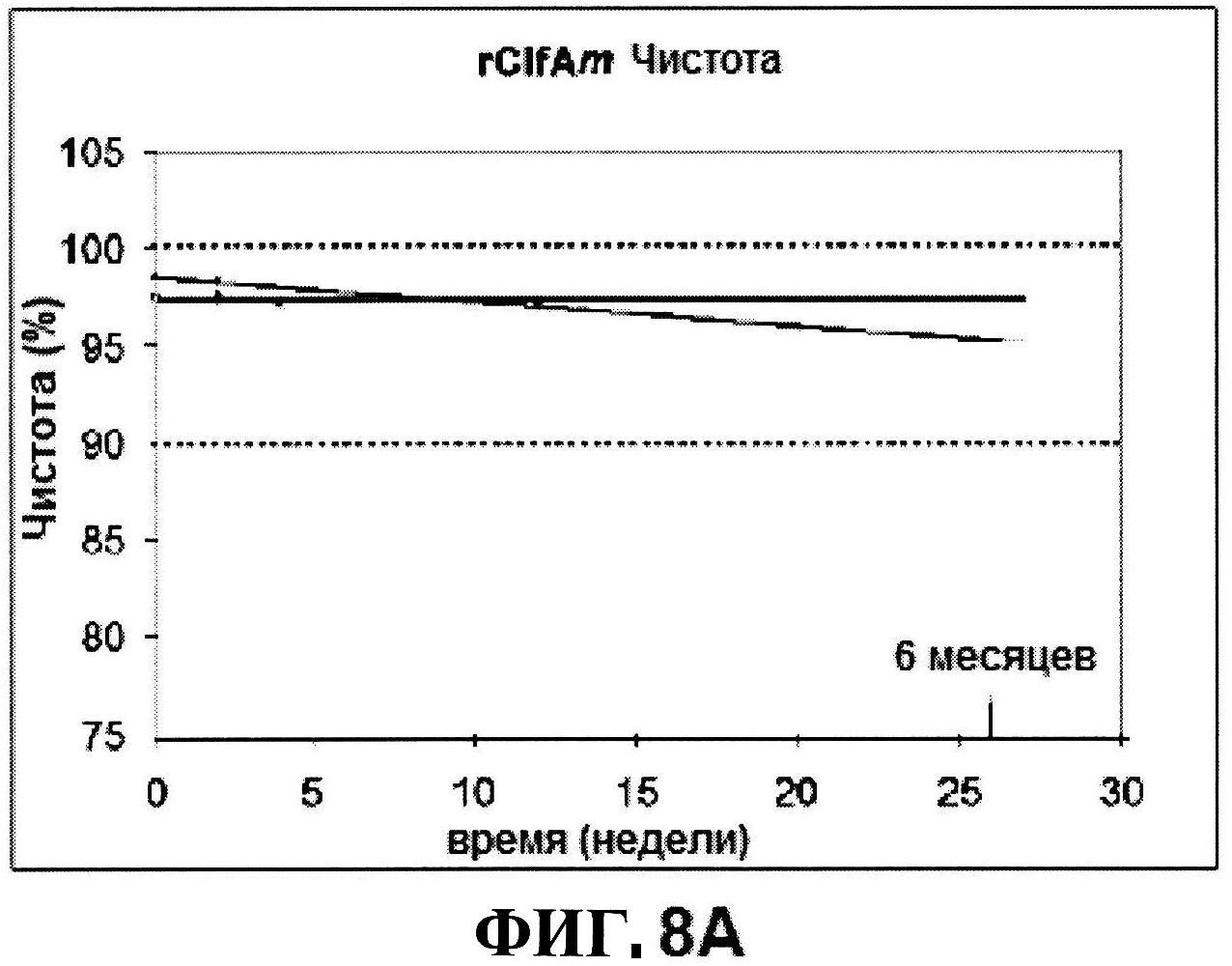
[0055] На фигуре 8 представлены чистота ClfA (панель A), эффективность (антигенные свойства) СР5 (панель В) и эффективность (антигенные свойства) СР8 в различные периоды времени после восстановления высоко дозированных лиофилизированных таблеток.
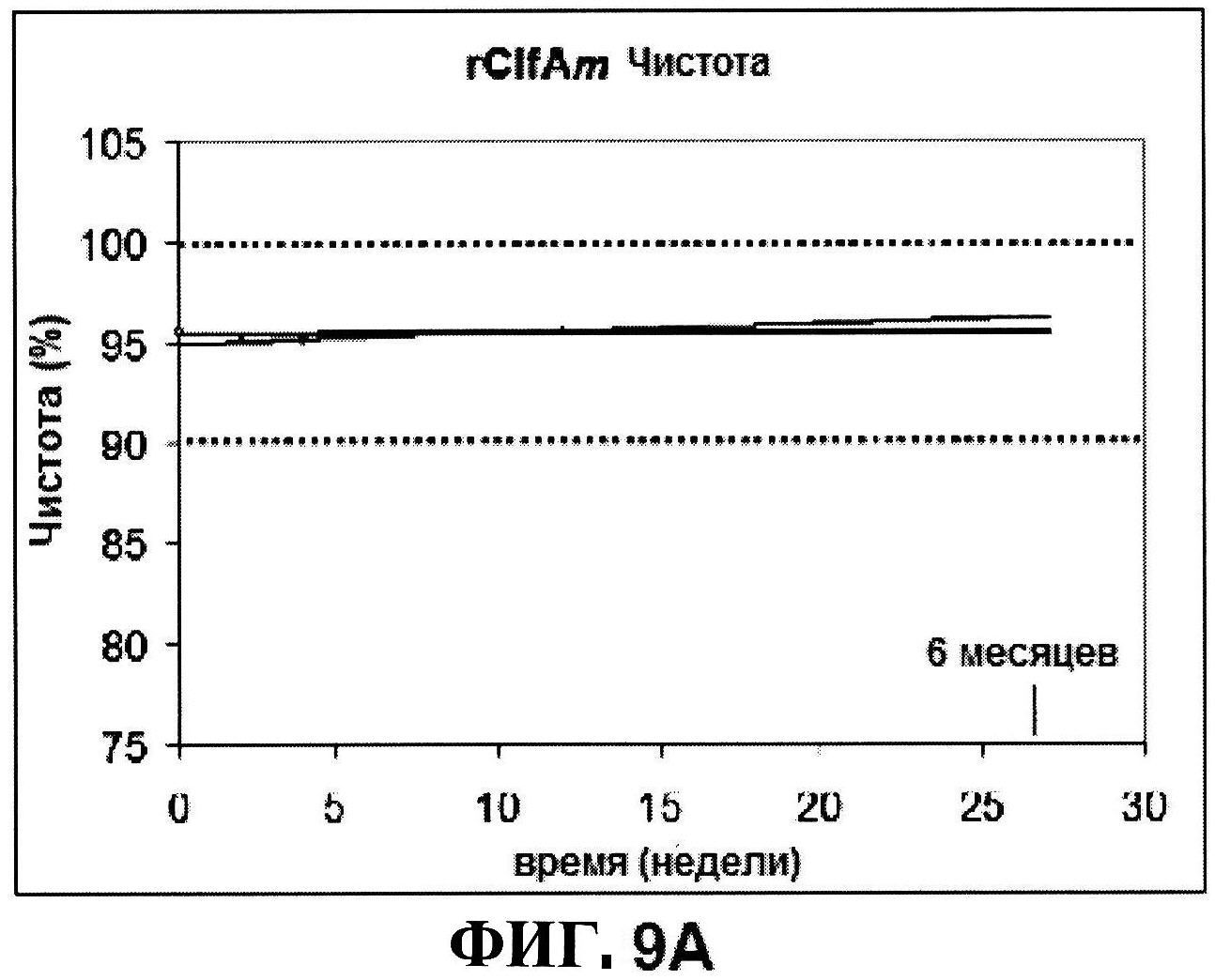
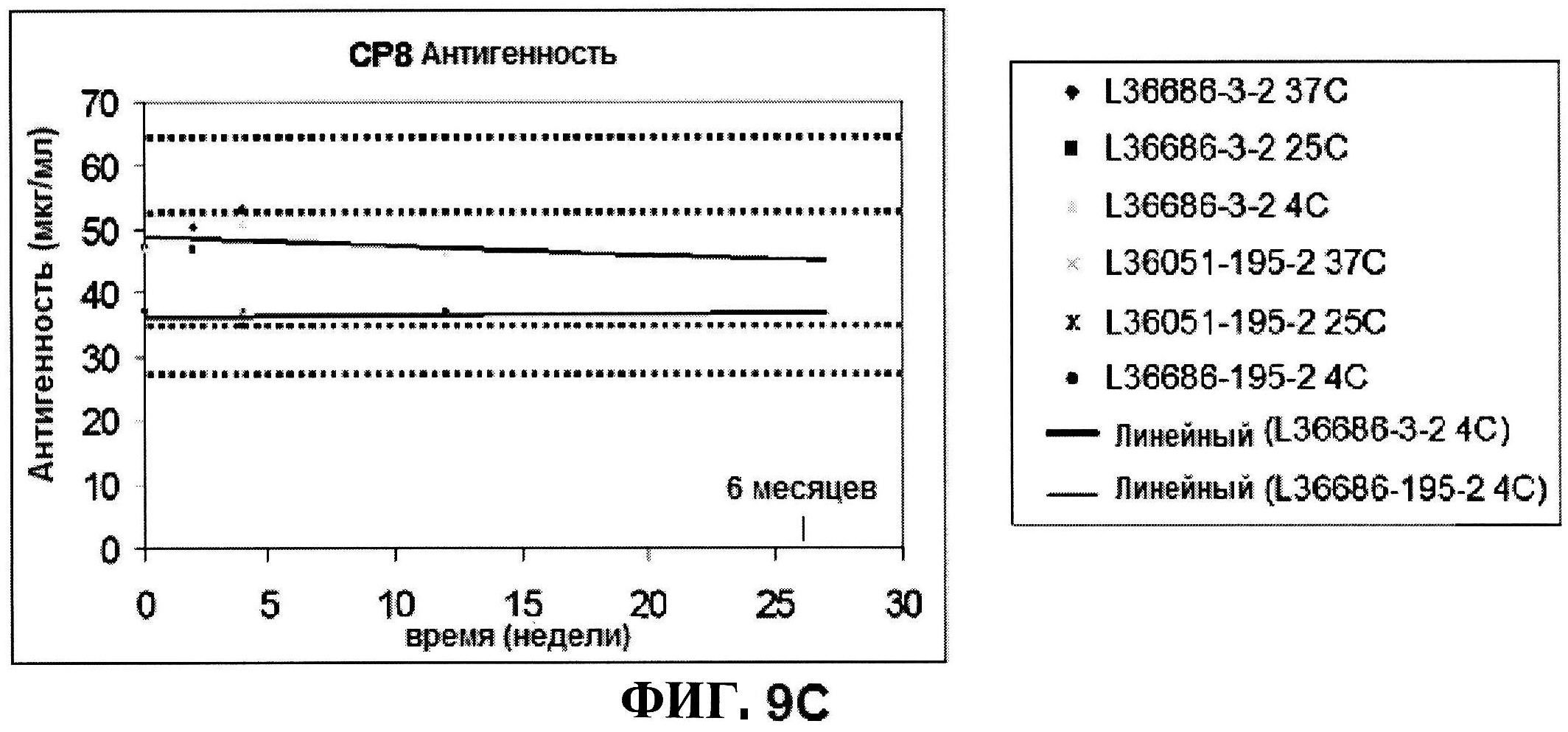
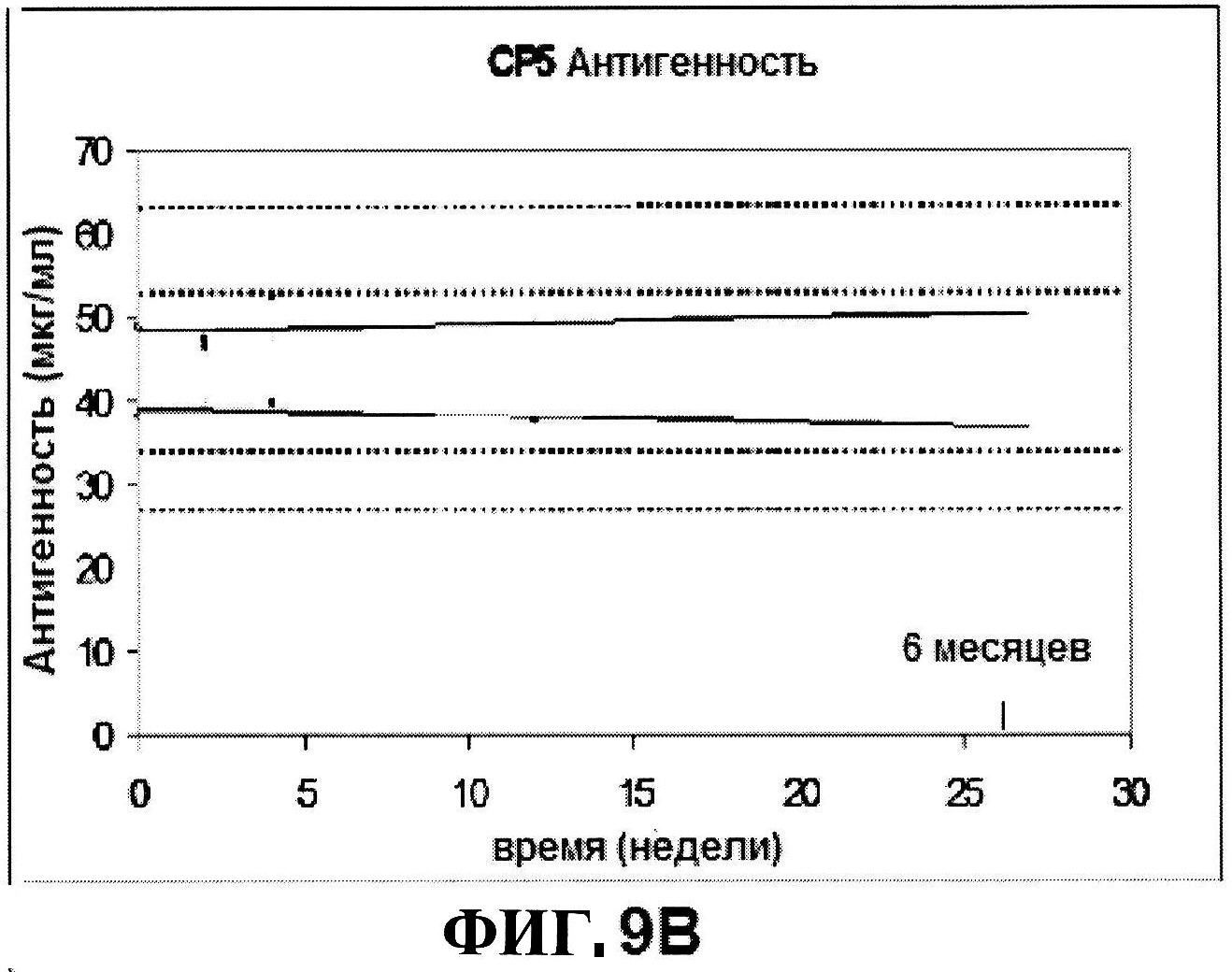
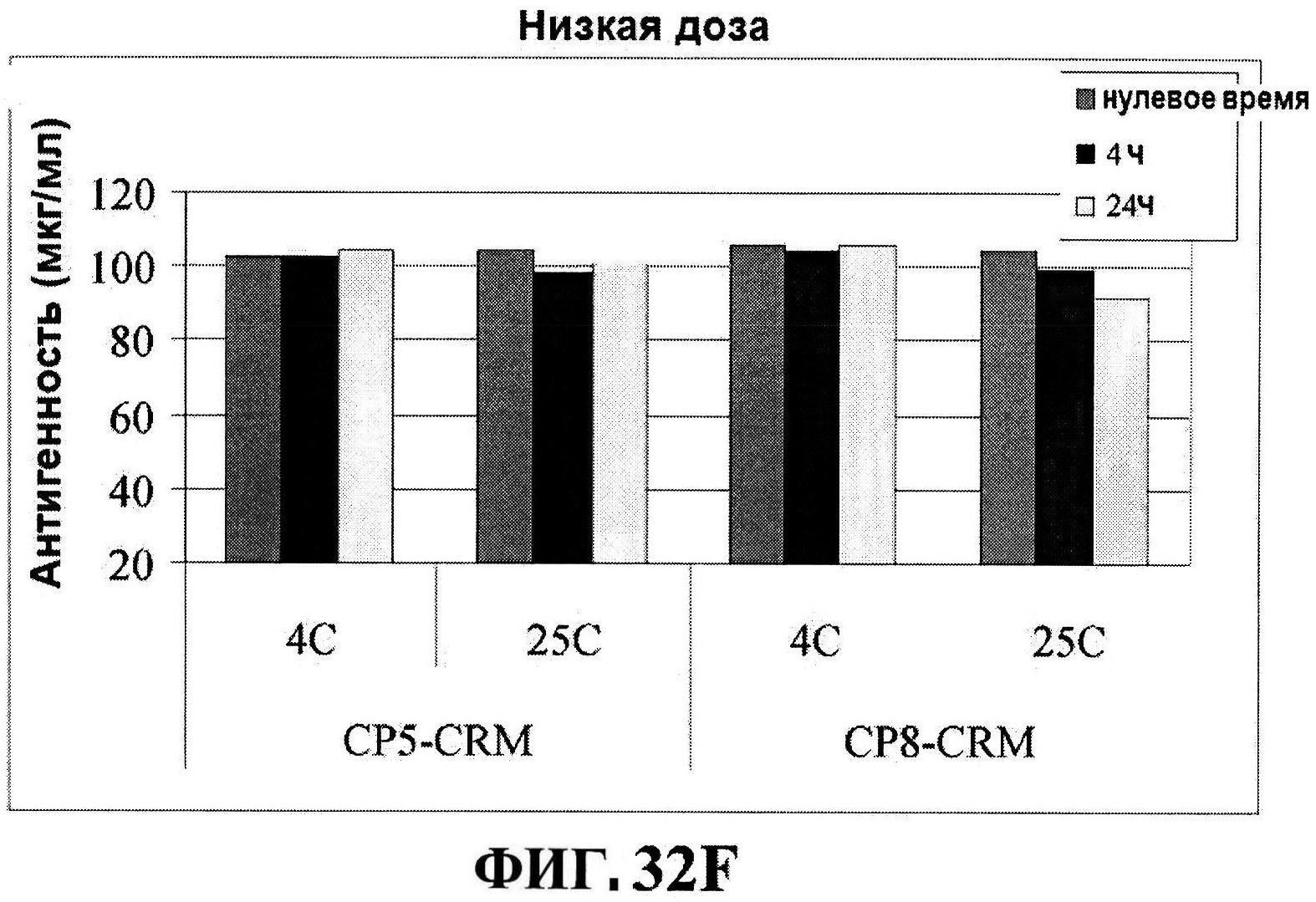
[0056] На фигуре 9 представлены чистота ClfA (панель A), эффективность (антигенные свойства) СР5 (панель B) и эффективность (антигенные свойства) СР8 в различные периоды времени после восстановления низко дозированных лиофилизированных таблеток.
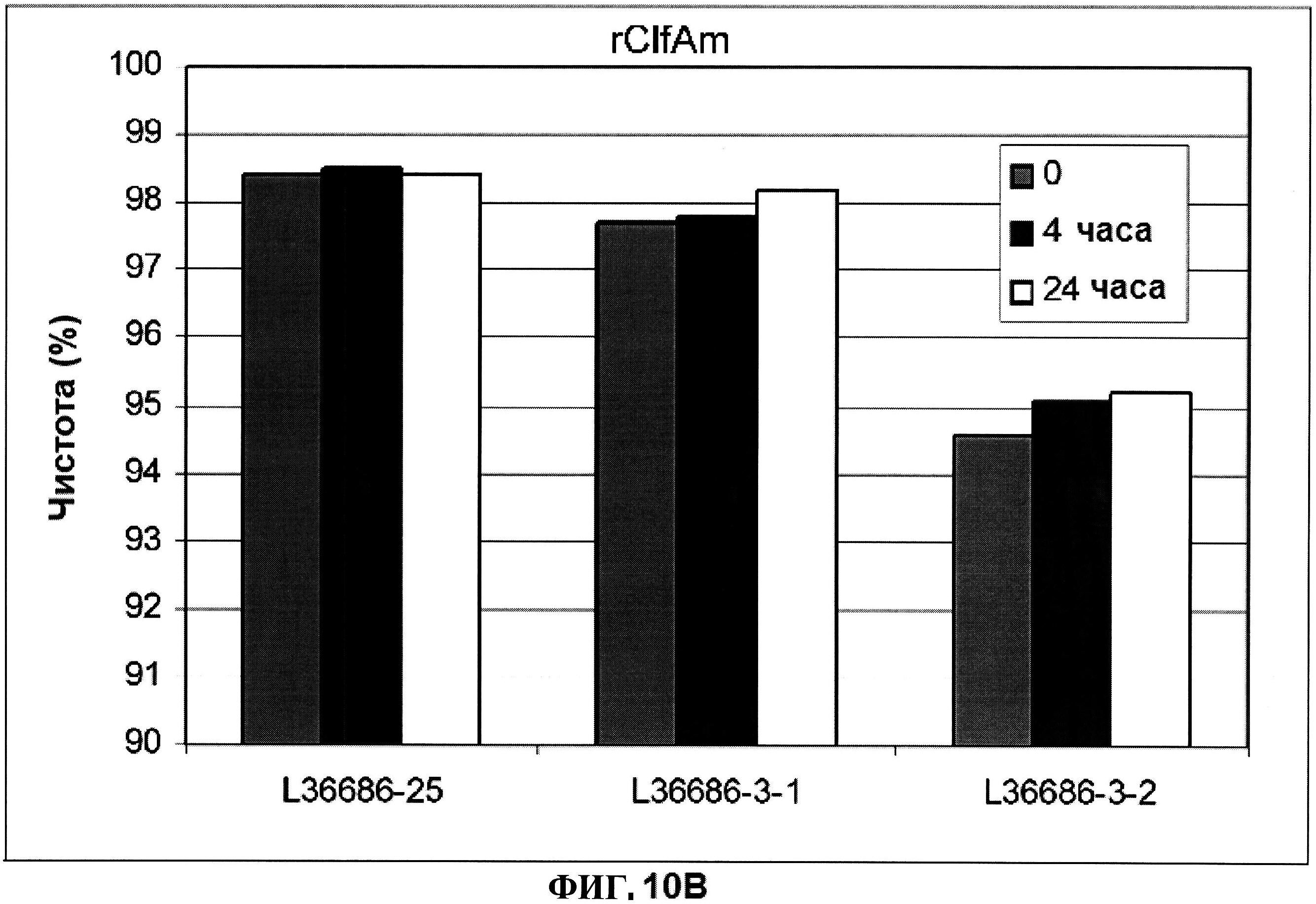
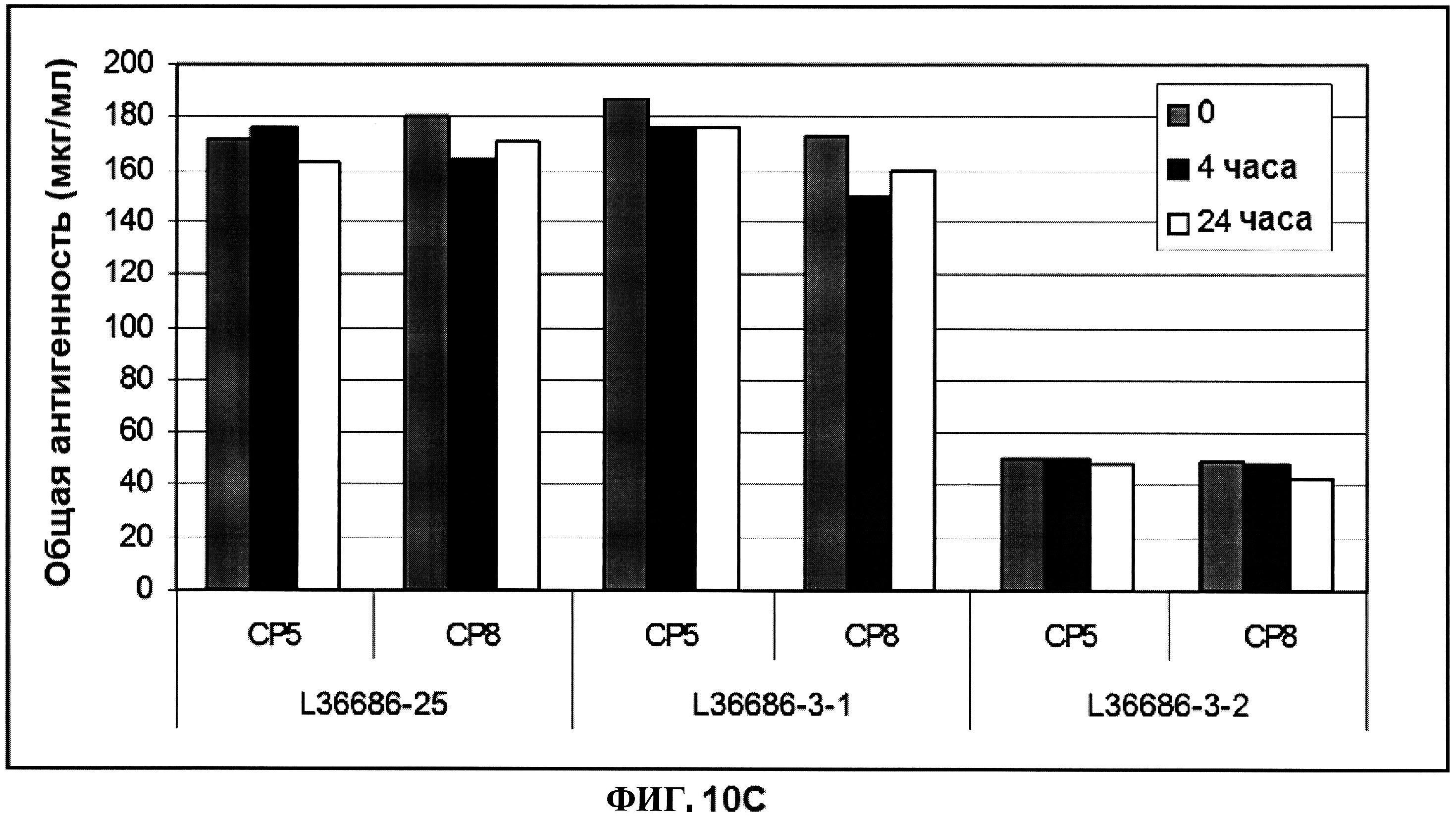
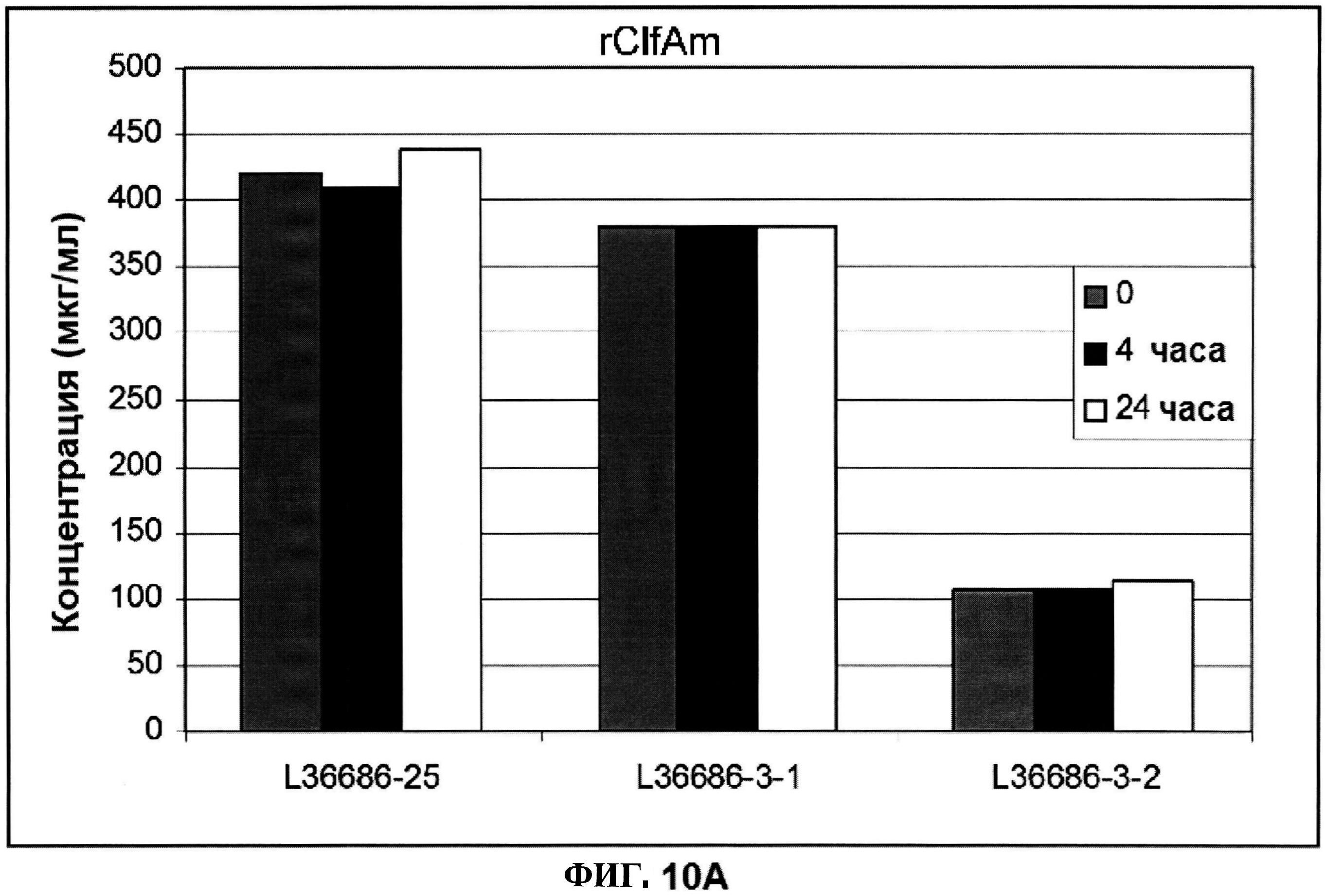
[0057] На фигуре 10 представлены концентрация (панель A) и процентная чистота (панель B) ClfA, и концентрация СР5 и СР8 (панель C) через 0, 4 и 24 часа при комнатной температуре после восстановления.
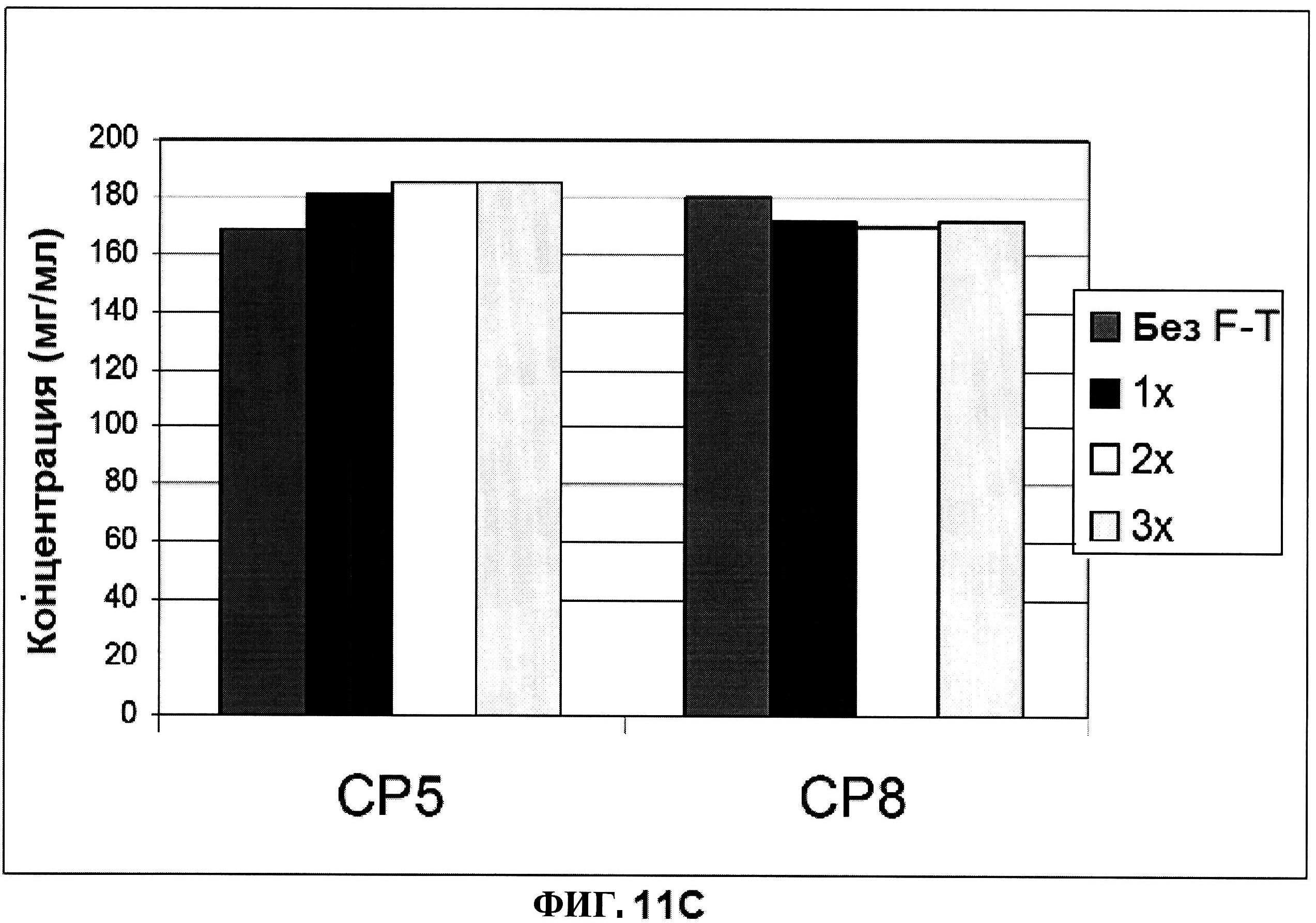
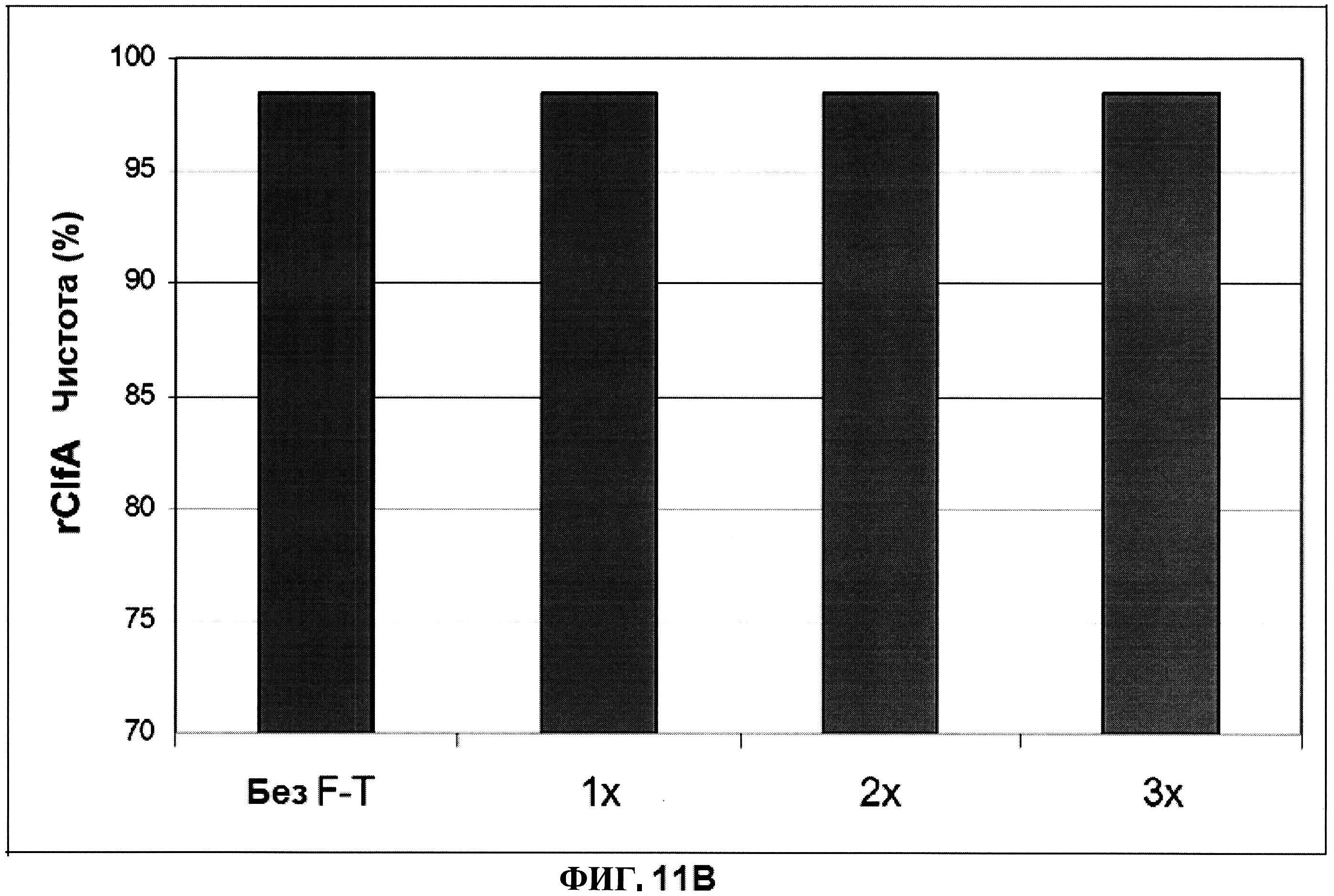
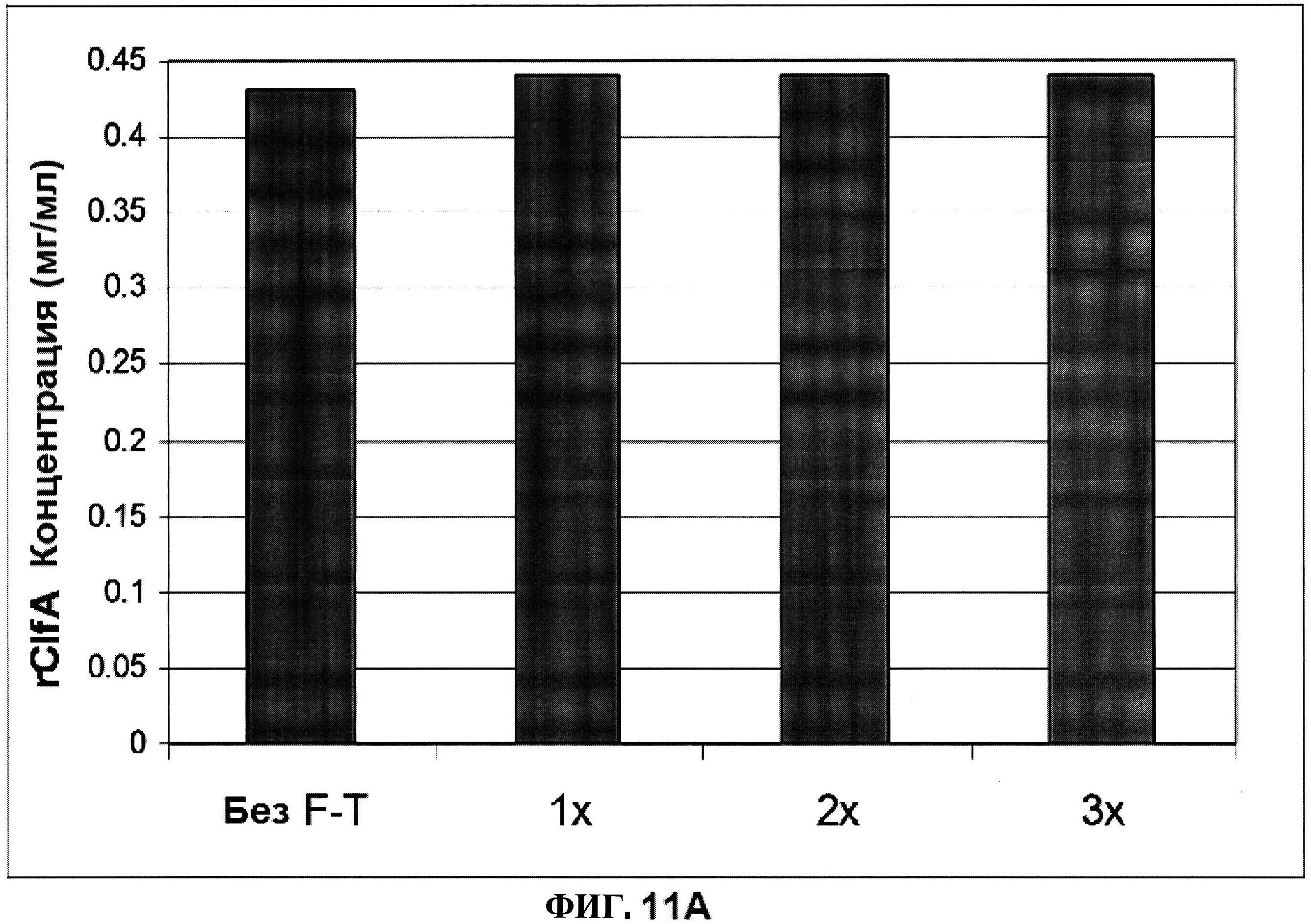
[0058] На фигуре 11 представлена концентрация (панель A) и процентная чистота (панель B) ClfA, и концентрация СР5 и СР8 (панель C) после 1, 2 и 3 циклов замораживания-размораживания.
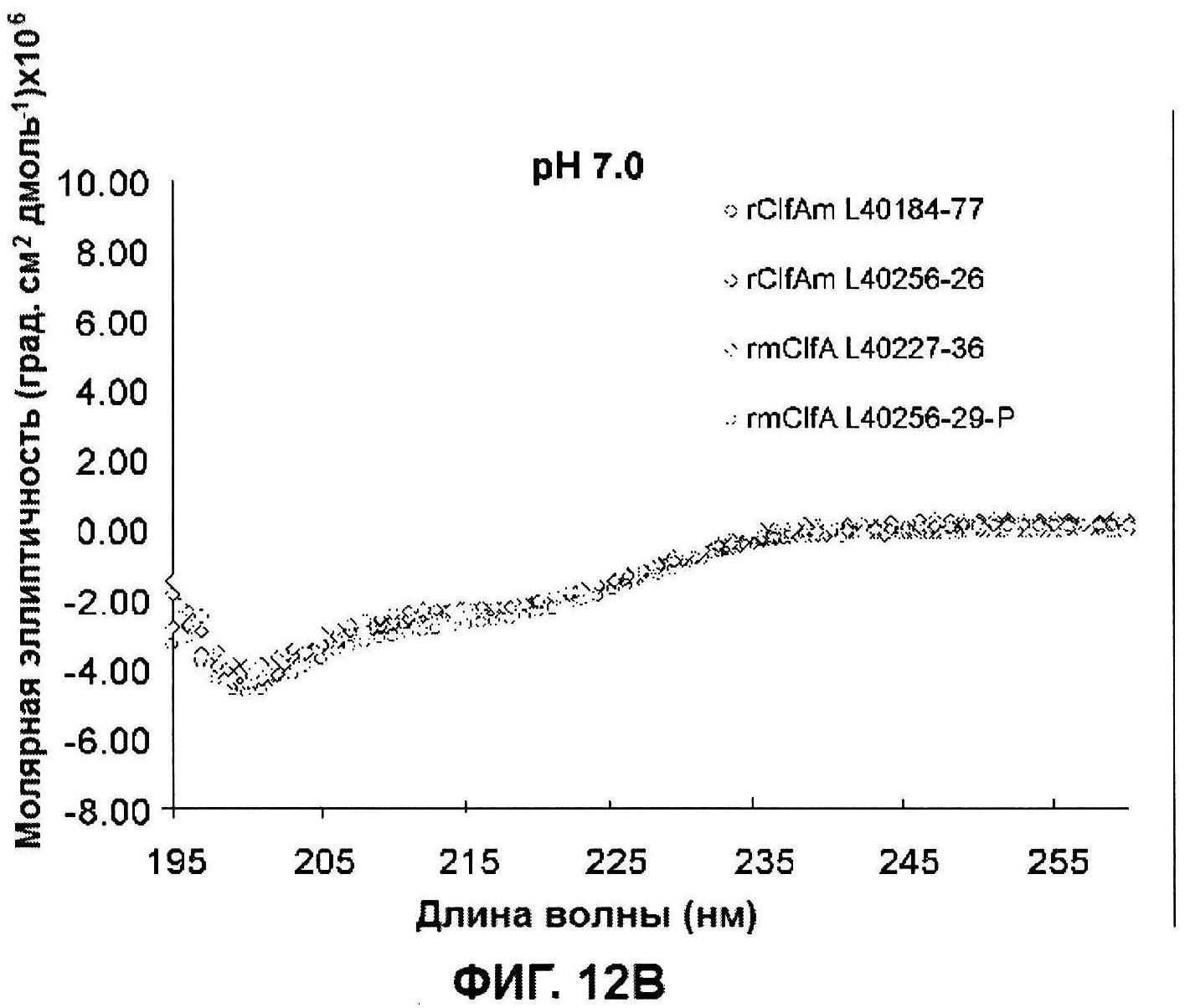
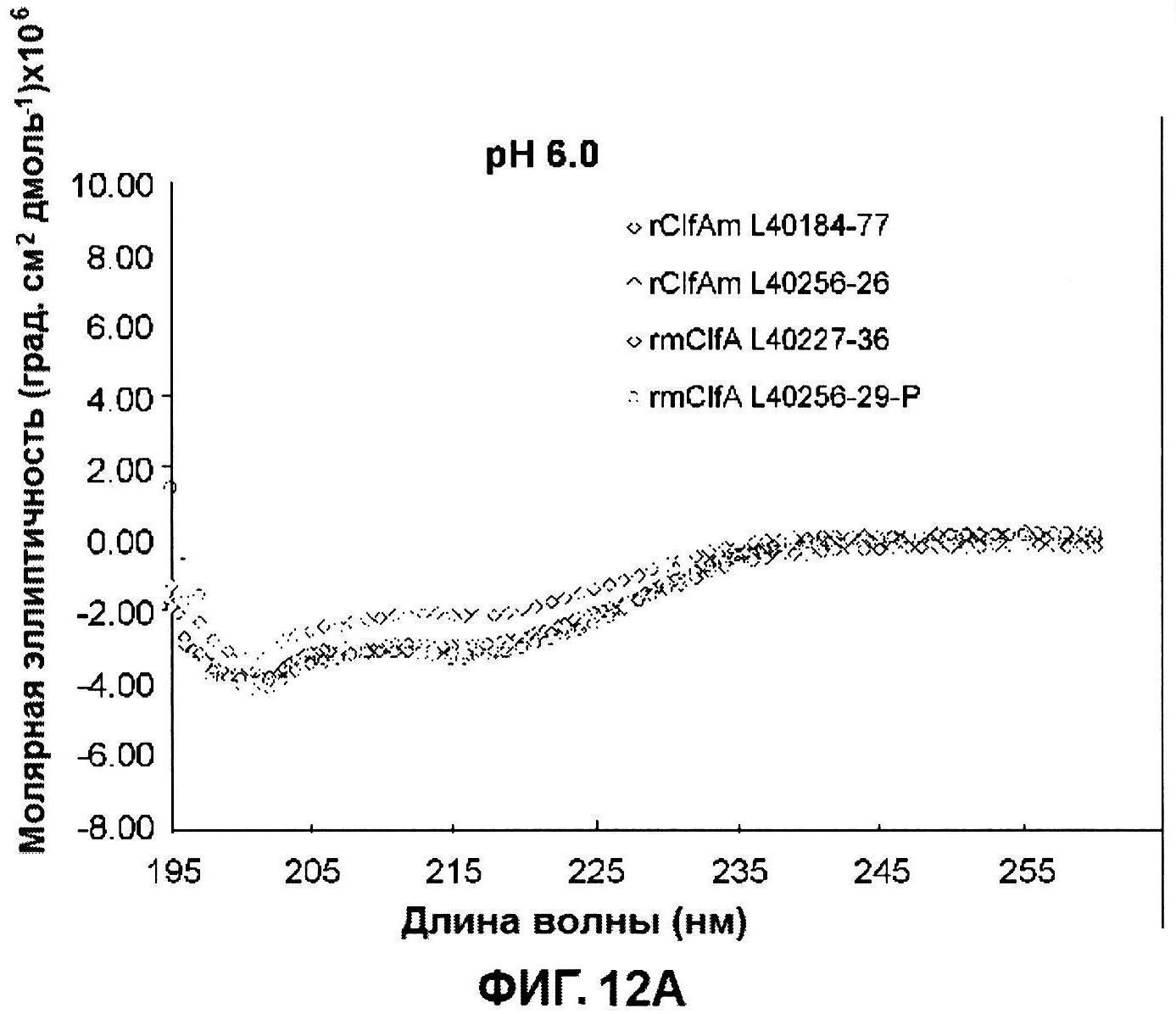
[0059] На фигуре 12 представлены сканограммы кругового дихроизма (КД) многократных серий rClfA при pH 6,0 (панель A) и 7,0 (панель В)
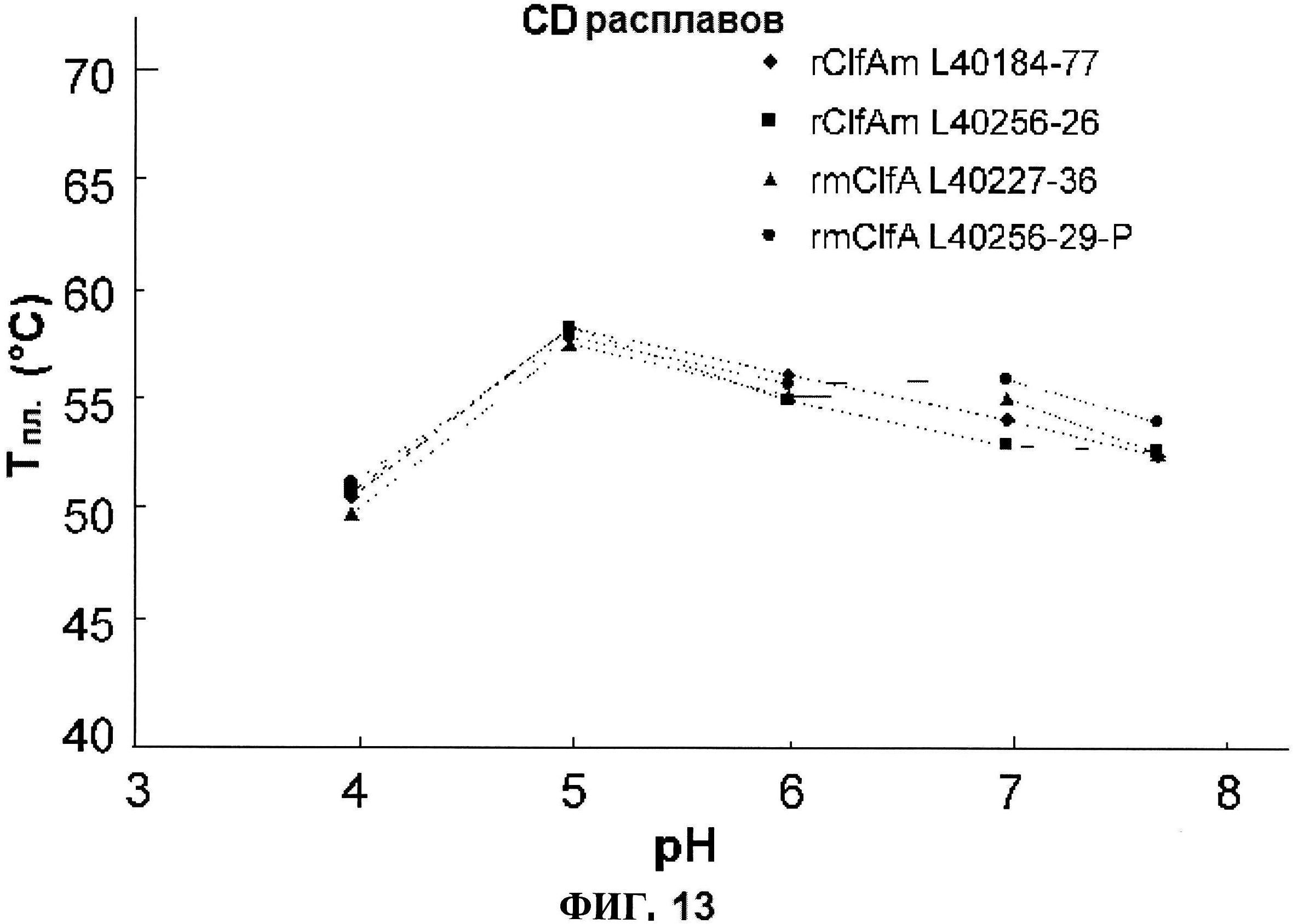
[0060] На фигуре 13 представлены КД расплавов многократных серий rClfA как функция pH.
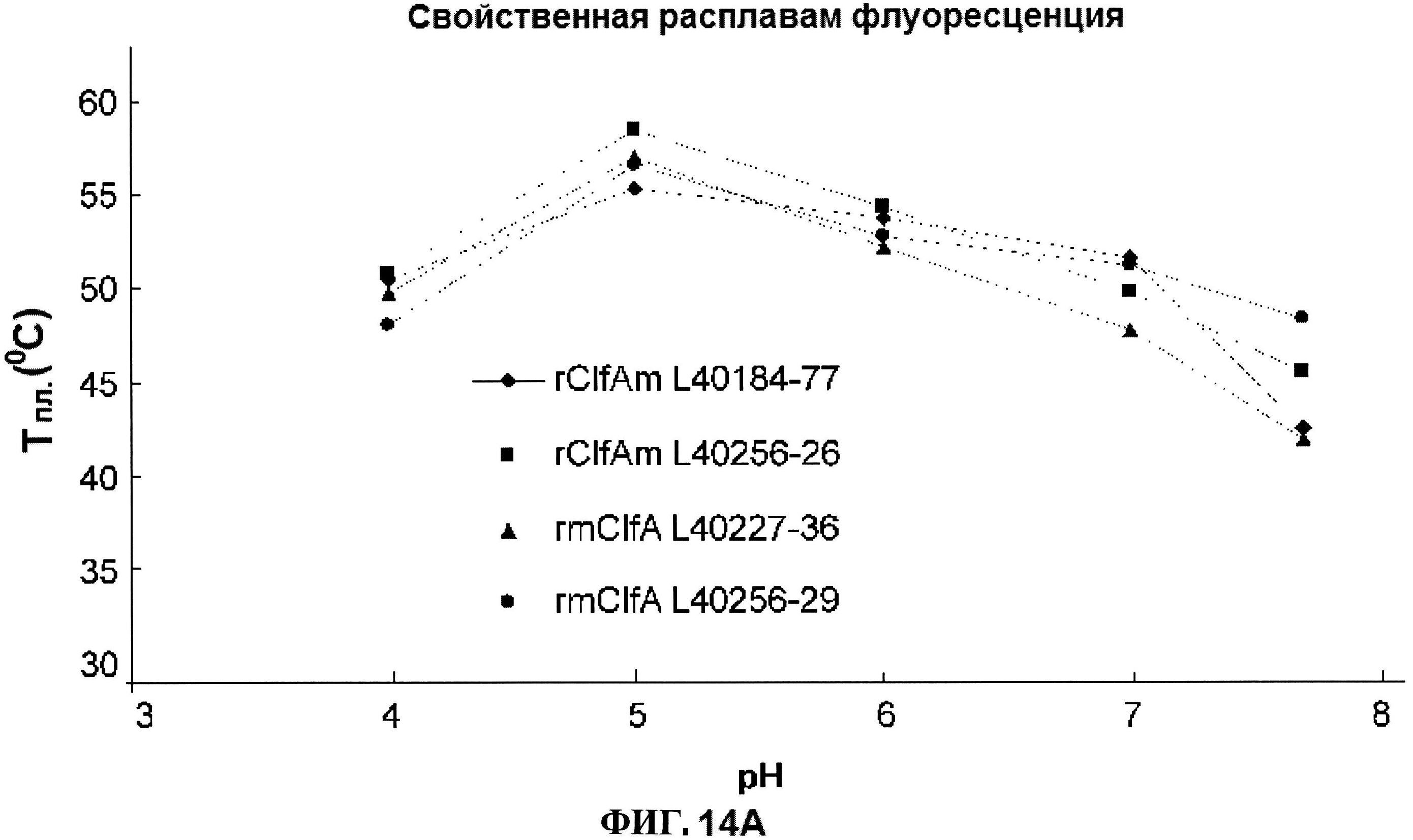
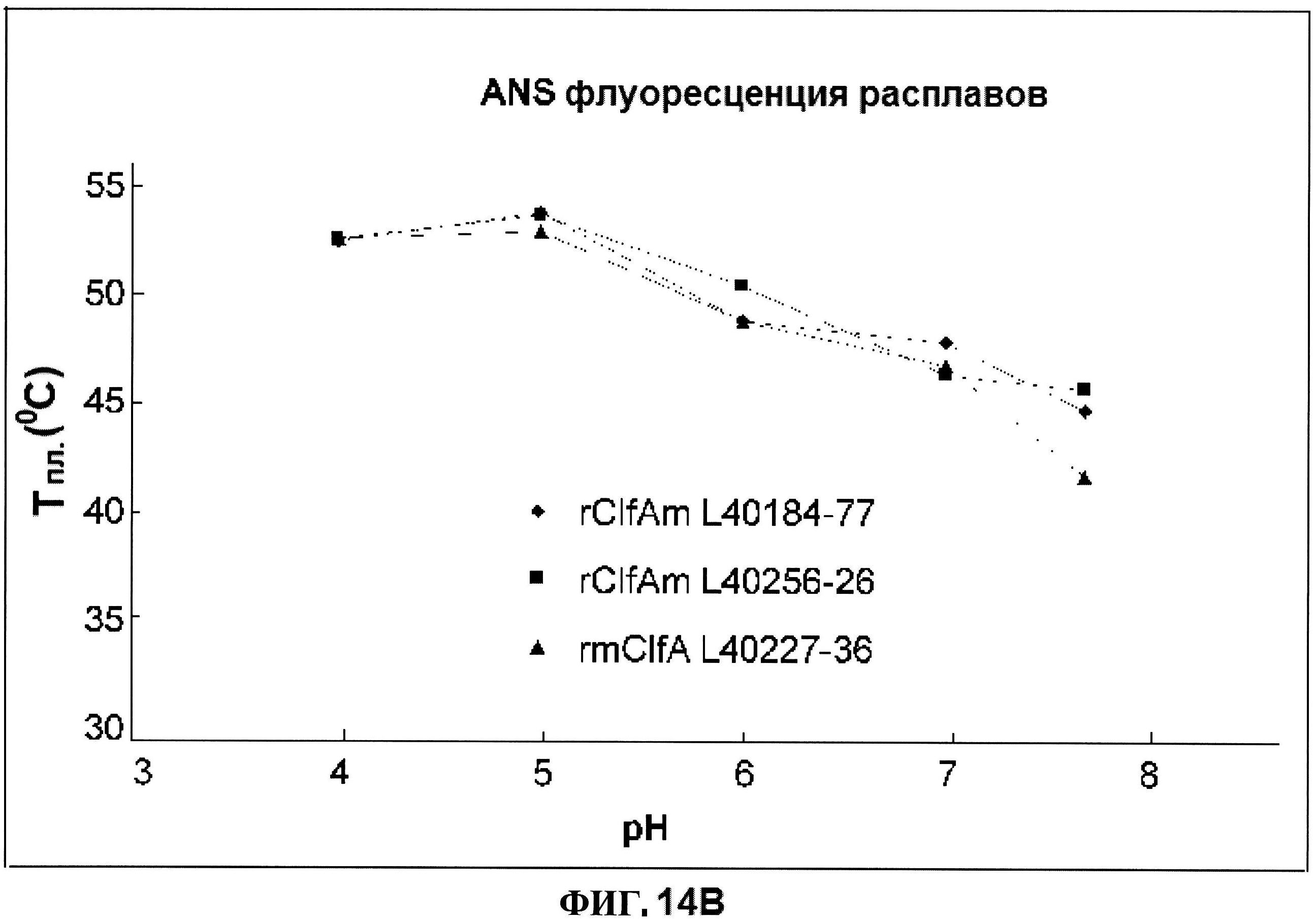
[0061] На фигуре 14 представлена истинная флуоресценция триптофана (панель А) и флуоресценция расплавов ANS (панель В), как функция pH для rClfAm и rmClfA.
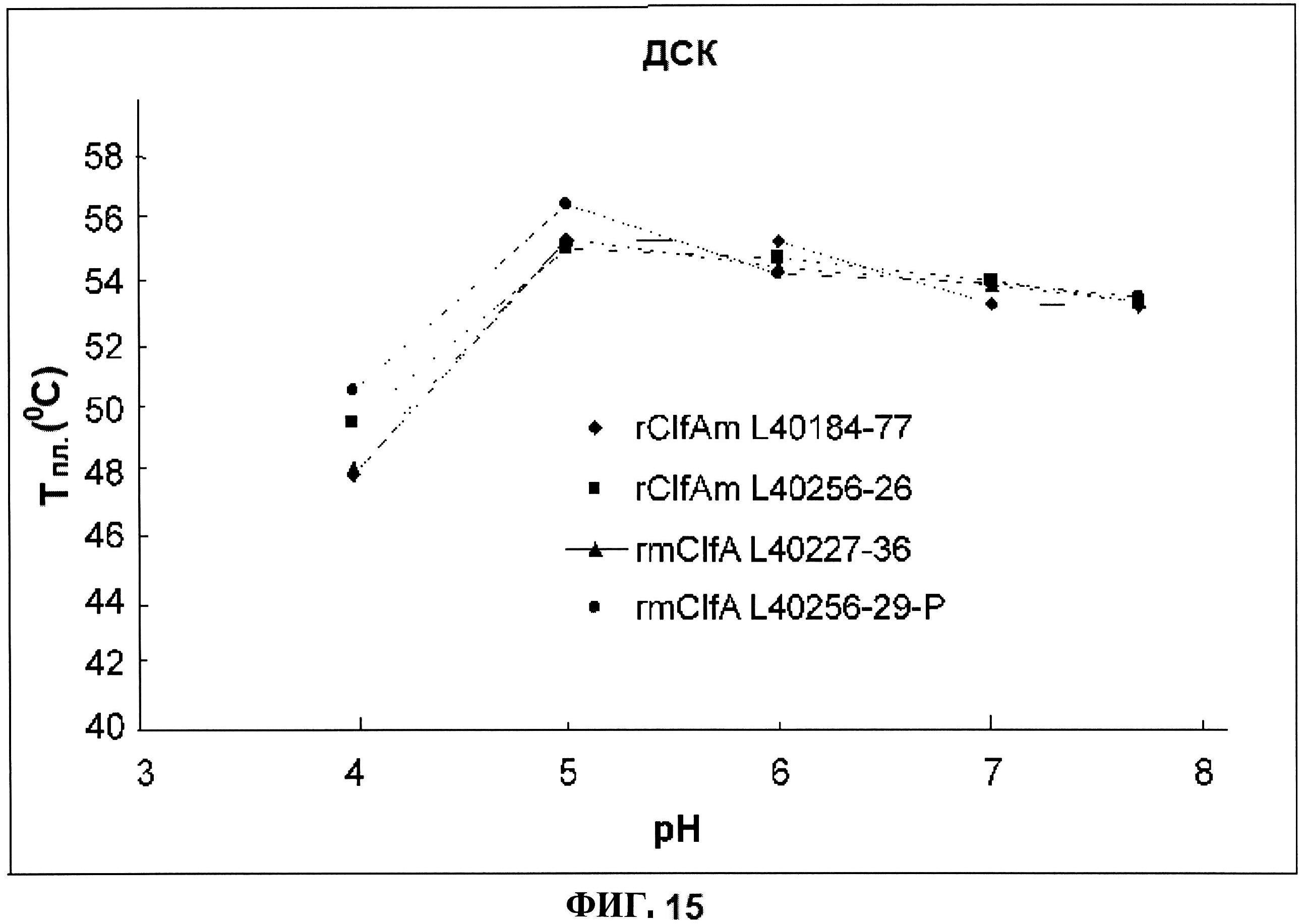
[0062] На фигуре 15 представлена дифференциальная сканирующая калориметрия (ДСК) расплавов, как функция pH для rClfAm и rmClfA.
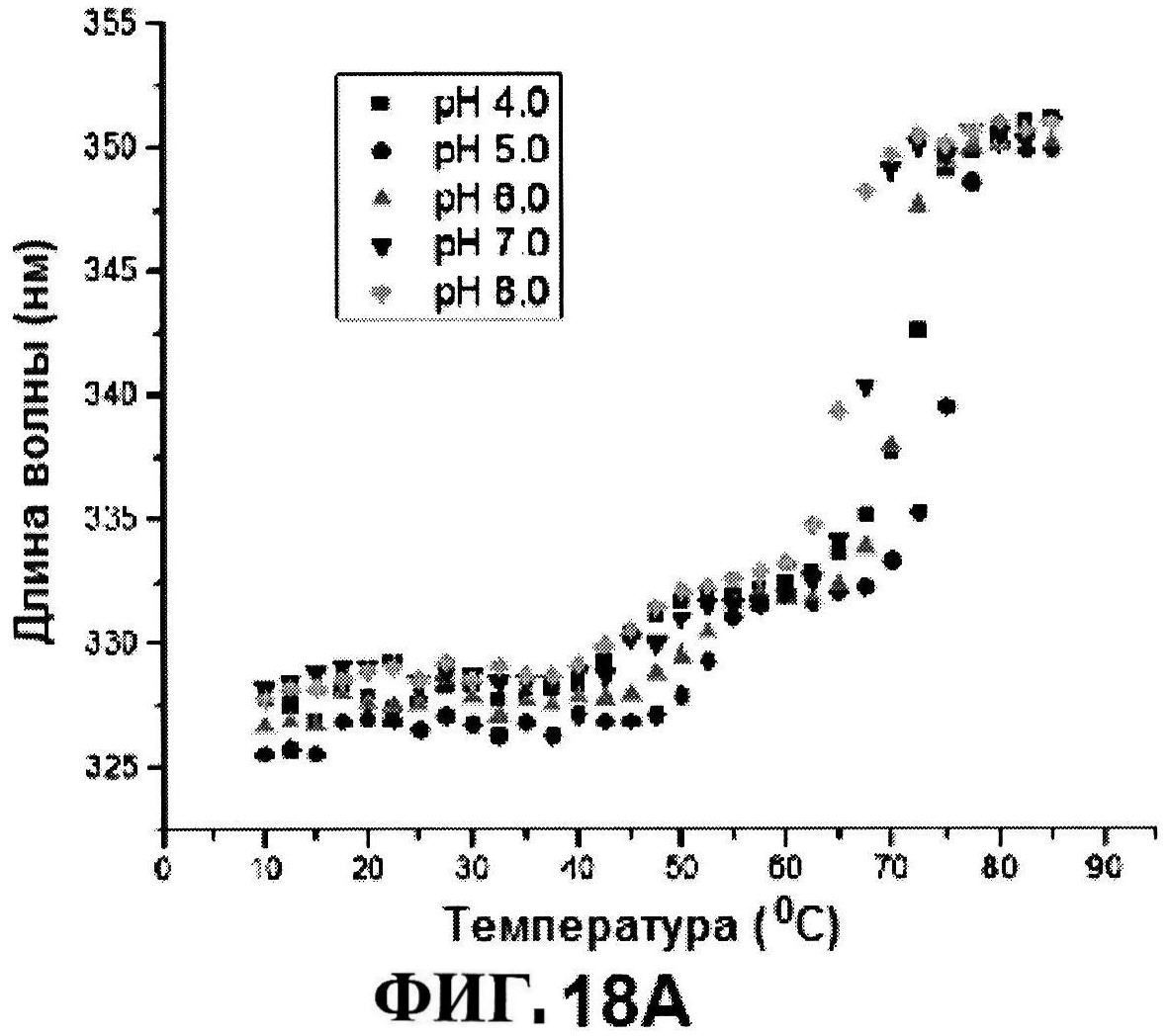
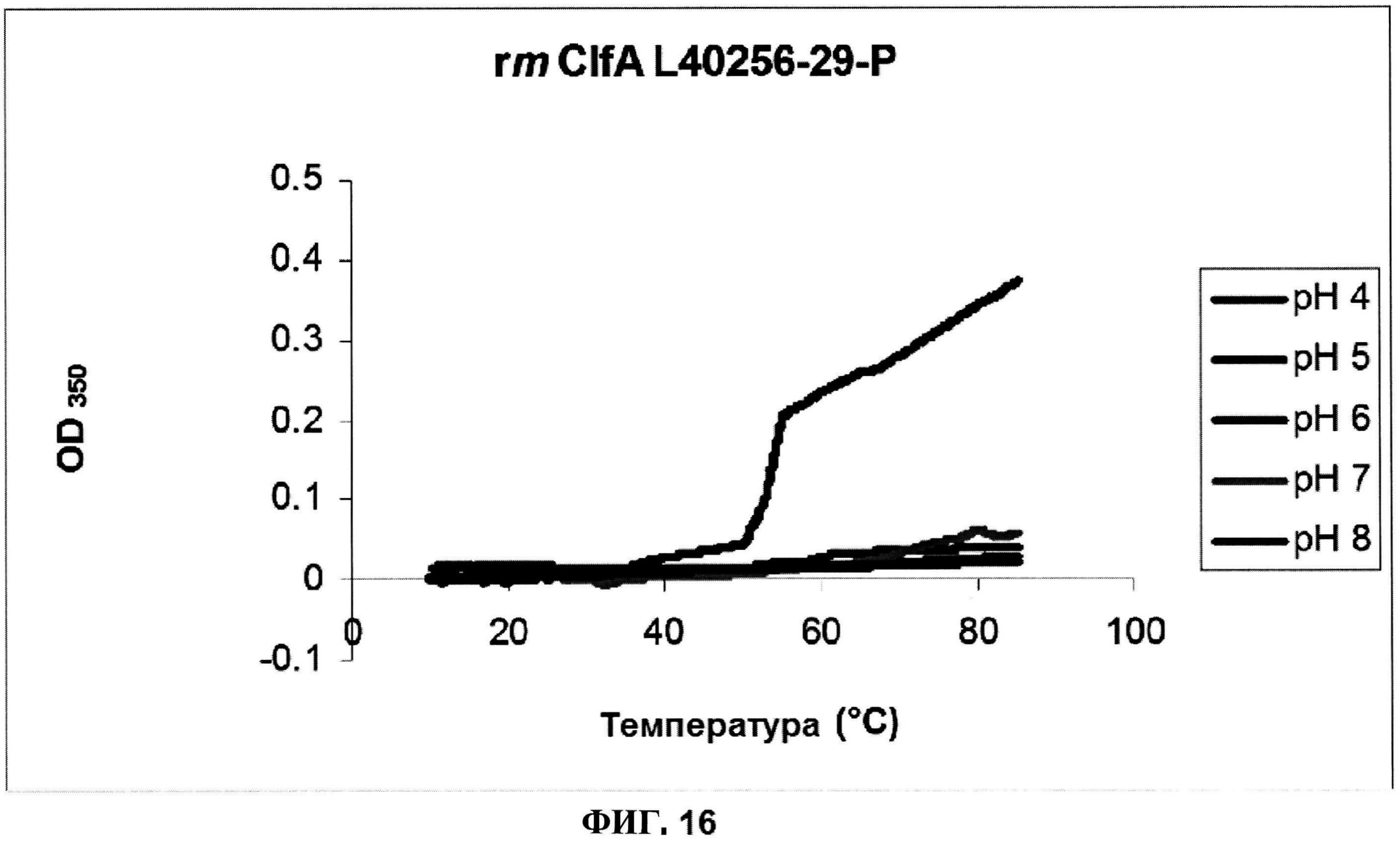
[0063] На фигуре 16 представлена OD350 расплавов rmClfA, как функция pH.
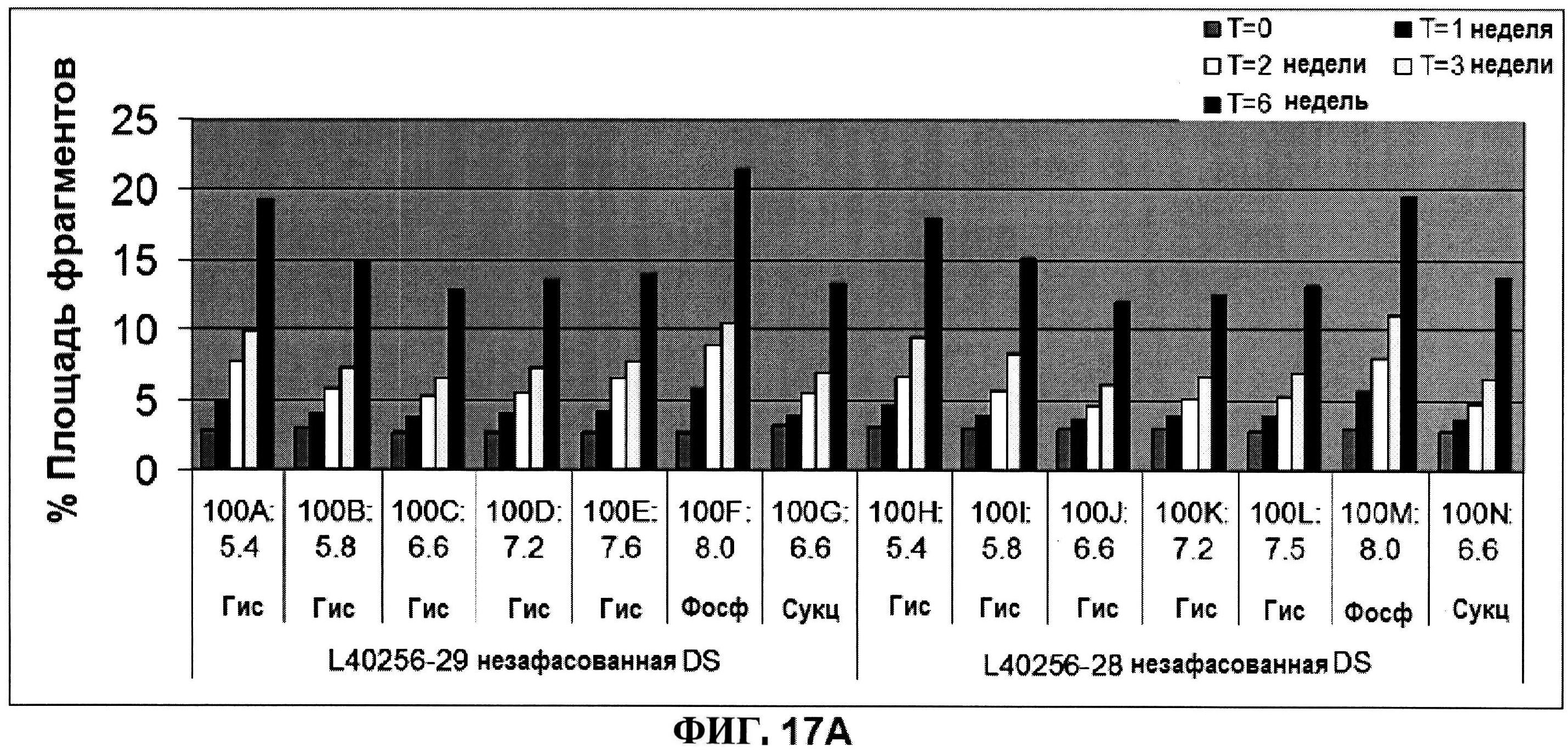
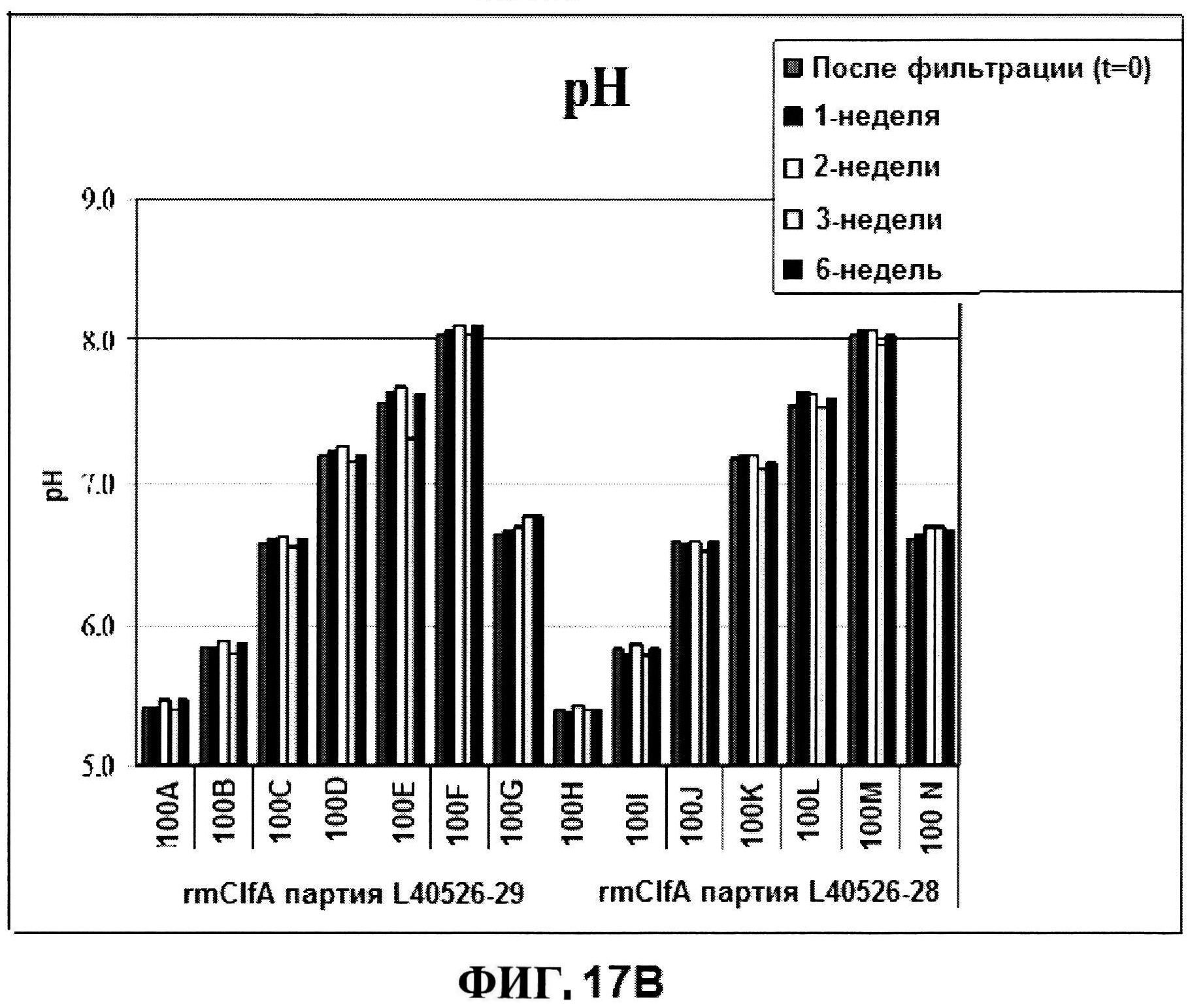
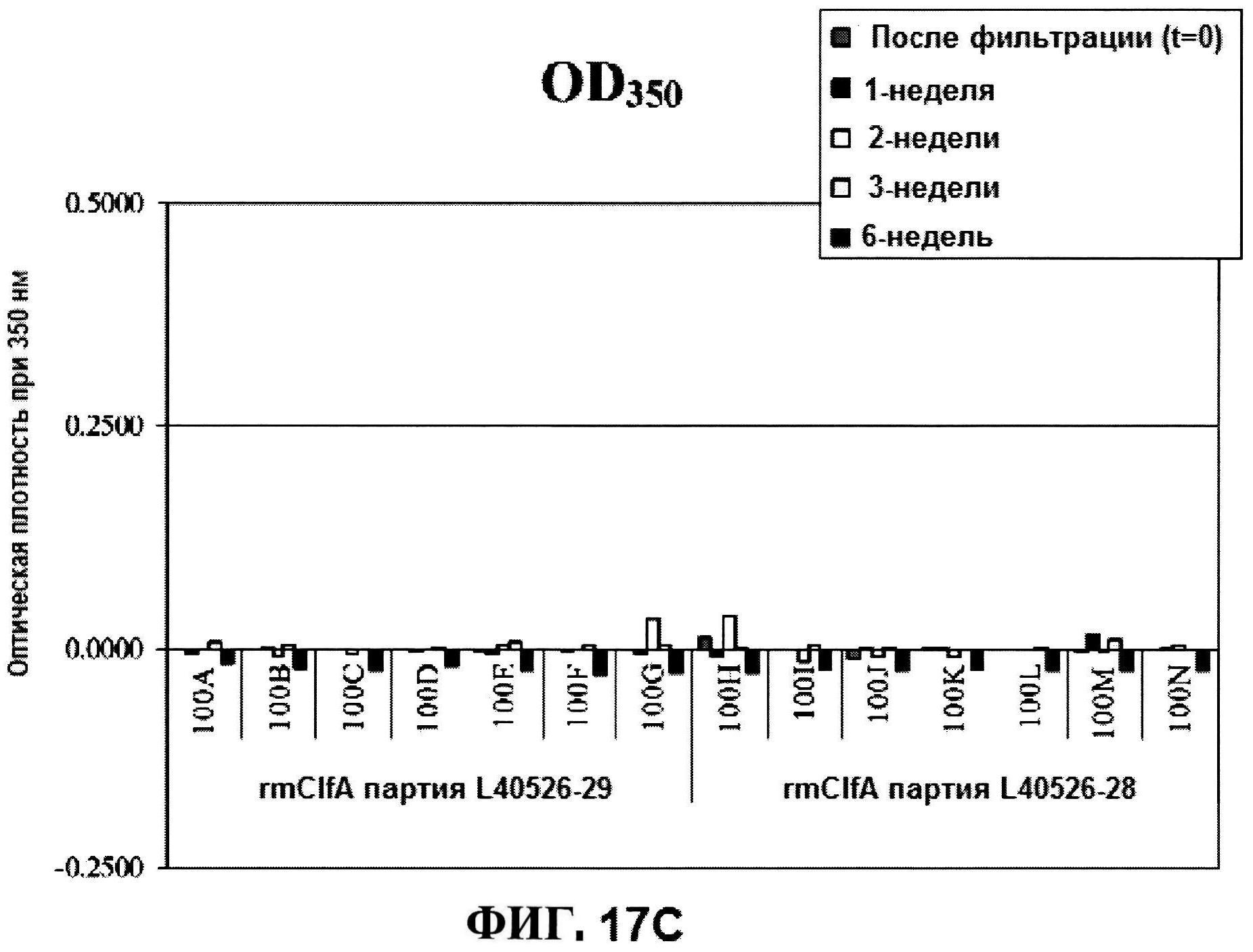
[0064] На фигуре 17 представлена эксклюзионная ВЭЖХ, как функция pH для rmClfA в течение шести недель при 25°C (панель A), и pH, и OD350 стабильности для жидких rmClfA составов (панель B).
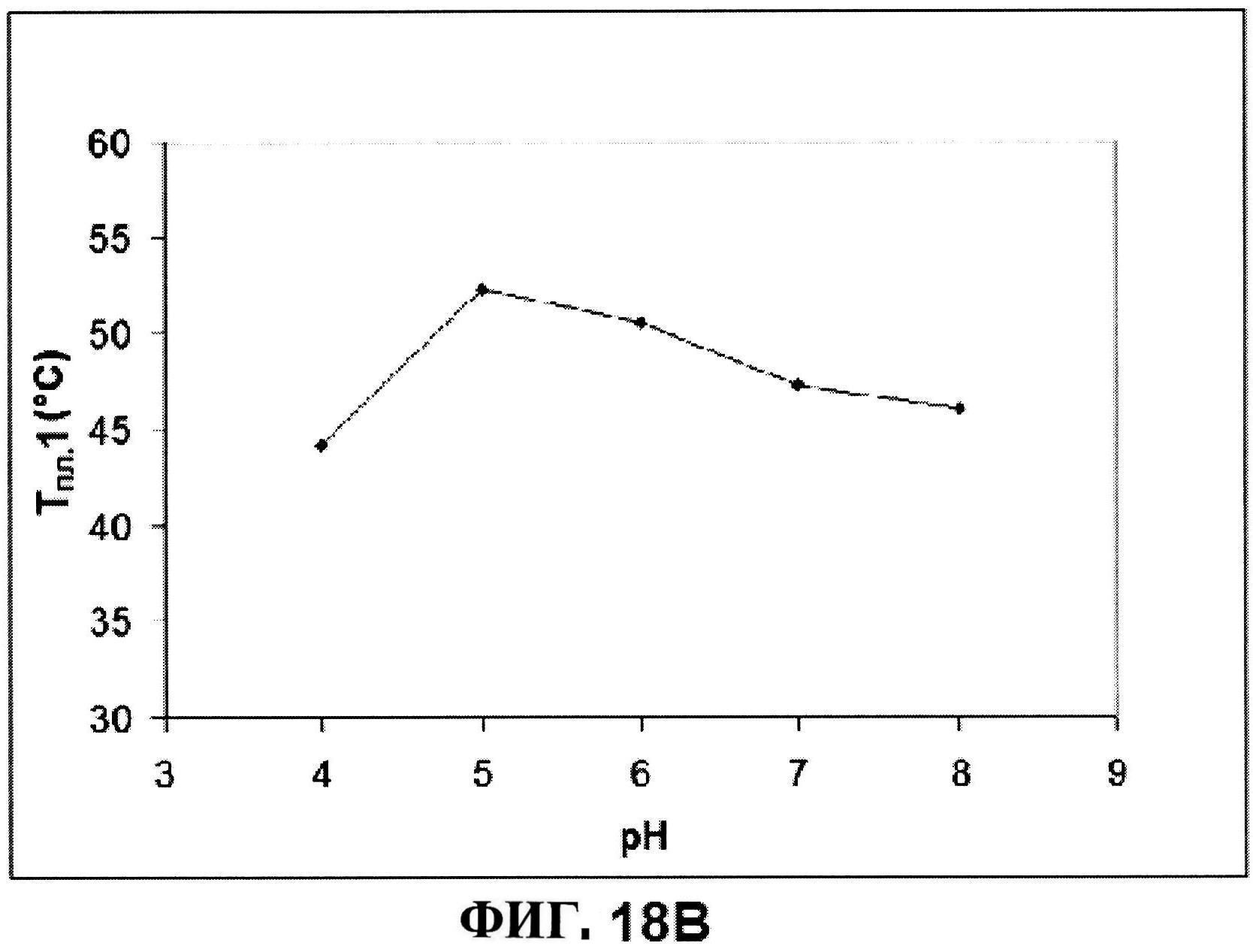
[0065] На фигуре 18 представлена истинная флуоресценция расплавов триптофана для MntC (панель A) и отслеживание Тпл. 1 (панель В).
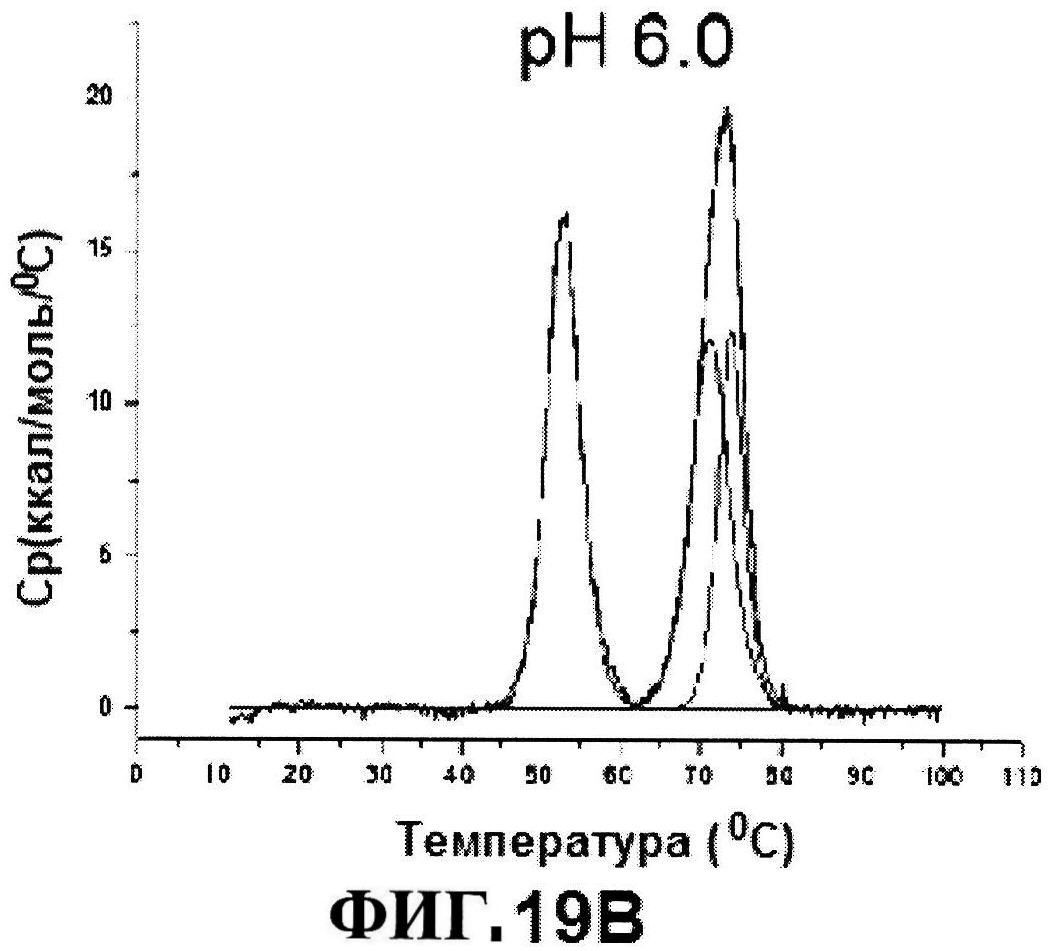
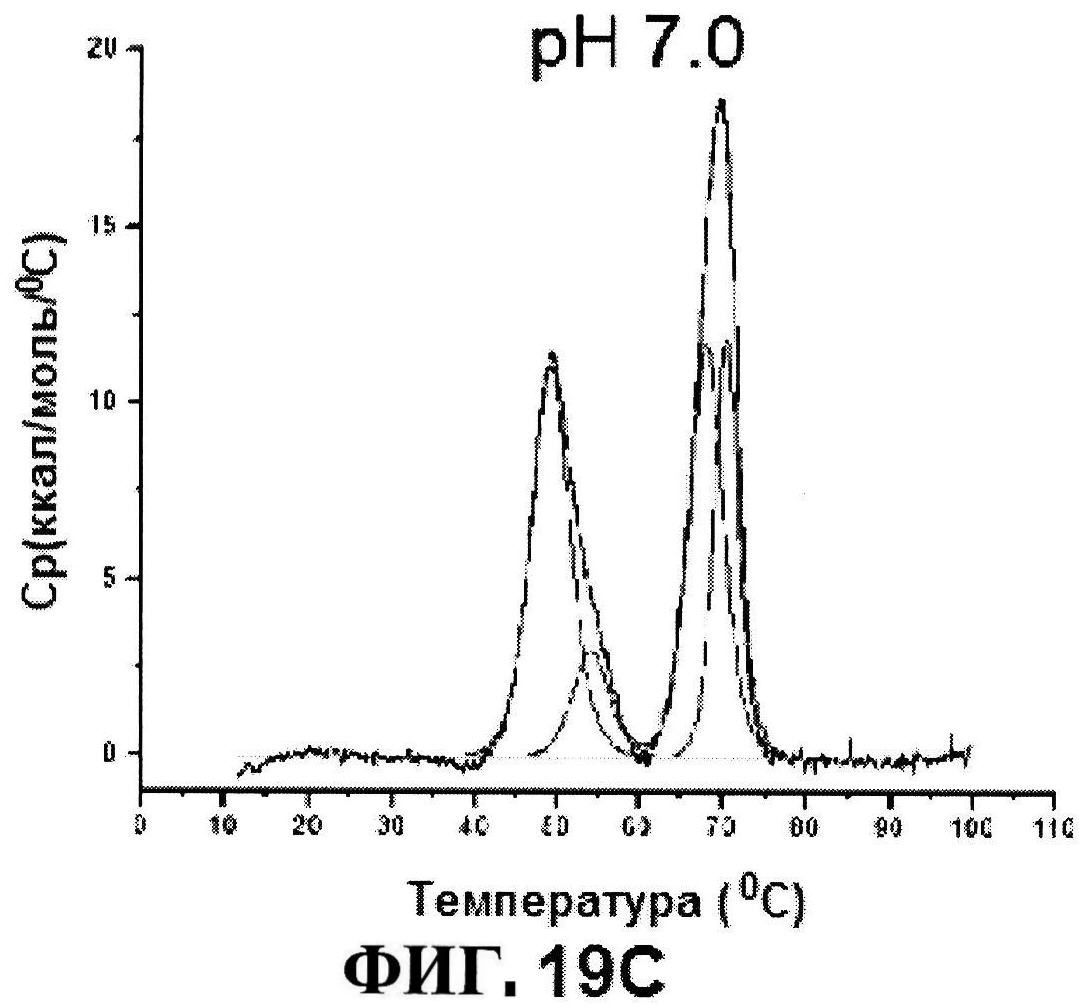
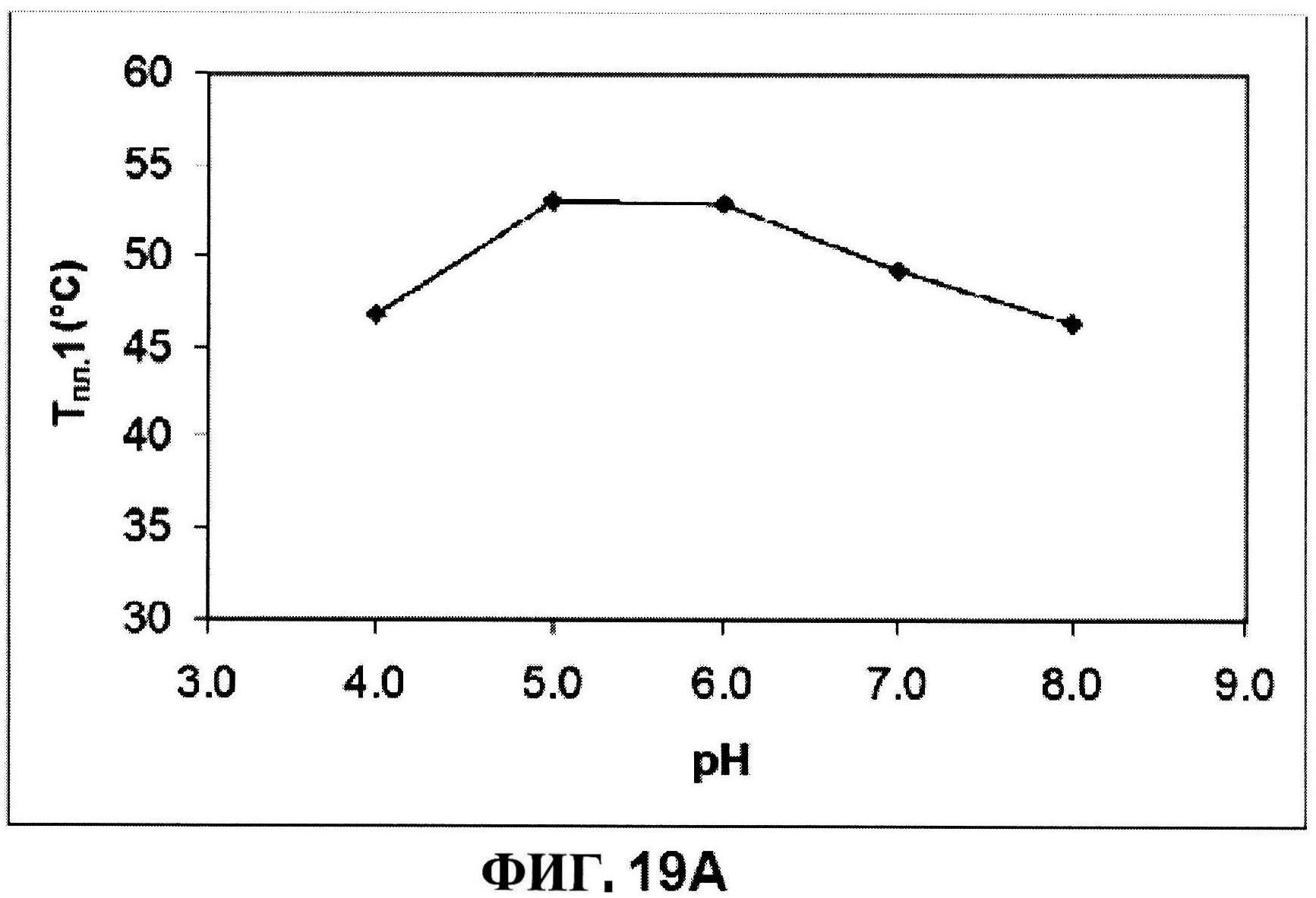
[0066] На фигуре 19 представлено отслеживание Тпл. 1 по ДСК расплавов, как функция от pH для MntC (панель A) и термограммы двух основных термических явлений (панели B и C).
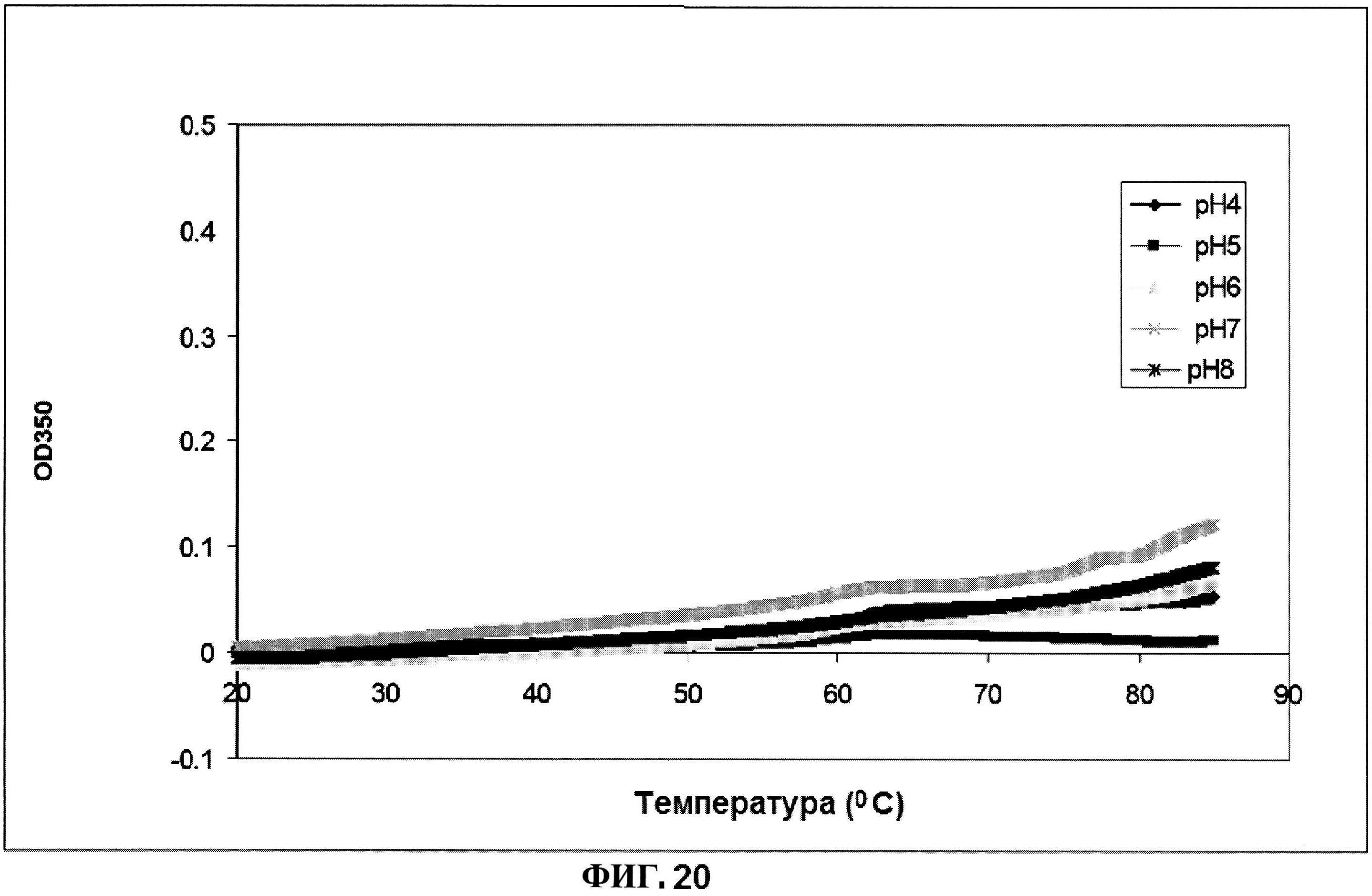
[0067] На фигуре 20 представлена OD350 расплавов MntC, как функция от pH.
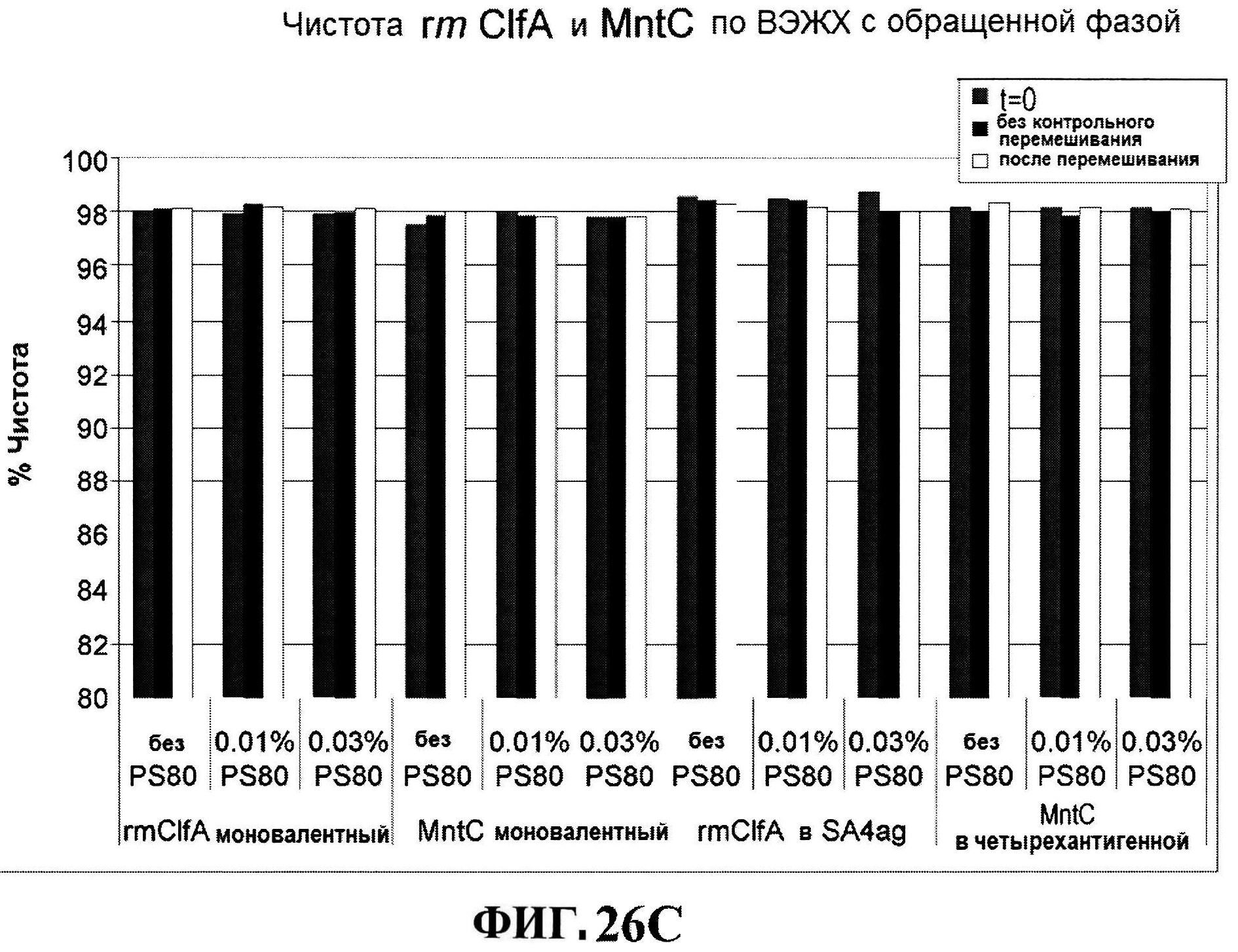
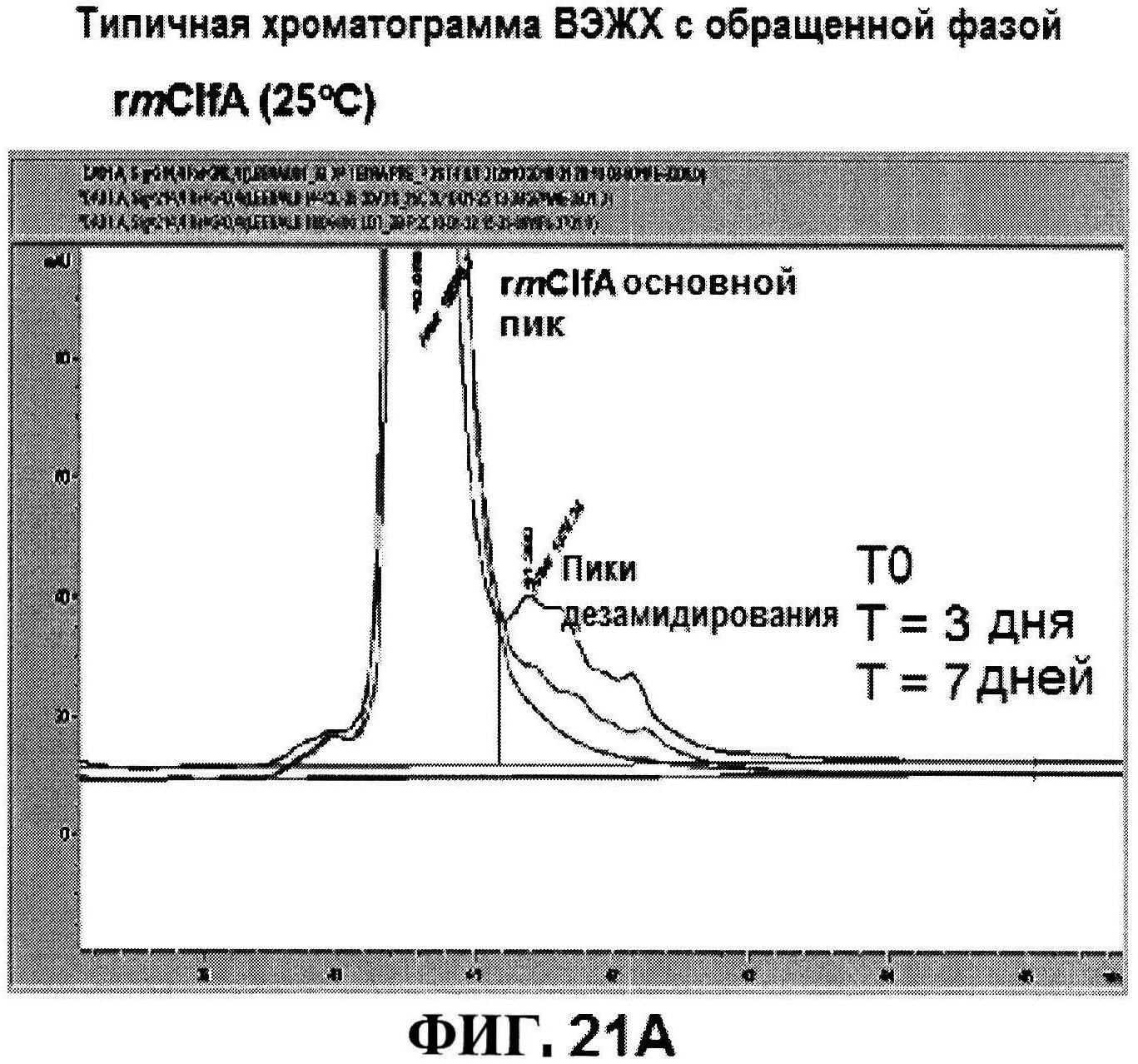
[0068] На фигуре 21 представлены хроматограммы rmClfA (панель A) и MntC (панель B) по контролированию стабильности.
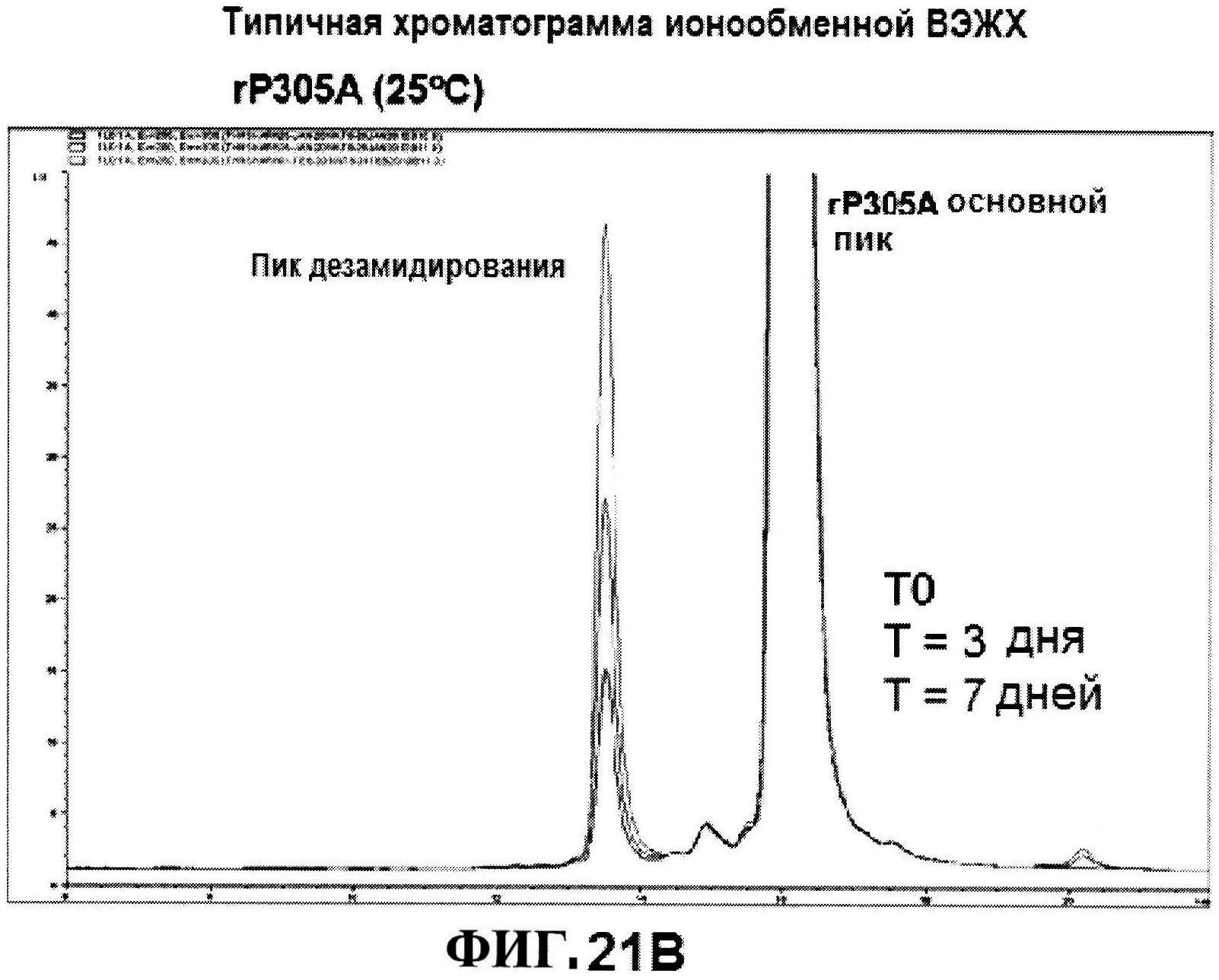
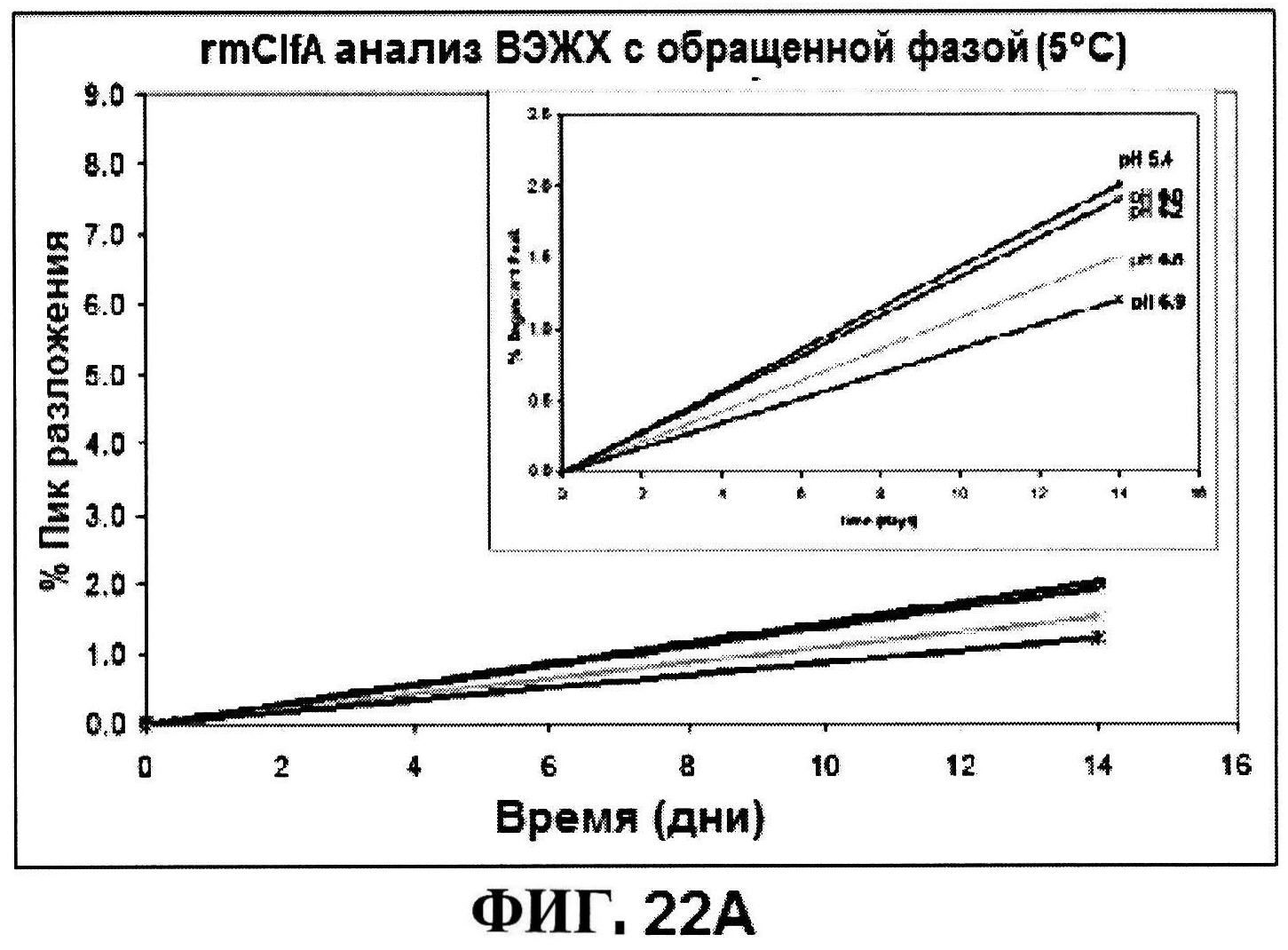
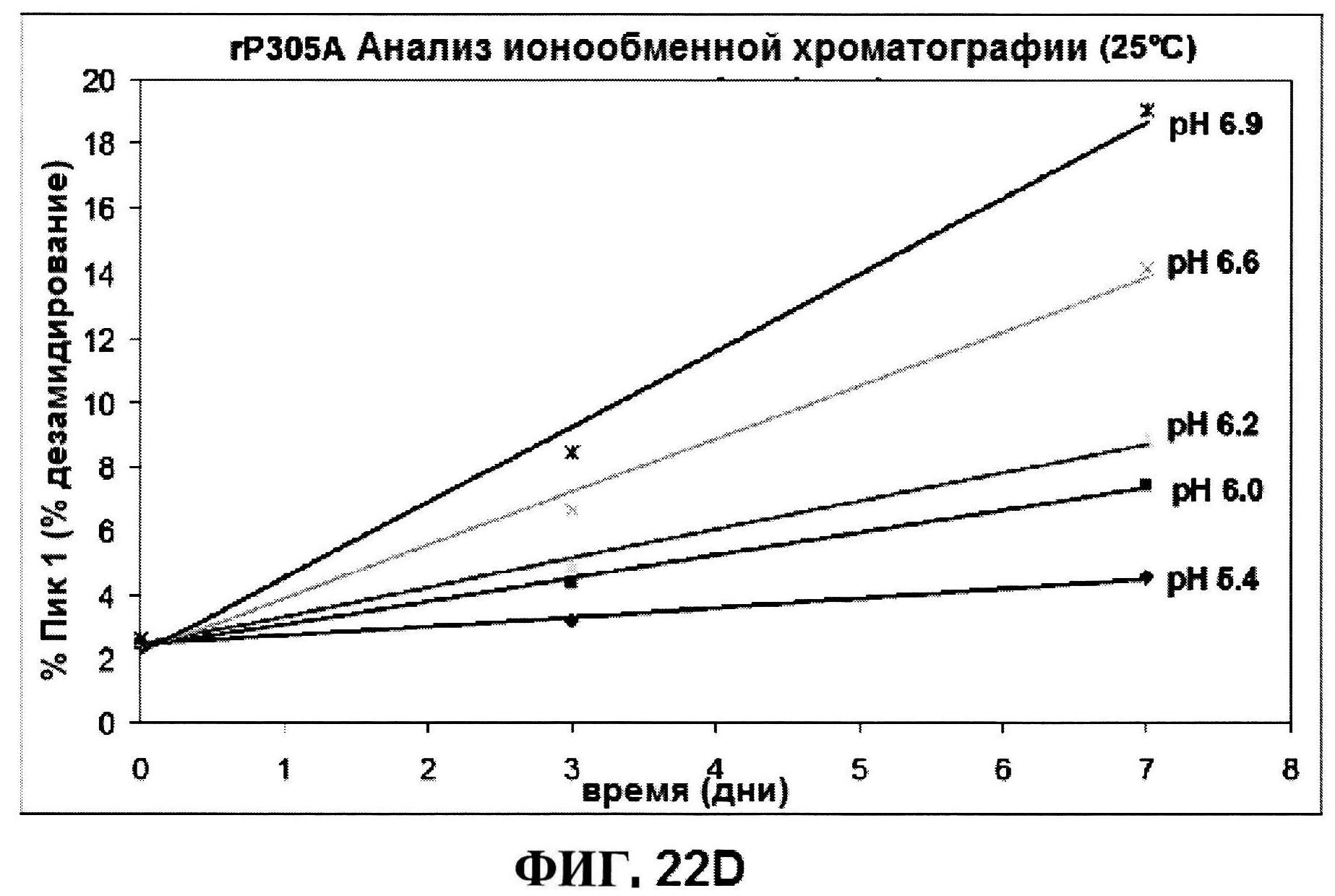
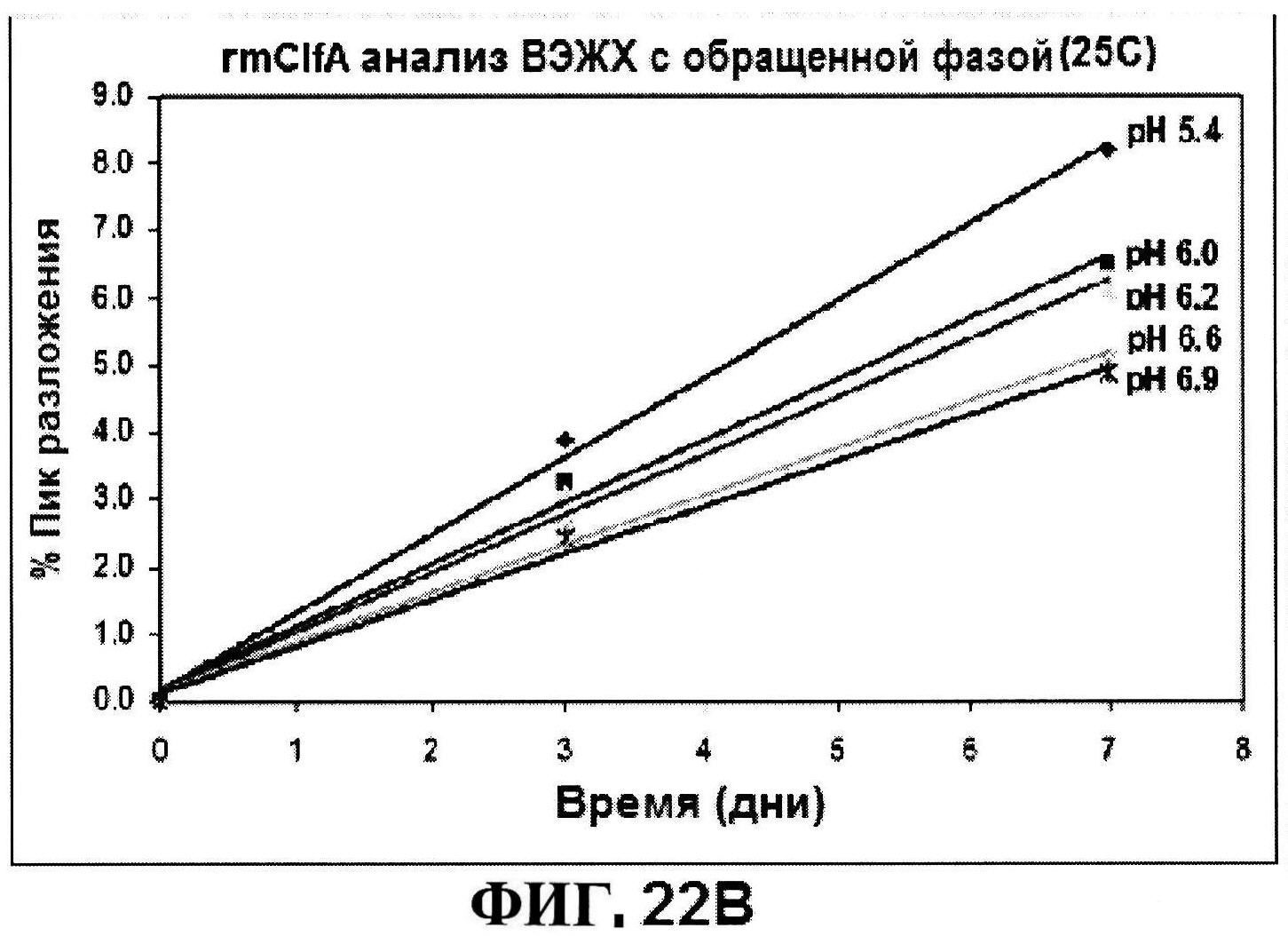
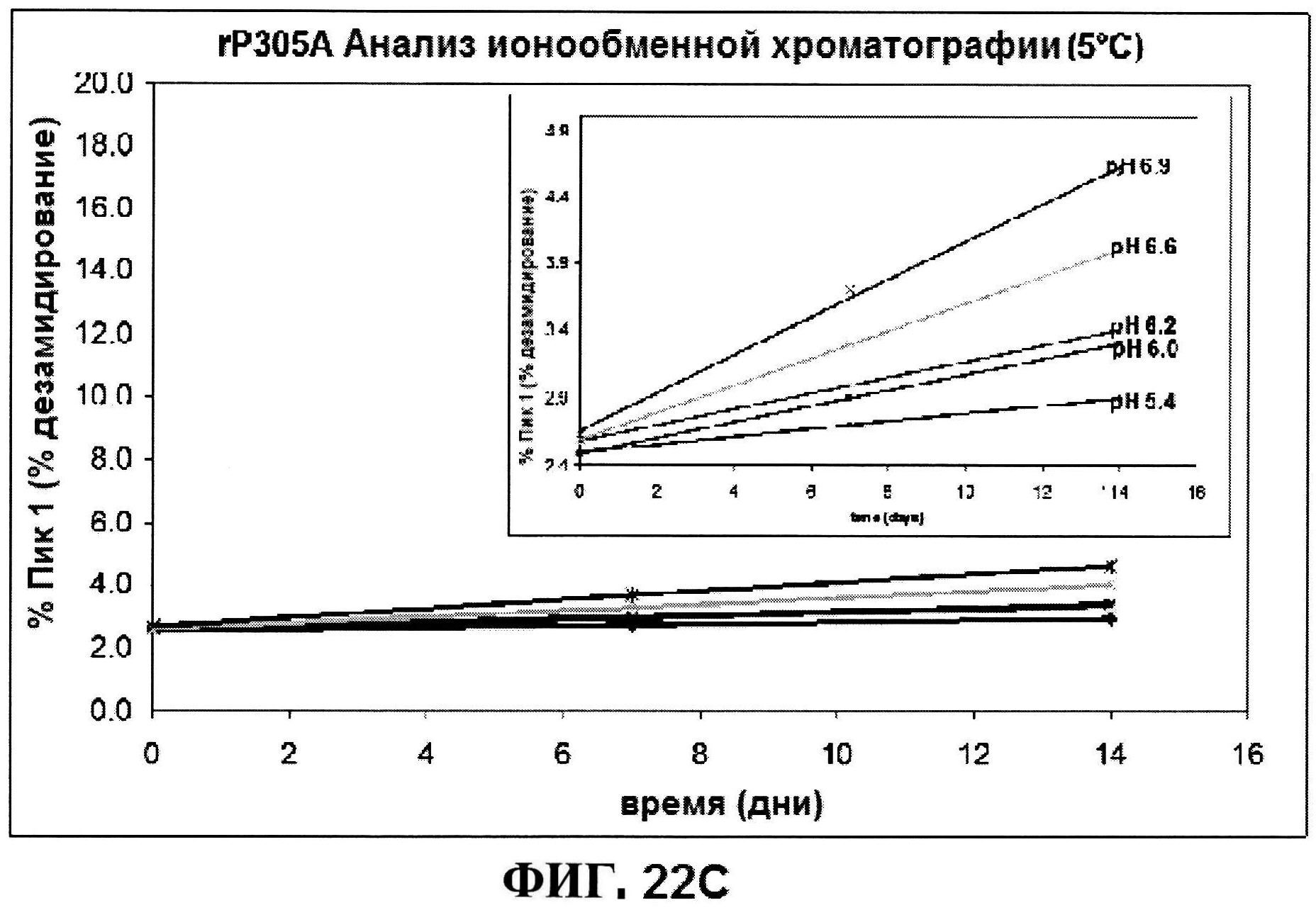
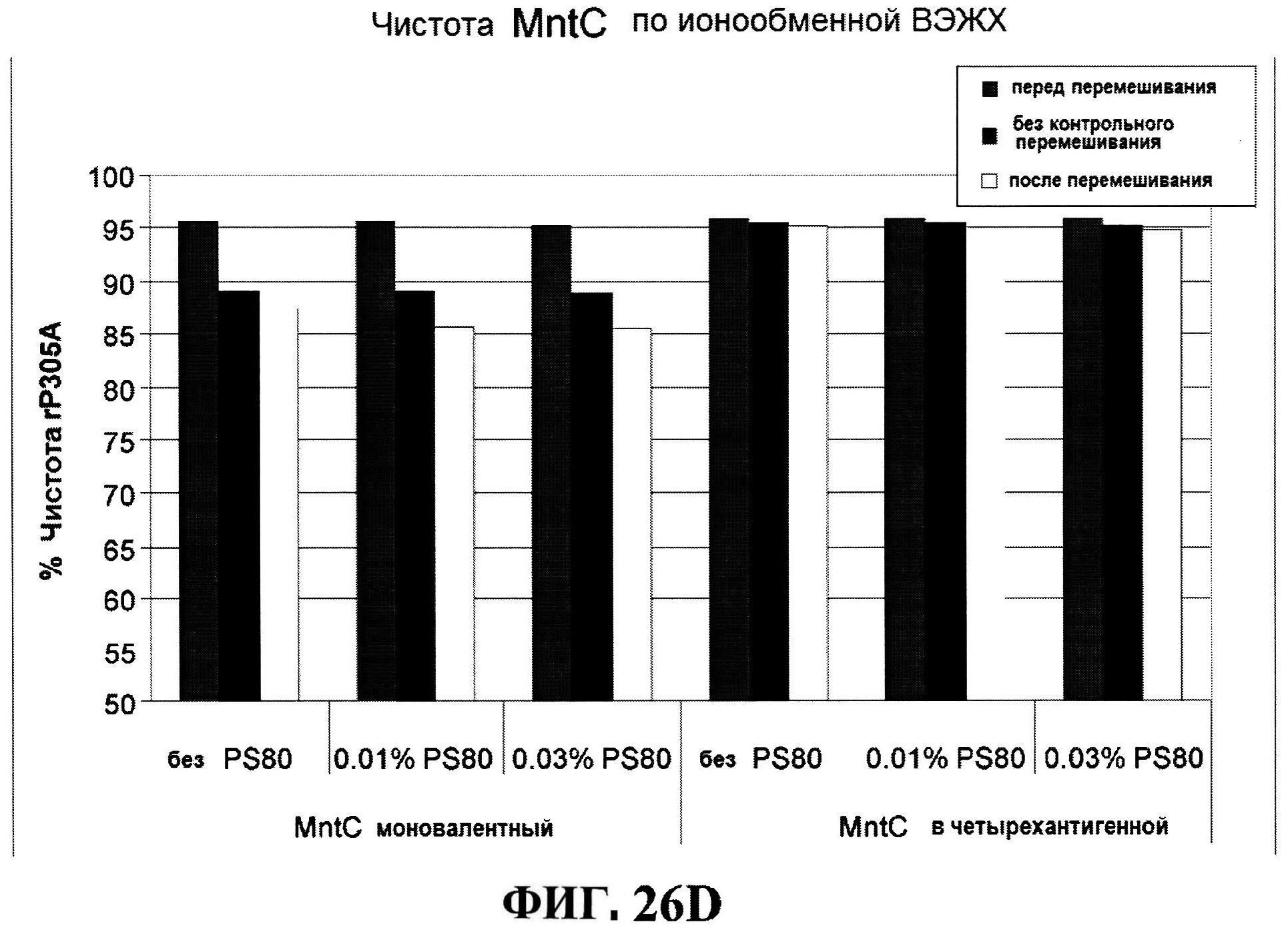
[0069] На фигуре 22 представлены результаты по стабильности rmClfA, полученные с использованием обращено-фазовой ВЭЖХ при 5°C (панель A) и при 25°C (панель B), и MntC, полученные с использованием ионообменной ВЭЖХ при 5°C (панель C) и при 25°C (панель D).
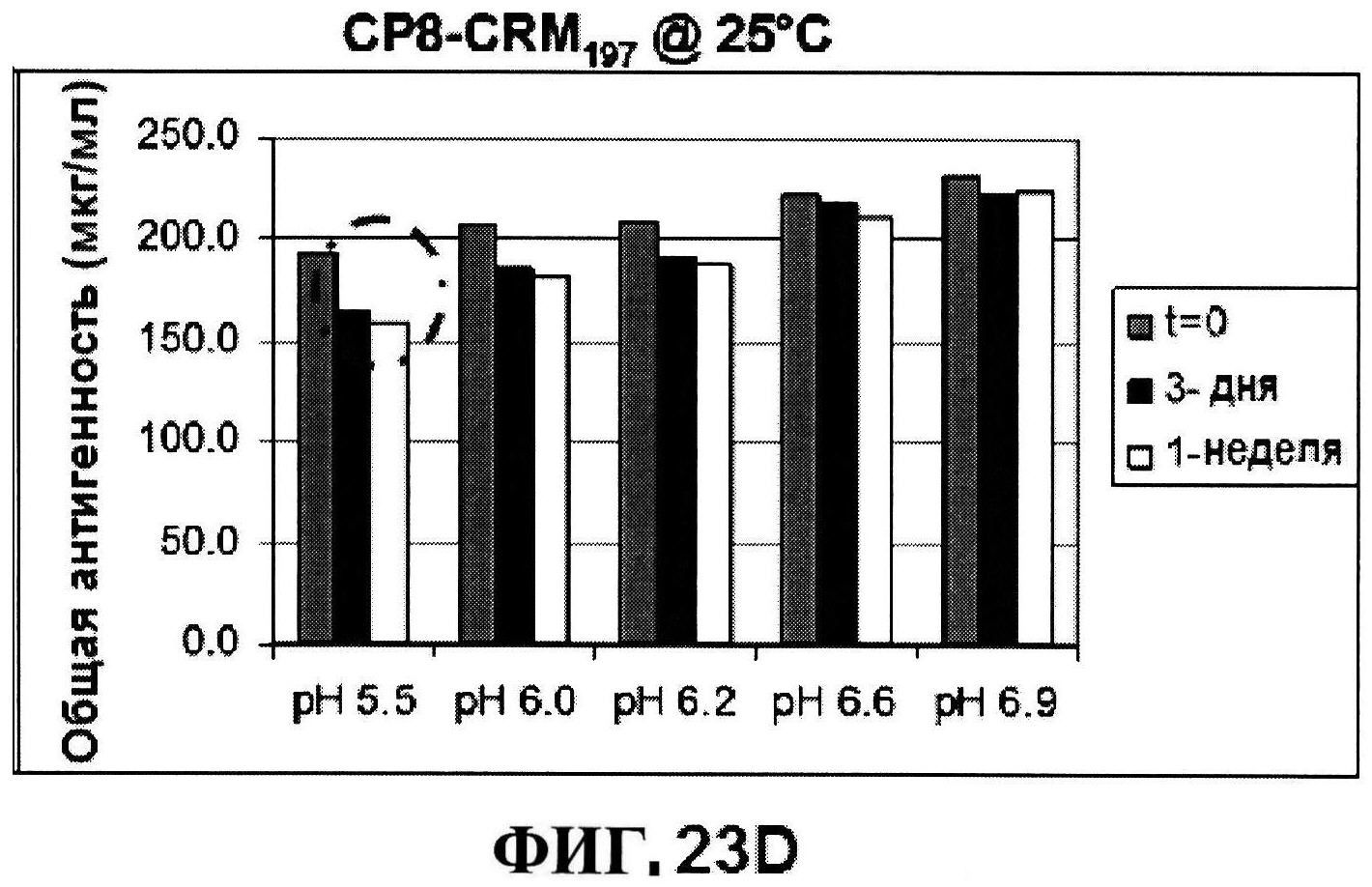
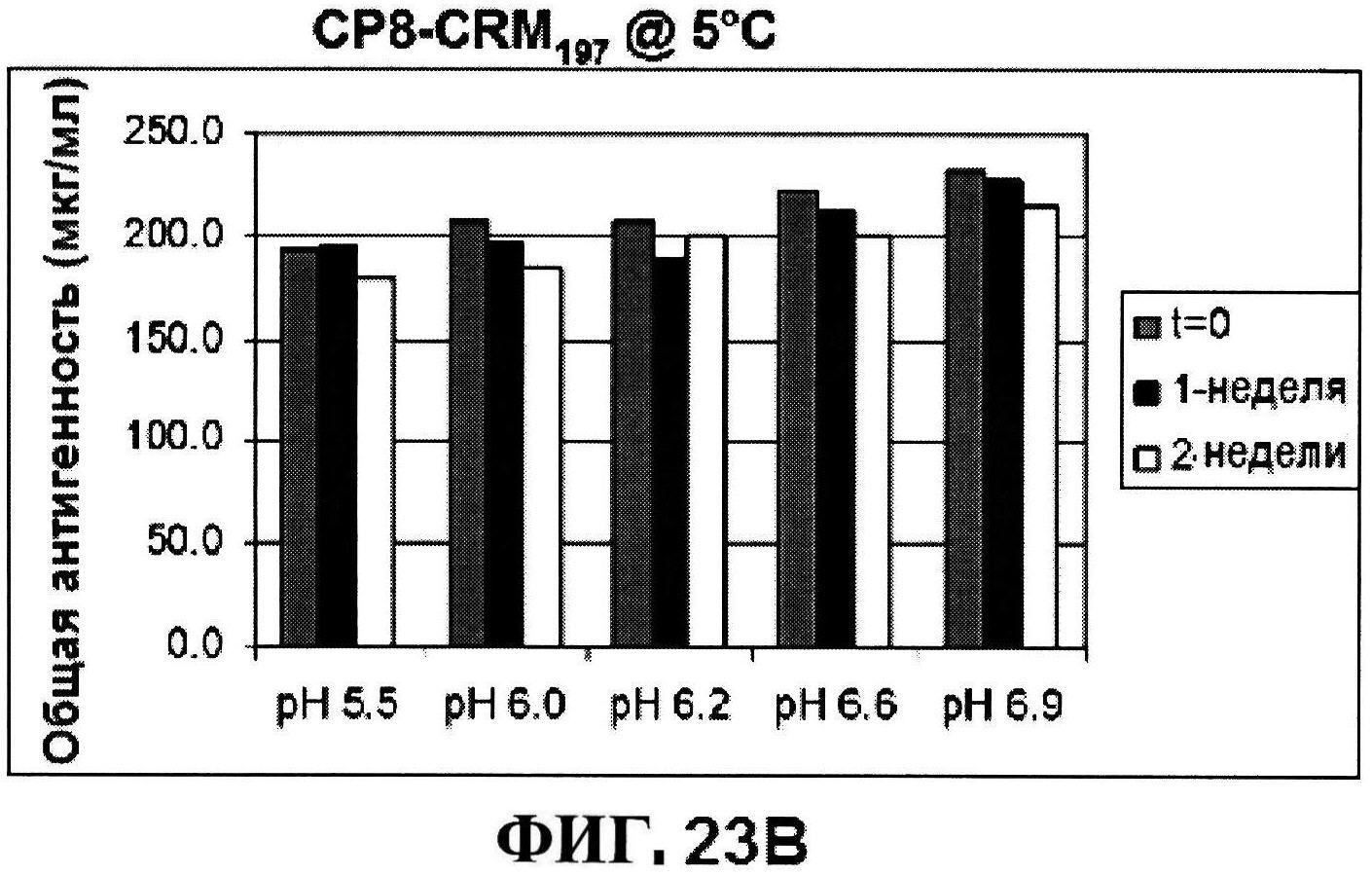
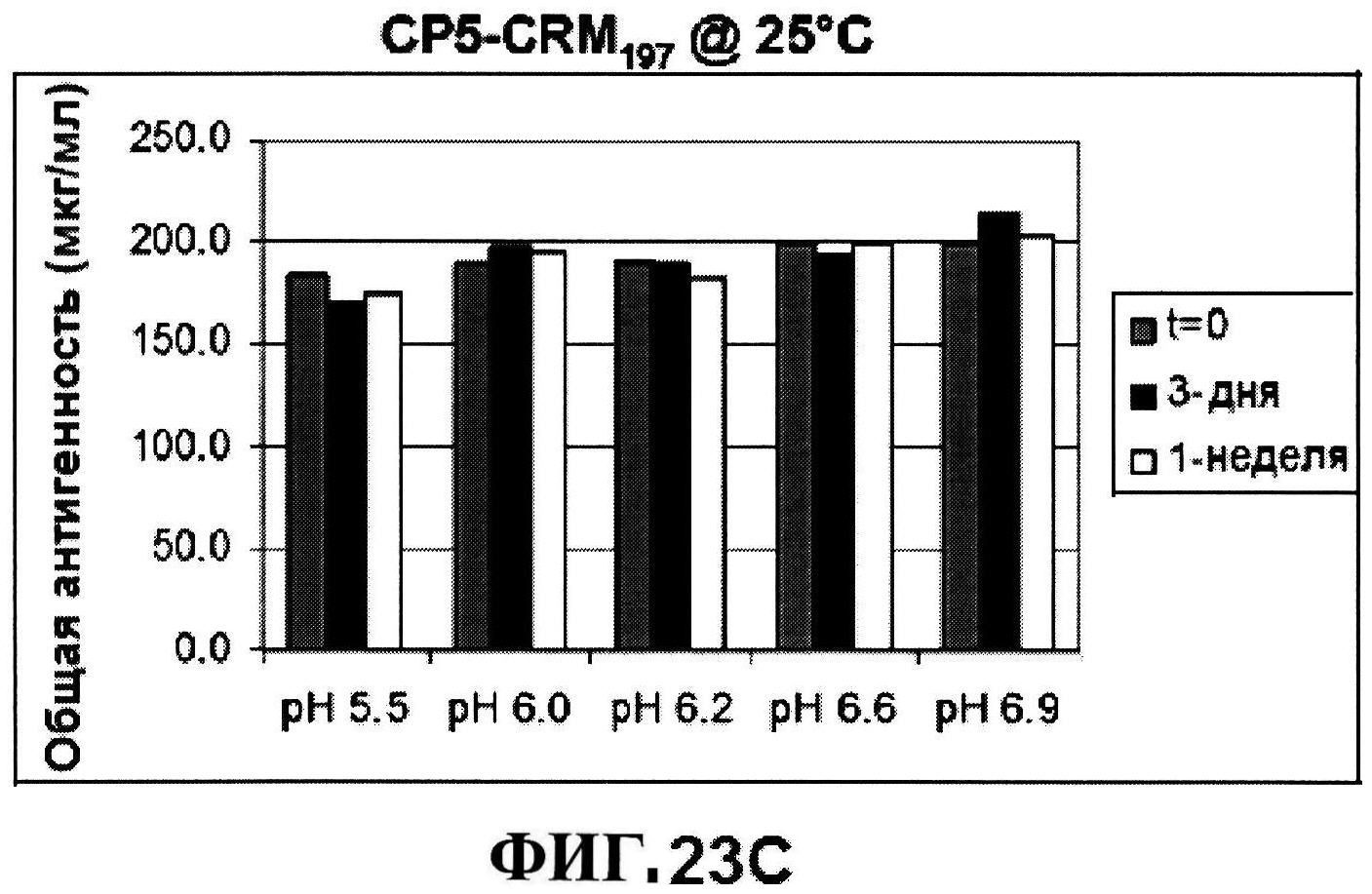
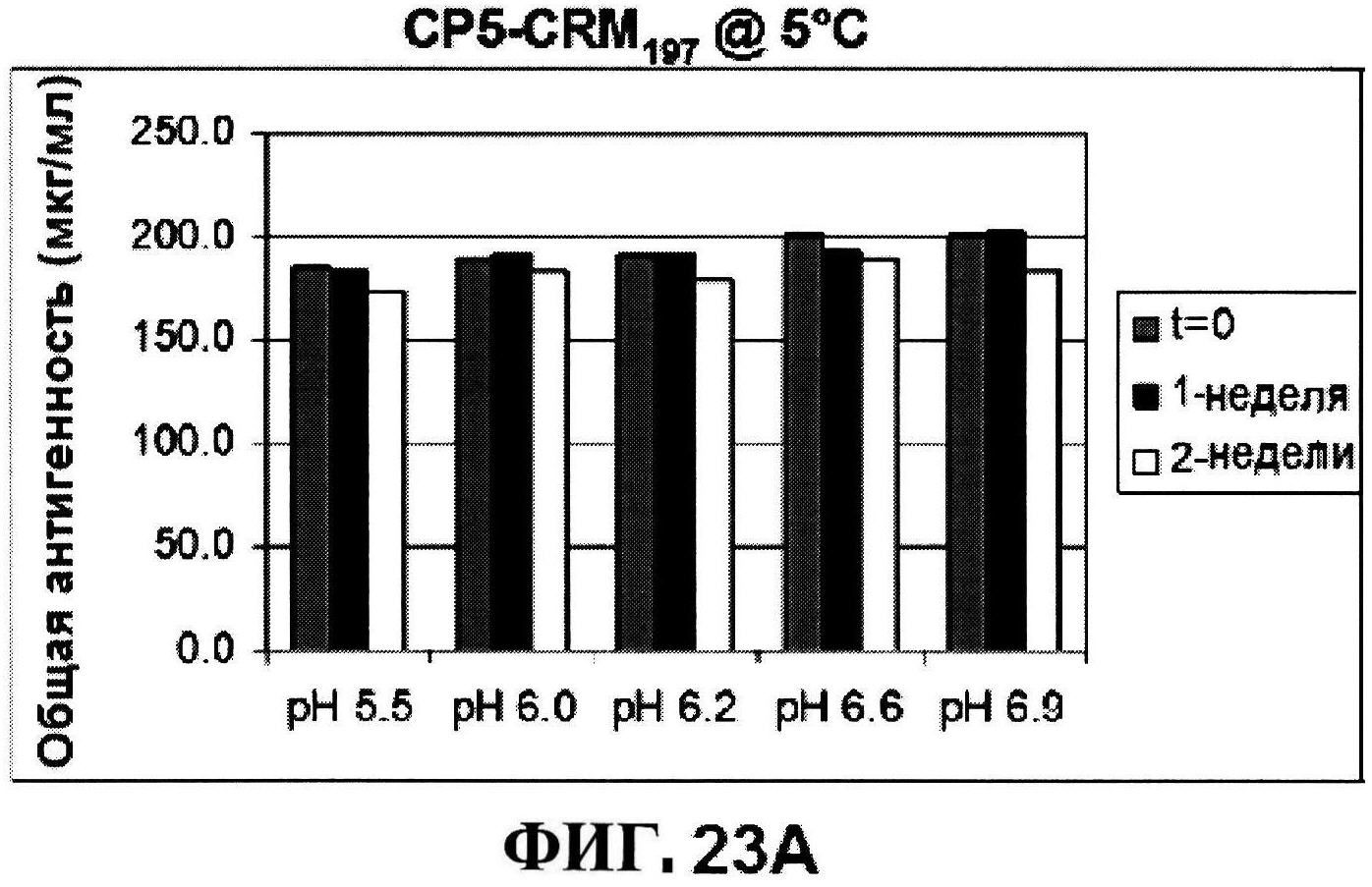
[0070] На фигуре 23 представлены результаты по стабильности CP5-CRM197 при 5°C и при 25°C (панели A и C, соответственно) и CP8-CRM197 при 5°C и при 25°C (панели B и D, соответственно) при различных pH, полученные с использованием нефелометрии.
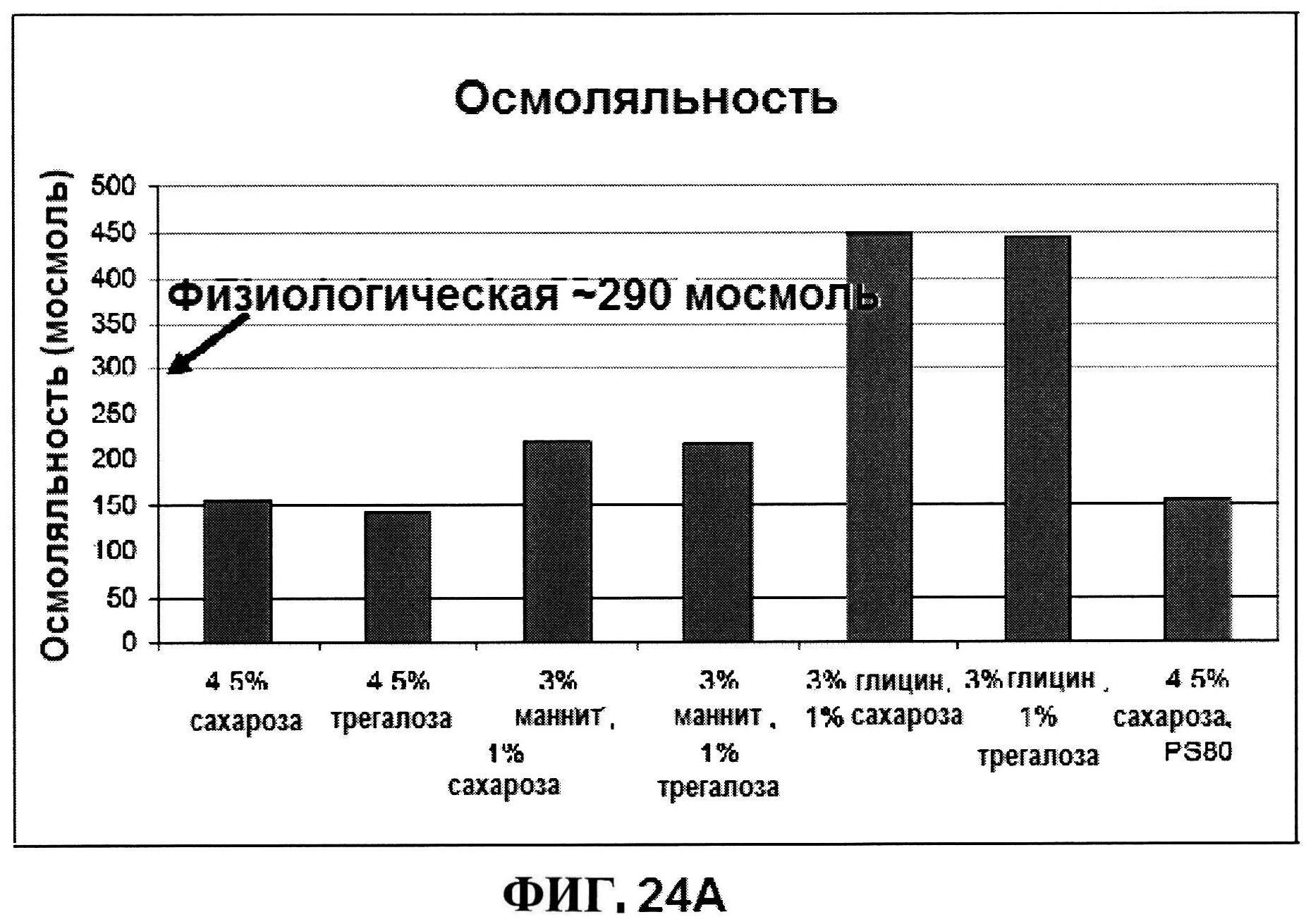
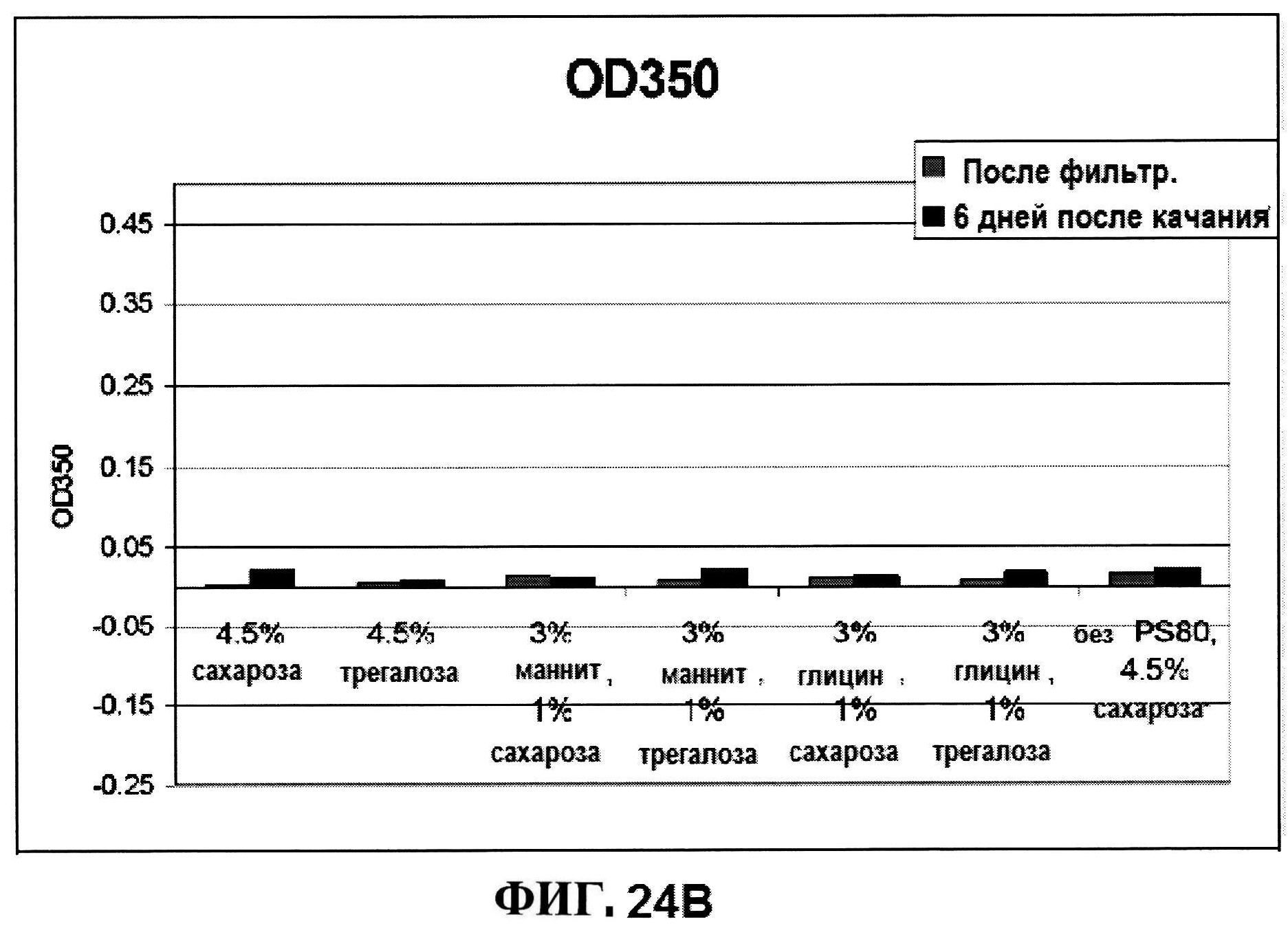
[0071] На фигуре 24 представлены результаты измерений осмоляльности (панель A) и OD350 (панель B) образцов после встряхивания с варирующими объемообразующими агентами.
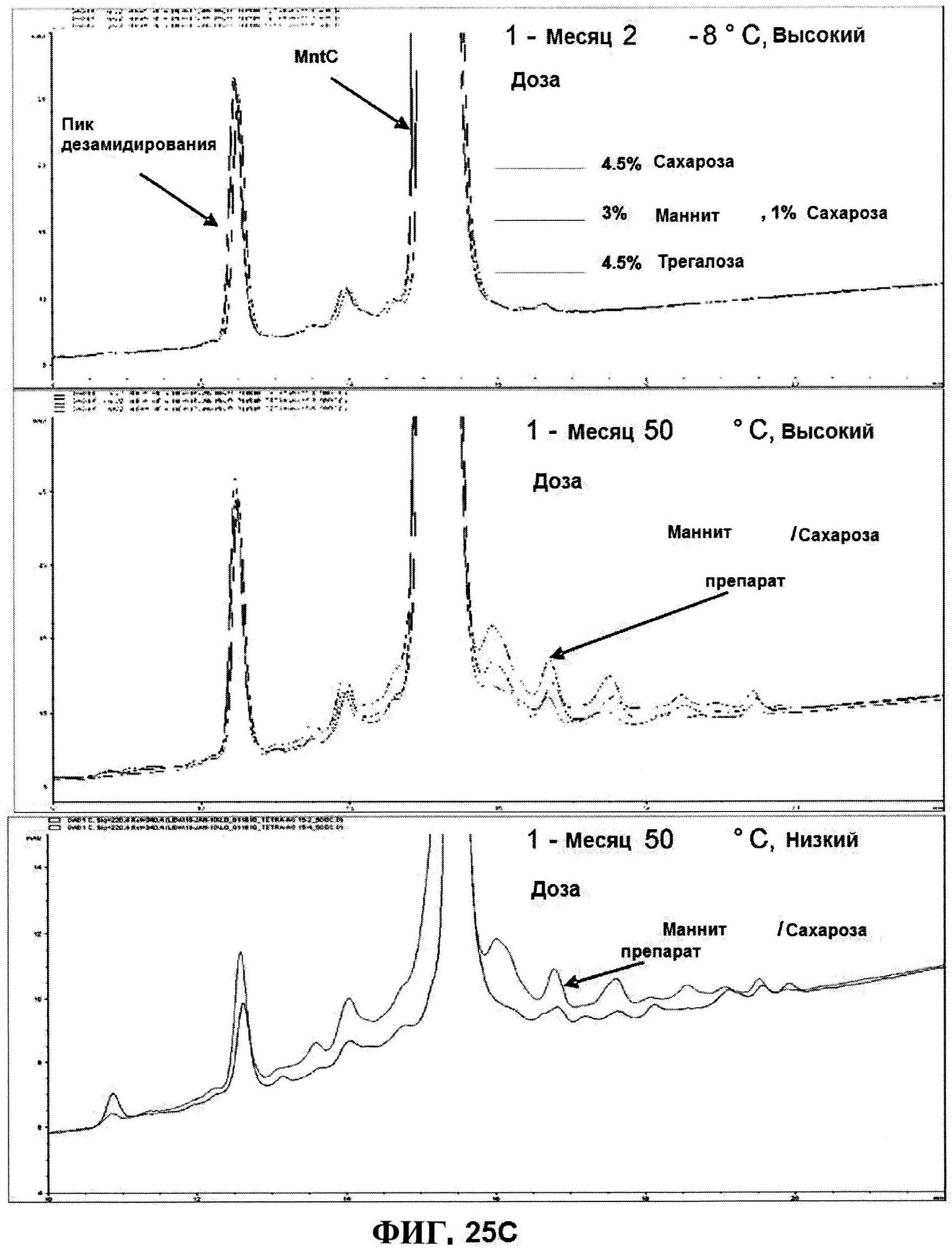
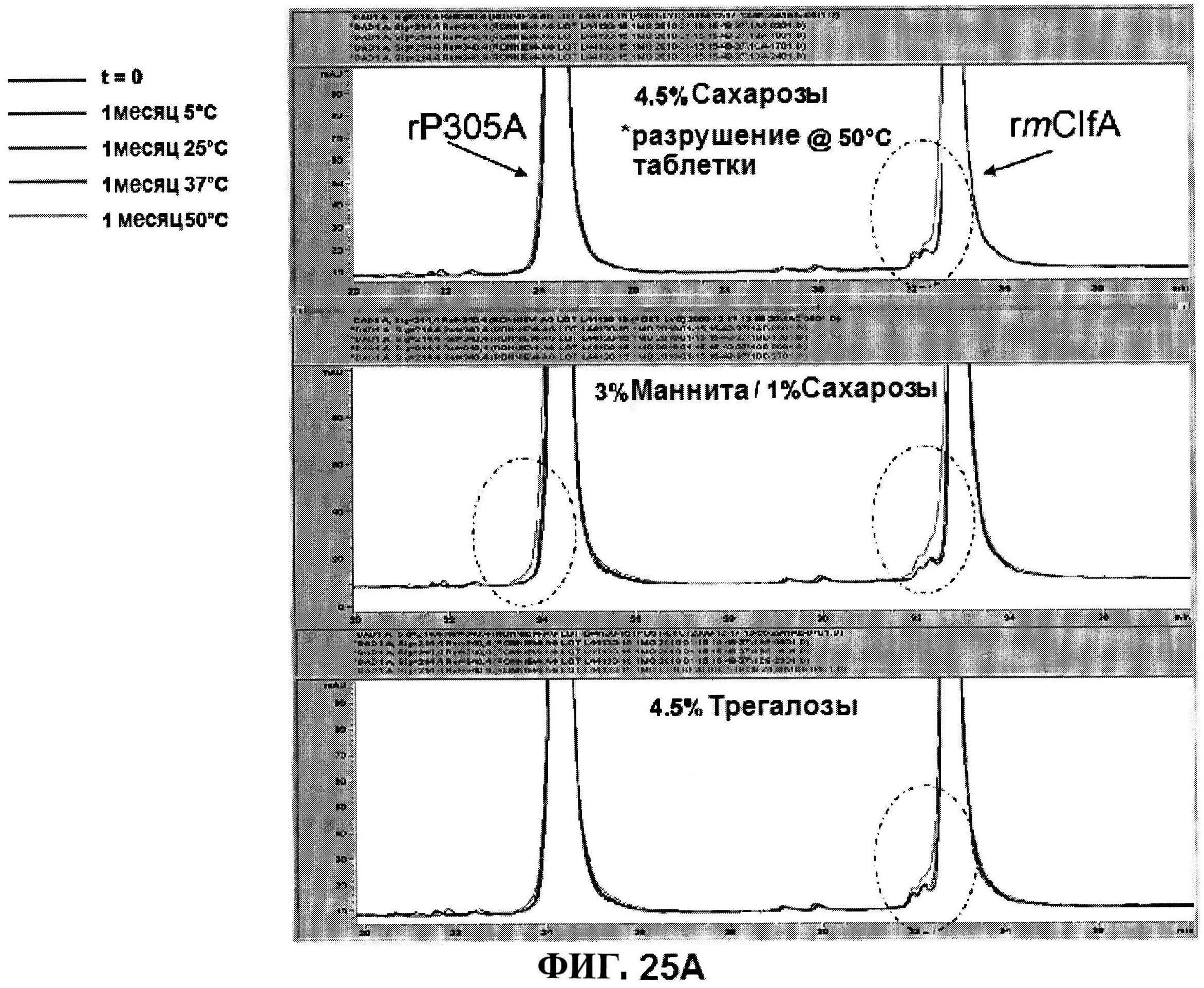
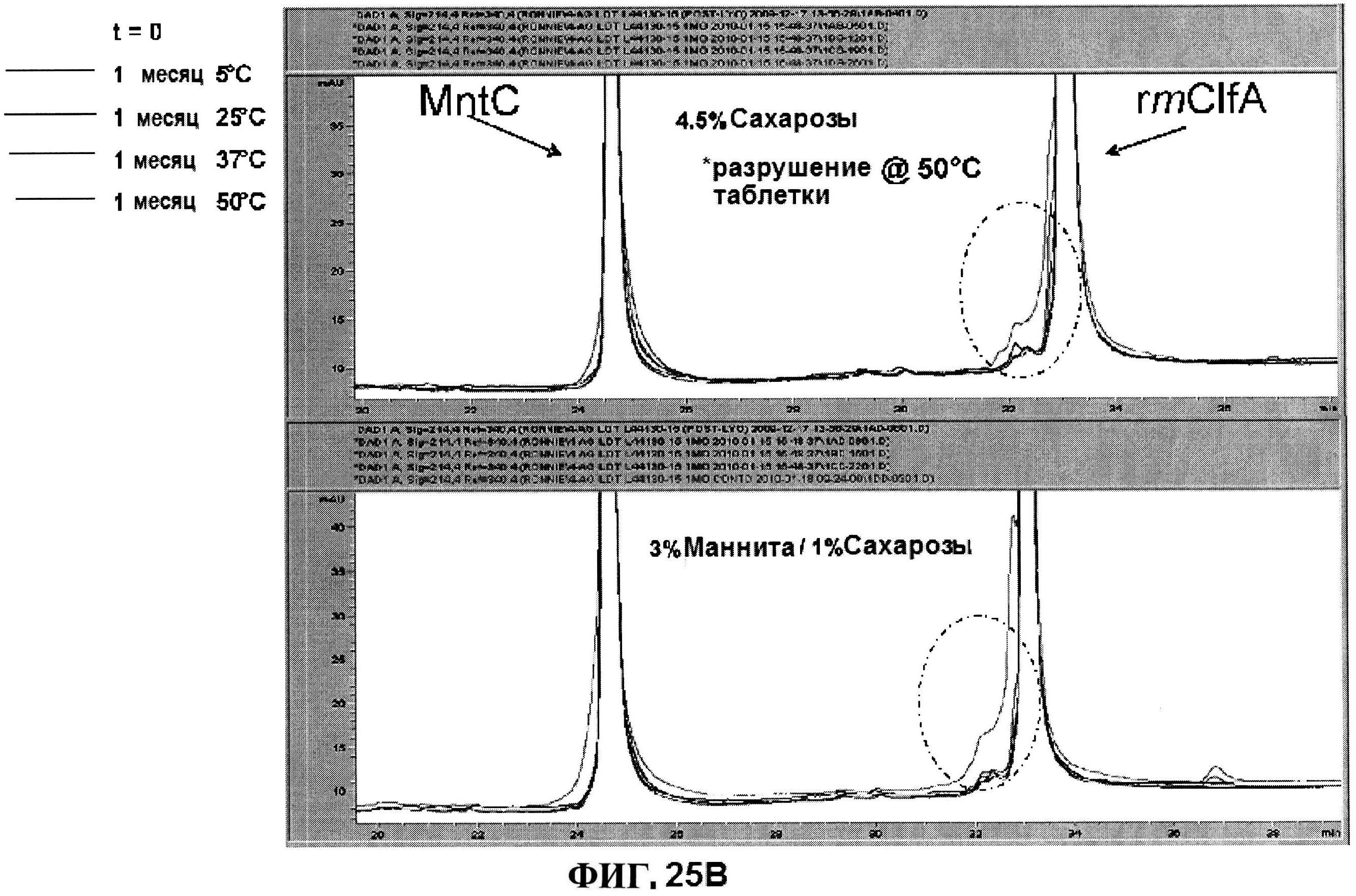
[0072] На фигуре 25 представлено исследование стабильности, как функции объемообразующего агента с использованием данных обращено-фазовой ВЭЖХ для высоко дозовых (панель A) и низко дозовых (панель В) лиофилизированных составов и данных ионообменной ВЭЖХ для характеристики MntC (панель C).
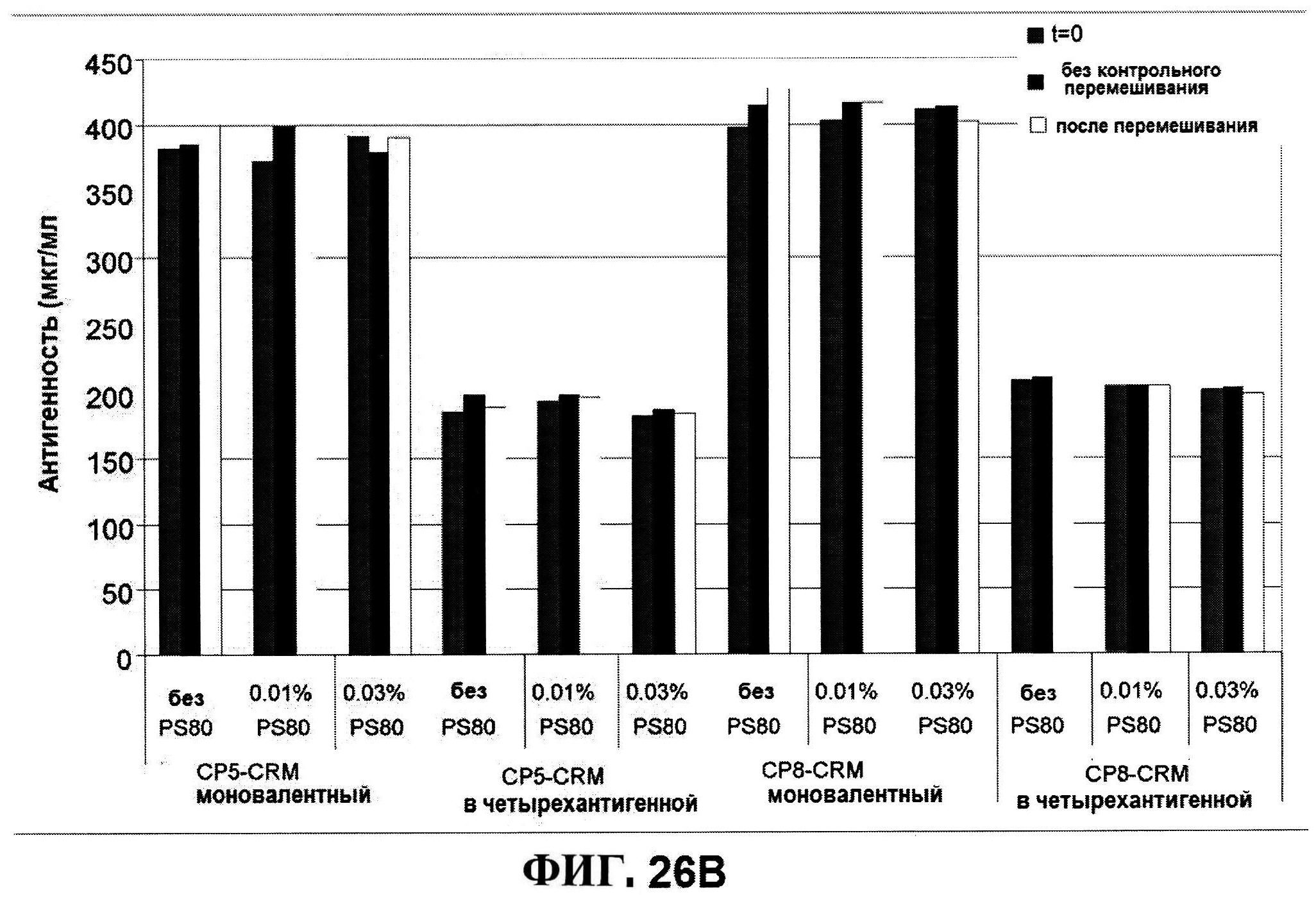
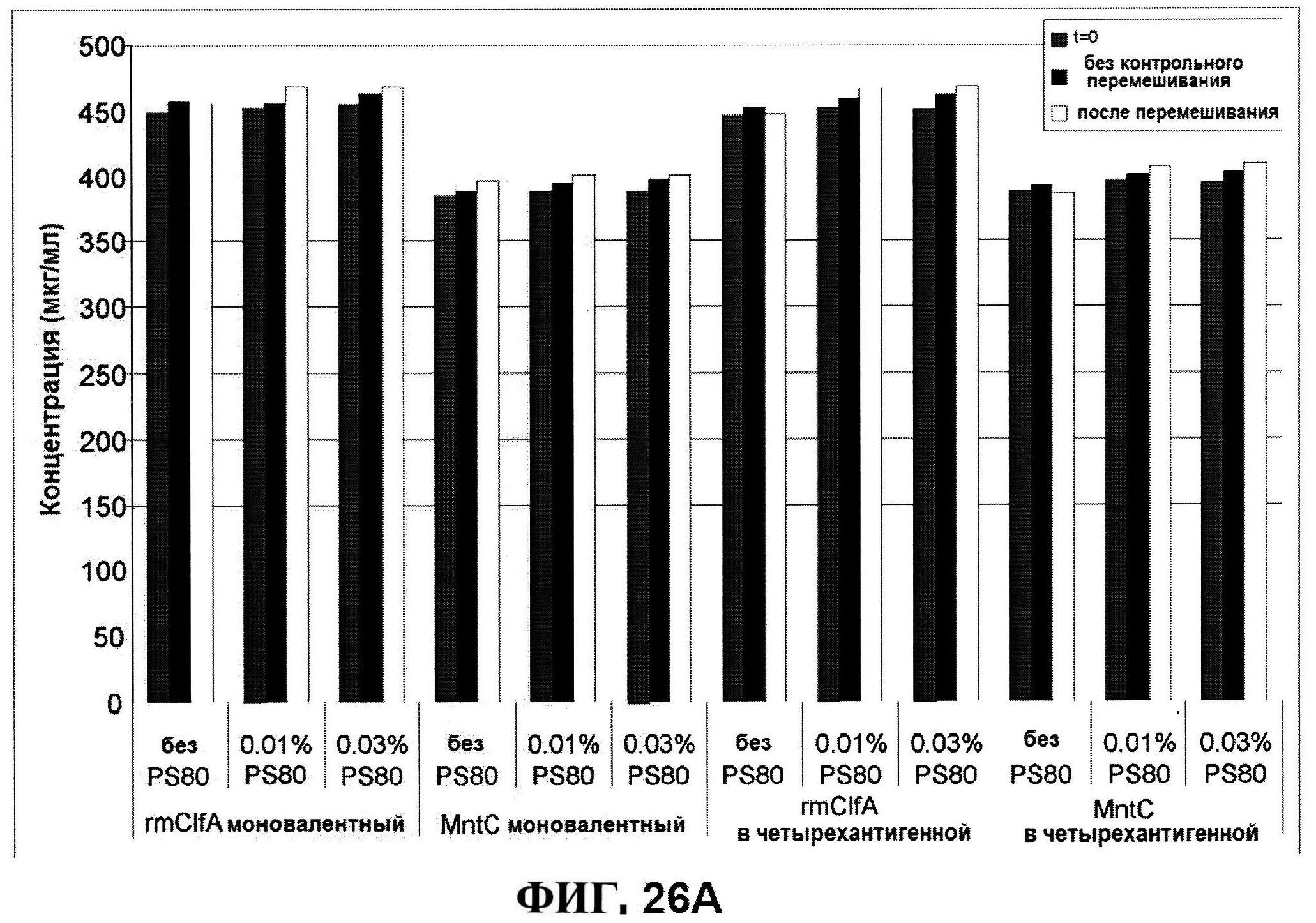
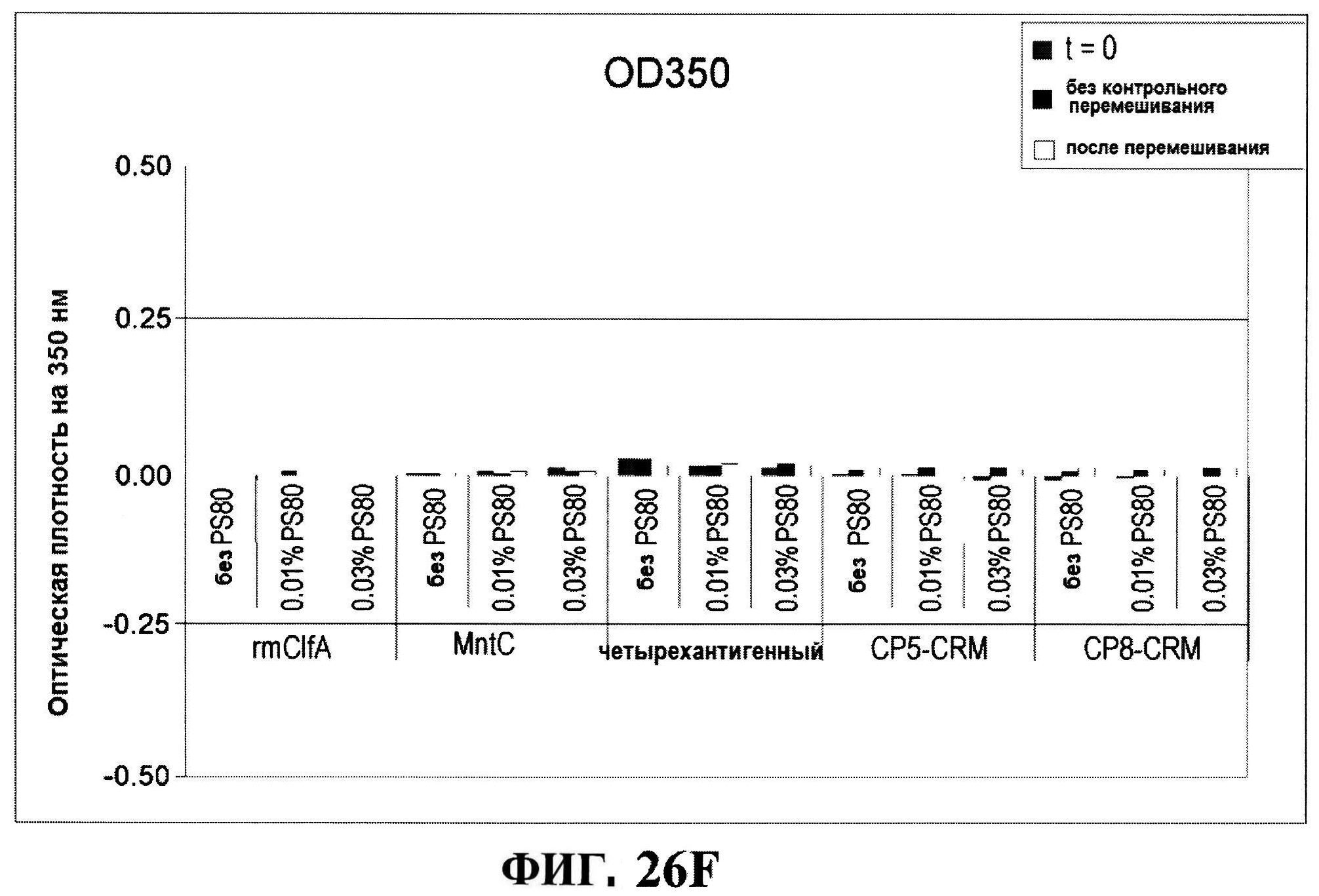
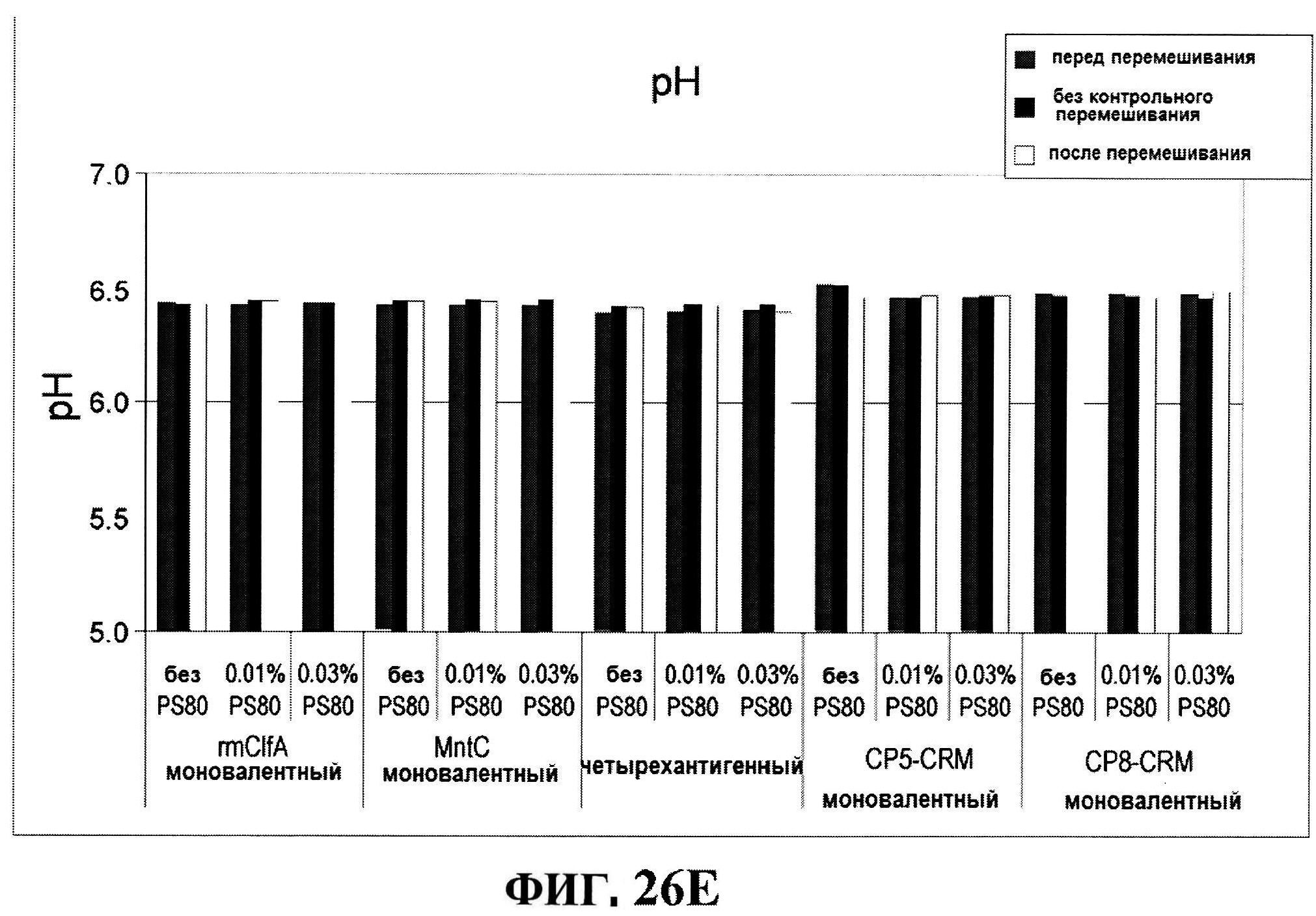
[0073] На фигуре 26 представлены данные после перемешивания всех четырех антигенов: антигенные концентрации (rmClfA и MntC на панели A; CP5-CRM197 и СР8-CRM197 не панеле В), чистота rmClfA и MntC, полученная с использованием обращено-фазовой ВЭЖХ (панель B), чистота MntC, полученная с использованием ионообменной ВЭЖХ (панель C), pH (панель D) и OD350 (панель Е).
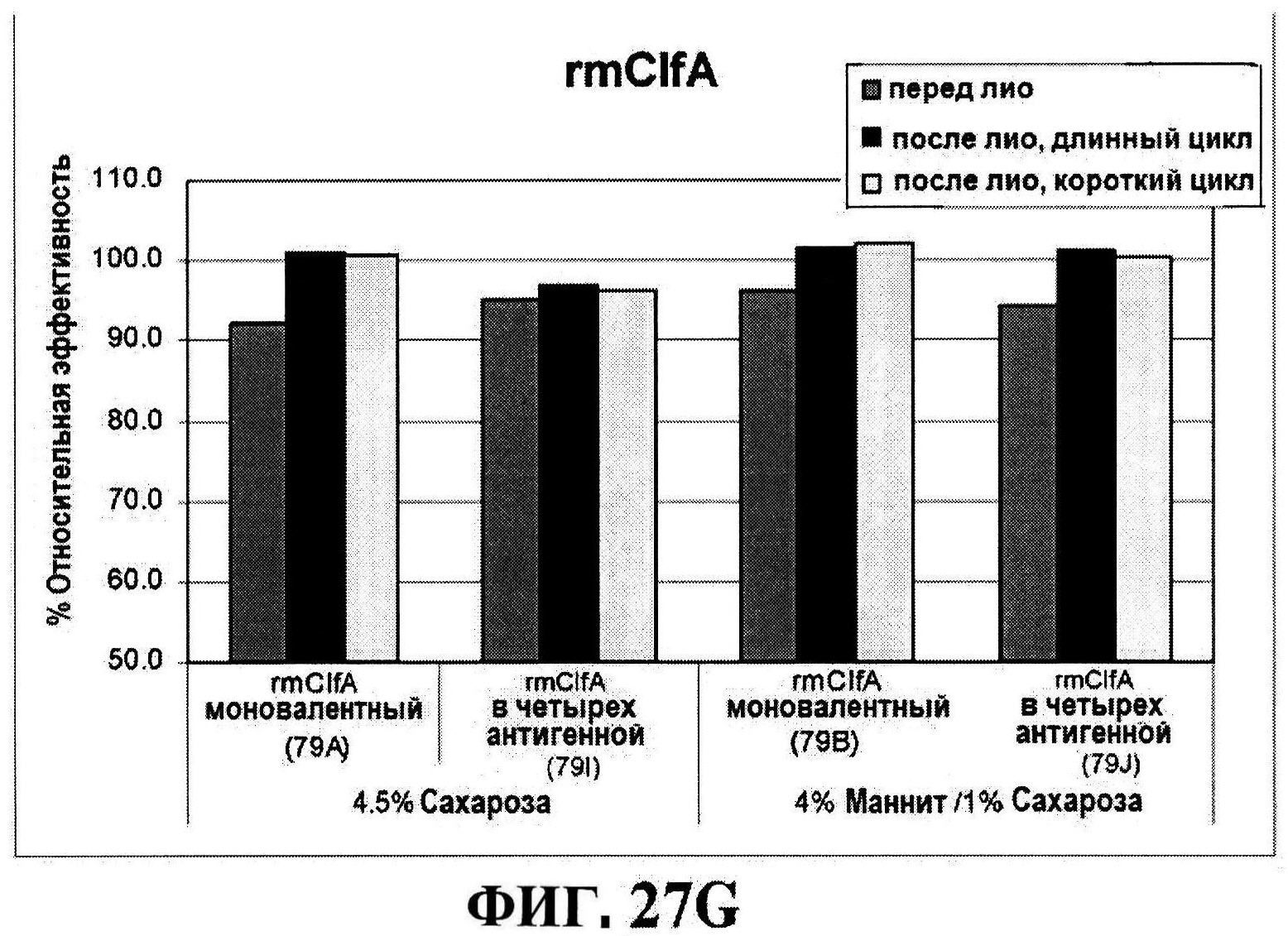
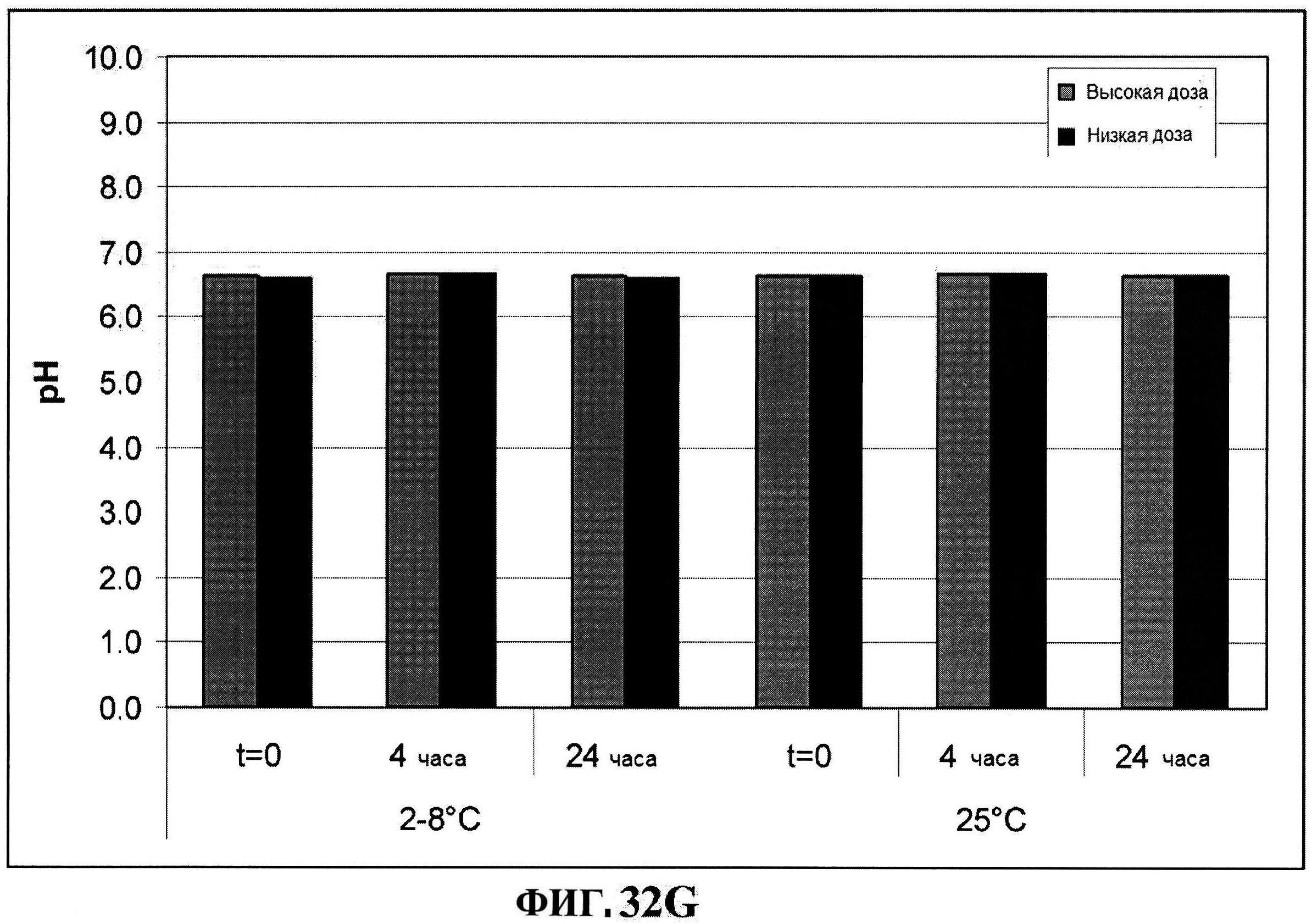
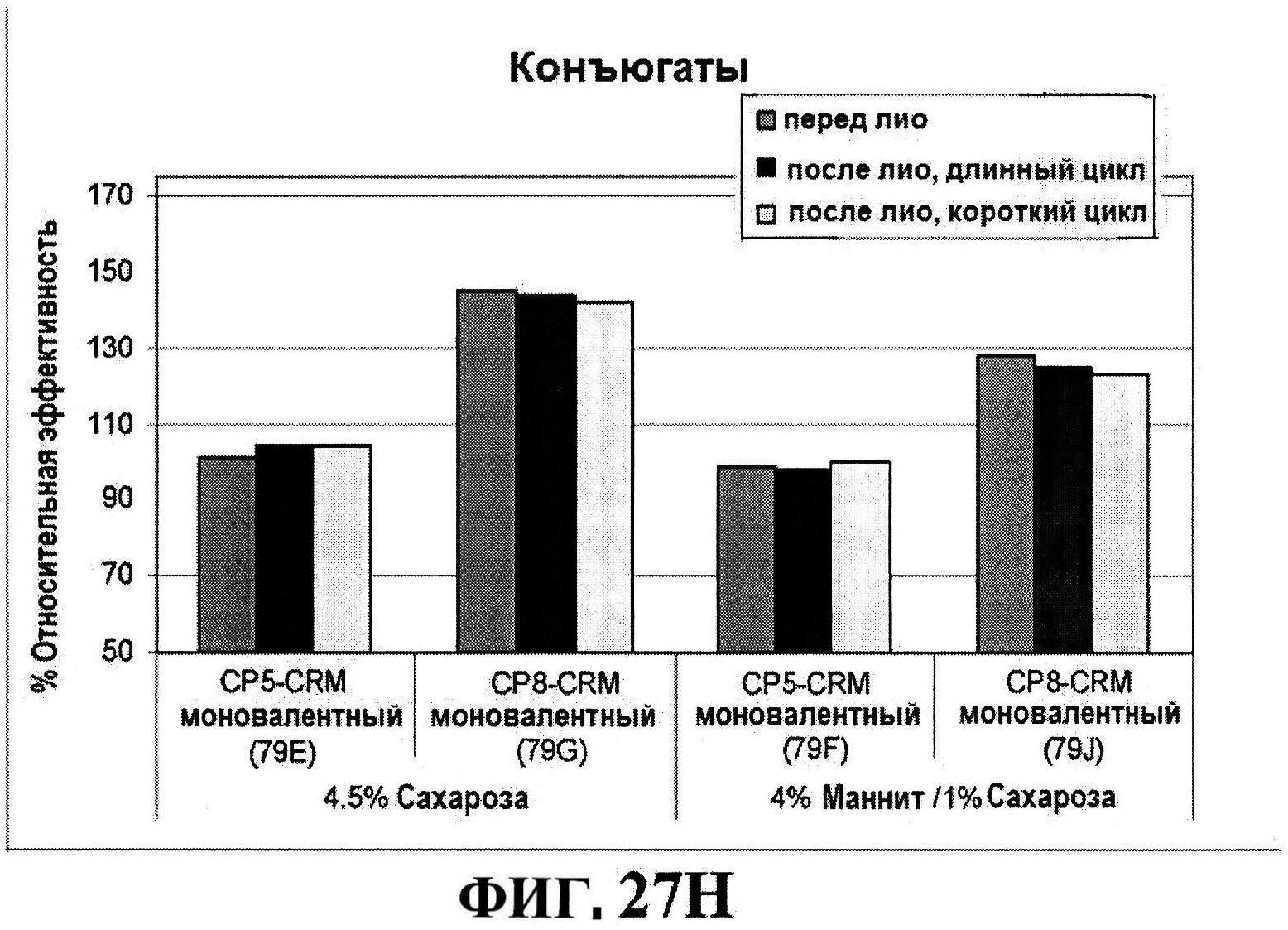
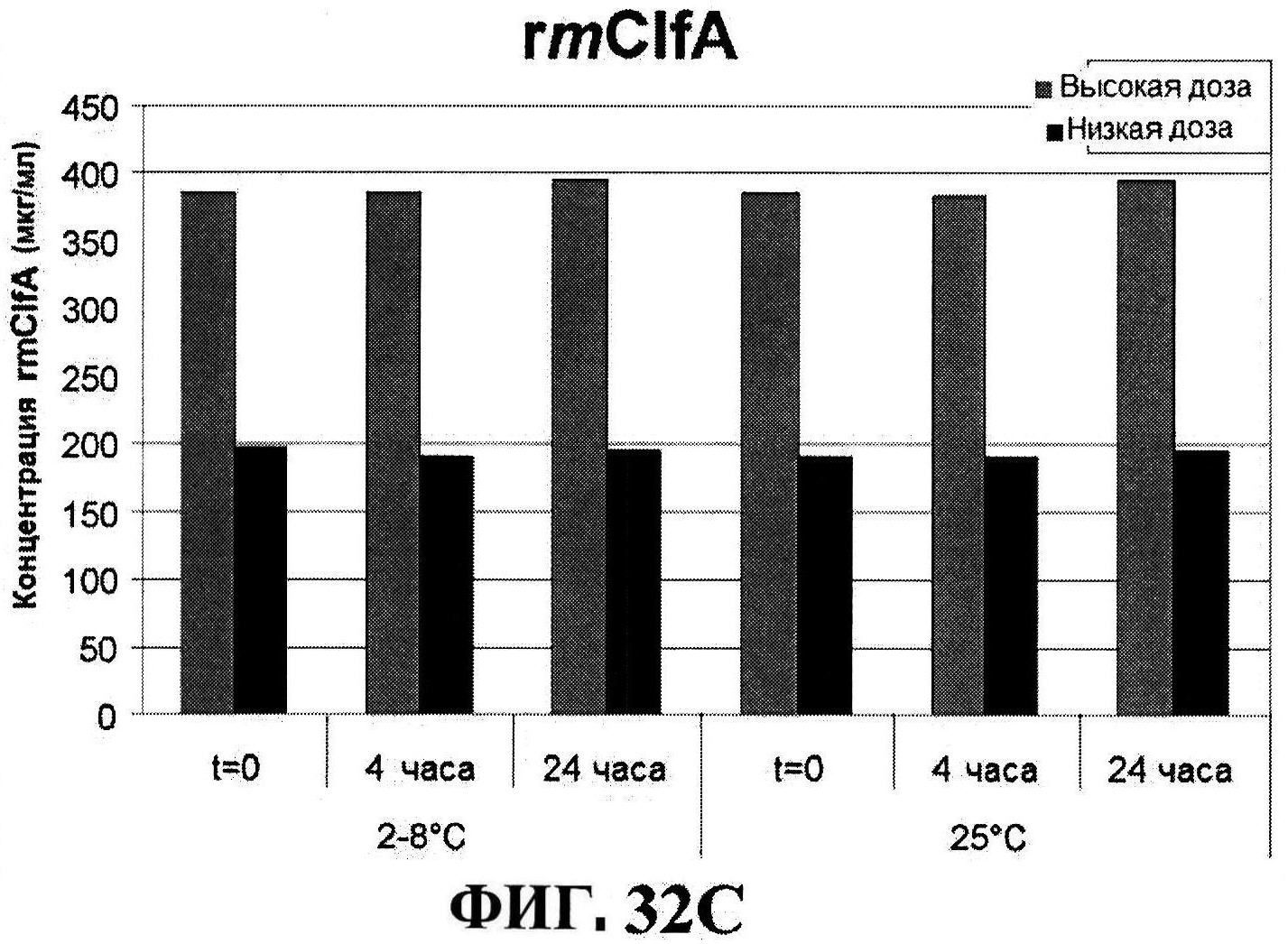
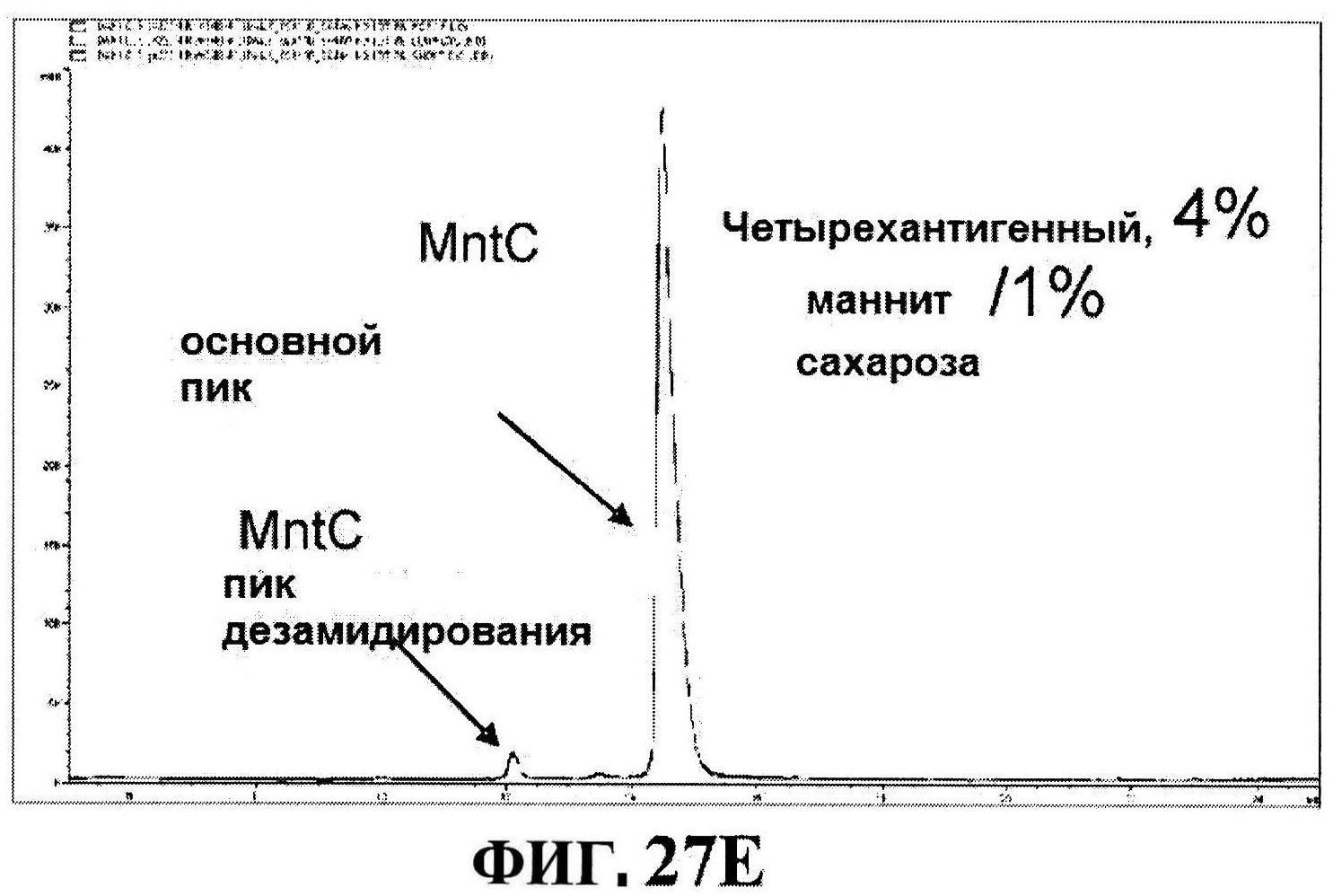
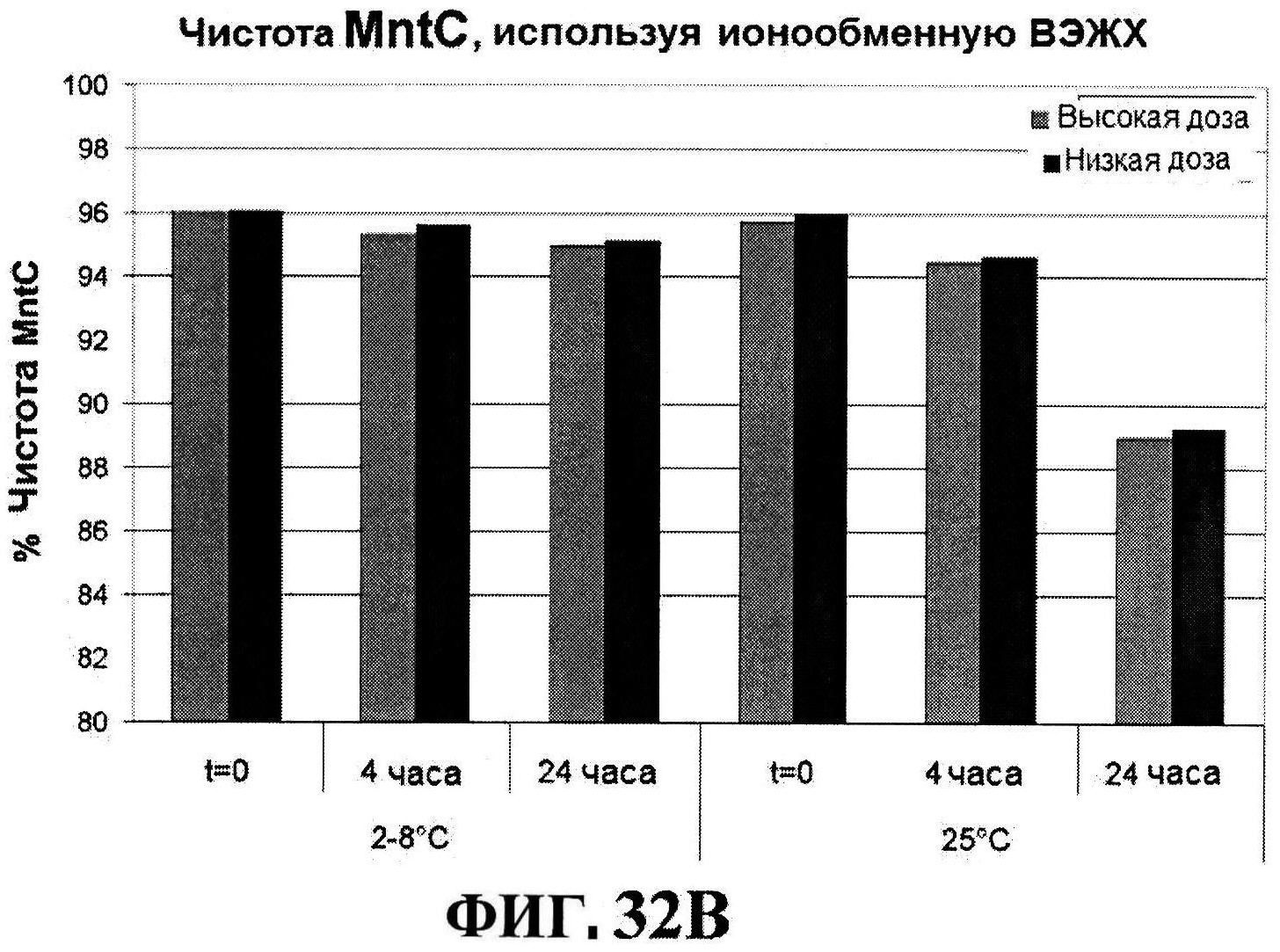
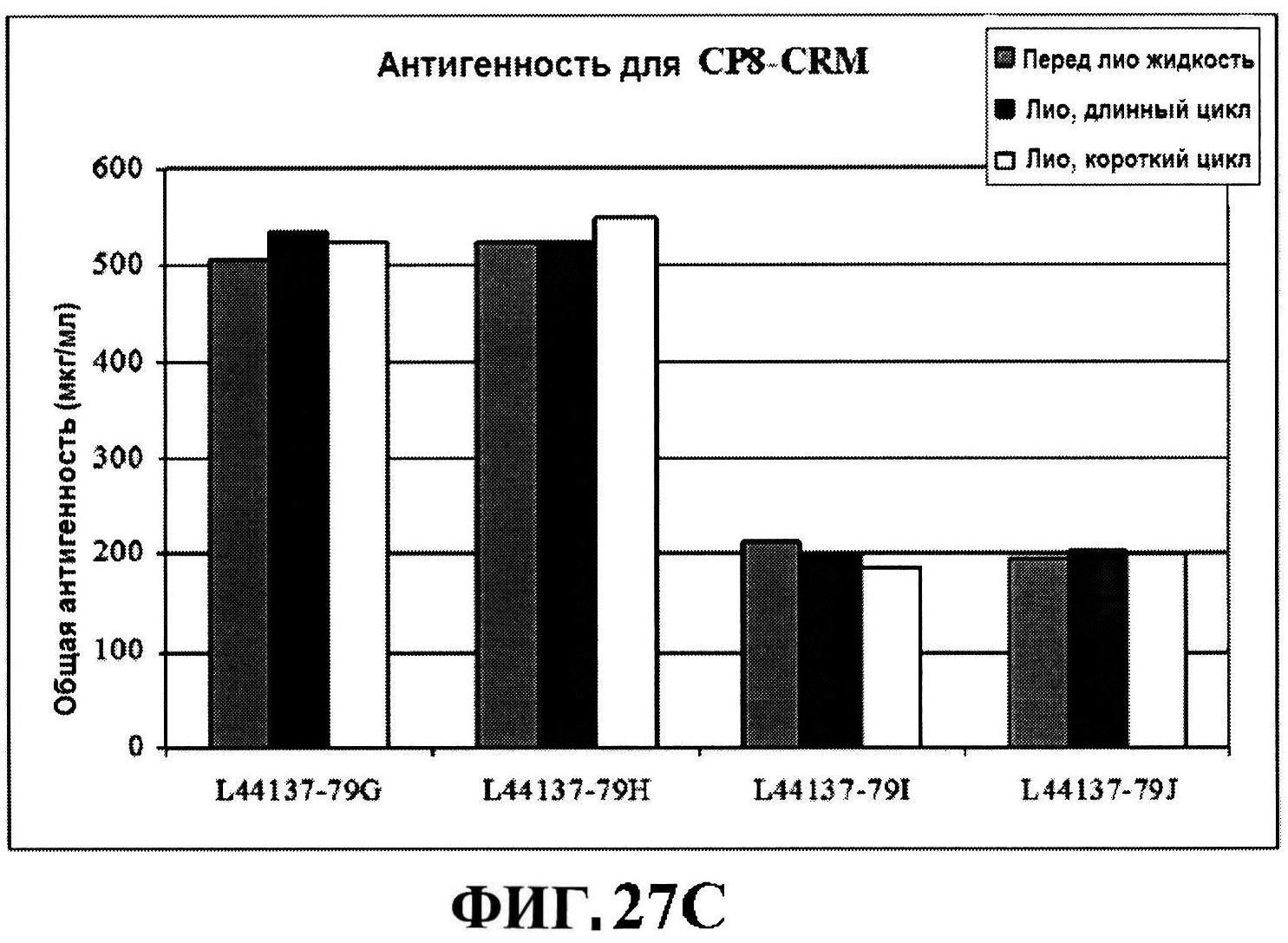
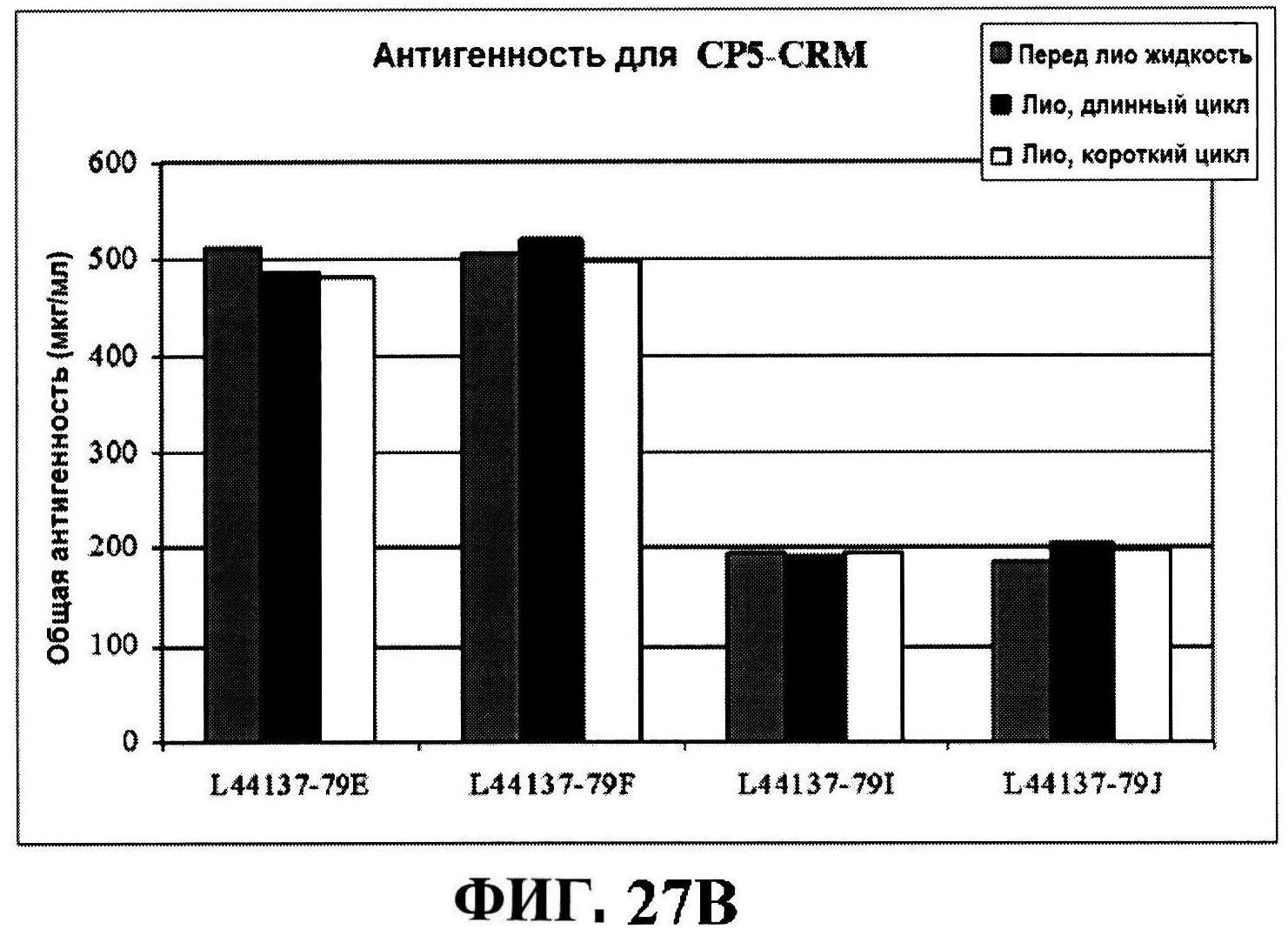
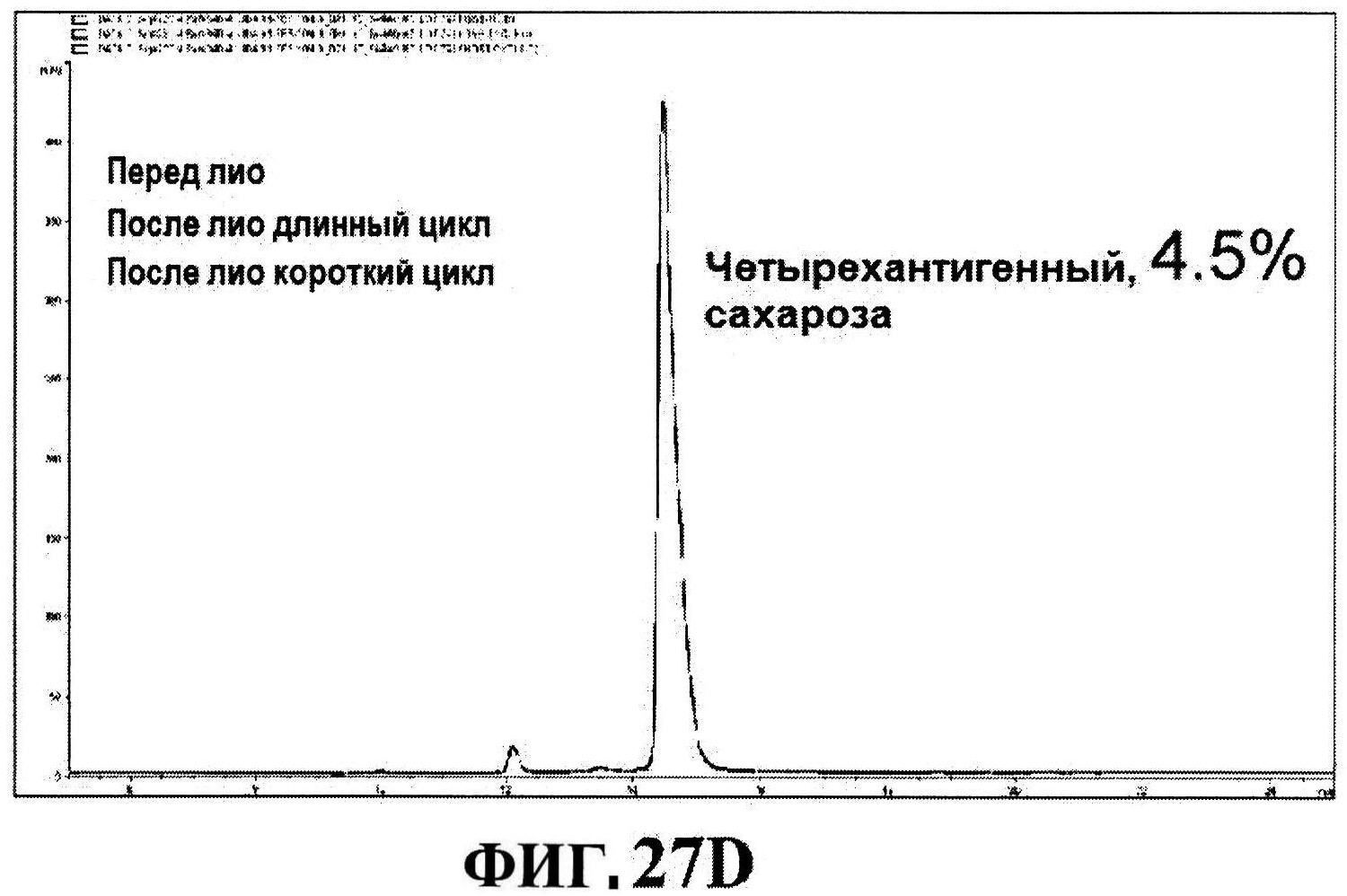
[0074] На фигуре 27 представлены данные перед лиофилизацией и после лиофилизации для всех четырех антигенов: данные обращено-фазовой ВЭЖХ для rmClfA и MntC (панель A), результаты нефелометрии для CP5-CRM197 (панель B) и CP8-CRM197 (панель C), данные катионообменной ВЭЖХ для MntC, используя 4,5% сахарозу (панель D) и 4% маннит/1% сахароза (панель E), данные ДСК (панель F) и процентная эффективность rmClfA (панель G) и конъюгатов (панель H).
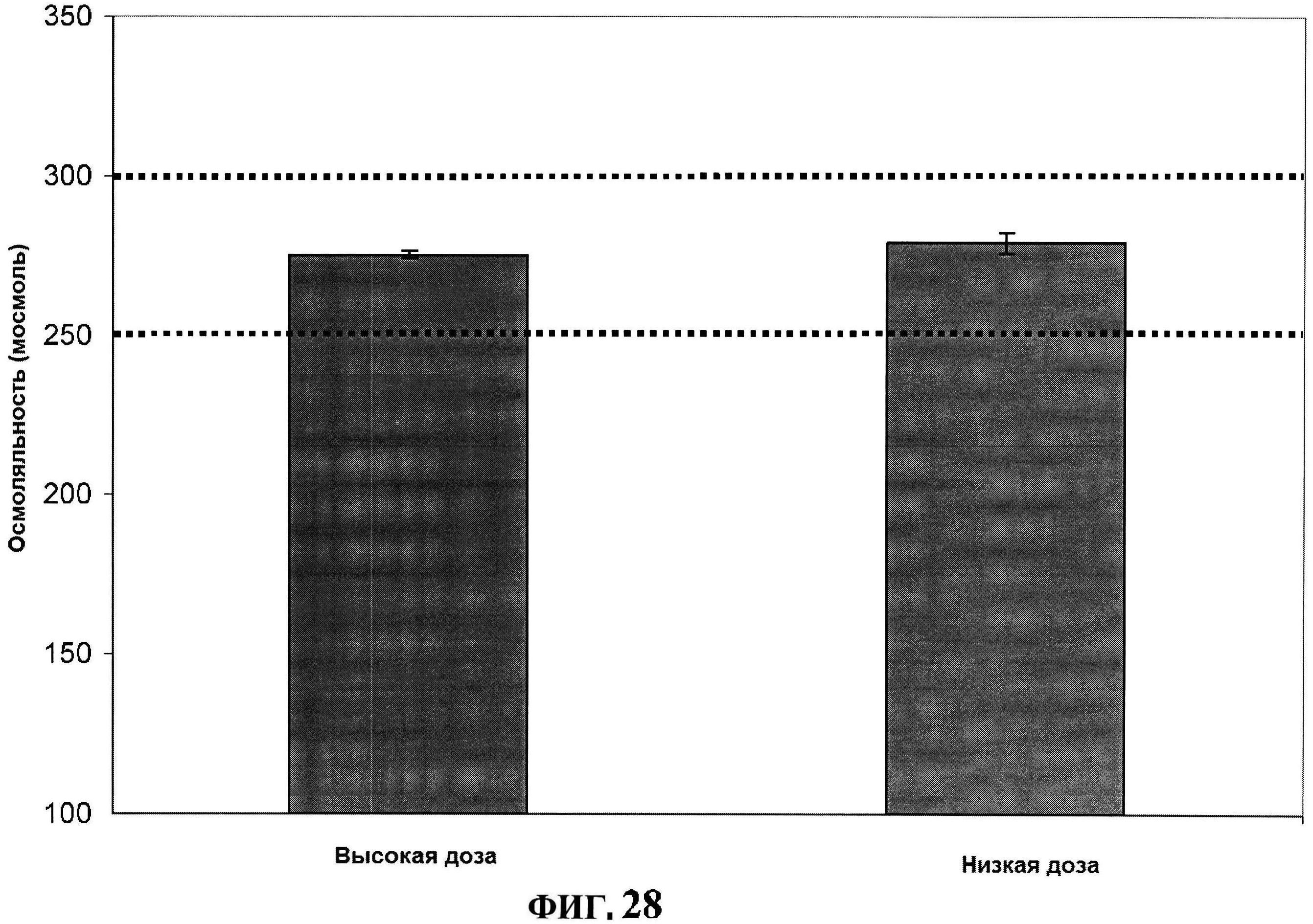
[0075] На фигуре 28 представлена осмоляльность высоко и низко дозированных составов.
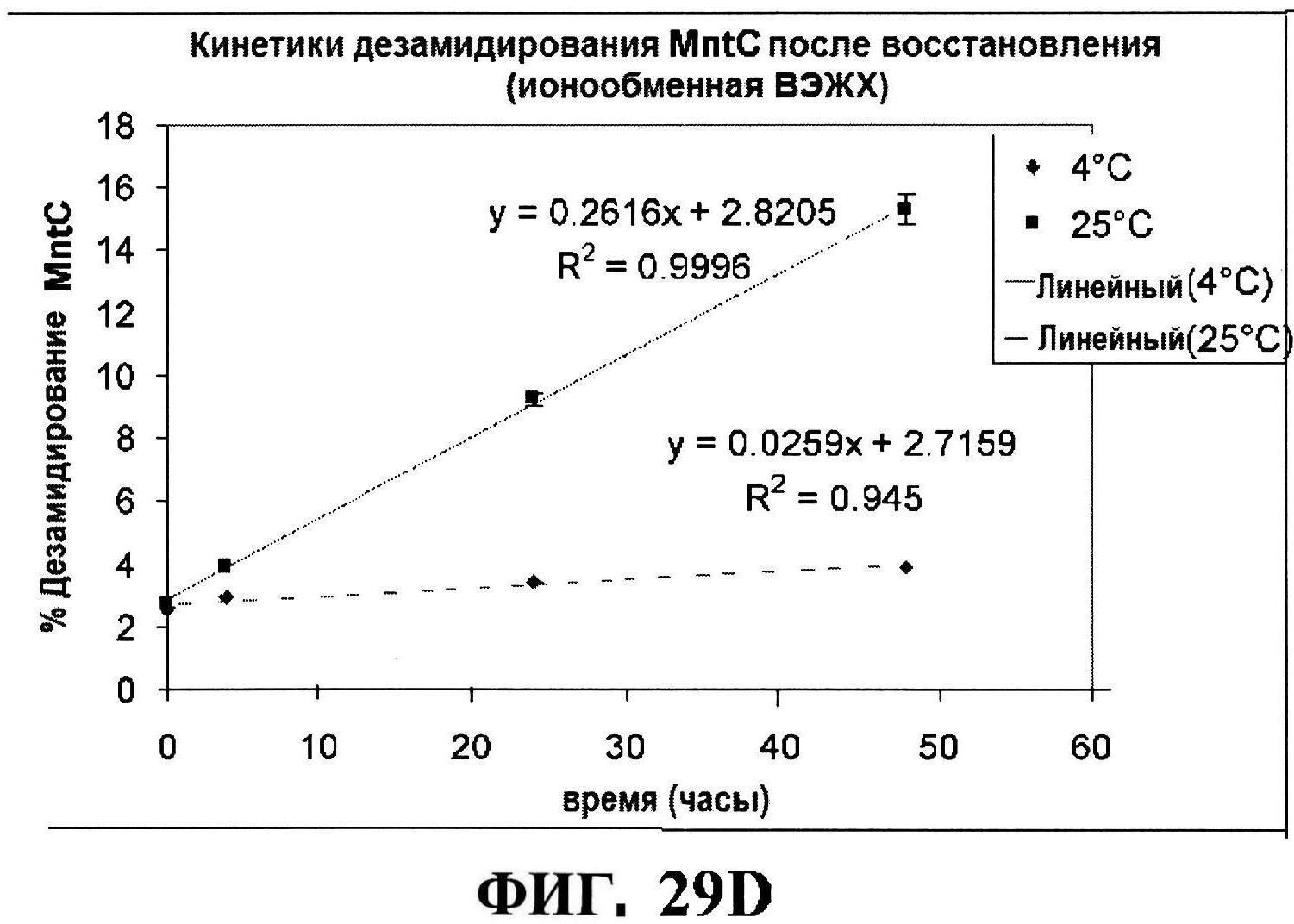
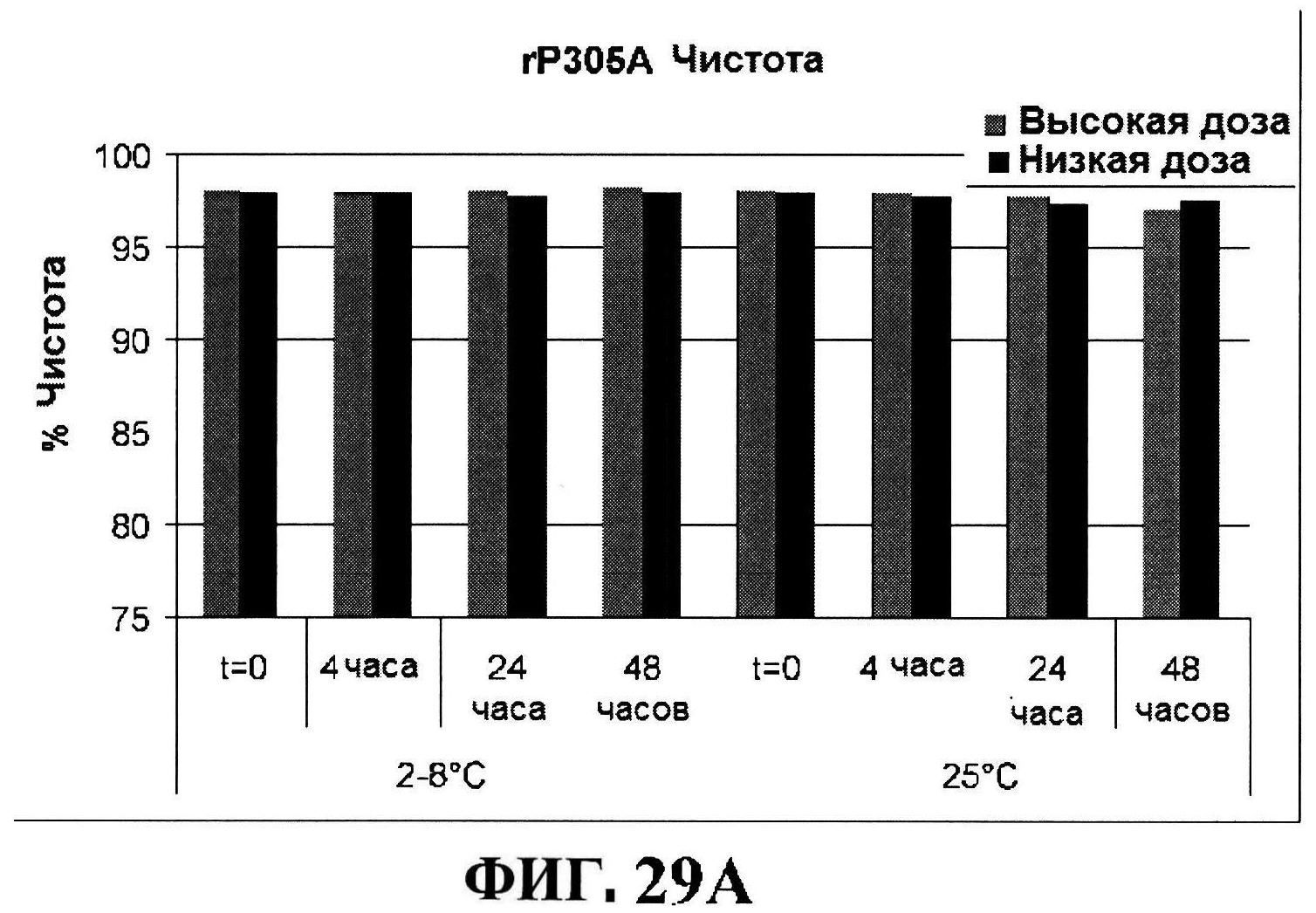
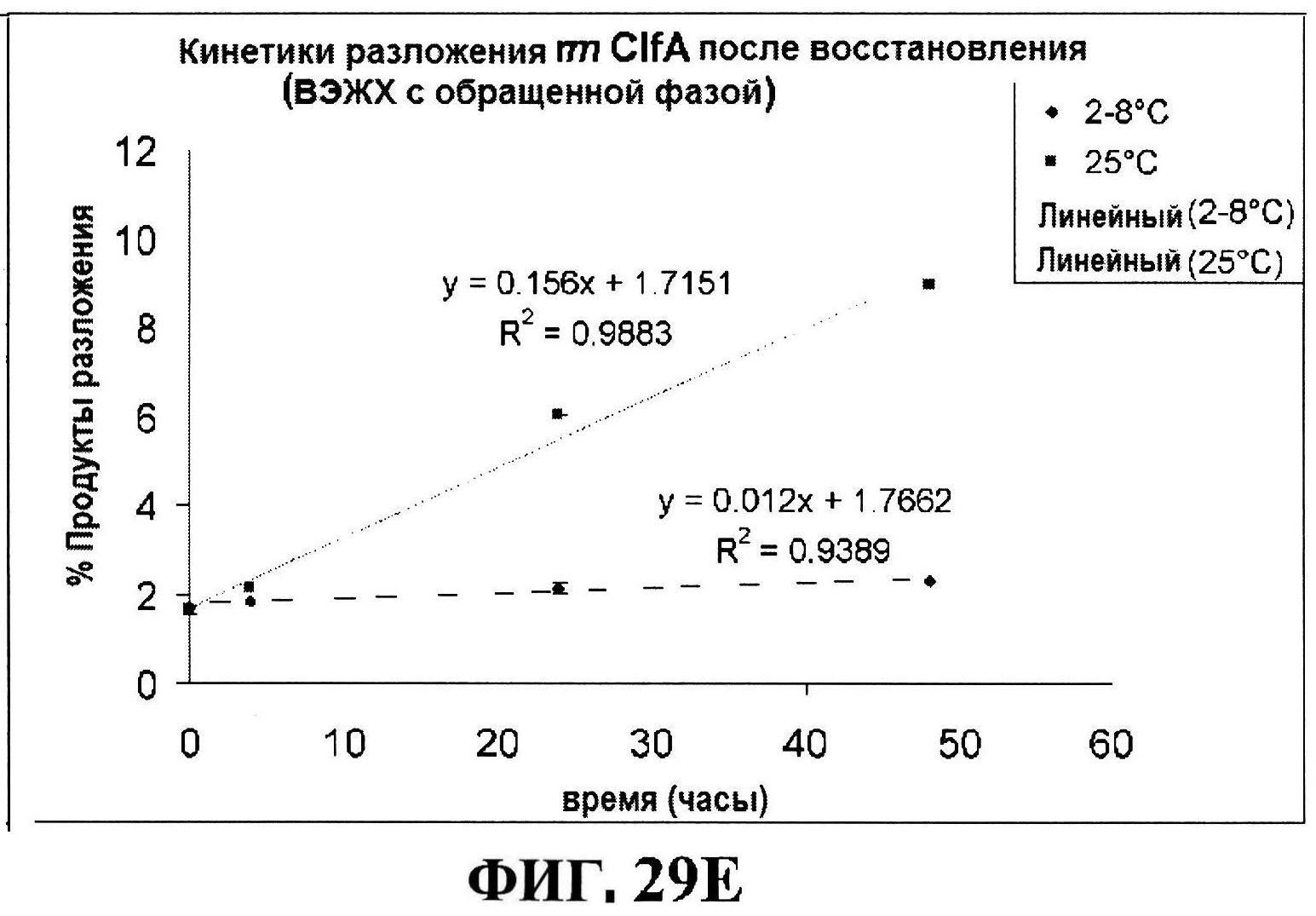
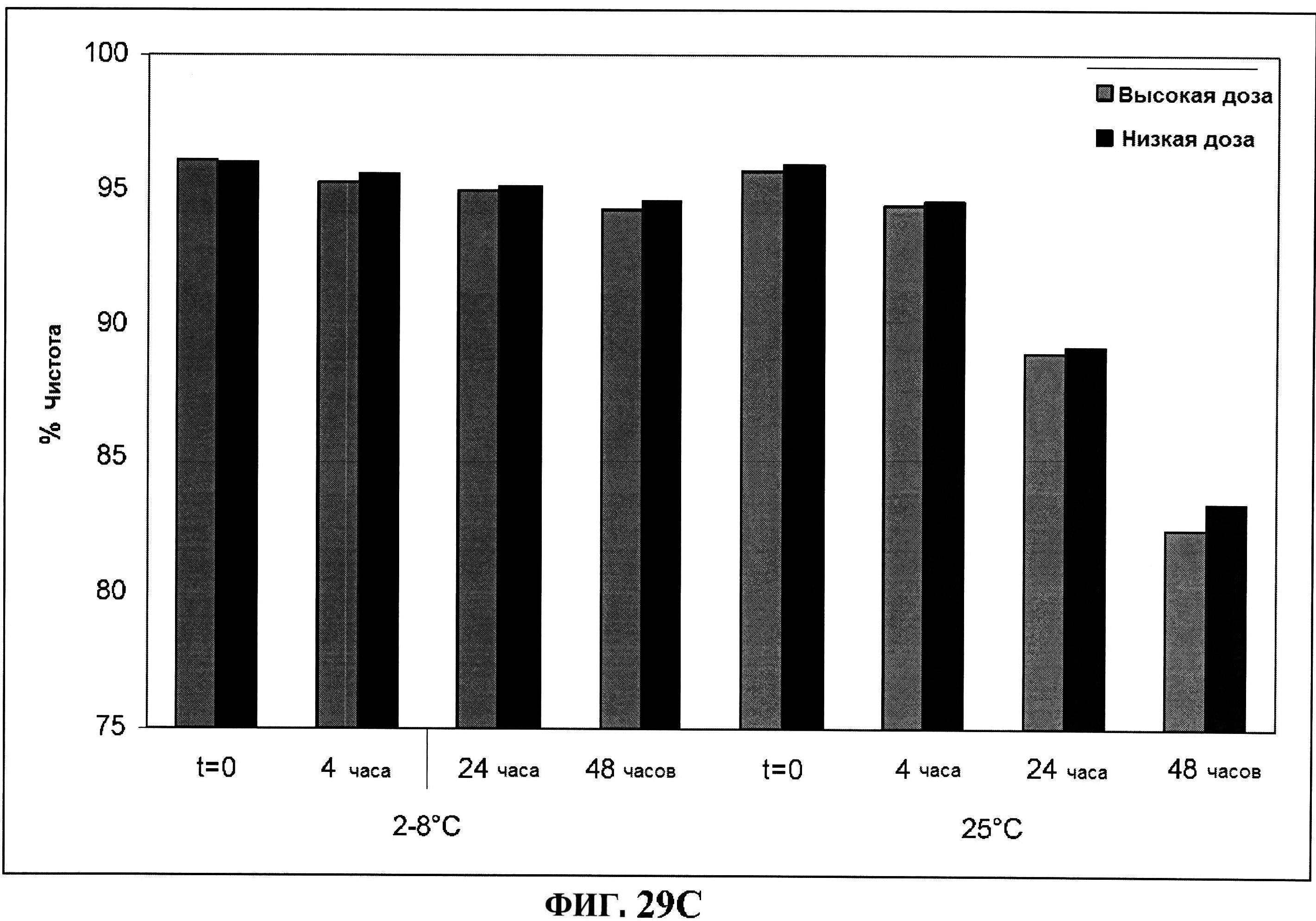
[0076] На фигуре 29 представлены данные обращено-фазовой ВЭЖХ по чистоте для MntC (панель A) и rmClfA (панель В), данные ионообменной ВЭЖХ по чистоте для MntC (панель C), и кинетики после восстановления MntC (панель D) и разложения rmClfA (панель E).
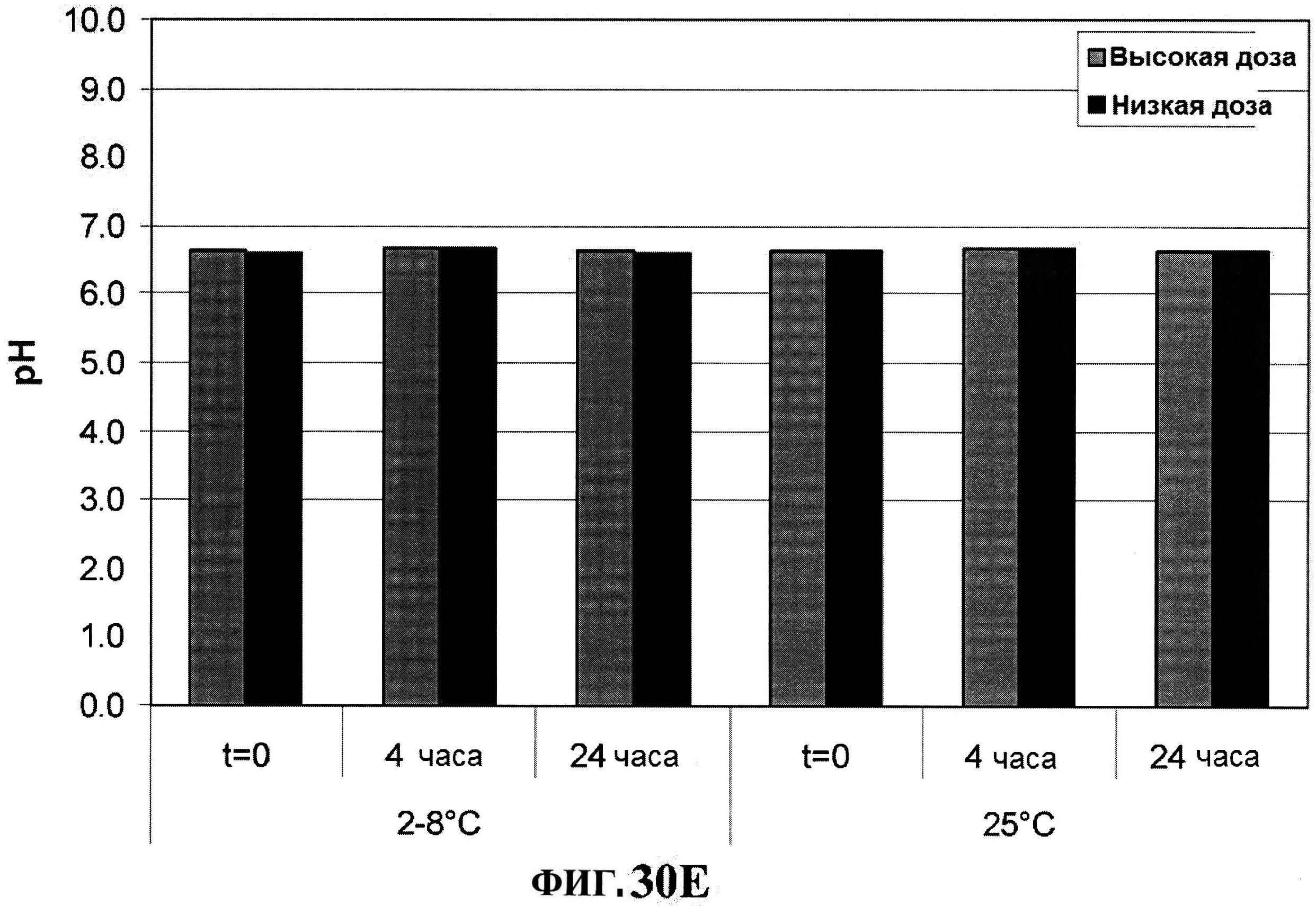
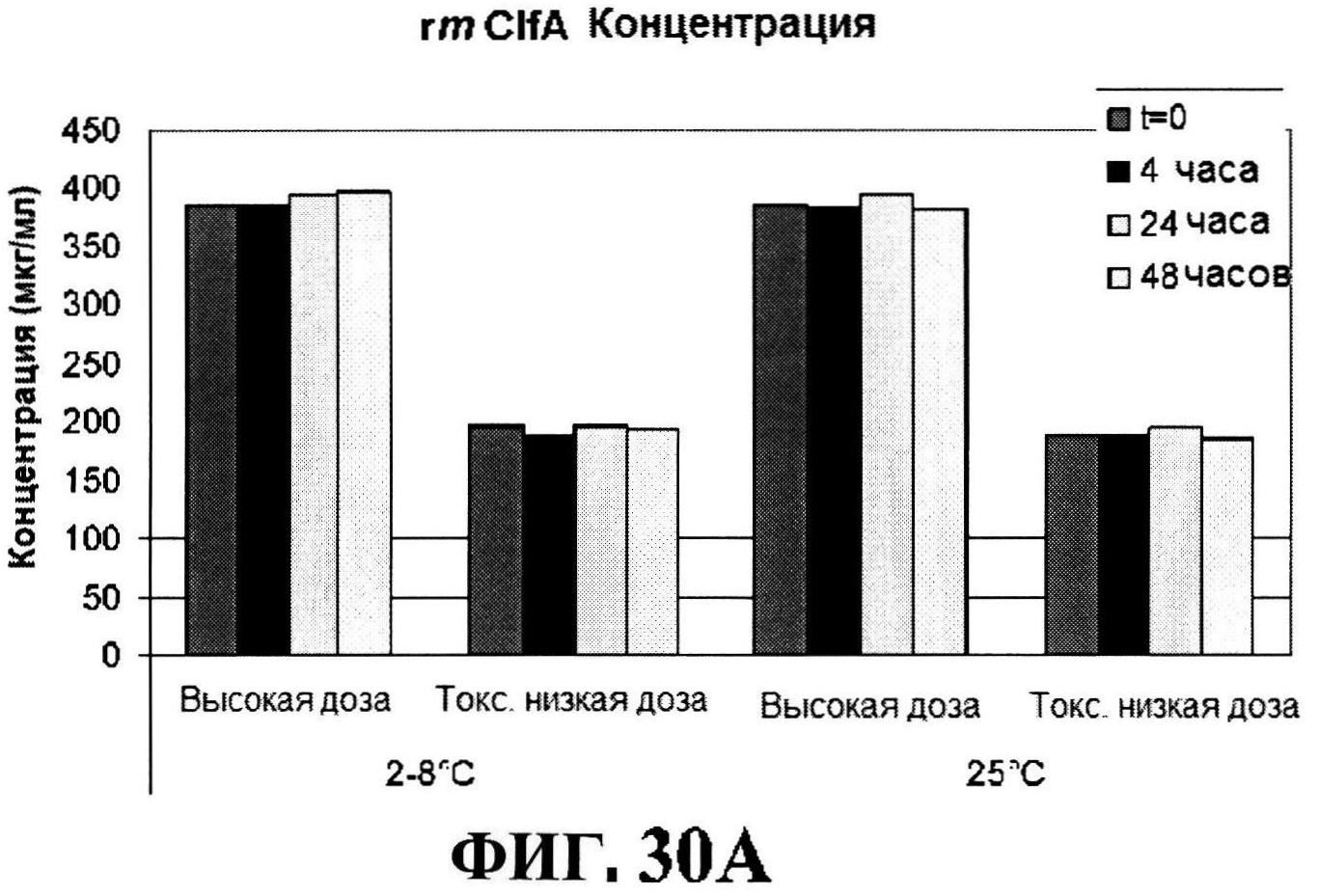
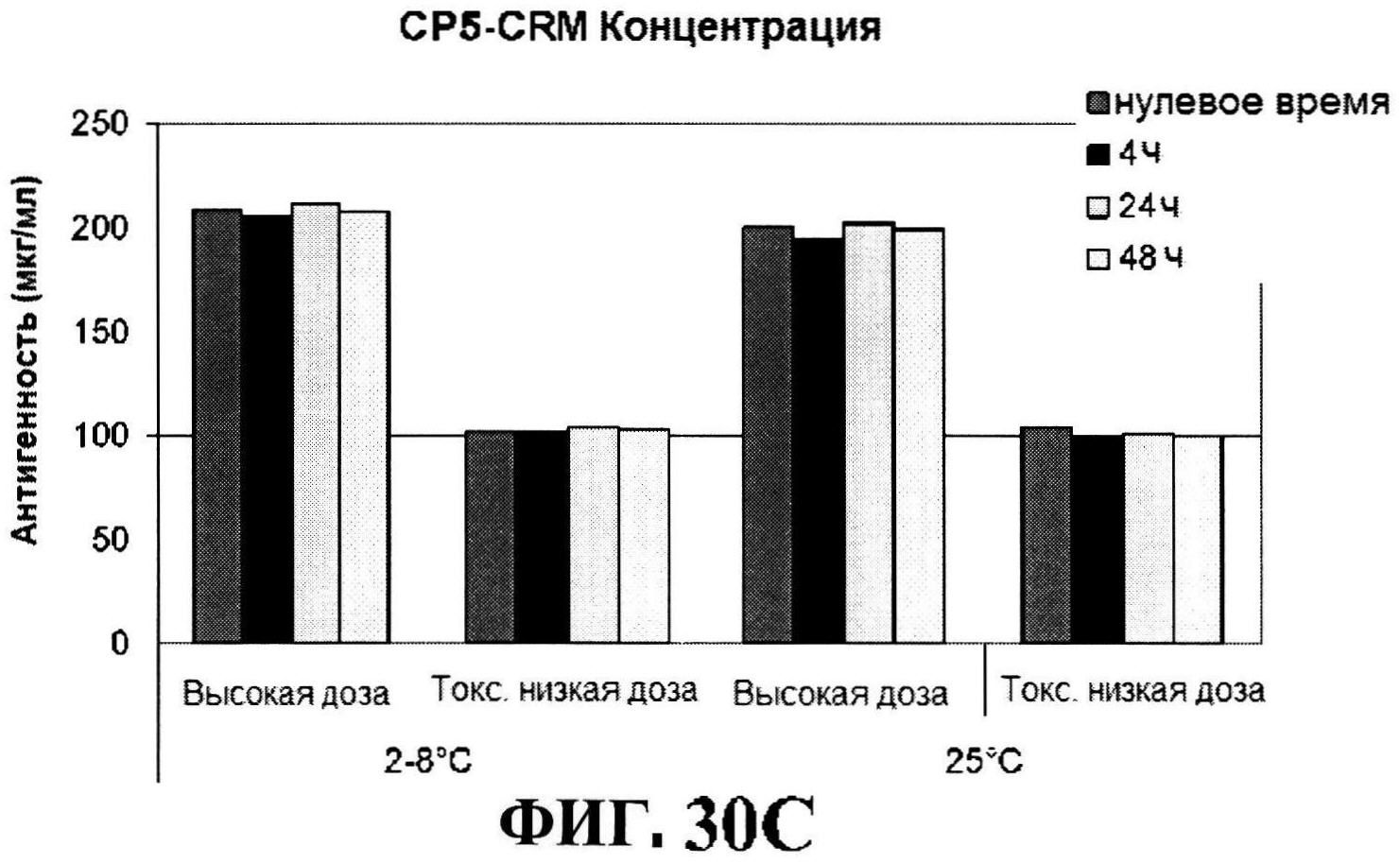
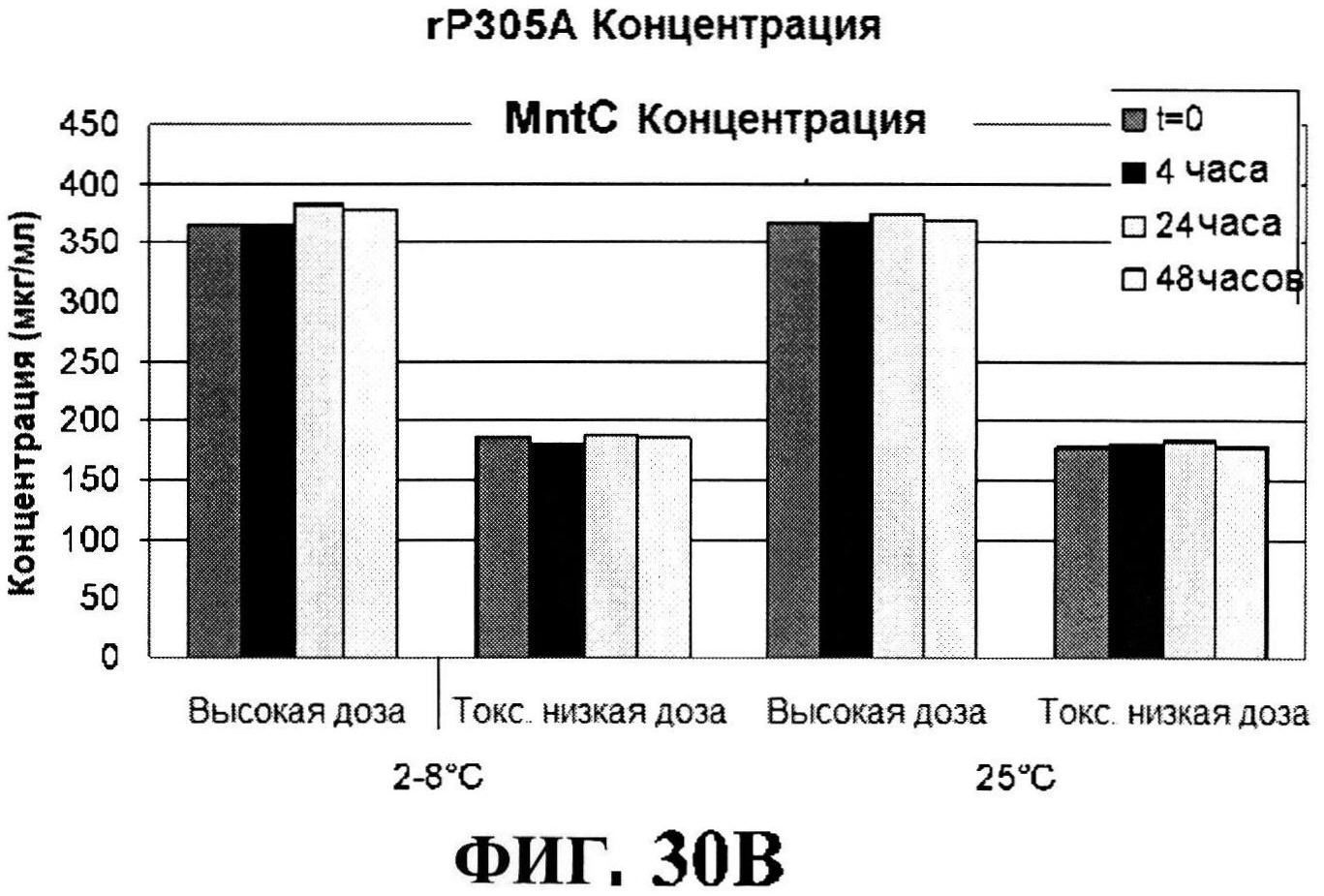
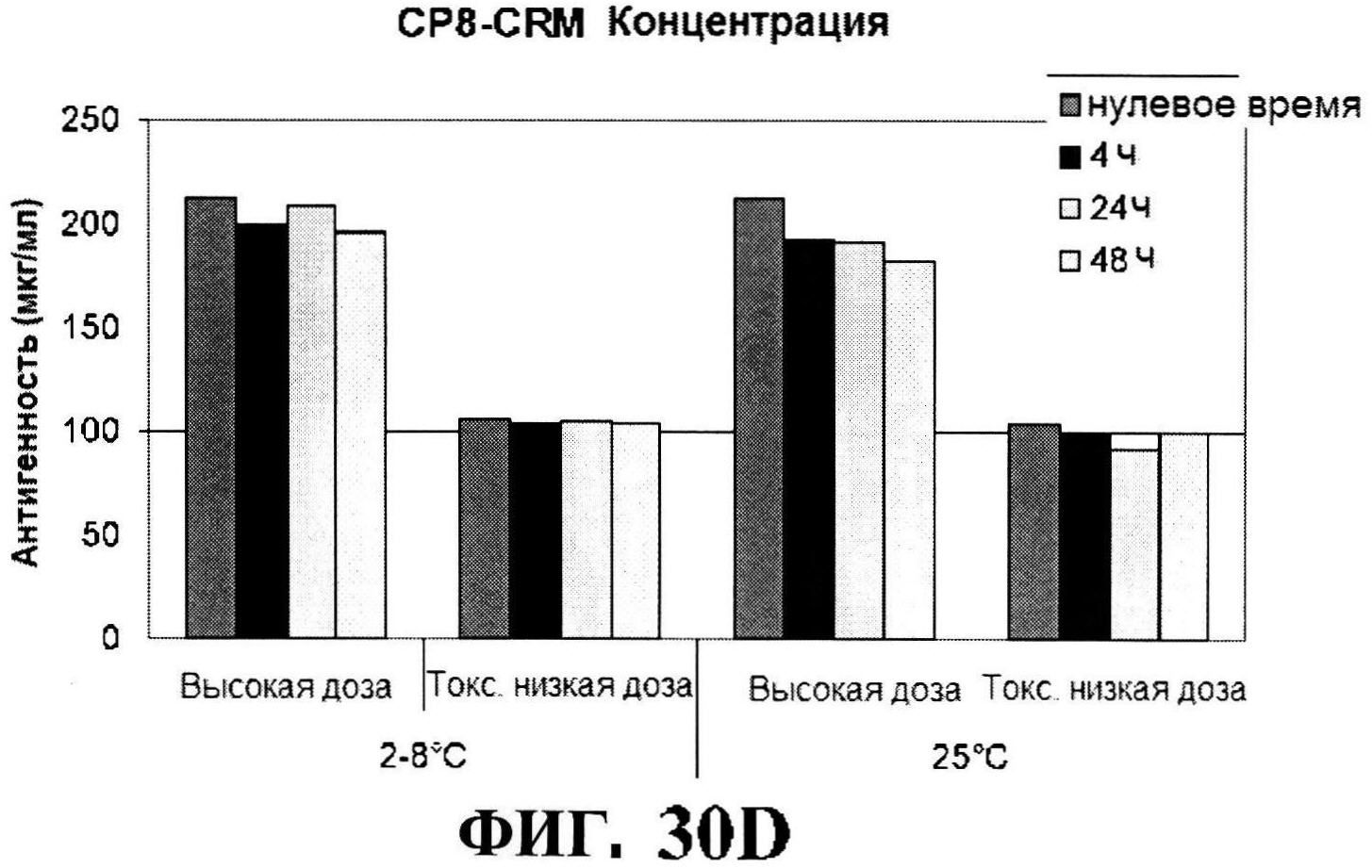
[0077] На фигуре 30 представлены концентрация антигена после восстановления (панели A-D) и pH стабильности (панель Е).
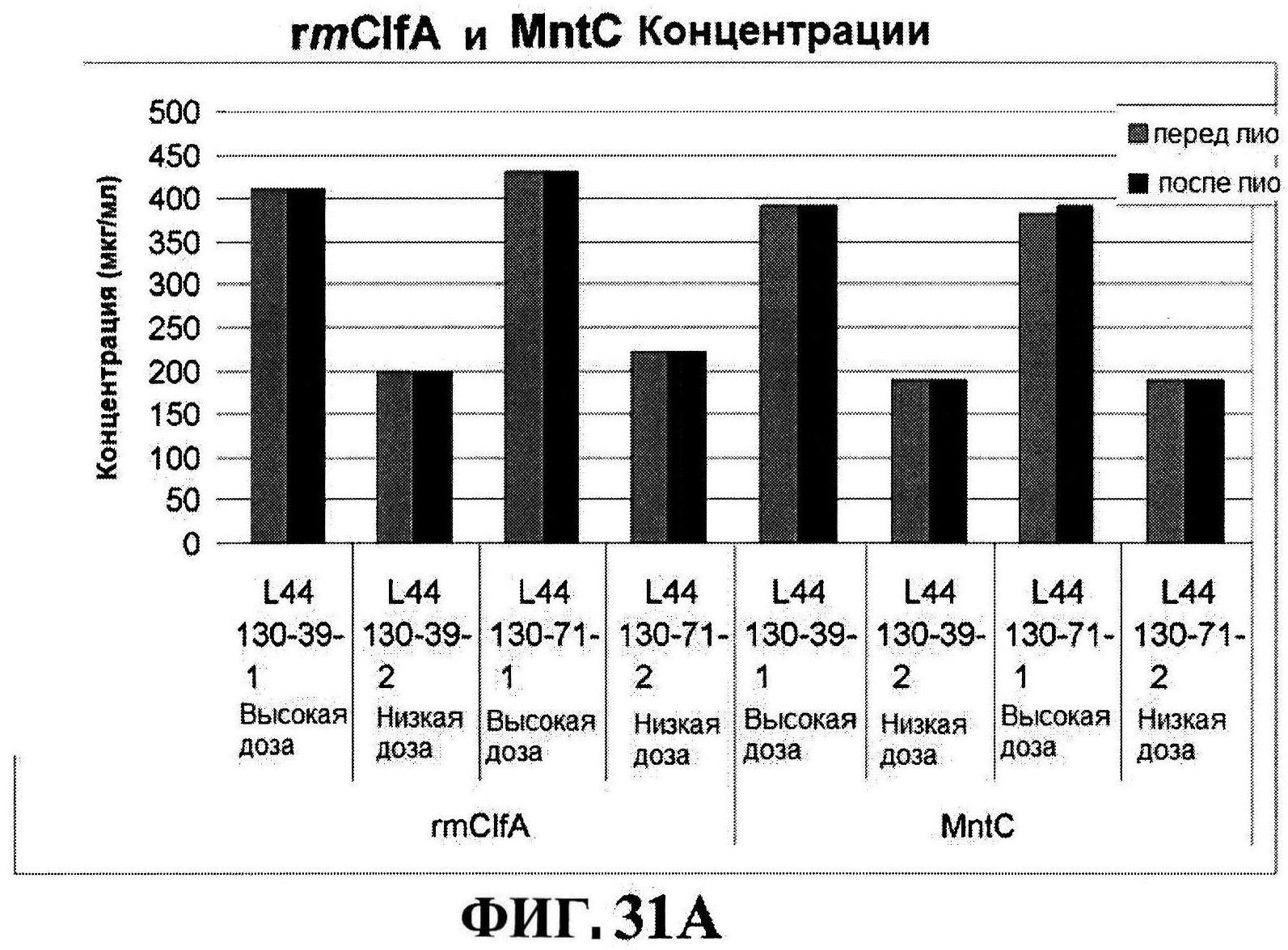
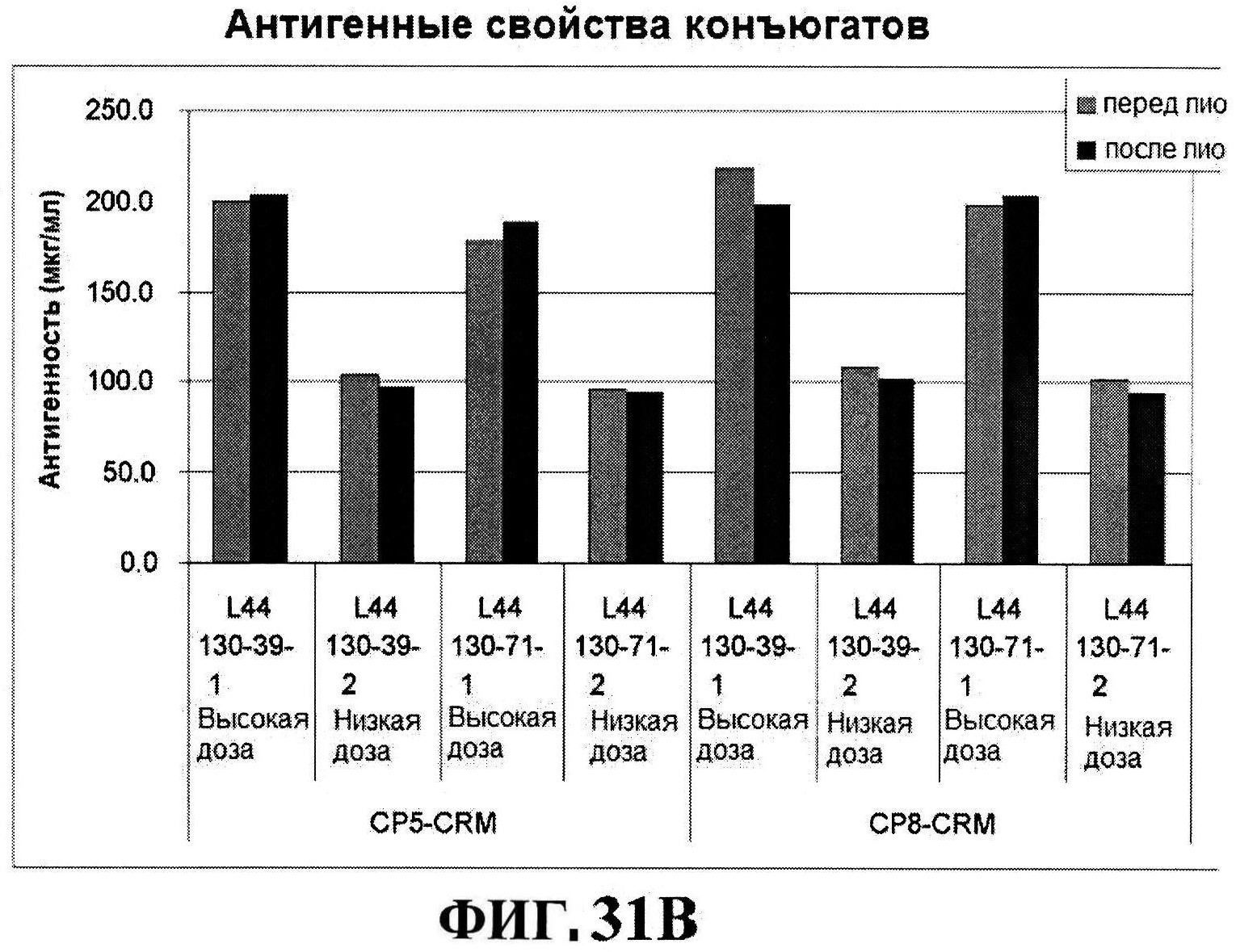
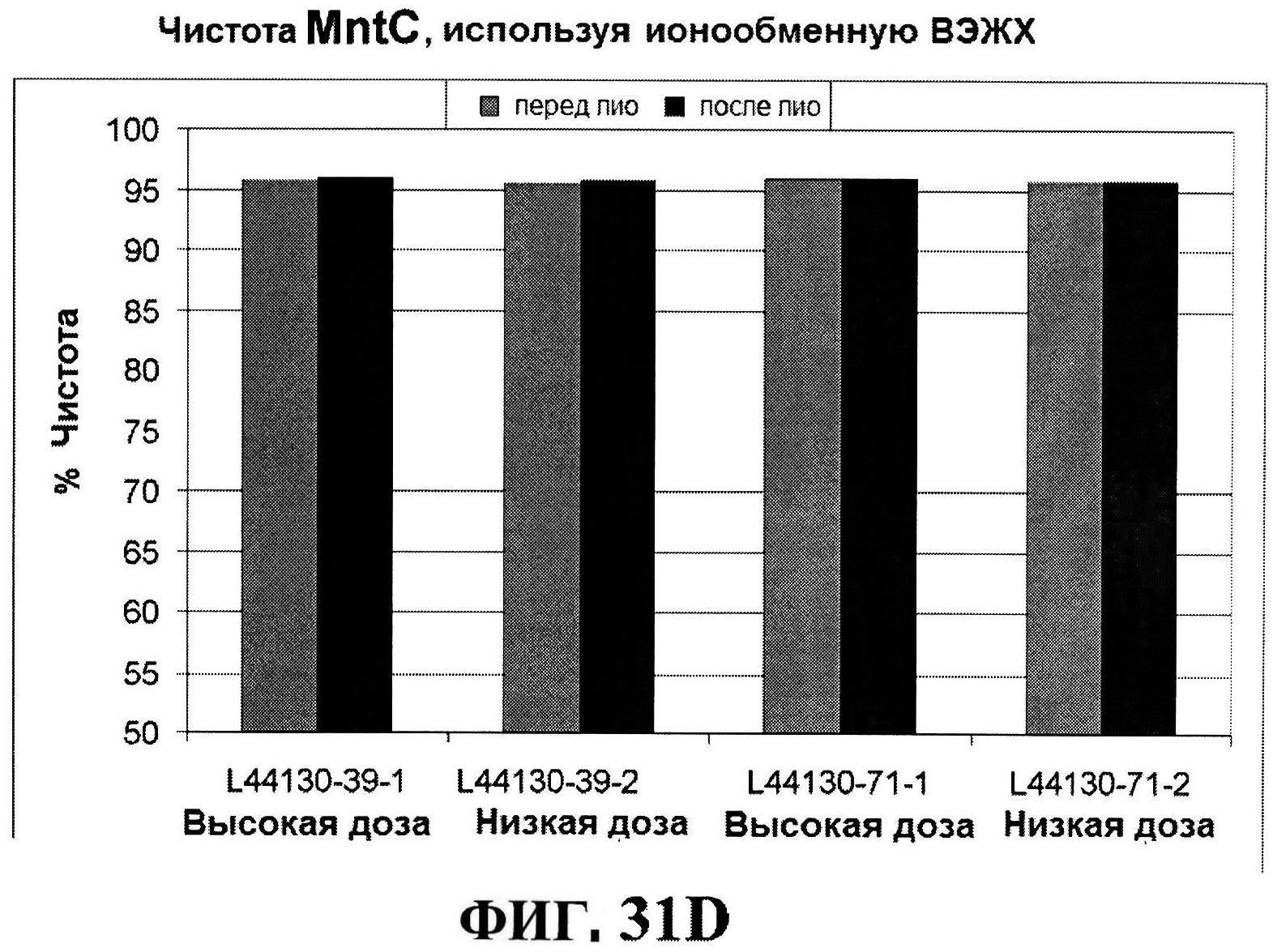
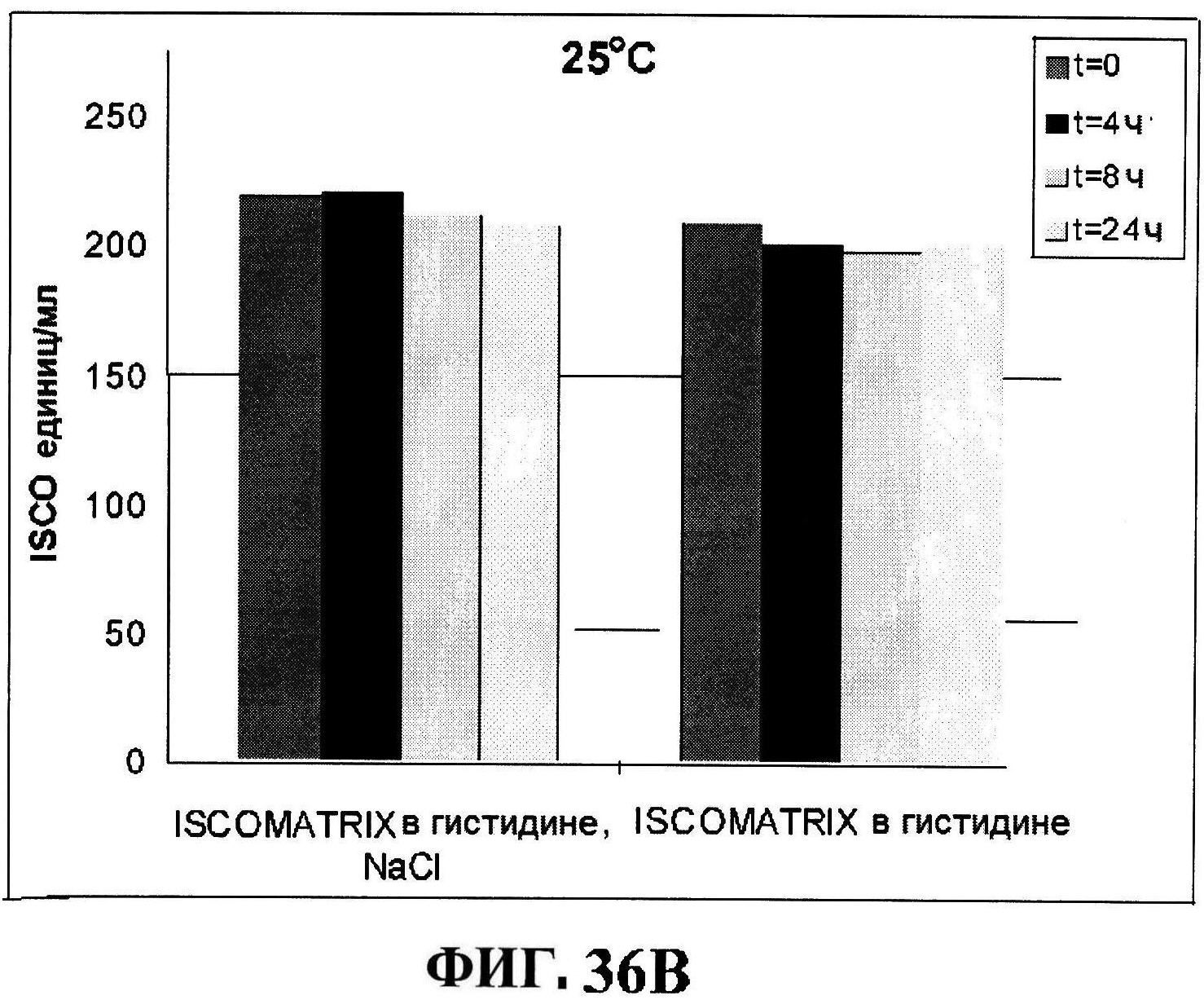
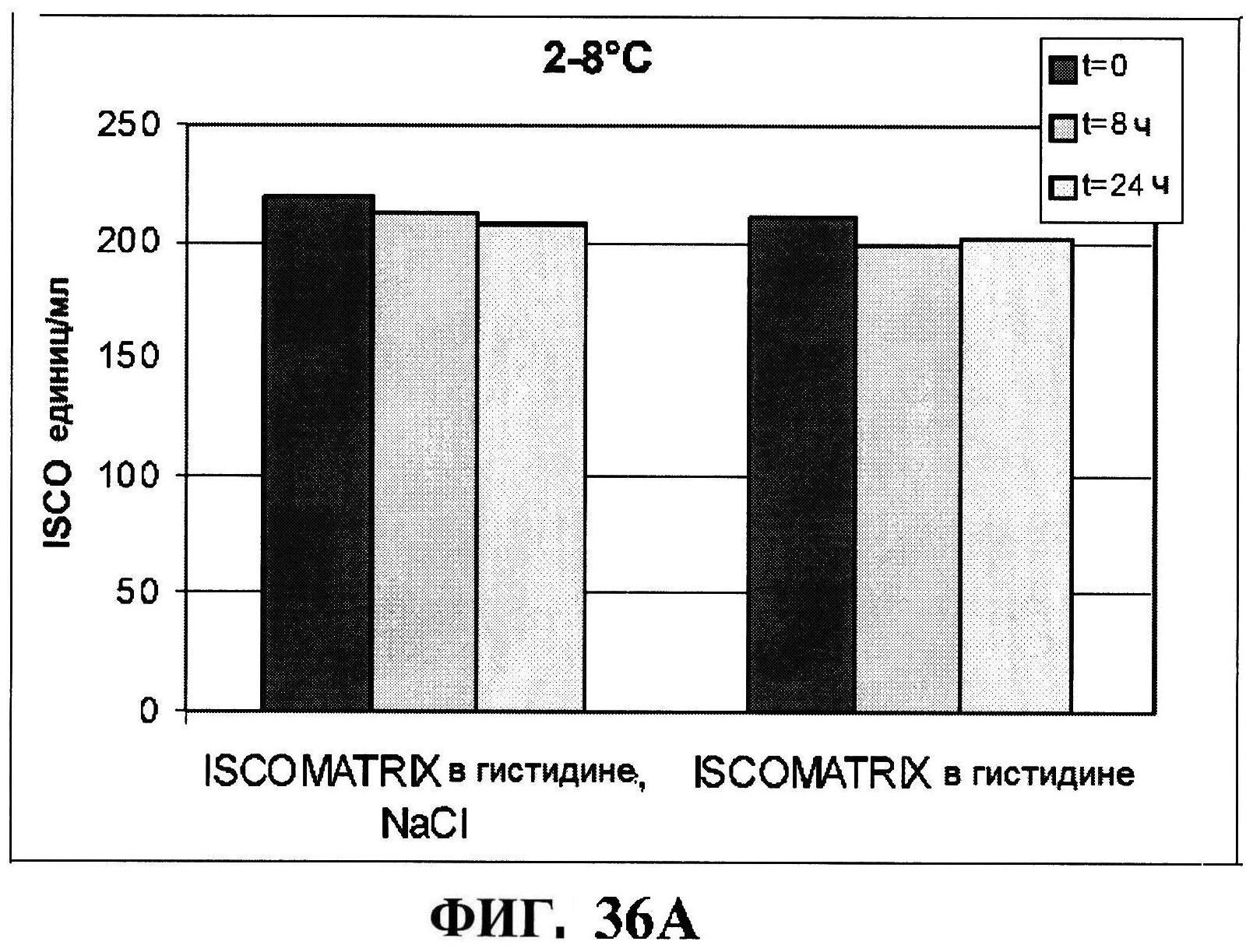
[0078] На фигуре 31 представлен после-лиофилизационный процесс восстановления концентрации антигена (панели A и B) и чистота (панели C и D).
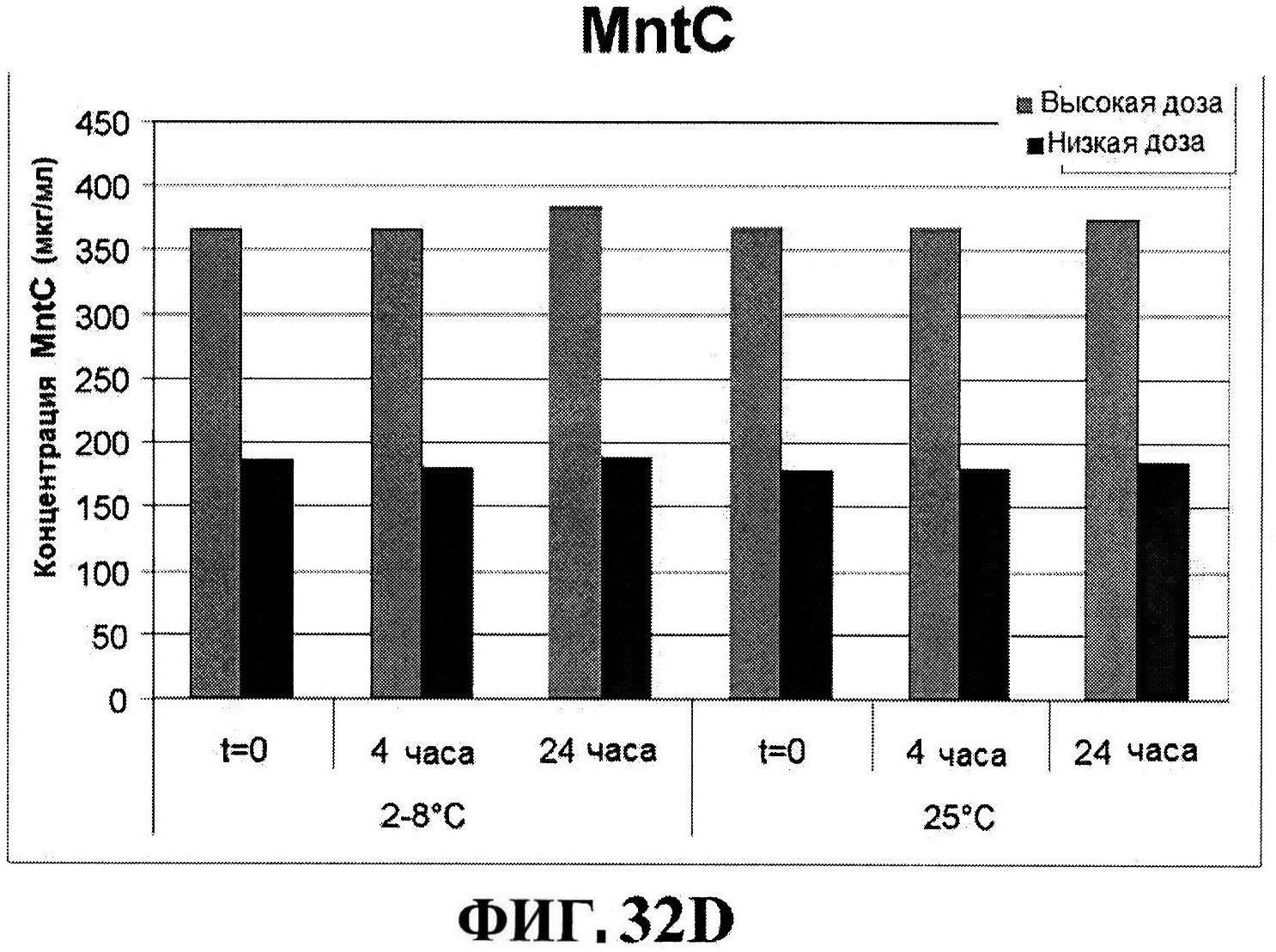
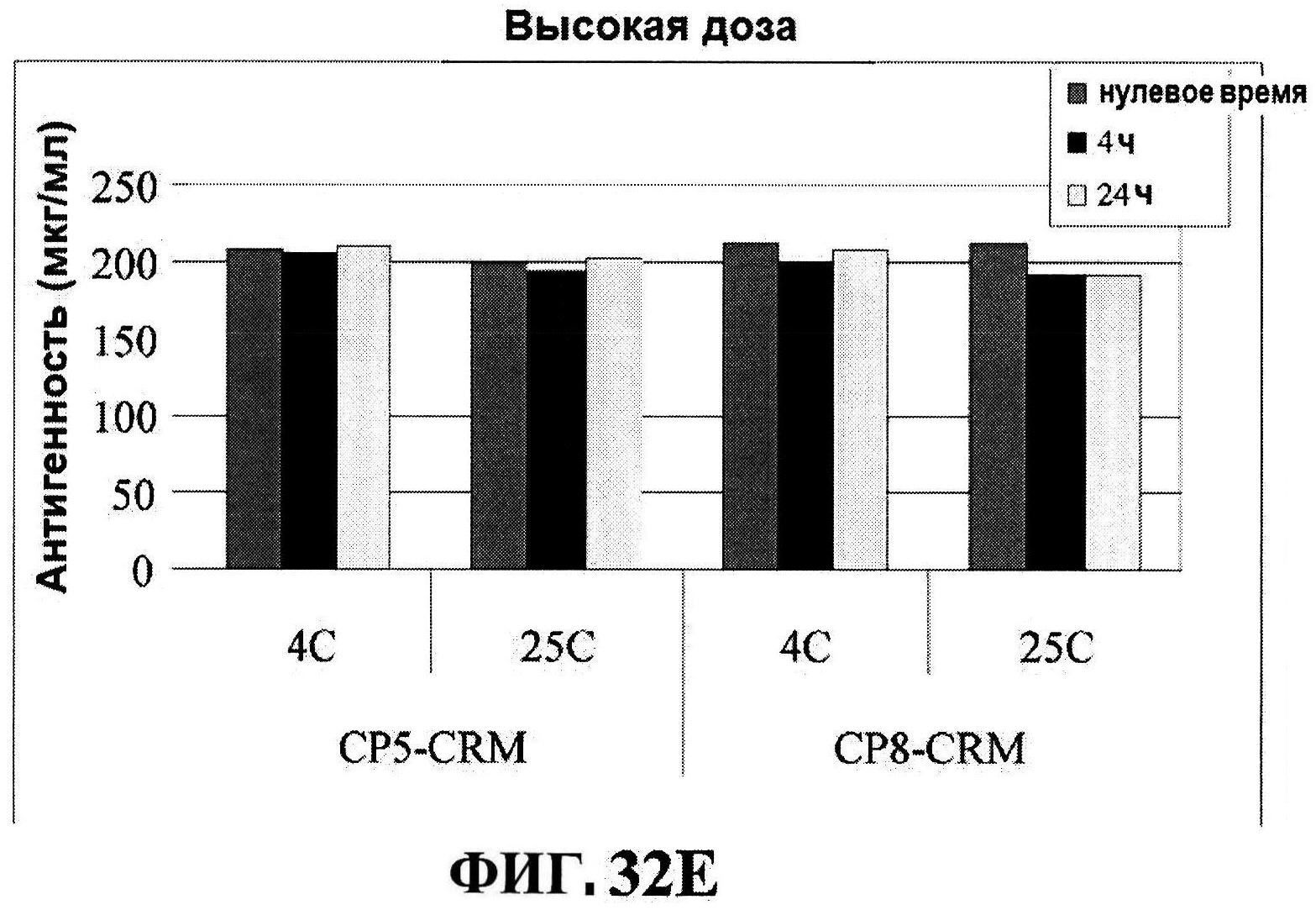
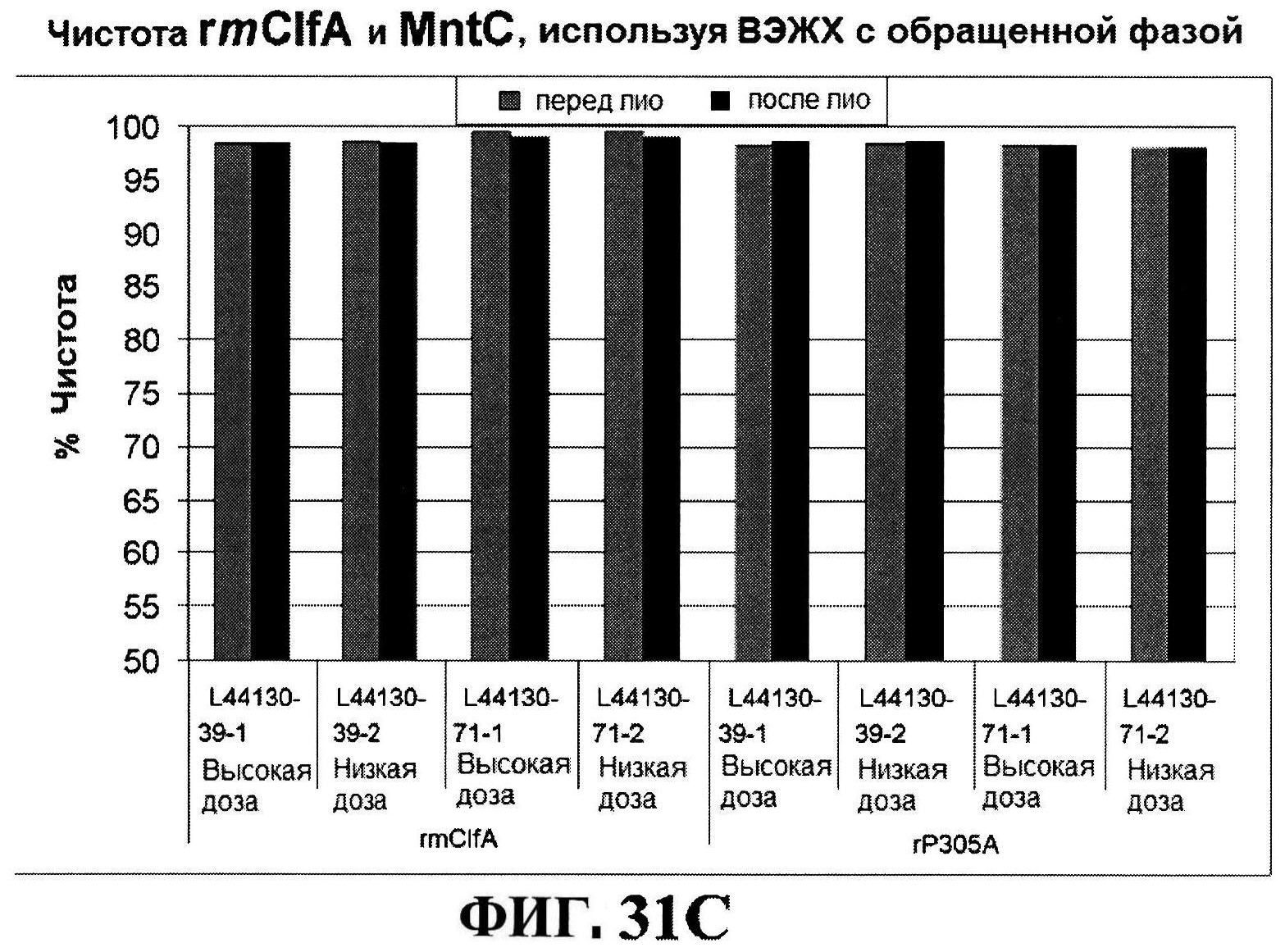
[0079] Фигура 32 демонстрирует после восстановления rmClfA (панель A) и чистоту MntC (панель B), концентрацию rmClfA (панель C) и MntC (панель D), концентрацию СР5-CRM197 (панель Е) и CP8-CRM197 (панель F), и pH стабильность (панель G).
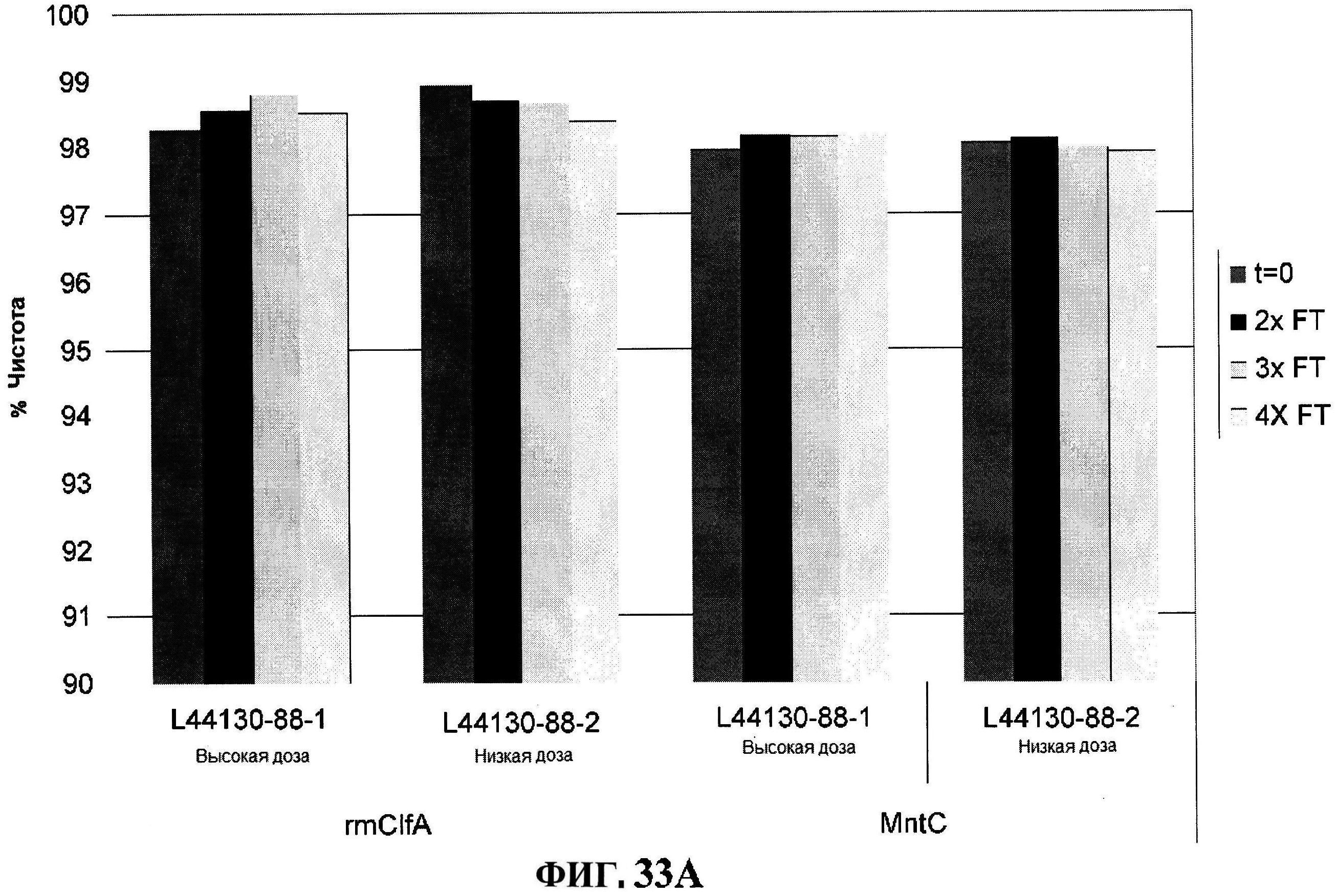
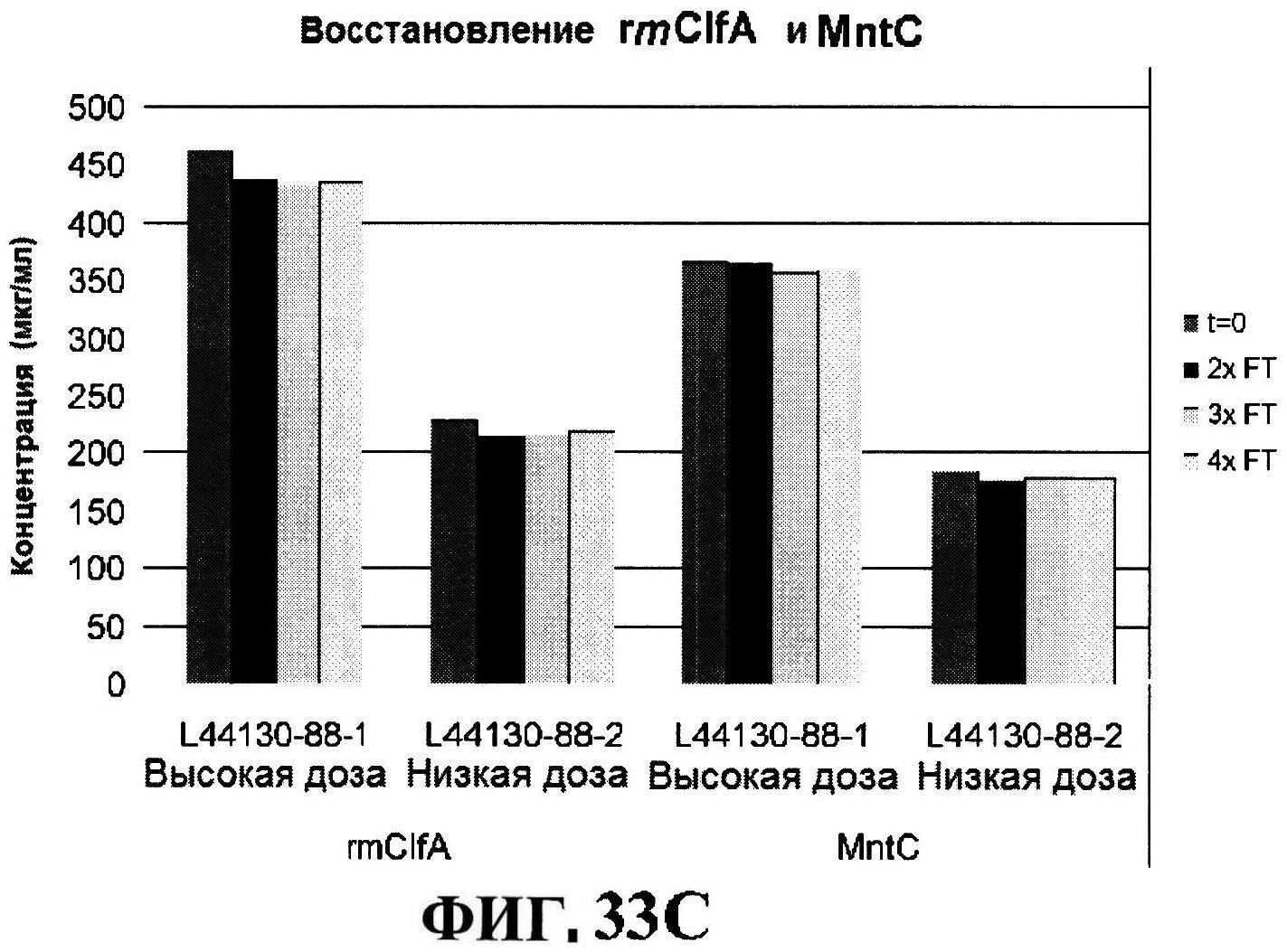
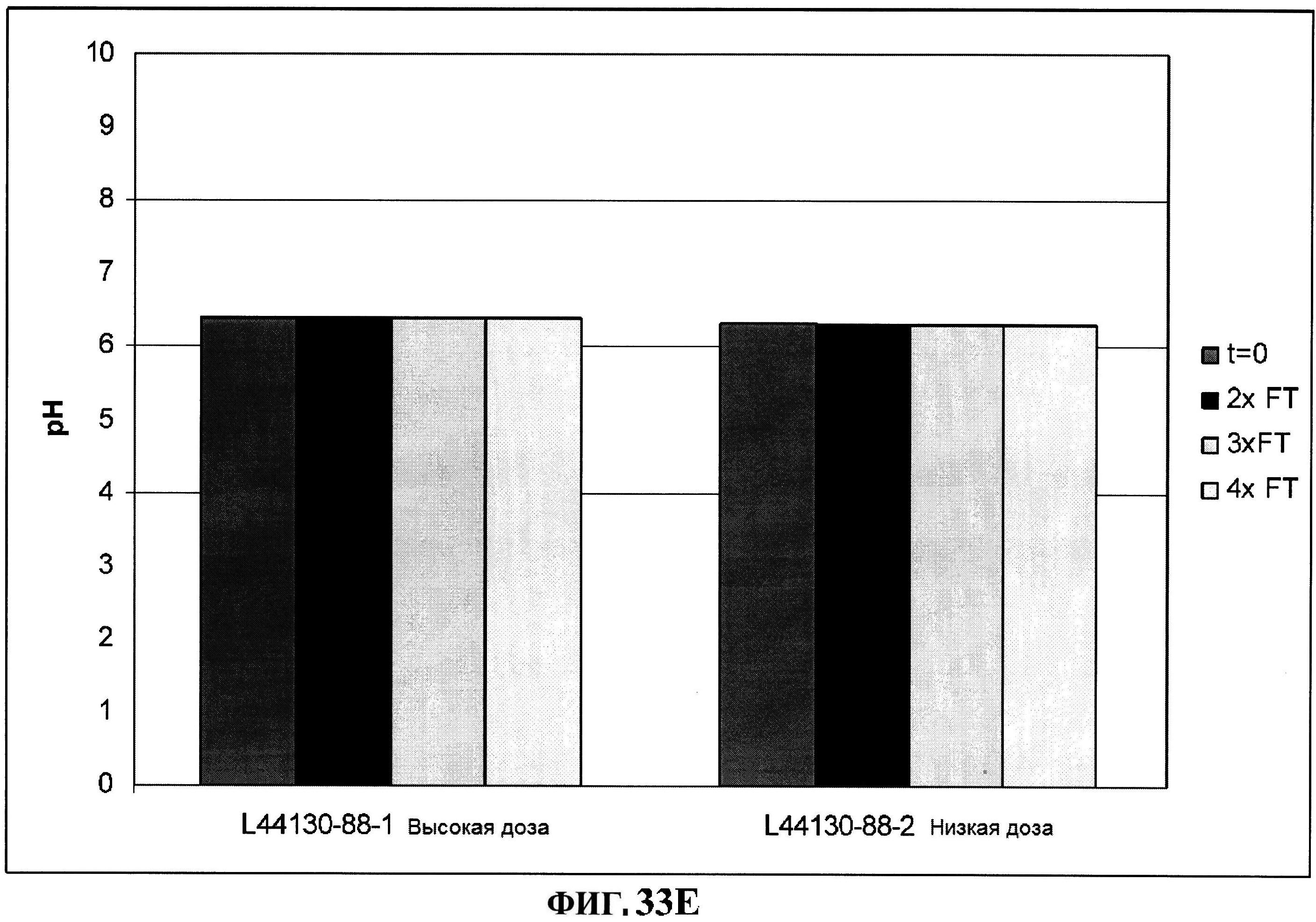
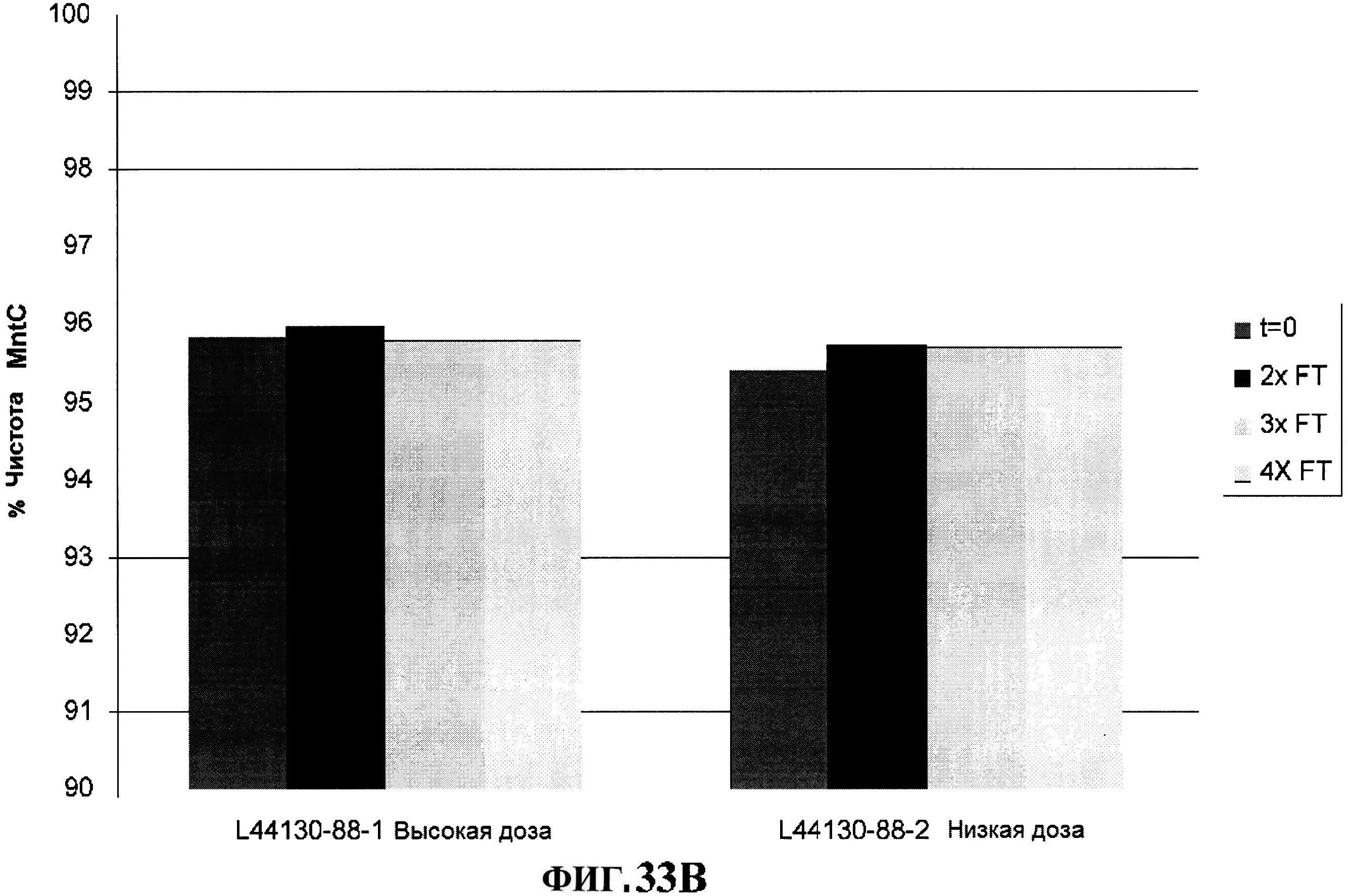
[0080] На фигуре 33 изображено размораживание после замораживания rmClfA и чистота MntC, полученная с использованием обращено-фазовой ВЭЖХ (панель A), чистота MntC, полученная с использованием ионообменной ВЭЖХ (панель B), концентрации антигенов (панели С и D) и pH стабильность (панель E).
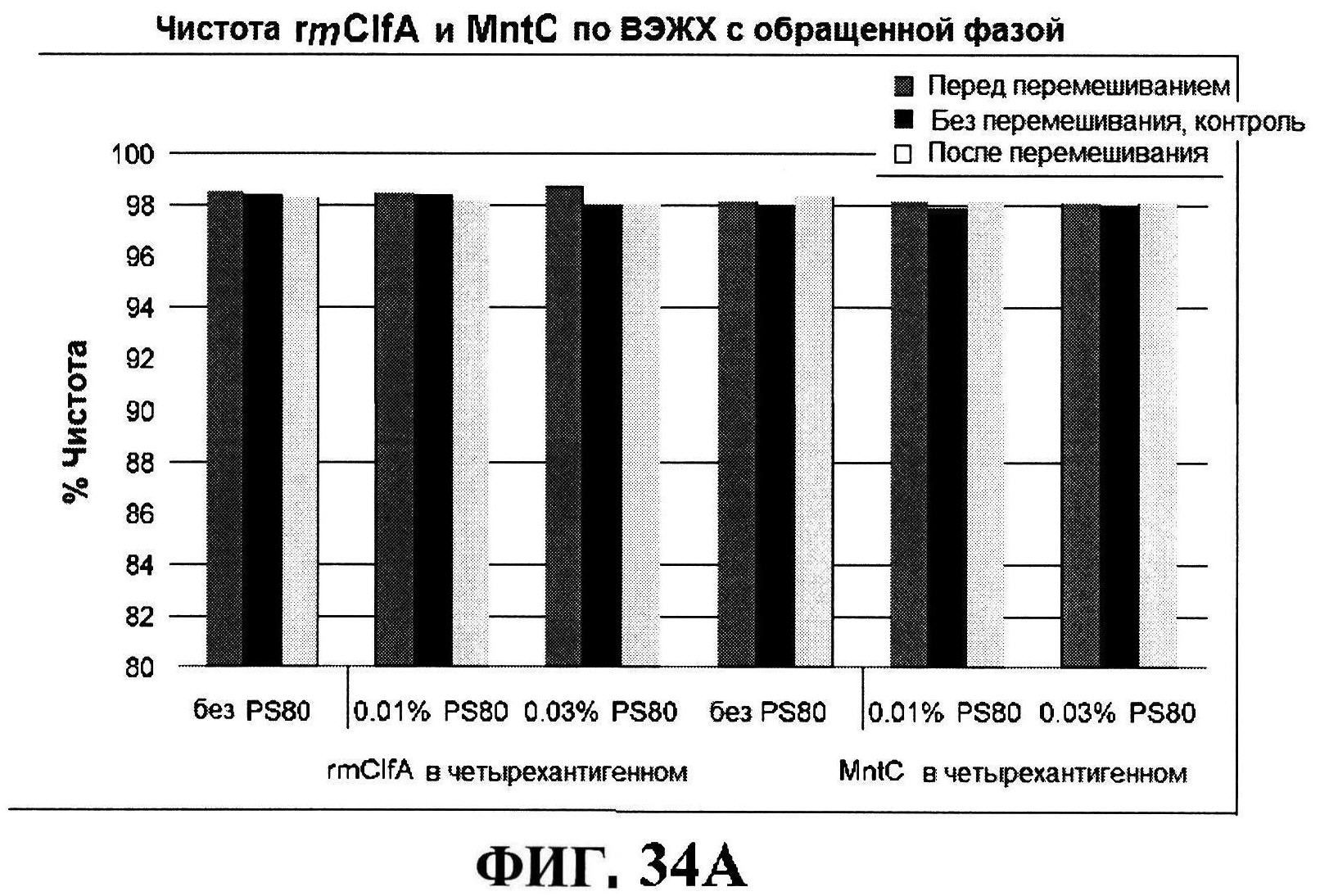
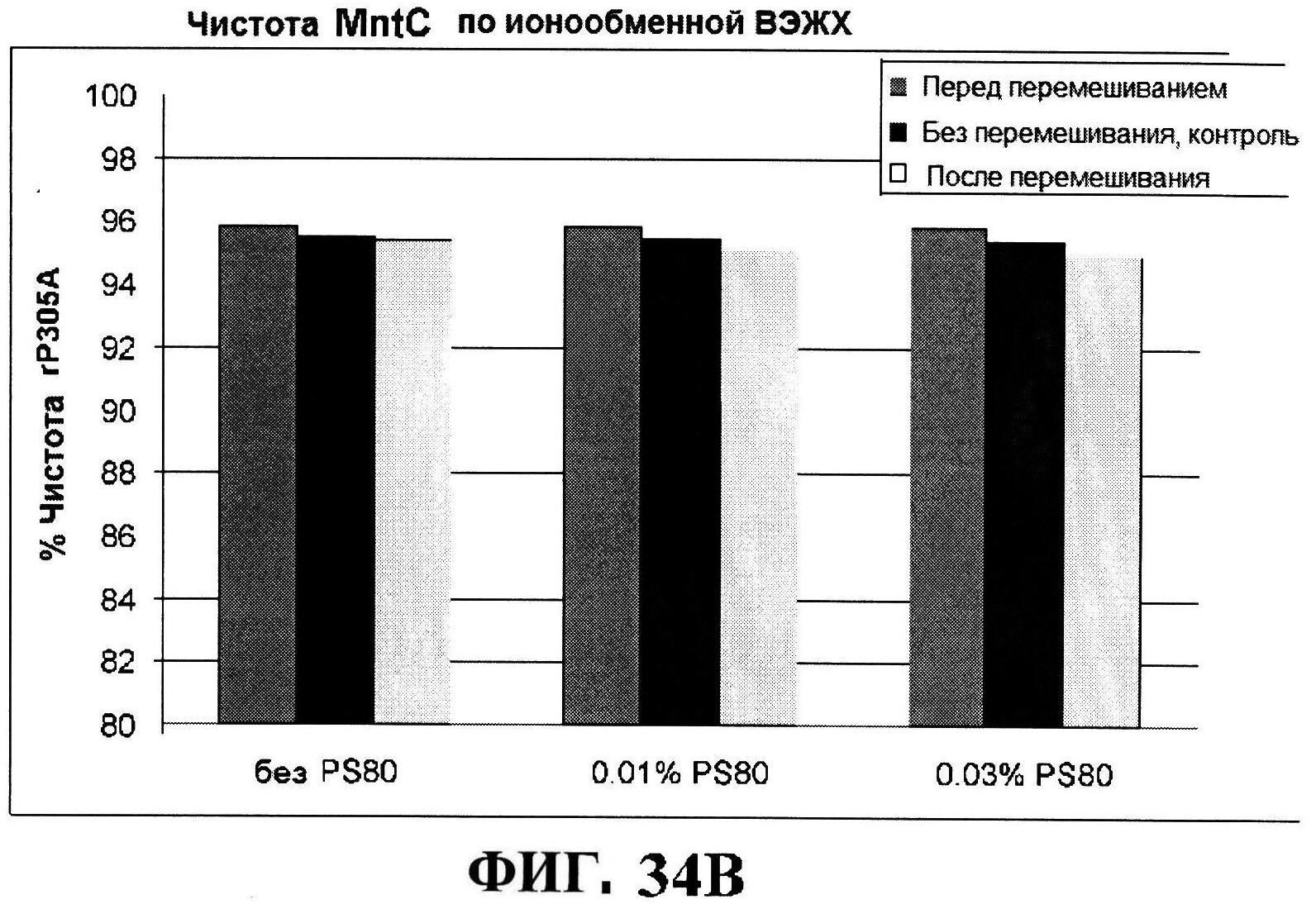
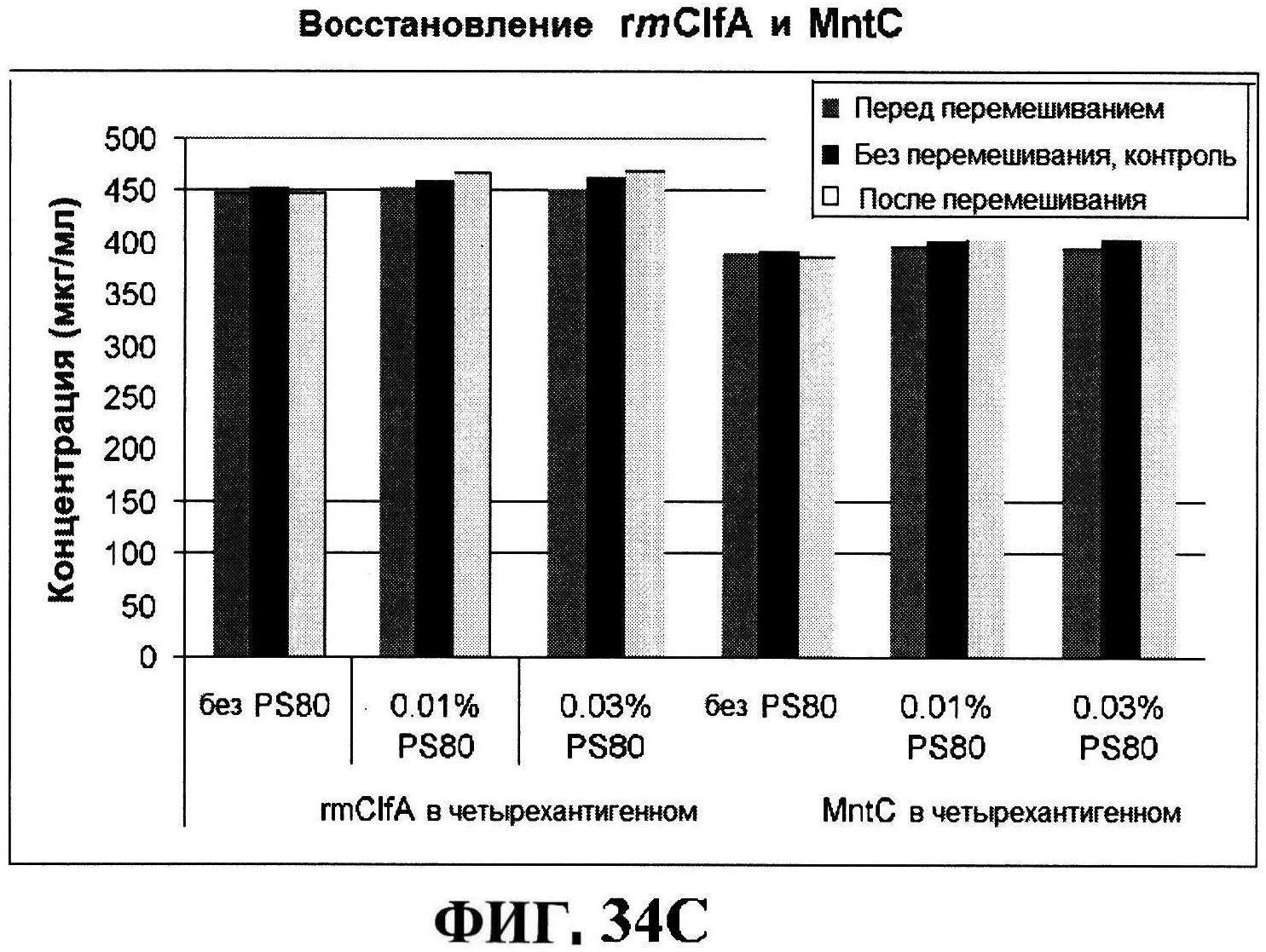
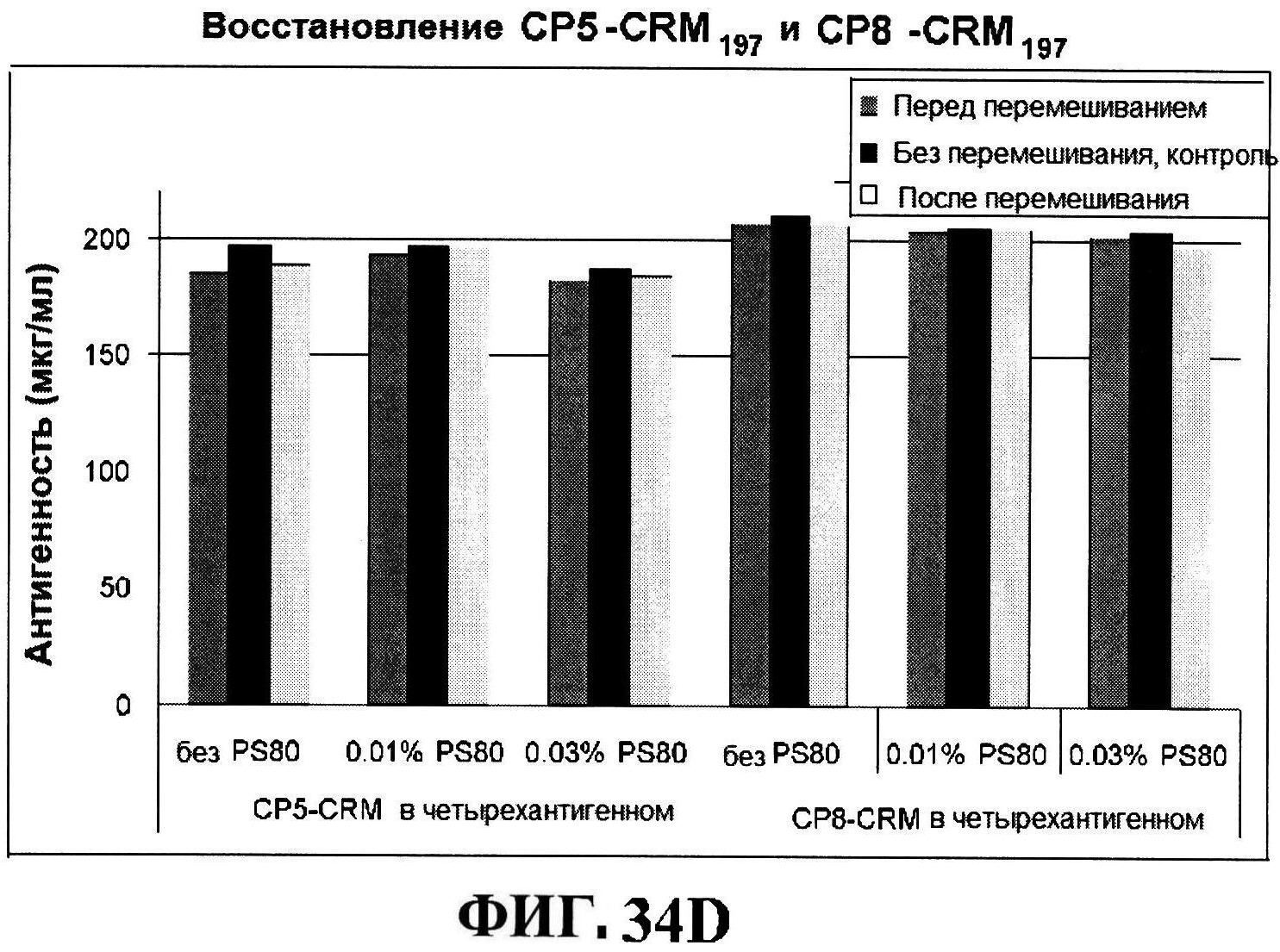
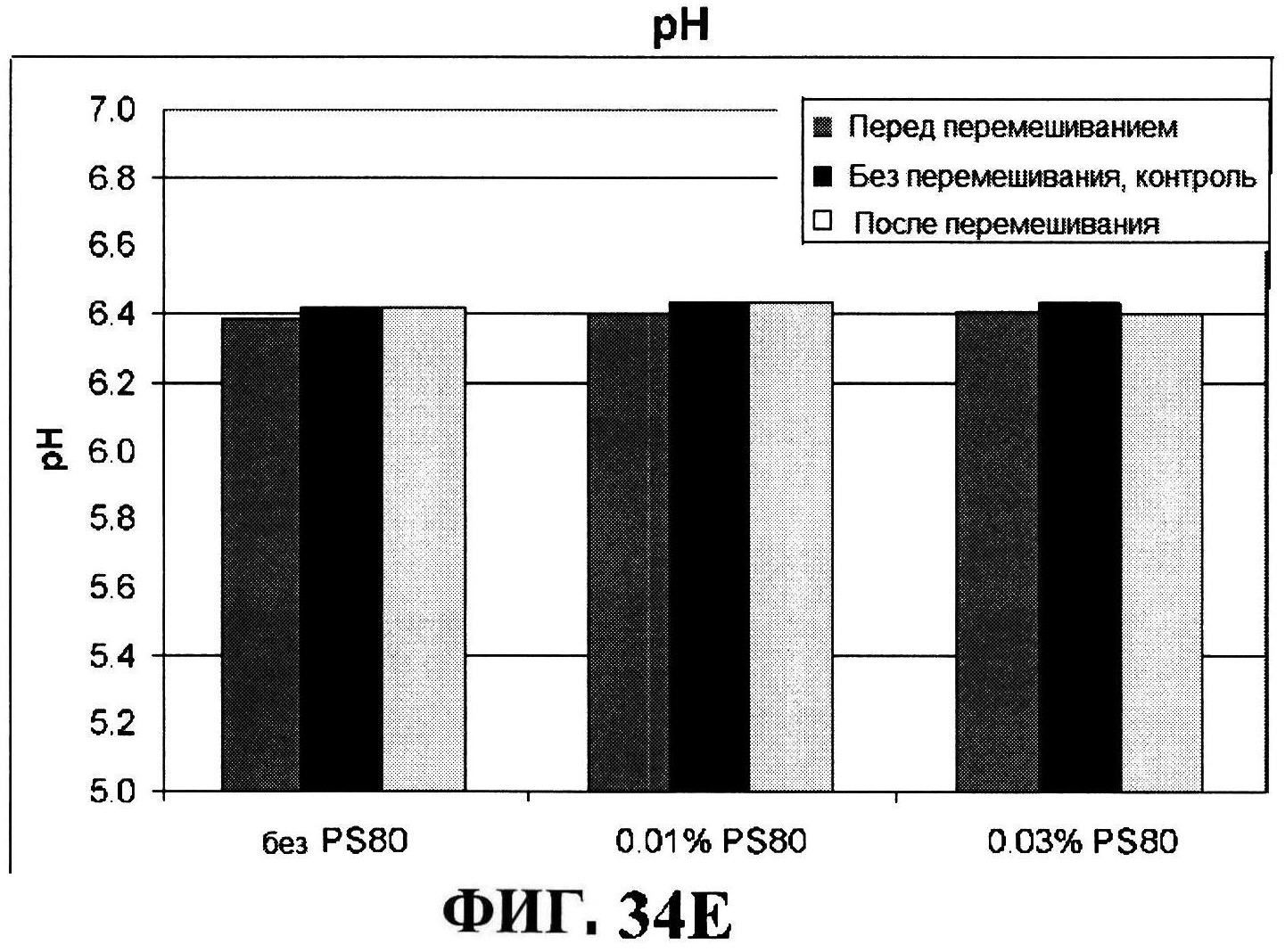
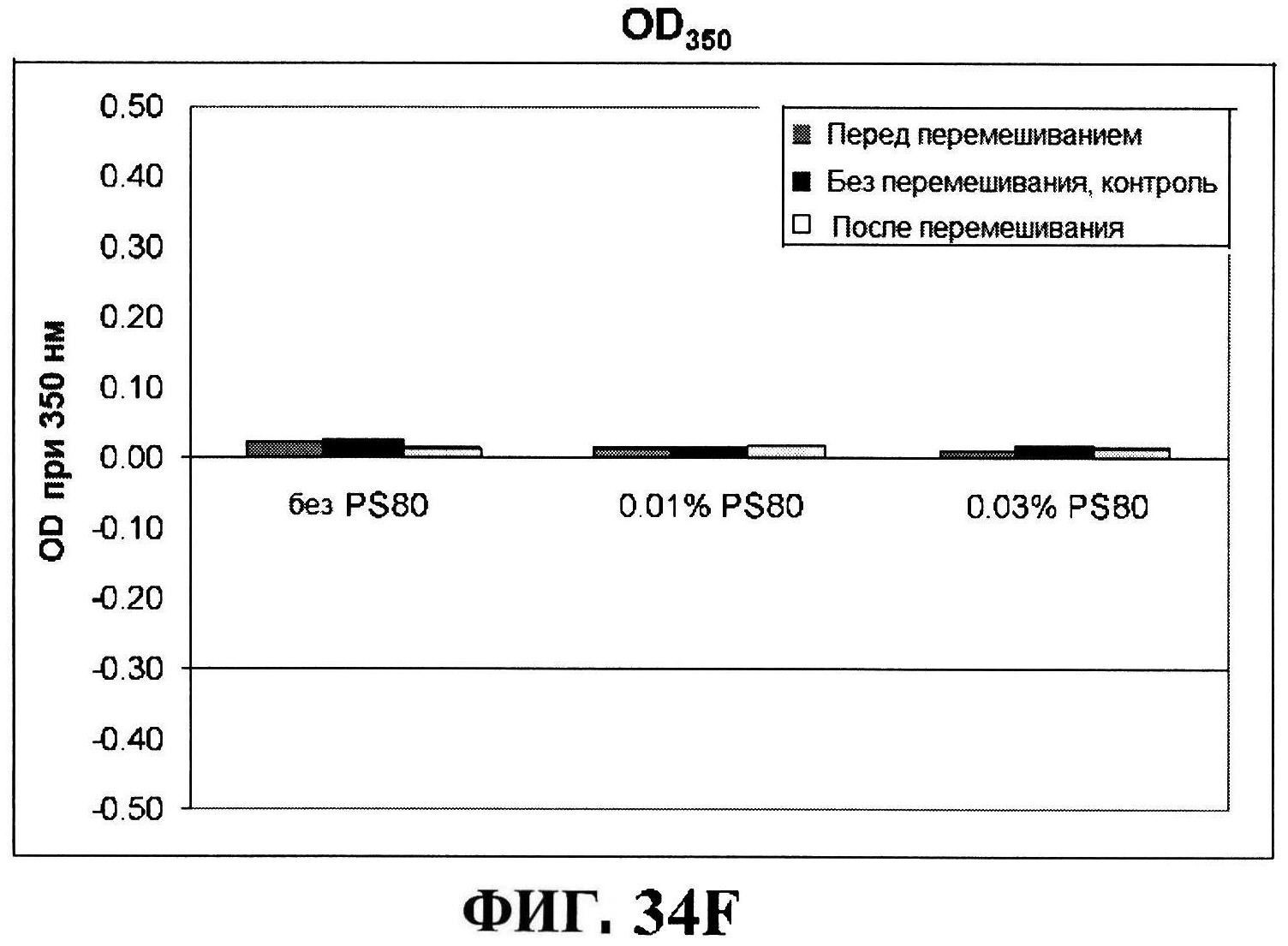
[0081] На фигуре 34 представлена после перемешивания rmClfA и чистота MntC, полученная с использованием обращено-фазовой ВЭЖХ (панель A), чистота MntC, полученная с использованием ионообменной ВЭЖХ (панель B), концентрации антигенов (панели C и D), pH (панель E) и OD350 (панель F).
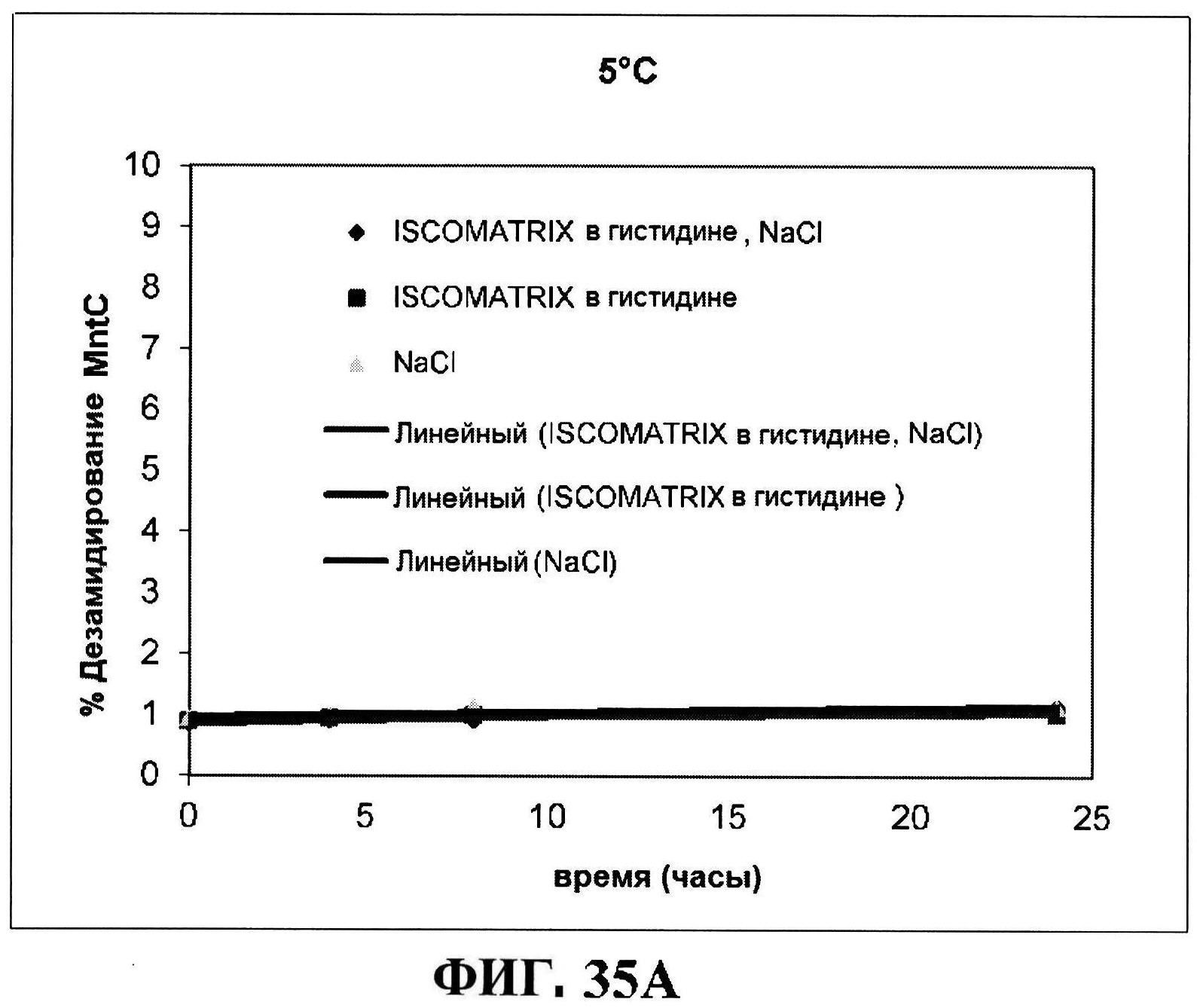
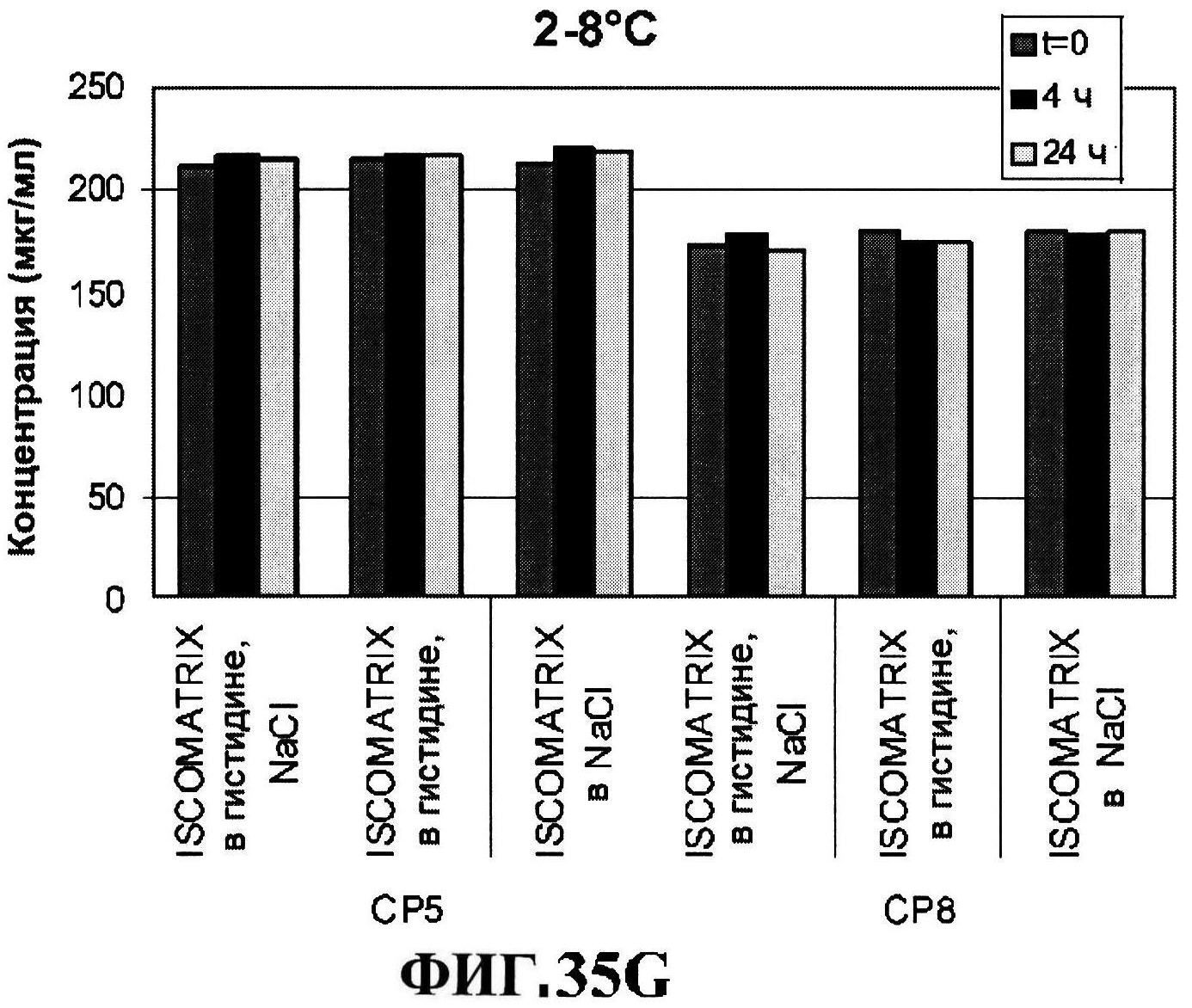
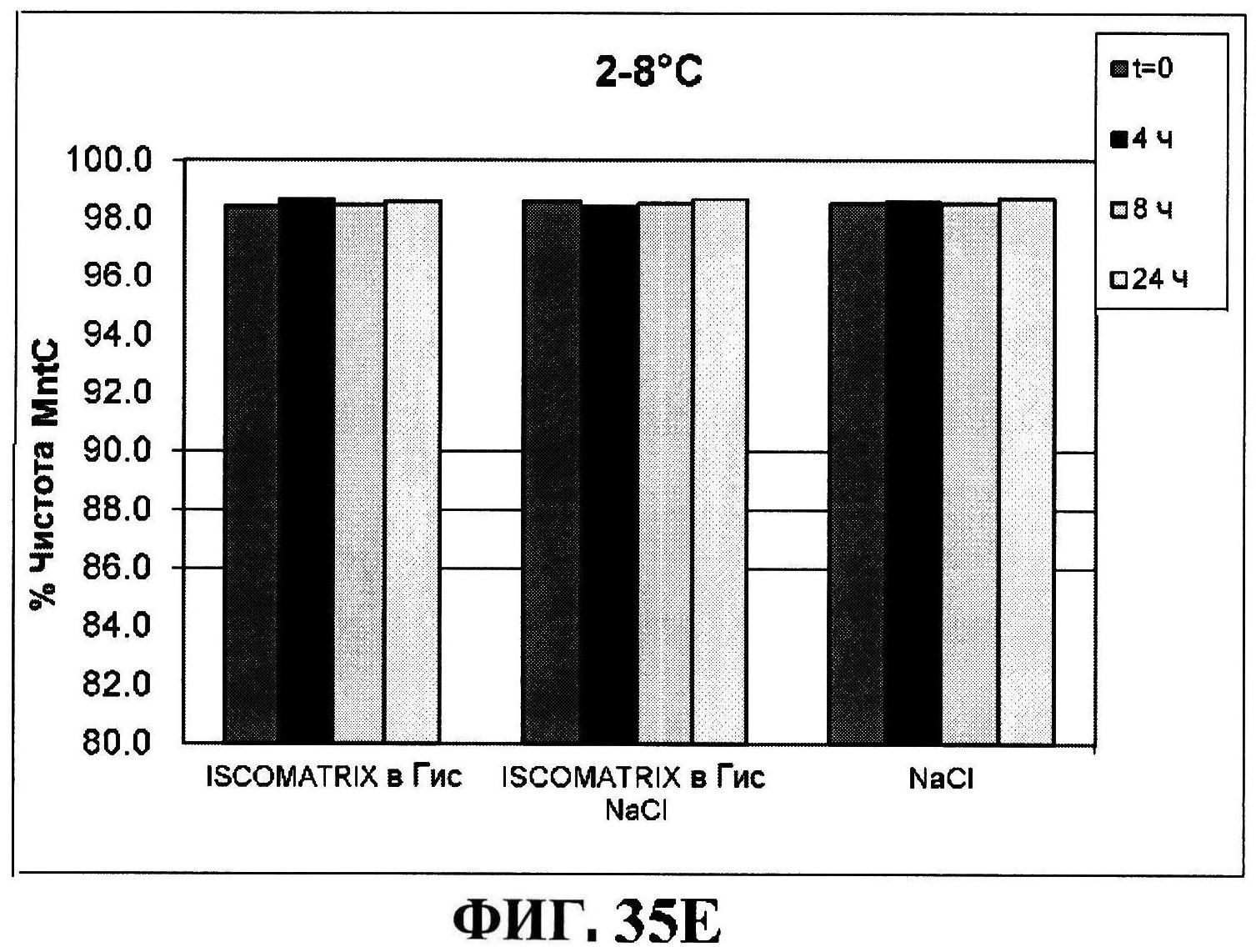
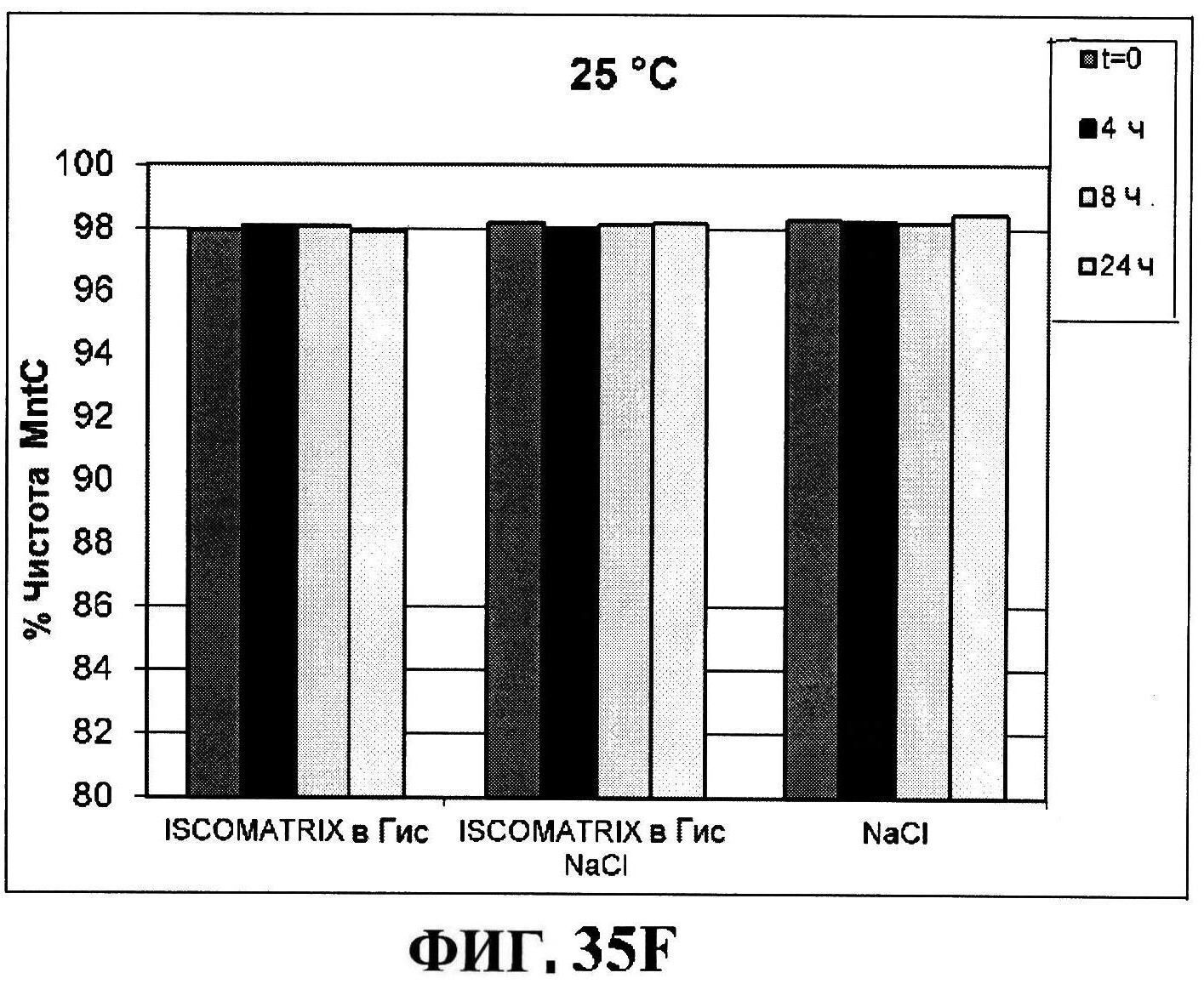
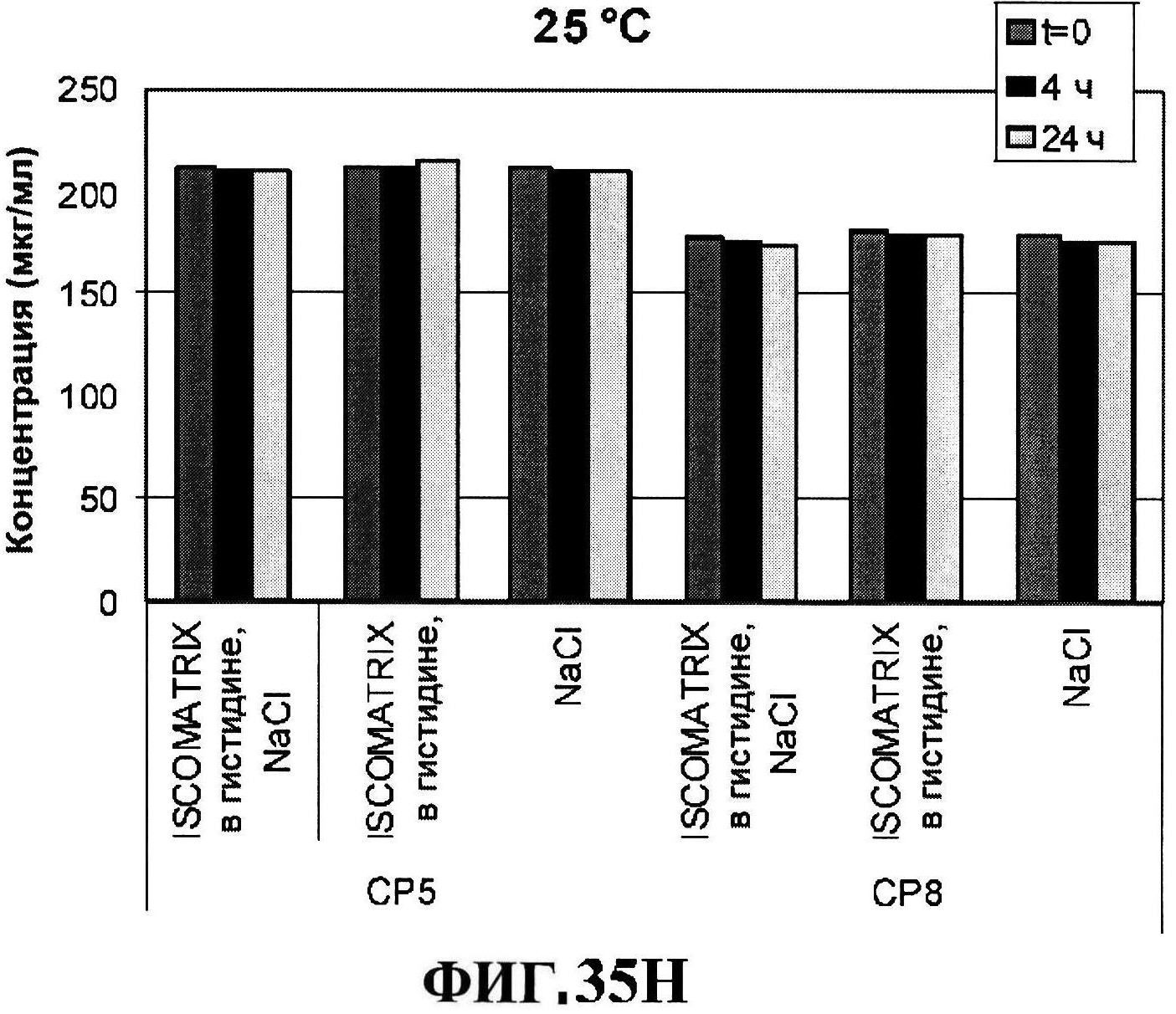
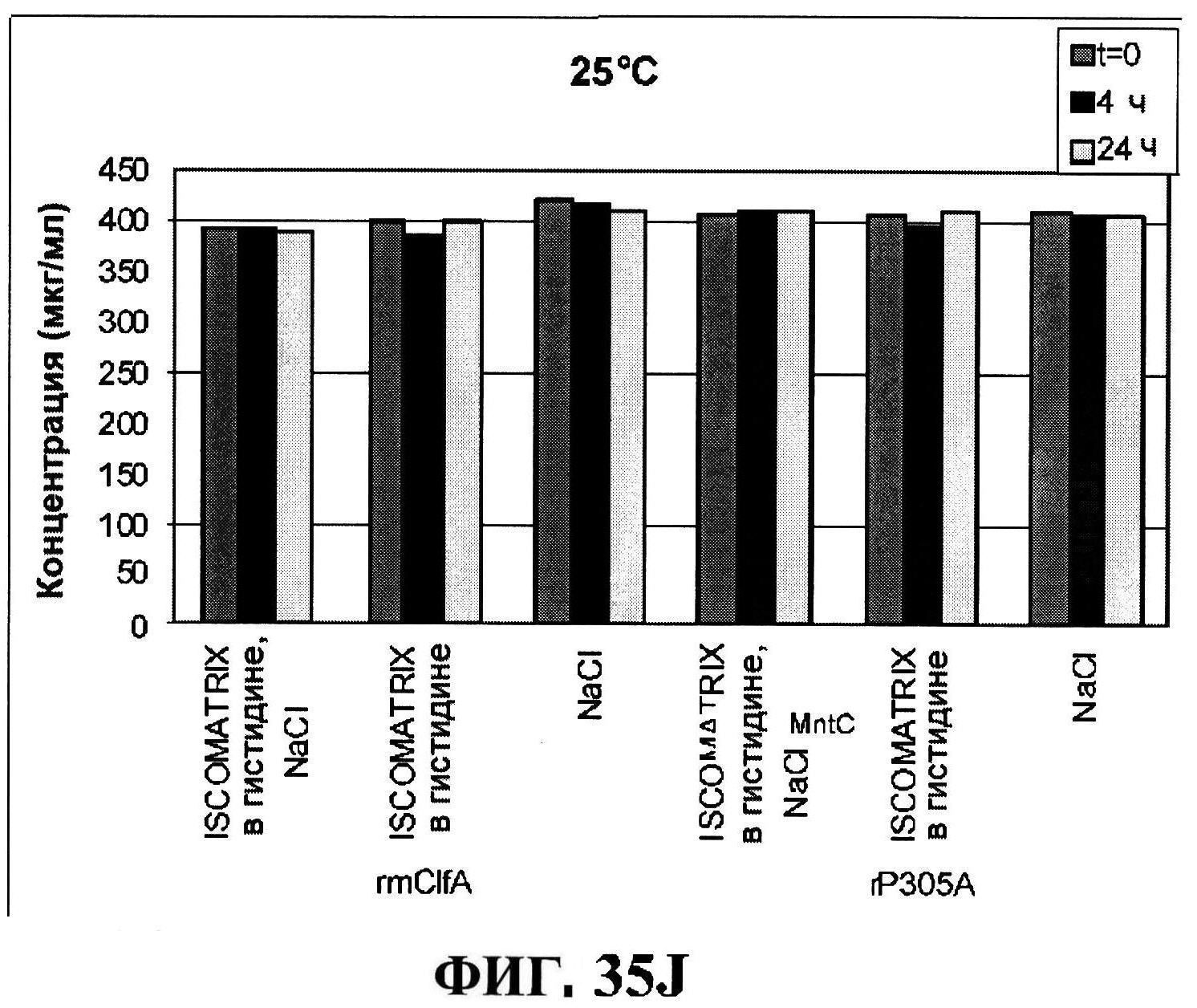
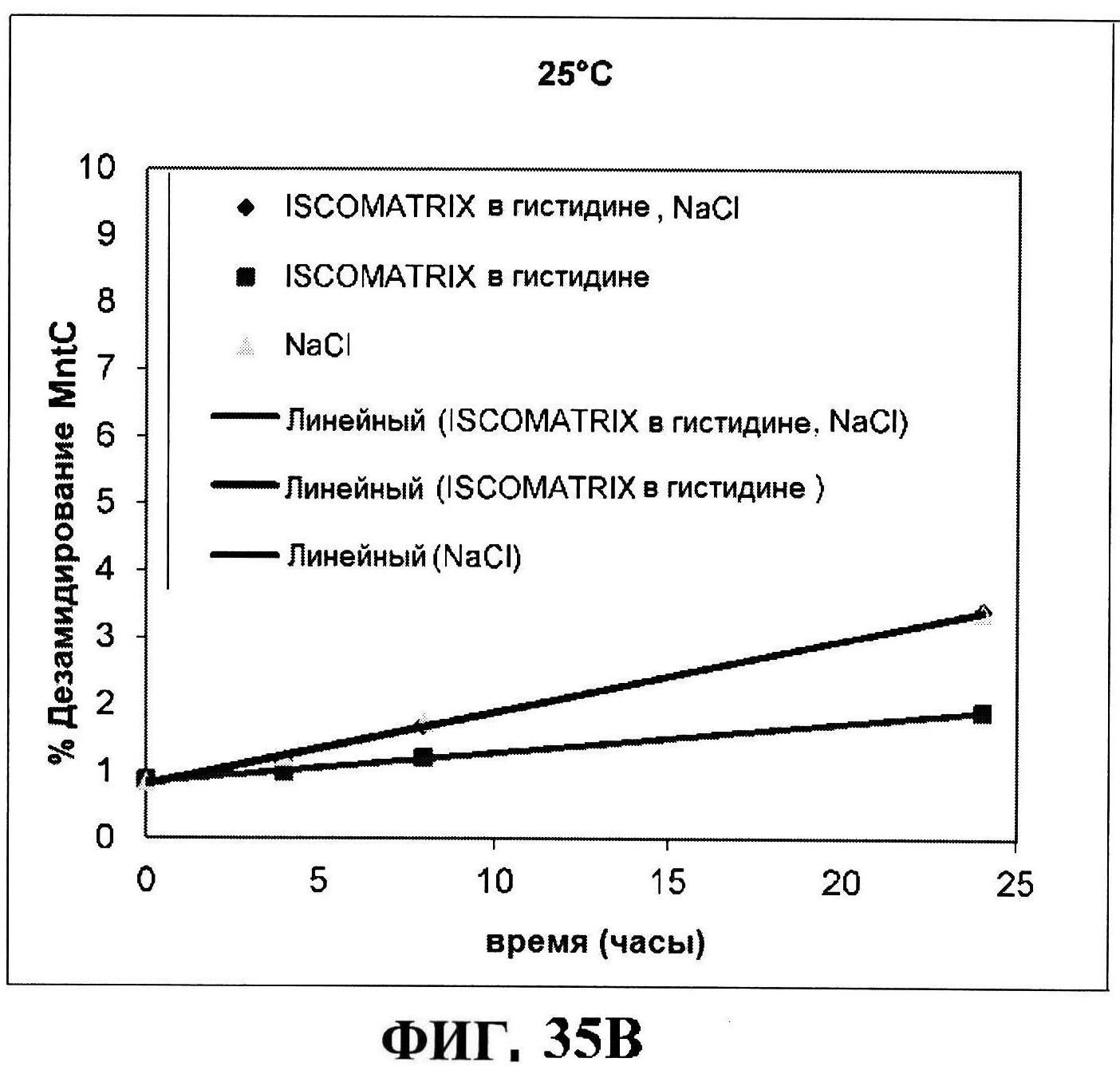
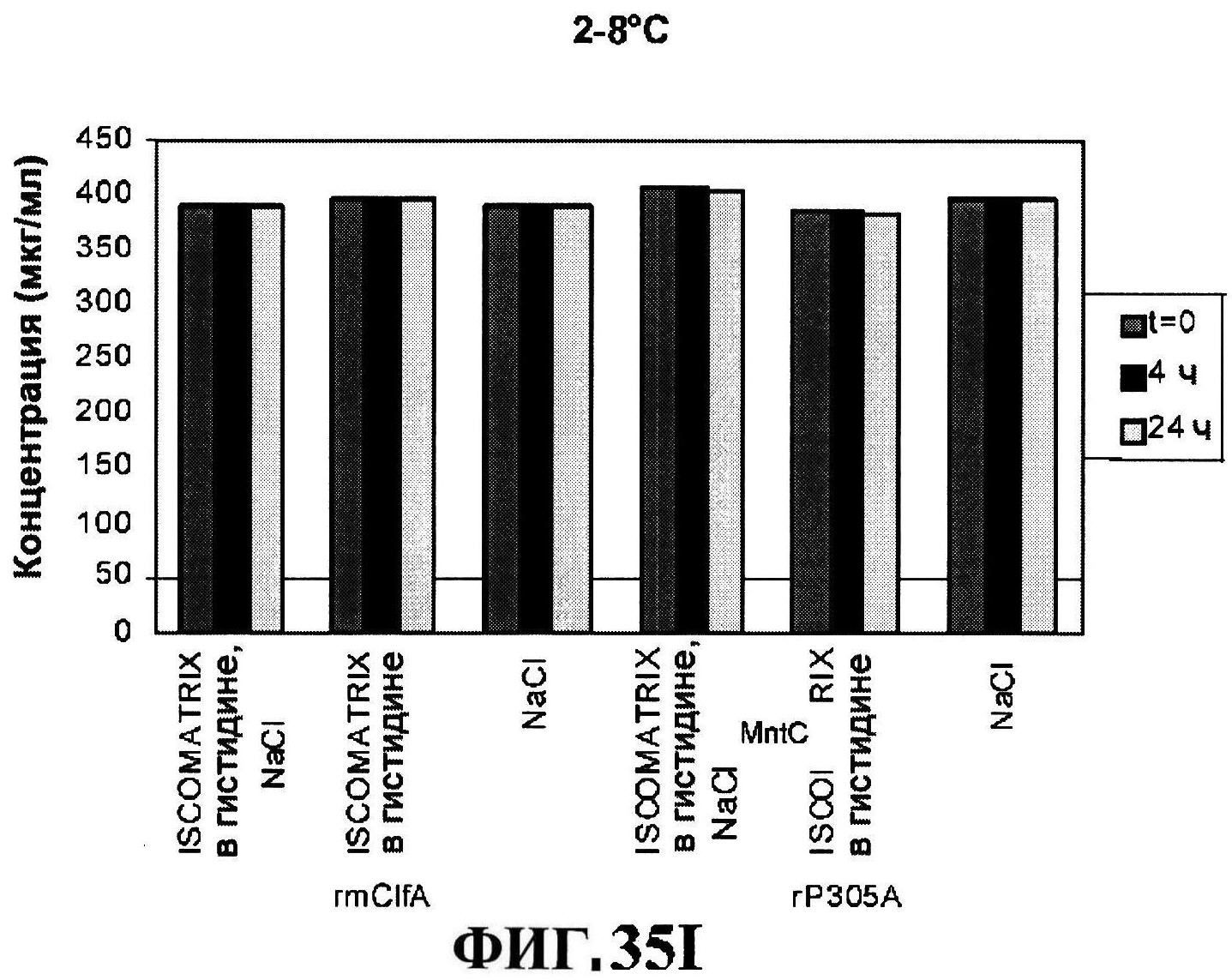
[0082] На фигуре 35 представлено расщепление восстановленного MntC с использованием ISCOMATRIX™ при 2-8°C (панель A) и при 25°C (панель B), которые анализировали с использованием катионообменной ВЭЖХ через 24 часа, чистота восстановленного rmClfA с использованием ISCOMATRIX™, которые анализировали с использованием катионообменной ВЭЖХ (панели C и D), чистота восстановленного MntC с использованием ISCOMATRIX™ при 2-8°C (панель E) и при 25°C (панель F), которые анализировали с использованием обращено-фазовой ВЭЖХ, концентрации конъюгатов CP5-CRM197 и CP8-CRM197 с использованием ISCOMATRIX™ при 2-8°C (панель G) и при 25°C (панель H), и концентрации rmClfA и MntC с использованием ISCOMATRIX™ при 2-8°C (панель I) и при 25°C (панель J).
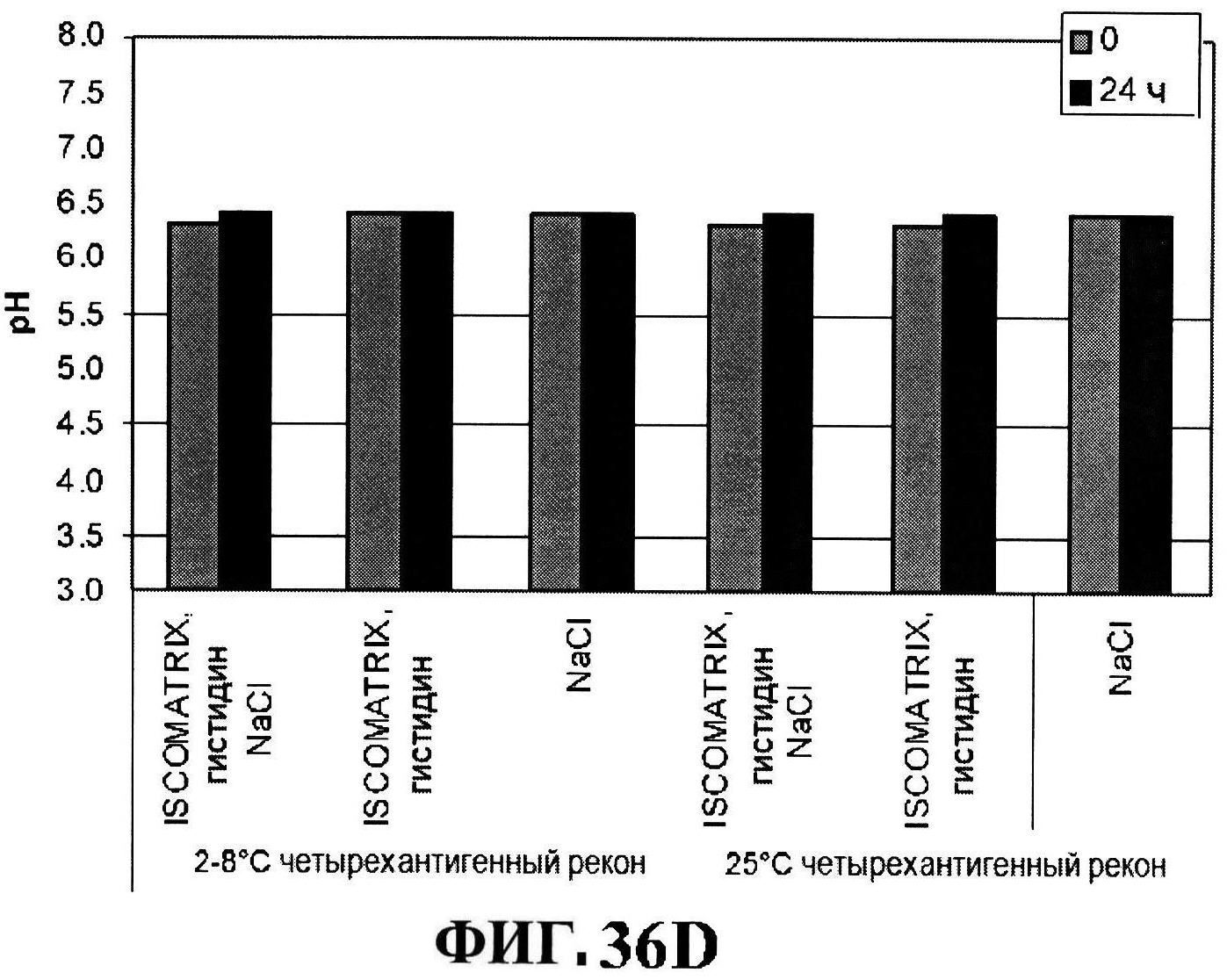
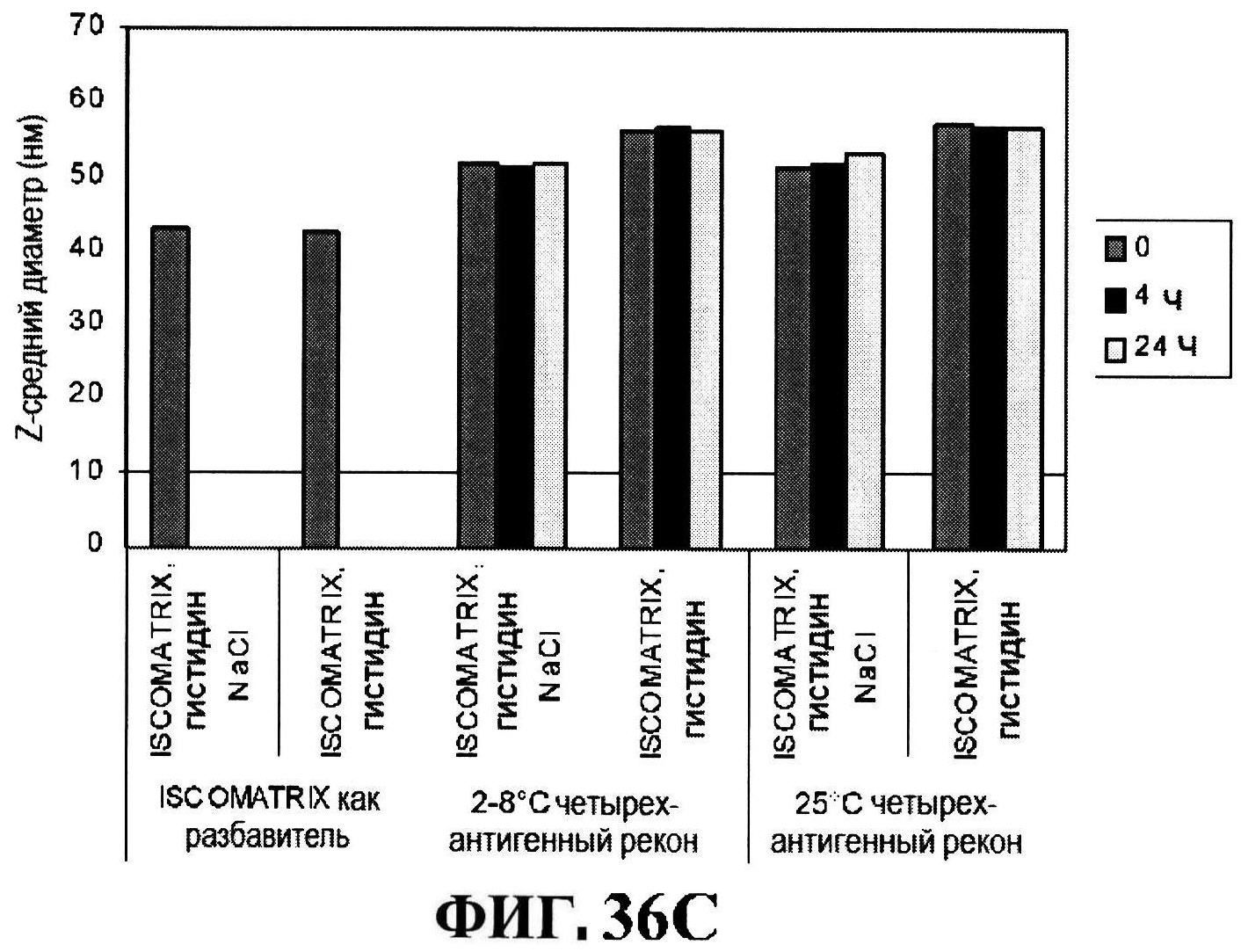
[0083] На фигуре 36 представлены ISCOMATRIX™ концентрации в течение 24 часов при 2-8°C (панель A) и при 25°C (панель B), размер частиц ISCOMATRIX™ (панель С), и pH стабильность (панель D) восстановленных составов.
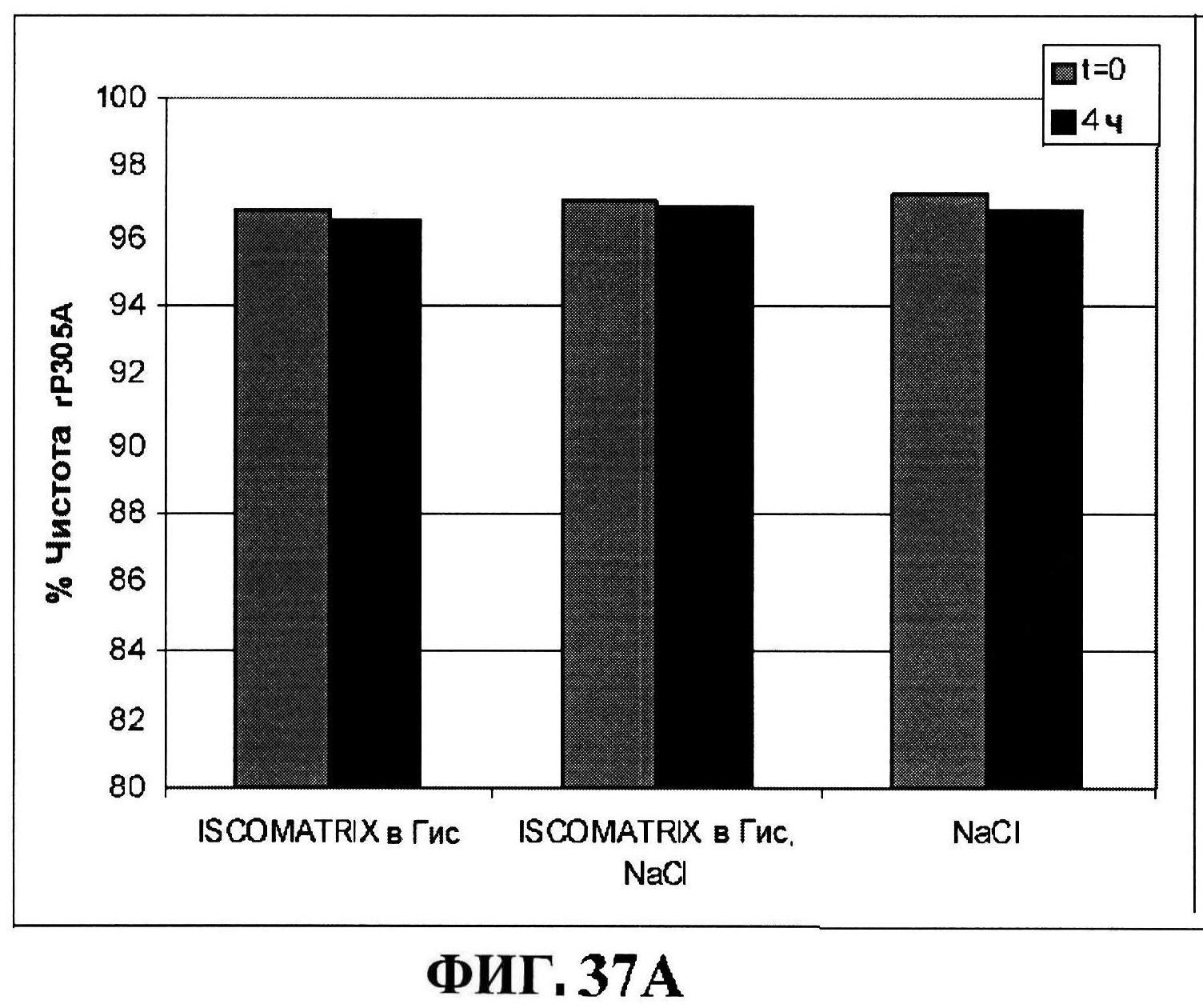
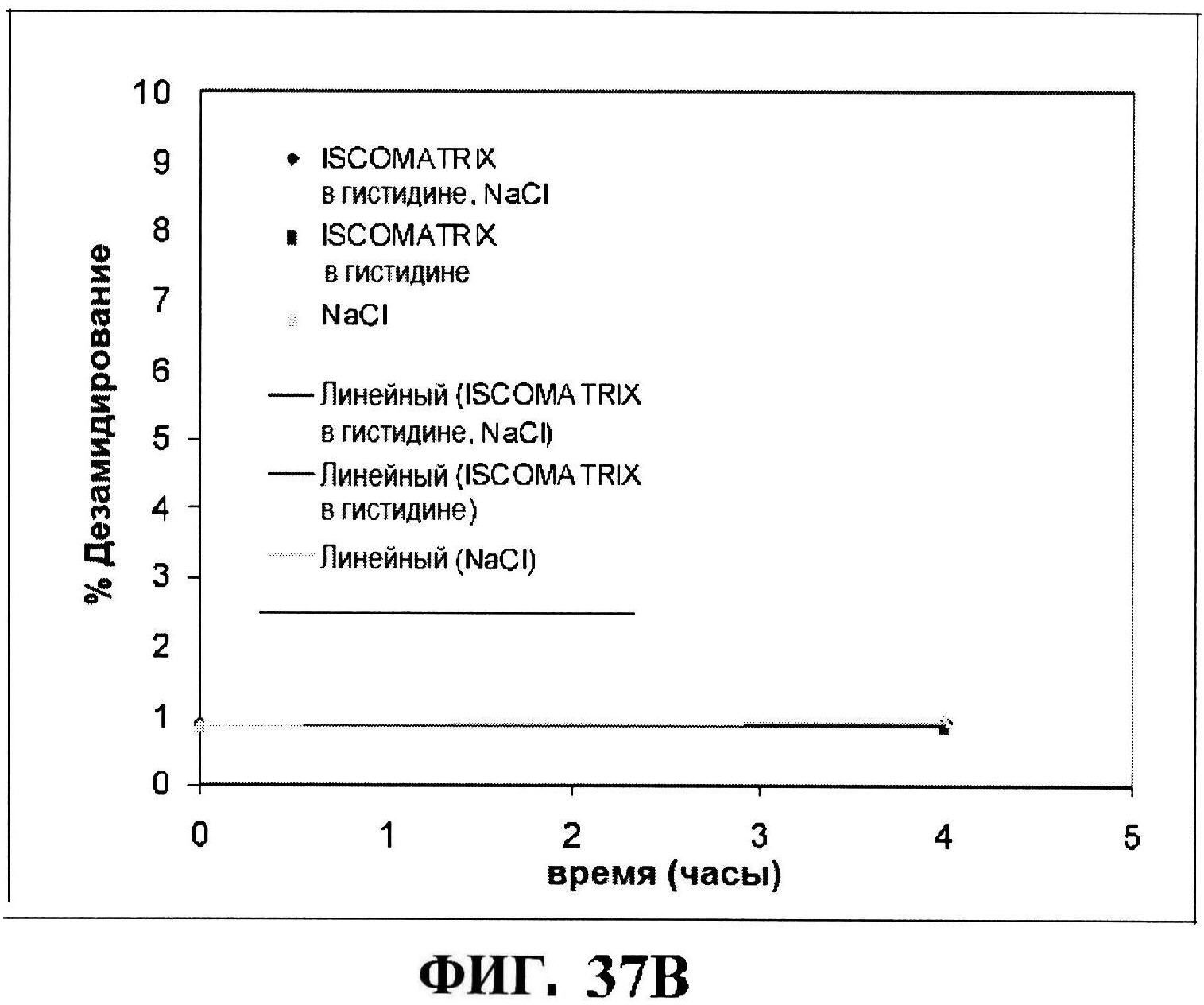
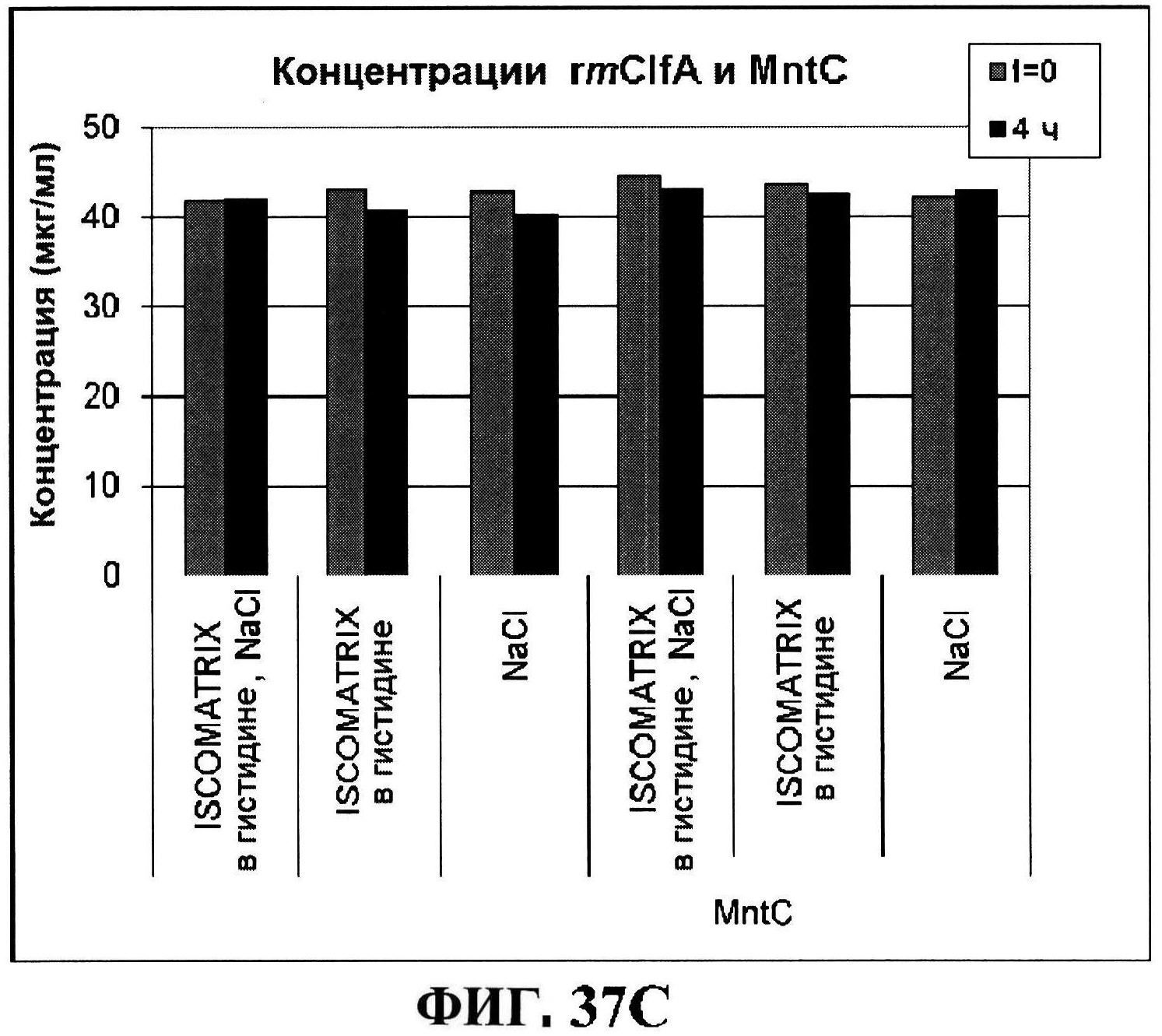
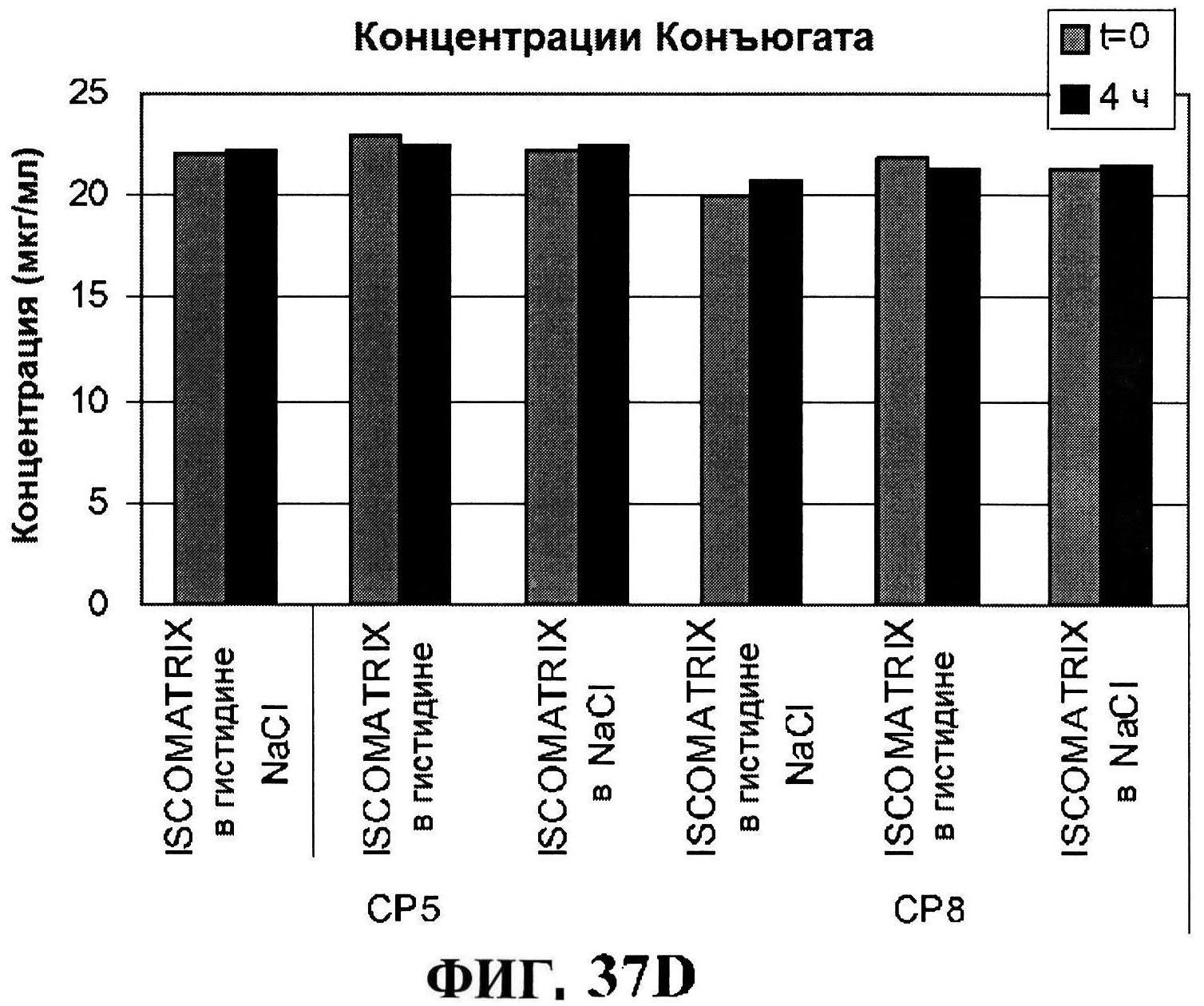
[0084] На фигуре 37 представлены чистота (панель A) и дезамидирование восстановленного MntC с использованием ISCOMATRIX™, которые анализировали, используя обращено-фазовую ВЭЖХ через 4 часа и антигенные концентрации с использованием ISCOMATRIX™ (панели C и D).
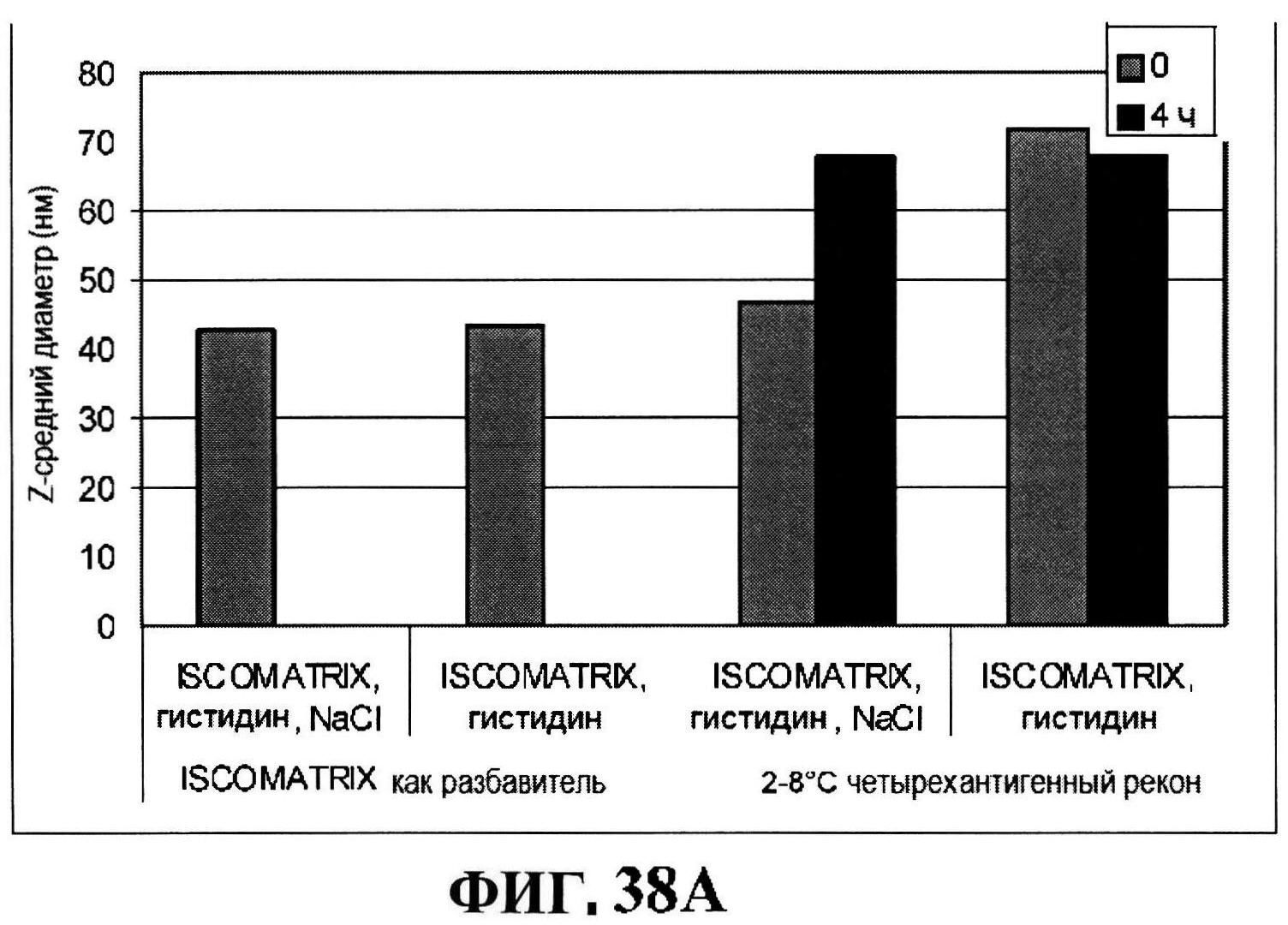
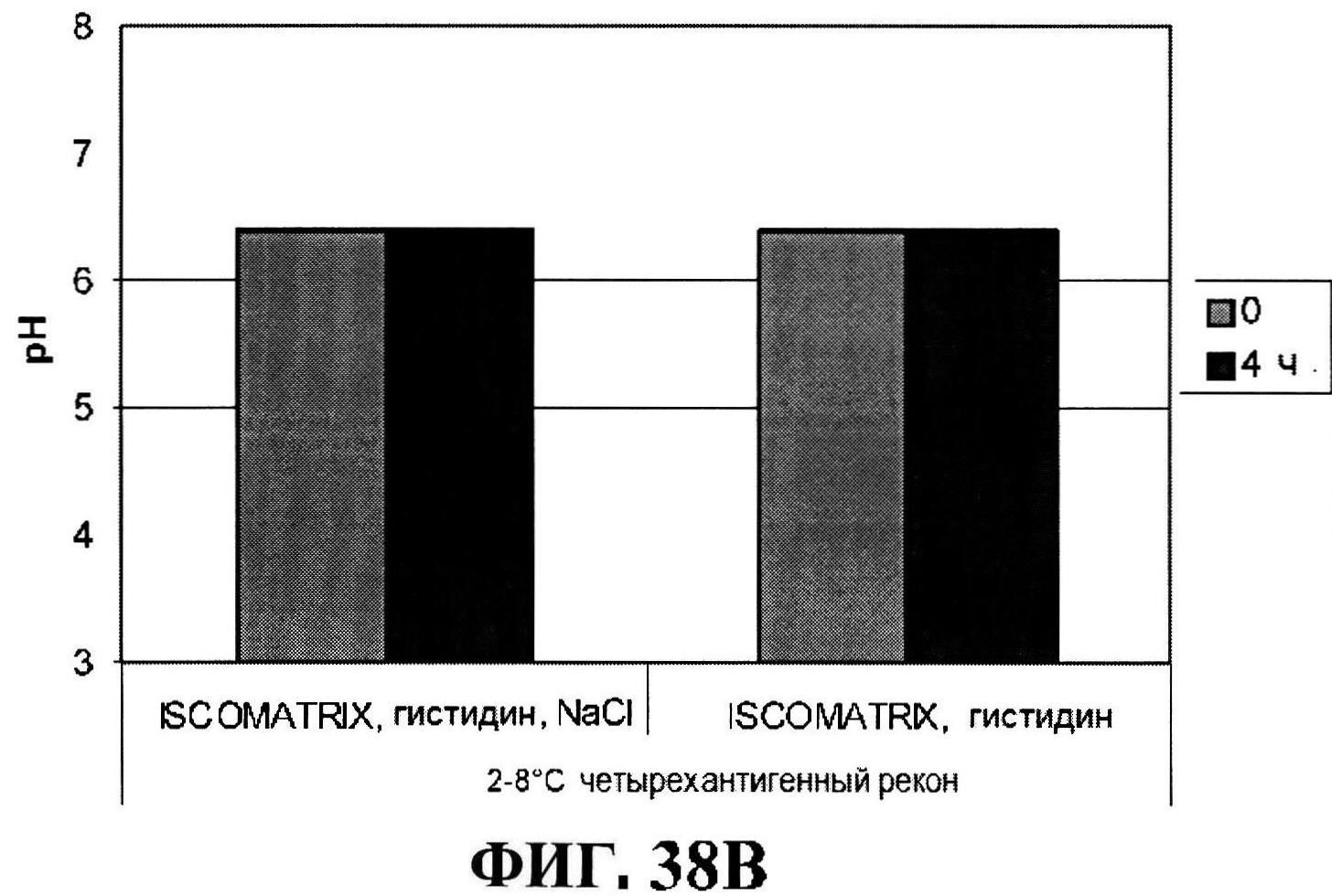
[0085] На фигуре 38 представлен размер частиц ISCOMATRIX™ (панель A) и pH стабильность (панель В) восстановленных составов через 4 часа.
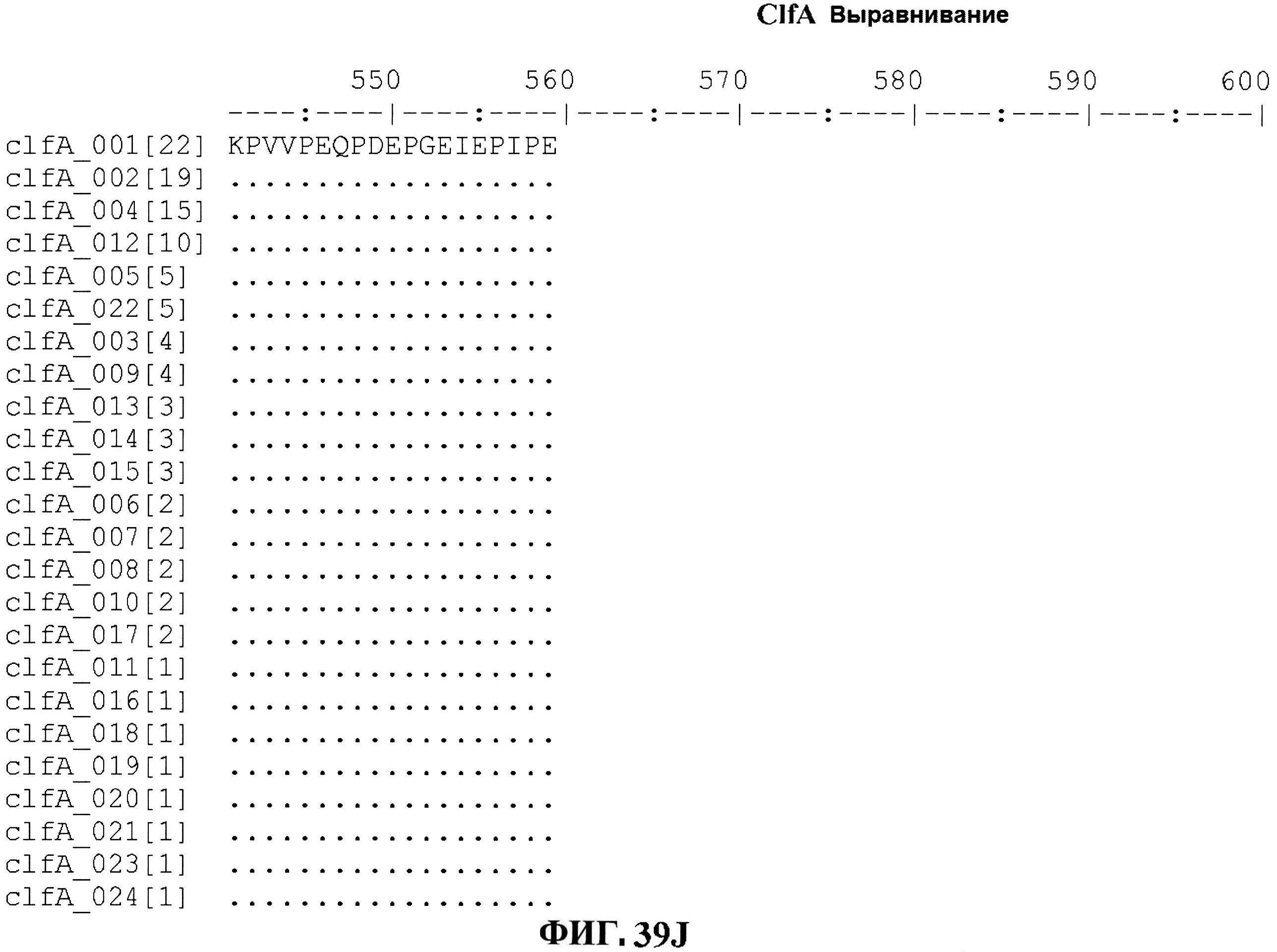
[0086] На фигурах 39A-J представлено выравнивание ClfA между различными штаммами S.aureus (SEQ ID No: 62, 64, 68, 84, 70, 104, 66, 78, 86, 88, 90, 72, 74, 76, 80, 94, 82, 92, 96, 98, 100, 102, 106 и 108, соответственно, в порядке встречаемости).
[0087] На фигурах 40A-I представлено выравнивание ClfB между различными штаммами S.aureus (SEQ ID No: 26, 28, 32, 18, 54, 34, 36, 30, 16, 20, 22, 24, 38, 40, 42, 44, 46, 48, 50, 52, 56, 58 и 60, соответственно, в порядке встречаемости).
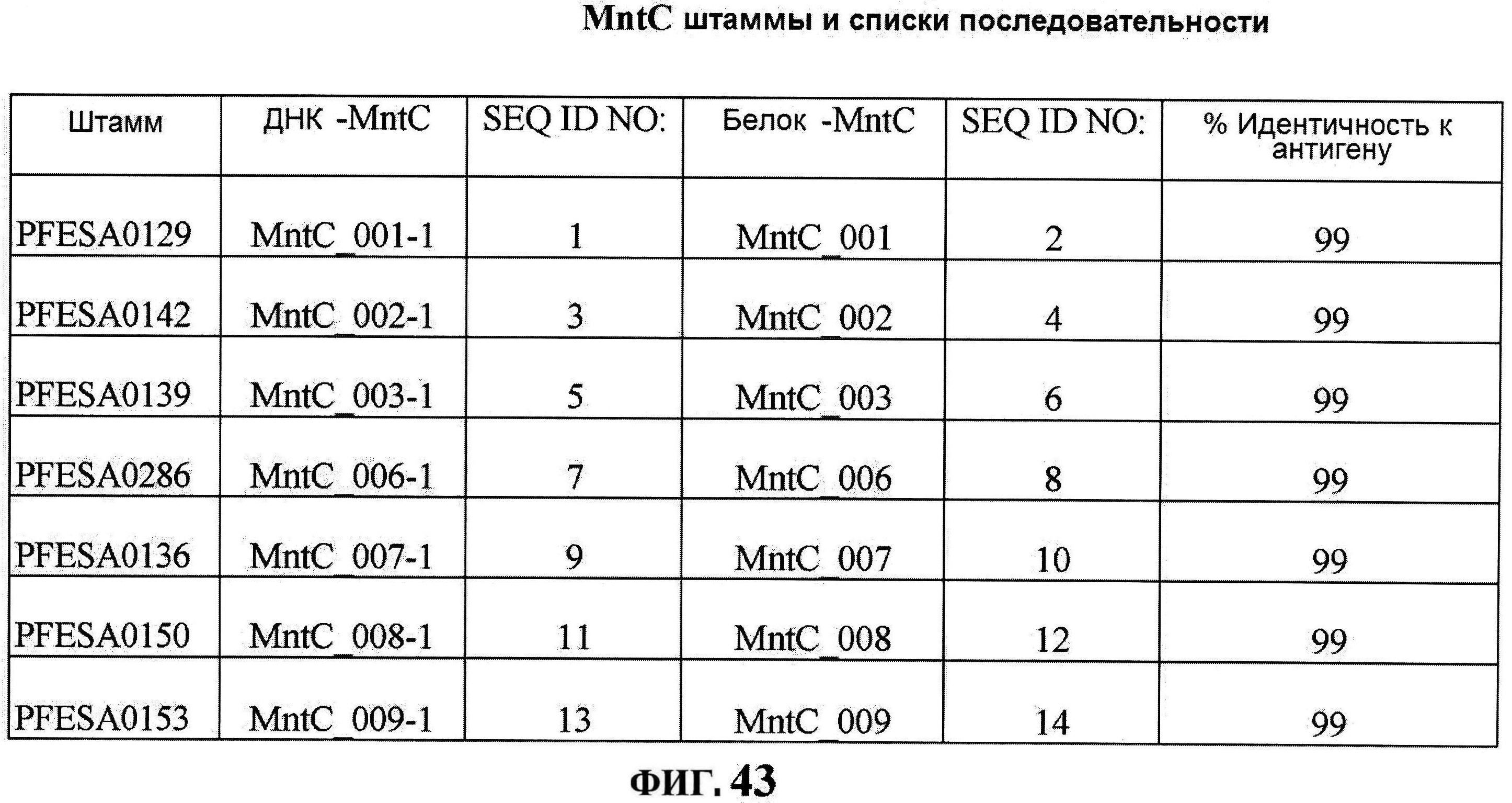
[0088] На фигурах 41A-C представлено выравнивание MntC между различными штаммами S.aureus (SEQ ID No: 2, 8, 10, 4, 6, 14 и 12, соответственно, в порядке встречаемости).
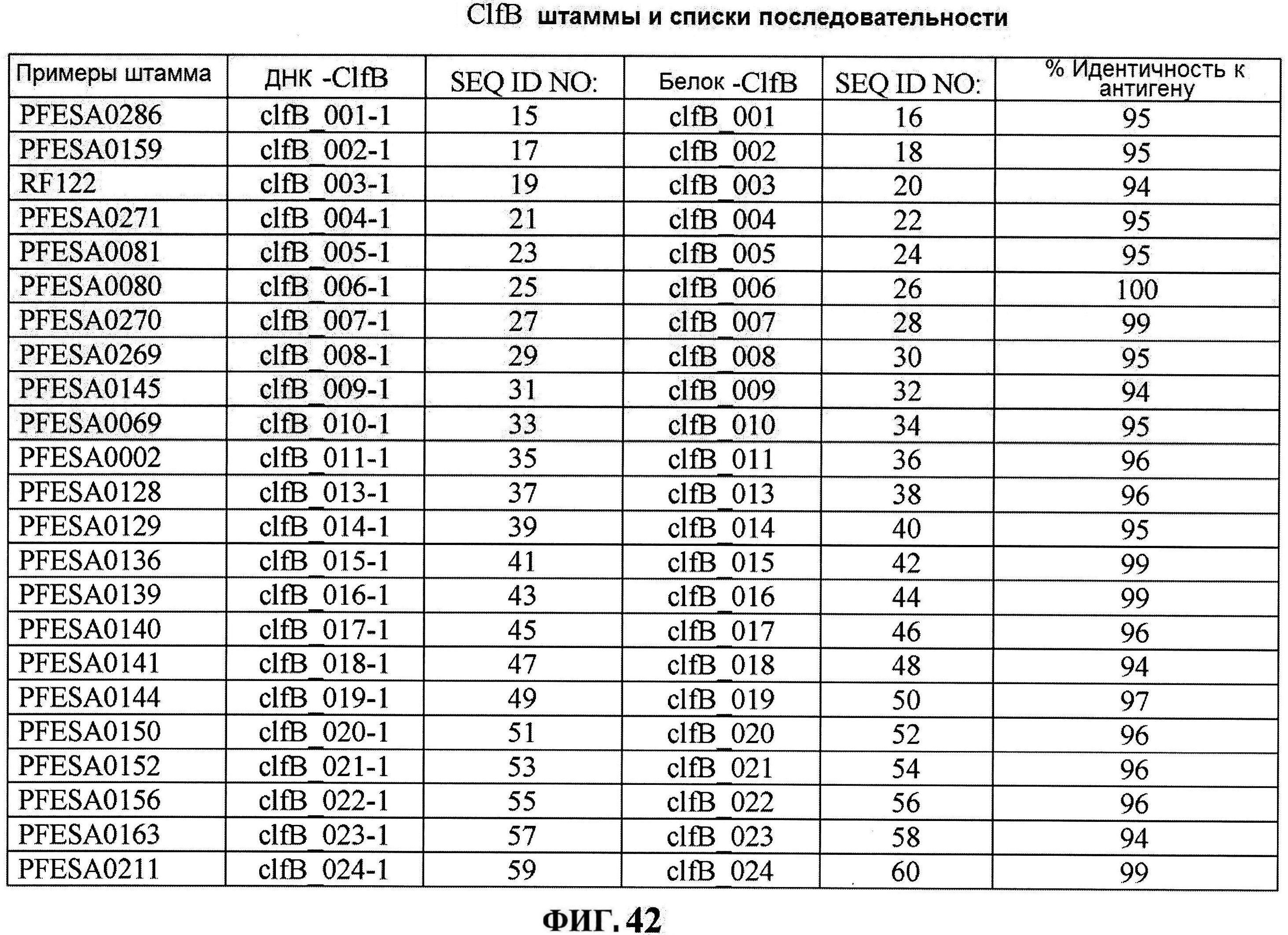
[0089] На фигуре 42 изображена карта ClfB последовательностей от различных штаммов S.aureus.
[0090] На фигуре 43 изображена карта MntC последовательностей от различных штаммов S.aureus.
Детальное описание изобретения
[0091] Вначале описываются представленные способы и методология лечения, следует понимать, что данное изобретение не ограничивается конкретными способами и описанными экспериментальными условиями, как таковые способы и условия могут варьировать. Кроме того, следует понимать, что терминология, использованная в данном документе, приводится только с целью описания конкретных вариантов осуществления, и не предназначена для ограничения.
[0092] Однако, какие-либо способы и материалы, аналогичные или эквивалентные тем, что описаны в данном документе, могут быть использованы на практике или исследованиях изобретения, предпочтительные способы и материалы сейчас будут описаны. Все публикации, упомянутые в данном документе, включены как ссылки в полном объеме.
[0093] Термины, использованные в данном документе, имеют общепринятые значения и известные для квалифицированного специалиста в данной области с уровня техники, однако, для преимущества и полноты исследования, конкретные термины и их значения представлены далее ниже.
[0094] Как используется в данном описании и прилагаемой формуле изобретения, формы единственного числа включают упоминание во множественном числе, кроме тех случаев, когда контекст предписывает другое. Таким образом, например, упоминание "способ" включает один или более способов, и/или стадий типа, описанного в данном документе и/или, которые станут очевидными для квалифицированных специалистов в данной облати с уровня техники, читающих данное раскрытие и так далее.
[0095] Термин "примерно" или "приблизительно" означает со статистически значительным диапазоном значения. Такой диапазон может находиться в пределах порядка величины, как правило, в пределах 20%, более типично в пределах 10%, и еще более типично в пределах 5% от предоставленного значения или диапазона. Допустимое изменение, которое охватывается термином "примерно" или "приблизительно", зависит от конкретной исследуемой системы, и может быть легко оценено каким-либо квалифицированным специалистом в данной области. Всякий раз, когда в данной заявке приводится диапазон, каждое целое число в пределах диапазона, кроме того, рассматривается как вариант осуществления изобретения.
[0096] "Антитело" представляет собой молекулу иммуноглобулина способного к специфическому связыванию с мишенью, такой как углевод, полинуклеотид, липид, полипептид, т.д., благодаря, по меньшей мере, одному сайту распознавания, который находится в вариабельной области молекулы иммуноглобулина. Как используется в данном документе, если не указано иное в контексте, то имеется в виду, что термин охватывает не только интактные поликлональные и моноклональные антитела, но также и сконструированные антитела (например, химерные, гуманизированные и/или производные для изменения эффекторных функций, стабильности и других биологических активностей) и их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одиночную цепь (ScFv) и доменные антитела (включая акульи и верблюжьи антитела), и слитые белки, содержащие участок антитела, поливалентные антитела, полиспецифические антитела (например, биспецифические антитела при условии, что они демонстрируют желаемую биологическую активность) и фрагменты антител, как описано в данном документе, и какую-либо другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит сайт распознавания антигена. Антитело включает антитело какого-либо класса, такого как IgG, IgA или IgM (или его подкласса), и нет необходимости, чтобы антитело было из какого-либо конкретного класса. В зависимости от аминокислотной последовательности антитела константного домена его тяжелых цепей, иммуноглобулины могут быть отнесены к различным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и несколько из них могут быть в дальнейшем разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2 у людей. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю, соответственно. Структуры субъединиц и тримерные конфигурации различных классов иммуноглобулинов хорошо известны.
[0097] "Фрагменты антитела" содержат только часть интактного антитела, где часть предпочтительно сохраняет, по меньшей мере, одну, предпочтительно, большинство или все из функций нормально связанного с той частью, которая присутствует в интактном антителе.
[0098] Термин "антиген", как правило, касается биологической молекулы, обычно, протеина, пептида, полисахарида, липида или конъюгата, который содержит, по меньшей мере, один эпитоп, к которому селективно может присоединяться родственное антитело; или в некоторых примерах иммуногенную субстанцию, которая может стимулировать продуцирование антител или T-клеточных ответов, или оба, у животных, включая композиции, которые вводятся или абсорбируются животными. Иммунной ответ может быть сформирован к молекуле в целом, или к одной или больше различным частям молекулы (например, эпитопу или гаптену). Термин может быть использован для того, чтобы сослаться на индивидуальную молекулу или на гомогенную или гетерогенную совокупность антигенных молекул. Антиген распознается антителами, T-клеточными рецепторами или другими элементами специфического гуморального и/или клеточного иммунитета. Термин "антиген" включает все родственные антигенные эпитопы. Эпитопы предоставленного антигена могут быть идентифицированы, используя какое-либо количество методик картирования эпитопа, хорошо известных в данной области с уровня техники. Смотри, например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol.66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, N.J. Например, линейные эпитопы могут быть определены, например, путем одновременного синтезирования большого количества пептидов на твердых подложках, пептидов, соответствующих частям протеиновой молекулы, и взаимодействия пептидов с антителами, в то время как пептиды все еще являются связанными с подложками. Такие методики хорошо известны в данной области с уровня техники и описаны, например, в патенте США No. 4,708,871; Geysen et al. (1984) Proc. Natl. Acad. Sci. USA 81:3998-4002; Geysen et al. (1986) Molec. Immunol. 23:709-715, все включены в данный документ в виде ссылки в полном объеме. Подобным образом, конформационные эпитопы могут быть идентифицированы путем определения пространственной конформации аминокислот, таким как, например, с использованием рентгеновской кристаллографии и 2-мерного ядерно-магнитного резонанса. Смотри, например, Epitope Mapping Protocols, как сказано выше. Более того, с точки зрения представленного изобретения, "антиген", кроме того, может быть использован для того, чтобы ссылаться на протеин, который включает модификации, такие как делеции, присоединения и замещения (как правило, консервативными в природе, но они могут быть неконсервативными), на нативную последовательность, при условии, что протеин сохраняет способность вызывать иммунологический ответ. Данные модификации могут быть спланированными, как посредством сайт-направленного мутагенеза, или посредством специфических способов синтеза, или посредством подходов генной инженерии, или могут быть случайными, такими как посредством мутаций хозяев, которые продуцируют антигены. Более того, антиген произведен, получен или выделен из микроорганизма, например, бактерии, или может быть организмом в целом. Подобным образом, олигонуклеотид или полинуклеотид, который экспрессирует антиген, такой как в применениях при иммунизации нуклеиновой кислотой, также является включенным в определение. Синтетические антигены также являются включенными, например, полиэпитопы, фланкирующие эпитопы и другие рекомбинантные или синтетически произведенные антигены (Bergmann et al. (1993) Eur. J. Immunol. 23:2777 2781; Bergmann et al. (1996) J. Immunol. 157:3242 3249; Suhrbier, A. (1997) Immunol, and Cell Biol. 75:402 408; Gardner et al. (1998) 12th World AIDS Conference, Geneva, Switzerland, Jun.28-Jul.3, 1998).
[0099] Термин "вспомогательное вещество" касается соединения или смеси, которая усиливает иммунной ответ к антигену, как в дальнейшем описано и проиллюстрировано в данном документе.
[0100] "Бактериемия" представляет собой преходящее присутствие бактерий в крови. Бактериемия может прогрессировать до септицемии или сепсиса, которая могла бы рассматриваться инфекцией и представляет собой персистирующее присутствие бактерий в крови с сопутствующими клиническими проявлениями/симптомами. Не все бактерии являются способными к выживанию в крови. Те, которые имеют специфические генетические признаки, которые обеспечивают такую способность. Кроме того, также факторы организма играют важную роль.
[0101] "Капсулярный полисахарид" или "капсульный полисахарид" относится к полисахаридной оболочке, которая является внешней по отношению к клеточной стенке большинства культур стафилококков. Например, S.aureus включает компонент клеточной стенки, состоящий из пептидогликанового комплекса, который дает возможность организму выжить при неблагоприятных осмотических условиях, и, кроме того, включает уникальную тейхоевую кислоту, связанную с пептидогликаном. Внешняя по отношению к клеточной стенке тонкая полисахаридная оболочка покрывает большинство культур S.aureus. Данная серологически отличающаяся оболочка может быть применена к серотипным различным культурам S.aureus. Показано, что большинство клинически значительных культур включает два капсулярных типа: серотип 5 (СР5) и серотип 8 (СР8).
[0102] Как используется в данном документе, "конъюгаты" содержат капсульный полисахарид обычно необходимого диапазона молекулярной массы и белок-носитель, в которых капсульный полисахарид конъюгирован с белком-носителем. Конъюгаты могут или не могут содержать некоторое количество свободного капсульного полисахарида. Как используется в данном документе, "свободный капсульный полисахарид" относится к капсульному полисахариду, который нековалентно связан с (то есть, нековалентно связанный с, адсорбированный на или захвачен в или с) капсульным полисахаридом, конъюгированным с белком-носителем. Термины "свободный капсульный полисахарид", "свободный полисахарид" и "свободный сахарид" могут быть использованы взаимозаменяемо и предназначены для того, чтобы передавать одинаковые значения. Независимо от природы молекулы носителя, он может быть конъюгирован с капсульным полисахаридом или напрямую, или через линкер. Как используется в данном документе, "конъюгировать", "конъюгированный" и "конъюгирующий" касаются процесса, посредством которого бактериальный капсульный полисахарид ковалентно связывается с молекулой носителя. Конъюгация усиливает иммуногенность бактериального капсульного полисахарида. Конъюгация может быть выполнена в соответствии со способами, описанными ниже или с использованием процессов, известных в данной области с уровня техники.
[0103] Как описано выше, представленное изобретение касается конъюгатов, содержащих капсульные полисахариды S.aureus серотипа 5 (СР5), конъюгированные с протеинами-носителями, и конъюгатов, содержащих капсульные полисахариды S.aureus серотипа 8 (СР8), конъюгированные с протеинами-носителями. Один вариант осуществления изобретения предусматривает конъюгаты, содержащие капсульный полисахарид S.aureus серотипа 5, конъюгированный с белком-носителем, и капсульный полисахарид S.aureus серотипа 8, конъюгированный с белком-носителем где: капсульный полисахарид типа 5 имеет молекулярную массу от 50 кДа до 800 кДа; капсульный полисахарид типа 8 имеет молекулярную массу от 50 до 700 кДа; иммуногенные конъюгаты имеют молекулярные массы от примерно 1000 кДа до примерно 5000 кДа; и конъюгаты содержат меньше, чем около 30% свободного полисахарида по отношению к общему полисахариду. В одном варианте осуществления, конъюгаты содержат меньше, чем примерно 25%, примерно 20%, примерно 15%, примерно 10% или примерно 5% свободного полисахарида по отношению к общему полисахариду. В одном варианте осуществления, полисахарид типа 5 или 8 имеет молекулярную массу от примерно 20 кДа до примерно 1000 кДа; от примерно 50 кДа до примерно 500 кДа; от примерно 50 кДа до примерно 200 кДа; и от примерно 75 кДа до примерно 150 кДа.
[0104] В одном варианте осуществления, конъюгат имеет молекулярную массу от примерно 50 кДа до примерно 5000 кДа. В одном варианте осуществления, конъюгат имеет молекулярную массу от примерно 200 кДа до примерно 5000 кДа. В одном варианте осуществления, иммуногенный конъюгат имеет молекулярную массу от примерно 400 кДа до примерно 2500 кДа. В одном варианте осуществления, иммуногенный конъюгат имеет молекулярную массу от примерно 500 кДа до примерно 2500 кДа. В одном варианте осуществления, иммуногенный конъюгат имеет молекулярную массу от примерно 600 кДа до примерно 2800 кДа. В одном варианте осуществления, иммуногенный конъюгат имеет молекулярную массу от примерно 700 кДа до примерно 2700 кДа. В одном варианте осуществления, иммуногенный конъюгат имеет молекулярную массу от примерно 1000 кДа до примерно 2000 кДа; от примерно 1800 кДа до примерно 2500 кДа; от примерно 1100 кДа до примерно 2200 кДа; от примерно 1900 кДа до примерно 2700 кДа; от примерно 1200 кДа до примерно 2400 кДа; от примерно 1700 кДа до примерно 2600 кДа; от примерно 1300 кДа до примерно 2600 кДа; от примерно 1600 кДа до примерно 3000 кДа.
[0105] Соответственно, в одном варианте осуществления, белок-носитель внутри иммуногенного конъюгата изобретения представляет собой CRM197, и CRM197 ковалентно связывается с капсульным полисахаридом посредством карбаматной связи, амидной связи, или обеих. Количество лизиновых остатков в белке-носителе, которые становятся конъюгированными с капсульным полисахаридом, могут быть охарактеризованы как ряд конъюгированных лизинов. Например, в представленной иммуногенной композиции, CRM197 может содержать от 5 до 15 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Другой способ, чтобы выразить данный параметр представляет, что от 12% до 40% из CRM197 лизинов являются ковалентно связанными с капсульным полисахаридом. В некоторых вариантах осуществления, часть CRM197 полисахарида, ковалентно связанного с CRM197, содержит от 5 до 25 лизинов, ковалентно связанных с полисахаридом. В некоторых вариантах осуществления, часть CRM197 полисахарида, ковалентно связанного с CRM197, содержит от 5 до 20 лизинов, ковалентно связанных с полисахаридом. В некоторых вариантах осуществления, часть CRM197 полисахарида, ковалентно связанного с белком-носителем, содержит от 10 до 25 лизинов, ковалентно связанных с полисахаридом. В некоторых вариантах осуществления, часть CRM197 полисахарида, ковалентно связанного с белком-носителем, содержит от 8 до 15 лизинов, ковалентно связанных с полисахаридом. Например, в представленной иммуногенной композиции, CRM197 может содержать от 18 до 22 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Другой способ, чтобы выразить данный параметр представляет, что от 40% до 60% из CRM197 лизинов являются ковалентно связанными с капсульным полисахаридом. В некоторых вариантах осуществления, CRM197 содержит от 5 до 15 лизинов из 39 ковалентно связанных с СР8. Другой способ, чтобы выразить данный параметр представляет, что от 12% до 40% из CRM197 лизинов являются ковалентно связанными с СР8. В некоторых вариантах осуществления, CRM197 содержит от 18 до 22 лизинов из 39 ковалентно связанных с СР5. Другой способ, чтобы выразить данный параметр представляет, что от 40% до 60% из CRM197 лизинов являются ковалентно связанными с СР5.
[0106] Как обсуждается выше, количество лизиновых остатков в белке-носителе, конъюгированном с капсульным полисахаридом может характеризоваться как диапазон конъюгированных лизинов, который может быть выражен как молярное соотношение. Например, молярное соотношение конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может составлять примерно от 18:1 до примерно 22:1. В одном варианте осуществления, диапазон молярных соотношений конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может составлять от примерно 15:1 до примерно 25:1. В некоторых вариантах осуществления, диапазон молярных соотношений конъюгированных лизинов к CRM197 в СР8 иммуногенном конъюгате может составлять от примерно 14:1 до примерно 20:1; от примерно 12:1 до примерно 18:1; от примерно 10:1 до примерно 16:1; от примерно 8:1 до примерно 14:1; от примерно 6:1 до примерно 12:1; от примерно 4:1 до примерно 10:1; от примерно 20:1 до примерно 26:1; от примерно 22:1 до примерно 28:1; от примерно 24:1 до примерно 30:1; от примерно 26:1 до примерно 32:1; от примерно 28:1 до примерно 34:1; от примерно 30:1 до примерно 36:1; от примерно 5:1 до примерно 10:1; от примерно 5:1 до примерно 20:1; от примерно 10:1 до примерно 20:1 или от примерно 10:1 до примерно 30:1. Кроме того, молярное соотношение конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате могут составлять от примерно 3:1 до 25:1. В одном варианте осуществления, диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате может составлять от примерно 5:1 до примерно 20:1. В одном варианте осуществления, диапазон молярного соотношения конъюгированных лизинов к CRM197 в СР5 иммуногенном конъюгате может составлять от примерно 4:1 до примерно 20:1; от примерно 6:1 до примерно 20:1; от примерно 7:1 до примерно 20:1; от примерно 8:1 до примерно 20:1; от примерно 10:1 до примерно 20:1; от примерно 11:1 до примерно 20:1; от примерно 12:1 до примерно 20:1; от примерно 13:1 до примерно 20:1; от примерно 14:1 до примерно 20:1; от примерно 15:1 до примерно 20:1; от примерно 16:1 до примерно 20:1; от примерно 17:1 до примерно 20:1; от примерно 18:1 до примерно 20:1; от примерно 5:1 до примерно 18:1; от примерно 7:1 до примерно 16:1 или от примерно 9:1 до примерно 14:1.
[0107] Другим способом, чтобы выразить количество лизиновых остатков в белке-носителе, конъюгированном с капсульным полисахаридом может быть представлено как диапазон конъюгированных лизинов. Например, в предоставленном СР8 иммуногенном конъюгате, CRM197 может содержать от 5 до 15 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Альтернативно, данный параметр может быть выражен в виде процентного содержания. Например, в предоставленном СР8 иммуногенном конъюгате, процентное содержание конъюгированных лизинов может составлять от 10% до 50%. В некоторых вариантах осуществления, от 20% до 50% лизинов могут быть ковалентно связанными с СР8. Альтернативно еще, от 30% до 50% из CRM197 лизинов могут быть ковалентно связанными с СР8; от 10% до 40% из CRM197 лизинов; от 10% до 30% из CRM197 лизинов; от 20% до 40% из CRM197 лизинов; от 25% до 40% из CRM197 лизинов; от 30% до 40% из CRM197 лизинов; от 10% до 30% из CRM197 лизинов; от 15% до 30% из CRM197 лизинов; от 20% до 30% из CRM197 лизинов; от 25% до 30% из CRM197 лизинов; от 10% до 15% из CRM197 лизинов; или от 10% до 12% из CRM197 лизинов являются ковалентно связанными с СР8. Кроме того, в предоставленном СР5 иммуногенном конъюгате, CRM197 может содержать от 18 до 22 лизинов из 39 ковалентно связанных с капсульным полисахаридом. Альтернативно, данный параметр может быть выражен в виде процентного содержания. Например, в предоставленном СР5 иммуногенном конъюгате, процентное содержание конъюгированных лизинов может составлять от 40% до 60%. В некоторых вариантах осуществления, от 40% до 60% из лизинов могут быть ковалентно связанными с СР5. Альтернативно еще, от 30% до 50% из CRM197 лизинов могут быть ковалентно связанными с СР5; от 20% до 40% из CRM197 лизинов; от 10% до 30% из CRM197 лизинов; от 50% до 70% из CRM197 лизинов; от 35% до 65% из CRM197 лизинов; от 30% до 60% из CRM197 лизинов; от 25% до 55% из CRM197 лизинов; от 20% до 50% из CRM197 лизинов; от 15% до 45% из CRM197 лизинов; от 10% до 40% из CRM197 лизинов; от 40% до 70% из CRM197 лизинов; или от 45% до 75% из CRM197 лизинов являются ковалентно связанными с СР5.
[0108] Частота присоединения капсульной полисахаридной цепи к лизину на молекуле-носителе является другим параметром для характеристики конъюгатов капсульных полисахаридов. Например, в одном варианте осуществления, по меньшей мере, одна ковалентная связь между CRM197 и полисахаридом встречается, по меньшей мере, для каждых от 5 до 10 сахаридных повторяющихся единиц капсульного полисахарида. В другом варианте осуществления, существует, по меньшей мере, одна ковалентная связь между CRM197 и капсульным полисахаридом для каждых от 5 до 10 сахаридных повторяющихся единиц; каждых от 2 до 7 сахаридных повторяющихся единиц, каждых от 3 до 8 сахаридных повторяющихся единиц; каждых от 4 до 9 сахаридных повторяющихся единиц; каждых от 6 до 11 сахаридных повторяющихся единиц; каждых от 7 до 12 сахаридных повторяющихся единиц; каждых от 8 до 13 сахаридных повторяющихся единиц; каждых от 9 до 14 сахаридных повторяющихся единиц; каждых от 10 до 15 сахаридных повторяющихся единиц; каждых от 2 до 6 сахаридных повторяющихся единиц, каждых от 3 до 7 сахаридных повторяющихся единиц; каждых от 4 до 8 сахаридных повторяющихся единиц; каждых от 6 до 10 сахаридных повторяющихся единиц; каждых от 7 до 11 сахаридных повторяющихся единиц; каждых от 8 до 12 сахаридных повторяющихся единиц; каждых от 9 до 13 сахаридных повторяющихся единиц; каждых от 10 до 14 сахаридных повторяющихся единиц; каждых от 10 до 20 сахаридных повторяющихся единиц; каждых от 5 до 10 сахаридных повторяющихся единиц капсульного полисахарида. В другом варианте осуществления, по меньшей мере, одна связь между CRM197 и капсульным полисахаридом возникает для каждых 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридных повторяющихся единиц капсульного полисахарида.
[0109] Химическая активация полисахаридов и дальнейшая конъюгация с белком-носителем может быть достигнута, используя общепринятые способы. Смотри, например, патенты США №№4,673,574 и 4,902,506. Альтернативно могут быть использованы другие способы активации и конъюгации.
[0110] "Носитель-белок" или "белок-носитель", как используется в данном документе, касается какой-либо молекулы белка, которая может быть конъюгированной с антигеном (таким как капсульные полисахариды) к которому является желательным иммунной ответ. Конъюгация антигена, такого как полисахарид, с белком-носителем может приводить к иммуногенному антигену. Белки-носители преимущественно представляют собой белки, которые нетоксичны и нереакционногенные и доступные в достаточном количестве и достаточной чистоты. Примерами белков-носителей являются токсины, анатоксины или какой-либо мутантный перекрестно-реактивный материал (CRM197) токсина из столбняка, дифтерии, коклюша, Pseudomonas вида, Е.coli, Staphylococcus вида и Streptococcus вида. Белки-носители должны быть поддающимися стандартным процедурам конъюгации. В конкретном варианте осуществления представленного изобретения CRM197 используется как белок-носитель.
[0111] CRM197 (Wyeth/Pfizer, Sanford, NC) является нетоксичным вариантом (то есть, анатоксином) токсина дифтерии, выделенного из культур Corynebacterium diphtheria штамма C7 (β197), выращенного в среде на основе казаминовых кислот и дрожжевого экстракта. CRM197 очищают посредством ультра-фильтрации, осаждения сульфатом аммония и ион-обменной хроматографии. Культура Corynebacterium diphtheriae штамма C7 (197), которая продуцирует CRM197 белок, была депонирована в Американской коллекции типовых культур (American Type Culture Collection), Rockville, Maryland и присвоен номер доступа АТСС 53281. Другие дифтерийные анатоксины также являются приемлемыми для использования как белки-носители.
[0112] Другие приемлемые белки-носители включают инактивированные бактериальные токсины, такие как анатоксин столбняка, анатоксин коклюша, анатоксин холеры (например, как описано в заявке на международный патент WO 2004/083251), Е.coli LT, Е.coli ST, и экзотоксин A из Pseudomonas aeruginosa. Бактериальные белки наружной мембраны, такие как комплекс с белка наружной мембраны (ОМРС), порины, трансферин связывающие белки, пневмогемолизин, пневмококковый поверхностный белок A (PspA), пневмококковый адгезивный белок (PsaA), С.difficile энтеротоксин (токсин A) и цитотоксин (токсин В) или Haemophilus influenzae белок D, также могут быть использованы. Другие белки, такие как стрептококковая С5а пептидаза (SCP), яичный белок, гемоцианин лимфы улитки (KLH), альбумин бычий сывороточный (BSA) или очищенный белковый продукт туберкулина (PPD) также могут быть использованы как белки-носители.
[0113] После конъюгации капсульного полисахарида с белком-носителем, конъюгаты полисахарид-белок очищают (обогащенного по отношению к количеству полисахарид-белкового конъюгата), используя разнообразие методик. Данные методики включают, например, операции концентрирования/диафильтрования, осаждения/элюирования, колоночную хроматографию, и глубинное фильтрование. Смотри примеры ниже.
[0114] Затем индивидуальные конъюгаты очищают, их могут комбинировать для формуляции иммуногенной композиции в соответствии с представленным изобретением, которая может быть использована, например, в вакцине. Формуляция иммуногенной композиции представленного изобретения могут выполнять, используя способы, принятые в данной области.
[0115] Следует отметить, что в данном раскрытии термины, такие как "содержит", "содержавший", "содержащий", "составляет", "составляющий" и им аналогичные могут иметь значения, прописанные для них в патентном законе США; например, они могут означать "включает", "включенный", "включающий" и им аналогичные. Такие термины относятся к включению индивидуальных ингредиентов или совокупности ингредиентов без исключения каких-либо других ингредиентов. Термины, такие как "состоящий преимущественно из" и "преимущественно состоит из" имеет значение, прописанное для них в патентном законе США, например, они допускают включение дополнительных ингредиентов или стадий, которые не приуменьшают новые или основные характеристики изобретения, то есть, они исключают дополнительные неперечисленные ингредиенты или стадии, которые приуменьшают новые или основные характеристики изобретения, и они исключают ингредиенты или стадии из уровня техники, такие как документы уровня техники, которые цитируются в данном документе или являются невключенными как ссылки в данном документе, тем более, что целью данного документа является определение вариантов осуществления, которые являются патентоспособными, например, новыми, неочевидными, оригинальными, по сравнению с уровнем техники, например, по сравнению с документами, цитируемыми в данном документе, или включенными в данный документ в качестве ссылки. И, термины "состоит из" и "состоящий из" имеют значения, прописанные для них в патентном законе США; а именно, такие термины, которые являются закрытыми. Соответственно, такие термины относятся к включению конкретного ингредиента или совокупности ингредиентов и исключению всех других ингредиентов.
[0116] "Консервативное аминокислотное замещение" относится к замещению одного или больше аминокислотных остатков в белке на другие аминокислотные остатки, имеющие подобные физические и/или химические свойства. Заместители для аминокислот в пределах последовательности могут быть выбраны из других членов класса, к которому аминокислота принадлежит. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин. Аминокислоты, содержащие ароматическую кольцевую структуру, представляют собой фенилаланин, триптофан и тирозин. Полярные нейтральные аминокислоты включают глицин, серии, треонин, цистеин, тирозин, аспарагин и глутамин. Положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин. Отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту. Предполагается, что такие изменения не будут влиять на среднюю молекулярную массу, как установлено с помощью электрофорез в полиакриламидном геле или по изоэлектрической точке. Особенно предпочтительными замещениями являются: Lys на Arg и наоборот, в результате чего положительный заряд может сохраняться; Glu на Asp и наоборот, в результате чего отрицательный заряд может сохраняться; Ser на Thr, в результате чего свободная -OH может сохраняться; и Gln на Asn, в результате чего свободная NH2 может сохраняться.
[0117] "Фрагмент" касается белков, в которые включены только специфические домены большего белка. Например, ClfA и ClfB белки содержат вплоть до 8 доменов каждый, если включены сигнальные последовательности. Рассматривается, что полипептид, соответствующий N1N2N3, N2N3, N1N2, N1, N2 или N3 доменам, каждый является фрагментами ClfA или ClfB. "Фрагмент", кроме того, касается или белка, или полипептида, содержащего аминокислотную последовательность, по меньшей мере, из 4 аминокислотных остатков (предпочтительно, по меньшей мере, 10 аминокислотных остатков, по меньшей мере, 15 аминокислотных остатков, по меньшей мере, 20 аминокислотных остатков, по меньшей мере, 25 аминокислотных остатков, по меньшей мере, 40 аминокислотных остатков, по меньшей мере, 50 аминокислотных остатков, по меньшей мере, 60 аминокислотных остатков, по меньшей мере, 70 аминокислотных остатков, по меньшей мере, 80 аминокислотных остатков, по меньшей мере, 90 аминокислотных остатков, по меньшей мере, 100 аминокислотных остатков, по меньшей мере, 125 аминокислотных остатков или, по меньшей мере, 150 аминокислотных остатков) аминокислотной последовательности исходного белка или полипептида, или нуклеиновую кислоту, содержащую нуклеотидную последовательность, по меньшей мере, из 10 пар оснований (предпочтительно, по меньшей мере, 20 пар оснований, по меньшей мере, 30 пар оснований, по меньшей мере, 40 пар оснований, по меньшей мере 50 пар оснований, по меньшей мере, 50 пар оснований, по меньшей мере, 100 пар оснований, по меньшей мере, 200 пар оснований) нуклеотидной последовательности исходной нуклеиновой кислоты.
[0118] "Функциональная активность" антитела или "функциональное антитело", как используется в данном документе, касается антитела, которое, по меньшей мере, может специфически связываться с антигеном. Дополнительные функции известны с уровня техники и могут включать дополнительные компоненты иммунной системы, которая осуществляет клиренс или подавление патогенна, такое как прямая опсонизация, ADCC или комплемент-опосредованная цитотоксичность. После антигенного связывания, какие-либо последующие функции антитела могут выступать связующим звеном через Fc область антитела. Опсонофагоцитарный анализ антитела (ОРА) представляет собой анализ in vitro, предназначенный для измерения in vitro lg комплемент-способствующего подавления бактерий эффекторными клетками (белыми кровяными клетками), таким образом, имитируя биологический процесс. Антительное связывание может, кроме того, напрямую ингибировать биологическую функцию антигена, который он связывает, например, антитела, которые связывают ClfA, могут нейтрализовать его ферментную функцию. В некоторых вариантах осуществления, "функциональное антитело" касается антитела, которое является функциональным, как определено путем подавления бактерий в эффективной модели на животных или опсонофагоцитарным анализом подавления, который демонстрирует, что антитела подавляют бактерии.
[0119] Молекулярная масса капсульных полисахаридов S.aureus представляет собой учитываемый фактор при использовании в иммуногенных композициях. Например, капсульные полисахариды с высокой молекулярной массой могут быть способными индуцировать определенные антительные иммунные ответы благодаря более высокой валентности эпитопов, присутствующих на антигенной поверхности. Выделение "высокомолекулярных капсульных полисахаридов" предполагается для использования в композициях и способах представленного изобретения. Например, в одном варианте осуществления изобретения рассматривается выделение высокомолекулярных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от примерно 50 до примерно 800 кДа. В одном варианте осуществления изобретения рассматривается выделение высокомолекулярных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от примерно 20 до примерно 1000 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от примерно 50 до примерно 300 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от примерно 70 кДа до 300 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от примерно 90 кДа до 250 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от 90 кДа до 150 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от 90 кДа до 140 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 5, изменяющийся по величине молекулярной массы в пределах от 80 кДа до 120 кДа. Другие диапазоны высокомолекулярных капсульных полисахаридов серотипа 5, которые могут быть выделены и очищены с использованием способов данного изобретения, включают диапазоны изменений от примерно 70 Да до примерно 100 кДа по молекулярной массе; от 70 кДа до 110 кДа по молекулярной массе; от 70 кДа to 120 кДа по молекулярной массе; от 70 кДа до 130 кДа по молекулярной массе; от 70 кДа до 140 кДа по молекулярной массе; от 70 кДа до 150 кДа по молекулярной массе; от 70 кДа до 160 кДа по молекулярной массе; от 80 кДа до 110 кДа по молекулярной массе; от 80 кДа до 120 кДа по молекулярной массе; от 80 кДа до 130 кДа по молекулярной массе; от 80 кДа до 140 кДа по молекулярной массе; от 80 кДа до 150 кДа по молекулярной массе; от 80 кДа до 160 кДа по молекулярной массе; от 90 кДа до 110 кДа по молекулярной массе; от 90 кДа до 120 кДа по молекулярной массе; от 90 кДа до 130 кДа по молекулярной массе; от 90 кДа до 140 кДа по молекулярной массе; от 90 кДа до 150 кДа по молекулярной массе; от 90 кДа до 160 кДа по молекулярной массе; от 100 кДа до 120 кДа по молекулярной массе; от 100 кДа до 130 кДа по молекулярной массе; от 100 кДа до 140 кДа по молекулярной массе; от 100 кДа до 150 кДа по молекулярной массе; от 100 кДа до 160 кДа по молекулярной массе; и аналогичные желаемые диапазоны молекулярных масс.
[0120] Как обсуждается выше, молекулярная масса капсульных полисахаридов S.aureus представляет собой учитываемый фактор при использовании в иммуногенных композициях. Например, капсульные полисахариды с высокой молекулярной массой могут быть способными индуцировать определенные антительные иммунные ответы благодаря более высокой валентности эпитопов, присутствующих на антигенной поверхности. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от примерно 20 кДа до примерно 1000 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от примерно 50 кДа до примерно 700 кДа. В одном варианте осуществления изобретения рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от примерно 50 кДа до 300 кДа. В одном варианте осуществления рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от 70 кДа до 300 кДа. В одном варианте осуществления рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от 90 кДа до 250 кДа. В одном варианте осуществления рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от 90 кДа до 150 кДа. В одном варианте осуществления рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от 90 кДа до 120 кДа. В одном варианте осуществления рассматривается выделение и очистка высокомолекулярных капсульных полисахаридов типа 8, изменяющийся по величине молекулярной массы в пределах от 80 кДа до 120 кДа. Другие диапазоны высокомолекулярных капсульных полисахаридов серотипа 8, которые могут быть выделены и очищены с использованием способов данного изобретения, включают диапазоны изменений от примерно 70 кДа до примерно 100 кДа по молекулярной массе; от 70 кДа до 110 кДа по молекулярной массе; от 70 кДа до 120 кДа по молекулярной массе; от 70 кДа до 130 кДа по молекулярной массе; от 70 кДа до 140 кДа по молекулярной массе; от 70 кДа до 150 кДа по молекулярной массе; от 70 кДа до 160 кДа по молекулярной массе; от 80 кДа до 110 кДа по молекулярной массе; от 80 кДа до 120 кДа по молекулярной массе; от 80 кДа до 130 кДа по молекулярной массе; от 80 кДа до 140 кДа по молекулярной массе; от 80 кДа до 150 кДа по молекулярной массе; от 80 кДа до 160 кДа по молекулярной массе; от 90 кДа до 110 кДа по молекулярной массе; от 90 кДа до 120 кДа по молекулярной массе; от 90 кДа до 130 кДа по молекулярной массе; от 90 кДа до 140 кДа по молекулярной массе; от 90 кДа до 150 кДа по молекулярной массе; от 90 кДа до 160 кДа по молекулярной массе; от 100 кДа до 120 кДа по молекулярной массе; от 100 кДа до 130 кДа по молекулярной массе; от 100 кДа до 140 кДа по молекулярной массе; от 100 кДа до 150 кДа по молекулярной массе; от 100 кДа до 160 кДа по молекулярной массе; и аналогичные желаемые диапазоны молекулярных масс.
[0121] "Иммунный ответ" к иммуногенной композиции представляет собой развитие у субъекта гуморального и/или клеточно-опосредованного иммунного ответа к молекулам, присутствующим в соответствующей композиции (например, антиген, такой как белок или полисахарид). С точки зрения представленного изобретения "гуморальный иммунный ответ" представляет собой антителоопосредованный иммунный ответ и включает генерирование антител с аффинностью антигенов, присутствующих в иммуногенных композициях изобретения, в то время как "клеточно-опосредованный иммунный ответ" представляет собой единственный, опосредованный Т-лимфоцитами и/или другими белыми кровяными клетками. "Клеточно-опосредованный иммунный ответ" вызывается презентированием антигенных эпитопов в ассоциации с молекулами класса I или класса II главного комплекса гистосовместимости (МНС). Это активирует антиген-специфические CD4+ клетки Т-хелперы или CD8+ цитотоксические T-лимфоциты ("CTL"). CTL имеют специфичность по отношению к белковым или липидным антигенам, которые являются представленными в ассоциации с белками, кодированными главным комплексом гистосовместимости (МНС) или CD1 и экспрессированными на поверхностях клеток. CTL помогают индуцированию и активированию внутриклеточной деструкции внутриклеточных микробов, или лизису клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфический ответ за счет клеток T-хелперов. Клетки T-хелперы действуют, чтобы помочь стимулированию функции, и фокус активности неспецифических эффекторных клеток по отношению к клеткам, представляющим белковые антигены в ассоциации с классическими или неклассическими МНС молекулами на их поверхности. "Клеточно-опосредованный иммунный ответ", кроме того, касается продуцирования цитокинов, хемокинов и других таких молекул, продуцируемых активированными T-клетками и/или другими белыми кровяными клетками, включая производные от CD4+ и CD8+ T-клеток. Способность конкретного антигена или композиции стимулировать клеточно-опосредованную иммунологическую реакцию может быть определена путем ряда исследований, таких как с использованием лимфопролиферационных (активации лимфоцитов) анализов, CTL анализы цитотоксической клетки, путем проведения анализа на T-лимфоциты, специфичные к антигену, у чувствительного субъекта, или путем измерения продуцирования цитокинов T-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны с уровня техники. Смотри, например, Erickson et al., J. Immunol. (1993) 151:4189-4199; Doe et al., Eur. J. Immunol. (1994) 24:2369-2376.
[0122] Термин "иммуногенный" касается способности антигена или вакцины вызывать иммунный ответ, или гуморальный или клеточно-опосредованный, или оба.
[0123] "Иммуногенное количество", или "иммунологически эффективное количество" или "доза", каждое из которых используется взаимозаменяемо в данном документе, как правило, касается количества антигена или иммуногенной композиции достаточного, чтобы вызвать иммунный ответ, или клеточный (T-клетка), или гуморальный (B-клетка или антитело) ответ, или оба, определяемый стандартными исследованиями, известными квалифицированному специалисту в данной области с уровня техники.
[0124] Количество конкретного конъюгата в композиции, как правило, рассчитывают на основе общего полисахарида, конъюгированного или неконъюгированного для этого конъюгата. Например, СР5 конъюгат с 20% свободного полисахарида будут составлять примерно 80 мкг конъюгированного СР5 полисахарида и примерно 20 мкг неконъюгированного СР5 полисахарида в 100 мкг дозы СР5 полисахарида. Вклад белка в конъюгат обычно не принимают во внимание при расчетах дозы конъюгата. Количество конъюгата может варьировать в зависимости от стафилококкового серотипа. Как правило, каждая доза будет содержать от 0,01 до 100 мкг полисахарида, в частности от 0,1 до 10 мкг и более конкретно от 1 до 10 мкг. "Иммуногенное количество" различных полисахаридных компонентов в иммуногенной композиции, может различаться и каждая может содержать 0,01 мкг, 0,1 мкг, 0,25 мкг, 0,5 мкг, 1 мкг, 2 мкг, 3 мкг, 4 мкг, 5 мкг, 6 мкг, 7 мкг, 8 мкг, 9 мкг, 10 мкг, 15 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг или примерно 100 мкг какого-либо конкретного полисахаридного антигена.
[0125] В другом варианте осуществления изобретения "иммуногенное количество" белковых компонентов в иммуногенной композиции может находиться в диапазоне от примерно 10 мкг до примерно 300 мкг каждого белкового антигена. В конкретном варианте осуществления "иммуногенное количество" белковых компонентов в иммуногенной композиции может находиться в диапазоне от примерно 20 мкг до примерно 200 мкг каждого белкового антигена. "Иммуногенное количество" различных белковых компонентов в иммуногенной композиции может различаться, и каждая содержит 10 мкг, 20 мкг, 30 мкг, 40 мкг, 50 мкг, 60 мкг, 70 мкг, 80 мкг, 90 мкг, 100 мкг, 125 мкг, 150 мкг, 175 мкг или примерно 200 мкг какого-либо конкретного белкового антигена.
[0126] Эффективность антигена, как иммуногена, может быть измерена путем измерения уровней активности В-клетки путем измерения уровней циркулирующих антител специфических для антигена в сыворотке, используя иммунологические анализы, иммунопреципитационные анализы, функциональные анализы антител, такие как in vitro опсонические исследования и многие другие анализы, известные в данной области с уровня техники. Другой критерий эффективности антигена, как T-клеточного иммуногена, может быть измерен с использованием любого из пролиферационных анализов, цитолитических анализов, таких как тесты с радиоактивным хромом, чтобы измерить способность Т-клетки лизировать ее клеточную специфическую мишень. Более того, в представленном изобретении, "иммуногенное количество" также может быть определено путем измерения сывороточных уровней антиген-специфического антитела, продуцированного последующим введением антигена, или, путем измерения способности антител, подобным образом индуцированных, чтобы увеличить опсонофагоцитирующую способность специфических белых кровяных клеток, как описано в данном документе. Уровень защиты иммунного ответа может быть измерен путем контрольного заражения иммунизированного хозяина антигеном, который вводили инъекционно. Например, если антиген, к которому желателен иммунный ответ, является бактерией, уровень защиты, индуцированный "иммуногенным количеством" антигена, может быть измерен путем определения процентного выживания или процентной смертности, после контрольного заражения животных бактериальными клетками. В одном варианте осуществления, количество защиты может быть измерено путем определения, по меньшей мере, одного симптома, связанного с бактериальной инфекцией, например, лихорадки, связанной с инфекцией. Количество каждого из антигенов в мульти-антигенной или многокомпонентной вакцине или иммуногенных композициях будет варьировать с учетом каждого из других компонентов и может быть определена с помощью способов, известных квалифицированному специалисту в данной области. Такие способы должны включать, например, методики измерения иммуногенности и/или эффективности in vivo.
[0127] Термин "иммуногенная композиция" касается какой-либо фармацевтической композиции, содержащей антиген, например, микроорганизм или его компонент, где композиция может быть использована, чтобы вызвать иммунный ответ у субъекта. Иммуногенные композиции представленного изобретения могут быть использованы для лечения человека, восприимчивого к S.aureus инфекции, посредством введения иммуногенных композиций системным, трансдермальным или мукосомальным способом. Данные введения могут включать инъекционные внутримышечные (в.м), внутрибрюшинные (в.д.), внутрикожные (в.к.) или подкожные способы; применение пластыря или других устройств трансдермальной доставки; или посредством мукосомального введения через ротовую полость/пищеварительный, дыхательный или мочеполовой тракты. В одном варианте осуществления, интраназальное введение используется для лечения или предупреждения носоглоточного носительства S.aureus, таким образом ослабляя инфекцию на ее самой ранней стадии. В одном варианте осуществления, иммуногенную композицию могут использовать в производстве вакцины или элиситации поликлональных или моноклональных антител, которые могли быть использованы для пассивной защиты или лечения животного.
[0128] Оптимальные количества компонентов для конкретной иммуногенной композиции может быть определено стандартными исследованиями, включающими изучение соответствующих иммунных ответов у субъектов. После первичной вакцинации, субъекты могут получать одну или несколько повторных иммунизации через соответствующие промежутки.
[0129] В одном варианте осуществления представленного изобретения, S.aureus лиофилизированная иммуногенная композиция содержит фрагмент рекомбинантного агглютинирующего фактора A (ClfA) S. aureus (N1N2N3 или их комбинации). В дополнительном варианте осуществления представленного изобретения S.aureus лиофилизированная иммуногенная композиция содержит фрагмент рекомбинантного агглютинирующего фактора A (ClfA) S.aureus, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197 и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197.
[0130] Иммуногенные композиции представленного изобретения могут, кроме того, содержать один или больше дополнительных "иммуномодуляторов", которые являются агентами, которые искажают или изменяют иммунную систему, в результате чего наблюдается или стимулирующая регуляция или супрессирующая регуляция гуморального и/или клеточно-опосредованного иммунитета. В одном конкретном варианте осуществления предпочтение отдается стимулирующей регуляции гуморальных и/или клеточно-опосредованных спейсеров иммунной системы. Примеры конкретных иммуномодуляторов, среди других, включают, например, вспомогательные вещества или цитокин, или ISCOMATRIX™ (CSL Limited, Parkville, Australia), описанные в патенте США No. 5,254,339. Неограничивающие примеры вспомогательных веществ, которые - могут быть использованы в вакцине представленного изобретения, включают RIBI адъювантную систему (Ribi Inc., Hamilton, Mont.), алюминиевые квасцы, минеральные гели, такие как гель гидроксида алюминия, эмульсии масло-в-воде, эмульсии вода-в-масле, такие как, например, полные и неполные адъюванты Фрейнда, блок-сополимер (CytRx, Atlanta Ga.), QS-21 (Cambridge Biotech Inc., Cambridge Mass.), SAF-M (Chiron, Emeryville Calif.), AMPHIGEN® адъювант, сапонин, Quil A или другая фракция сапонина, монофосфорил-липид А, и липидно-аминный адъювант авридин. Неограничивающие примеры эмульсий масло-в-воде, пригодные для вакцины изобретения, включают модифицированные SEAM62 и SEAM 1/2 составы. Модифицированный SEAM62 представляет собой эмульсию масло-в-воде, содержащую 5% (об./об.) сквалена (Sigma), 1% (об./об.) детергента SPAN® 85 (ICI Surfactants), 0,7% (об./об.) детергента - полисорбат 80 (ICI Surfactants), 2,5% (об./об.) этанола, 200 мкг/мл Quil А, 100 мкг/мл холестерина и 0,5% (об./об.) лецитина. Модифицированный SEAM 1/2 представляет собой эмульсию масло-в-воде, содержащую 5% (об./об.) сквалена, 1% (об./об.) детергента SPAN® 85, 0,7% (об./об.) детергента - полисорбат 80, 2,5% (об./об.) этанола, 100 мкг/мл Quil A и 50 мкг/мл холестерина. Другие "иммуномодуляторы", которые могут быть включены в композиции изобретения, включают, например, один или больше интерлейкинов, интерферонов или других известных цитокинов или хемокинов. В одном варианте осуществления вспомогательное вещество может быть производным циклодекстрина или полианионным полимером, таким как те, которые описаны в патентах США с номерами 6,165,995 и 6,610,310, соответственно. Следует понимать, что иммуномодулятор и/или вспомогательное вещество, которые используются, будут зависеть от субъекта, которому вакцина или иммуногенная композиция будут вводиться, способа инъекции и количества инъекций, которые будут сделаны.
[0131] В еще дополнительном варианте осуществления представленного изобретения лиофилизированная иммуногенная композиция S.aureus содержит фрагмент рекомбинантного агглютинирующего фактора A (ClfA) S.aureus, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, выделенные капсульные полисахариды типа 8, конъюгированные с CRM197, и рекомбинантный MntC белок (также известный как rP305A). В некоторых вариантах осуществления MntC белок является липидированным. В других вариантах осуществления, MntC белок является нелипидированным. В другом варианте осуществления иммуногенная композиция S.aureus является стерильным препаратом (жидким, лиофилизированным, ДНК вакциной, внутрикожным препаратом) фрагмента рекомбинантного агглютинирующего фактора A (ClfA) S.aureus (N1N2N3 или их комбинациями), фрагмента рекомбинантного агглютинирующего фактора B (ClfB) S.aureus (N1N2N3 или их комбинациями), выделенных капсульных полисахаридов типа 5, конъюгированных с CRM197, и выделенных капсульных полисахаридов типа 8, конъюгированных с CRM197.
[0132] В одном варианте осуществления представленного изобретения, S.aureus иммуногенная композиция содержит фрагмент рекомбинантного агглютинирующего фактор A (ClfA) S.aureus (N1N2N3 или их комбинацию), S.aureus железо-связывающий белок MntC, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном варианте осуществления S.aureus иммуногенная композиция является стерильным препаратом (жидким, лиофилизированным, ДНК вакциной, внутрикожным препаратом) фрагмента рекомбинантного агглютинирующего фактора (ClfA) S.aureus (N1N2N3 или их компбинации), фрагмента рекомбинантного агглютинирующего фактора B (ClfB) S.aureus (N1N2N3 или их компбинации), S.aureus железо-связывающего белка MntC, выделенных капсульных полисахаридов типа 5, конъюгированных с CRM197, и выделенных капсульных полисахаридов типа 8, конъюгированных с CRM197.
[0133] В одном варианте осуществления представленного изобретения, S.aureus иммуногенная композиция содержит фрагмент рекомбинантного агглютинирующего фактора B (ClfB) S.aureus (N1N2N3, или их комбинации), выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном варианте осуществления представленного изобретения, S.aureus иммуногенная композиция содержит фрагмент рекомбинантного агглютинирующего фактора B (ClfB) S.aureus (N1N2N3 или их комбинации), S.aureus железо-связывающий белок MntC, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197. В одном варианте осуществления представленного изобретения S.aureus иммуногенная композиция содержит S.aureus железо-связывающий белок MntC, выделенные капсульные полисахариды типа 5, конъюгированные с CRM197, и выделенные капсульные полисахариды типа 8, конъюгированные с CRM197.
[0134] S.aureus "инвазивным заболеванием" является выделение бактерий из естественно стерильных мест, где существуют связанные клинические признаки/симптомы заболевания. Естественно стерильные места в организме включают кровь, CSF, плевральную жидкость, перикардиальную жидкость, перитониальную жидкость, суставная/синовиальная жидкость, кость, места внутри организма (лимфатический узел, мозг, сердце, печень, селезенка, стекловидная жидкость, почка, поджелудочная железа, яичник), или другие естественно стерильные места. Клинические состояния, характеризующие инвазивные заболевания, включают бактериемию, пневмонию, целлюлит, остеомиелит, эндокардит, септический шок и многое другое.
[0135] Термин "выделенный" означает, что материал выделен из своей первоначальной окружающей среды (например, естественной окружающей среды, если он встречается в природе, или из организма хозяина, если он является рекомбинантным объектом, или взятый из одной окружающей среды в другую окружающую среду). Например, "выделенный" капсульный полисахарид, белок или пептид является в значительной степени свободным от клеточного материала или других загрязняющих белков из клеточного или тканевого источника, из которого белок произведен, или в значительной степени свободным от химических предшественников или других химических реагентов, если синтезированы химически, или в противном случае присутствуют в смеси как часть химической реакции. В представленном изобретении белки или полисахариды могут быть выделены из бактериальной клетки или из продукта распада клеток, таким образом, они предусматриваются в форме приемлемой для производства иммуногенной композиции. Термин "выделенный" или "выделяемый" может включать очищение или очистку, в том числе, например, способы очистки белков или капсульных полисахаридов, как описано в данном документе. Выражение "в значительной степени свободный от клеточного материала" включает получения полипептида/белка, при которых полипептид/белок отделяют от клеточных компонентов клеток, из которых их выделяют или рекомбинантно получают. Таким образом, капсульный полисахарид, белок или пептид, который в значительной степени, является свободным от клеточного материала, включает препараты капсульного полисахарида, белка или пептида, имеющие меньше, чем примерно 30%, 20%, 10%, 5%, 2,5% или 1%, (по отношению к сухой массе) загрязняющего белка или полисахарида, или другого клеточного материала. Когда полипептид/белок получен рекомбинантно, он также, предпочтительно, является в значительной степени свободным от культуральной среды, то есть, культуральная среда представляет собой меньше, чем примерно 20%, 10% или 5% от объема препарата белка. Когда полипептид/белок или полисахарид получен путем химического синтеза, он, предпочтительно, является в значительной степени свободным от химических предшественников или других химических реагентов, то есть, его отделяют от химических предшественников или других химических реагентов, которые принимают участие в синтезе белка или полисахарида. Соответственно, такие препараты полипептида/белка или полисахарида содержат меньше, чем примерно 30%, 20%, 10%, 5% (по отношению к сухой массе) химических предшественников или соединений за исключением интересующего фрагмента полипептида/белка или полисахарида.
[0136] "Неконсервативное аминокислотное замещение" относится к замещению одного или больше аминокислотных остатков белка на другие аминокислотные остатки, имеющие непохожие физические и/или химические свойства, используя характеристики, определенные выше.
[0137] Термин "фармацевтически приемлемый носитель" означает носитель, одобренный Федеральным агентством по регулированию, государственным правительством или другим регулирующим органом, или перечисленный в Фармакопее США или другой общепризнанной фармакопее для использования у животных, включая человека, а также млекопитающих, кроме человека. Термин "носитель" касается разбавителя, вспомогательного вещества, наполнителя или основы, с которыми фармацевтическая композиция вводится. Такие фармацевтические носители могут быть стерильными жидкостями, такими как вода или масла, включая и те, что нефтяного, животного, растительного или синтетического происхождения. Вода, солевые растворы и водные растворы декстрозы и глицерина могут быть использованы как жидкие носители, в частности для инъекционных растворов. Подходящие фармацевтические наполнители включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т.п. Композиция, если необходимо, может, кроме того, содержать незначительные количества увлажняющих, объемообразующих, эмульгирующих агентов или pH буферных агентов. Данные композиции могут находиться в форме растворов, суспензий, эмульсий, составов с замедленным высвобождением и т.д. Примеры приемлемых фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" под редакцией Е.W. Martin. Препарат должен соответствовать способу введения.
[0138] Термины "белок", "полипептид" и "пептид" относятся к полимеру из аминокислотных остатков и не ограничивают минимальную длину продукта. Таким образом, пептиды, олигопептиды, димеры, мультимеры и т.п. являются включенными в определение. Термины, кроме того, включают модификации, такие как делеции, присоединения и замещения (обычно традиционные в природе, но которые могут быть неконсервативными), нативной последовательности, предпочтительно такие, при которых белок сохраняет способность вызывать иммунологический ответ у животного, которому белок введен. Также включенными являются после экспрессионные модифицирования, например гликозилирование, ацетилирование, липидизация, фосфорилирование и т.п.
[0139] "Защитный" иммунный ответ касается способности иммуногенной композиций вызывать иммунный ответ или гуморальный, или клеточно-опосредованный, который служит для защиты субъекта от инфекции. Предусмотренная защита не должна быть абсолютной, то есть, инфекция не должна быть полностью предотвращена или уничтожена, если существует статистически значительное улучшение по сравнению с контрольной группой субъектов, например инфицированных животных, которым не вводилась вакцина или иммуногенная композиция. Защита может быть ограничена уменьшением тяжести или скорости появления симптомов инфекции. В общем, "защитный иммунный ответ" должен бы включать индуцирование увеличения уровней антител, специфичных для конкретного антигена, по меньшей мере, у 50% субъектов, в том числе некоторый уровень измеримых ответов функциональных антител к каждому антигену. В конкретных ситуациях, "защитный иммунный ответ" мог включать индуцирование двукратного повышения уровней антител или четырехкратного увеличения уровней антител, специфических для конкретного антигена, по меньшей мере, у 50% субъектов, в том числе некоторый уровень измеримых ответов функциональных антител к каждому антигену. В конкретных вариантах осуществления, опсонизирующие антитела коррелируют с защитным иммунным ответом. Таким образом, защитный иммунный ответ может быть количественно оценен путем измерения процентного снижения количества бактерий в опсоно-фагоцитарной реакции, например тех, что описаны ниже. Предпочтительным является снижение количества бактерий, по меньшей мере, на 10%, 25%, 50%, 65%, 75%, 80%, 85%, 90%, 95% или более.
[0140] Термин "рекомбинантный", как используется в данном документе, попросту касается какого-либо белка, полипептида или клетки, экспрессирующей интересующий ген, который получают способами генной инженерии. Термин "рекомбинантный", как используется в данном документе, применительно к белку или полипептиду, означает полипептид, полученный путем экспрессии рекомбинантного полинуклеотида. Белки, использованные в иммуногенных композициях изобретения, могут быть выделены из природного источника или полученные с использованием способов генной инженерии, такие как, например рекомбинантный ClfA, рекомбинантный ClfB или рекомбинантный MntC. "Рекомбинантный", как используется в данном документе, кроме того, описывает молекулу нуклеиновой кислоты, которая, в соответствии со своим источником или манипуляцией, не связывается со всем или частью полинуклеотида, с которым связывается в природе. Термин "рекомбинантный", как используется по отношению к клетке-хозяину, означает клетку-хозяин, в которую введен рекомбинантный полинуклеотид.
[0141] Рекомбинантный ClfA (rClfA) и рекомбинантный ClfB (rClfB), как используется в данном документе, касается форм ClfA или ClfB для применения в иммуногенных композициях изобретения. В конкретных вариантах осуществления, rClfA является фрагментом ClfA, содержащим один или больше N доменов, например, N1N2N3, N2N3, N2 или N3, и называется в данном документе, как "рекомбинантный ClfA" или "rClfA". В одном варианте осуществления, rClfB является фрагментом ClfB, содержащим один или больше N доменов ClfB, например, N1N2N3, N2N3, N2 или N3, и называется в данном документе, как "рекомбинантный ClfB" или "rClfB".
[0142] Термин "субъект" касается млекопитающего, птицы, рыбы, пресмыкающегося или какого-либо другого животного. Термин "субъект" также включает людей. Термин "субъект" также включает домашних любимцев. Неограничивающие примеры домашних любимцев включают: собак, котов, свиней, кроликов, крыс, мышей, песчанок, хомяков, морских свинок, хорьков, птиц, змей, ящериц, рыб, черепах и жаб. Термин "субъект" также включает домашних сельскохозяйственных животных. Неограничивающие примеры домашних сельскохозяйственных животных включают: альпаку, бизона, верблюда, крупный рогатый скот, оленя, свиней, лошадей, лам, мулов, ослов, овец, коз, кроликов, северных оленей, яка, цыплят, гусей и индюков.
[0143] Как используется в данном документе, "лечение" (включая его вариации, например, "лечить" или "поддаваемый лечению") касается какого-либо одного или больше из следующего: (i) предупреждение инфицирования или повторного инфицирования, как при традиционном вакцинировании, (ii) снижение тяжести или устранение симптомов, и (iii) значительное или полное устранение патогена или расстройства в проблеме. Следовательно, лечение может быть эффективным профилактически (до момента инфицирования) или терапевтически (после инфицирования). В представленном изобретении могут быть использованы профилактические или терапевтические лечения. В соответствии с конкретным вариантом осуществления представленного изобретения предусматриваются композиции и способы, которые лечат, в том числе профилактически и/или терапевтически иммунизируют, животного-хозяина против микробного инфицирования (например, бактерией, такой как вида Staphylococcus). Способы представленного изобретения являются пригодными для предоставления профилактического и/или терапевтического иммунитета субъекту. Способы представленного изобретения, кроме того, могут быть осуществлены на практике у субъектов для биомедицинских применений исследований.
[0144] Термины "вакцина" или "вакцинная композиция", которые используются взаимозаменяемо, касаются фармацевтических композиций, содержащих, по меньшей мере, одну иммуногенную композицию, которая индуцирует иммунный ответ у животных.
Общее описание
[0145] Представленное изобретение касается лиофилизированных иммуногенных композиций, содержащих антигены из стафилококкового организма, например S.aureus. В некоторых вариантах осуществления, лиофилизированная иммуногенная композиция содержит ClfA. В некоторых вариантах осуществления, лиофилизированная иммуногенная композиция содержит, по меньшей мере, три антигена. В некоторых вариантах осуществления, лиофилизированная иммуногенная композиция содержит, по меньшей мере, четыре антигена. Антигены могут быть выделены из организма, используя биохимические методики выделения, или они могут быть получены синтетически или с помощью рекомбинантных способов. Антигены могут быть полипептидами или полисахаридами, или их комбинацией. Данные иммуногенные композиции могут быть использованы в производстве вакцины, чтобы иммунизировать субъектов против инфекций, возникших по вине стафилококкового организма. Компоненты, подходящие для использования в данных композициях описаны более детально ниже.
Стафилококковые иммуногенные композиции
[0146] S.aureus является возбудителем заболевания широкого ряда человеческих заболеваний, начиная с поверхностных кожных инфекций, и заканчивая состояниями, угрожающими жизни, такими как пневмония, сепсис и эндокардит. Смотри Lowy N. Eng. J. Med. 339:580-532(1998). В случаях инвазивного заболевания, S.aureus может быть выделен из естественно стерильных мест организма, включая кровь, церебральную спинальную жидкость CSF, плевральную жидкость, перикардиальную жидкость, перитониальную жидкость, суставную/синовиальную жидкость, кость, место внутри организма (лимфатический узел, мозг, сердце, печень, селезенку, стекловидную жидкость, почку, поджелудочную железу, яичник), или другие естественные стерильные места. Это может привести к опасным для жизни клиническим состояниям, таким как бактериемия, пневмония, целлюлит, остеомиелит, эндокардит и септический шок. Взрослые, преклонного возраста и детского возраста пациенты наиболее подвержены S.aureus инфекциям.
[0147] Варианты осуществления представленного изобретения описывают выбранный антиген или антигены в лиофилизированных иммуногенных композициях, включая выделенный полипептид агглютинирующего фактора A (ClfA) S.Aureus, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем, выделенный агглютинирующий фактор B (ClfB) S.aureus, и выделенный S.aureus MntC белок. Некоторые составы лиофилизированных иммуногенных композиций были исследованы, чтобы продемонстрировать повышенную стабильность ClfA белка. Некоторые составы лиофилизированных иммуногенных композиций были исследованы, чтобы продемонстрировать повышенную стабильность MntC белка. Некоторые составы лиофилизированных композиций были, кроме того, исследованы, чтобы гарантировать, что конъюгаты СР5-белка и конъюгаты СР8-белка стабильны после лиофилизации.
[0148] Соответственно, какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный агглютинирующий фактор B (ClfB) S.aureus, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный S. aureus MntC белок, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный S.aureus MntC белок, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, выделенный S.aureus MntC белок, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8, конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный S.aureus MntC белок, выделенный S.aureus капсульный полисахарид типа 5, конъюгированный с белком-носителем, и выделенный S.aureus капсульный полисахарид типа 8 конъюгированный с белком-носителем. Какая-либо лиофилизированная иммуногенная композиция содержит: выделенный полипептид агглютинирующего фактора A (ClfA) S.aureus, выделенный полипептид агглютинирующего фактора B (ClfB) S.aureus, и выделенный S.aureus MntC белок.
[0149] В некоторых вариантах осуществления, указанные выше комбинации дополнительно содержат, по меньшей мере, один из следующих антигенов: EkeS, DsqA, KesK, KrkN, KrkN2, RkaS, RrkN, KnkA, SdrC, SdrD, SdrE, ОррЗа, DltD, HtsA, LtaS, IsdA, IsdB, IsdC, SdrF, SdrG, SdrH, SrtA, SpA, Sbi, альфа-гемолизин (hla), бета-гемолизин, фибронектин связывающий белок A (fnbA), фибронектин связывающий белок B (fnbB), коагулазу, Fig, map, лейкоцидин Пантон-Валентина (pvl), альфа-токсин и его разновидности, гамма-токсин (hlg) и его разновидности, ica, иммунодоминантный переносчик ABC, переносчик Mg2+, переносчик ABC Ni, RAP, аутолизин, лимининовые рецепторы, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, SasA, SasF, SasH, EFB (FIB), SBI, Npase, EBP, остеопонтин связывающий белок II, предшественник ауреолизина (AUR)/Sepp1, Cna, и их фрагменты, такие как М55, TSST-1, mecA, poly-N-ацетилгликозамин (PNAG/dPNAG) экзополисахарид, GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектин связывающий белок, HarA, EsxA, EsxB, энтеротоксин A, энтеротоксин B, энтеротоксин C1, и новый аутолизин.
Вспомогательные вещества
[0150] Лиофилизированные иммуногенные композиции, как описано в данном документе, кроме того, содержат, в конкретных вариантах осуществления, одно или больше вспомогательных веществ. В некоторых вариантах осуществления вспомогательное вещество является компонентом высушенной лиофилизированной композиции. В других вариантах осуществления вспомогательное вещество может быть добавлено к восстановленной лиофилизированной композиции перед введением композиции пациенту. Вспомогательное вещество является веществом, которое усиливает иммунный ответ, при введении его вместе с иммуногеном или антигеном. Показано, что ряд цитокинов или лимфокинов имеет иммуномодулирующую активность и, таким образом, являются пригодными, как вспомогательные вещества, включая, но не ограничиваясь этим, интерлейкины 1-α, 1-β, 2, 4, 5, 6, 7, 8, 10, 12 (смотри, например, патент США No. 5,723,127), 13, 14, 15, 16, 17 и 18 (и его мутантные формы); интерфероны α, β и γ; гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (смотри, например, патент США No. 5,078,996 и АТСС номер доступа 39900); макрофагальный колониестимулирующий фактор (M-CSF); гранулоцитарный колониестимулирующий фактор (G-CSF); и факторы некроза опухоли α и β. Еще другие вспомогательные вещества, которые используются с иммуногенными композициями, описанными в данном документе, включают хемокины, включая без ограничения, MCP-1, MIP-1α, MIP-1β и RANTES; адгезивные молекулы, такие как селектин, например, L-селектин, P-селектин и E-селектин; муцин-подобные молекулы, например, CD34, GlyCAM-1 и MadCAM-1; член интегринового семейства, такой как LFA-1, VLA-1, Mac-1 и p150.95; член иммуноглобулинового суперсемейства, такой как РЕСАМ, ICAMs, например, ICAM-1, ICAM-2 и ICAM-3, CD2 и LFA-3; со-стимулирующие молекулы, такие как B7-1, B7-2.CD40 и CD40L; факторы роста, включая васкулярный фактор роста, фактор роста нервов, фактор роста фибробластов, эпидермальный фактор роста, PDGF, ВЫ и васкулярный эндотелиальный фактор роста; рецепторные молекулы, включая Fas, TNF рецептор, Flt, Аро-1, р55, WSL-1, DR3, TRAMP, Аро-3, AIR, LARD, NGRF, DR4, DR5, KILLER, TRAIL-R2, TRICK2 и DR6; и каспаза (ICE).
[0151] Приемлемые вспомогательные вещества, используемые для увеличения иммунного ответа, дополнительно включают, без ограничения, MPL™ (3-О-деацилированный монофосфорильный липид A, Corixa, Hamilton, МТ), который описан в патенте США No. 4,912,094. Кроме того, приемлемыми для использования, как вспомогательные вещества, являются синтетические аналоги липида A или соединения аминоалкилглюкозамина фосфата (AGP), или их производные, или аналоги, которые предоставлены фирмой Corixa (Hamilton, МТ), и которые описаны в патенте Соединенных Штатов No. 6,113,918. Одним таким AGP является 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил-2-дезокси-4-O-фосфоно-3-O-[R)-3-тетрадеканоилокситетрадеканоил]-2-[R)-3-тетрадеканоилокситетрадеканоиламино]-b-D-глюкопиранозид, который также известен, как 529 (ранее известный, как RC529). Данное 529 вспомогательное вещество формулируется как водная форма (AF) или как стабильная эмульсия (SE).
[0152] Еще другие вспомогательные вещества включают мурамилпептиды, такие как N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланин-2-(1'-2' диполмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (МТР-PE); эмульсии масло-в-воде, такие как MF59 (патент США No. 6,299,884) (содержащий 5% сквалена, 0,5% полисорбата 80 и 0,5% SPAN™ 85 (необязательно содержащий различные количества МТР-PE), сформулированный в субмикронные частицы, используя микрофлюидайзер, такой как микрофлюидайзер Model 110Y (Microfluidics, Newton, MA)), и SAF (содержащий 10% сквалена, 0,4% полисорбата 80, 5% плюроник-блокированный полимер L121, и thr-MDP, или микрофлюидизированные в субмикронную эмульсию или перемешиваемые для получения эмульсии с большим размером частиц); неполные адъюванты Фрейнда (IFA); соли алюминия (алюминиевые квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия; амфиген; авридин; L121/сквален; D-лактид-полилактид/гликозид; плюрониловые полиолы; ослабленные Bordetella; сапонины, такие как STIMULON™ QS-21 (Antigenics, Framingham, MA.), описанный в патенте США No. 5,057,540, ISCOMATRIX™ (CSL Limited, Parkville, Australia), описанный в патенте США No. 5,254,339, и иммуностимулирующие комплексы (ISCOMATRIX™); Mycobacterium tuberculosis; бактериальные липополисахариды; синтетические полинуклеотиды, такие как олигонуклеотиды, содержащие CpG мотив (например, патент США No. 6,207,646); IC-31 (Intercell AG, Vienna, Austria), описанный в Европейских патентах No. 1,296,713 и 1,326,634; коклюшный токсин (PT) или его мутант, холерный токсин или его мутант (например, патенты США No. 7,285,281, 7,332,174, 7,361,355 и 7,384,640); или термолабильный токсин Е.coli (LT) или его мутант, в особенности LT-K63, LT-R72 (например, патенты США No. 6,149,919, 7,115,730 и 7,291,588).
[0153] В некоторых вариантах осуществления вспомогательным веществом является ISCOMATRIX™ (смотри, например, Davis et al., Proc. Nat'l. Acad. Sci., 2004, 101(29): 10697-10702).
Антигены кандидаты:
ClfA: организация домена
[0154] Агглютинирующий фактор A (ClfA) представляет собой поверхностный белок S.Aureus, ассоциированный со связывающим с хозяином матриксными белками посредством фиброгенного сайта связывания. ClfA является членом семейства белков, содержащих карбоксильный терминальный LPXTG (SEQ ID NO: 125) мотив, который позволяет белку стать ковалентно связанным с поверхностью клетки. ClfA, кроме того, относится к другому семейству белков (компоненты поверхности микробов, распознающие адгезивные матриксные молекулы или MSCRAMMs), которые ассоциированы со связывающими белками хозяина, такими как фибриноген (связанный посредством ClfA), фибронектин-связывающие белки (FnbA и FnbB), коллаген-связывающий белок (Cna) и другие. Данные белки все участвуют в аминотерминальной сигнальной последовательности, которая выступает посредником транспорта к клеточной поверхности. MSCRAMMs, кроме того, включает А-домен, который является функциональной областью, содержащей активный сайт для лигандного связывания (например, фибриноген, фибронектин, эластин, кератин). А-домен является следующим за областью, состоящей из повторов серин-аспартат (SD повтор), которые, как полагают, покрывает пептидогликановый слой. SD повтор является следующим за покрывающей мембрану областью, которая включает LPXTG (SEQ ID NO: 125) мотив для ковалентного связывания белка с пептидогликаном. ClfA описан в патенте США No. 6,008,341.
[0155] Связывающая лиганд область ClfA, содержащая N1N2N3 A домена (Фигура 1), охватывает аминокислоты 40-559. N домены ClfA определены как следующие: N1 охватывает остатки 45-220; N2 охватывает остатки 229-369; и N3 охватывает остатки 370-559. Смотри Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Для облегчения отнесения N1N2N3 домены могут быть определены как N123, подобным образом N2N3 могут быть определены как N23. При приготовлении рекомбинантного N1N2N3, обнаружено, что N1 домен является чувствительным к протеазе и является легко расщепляемым и гидролизуемым, что позволяет N2N3, как стабильному лиганду, связывать рекомбинантный фрагмент. Смотри Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Кристаллическая структура фибриногена, связывающего N2N3 фрагмент ClfA A домена, показала, что как N2, так и N3 являются доминируемыми за счет антипараллельных бета-цепей. В дополнение к анти-параллельным цепям N2 домен содержит одновитковую альфа-спираль и две 310 спирали и N3 домен содержит три 310 спирали. Смотри Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Выравнивание последовательности N2 и N3 обнаруживает только 13% идентичности последовательности и 36% сходства последовательности из-за их длин. Смотри Deivanayagam et al. EMBO J. 21:6660-6672 (2002). Топология N2 и N3 доменов является аналогичной классической IgG складке и, предполагается, что является новыми вариантами IgG складки. Смотри Deivanayagam et al. EMBO J. 21:6660-6672 (2002).
[0156] Раскрытыми в данном документе является композиция, содержащая стабильный полипептид агглютинирующего фактора A ("ClfA") Staphylococcus aureus, и способы ее создания, которая является пригодной, как иммуногенная композиция или вакцина. Кроме того, раскрытой в данном документе является композиция, содержащая стабильный ClfA полипептид, СР5 конъюгат и СР8 конъюгат ("трехантигенная"), и способы ее создания, которая является пригодной, как иммуногенная композиция или вакцина. Кроме того, раскрытой в данном документе является композиция, содержащая стабильный ClfA полипептид, СР5 конъюгат, СР8 конъюгат и MntC полипептид ("четырехантигенная"), и способы ее создания, которая является пригодной, как иммуногенная композиция или вакцина. Известно, что ClfA является нестабильным белком, который легко подвергается ограничению между N1 и N2 доменами. Данная заявка направлена на препарат ClfA, который дает возможность ClfA N1N2N3 оставаться в значительной степени подверженным увеличенным стрессовым состояниям, по меньшей мере, в течение трех месяцев. В некоторых вариантах осуществления, препарат является лиофилизированной композицией, которая содержит меньше чем три процента воды. Термин "лиофилизированная композиция" касается препарата, содержащего меньше, чем 3% воды, и не означает ограничение композиции способом, по которому композиция была изготовлена, например, лиофилизация или какой-либо другой способ высушивания смеси, или смешивание сухих ингредиентов. Посредством увеличенных стрессовых условий, которые представляют собой условия экстремальной температуры, pH и/или ионной силы, что, как правило, используются для испытания стабильности состава, такие как, например, 37°C в течение нескольких недель или больше.
[0157] Таким образом, в одном варианте осуществления заявка касается стабильной композиции, содержащей, главным образом, неразложившийся белок ClfA и воду в количестве меньшем, чем три процента. В одном варианте осуществления заявка касается стабильной композиции, содержащей, главным образом, неразложившийся белок ClfA, конъюгат капсульного полисахарида типа 5 (СР5), СР8 конъюгат и воду в количестве меньшем, чем три процента. В одном варианте осуществления заявка касается стабильной композиции, содержащей, главным образом, неразложившийся белок ClfA, конъюгат капсульного полисахарида типа 5 (СР5), СР8 конъюгат, MntC белок и воду в количестве меньшем, чем три процента. ClfA белок может быть выделен из какого-либо штамма стафилококка, или он может быть рекомбинантным полипептидом. Рекомбинантный ClfA полипептид может иметь немутантную последовательность, может содержать одну или больше мутаций, или может быть, по меньшей мере, на 90% идентичным в аминокислотной последовательности к немутантной последовательности. Таблица 1 демонстрирует несколько штаммов S.aureus и их соответствующие ClfA последовательности ДНК и белка.
|
ClfA последовательность
[0158] Ген для белка агглютинирующего фактора A, указанного ClfA, был клонирован, упорядочен и проанализирован детально на молекулярном уровне (McDevitt et al., Mol. Microbiol. 11: 237-248 (1994); McDevitt et al., Mol. Microbiol. 16:895-907 (1995)). Идентификаторы последовательности для аминокислотных последовательностей ClfA из 111, которые выделяет болезнетворный S. aureus, представлены в таблице 1. Аминокислотная последовательность полной длины (включая сигнальную последовательность) немутантного типа ClfA из S.aureus штамма PFESA0237, представлена в SEQ ID NO: 130. Данная последовательность показывает тирозин в положении 338, который меняется на аланин в мутированной форме ClfA. Ген полной длины, кодирующий немутантный тип ClfA из S.aureus штамма PFESA0237, содержащего N123 область, область повтора и якорную область, представлен в SEQ ID NO: 131. Аминокислотная последовательность Y338A мутированных форм ClfA представлена в SEQ ID NO: 123. Однако, следует отметить, что замена тирозина на аланин, которая осуществляется в немутантном типе ClfA в положении 338 SEQ ID NO: 130, и которая обозначается, как Y338A, показана в мутированной форме ClfA, в SEQ ID NO: 123 в положении 310. Более того, мутированная форма ClfA, представленная аминокислотной последовательностью SEQ ID NO: 123, представляет собой зрелую форму ClfA без сигнальной последовательности, таким образом, рассматривая как отличие в положении данной мутации между SEQ ID NO: 130 и SEQ ID NO: 123.
[0159] В одном варианте осуществления ClfA белок включает последовательность SEQ ID NO: 123, которая содержит Y388A мутацию, разрушающую связывание с фибриногеном.
[0160] В некоторых вариантах осуществления, ClfA белку нет необходимости быть полной длины, и может состоять из аминокислот 50-597 (как пронумеровано в соответствии с SEQ ID NO: 130, но которое может быть основано на каком-либо ClfA белке).
[0161] В некоторых вариантах осуществления ClfA белок содержит или состоит, существенным образом, из Ждомена, N2 домена и N3 домена. В некоторых вариантах осуществления белок ClfA содержит N домен. Под N доменом подразумевают, что он является N1 доменом, N2 доменом или N3 доменом.
[0162] ClfA белки, способы их производства и использование описаны в совместно рассматриваемой заявке на патент с серийным номером 61/219,134, зарегистрированной 22 июня 2009, которая включена в данный документ в полном объеме в виде ссылки. ClfA белки, кроме того, описаны в международной заявке на патент No PCT/US 2010/039510, которая включена в данный документ в полном объеме в виде ссылки.
[0163] Под стабильным подразумевают, что ClfA остается, главным образом, неразложившимся под усиленными или другими стрессовыми условиями и на протяжении длительного периода времени, таком ка при хранении. Под главным образом неразложившимся подразумевают, что, по меньшей мере, 70%, 80%, 90%, 95% или 99% от общего накопленной совокупности полипептидов ClfA содержат полипептиды, включающие N1 последовательности и дополнительные последовательности N2 и/или N3. Под интактным подразумевают, что ClfA белок содержит, по меньшей мере, N1, N2 и N3 домены. В некоторых вариантах осуществления, ClfA остается стабильным на протяжении, по меньшей мере, двух недель, по меньшей мере, одного месяца или, по меньшей мере, трех месяцев при 37°C.
[0164] В некоторых вариантах осуществления лиофилизированная композиция изобретения содержит интактный ClfA в количестве, которое составляет меньше, чем один процент по массе от общей массы лиофилизированной иммуногенной композиции (1% [масс./масс.]). В некоторых вариантах осуществления ClfA находится в количестве от 0,09%±0,027% до 0,85%±0,26%.
ClfB: организация домена
[0165] ClfB представляет собой белок S.aureus, содержащий фибриноген, связывающий активное вещество и триггеры S.aureus, для образования группы в присутствии плазмы. ClfB представляет собой белок MSCRAMM и демонстрирует характерную организацию MSCRAMM домена, включая A-домен, который является функциональной областью, содержащей активный сайт для лигандного связывания (например, фибриноген, фибронектин, эластин, кератин). A-домен является следующим за областью, состоящей из повторов серин-аспартат (SD повтор), который, как предполагается, покрывает слой петидогликана. SD повтор является следующим за областью, покрывающей мембрану, который включает LPXTG (SEQ ID NO: 125) мотив для ковалентного связывания белка с пептидогликаном. ClfB описан в WO 99/27109 и в патенте США 6,680,195.
[0166] Внутренняя организация N-терминального A домена ClfB очень сходна с организацией, обнаруженной в ClfA. A домен состоит из трех субдоменов N1, N2 и N3. Область лигандного связывания ClfB, содержащая N1N2N3 A домена охватывает аминокислоты 44-585. Для облегчения отнесения N1N2N3 домены могут быть определены как N123, подобным образом N2N3 могут быть определены как N23. N домены ClfB были определены, как следующие: N1 охватывает остатки 44-197; N2 охватывает остатки 198-375; и N3 охватывает остатки 375-585. В ClfA, кристаллическая структура A домена, как было обнаружено, имеет уникальную модификацию иммуноглобулиновой складки и по аналогии, как можно предположить, вышеупомянутая является случаем для ClfB. Смотри Deivanayagam et al., EMBO J. 21:6660-6672 (2002). Даже, несмотря на то, что организация A доменов ClfB и ClfA является подобной, идентичность последовательности составляет только 26%. Смотри Ni Eidhin etal., Mol. Microbiol. 30:245-257 (2002).
ClfB последовательность
[0167] Ген, кодирующий ClfB, классифицируют как ген центра адгезии. ClfB последовательности из 92 штаммов S.aureus, связанные с множественными болезненными состояниями, просуммированы на фигуре 42. Дополнительные последовательности были получены из GenBank. Другой MSCRAMMS
[0168] Другой MSCRAMMS может быть рассмотрен для использования в иммуногенной композиции представленного изобретения. Например, белки с повтором серин-аспартат (Sdr), SdrC, SdrD и SdrE связаны в первичную последовательность и структурную организацию с белками ClfA и ClfB и локализованы на клеточной поверхности. Белки SdrC, SdrD и SdrE являются белками, ассоциированными с клеточной оболочкой, имеющими сигнальную последовательность на N-конце и LPXTG (SEQ ID NO: 125) мотив, гидрофобный домен и положительно заряженные остатки на C-конце. Каждый, кроме того, имеет SD повтор, содержащий область R достаточной длины, чтобы дать возможность, параллельно с B мотивами, эффективной экспрессии области A домена лигандного связывания на клеточной поверхности. Вместе с областью A SdrC, SdrD и SdrE белков, локализованных на клеточной поверхности, белки могут взаимодействовать с белками плазмы, внеклеточным матриксом или с молекулами на поверхности клеток-хозяев. Sdr белки используют совместно с некоторой ограниченной аминокислотной последовательностью подобной ClfA и ClfB. Подобно ClfA и ClfB, SdrC, SdrD и SdrE также демонстрируют катион-зависимое лигандное связывание белков внеклеточного матрикса.
[0169] Гены sdr являются сцепленными и тандемно упорядоченными. Белки Sdr (SdrC, SdrD, SdrE, ClfA и ClfB) характерно содержат область A, в которой существует высоко консервативная аминокислотная последовательность, которая может быть использована для получения консенсусного TYTFTDYVD (SEQ ID NO: 126) мотива. Мотив демонстрирует небольшое изменение между разными белками. Данное изменение, наряду с консенсусной последовательностью мотива, описано в патенте США 6,680,195. В Clf-Sdr белках, данный мотив высоко консервативен. Мотив может быть использован в иммуногенных композициях, чтобы вызывать широкий спектр иммунитета к бактериальным инфекциям, и, кроме того, может быть использован, как антиген, в производстве моноклональных или поликлональных антител. Такое антитело может быть использовано, чтобы вызвать широкий спектр пассивного иммунитета.
[0170] Белки Sdr отличаются от ClfA и ClfB тем, что имеют от двух до пяти дополнительных повторяемых последовательностей 110-113 остатка (B-мотивы), расположенные между областью A и R-участком. Каждый B-мотив содержит консеснусный Са2+-связывающий EF-плечевую петлю, как правило, обнаруживаемую в эукариотических белках. Структурная целостность рекомбинантного белка, содержащего пять B-повторов SdrD, как показано посредством 6ncANS флуоресцентного анализа, является Са2+-зависимой, предполагая, что EF-плечи являются функциональными. Когда Са2+ удаляли, структура разрушалась до нескладчатой конформации. Исходная структура восстанавливалась при добавлении Са2+. С-терминальные R-домены Sdr белков содержат 132-170 SD остатки. За ними следуют консервативные якирующие оболочку области характерные для многих поверхностных белков грамм положительных бактерий.
[0171] B Sdr и Clf белках данный B мотив является высоко консервативным, тогда как вырожденный вариант встречается в фиброниктине, связывающем MSCRAMMS, а также коллагене, связывающем белок Cna. В мотивы, в конъюгации с R участками, необходимы для проявления лиганд-связывающего домена на некотором расстоянии от клеточной поверхности. Повторяемые B мотивы являются одним общим действующим веществом подгруппы белков SD повтора, которые описаны в данном документе. Данные мотивы обнаружены в разных количествах в трех Sdr белках из штамма PFESA0237. Существует отчетливое разграничение между конкретными B мотивами. Наиболее консервативными единицами являются те, которые расположены по соседству к R участкам (SdrC B2, SdrD В5 и SdrE B3). Они отличаются от остатка на некоторых сайтах, особенно в C-терминальной половине. Заслуживающей внимания структурной деталью является то, что B повторы всегда являются отделенными пролиновым остатком, присутствующим в C-терминальной области, но пролин никогда не встречается между последними B повторами и R участком. Вместе с тем данный линкер характеризуется коротким кислым фрагментом секвенирования. Данные отличия являются доказательством того, что конечные единицы имеют различную структурную или функциональную роль по сравнению с другими B мотивами. N-терминальные B мотивы SdrD и SdrE все больше отдаляются от других, и существуют многочисленные аминокислотные чередования, включая маленькие включения и делеции, несмотря на то, что остающиеся внутренние B мотивы являются более высоко консервативными. Отмечается, что каждый из трех Sdr белков имеет, по меньшей мере, один B мотив каждого вида.
[0172] С-терминальные R-домены Sdr белков содержат 132-170 SD остатки. За ними следуют консервативные якирующие оболочку области характерные для многих поверхностных белков грамм положительных бактерий.
[0173] Другие кандидаты SdrD молекулы могут быть производными от различных видов организмов для использования в иммуногенной композиции изобретения, некоторые из которых включают следующие SdrD из S.aureus: штамма USA300 FPR3757 (номер доступа белка SAUSA300 0547); штамма NCTC8325 (номер доступа белка SAOUHSC 00545); штамма MW2 (номер доступа белка MW0517); штамма MSSA476 (номер доступа белка SAS0520; и штамма Mu50 (номер доступа белка SAV0562).
[0174] Кроме того, MSCRAMMS, который может рассматриваться для использования в иммуногенной композиции представленного изобретения, включает EkeS, DsqA, KesK, KrkN, KrkN2, RkaS, RrkN и KnkA. Данные MSCRAMMS описаны в WO 02/102829, которая включена в данный документ в виде ссылки. Дополнительные MSCRAMMS, идентифицированные номером доступа GenBank, включают NP_373261.1, NP_373371.1, NP_374246.1, NP_374248.1, NP_374841.1, NP_374866.1, NP_375140.1, NP_375614.1, NP_375615.1, NP_375707.1, NP_375765.1 и NP_375773.1.
Капсульные полисахариды типа 5 и типа 8
[0175] Стафилококковые микроорганизмы способные вызывать инвазивное заболевание, как правило, также являются способными к продуцированию капсульного полисахарида (CP), который инкапсулирует бактерию и увеличивает ее резистентность к клиренсу врожденной иммунной системы хозяина. CP служит, чтобы покрывать бактериальную клетку защитной капсулой, которая делает бактерии устойчивыми к фагоцитозу и внутриклеточному уничтожению. Бактерии, у которых отсутствует капсула, являются более восприимчивыми к фагоцитозу. Капсульные полисахариды часто являются важным фактором вирулентности для многих бактериальных патогенов, включая Haemophilus influenzae, Streptococcus pneumoniae и группу B стрептококков.
[0176] Капсульный полисахарид может быть использован для серотипа конкретного вида бактерий. Типирование обычно осуществляют посредством реакции со специфической антисывороткой или моноклональным антителом, который генерируется на конкретную структуру или уникальный эпитоп, характерный для капсульного полисахарида. Инкапсулированные бактерии проявляют тенденцию к росту в гладких колониях, тогда как колонии бактерий, которые потеряли свои капсулы, возникают в грубых. Колонии, продуцирующие мукоидное возникновение, известны как, в значительной мере инкапсулированные. Типы 1 и 2 S. aureus являются в значительной мере инкапсулированными и редко ассоциируются с заболеванием.
[0177] Наибольший клинический штамм S. aureus является инкапсулированным или с серотипами 5, или 8. Тип 5 (СР5) и тип 8 (СР8) капсульных полисахаридов имеют подобные трисахаридные повторяющиеся единицы, состоящие из N-ацетил маннозаминуроновой кислоты, N-ацетил L-фукозамина и N-ацетил D-фукозамина. Смотри Fournier, J.M. et al., Infect. Immun. 45:97-93 (1984) и Moreau, M., etal., Carbohydrate Res. 201:285-297 (1990). Два CP имеют одинаковае сахара, но отличаются связями в сахарах и сайтами O-ацетилирования, чтобы продуцировать серологически различные модели иммунореактивности.
[0178] В некоторых вариантах осуществления капсульные полисахариды серотипа 5 и/или 8 изобретения являются О-ацетилированными. В некоторых вариантах осуществления степень О-ацетилирования капсульного полисахарида типа 5 или олигосахарида составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых вариантах осуществления степень О-ацетилирования капсульного полисахарида типа 8 или олигосахарида составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%. В некоторых вариантах осуществления степень О-ацетилирования капсульных полисахаридов типа 5 и типа 8 или олигосахаридов составляет 10-100%, 20-100%, 30-100%, 40-100%, 50-100%, 60-100%, 70-100%, 80-100%, 90-100%, 50-90%, 60-90%, 70-90% или 80-90%.
[0179] Степень O-ацетилирования полисахарида или олигосахарида может быть определена с помощью какого-либо способа, известного в данной области с уровня техники, например, с помощью протонного ЯМР (Lemercinier and Jones 1996, Carbohydrate Research 296; 83-96, Jones and Lemercinier 2002, J Pharmaceutical and Biomedical Analysis 30; 1233-1247, WO 05/033148 или WO 00/56357). Другой широко используемый способ описан Hestrin (1949) J. Biol. Chem. 180; 249-261.
[0180] В некоторых вариантах осуществления капсульные полисахариды серотипа 5 и/или 8 изобретения используют для генерирования антител, которые являются функциональными, как измерено путем уничтожения бактерий в эффективной модели на животных или опсоно-фагоцитарного килингового анализа, который демонстрирует, что антитела убивают бактерии. Такая функциональность не может наблюдаться, используя анализ, который контролирует генерирование антител само по себе, что не является показательным для важности О-ацетилирования в действительности.
Капсульная эпидемиология
[0181] Ассоциация конкретных капсульных серотипов с заболеванием является возможной посредством осуществления контроля за клиническими штаммами. Из восьми разных идентифицированных серотипов S.aureus (Karakawa и Vann (1982)) только серотипы 1 и 2 являются в значительной степени инкапсулированными, и их редко выделяют. Смотри, Capsular Polysaccharides of Staphylococcus aureus, p.285-293, у J.В. Robbins, J.C. Hill and J.C. Sadoff (ed.), Seminars in infectious disease, vol.4, Bacterial Vaccines. Thieme Stratton, Inc. New York. Исследования показали, что приблизительно 85-90% клинических штаммов S.aureus экспрессируют СР5 или СР8 (Arbeit RD, et al., Diagn. Microbiol. Infect. Dis. (1984) Apr; 2(2):85-91; Karakawa WW, etal., J. Clin. Microbiol. (1985) Sep; 22(3):445-7; Essawi T, etal., Trop. Med. Int. Health. (1998) Jul; 3(7):576-83; Na'was T, etal., J. Clin. Microbiol. (1998) 36(2):414-20). Большинство из CP5 и CP8 нетипируемых штаммов генетически являются типом 5 или типом 8, содержащим мутации в сар5/8 локусе (Cocchiaro, Gomez etal., (2006), Mol. Microbiol. Feb. 59(3):948-960). Капсулирование для некоторых штаммов быстро теряется в пределах нескольких пассажей in vitro, что связано с репрессивными эффектами высоких концентраций фосфатов в среде, используемой при клинической диагностике на продуцирование капсулы. Кроме того, сообщалось, что некапсулированные штаммы восстанавливают экспрессию капсулы после прохождения через скот. Смотри Opdebeck, J.P. et al., J. Med. Microbiol. 19:275-278 (1985). Некоторые нетипируемые штаммы становятся капсуло-положительными при соответствующих условиях роста.
СР5 и СР8 структура
[0182] Единица повтора из, как СР5, так и СР8, состоит из 2-ацетамидо-2-дезокси-D-маннуроновой кислоты, 2-ацетамидо-2-дезокси-L-фукозы и 2-ацетамидо-2-дезокси-D-фукозы. Смотри С. Jones et al., Carbohydr. Res. 340:1097-1106 (2005). Несмотря на то, что СР5 и СР8 имеют одинаковую композицию сахара, показано, что они являются иммунологически различными. Они различаются в гликозидных связях и сайте O-ацетилирования урониевой кислоты. Наблюдалась зависимость штамма от неполного N-ацетилирования одного из FucNAc остатков. Смотри Tzianabos etal., PNAS V98: 9365(2001).
Капсульный полисахарид S.aureus в иммуногенной композиции
[0183] Молекулярная масса капсульных полисахаридов S.aureus является важным рассматриваемым фактором для применения в иммуногенных композициях. Высокая молекулярная масса капсульных полисахаридов способна индуцировать иммунные ответы к определенному антителу благодаря более высокой валентности эпитопов, присутствующих на антигенной поверхности. Способы, описанные в данном документе, предусматривают выделение и очистку капсульного полисахарида типа 5 и типа 8 со значительно большей молекулярной массой чем это было доступно ранее.
MntC/SitC/Слюна связывающий белок
[0184] MntC/SitC/Слюна связывающий белок представляет собой белок с транспортной функцией и имеет гомологи у S.epidermidis и S.aureus. Он упоминается в представленном изобретении как MntC. Данный белок представляет собой 32 кДа липопротеин и расположен в клеточной оболочке бактерии. Смотри Sellman et al., и Cockayne et al., Infect. Immun. 66: 3767(1998). В S.epidermidis он является компонентом железо-регулируемого оперона. Это показывает значительную гомологию, как к адгезинам, включая FimA из S.parasanguis, так и к липопротеинам семейства ABC транспортеров с доказанными или предполагаемыми транспортными функциями. (Смотри таблицу 2 для штаммов S.aureus и последовательностей.)
MntC белок S.aureus
[0185] S.aureus гомолог MntC известен как связывающий белок слюны и раскрыт в патенте США No. 5,801,234 и может быть включен в иммуногенную композицию изобретения. Последовательность белка для S.aureus гомолога MntC/SitC/слюна связывающего белка найдена в GenBank с номером доступа NP_371155 для штамма Mu50 (кроме того, известная как SAV0631). Идентификатором последовательности является SEQ ID NO: 134. Номером доступа для нуклеотидной последовательности для полного генома штамма Mu50 является NC_002758.2. Координаты для кодирующей ДНК последовательности для последовательности белка, найденные в GenBank с номером доступа NP_371155, представляют собой 704988-705917 (SEQ ID NO: 135). В конкретных вариантах осуществления N-конец MntC расщепляют, как показано в SEQ ID NO:119 (полипептидной последовательности) и SEQ ID NO: 136 (нуклеотидной последовательности, кодирующей полипептид). MntC последовательности из разных штаммов S.aureus просуммированы на фигуре 43.
SitC белок S.epidermidis
[0186] S.epidermidis гомолог MntC/SitC/Слюна связывающего белка известен как SitC и раскрыт в Sellman etal., (Sellman etal., Infect. Immun. 2005 October; 73(10): 6591-6600). Последовательность белка для S. epidermidis гомолога MntC/SitC/Слюна связывающего белка найдена в GenBank с номером доступа YP_187886.1 (также известная как SERP0290). Идентификатором последовательности является SEQ ID NO: 132.
[0187] Номером доступа для нуклеотидной последовательности для полного генома штамма RP62A является NC_002976. Координаты для кодирующей ДНК последовательности для последовательности белка, найденные в GenBank с номером доступа YP_187886.1, представляют собой 293030-293959 (SEQ ID NO: 133). Соответствующий усеченный вариант N-конца SitC показан в SEQ ID NO: 121 (полипептидной последовательности) и SEQ ID NO: 137 (нуклеотидной последовательности, кодирующей полипептид). Другие кандидаты SitC молекулы могут быть производными от различных видов организмов для применения в иммуногенной композиции изобретения, некоторые из которых перечислены в таблице 2 ниже.
|
Железо-связывающие белки S.aureus
[0188] Принимается во внимание, что другой потенциальный кандидатный антиген для использования в иммуногенных композициях изобретения включает детерминанту B поверхностного железа поверхностного белка S.aureus (IsdB). Данный MSCRAMM описан Mazmanian et al. (Mazmanian, SK et al. Proc. Natl. Acad. Sci., USA 99:2293-2298 (2002)) и он впоследствии был исследован и, как показано, является эффективным как кандидат в вакцину в мышиной модели инфекции и в исследовании иммуногенности макак-резус Kuklin, et al. (Kuklin, NA, et al. Infection and Immunity, Vol.74, No.4, 2215-2223, (2006)). Данная IsdB молекула присутствует в различных штаммах S.aureus, включая штамм MRSA252 (номер доступа белка CAG40104.1); штамм Newman (номер доступа белка BAF67312.1); штамм MSSA476 (номер доступа белка CAG42837.1); штамм Mu3 (номер доступа белка BAF78003.1); штамм RF122 (номер доступа белка CAl80681.1).
Кандидатные антигены:
[0189] Иммуногенные композиции представленного изобретения, кроме того, могут включать один или больше из следующих антигенов: Орр3а, DltD, HtsA, LtaS, IsdA, IsdC, SdrF, SdrG, SdrH, SrtA, SpA, Sbi, альфа-гемолизин (hla), бета-гемолизин, фибронектин-связывающий белок A (fnbA), фибронектин-связывающий белок B (fnbB), коагулазу, Fig, map, лейкоцидин Пантон-Валентина (pvl), альфа-токсин и его варианты, гамма-токсин (hlg) и варианты, ica, иммунодоминанту переносчика ABC, переносчик Mg2+, переносчик Ni ABC, RAP, аутолизин, рецепторы ламинина, IsaA/PisA, IsaB/PisB, SPOIIIE, SsaA, EbpS, Sas A, SasF, SasH, EFB (FIB), SBI, Npase, EBP, остеопонтин связывающий белок II, предшественник ауреолизина (AUR)/Sepp1, Cna, и их фрагменты, такие как М55, TSST-1, тесА, поли-N-ацетилглюкозамин (PNAG/dPNAG) экзополисахарида, GehD, EbhA, EbhB, SSP-1, SSP-2, HBP, витронектин связывающий белок, HarA, EsxA, EsxB, энтеротоксин A, энтеротоксин B, энтеротоксин C1, и новый аутолизин. В конкретных вариантах осуществления изобретения, когда иммуногенная композиция содержит определенные формы СР5 и/или СР8, то она не может дополнительно содержать PNAG.
Составы иммуногенной композиции
[0190] В одном варианте осуществления лиофилизированные иммуногенные композиции изобретения, кроме того, содержат, по меньшей мере, одно вспомогательное вещество, буфер, криозащитное вещество, соль, двухвалентный катион, неионный детергент, ингибитор свободнорадикального окисления, объемообразующий агент или носитель.
[0191] Иммуногенные композиции изобретения, кроме того, могут содержать один или больше консервантов, в дополнение к множеству антигенов стафилококкового белка, и конъюгаты: капсульный полисахарид-белок. FDA подразумевает, что биологические продукты в емкостях с многократной дозой (мульти-дозой) содержат консервант только с незначительным количеством наполнителей. Вакцинные продукты, содержащие консерванты, включают вакцины, содержащие бензетония хлорид (антракс), 2-феноксиэтанол (DTaP, НерА, Lyme, Polio (парентеральный)), фенол (Pneumo, Typhoid (парентеральный), вакциния) и тимеросал (DTaP, DT, Td, НерВ, Hib, грипп, JE, Mening, пневмо, бешенство). Консерванты, одобренные для использования в инъекционных лекарственных средствах, включают, например, хлорбутанол, м-крезол, метилпарабен, пропилпарабен, 2-феноксиэтанол, бензетония хлорид, бензалкония хлорид, бензойную кислоту, бензиловый спирт, фенол, тимеросал и нитрат фенилртути.
[0192] Препараты изобретения, кроме того, могут содержать один или больше из буфера, соли двухвалентного катиона, неионного детергента, криозащитного вещества, такого как сахар, объемообразующего агента и анти-оксиданта, такого как ловушка свободных радикалов или хелатирующего агента, или какой-либо многократной их комбинации. Выбор какого-либо одного компонента, например, хелатирующего агента, может определить необходимость того или иного другого компонента (например, ловушки). Конечная композиция, сформулированная для введения, должна быть стерильной и/или свободной от пирогенов. Квалифицированный специалист может эмпирически определить, какие комбинации из тех или других компонентов будут оптимальными для включения в иммуногенные композиции изобретения, содержащие консервант, в зависимости от множества факторов, таких как особенности хранения и необходимых условий хранения.
[0193] В некоторых вариантах осуществления лиофилизированная композиция, кроме того, содержит буфер, который имеет рКа от 6,0±0,6 в количестве, которое меньше чем 3% (масс./масс.). В конкретных вариантах осуществления препарат является забуференным в пределах pH от примерно 6,0 до примерно 9,0, предпочтительно от примерно 7,5 до примерно 7,5. В некоторых вариантах осуществления буфер находится в концентрации 2,54%±0,76% (масс./масс.). В некоторых вариантах осуществления буфер содержит сукцинат с pH 6,0±0,6. В некоторых вариантах осуществления буфер содержит гистидин с pH 6,0±0,6. В некоторых вариантах осуществления буфер содержит гистидин с pH 6,5±0,6. Таблица 3 перечисляет некоторые неограничивающие примеры буферов, которые могут быть использованы на практике данного изобретения.
|
[0194] В конкретных вариантах осуществления может быть необходимым регулировать pH лиофилизированной иммуногенной композиции или препарата изобретения. pH препарата изобретения может регулироваться, используя стандартные методики в данной области. pH препарата изобретения может регулироваться, чтобы составлять от 3,0 до 8,0. В конкретных вариантах осуществления pH препарата может составлять или может регулироваться, чтобы составлять, от 3,0 до 6,0, от 4,0 до 6,0, от 5,0 до 7,0 или от 5,0 до 8,0. В других вариантах осуществления pH препарата может составлять, или может регулироваться, чтобы составлять, примерно 3,0, примерно 3,5, примерно 4,0, примерно 4,5, примерно 5,0, примерно 5,5, примерно 5,8, примерно 6,0, примерно 6,5, примерно 7,0, примерно 7,5 или примерно 8,0. В конкретных вариантах осуществления pH может составлять или может регулироваться, чтобы находиться в диапазоне от 4,5 до 7,5 или от 4,5 до 6,5, от 5,0 до 5,4, от 5,4 до 5,5, от 5,5 до 5,6, от 5,6 до 5,7, от 5,7 до 5,8, от 5,8 до 5,9, от 5,9 до 6,0, от 6,0 до 6,1, от 6,1 до 6,2, от 6,2 до 6,3, от 6,3 до 6,4, от 6,4 до 6,5, от 6,5 до 6,6, от 6,6 до 6,7, от 6,7 до 6,8, от 6,8 до 6,9, от 6,9 до 7,0, от 6,5 до 7,0, от 7,0 до 7,5 или от 7,5 до 8,0. В конкретном варианте осуществления pH препарата составляет примерно 6,0. В особенном варианте осуществления pH препарата составляет примерно 6,5.
[0195] В некоторых вариантах осуществления лиофилизированная иммуногенная композиция содержит объемообразующий агент. Объемообразующий агент главным образом служит для обеспечения объема композиции и способствования формирования лекарственного средства, которое находится, как правило, в таких малых количествах на дозу, что сухая пеллета лекарственного средства является невидимой или едва видимой, и/или предотвращает выброс активных ингредиентов из емкости, например, во время лиофилизации. Объемообразующий агент, кроме того, может служить для облегчения осаждения агента лекарственного средства. Объемообразующие агенты, кроме того, могут служить как криозащитные вещества. Разнообразие криозащитных веществ описано в общепринятых учебниках, таких как Remington: The Science and Practice of Pharmacy, Vol.2, 19th edition (1995).
[0196] Неограничивающие примеры объемообразующих агентов включают сахарные спирты, такие как альдитол, маннит, сорбит, инозит и полиэтиленгликоль, сахарные кислоты, такие как альдоновая кислота, уроновая кислота и альдаровая кислота, и углеводы, такие как альдозы, кетозы, аминосахара, полиолы, инозиты, альдоновые кислоты, уроновые кислоты, альдаровые кислоты, моно-, ди- или полиуглеводы, глицеральдегид, арабиноза, ликсоза, пентоза, рибоза, ксилоза, галактоза, глюкоза, гексоза, идоза, манноза, талоза, гептоза, глюкоза, фруктоза, глюконовая кислота, сорбит, лактоза, маннит, метил-а-глюкопиранозид, мальтоза, изоаскорбиновая кислота, аскорбиновая кислота, лактон, сорбоза, глюкаровая кислота, эритроза, треоза, арабиноза, аллоза, альтроза, гулоза, идоза, талоза, эритрулоза, рибулоза, ксилулоза, псикоза, тагатоза, глюкуроновая кислота, глюконовая кислота, глюкаровая кислота, галактуроновая кислота, маннуроновая кислота, глюкозамин, галактозамин, сахароза, трегалоза, нейраминовая кислота, арабинаны, фруктаны, фуканы, галактаны, галактуронаны, глюканы, маннаны, ксиланы (такие как, например, инулин), леван, фукоидан, каррагенан, галактокаролоза, пектины, пектиновые кислоты, амилоза, пуллулан, гликоген, амилопектин, целлюлоза, декстран, пустулан, хитин, агароза, кератин, хондроитин, дерматан, гиалуроновая кислота, альгиновая кислота, ксантиновая камедь или крахмал.
[0197] В некоторых вариантах осуществления объемообразующий агент является каким-либо одним или больше из сахарозы, маннита, глицина и сорбита. В некоторых вариантах осуществления объемообразующим агентом является сахароза. В некоторых вариантах осуществления сахароза составляет больше чем 91% (масс./масс.). В некоторых вариантах осуществления сахароза составляет 96%±2,0% (масс./масс.).
[0198] В конкретных вариантах осуществления препарат лиофилизированной или восстановленной лиофилизированной композиции, который является сочетаемым с парентеральным введением, содержит один или больше двухвалентных катионов, включая, но не ограничиваясь этим, MgCl2, CaCl2 и MnCl2, с концентрацией в диапазоне от примерно 0,1 мМ до примерно 10 мМ, причем до примерно 5 мМ является предпочтительным.
[0199] В конкретных вариантах осуществления препарат лиофилизированной или восстановленной лиофилизированной композиции, который является сочетаемым с парентеральным введением, содержит одну или больше солей, включая, но не ограничиваясь этим, хлорид натрия, хлорид калия, сульфат натрия и сульфат калия, присутствующие с ионной силой, которая физиологически приемлема для субъекта при парентеральном введении, и включена с такой конечной концентрацией, чтобы получить выбранную ионную силу или осмолярность при конечном составе. Конечная ионная сила или осмолярность препарата будет определяться многими компонентами (например, ионами из буферного(ых) соединения(ий) и другими небуферными солями. Предпочтительная соль, NaCl, присутствует в диапазоне вплоть до примерно 250 мМ, с концентрациями соли, которые выбраны в дополнение к другим компонентам (например, сахарам), таким образом, что конечная общая осмолярность препарата согласуется с парентеральным введением (например, внутримышечной или подкожной инъекцией) и будет способствовать долговременной стабильности иммуногенных компонентов препарата иммуногенной композиции в пределах различных температурных интервалов. Препараты свободные от соли будут толерантными к увеличенным пределам одного или больше выбранных криозащитных веществ, чтобы поддерживать необходимые конечные уровни осмолярности.
[0200] В конкретных вариантах осуществления препарат лиофилизированной или восстановленной лиофилизированной композиции, который является сочетаемым с парентеральным введением, содержит одно или больше криозащитных веществ, выбранных из, но не ограничивающийся этим, дисахаридов (например, лактоза, мальтоза, сахароза или трегалоза) и полигидроксиуглеводородов (например, дульцит, глицерин, манит и сорбит).
[0201] В конкретных вариантах осуществления осмолярность восстановленного лиофилизированного препарата находится в диапазоне от примерно 200 мосмоль/л до примерно 800 мосмоль/л, с предпочтительным диапазоном от примерно 250 мосмоль/л до примерно 500 мосмоль/л, или от примерно 300 мосмоль/л до примерно 400 мосмоль/л. Восстановленный лиофилизированный препарат может содержать, например, от примерно 0% до примерно 25% сахарозы, от примерно 3% до примерно 15%, и от примерно 5 до примерно 10% сахарозы. Альтернативно, восстановленный лиофилизированный препарат может содержать, например, от примерно 3% до примерно 12% сорбита. Если добавлена соль, такая как хлорид натрия, то эффективный диапазон сахарозы или сорбита может или не может быть относительно сниженным. Эти и другие подобные факторы осмоляльности и осмолярности находятся в необходимых пределах для данной области техники.
[0202] В конкретных вариантах осуществления лиофилизированный или восстановленный лиофилизированный препарат изобретения, который совместим с парентеральным введением, содержит один или больше ингибиторов свободно радикального окисления и/илм хелатирующих агентов. Разнообразие свободно радикальных антиоксидантов и хелатирующих агентов известно в данной области с уровня техники и применяется к препаратам и способам применения, описанным в данном документе. Примеры включают, но не ограничиваются этим, этанол, ЭДТА, комбинацию ЭДТА/этанол, триэтаноламин, маннит, гистидин, глицерин, цитрат натрия, инозита гексафосфат, триполифосфат, аскорбиновую кислоту/аскорбат, янтарную кислоту/сукцинат, яблочную кислоту/малеат, десферал, EDDHA и DTPA, и различные комбинации из двух или больше из указанных выше. В конкретных вариантах осуществления, по меньшей мере, один невосстанавливающий свободно радикальный антиоксидант может быть добавлен при концентрации, которая эффективно повышает долговременную стабильность препарата. Один или больше ингибиторов свободно радикального окисления / хелатирующих агентов также могут быть добавлены в различные комбинации, такие как антиоксиданты и двухвалентные ионы. Выбор хелатирующего агента будет определять то или иное добавление антиоксиданта является необходимым.
[0203] В некоторых вариантах осуществления лиофилизированная иммуногенная композиция содержит поверхностно-активное вещество меньше, чем 0,5% (масс./масс.). В некоторых вариантах осуществления поверхностно-активное вещество составляет 0,21%±0,04% (масс./масс.). Поверхностно-активные вещества имеют множество неограничивающих ролей в препаратах, в том числе, например, как вспомогательное вещество, как эмульгатор и как солюбилизатор. Например, в некоторых вариантах осуществления поверхностно-активное вещество выступает как солюбилизатор, чтобы препятствовать субстанции лекарственного средства, то есть ClfA белку, прилипать к стенкам контейнера или шприца, и следовательно не быть извлеченному или доставленному. Кроме того, поверхностно-активные вещества применяют для предотвращения возможности агрегации, которая возникает, например, когда или если ClfA белок приходит в контакт с силиконовым смазочным материалом из пробок. Поверхностно-активные вещества для применения в иммуногенных композициях и вакцинах описаны в Ascarateil and Dupuis, Vaccine, 24(2006): S83-S85. Коротко говоря, неограничивающие поверхностно-активные вещества включают липополисахариды (LPS), сапонины, диметилдиоктадециламмония бромид (DDAB), блок-полимеры или полоксамеры, которые являются неупорядоченными полимерами этиленоксида (ЕО) и пропиленоксида (PO), сложные эфиры сорбитана, которые могут быть моно- или триолеатами сорбитана, и которые могут быть получены из сорбита и олеиновой кислоты, связанных сложноэфирными связями и этоксилированными ими (то есть, полисорбаты, такие как, например, полисорбат 80), фосфолипиды, такие как лецитин, и маннид олеатами, которые являются сложными эфирами олеиновой кислоты и маннита.
[0204] В некоторых вариантах осуществления поверхностно-активное вещество является каким-либо одним или больше из полоксамера, полиоксиэтиленалкиловый простой эфир, включающий, но не ограничивающийся этим, Brij 58, Brij 35, а также другие, такие как Triton Х-100; Triton Х-114, NP40, Span 85 и плюрониловый ряд неионных поверхностно-активных веществ (например, Pluronic 121), и сложный эфир полиоксиэтиленсорбитана и жирной кислоты, который включает полисорбаты. В некоторых вариантах осуществления поверхностно-активное вещество является полисорбатом-80 (Tween 80), полисорбатом-60 (Tween 60), полисорбатом-40 (Tween 40) или полисорбатом-20 (Tween 20). В некоторых вариантах осуществления полисорбат 80 (Tween 80) составляет 0,20%±0,042% (масс./масс.).
[0205] В некоторых вариантах осуществления особенно тех, в которых лиофилизированная композиция не содержит вспомогательное вещество, водные разбавители содержат вспомогательное вещество. В некоторых вариантах осуществления вспомогательным веществом является ISCOMATRIX™.
[0206] В некоторых вариантах осуществления, особенно тех, в которых лиофилизированная композиция не содержит поверхностно-активное вещество, разбавитель содержит поверхностно-активное вещество, такое как, например, полисорбат 80.
[0207] В некоторых вариантах осуществления жидкая иммуногенная композиция содержит интактный rClfA полипептид, как описано в данном документе, который находится в концентрации от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл. В некоторых вариантах осуществления жидкая иммуногенная композиция содержит интактный ClfA полипептид, который находится в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл. В некоторых вариантах осуществления жидкая иммуногенная композиция содержит (a) интактный rClfA полипептид, как описано в данном документе, который находится в концентрации от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, (b) CP5-CRM197 конъюгат в концентрации от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл (c) CP8-CRM197 конъюгат в концентрации от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, (d) гистидиновый буфер в концентрации от примерно 5 мМ до примерно 50 мМ, от примерно 5 мМ до примерно 25 мМ и от примерно 5 мМ до примерно 15 мМ, (e) полисорбат 80 - от примерно 0,05% до примерно 0,5%, от примерно 0,075% до примерно 0,25% и от примерно 0,1% до примерно 0,2% масса к объему (масс./об.); и (f) сахароза в концентрации от примерно 0% до примерно 25% сахарозы, от примерно 3% до примерно 15% и от примерно 5 до примерно 10% масс./об. В других вариантах осуществления полисорбат 80 находится в концентрации 0,01%±0,005% масса к объему (масс./об.) и сахароза находится в концентрации 4,5%±1,5% масс./об. В некоторых вариантах осуществления, жидкая иммуногенная композиция содержит (a) интактный rClfA полипептид, как описано в данном документе, который находится в концентрации от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, (b) CP5-CRM197 конъюгат - от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, (c) CP8-CRM197 конъюгат - от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, (d) MntC полипептид - от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например, 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, (e) гистидиновый буфер - от примерно 5 мМ до примерно 50 мМ, от примерно 5 мМ до примерно 25 мМ и от примерно 5 мМ до примерно 15 мМ, (f) полисорбат 80 - от примерно 0,05% до примерно 0,5%, от примерно 0,075% до примерно 0,25% и от примерно 0,1% до примерно 0,2% масса к объему (масс./об); и (g) сахарозу в концентрации от примерно 0% до примерно 25% сахарозы, от примерно 3% до примерно 15% и от примерно 5 до примерно 10% масс./об. В другом варианте осуществления полисорбат 80 находится в концентрации 0,01%±0,005% масса к объему (масс./об.) и сахароза находится в концентрации 4,5%±1,5% масс./об.
[0208] В некоторых вариантах осуществления, особенно в случаях, в которых ни лиофилизированная композиция, ни разбавитель не содержат вспомогательное вещество, жидкая иммуногенная является комбинированной с вспомогательным веществом.
[0209] В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, который включает стадии: (а) комбинирования, в водной среде, (i) полипептида агглютинирующего фактора A ("rClfA") полипептида, (ii) буфера, имеющего pKa примерно 6,0±0,6, и (iii) объемообразующего агента; и (b) лиофилизирования комбинации со стадии (a), чтобы образовалась таблетка, которая содержит меньше, чем 3% воды по массе. В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, включающей стадии: (a) комбинирования, в водной среде, (i) полипептида агглютинирующего фактора A ("rClfA") полипептида, (ii) CP5-CRM197 конъюгата, (iii) СР8-CRM197 конъюгата, (iv) буфера, имеющего pKa примерно 6,0±0,6, и (v) объемообразующего агента; и (b) лиофилизирования комбинации со стадии (a), чтобы образовалась таблетка, которая содержит меньше, чем 3% воды по массе. В одном варианте осуществления, изобретение предусматривает процесс изготовления иммуногенной композиции, который включает стадии: (a) комбинирование водного раствора, содержащего (i) полипептид агглютинирующего фактора A ("rClfA") полипептида, (ii) CP5-CRM197 конъюгат, (iii) CP8-CRM197 конъюгат, (iv) выделенный MntC полипептид, (v) буфер, имеющий рКа примерно 6,0±0,6, и (vi) объемообразующий агент; и (b) лиофилизирование комбинации со стадии (a), чтобы образовалась таблетка, которая содержит меньше, чем 3% воды по массе. Иммуногенные композиции изобретения являются подходящими для предупреждения или лечения инфекции Staphylococcus aureus. В некоторых вариантах осуществления, таблетка белого цвета и имеет пористую текстуру.
[0210] Под "лиофилизацией", имеют в виду процесс высушивания при замораживании (криодесикации) материала. Как правило, процесс лиофилизации включает замораживание материала, затем снижение окружающего давления и обеспечивая нагревание достаточное, чтобы дать замороженной воде в материале сублимировать. В некоторых случаях, лиофилизация включает первоначальную стадию замораживания, стадию первичного высушивания (сублимации), вторичное высушивание, предназначенное для удаления конечных следов воды, которые остались. В некоторых случаях, стадия ренатурация является включенной для улучшения характеристик таблетки и для улучшения сублимации. Смотри Lyophilization of Biopharmaceuticals, Henry Costatino and Michael Pikal, eds., AAPS Press, Arlington VA, 2004 для более детального обсуждения лиофилизации.
[0211] Под "таблеткой", как правило, подразумевают высушенный материал, который остается после процесса лиофилизации. Внешний вид таблетки зависит от твердой матричной структуры, которая образуется при замораживании, и находится под влиянием различных параметров во время процедуры лиофилизации. Добавление стадии ренатурация к процедуре лиофилизации часто могут в результате приводить к более однородному внешнему виду таблетки.
[0212] В некоторых вариантах осуществления поверхностно-активное вещество, такое как, например, полисорбат 80, комбинируют с rClfA, буфером и объемообразующим агентом на стадии (a). В некоторых вариантах осуществления поверхностно-активное вещество имеет концентрацию примерно 0,1%±0,05% (масс./об.). В других вариантах осуществления поверхностно-активное вещество имеет концентрацию 0,01%±0,005% масс./об.
[0213] В некоторых вариантах осуществления водная комбинация, которая образуется на стадии (a) содержит интактный rClfA полипептид в концентрации от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например, 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл. В некоторых вариантах осуществления водная комбинация, которая образуется на стадии (a) содержит интактный rClfA полипептид в концентрации от 20 мкг/мл ± 2 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например, 20 мкг/мл ± 2 мкг/мл, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 400 мкг/мл ± 40 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, CP5-CRM197 конъюгат - от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, CP8-CRM197 конъюгат - от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, гистидиновый буфер - 10 мМ ± 5 мМ, полисорбат 80 - 0,1%±0,05% масса к объему (масс./об.), и сахарозу в концентрации 9%±4,5% масс./об. В другом варианте осуществления полисорбат 80 находится в концентрации 0,01%±0,005% масс./об. и сахароза находится в концентрации 4,5%±1,5% масс/об.
[0214] В некоторых вариантах осуществления водная комбинация, которая образуется на стадии (a) содержит интактный rClfA полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, CP5-CRM197 конъюгат в концентрации от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, CP8-CRM197 конъюгат в концентрации от 10 мкг/мл ± 1 мкг/мл до 400 мкг/мл ± 40 мкг/мл, включая, например, 10 мкг/мл ± 1 мкг/мл, 20 мкг/мл ± 2 мкг/мл, 100 мкг/мл ± 10 мкг/мл, 200 мкг/мл ± 20 мкг/мл и 400 мкг/мл ± 40 мкг/мл, MntC полипептид в концентрации от 40 мкг/мл ± 4 мкг/мл до 800 мкг/мл ± 80 мкг/мл, включая, например, 40 мкг/мл ± 4 мкг/мл, 200 мкг/мл ± 20 мкг/мл, 600 мкг/мл ± 60 мкг/мл и 800 мкг/мл ± 80 мкг/мл, гистидиновый буфер - 10 мМ ± 5 мМ, полисорбат 80 - 0,1%±0,05% масса к объему (масс./об.) и сахарозу в концентрации 9%±4,5% масс./об. В другом варианте осуществления полисорбат 80 находится в концентрации 0,01%±0,005% масса к объему (масс./об.) и сахароза находится в концентрации 4,5%±1,5% масс/об.
[0215] В некоторых вариантах осуществления стадия лиофилизации включает стадии (i) замораживания водной комбинации, (ii) ренатурации водной комбинации, и (iii) высушивания комбинации в две фазы. В одном варианте осуществления, (i) замораживание выполняют при понижении температуры водной комбинации на стадиях со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C при давлении 400 миллибар ± 40 миллибар, затем выдерживая в течение 60 минут ± 6 минут; (и) ренатурацию выполняют при повышении температуры до -10°C±5°C со скоростью 0,3°C±0,03°C в минуту, с последующим выдерживанием при температуре -10°C±5°C в течение 120 минут ± 12 минут, с последующим понижением температуры со скоростью 0,3°C±0,03°C в минуту до достижения температуры -50°C±5°C, и затем выдерживая при температуре -50°C±5°C в течение 180 минут ± 18 минут; (iii) первую фазу высушивания выполняют при понижении давления до 50 мторр (миллиторр) и выдерживая в течение 30 минут ± 3 минут, с последующим повышением температуры до -30°C±5°C со скоростью 0,2°C±0,02°C в минуту и затем выдерживая при такой температуре в течение 1 920 минут ± 192 минут; и (iv) вторую фазу высушивания выполняют при повышении температуры до 30°C±5°C со скоростью 0,2°C±0,02°C в минуту, с последующим повышением давления до 200 мторр и выдерживая при температуре 30°C±5°C в течение 720 минут ± 72 минут. В конкретных вариантах осуществления замораживание выполняют при давлении примерно 1013 мбар (1 атм.). В конкретных вариантах осуществления замораживание выполняют при давлении вплоть до 1013 мбар (1 атм.). В конкретных вариантах осуществления время высушивания может составлять примерно 2 600 минут. В конкретных вариантах осуществления время высушивания может составлять вплоть до 2 600 минут. В конкретных вариантах осуществления температура высушивания составляет 40°C±5°C, 50°C±5°C или 60°C±5°C. После конечной стадии высушивания температуру лиофилизированной композиции понижают до 5°C±5°C со скоростью 0,5°C±0,05°C в минуту. В конкретных вариантах осуществления лиофилизация происходит в емкости. В некоторых вариантах осуществления емкость укупоривают после лиофилизации. В некоторых вариантах осуществления емкость заполняют азотом перед укупориванием, и укупоривают под парциальным вакуумом, таким как 60% атмосферного давления.
[0216] В одном варианте осуществления процесс, кроме того, включает стадию восстановления лиофилизированной композиции в водном разбавителе, после которой осмоляльность восстановленной комбинации составляет 300 мосмоль ±30 мосмоль. В некоторых вариантах осуществления, водным разбавителем является вода. В некоторых вариантах осуществления, водным разбавителем является 60 мМ NaCl.
[0217] В одном варианте осуществления, заявка предусматривает иммуногенную композицию, произведенную в соответствии с процессом, описанным выше.
[0218] В конкретных вариантах осуществления, препарат изобретения включает один или больше дополнительных стабилизирующих агентов приемлемых для парентерального введения, например, восстанавливающий агент, содержащий, по меньшей мере, одну тиольную (-SH) группу (например, цистеин, N-ацетилцистеин, восстановленный глутатион, натрия тиогликолят, тиосульфат, монотиоглицерол или их смеси). Альтернативно или необязательно, препараты иммуногенной композиции изобретения, содержащие консерванты, дополнительно могут быть стабилизированы путем удаления кислорода из контейнеров для хранения, защиты препарата от света (например, путем использования контейнеров из янтарного стекла).
[0219] Препараты иммуногенной композиции изобретения, содержащие консерванты, могут содержать один или больше фармацевтически приемлемых носителей или наполнителей, которые включают какой-либо носитель, который сам по себе не вызывает иммунный ответ. Подходящие наполнители включают, но не ограничиваются этим, макромолекулы, такие как белки, сахариды, полимолочные кислоты, полигликолиевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, сахароза (Paoletti et al, 2001, Vaccine, 19:2118), трегалоза, лактоза и липидные агрегаты (такие как жирные капли или липосомы). Такие носители хорошо известны квалифицированным специалистам. Фармацевтически приемлемые носители обсуждаются, например, в Gennaro, 2000, Remington: The Science and Practice of Pharmacy, 20th edition, ISBN:0683306472.
[0220] В одном варианте осуществления изобретение предусматривает жидкую иммуногенную композицию, изготовленную путем восстановления лиофилизированной иммуногенной композиции, как описано в данном документе, в водном разбавителе. В некоторых вариантах осуществления, водным разбавителем является вода. В других вариантах осуществления, водным разбавителем является разбавленный солевой раствор. Под разбавленным солевым раствором следует понимать водный раствор с концентрацией соли от примерно 1 мМ до примерно 200 мМ, предпочтительно от примерно 1 мМ до примерно 100 мМ. В некоторых вариантах осуществления, солью является хлорид натрия. В некоторых вариантах осуществления, разбавленный солевой раствор содержит хлорид натрия с концентрацией 60 мМ ± 6 мМ. В некоторых вариантах осуществления, жидкая иммуногенная композиция имеет pH равный 6,0±0,6. В некоторых вариантах осуществления, жидкая иммуногенная композиция имеет pH равный 6,5±0,6.
[0221] При использовании термина "разбавитель", имеется в виду, что жидкость способна к суспендированию, разбавлению или растворению какого-либо вещества. В некоторых вариантах осуществления, вещество представляет собой лиофилизированную композицию, которая содержит ClfA полипептид. В некоторых вариантах осуществления, разбавитель представляет собой воду, и растворяет лиофилизированную композицию.
[0222] Непосредственную доставку восстановленных лиофилизированных иммуногенных композиций представленного изобретения субъекту могут выполнять путем парентерального введения (внутримышечно, внутрибрюшинно, внутрикожно, подкожно, внутривенно или в пространство интерстициальной ткани); или путем ректального, перорального, вагинального, местного, трансдермального, интраназального, глазного, ушного, легочного или другого мукосомального (через слизистую оболочку) введения. В предпочтительном варианте осуществления, парентеральное введение осуществляют путем внутримышечной инъекции, например, в бедро или плечо субъекта. Инъекцию могут выполнять с помощью иголки (например, иглой для подкожных инъекций), тем не менее, альтернативно могут использовать инъекции без применения иглы. Типичная внутримышечная доза составляет 0,5 мл. Композиции изобретения могут быть приготовлены в разных формах, например, для инъекций, или как жидкие растворы, или суспензии.
[0223] Оптимальные количества компонентов для конкретной иммуногенной композиции могут быть установлены, используя стандартные исследования, включающие наблюдение за соответствующими иммунными ответами у субъектов. После первоначального вакцинирования, субъекты могут получать одну или несколько ревакцинирующих иммунизации через достаточные промежутки времени. Упаковка и дозированные формы
[0224] Иммуногенные композиции изобретения могут быть упакованы в единичную дозированную или многократную дозированную форму (например, 2 дозы, 4 дозы или больше). В конкретных вариантах осуществления, дозой является 0,5 мл дозы после восстановления лиофилизированной иммуногенной композиции. Смотри, например, международную заявку на патент WO 2007/127668, которая включена в виде ссылки в данный документ.
[0225] Композиции могут быть представлены во флаконах или других приемлемых для хранения контейнерах, или могут быть представлены в виде предварительно наполненных устройств для доставки, например, одно- или многокомпонентные шприцы, которые могут поставляться с или без игл. Шприц, как правило, но не обязательно, содержит одну дозу иммуногенной композиции изобретения, содержащей консервант, хотя также предвидятся многократно дозированные, предварительно наполненные шприцы. Более того, флакон может содержать одну дозу, но, альтернативно, может включать многократные дозы.
[0226] Эффективные дозированные объемы могут быть установлены в обычном порядке, но обычная доза восстановленной лиофилизированной композиции для инъекции имеет объем 0,5 мл. В конкретных вариантах осуществления, доза формулируется для введения человеку, как субъекту. В конкретных вариантах осуществления, доза формулируется для введения взрослому, подростку, человеку молодого возраста, ребенку или младенцу (то есть, возраст не меньше чем один год) субъекта-человека и может в предпочтительных вариантах осуществления вводиться в виде инъекции.
[0227] Иммуногенные композиции представленного изобретения могут быть лиофилизированными и восстановленными, например, используя один из множества способов высушивания при замораживании, хорошо известных в данной области с уровня техники для получения частиц сухой, правильной формы (например, сферической), таких как микропеллеты или микросферы, имеющие характеристики частицы, такие как средние размеры диаметра, которые могут быть выбраны и проконтролированы с помощью разных точных способов, использованных для их получения. Иммуногенные композиции дополнительно могут содержать вспомогательное вещество, которое необязательно может быть получено с или содержаться в отдельных частицах сухой правильной формы (например, сферической), таких как микропеллеты или микросферы. В одном варианте осуществления представленное изобретение, кроме того, предусматривает набор иммуногенной композиции, содержащий первый компонент, который включает лиофилизированную иммуногенную композицию, необязательно дополнительно содержащую один или больше консервантов изобретения, и второй компонент, содержащий стерильный, водный раствор для восстановления первого компонента. В конкретных вариантах осуществления, водный раствор содержит один или больше консервантов, и может необязательно содержать, по меньшей мере, одно вспомогательное вещество (смотри, например, WO 2009/109550 (включенная в данный документ в виде ссылки)).
[0228] В еще другом варианте осуществления, контейнер многодозированного формата выбирают из одного или больше из группы, состоящей из, но не ограничивающейся этим, общепринятая лабораторная стеклянная посуда, колбы, мензурки, мерные цилиндры, ферментаторы, биореакторы, трубки, трубопроводы, пакеты, сосуды, флаконы, закрывающиеся флаконы (например, резиновой пробкой, закручивающейся крышкой), ампулы, шприцы, двух- или многокамерные шприцы, шприцы с пробками, шприцы с фиксаторами, резиновые затворы, пластиковые затворы, стеклянные затворы, картриджи и одноразовые ручки и т.п. Контейнер представленного изобретения не ограничивается материалом производства, и включает материалы, такие как стекло, металлы (например, сталь, нержавеющая сталь, алюминий и т.п.) и полимеры (например, термопластмассы, эластомеры, термопластические эластомеры). В конкретном варианте осуществления, контейнер формата представляет собой 5 мл стеклянный флакон Schott типа 1 с бутиловой пробкой. Квалифицированный специалист оценит, что формат, предложенный выше, не представляет собой исчерпывающий список, а только служит, как руководство для специалиста по отношению к многообразию форматов, имеющихся в распоряжении представленного изобретения. Дополнительные форматы, рассматриваемые для использования в представленном изобретении, могут быть найдены в опубликованных каталогах от продавцов лабораторного оборудования и производителей, таких как United States Plastic Corp. (Lima, OH), VWR.
Оценка иммуногенных композиций
[0229] В одном варианте осуществления представленное изобретение предусматривает иммуногенные композиции, содержащие, по меньшей мере, один антиген из организма S.aureus. В одном варианте осуществления представленное изобретение предусматривает иммуногенные композиции, содержащие, по меньшей мере, три антигена из организма S.aureus. В одном варианте осуществления представленное изобретение предусматривает иммуногенные композиции, содержащие, по меньшей мере, четыре антигена из организма S.aureus.
[0230] Различные исследования in vitro могут быть использованы для оценки иммуногенности иммуногенных композиций изобретения. Например, опсонический анализ in vitro может быть проведен путем инкубирования вместе со смесью стафилококковых клеток, нагретой инактивированной сывороткой, содержащей специфические антитела к антигенам в исследовании, и экзогенным источником комплемента. Опсонофагоцитоз протекает во время инкубирования свежевыделенных полиморфно-ядерных клеток (PMN's) или продифференцированных эффекторных клеток, таких как HL60, и смеси антитело/комплемент/стафилококковая клетка. Бактериальные клетки, которые покрыты антителом и комплементом, являются убитыми во время опсонофагоцитоза. Колонии, образующие единицы (cfu) выживших бактерий, которые выделили из опсонофагоцитоза, могут быть определены, используя планшетный анализ смеси. Титры описывают как обратные величины наибольшего разбавления, которая дает 50% смерть убийство, как определено по сравнению с контрольными анализами.
[0231] Полный клеточный ELISA анализ также может быть использован для оценки иммуногенности и поверхностного воздействия антигена in vitro, в котором интересующий бактериальный штамм (S.aureus) покрыт на планшете, таком как 96 луночный планшет, и исследованные сыворотки от иммунизированного животного взаимодействуют с бактериальными клетками. Если какое-либо антитело, специфическое для исследуемого антигена, реагирует с поверхностью незащищенного эпитопа антигена, то он может быть выявлен с помощью стандартных способов, известных квалифицированному специалисту в данной области с уровня техники.
[0232] Какой-либо антиген, демонстрирующий необходимую in vitro активность, затем может быть исследован in vivo в модели на животных с контрольным заражением. В конкретных вариантах осуществления, иммуногенные композиции могут быть использованы в иммунизации животного (например, мыши) с помощью способов и путей иммунизации, известных квалифицированному специалисту в данной области с уровня техники (например, интраназального, парентерального, перорального, ректального, вагинального, трансдермального, внутрибрюшинного, внутривенного, подкожного и т.п.). После иммунизации животного специфической Staphylococcus sp. иммуногенной композицией, производят контрольное заражение животного Staphylococcus sp. и исследуют на резистентность к стафилококковой инфекции.
[0233] В одном варианте осуществления, беспатогенные мыши могут быть иммунизированы и подвержены контрольному заражению S.aureus. Например, мышей иммунизируют одной или больше дозами иммуногенной композиции. Впоследствии производят контрольное заражение мышей S.aureus и контролируют выживание на протяжении времени после заражения.
Способы иммунизации
[0234] Кроме того, предусмотренными являются способы иммунизации хозяина для предупреждения стафилококковой инфекции. В предпочтительном варианте осуществления, хозяином является человек. Таким образом, хозяину или субъекту вводят иммуногенное количество иммуногенной композиции, как описано в данном документе. Иммуногенное количество иммуногенной композиции может быть определено путем проведения исследования ответа на дозу, в котором субъектов иммунизируют постепенно возрастающими количествами иммуногенной композиции и анализируют иммунный ответ, чтобы определить оптимальную дозу. Исходные точки исследования могут быть обозначены исходя из иммунизационных данных в моделях на животных. Дозированное количество может варьировать в зависимости от специфических состояний индивидуума. Количество может быть определено в общепринятых испытаниях способами, известными квалифицированному специалисту в данной области с уровня техники. В некоторых вариантах осуществления, способ иммунизации хозяина для предотвращения стафилококковой инфекции, заболевания или состояния включает обработку человека, ветеринарную обработку, обработку животного или сельскохозяйственную обработку. Другой вариант осуществления предусматривает способ иммунизации хозяина, для того чтобы предотвратить стафилококковую инфекцию, заболевание или состояние, связанное со Staphylococcus sp. у субъекта, способ, который включает генерирование получения поликлонального или моноклонального антитела из иммуногенной композиции, описанной в данном документе, и, используя указанное получение антитела, дать положительный иммунитет субъекту.
[0235] Иммунологически эффективное количество иммуногенной композиции в соответствующем числе доз вводят субъекту, чтобы вызвать иммунный ответ. Обработанный индивидуум не должен демонстрировать более серьезные клинические проявления стафилококковой инфекции. Дозированное количество может варьировать в зависимости от специфических состояний индивидуума, таких как возраст и вес. Данное количество может быть определено в общепринятых испытаниях способами, известными квалифицированному специалисту в данной области с уровня техники.
[0236] В одном варианте осуществления, пациент, которому вводят иммуногенные композиции изобретения, показывает снижение уровней носительства S.aureus. Такое снижение носительства или продолжительный промежуток времени, проведенный как не носитель после введения иммуногенной композиции, является значительным для необходимой медицинской перспективности. Например, снижение общего носительства S.aureus в носительствах может быть оценено после одной дозы S.aureus мультиантигенной вакцины. Например, за 1 день перед введением иммуногенной композиции, группа взрослых людей в возрасте 18-50 лет может быть отобрана для носительства путем назального и гортанных мазков с последующим культивированием, чтобы определить состояние их носителей. Далее, группе могут вводить иммуногенную композицию изобретения с группой, получающей контроль. Назальные и гортанные мазки, выполняемые еженедельно в течение 12 недельного периода, и ежемесячно вплоть до 6 месяцев после введения иммуногенной композиции, проводили и сравнивали с группой плацебо. Одна первоначальная конечная точка является такой, чтобы сравнивать показатели носительства у пациентов после введения иммуногенной композиции по отношению к плацебо в течение 3 месячного промежутка времени после иммунизации.
Модели на животных стафилококковой инфекции
[0237] Несколько моделей на животных описаны ниже для использования в оценке эффективности какой-либо одной из иммуногенных композиций, описанных в данном документе.
Модель сепсиса на мышах (пассивная или активная)
Модель пассивной иммунизации
[0238] Мышей пассивно иммунизировали внутрибрюшинно (в.б.) иммунным IgG или моноклональным антителом. Затем спустя 24 часа проводят контрольное заражение мышей летальной дозой S.aureus. Бактериальное контрольное заражение вводят внутривенно (в.в.) или в.б. обеспечивая, чтобы какое-либо выживание могло быть приписано специфическому in vivo взаимодействию антитела с бактериями. Определено, что доза бактериального контрольного заражения является дозой, требуемой для достижения летального заражения крови приблизительно у 20% неиммунизированных контрольных мышей. Статистическая оценка исследования выживаемости может быть выполнена с помощью анализа Каплана-Мейера.
Модель активной иммунизации
[0239] В данной модели мышей (например, мыши Swiss Webster) активно иммунизируют внутрибрюшинно (в.б.) или подкожно (п.к.) антигеном-мишенью в 0, 3 и 6 недель (или другие аналогичные соответствующие промежутки времени графика вакцинации) и впоследствии через 8 недель проводили контрольное заражение S.aureus внутривенным путем. Дозу бактериального контрольного заражения калибруют, чтобы достичь приблизительно 20% выживание в контрольной группе в течение 10-14 дневного периода. Статистическую оценку исследования на выживание могут выполнять с помощью анализа Каплана-Мейера.
Модель инфекционного эндокардита (пассивная или активная)
[0240] Модель пассивной иммунизации инфекционным эндокардитом (IE), который вызван S.aureus, ранее была использована, чтобы показать, что ClfA может индуцировать защитный иммунитет. Смотри Vernachio et al., Antmicro. Agents & Chemo. 50:511-518 (2006). В данной модели IE, кроликов и крыс используют для моделирования клинических инфекций, которые включают центральный венозный катетер, бактеремию и гемопоэтическое обсеменение дистальных органов. Катетеризированным кроликам и крысам со стерильными патологическими разрастаниями ткани клапана аорты вводят одну или несколько внутривенных инъекций моноклонального или поликлонального антитела, специфического для антигена-мишени. Потом, животных подвергают контрольному заражению в.в. штаммом S.aureus или S.epidermidis. Затем после контрольного заражения, сердце, патологические разрастания ткани сердца и дополнительные ткани, включая почки, и кровь собирают и культивируют. Затем измеряли частоту стафилококковой инфекции в ткани сердца, почек и крови. В одном исследовании, когда животных подвергали контрольному заражению или MRSE АТСС 35984, или MRSA 67-0, значительные снижения скорости инфицирования были показаны, используя или препарат поликлонального антитела, или моноклонального антитела к ClfA. Смотри Vernachio et al., Antmicro. Agents & Chemo. 50:511-518 (2006).
[0241] Модель инфекционного эндокардита, кроме того, была приспособлена для исследований активной иммунизации, как у кроликов, так и у крыс. Кроликов или крыс иммунизировали внутримышечно или подкожно антигеном-мишенью и подвергали контрольному заражению S.aureus спустя две недели путем внутривенного введения.
Пиелонефритная модель
[0242] В пиелонефритной модели, мышей иммунизировали на 0, 3 и 6 неделе (или другие соответствующие промежутки времени графика иммунизации) антигенами-мишенями. Далее животных подвергали контрольному заражению в.б. или в.в. S.aureus PFESA0266. Через 48 часов почки собирают и подсчитывают бактериальный CFU.
Композиции антител и антитела
[0243] Кроме того, изобретение предусматривает композиции антител и антитела, которые специфически и селективно связывают один или больше антигенов иммуногенной композиции представленного изобретения. В некоторых вариантах осуществления, антитела вырабатываются при введении субъекту иммуногенной композиции представленного изобретения. В некоторых вариантах осуществления, изобретение предусматривает очищенные или выделенные антитела, направленные против одного или больше антигенов иммуногенной композиции представленного изобретения. В некоторых вариантах осуществления, антитела представленного изобретения являются функциональными, как измерено путем уничтожения бактерий или в модели эффективности на животных, или с использованием опсонофагоцитозного анализа ослабления. В некоторых вариантах осуществления, антитела изобретения дают субъекту пассивный иммунитет. Представленное изобретение, кроме того, предусматривает полинуклеотидные молекулы, кодирующие антитело или фрагмент антитела изобретения, и клетку или линию клеток (такую как клетки гибридомы или другие сконструированные клеточные линии для рекомбинантного продуцирования антител), и трансгенное животное, которое продуцирует антитело или композицию антител изобретения, используя методики, хорошо известные квалифицированному специалисту в данной области с уровня техники.
[0244] Композиции антитела и антител изобретения могут быть использованы в способе лечения или предупреждения стафилококковой инфекции, заболевания или состояния, связанного со Staphylococcus sp. у субъекта, способ, который включает генерирование препарата поликлонального или моноклонального антитела, и использование упомянутого антитела или композиции антитела, чтобы дать субъекту пассивный иммунитет. Антитела изобретения, кроме того, могут быть пригодными для диагностических методов, например, обнаружение присутствия или количественное определение уровней одного или больше антигенов иммуногенных композиций представленного изобретения.
Примеры
[0245] Следующие примеры демонстрируют некоторые варианты осуществления представленного изобретения. Однако, следует понимать, что эти примеры являются только иллюстрацией замыслов и не означает, как подразумевается, что они всецело определяют условия и рамки данного изобретения. Следует принимать во внимание, что когда предоставляются типичные условия реакции (например, температура, времена реакции и т.п.), условия как выше, так и ниже указанных диапазонов также могут быть использованы, хотя, как правило, это менее удобно. Все части и проценты, упоминаемые в данном документе, относятся к массовой основе и все температуры выражают в градусах по шкале Цельсия, если не указано другое.
[0246] Более того, следующие примеры выполняют, используя стандартные методики, хорошо известные и общепринятые для квалифицированного специалиста в данной области с уровня техники, за исключением, когда иное описано в подробностях.
[0247] Раскрытым является стабильный, лиофилизированный три-антигенный препарат, который включает рекомбинантный агглютинирующий фактор A (rClfA), конъюгат капсульного полисахарида типа-5 (CP5-CRM197) и конъюгат капсульного полисахарида типа-8 (CP8-CRM197), который разработан как Staphylococcus aureus вакцина или иммуногенная композиция. В одном конкретном варианте осуществления, rClfA является видоизмененной формой сконструированного поверхностно-экспрессированного фактора вирулентности, чтобы уменьшить его аффинность связывания с фибриногеном (Y388A) (rClfAm). СР5 и СР8 являются общими полисахаридами, найденными в клинических штаммах и, в данной вакцине, являются конъюгированными с белком-носителем CRM197.
[0248] Лиофилизированные таблетки, которые изготовляются, были визуально приемлемыми, и активные компоненты были стабильными при восстановлении лиофилизированных таблеток. Кроме того, одномесячное хранение составной серии (группируя высокие и низкие дозы) лиофилизированного препарата в реальном времени (2-8°C), и ускоренных (25°C и 37°C) температурах показало, что лиофилизированный три-антигенный препарат оставался стабильным. Кроме того, три цикла замораживания-размораживания и 24-часовое исследование стабильности, проводимые при комнатной температуре, после восстановления каждый показал стабильность активных ингредиентов при тех условиях.
[0249] Кроме того, раскрытым является стабильный, лиофилизированный четырехантигенный препарат, который включает рекомбинантный ClfA, CP5-CRM197, CP8-CRM197 и MntC, который был разработан, как Staphylococcus aureus вакцина или иммуногенная композиция. В одном конкретном варианте осуществления, ClfA является мутированной формой сконструированного поверхностно-экспрессированного фактора вирулентности, чтобы уменьшить его аффинность связывания с фибриногеном (Y388A). В одном конкретном варианте осуществления, MntC не является липидированным. В одном конкретном варианте осуществления, MntC является рекомбинантным. Как и для три-антигенного препарата, лиофилизированный четырех-антигенный препарат имел значительно повышенную стабильность по сравнению с жидкими препаратами, содержащими такие же антигены.
[0250] Тогда как некоторые варианты осуществления изобретения описаны путем иллюстрации, будет очевидным, что изобретение может быть внедрено в практику с многими модификациями, вариациями и приспособлениями, и с использованием многочисленных эквивалентных или альтернативных растворов, которые находятся в пределах квалификации специалиста в данной области, без отклонения от замысла изобретения или выхода за пределы формулы изобретения.
[0251] Все публикации, патенты и заявки на патент включены в данный документ в виде ссылок в их полном объеме в таком же объеме, как если бы каждая конкретная публикация, патент или заявка на патент была специфически и индивидуально обнаружена, чтобы быть включенной в виде ссылки в полном своем объеме.
ПРИМЕР 1: МЕТОДОЛОГИЯ ПРЕДВАРИТЕЛЬНОЙ ФОРМУЛЯЦИИ
[0252] Многообразие биофизических инструментальных методов (деривативная УФ спектроскопия поглощения, флуоресцентная спектроскопия, круговой дихроизм (CD) и дифференциальная сканирующая калориметрия (ДСК)) были использованы для исследования характеристик свойственных белку агглютинирующего фактора A (ClfA) Staphylococcus aureus в контексте структурной стабильности. Температура и pH были вариабельными параметрами, использованными для приведения в действие нагрузки на белок, чтобы помочь охарактеризовать свойственное структурное поведение ClfA белка. Эти данные затем были использованы для проведения скрининга наполнителей, которые могут обеспечить дополнительную стабильность белку. Более того, исследования связывания выполняли, чтобы оценить в зависимости от дозы или pH аффинность ClfA к AlPO4 и Al(OH)3 Данные, раскрытые в данном документе, исследовали, чтобы достичь для препарата ClfA использование в биомедицинских применениях, таких как, например, как вакцина или иммуногенная композиция.
[0253] Тогда как изобретение направлено на какой-нибудь и все белки агглютинирующего фактора A (ClfA) и препараты, содержащие ClfA, следующие примеры, которые используют вариант ClfA, которые включают N1N2N3 домены ClfA и имеют Y338A замещение, которое включает замещенный на тирозин аланин, в соответствующем положении 338 всей длины ClfA, и который испытывает недостаток способности связывания фибриногена.
[0254] Образцы, подготовленные для начальных биофизических характеристик, были составлены из 10 мМ буфера (ацетатного, сукцинатного или фосфатного) в 150 мМ NaCl. Приблизительные концентрации мишени ClfA составляли 0,1 мг/мл для флуоресценции, 0,2 мг/мл для кругового дихроизма (CD), и 0,5 мг/мл для УФ спектроскопии поглощения.
[0255] Концентрации белка определяли, используя коммерчески доступный модифицированный Лоури анализ белка (Смотри; Lowry et al. J. Biol. Chem.; 193:265-275 [1951]) или УФ спектроскопию поглощения.
[0256] Круговой дихроизм (CD) выполняли, используя Jasco J-810 спектрополяриметр, чтобы оценить вторичную структуру ClfA белка в иммуногенной композиции или вакцине. Действие pH на структуру ClfA исследовали посредством наблюдения качественных различий в CD спектрах, когда белок формулировали в диапазоне pH от 5,0 до 8,0. Более того, эксперименты по нарушению температурного режима выполняли от 10°C до 85°C на 218 нм, чтобы наблюдать конформационную стабильность белка от перспективы вторичной структуры. Длина волны 218 нм была выбрана, потому что известная N2N3 структура ClfA включает большие количества р-листовая структура. Экспериментальные параметры для CD сканирований включали диапазон длин волн 190-260 нм, скорость сканирования 20 нм/мин, время отклика - две секунды, ширина полосы - 1 нм, и накопление от трех (3). Эксперименты по нарушению температурного режима выполняли, используя вариабельный температурный способ с программным обеспечением Jasco, используя температурную скорость отслеживания нагрузки 15°C/час, ответ - одна секунда, и ширина полосы - 1 нм.
[0257] Флуоресцентная эмиссионная спектроскопия, свойственная триптофану была использована для контролирования изменений в третичной структуре ClfA белка, как функции температуры. Кроме того, способ использовали для наблюдения изменений в структуре белка в реальном времени и во время ускоренных исследований. Флуоресцентные спектры записывали на флуориметре PTI QM-1 (Brunswick, NJ) с длиной волны экситации 295 нм. Концентрация используемого белка составляла ~0,1 мг/мл. Характерные для триптофана эмиссионные спектры наблюдали в диапазоне 320~350 нм, используя 1-см толщины кварцевую кювету. Данные флуоресценции получали в диапазоне температур 10°C-85°C (с интервалами 2,5°C) для серии значений pH от 4,0 до 8,0. Контрольные эксперименты выполнили, используя буфер, как контрольную пробу для базовой коррекции. Инструментальные установочные параметры включали ширину полосы экситации и эмиссии 4 нм и 3 нм, соответственно, время интегрирования - одна секунда и собирали данные в диапазоне длины волны 290 нм - 400 нм. Для препаратов, содержащих AlPO4, фронтальная (треугольная) геометрия кюветы была использована для обхода ограничений, связанных с мутностью образца. Анализ данных выполняли, Origin® с помощью 7.0, используя полиномную 11-точечную функцию второго-порядка Савицкого-Голая для сглаживания.
[0258] Эксперименты по нарушению температурного режима со второй производной УФ спектроскопией поглощения использовали как другой способ для исследования ClfA третичной структуры, чтобы оценить стабильность свойственную белку. Многодлинноволновые электронные спектры поглощения были получены в диапазоне 200 нм-400 нм на спектрометре Agilent 8453 с УФ-видимой, диодной матрицей, оснащенном температурным контролером Peltier. Для всех экспериментов использовали кварцевую кювету с длиной пробега 1 см объемом 100 мкл. Для экспериментов в расплаве, после каждого изменения температуры давали четыре минуты, которые, как считается, являются достаточными для достижения равновесия. Данные оптической плотности на 350 нм также собирают, как функцию температуры, чтобы контролировать потенциальную агрегацию ClfA белка.
[0259] Анализ спектров проводили, используя программное обеспечение CHEMSTATION™ (Agilent). Спектры второй производной были получены, используя фильтр с девятиточечными параметрами, и соответствующий Савицкого-Голая полиному третей степени. Производные спектры были интерполированы с 99 точками данных между каждым одно-нанометровым интервалом, обеспечивая эффективное разрешение приблизительно 0,01 нм при неагрегационных условиях. MICROCAL ORIGIN™ 6.0 использовали для отбора положений пиков производных спектров. Обнаружены положения пиков, соответствующие аминокислотным остаткам фенилаланина, тирозина и триптофана, (основанные на способе Kueltzo et al., J Pharm Sci. 2003; 92(9): 1805-1820), и нанесены на график, как функция температуры.
[0260] Гель-проникающую хроматографию проводили, используя колонку TOSOH TSK-GEL G3000SWxl, 7,8 мм × 30 см, 5 мкм, номер детали 08541, используя следующие условия: скорость потока - 0,5 мл/мин; максимальное давление - 60 бар; время пробега -30 мин.; подвижная фаза - Cellgro PBS, pH 7,4; объем инжекции - 100 мкл; детектор - УФ 280, 260, 214 нм, ширина полосы - 4 нм для всех; контрольный - 340 нм, ширина полосы - 16 нм; температура - 25°C.
[0261] Температуру плавления (Тпл.) ClfA белка определяли с использованием дифференциальной сканирующей калориметрии (ДСК). ДСК профиль ClfA образца измеряли по сравнению с приготовленным совместимым буфером, одновременно как и образец ClfA, за исключением того, что объем, который был бы занят субстанцией лекарственного средства (ClfA), был заменен на буфер. Инструментальные установочные параметры были следующими: скорость сканирования - 200°C/час; диапазон сканирования - 10-90°C; периоды фильтрования - 8 секунд; способ обратной связи/усиления, среднее значение. После каждого сканирования ДСК клетки и шприц промывали 3-5 раз водой для инъекций (WFI). В случае каких-нибудь экспериментов повторного сканирования, цикл очищения клеток включал использование 10% Contrad (Decon Laboratories Ltd., East Sussex, UK), чтобы обеспечить чистую клетку для следующего пробега.
[0262] Микрокалориметрический капилляр ДСК использовали, как платформу с высокой пропускной способностью для проведения скрининга наполнителей. В каждом эксперименте скрининга наполнителя использовали ClfA в 10 мМ сукцинатном буфере, 150 мМ NaCl, pH 6,0, как основу для расчета изменения в Тпл. Видимая Тпл. была получена для парных ДСК образцов, и среднее значение Тпл. затем сравнивали со средним значением Тпл. препарата без наполнителя в таком же ДСК пробеге. Действие каждого наполнителя/концентрации сравнивали с действием изменения в Тпл.. Положительное изменение в Тпл. в присутствии наполнителя предполагает положительное влияние на термическую стабильность IfA. Для расчета ΔG, рассчитывали ΔCP исходя из выбранной вручную базовой линии до и после перехода, затем рассчитывали ΔH и Тпл. по интегрированию площади между кривой и базовой линией. ΔG кривую рассчитывали, используя программное обеспечение Microcal DSC.
ПРИМЕР 2: ПРЕДВАРИТЕЛЬНАЯ ФОРМУЛЯЦИЯ ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: РЕЗУЛЬТАТЫ
[0263] Фармацевтически релевантными стрессовыми температурами (10-85°C) и pH (4,0-8,0) воздействовали на продукт лекарственного средства (жидкий сформулированный ClfA) и субстанцию лекарственного средства (несформулированный ClfA белок в жидкой фазе), чтобы установить их чувствительности.
[0264] Исследование свойственной триптофану флуоресценции в термическом расплаве проводили на образцах ClfA при различных pH от pH 4,0 до pH 8,0 и создавали кривые флуоресцентной эмиссии. Для данных экспериментов ClfA, как правило, находился в концентрации 0,1 мг/мл - 0,2 мг/мл. Установлено, что точки перегиба каждой кривой являются температурой плавления (Тпл.), и приведены в таблице 4. При 10°C, образцы при более высоких значениях pH показывали положения пиков в более длинноволновой области, предполагая, что триптофановые остатки более подвержены действию растворителя. Более того, при более высоких значениях pH, ClfA демонстрировал более низкие значения Тпл., показывая меньшую стабильность по сравнению с более низкими значениями pH, такими как pH 5,5 и 6,0. Панель pH при более мелких возрастаниях от 0,2 (таблица 5) от pH 5,5 до 6,5 показала постепенное возрастание Тпл. с понижением pH.
|
|
[0265] Спектроскопию кругового дихроизма (CD) применяли, чтобы исследовать вторичную структуру ClfA как функцию от pH. Спектры, полученные при pH 7,0 и pH 8,0, в частности, показали хорошо-определяемый минимум при ~200 нм и 220 нм. Единственно вероятная интерпретация данного наблюдения представляет собой то, что минимум при ~220 нм мог быть соответствующим β-листовой компоненте известной N2N3 структуры, и что минимум при ~200 нм является приближением случайной спирали, минимум которой наблюдается на приблизительно 195 нм. Эти наблюдения подтверждают флуоресцентные данные, что ClfA белок является незначительно более нескладчатым при pH 7,0 и pH 8,0.
[0266] CD плавления ClfA от pH 4,0 до 8,0 выполняли при 10°C-85°C и кривые получали, изображая молярную эллиптичность, как функцию поглощения для каждой точки pH. Наблюдали формы кривых через различные значения pH. Представлено, что данные при pH 6,0 и более высоких имеют подобные переходы, что может быть визуально оценено при около 55°C. Кривые при pH 5,0 и 5,5 имеют более высокие переходы. Более того, pH 5,0 демонстрировало наибольшую степень изменения (в значениях эллиптичности), предполагая наибольшее возрастание содержания β-листа. Так как повышенное содержание β-листа является типичным в агрегированных образцах, pH 5,0 может показывать, что ClfA белок является наиболее предрасположенным к само-ассоциации при повышенных температурах.
[0267] Оптическую плотность при 350 нм (OD350) измеряли, используя УФ-видимого спектра спектрометр Agilent 8453, и рассеивание света под прямым углом измеряли, используя спектрофлуориметр Photon Technology International, как функцию от температуры, чтобы наблюдать увеличения размера частиц, которые следует соотнести с увеличением интенсивностей сигналов и, возможно, коррелировать с агрегацией ClfA белка. Значительные переходы наблюдали в температурных записях при pH 4,0, 5,0 и 5,5, при pH 4,0 была наибольшую степень изменения (наибольшая агрегация). Напротив, pH 6,0 и более высокие демонстрировали только маленькие, постепенные, направленные вверх изменения, указывающие на незначительные случаи само-ассоциирования.
[0268] Рассеивание света под прямым углом представляет собой методику, которая является более чувствительной, чем OD350 при обнаружении олигомеризаций (агрегации). В соответствии с данными, полученными по этой методике, наиболее раннее возникновение агрегации ClfA были видны при pH 5,0 и 5,5, тогда как более высокие значения pH, показанные, даже если 15°C замедляло увеличение размера частиц.
[0269] Структурную стабильность ClfA характеризовали, используя дифференциальную сканирующую калориметрию (ДСК), которой меряют изменение энтальпии, как измеренную в ккал/моль/°C. В соответствии с ДСК анализом, наблюдалось, что разворачивание ClfA является обратимым с единственным переходом, замеченным при около 55,5°C. Рассчитали, что энтальпия данного перехода составляет приблизительно 10 ккал/моль.
[0270] Кроме того, Тпл. ClfA измеряли, как функцию концентрации, которая, соответственно, может быть определена от 0,1 мг/мл до 1,0 мг/мл. Наблюдалось, что Тпл. ClfA не изменяется с возрастанием концентрации белка, которая показывает, что ClfA существует главным образом, как мономер. Данное наблюдение является согласующимся с данными гельпроникающей хроматографии, раскрытыми в данном документе ниже.
[0271] Кроме того, Тпл. для ClfA была определена с помощью капиллярной ДСК, как функции от pH (таблица 6). В данных экспериментах Тпл. для ClfA наблюдалось достижение плато между pH 5,0 та 8,0 при около 55-56°C, несмотря на то, что Тпл. отклоняется вниз, в то время как pH возрастает. Тпл. для ClfA при pH 4,0 составляла только 50,8°C, демонстрируя структурную нестабильность ClfA при данном pH. Для этих ДСК экспериментов концентрация ClfA составляла 1,0 мг/мл. Тпл. для ClfA, определяемая с помощью ДСК, кроме того, сравнивали с Тпл., определенной для триптофана (Trp) по сдвигу пика флуоресценции (выше). Тпл., определенная с помощью флуоресценции Trp, была совместима с Тпл., определенной с помощью ДСК между pH 4,0 и pH 5,5. Однако, Тпл., определенная с помощью флуоресценции Trp, резко понижалась, когда pH возрастала от 6,0 до 8,0. Возможным объяснением является то, что N3 домен развертывается в то время, как pH возрастала от 6,0 до 8,0. Существует только два триптофана в ClfA, оба из которых расположены в N3 домене. Резкое снижение Тпл. в флуоресценции Trp, в то время, как pH возрастала от 6,0 до 8,0, демонстрировало, что эти остатки подвергали действию более полярных окружающих условий, которые обычно являются указывающими на разворачивание белка.
|
[0272] Продукт лекарственного средства ClfA может поставляться в предварительно наполненном шприце, который предварительно покрыт кремнийорганическим соединением. Для предотвращения агрегации белка, которая вызывается силиконовым маслом на цилиндре шприца и поршне, а также, среди прочего, для предотвращения адсорбции белка на стеклянной поверхности, часто включают полисорбат 80 (PS 80) в конечный состав продукта лекарственного средства. Так как PS 80 является детергентом, который потенциально мог бы дестабилизировать белок, Тпл. для ClfA оценивали в присутствии PS 80. В таблице 7 просуммированы результаты экспериментов капиллярного ДСК с 1,0 мг/мл ClfA в присутствии или при отсутствии полисорбата 80, которые показали, что присутствие PS 80 понижало Тпл. для ClfA на около 1°C, что является статистически значительным отличием от Тпл. для препарата ClfA без PS 80.
|
[0273] Кроме того, оценивали влияние AlPO4 на Тпл. для ClfA. Для измерения Тлл. для ClfA, связанного с AlPO4, 0,1 мг/мл ClfA был сформулирован с сукцинатным солевым раствором при pH 5,0, в котором большая часть ClfA была связана с алюминием. Тпл. связанного ClfA измеряли по отношению к подобранному буферу, содержащему такие же концентрации алюминия фосфата. Результат такого эксперимента показал, что Тпл. для ClfA особенно не изменилась при связывании с алюминием фосфатом (то есть, 56,16°C±0,12°C) по сравнению с несвязанным ClfA (то есть, 56,34°C±0,15°C).
[0274] Для обеспечения выбора типа буфера, концентрации и ионной силы продукта лекарственного средства определяли изменение Тпл. в препаратах с высоким/низким содержанием соли и препаратах с различными концентрациями гистидина и сукцинатного буфера. В таблице 8 показано, что Тпл. ClfA возрастала, в то время каквозрастала концентрация NaCl или концентрация сукцинатного буфера. Однако, Тпл. для ClfA не возрастала в каких-либо исследованных препаратах с гистидин - солевым буфером.
|
[0275] Наполнители известных фармацевтических стабилизаторов, такие как сахара, полиолы и аминокислоты, подвергали скринингу на их влияние на Тпл. ClfA по сравнению с базовым препаратом (0,6 мг/мл ClfA в 10 мМ сукцинатном буфере, 150 мМ NaCl, pH 6,0). В таблице 9 показано, что увеличения Тпл. для ClfA зависели от концентрации CaCl2, трегалозы, сахарозы, сорбита, маннита и глутаминовой кислоты. Аргинин, однако, понижал Тпл. для ClfA. Пролин не показывал значительного влияния на Тпл для ClfA. Влияние наполнителей на белки является белок-зависимым, таким образом, квалифицированный специалист в данной области не будет знать какое влияние будут иметь наполнители априори. Сахароза, сорбит, CaCl2 и высокая концентрация NaCl не только повышали Тпл., а также повышали ΔG при 4°C. В таблице 10 представлено дополнительное влияние наполнителей на повышение Тпл. для ClfA на 2°C-3°C, даже в присутствии PS80.
|
[0276] Результирующие поверхностные заряды ClfA и AlPO4 были получены как функция от pH между 4,0 и 8,0 для использования, как независимые переменные связывания. Буферными системами, которые применяли для исследования, были ацетат (для pH 4,0-5,0), сукцинат (для pH 5,5-6,5) и фосфат (для pH 7,0-8,0). Профиль дзета-потенциала ClfA пересекает точку нулевого заряда приблизительно между pH 4,0 и 5,0. (Дзета потенциал представляет собой меру электрокинетического потенциала агентов в коллоидной системе. Смотри Lyklema, J. "Fundamentals of Interface and Colloid Science", vol.2, page.3.208, 1995.) Это согласуется с фактом, что ClfA имеет значение pl ниже 4. Более того, также было выявлено, что профиль дзета потенциала AlPO4 согласуется с его pl ~5,5-5,8. Таким образом, наилучшее связывание должно происходить, когда два элемента имеют разноименные результирующие заряды, приблизительно между pH 4,5-5,5. Анализ Лоури показал, что наилучшее связывание происходило при pH 5,0, как при 0,020, так и при 0,100 мг/мл концентрациях ClfA. Противоположное направление подтвердилось для кривой Al(OH)3, где pH 5,0 продемонстрировало наименьшее связывание. Al(OH)3 никогда не достигал 100% связывания при каком-либо исследуемом значении pH.
[0277] Эксперименты связывания AlPO4 с концентрациями титрования (0,25, 0,50, 0,75 мг/мл) проводили с ClfA при pH 5,0, 5,5 и 6,0. В соответствии с такими экспериментами, ClfA при pH 6,0 оказался нечувствительным к концентрации белка, соответственно достигая ~50% связывание, тогда как белок при pH 5,0 показал возрастание в связывании, сопровождающееся увеличением у AlPO4. Наблюдалось, что ClfA достигал наилучшее связывание при pH 5,0 и при более низких концентрациях белка, вместе с уменьшением связывания, когда возрастали концентрации. Более того, pH 5,5 и 6,0 обе показали одинаковое направление, но связывание было не адекватным для любых из этих значений pH, даже при самой низкой дозе.
[0278] При попытке улучшить связывание при pH 6,0, были выбраны несколько наполнителей, которые включали 150 мМ NaCl, 500 мМ NaCl, 300 мМ глицина, 300 мМ лизина, 20 мМ MgCl2 и 1 мМ ЭДТА, чтобы исследовать наряду с изменением концентраций NaCl. Большинство из наполнителей были выбраны благодаря их катионным характеристикам, когда при pH 6.0, как ClfA, так и AlPO4 оба являются отрицательно заряженными. Модифицированный анализ Лоури использовали для исследования процента связывания белка. В соответствии с анализом, наблюдалось, что ни один из наполнителей не показывали заметное улучшение по сравнению со 150 мМ NaCl контроля.
ПРИМЕР 3: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: РЕФЕРАТ
[0279] Полагают, что ClfA, как правило, является нестабильным белком, что означает, что он легко подвергается гидролизу или "клипированию" между N1 доменом и N2 доменом для создания, по меньшей мере, двух фрагментов, один из которых содержит N1 домен, и другой, который содержит N2N3 домены. Под стабильностью, подразумевают, что существует относительное содержание негидролизованого ClfA, который содержит, главным образом, неразложившийся ClfA, по сравнению с продуктами разложения, которые включают, например, N1 и N2N3 пептидные фрагменты. Более значительное относительное содержание, главным образом, неразложившегося ClfA означает, что белок более стабильный.
[0280] Наблюдалось, что ClfA белок в жидком препарате (выше), претерпевшем клипирование между N1 и N2N3 доменами, как обнаружено с помощью гельпроникающей ВЭЖХ. После скрининга с тщательно выбранными наполнителями, исследовали лиофилизацию, как альтернативу жидким препаратам, основываясь на нестабильности жидкости. Четыре партии вещества лекарственного средства ClfA были исследованы, используя модифицированный лиофилизированный препарат из 10 мМ сукцината, pH 6,0, 0,01% полисорбата 80 и 4,5% сахарозы (объемообразующий агент) в воде для инъекций (WFI) (маленькое количество или без NaCl). Результаты для всех четырех партий показали, что, высушенный при замораживании, препарат ClfA успешно стабилизированного белка от клипирования в течение вплоть до трех месяцев при температуре реального времени и увеличенных (37°C) температурах. Анализ препарата, используя ВЭЖХ с обращенной фазой, продемонстрировал, что лиофилизация предотвращала другие модификации, такие как деамидирование и окисление, на всем протяжении наблюдаемых моментов времени. Кроме того, исследования эффективности in vitro (то есть, BIOVERIS исследования) обнаружили, что ClfA сохранял свою эффективность в течение свыше трех месяцев.
[0281] Кроме того, лиофилизированные продукты лекарственного средства характеризовали, используя биофизические (pH, влажность по Карлу Фишеру кулонометрии [смотри Scholz, Eugen, Fresenius' J. of Anal. Chem., 348 (4): 269-271, Apr. 1994], OD350, осмоляльность, круговой дихроизм, УФ спектроскопия поглощения, дифференциальная сканирующая калориметрия) способы, способы разделения (ВЭЖХ), и способы определения эффективности (BIOVERIS) для контролирования влияний высушивания при замораживании на препарат (продукт лекарственного средства) и на сам белок (субстанцию лекарственного средства). Анализы с использованием многочисленных способов подтвердили, что характеристики белка были аналогичными до и после лиофилизации. Кроме того, проводили эксперименты по встряхиванию, замораживанию-размораживанию и скринингу наполнителей, как предварительную оптимизацию для лиофилизированного препарата.
ПРИМЕР 4: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ЛИОФИЛИЗАЦИЯ
[0282] Перед лиофилизацией, флаконы наполняли 650 мкл жидких препаратов. После лиофилизации, необходимо определить объем восстановления с помощью шприца, таким образом, чтобы объем дозирования следует брать с учетом мертвого пространства внутри шприца. В данном эксперименте шприцы наполняли 0,55, 0,60, 0,65 и 0,70 мл разбавителя. Разбавитель выдавливали в лиофилизированные флаконы и восстановленную жидкость втягивали назад в шприц. Затем жидкость дозировали и взвешивали на весах. Принимая, что плотность жидкости приблизительно составляет 1 г/мл, определили, что флакон должен содержать приблизительно 0,65 мл вакцины, для того чтобы доставить приблизительно 0,5 мл вакцины пациенту. Объемы сверх 0,5 мл являются приемлемыми, а объемы меньше, чем приблизительно 0,5 мл являются нецелесообразными.
[0283] Фильтрационное восстановление предварительно лиофилизированных жидких препаратов из двух партий L36051-81-1 и L36051-81-2 контролировали, используя гельпроникающую ВЭЖХ. Применяемым фильтром был Millipore с 0,22 мкм PVDF мембраной. Восстановление ClfA для обеих партий составляло >99%.
[0284] Лиофилизатор Virtis Genesis EL35 Lyophilizer использовали для всех препаратов, описанных в данном документе. Параметры иллюстративных и не ограничивающих циклов прохождения лиофилизации приведены в таблице 11. Партия L36051-44 (DS L35812-59) не включала стадию ренатурации, тогда как остальные три партии были получены со стадией ренатурации.
|
[0285] Влажность измеряли по методу Карла Фишера, используя кулонометр Бринкмана, связанный с образцом печи. Сухой газообразный азот использовали для переноски влаги из образца в ячейку Карла Фишера. Безводный стандарт с 5,5% влаги использовали для контролирования системного выполнения. Используя печь, стандарт воды измеряли при 230°C и высушенные при замораживании образцы измеряли при 115°C. В основном, успешный цикл высушивания при замораживании включает минимальное количество воды, в то время как все другие желательные характеристики продукта сохраняются.
[0286] Десять случайно выбранных пост-лиофилизированных препаратов были проверены с каждой партии и оценены по визуальным характеристикам. Качество таблетки от серии к серии было сопоставимым, однако, партия L36051-44, которая была получена без стадии ренатурации, показала большую усадочную деформацию, чем другие партии, которые включали стадию ренатурации. Вобщем, таблетки были белыми и пористыми, демонстрируя хорошую структурную целостность. Визуальные характеристики 10 индивидуальных лиофилизированных продуктов из одной конкретной партии препарата (с ренатурацией) представлены в таблице 12.
|
[0287] Физические отличительные свойства препаратов были описаны перед и после лиофилизации. Образцы были восстановлены после лиофилизации приблизительно 630 мкл солевого раствора (партия 44 была восстановлена 150 мМ NaCl, тогда как другие партии были восстановлены 50 мМ NaCl). Осмоляльность после восстановления была близка к физиологическому значению ~290 мосмоль, когда использовали 50 мМ NaCl. Наблюдалось, что значения pH сохранялось равным 6,0±0,3, когда лиофилизированные таблетки были восстановлены разбавителем. Более того, время восстановления всех партий составляло меньше, чем 30 секунд. Недолговечные микро-пузырьки генерировались при добавлении разбавителя к таблеткам, как результат заполнения азотом во время закупоривания.
[0288] Оборудование TA Instruments Modulated DSC использовали для характеристики температуры стеклования (Tg') пред-лиофилизированной жидкости. Tg' определяют, как температуру, при которой аморфное твердое тело достигает хрупкого, стекловидного состояния, с высоким уровнем водородных связей при охлаждении. Выше Tg', становится возможной большая молекулярная текучесть. Экспериментальный сбор данных Tg' является важным для оптимизации цикла лиофилизации для того, чтобы достичь получения таблетки высокого качества и стабильного продукта. Модулированный ДСК прибор использовали для Tg' измерений из-за их способности сканировать при температурах ниже нуля.
[0289] Стеклование (Tg') и содержание влаги в таблетках принимали во внимание во время оптимизации процедуры лиофилизирования. Важно, что образец находится выше своего стеклования во время фазы ренатурации лиофилизирования. Стадия ренатурации при лиофилизировании проходила при -10°C, которая является более высокой Tg' - 34,6°C±0,8°C для всех препаратов. Кроме того, важным является то, что процедура лиофилизации в достаточной мере высушивает таблетку, чтобы предотвратить реакции между белками и водой, таким образом, понижая стабильность продукта и срок хранения. Процедура лиофилизации в результате дала меньше, чем 1% (то есть, 0,42%±0,19%) воды для всех препаратов.
ПРИМЕР 5: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ТЕРМОСТАБИЛЬНОСТЬ
[0290] MICROCAL VP-дифференциальный сканирующий калориметр (ДСК) использовали для характеристики свойственной термостабильности ClfA. Быстрое тепловое возрастание от 10°C до 100°C выявило температуру, при которой белок плавится (Тпл.) и изменяется необходимая энтальпия (ΔH) для этапа разворачивания (плавления). Это дает информацию о характеристиках складчатости белка (то есть о вторичной и третичной структурах) и, так или иначе, конформация изменялась после лиофилизации.
[0291] Дифференциальную сканирующую калориметрию (ДСК), используя MicroCal Capillary DSC, выполняли перед и после лиофилизирования партий ClfA, чтобы сравнить температуры плавления (Тпл.) препаратов. Все исследованные партии выявили сходные значения Тпл и энтальпии разворачивания (ΔH) перед и после лиофилизации, предполагая, что общая складчатость белка не меняется от перед- до после- лиофилизации. Средняя Тпл. перед лиофилизацией составляла 55,2°C±0,14°C по сравнению с 55,2°C±0,16°C после лиофилизации. Средняя ΔН перед лиофилизацией составляла 1,90×106±0,12×106 кал/моль/°C по сравнению с 1,90×106±0,11×106 кал/моль/°C после лиофилизации.
ПРИМЕР 6: ФОРМУЛЯЦИЯ CLFA ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА: ВТОРИЧНАЯ СТРУКТУРА АНТИГЕНА
[0292] Круговой дихроизм (CD) использовали, чтобы оценить вторичную структуру белка в каждом препарате перед и после лиофилизации. Все эксперименты проводили на спектре-поляриметре Jasco J-810. Параметры эксперимента для сканирований CD включали диапазон длины волны от 190 нм до 260 нм, скорость сканирования - 20 нм/мин., время ответа - 2 секунды, ширина полосы - 1 нм и накопление - 3. Идентичную буферную матрицу, которая содержит сукцинат, сахарозу и NaCl, использовали для фонового вычитания.
[0293] Круговой дихроизм (CD) обеспечивает спектральные «отпечатки пальцев» вторичной структуры белка, такой как α-спираль и β-лист. Сравнение партий ClfA перед и после лиофилизации показало, что общие виды спектров перед и после лиофилизации не изменялись, предполагая, что все партии сохранили вторичную структуру на всем протяжении процедуры лиофилизации и восстановления.
ПРИМЕР 7: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ТРЕТИЧНАЯ СТРУКТУРА АНТИГЕНА
[0294] Вторую производную УФ спектроскопии поглощения использовали, как другой способ для исследования третичной структуры антигена, чтобы оценить стабильность свойственную белку перед и после лиофилизации. Спектры УФ-видимой области длин волн были получены в диапазоне от 200 нм до 400 нм на спектрометре Agilent 8453 УФ-видимой области с диодной матрицей. Для всех экспериментов использовали кварцевую кювету с длиной пробега 1-см с объемом 100 мкл.
[0295] Анализ спектров выполняли, используя программное обеспечение CHEMSTATION™ (Agilent). Спектры второй производной были получены, используя информационный фильтр из девяти точек и подходящий полином третей степени Савицкого-Голая. Производные спектры были интерполированы на 99 точек данных между каждым одно-нанометровым интервалом, обеспечивая эффективное разрешение приблизительно 0,01 нм при не агрегирующих условиях. Microcal Origin™ 6.0 использовали для выбора положения пиков дифференцированного спектра. Положения пиков, соответствующие аминокислотным остаткам фенилаланина, тирозина и триптофана, были идентифицированы и графически нанесены как функция температуры. [0296] В трех из четырех партий (партии - 44, - 81-1 и - 81-2), после лиофилизации были видны некоторые различия в фенилаланиновой/тирозиновой областях (260 нм ~ 270 нм). Однако, партия - 72 показала хорошее перекрывание. Данная партия содержала наивысший остаточный NaCl (перенесенный из объемных матриц).
ПРИМЕР 8: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: СТРУКТУРНАЯ СТАБИЛЬНОСТЬ: N1 КЛИПИРОВАНИЕ
[0297] Гельпроникающую ВЭЖХ использовали, чтобы оценить начальное качество продукта лекарственного средства перед лиофилизацией, восстановленного продукта лекарственного средства после лиофилизации, и восстановленный продукт лекарственного средства выдерживали при различных температурах в течение длительного времени для изучения стабильности. Данный способ способен детектировать вид ClfA различных размеров, включая мономер, димер, олигомеры (большие, чем димеры) и продукты разложения (вследствие расщепления между N1 и N2N3 доменами), поэтому его использовали, как одну из первостепенных методик для сравнения стабильностей жидких препаратов перед лиофилизацией с их лиофилизированными аналогами.
[0298] Стабильность жидких и лиофилизированных препаратов ClfA при 2-8°C, 25°C и 37°C контролировали, используя два ВЭЖХ метода. Гельпроникающая ВЭЖХ была использована для детектирования расщепления N1 и N2N3 доменов, тогда как ВЭЖХ с обращенной фазой была использована, чтобы контролировать какие-либо химические деградации (то есть, дезамидирование, окисление) белка со временем.
[0299] На фигуре 2, панелях A, B, C и D изображены кинетические графики первого порядка четырех лиофилизированных партий ClfA по сравнению с их жидкими аналогами, все выдерживали при 2-8°C, 25°C и 37°C и контролировали во времени, используя гельпроникающую ВЭЖХ. Результаты были нанесены на график как ln[C] относительно времени, где C представляет собой концентрацию интактного антигена (димер+мономер), в тоже время, исключая расщепленные продукты разложения. Все четыре партии показали постоянство стабильности лиофилизированного продукта при всех трех температурах выдерживания, что показано с помощью минимального изменения в C в течение вплоть до трех месяцев. В отличие от них, жидкие образцы перед лиофилизацией показывают пропорциональное возрастание скорости деградации с возрастанием температур. Следует отметить, что жидкий аналог партии L36051-44 (L36051-37-1) представляет собой жидкий препарат (как противоположный к долиофилизированному препарату), содержащий 10 мМ сукцинат, pH 6,0, 0,01% полисорбат 80 и 150 мМ NaCl (Фигура 2A). Однако, общие отклонения партии - 37-1, как функции от температуры, являются аналогичными к тем, что у жидкостей перед лиофилизацией.
[0300] Фигура 3 демонстрирует типичные хроматограммы гельпроникающей ВЭЖХ лиофилизированной DS L40184-61 при t=0 по сравнению с таблетками, которые хранили при 2-8°C, 25°C и 37°C в течение трех месяцев. Профили накопленных хроматограмм выглядели идентичными без видимого возрастания пиков димера или продукта разложения. Другие три лиофилизированные партии показали аналогичные результаты.
[0301] Проводили сравнение партии жидкого (пред-лиофилизированного) и лиофилизированного ClfA препарата. Типичные хроматограммы гельпроникающей ВЭЖХ представлены на фигуре 4, сравнивая лиофилизированный препарат с пред-лиофилизированными жидкостями после того, как их хранили при 2-8°C, 25°C и 37°C в течение четырех недель. Лиофилизированные образцы показали хорошие перекрестные наложения при всех трех температурах хранения, в особенности поблизости области продукта разложения непосредственно справа от главного пика мономера. В отличие от них, жидкие препараты показали заметное увеличение пиков продукта разложения (фигура 4, кружочками). Кроме того, лиофилизированные пики показали незначительное присутствие олигомерных пиков (слева от главного мономерного пика, фигура 4), отличительная черта которых была общей для всех лиофилизированных партий.
ПРИМЕР 9: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: СТРУКТУРНАЯ СТАБИЛЬНОСТЬ: МОДИФИКАЦИИ БЕЛКА
[0302] ВЭЖХ с обращенной фазой представляет собой аналитический метод, который часто используют для получения характеристики качества и целостности белка. Разделение веществ, определяемых при анализе, основывается на различиях в гидрофобности различных видов, которые могут значительно варьировать от белка к белку. Как результат, анализ ВЭЖХ с обращенной фазой, как правило, может давать хорошее разделение между интересующим белком, например, белком продуктов разложения, белок с модификациями последовательности (такими как дезамидирование и окисление), и загрязнения белка остаточными клетками-хозяевами, в добавление к расщеплению. Данный анализ был использован для получения данных о качестве белка в течение времени исследования стабильности.
[0303] Как и данные гельпроникающей ВЭЖХ, хроматограммы с обращенной фазой показывают аналогичные профили для лиофилизированного продукта после трех месяцев при 37°C, 25°C и 2-8°C, по сравнению со свежеприготовленными формулами.
[0304] Во время проведения изучения лиофилизированной стабильности контролировали pH, влажность и OD350. Значения pH следует оставлять в пределах ±0,03 единицы от целевого pH, и влажность должна составлять <3%. OD350 является мерой рассеянного света за счет агрегированных частиц. Как правило, отсутствие детектируемых агрегатов будет возвращать OD350 несколько <0,03. Фигура 5, панели A, B и C представляют собой данные, комбинированные от многократно лиофилизированных партий, которые демонстрируют, что все три параметра показывают хорошую стабильность в течение более трех месяцев.
ПРИМЕР 10: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ЭФФЕКТИВНОСТЬ КАК ОПРЕДЕЛЕНО МЕТОДОМ
[0305] Исследование эффективности in vitro использовали, чтобы оценить персистирование функционального эпитопа ClfA белка в выбранные моменты времени при изучении стабильности. Для этой цели была использована BIOVERIS платформа. В данном анализе использовали «сэндвич» формат, в котором одно моноклональное антитело (mAb 12-9) было использовано для захвата антигена и другое моноклональное антитело (mAb 15ЕС6), выведенное против отличающегося эпитопа, было использовано для обнаружения присутствия антигена с ECL детектированием. Моноклональное антитело 12-9 является антителом, которое идентифицирует и связывает N3 домен ClfA, в то время как mAb 15ЕС6 идентифицирует и связывает N2 домен ClfA.
[0306] Систему сравнительного анализа антитела BIOVERIS использовали, чтобы контролировать эффективность ClfA в партиях L36051-81-1 (DS L40184-61) и L36051-81-2 (DS L40184-62) в течение вплоть до трех месяцев. Как лиофилизированные, так и пред-лиофилизированные жидкие препараты показали отсутствие снижения эффективности в течение 3-месячного периода при 2-8°C, 25°C и 37°C.
ПРИМЕР 11: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ВЛИЯНИЕ НАПОЛНИТЕЛЕЙ
[0307] После того, как стабильность ClfA была установлена, планировалось дополнительное изучение, чтобы (1) установить технические требования для компонентов препарата, (2) провести скрининг для наполнителей, чтобы оптимизировать внешний вид таблетки (3) понять процедуру формуляции в контексте процесса разработки, и (4) исследовать устойчивость к замораживанию-размораживанию субстанции лекарственного средства и продукта лекарственного средства.
[0308] Титрование полисорбата 80 (PS80) проводили в лиофилизированной буферной матрице, содержащей 0,2 мг/мл ClfA и 10 мМ сукцината, pH 6,0, тогда как содержание сахарозы варьировало от 3% до 4,5% до 6% масс./об. Концентрации PS80 находились в диапазоне от нуля (0) до 0,005% до 0,01% об./об. Данный эксперимент выполняли, чтобы (1) определить необходимость присутствия полисорбата в пред-лиофилизированном жидком препарате, (2) установить конкретную концентрацию для полисорбата в пред-лиофилизированном жидком препарате, и, кроме того, (3) установить конкретную концентрацию для сахарозы в пред-лиофилизированном жидком препарате.
[0309] Эксперименты по агрегации выполняли, варьируя концентрациями PS80 и сахарозы. Фигура 6, панели A, B и C показывают процент димера, процент мономера и процент продукта разложения (расщепления), результаты гельпроникающей ВЭЖХ после 24 часов перемешивания при комнатной температуре для L40184-61 (200 мкг/мл ClfA, 6% сахарозы, 10 мМ сукцината pH 6,0, 0,005% PS 80) и L401840-62 (200 мкг/мл ClfA, 4,5% сахарозы, 10 мМ сукцината pH 6,0, 0,01% PS 80) препаратов. Препараты, не содержащие PS80, продемонстрировали увеличение процент образования димера после выдерживания по отношению к t=0 образцу (Фигура 6D). В присутствии даже наименьшего количества PS80 (0,005%), количество продукта димеризации составляет меньше, чем тот, что при t=0, предполагается, что PS 80 был полезным для препарата. Кроме того, анализ гельпроникающей ВЭЖХ контроля "без PS 80" показал присутствие олигомеров более высокого порядка (больше, чем димеры) после выдерживания, тогда как образцы, содержащие PS80, нет. Более того, рекомендованное содержание полисорбата 80 было установлено при 0,01±0,005%. Переменные количества сахарозы (3, 4,5 и 6%) не показали какие-либо различия в SEC данных. Кроме того, представлено, что на процент мономера и продуктов разложения, в значительной степени, не оказывает воздействия присутствие или отсутствие PS 80 или изменения количества сахарозы.
[0310] Смешанные исследования проводили, чтобы определить какие из разнообразных наполнителей будут иметь побочное действие на ClfA во время стадии формуляции/смешивания в процессе производства. Разнообразные наполнители включают сахарозу - 0% и 5%, трегалоза - 0% и 5%, и комбинацию сахарозы и маннита, в которой 4% сахарозы и 1% маннита. Наполнители выбирали на основе их общепринятого использования в лиофилизации. Для данных наполнителей, основа препарата включала ClfA - 0,3 мг/мл, 10 мМ сукцината, pH 6,0 и полисорбат 80 - 0,01%. Образцы были сформулированы, оставлены на всю ночь при 2-8°C и начинали исследования со следующего утра. Препараты размещали в 30 мл стеклянные флаконы типа 1 фирмы Shott с West 4432 серыми бутиловыми пробками и устанавливали на встряхиватель VWR Microplate Shaker. Флаконы перемешивали при постоянной скорости 500 оборотов в минуту при комнатной температуре, и проверяли через t=0, 2, 4, 8, и 24 часа, используя гельпроникающую ВЭЖХ, которую использовали, как первичный анализ.
[0311] Некоторые партии (L36051-96-1, L36501-96-2, L36051-96-3, L36051-96-4, L36051-100-1 и L36051-100-2) были проверены в смешанной исследовании, чтобы определить, какое влияние сахароза, трегалоза и сахароза/маннит имеют на стабильность ClfA, когда их смешивают в течение 24 часов при комнатной температуре. Фигура 7, панели A, B и C демонстрирует процент продукта разложения (расщепления), процент димера и процент мономера, представленные с помощью гельпроникающей ВЭЖХ для каждого препарата в течение периода времени процесса. В образцах с одной только сахарозой и сахарозой/маннитом не было видно значительного разложения; однако, препарат с трегалозой показал значительное увеличение разложения. Скорость димеризации была сравнимой для обоих DS препаратов ClfA только с одной сахарозой, а зависящее от партии возрастание димеров было видно с трегалозой и сахарозой/маннитом. Изменения в мономере отражались изменениями в продуктах разложения и димерах.
[0312] Различные комбинации сахарозы, метионина, глицина и маннита были сформулированы с ClfA и впоследствии исследованы на стабильность ClfA, используя ускоренные тесты на стабильность. Ускоренные тесты на стабильность включают хранение препарата (жидкого или лиофилизированного) при температуре, которая является более высокой, чем планируемая температура хранения, и контролирование ClfA белка в течение времени для отметок разложения. В случае лиофилизированного ClfA, рекомендуемая температура хранения составляет 2-8°C, таким образом, 25°C и 37°C следует рассматривать как "ускоренные" условия. Восемь препаратов (смотри таблицу 13), каждый из которых содержал ClfA - 0,300 мг/мл, 10 мМ сукцината, pH 6,0 и полисорбат 80, и содержащие различные комбинации сахарозы, метионина, глицина и маннита, были подвергнуты исследованию их влияния на (1) стабильность пред-лиофилизированных жидких ClfA, (2) стабильность лиофилизированных таблеток, и (3) внешнего вида лиофилизированной таблетки. Метионин был выбран за его способность предотвращать окисление белка, глицин - за его общие стабилизирующие свойства за счет запрещенного объема, и маннит за его склонность совершенствовать внешний вид таблетки. Жидкие препараты размещали на ускоренную стабильность и контролировали в течение одной недели, используя гельпроникающую ВЭЖХ, и ВЭЖХ с обращенной фазой через две недели. Лиофилизированные таблетки хранили при 2-8°C и 37°C и контролировали через два месяца. Внешний вид таблеток оценивали, визуально относительно препарата только с сахарозой.
|
[0313] Данные гельпроникающей хроматографии для жидких образцов при 2-8°C, 25°C и 37°C через одну неделю показали, что ни один из проверенных наполнителей не улучшил стабильность ClfA (в пределах расщепления), сравнивали с контролем, содержащим только одну сахарозу (препарат - 109-1). При t=0, все препараты имели очень сходные профили. Все препараты показали незначительную потерю в высоте основного пика, как функции от температуры, связанную с сопутствующим возрастанием меньших пиков, расположенных по обе стороны основного пика, возникшие при разложении продуктов. Наблюдалось, что присутствие различных наполнителей не показывает какие-либо заметные улучшения над препаратом только с одной сахарозой.
[0314] Кроме того, препараты были лиофилизированными и проверенными на внешний вид таблетки. По сравнению с контролем только с одной сахарозой, ни один из наполнителей в исследуемых пропорциях не оказывает какие-либо улучшения в визуальном качестве таблеток. Лиофилизированные таблетки, кроме того, подвергали исследованию на стабильность и проверяли на разложение (расщепление), используя гельпроникающую ВЭЖХ через два месяца при 2-8°C и 37°C. Результаты показали, что все препараты были стабильными.
ПРИМЕР 12: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA: ЗАМОРАЖИВАНИЕ-РАЗМОРАЖИВАНИЕ
[0315] Изучение замораживания-размораживания выполняли на нескольких партиях ClfA белка (то есть, L40184-63, -64 и -65). Препарат содержал 0,2 мг/мл ClfA, 10 мМ сукцината, pH 6,0, 4,5% сахарозы масс./об. и 0,01% полисорбата 80 об./об. Исследование разделили на три ветви: (1) 3х замораживание-размораживание не сформулированного ClfA (субстанция лекарственного средства); (2) 3х замораживание-размораживание сформулированного ClfA (продукт лекарственного средства); и (3) замороженная субстанция лекарственного средства и размороженный три раза и сформулированный до продукта лекарственного средства после каждого размораживания. Анализ выполняли, используя гельпроникающую ВЭЖХ.
[0316] Целью исследования было оценить стабильность белка после многократных замораживаний-размораживаний, как субстанции лекарственного средства, так и продукта лекарственного средства. Образцы анализировали после каждого размораживания, используя гельпроникающую ВЭЖХ для обнаружения каких-либо изменений в разложении (расщеплении) ClfA. Наблюдалось, что три эпизода замораживания-размораживания не показали возрастания разложения при третьем размораживании для двух из трех исследуемых партий. В частности, одна партия показала большие изменения в разложении, чем другие.
ПРИМЕР 13: ПРЕПАРАТ ЛИОФИЛИЗИРОВАННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА CLFA/CP5/CP8 (ТРИ-АНТИГЕН)
[0317] На основе благоприятного исхода стабилизации ClfA путем лиофилизации, дополнительно продукты лекарственного средства были сформулированы путем комбинирования ClfA с конъюгатами СР5 и СР8 стафилококковых антигенов и CRM. Некоторые варианты осуществления жидкого препарата (перед лиофилизацией или после лиофилизации) содержат 200 мкг rClfAm и 100 мкг каждого из CP5-CRM197 и СР8-CRM197 конъюгатов на 0,5 мл продукта. В некоторых вариантах осуществления жидкий препарат содержит 100 мкг rClfAm и 50 мкг каждого из CP5-CRM197 и CP8-CRM197 конъюгатов на 0,5 мл продукта.
[0318] Различные объемообразующие агенты были оценены, включая сахарозу, маннит и трегалозу. На основе смешанных исследований наблюдалось, что сахароза проявляет наилучшую стабильность, внешний вид таблетки и кратковременную стабильность в жидкости.
[0319] Кратковременная ускоренная стабильность жидких препаратов не основе трех партий при переменных pH предположила, что pH 6,0 является оптимальным. СР5- и CP8-CRM197 конъюгаты были стабильными в пределах pH диапазона от 5,0 до 7,0.
[0320] Различные буферные системы, буфер в которых имеет pH около 6, включая сукцинат и гистидин, были исследованы. Отличия в температуре плавления (Тпл.) rClfAm наблюдали, используя гистидиновый или сукцинатный буферы. Оба буфера были совместимыми как с СР5, так и с СР8 CRM197 конъюгатами. 10 мМ сукцинатный буфер (pH 6,0) был выбран, как лучший.
[0321] Полисорбат 80 (PS80) исследовали как потенциальный стабилизатор в исследовании встряхивания. Исследования встряхивания подражает скалыванию и ударам при транспортировке, которые, как правило, могут приводить к возрастанию димеров или олигомеров более высокого порядка. Результаты данных экспериментов предполагает, что PS80 предотвращает агрегацию ClfA. 0,01% (0,005 до 0,15%) полисорбата 80 был выбран, как лучший.
[0322] Для восстановления лиофилизированного продукта был выбран разбавитель, который достигает физиологическую осмоляльность (то есть, от 250 до 300 мосмоль). В одном варианте осуществления, 60 мМ NaC был выбран как разбавитель. Основываясь на способности доставлять 0,5 мл дозы после восстановления, объем наполнения был выбран от 0,64 до 0,66 мл на флакон. Для обеспечения восстановленного объема от 0,64 до 0,66 мл, чтобы доставить дозу 0,5 мл, объем наполнения был выбран от 0,66 до 0,68 мл на шприц.
[0323] Определено, что разбавитель препарата является оптимальным при 60 мМ концентрации для восстановления лиофилизированной три-антигенной таблетки, чтобы достичь близкой к физиологической осмоляльности ~300 мосмоль. 4,5% сахарозы в препарате делает значительный вклад в осмоляльность жидкого продукта лекарственного средства, давая осмоляльность примерно 200 мосмоль без какой-либо дополнительной соли.
[0324] Параметры лиофилизации были выбраны, чтобы сформировать таблетку, которая является белой и пушистой, с неоплавленной задней частью или без усадочной деформации, и которая дает прозрачный раствор, имеющий pH 6,0±0,3 при восстановлении 60 мМ NaCl.
ПРИМЕР 14: ПРОЦЕСС ФОРМУЛИРОВАНИЯ ТРИ-АНТИГЕННОГО ПРОДУКТА ЛЕКАРСТВЕННОГО СРЕДСТВА
[0325] Примерный жидкий препарат, содержащий 10 мМ сукцината, ppH 6,0, 4,5% сахарозы и 0,01% полисорбата 80, приготовили, фильтровали через Millipore 0,22 мкм PVDF мембрану, аликвотированный 650 мкл на 2 мл флакона, и лиофилизировали, используя цикл, описанный ниже. Лиофилизированные таблетки были восстановлены, используя шприцы, предварительно наполненные 60 мМ NaCl, как разбавителем.
[0326] В одном варианте осуществления, жидкий препарат был скомбинирован как приведено дальше: (a) 25% сахарозы, 100 мМ сукцината pH 6,0, 1% PS 80 и WFI были скомбинированы так, чтобы получить 10 мМ сукцината, 4,5% сахарозы и 0,01% PS 80. (b) Соответствующее количество rClfAm, СР5 конъюгата и СР8 конъюгата добавляли к смеси (а), которая затем была (c) стерилизована через фильтр 0,22 мкм. (d) Каждый из лиофилизированных флаконов заполняли 0,65 мл ± 0,1 мл фильтрованного раствора, (e) лиофилизировали в соответствии с параметрами из таблицы 14, (f) закупоривали, (g) запечатывали и (h) маркировали. Лиофилизированный продукт лекарственного средства хранили при 2-8°C.
|
[0327] Два экспериментальных проекта выполняли, чтобы определить влияние активных и неактивных ингредиентов на процесс формуляции, выход после фильтрации и лиофилизацию. Ключевыми переменными были концентрация rClfAm и СР5 и СР8 конъюгатов (±30% целевых). Показано, что полный выход данных компонентов от формуляции до лиофилизации составляет больше, чем 95% для всех препаратов. Данные анализа (используя программное обеспечение DESIGN EXPERT) предположили следующее: (a) чистота rClfAm не оказывается под воздействием концентрации rClfAm в пределах ограничений анализа, где низкая доза (70 мкг/мл) демонстрировала максимум измеренной чистоты ~93%, и высокая доза (520 мкг/мл) демонстрировала максимум измеренной чистоты ~97%; (b) концентрация СР5 и СР8 конъюгатов может влиять на выход конкретных конъюгатов, но несмотря на остаток в пределах возможности анализа; и (c) все три компонента не находятся под влиянием концентрации PS 80. Результаты приведены в таблице 15.
|
[0328] В других экспериментах pH (диапазон от 5,7 до 6,3, при целевом значении, которое составляет 6,0), сукцинат (от 5 мМ до 15 мМ, при целевом значении, которое составляет 10 мМ), полисорбат 80 (от 0,005% до 0,15%, при целевом значении, которое составляет 0,01%), и сахароза (от 3,0% до 6,0%, при целевом значении, которое составляет 4,5%) варьировали в препарате. Результаты, показанные в таблице 16, демонстрируют, что критерии получения активных продуктов лекарственного средства (rClfAm (397±6,7 мкг/мл), CP5-CRM197 конъюгат (179,8±64,0 мкг/мл), и CP8-CRM197 конъюгат (188,2±10,5 мкг/мл)) находятся в диапазоне контроля.
|
[0329] Данные для партий представляющих препарат показаны в таблицах 17 и 18. Три показательных партии были сформулированы, заполнены и лиофилизированы с высокой дозой (400 мкг/мл rClfAm, 200 мкг/мл каждого из СР5- и CP8-CRM197 конъюгатов), и две с низкой дозой (200 мкг/мл rClfAm, 50 мкг/мл каждого из СР5- и CP8-CRM197 конъюгатов). Препараты получены с хорошим качеством с заданными критериями чистоты, эффективности, влажности, внешнего вида и pH. Эти данные были использованы, чтобы установить средний уровень доз.
|
|
ПРИМЕР 15: СТАБИЛЬНОСТЬ ПРОДУКТА ТРИ-АНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА
[0330] Исследование стабильности выполняли на шести партиях лиофилизированных три-антигенных препаратов. Некоторыми из ключевых исследований были хроматография с обращенной фазой (например, ВЭЖХ с обращенной фазой) для определения эффективности и чистоты rClfAm, и нефелометрия для определения эффективности CP5-CRM197 и CP8-CRM197. Лиофилизированные таблетки ставили на хранение при 2°C-8°C, 25°C и 37°C и анализировали в выбранные моменты времени. Таблетки восстанавливали непосредственно перед исследованием. Результаты исследований не показывают изменений в эффективности (концентрации) или чистоте rClfAm и эффективности (антигенные свойства) конъюгатов через четыре недели в сухой форме (фигуры 8 и 9). Концентрация и чистота rClfAm, и концентрация CP5-CRM197/CP8-CRM197 (антигенные свойства), кроме того, были определены, используя ВЭЖХ с обращенной фазой и нефелометрию, соответственно, в течение периодов вплоть до трех месяцев. Линейно-регрессионный анализ, выполненный на образцах, которые хранили при 2°C-8°C, показывает, что образцы являются стабильными в течение минимум шести месяцев (фигуры 8 и 9). Образцы были исследованы как с высоким (L36686-3-1 и L36686-25), так и с низким (L36686-3-2 и L360510195-2) дозированием (таблицы 19-22).
|
|
|
|
[0331] Кроме того, выполняли исследования по кратковременной стабильности. Лиофилизированные три-антигенные препараты восстанавливали 60 мМ NaCl разбавителем и выдерживали при комнатной температуре в течение разного времени, t=0, 4 часовой и 24 часовой моменты времени, которые были проанализированы на эффективность и чистоту rClfAm и эффективность CP5-CRM197/CP8-CRM197 (таблицы 23-25). Препараты с высокой дозой (400 мкг/мл rClfAm, 200 мкг/мл CP5-CRM197 и 200 мкг/мл CP8-CRM197) и низкой дозой (200 мкг/мл rClfAm, 50 мкг/мл СР5-CRM197 и CP8-CRM197) были исследованы. Обе дозы показали стабильность компонентов через 24 часа при комнатной температур (после восстановления), как видно на фигуре 10.
|
|
|
[0332] Кроме того, выполняли исследование по замораживанию-размораживанию. Продукт лекарственного средства с высокой дозой три-антигена (400 мкг/мл rClfAm, 200 мкг/мл CP5-CRM197 и 200 мкг/мл CP8-CRM197) подвергали трем циклам замораживания-размораживания и анализировали эффективность и чистоту для rClfAm и эффективность CP5-CRM197/CP8-CRM197. Фактически, для каждого компонента не наблюдалось изменения в концентрации, что говорит о том, что активные компоненты продукта лекарственного средства являются стабильными во время трех циклов (фигура 11, таблица 26).
|
ПРИМЕР 16: ПРОДУКТ CLFA/CP5/CP8/MNTC (ЧЕТЫРЕХАНТИГЕННОГО) ЛЕКАРСТВЕННОГО СРЕДСТВА: ХАРАКТЕРИСТИКА CLFA
[0333] Успешная стабилизация ClfA в три-антигенном препарате привела к разработке препаратов, которые дополнительно содержат S. aureus MntC белок. Кроме того, агглютинирующий фактор A был дополнен из T7 меченого варианта (rClfAm) к одному без метки (rmClfA). СР5- и CP8-CRM197 оставались такими же в составляющих белка-носителя и повторяющимися единицами сахарида.
[0334] Вследствие различных изменений в компонентах продукта лекарственного средства, систематический и рациональный подход был принят для формулирования нового продукта лекарственного средства, который был совместимым со всеми четырьмя активными компонентами. Активности включали пред-формуляционную характеристику антигенов, разработку обоснований для формуляции компонентов, демонстрацию стабильности и устойчивости сформулированного продукта лекарственного средства и разработку процесса формуляции. Исследования были спланированы вокруг следующих доз:
1. 400/400/200/200 мкг/мл - rmClfA/MntC/CP5-CRM197/CP8-CRM197, и
2. 200/200/100/100 мкг/мл - rmClfA/MntC/CP5-CRM197/CP8-CRM197.
[0335] Биофизическая характеристика, используя многочисленные ортогональные методы (круговой дихроизм, флуоресценцию, капиллярную дифференциальную сканирующую калориметрию и OD350) была выполнена на двух партиях rClfAm (L40184-77 и L40256-26; матрица: 10 мМ сукцината pH 6,0, 20 мМ NaCl) и на двух партиях rmClfA (L40227-36 и L40256-28; матрица: 10 мМ гистидина pH 6,5). Полученные в результате данные показали 1) сопоставимость между rClfAm и rmClfA, 2) от партии к партии постоянство каждого rClfA структурного компонента, и 3) обеспечение рамок для рабочего диапазона pH для продвижения вперед.
[0336] Круговой дихроизм (CD) был использован, как инструмент для сравнения разных партий rClfA при pH 6,0 и 7,0 (фигура 12). Сканирования CD при обеих pH показали, что все исследованные партии rClfAm и rmClfA имели подобные вторичные структуры, основанные на совмещениях спектров. Кроме того, CD расплава белков был выполнен, чтобы сравнить термостабильность партий, как функцию от pH. Результаты, представленные на фигуре 13, показывают, что все партии являются сравнимыми в контексте вторичной структуры. Результаты, кроме того, представили, что pH 5,0-7,0 является оптимальным диапазоном для формуляции, основываясь на данном методе.
[0337] Свойственная триптофану флуоресценция была использована, чтобы получить информацию о третичной структуре rClfAm и rmClfA. Партии обоих белков подвергали флуоресценции в расплавах, как функцию от pH, чтобы оценить термостабильность. Важно отметить, что rClfA имеют два триптофана, которые расположены на таком же N3 домене белка; следовательно, данные, полученные данным способом, расположены в данной области. Фигура 14A показывает, что все исследованные партии rClfA имели сравнимые термостабильности, подразумевая, что структуры также были подобными. Несвойственные флуоресценции расплавов, кроме того, были выполнены на различных rClfA партиях, используя гидрофобный краситель, 8-анилино-1-нафталинсульфоната (ANS). Когда структура белка раскрывается с повышением температуры, ANS связывается с вновь незащищенным участком белка, повышая интенсивность эмиссии. На фигуре 14B, температуры плавления на основании сигнала ANS являются подобными как функция от pH для всех исследованных партий белка. Данные ДСК подтвердили, что температуры плавления для всех партий rClfA были подобными как функция от pH (фигура 15), и что pH 5-7 является хорошим диапазоном для продвижения вперед. Кроме того, OD350 был использован для контролирования агрегации как функций от температуры и pH (фигура 16). Расплавы rmClfA партии L40256-29 (матрица: 10 мМ гистидина pH 6,5) как функция от pH показали, что случай агрегации, обнаруженный данным способом, был только при pH 4,0.
[0338] Две партии субстанций лекарственного средства (L40256-28, L40256-29) были использованы, чтобы оценить стабильность жидкого rmClfA в гистидине, предпочтительнее, чем сукцинате, как функция от pH. Препараты состояли из 400 мкг/мл rmClfA, 10 мМ гистидина (pH диапазон 5,5-7,5), 4,5% сахарозы и 0,01% полисорбата 80. Два дополнительных препарата состояли из 10 мМ сукцината, pH 6,5 как и в сравнении с гистидином pH 6,5, и 10 мМ фосфата, pH 8,0 как исследование с высоким pH (оба препарата, кроме того, содержали 4,5% сахарозы и 0,01% PS 80). Гельпроникающая ВЭЖХ была использована, чтобы контролировать расщепление rmClfA в течение шести недель при 25°C. Результаты показали, что гистидин pH ~6,5 демонстрировал наименьшую скорость разложения как в -28, так и в -29 партиях (фигура 17A). Данная скорость совпадала с той, что для сукцинатных pH 6,6 препаратов, демонстрируя, что гистидин был также совместимый с rmClfA, как и сукцинат. Более того, pH для всех препаратов оставался стабильным, и агрегация не была обнаруженной, используя OD350 на всем протяжении исследования (Фигура 17B).
ПРИМЕР 17: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ХАРАКТЕРИСТИКА MNTC
[0339] В отличие от ClfA, который является склонным к разложению путем гидролиза, MntC разлагается путем дезамидирования. Таким образом, является важным определить стабильность MntC в пределах диапазона pH. Эксперименты по свойственной триптофану флуоресценции, выполненные с MntC, показали, что два основных случая выполнялись с Тпл.1 при 40-55°C и Тпл.2 при 65-75°C (Фигура 18). Исследование показало, что Тпл.1 при pH 5,0 и 6,0 были самыми высокими, после которых pH 7,0. Данные показали рабочий диапазон pH 5,0-7,0. Кроме того, выполняли ДСК для типичной партии MntC. Характерные термограммы показывают два основных термических случая, которые дополнительно могут быть развернуты (фигура 19). Отслеживая первую температуру плавления (Тпл.1), становится очевидным, что pH 5,0 и 6,0 имеют самую высокую термическую стабильность, а затем при pH 7,0 (фигура 19). В согласованности с результатами флуоресценции, эти данные предполагают рабочий диапазон pH 5,0-7,0. OD350 данные также подтверждают эти наблюдения (фигура 20). Анализ определения с использованием ионообменной ВЭЖХ подтвердил, что высокий pH и высокая температура повышали скорость дезамидирования MntC.
ПРИМЕР 18: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: РАЗРАБОТКА ПРЕПАРАТА (БУФЕР)
[0340] В три-антигенных препаратах, описанных выше, субстанции СР5 и СР8 конъюгата лекарственного средства были предоставлены в сукцинате при pH 7,0. Сукцинатная буферная система, однако, не проявляет хорошую буферную емкость при более низких pH. По этой причине эксперименты выполняли с СР5 и СР8 конъюгатами, сформулированными в 10 мМ гистидине при pH 6,7. Так как субстанции конъюгата лекарственного средства не фильтруются хорошо при pH<6,5, получая в результате замедленную фильтрацию и потерю конъюгированного белка, предпочтение отдавалось более высоким pH, чем 6,5. Это стало движущей силой для оценки rmClfA, MntC и препаратов продукта лекарственного средства в гистидине для единообразия.
[0341] Из исследований пред-формуляционных характеристик было определено, что рабочий диапазон pH как для rmClfA, так и MntC составлял 5-7. Изменение DS матрицы конъюгата к гистидину делало необходимым определение данной буферной системы в продукте лекарственного средства. Скорости разложения антигенов были определены в четырехантигенном препарате как функция от времени, чтобы установить оптимальный pH препарата. Эксперименты по активации проводили, чтобы определить необходимость поверхностно-активного вещества в препарате. Ожидаемые для лиофилизации, стабилизаторы и объемообразующие агенты оценивали на совместимость с антигенами.
[0342] Четырехантигенные препараты с высокой дозой, содержащие 400/400/200/200 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197 были изготовлены как функционирующие в pH гистидинового буфера. ВЭЖХ с обращенной фазой была использована для обнаружения разложения rmClfA белка, и ионообменная ВЭЖХ была использована для обнаружения разложения MntC. Фигура 21 представляет характерные хроматограммы двух белков и как с их помощью контролировали компоненты разложения. Для rmClfA фрагменты расщепления белка были обнаружены справа от основного пика белка, тогда как для MntC, пик дезамидированного продукта может быть найден слева от основного пика. Оба белка показаны на фигуре 21 как разрушающиеся со временем при 25°C.
[0343] Стабильности препаратов контролировали в течение 0, 1 и 2 недель при 2-8°C и в течение 0, 3 и 7 дней при 25°C. При 25°C rmClfA показал, что возрастание pH снижало скорость расщепления белка (фигуры 22A и B). Наоборот, возрастание pH снижало скорость дезамидирования MntC (фигуры 22C и D). Оба механизма значительно замедляются при 2-8°C, хотя pH-зависимые отклонения оставались постоянными.
[0344] Антигенные свойства СР5- и CP8-CRM197 конъюгатов контролировали при разных pH при 2-8°C и 25°C, используя нефелометрию. При 2-8°C, оба конъюгата сохраняли антигенные свойства в течение 2-недельной продолжительности эксперимента (фигуры 23A и B). При 25°C, CP5-CRM197 не показал изменения после первой недели, однако, CP8-CRM197 показал приблизительно 18% снижение антигенных свойств при pH 5,5 (фигуры 23C и D).
ПРИМЕР 19: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: РАЗРАБОТКА ПРЕПАРАТА (ОБЪЕМООБРАЗУЮЩИЙ АГЕНТ)
[0345] Препараты, содержащие 400/400/200/200 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197 и содержащие 1) 4,5% сахарозы, 2) 4,5% трегалозы, 3) 3% маннита/1% сахарозы, 4) 3% маннита/1% трегалозы, 5) 3% глицина/1% трегалозы, 6) 3% глицина/1% трегалозы и 7) 4,5% сахарозы, без PS 80, были исследованы на стабильность. Все препараты содержали 10 мМ гистидина и 0,01% полисорбата 80 (за исключением препарата 7) с измеренным pH препаратов - 6,3. Аликвоты препаратов переносили во флаконы фирмы Schott типа 1 объемом 2 мл с Flurotec-покрытыми 4432/50 пробками, и флаконы осторожно встряхивали в течение 6 дней при комнатной температуре.
[0346] Измерения OD350 всех образцов после встряхивания не показали увеличение агрегированных компонентов (фигура 24B). Измерения осмоляльности обнаружили, что препараты, содержащие глицин, имели значения, которые превышали физиологическую осмоляльность 290 мосмоль (фигура 24A). Восстановления составляли >98% для ClfA и MntC, >95% для CP5-CRM197, и >93% для CP8-CRM197, все из которых были хорошими в пределах изменчивости анализа. Анализ ионообменной ВЭЖХ, чтобы контролировать дезамидирование MntC, показал увеличение дезамидирование через 6 дней встряхивания, однако, все препараты показали подобные скорости, демонстрирующие, что специфический наполнитель или комбинация наполнителей не улучшали, не ускоряя процесс. Окончательно, анализ ВЭЖХ с обращенной фазой MntC и rmClfA не показал значительных изменений в профилях хроматограмм.
[0347] Образцы, содержащие глицин были исключены из списка кандидатов в наполнители из-за высокой осмоляльности. Сахароза, трегалоза, маннит и глицин определяли, как лиофилизированные продукты, как описано с помощью препаратов в таблице 27. Препараты были лиофилизированными, и каждый был исследован на стабильность при 2-8°C, 25°C, 37°C и 50°C. Данные ВЭЖХ с обращенной фазой для высоких доз на фигуре 25A не показали изменения через один месяц при 2-8°C, 25°C и 37°C. При 50°C, rmClfA показал возрастание в фронтальном плечевом пике, при этом маннит/сахароза препарат демонстрировал наибольшее изменение. Кроме того, фронтальный плечевой пик MntC также увеличивался в препарате маннит/сахароза. Для низкой дозы изменение было видно в обоих фронтальных плечевых пиках rmClfA, однако, препарат маннит/сахароза снова демонстрировал большее увеличение (фигура 25B).
|
[0348] Кроме того, ионообменную ВЭЖХ использовали, чтобы контролировать качество MntC. На фигуре 25C при 2-8°C стабильность образцов с высокой дозой не показывает изменения в каких-либо препаратах через один месяц. Образцы, хранившиеся при 25 и 37°C, показали подобные результаты (не изображены). При 50°C, однако, как высокие, так и низкие дозы показали наибольшие изменения в профиле для комбинации маннит/сахароза. Результаты нефелометрии для CP5 и СР8 конъюгаты не показали каких-либо изменений в антигенности при какой-либо температуре черз один месяц.
[0349] Так как сахароза была лидирующим кандидатом в наполнители, проводят такие эксперименты, в которых матрицы продукта лекарственного средства были сформулированы с 10 мМ гистидина, где pH 6,5 и 0,01% PS 80 сохранялись постоянными, и концентрация сахарозы варьировала в диапазоне 2,0-7,0%, и лиофилизированными. Ключевыми снимаемыми показателями были время высушивания на первичной стадии высушивания, внешний вид и влажность. Результаты исследований показали, что концентрация сахарозы в диапазоне 3-6%, которую использовали в три-антигенных препаратах, также были приемлемы для четырехантигенного препарата.
ПРИМЕР 20: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: РАЗРАБОТКА ПРЕПАРАТА (ПОЛИСОРБАТ 80)
[0350] Эксперимент по перемешиванию был спланирован, чтобы 1) определить необходимость полисорбата 80, и 2) проверить устойчивость препарата. Как описано в таблице 28, определяли качество моновалентного и SA4ag препаратов с 0, 0,01 и 0,03% PS 80. Образцы аликвотами расфасовывали во флаконы фирмы Schott типа 1 объемом 2 мл с FluroTec-покрытыми 4432/50 пробками, и перемешивали в течение 24 часов при комнатной температуре, используя VWR мешалку (Model DVX-2500, 500 RPM pulse mode). Контроли, которые не перемешивали, оставляли при комнатной температура в течение 24 часов параллельно с образцами, которые перемешивали. Несколько флаконов каждой композиции собирали и анализировали.
|
[0351] Концентрации антигенов были исследованы на восстановление после перемешивания. После перемешивания данные всех четырех антигенов не показали изменений в концентрациях, демонстрируя отсутствие потерь в каком-либо из образцов, включая препараты, не содержащие PS 80 (фигуры 26A и B). Анализ чистоты rmClfA и MntC, используя ВЭЖХ с обращенной фазой, не обнаружил изменений в каком-либо белке после перемешивания (фигура 26C). Чистота MntC, полученная, используя ионообменную ВЭЖХ, показала аналогичное снижение (из-за дезаминирования) в моновалентных препаратах, когда сравнивались уровни PS 80 (фигура 26D). Одним интересным наблюдением из данных чистоты по ионообменной ВЭЖХ является то, что, когда моновалентный препарат, то скорость разложения (соответствующая дезамидированию) является значительной по сравнению с MntC в четырехантигенном препарате. Принимая во внимание, что все препараты использовали одинаковую буферную матрицу, возможно, что MntC взаимодействует с другим антигеном, который показывает скорость дезамидирования белка. Значения pH препаратов также остаются постоянными (фигура 26E), и измерения OD350 не обнаруживают увеличение агрегации после перемешивания (фигура 26F).
ПРИМЕР 21: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ЛИОФИЛИЗАЦИЯ
[0352] Модулированный дифференциальный сканирующий калориметр (мДСК) фирмы ТА Instruments был использован, чтобы получить переходы стеклования для пред-лиофилизированных жидких препаратов, и значения Tg' представлены в таблице 29. Партии L44130-39-1 и 39-2 представляют собой целевые препараты с высокой и низкой дозой, содержащие 4,5% сахарозы. Образцы партии L44130-45 ограничивают целевую концентрацию сахарозы и содержат 3% или 6% наполнителя. Данные образцы содержат ClfA/CP5-CRM197/CP8-CRM197/MntC в концентрациях, охватывающих высокие и низкие дозы L44130-39-1 (+30% и -30%). Все препараты дали значения Tg' от -33 до -35°C, которые являются типичными для сахарозы, как указано в литературе.
|
[0353] Значения Tg лиофилизированных образцов представлены в таблице 30. Образцы были открыты, перенесены и запечатаны в герметичные алюминиевые ячейки ДСК в сухом перчаточном боксе, чтобы предотвратить накопление лиофилизированными таблетками влаги из атмосферы. Измеренные значения находились в диапазоне 65-70°C, что является типичным препарата сахароза
|
[0354] Цикл лиофилизации основан на цикле, использованном для продукта SA3ag лекарственного средства SA3ag, потому что два препарата были похожими, в обеих использовалась сахароза как объемообразующий агент. В таблице 31 определены диапазоны циклов лиофилизации, использованные для производства четырехантигенных препаратов.
|
[0355] Изучение лиофилизации выполняли, сравнивая следующие параметры:
1. 4,5% сахарозы по сравнению с 4% маннит/1% сахарозы, и
2. традиционный цикл лиофилизации по сравнению с ускоренный, агрессивный цикл.
Образцы оценивали и как продукт моновалентных препаратов лекарственного средства, а также как четырехантигенный препарат. Все препараты включали 10 мМ гистидина, pH 6,5, и 0,01% PS 80. Дозы составляли 400 мкг/мл для rmClfA и MntC, и 200 мкг/мл для СР5-и CP8-CRM197 конъюгатов. Пред- и после-лиофилизированные препараты сравнивали, используя следующие анализы: внешний вид, pH, катионобменную ВЭЖХ для определения дезамидирования MntC, ВЭЖХ с обращенной фазой для определения чистоты MntC и rmClfA, нефелометрию для восстановления конъюгата, влажность, OD350 для обнаружения осадков и дифференциальную сканирующую калориметрию (ДСК) для структурной оценки. Использованные циклы описаны в таблице 32 и таблице 33.
|
|
[0356] Внешний вид таблеток описан в таблице 34. Все таблетки, содержащие манит, получились визуально первоклассными таблетками при обоих циклах. Препараты с сахарозой показали приемлемые таблетки, как и ожидалось, на длительном цикле, однако, на коротком агрессивном цикле, получены частично осевшие таблетки. Содержание влаги в таблетке показало, что все препараты содержали <1%, однако, образцы, содержащие манит, обычно имели более низкую влажность, чем с одной сахарозой. Наложения ВЭЖХ с обращенной фазой на фигуре 27A не показали изменений в чистоте rmClfA и MntC перед и после лиофилизации, и результаты нефелометрии также не показали изменений в антигенных свойствах для CP5-CRM197 (фигура 27B) и СР8-CRM197 (фигура 27C) после лиофилизации не зависимо от цикла и наполнителя. Фигуры 27D и Е демонстрируют, что дезамидированные компоненты MntC сохранялись на уровне ~2,5% после лиофилизации для четырехантигенного препарата. pH сохранялся таким же после лиофилизации, и незначительное повышение OD350 было обнаружено в каких-либо образцах после лиофилизации, показывая отсутствие осадкой. Однако, важно отметить, что OD350 не будет обнаруживать маленькие растворимые агрегаты. Данные ДСК показали, что структурным искажениям в антигенах (rmClfA и MntC) не способствовали ни результат какого-либо цикла, ни как свидетельствовало, отсутствие изменения в температурах плавления (фигура 27F). Конъюгаты не контролировались, так как они не получают сильный сигнал плавления. Окончательно, % in vitro относительной активности антигенов сравнивали перед и после лиофилизации, используя Luminex анализ. rmClfA анализировали, как в моновалентном, так и четырехантигенном препарате, но конъюгаты были проанализированы только как моновалентные препараты, потому что в четырехантигенном препарате происходила интерференция. Результаты показали, что все проанализированные образцы (манит и сахароза) были хорошими в пределах ошибки анализа, когда сравнивали перед и после лиофилизации (как медленный, так и быстрый циклы), и что rmClfA (Фигура 27G) и конъюгаты (Фигура 27H) были стабильными при этих условиях.
|
ПРИМЕР 22: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ВОССТАНОВЛЕНИЕ
[0357] Выбрано, что разбавитель для восстановления представляет собой 60 мМ NaCl в воде для инъекции (WFI). Фигура 28 демонстрирует, что когда препарат, восстановленный данным разбавителем, как с высокой (400/400/200/200 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197), так и с низкой дозой (200/200/100/100 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197) показывает осмоляльность в физиологическом диапазоне. Выбранный объем для восстановления составил 0,7 мл, получая в результате конечный объем 0,73 мл.
[0358] После восстановления 60 мМ NaCl, четырехантигенные вакцины с высокой и низкой дозой хранили для изучения стабильности при 2-8°C и 25°C в течение 48 часов. Данные на фигуре 29A показывают, что чистота MntC, как определено с использованием ВЭЖХ с обращенной фазой, сохранялись неизмененными в течение 48 часов при 2-8°C и 25°C. rmClfA был стабильным в течение 48 часов при 2-8°C, но при 25°C чистота снижалась в течение 24-часового периода времени (Фигура 29 В). Ионообменную ВЭЖХ использовали, чтобы контролировать чистоту MntC, для которого снижение указывало на возрастание дезамидирования (Фигура 29C). Белок оставался стабильным при 2-8°C с уменьшением номинальной чистоты на <2%. При 25°C, MntC оставался стабильным в течение 4 часов, однако, чистота значительно снижалась (ниже 90%) после 24 часов. Кинетические анализы данных показали следующее: 0,03% и 0,26% разложения за час при 2-8°C и 25°C, соответственно, для MntC (фигура 29D), и 0,01% и 0,16% разложения за час при 2-8°C и 25°C, соответственно, для rmClfA (фигура 29E). Дополнительные данные показали, что концентрации антигенов не изменились при какой-либо из температур через 48 часов (фигуры 30A-D). pH также оставался одинаковым в течение 48 часов (фигура 30E).
[0359] Вакцина после восстановления была стабильной в течение четырех часов при комнатной температура и вплоть до двадцати четырех часов при 2-8°C, основываясь на данных анализа пост-восстановленной вакцины для всех четырех антигенов.
ПРИМЕР 23: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ПОСЛЕ-ЛИОФИЛИЗАЦИОННОЕ ВОССТАНОВЛЕНИЕ
[0360] После-лиофилизационный процесс восстановления четырехантигенных препаратов оценивали по двум направлениям исследований (два с высокой дозой и два с низкой дозой), где процесс состоял из формуляции, фильтрации, наполнения и лиофилизации. Фигуры 31A и B показывают, что не существует потерь какого-либо антигена после лиофилизации. Аналогично, фигуры 31C и D показывают, что не происходит изменений чистоты rmClfA или MntC в после-лиофилизированных образцах.
ПРИМЕР 24: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: СТАБИЛЬНОСТЬ ПРЕПАРАТА
[0361] Четырехантигенные препараты с:
1) 400/400/200/200 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197,
2) 200/200/100/100 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197, or
3) 40/40/20/20 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197
Были исследованы на стабильность при 2-8°C, 25°C и 37°C. Препараты (1) и (2) были стабильными при трех температурах в течение шести месяцев. Препарат (3) продемонстрировал 5 месяцев стабильности при 2-8°C (таблица 35). Субстанциями лекарственного средства, использованными для данного исследования, были L40256-30 для rmClfA (четырехантигенная типичная партия), L44124-64 для MntC (четырехантигенная типичная партия), 7СР5С-1002 для CP5-CRM197 (три-антигенная типичная партия) и G-C8-3-9 CP8-CRM197 (три-антигенная типичная партия).
|
[0362] Таблица 36 описывает партии четырехантигенных лиофилизированных препаратов, использованных для изучения стабильности.
|
Субстанции лекарственного средства были обеспечены следующими матрицами:
rmClfA: 10 мМ гистидина, pH 6,5 MntC:
10 мМ гистидина, pH 6,0
СР5- и CP8-CRM197 конъюгаты: 10 мМ гистидина, pH 6,7
[0363] Таблица 37 и таблица 38 показывает просуммированные данные 6-месячной стабильности высоких и низких доз, соответственно. После шести месяцев обе дозы сохранили одинаковый внешний вид, быстро восстанавливались разбавителем, pH сохранялся 6,5±0,3, и влажность оставалась на уровне <1,5%. Эффективности rmClfA, MntC, CP5-CRM197 и CP8-CRM197 не менялись. Кроме того, значения чистоты rmClfA и MntC оставались относительно такими же, как при t=0. Показано, что четырехантигенные препараты с высокой и низкой дозой являются стабильными в течение длительного времени и при условиях ускоренного хранения в течение трех месяцев. Аналогично, вторая серия препаратов при двух уровнях доз показала стабильность при 2-8°C, 25°C и 37°C в течение шести месяцев (таблица 39 и таблица 40). На основании данных предлагаемый срок хранения образцов составляет 12 месяцев.
|
|
|
|
|
[0364] Шести месячное исследование стабильности лиофилизированной матрицы продукта лекарственного средства при 2-8°C показали, что все исследованные параметры оставались такими же в течение времени проведения исследования (таблица 41). Предлагаемый срок хранения матрицы продукта лекарственного средства составляет 12 месяцев.
|
[0365] Лиофилизированные четырехантигенные токсикологические препараты с высокой дозой (L44130-39-1) и низкой дозой (L44130-39-2) были восстановлены 0,7 мл разбавителя 60 мМ NaCl и исследованы на стабильность при 2-8°C и 25°C. Образцы анализировали через t=0, 4 и 24 часа. Критическими анализами были pH, rmClfA чистота по ВЭЖХ с обращенной фазой, MntC чистота по ионообменной ВЭЖХ, эффективности rmClfA и MntC по ионообменной ВЭЖХ и антигенные свойства СР5/СР8 конъюгата по нефелометрии. Основными механизмами разложения, которые контролировали, были расщепление белка rmClfA и дезамидирование MntC. На фигурах 32A и B, чистота обоих рекомбинантных белков сохранялась при 2-8°C в течение 24 часов для обеих доз. При 25°C выдерживания в термостате чистота обоих белков оставалась неизменной через 4 часа, но снижалась через 24 часа. Эффективности белков (фигуры 32C и D) и конъюгатов (фигуры 32E и F), и pH (фигура 32G) также были постоянными через 24 часа при 2-8 и 25°C. Короче говоря, препараты для всех четырех антигенов были стабильными после восстановления в течение четырех часов при комнатной температуре и вплоть до двадцати четырех часов при 2-8°C, основываясь на анализе пост-восстановленных препаратов.
ПРИМЕР 25: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ГРАНИЧНЫЕ ИССЛЕДОВАНИЯ
[0366] Граничное исследование было разработано, чтобы установить компоненты препаратов с высокой и низкой дозой, чтобы продемонстрировать устойчивость препарата. Таблица 42 дает детальную информацию о препаратах. Активные компоненты были изменены как на 30% выше, чем высокая доза (400/400/200/200 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197) и на 30% ниже, чем низкая доза (200/200/100/100 мкг/мл rmClfA/MntC/CP5-CRM197/CP8-CRM197). Неактивные компоненты варьировали в диапазоне 6,0-7,0 для pH, 5-15 мМ для гистидина, 3-6% для сахарозы и 0,005-0,015% для PS 80.
|
[0367] Препараты с граничными дозами лиофилизировали, и размещали на стабильность при 2-8°C, 25°C и 37°C. Результаты, показанные в таблицах 43-46, продемонстрировали, что все препараты с граничной дозой были стабильными в течение 3 месяцев при трех температурах, подтверждая устойчивость четырехантигенного препарата.
|
|
|
|
|
ПРИМЕР 26: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: СТАБИЛЬНОСТЬ ПРИ ЗАМОРАЖИВАНИИ-РАЗМОРАЖИВАНИИ
[0368] Пред-лиофилизированные четырехантигенные жидкие препараты с высокой дозой (L44130-88-1) и низкой дозой (L44130-88-2) замораживали и размораживали во флаконах Schott типа 1 на протяжении четырех циклов. Образцы замораживали каждый раз в течение, по меньшей мере, 24 часов при -70°C и затем размораживали при комнатной температуре. Во время цикла размораживания, флаконы внимательно контролировали, так чтобы размороженные жидкие препараты не оставались при комнатной температуре в течение продолжительного периода. Это было сделано, чтобы гарантировать, что данные не отражали какое-либо клиппирование rmClfA и дезамидирование MntC в результате стояния препаратов при комнатной температуре. Каждая серия замораживания-размораживания (делается в трех повторениях) собиралась и анализировалась с использованием ВЭЖХ с обращенной фазой для определения чистоты rmClfA и MntC, ионообменной ВЭЖХ для определения концентрации rmClfA и MntC, ионообменной ВЭЖХ для определения чистоты MntC, и нефелометрии для определения концентраций СР5 и СР8 конъюгата. После четырех циклов замораживания-размораживания, чистота rmClfA и MntC по ВЭЖХ с обращенной фазой (Фигура 33A) и чистота MntC по ионообменной ВЭЖХ (Фигура 33B) не изменились. Аналогично, концентрации антигенов (фигуры 33C и D) и pH (фигура 33EE) оставались постоянными после четырех циклов замораживания-размораживания.
ПРИМЕР 27: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: СТАБИЛЬНОСТЬ ПОСЛЕ ПЕРЕМЕШИВАНИЯ
[0369] Целью исследований измерений стабильности после перемешивания было гарантировать, чтобы четырехантигенный препарат, содержащий 0,01% полисорбата 80, не показал каких-либо последствий абсорбции с укупорочной системой контейнера. Пред-лиофилизированные четырехантигенные препараты с высокой дозой (L44130-100) были изготовлены с 0, 0,01% и 0,03% полисорбата 80, и образцы встряхивали в течение 24 часов при комнатной температуре при закупоривании лиофилизированных контейнеров флакон/пробка. Контрольные образцы размещали при той же температуре окружающей среды, но без встряхивания. Для перемешивания, мешалку с несколькими трубками VWR DVX-2500 была установлена скорость 500 оборотов в минуту в импульсном режиме. Концентрация полисорбата 80 была установлена в диапазоне от 0 до 0,03%.
[0370] Ключевые анализы включали следующее: ВЭЖХ с обращенной фазой для обнаружения расщепления rmClfA и разложения MntC (за исключением дезамидирования), ионообменную ВЭЖХ, чтобы контролировать дезамидирование MntC, концентрацию четырех антигенов, и pH, и OD350. Фигуры 34A и B показывают, что чистота rmClfA и MntC оставалась близкой после перемешивания. Кроме того, на фигурах 34C и D показано, что все четыре антигена получают обратно после перемешивания. pH сохраняется (фигура 34E), и перемешивание не вызывает агрегации антигенов, как отслеживалось с помощью OD350 (фигура 34E). Все данные показали, что препарат совместим с лиофилизационной системой укупоривания контейнеров.
[0371] Хотя лиофилизационный контейнер для укупоривания не содержит силикона, препарат будет вступать в контакт с силиконом на пробках стеклянных шприцов, которые будут использоваться для восстановления и доставки вакцины.
ПРИМЕР 28: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: ИССЛЕДОВАНИЯ ISCOMATRIX™
[0372] Стабильность четырехантигенного препарата с высокой дозой (400/400/200/200 мкг/мл rmClfA/rP305A/CP5-CRM197/CP8-CRM197) анализировали после восстановления в 10 мМ гистидина, pH 6,5 с 20 единицами/мл ISCOMATRIX™ с и без 60 мМ NaCl. Стабильность контролировали при 2-8°C и 25°C в течение 24 часов. Чистоту MntC анализировали с помощью катионообменной ВЭЖХ. При 25°C ISCOMATRIX™ с NaCl и контрольный NaCl с солью показывают подобные скорости дезамидирования (фигура 35B). ISCOMATRIX™ без соли показали более низкую скорость дезамидирования. При 5°C скорость дезамидирования была радикально сниженной (фигура 35A). Невозможно было определить количественно чистоту rmClfA непосредственно благодаря интерференции от ISCOMATRIX™ (фигуры 35С). Анализ наложения характерного периода образа действия показал, что основной пик rmClfA не изменился, показывая стабильность в течение 24 часов при 25°C (фигура 35D). Аналогичные результаты были получены для всех образцов при 2-8°C. Никаких изменений в чистоте MntC через 24 часа при 2-8°C (фигура 35Е) и 25°C (фигура F) не было обнаружено, используя ВЭЖХ с обращенной фазой (фигура 35C). Никаких изменений в концентрациях CP5-CRM197 и СР8-CRM197 конъюгатов не наблюдалось через 24 часа при 2-8°C (фигура 35G) и 25°C (фигура 35H). Никаких изменений в концентрациях rmClfA или MntC не наблюдалось через 24 часа при 2-8°C (фигура 35I) и 25°C (фигура 35J).
[0373] Концентрации ISCOMATRIX™ не изменялись в течение 24 часов при 2-8°C (фигура 36A) и 25°C (фигура 36B). Размер частицы ISCOMATRIX™ с NaCl увеличивались в размере до ~50 нм и без NaCl увеличивались в размере до ~60 нм (фигура 36C). Все количества были монодиспергированными (<0,2). pH восстановленных препаратов оставались постоянными на протяжении исследования стабильности (фигура 36D).
[0374] Стабильность четырехантигенного препарата с низкой дозой (40/40/20/20 мкг/мл rmClfA/rP305A/CP5-CRM197/CP8-CRM197) анализировали после восстановления в 10 мМ гистидина, pH 6,5 с 20 единицами/мл ISCOMATRIX™ с и без 60 мМ NaCl. Никаких изменений в чистоте MntC не было обнаружено с помощью ВЭЖХ с обращенной фазой через 4 часа при 2-8°C (фигура 37A). Возрастание дезамидирования MntC не было обнаружено с помощью катионообменной ВЭЖХ через 4 часа при 2-8°C (фигуры 37B). Концентрации всех четырех антигенов оставались постоянными на всем протяжении исследования (фигуры 37C и D).
[0375] Размер частицы ISCOMATRIX™ с NaCl увеличивался через 4 часа и без NaCl оставалсь постоянным, но в обоих случаях был больше, чем исключительно один ISCOMATRIX™ (фигура 38A). Восстановленные образцы были полидиспергированными (~0,3). pH восстановленных препаратов оставались постоянными через 4 часа (фигура 38B).
ПРИМЕР 29: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА. СОПОСТАВЛЕНИЕ РАЗБАВИТЕЛЯ
[0376] Изучение кратковременной стабильности проводили, используя низкую, среднюю и высокую дозы MntC в четырехантигенном препарате, чтобы сравнить 60 мМ NaCl, 4,5% сахарозы в воде, и воду, как разбавители. Каждый препарат содержал 4,5% сахарозы, 0,01% PS 80, и концентрация антигена приведены в таблице 47 при pH 6,5.
|
[0377] Флаконы хранили при 2-8°C до начала эксперимента и исследовали на стабильность при 5°C и 25°C через 2 и 7 дней. Препараты сравнивали, используя следующие анализы: катионообменной ВЭЖХ для определения уровня дезамидирования и чистоты MntC, ВЭЖХ с обращенной фазой для определения чистоты MntC и ClfA, ионообменную хроматографию для определения концентрации MntC и ClfA, и нефелометрию для определения концентрации конъюгата. Детали результатов приведены в таблицах 48-56. Скорость дезамидирования MntC была более высокой во всех трех препаратах, восстановленных 60 мМ NaCl, и высокая доза MntC имела самую высокую скорость дезамидирования среди трех уровней доз. Все другие результаты были сопоставимыми.
|
|
|
|
|
|
|
|
|
ПРИМЕР 30: ПРОДУКТ ЧЕТЫРЕХАНТИГЕННОГО ЛЕКАРСТВЕННОГО СРЕДСТВА: АЛЬТЕРНАТИВНЫЕ ПРЕПАРАТЫ
[0378] Исследования стабильности выполняли на нескольких различных препаратах продукта четырехантигенного лекарственного средства, как показано в таблице 57.
|
[0379] Лиофилизированные препараты восстанавливали 0,7 мл воды и исследовали на стабильность при 5°C и 25°C через 1, 3 и 6 месяцев и при 40°C через 1 и 3 месяца.
Препараты сравнивали, используя следующие анализы: влажность по Карлу Фишеру, прозрачность, цветность, определение частей, Катионообменную ВЭЖХ для определения дезамидирования и чистоты MntC, ВЭЖХ с обращенной фазой для определения чистоты MntC и ClfA, ионообменную хроматографию для определения концентрации MntC и ClfA, нефелометрию для определения концентрации конъюгата. Процент влажности был выше в препарате с 45 мг/мл сахарозы. Количество воды в таблетке представляет собой процент от общей массы таблетки. Таким образом, таблетки с 90 мг/мл сахарозы были более устойчивыми по проценту влаги благодаря двойному количеству по массе сахарозы. Детальное представление результатов приведено в таблицах 58-66.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|