Результат интеллектуальной деятельности: ПРОЦЕСС ПОЛУЧЕНИЯ ФОСФАТА АЛЮМИНИЯ
Вид РИД
Изобретение
Уровень техники
[0001] Некоторые вакцины и другие медикаменты содержат один или несколько компонентов, которые служат для повышения иммуногенности антигенов вакцины, таким образом увеличивая ее эффективность. Исследования показали, что вакцины, содержащие алюминий, вызывают более сильный и продолжительный гуморальный иммунный ответ, чем такие же вакцины без адъюванта. Существует несколько типов солей алюминия ("также называемых квасцами"), обладающих свойствами вакцинных адъювантов: (i) фосфат алюминия AlPO4, (ii) гидроксид алюминия Al(ОН)3 и (iii) сульфат калия-алюминия AlK(SO4)2. Эффективность каждого алюминийсодержащего адъюванта часто зависит от характеристик конкретной вакцины и способа ее изготовления (Baylor et al., "Aluminum salts in vaccines-US perspective," Vaccine 20:S18-23, 2002). Для проявления адъювантных свойств обычно необходимо, чтобы антиген был адсорбирован на алюминии с целью его задержки антигена в месте инъекции.
[0002] Список лицензированных в США вакцин для детей, содержащих адъюванты на основе алюминия, включает, в числе прочего, ацеллюлярную коклюшно-дифтерийно-столбнячную (АКДС) вакцину, некоторые конъюгатные вакцины Haemophilus influenzae типа В (Hib), пневмококковую конъюгатную вакцину, вакцины гепатита В, комбинированные вакцины АКДС, вакцины гепатита А и вакцину папилломавируса человека.
[0003] Вакцина Prevnar®, реализуемая Wyeth - конъюгатная пневмококковая вакцина, содержащая фосфат алюминия в качестве адъюванта. Антигены Prevnar® представляют смесь полисахаридов семи различных серотипов бактерии Streptococcus pneumoniae, каждый из которых конъюгирован с белком-переносчиком CRM197. Prevnar® выпускается в виде прозрачной жидкости, содержащей коллоидную взвесь антигена - вещества, вызывающего специфический защитный иммунный ответ - адсорбцированного на алюминийсодержащем адъюванте AlPO4.
[0004] Несмотря на то, что описаны способы получения фосфата алюминия, остается необходимость в разработке более эффективных способов и/или стерильных способов, особенно промышленного масштаба. Кроме того, желательно, чтобы новые способы позволяли получать адъюванты на основе фосфата алюминия с физическими, химическими и функциональными свойствами, сходными с таковыми для адъювантов, уже нашедших коммерческое применение, например, в составе Prevnar®.
Краткое описание изобретения
[0005] Настоящее изобретение описывает усовершенствованные способы получения алюминийсодержащего адъюванта AlPO4. Преимущества этих усовершенствованных технологических способов по сравнению с другими заключаются в повышенной производительности и/или повышенной стерильности; они особенно полезны при использовании в промышленном масштабе.
[0006] Таким образом, в одном аспекте, настоящее изобретение описывает способ получения фосфата алюминия, включающий этапы смешивания раствора хлорида алюминия и раствора ортофосфата натрия с получением осадка фосфата алюминия, согласно которому стадию осаждения фосфата алюминия проводят при диапазоне температур от примерно 50°С до примерно 70°С.
[0007] В другом аспекте, настоящее изобретение описывает способ получения фосфата алюминия, включающий этапы: (i) смешивания раствора хлорида алюминия и раствора ортофосфата натрия с получением взвеси фосфата алюминия и надосадочной жидкости; (ii) осаждения взвеси фосфата алюминия с получением осадка фосфата алюминия; и (iii) удаления надосадочной жидкости, причем этапы смешивания, осаждения и удаления осуществляют в замкнутой системе.
[0008] Эти и другие аспекты настоящего изобретения станут очевидны из дальнейшего описания и пунктов формулы изобретения.
Краткое описание фигур
[0009] На Фигуре 1 изображена технологическая схема способа получения AlPO4.
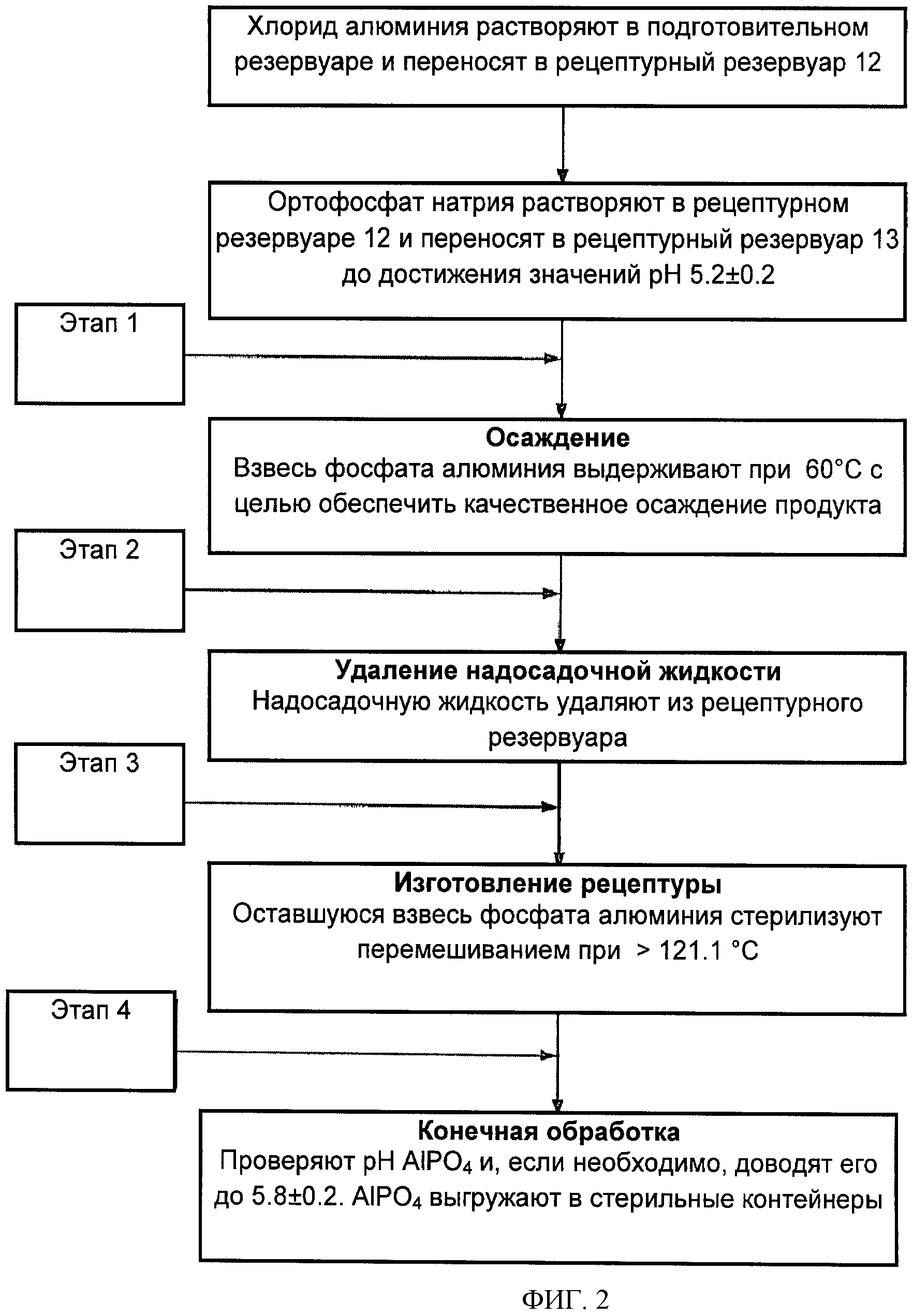
[0010] На Фигуре 2 изображена технологическая схема усовершенствованного способа получения AlPO4.
Подробное описание некоторых вариантов осуществления
[0011] Данное изобретение описывает усовершенствованные способы получения алюминийсодержащего адъюванта AlPO4. Эти способы особенно полезны при производстве AlPO4 в промышленных масштабах.
[0012] Фигура 1 иллюстрирует способ получения фосфата алюминия, при котором вначале раздельно подготавливают хлорид алюминия (AlCl3) и ортофосфат натрия (Na3PO4). Хлорид алюминия может быть в форме гексагидрата хлорида алюминия. Затем эти реактивы стерильно переносят в резервуар для приготовления рецептуры и смешивают с водой (например, с водой для инъекций Water-for-Injection™, или WFI™). Реакция между этими реактивами приводит к образованию суспензии AlPO4. Эту суспензию затем переносят в емкости для осаждения при 25°С. Время осаждения для этого процесса (т.е., время, необходимое для того, чтобы осадок AlPO4 осел в емкостях) составляет приблизительно 7-10 суток; это - наиболее медленная стадия процесса. После осаждения удаляют надосадочную жидкость из каждой емкости, а осажденный AlPO4 переносят в резервуар для приготовления рецептуры для стерилизации (например, при >121°С, 45 мин) и регулирования рН. Конечный продукт AlPO4 затем переносят в емкости для хранения. Общее время производственного цикла согласно этому способу при промышленном производстве составляет приблизительно 10-12 суток. Кроме того, поскольку процесс происходит в открытой системе, для поддержания чистоты воздуха (например, согласно классу чистоты 100) необходимы множественные стерилизационные операции. Это приводит к повышению стоимости и необходимости проведения тестов на стерильность.
[0013] Производительность способа, изображенного на Фигуре 1, значительно повышается путем выполнения, в числе прочего, этапа осаждения при повышенной температуре. В усовершенствованном способе, изображенном на Фигуре 2, после смешивания хлорида алюминия, ортофосфата натрия и воды с получением взвеси AlPO4, взвесь осаждают при температуре от примерно 50°С до примерно 70°С (например, при 60°С). Время осаждения при повышенной температуре снижается с примерно 7-10 суток до примерно 2-5 суток.
[0014] Еще одно усовершенствование по сравнению со способом, изображенным на Фигуре 1, состоит в проведении всех этапов процесса в замкнутой системе. Это дает преимущество снижения риска загрязнения (например, бактериями и т.д.), таким образом увеличивая гарантии стерильности конечного продукта и снижая необходимость проведения тестов на стерильность. Так, на Фигуре 2 надосадочную жидкость удаляют из резервуара для приготовления рецептуры (например, с помощью погружаемой трубки) и оставшуюся суспензию AlPO4 (в том же реакционном резервуаре) стерилизуют по месту (например, при ≥121.1°С, 30 мин) до регулирования рН. Затем конечный продукт AlPO4 может быть перенесен в емкости для хранения. Общее время производственного цикла согласно этому способу при промышленном производстве составляет приблизительно 3-6 суток (т.е. вдвое меньше, чем при способе, изображенном на Фигуре 1). Сниженное время производственного цикла создает преимущество в производительности. В Таблице 2 приведено непосредственное сравнение некоторых различий между способами, изображенными на Фигурах 1 и 2.
[0015] Частично основываясь на этих технологических решениях, данное изобретение описывает способ получения фосфата алюминия, включающий этапы смешивания раствора хлорида алюминия и раствора ортофосфата натрия с получением осадка фосфата алюминия, согласно которому стадию осаждения фосфата алюминия проводят в диапазоне температур от примерно 50°С до примерно 70°С. В некоторых вариантах осуществления усовершенствования включают проведение стадии осаждения фосфата алюминия в диапазоне температур от примерно 55°С до примерно 65°С. В другом варианте осуществления усовершенствование включает проведение стадии осаждения фосфата алюминия при температуре около 62°С. Еще в одном варианте осуществления усовершенствование включает проведение стадии осаждения фосфата алюминия при температуре около 60°С.
[0016] Как обсуждалось выше, эти усовершенствования неожиданно значительно снижают время осаждения фосфата алюминия. Например, в некоторых вариантах осуществления этап осаждения может быть осуществлен примерно за 2-5 суток по сравнению с примерно 7-10 сутками при более низких температурах. В одной из серий вариантов осуществления этап осаждения может быть осуществлен примерно за 2-4 суток, например примерно за 2-3 или примерно за 3-4 суток. Следует понимать, что этап осаждения может выполняться так долго, как это необходимо, в этих временных рамках или в течение более длительного (например, 5 суток или более) или короткого промежутка времени (например, менее 2 суток). Более длительные времена осаждения дают больший выход по сравнению с более короткими; однако это может быть компромиссным решением, поскольку может привести к снижению производительности вследствие повышенной длительности производственного процесса. Соответственно, оптимальное время осаждения будет определяться с учетом обоих факторов и также будет зависеть от точной температуры осаждения.
[0017] Согласно другому аспекту, данное изобретение направлено на разработку способа получения фосфата алюминия в замкнутой системе. Использование замкнутой системы значительно повышает гарантии стерильности процесса. Оно увеличивает производительность процесса в целом, поскольку снижает количество тестов на стерильность, и не требует проведения процесса в условиях чистой атмосферы. Для целей данного документа термин "замкнутая система" означает систему, в которой воздействие внешней среды (например, воздуха, кислорода, микроорганизмов и т.п.) на реакционную смесь, содержащуюся внутри одного или нескольких резервуаров, снижено или исключено. В соответствии с этим заявляемый способ включает этапы (i) смешивания раствора хлорида алюминия и раствора ортофосфата натрия с получением взвеси фосфата алюминия и надосадочной жидкости; (ii) осаждения взвеси фосфата алюминия с получением осадка фосфата алюминия; и (iii) удаления надосадочной жидкости, причем этапы смешивания, осаждения и удаления осуществляют в замкнутой системе.
[0018] В некоторых вариантах осуществления на этапе смешивания в вышеописанном способе раствор ортофосфата натрия добавляют к раствору хлорида алюминия. Раствор ортофосфата натрия обычно добавляют к раствору хлорида алюминия до тех пор, пока рН не установится в диапазоне от примерно 5.0 до примерно 5.4 (т.е. около 5.2±0.2). В некоторых вариантах осуществления раствор ортофосфата натрия добавляют к раствору хлорида алюминия до тех пор, пока рН не установится в диапазоне от примерно 5.1 до примерно 5.3.
[0019] В некоторых вариантах осуществления этап смешивания в вышеописанном способе осуществляют при диапазоне температур от примерно 20°С до примерно 30°С. В некоторых вариантах осуществления этап смешивания осуществляют при температуре около 25°С.
[0020] В некоторых вариантах осуществления этап смешивания в вышеописанном способе включает смешивание раствора хлорида алюминия и раствора ортофосфата натрия с помощью лопастной мешалки, вращающейся со скоростью от примерно 150 оборотов/мин до примерно 350 оборотов/мин. В некоторых вариантах осуществления этап смешивания в вышеописанном способе включает смешивание раствора хлорида алюминия и раствора ортофосфата натрия с помощью лопастной мешалки, вращающейся со скоростью от примерно 200 оборотов/мин до примерно 300 оборотов/мин. В ряде других вариантов осуществления этап смешивания в вышеописанном способе включает смешивание раствора хлорида алюминия и раствора ортофосфата натрия с помощью лопастной мешалки, вращающейся со скоростью около 250 оборотов/мин.
[0021] В некоторых вариантах осуществления этап осаждения в вышеописанном способе осуществляют при диапазоне температур от примерно 50°С до примерно 70°С, т.е., как указано в описании первой особенности изобретения. В некоторых вариантах осуществления этап осаждения в вышеописанном способе осуществляют при диапазоне температур от примерно 55°С до примерно 65°С. Еще в одном варианте осуществления этап осаждения осуществляют при температуре около 62°С. В другом варианте осуществления этап осаждения осуществляют при температуре около 60°С.
[0022] В некоторых вариантах осуществления этап осаждения может быть осуществлен в течение примерно 2-5 суток. Например, этап осаждения может быть осуществлен примерно за 2-4 суток, например примерно за 2-3 суток или примерно за 3-4 суток. Следует понимать, что этап осаждения может выполняться так долго, как это необходимо, в этих временных рамках или в течение более длительного (например, 5 суток или более), или короткого промежутка времени (например, менее 2 суток).
[0023] В некоторых вариантах осуществления этап удаления включает декантацию надосадочной жидкости. В некоторых вариантах осуществления этап удаления включает удаление надосадочной жидкости с помощью погружаемой трубки.
[0024] В некоторых вариантах осуществления вышеописанный способ, кроме того, включает стерилизацию осадка фосфата алюминия, причем все этапы смешивания, осаждения, удаления и стерилизации выполняют в замкнутой системе. В некоторых вариантах осуществления этап стерилизации включает нагревание осадка фосфата алюминия до температуры свыше примерно 110°С. В некоторых вариантах осуществления этап стерилизации включает нагревание осадка фосфата алюминия до температуры свыше примерно 121°С.
[0025] В некоторых вариантах осуществления вышеописанный способ, кроме того, включает регулирование рН осадка фосфата алюминия, причем все этапы смешивания, осаждения, удаления и регулирования выполняют в замкнутой системе. В некоторых вариантах осуществления этап регулирования включает регулирование рН осадка фосфата алюминия до значений в диапазоне от примерно 5.6 до примерно 6.0. В некоторых вариантах осуществления этап регулирования включает регулирование рН осадка фосфата алюминия до значений в диапазоне от примерно 5.7 до примерно 6.0. В некоторых вариантах осуществления этап регулирования включает регулирование рН осадка фосфата алюминия до значений в диапазоне от примерно 5.8 до примерно 6.0. В некоторых вариантах осуществления этап регулирования включает регулирование рН осадка фосфата алюминия до значений в диапазоне от примерно 5.9 до примерно 6.0.
[0026] Способ согласно настоящему изобретению можно использовать для получения фосфата алюминия в широком диапазоне концентраций; однако в некоторых вариантах осуществления концентрация фосфата алюминия после вышеописанного этапа смешивания находится в диапазоне примерно 9.0-16.5 мг/мл.
[0027] В некоторых вариантах осуществления после вышеописанного этапа регулирования рН осадок фосфата алюминия включает частицы размерных фракций, соответствующих значениям D [v, 0.5] (определения конкретных значений размерных фракций изложены в Примере 1 ниже) в диапазоне от примерно 3.0 мкм до примерно 9.0 мкм, или от примерно 4.5 мкм до примерно 6.5 мкм. В некоторых вариантах осуществления после вышеописанного этапа регулирования рН осадок фосфата алюминия включает частицы размерных фракций, соответствующих значениям D [v, 0.1] свыше примерно 1.5 мкм или свыше примерно 2.0 мкм. В некоторых вариантах осуществления после вышеописанного этапа регулирования рН осадок фосфата алюминия включает частицы размерных фракций, соответствующих значениям D [v, 0.9] менее примерно 25 мкм, менее примерно 24 мкм, менее примерно 23 мкм, менее примерно 22 мкм, менее примерно 21 мкм или менее примерно 20 мкм.
[0028] Данное изобретение будет более конкретно описано на следующих примерах. Однако следует понимать, что данное изобретение никоим образом не ограничивается этими примерами.
Примеры
Пример 1 - Описание Системы/Процесса
[0029] Этот пример описывает модельные систему и процесс для осуществления некоторых из описываемых в данном документе способов, таких как способ, изображенный на Фигуре 2. В этом примере подготовку и последовательное осуществление процесса производства AlPO4 контролируют с помощью системы подготовки сред (Media Preparation System, MPS, или агрегата для подготовки сред - Media Preparation Skid). MPS состоит из 3 дозировочных резервуаров (на 50 л, 200 л и 800 л), фильтровального блока и системы труб с разъемами, обеспечивающими стерильность. В производственном процессе задействованы и 200-л (V12), и 800-л (V13) резервуары. Таким образом, AlPO4 получают в порциях объемом 800 л, что дает на выходе 350 кг осадка фосфата алюминия. Конечный продукт выгружают в 50-л емкости.
[0030] Исходные материалы, используемые в этом процессе, включали:
- Ортофосфат натрия (20.4 кг)
- WFI™ (для растворения ортофосфата натрия) (107.4 л)
- 6-водный хлорид алюминия (10.1 кг)
- WFI™ (для растворения 6-водного хлорида алюминия) (91.6 л)
- 5 н. гидроксид натрия (для регулирования рН)
[0031] На первом этапе процесса в приемный контейнер для исходного материала взвешивали 20.4 кг ортофосфата натрия и на время отставляли его. Затем в приемный контейнер для исходного материала взвешивали 10.1 кг гексагидрата хлорида алюминия и также отставляли на время.
[0032] Запускали автоматическую процедуру синтеза фосфата алюминия, система проходила тест давления. Затем резервуары V12, V13 и связанные с ними трубопроводы предварительно промывали WFI™. После промывки WFI™ в трубопровод между резервуарами V12 и V13 встраивали контрольные фильтры для задержания примесей как "со стороны фильтрации", так и "со стороны очистки". Перед выборочной проверкой к резервуару V13 присоединяли предварительно стерилизованный пробоотборник с С-образным изгибом.
[0033] Система проходила еще один тест на целостность фильтра способом падения давления. По завершении теста систему продували чистым паром. После продувки паром ранее установленные фильтры промывали под давлением 50-литровым объемом WFI.
[0034] Затем в V12 добавляли заданные 162.0 л WFI, после чего WFI переносили в V13. В V12 добавляли дополнительные 100 л WFI и затем также переносили их в V13. BV13 устанавливали конечную критическую температуру реакции 25°С.
[0035] В резервуар V12 добавляли заданные 63.0 л WFI. Включали мешалку, связанную с V12 и устанавливали ее на заданной скорости 350 оборотов/мин. В V12 добавляли заранее взвешенный хлорид алюминия (после растворения температура достигала 35-45°С). После начального растворения хлорида алюминия содержимое V12 переносили в заданный объем 91.6 л WFI и перемешивали в течение 5-35 минут, после чего визуально проверяли растворение хлорида алюминия. Затем начинали перемешивание WFI в резервуаре V13 с заданной скоростью 250 оборотов/мин. Затем переносили хлорид алюминия из V12 в V13.
[0036] В V12 добавляли заданный объем 150 л WFI. Затем WFI переносили в V13, в V12 добавляли дополнительные 150 л WFI и вновь переносили в V13. В V13 устанавливали конечную критическую температуру реакции 25°С.
[0037] В V12 добавляли заданный объем 70 л WFI. Включали мешалку, связанную с V12 и устанавливали ее на заданной скорости 350 оборотов/мин. В V12 добавляли заранее взвешенный ортофосфат натрия (после растворения температура достигала 35-45°С).
После начального растворения ортофосфата натрия содержимое V12 переносили в заданный объем 107.4 л WFI и перемешивали в течение 5-35 минут, после чего визуально проверяли растворение ортофосфата натрия.
[0038] Затем ортофосфат натрия переносили из V12 в V13 и смешивали с хлоридом алюминия до достижения заданного значения рН 5.20. Через час рН вновь доводили до заданного значения 5.20 путем добавления ортофосфата натрия. После стабилизации рН замедляли мешалку до 150 оборотов/мин и изменяли заданное значение температуры на 60°С. После перемешивания в течение часа мешалку выключали. Оставшийся ортофосфат натрия вымывали из V12, затем удаляли фильтры для задержки примесей и заменяли их насадками для безразборной мойки, после чего V12 и трубопроводы подвергали процедуре безразборной мойки.
[0039] Фосфат алюминия осаждали в V13 до уровня ниже погружаемой трубки при заданной температуре 60°С. По завершении осаждения (ниже уровня погружаемой трубки) надосадочную жидкость декантировали из V13 через погружаемую трубку. Затем вручную стерилизовали кран пробоотбора в V13 в течение 15 мин при >121.1°С. После стерилизации и охлаждения крана пробоотбора до температуры ниже 60°С отбирали две 25-мл пробы на микрофлору.
[0040] Затем стерилизовали фосфат алюминия в V13 в течение 30 мин при ≥121.1°С с последующей стерилизацией линии подачи щелочи (15 мин при температуре ≥121.1°С). С помощью стерильного разъема к линии подачи щелочи присоединяли 1-литровую бутыль с 5 н. NaOH.
[0041] После охлаждения фосфата алюминия до заданной температуры 25°С рН фосфата алюминия доводили до заданного значения 5.95. До 16 заранее очищенных и стерилизованных 50-л емкостей присоединяли к соответствующим портам заполнения.
[0042] Затем стерилизовали трубопроводы в течение 15 мин при ≥121.1°С. Затем стерилизовали кран пробоотбора в V13 в течение 15 мин при ≥121.1°С. После стерилизации и охлаждения крана пробоотбора до температуры ниже 60°С отбирали две 30-мл объемные пробы на гранулометрический состав, рН, концентрацию алюминия и стерильность.
[0043] После отбора проб фосфат алюминия выгружали в 50-л емкости. После завершения выгрузки V13 и трубопроводы подвергали полной химической безразборной мойке. Из всех 50-л емкостей отбирали пробы на концентрацию алюминия и стерильность (однако на практике пробы на стерильность отбирали только из первой и последней емкостей). К каждой емкости были прикреплены магнитные стабилизаторы, емкости хранили в холодильной камере при 2-8°С.
Пример 2 - Анализ Физических, Химических и Функциональных Характеристик AlPO4
[0044] Три партии AlPO4, полученные согласно процессу, изображенному на Фигуре 1, и три партии материала, полученные согласно процессу, изображенному на Фигуре 2 (и Примеру 1), были проанализированы с тем, чтобы убедиться в сопоставимости материала, полученного в ходе обоих процессов. Способы анализа были выбраны, исходя из физических, химических и функциональных характеристик AlPO4. Эти исследования были выполнены в дополнение к сдаточным испытаниям, и все партии удовлетворяли сдаточным критериям для AlPO4. Результаты исследований равноценности обобщены следующим образом:
[0045] Гранулометрический анализ: Гранулометрический анализ сухого адъюванта и рецептированной вакцины выполняли способом рассеяния лазерного излучения на анализаторе размеров частиц Malvem (Mastersizer, Serial 2.15). Взвесь порошка в растворителе (например, изопропаноле) измеряли при малоугловом лазерном луче и рассчитывали распределение частиц по размеру. Срединный диаметр по объему распределения D [v,0.5] - диаметр, для которого 50% распределения крупнее и 50% - мельче срединного значения. Желательно, чтобы два определения среднего размера частиц не различались более, чем на относительную величину 5%. Также желательно, чтобы форма кривых при этих двух определениях совпадала. D[v,0.9] - диаметр, для которого 90% объема распределения мельче этого значения. D[v,0.1] - диаметр, для которого 10% объема распределения мельче этого значения. Шаг - ширина распределения на основе 10%, 50% и 90% квантиля (Шаг ={D[v,0.9]-D[v,0.1]}/D[v,0.5]). Перед каждым измерением инструмент калибровали, используя гранулы известного молекулярного размера 2 мкм и 10 мкм. Было определено, что размеры частиц AlPO4 (до и после рецептирования в составе Prevnar®), полученных в ходе обоих процессов, сопоставимы и соответствуют параметрам, перечисленным в Таблице 1.
|
[0046] Анализ связывания белка: Процентное содержание белка, связанного с AlPO4, определяли путем измерения общей концентрации белка перед контактом с гранулами алюминия и после обработки гранулами алюминия. Содержание белка в грануле измеряли путем последующего ресуспендирования в солевом растворе. Средние значения процента связывания белка-переносчика CRM197, входящего в состав рецептуры с AlPO4, полученного согласно процессу, изображенному на Фигуре 1 (97.5±0.8) и входящего в состав рецептуры с AlPO4, полученного согласно процессу, изображенному на Фигуре 2 (96.1±1.4), были сопоставимы. Средние значения процента связывания Prevnar®, входящего в состав рецептуры с AlPO4, полученного согласно процессу, изображенному на Фигуре 1 (91.5±1.6) и входящего в состав рецептуры с AlPO4, полученного согласно процессу, изображенному на Фигуре 2 (91.7±1.9), также были сопоставимы.
[0047] Нефелометрический анализ: Вакцину Prevnar® анализировали на антигенность методом нефелометрии с использованием лимонной кислоты как средства для солюбилизации гранул алюминия. Из предыдущей работы известно, что с алюминием связываются только конъюгированные полисахариды, но не свободные полисахариды или активированные сахариды. Антигенность гранул отражает тот факт, что составляющие их полисахариды конъюгированы. Нефелометрические измерения проводили на Beckman Array 360 System с использованием кроличьих антител. Связывание отдельных конъюгатов Prevnar® с AlPO4 измеряли нефелометрически, было найдено, что данные по материалу, полученному в ходе процессов, изображенных на Фигурах 1 и 2, сопоставимы.
[0048] Электрокинетический потенциал/электрофоретическая подвижность: Электрокинетический потенциал и электрофоретическую подвижность определяли с помощью Zetasizer. Электрокинетический потенциал AlPO4 в среднем составлял 4.7±0.2 мВ (5.1±0.1, 3.5±0.2 и 5.5±0.2 мВ). Электрокинетический потенциал AlPO4, полученного согласно процессу, изображенному на Фигуре 2, в среднем составлял 3.3±0.3 мВ (3.6±0.3, 2.6±0.4 и 3.7±0.1 мВ).
[0049] Время осаждения: Время осаждения контролировали, измеряя изменения оптической плотности на спектрофотометре (Shimadzu UV160-IPC) в течение 30 мин при длине волны 645 нм. Время/скорость осаждения (А645/мин) AlPO4, полученного согласно процессу, изображенному на Фигуре 1, составляло 0.024, 0.025 и 0.023. Время/скорость осаждения (А645/мин) of AlPO4, полученного согласно процессу, изображенному на Фигуре 2, составляло 0.027, 0.026 и 0.026.
[0050] В Таблице 2 приведено сравнение некоторых параметров, использованных в способах, изображенных на Фигурах 1 и 2. Показано, что время осаждения осадка фосфата снизилось от примерно 7-10 суток до примерно 2-5 суток за счет повышения температуры осаждения с 25°С до 60°С. Эти факты представляют существенное усиление производительности. Как описано в Примере 1, образцы фосфата алюминия, полученные обоими способами, имеют сходные физические, химические и функциональные характеристики.
|
Пример 3 - Моделирование Сред
[0051] Исследования по моделированию сред выполняли с использованием агрегата для подготовки сред (MPS) из Примера 1 с использованием триптического соевого бульона (ТСБ). Эти исследования продемонстрировали высокую степень гарантии того, что стерилизационные операции поддерживали стерильность MPS и защищали от проникновения микроорганизмов во время производства, регулирования рН, пробоотбора и переноса стерильных растворов в емкости. Каждое испытание сред состояло из стерилизации, стерильного регулирования рН с помощью 5 н. гидроксида натрия и стерильного переноса ТСБ в шестнадцать емкостей. Стерильный перенос происходил после поддержания стерильности в течение ≥10 ч. Поддержание стерильности установило общее время, в течение которого система может сохранять стерильность после выполнения стерилизационных операций (11 часов). ТСБ собирали в 1-литровые бутыли через все шестнадцать портов заполнения и подвергали полной инкубации. Образцы, отобранные с портов №1 и №16, являются репрезентативными для процесса переноса раствора в емкости в целом. Ввиду конструктивного исполнения агрегата для подготовки сред из Примера 1 в виде замкнутой системы и успешных результатов данного исследования выполнение тестов на стерильность во время коммерческого производства необходимо только для первой и последней емкостей, а не для каждой емкости, как это было необходимо в способе, изображенном на Фигуре 1.
Эквиваленты
[0052] Все материалы, упомянутые в данной заявке, включая, в числе прочего, патенты и патентные заявки, независимо от формата подобных литературных источников и сходных материалов, оформлены во всей полноте. В случае, если один или несколько приведенных по ссылке литературных источников и аналогичных материалов отличаются от данной заявки или противоречат ей в части, в числе прочего, определения и использования терминологии, описанных технологий или чего-то подобного, преимущество имеет данная заявка.
[0053] Заголовки разделов, используемые для целей данного документа, предназначены только для организационных целей и не должны толковаться как ограничивающие описанный объект изобретения каким-либо образом.
[0054] Несмотря на то, что данное изобретение описано в связи с различными вариантами и примерами осуществления, не следует предполагать, что данные изобретения ограничены такими вариантами и примерами осуществления. Напротив, данное изобретение охватывает различные варианты, модификации и эквиваленты, как должно быть понятно специалистам в этой области.
[0055] Несмотря на то, что данное изобретение детально показано и описано со ссылкой на характерные наглядные варианты осуществления, следует понимать, что допустимы различные изменения в форме и деталях, не нарушающие сути и масштаба данного изобретения. Следовательно, все варианты осуществления, соответствующие сущности и подпадающие под область охвата данного изобретения, и его аналоги должны рассматриваться как описываемые формулой изобретения. Пункты формулы изобретения и описания данного изобретения не должны рассматриваться как ограничивающие описанный порядок элементов, если не установлено обратное.