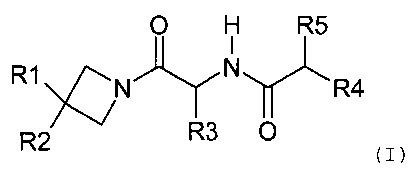
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ОКСОАЗЕТИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЯ В МЕДИЦИНЕ И КОСМЕТОЛОГИИ
Вид РИД
Изобретение
Данное изобретение относится к новым соединениям в качестве продуктов, которые модулируют один или более рецепторов меланокортина. Оно также относится к способу их получения и к их терапевтическому применению.
Меланокортины составляют семейство регуляторных пептидов, которые синтезируются при пост-трансляционной обработке гормона проопиомеланокортина (ПОМК - длина 131 аминокислоты). ПОМК производит три класса гормонов, меланокортины, гормон адренокортикотропин и различные эндорфины, такие как, например, лиготропин (Cone, et al., Recent Prog. Horm. Res., 51:287-317, (1996); Cone et al., Ann. N. Y. Acad. Sd., 31:342-363 (1993)).
Рецепторы меланокортина (РМК) образуют часть 7-трансмембранного домена суперсемейства GPCR. В настоящее время у млекопитающих идентифицировано 5 подтипов рецептора, MC1-5R. Эндогенная группа пептидов связывается с РМК с агонистическим или антагонистическим эффектом, такими как меланоцит-стимулирующие гормоны (МСГ), аденокортикотропический гормон (АКТГ) и протеины Агути и их производные. Одним исключением, однако, является рецептор MC2R, который связывается только с АКТГ (основное фармакологическое отличие рецептора АКТГ от других рецепторов меланокортина, Schioth et al. Life sciences (1996), 59(10), 797-801).
РМК играют различные роли на физиологическом уровне. РМК1 регулирует образование меланина в коже и играет роль в регулировании иммунной системы. РМК2 регулирует образование кортикостероидов на уровне надпочечников. Рецепторы РМК3 и РМК4 играют роль в контроле поглощения пищи и полового поведения. РМК5 вовлечен в регулирование экзокринной железы (Wikberg, Jarl E. S., Melanocortin receptors: perspectives for novel drugs. European Journal of Pharmacology (1999), 375(1-3), 295-310. Wikberg, Jarl E. S., Melanocortin receptors: new opportunities in drug discovery. Expert Opinion on Therapeutic Patents (2001), 11(1), 61-76).
Потенциальное применение РМК в качестве мишени для лекарственных средств, предназначенных для лечения значительных патологических состояний, таких как ожирение, диабет, воспалительные состояния и половая дисфункция, создает потребность в соединениях, которые обладают большой специфичностью к конкретному подтипу. Однако, моделирование лекарственных средств, которые являются селективными для незначительно отличающихся подтипов рецептора, является трудной задачей, которая будет упрощена, если станут доступными подробные знания детерминант взаимоотношения лиганд-рецептор.
Заявители неожиданно обнаружили, что новые соединения общей формулы (I), определенные ниже, оказывают эффективное воздействие на рецепторы меланокортина, и в определенных вариантах, высоко селективны к РМК1.
Было продемонстрировано, в частности, что РМК1 является одним из ключевых белков в регулировании синтеза меланина в меланоцитах.
РМК1 экспрессируется в меланоцитах и вовлечен в пигментацию кожи, окрашивание меха животных и функции меланоцитов. Меланокортины, таким образом, могут применяться для лечения расстройств гипопигментации и гиперпигментации. Данные полиморфизма гена РМК1 имеют отношение к фенотипу с рыжим цветом волос и к злокачественному и не злокачественному раку кожи (Xu X et al. Nat Genet 1996; 14: 384; Van Der Velden PA et al. Am J Hum Gent 2001; 69; 774-779; Valverde P et al. Hum Mol. Genet 1996; 5; 1663-1666; Schioth HB Biochem. Biophys. Res Commun. 1999; 260: 488-491; Scott MC et al. J Cell Sci 2002; 115; 2349-2355). Таким образом, существует связь между РМК1 и меланомой; в результате, РМК1 может быть важным для профилактики и лечения определенных форм рака кожи (Stockfleth E et al Recent Results Cancer Res 2002; 160; 259-268; Stander et al Exp Dermatol 2002; 11:42-51). РМК1 также экспрессируется в макрофагах и моноцитах (Star et al. Proc. Natl. Acad. Sci. USA 92; 8016-8020; Hartmeyer et al. J. Immunol. 159; 1930-1937), нейтрофилах (Catania et al Peptides 17; 675-679), эндотелиальных клетках (Hartmeyer et al. J. Immunol. 159; 1930-1937), клетках глиомы и астроцитах (Wong et al. Neuroimmunomodulation 4, 37-41), фибробластах (Boston and Cone, Endocrinology 137, 2043-2050) и кератиноцитах (Luger et al. J. Invest Dermatol. Symp. Proc. 2, 87-93). Локализация РМК1 в этих клетках связана со способностью МСГ-производных пептидов ингибировать воспалительные процессы. Более конкретно, α-МСГ демонстрирует сильное ингибирование воспаления в хронических моделях воспаления кишечника, артрита, ишемии, контактной гиперчувствительности и дерматита, а также способен вызывать устойчивость к гаптенам (Ceriana et al. Neuroimmunomodulation 1, 28-32; Chiao et al. Clin. Invest. 99, 1165-1172; Huh and Lipton Neurosurgery 40, 132-139; Luger et al. J. Invest Dermatol. Symp. Proc. 2, 87-93; Rajora et al. Peptides 18, 381-385; J. Neurosci. 17, 2181-2196; Lipton et al. Neuroimmunomodulation 5, 178-183). Меланокортины, таким образом, могут применяться для лечения воспалительных расстройств и иммунных заболеваний. Было выдвинуто предположение, что РМК1 сигнальные пути играют роль в осознании боли, и что функциональные вариации РМК1 связаны с высокой переносимостью боли (Mogil et al J Med Genet. 2005 Jul; 42(7): 583-7).
Сильная корреляция существует между цветом волос человека и вариантами РМК1 (Valverde et al. Nat Genet. 1995 Nov; 11(3):328-30). Функциональные вариации в РМК1 связаны с рыжим цветом волос.
Также известно, что сальные железы экспрессируют РМК1 (Ganceviciene et al. Exp Dermatol. 2007 Jul; 16(7):547-52) и РМК5 (Zhang et al. Peptides. 2006 Feb; 27(2):413-20). Также было описано, что РМК1 чрезмерно экспрессируется в сальных железах в случае акне.
Эти соединения находят применение в медицине, в частности, в дерматологии, и в косметологии.
Среди уже известных производных оксоазетидина некоторые были описаны как имеющие антибактериальные свойства (WO 9709328, WO 04045616, WO4087697), противовирусные свойства в качестве антагонистов CCR5 (WO 04055016, WO 08034731) и обезболивающие свойства (Journal of Medicinal Chemistry (1968), 11, 466-470).
В патенте WO 9810653 описаны определенные пиперидиновые, пирролидиновые и гексагидро-1Н-азепиновые соединения способствующие синтезу гормона роста у человека и животных.
В патентах WO 9635713 и WO 9638471 описаны определенные дипептиды для стимулирования синтеза гормона роста.
В публикации в Journal of Medicinal Chemistry (2003), 46, 1123-1126 описано «открытие мощных и селективных агонистов низкомолекулярного РМК1 рецептора на основе тирозина с противовоспалительными свойствами».
В патентах WO 02070511, WO 02079146 и WO 02069905 заявлено применение соединений в качестве модуляторов рецепторов меланокортина, более конкретно, РМК1 и РМК4.
В настоящее время неожиданно заявители обнаружили, что определенные соединения формулы (I), которые являются объектом данного изобретения, являются модуляторами одного или более рецепторов меланокортина и, в частности, некоторые соединения высоко селективны к РМК1.
Таким образом, данное изобретение относится к соединениям общей формулы (I) ниже:
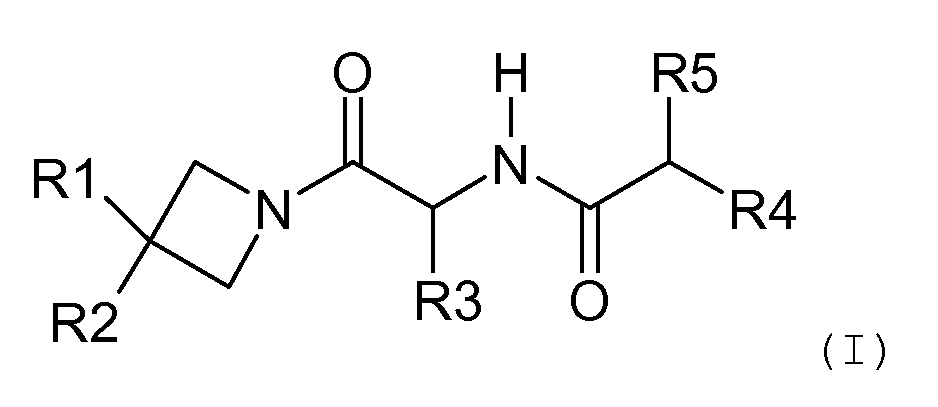
в которой:
R1 является арилом, замещенным арилом или циклоалкилом;
R2 является атомом водорода, гидроксилом, низшим алкилом, замещенным низшим алкилом, высшим алкилом, замещенным высшим алкилом, циклоалкилом, циклоалкилалкилом, низшим алкокси, замещенным низшим алкокси, высшим алкокси, замещенным высшим алкокси, циклоалкилалкокси или ацилокси;
R3 является аралкилом или замещенным аралкилом;
R4 является гетероалкилом, замещенным гетероаралкилом, гетероалкилом или замещенным гетероалкил;
R5 является атомом водорода, гидроксилом, амино, ациламино или сульфонамидом;
а также соответствующим солям и энантиомерам соединений общей формулы (I).
Среди аддитивных солей соединений общей формулы (I) с фармацевтически приемлемой кислотой предпочтительными являются соли с органической кислотой или с неорганической кислотой.
Подходящие неорганические кислоты включают, например, галогенводородные кислоты, такие как хлороводородная кислота или бромоводородная кислота, серная кислота или азотная кислота.
Подходящие органические кислоты включают, например, пикриновую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, пара-толуолсульфоновую кислоту, лимонную кислоту, щавелевую кислоту или винную кислоту.
Соединения общей формулы (I) также могут существовать в форме гидратов или сольватов с водой или растворителем.
Подходящие растворители для образования сольватов или гидратов включают, например, спирты, такие как этанол или изопропанол, или воду.
В соответствии с данным изобретением, термин "арил" означает незамещенный фенил или нафтил.
В соответствии с данным изобретением, термин "замещенный арил" означает фенил или нафтил, замещенный одной или более группами атомов, выбранных из алкила, алкокси, галогена, гидроксила, циано, трифторметила и нитро.
В соответствии с данным изобретением, термин "циклоалкил" означает циклическую насыщенную углеводородную цепь, содержащую от 3 до 7 атомов углерода.
В соответствии с данным изобретением, термин "гидроксил" означает OH группу.
В соответствии с данным изобретением, термин "амино" означает NH2 группу.
В соответствии с данным изобретением, термин "ацил" означает формил или карбонил, замещенный алкилом.
В соответствии с данным изобретением, термин "сульфонил" означает сульфон, замещенный алкилом.
В соответствии с данным изобретением, термин "низший алкил" означает линейную или разветвленную углеводородную цепь, содержащую от 1 до 4 атомов углерода, или линейную или разветвленную ненасыщенную углеводородную цепь, содержащую от 2 до 4 атомов углерода.
В соответствии с данным изобретением, термин "алкил" означает замещенный или незамещенный низший алкил или высший алкил.
В соответствии с данным изобретением, термин "замещенный низший алкил" означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 4 атомов углерода, или линейную или разветвленную ненасыщенную углеводородную цепь, содержащую от 2 до 4 атомов углерода и замещенную одним или более атомами галогена или гидроксилом, и, в частности, например, метил, этил, пропил, изопропил или бутил.
В соответствии с данным изобретением, термин "высший алкил" означает линейную или разветвленную, насыщенную или ненасыщенную углеводородную цепь, содержащую от 5 до 10 атомов углерода.
В соответствии с данным изобретением термин "замещенный высший алкил" означает линейную или разветвленную, насыщенную или ненасыщенную углеводородную цепь, содержащую от 5 до 10 атомов углерода и замещенную одним или более атомами галогена или гидроксилом.
В соответствии с данным изобретением термин "циклоалкилалкил" означает алкил, замещенный циклоалкилом.
В соответствии с данным изобретением термин "низший алкокси" означает атом кислорода, замещенный низшим алкилом и, в частности, например, метокси, этокси, пропокси, изопропокси или бутокси.
В соответствии с данным изобретением термин "замещенный низший алкокси" означает атом кислорода, замещенный замещенным низшим алкилом.
В соответствии с данным изобретением, термин "высший алкокси" означает атом кислорода, замещенный высшим алкилом.
В соответствии с данным изобретением термин "замещенный высший алкокси" означает атом кислорода, замещенный замещенным высшим алкилом.
В соответствии с данным изобретением термин "циклоалкилалкокси" означает атом кислорода, замещенный циклоалкилалкилом.
В соответствии с данным изобретением термин "ацилокси" означает атом кислорода, замещенный ацилом.
В соответствии с данным изобретением термин "аралкил" означает алкил, замещенный арилом.
В соответствии с данным изобретением термин "замещенный аралкил" означает алкил, замещенный замещенным арилом.
В соответствии с данным изобретением термин "атом галогена" означает хлор, фтор, йод и бром.
В соответствии с данным изобретением термин "гетероцикл" означает насыщенную или ненасыщенную, циклическую или бициклическую углеводородную цепь, содержащую один или более гетероатомов, выбранных из O, S и N.
В соответствии с данным изобретением термин "замещенный гетероцикл" означает насыщенную или ненасыщенную, циклическую или бициклическую углеводородную цепь, содержащую один или более гетероатомов, выбранных из O, S и N, замещенную одной или более алкильными группами.
В соответствии с данным изобретением термин "гетероарил" означает ароматический гетероцикл.
В соответствии с данным изобретением термин "замещенный гетероарил" означает ароматический гетероцикл, замещенный одной или более алкильными группами.
В соответствии с данным изобретением термин "гетероаралкил" означает алкил, замещенный гетероарилом.
В соответствии с данным изобретением термин "замещенный гетероаралкил" означает алкил, замещенный замещенным гетероарилом.
В соответствии с данным изобретением термин "гетероалкил" означает алкил, замещенный гетероциклом.
В соответствии с данным изобретением термин "замещенный гетероалкил" означает алкил, замещенный замещенным гетероциклом.
В соответствии с данным изобретением термин "ациламиногруппы" означает амин, замещенный ацилом.
В соответствии с данным изобретением термин "сульфонамидные группы" означает амин, замещенный сульфонильной группой.
Среди соединений общей формулы (I), которые попадают в контекст данного изобретения, могут быть указаны следующие:
- 1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-фенилазетидин-3-иловый эфир масляной кислоты
- N-[(S)-1-[(S)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-(3-гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- 1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-o-толилазетидин-3-ил ацетат
- 1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-(4-фторфенил)азетидин-3-иловый эфир масляной кислоты
- N-[(S)-1-[(S)-2-(3-циклогексил-3-гидроксиазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-[3-бутокси-3-(3-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-2-(3-циклогексил-3-гидроксиазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(S)-2-(3-гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(3,4-дихлорбензил)-2-(3-гидрокси-3-фенилазетидин-1-ил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(S)-2-(3-этокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(S)-2-(3-циклопропилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(S)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-этокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-циклогексилметил-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(2,4-дихлорбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклопропилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(S)-1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-гексилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутил-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(S-циклопропилметокси-S-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(3-фторбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-фторбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-фторбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-{(R)-1-бензил-2-[3-бутокси-3-(4-фтор-фенил)азетидин-1-ил]-2-оксоэтил}-3-(4H-имидазол-2-ил)пропионамид
- N-[(R)-1-бензил-2-(3-бутокси-3-фенилазетидин-1-ил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(4-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H[1,2,3]триазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-[1,2,4]триазол-3-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(2-метоксифенил)-3-пентилазетидин-1-ил]-2-оксоэтил}-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-хлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-хлорбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-фторбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-бензил-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)акриламид
- N-[(R)-2-[3-(2,4-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)-1-(3-трифторметилбензил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)-1-(4-трифторметилбензил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(3,4-дихлорбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(3,4-дифторбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3,4-дихлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(3-фторбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(2-фторбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(2,4-дихлорбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(4-хлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,5-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,6-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пентиламид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(3-метил-3H-имидазол-4-ил)пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2,4-дихлорбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамид
- N-[(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(3-метил-3H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1-метил-1H-имидазол-4-ил)пропионамид
- трифторацетат N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида
- (S)-N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-2-гидрокси-3-(1H-имидазол-4-ил)пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
- N-[1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклогексилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- 3-(1H-имидазол-4-ил)-N-{(R)-1-(4-метоксибензил)-2-оксо-2-[3-o-толил-3-(4,4,4-трифторбутокси)азетидин-1-ил]этилпропионамид
- N-[(R)-2-(3-циклобутилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(3-метилбут-2-енилокси)-3-o-толилазетидин-1-ил]-2-оксоэтил}-3-(5-метил-1H-имидазол-4-илпропионамид
- 3-(1H-имидазол-4-ил)-N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-фенилазетидин-1-ил)этил]пропионамид
- N-[(R)-2-[3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- 3-(1H-имидазол-4-ил)-N-{(R)-1-(4-метоксибензил)-2-[3-(2-метоксифенил)азетидин-1-ил]-2-оксоэтил}пропионамид
- N-[(R)-2-[3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- 3-(1H-имидазол-4-ил)-N-{(R)-1-(4-метоксибензил)-2-оксо-2-[3-фенил-3-(4,4,4-трифторбутил)азетидин-1-ил]этил}пропионамид
- N-[(R)-2-[3-(5-фторпентил)-3-фенилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклопропил-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклопропилметил-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- (S)-2-гидрокси-3-(1H-имидазол-4-ил)-N-[1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]пропионамид
- (S)-2-амино-3-(1H-имидазол-4-ил)-N-[1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)бутирамид
- (S)-N-[2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)-2-метансульфониламинопропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1-метил-1H-имидазол-4-ил)пропионамид
а также их соответствующие соли и энантиомеры.
Соединения общей формулы (I) получают по схеме реакции 1, представленной ниже:
Схема 1:
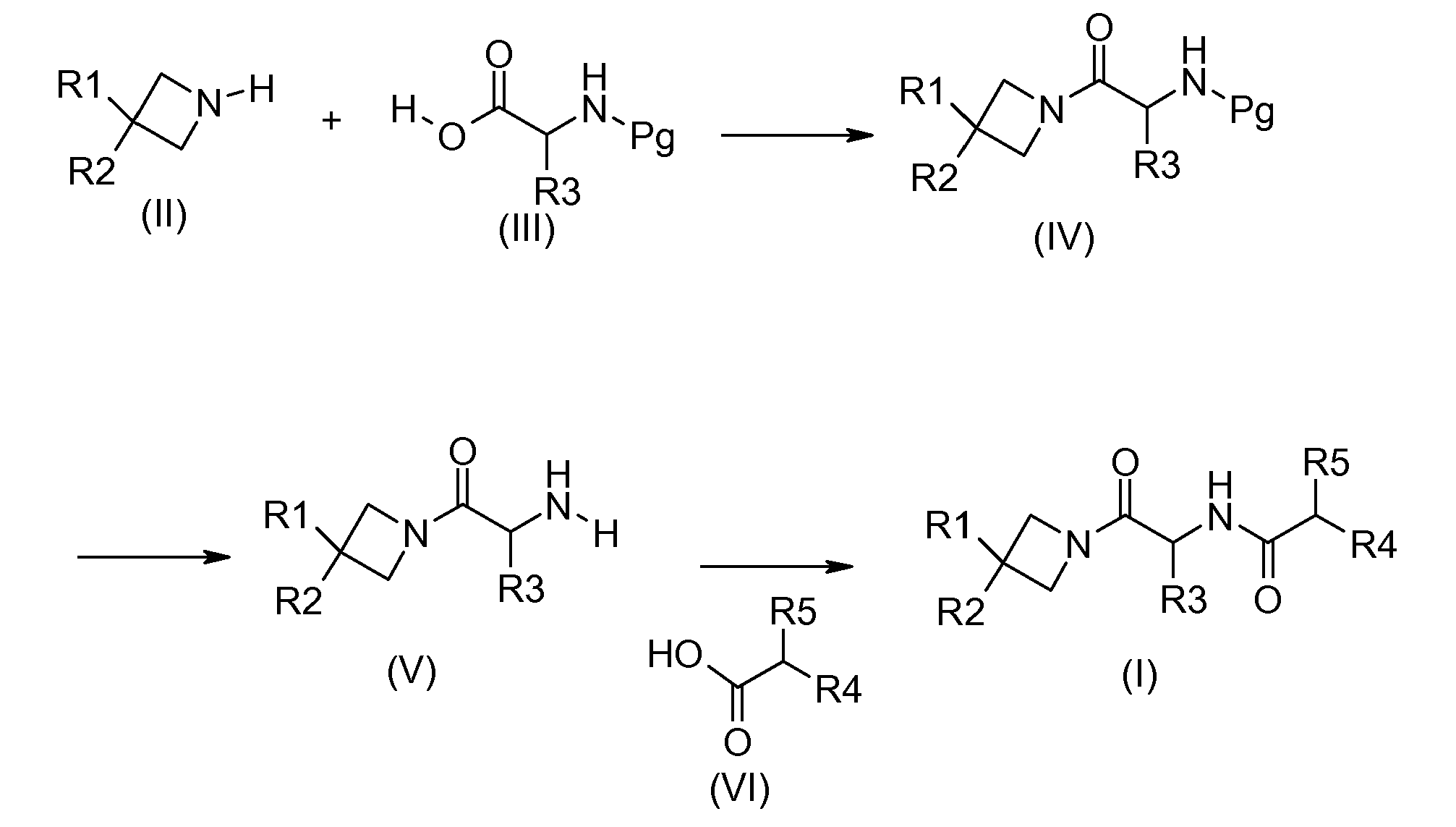
Согласно схеме 1, соединения общей формулы (IV) могут быть получены конденсацией промежуточных соединений формулы (II) и аминокислоты формулы (III), амино-функциональная группа которой защищена защитной группой Pg (например, Boc, CBz или Fmoc группой), в обычных условиях пептидной конденсации, с применением, например, в качестве конденсирующего агента, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида или гидроксибензотриазола или TBTU, и, в качестве основания, триэтиламина или диизопропилэтиламина, в растворителе, таком как дихлорметан или диметилформамид.
Аминокислоты общей формулы (IV) коммерчески доступны или их получают методами, описанными в литературе (Williams, R. M., Synthesis of optically active α-amino acids, Pergamon Press, Oxford, 1989).
Соединения общей формулы (V) получают снятием защиты с аминогруппы соединений общей формулы (IV), способами, выбранными из известных специалистам в данной области техники. Они включают, кроме прочего, применение трифторуксусной кислоты или хлороводородной кислоты в дихлорметане или этилацетате, например, в случае защиты Boc группой, гидрирование с подходящим металлом в тетрагидрофуране или метаноле, например, в случае защиты CBz группой, и пиперидина в ацетонитриле, например, в случае защиты Fmoc группой.
На конечной стадии соединения общей формулы (I) получают конденсацией амина формулы (V) и кислоты формулы (VI) в обычных условиях пептидной конденсации, с применением, например, в качестве конденсирующего агента, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида или гидроксибензотриазола или TBTU, и, в качестве основания, триэтиламина или диизопропилэтиламина в растворителе, таком как дихлорметан или диметилформамид. Соединения общей формулы (VI) коммерчески доступны или их получают методами, описанными в литературе или известными специалистам в данной области техники, адаптированными к природе заместителей R4 и R5. В зависимости от природы R4 и R5, схемы 2, 3 и 4, представленные ниже, представляют получение соединений общей формулы (VI).
Например, если R5 содержит алкил, замещенный 1, 2, 3-триазольным гетероциклом, соединение (VI) может быть получено по схеме 2:
Схема 2:
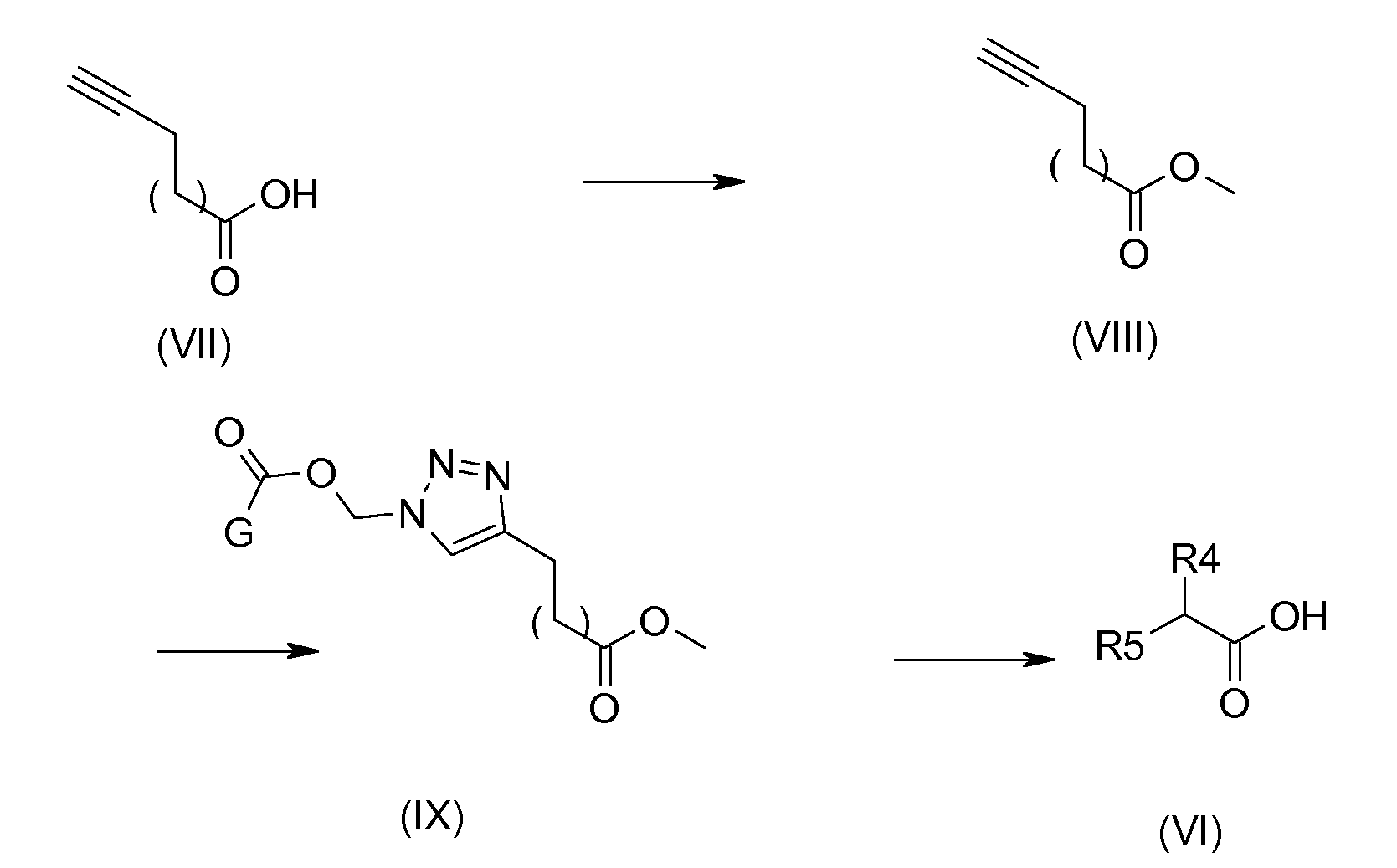
Соединения общей формулы (VIII) получают эстерификацией функциональной группы кислоты соединений общей формулы (VII), способами, выбранными из известных специалистам в данной области техники. Они включают, кроме прочего, применение серной кислоты в метаноле, например. Соединения формулы (IX) получают из соединений формулы (VIII) способами, описанными в литературе (Loren J. C, Synlett, 2005, 2847-2850) с последующим расщеплением в щелочной среде в присутствии, например, гидроксида натрия в смеси воды/метанол, с получением соединений триазола (VI).
Например, если R5 содержит алкил, замещенный имидазольным гетероциклом, соединение (VI) получают по схеме 3:
Схема 3:
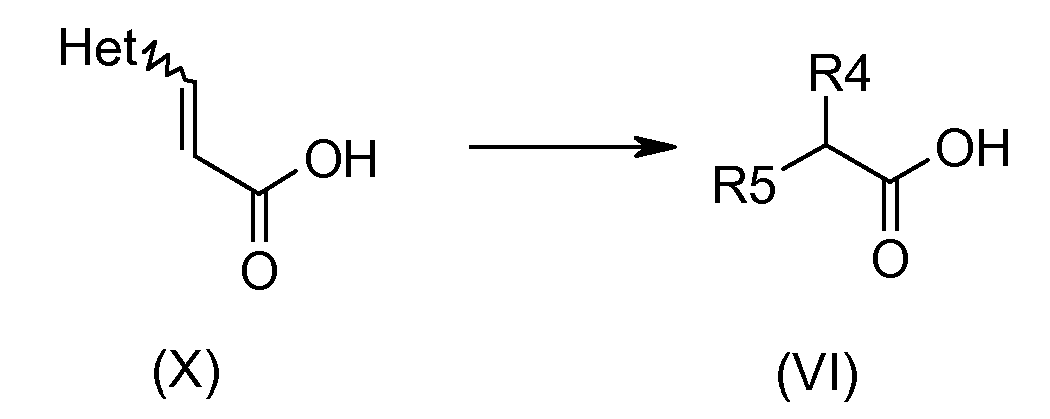
Соединения общей формулы (X) коммерчески доступны или их получают способами, описанными в литературе, известными специалистам в данной области техники. Соединения общей формулы (VI) получают, например, гидрированием соединения (X) в присутствии катализатора, который может быть палладием на угле в метаноле.
Например, если R5 содержит алкил, замещенный гетероциклом, соединение (VI) может быть получено по схеме 4:
Схема 4:
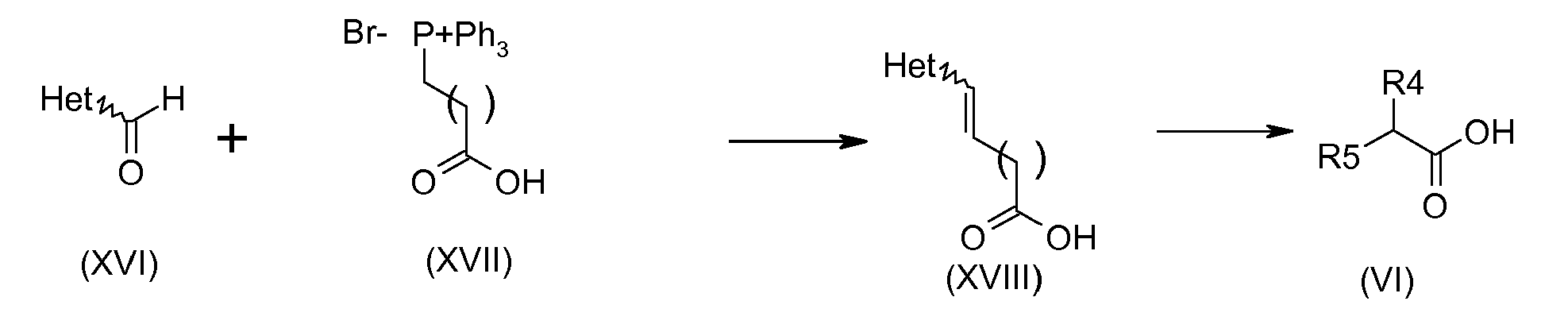
Соединения общей формулы (XVIII) получают, например, реакцией Виттига между илидом (XVII) и гетероциклом, замещенным альдегидом (XVI) в присутствии основания, которое может быть дисилазаном гексаметил лития в растворителе, таком как тетрагидрофуран, например. Соединения общей формулы (VI) получают, например, гидрированием соединения (XVIII) в присутствии катализатора, который может быть палладием на угле, в кислой среде, например, в уксусной кислоте.
Соединения общей формулы (II) получают способами, описанными в литературе, или известным специалистам в данной области техники, адаптированными к природе заместителей R1 и R2. На схемах 5 и 6 представлены примеры получения соединений общей формулы (II).
Например, если R2 содержит цепь алкокси, соединение (II) может быть получено по схеме 5:
Схема 5:
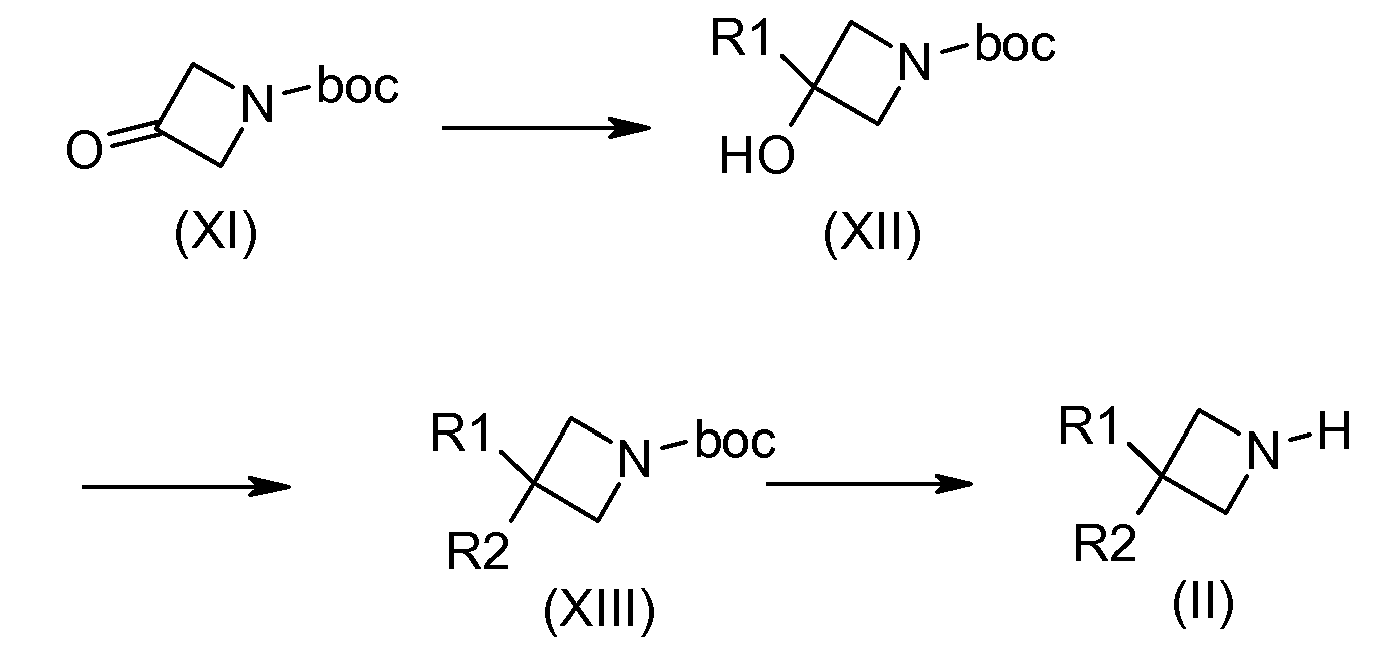
Соединения общей формулы (XII) получают, например, присоединением галогенида магния, полученного из R1, к N-boc-азетидинону (XI) (коммерческому) с последующим алкилированием третичного спирта в присутствии основания, которое может быть гидридом натрия, например, и галогенированного производного, полученного из R2, с получением соединений (XIII). Соединения общей формулы (II) получают снятием защиты с амино-функциональной группы соединений общей формулы (XIII), например, с присутствии трифторуксусной кислоты или хлороводородной кислоты, в дихлорметане или этилацетате.
Например, если R2 содержит алкильную цепь, соединение (II) получают по схеме 6:
Схема 6:
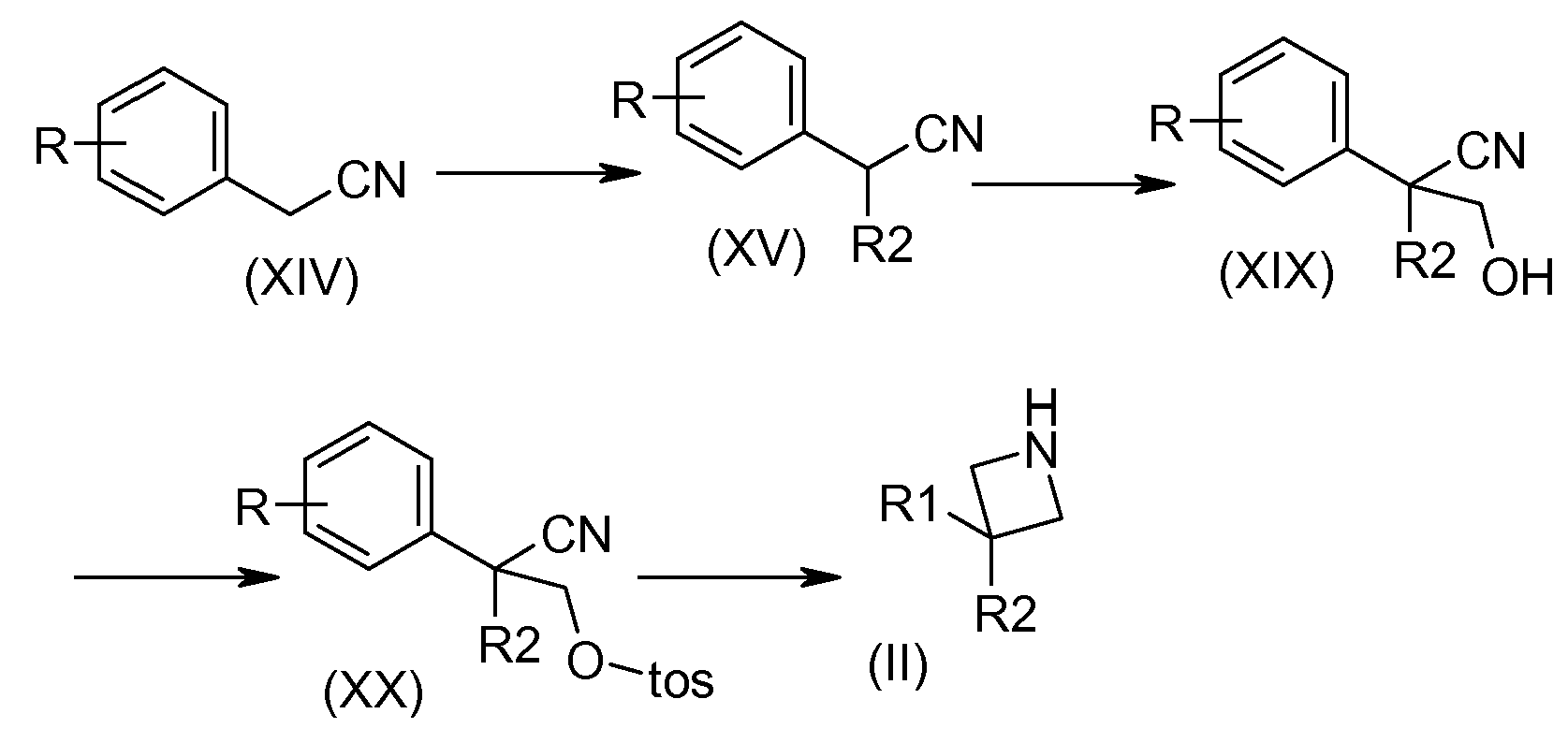
Соединения общей формулы (XV) могут быть получены, например, добавлением основания, такого как гидрид натрия, в присутствии галогенированного производного, полученного из R2. Первичные спирты общей формулы (XIX) синтезируют из производных нитрила (XV) в присутствии основания, например, гидрида натрия и параформальдегида. Функциональную группу первичного спирта соединений (XIX) превращают в сульфонат в присутствии основания, которым может быть триэтиламин или тозил хлорид, например. Соединения азетидина общей формулы (II) синтезируют внутримолекулярной циклизацией между амино-функциональной группой, полученной после восстановления нитрильной функциональной группы, например, в присутствии алюмогидрида лития, и тозилатной функциональной группой соединения общей формулы (XX).
В соответствии с данным изобретением, особенно предпочтительны соединения общей формулы (I), для которых:
- R1 является арилом, замещенным арилом или циклоалкилом;
- R2 является гидроксилом, низшим алкилом, замещенным низшим алкилом, высшим алкилом, замещенным высшим алкилом, низшим алкокси, замещенным низшим алкокси, высшим алкокси, замещенным высшим алкокси или циклоалкилалкокси;
- R3 является аралкилом или замещенным аралкилом;
- R4 является гетероаралкилом или замещенным гетероаралкилом;
- R5 является водородом или ациламино; а также соответствующие соли и энантиомеры соединений общей формулы (I).
Предпочтительными соединениями являются:
- N-[(S)-1-[(S)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(S)-1-[(S)-2-[3-бутокси-3-(3-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-этокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(2,4-дихлорбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклопропилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутил-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(3-фторбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-фторбензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-бензил-2-(3-бутокси-3-фенилазетидин-1-ил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(4-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-[1,2,4]триазол-3-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(2-метоксифенил)-3-пентилазетидин-1-ил]-2-оксоэтил}-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-хлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-бензил-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,4-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3,4-дихлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3,4-дихлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(2,4-дихлорбензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,5-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,6-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пентирамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(3-метил-3H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(3-метил-3H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(l-метил-1H-имидазол-4-ил)пропионамид
- трифторацетат N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида
- (S)-N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-2-гидрокси-3-(1H-имидазол-4-ил)пропионамид
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклогексилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- 3-(1H-имидазол-4-ил)-N-{(R)-1-(4-метоксибензил)-2-оксо-2-[3-o-толил-3-(4,4,4-трифторбутокси)азетидин-1-ил]этилпропионамид
- N-[(R)-2-(3-циклобутилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(3-метилбут-2-енилокси)-3-o-толилазетидин-1-ил]-2-оксоэтил}-3-(5-метил-1H-имидазол-4-илпропионамид
а также их соответствующие соли и энантиомеры.
В соответствии с данным изобретением, особенно предпочтительны соединения общей формулы (I), для которых:
- R1 является арильным радикалом, замещенным арильным радикалом или циклоалкильным радикалом;
- R2 является низшим алкокси радикалом, высшим алкокси радикалом, циклоалкилалкокси радикалом, низшим алкильным радикалом или высшим алкильным радикалом;
- R3 является замещенным аралкильным радикалом;
- R4 является замещенным имидазолом или незамещенным имидазолом;
- R5 является водородом; а также их соответствующие соли и энантиомеры соединений общей формулы (I).
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-этокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклопропилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пропокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-бутокси-3-(4-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутил-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(4-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(2-метоксифенил)-3-пентилазетидин-1-ил]-2-оксоэтил}-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2-хлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,4-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3,4-дихлорфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(3-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,5-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-[3-(2,6-дифторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид,
- N-[(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1-метил-1H-имидазол-4-ил)пропионамид
- трифторацетат N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида
- N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-гидрокси-бензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
- N-[1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-[(R)-2-(3-циклогексилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
- 3-(1H-имидазол-4-ил)-N-{(R)-1-(4-метоксибензил)-2-оксо-2-[3-o-толил-3-(4,4,4-трифторбутокси)азетидин-1-ил]этилпропионамид
- N-[(R)-2-(3-циклобутилметокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
- N-{(R)-1-(4-метоксибензил)-2-[3-(3-метилбут-2-енилокси)-3-o-толилазетидин-1-ил]-2-оксоэтил}-3-(5-метил-1H-имидазол-4-илпропионамид
и также их соответствующие соли и энантиомеры.
Соединения в соответствии с данным изобретением обладают свойствами модулирования рецептора меланокортина. Термин "свойство модулирования рецептора меланокортина" означает агонист или антагонист рецептора меланокортина. Это действие на РМК измеряют в тесте трансактивации и оценивают как 50% эффективную концентрацию (EC50), как описано в примере 10.
Предпочтительно, соединениями являются соединения, которые, по крайней мере моделируют РМК, селективно в отношении подтипа 1 (РМК1), т.е. они демонстрируют отношение EC50 РМК1, по отношению к другим РМК, больше или равное 10. Предпочтительно, это отношение больше или равно 10, более предпочтительно, больше или равно 20, и наиболее предпочтительно, больше или равно 50.
Предпочтительно, соединения в соответствии с данным изобретением демонстрируют 50% эффективную концентрацию (EC50) по отношению к MК1 рецептору менее или равную 10 мкМ, и более предпочтительно, меньше или равную 1 мкМ.
Поэтому данное изобретение относится к применению, по крайней мере, одного соединения общей формулы (I), описанного выше, для получения фармацевтической или косметической композиции, в которой указанное соединение обладает модуляторным действием на один или более рецепторов меланокортина, и в частности, на подтипы 1, 3, 4 и 5.
В одном конкретном варианте данного изобретения соединения общей формулы (I) в соответствии с данным изобретением обладают РМК1 селективным действием и особенно полезны в лечении расстройств пигментации и воспалительных и иммунных расстройств. Некоторые другие соединения в соответствии с данным изобретением являются селективными к РМК4 и особенно полезны в лечении расстройств питания и метаболизма, а также нейродегенеративных расстройств.
Данное изобретение также относится к терапевтическому или косметическому способу лечения, включающему введение фармацевтической или косметической композиции, содержащей указанное соединение в качестве модулятора одного или более рецепторов меланокортина, и в частности, подтипов 1, 3, 4 и 5. В одном конкретном варианте, данное изобретение также относится к терапевтическому или косметическому способу, включающему введение фармацевтической или косметической композиции, содержащей указанное соединение, для лечения расстройств пигментации и воспалительных и иммунных расстройств. В одном конкретном варианте, соединениями являются селективные к типу 1 модуляторы.
Данное изобретение также относится к применению соединения общей формулы (I), описанного выше, для получения лекарственного средства для применения в лечении расстройств, связанных с дисфункцией РМК1.
Более конкретно, соединения, применяемые в соответствии с данным изобретением, особенно подходят для лечения и/или профилактики расстройств и/или заболеваний, выбранных из:
- воспалительные заболевания пищеварительного тракта, включая, в частности, кишечник (и особенно толстую кишку при синдроме раздраженного толстого кишечника, язвенного колита и болезни Крона); панкреатит, гепатит (острый и хронический), воспалительные патологические состояния мочевого пузыря и гастрит;
- воспалительные заболевания опорно-двигательного аппарата, включая ревматоидный артрит, остеоартрит, остеопороз, травматический артрит, послеинфекционный артрит, мышечную дегенерацию, дерматомиозит;
- воспалительные заболевания мочеполовой системы, и в частности, гломерулонефрит;
- воспалительные заболевания сердечной системы, и в частности, перикардит и миокардит, и заболевания, включающие такие, в основе которых лежит воспаление. Эти заболевания включают, но не ограничены ими, атеросклероз, атеросклероз трансплантата, заболевания периферийных сосудов, воспалительные заболевания сосудов, перемежающуюся хромоту или прихрамывание, рестеноз, удар, преходящее нарушение мозгового кровообращения, ишемию миокарда и инфаркт миокарда. Эти соединения также могут применяться для лечения гипертонии, гиперлипидемии, заболеваний коронарной артерии, нестабильной стенокардии (или грудной жабы), тромбоза, агрегации тромбоцитов, вызванной тромбином и/или последствиями тромбоза и/или образования атеросклеротических бляшек;
- воспалительные заболевания дыхательного и ЛОР тракта, включая, в частности, астму, острый респираторный дистресс-синдром, сенную лихорадку, аллергический ринит и хроническое обструктивное заболевание легких. Соединения в соответствии с данным изобретением также могут применяться для лечения аллергий;
- воспалительные заболевания центральной нервной системы, и в частности, болезнь Альцгеймера и любая форма слабоумия, болезнь Паркинсона, болезнь Крейцфельдта-Якоба, рассеянный склероз, менингит;
- воспалительные заболевания кожи, и в частности, крапивница, склеродерма, контактный дерматит, атопический дерматит, псориаз, ихтиоз, акне и другие формы фолликулита, красные угри и облысение;
- аутоиммунные заболевания, и в частности, красная волчанка, состояния щитовидной железы, аутоиммунные заболевания надпочечников и аутоиммунный гастрит, витилиго и очаговая алопеция;
- воспаления, сопровождающие бактериальные, вирусные и грибковые инфекции, в частности, туберкулез, сепсис, лихорадка, ВИЧ независимо от нахождения инфекции, герпес, цитомегаловирус, гепатит А, В и С;
- отторжение трансплантата или графта, таких как почки, печень, легкие, поджелудочная железа, костный мозг, роговица, тонкий кишечник, кожа (аллографт гомографт и гетерографт кожи и т.д.).
Кроме того, эти соединения могут применяться для лечения боли, независимо от ее происхождения: послеоперационная боль, нервно-мышечная боль, головная боль, раковая боль, зубная боль, костно-суставная боль.
Эти соединения могут применяться для модулирования пигментации и, в результате, для:
- лечения заболеваний с расстройством пигментации, и в частности, доброкачественных дерматозов, таких как витилиго, альбинизм, меланодермия, лентигиноз, пятна на коже, меланоцитарный невус и все пост-воспалительные пигментации; а также пигментированные опухоли, такие как меланола и местные метастазы (проникающие узелки), их местные метастазы или системные метастазы;
- фотозащита от солнечного света с целью профилактики;
- повреждающего действия солнечного света, такого как фотохимически активная эритема, старение кожи, рак кожи (позвоночно-клеточный, базально-клеточный и меланома), и, в частности, заболеваний, где свет усиливает наступление (пигментная ксеродерма, синдром невуса базальных клеток, наследственная меланома);
- фотодерматозы вследствие экзогенных фотосенсибилизирующих агентов, и в частности, вызванные контактными фотосенсибилизирующими агентами (например, фурокумаринами, галогенированными салициланилидами и производными, и местными сульфамидами и производными) или вызванные фотосенсибилизирующими агентами через системный путь (например, псораленами, тетрациклинами, сульфамидами, фенотиазинами, налидиксиновой кислотой, трициклическими антидепрессантами);
- приступов дерматоза с фоточувствительностью, и в частности,
- фотообострений (например, красной волчанки, вторичного герпеса, врожденных пойкилодермических или телеангиэктатических состояний с фоточувствительностью (синдром Блума, синдром Кокайна, синдром Ротмунда-Томсона), фотохимически активного красного плоского лишая, фотохимически активной гранулемы, диссеминированного поверхностного фотохимически активного порокератоза, розовых угрей, юношеских угрей, буллезного дерматоза, болезни Дарьера, кожной лимфомы, псориаза, атопического дерматита, контактной экземы, фолликулярного муциноза, полиморфной эритемы, лекарственной эритемы, кожной лимфоцитомы, ретикулярной эритемы с муцинозом, меланолермии),
- дерматозы с фоточувствительностью, вызванной дефицитом защитной системы с аномалиями образования или распределения меланина (например, окулокутанный альбинизм, фенилкетонурия, начальная гипофизарная недостаточность, витилиго, «пегая кожа») и с дефицитом системы восстановления ДНК (например, пигментная ксеродерма, синдром Кокайна),
- дерматозы с фоточувствительностью, вызванной аномалиями метаболизма, такие как кожная порфирия (например, поздняя кожная порфирия, смешанные порфирии, эритропоэтическая протопорфирия, мочеполовая эритропоэтическая порфирия (болезнь Гюнтера), эритропоэтическая копропорфирия), пеллагра или пеллагроидные эритемы (например, пеллагра, пеллагроидные эритемы и расстройства метаболизма триптофана);
- идиопатические приступы фотодерматоза, и в частности, PMLE (полиморфный фотодерматоз), доброкачественное высыпание от солнечного света, солнечная почесуха, хроническая фотосенсибилизация (фотохимически активный ретикулез, хронический фотохимически активный дерматоз, фоточувствительная экзема), солнечная крапивница, световая оспа, юношеские весенние высыпания, солнечный зуд),
- модулирования цвета кожи или волос и голове и на теле, и в частности, загорания кожи через повышение синтеза меланина, или отбеливания кожи через вмешательство в синтез меланина, профилактики поседения волос (например, поседение и «пегая кожа»);
- модификации цвета волос головы и тела при косметических показаниях.
Эти соединения могут применяться для модулирования функции сальных желез для:
- лечения состояний с гиперсебореей, а в частности, акне, себорейного дерматита, жирной кожи и жирных волос, гиперсебореи при болезни Паркинсона и эпилепсии, и гиперандрогенизма;
- лечения состояний с пониженной секрецией сальных желез, и в частности, ксероза и всех состояний сухости кожи;
- регулирования доброкачественной и злокачественной пролиферации себоцита и сальной железы;
- лечения воспалительных состояний волосяных фолликулов, и в частности, акне, фурункулов, карбункулов и фолликулитов.
Данное изобретение также относится к применению соединения общей формулы (I), такого как определено выше, для получения лекарственного средства для применения для лечения расстройств, связанных с дисфункцией РМК4.
Соединения в соответствии с данным изобретением также могут применяться для лечения нейродегенеративных расстройств, включая депрессию, тревогу, навязчивые расстройства, такие как навязчивые неврозы, неврозы, психозы, бессонница и расстройство сна, апноэ во сне, и зависимость от лекарственных средств.
Эти соединения могут применяться для лечения мужской или женской половой дисфункции. Мужская половая дисфункция включает, но не ограничена ими, импотенцию, потерю либидо и эректильную дисфункцию.
Женская половая дисфункция включает, но не ограничена ими, расстройства половой стимуляции или расстройства, связанные с желанием, половой восприимчивостью, оргазмом и нарушения основных моментов половой функции. Женская половая дисфункция также включает боль, преждевременные роды, дисменорею, избыточную менструацию и эндометриоз.
Соединения в соответствии с данным изобретением также могут применяться для лечения расстройств, относящихся к весу, но не ограниченных ими, включающих ожирение и анорексию (такую как изменение или ухудшение аппетита, метаболизма селезенки, доброкачественного поглощения жиров и углеводов); сахарного диабета (через толерантность к глюкозе и/или пониженной устойчивости к инсулину).
Соединения также могут применяться для лечения рака, и в частности, рака легких, рака простаты, рака толстой кишки, рака молочной железы, рака яичников и рака костей, или расстройств ангиогенеза, включая образование или рост твердых опухолей.
Объектом данного изобретения также является фармацевтическая композиция для применения, в частности, в лечении указанных выше состояний, которая характеризуется тем, что содержит, в фармацевтически приемлемом носителе, совместимом со способом введения, выбранным для данной композиции, соединение общей формулы (I) или его энантиомер или его соль с фармацевтически приемлемой кислотой.
Термин "фармацевтически приемлемый носитель" означает среду, совместимую с кожей, слизистыми мембранами и придатками кожи.
Введение композиции в соответствии с данным изобретением может проводиться перорально, энтерально, парентерально, местно или через глаза. Предпочтительно, фармацевтическая композиция составлена в форме, подходящей для местного нанесения.
Если она составлена для перорального введения, композиция может быть в форме таблеток, геля, капсул, драже, сиропов, суспензий, растворов, порошков, гранул, эмульсий, суспензий из микросфер или наносфер или жировых или полимерных везикул для контролируемого выделения. Если она составлена для парентерального введения, композиция может быть в форме растворов или суспензий для вливания или инъекции.
Соединения в соответствии с данным изобретением обычно вводят перорально или системно в суточной дозе приблизительно от 0,01 мг/кг до 100 мг/кг массы тела, 1 или более раз.
Соединения применяют системно в концентрации от 0,001% до 10% масс., предпочтительно, от 0,01% до 1% масс., по отношению к общей массе композиции.
При местном введении, фармацевтические композиции в соответствии с данным изобретением более подходят для лечения кожи и слизистых мембран, и могут быть в жидкой, пастообразной или твердой форме, и более конкретно, в форме мазей, кремов, молочка, мазей, порошков, пропитанных подушек, синтетических моющих средств, растворов, гелей, спреев, пен, суспензий, пластырей, шампуней или моющих основ. Они также могут быть в форме суспензий из микросфер или наносфер или жировых или полимерных везикул или полимерных или гелевых пластырей для контролируемого выделения.
Композиции, применяемые для местного введения, имеют концентрацию соединения в соответствии с данным изобретением от 0,001% до 10% масс., предпочтительно от 0,01% до 5% масс., по отношению к общей массе композиции.
Соединения общей формулы (I) в соответствии с данным изобретением также находят применение в косметологии, в частности, для защиты от вредного влияния солнечного света, для профилактики и/или борьбы с вызванным действием света или временным старением кожи и придатков кожи.
Поэтому объектом данного изобретения также является композиция, содержащая, в косметически приемлемом носителе, по крайней мере, одно из соединений общей формулы (I). Термин "косметически приемлемый носитель" означает среду, совместимую с кожей, слизистыми мембранами и придатками кожи.
Объектом данного изобретения является также косметическое применение композиции, содержащей, по крайней мере, одно соединение общей формулы (I), для профилактики и/или лечения признаков старения и/или кожи.
Объектом данного изобретение также является косметическое применение композиции, содержащей, по крайней мере, одно соединение общей формулы (I) для гигиены тела или волос.
Косметическая композиция в соответствии с данным изобретением содержит, в косметически приемлемом носителе, соединение общей формулы (I), или его энантиомер или его соль с фармацевтически приемлемой кислотой, и может быть в форме крема, молочка, геля, суспензий из микросфер или наносфер или жировых или полимерных везикул, пропитанных подушек, растворов, спреев, пен, пластырей, мыла, моющих основ или шампуней.
Концентрация соединения общей формулы (I) в косметической композиции предпочтительно от 0,001% до 10% масс., по отношению к общей массе композиции.
Фармацевтические и косметические композиции, описанные выше, также могут содержать инертные добавки, или фармакодинамически активные добавки относительно фармацевтических композиций, или сочетания этих добавок, и в частности:
- смачивающие агенты;
- улучшители вкуса;
- консерванты, такие как сложные эфиры пара-гидроксибензойной кислоты;
- стабилизаторы;
- регуляторы влажности;
- регуляторы pH;
- модификаторы осмотического давления;
- эмульгаторы;
- УФ-A и УФ-B экранирующие агенты;
- антиоксиданты, такие как α-токоферол, бутилгидроксианизол или бутилгидрокситолуол, супероксиддисмутаза, убихинол;
- умягчители;
- увлажнители, такие как глицерин, ПЭГ 400, тиаморфолинон и его производные или мочевина;
- анитисеборейные или анти-акне агенты, такие как S-карбоксиметилцистеин, S-бензилцистеамин, их соли или их производные, или перекись бензоила.
Конечно, специалисты в данной области техники могут подобрать необязательное соединение(я) для добавления к таким композициям так, чтобы преимущественные свойства, связанные с данным изобретением, не ухудшались или существенно не ухудшались данным добавлением.
Несколько примеров получения соединений общей формулы (I) в соответствии с данным изобретением и результаты тестирования биологической активности данных соединений представлены для иллюстрации и не ограничивают данное изобретение.
В представленных ниже примерах описано получение некоторых соединений в соответствии с данным изобретением. Эти примеры не являются ограничивающими, а только иллюстрируют данное изобретение. Номера представленных соединений такие, как указаны в таблице 1 ниже, в которой показаны химические наименования и физические свойства некоторых соединений в соответствии с данным изобретением.
Применяются следующие аббревиатуры:
- ТТБУ: тетрафторборат N,N,N',N'-тетраметил-O-(бензотриазол-1-ил)урония
- ГОБт: 1-гидрокси-1,2,3-бензотриазол
- ЭДК: гидрохлорид 1-этил-(3-диметиламинопропил)карбодиимида,
- BOC: трет-бутоксикарбонил
- CBz: бензилоксикарбонил
- Fmoc: 6-флуоренилметоксикарбонил
- Tos: п-толуолсульфонил
- ДМФА: диметилформамид
- ДХМ: дихлорметан
- ДИЭА: диизопропилэтиламин
Термин "конформеры" относится к стереоизомерам, которые превращаются друг в друга вращением вокруг связей (одинарной связи, образованной дублетом электронов).
Материалы и способы
Способы ВЭЖХ:
Способ A
Колонка: Gemini 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: CH3CN + 0,05 ТФК
Растворитель B: H2O + 0,05 ТФК
градиент:
|
Способ В
Колонка: Gemini 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: CH3CN + 0,05 ТФК
Растворитель B: H2O + 0,05 ТФК
градиент:
|
Способ С
Колонка: Atlantis C18 150×3,2 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,1 ТФК
Растворитель B: H2O + 0,1 ТФК
градиент:
|
Способ D
Колонка: Gemini 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: CH3CN
Растворитель B: H2O + 0,02 ТФК
градиент:
|
Способ Е
Колонка: Xbridge phenyl 150×2,1 мм, 3,5 мкМ
УФ детектор: 220-420 нм
Скорость потока: 1,0 мл/мин
Растворитель A: 95% MeOH/5% вода + 25 мМ NH4OAc
Растворитель B: H2O + 25 мМ NH4OAc
градиент:
|
Способ F
Колонка: Xbridge phenyl 250×4,6 мм, 5 мкМ
УФ детектор: 220-420 нм
Скорость потока: 1,0 мл/мин
Растворитель A: 90% MeOH/10% вода + 25 мМ NH4OAc
Растворитель B: H2O + 25 мМ NH4OAc
градиент:
|
|
Способ G
Колонка: Xbridge phenyl 250×4,6 мм, 5 мкМ
УФ детектор: 220-420 нм
Скорость потока: 1,0 мл/мин
Растворитель A: 90% MeOH/10% вода + 25 мМ NH4OAc
Растворитель B: H2O + 25 мМ NH4OAc
градиент:
|
Способ Н
Колонка: Gemini С18 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: 94% MeOH/6% вода + 10 мМ NH4OAc
Растворитель B: H2O + 10 мМ NH4OAc
градиент:
|
Способ I
Колонка: Gemini С18 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: H2O + 0,05% ТФК
Растворитель B: CH3CN + 0,05% ТФК
градиент:
|
Способ J
Колонка: Gemini С18 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: MeOH + 0,1% ТФК
Растворитель B: H2O + 0,02 ТФК
градиент:
|
Способ К
Колонка: Gemini С6-phenyl 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: H2O + 0,05% ТФК
Растворитель B: CH3CN + 0,05% ТФК
градиент:
|
Способ L
Колонка: Gemini С18 150×3 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: CH3CN + 0,1% HCOOH
Растворитель B: H2O + 0,1% HCOOH
градиент:
|
Способ М
Колонка: ThermoHypersil Hypurity C18 150×4,6 мм, 5 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,5 мл/мин
Растворитель A: H2O + 0,05% ТФК
Растворитель B: CH3CN + 0,05% ТФК
градиент:
|
|
Способ N
Колонка: Atlantis Т3 150×2,1 мм, 3 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: H2O + 0,05 ТФК
Растворитель B: CH3CN + 0,05 ТФК
градиент:
|
Способ О
Колонка: Atlantis Т3 150×4,6 мм, 5 мкМ
УФ детектор: 220-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: H2O + 0,05 ТФК
Растворитель B: CH3CN + 0,05 ТФК
градиент:
|
Способ Р
Колонка: Atlantis Т3 150×4,6 мм, 5 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,25 мл/мин
Растворитель A: H2O + 0,05 ТФК
Растворитель B: CH3CN + 0,05 ТФК
градиент:
|
Способ Q
Колонка: Atlantis Т3 150×4,6 мм, 5 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: H2O + 0,05 ТФК
Растворитель B: CH3CN + 0,05 ТФК
градиент:
|
Способ R
Колонка: Gemini С6-phenyl 150×3 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,05% ТФК
Растворитель B: H2O + 0,05% ТФК
градиент:
|
Способ S
Колонка: Eclipse XDB C8 150×4,6 мм, 5 мкМ
УФ детектор: 190-420 нм
Скорость потока: 1 мл/мин
Растворитель A: CH3CN + 0,1% HCOOH
Растворитель B: H2O + 0,1% HCOOH
градиент:
|
Способ Т
Колонка: Gemini С6-phenyl 150×3 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,05% ТФК
Растворитель B: H2O + 0,05% ТФК
градиент:
|
Способ U
Колонка: Atlantis Т3 150×4,6 мм, 5 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,05 ТФК
Растворитель B: H2O + 0,05 ТФК
градиент:
|
Способ V
Колонка: Xbridge С18 250×4,5 мм, 5 мкМ
УФ детектор: 190-420 нм
Скорость потока: 1 мл/мин
Растворитель A: CH3CN + 0,05 ТФК
Растворитель B: H2O + 0,05 ТФК
градиент:
|
Способ W
Колонка: Xbridge phenyl 150×3 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 1 мл/мин
Растворитель A: CH3CN + 0,05 ТФК
Растворитель B: H2O + 0,05 ТФК
градиент:
|
Способ Х
Колонка: Atlantis 150×2,1 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,02% ТФК
Растворитель B: H2O + 0,02% ТФК
градиент:
|
Способ Y
Колонка: Xbridge phenyl 250×4 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,8 мл/мин
Растворитель A: CH3CN + 5% ТГФ + 0,02 ТФК
Растворитель B: H2O + 0,02 HCOOH
градиент:
|
|
Способ Z
Колонка: Atlantis Т3 150×2,1 мм, 3 мкМ
УФ детектор: 190-420 нм
Скорость потока: 0,3 мл/мин
Растворитель A: CH3CN + 0,02 ТФК
Растворитель B: H2O + 0,02 ТФК
градиент:
|
Пример 1
N-[(S)-1-[(S)-2-(3-Бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид (соединение № 3; таблица I)
1-1 (S)-2-[(S)-2-Бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропановая кислота
5,07 г (15,8 ммоль) ТТБУ добавляют к раствору, содержащему 4,05 г (15,6 ммоль) (5)-2-бензоиламино-3-(1H-имидазол-4-ил)пропановой кислоты в 30 мл ДМФА. Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды. Добавляют 3 г (14,3 ммоль) метил (S)-2-амино-3-(4-метоксифенил)пропаноата и 7,5 мл ДИЭА в 20 мл ДМФА по каплям, и перемешивают при температуре окружающей среды в течение 4 часов. Реакцию останавливают добавлением воды, и органические продуты, экстрагируют дихлорметаном. Органическую фазу сушат в присутствии сульфата магния. После фильтрации раствор выпаривают. Получают 6,56 г бледно-желтого твердого вещества, и растворяют в 100 мл THF. Добавляют 29 мл 1н раствора LiOH. Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов. Добавляют 20 мл насыщенного раствора хлорида алюминия с последующим экстрагированием диэтиловым эфиром. Водную фазу подкисляют до pH 5 добавлением 1н раствора HCl. Полученный белый осадок отфильтровывают и сушат в печи в вакууме при 40°C. Получают 5,6 г (12,8 ммоль) (S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропановой кислоты с выходом 88%.
1-2 N-[(S)-1-[(S)-2-(3-Бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
1-2-1 3-Гидрокси-3-фенил-1-(трет-бутоксикарбонил)азетидин
3,9 мл (11,7 ммоль) 3M раствора бромида фенилмагния в диэтиловом эфире по каплям добавляют к раствору, погруженному в баню при -50°C, содержащему 500 мг (2,92 ммоль) 3-оксо-1-(трет-бутоксикарбонил)азетидина в 10 мл THF. Среду перемешивают в течение 1 часа при -50°C и гидролизуют добавлением насыщенного раствора хлорида аммония. После возвращения к температуре окружающей среды добавляют 1н раствор хлороводородной кислоты с последующим экстрагированием этилацетатом. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают на двуокиси кремния в 7/3 смеси гептана/этилацетата. Получают 253 мг в виде белого порошка с выходом 35%.
1-2-2 3-Бутокси-3-фенил-1-(трет-бутоксикарбонил)азетидин
Раствор 1 г (4,0 ммоль) 3-гидрокси-3-фенил-1-(трет-бутоксикарбонил)азетидина, растворенного в 5 мл ДМФА, добавляют по каплям к суспензии 300 мг 60% NaH в 3 мл ДМФА, погруженной в баню при 0°C. По каплям добавляют 2,5 мл н-йодбутана. Реакционную среду перемешивают при 0°C в течение 15 минут и в течение 72 часов при температуре окружающей среды. Среду гидролизуют добавлением насыщенного раствора хлорида аммония с последующим экстрагированием этилацетатом. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают на двуокиси кремния в 7/3 смеси гептана/этилацетата. Получают 500 мг в форме светло-желтого масла с выходом 41%.
1-2-3 Трифторацетат 3-Бутокси-3-фенилазетидин
1 мл трифторуксусной кислоты добавляют к раствору, содержащему 500 мг (1,64 ммоль) 3-бутокси-3-фенил-1-(трет-бутоксикарбонил)азетидина, растворенного в 5 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 3 часов, затем концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). Получают 400 мг в виде бледно-желтого порошка с выходом 76%.
1-3 N-[(S)-1-[(S)-2-(3-Бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
1 мл раствора 3/2 дихлорметана/трифторуксусной кислоты добавляют к 200 мг (0,343 ммоль) (S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропановой кислоты. После перемешивания при температуре окружающей среды в течение 1 часа растворители выпаривают. Полученный остаток растворяют в 5 мл ДМФА, и добавляют 110 мг (0,343 ммоль) ТТБУ и 2,37 мл ДИЭА. Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды. По каплям добавляют 47 мг (0,147 ммоль) трифторацетата 3-бутокси-3-фенилазетидина, растворенного в 5 мл 1/4 ДХМ/ДМФА растворе, и перемешивают при температуре окружающей среды в течение 16 часов. Добавляют 5% раствор лимонной кислоты с последующим экстрагированием дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната калия. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 9/1 дихлорметан/метанол). Получают 55 мг N-[(S)-1-[(S)-2-(3-бутокси-3-фенилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамида в форме белого порошка с выходом 60%.
ВЭЖХ: (способ A); 2 пика (смеси конформеров): время удержания: 16,44 мин и 16,60 мин, (34+57)%, M+H: 624.
Пример 2
[1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-(4-фторфенил)азетидин-3-иловый]эфир масляной кислоты (соединение № 6; таблица I):
2-1 3-(4-Фторфенил)-3-гидрокси-1-(трет-бутоксикарбонил)азетидин
6 мл (11,7 ммоль) 2M раствора бромида 4-фторфенилмагния в диэтиловом эфире по каплям добавляют к раствору, погруженному в баню при -50°C, содержащему 500 мг (2,92 ммоль) 3-оксо-1-(трет-бутоксикарбонил)азетидин в 10 мл ТГФ. Среду перемешивают в течение 1 часа при -50°C и гидролизуют добавлением насыщенного раствора хлорида аммония. После возвращения к температуре окружающей среды добавляют 1н раствор хлороводородной кислоты с последующим экстрагированием этилацетатом. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 7/3 гептан/этилацетат). Получают 333 мг в форме белого порошка с выходом 43%.
2-2 3-Бутурилокси-3-(4-фторфенил)-1-(трет-бутоксикарбонил)азетидин
23 мг (0,188 ммоль) ДМАП и 0,03 мл пиридина добавляют к раствору, содержащему 50 мг (0,187 ммоль) 3-бутурилокси-3-(4-фторфенил)-1-(трет-бутоксикарбонил)азетидина в 1 мл дихлорметана. После перемешивания при температуре окружающей среды в течение 10 минут добавляют 0,06 мл масляного ангидрида. Через 3 часа добавляют насыщенный раствор хлорида аммония с последующим экстрагированием дихлорметаном. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 7/3 гептан/этилацетат). Получают 61 мг в виде бесцветного масла с выходом 97%.
2-3 Трифторацетат бутирата 3-(4-фторфенил)азетидин-3-ила
2 мл трифторуксусной кислоты добавляют к раствору, содержащему 61 мг (0,181 ммоль) 3-гидрокси-3-(4-фторфенил)-1-(трет-бутоксикарбонил)азетидина, растворенного в 8 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 3 часов и затем концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). Получают 40 мг в виде бледно-желтого масла с выходом 63%.
2-4 1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-(4-фторфенил)азетидин-3-иловый эфир масляной кислоты
1 мл раствора 3/2 дихлорметана/трифторуксусной кислоты добавляют к 109 мг (0,252 ммоль) (S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропановой кислоты (см. методику 1-1). После перемешивания при комнатной температуре в течение 1 часа растворители выпаривают. Полученный остаток растворяют в 5 мл ДМФА и добавляют 81 мг (0,252 ммоль) ТТБУ и 1,74 мл ДИЭА. Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды. По каплям добавляют 40 мг (0,114 ммоль) трифторацетата бутирата 3-(4-фторфенил)азетидин-3-ила, растворенные в 5 мл 1/4 раствора дихлорметана/диметилформамида, и перемешивают при комнатной температуре в течение 16 часов. Добавляют 5% раствор лимонной кислоты с последующим экстрагированием дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната калия. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 9/1 дихлорметан/метанол). Получают 19 мг 1-[(S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропионил]-3-(4-фторфенил)азетидин-3-илового эфира масляной кислоты в форме белого порошка с выходом 25%.
ВЭЖХ: (способ B): 2 пика (смеси конформеров): время удержания: 13,51 мин и 13,72 мин, (28+55)%, M+H: 656.
Пример 3
N-[(S)-1-[(S)-2-(3-циклогексил-3-гидроксиазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид (соединение № 7; таблица I)
3-1 3-Циклогексил-3-гидрокси-1-(трет-бутоксикарбонил)азетидин
0,5 мл уксусной кислоты и 40 мг родия на окиси алюминия 5% добавляют к раствору, содержащему 117 мг (0,470 ммоль) 3-гидрокси-3-фенил-1-(трет-бутоксикарбонил)азетидина (см. методику 1-2-1), растворенного в 4 мл метанола. Реакционную среду помещают в водород под давлением 4 бара и нагревают при 85°C в течение 4 часов. Катализатор отфильтровывают и промывают метанолом и растворители выпаривают. Получают 120 мг в виде порошка с выходом 100%.
3-2 Трифторацетат 3-циклогексилазетидин-3-ол
1 мл трифторуксусной кислоты добавляют к раствору, содержащему 120 мг (0,47 ммоль) 3-циклогексил-3-гидрокси-1-(трет-бутоксикарбонил)азетидина, растворенного в 3 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 1 часа и затем концентрируют досуха и применяют без дальнейшей очистки.
3-3 N-[(S)-1-[(S)-2-(3-Циклогексил-3-гидроксиазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамид
1 мл 3/2 раствора дихлорметана/трифторуксусной кислоты добавляют к 84 мг (0,193 ммоль) (S)-2-[(S)-2-бензоиламино-3-(1H-имидазол-4-ил)пропиониламино]-3-(4-метоксифенил)пропановой кислоты (см. методику 1-1). После перемешивания при температуре окружающей среды в течение 1 часа растворители выпаривают. Полученный остаток растворяют в 1 мл ДМФА, и добавляют 79 мг (0,246 ммоль) ТТБУ и 15 капель ДИЭА. По каплям добавляют 0,235 ммоль трифторацетата 3-циклогексилазетидин-3-ола, растворенного в 1 мл раствора ДХМ, и перемешивают при температуре окружающей среды в течение 2 часов. Добавляют насыщенный раствор гидрокарбоната натрия с последующим экстрагированием дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 85/15 смесь дихлорметана/метанола). Получают 35 мг N-[(S)-1-[(S)-2-(3-циклогексил-3-гидроксиазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтилкарбамоил]-2-(1H-имидазол-4-ил)этил]бензамида в виде желтого порошка с выходом 32%.
ВЭЖХ: (способ B): 2 пика (смесь конформеров): время удержания: 10,68 мин и 10,94 мин, (36+62)%, M+H: 574.
Пример 4
N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид (соединение № 24; таблица I)
4-1 3-Пентилокси-3-o-толил-1-(трет-бутоксикарбонил)азетидин
Раствор 3,53 г (13,4 ммоль) 3-гидрокси-3-фенил-1-(трет-бутоксикарбонил)азетидина (см. методику 1-2-1) по каплям добавляют к суспензии 1,07 г (26,8 ммоль) 60% NaH в 17 мл ДМФА, погруженной в баню при 0°C. По каплям добавляют 9,0 мл н-йодпентана. Реакционную среду перемешивают при 0°C в течение 15 минут и в течение 24 часов при температуре окружающей среды. Среду гидролизуют добавлением насыщенного раствора хлорида аммония с последующим экстрагированием этилацетатом. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 7/3 гептан/этилацетат). Получают 3,41 г в виде светло-желтого масла с выходом 76%.
4-2 трифторацетат 3-пентокси-3'-фенилазетидина
5,5 мл трифторуксусной кислоты добавляют к раствору, содержащему 3,34 г (10 ммоль) 3-пентокси-3-фенил-1-(трет-бутоксикарбонил)азетидина, растворенного в 10 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 2 часов 30 мин и затем концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). Получают 3,5 г в виде бледно-желтого масла с выходом 100%.
4-3 трет-бутил [(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]карбамат
2,93 г (9,93 ммоль) (R)-2-трет-бутокси-карбониламино-3-(4-метоксифенил)пропионовой кислоты растворяют в 10 мл ДМФА. Затем добавляют 2,08 г (10,9 ммоль) ЭДК, 1,47 г (10,9 ммоль) ГОБт и раствор 3,45 г (9,93 ммоль) трифторацетата 3-пентокси-3-фенилазетидина в 15 мл ДМФА. Добавляют 7 мл (40,2 ммоль) ДИЭА. Реакционную среду перемешивают при температуре окружающей среды в течение 2 ч 30 и затем экстрагируют этилацетатом. Органическую фазу промывают 1н гидроксидом натрия и затем сушат над сульфатом магния, фильтруют и выпаривают. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 6/4 гептан/этилацетат). Получают 2,83 г в виде белого порошка с выходом 56%.
4-4 трифторацетат (R)-2-Амино-3-(4-метоксифенил)-1-(3-пентилокси-3-o-толилазетидин-1-ил)пропан-1-он
2,81 г (5,5 ммоль) трет-бутил [(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]карбамата солюбилизируют в 10 мл дихлорметана. Реакционную среду охлаждают до 0°C. Затем добавляют 6,5 мл трифторуксусной кислоты. После возвращения к температуре окружающей среды реакционную среду перемешивают в течение 5 часов и затем концентрируют досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 9/1 дихлорметан/метанол). Получают 2,81 г в форме белого порошка с выходом 97%.
4-5 N-[(R)-1-(4-Метоксибензил)-2-оксо-2-(3-пентилокси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
670 мг (2,08 ммоль) ТТБУ, 0,8 мл триэтиламина и затем 1,0 г (1,91 ммоль) трифторацетата (R)-2-амино-3-(4-метоксифенил)-1-(3-пентилокси-3-o-толилазетидин-1-ил)пропан-1-она добавляют к раствору, содержащему 370 мг (2,10 ммоль) гидрохлорида дезаминогистидина в 15 мл диметилформамида. Реакционную среду перемешивают при температуре окружающей среды в течение 21 часа. Реакцию останавливают добавлением 1н раствора гидроксида натрия и затем проводят экстрагирование дихлорметаном. Органические фазы объединяют и сушат над сульфатом натрия. После фильтрации растворители выпаривают, и остаток затем очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). Получают 598 мг N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-окси-3-o-толилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамида в форме белого порошка с выходом 59%.
ВЭЖХ: (способ M); время удержания: 18,20 мин, 99%, M+H: 533.
Пример 5
N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид (соединение № 26; таблица I)
5-1 Метил (R)-2-амино-3-(4-метоксифенил)пропаноат
20 мл серной кислоты добавляют, по каплям, в течение более 30 минут, к раствору, содержащему 13 г (66,6 ммоль) (R)-2-амино-3-(4-метоксифенил)пропионовой кислоты в 150 мл метанола. После перемешивания в течение 24 часов при температуре окружающей среды реакционную среду подщелачивают до pH 8-9 добавлением 10н гидроксида натрия и насыщенного раствора гидрокарбоната натрия, с последующим экстрагированием дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают. Получают 12,8 г в виде бледно-желтого масла с выходом 92%.
5-2 Метил (R)-2-(3-1H-имидазол-4-илпропиониламино)-3-(4-метоксифенил)пропаноат
35,5 мл ДИЭА добавляют к раствору, содержащему 13,2 г (74,7 ммоль) гидрохлорида дезаминогистидина и 24 г (74,7 ммоль) ТТБУ в 100 мл ДМФА. После перемешивания в течение 15 минут при температуре окружающей среды добавляют 14,2 г (67,9 ммоль) метил (R)-2-амино-3-(4-метоксифенил)пропаноата в 150 мл ДМФА. Реакционную среду перемешивают в течение 16 часов и затем подщелачивают до pH=8-9 добавлением 1н гидроксида натрия и насыщенного раствора гидрокарбоната натрия, с последующим экстрагированием дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 85/15 дихлорметан/метанол). Получают 11,0 г в виде оранжевого масла с выходом 49%.
5-3 (R)-2-(3-1H-имидазол-4-илпропиониламино)-3-(4-метоксифенил)пропановая кислота
40 мл 1н водный раствор гидроксида лития добавляют к раствору, содержащему 11,0 г (33,3 ммоль) метил (R)-2-(3-1H-имидазол-4-илпропиониламино)-3-(4-метоксифенил)пропаноата в 100 мл ТГФ. После перемешивания в течение 16 часов реакционную среду концентрируют. Остаток очищают хроматографией на силикагеле (элюент 70/30/1 дихлорметан/метанол/триэтиламин). Получают 8,4 г в виде белого порошка с выходом 79%.
5-4-1 2-Фенилгептаннитрил
5 г (42,7 ммоль) фенилацетонитрила по каплям добавляют к суспензии 2 г 60% NaH в 50 мл ДМФА, охлажденной до 0°C. После перемешивания в течение 30 минут при 0°C по каплям добавляют 5,32 мл (42,7 ммоль) бромпентана. Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды и затем обрабатывают льдом и экстрагируют этиловым эфиром. Органическую фазу промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Получают оранжево-желтое масло и очищают фракционной перегонкой при пониженном давлении (70-75°C при 1×10-1 мбар). Получают 5,14 г в виде оранжевого масла с выходом 64%.
5-4-2 2-Гидроксиметил-2-фенилгептаннитрил
5,14 г (27,4 ммоль) 2-фенилгептаннитрила добавляют к суспензии 1,34 г 60% NaH в 50 мл ДМФА, охлажденной до 0°C. После перемешивания в течение 30 минут порциями добавляют 7,6 г (220 ммоль) параформальдегида. Реакционную среду перемешивают при температуре окружающей среды в течение 6 часов и затем гидролизуют на льду и экстрагируют диэтиловым эфиром. Органическую фазу промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 8/2 гептан/этилацетат). Получают 4,24 г в виде бледно-желтого масла с выходом 71%.
5-4-3 2-циано-2-фенилгептиловый эфир толуол-4-сульфоновой кислоты
4,1 г (21,5 ммоль) п-толуолсульфонилхлорида и 6 мл триэтиламина добавляют к раствору, содержащему 4,24 г (19,5 ммоль) 2-гидроксиметил-2-фенилгептаннитрила в 25 мл дихлорметана. Реакционную среду перемешивают в течение 15 часов при температуре окружающей среды и затем обрабатывают 1н раствором хлороводородной кислоты и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Получают желтое масло и осаждают из смеси 9/1 гептана/диизопропилового эфира. Полученный осадок отфильтровывают и промывают диизопропиловым эфиром. Получают 5,26 г в виде бежевого порошка с выходом 72%.
5-4-4 3-Пентил-3-фенилазетидин
600 мг (15,52 ммоль) порошкового LiAlH4 осторожно добавляют к раствору, содержащему 5,26 г (14,15 ммоль) 2-циано-2-фенилгептилового эфира толуол-4-сульфоновой кислоты в 25 мл ТГФ под азотом. Реакционную среду перемешивают в течение 1 часа при температуре окружающей среды и затем обрабатывают водным раствором сульфата натрия. После перемешивания в течение 30 минут при температуре окружающей среды образуется соль, которую отфильтровывают, и фильтрат выпаривают при пониженном давлении. Остаток помещают в дихлорметан и промывают 1н водным раствором гидроксида натрия. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают при пониженном давлении. Получают 2,90 г в виде бесцветного масла, которое применяют на следующей стадии без дальнейшей очистки.
5-4-5 N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамид
70 мг (0,345 ммоль) 3-пентил-3-фенилазетидина и 100 мг (0,315 ммоль) (R)-2-(3-1H-имидазол-4-илпропиониламино)-3-(4-метоксифенил)пропановой кислоты солюбилизируют в 1 мл ДМФА. К этому раствору добавляют 67 мг (0,345 ммоль) ЭДК и 47 мг (0,345 ммоль) HOBT. Смесь перемешивают в течение 4 часов и затем обрабатывают 1н гидроксидом натрия и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Неочищенный продукт очищают хроматографией на силикагеле (элюент 9/1 дихлорметан/метанол). Получают 85 мг N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(1H-имидазол-4-ил)пропионамида в виде белого порошка с выходом 49%.
ВЭЖХ: (способ L); время удержания: 22,96 мин, 97%, M+H: 503.
Пример 6
N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-[1,2,3]триазол-4-ил)пропионамид (соединение № 39; таблица I)
6-1 3-(1H-[1,2,3]триазол-4-ил)пропановая кислота
39 мг 10% палладия на угле добавляют к раствору, содержащему 390 мг (1,7 ммоль) 3-(1-бензил-1H[1,2,3]триазол-4-ил)пропановой кислоты в 3 мл метанола. Реакционную смесь помещают под 10 бар давление водорода и перемешивают при 60°C в течение 16 часов. После фильтрации через целит растворители выпаривают и остаток очищают хроматографией на силикагеле (элюент 95/5 дихлорметан/метанол). Получают 159,8 мг 3-(1H[1,2,3]триазол-4-ил)пропановой кислоты в виде белого порошка с выходом 67%.
6-2 гидрохлорид (R)-2-амино-3-(4-метоксифенил)-1-(3-бутилокси-3-o-толилазетидин-1-ил)пропан-1-она
6 мл 4н раствор хлороводородной кислоты в этилацетате добавляют к 615 мг (1,24 ммоль) трет-бутил [(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамата (методика идентична 4-3). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов. Полученный осадок отфильтровывают, промывают диэтиловым эфиром и затем растворяют в метаноле, с последующим выпариванием растворителей. 441 мг гидрохлорида (R)-2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она получают в виде белого порошка с выходом 82%.
6-3 N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H[1,2,3]триазол-4-ил)пропионамид
146 мг (0,34 ммоль) гидрохлорида (R)-2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она в 2 мл диметилформамиде добавляют к раствору 47 мг (0,34 ммоль) 3-(1H[1,2,3]триазол-4-ил)пропановой кислоты, 119 мг (0,37 ммоль) ТТБУ и 0,15 мл (1,1 ммоль) триэтиламина в 2 мл диметилформамида. Реакционную смесь перемешивают в течение 2 часов при температуре окружающей среды. Реакцию останавливают добавлением 10 мл воды и затем экстрагируют этилацетатом. Органические фазы объединяют, промывают 1н раствор гидроксида натрия и затем насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После фильтрации растворители выпаривают, и остаток очищают хроматографией на силикагеле (элюент 90/10 этилацетат/гептан). 78,6 мг N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H[1,2,3]триазол-4-ил)пропионамида получают в виде белого порошка с выходом 45%.
ВЭЖХ: (способ M); время удержания: 19,03 мин, 93%, M+H: 520.
Пример 7
N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамид (соединение № 41; таблица I):
7-1 3-(5-Метил-3H-имидазол-4-ил)пропановая кислота
50 мг 10% палладия на угле добавляют к 500 мг (2,65 ммоль) хлорида 3-(5-метил-3H-имидазол-4-ил)акриловой кислоты в 10 мл 0,5н растворе гидроксида натрия. Реакционную смесь помещают под 6 бар давление водорода и перемешивают при 80°C в течение 72 часов. После фильтрации катализатора через целит остаток подкисляют до pH 2 добавлением хлороводородной кислоты, концентрируют досуха и помещают в этанол. Нерастворимый материал отфильтровывают, и фильтрат концентрируют досуха. 102 мг хлорида 3-(5-метил-3H-имидазол-4-ил)пропановой кислоты получают в виде белого порошка с выходом 16%.
7-2 N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамид
146 мг (0,34 ммоль) гидрохлорида (R)-2-амино-3-(4-метоксифенил)-1-(3-бутилокси-3-o-толилазетидин-1-ил)пропан-1-она в растворе 2 мл диметилформамида добавляют к раствору 64 мг (0,34 ммоль) хлорида 3-(5-метил-3H-имидазол-4-ил)пропановой кислоты, 119 мг (2,34 ммоль) ТТБУ и 0,15 мл (1,1 ммоль) триэтиламина в 2 мл диметилформамида. Реакционную смесь перемешивают в течение 2 часов при температуре окружающей среды. Реакцию останавливают добавлением 10 мл воды и затем экстрагируют этилацетатом. Органические фазы объединяют, промывают 1н раствором гидроксида натрия и затем насыщенным раствором хлорида натрия, и сушат над сульфатом натрия. После фильтрации растворители выпаривают, и остаток затем очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). 154 мг N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-3H-имидазол-4-ил)пропионамида получают в виде белого порошка с выходом 86%.
ВЭЖХ: (способ M); время удержания: 17,65 мин, 96%, M+H: 533.
Пример 8
N-[(S)-2-(3-Гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид (соединение № 11; таблица I)
8-1 Трифторацетат 3-гидрокси-3-фенилазетидина
1 мл трифторуксусной кислоты добавляют к раствору, содержащему 50 мг (0,19 ммоль) трет-бутил 3-гидрокси-3-фенилазетидин-1-карбоксилата, растворенного в 4 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 3 часов, и затем концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 90/10 дихлорметан/метанол). Получают 36 мг в виде белого порошка с выходом 68%.
8-2 Трифторацетат N-[(S)-2-(3-гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида
2 мл ДМФА, 106 мг (0,33 ммоль) ТТБУ и 1 мл ДИЭА добавляют к 105 мг (0,33 ммоль) (R)-2-(3-1H-имидазол-4-илпропиониламино)-3-(4-метоксифенил)пропановой кислоты. Реакционную среду перемешивают в течение 15 минут при температуре окружающей среды. 36 мг (0,13 ммоль) трифторацетата 3-гидрокси-3-фенилазетидина, растворенного в 5 мл 1/4 ДХМ/ДМФА растворе по каплям добавляют и перемешивают при температуре окружающей среды в течение 16 часов. Добавляют 5% раствор лимонной кислоты с последующим экстрагированием дихлорметаном. Органическую фазу промывают насыщенным раствором гидрокарбоната калия. Органическую фазу сушат и выпаривают досуха. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 9/1 дихлорметан/метанол). 6 мг трифторацетата N-[(S)-2-(3-гидрокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида в виде белого порошка с выходом 10%.
ВЭЖХ: (способ D); время удержания: 9,25 мин, 89%, M+H: 463.
Пример 9
N-[(R)-2-[3-(4-Фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид (соединение № 38; таблица I)
9-1-1 (4-Фторфенил)гептаннитрил
5 г (37,0 ммоль) (4-фторфенил)ацетонитрила по каплям добавляют к суспензии 1,62 г 60% NaH в 50 мл ДМФА, охлажденной до 0°C. После перемешивания в течение 30 минут при 0°C, по каплям добавляют 4,62 ммоль (37,0 ммоль) бромпентана. Реакционную среду перемешивают в течение 16 часов при температуре окружающей среды и затем обрабатывают льдом и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Получают оранжево-желтое масло и применяют его на следующей стадии.
9-1-2 2-Гидроксиметил-2-(4-фторфенил)гептаннитрил
Неочищенный (4-фторфенил)гептаннитрил, полученный на стадии 9-1-1, добавляют к суспензии 1,62 г 60% NaH в 50 мл ДМФА, охлажденной до 0°C. После перемешивания в течение 30 минут порциями добавляют 8,9 г (296 ммоль) параформальдегида. Реакционную среду перемешивают при температуре окружающей среды в течение 3 часов, затем гидролизуют льдом и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент 8/2 гептан/этилацетат). Получают 3,85 г в виде бледно-желтого масла с выходом 44%.
9-1-3 2-циано-2-(4-фторфенил)гептиловый эфир толуол-4-сульфоновой кислоты
3,43 г (18,0 ммоль) хлорида п-толуолсульфонила и 5 мл триэтиламина добавляют к раствору, содержащему 3,85 г (16,4 ммоль) 2-гидроксиметил-2-(4-фторфенил)гептаннитрила в 40 мл дихлорметана. Реакционную среду перемешивают в течение 15 часов при температуре окружающей среды и затем обрабатывают 1н раствором хлороводородной кислоты и экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают под давлением. Получают желтое масло и осаждают из 8/2 смеси дихлорметана/диизопропилового эфира. Полученный осадок отфильтровывают. Получают 4,4 г в виде бежевого порошка с выходом 65%.
9-1-4 3-Пентил-3-(4-фторфенил)азетидин
471 мг (12,4 ммоль) порошкового LiAlH4 осторожно добавляют к раствору, содержащему 4,4 г (11,3 ммоль) 2-циано-2-(4-фторфенил)гептилового эфира толуол-4-сульфоновой кислоты в 40 мл ТГФ под азотом. Реакционную смесь перемешивают в течение 1 часа при температуре окружающей среды, и затем обрабатывают водным раствором сульфата натрия. После перемешивания в течение 30 минут при температуре окружающей среды, полученные соли отфильтровывают, и фильтрат выпаривают при пониженном давлении. Остаток помещают в дихлорметан и промывают 1н водным раствором гидроксида натрия. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают при пониженном давлении. Получают 2,02 г в виде желтого масла и применяют на следующей стадии без дальнейшей очистки.
9-2 Трет-бутил [(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-(4-фторфенил)азетидин-1-ил)этил]карбамат
606 мг (2,05 ммоль) (R)-2-трет-бутокси-карбониламино-3-(4-метоксифенил)пропионовой кислоты и 500 мг (2,26 ммоль) 3-пентил-3-(4-фтор-фенил)азетидина растворяют в 10 мл ДМФА. К этому раствору добавляют 473 мг (2,46 ммоль) ЭДК, 333 мг (2,46 ммоль) ГОБт и 0,6 мл (4,5 ммоль) триэтиламина. Реакционную среду перемешивают при температуре окружающей среды в течение 5 ч и экстрагируют дихлорметаном. Органическую фазу промывают 1н гидроксида натрия и затем сушат над сульфатом магния, фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на силикагеле (элюент 6/4 гептан/этилацетат). Получают 780 мг в виде белого порошка с выходом 76%.
9-3 (R)-2-Амино-3-(4-метоксифенил)-1-(3-пентил-3-(4-фторфенил)азетидин-1-ил)-пропан-1-он
780 мг (1,56 ммоль) трет-бутил [(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-(4-фтор-фенил)азетидин-1-ил)этил]карбамата солюбилизируют в 10 мл дихлорметана. Добавляют 4 мл трифторуксусной кислоты. Реакционную среду перемешивают в течение 1 часа и затем концентрируют досуха. Остаток помещают в 1н водный раствор гидроксида натрия и экстрагируют дихлорметаном и затем полученный продукт сушат над сульфатом магния, фильтруют и выпаривают.
590 мг в виде бесцветной смолы получают с выходом 95%.
9-4 N-[(R)-2-[3-(4-Фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида
600 мг (1,86 ммоль) ТТБУ и 0,45 мл триэтиламина добавляют к раствору, содержащему 330 мг (1,86 ммоль) гидрохлорида дезаминогистидина в 5 мл диметилформамида. После перемешивания в течение 15 минут добавляют 590 мг (1,55 ммоль) (R)-2-амино-3-(4-метоксифенил)-1-(3-пентил-3-(4-фторфенил)азетидин-1-ил)пропан-1-она, растворенного в 5 мл диметилформамида. Реакционную смесь перемешивают при температуре окружающей среды в течение 3 дней. Реакцию останавливают добавлением 1н раствора гидроксида натрия и затем экстрагируют смесью 1/1 гептана/этилацетата. Органические фазы объединяют и сушат над сульфатом натрия. После фильтрации растворители выпаривают, и остаток очищают хроматографией на силикагеле (элюент 85/15 дихлорметан/метанол). Получают 490 мг N-[(R)-2-[3-(4-фторфенил)-3-пентилазетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид в виде белого порошка с выходом 61%.
ВЭЖХ: (способ O); время удержания: 15,85 мин, 99%, M+H: 521.
Пример 10
N-[2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамид (соединение № 62; таблица I)
10-1-1 6-(1-тритил-1H-имидазол-4-ил)гекс-5-еновая кислота
13,5 мл (14,3 ммоль) 1,06M раствора гексаметилдисилазана лития в ТГФ добавляют к 3,27 г (7,38 ммоль) бромида (4-карбоксибутил)трифенилфосфония в суспензии 45 мл ТГФ, охлажденной до -75°C. Реакционную смесь перемешивают при -75°C в течение 20 минут, и затем при 0°C в течение 15 минут. После возвращения к -75°C добавляют 1,50 г (4,43 ммоль) 1-тритил-1H-имидазол-4-карбальдегида в суспензии 15 мл ТГФ. После возвращения к температуре окружающей среды реакционную смесь перемешивают в течение 20 часов, и затем при 90°C при нагревании микроволнами в течение 5 минут. Реакционную среду фильтруют и концентрируют в роторном испарителе и помещают в 1/1 гептан/EtOAc. Органическую фазу промывают насыщенным водным раствором NaHCO3. Полученную водную фазу подкисляют до pH=5 добавлением водного раствора 5% лимонной кислоты и последующим экстрагированием с 1/1 смесью гептана/EtOAc. Органическую фазу сушат над MgSO4, фильтруют и концентрируют на роторном испарителе. Получают 0,58 г 6-(1-тритил-1H-имидазол-4-ил)гекс-5-еновой кислоты в виде бежевого порошка с выходом 31%.
10-1-2 Трифторацетат 6-(1H-имидазол-4-ил)гекс-5-еновой кислоты
2 мл трифторуксусной кислоты добавляют к 0,58 г (1,37 ммоль) 6-(1-тритил-1H-имидазол-4-ил)гекс-5-еновой кислоты в суспензии в 8 мл дихлорметана. После выпаривания растворителей полученное масло очищают на колонке с двуокисью кремния (элюент 8/2 ДХМ/MeOH). Получают 240 мг трифторацетата 6-(1H-имидазол-4-ил)гекс-5-еновой кислоты в виде желтого масла с выходом 60%.
10-1-3 трифторацетат 6-(1H-имидазол-4-ил)гексановой кислоты
4 мл уксусной кислоты и 80 мг 10% палладия на угле добавляют к 218 мг (0,741 ммоль) трифторацетата 6-(1H-имидазол-4-ил)гекс-5-еновой кислоты. Реакционную среду помещают в атмосферу водорода при атмосферном давлении. Через 13 часов реакционную среду фильтруют через целит. После выпаривания растворителей получают 175 мг трифторацетата 6-(1H-имидазол-4-ил)гексановой кислоты в виде желтого масла с выходом 80%.
10-2 N-[2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамид
60 мг (0,186 ммоль) ТТБУ, 0,1 мл (0,715 ммоль) триэтиламина и раствор 79 мг (0,155 ммоль) трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она (см. методику 4-4) в 1 мл ДМФА добавляют к 55 мг (0,186 ммоль) трифторацетата 6-(1H-имидазол-4-ил)гексановой кислоты, растворенной в 1 мл ДМФА. Реакционную среду перемешивают в течение 66 часов и экстрагируют 1/2 смесью гептан/EtOAc, и затем промывают 1н гидроксида натрия. Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Неочищенный продукт очищают на колонке с двуокисью кремния (элюент 8/2 ДХМ/MeOH). Получают 40,8 мг N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)гексирамида в виде белого порошка с выходом 47%.
ВЭЖХ: (способ V); время удержания: 18,05 мин, 99%, M+H: 561.
Пример 11
N-[(R)-1-(4-Метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(3-метил-3H-имидазол-4-ил)пропионамид (соединение № 64; таблица I)
11-1-1 Йодид 5-(2-метоксикарбонилэтил)-1-метил-3-тритил-3H-имидазол-1-ия
720 мг (5,2 ммоль) карбоната калия и 0,34 мл (5,72 ммоль) йодметана добавляют к раствору 1 г (2,6 ммоль) N-1-тритил-дезаминогистидина в 10 мл ДМФА. Реакционную среду нагревают при 60°C в течение 3 часов. После возвращения к температуре окружающей среды, реакционную среду обрабатывают водой и уксусной кислотой (до pH 4-5) и экстрагируют дихлорметаном. Органическую фазу сушат над MgSO4, фильтруют и выпаривают. Полученный остаток очищают хроматографией на двуокиси кремния (элюент 8/2 ДХМ/MeOH). Получают 970 мг йодида 5-(2-метоксикарбонилэтил)-1-метил-3-тритил-3H-имидазол-1-ия с выходом 69%.
11-1-2 Трифторацетат метил 3-(3-метил-3H-имидазол-4-ил)пропионата
0,5 мл трифторуксусной кислоты добавляют к раствору 200 мг (0,37 ммоль) йодида 5-(2-метоксикарбонилэтил)-1-метил-3-тритил-3H-имидазол-1-ия в 2 мл дихлорметана. Реакционную среду перемешивают в течение ночи при температуре окружающей среды, и растворители выпаривают. Остаток очищают хроматографией на двуокиси кремния (элюент 9/1 ДХМ/MeOH). Получают 80 мг трифторацетата метил 3-(3-метил-3H-имидазол-4-ил)пропионата с выходом 76%.
11-1-3 Гидрохлорид 3-(3-метил-1H-имидазол-4-ил)пропионовой кислоты
2 мл 30% водного раствора гидроксида натрия добавляют к раствору 320 мг (1,13 ммоль) трифторацетата метил 3-(3-метил-3H-имидазол-4-ил)пропионата в 10 мл ТГФ. Реакционную среду перемешивают при температуре окружающей среды в течение 16 часов, затем охлаждают до 0°C, и по каплям добавляют концентрированную хлороводородную кислоту до pH 1. После фильтрации фильтрат выпаривают. Получают 87 мг гидрохлорида 3-(3-метил-1H-имидазол-4-ил)пропионовой кислоты с выходом 39%.
11-2 N-[(R)-1-(4-Метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(3-метил-3H-имидазол-4-ил)пропионамид
0,17 мл (1,23 ммоль) триэтиламина осторожно добавляют к раствору, содержащему 87 мг (0,45 ммоль) гидрохлорида 3-(3-метил-1H-имидазол-4-ил)пропионовой кислоты и 160 мг (0,49 ммоль) ТТБУ в 1 мл ДМФА. После перемешивания в течение 60 минут при температуре окружающей среды добавляют 200 мг (0,32 ммоль) трифторацетата (R)-2-амино-3-(4-метоксифенил)-1-(3-пентил-3-фенилазетидин-1-ил)пропан-1-она (см. методику 9-3), и реакционную среду перемешивают в течение трех дней. Реакционную среду обрабатывают смесью 2 гептана/8 EtOAc и 1н водным раствором гидроксида натрия. Органическую фазу сушат над MgSO4, фильтруют и выпаривают. Полученный остаток очищают хроматографией на двуокиси кремния (элюент 9 ДХМ/1 MeOH). Получают 21 мг N-[(R)-1-(4-метоксибензил)-2-оксо-2-(3-пентил-3-фенилазетидин-1-ил)этил]-3-(3-метил-3H-имидазол-4-ил)пропионамида с выходом 9%.
ВЭЖХ: (способ W); время удержания: 18,04 мин, 96%, M+H: 517.
Пример 12
N-[(R)-2-(3-Циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид (соединение № 66; таблица I)
12-1 Оксалат 3-циклогексил-3-пентилазетидина
254 мг 5% родия на окиси алюминия добавляют к 652 мг (2,62 ммоль) оксалата 3-пентил-3-фенилазетидина (см.) в 13 мл воды и 6,5 мл ТГФ. Среду помещают в атмосферу водорода под давлением 6 бар и нагревают до 80°C. Через 23 часа реакционную среду фильтруют через целит, и растворители выпаривают. Получают 0,43 г оксалата 3-циклогексил-3-пентилазетидина с выходом 64%.
12-2 трет-Бутил [(R)-2-(3-циклогексил-3-пентил-азетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамат
0,36 г (1,98 ммоль) ЭДК, 0,25 г (1,85 ммоль) ГОБт и 0,51 г (1,73 ммоль) (R)-2-трет-бутокси-карбониламино-3-(4-метоксифенил) пропионовой кислоты добавляют к 0,43 г (1,69 ммоль) оксалата 3-циклогексил-3-пентилазетидина, растворенного в 8 мл ДМФА. Через 5 минут добавляют 0,9 мл (6,5 ммоль) триэтиламина. Через 1 час 30 минут реакционную среду экстрагируют 1/1 смесью EtOAc/гептана и промывают раствором 1н хлороводородной кислоты, 1н гидроксидом натрия и водой. Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на колонке с двуокисью кремния (элюент 6/4 гептан/EtOAc). 0,48 г трет-бутил [(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамата в форме бесцветного масла получают с выходом 59%.
12-3 (R)-2-Амино-1-(3-циклогексил-3-пентилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-он
2,5 мл трифторуксусной кислоты добавляют, при 0°C, к 0,48 г (0,99 ммоль) трет-бутил [(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамату, растворенному в 10 мл дихлорметана. Через 2 часа растворители выпаривают. Остаток помещают в дихлорметан и промывают 1н гидроксидом натрия. Органические фазы объединяют, сушат над MgSO4, фильтруют и концентрируют. Получают 327 мг (R)-2-амино-1-(3-циклогексил-3-пентилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она с выходом 86%.
12-4 N-[(R)-2-(3-Циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
100 мг (0,311 ммоль) ТТБУ и 0,1 мл (0,715 ммоль) триэтиламина добавляют к 55 мг (0,311 ммоль) гидрохлорида 3-(1H-имидазол-4-ил)пропионовой кислоты в 1 мл ДМФА. Через 10 минут добавляют 99 мг (0,256 ммоль) (R)-2-амино-1-(3-циклогексил-3-пентилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она, растворенного в 1 мл ДМФА. После перемешивания в течение 118 при температуре окружающей среды реакционную смесь экстрагируют 1/2 смесью гептана/EtOAc и промывают 1н гидроксидом натрия и насыщенным раствором хлорида натрия. Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на колонке с двуокисью кремния (элюент 9/1 ДХМ/MeOH). Получают 72 мг N-[(R)-2-(3-циклогексил-3-пентилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида в виде белого порошка с выходом 55%.
ВЭЖХ: (способ Y); время удержания: 18,34 мин, 98%, M+H: 509.
Пример 13
N-[(R)-2-[3-бутокси-3-(2-фторфенил)-азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
13.1 3-(2-Фторфенил)-3-гидрокси-1-(трет-бутоксикарбонил)азетидин
3,1 мл (6,1 ммоль) 2M раствора хлорида изопропилмагния в тетрагидрофуране добавляют к раствору 1,1 г (6,2 ммоль) 1-бром-2-фторбензола в 4 мл тетрагидрофуране, охлажденному заранее до -25°C. После перемешивания в течение 30 минут при -25°C, добавляют раствор 0,65 г (3,7 ммоль) 3-оксо-1-(трет-бутоксикарбонил)азетидина в 7,5 мл тетрагидрофурана. Реакционную среду перемешивают в течение 30 мин, и затем добавляют насыщенный водный раствор хлорида аммония. Органические соединения экстрагируют 1/1 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом магния и затем фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на силикагеле, элюируют 5/5 смесью гептана/этилацетата. Получают 135 мг 3-(2-фторфенил)-3-гидрокси-1-(трет-бутоксикарбонил)азетидина в виде белого твердого вещества с выходом 14%.
13.2: 3-Бутокси-3-(2-фторфенил)-1-(трет-бутоксикарбонил)азетидин
135 мг (0,4 ммоль) 80% 3-(2-фторфенил)-3-гидрокси-1-(трет-бутоксикарбонил)азетидина в 2 мл диметилформамида добавляют к суспензии 65 мг (1,6 ммоль) 60% гидрида натрия в 1,5 мл диметилформамида, в атмосфере азота, при 0°C. После перемешивания в течение 20 минут при 0°C добавляют 0,2 мл (1,5 ммоль) йодбутана. Реакционную смесь перемешивают при температуре окружающей среды в течение 1 ч 30 мин и затем гидролизуют водой и насыщенным водным раствором хлорида аммония и экстрагируют 1/2 смеси гептана/этилацетата. Органические фазы объединяют, промывают водой, сушат над сульфатом магния, фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на силикагеле, элюируют 8/2 смесью гептана/этилацетата. Получают 104 мг 3-бутокси-3-(2-фторфенил)-1-(трет-бутоксикарбонил)азетидина в виде желтого масла с выходом 79%.
13.3: Трифторацетат 3-бутокси-3-(2-фторфенил)азетидина
1 мл трифторуксусной кислоты добавляют к раствору, содержащему 104 мг (0,3 ммоль) 3-бутокси-3-(2-фторфенил)-1-(трет-бутоксикарбонил)азетидина в 3 мл дихлорметана при 0°C. После перемешивания в течение 30 минут реакционную среду выпаривают в потоке азота. Получают 126 мг трифторацетата 3-бутокси-3-(2-фторфенил)азетидина в виде бледно-желтого масла с выходом 100%.
13.4: трет-Бутил [(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]карбамат
68 мг ЭДК (0,3 ммоль), 45 мг (0,3 ммоль) ГОБт и 100 мг (0,33 ммоль) Boc-D-метоксифенилаланина последовательно добавляют к 126 мг (0,3 ммоль) трифторацетата 3-бутокси-3-(2-фторфенил)азетидина в 1,5 мл диметилформамида под азотом. После перемешивания в течение 5 минут, добавляют 0,2 мл (1,3 ммоль) триэтиламина. Реакционную среду затем перемешивают в течение 23 часов при температуре окружающей среды и экстрагируют 1/1 смесью этилацетата/гептана в присутствии 1н водного раствора гидроксида натрия. Органическую фазу промывают 1н водным раствором хлороводородной кислоты и затем водой, сушат над сульфатом магния, фильтруют и выпаривают. Получают 94 мг трет-бутил [(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]карбамата в виде желтого масла с выходом 58%.
13.5: трифторацетат (R)-2-Амино-1-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-3-(4-метоксифенил)пропан-1-она
1 мл трифторуксусной кислоты добавляют к раствору 94 мг (0,2 ммоль) трет-бутил [(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]карбамата в 10 мл дихлорметана, охлажденному заранее до 0°C. После перемешивания в течение 1 ч 30 мин при температуре окружающей среды реакционную среду выпаривают в потоке азота. 119 мг трифторацетата (R)-2-амино-1-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-3-(4-метоксифенил)пропан-1-она получают в виде желтого масла с выходом 100%.
13.6: N-[(R)-2-[3-Бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
81 мг (0,3 ммоль) ТТБУ и 0,1 мл (0,6 ммоль) триэтиламина добавляют к раствору 42 мг (0,25 ммоль) гидрохлорида дезаминогистидина в 1 мл диметилформамида. После перемешивания в течение 10 минут добавляют 119 мг (0,2 ммоль) трифторацетата (R)-2-амино-1-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-3-(4-метоксифенил)пропан-1-она, и реакционную смесь перемешивают в течение 64 ч при температуре окружающей среды. После экстрагирования 1/2 смесью гептана/этилацетата, органическую фазу промывают 1н водным раствором гидроксида натрия и насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на силикагеле, элюируют 90/10 смесью дихлорметана/метанола. Получают 59 мг N-[(R)-2-[3-бутокси-3-(2-фторфенил)азетидин-1-ил]-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида в виде белого твердого вещества с выходом 57%.
1Н ЯМР/ДМСО d6 100°C: δ = 0,78 (т, J=7,2-7,6 Гц, 3Н); 1,23 (секст, J=6,8-7,2 Гц, 2Н); 1,37 (квинт, J=6,4-7,6 Гц, 2Н); 2,38-2,42 (м, 2Н); 2,68-2,94 (м, 7Н); 3,10 (ушир.т, J=5,6-6,4, 2H); 4,00-4,40 (м, 3Н); 4,50 (кв, J=7,2-7,6 Гц, 1Н); 6,67-6,90 (м, 3Н); 7,09-7,24 (м, 4Н); 7,30-7,43 (м, 4Н); 7,70-7,90 (м, 1Н).
Пример 14
N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1-метил-1H-имидазол-4-ил)пропионамид
14.1 Метил (E)-3-(1-метил-1H-имидазол-4-ил)акрилат
1 мл (5,5 ммоль) метилдиэтилфосфоноацетата добавляют к суспензии 220 мг (5,5 ммоль) 60% гидрида натрия в 5 мл тетрагидрофурана, охлажденной до 0°C. После перемешивания в течение 1 ч добавляют 500 мг (4,5 ммоль) 1-метил-1H-имидазол-4-карбальдегида, и смесь перемешивают в течение 4 часов при температуре окружающей среды и затем гидролизуют водой и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом магния, фильтруют и выпаривают. Полученный продукт осаждают из гептана и фильтруют. Получают 430 мг метил (E)-3-(1-метил-1H-имидазол-4-ил)акрилата в виде желтого порошка с выходом 57%.
14.2 Гидрохлорид 3-(1-метил-1H-имидазол-4-ил)пропановой кислоты
50 мг 10% палладия на угле добавляют к раствору 100 мг (0,6 ммоль) метил (E)-3-(1-метил-1H-имидазол-4-ил)акрилата в 5 мл 1н водного раствора гидроксида натрия. Реакционную среду промывают азотом и затем перемешивают в атмосфере водорода в течение 24 ч. После фильтрации через целит, фильтрат доводят обратно до pH 2 с помощью концентрированного водного раствора хлороводородной кислоты, добавляют толуол, и среду концентрируют досуха. Полученный остаток помещают в ацетон и осажденные соли отфильтровывают. Фильтрат концентрируют. Получают 160 мг гидрохлорида 3-(1-метил-1H-имидазол-4-ил)пропановой кислоты в виде твердого вещества с выходом 32%.
14.3 N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1-метил-1H-имидазол-4-ил)пропионамида
84 мг (0,3 ммоль) ТТБУ и 0,1 мл (0,5 ммоль) триэтиламина добавляют к раствору 50 мг (0,3 ммоль) гидрохлорида 3-(1-метил-1H-имидазол-4-ил)пропановой кислоты в 2 мл диметилформамида. После перемешивания в течение 1 ч при температуре окружающей среды, добавляют 90 мг (0,2 ммоль) гидрохлорида (R)-2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она (получают по методике примера 6.2). Реакционную среду перемешивают при температуре окружающей среды в течение 72 ч, экстрагируют 2/8 смесью гептана/этилацетата и затем промывают 1н водным раствором гидроксида натрия. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают. Неочищенный продукт очищают хроматографией на силикагеле, элюируют 97/3 смесью дихлорметана/метанола. Получают 22 мг N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1-метил-1H-имидазол-4-ил)пропионамида в виде бежевого порошка с выходом 23%.
ВЭЖХ: (способ U); время удержания: 15,28 мин, 96,5%, M+H: 533
Пример 15
Трифторацетат N-[2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида
15.1 2-Бензилокси-4-метоксибензальдегид
160 мл (1,3 ммоль) бензилбромида и (1,3 ммоль) карбоната калия добавляют к раствору 2 г (1,3 ммоль) 2-гидрокси-4-метоксибензальдегида в 20 мл ацетона. Смесь перемешивают при температуре кипения с обратным холодильником в течение 6 часов, затем выпаривают. Добавляют 50 мл 1н водного раствора гидроксида натрия и среду экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают. Полученный остаток осаждают из 1 смеси гептана/этилацетата (95/5). Получают 2,75 г 2-бензилокси-4-метоксибензальдегида в виде белого порошка с выходом 86%.
15.2: Метил (E)-3-(2-бензилокси-4-метоксифенил)-2-(трет-бутоксикарбонил)аминоакрилат
1,8 г (5,4 ммоль) 1,8-диазабицикло[5.4.0]ундец-7-ен добавляют к раствору 1,8 г (6,2 ммоль) триметилового эфира (±)-Boc-α-фосфоноглицина в 10 мл дихлорметана, охлажденному заранее до 0°C. Смесь перемешивают в течение 10 минут при 0°C и затем добавляют раствор 1 г (4,1 ммоль) 2-бензилокси-4-метоксибензальдегида в 5 мл дихлорметана, и реакционную смесь затем перемешивают в течение 18 ч при температуре окружающей среды. После выпаривания дихлорметана остаток помещают в 50 мл этилацетата. Органическую фазу промывают насыщенным водным раствором хлорида аммония и водой, сушат над сульфатом магния, фильтруют и выпаривают. Полученный остаток очищают хроматографией на силикагеле (элюент: 70/30 гептан/этилацетат). Получают 1,5 г метил (E)-3-(2-бензилокси-4-метоксифенил)-2-(трет-бутоксикарбониламино)акрилата в виде бежевого порошка с выходом 85%.
15.3: Метил 2-трет-бутоксикарбониламино-3-(2-гидрокси-4-метоксифенил)пропаноат
350 мг 10% палладия на угле добавляют к раствору, содержащему 1,5 г (3,5 ммоль) метил (E)-3-(2-бензилокси-4-метоксифенил)-2-(трет-бутоксикарбониламино)акрилата в 15 мл метанола. После перемешивания в течение 4 часов в атмосфере водорода, реакционную среду фильтруют через целит, и фильтрат выпаривают. Получают 850 мг метил 2-трет-бутоксикарбониламино-3-(2-гидрокси-4-метоксифенил)пропаноата в виде серого порошка с выходом 74%.
15.4: 2-трет-Бутоксикарбониламино-3-(2-гидрокси-4-метоксифенил)пропановая кислота
5 мл 1н водного раствора гидроксида натрия добавляют к раствору 850 мг (2,6 ммоль) метил 2-трет-бутоксикарбониламино-3-(2-гидрокси-4-метоксифенил)пропаноата в 10 мл тетрагидрофурана. Реакционную среду перемешивают в течение 4 часов при температуре окружающей среды и затем добавляют 1н водный раствор хлороводородной кислоты до pH 1, и среду экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают. Получают 820 мг 2-трет-бутоксикарбониламино-3-(2-гидрокси-4-метокси-фенил)пропановую кислоту в виде бежевого порошка с количественным выходом.
15.5: Трифторацетат 3-бутокси-3-o-толилазетидина
1 мл трифторуксусной кислоты добавляют к раствору, содержащему 500 мг (1,65 ммоль) 3-бутокси-3-o-толилазетидин-1-(трет-бутоксикарбонил)азетидина, растворенного в 5 мл дихлорметана. Реакционную среду перемешивают при температуре окружающей среды в течение 3 часов и затем концентрируют. Полученный неочищенный продукт очищают хроматографией на силикагеле (элюент: 90/10 дихлорметан/метанол). Получают 400 мг в виде бледно-желтого порошка с выходом 76%.
15.6: трет-Бутил [2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]карбамат
74 мг (0,4 ммоль) ЭДК и 52 мг (0,4 ммоль) ГОБт добавляют к раствору 100 мг (0,3 ммоль) 2-трет-бутоксикарбониламино-3-(2-гидрокси-4-метоксифенил)пропановой кислоты в 5 мл диметилформамида. Смесь перемешивают в течение 15 мин и добавляют 107 мг (0,3 ммоль) трифторацетата 3-бутокси-3-o-толилазетидина. После перемешивания в течение еще 15 минут при температуре окружающей среды добавляют 0,3 мл (1,3 ммоль) диизопропилэтиламина. Реакционную среду перемешивают в течение 2 ч, и затем добавляют 10 мл 1н водный раствор хлороводородной кислоты и среду экстрагируют этилацетатом. Органическую фазу промывают водой и затем сушат над сульфатом магния, фильтруют и выпаривают. Остаток фильтруют через силикагель (элюент: 70/30 гептан/этилацетат). Получают 220 мг трет-бутил [2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]карбамата в виде желтого масла, и его применяют неочищенным на следующей стадии.
15.7 Трифторацетат 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(2-гидрокси-4-метоксифенил)пропан-1-она
1 мл трифторуксусной кислоты добавляют к 220 мг (0,4 ммоль) трет-бутил [2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]карбамата в 2 мл дихлорметана. После перемешивания в течение 1 часа при температуре окружающей среды, реакционную среду концентрируют в вакууме. Получают 250 мг трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(2-гидрокси-4-метоксифенил)пропан-1-она в виде желтого масла с количественным выходом.
15.8: трифторацетат N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
0,25 мл (0,6 ммоль) триэтиламина добавляют к раствору 90 мг (0,6 ммоль) дезаминогистидина и 207 мг (0,6 ммоль) ТТБУ в 2 мл диметилформамида. После перемешивания в течение 1 ч при температуре окружающей среды, добавляют 250 мг (0,4 ммоль) трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(3-гидрокси-4-метоксифенил)пропан-1-она, и смесь перемешивают в течение 72 ч при температуре окружающей среды. 10 мл насыщенного водного раствора гидрокарбоната натрия затем выливают в реакционную среду, которую экстрагируют 20/80 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Продукт очищают препаративной тонкослойной хроматографией (элюент: 90/10 дихлорметан/метанол). Получают 30 мг трифторацетата N-[2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(2-гидрокси-4-метоксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида в виде бежевого порошка с выходом 11%.
ВЭЖХ: (способ A1) : время удержания: 14,39 мин, 94,2%, M+H: 535.
Пример 16
(S)-N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-2-гидрокси-3-(1H-имидазол-4-ил)пропионамид
0,1 мл (0,8 ммоль) триэтиламина добавляют к раствору, содержащему 50 мг (0,3 ммоль) (S)-2-гидрокси-3-(1H-имидазол-4-ил)пропановой кислоты и 100 мг (0,3 ммоль) ТТБУ в 2 мл диметилформамида. После перемешивания в течение 1 часа при температуре окружающей среды добавляют 128 мг (0,3 ммоль) гидрохлорида (R)-2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она (описан в примере 6.2), и смесь перемешивают в течение 72 ч при температуре окружающей среды. Добавляют 1н водный раствор гидроксида натрия, и среду экстрагируют 20/80 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Неочищенный продукт очищают препаративной тонкослойной хроматографией (элюент: 90/10 дихлорметан/метанол). Получают 17 мг (S)-N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-2-гидрокси-3-(1H-имидазол-4-ил)пропионамида в виде белого порошка с выходом 13%.
1Н ЯМР/ДМСО d6 100°C: δ = 0,78 (т, J=7,2 Гц, 3H); 1,23 (секст, J=7,3 Гц, 2H); 1,36 (квинт, J=6,7 Гц, 2H); 2,12 (c, 3H); 2,55-2,75 (м, 1H); 2,86-2,98 (м, 7H); 3,68 (ушир.с, 3H); 3,90-4,30 (м, 4H); 4,54 (ушир.кв, J=6,4 Гц, 1H); 5,25-5,45 (м, 1H); 6,55-6,95 (м, 3H); 7,09-7,27 (м, 6H); 7,43 (ушир.с, 1H); 7,50-7,65 (м, 1H).
Пример 17
N-[2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
17.1: трет-Бутил [2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]карбамат
205 мг (1,1 ммоль) ЭДК и затем 145 мг (1,1 ммоль) ГОБт добавляют к раствору 250 мг (0,9 ммоль) (R)-2-трет-бутоксикарбониламино-3-(4-гидроксифенил)пропановой кислоты в 5 мл диметилформамид. После перемешивания в течение 15 минут при температуре окружающей среды добавляют 300 мг (1,1 ммоль) трифторацетата 3-бутокси-3-o-толилазетидин (описан в примере 15,5) и 0,5 мл (3,6 ммоль) триэтиламина. Реакционную среду перемешивают в течение 2 ч при температуре окружающей среды, и затем добавляют 1н водный раствор хлороводородной кислоты, и смесь экстрагируют этилацетатом. Органическую фазу промывают водой и затем сушат над сульфатом магния, фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируют 60/40 смесью гептана/этилацетата. Получают 410 мг [2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида с выходом 90%.
17.2: Трифторацетат 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-гидроксифенил)пропан-1-он
2 мл трифторуксусной кислоты добавляют к раствору 410 мг (0,8 ммоль) трет-бутил [2-(3-бутокси-3-o-толил-азетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]карбамата в 5 мл дихлорметана. После перемешивания в течение 1 часа при температуре окружающей среды растворитель выпаривают. Получают 440 мг трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-гидроксифенил)пропан-1-она с количественным выходом.
17.3: N-[2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамид
0,35 мл (2,6 ммоль) триэтиламина добавляют к раствору, содержащему 225 мг (1,3 ммоль) гидрохлорид дезаминогистидина и 410 мг (1,3 ммоль) ТТБУ в 5 мл ДМФА. После перемешивания в течение 1 часа при температуре окружающей среды добавляют 440 мг (0,9 ммоль) трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-гидроксифенил)пропан-1-она. После перемешивания в течение 72 ч при температуре окружающей среды, реакционную среду обрабатывают насыщенным водным раствором гидрокарбоната натрия и затем экстрагируют 20/80 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Продукт очищают препаративной тонкослойной хроматографией (элюент: 90/10 дихлорметан/метанол). Получают 205 мг N-[2-(3-бутокси-3-o-толил-азетидин-1-ил)-1-(4-гидроксибензил)-2-оксоэтил]-3-(3H-имидазол-4-ил)пропионамида в виде белого порошка с выходом 47%.
1Н ЯМР/ДМСО d6 100°C: δ = 0,80 (т, J=7,6 Гц, 3H); 1,22 (м, 2H); 1,36 (квинт, J=6,4 Гц, 2H); 2,23 (c, 3H); 2,40 (т, J=8,8 Гц, 2H); 2,82-2,70 (м, 4H); 2,97 (т, J=6,4 Гц, 2H); 4,09 (д, J=10 Гц, 2H); 4,23 (д, J=7,6 Гц, 2H); 4,50 (кв, J=7,6 Гц, 1H); 6,63 (м, 2H); 6,70 (c, 1H); 6,99 (м, 2H); 7,26-7,20 (м, 4H); 7,49 (c, 1H); 7,75 (c, 1H).
Пример 18
N-[1-(3-Бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]-3-(1H-имидазол-4-ил)пропионамид
18.1: Гидрохлорид этил 2-амино-3-(4-метоксифенил)-3-оксопропаноата
5 г (18,6 ммоль) этил N-(дифенилметилен)глицината в растворе в 20 мл тетрагидрофурана добавляют к раствору 18,7 мл (18,6 ммоль) 1н трет-бутоксида калия в 20 мл тетрагидрофурана, охлажденному до -70°C. После перемешивания в течение 30 минут эту смесь добавляют к раствору, содержащему 3,2 г (18,6 ммоль) 4-метоксибензоилхлорида в 20 мл тетрагидрофурана при -70°C. Через час после добавления реакционную среду гидролизуют 1н водным раствором хлороводородной кислоты и концентрируют. Остаток помещают в воду и экстрагируют диэтиловым эфиром. Органическую фазу сушат над сульфатом магния и растворитель выпаривают. Получают 5,5 г гидрохлорида этил 2-амино-3-(4-метоксифенил)-3-оксопропаноата с количественным выходом.
18.2: Этил 2-трет-бутоксикарбониламино-3-(4-метоксифенил)-3-оксопропаноат
4 г (18,3 ммоль) ди-трет-бутилдикарбоната и 2,6 мл (18,3 ммоль) триэтиламина добавляют к 5 г (18,3 ммоль) гидрохлорида этил 2-амино-3-(4-метоксифенил)-3-оксопропаноата, растворенного в 60 мл тетрагидрофурана при 0°C. После перемешивания в течение 3 часов при температуре окружающей среды, смесь обрабатывают водой и экстрагируют этилацетатом. Органическую фазу промывают 1н водным раствором гидросульфата натрия и водой, затем сушат над сульфатом магния, фильтруют и концентрируют. Получают 4,1 г этил 2-трет-бутоксикарбониламино-3-(4-метоксифенил)-3-оксопропаноата в виде желтого масла с выходом 66%.
18.3: Этил 2-трет-бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропаноат
461 мг (0,7 ммоль) боргидрида натрия осторожно добавляют к раствору 4,1 мг (12,2 ммоль) этил 2-трет-бутоксикарбониламино-3-(4-метоксифенил)-3-оксо-пропаноата в 40 мл этанола, охлажденному до -78°C. После перемешивания в течение 15 минут реакционную среду гидролизуют насыщенным водным раствором хлорида аммония. Этанол выпаривают, и водную фазу экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, элюируют 70/30 смесью гептана/этилацетата. Получают 3 г этил 2-трет-бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропаноата в виде желтого масла с выходом 72%.
18.4: 2-трет-Бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропановая кислота
15 мл 1н водного раствора гидроксида натрия добавляют к раствору, содержащему 3 г (8,4 ммоль) 2-трет-бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропановой кислоты 40 мл тетрагидрофурана. Смесь перемешивают в течение 4 часов при температуре окружающей среды, обрабатывают 1н водным раствором хлороводородной кислоты до pH 1, и затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Остаток осаждают из 1/1 смеси диэтилового эфира/гептана. Получают 2,2 г 2-трет-бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропановой кислоты в виде белого порошка с выходом 84%.
18.5: трет-Бутил [1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]карбамат
740 мг (3,5 ммоль) ЭДК и 1,2 г (9,6 ммоль) 4-диметиламинопиридина добавляют к раствору 1 г (3,2 ммоль) 2-трет-бутоксикарбониламино-3-гидрокси-3-(4-метоксифенил)пропановой кислоты, 1,1 г (3,5 ммоль) трифторацетата 3-бутокси-3-o-толилазетидина и 480 мг (3,5 ммоль) HOAT в 10 мл дихлорметана, охлажденному до 0°C. После перемешивания в течение 24 часов при температуре окружающей среды реакционную смесь обрабатывают 1н водным раствором гидроксида натрия и затем экстрагируют этилацетатом. Органическую фазу промывают последовательно 1н водным раствором хлороводородной кислоты и водой, затем сушат над сульфатом магния, фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле (элюент: 60/40 гептан/этилацетат). Получают 1,4 г трет-бутил [1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]карбамата в виде бесцветного масла с выходом 87%.
18.6: Трифторацетат 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-гидрокси-3-(4-метоксифенил)пропан-1-она
10 мл трифторуксусной кислоты добавляют к раствору, содержащему 1,4 г (2,8 ммоль) трет-бутил [1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]карбамата в 20 мл дихлорметана. После перемешивания в течение 1 часа при температуре окружающей среды реакционную среду концентрируют. Получают 1,5 г трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-гидрокси-3-(4-метоксифенил)пропан-1-она в виде бежевого порошка с количественным выходом.
18.7: N-[1-(3-Бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]-3-(1H-имидазол-4-ил)пропионамид
0,2 мл (1,5 ммоль) триэтиламина добавляют к раствору, содержащему 100 мг (0,6 ммоль) гидрохлорида дезаминогистидина и 180 мг (0,6 ммоль) ТТБУ в 5 мл диметилформамида. После перемешивания в течение 1 ч при температуре окружающей среды добавляют 200 мг (0,4 ммоль) трифторацетата 2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-гидрокси-3-(4-метоксифенил)пропан-1-она. Реакционную среду перемешивают в течение 48 ч при температуре окружающей среды, и затем обрабатывают 1н водным раствором гидроксида натрия и экстрагируют 20/80 смесью гептана/этилацетата. органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Остаток очищают препаративной тонкослойной хроматографией (элюент: 90/10 дихлорметан/метанол). Получают 80 мг N-[1-(3-бутокси-3-o-толилазетидин-1-карбонил)-2-гидрокси-2-(4-метоксифенил)этил]-3-(1H-имидазол-4-ил)пропионамида в виде бежевого порошка с выходом 39%.
1Н ЯМР/ДМСО d6 100°C: δ = 0,78 (т, J=7,6 Гц, 3H); 1,23 (секст, J=7,3 Гц, 2H); 1,37 (квинт, J=6,7 Гц, 2H); 2,25 (c, 3H); 2,40-2,50 (м, 2H); 2,75 (м, 2H); 3,01 (т, J=12 Гц, 2H); 3,70-3,80 (ушир.с, 3H); 4,10-4,50 (м, 6H); 4,55 (м, 1H); 4,73 (м, 1H); 6,82 (м, 2H); 7,10-7,40 (м, 8H); 7,86 (м, 1H).
Пример 19
N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамид
19.1: трет-Бутил 3-гидрокси-3-(1-тритил-1H-имидазол-4-ил)пропаноат
2,15 мл (14,5 ммоль) трет-бутилбромацетата по каплям добавляют к раствору 1 г (15,3 ммоль) цинка 20 меш в 20 мл тетрагидрофурана, перемешивают в течение 15 минут с несколькими каплями хлорида триметилсилана. После перемешивания в течение 15 минут при температуре окружающей среды, температуру смеси выдерживают на уровне 50°C в течение 1 часа. После охлаждения до температуры окружающей среды добавляют раствор, содержащий 1,2 г (3,6 ммоль) 1-тритил-1H-имидазол-4-карбальдегида в 10 мл ТГФ. Реакционную среду перемешивают в течение 6 ч при температуре окружающей среды, и затем обрабатывают 1н водным раствором хлороводородной кислоты и экстрагируют этилацетатом. Органическую фазу последовательно промывают насыщенным водным раствором гидрокарбоната натрия и затем водой. После сушки над сульфатом магния и фильтрации растворитель выпаривают. Остаток осаждают из диизопропилового эфира и фильтруют. Получают 1,4 г трет-бутил 3-гидрокси-3-(1-тритил-1H-имидазол-4-ил)пропаноата в виде белого порошка с выходом 84%.
19.2: 3-Гидрокси-3-(1H-имидазол-4-ил)пропановая кислота
3 мл трифторуксусной кислоты добавляют к раствору 1,4 г (3 ммоль) трет-бутил 3-гидрокси-3-(1-тритил-1H-имидазол-4-ил)пропаноата в 7 мл дихлорметана. После перемешивания в течение 4 часов при температуре окружающей среды реакционную среду концентрируют. 0,5 г неочищенного продукта применяют непосредственно на следующей стадии.
19.3: N-[(R)-2-(3-Бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамид
0,5 мл (3 ммоль) триэтиламина добавляют к раствору, содержащему 0,5 г (3 ммоль) 3-гидрокси-3-(1H-имидазол-4-ил)пропановой кислоты и 1,0 г (3 ммоль) ТТБУ в 2 мл диметилформамида. После перемешивания в течение 1 ч при температуре окружающей среды добавляют 1,5 г (3 ммоль) гидрохлорида (R)-2-амино-1-(3-бутокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)-пропан-1-она (полученного по методике примера 6.2). Реакционную среду перемешивают в течение 24 ч при температуре окружающей среды, обрабатывают 1н водным раствором гидроксида натрия и экстрагируют 20/80 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют. Продукт очищают хроматографией на силикагеле, элюируя 97/3 смесью дихлорметана/метанола. Получают 72 мг N-[(R)-2-(3-бутокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-гидрокси-3-(1H-имидазол-4-ил)пропионамида в виде бежевого порошка с выходом 5%.
1Н ЯМР/ДМСО d6 100°C: δ = 0,78 (т, J=7,2 Гц, 3H); 1,23 (секст, J=7,3 Гц, 2H); 1,36 (квинт, J=6,7 Гц, 2H); 2,21 (c, 3H); 2,55-2,65 (м, 2H); 2,70-2,90 (м, 3H); 2,90-3,00 (м, 2H); 3,68 (ушир.с, 3H); 3,90-4,40 (м, 5H); 4,54 (ушир.кв, J=7,2 Гц, 1H); 4,92 (ушир.с, 1H); 6,60-6,80 (м, 3H); 7,00-7,30 (м, 6H); 7,46 (ушир.с, 1H); 7,81 (ушир.с, 1H).
Пример 20
N-[(R)-2-(3-Бут-2-инилокси-3-o-толил-азетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
20.1: трет-Бутил 3-гидрокси-3-o-толилазетидин-1-карбоксилат
60 мл (60 ммоль) 1M хлорида орто-толилмагния в ТГФ по каплям добавляют к раствору 7,4 г (43 ммоль) трет-бутил 3-оксоазетидин-1-карбоксилата в 60 мл тетрагидрофурана, охлажденному до -78°C. После перемешивания в течение 1 ч 30 мин при температуре окружающей среды смесь гидролизуют насыщенным водным раствором хлорида аммония и затем экстрагируют этилацетатом. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Полученное бежевое твердое вещество очищают хроматографией на силикагеле, элюируя 50/50 смесью гептана/этилацетата. Получают 8,9 г трет-бутил 3-гидрокси-3-o-толилазетидин-1-карбоксилата в виде белого твердого вещества с выходом 79%.
20.2: трет-Бутил 3-бут-2-инилокси-3-o-толилазетидин-1-карбоксилат
1 мл (11,4 ммоль) 1-бром-2-бутина добавляют к суспензии 1,4 г (34,2 ммоль) 60% гидрида натрия в 14 мл диметилформамида, охлажденной заранее до 0°C. После перемешивания в течение 1 ч по каплям добавляют 3 г (11,4 ммоль) трет-бутил 3-гидрокси-3-o-толилазетидин-1-карбоксилата в 20 мл диметилформамида, и реакционную смесь перемешивают в течение 1 ч 30 мин. После гидролиза водой и насыщенным водным раствором хлорида аммония, реакционную среду экстрагируют 1/1 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле, элюируя 80/20 смесью гептана/этилацетата. Получают 2,9 г трет-бутил 3-бут-2-инилокси-3-o-толилазетидин-1-карбоксилата в виде желтого масла с выходом 81%.
20.3: Гидрохлорид 3-бут-2-инилокси-3-o-толилазетидина
2,8 г (9 ммоль) трет-бутил 3-бут-2-инилокси-3-o-толилазетидин-1-карбоксилата солюбилизируют в 40 мл (120 ммоль) 3M раствора хлороводородной кислоты в этилацетате. После перемешивания в течение 1 часа 30 минут при температуре окружающей среды, реакционную среду концентрируют в вакууме. Получают 2,2 г гидрохлорида 3-бут-2-инилокси-3-o-толилазетидина в виде бежевого твердого вещества с выходом 96%.
20.4: трет-Бутил [(R)-2-(3-бут-2-инилокси-3-o-толил-азетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамат
1,9 г (10,2 ммоль) ЭДК, 1,4 г (10,2 ммоль) ГОБт и 3,8 мл (27,2 ммоль) триэтиламина добавляют к раствору, содержащему 2,7 г (9,2 ммоль) Boc-D-метоксифенилаланина в 55 мл диметилформамида. После перемешивания в течение 1 ч к смеси добавляют раствор 2,2 г (8,7 ммоль) гидрохлорида 3-бут-2-инилокси-3-o-толилазетидина в 35 мл диметилформамида. Реакционную среду затем перемешивают в течение 38 часов при температуре окружающей среды. Затем ее последовательно экстрагируют 1/1 смесью гептана/этилацетата. Органическую фазу последовательно промывают 1н водным раствором гидроксида натрия и затем 1н водным раствором хлороводородной кислоты, сушат над сульфатом натрия, фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле, элюируя 60/40 смесью гептана/этилацетата. Получают 1,8 г трет-бутил [(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамата в виде белого твердого вещества с выходом 41%.
20.5: (R)-2-Амино-1-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-он
1,7 г (3,5 ммоль) трет-бутил [(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]карбамата солюбилизируют в 45 мл (135 ммоль) 3M раствора хлороводородной кислоты в этилацетате. После перемешивания в течение 3 ч при температуре окружающей среды смесь концентрируют. Получают 1,6 г (R)-2-амино-1-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она в виде бежевого твердого вещества с количественным выходом.
20.6: N-[(R)-2-(3-Бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамид
732 мг (2,3 ммоль) ТТБУ и 1 мл (7 ммоль) триэтиламина добавляют к раствору 408 мг (2,3 ммоль) гидрохлорида дезаминогистидина в 6 мл диметилформамида. После перемешивания в течение 10 мин добавляют 751 мг (1,8 ммоль) (R)-2-амино-1-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)пропан-1-она в 6 мл диметилформамида. Реакционную среду перемешивают в течение 115 часов при температуре окружающей среды и затем добавляют 1н водный раствор гидроксида натрия, и среду экстрагируют 1/1 смесью гептана/этилацетата. Органическую фазу сушат над сульфатом натрия, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле, элюируя 90/10 дихлорметаном/метанолом. Получают 362 мг N-[(R)-2-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(1H-имидазол-4-ил)пропионамида в виде белого твердого вещества с выходом 40%.
1Н ЯМР/ДМСО d6 100°C: δ = 1,74 (ушир.с, 3H); 2,21 (c, 3H); 2,39-2,43 (м, 2H); 2,69-3,10 (м, 4H); 3,68 (м, 5H); 4,10-4,40 (м, 4H); 4,52 (кв, J=7,2-8,0 Гц, 1H); 6,67-6,85 (м, 3H); 7,05-7,15 (м, 2H); 7,18-7,29 (м, 4H); 7,41 (c, 1H); 7,75-7,85 (м, 1H).
Пример 21
N-[(R)-2-(3-Бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
21.1: Гидрохлорид 3-(5-метил-1H-имидазол-4-ил)пропановой кислоты
60 мг 10% палладия на угле добавляют к раствору 387 мг (1,1 ммоль) гидрохлорида (E)-3-(5-метил-1H-имидазол-4-ил)акриловой кислоты в 1/1 смеси тетрагидрофурана/воды. Реакционную среду помещают в атмосферу водорода и перемешивают в течение 19 ч, затем фильтруют через целит. Фильтрат концентрируют в вакууме. Полученный остаток помещают в смесь гептана/диизопропилового эфира при перемешивании на 2 ч. Белый осадок отфильтровывают и затем сушат. Получают 326 мг гидрохлорида 3-(5-метил-1H-имидазол-4-ил)пропановой кислоты в виде белого твердого вещества с выходом 83%.
21.2: N-[(R)-2-(3-Бут-2-инилокси-3-o-толилазетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамид
389 мг (1,2 ммоль) ТТБУ и 0,5 мл (3,7 ммоль) триэтиламина добавляют к раствору, содержащему 229 мг (1,2 ммоль) гидрохлорида 3-(5-метил-1H-имидазол-4-ил)пропановой кислоты в 4 мл диметилформамида. Через 5 мин добавляют 402 мг (0,9 ммоль) (R)-2-амино-1-(3-бут-2-инилокси-3-o-толилазетидин-1-ил)-3-(4-метоксифенил)-пропан-1-она, растворенного в 4 мл диметилформамида. Затем реакционную среду перемешивают в течение 90 ч при температуре окружающей среды, и затем добавляют 1н водный раствор гидроксида натрия и среду экстрагируют смесью 1/1 гептана/этилацетата. Органическую фазу промывают насыщенным водным раствором хлорида натрия и затем сушат над сульфатом натрия, фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле, элюируя 88/12 смесью дихлорметана/метанола. Получают 45 мг N-[(R)-2-(3-бут-2-инилокси-3-o-толил-азетидин-1-ил)-1-(4-метоксибензил)-2-оксоэтил]-3-(5-метил-1H-имидазол-4-ил)пропионамида в виде белого твердого вещества с выходом 9%.
1Н ЯМР/ДМСО d6 100°C: δ = 1,74 (c, 3H); 2,06 (c, 3H); 2,21 (c, 3H); 2,30-2,45 (м, 2H); 2,55-2,70 (м, 2H); 2,74-3,10 (м, 2H); 3,55-3,80 (м, 5H); 4,00-4,45 (м, 4H); 4,50 (ушир.кв, J=8,0 Гц, 1H); 6,65-6,85 (м, 2H); 7,00-7,15 (м, 2H); 7,15-7,35 (м, 5H); 7,75-7,90 (м, 1H).
В таблице I показаны примеры соединений в соответствии с данным изобретением. В этой таблице:
- в столбце "соль", ТФК обозначает соединение в виде трифторацетата,
- чистота (%) является чистотой продукта, полученной ВЭЖХ,
- масса (M+H) является массой + 1 (водород), полученной из масс-спектра, связанного с пиком ВЭЖХ ожидаемого продукта
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

|
|
|
|
|
|
|
|
|
Пример 22
Тест трансактивации: рецепторы меланокортина:
Клетки: HEK293 колонии трансфицируют pCRE-Luc и чМРК1, чРМК3, чРМК4 или чРМК5 векторами. Клетки культивируют при 37°C, 5% CO2, в среде DMEM с добавлением 10% фетальной телячьей сыворотки.
Принцип тестирования: В присутствии активатора (агониста) рецептор меланокортина активирует путь цАМФ который, через вектор CRE-Luc, дает синтез люциферазы. После добавления лизисного буфера, содержащего люминесцентный субстрат для люциферазы, возможно измерить люминесценцию пропорционально степени активации или ингибирования рецептора.
Тестирование продукта: Продукты солюбилизируют при 10 мМ в ДМСО. Их тестируют в режиме доза-реакция при конечной концентрации ДМСО 0,1%. Интервал содержит 10 точек и одну нулевую отметку при 10 мкМ с 4-кратными разведениями. Для тестирования агонистов, продукт тестируют в чистом виде. Для определения поведения антагонистов, интересующие продукты тестируют в присутствии 1 нМ NDP-МСГ (ссылочный агонист). Клетки засевают в количестве 5000 клеток на лунку (384-луночный планшет) в не содержащей сыворотки среде DMEM, и инкубируют в течение ночи при 37°C, 5% CO2.
Продукты и ссылочный лиганд (NDP-МСГ) добавляют на следующий день, и планшеты инкубируют в течение 6 ч при 37°C, 5% CO2. После добавления лизисного буфера, содержащего люциферин, планшеты считывают на инструменте Top-Count. Результаты стандартизируют как % активности с применением 100% (клетки + NDP-МСГ при 10 нМ) и 0% (только клетки) контролей. EC50 рассчитывают для каждого продукта с применением программного обеспечения XLFit. Результаты даны в нМ.