Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ТЕТРАХЛОРОПЛАТОАТ (II)-ИОНА И ЕГО СОЛЕЙ С НАТРИЕМ, КАЛИЕМ ИЛИ АММОНИЕМ
Вид РИД
Изобретение
Изобретение относится к способам получения тетрахлороплатоат(II)-иона или его солей - тетрахлороплатоатов(II)калия (K2PtCl4) или аммония (NH4)2PtCl4, которые широко используются в химической практике в качестве исходных соединений для получения различных типов комплексных соединений Pt(II) и Pt(IV). Все известные способы синтеза этих реагентов проводят путем восстановления соответствующих гексахлороплатеатов, находящихся в степени окисления (IV) до (II) по реакции:
M2PtCl6+2е=M2PtCl4+2Сl-, где М=К+, NH4 +.
Набор применяемых для этого восстановителей довольно большой и включает в себя соли Fe(II), Cu(I), щавелевую кислоту, гидразингидрат, его производные и т.д. (С.И. Гинзбург, Н.А. Езерская. Аналитическая химия платиновых металлов., М., Наука, 1972, с. 40). Однако, как отмечают многие авторы, успешное проведение данной реакции очень сильно зависит от выбранного восстановителя и экспериментальных условий ее осуществления, что отражается на выходе целевого соединения и его конечной чистоты (Х.И. Гильденгершель, Г.А. Шагисултанова. Новый способ получения тетрахлороплатоата (хлороплатинита) калия. Журнал прикладной химии т. 26, №2, 1953, с. 222-223), (И.Г. Ключников, Р.И. Савельева, Получение хлороплатинитов восстановлением хлороплатинатов гидразингидратом и его солями. ЖНХ, т. 1, вып. 12, 1956, с. 2764-2766).
В итоге все способы-аналоги сводятся к двум основным методам проведения данного синтеза, которые в наименьшей степени, чем другие, приводит к нежелательному выделению металлической платины и загрязнению продукта - хлороплатоата - исходным хлороплатеатом и продуктами их полимеризации. Это, во-первых, классический оксалатный способ, а, во-вторых, последующие варианты гидразинсульфатного или гидразинхлоридного методов (Синтез комплексных соединений металлов платиновой группы / под ред. Черняева И.И., М.: Наука, 1964, С. 8). Все приведенные выше аналоги не свободны от недостатков, которые связаны с проявлением инертности хлорокомплекса Pt(IV) к различным реакциям во внутренней координационной сфере, в том числе восстановления. Это отражается на большом времени проведения данного процесса, которое уменьшают нагреванием реакционного раствора, введением в него катализатора (специально полученной платиновой черни) или более интенсивного восстановителя, взятого с некоторым избытком. В итоге крайне затруднительным становится определение завершения реакции восстановления и отделения продукта от исходной соли. Избыток мощного восстановителя всегда приводит к дальнейшему переходу некоторой части иона ([PtCl4]2-) в осадок серовато-зеленого цвета и металлическую платину. Особенно заметным данный процесс становится на конечной стадии выделения целевого соединения путем его кристаллизации из раствора даже при мягком выпаривании на водяной бане. В итоге, выход конечного продукта не превышает 50-60%.
Прототипом заявляемого способа является метод, описанный в работе (Е.А. Максимюк. Применение аскорбиновой кислоты для объемного определения платины. Изв. сектора платины, вып. 30, 1955 г.). В данной статье приводятся данные по обработке на холоду водного раствора навески хлороплатеата(IV) калия раствором аскорбиновой кислоты в 0.02 н. НСl, взятым сверх стехиометрии почти в два раза. Избыток аскорбиновой кислоты затем быстро оттитровывался раствором хлорного железа (FeCl3) с применением потенциометрической схемы для контроля за течением процесса. К недостаткам способа-прототипа следует отнести необходимость строгого соблюдения концентрационных, временных и температурных условий, при которых удастся препятствовать восстановлению платины в степени окисления(IV) до металла. Лучше проводить данную реакцию на холоду. И основное условие - соблюдение строгого режима поддержания кислотности раствора. Последнее обстоятельство вытекает из зависимости редокс-потенциала пары аскорбиновая кислота-дегидроаскорбиновая кислота от концентрации ионов водорода, как видно из уравнения 1:
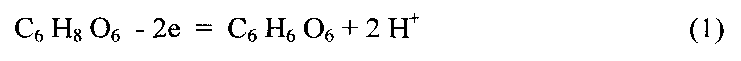
Однозарядный анион аскорбиновой кислоты разрушается в водных растворах гораздо медленнее двухзарядного, поэтому ее растворы более устойчивы при pH в пределах 5,0-8,0, т.е. когда аскорбиновая кислота находится в растворе в виде однозарядного аниона. При pH 3,0-4,5 аскорбиновая кислота менее устойчива. В щелочной среде восстановительная способность аскорбиновой кислоты наибольшая. Но ее щелочные растворы не стабильны из-за быстрого окисления кислородом воздуха. По мере увеличения кислотности растворов восстановительная способность ее уменьшается.
В аналитических целях при работе с малыми по объему и чистыми платиновыми растворами аскорбиновую кислоту еще можно применять, подбирая нужную кислотность и быстро оттитровывая ее избыток, правда, загрязняя платиновую соль железом. А технологические платиновые среды после выщелачивания металла представляют собой раствор платинохлористоводородной кислоты (H2PtCl6) на фоне высокой кислотности соляной кислоты и при таких условиях восстанавливаться не будут.
Кроме этого главным фактором, определяющим устойчивость аскорбиновой кислоты в водных растворах, является наличие в них ионов некоторых металлов. Механизм каталитического разложения аскорбиновой кислоты под действием ионов металлов сводится к образованию комплексных соединений, скорость разложения которых в тех же условиях значительно выше скорости расщепления свободной аскорбиновой кислоты. По каталитической активности ионы металлов располагают в следующий ряд: Cu2+>Pb2+>Zn2+ Со2+>Fe2+>Mn2>Ni2+>Mg2+>Са2+. Сама платина и компоненты ее производственных растворов, полученных из концентратов или шлихов, всегда содержат большое количество данных каталитически активных металлических примесей.
Поэтому главной задачей данного изобретения является создание способа количественного перевода платины из степени окисления (IV) в (II) из кислых растворов, используя стехиометрическое количество аскорбиновой кислоты, техническим результатом которого является быстрое проведение процесса с практически количественным выходом целевых продуктов и высокой чистотой полученного продукта.
Поставленная задача и технический результат достигаются тем, что в качестве предшественника для получения тетрахлороплатоата(II)-иона используют хлорплатиновую кислоту, а в качестве предшественника для получения соли тетрахлороплатоата(II) калия или аммония используют соответствующий гексахлороплатеат, подвергают указанные предшественники взаимодействию в растворе со стехиометрическим количеством аскорбиновой кислоты или ее насыщенным раствором при температуре 50°C-80°C с последующей кристаллизацией продукта из раствора.
Поставленная задача достигается соблюдением ряда необходимых условий. Во-первых, общее количество вводимой по частям навески аскорбиновой кислоты в нагретый платиносодержащий раствор строго соответствует уравнению 2:
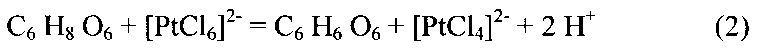
Во-вторых, проведение реакции восстановления хлорокомплекса платины (IV) проводится в диапазоне температур 50-80°C, что способствует протеканию процесса в кислой среде и увеличению его скорости.
Обоснованием такого температурного диапазона служат данные о том, что при 50°C реакция восстановления проходит быстро за время не более 10 мин, а верхний предел температуры ведения процесса в 80°C еще не приводит к заметному проявлению реакции диспропорционирования аниона [PtCl4]2- и его гидролиза. Способ ведут при заданной кислотности от 0,01 моль/л до 1,0 моль/л. В этом интервале концентрации ионов водорода изменение редокс-потенциала системы аскорбиновая кислота-дегидроаскорбиновая кислота, составляющего ~400 мВ, вполне достаточно для проведения реакции восстановления (3), имеющей значение Е°=0,708 В

Экспериментальные условия проведения целевой реакции восстановления легко контролируются двумя независимыми методами - спектрофотометрическим и потенциометрическим. Первый позволяет наблюдать за изменением спектра поглощения исходного раствора [PtCl6]2- до полного его перехода в характеристический спектр [PtCl4]2-. А постоянные замеры ох-red потенциалов для построения кривой титрования, используя платиновый индикаторный электрод в паре со вспомогательным хлорсеребряным, устанавливают точное значение точки эквивалентности.
Главный отличительный признак предлагаемого способа состоит в использовании такого количества применяемого восстановителя, каким выбрана аскорбиновая кислота, которое пойдет лишь на проведение реакции перевода [PtCl6]2- в [PtCl4]2-. Второй признак способствует реализовать на практике первый, поскольку желаемый результат можно получить только при проведении реакции в нагретом до 50°C-80°C растворе. Третий признак способа способствует «мягкому» протеканию процесса, который проводят в интервале заданной кислотности от 0,01 моль/л до 1,0 моль/л, а также использование в качестве предшественника для получения тетрахлороплатоата(II)-иона - хлорплатиновой кислоты, а для получения соли тетрахлороплатоата(II) калия или аммония соответствующий гексахлороплатеат.
Таким образом, сущность изобретения заключается в том, что представленные существенные признаки позволяют решить поставленную задачу - провести процесс с практически количественным выходом при высокой чистоте продукта. Применение данного способа позволяет исключить известные из препаративной практики случаи, когда исходное соединение либо не полностью переводится в целевую соль, либо последняя переходит в платиновую чернь.
Пример 1.
В стеклянный стакан объемом 1 л, снабженный регулируемым нагревом, вносят 500 мл H2PtCl6, содержащей, по данным весового химического анализа, 96,26 г металлической платины. Раствор, имеющий общую кислотность 0,58 моль/л нагревают до 50°C при перемешивании на магнитной мешалке и вводят навеску аскорбиновой кислоты массой 83,16 г.
Через 10 мин нагрева, когда цвет реакционной массы полностью переходит из желтого в рубиново-красный, отвечающий иону [PtCl4]2-, нагрев отключают. Полученная тетрахлороплатиновая кислота (H2PtCl4), которая устойчива лишь в растворах в присутствии избытка HCl, направляется на синтез солей с нужными катионами (К+, NH4+). Выход образующейся по данной реакции тетрахлороплатиновой кислоты составляет 99,6% от теоретического. Последующий синтез солей данной кислоты со щелочными катионами и аммонием проводят известными способами.
Пример 2.
Навеску K2PtCl6 массой 120,01 г обливают 250 мл воды, подкисленной HCl до pH=1, и полученную суспензию нагревают при перемешивании до 80°C. К горячему раствору добавляют 150 мл водного раствора, содержащего 41,58 г аскорбиновой кислоты. Кристаллы исходной соли желтого цвета растворяются и после нагрева в течение 15 мин раствор охлаждают и выдерживают около 1 часа до выпадения кристаллов красного цвета конечного продукта K2PtCl4, которые отфильтровывают на стеклянном фильтре, промывают спиртом и сушат на воздухе. Выход его составляет около 80-90%. Маточный раствор вдвое выпаривают на водяной бане и дополнительное количество K2PtCl4 объединяют с первой фракцией. Общий выход соли составляет 99,25 г, что соответствует 96,8%.
Способ получения тетрахлороплатоат(II)-иона или его солей с калием или аммонием, отличающийся тем, что в качестве предшественника для получения тетрахлороплатоата(II)-иона используют хлорплатиновую кислоту, а в качестве предшественника для получения соли тетрахлороплатоата(II) калия или аммония используют соответствующий гексахлороплатеат, подвергают указанные предшественники взаимодействию в растворе со стехиометрическим количеством аскорбиновой кислоты или ее насыщенным раствором при температуре 50-80°C с последующей кристаллизацией продукта из раствора.
