Результат интеллектуальной деятельности: ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРРОЛИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ 5-HT РЕЦЕПТОРОВ
Вид РИД
Изобретение
Перекрестные ссылки к родственным заявкам
По данной патентной заявке испрашивается приоритет в соответствии с патентной заявкой США № 12/950029, поданной 19 ноября 2010 года, и патентной заявкой США № 12/784624, поданной 21 мая 2010 года, содержание каждой включено в данное описание путем ссылки во всей своей полноте.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным арил- и гетероарил-конденсированного декагидропирролоазепина, октагидрооксепинопиррола, диоксида октагидропирролотиазепина, декагидроциклогепта[c]пиррола и октагидроциклогепта[c]пиррола, способам модулирования 5-HT2C рецептора, 5-HT6 рецептора или обоих, 5-HT2C и 5-HT6 рецепторов при предотвращении или лечении опосредованных серотонином состояний и заболеваний, используя такие соединения или композиции, содержащие такие соединения, и способы получения таких соединений и композиций.
УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к соединениям и фармацевтическим композициям, содержащим указанные соединения, используемым в качестве агонистов или частичных агонистов 5-HT2C рецептора, антагонистов 5-HT6 или как агонистов или частичных агонистов 5-HT2C, так и антагонистов 5-HT6, для лечения заболеваний, расстройств и состояний, при которых необходимо модулирование 5-HT2C или 5-HT6 рецепторов, таких как депрессия, тревожность, шизофрения, биполярное расстройство, обсессивно-компульсивное расстройство, мигрень, боль, эпилепсия, злоупотребление психоактивными веществами, пищевые расстройства, ожирение, диабет, эректильная дисфункция и другие.
Серотонин (5-гидрокситриптамин, 5-HT), моноаминовый нейротрансмиттер и местный гормон, образуется путем гидроксилирования и декарбоксилирования триптофана. Наибольшая его концентрация обнаружена в энтерохромаффинных клетках желудочно-кишечного тракта, остальное количество преимущественно находится в тромбоцитах и в центральной нервной системе (ЦНС). 5-НТ участвует в большом количестве физиологических и патофизиологических процессов. На периферии он вызывает сокращение ряда гладких мышц и вызывает эндотелийзависимую вазодилатацию. В ЦНС, как полагают, он вовлечен в широкий диапазон функций, включая контроль аппетита, настроения, тревожности, галлюцинаций, сна, рвоты и болевой чувствительности.
Нейроны, которые секретируют 5-НТ, обозначаются как серотонинергические. Функция 5-НТ опосредуется через его взаимодействие со специфическими (серотонинергическими) нейронами. До настоящего времени было идентифицировано семь типов 5-НТ рецепторов: 5-НТ1 (с подтипами 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E и 5-HT1F), 5-НТ2 (с подтипами 5-HT2A, 5-HT2B и 5-HT2C), 5-HT3, 5-HT4, 5-HT5 (с подтипами 5-HT5A и 5-HT5B), 5-HT6 и 5-HT7. Большинство из этих рецепторов сопряжено с G-белками, которые воздействуют на активность либо аденилат циклазы, либо фосфолипазы Cγ.
Изменения в активности множественных нейротрансмиттерных рецепторных систем (допамин, серотонин, глутамат, GABA, ацетилхолин) были причастны к проявлению симптомов шизофрении. Наиболее широко распространенная "допаминовая гипотеза шизофрении", в ее самой простой форме, устанавливает, что положительные симптомы этой патологии связаны с функциональной гиперактивностью мезолимбической допаминергической системы, тогда как негативные и когнитивные аспекты могут быть отнесены к функциональной гипоактивности мезокортикальных допаминергических проецирований. Атипичные антипсихотические средства блокируют мезолимбическую допаминергическую нейротрансмиссию, регулируя, таким образом, положительные симптомы с минимальным воздействием или без воздействия на нигростриальную систему, что приводит к меньшему проявлению экстрапирамидальных побочных эффектов (EPS).
Первичные негативные и когнитивные симптомы шизофрении отражают дисфункцию лобной коры ("гипофронтальность"), которая, как полагают, вызвана сниженным тоном в мезокортикальной допаминергической области проецирования [Davis KL, Kahn RS, Ko G and Davidson M. (1991). Dopamine in schizophrenia: a review and re-conceptualization. Am. J. Psychiatry 148: 1474-86. Weinberger DR and Berman KF (1996). Prefrontal function in schizophrenia: confounds and controversies. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 351: 1495-503]. Средства, которые селективно повышают уровни допамина в коре головного мозга, обладают способностью устранять негативные симптомы этого расстройства. Атипичные антипсихотические средства не обладают надежным действием в отношении негативных и когнитивных компонентов шизофренического синдрома.
Шизофреническая симптоматология дополнительно осложняется возникновением вызванных лекарственными средствами так называемых вторичных негативных симптомов и когнитивного ухудшения, которые трудно отличить от основных негативных и когнитивных симптомов [Remington G. and Kapur S. (2000). Atypical antipsychotics: are some more atypical than others? Psychopharmacol. 148: 3-15]. Возникновение вторичных негативных симптомов не только ограничивает терапевтическую эффективность, но также вместе с этими побочными эффектами оказывает негативное влияние на соблюдение больным режима и схемы лечения.
Таким образом, можно предположить, что новый механистический подход, который блокирует допаминергическую нейротрансмиссию в лимбической системе, но не затрагивает стриарную и гипофизарную области проецирования и стимулирует фронтокортикарные области проецирования, мог бы обеспечить эффективное лечение всех сфер шизофренической патологии, включая ее позитивные, негативные и когнитивные симптомы. Кроме того, селективное соединение, которое по существу не обладает вспомогательной фармакологией, характерной для существующих в настоящее время агентов, как ожидают, устранит множество нецелевых побочных эффектов, которые нежелательным образом сопутствуют проводимым в настоящее время лечениям, такие как экстрапирамидальные побочные эффекты (EPS) и увеличение веса.
Рецептор 5-HT2C, ранее называемый 5-HT1C, является G-белок-сопряженным рецептором, который сопряжен с многочисленными клеточными эффекторными системами, включая каскад реакций фосфолипаз C, A и D. Он обнаружен первоначально в головном мозге, и его распределение особенно высоко в сосудистом сплетении желудочков мозга, где он, как полагают, регулирует продукцию спинномозговой жидкости [Kaufman MJ, Hirata F. (1996) Cyclic GMP inhibits phosphoinositide turnover in choroid plexus: evidence for interactions between second messengers concurrently triggered by 5-HT2C receptors. Neurosci. Lett. 206: 153-156]. Очень высокие уровни были также обнаружены в ретроспленальной, грушевидной и энторинальной коре головного мозга, переднем обонятельном ядре, боковом септальном ядре, гипоталамическом ядре, миндалевидном теле, основании гиппокампа и вентральной части CA3, латеральной части ножки шишковидного тела, в компактной части черного вещества, в некоторых отделах ствола головного мозга и во всем сером веществе спинного мозга [Pompeiano M., Palacios JM, Mengod G. (1994). Distribution of the serotonin 5-HT2 receptor family mRNAs: comparison between 5-HT2A and 5-HT2C receptors. Brain Res. Mol. Brain Res. 23: 163-178]. Сравнение распределения мРНК 5-HT2C и мРНК белка 5-HT2C в головном мозге обезьяны и человека показало как пред-, так и постсинаптическую локализацию [Lopez-Gimenez JF, Mengod G., Palacios JM, Vilaro MT (2001) Regional distribution and cellular localization of 5-HT2C receptor mRNA in monkey brain: comparison with [3H]mesulergine binding sites and choline acetyltransferase mRNA. Synapse 42: 12-26].
Ожидается, что модуляция рецептора 5-HT2C будет способствовать выздоровлению при расстройствах, таких как депрессия, тревожность, шизофрения, когнитивные нарушения при шизофрении, обсессивно-компульсивное расстройство, биполярное расстройство, мигрень, эпилепсия, злоупотребление психоактивными веществами, пищевые растройства, ожирение, диабет, сексуальная дисфункция/эректильная дисфункция, нарушение сна, псориаз, болезнь Паркинсона, болевые состояния и расстройства и повреждения спинного мозга, прекращение курения, офтальмогипертензия и болезнь Альцгеймера. Модуляторы рецептора 5-HT2C также показаны для использования при модуляции функции мочевого пузыря, включая предотвращение или лечение недержания мочи при напряжении.
Модуляция рецептора 5-HT6 с помощью подходящих веществ, как ожидают, будет способствовать выздоровлению при расстройствах, включая когнитивные дисфункции, такие как дефицит памяти, когнитивных способностей и приобретения знаний, связанные с болезнью Альцгеймера, возрастное снижение когнитивных способностей и умеренные когнитивные нарушения, синдром дефицита внимания/синдром гиперактивности, расстройства личности, такие как шизофрения, в частности, когнитивные расстройства, связанные с шизофренией, аффективные расстройства, такие как депрессия, тревога, и обсессивно-компульсивные расстройства, нарушения походки или двигательные нарушения, такие как болезнь Паркинсона и эпилепсия, мигрень, нарушения сна (включая нарушения циркадного ритма), пищевые расстройства, такие как анорексия и булимия, некоторые желудочно-кишечные расстройства, такие как синдром раздраженной толстой кишки, заболевания, связанные с нейродегенерацией, такие как инсульт, травма позвоночника или головы, и черепно-мозговые поражения, такие как гидроцефалия, наркозависимость и ожирение.
По-прежнему существует потребность в разработке соединений, обладающих высоким сродством и избирательностью в отношении рецептора 5-HT6. В частности, соединения должны иметь низкое сродство к адренергическим рецепторам, таким как α1-адренергический рецептор, гистаминовым рецепторам, таким как H1-рецептор, и допаминергическим рецепторам, таким как D2-рецептор, для устранения или уменьшения побочных эффектов, связанных с модуляцией этих рецепторов, таких как постуральная гипотензия, рефлекторная тахикардия, потенциирование противогипертонического эффекта празозина, теразозина, доксазозина и лабеталола, или головокружение, связанное с блокадой α1-адренергического рецептора, прибавление в весе, седативный эффект, сонливость или потенциирование основных депрессантов, связанное с блокадой рецептора H1, или экстрапирамидальное нарушение движения, такие как дистония, паркинсонизм, акатизия, поздняя дискинезия или синдром кролика, или эндокринные эффекты, такие как повышение уровня пролактина (галакторея, гинекомастия, ежемесячные изменения, сексуальная дисфункция у мужчин), связанное с блокадой D2-рецептора.
Настоящее изобретение касается соединений, обладающих сродством к рецептору 5-HT2C или 5-HT6, или к обоим рецепторам 5-HT2C и 5-HT6, обеспечивая таким образом лечение расстройств, связанных с или находящихся под влиянием рецепторов 5-HT2C или 5-HT6, или обоих рецепторов, 5-HT2C и 5-HT6.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к производным арил- и гетероарил-конденсированных декагидропирролоазепина, и октагидро-1H-оксепино[4,5-c]пиррола, октагидропирролотиазепин диоксида, декагидроциклогепта[c]пиррола и октагидроциклогепта[c]пиррола, к содержащим такие соединения композициям и способам применения таких соединений и композиций.
В одном аспекте настоящее изобретение относится к соединениям, имеющим формулу (I):
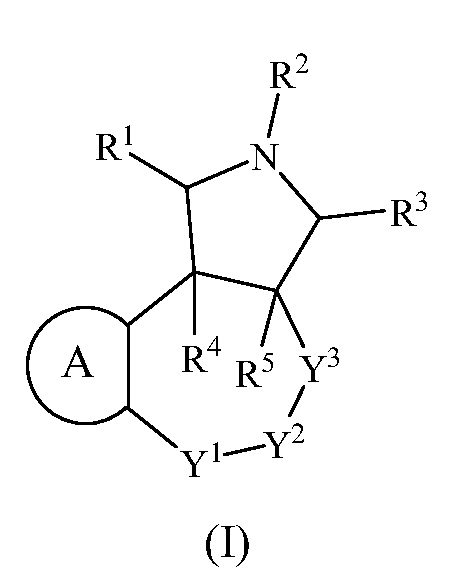
или его фармацевтически приемлемой соли или пролекарству, где
A выбран из группы, состоящей из
R1, R3, R4 и R5 независимо выбраны из группы, состоящей из водорода, алкенила, алкила, галогеналкила, G1, G2, -(CR4aR5a)m-G1 и -(CR4aR5a)m-G2;
R4a и R5a в каждом случае, каждый, независимо представляют собой водород, галоген, алкил или галогеналкил;
G1 в каждом случае независимо представляет собой арил или гетероарил, где каждый G1 независимо не замещен или замещен 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, галогена, циано, -NO2, -OR1b, -OC(O)R1b, -OC(O)N(Rb)(R3b), -SR1b, -S(O)R2b, -S(O)2R2b, -S(O)2N(Rb)(R3b), -C(O)R1b, -C(O)OR1b, -C(O)N(Rb)(R3b), -N(Rb)(R3b), -N(Ra)C(O)R1b, -N(Ra)C(O)O(R1b), -N(Ra)C(O)N(Rb)(R3b), -(CR4bR5b)m-NO2, -N(Rb)S(O)2(R2b), -(CR4bR5b)m-OR1b, -C(OH)[(CR4bR5b)m-R4b]2, -(CR4bR5b)m-OC(O)R1b, -(CR4bR5b)m-OC(O)N(Rb)(R3b), -(CR4bR5b)m-SR1b, -(CR4bR5b)m-S(O)R2b, -(CR4bR5b)m-S(O)2R2b, -(CR4bR5b)m-S(O)2N(Rb)(R3b), -(CR4bR5b)m-C(O)R1b, -(CR4bR5b)m-C(O)OR1b, -(CR4bR5b)m-C(O)N(Rb)(R3b), -(CR4bR5b)m-N(Rb)(R3b), -(CR4bR5b)m-N(Ra)C(O)R1b, -(CR4bR5b)m-N(Ra)C(O)O(R1b), -(CR4bR5b)m-N(Ra)C(O)N(Rb)(R3b), -(CR4bR5b)m-N(Rb)S(O)2(R2b), цианоалкила и галогеналкила;
G2 представляет собой циклоалкил, циклоалкенил или гетероцикл, незамещенный или замещенный 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из алкила, алкенила, алкинила, галогена, циано, оксо, -SR1b, -S(O)R2b, -S(O)2R2b, -S(O)2N(Rb)(R3b), -C(O)R1b, -C(O)OR1b, -C(O)N(Rb)(R3b), -N(Rb)(R3b), -N(Ra)C(O)R1b, -N(Ra)C(O)O(R1b), -N(Ra)C(O)N(Rb)(R3b), -(CR4bR5b)m-NO2, -N(Rb)S(O)2(R2b), -(CR4bR5b)m-OR1b, -(CR4bR5b)m-OC(O)R1b, -(CR4bR5b)m-OC(O)N(Rb)(R3b), -(CR4bR5b)m-SR1b, -(CR4bR5b)m-S(O)R2b, -(CR4bR5b)m-S(O)2R2b, -(CR4bR5b)m-S(O)2N(Rb)(R3b), -(CR4bR5b)m-C(O)R1b, -(CR4bR5b)m-C(O)OR1b, -(CR4bR5b)m-C(O)N(Rb)(R3b), -(CR4bR5b)m-N(Rb)(R3b), -(CR4bR5b)m-N(Ra)C(O)R1b, -(CR4bR5b)m-N(Ra)C(O)O(R1b), -(CR4bR5b)m-N(Ra)C(O)N(Rb)(R3b), -(CR4bR5b)m-N(Rb)S(O)2(R2b), цианоалкила и галогеналкила;
Ra и Rb в каждом случае, каждый, независимо представляют собой водород, алкил или галогеналкил;
R1b и R3b в каждом случае, каждый, независимо представляют собой водород, алкил или галогеналкил;
R2b в каждом случае независимо представляет собой алкил или галогеналкил;
R4b и R5b в каждом случае, каждый, независимо представляют собой водород, галоген, алкил или галогеналкил;
m в каждом случае независимо равен 1, 2, 3, 4 или 5;
R2 выбран из группы, состоящей из водорода, алкоксиалкила, алкила, алкилкарбонила, галогеналкила, -(CR4aR5a)m-G1, -(CR4aR5a)p-O-G1, -C(O)-G1, -(CR4aR5a)m-G2, -(CR4aR5a)p-O-G2, -C(O)-G2, -S(O)2R6 и -C(O)NR7R8;
p в каждом случае независимо равен 2, 3, 4 или 5;
R6 и R7 независимо выбраны из группы, состоящей из алкила, галогеналкила, G1, -(CR4aR5a)m-G1, G2 и -(CR4aR5a)m-G2;
R8 выбран из группы, состоящей из водорода, алкила и галогеналкила; или
R7 и R8, взятые вместе с атомом азота, к которому они присоединены, образуют гетероцикл;
X1 представляет собой N или CR9;
X2 представляет собой N или CR10;
X3 представляет собой N или CR11;
X4 представляет собой N или CR12;
при условии, что только один или два из X1, X2, X3 или X4 могут представлять собой N;
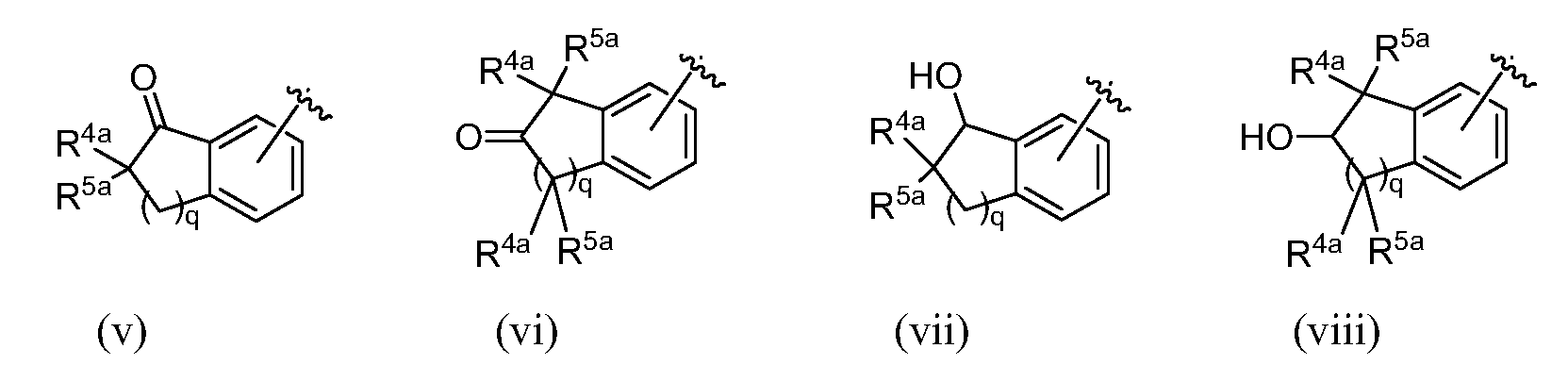
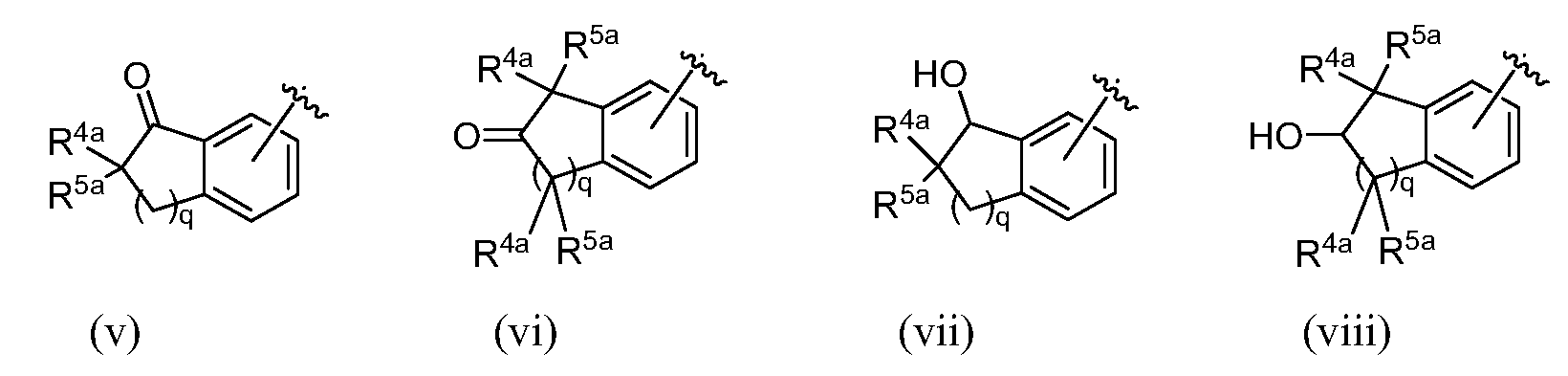
R9, R10, R11, R12, R13, R14, R15 и R16, каждый, независимо представляют собой водород, алкил, алкенил, алкинил, галоген, циано, -G1, -G2, -NO2, -OR1a, -OC(O)R1a, -OC(O)N(Rb)(R3a), -SR1a, -S(O)R2a, -S(O)2R2a, -S(O)2N(Rb)(R3a), -C(O)R1a, -C(O)G3, -C(O)OR1a, -C(O)N(Rb)(R3a), -N(Rb)(R3a), -N(Ra)C(O)R1a, -N(Ra)C(O)O(R1a), -N(Ra)C(O)N(Rb)(R3a), -N(Ra)S(O)2(R2a), -(CR4aR5a)m-NO2, -(CR4aR5a)m-OR1a, -(CR4aR5a)m-OC(O)R1a, -(CR4aR5a)m-OC(O)N(Rb)(R3a), -(CR4aR5a)m-SR1a, -(CR4aR5a)m-S(O)R2a, -(CR4aR5a)m-S(O)2R2a, -(CR4aR5a)m-S(O)2N(Rb)(R3a), -(CR4aR5a)m-C(O)R1a, -(CR4aR5a)m-C(O)OR1a, -(CR4aR5a)m-C(O)N(Rb)(R3a), -(CR4aR5a)m-N(Rb)(R3a), -(CR4aR5a)m-N(Ra)C(O)R1a, -(CR4aR5a)m-N(Ra)C(O)O(R1a), -(CR4aR5a)m-N(Ra)C(O)N(Rb)(R3a), -(CR4aR5a)m-G1, -CR4a=CR5a-G1, -(CR4aR5a)m-G2, -CR4a=CR5a-G2, -CR6a=C(R7a)2, цианоалкил, галогеналкил, (v), (vi), (vii) или (viii); где
R1a и R3a в каждом случае, каждый, независимо представляют собой водород, алкил, галогеналкил, G1, -(CR4aR5a)m-G1, G2 или -(CR4aR5a)m-G2;
R2a в каждом случае независимо представляет собой алкил, галогеналкил, G1 или -(CR4aR5a)m-G1;
R6a представляет собой алкил или галогеналкил;
R7a в каждом случае независимо представляет собой водород, алкил или галогеналкил;
G3 представляет собой гетероциклическое кольцо, присоединенное к соседней карбонильной группе через атом азота, имеющийся в гетероцикле;
q равен 1 или 2; или
R9 и R10, R10 и R11, R11 и R12 или R13 и R14, взятые вместе с атомом углерода, к которому они присоединены, образуют замещенное или незамещенное фенильное, циклоалкильное, гетероциклическое или гетероарильное кольцо;
Y1 представляет собой NR17, CR18R19, C(O), S(O)n или O;
Y2 представляет собой NR20, CR18R19, C(O) или S(O)n;
Y3 представляет собой NR17, CR18R19, C(O) или S(O)n; или
Y1 и Y2 вместе представляют собой CR18=CR19, при условии, что Y3 является иным, чем NR17; или
Y2 и Y3 вместе представляют собой CR18=CR19, при условии, что Y1 является иным, чем NR17 или O;
n равен 1 или 2;
при условии, что только один из Y1 и Y3 может представлять собой NR17; или Y1 и Y3 являются иными, чем NR17, когда Y2 представляет собой NR20; или только один из Y1, Y2 или Y3 может представлять собой C(O) или S(O)n; или Y2 является иным, чем NR20 или S(O)n, когда Y1 представляет собой O; или Y3 является иным, чем NR17, когда Y1 представляет собой O;
R17 выбран из группы, состоящей из водорода, алкила, алкилкарбонила, галогеналкила, -C(O)-G1, -(CR4aR5a)m-G1, -C(O)-G2 и -(CR4aR5a)m-G2;
R18 и R19 независимо выбраны из группы, состоящей из водорода, алкила и галогеналкила; и
R20 выбран из группы, состоящей из водорода, алкила, алкилкарбонила, галогеналкила, -C(O)-G1, -C(O)NRa-G1, -S(O)n-G1, -(CR4aR5a)m-G1, -C(O)-G2, -C(O)NRa-G2, -S(O)n-G2 и -(CR4aR5a)m-G2.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество по меньшей мере одного соединения, имеющего формулу (I), описанную выше, или его фармацевтически приемлемые соли, в сочетании с по меньшей мере одним фармацевтически приемлемым носителем.
Другой аспект изобретения относится к фармацевтической композиции, содержащей соединения по изобретению. Такие композиции могут быть введены в соответствии со способом по изобретению, обычно как часть курса терапии при лечении или предотвращении состояний и расстройств, связанных с 5-HT активностью и, более конкретно, 5-HT2C активностью, 5-HT6 активностью или обеих, 5-HT2C активностью и 5-HT6 активностью.
В еще одном аспекте настоящее изобретение относится к способу предотвращения или лечения когнитивной дисфункции, синдрома дефицита внимания/синдрома гиперактивности, расстройств личности, аффективных расстройств, расстройств движения или двигательной функции, мигрени, боли, недержания мочи, расстройству сна, пищевых расстройств, желудочно-кишечных расстройств, заболеваний, связанных с нейродегенерацией, наркотических заболеваний, ожирения, сахарного диабета, псориаза или гипертензивных расстройств глаз, с использованием соединения формулы (I). Такие способы включают введение терапевтически эффективного количества по меньшей мере одного соединения формулы (I) субъекту при необходимости его лечения. Примерами когнитивной дисфункции являются дефицит памяти, познания и обучения, болезнь Альцгеймера, возрастные когнитивные нарушения и умеренные когнитивные нарушения или любое их сочетание. Примерами расстройств личности являются шизофрения и когнитивные нарушения, связанные с шизофренией. Примерами аффективных расстройств являются депрессия, тревожность, биполярное расстройство и обсессивно-компульсивное расстройство или любое их сочетание. Примерами расстройств движения или двигательных функций являются болезнь Паркинсона и эпилепсия. Примерами пищевых расстройств являются анорексия и булимия. Примером желудочно-кишечных расстройств является синдром раздраженного кишечника. Примерами заболеваний, связанных с нейродегенерацией, являются инсульт, спинальная или головная травма головы и раны головы.
В одном варианте осуществления настоящего изобретения способ лечения млекопитающего, страдающего шизофренией и/или когнитивным дефицитом, связанным с шизофренией, предусматривает введение млекопитающему по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли.
В еще одном аспекте настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли при производстве лекарственного средства для предотвращения или лечения расстройств, описанных выше, самих по себе или в сочетании с по меньшей мере одним фармацевтически приемлемым носителем.
Соединения формулы (I), композиции, содержащие указанные соединения, и способы предотвращения или лечения когнитивной дисфункции, синдрома дефицита внимания/синдрома гиперактивности, расстройств личности, аффективных расстройств, расстройств движения или двигательной функции, расстройства сна, пищевых расстройств, желудочно-кишечных расстройств, заболеваний, связанных с нейродегенерацией, наркотических заболеваний, ожирения, сахарного диабета, псориаза или гипертензивных расстройств глаз путем введения указанных соединений или фармацевтических композиций описаны здесь далее.
Соединения, композиции, содержащие указанные соединения, способы применения этих соединений и способы получения соединений, а также промежуточные соединения, получаемые в таких способах, описаны здесь далее.
Эти и другие объекты изобретения описаны в следующих параграфах. Эти объекты не должны рассматриваться как сужающие объем изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
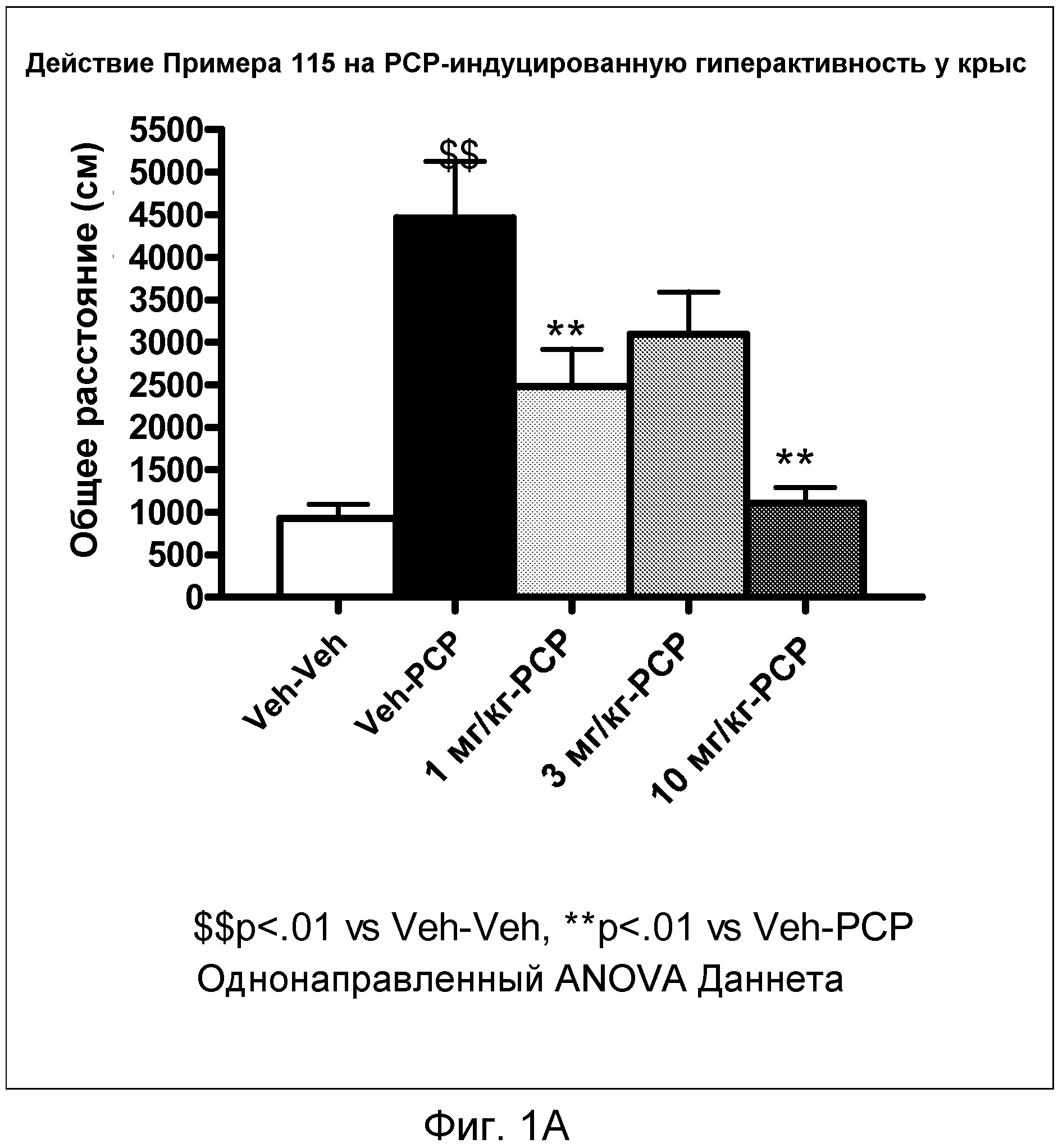
На фиг.1A показано графическое изображение доза-зависимых эффектов соединения примера 115, ослабляющих действие фенциклидина (PCP). Крыс обрабатывали носителем, PCP или дозой соединения примера 115, затем фенциклидином. По оси X отложен режим дозирования, а по оси Y отложена активность, регистрируемая по расстоянию, которое преодолевают испытуемые животные в течение периода времени эксперимента.
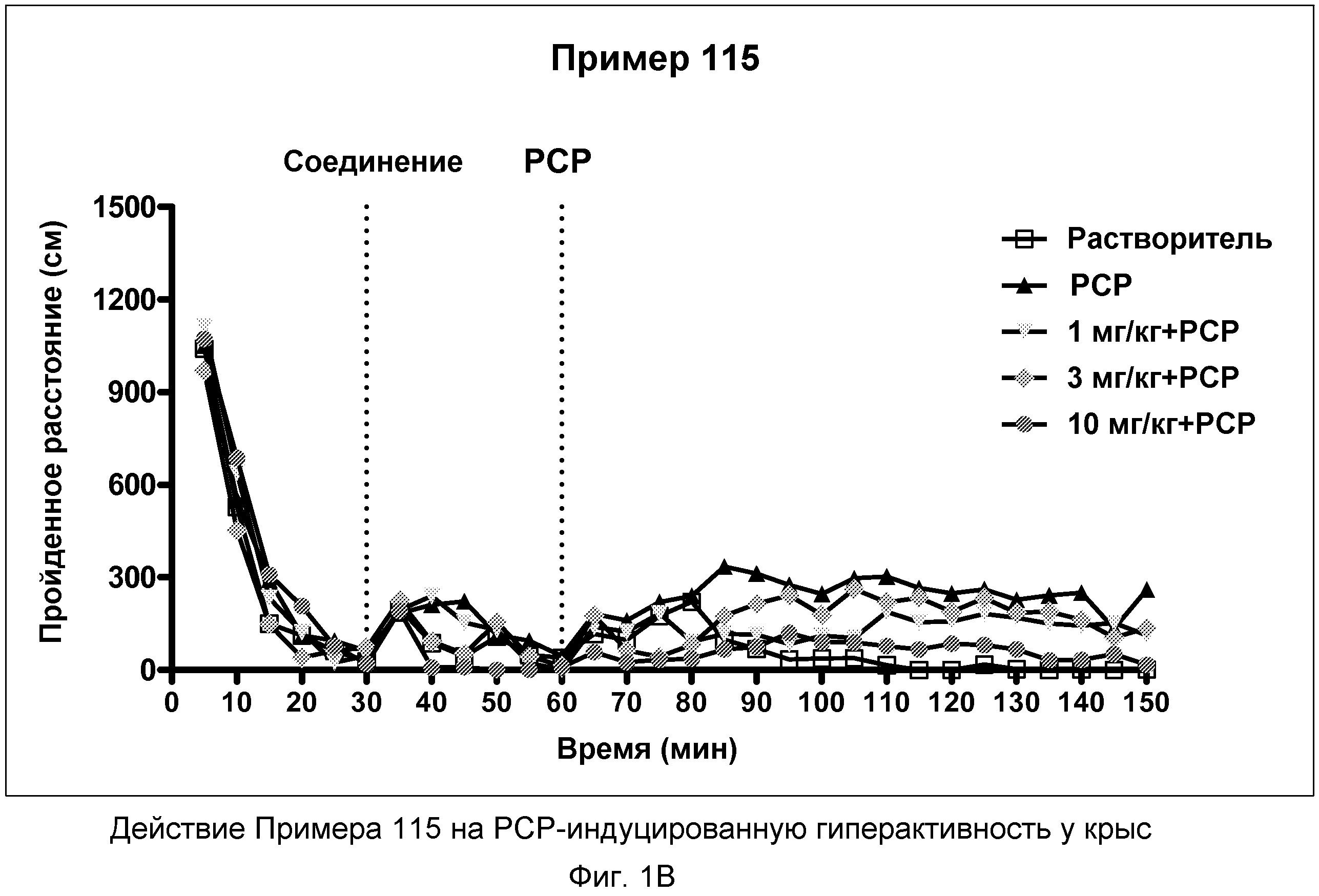
На фиг.1В показано графическое изображение доза-зависимых эффектов соединения примера 115, ослабляющих действие фенциклидина (PCP). Крыс обрабатывали носителем, PCP или дозой соединения примера 115, затем фенциклидином. По оси X отложено время эксперимента, а по оси Y отложено расстояние, преодолеваемое в течение 5 минут.
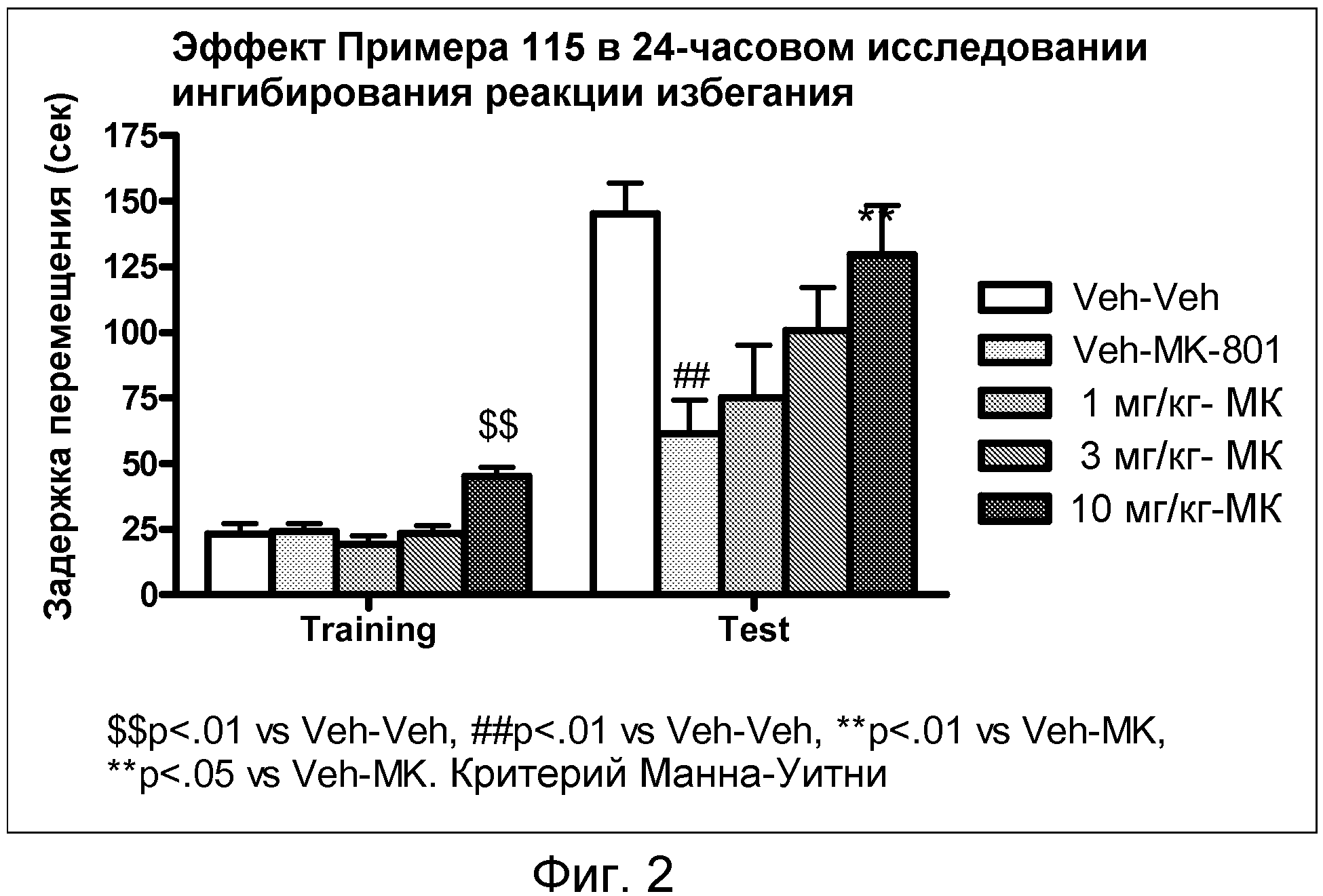
На фиг.2 показано графическое изображение доза-зависимого улучшения показателей подавления избегания у мышей в течение 24 часов, определяемых после обработки тестируемым соединением (пример 115) с последующей обработкой МК-801. Животных обрабатывали носителем или соединением примера 115, затем носителем или МК-801. По оси X отложен режим дозирования в день воздействия условия и тех же самых испытуемых групп через 24 часа, а по оси Y отложено время задержки пересечения участка наказания.
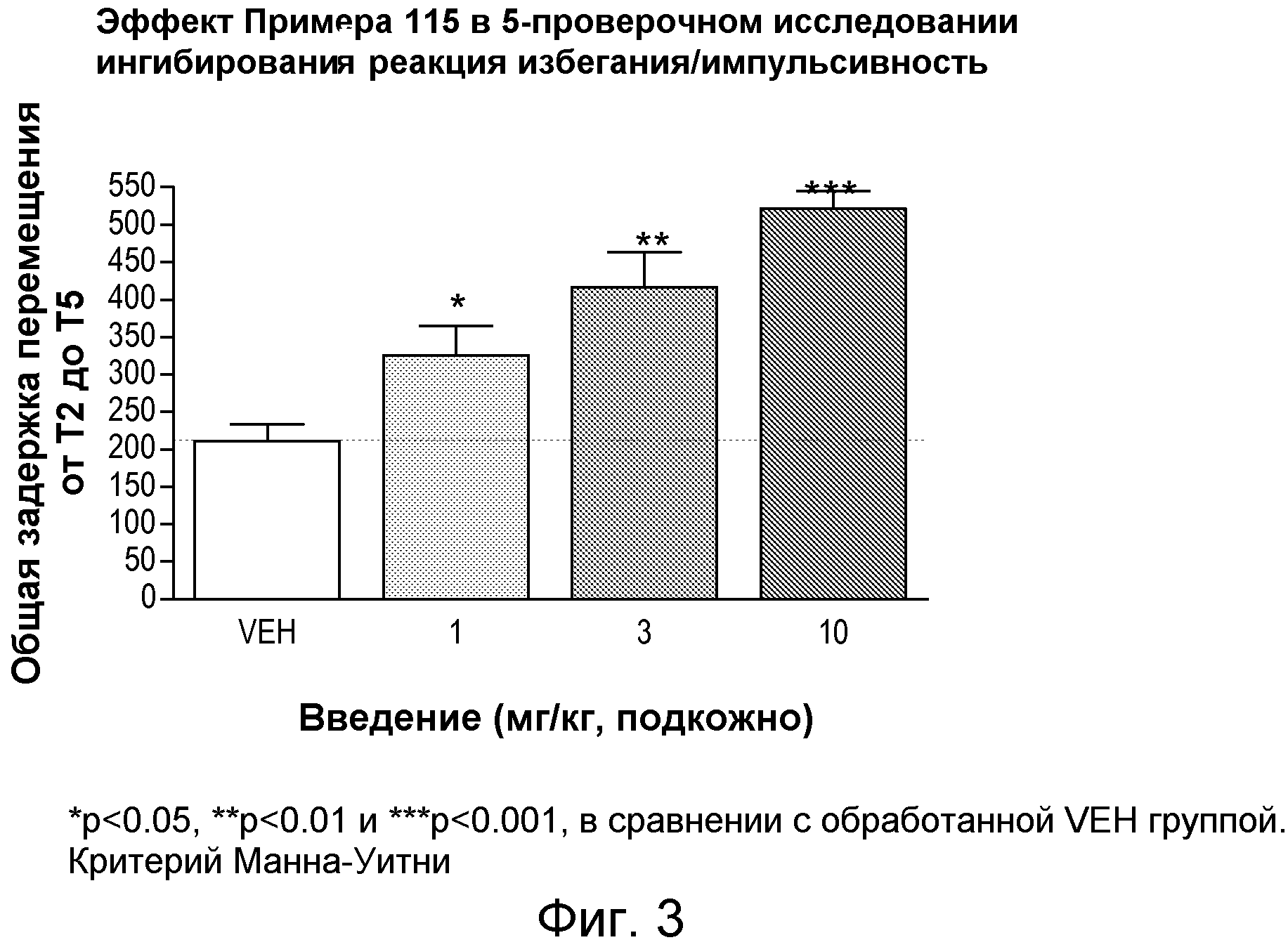
На фиг.3 показано графическое изображение доза-зависимого улучшения показателей подавления избегания в 5 испытаниях у детенышей крыс со спонтанной гипертензией (SHR) после срочной обработки исследуемым соединением (Пример 115). По оси Х отложена доза исследуемого соединения, а по оси Y общее время задержки перемещения 2-5 испытаний для пересечения участка наказания.
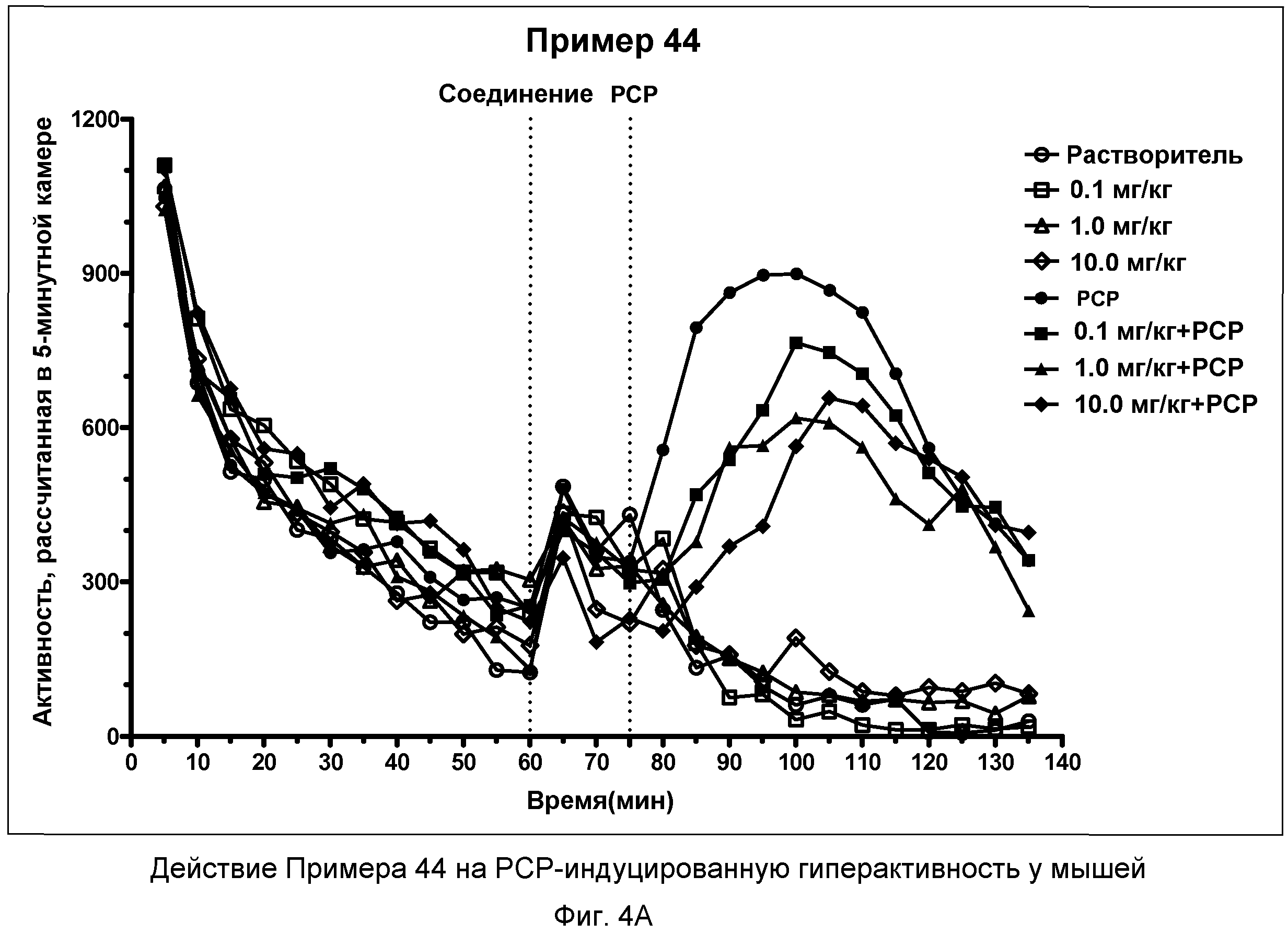
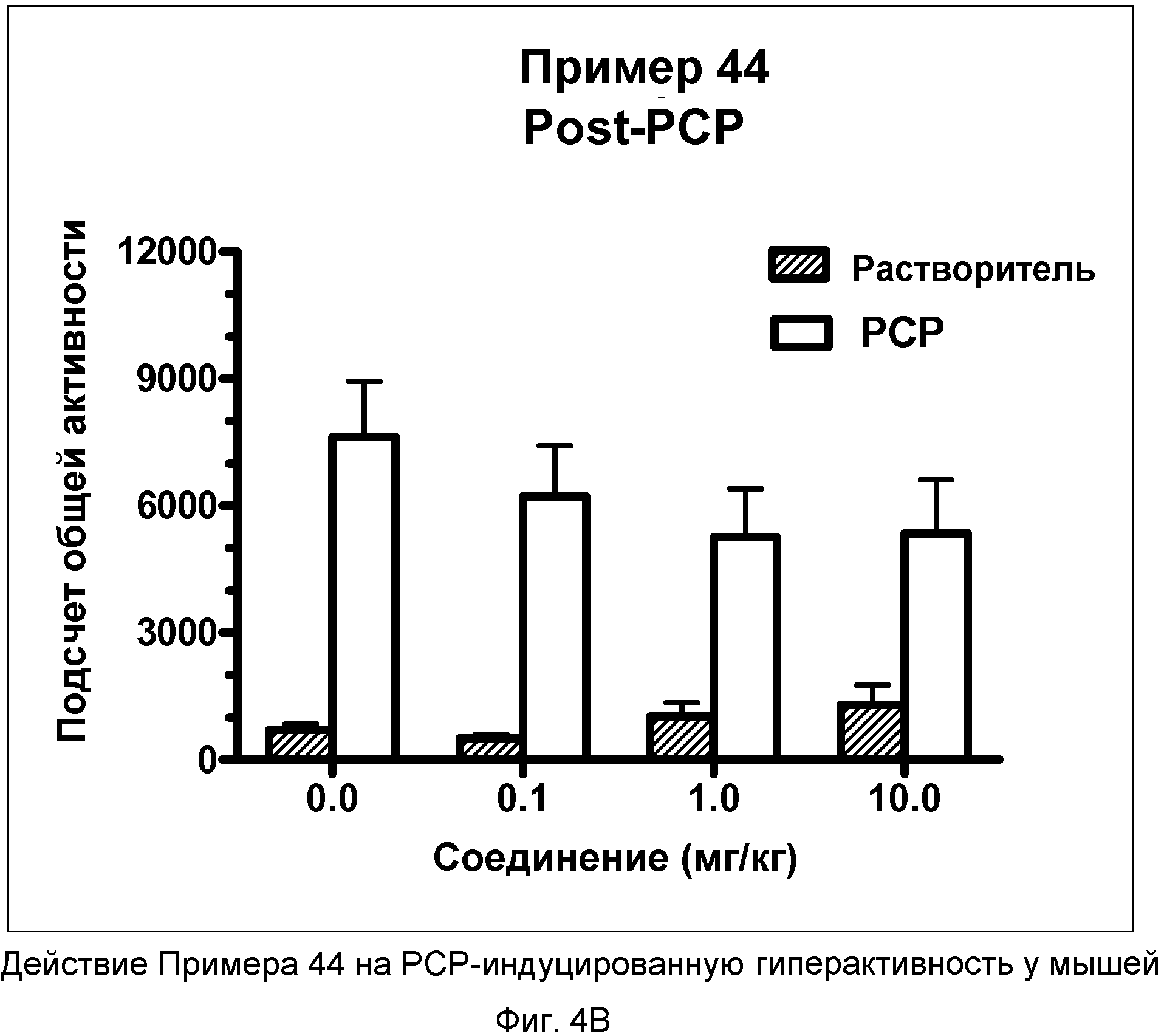
На фиг.4A показано графическое изображение концентрация-зависимых эффектов соединения примера 44, ослабляющих действие фенциклидина (PCP). Мышь обрабатывали носителем, d-амфетамином или дозой соединения примера 44, затем PCP. По оси Х отложено время (минуты), а по оси Y отложен индекс активности за 5-минутный период времени.
На фиг.4B показано графическое изображение концентрация-зависимых эффектов соединения примера 44, ослабляющих действие фенциклидина (PCP). Мышь обрабатывали носителем, d-амфетамином или дозой соединения примера 44, затем PCP. На фиг.4B показаны общие индексы активности после инъекции PCP для различных групп.
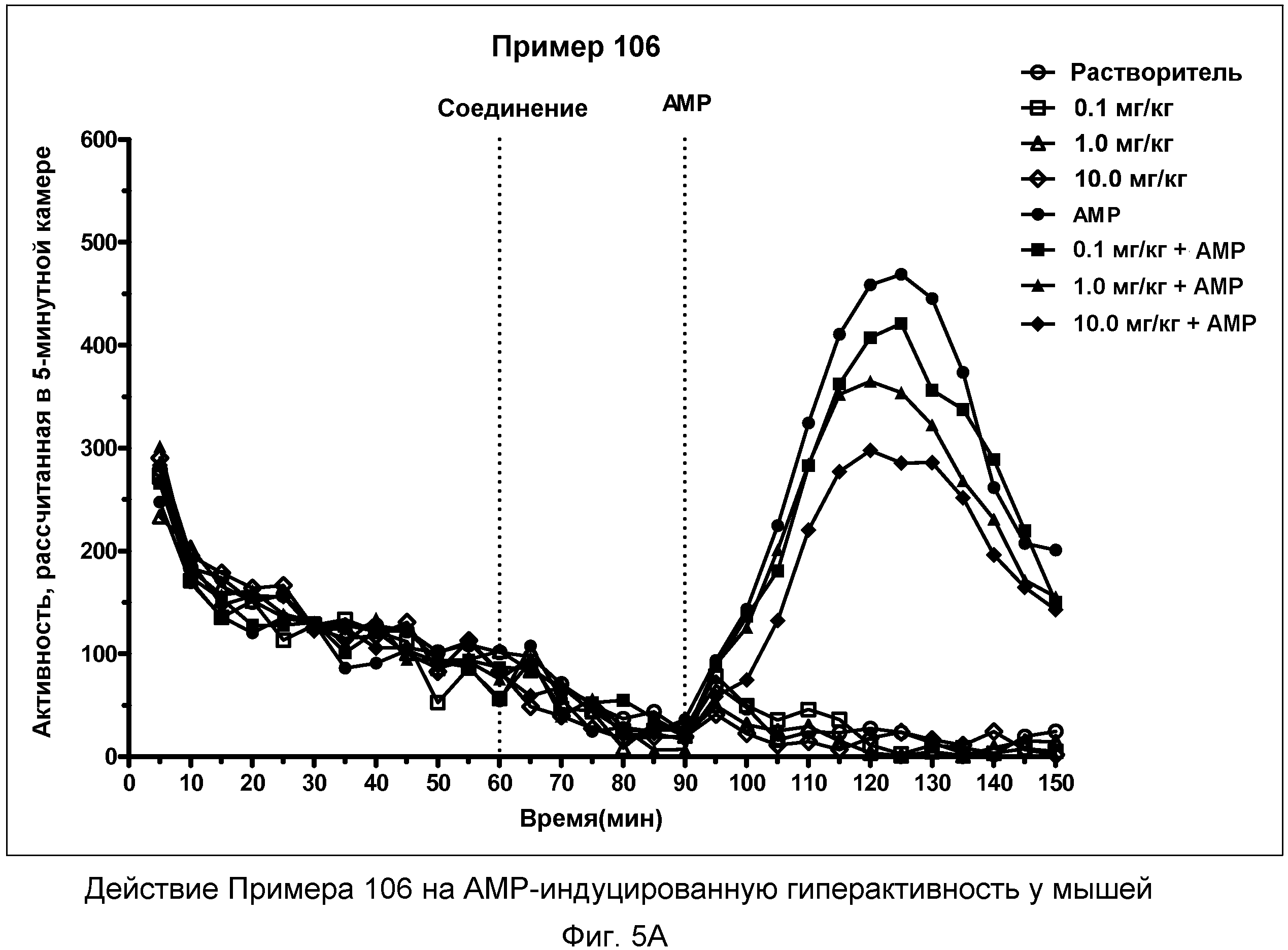
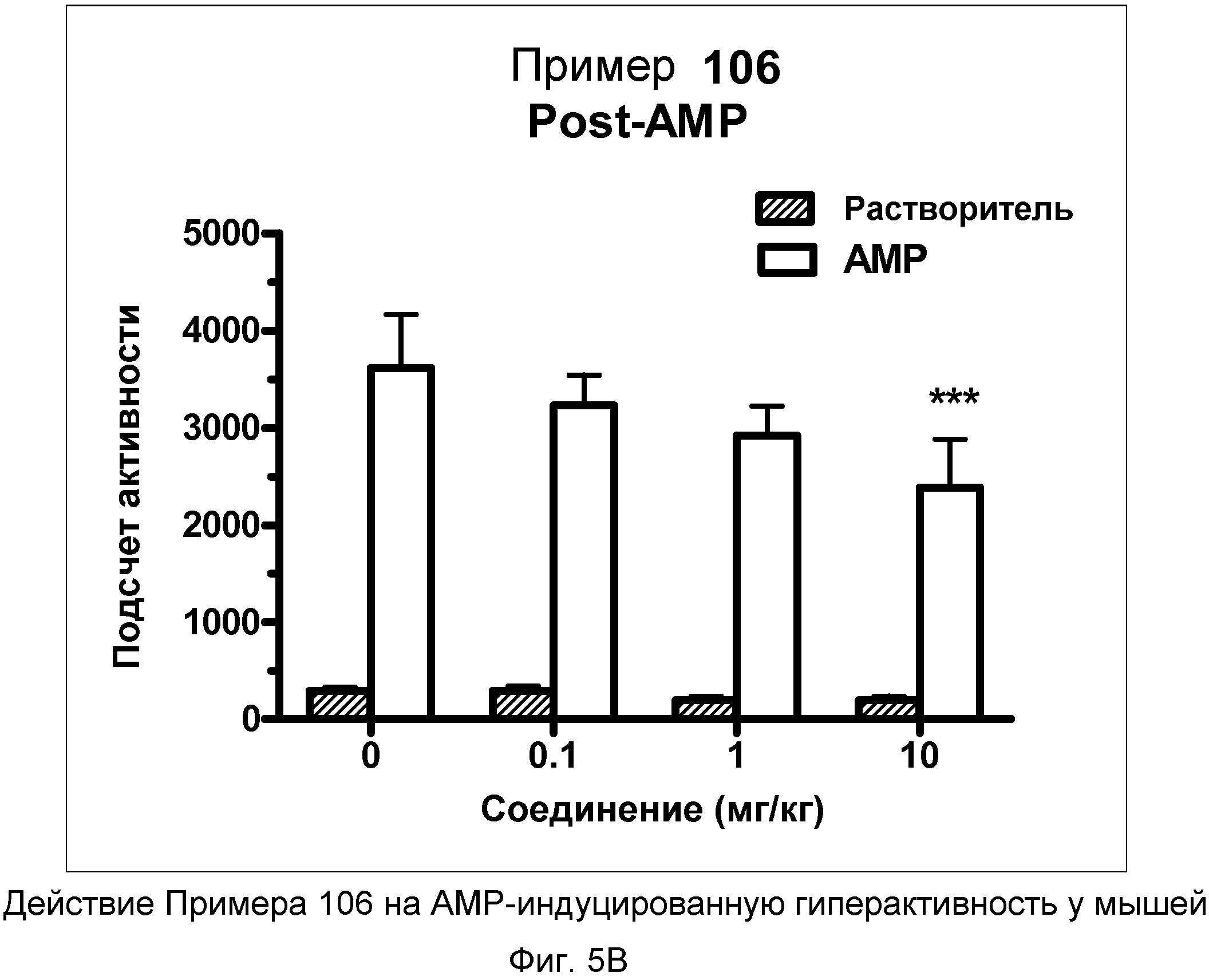
На фиг.5A показано графическое изображение концентрация-зависимых эффектов соединения примера 106, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 106, затем AMP. По оси Х отложено время (минут), а по оси Y отложены индексы активности за 5-минутный период времени.
На фиг.5B показано графическое изображение концентрация-зависимых эффектов соединения примера 106, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 106, затем AMP. На фиг.5B показаны общие индексы активности после инъекции AMP для различных групп.
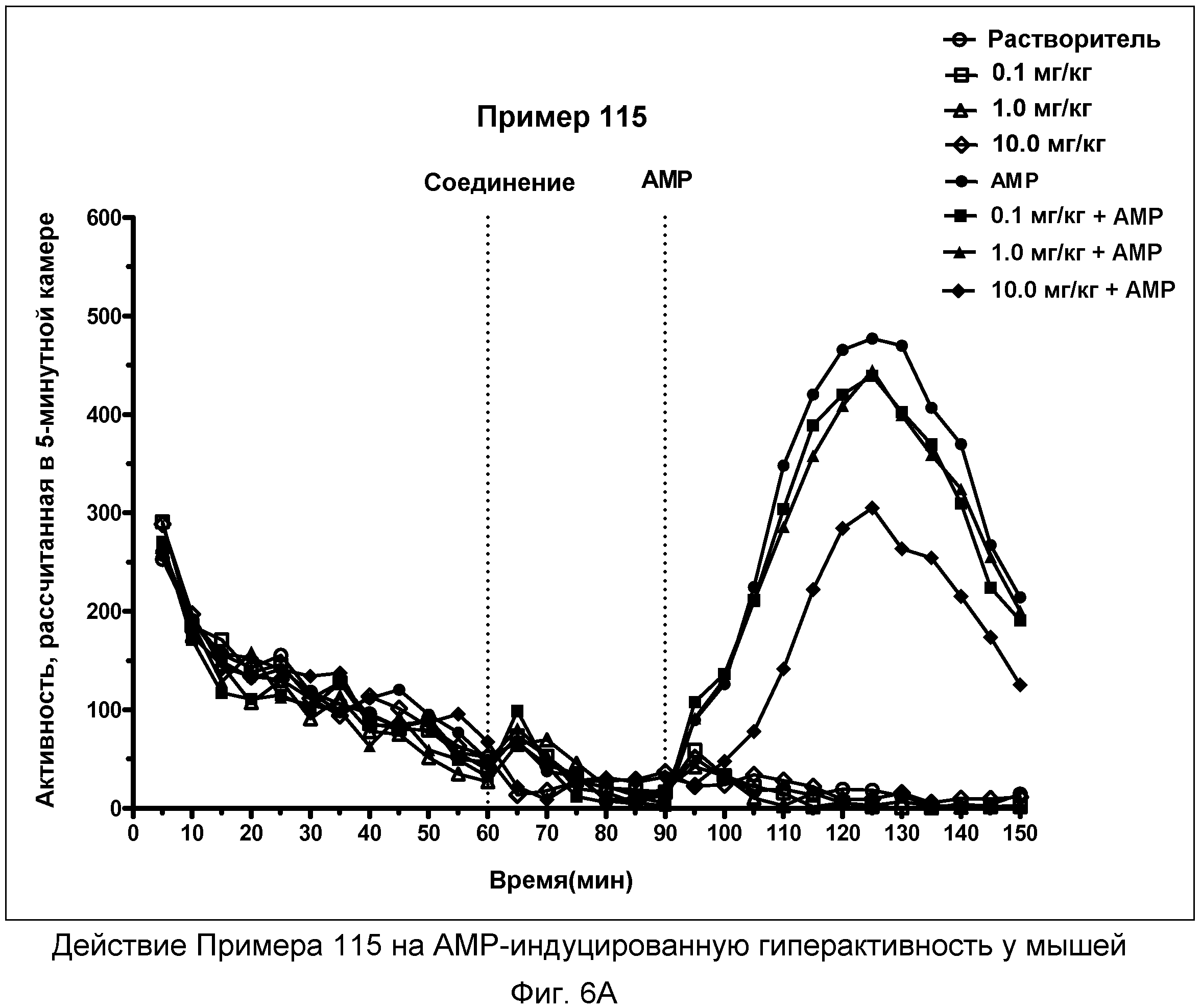
На фиг.6A показано графическое изображение концентрация-зависимых эффектов соединения примера 115, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 115, затем AMP. По оси Х отложено время (минут), а по оси Y отложены индексы активности за 5-минутный период времени.
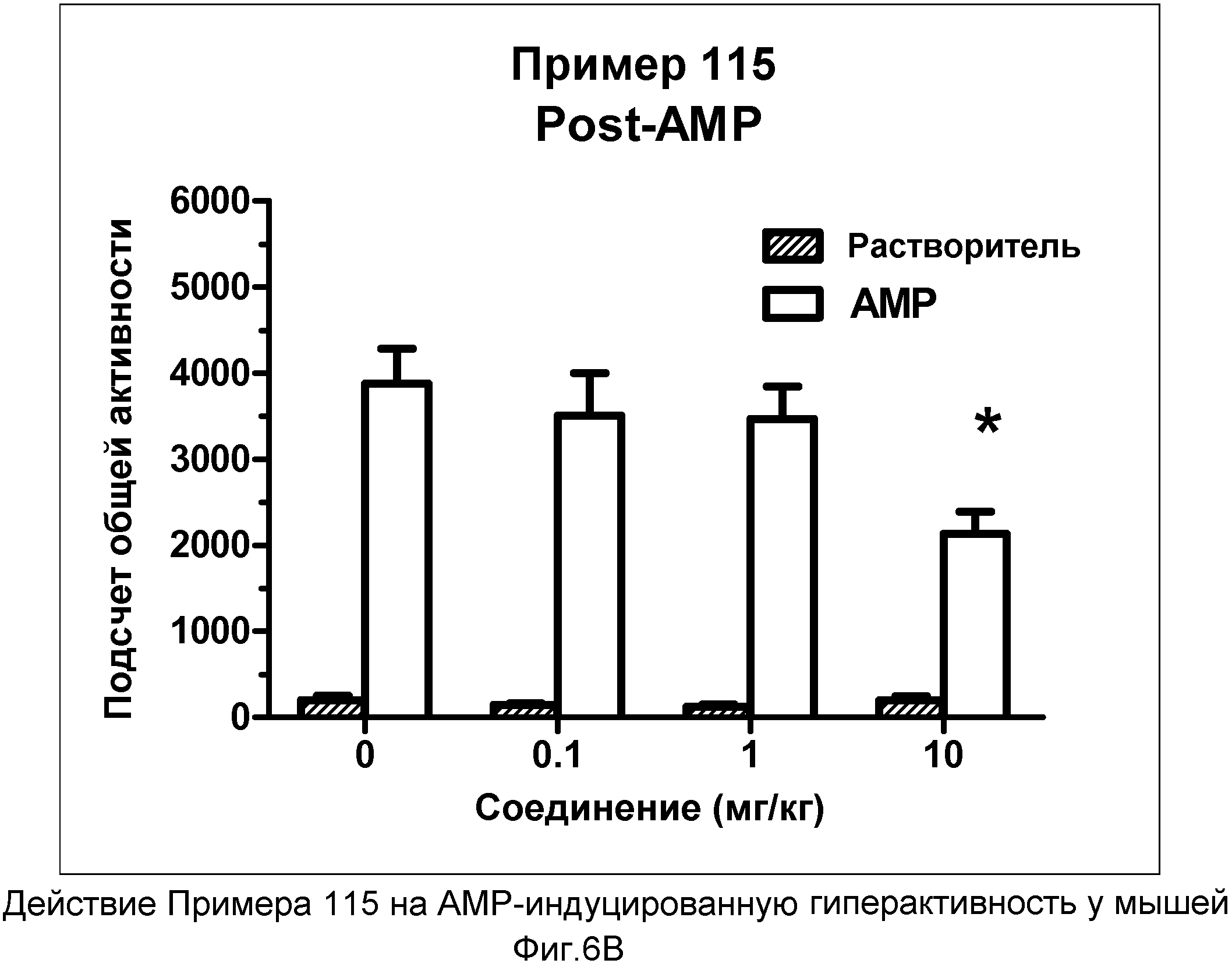
На фиг.6B показано графическое изображение концентрация-зависимых эффектов соединения примера 115, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 115, затем AMP. На фиг.6B показаны общие индексы активности после инъекции AMP для различных групп.
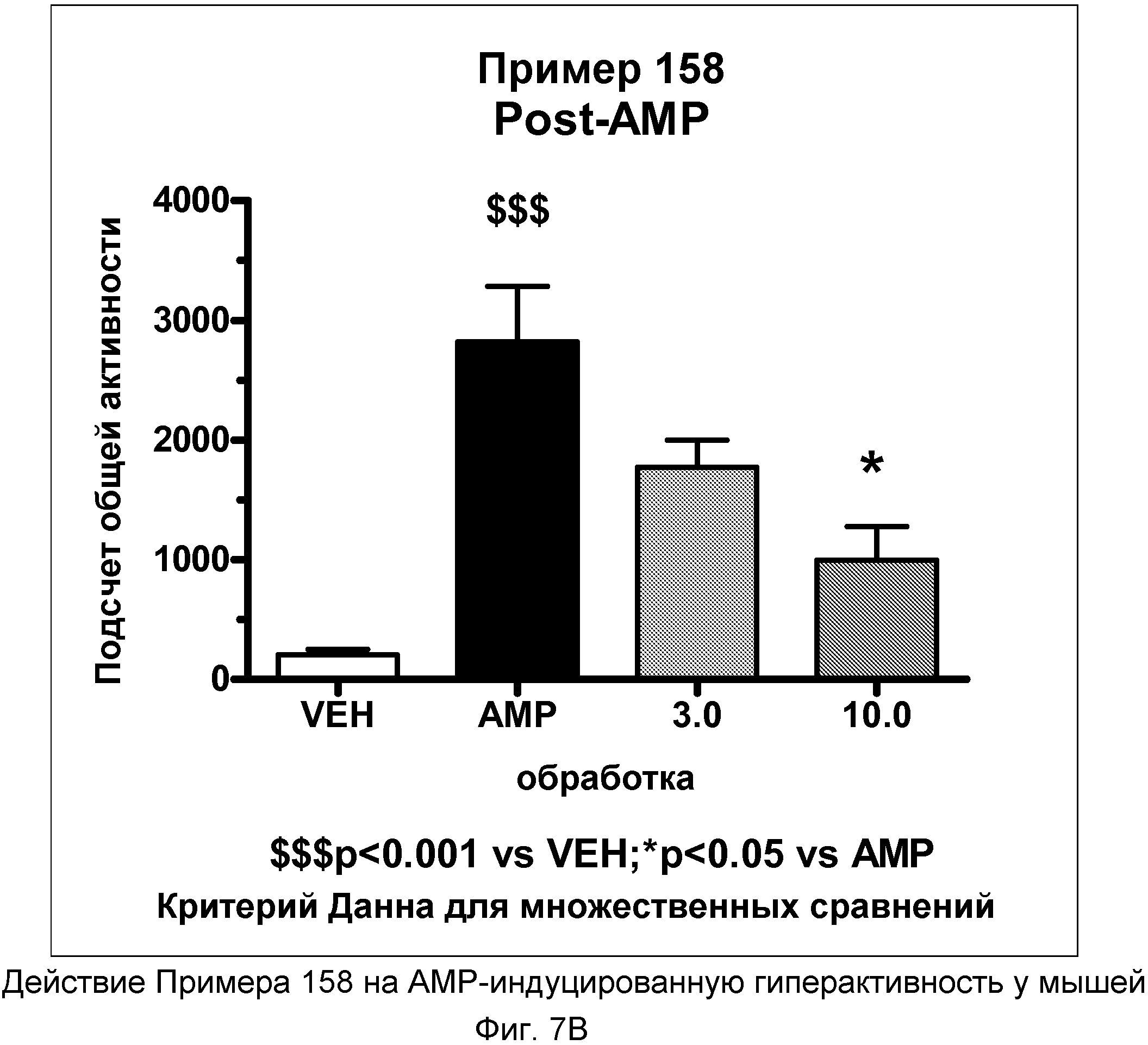
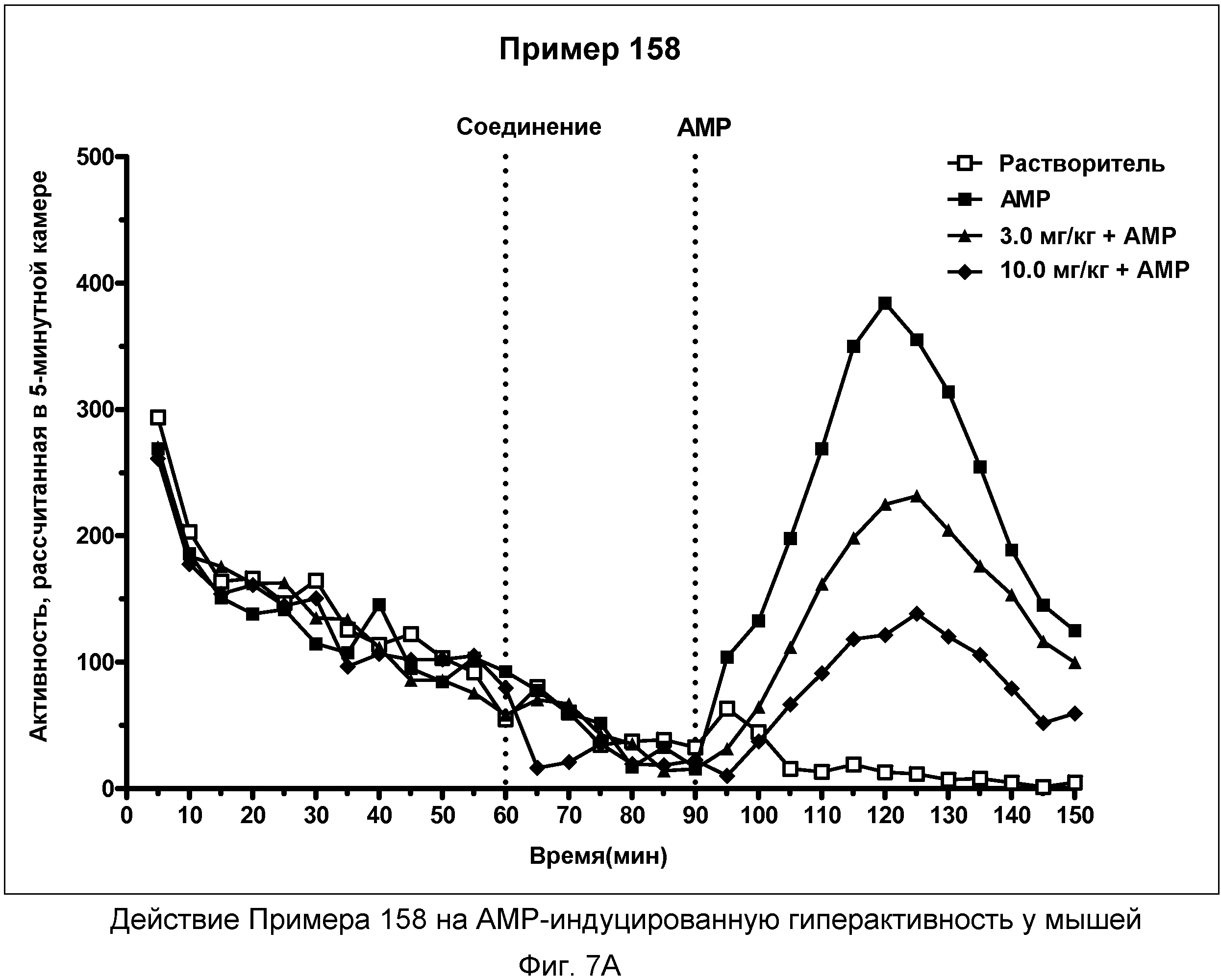
На фиг.7A показано графическое изображение концентрация-зависимых эффектов соединения примера 158, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 158, затем AMP. По оси Х отложено время (минут), а по оси Y отложены индексы активности за 5-минутный период времени.
На фиг.7B показано графическое изображение концентрация-зависимых эффектов соединения примера 158, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 158, затем AMP. На фиг.7B показаны общие индексы активности после инъекции AMP для различных групп.
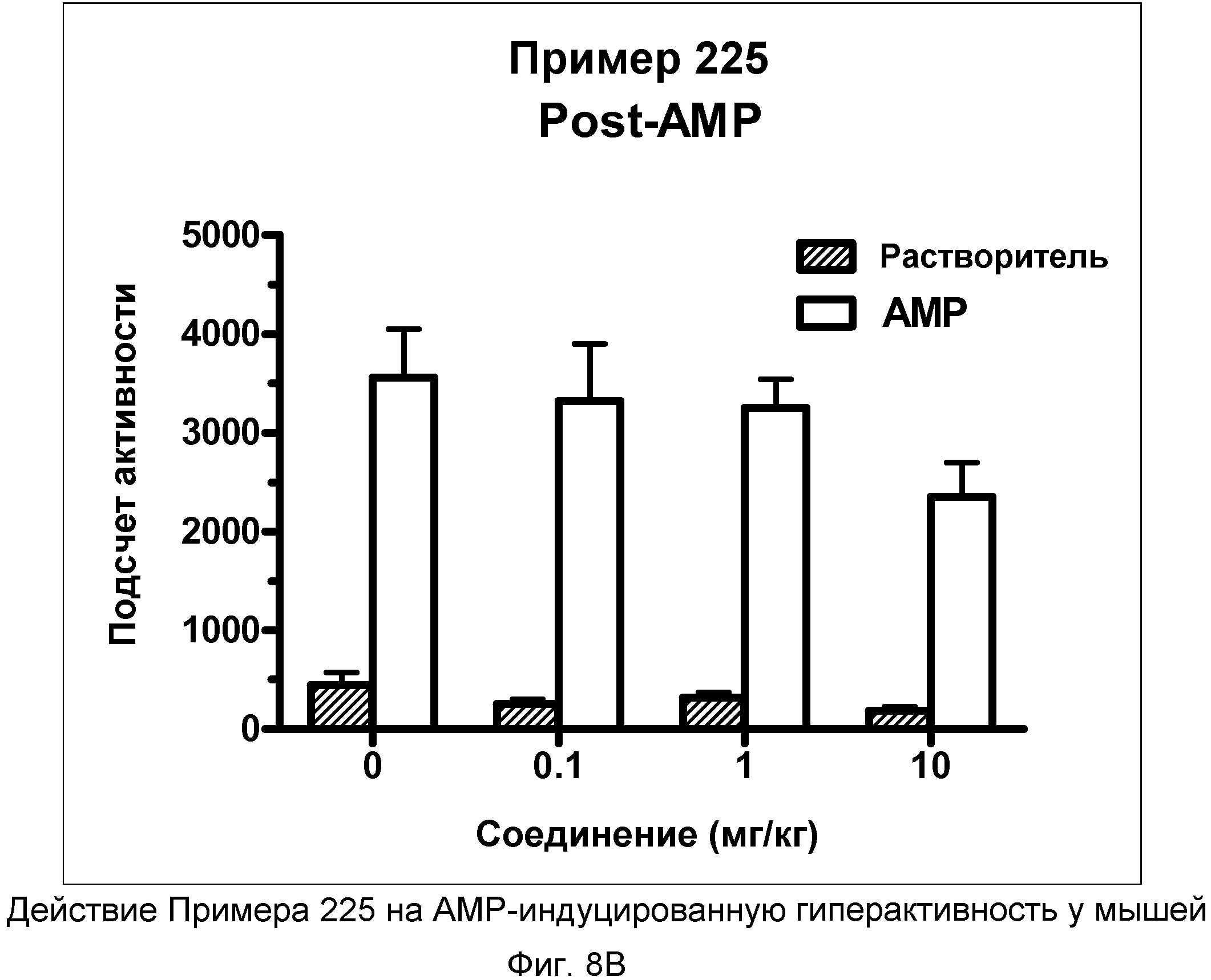
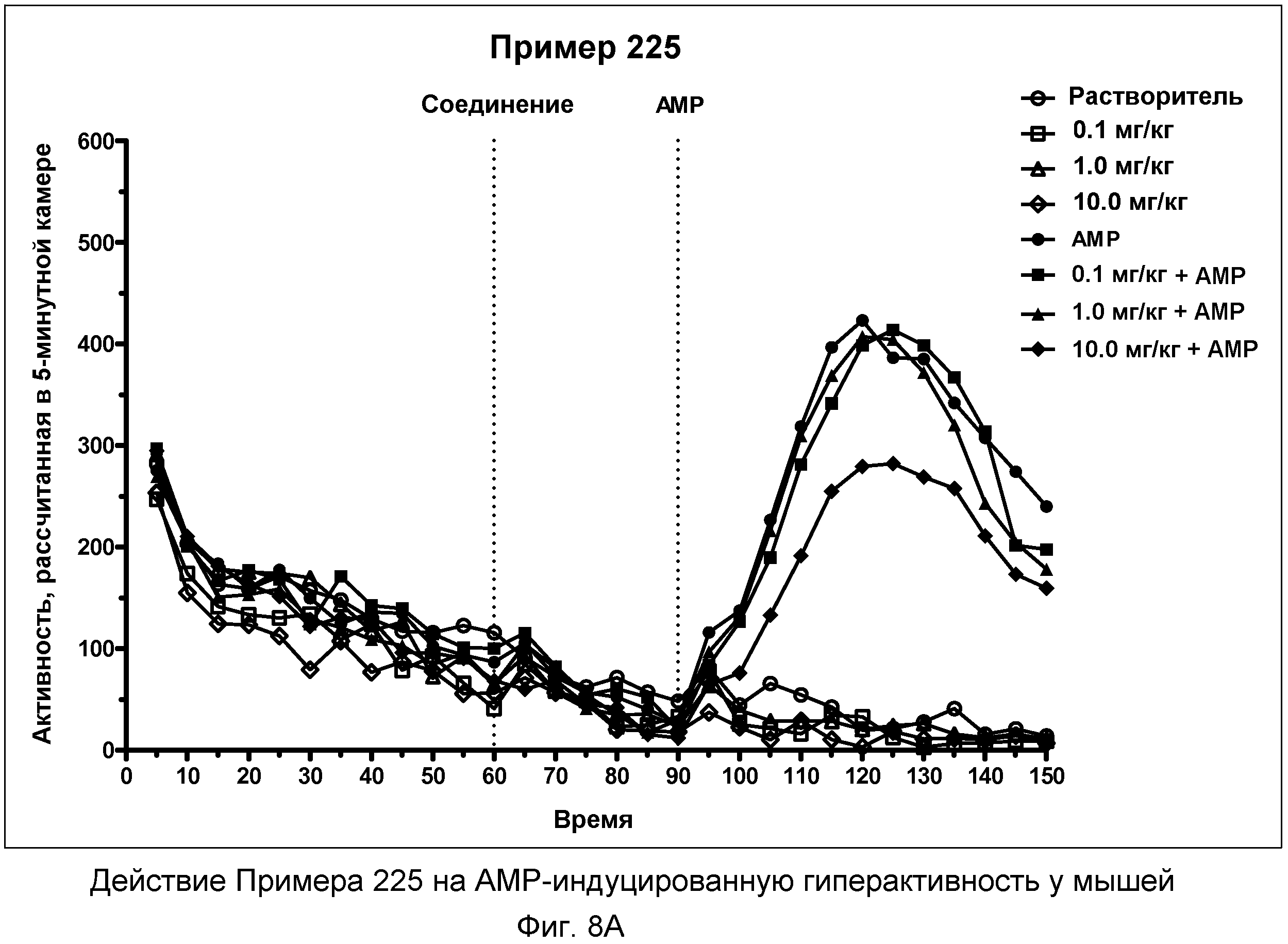
На фиг.8A показано графическое изображение концентрация-зависимых эффектов соединения примера 225, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 225, затем AMP. По оси Х отложено время (минут), а по оси Y отложены индексы активности за 5-минутный период времени.
На фиг.8B показано графическое изображение концентрация-зависимых эффектов соединения примера 225, ослабляющих действие d-амфетамина (AMP). Мышь обрабатывали носителем, AMP или дозой соединения примера 225, затем AMP. На фиг.8B показаны общие индексы активности после инъекции AMP для различных групп.
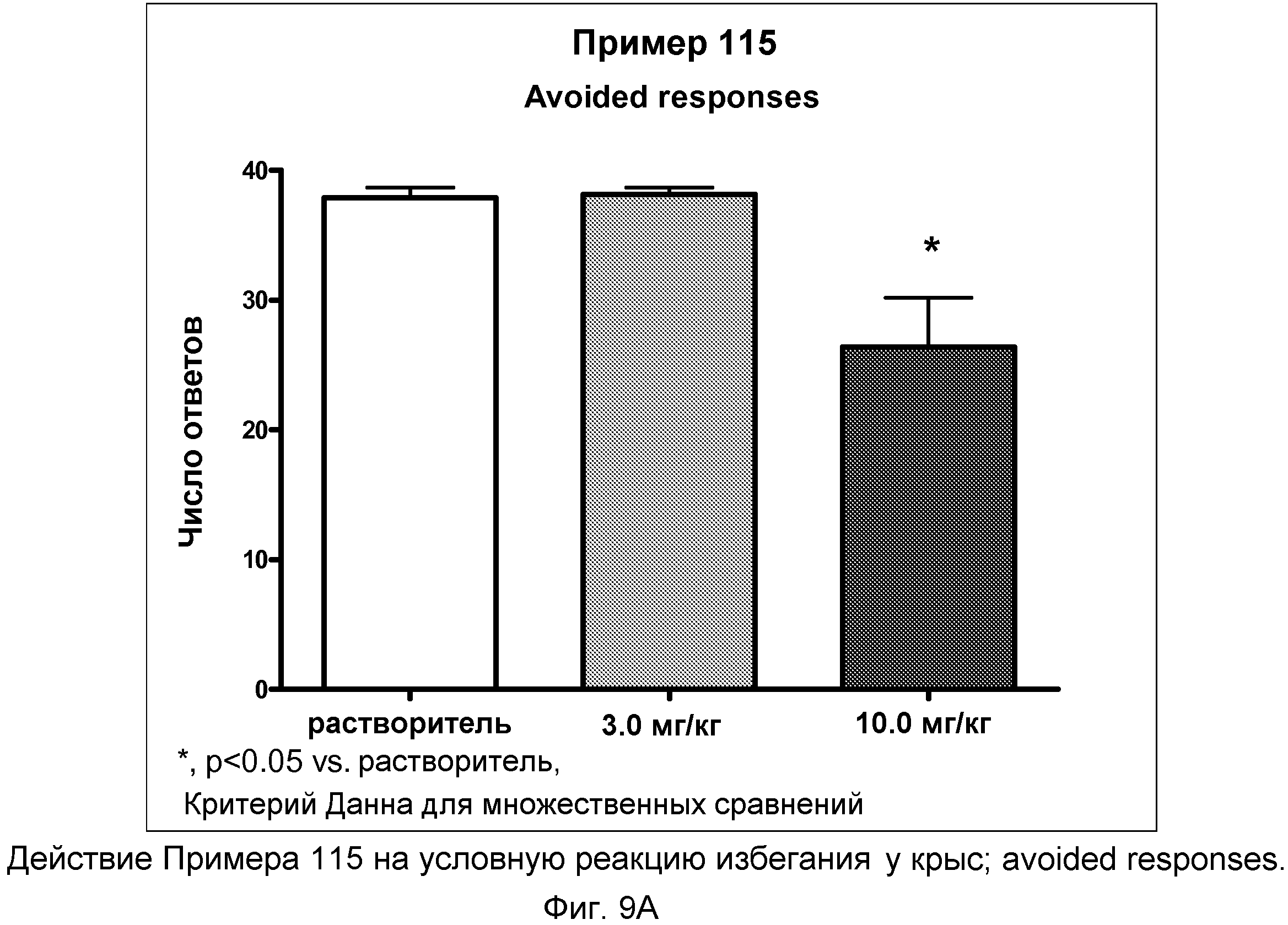
На фиг.9A показано графическое изображение реакций избегания в условной реакции избегания у крыс после неотложного введения соединения примера 115. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
На фиг.9B показано графическое изображение реакций уклонения в условной реакции избегания у крыс после неотложного введения соединения примера 115. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
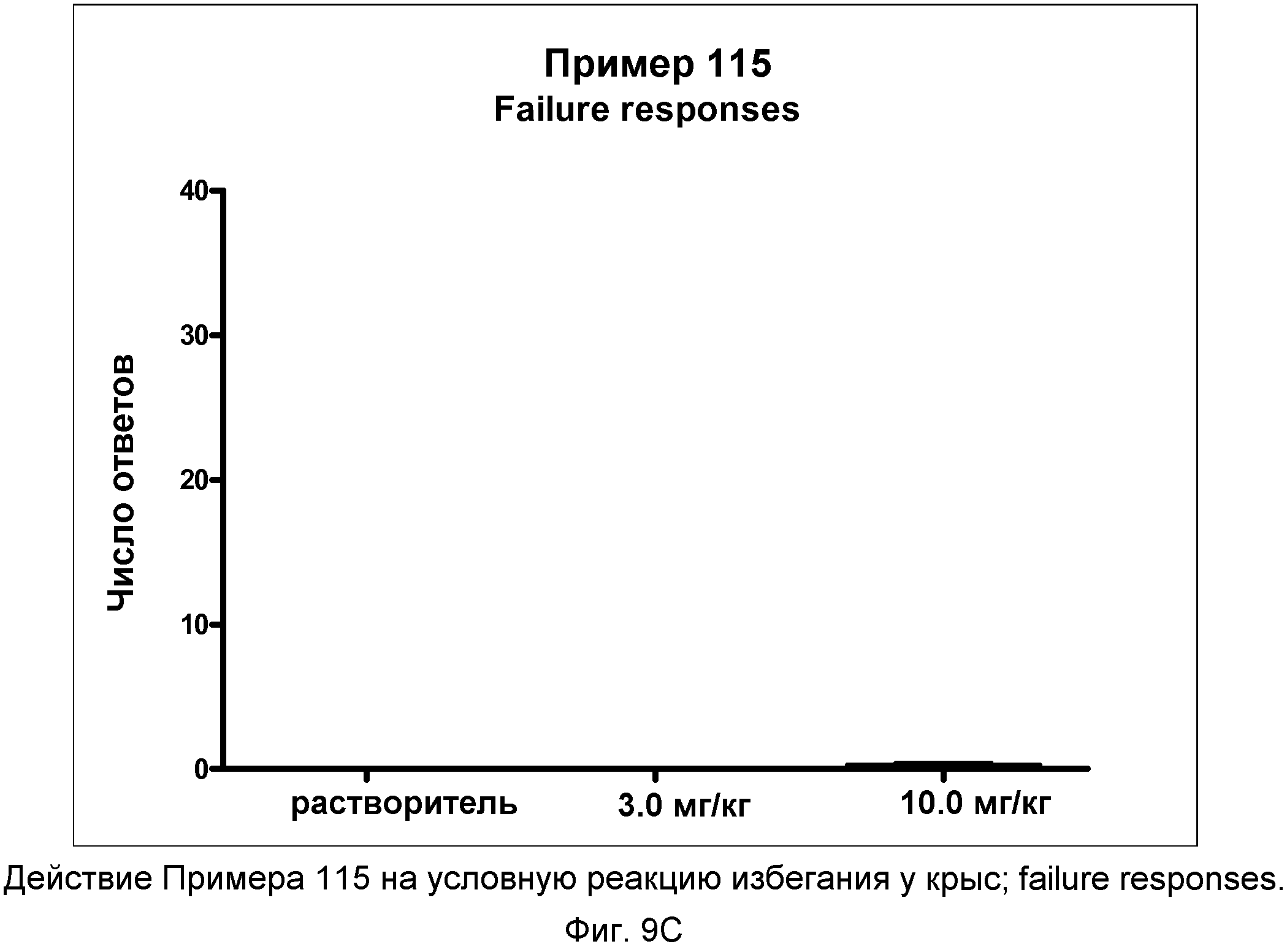
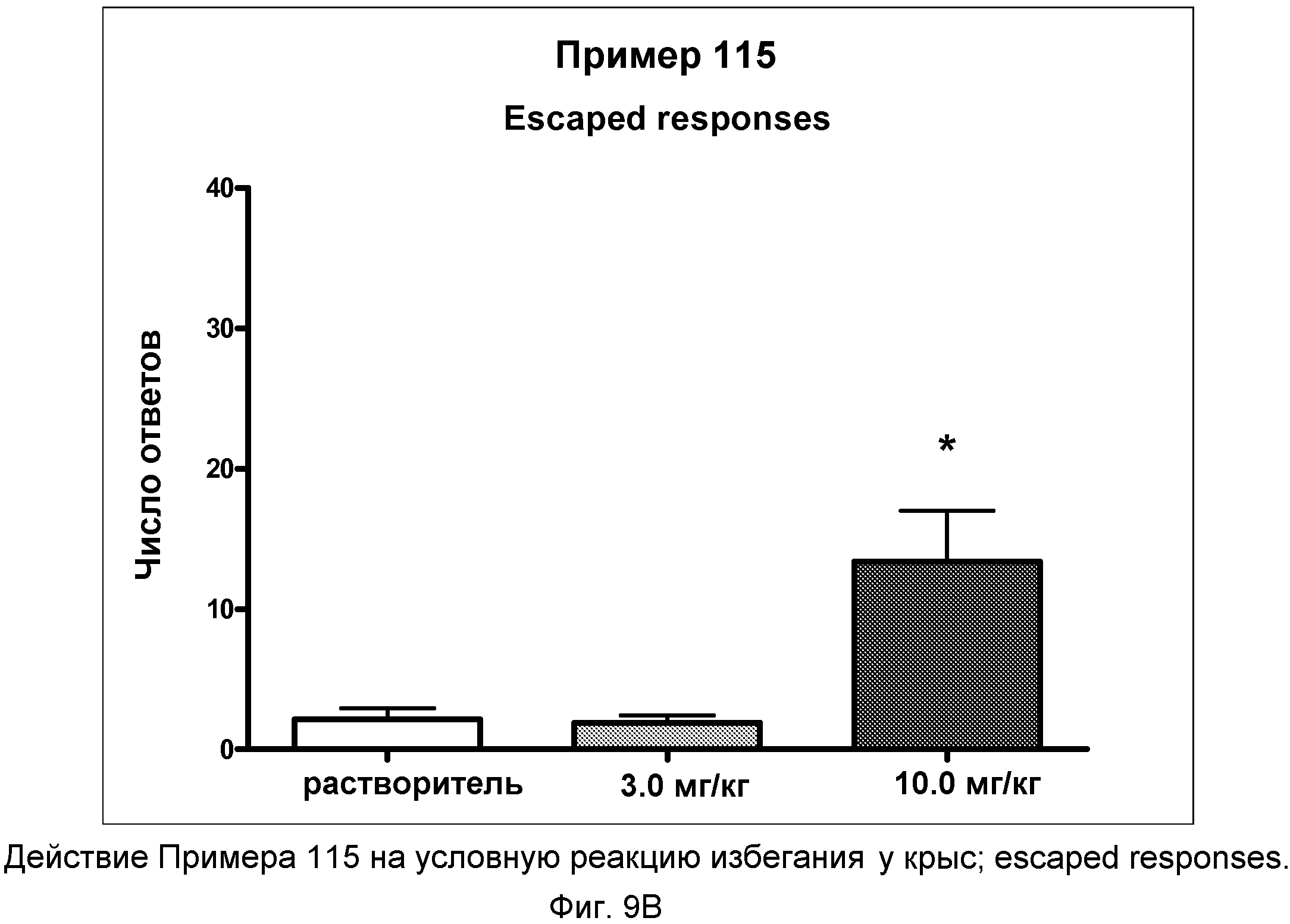
На фиг.9C показано графическое изображение реакций отказа в условной реакции избегания у крыс после неотложного введения соединения примера 115. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
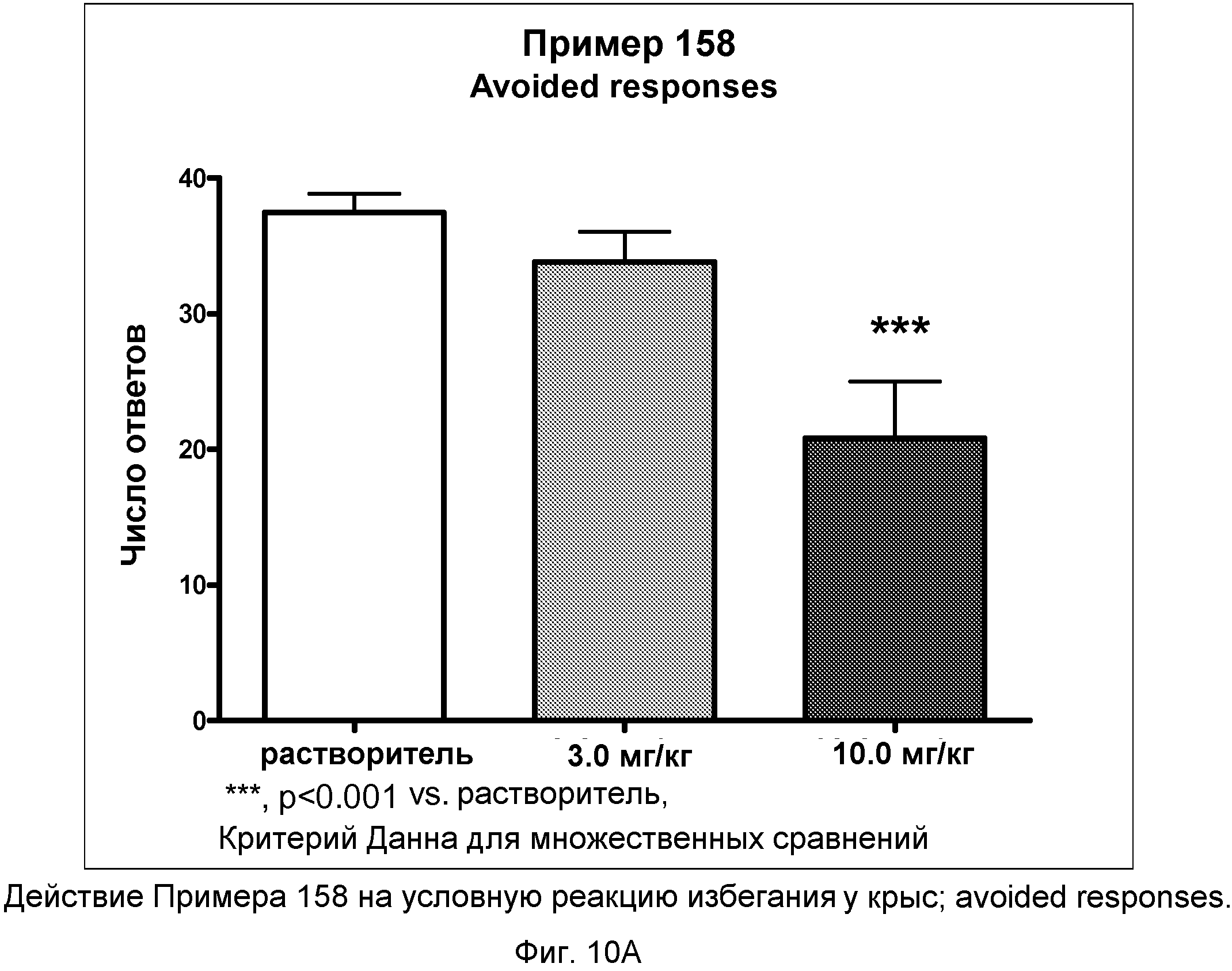
На фиг.10A показано графическое изображение реакций избегания в условной реакции избегания у крыс после неотложного введения соединения примера 158. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
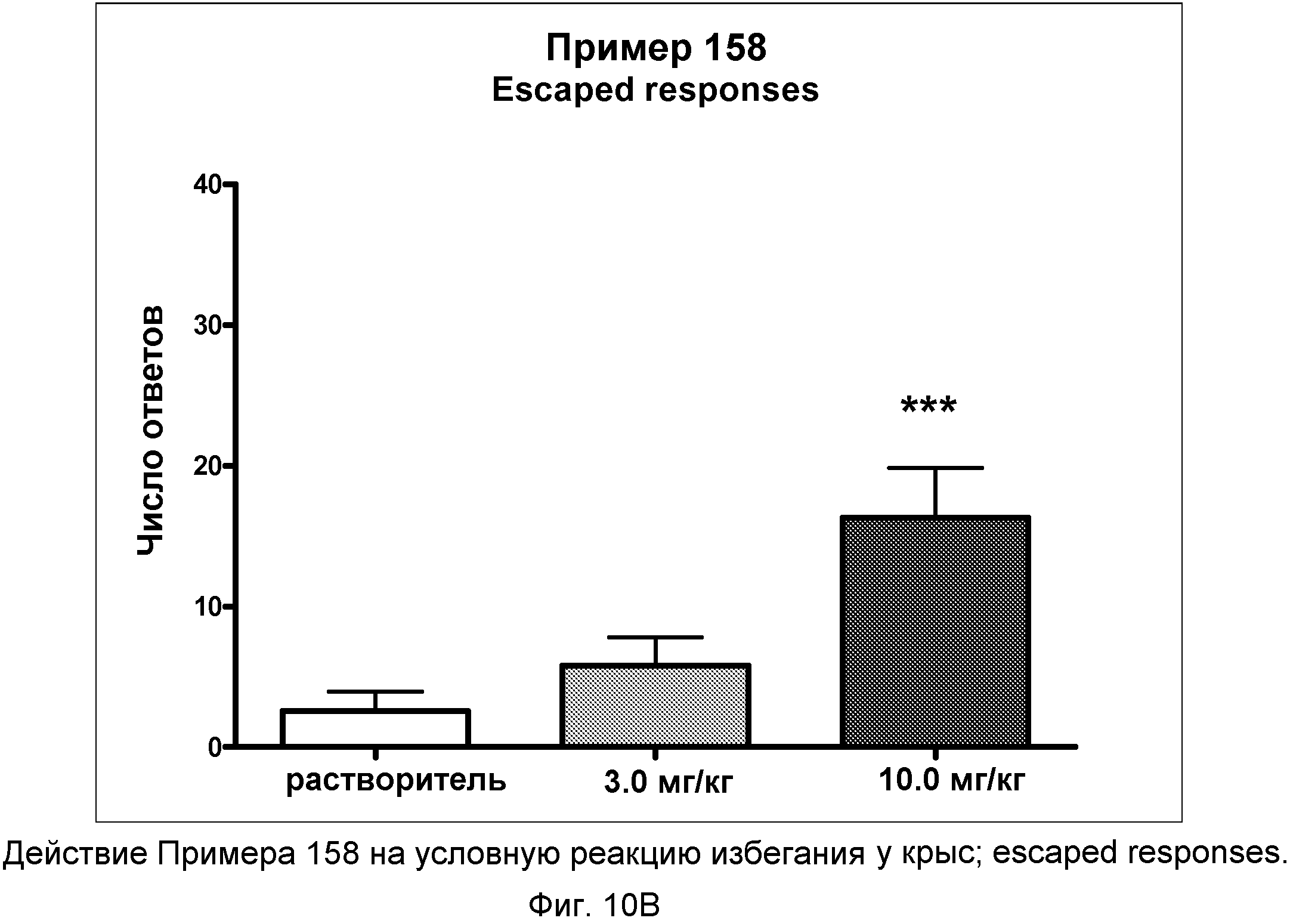
На фиг.10B показано графическое изображение реакций уклонения в условной реакции избегания у крыс после неотложного введения соединения примера 158. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
На фиг.10C показано графическое изображение реакций отказа в условной реакции избегания у крыс после неотложного введения соединения примера 158. По оси Х отложена доза, а по оси Y отложено количество этих типов реакции.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение относится к соединениям, имеющим формулу (I), как показано ниже:
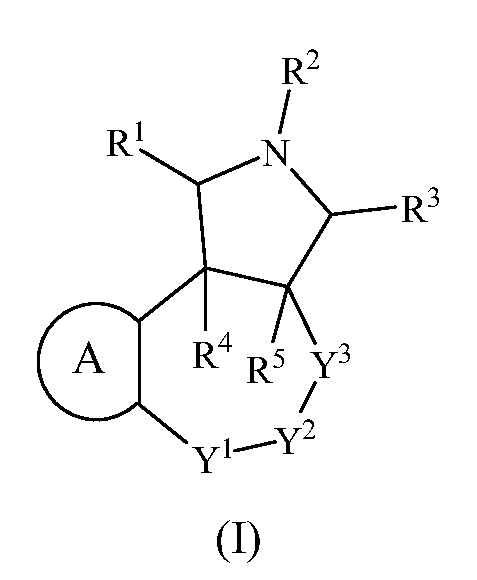
где R1, R2, R3, R4, R5, A, Y1, Y2 и Y3 являются такими, как определено выше в разделе Сущность изобретения.
В другом аспекте настоящее изобретение относится к композициям, содержащим соединения, имеющие формулу (I), как описано выше, и по меньшей мере один фармацевтически приемлемый носитель.
В еще одном аспекте настоящее изобретение относится к способам предотвращения и лечения болезненных состояний, например, лечения когнитивной дисфункции, дефицита внимания/синдрома гиперактивности, расстройств личности, аффективных расстройств, двигательных нарушений или моторных нарушений, мигрени, нарушений сна, пищевых расстройств, желудочно-кишечных расстройств, заболеваний, связанных с нейродегенерацией, зависимостей от наркотика или алкоголя, ожирения, диабета, псориаза или офтальмогипертензий, используя соединения, имеющие формулу (I), как описано выше.
В еще одном аспекте настоящее изобретение относится к применению соединений, имеющих формулу (I), при получении лекарственного средства для профилактики или лечения болезненных состояний, например, лечения когнитивной дисфункции, дефицита внимания/синдрома гиперактивности, расстройств личности, аффективных расстройств, двигательных нарушений или моторных нарушений, мигрени, нарушений сна, пищевых расстройств, желудочно-кишечных расстройств, заболеваний, связанных с нейродегенерацией, зависимости от наркотика или алкоголя, ожирения, диабета, псориаза или офтальмогипертензий, описанных выше, самостоятельно или в сочетании с по меньшей мере одним фармацевтически приемлемым носителем.
В различных вариантах осуществления настоящее изобретение обеспечивает по меньшей мере одну переменную, которая встречается чаще одного раза в любом заместителе или в соединении по настоящему изобретению или любых других формулах, описанных в настоящем документе. Определение переменной в каждом случае независимо от ее определения в другом случае. Кроме того, сочетания заместителей допустимы, только если такие сочетания дают стабильные соединения. Стабильные соединения представляют собой соединения, которые могут быть выделены из реакционной смеси.
a. Определения
Как используется в описании и прилагаемой формуле изобретения, если не указано иного, следующие термины имеют следующие значения:
Термин "алкенил", как здесь используется, подразумевает прямую или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода и содержащую по меньшей мере одну углерод-углеродную двойную связь, образованную путем удаления двух атомов водорода. Представительные примеры алкенила включают, но этим не ограничиваются, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил и 3-деценил.
Термин "алкокси", как здесь используется, подразумевает алкильную группу, как определено выше, присоединенную к основной молекулярной части через атом кислорода. Представительные примеры алкокси включают, но этим не ограничиваются, метокси, этокси, пропокси, 2-пропокси, бутокси, трет-бутокси, пентилокси и гексилокси.
Термин "алкоксиалкил", как здесь используется, подразумевает алкоксигруппу, как определено выше, присоединенную к основной молекулярной части через алкильную группу, как здесь определено. Представительные примеры алкоксиалкила включают, но этим не ограничиваются, трет-бутоксиметил, 2-этоксиэтил, 2-метоксиэтил и метоксиметил.
Термин "алкил", как здесь используется, подразумевает прямую или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 10 атомов углерода. Термин “низший алкил” или “C1-6 алкил” подразумевает прямой или разветвленный углеводород, содержащий от 1 до 6 атомов углерода. Термин “C1-3 алкил” подразумевает прямой или разветвленный углеводород, содержащий от 1 до 3 атомов углерода. Представительные примеры алкила включают, но этим не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил и н-децил.
Термин "алкилкарбонил", как здесь используется, подразумевает алкильную группу, как определено выше, присоединенную к основной молекулярной части через карбонильную группу, как здесь определено. Представительные примеры алкилкарбонила включают, но этим не ограничиваются, метилкарбонил, этилкарбонил, изопропилкарбонил, н-пропилкарбонил и тому подобное.
Термин "алкилен" подразумевает бивалентную группу, производную прямого или разветвленного углеводорода, содержащую от 1 до 10 атомов углерода. Представительные примеры алкилена включают, но этим не ограничиваются, -CH2-, -CH(CH3)-, -C(CH3)2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2- и -CH2CH(CH3)CH2-.
Термин "алкинил", как здесь используется, подразумевает прямую или разветвленную цепь углеводорода, содержащую от 2 до 10 атомов углерода и содержащую по меньшей мере одну углерод-углеродную тройную связь. Представительные примеры алкинила включают, но этим не ограничиваются, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.
Термин "арил", как здесь используется, подразумевает фенил или бициклический арил. Бициклический арил представляет собой нафтил, или фенил, конденсированный с моноциклическим циклоалкилом, или фенил, конденсированный с моноциклическим циклоалкенилом. Представительные примеры арильных групп включают, но этим не ограничиваются, дигидроинденил, инденил, нафтил, дигидронафталинил и тетрагидронафталинил. Бициклический арил присоединен к основной части молекулы посредством атома углерода, входящего в состав бициклической кольцевой системы. Арильные группы по настоящему изобретению могут быть незамещенными или замещенными.
Термин "карбонил", как здесь используется, подразумевает -C(=O)- группу.
Термин "циано", как здесь используется, подразумевает -CN группу.
Термин "цианоалкил", как здесь используется, подразумевает цианогруппу, как определено выше, присоединенную к основной молекулярной части через алкиленовую группу, как здесь определено. Представительные примеры цианоалкила включают, но этим не ограничиваются, цианометил, 2-цианоэтил и 3-цианопропил.
Термин "циклоалкенил", как здесь используется, подразумевает циклическую углеводородную группу, содержащую от 3 до 10 атомов углерода, содержащую 1 или 2 углерод-углеродные двойные связи. Примеры циклоалкенила включают циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил.
Термин "циклоалкил" или “циклоалкан”, как здесь используется, подразумевает моноциклический, бициклический или трициклический циклоалкил. Моноциклический циклоалкил представляет собой карбоциклическую кольцевую систему, содержащую от трех до восьми атомов углерода, не содержащую гетероатомы и двойные связи. Примеры моноциклических кольцевых систем включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Бициклический циклоалкил представляет собой моноциклический циклоалкил, конденсированный с моноциклическим циклоалкильным кольцом, или мостиковую моноциклическую кольцевую систему, в которой два не соседних атома углерода моноциклического кольца соединены алкиленовым мостиком, содержащим один, два, три или четыре атома углерода. Представительные примеры бициклической кольцевой системы включают, но этим не ограничиваются, бицикло[3.1.1]гептан, бицикло[2.2.1]гептан, бицикло[2.2.2]октан, бицикло[3.2.2]нонан, бицикло[3.3.1]нонан и бицикло[4.2.1]нонан. Трициклические циклоалкилы проиллюстрированы примерами бициклического циклоалкила, конденсированного с моноциклическим циклоалкилом, или бициклического циклоалкила, в котором два не соседних атома углерода кольцевых систем соединены алкиленовым мостиком из 1, 2, 3 или 4 атомов углерода. Представительные примеры трициклических кольцевых систем включают, но этим не ограничиваются, трицикло[3.3.1.03,7]нонан (октагидро-2,5-метанопентален или норадамантан) и трицикло[3,3,1,13,7]декан (адамантан). Моноциклический, бициклический и трициклический циклоалкилы могут быть незамещенными или замещенными, и они присоединены к основной части молекулы через способный к замещению атом, входящий в состав кольцевой системы.
Термин "галоген", как здесь используется, подразумевает Cl, Br, I или F.
Термин "галогеналкил", как здесь используется, подразумевает алкильную группу, как определено выше, в которой один, два, три, четыре, пять или шесть атомов водорода заменены на галоген. Представительные примеры галогеналкила включают, но этим не ограничиваются, фторметил, 2-фторэтил, 2,2,2-трифторэтил, трифторметил, дифторметил, пентафторэтил, 2-хлор-3-фторпентил и трифторпропил, такой как 3,3,3-трифторпропил.
Термин "гетероарил", как здесь используется, подразумевает моноциклический гетероарил или бициклический гетероарил. Моноциклический гетероарил представляет собой пяти- или шестичленное кольцо. Пятичленное кольцо содержит две двойные связи. Пятичленное кольцо может содержать один гетероатом, выбранный из O или S; или один, два, три или четыре атома азота и, необязательно, один атом кислорода или серы. Шестичленное кольцо содержит три двойные связи и один, два, три или четыре атома азота. Представительные примеры моноциклического гетероарила включают, но этим не ограничиваются, фуранил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, 1,3-оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, 1,3-тиазолил, тиенил, триазолил и триазинил. Термин "бициклический гетероарил" включает моноциклический гетероарил, конденсированный с фенилом, или моноциклический гетероарил, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероарил, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероарил, конденсированный с моноциклическим гетероарилом, или моноциклический гетероарил, конденсированный с моноциклическим гетероциклом. Представительные примеры бициклических гетероарильных групп включают, но этим не ограничиваются, бензофуранил, бензотиенил, бензоксазолил, бензимидазолил, бензоксадиазолил, 6,7-дигидро-1,3-бензотиазолил, имидазо[1,2-a]пиридинил, индазолил, индолил, изоиндолил, изохинолинил, нафтиридинил, пиридоимидазолил, хинолинил, тиазоло[5,4-b]пиридин-2-ил, тиазоло[5,4-d]пиримидин-2-ил и 5,6,7,8-тетрагидрохинолин-5-ил. Моноциклические и бициклические гетероарильные группы по настоящему изобретению могут быть замещенными или незамещенными и связаны с основной частью молекулы через атом углерода или атом азота, входящими в состав кольцевых систем.
Термин "гетероатом", как здесь используется, подразумевает атом азота, кислорода или серы.
Термин "гетероцикл" или "гетероциклический", как здесь используется, подразумевает моноциклический гетероцикл, бициклический гетероцикл или трициклический гетероцикл. Моноциклический гетероцикл представляет собой трех-, четырех-, пяти-, шести-, семи- или восьмичленное кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из группы, состоящей из O, N и S. Трех- или четырехчленное кольцо не содержит или содержит одну двойную связь и один гетероатом, выбранный из группы, состоящей из O, N и S. Пятичленное кольцо не содержит или содержит одну двойную связь и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Шестичленное кольцо не содержит или содержит одну или две двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Семи- и восьмичленные кольца не содержат или содержат одну, две или три двойные связи и один, два или три гетероатома, выбранных из группы, состоящей из O, N и S. Представительные примеры моноциклических гетероциклов включают, но этим не ограничиваются, азетидинил, азепанил, азиридинил, диазепанил, дигидропиранил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолин сульфон), тиопиранил и тритианил. Бициклический гетероцикл представляет собой моноциклический гетероцикл, конденсированный с фенильной группой, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероцикл, конденсированный с моноциклическим гетероциклом, или мостиковую моноциклическую гетероциклическую кольцевую систему, в которой два не соседних атома кольца соединены алкиленовым мостиком из 1, 2, 3 или 4 атомов углерода или алкениленовым мостиком из двух, трех или четырех атомов углерода. Представительные примеры бициклических гетероциклов включают, но этим не ограничиваются, бензопиранил, бензотиопиранил, хроманил, 2,3-дигидробензофуранил, 2,3-дигидробензотиенил, азабицикло[2.2.1]гептил (включая 2-азабицикло[2.2.1]гепт-2-ил), 2,3-дигидро-1H-индолил, изоиндолинил, октагидроциклопента[c]пирролил, октагидропирролопиридинил и тетрагидроизохинолинил. Трициклические гетероциклы проиллюстрированы примерами бициклического гетероцикла, конденсированного с фенильной группой, или бициклического гетероцикла, конденсированного с моноциклическим циклоалкилом, или бициклического гетероцикла, конденсированного с моноциклическим циклоалкенилом, или бициклического гетероцикла, конденсированного с моноциклическим гетероциклом, или бициклического гетероцикла, в котором два не соседних атома бициклического кольца связаны алкиленовым мостиком из 1, 2, 3 или 4 атомов углерода или алкениленовым мостиком из двух, трех или четырех атомов углерода. Примеры трициклических гетероциклов включают, но этим не ограничиваются, октагидро-2,5-эпоксипентален, гексагидро-2H-2,5-метаноциклопента[b]фуран, гексагидро-1H-1,4-метаноциклопента[c]фуран, азаадамантан (1-азатрицикло[3.3.1.13,7]декан) и оксаадамантан (2-охатрицикло[3.3.1.13,7]декан). Моноциклические, бициклические и трициклические гетероциклы присоединены к основной части молекулы через атом углерода или атом азота, содержащиеся в кольцах, и могут быть незамещенными или замещенными.
Термин "азотзащитная группа", как здесь используется, подразумевает такие группы, которые предназначены для защиты аминогруппы от нежелательных взаимодействий в процессе осуществления способов синтеза. Предпочтительные азотзащитные группы представляют собой ацетил, бензоил, бензил, бензилоксикарбонил (Cbz), формил, фенилсульфонил, трет-бутоксикарбонил (Boc), трет-бутилацетил, трифторацетил и трифенилметил (тритил).
Термин "оксо", как здесь используется, подразумевает группу =O.
b. Соединения
Соединения по настоящему изобретению имеют формулу (I), как описано выше.
Конкретные значения изменяющихся групп в соединениях формулы (I) являются следующими. Такие значения могут быть использованы, когда необходимо, с любым из других значений, определений, пунктов формулы или вариантов изобретения, определенных выше или далее.
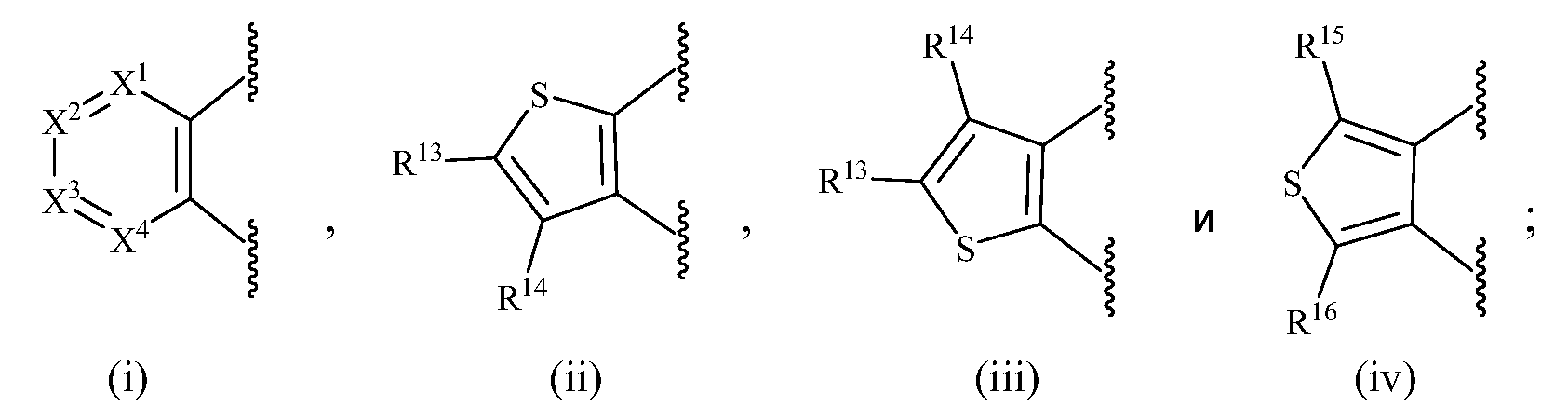
В одном варианте осуществления изобретения A представляет собой (i).
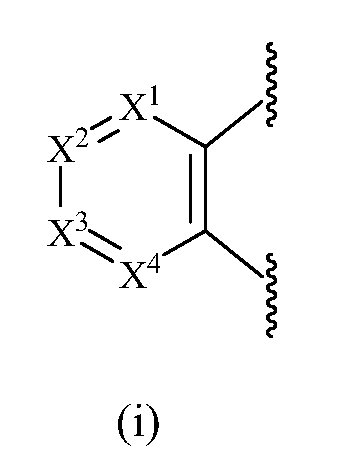
В одном варианте осуществления изобретения X1, X2, X3 и X4 представляют собой N или CR9, CR10, CR11 или CR12, соответственно, при условии, что только один или два из X1, X2, X3 или X4 представляет собой N.
В одном варианте осуществления изобретения X1, X2, X3 и X4 представляют собой CR9, CR10, CR11 и CR12, соответственно.
В одном варианте осуществления изобретения X1 представляет собой N, и X2, X3 и X4 представляют собой CR10, CR11 и CR12, соответственно.
В одном варианте осуществления изобретения X2 представляет собой N и X1, X3 и X4 представляют собой CR9, CR11 и CR12, соответственно.
В одном варианте осуществления изобретения X3 представляет собой N и X1, X2 и X4 представляют собой CR9, CR10 и CR12, соответственно.
В одном варианте осуществления изобретения X4 представляет собой N и X1, X2 и X3 представляют собой CR9, CR10 и CR11, соответственно.
В одном варианте осуществления изобретения R9, R10, R11 и R12, каждый, независимо представляют собой водород, алкил, алкенил, алкинил, галоген, циано, -G1, -G2, -NO2, -OR1a, -OC(O)R1a, -OC(O)N(Rb)(R3a), -SR1a, -S(O)R2a, -S(O)2R2a, -S(O)2N(Rb)(R3a), -C(O)R1a, -C(O)G3, -C(O)OR1a, -C(O)N(Rb)(R3a), -N(Rb)(R3a), -N(Ra)C(O)R1a, -N(Ra)C(O)O(R1a), -N(Ra)C(O)N(Rb)(R3a), -N(Ra)S(O)2(R2a), -(CR4aR5a)m-NO2, -(CR4aR5a)m-OR1a, -(CR4aR5a)m-OC(O)R1a, -(CR4aR5a)m-OC(O)N(Rb)(R3a), -(CR4aR5a)m-SR1a, -(CR4aR5a)m-S(O)R2a, -(CR4aR5a)m-S(O)2R2a, -(CR4aR5a)m-S(O)2N(Rb)(R3a), -(CR4aR5a)m-C(O)R1a, -(CR4aR5a)m-C(O)OR1a, -(CR4aR5a)m-C(O)N(Rb)(R3a), -(CR4aR5a)m-N(Rb)(R3a), -(CR4aR5a)m-N(Ra)C(O)R1a, -(CR4aR5a)m-N(Ra)C(O)O(R1a), -(CR4aR5a)m-N(Ra)C(O)N(Rb)(R3a), -(CR4aR5a)m-G1, -CR4a=CR5a-G1, -(CR4aR5a)m-G2, -CR4a=CR5a-G2, -CR6a=C(R7a)2, цианоалкил, галогеналкил, (v), (vi), (vii) или (viii); где
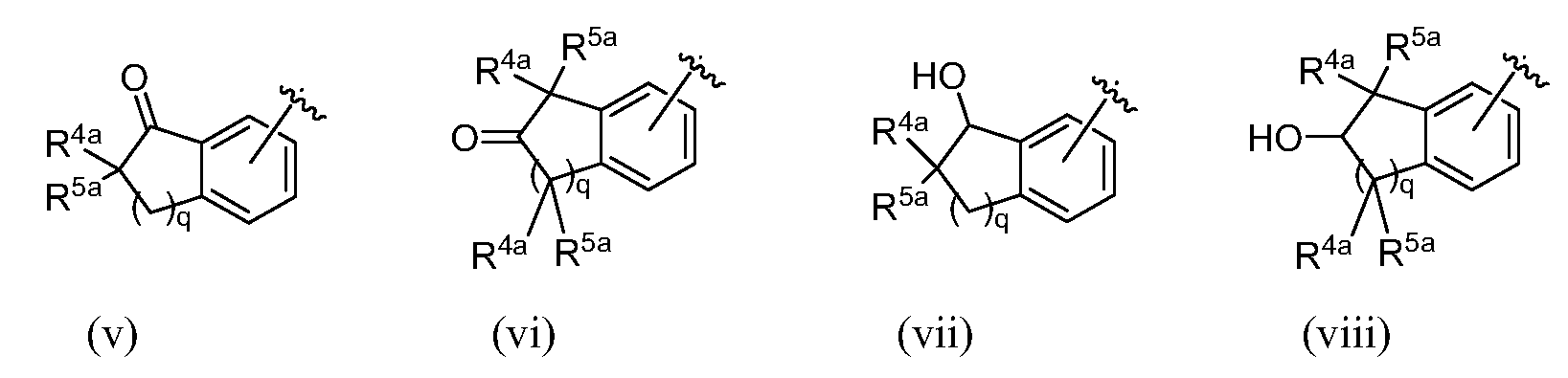
R1a и R3a в каждом случае, каждый, независимо представляют собой водород, алкил, галогеналкил, G1, -(CR4aR5a)m-G1, G2 или -(CR4aR5a)m-G2; R2a, в каждом случае, независимо представляет собой алкил, галогеналкил, G1, или -(CR4aR5a)m-G1; R6a представляет собой алкил или галогеналкил; R7a, в каждом случае, независимо представляет собой водород, алкил или галогеналкил; G3 представляет собой гетероциклическое кольцо, присоединенное к соседней карбонильной группе через атом азота, имеющийся в гетероцикле; и q равен 1 или 2.
В следующем варианте осуществления один или два из R9, R10, R11 и R12, каждый, независимо представляют собой алкил, алкенил, алкинил, галоген, циано, -G1, -G2, -NO2, -OR1a, -OC(O)R1a, -OC(O)N(Rb)(R3a), -SR1a, -S(O)R2a, -S(O)2R2a, -S(O)2N(Rb)(R3a), -C(O)R1a, -C(O)G3, -C(O)OR1a, -C(O)N(Rb)(R3a), -N(Rb)(R3a), -N(Ra)C(O)R1a, -N(Ra)C(O)O(R1a), -N(Ra)C(O)N(Rb)(R3a), -N(Ra)S(O)2(R2a), -(CR4aR5a)m-NO2, -(CR4aR5a)m-OR1a, -(CR4aR5a)m-OC(O)R1a, -(CR4aR5a)m-OC(O)N(Rb)(R3a), -(CR4aR5a)m-SR1a, -(CR4aR5a)m-S(O)R2a, -(CR4aR5a)m-S(O)2R2a, -(CR4aR5a)m-S(O)2N(Rb)(R3a), -(CR4aR5a)m-C(O)R1a, -(CR4aR5a)m-C(O)OR1a, -(CR4aR5a)m-C(O)N(Rb)(R3a), -(CR4aR5a)m-N(Rb)(R3a), -(CR4aR5a)m-N(Ra)C(O)R1a, -(CR4aR5a)m-N(Ra)C(O)O(R1a), -(CR4aR5a)m-N(Ra)C(O)N(Rb)(R3a), -(CR4aR5a)m-G1, -CR4a=CR5a-G1, -(CR4aR5a)m-G2, -CR4a=CR5a-G2, цианоалкил, галогеналкил, (v), (vi), (vii) или (viii), и другие R9, R10, R11 и R12 представляют собой водород.
В другом варианте осуществления изобретения R9, R10, R11 и R12, каждый, независимо представляют собой водород, алкил, алкенил, галоген, -G1, -G2, -OR1a, -C(O)G3, -C(O)OR1a, -C(O)N(Rb)(R3a), -N(Rb)(R3a), -(CR4aR5a)m-OR1a, -(CR4aR5a)m-G1, -CR4a=CR5a-G1, -CR4a=CR5a-G2, (v) или (vii), где G1, необязательно, представляет собой замещенный фенил, нафтил или гетероарил.
В другом варианте осуществления изобретения R9 и R10, R10 и R11, или R11 и R12, взятые вместе с атомом углерода, к которому они присоединены, образуют замещенное или незамещенное фенильное, циклоалкильное, гетероциклическое или гетероарильное кольцо.
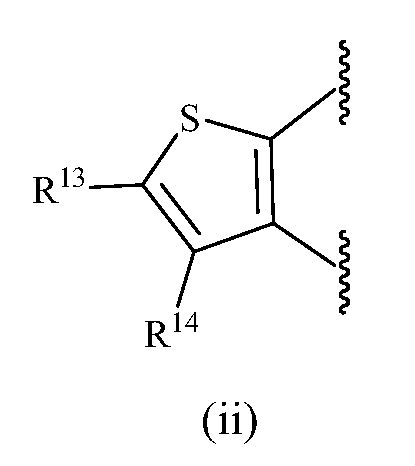
В одном варианте осуществления изобретения A представляет собой (ii).
В одном варианте осуществления изобретения A представляет собой (iii).
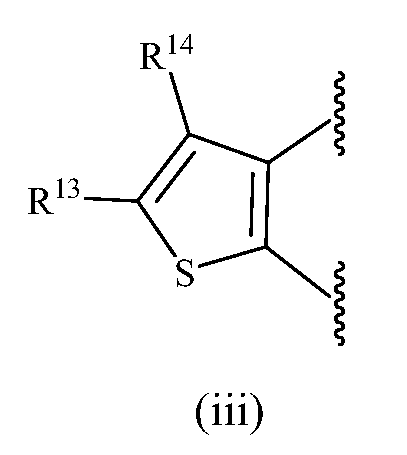
В одном варианте осуществления изобретения A представляет собой (iv).
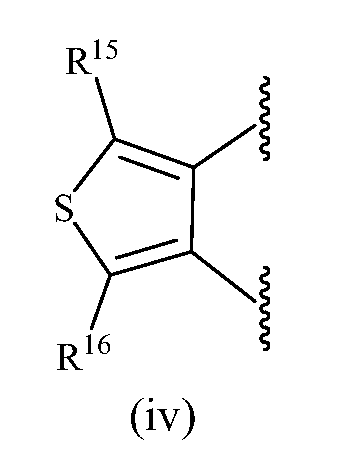
В одном варианте осуществления изобретения R13, R14, R15 и R16, каждый, независимо представляет собой водород, алкил, алкенил, алкинил, галоген, циано, -G1, -G2, -NO2, -OR1a, -OC(O)R1a, -OC(O)N(Rb)(R3a), -SR1a, -S(O)R2a, -S(O)2R2a, -S(O)2N(Rb)(R3a), -C(O)R1a, -C(O)G3, -C(O)OR1a, -C(O)N(Rb)(R3a), -N(Rb)(R3a), -N(Ra)C(O)R1a, -N(Ra)C(O)O(R1a), -N(Ra)C(O)N(Rb)(R3a), -N(Ra)S(O)2(R2a), -(CR4aR5a)m-NO2, -(CR4aR5a)m-OR1a, -(CR4aR5a)m-OC(O)R1a, -(CR4aR5a)m-OC(O)N(Rb)(R3a), -(CR4aR5a)m-SR1a, -(CR4aR5a)m-S(O)R2a, -(CR4aR5a)m-S(O)2R2a, -(CR4aR5a)m-S(O)2N(Rb)(R3a), -(CR4aR5a)m-C(O)R1a, -(CR4aR5a)m-C(O)OR1a, -(CR4aR5a)m-C(O)N(Rb)(R3a), -(CR4aR5a)m-N(Rb)(R3a), -(CR4aR5a)m-N(Ra)C(O)R1a, -(CR4aR5a)m-N(Ra)C(O)O(R1a), -(CR4aR5a)m-N(Ra)C(O)N(Rb)(R3a), -(CR4aR5a)m-G1, -CR4a=CR5a-G1, -(CR4aR5a)m-G2, -CR4a=CR5a-G2, -CR6a=C(R7a)2, цианоалкил, галогеналкил, (v), (vi), (vii) или (viii); где
R1a и R3a в каждом случае, каждый, независимо представляют собой водород, алкил, галогеналкил, G1, -(CR4aR5a)m-G1, G2 или -(CR4aR5a)m-G2; R2a в каждом случае независимо представляет собой алкил, галогеналкил, G1, или -(CR4aR5a)m-G1; R6a представляет собой алкил или галогеналкил; R7a в каждом случае независимо представляет собой водород, алкил или галогеналкил; G3 представляет собой гетероциклическое кольцо, присоединенное к соседней карбонильной группе через атом азота, имеющийся в гетероцикле; и q равен 1 или 2.
В другом варианте осуществления изобретения R13, R14, R15 и R16, каждый, независимо представляет собой водород, алкил или галоген.
В следующем варианте осуществления R13 и R14, взятые вместе с атомом углерода, к которому они присоединены, образуют замещенное или незамещенное фенильное или гетероарильное кольцо.
В одном варианте осуществления изобретения R1, R3, R4 и R5 независимо выбраны из группы, состоящей из водорода, алкенила, алкила, галогеналкила, G1, G2, -(CR4aR5a)m-G1 и -(CR4aR5a)m-G2.
В другом варианте осуществления изобретения R1, R3, R4 и R5 независимо выбраны из группы, состоящей из водорода и алкила.
В следующем варианте осуществления R1, R3, R4 и R5 представляют собой водород.
В одном варианте осуществления изобретения R2 представляет собой водород, алкоксиалкил, алкил, алкилкарбонил, галогеналкил, -(CR4aR5a)m-G1, -(CR4aR5a)m-G2, -(CR4aR5a)p-O-G1, -(CR4aR5a)p-O-G2, -C(O)-G1, -C(O)-G2, -S(O)2R6 или -C(O)NR7R8; где R6 и R7 независимо выбраны из группы, состоящей из алкила, галогеналкила, G1, G2, -(CR4aR5a)m-G1 и -(CR4aR5a)m-G2; где R8 выбран из группы, состоящей из водорода, алкила и галогеналкила; или R7 и R8, взятые вместе с атомом азота, к которому они присоединены, образуют гетероцикл.
В другом варианте осуществления изобретения R2 представляет собой водород, алкил, галогеналкил, -(CR4aR5a)m-G1 или -S(O)2R6; где R6 представляет собой G1.
В следующем варианте осуществления R2 представляет собой водород, алкил или галогеналкил.
В одном варианте осуществления изобретения Y1 представляет собой NR17, CR18R19, C(O), S(O)n или O.
В другом варианте осуществления изобретения Y1 представляет собой CR18R19, C(O) или O.
В другом варианте осуществления изобретения Y1 представляет собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой C(O).
В другом варианте осуществления изобретения Y1 представляет собой O.
В другом варианте осуществления изобретения Y1 представляет собой NR17.
В одном варианте осуществления изобретения Y2 представляет собой NR20, CR18R19, C(O) или S(O)n.
В другом варианте осуществления изобретения Y2 представляет собой NR20, C(O) или CR18R19.
В одном варианте осуществления изобретения Y3 представляет собой NR17, CR18R19, C(O) или S(O)n.
В другом варианте осуществления изобретения Y3 представляет собой NR17, CR18R19 или C(O).
В одном варианте осуществления изобретения Y1 представляет собой C(O), Y2 представляет собой NR20 и Y3 представляет собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой C(O), Y2 представляет собой NCH3 и Y3 представляет собой CH2.
В следующем варианте осуществления Y1 представляет собой C(O), Y2 представляет собой NH и Y3 представляет собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой CR18R19, Y2 представляет собой NR20 и Y3 представляет собой C(O).
В следующем варианте осуществления Y1 представляет собой CH2, Y2 представляет собой NH и Y3 представляет собой C(O).
В одном варианте осуществления изобретения Y1 представляет собой NR17, Y2 представляет собой C(O) и Y3 представляет собой CR18R19.
В следующем варианте осуществления Y1 представляет собой NH, Y2 представляет собой C(O) и Y3 представляет собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой CR18R19, Y2 представляет собой C(O) и Y3 представляет собой NR17.
В следующем варианте осуществления Y1 представляет собой CH2, Y2 представляет собой C(O) и Y3 представляет собой NH.
В одном варианте осуществления изобретения Y1 представляет собой S(O)n, где n равно 2, Y2 представляет собой NR20 и Y3 представляет собой CR18R19.
В следующем варианте осуществления Y1 представляет собой S(O)2, Y2 представляет собой NH и Y3 представляет собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой C(O) и Y2 и Y3, каждый, представляют собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой C(O) и Y2 и Y3, каждый, представляют собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой CR18R19, Y2 представляет собой NR20 и Y3 представляет собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой CH2, Y2 представляет собой NR20 и Y3 представляет собой CH2.
В следующем варианте осуществления Y1 представляет собой CH2, Y2 представляет собой NR20 и Y3 представляет собой CH2; где R20 выбран из группы, состоящей из водорода, алкила, алкилкарбонила, галогеналкила, -C(O)-G1, -C(O)NRa-G1, -S(O)n-G1 и -(CR4aR5a)m-G1.
В еще одном следующем варианте осуществления изобретения Y1 представляет собой CH2, Y2 представляет собой NR20 и Y3 представляет собой CH2; где R20 представляет собой -S(O)n-G1; где n и G1 имеют значения, как описано выше.
В одном варианте осуществления изобретения Y1 представляет собой NR17 и Y2 и Y3, каждый, представляют собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой NR17, где R17 представляет собой водород, алкил, алкилкарбонил или -(CR4aR5a)m-G1, и Y2 и Y3, каждый, представляют собой CH2.
В другом варианте осуществления изобретения Y1 представляет собой NH и Y2 и Y3, каждый, представляют собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой O, Y2 представляет собой CR18R19 и Y3 представляет собой CR18R19.
В другом варианте осуществления изобретения Y1 представляет собой O, Y2 представляет собой CH2 и Y3 представляет собой CH2.
В одном варианте осуществления изобретения Y1 и Y2 вместе представляют собой CR18=CR19 и Y3 представляет собой CR18R19.
В следующем варианте осуществления Y1 и Y2 вместе представляют собой CH=CH, и Y3 представляет собой CH2.
В одном варианте осуществления изобретения Y1 представляет собой CR18R19 и Y2 и Y3 вместе представляют собой CR18=CR19.
В другом варианте осуществления изобретения Y1 представляет собой CH2 и Y2 и Y3 вместе представляют собой CH=CH.
В одном варианте осуществления изобретения Y1, Y2 и Y3, каждый, представляют собой CR18R19.
В другом варианте осуществления изобретения Y1, Y2 и Y3, каждый, представляют собой CH2.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ia):
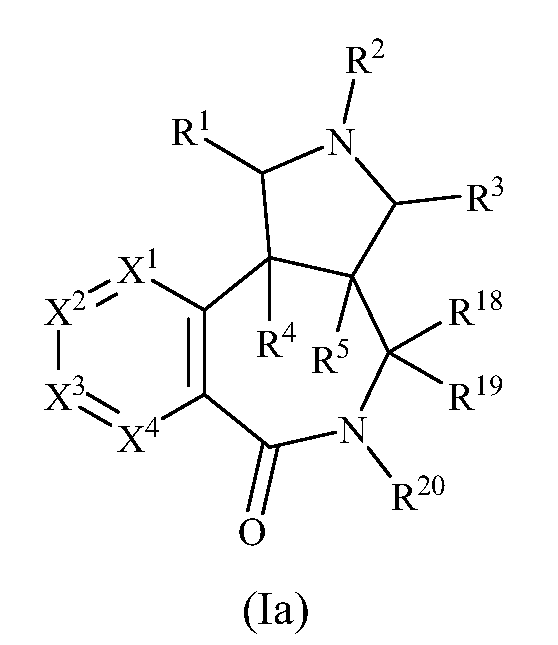
где R1, R2, R3, R4, R5 R18, R19, R20, X1, X2, X3 и X4 имеют значения, как описано выше.
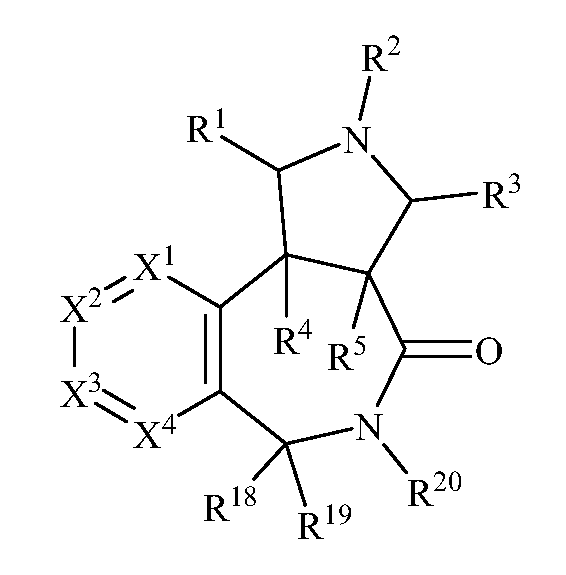
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ib):
где R1, R2, R3, R4, R5 R18, R19, R20, X1, X2, X3 и X4 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ic):
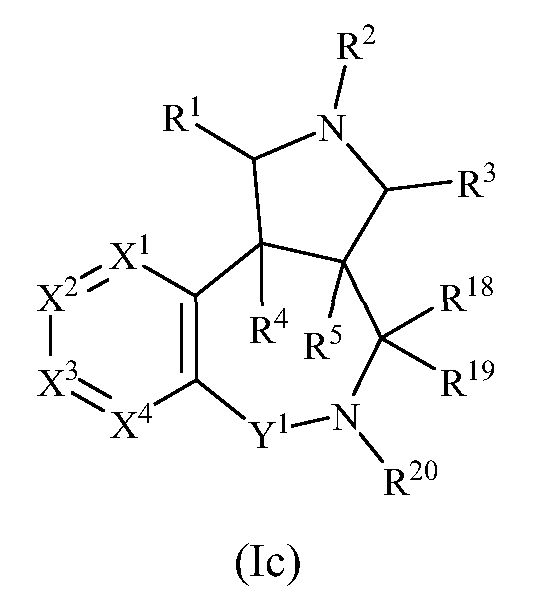
где R1, R2, R3, R4, R5 R18, R19, R20, X1, X2, X3 и X4 имеют значения, как описано выше, и Y1 представляет собой S(O)2 или CR18R19.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Id):
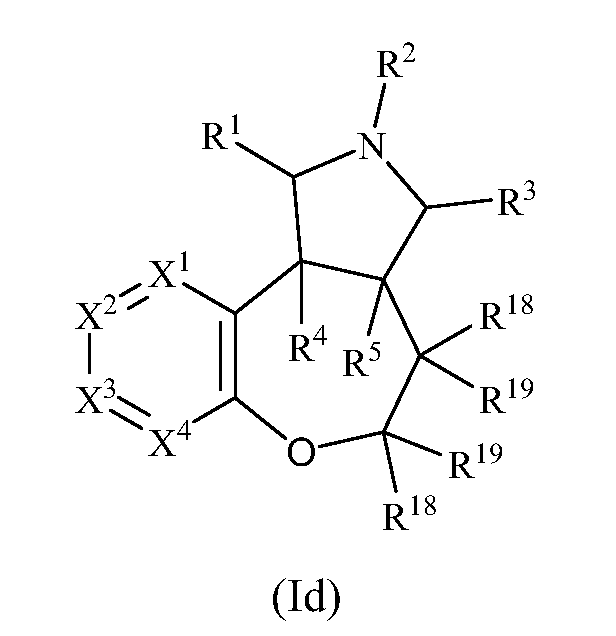
где R1, R2, R3, R4, R5 R18, R19, X1, X2, X3 и X4 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ie):
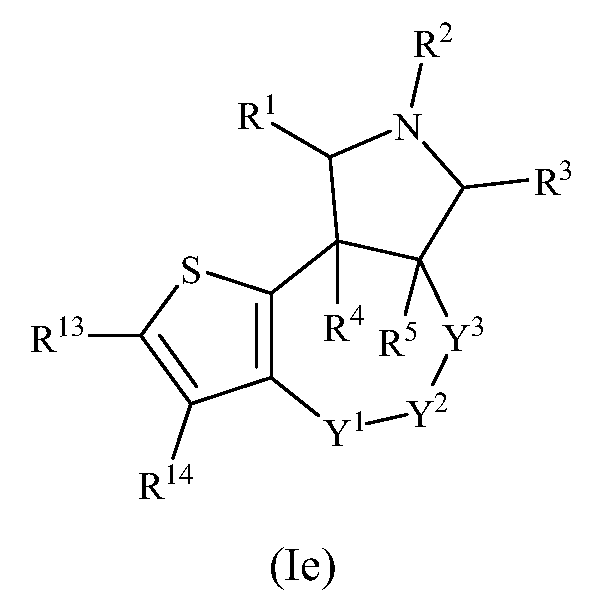
где R1, R2, R3, R4, R5, R13, R14, Y1, Y2 и Y3 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (If):
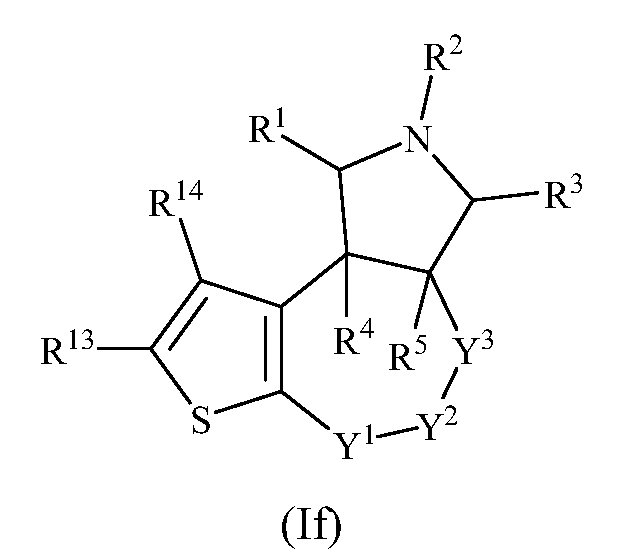
где R1, R2, R3, R4, R5, R13, R14, Y1, Y2 и Y3 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ig):
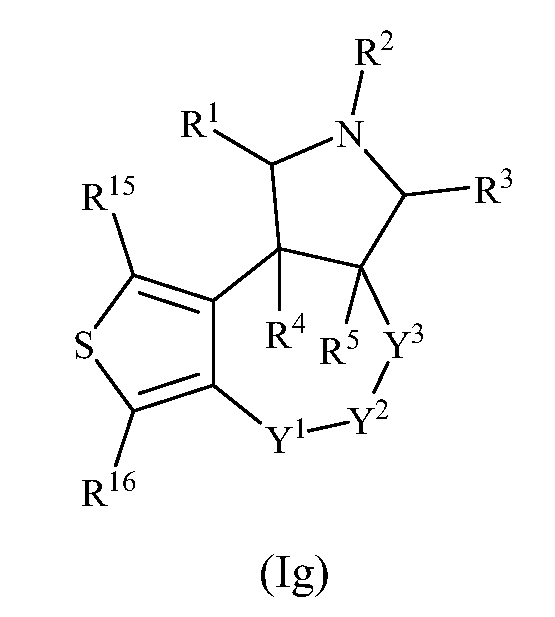
где R1, R2, R3, R4, R5, R15, R16, Y1, Y2 и Y3 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ih):
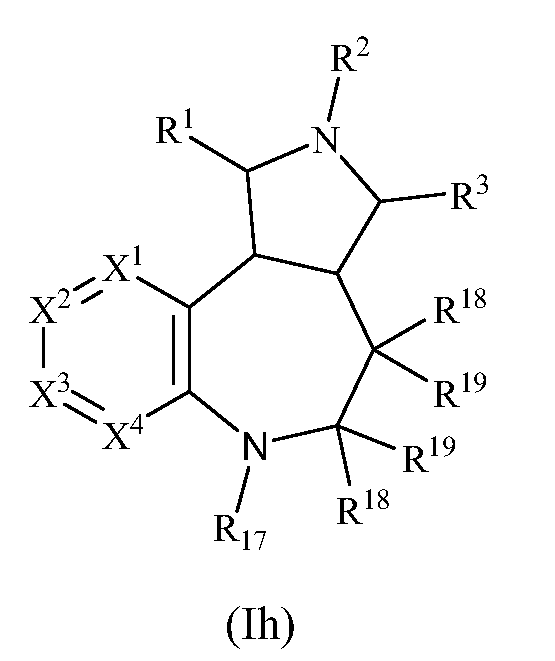
где R1, R2, R3, R17, R18, R19, X1, X2, X3 и X4 имеют значения, как описано выше.
В одном варианте осуществления изобретения соединения формулы (I) могут включать соединения формулы (Ii):
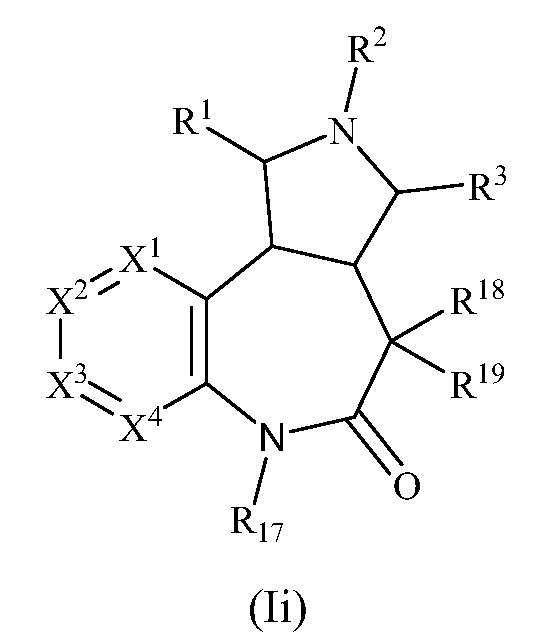
где R1, R2, R3, R17, R18, R19, X1, X2, X3, и X4 имеют значения, как описано выше.
Конкретные варианты осуществления соединений, рассматриваемые как часть изобретения, включают, но этим не ограничиваются,
транс-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он;
транс-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он;
транс-2-бензил-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2,3-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2,5-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2-бромфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-бромфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(нафталин-1-илсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-хлор-4-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2,5-диметоксифенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-(трифторметил)фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2,5-диметилфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-метоксифенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(3-хлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-5-(2-цианофенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-(3,5-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2,5-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2,4-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3,4-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3-метилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2,3-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3-метоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2-метоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
3-((транс-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-ил)метил)бензонитрил;
транс-2-(2,5-диметоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(3,5-диметоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(2,3-дихлорфенилсульфонил)-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он;
цис-2-(3,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-2-(3-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-2-(3-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-2-(нафталин-1-илметил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aR,10bS)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-8-хлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bS)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-10-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-7-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-7-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-9-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-9-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-бензил-8-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8,9-дихлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-7-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
цис-2-бензил-7-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-7-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bS)-2-бензил-8-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-7-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-9-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-9-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
цис-2-бензил-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-метил-3-((6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-ил)метил)бензоат;
транс-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-(5-хлор-2-фторбензил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-5-(фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
цис-2-метил-5-(фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-5-(3-фторфенилсульфонил)-2-(4-метоксибензил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-2-(4-фторбензил)-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин;
транс-8-(4-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3,4-дифторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(4-(трифторметил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(нафталин-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-м-толил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-п-толил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(4-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-стирил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-фенил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-фенетил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-метил 2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксилат;
транс-10-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-9-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-7-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
цис-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2-бензил-2,3,3a,4,5,11c-гексагидро[1]бензотиено[2,3-c]пирроло[3,4-e]азепин-6(1H)-он;
транс-2-бензил-8,10-диметокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2,3,3a,4,5,11c-гексагидро[1]бензотиено[2,3-c]пирроло[3,4-e]азепин-6(1H)-он;
транс-8,10-диметокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-бензил-6,6a,7,8,9,9a-гексагидропирроло[3,4-e]тиено[3,2-c]азепин-4(5H)-он;
транс-2-бензил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-6,6a,7,8,9,9a-гексагидропирроло[3,4-e]тиено[3,2-c]азепин-4(5H)-он;
(3aS,10bS)-2-бензил-8,10-дифтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aR,10bS)-8,10-дифтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-8-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2-метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3,4-d][1,2]бензотиазепин 6,6-диоксид;
(3aR,10bR)-2-метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bS)-2-метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-метил-7-фенил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bS)-8-(4-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bR)-8-(4-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-гидрокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-(3-фторфенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-((S)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-фенетокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(пиперидин-1-карбонил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-фенетокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-фторфенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-N,2-диметил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид;
транс-2-метил-6-оксо-N-фенетил-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид;
транс-2-метил-6-оксо-N-(3-(трифторметил)фенетил)-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид;
транс-2-метил-6-оксо-N-фенил-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид;
транс-метил 2-бензил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксилат;
цис-2-бензил-8-метокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(3-(трифторметокси)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-изобутоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
цис-8-метокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-8-(1,3,4-оксадиазол-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4-изопропилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4-этилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(4-(трифторметокси)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-амино-2-бензил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
цис-8-амино-2-бензил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(пиридин-3-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-амино-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
цис-8-амино-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-(трифторметил)бензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-((S)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-((R)-1-фенилэтокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-9-бензил-7,7a,8,9,10,10a-гексагидропиридо[2,3-e]пирроло[3,4-c]азепин-5(6H)-он;
транс-2-бензил-1,2,3,3a,4,5-гексагидропиридо[3,4-e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-7,7a,8,9,10,10a-гексагидропиридо[2,3-e]пирроло[3,4-c]азепин-5(6H)-он;
транс-2-бензил-1,2,3,3a,4,5-гексагидропиридо[3,2-e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-((S)-1-фенилэтокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-1,2,3,3a,4,5-гексагидропиридо[3,2-e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(4-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bR)-8-(4-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bR)-8-(3-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8,10-дифтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bS)-8-фтор-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-втор-бутокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-изобутокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(циклогексилметокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2,6-дифторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(изопентилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-втор-бутокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(изопентилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-изобутокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(циклогексилметокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(пиридин-4-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-метоксипиримидин-5-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bS)-8-(2-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bR)-8-(2-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bS)-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bR)-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2-метоксифенетокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(тиофен-3-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксипропан-2-ил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-ацетилфенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-метокси-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксиэтил)фенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-метокси-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-ацетилфенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксиэтил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(1-гидроксиэтил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксипропан-2-ил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(бензо[c][1,2,5]оксадиазол-5-ил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-изопропил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(2-метилпроп-1-енил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-3-(2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-ил)бензальдегид;
(3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-циклопентенил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(3,3,3-трифторпроп-1-ен-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-метил-8-(5-метилфуран-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-циклогексил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-циклопентил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(2-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3,5-дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(2,6-дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3,4-дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(4-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(2,3-дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-2-метил-8-(2,3,6-трифторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-9-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-(бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aR,10bS)-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bR)-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[b]пирроло[3,4-d]азепин-5(6H)-он;
транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[d]пирроло[3,4-b]азепин-5(6H)-он;
транс-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aR,10bS)-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bR)-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bS)-2-метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aR,10bR)-2-метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
N,N-диметил-3-(транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензамид;
транс-8-(2-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-метил-8-(2-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aR,10bS)-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
(3aR,10bS)-9-хлор-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
(3aR,10bS)-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-(3-ацетилфенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он гидрохлорид;
транс-8-(3-ацетилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3-(1-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
3-(транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензонитрил;
3-(транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензонитрил;
транс-8-(3,6-дигидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3,6-дигидро-2H-пиран-4-ил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(4-фторфенокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-изобутил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3,5-диметилизоксазол-4-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(4,4-диметилциклогексилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
(3aS,10bS)-8-(3-((S)-1-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3-((R)-1-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(3-(этилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-метил-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксиэтил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-(3-(2-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-1,2,3,3a,4,5,6,10b-октагидробензо[b]пирроло[3,4-d]азепин;
транс-8-(3-(этилсульфонил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-бензил-1,2,3,3a,4,5-гексагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он;
транс-1,2,3,3a,4,5-гексагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он;
транс-1,2,3,3a,4,5,8,9,10,11-декагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он;
(3aR,10bS)-9-метокси-2,3,3a,4,5,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-6(1H)-он;
2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин;
транс-2-бензил-9-метокси-2,3,3a,4,5,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-6(1H)-он;
транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин;
транс-9-метокси-1,2,3,3a,4,5,6,10b-октагидробензо[3,4]циклогепта[1,2-c]пиррол;
транс-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин;
транс-8-(тетрагидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-9-метокси-1,2,3,3a,4,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол;
транс-2-метил-8-(тетрагидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-2-метил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин;
цис-2-метил-1,2,3,3a,4,5,6,10b-октагидробензо[3,4]циклогепта[1,2-c]пиррол;
(3aR,10bS)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
(3aS,10bR)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-10-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-10-метокси-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
(3aS,10bS)-8-(бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(2-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
транс-8-(2,6-дифторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(циклопропилметокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
(3aS,10bS)-8-(3-ацетилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он;
цис-8-фтор-9-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он;
транс-8-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-(трифторметокси)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7,9-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
цис-9-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-(трифторметокси)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-10-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
цис-7,10-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7,10-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-(3,5-диметил-1,2-оксазол-4-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-{3-[(1S)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-{3-[(1R)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
цис-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-(5-ацетил-2-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(изобутиламино)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-2-метил-8-(пиперидин-1-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(4-фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(5-фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(5-изопропил-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2-метокси-4-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2,4-диметоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-[3-(1-гидрокси-2-метилпропил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-[(E)-2-циклопропилвинил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-2-метил-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-[4-фтор-3-(1-гидроксиэтил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aR,10bS)-8-изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bR)-8-изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-(3-гидрокси-2,3-дигидро-1H-инден-5-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-[3-(1-гидроксипропил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-[3-(1-гидрокси-3-метилбутил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-[3-(1-гидроксибутил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(4-фтор-3-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(4-метокси-3-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(3-фтор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(4-метокси-3,5-диметилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-(6-метоксипиридин-3-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-(3-хлор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(4-фтор-3-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-2-метил-8-(3,4,5-трифторфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2-фтор-5-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2,3-дигидро-1-бензофуран-6-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-(2-фтор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-(4-фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
1-[транс-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][1]бензазепин-6(1H)-ил]этанон;
транс-6-бензил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-8-(2,4-дифторфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
цис-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
1-[транс-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][1]бензазепин-6(1H)-ил]-2-метилпропан-1-он;
транс-6-[(3,4-дихлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[4-(дифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(3-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(3-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-(фенилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(5-хлор-2-тиенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(4-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(2-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(3-хлор-2-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(2,5-диметоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(4-трет-бутилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[3-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(4-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[4-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(3-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[4-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-7-[3-(метилсульфонил)фенил]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
1-{3-[транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанон;
(3aS,10bS)-8-{4-фтор-3-[(1S)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-8-{4-фтор-3-[(1R)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-6-[(2-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
2-[транс-7,7a,8,9,10,10a-гексагидропиридо[3,2-c]пирроло[3,4-e]азепин-6(5H)-илсульфонил]бензонитрил;
транс-6-[(4-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(4-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-(2-тиенилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(3-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(5-бром-2-тиенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(2-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-[(2-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-(мезитилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[2-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[2-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
транс-6-{[3-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин;
1-{3-[транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанол;
транс-7-(пиридин-3-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-(пиридин-4-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2-метил-7-(пиридин-3-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
4-[транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]-N-метилбензамид;
транс-7-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-10-ол;
транс-7-хлор-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-10-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-8-(3-изопропилфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(3-изопропилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-2-(2-фторэтил)-8-изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
N-метил-3-[транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензамид;
N-метил-3-[транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензамид;
транс-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-2-(2-фторэтил)-8-(4-фторфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2-хлор-3-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(3-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он и транс-8-(5-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-8-(2-хлор-3-тиенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
(3aS,10bS)-2-метил-8-(пиридин-2-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-2-метил-8-(4-оксо-3,4-дигидро-2H-хромен-6-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он;
транс-9-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-7-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
цис-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-9-хлор-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-9-бром-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин;
транс-7-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-[(4-фторбензил)окси]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-(4-фторфенил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-(4-фторфенил)-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол;
транс-7-(4-фторфенил)-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин; или
метил транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин-7-карбоксилат.
Соединения по настоящему изобретению могут существовать в виде стереоизомеров, когда имеются асимметрические или хиральные центры. Указанными стереоизомерами являются "R" или "S", в зависимости от конфигурации заместителей вокруг хирального атома углерода. Термины "R" и "S", используемые здесь, представляют собой конфигурации, как указано в IUPAC 1974 Рекомендации для секции E, Основная стереохимия, Pure Appl. Chem., 1976, 45: 13-30. Изобретение предусматривает различные стереоизомеры и их смеси, и они, в частности, включены в объем данного изобретения. Стереоизомеры включают энантиомеры и диастереомеры и смеси энантиомеров или диастереомеров. Индивидуальные стереоизомеры соединений по изобретению могут быть синтезированы из коммерчески доступных исходных продуктов, которые содержат асимметрические или хиральные центры, или путем получения рацемических смесей с последующим разделением, что хорошо известно специалисту в данной области. Указанные способы разделения проиллюстрированы примерами (1) связывания смеси энантиомеров с хиральным вспомогательным материалом, разделения полученной смеси диастереомеров перекристаллизацией или хроматографией и необязательного высвобождения оптически чистого продукта из вспомогательного материала, как описано в работе Furniss, Hannaford, Smith and Tatchell, "Vogel's Textbook of Practical Organic Chemistry", 5th edition (1989), Longman Scientific & Technical, Essex CM20 2JE, England, или (2) прямого разделения смеси оптических энантиомеров на хиральных хроматографических колонках или (3) методами фракционной перекристаллизации.
Другой вариант осуществления изобретения по данному изобретению, таким образом, относится к способу получения (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она, включающему
(a) объединение дибензоил-D-виннокаменной кислоты (1,05 эквивалента) и метанола;
(b) добавление раствора в метаноле транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она (0,10-0,15 эквивалента);
(c) внесение в раствор затравочных кристаллов (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она, которые получают небольшими партиями в той же последовательности с многократным увеличением энантиомерного избытка при последовательном прохождении;
(d) медленное добавление дополнительного количества транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она (0,85-0,90 эквивалента), растворенного в метаноле; и
(e) перемешивание полученной смеси в течение периода времени, приводящего к кристаллизации и выделению кристаллического дибензоил-D-тартрата (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она.
Другой вариант осуществления изобретения по данному изобретению относится к способу получения (3aS,10bS)-8-гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она, включающему
(a) объединение ацетата палладия(II) (0,04 эквивалента), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенила (0,05 эквивалента), карбоната цезия (1,5 эквивалента) и (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она (1 эквивалент);
(b) добавление раствора бензилового спирта (20 эквивалентов) в толуоле к смеси ацетата палладия(II), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенила, карбоната цезия и (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она;
(c) выделение (3aS,10bS)-8-(бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она;
(d) объединение (3aS,10bS)-8-(бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она с катализатором JM UK#3 (10 массовых процентов на сухое основание, катализатор в 50>9% воды) и метанола и гидрирование смеси от 5 минут до 24 часов; и
(e) выделение (3aS,10bS)-8-гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она.
Настоящее изобретение предусматривает различные стереоизомеры и их смеси, и они, в частности, включены в объем данной заявки. Стереоизомеры включают энантиомеры и диастереомеры и смеси энантиомеров или диастереомеров. Отдельные стереоизомеры соединений по настоящему изобретению могут быть синтезированы из коммерчески доступных исходных продуктов, которые содержат асимметрические или хиральные центры, или путем получения рацемических смесей с последующим разделением, что хорошо известно обычному специалисту в данной области. Эти способы разделения проиллюстрированы примерами (1) присоединения смеси энантиомеров к хиральному вспомогательному материалу, выделения полученной смеси диастереомеров путем перекристаллизации или хроматографией и отделения оптически чистого продукта от вспомогательного материала или (2) прямого выделения смеси оптических энантиомеров на хиральных хроматографических колонках.
Соединения по настоящему изобретению могут существовать в виде геометрических изомеров. Настоящее изобретение охватывает различные геометрические изомеры и их смеси, образованные в результате различного положения заместителей вокруг углерод-углеродной двойной связи, углерод-азотной двойной связи, циклоалкильной группы или группы гетероцикла. Заместители вокруг углерод-углеродной двойной связи или углерод-азотной связи обозначаются как Z- или E-конфигурация, и заместители вокруг циклоалкила или гетероцикла обозначаются как цис- или транс-конфигурация.
В соответствии с настоящим изобретением следует учесть, что соединения, описанные здесь, могут проявлять явления таутомерии.
Таким образом, изображение формул в этом описании может представлять только одну из возможных таутомерных или стереоизомерных форм. Понятно, что настоящее изобретение охватывает любую таутомерную или стереоизомерную форму и их смеси, и не должно ограничиваться лишь какой-либо таутомерной или стереоизомерной формой, используемой в названии соединения или в изображениях формул.
Настоящее изобретение включает также изотопно меченные соединения, которые идентичны тем, которые указаны в формуле I, но при условии, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, подходящих для введения в соединения по изобретению, представляют собой водород, углерод, азот, кислород, фосфор, фтор и хлор, такие как, но этим не ограничиваются, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl, соответственно. Замена на более тяжелые изотопы, такие как дейтерий, то есть, 2H, может давать некоторые терапевтические преимущества, что приводит к более высокой метаболической стабильности, например, к увеличению времени полужизни in vivo или уменьшенному режиму дозировки и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Соединения, содержащие позитронно-излучающие изотопы, могут быть использованы в области медицинской визуализации и в исследованиях путем позитронно-эмиссионной томографии (ПЭТ) по определению распределения рецепторов. Подходящие позитронно-излучающие изотопы, которые могут быть включены в соединения формулы (I), представляют собой 11C, 13N, 15O и 18F. Изотопно меченные соединения формулы (I) обычно могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными описанным в прилагаемых примерах с использованием подходящих изотопно меченных реагентов вместо не изотопно меченных реагентов.
c. Биологические данные
Для определения эффективности соединений, имеющих формулу (I), указанные соединения могут быть оценены в исследовании радиолигандного связывания агониста с участком человеческого 5-HT2C рецептора серотонина, человеческого 5-HT6 рецептора или на in vitro моделях клеточной функции.
Сокращения, которые использовали в описаниях биологических данных, являются следующими: BSA - бычий сывороточный альбумин; CHO - яичник китайского хомячка; DMEM - модифицированная по способу Дульбекко среда Игла; dFCS - диализированная эмбриональная телячья сыворотка; ДМСО - диметилсульфоксид; EDTA - этилендиаминтетрауксусная кислота; FLIPR - http://www.multitran.ru/c/m.exe?t=5293724_2_1; HEPES - 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота; ip - интраперитонеальный; PBS - физиологический раствор с фосфатным буфером; PEI - полиэтиленимин; rpm - оборотов в минуту; RPMI - Roswell Park Memorial Institute; sc - подкожный; Трис - трис(гидроксиметил)аминометан; и Трис-Cl - трис(гидроксиметил)аминометан гидрохлорид.
(i) Анализ радиолигандного связывания 5-HT2C рецептора человека
Сродство соединений к агонистическому сайту 5-HT2C рецептора в трансфицированных клетках CHO определяли в исследовании радиолигандного связывания способом, по существу описанным Bryant, H. U. et al., Life Sciences (1996) 59(15), 1259-1268. Вкратце, гомогенаты клеточных мембран с 40 мкг белка инкубировали в течение 15 минут при 37°C с 0,2 нМ [125I](±)(1-(4-йод-2,5-диметоксифенил)изопропиламина (DOI) с исследуемыми соединениями или без них в буфере, содержащем 50 мМ Трис-HCl, 5 мМ MgCl2 и 0,3% BSA. Неспецифическое связывание определяли в присутствии 10 мкМ (±)DOI. Величину связывания определяли подсчетом радиоактивности с помощью сцинтилляционного счетчика. Значения IC50 определяли по стандартной кривой контрольного соединения (±)DOI. Значения Ki, как показано в таблице 1, получали из значений IC50 стандартным методом.
|
(ii) Функциональный анализ 5-HT2C человека в клетках 1321N1
Функциональную активность определяли путем тестирования эффекта соединений на внутриклеточный уровень кальция в клетках 1321N1, стабильно трансфицированных 5-HT2C рецептором человека. Клетки высевали в 96-луночные планшеты при 50000 клеток/лунка и выращивали в течение ночи в среде для культуры тканей (DMEM с Glutamax I (Invitrogen), содержащей 10% dFCS, 50 мкг/мл Gentamicin, 400 мкг/мл Geneticin) при 37°C и 7% CO2. Среду для роста заменяли средой без dFCS для инкубации в течение ночи. Клетки подвергали воздействию чувствительного к кальцию флуоресцентного красителя в присутствии 1% пробеницида в соответствии с протоколом производителя (Fluo4 AM, Molecular Devices). В клетки добавляли серийные разведения соединений (конечные концентрации 10-10-10-5 M) либо самих по себе, либо в присутствии серотонина (10-9 M), и определяли максимальный кальциевый ответ с использованием устройства FLIPR (Molecular Devices). Кривые концентрация-эффект строили с использованием четырехпараметрового логистического уравнения (GraphPad Prism). Концентрация, при которой соединение проявляет половину своего максимального эффекта, называется «эффективной концентрацией 50» или «EC50» и приведена в таблице 2.
|
(iii) Функциональные высокопроизводительные скрининговые анализы 5-HT2C и 5-HT2B человека в клетках CHO-K1
Клетки CHO-K1, сверхэкспрессирующие 5-HT2C или 5-HT2B рецепторы, выращивали в 1272 см2 сосудах до 70-80% заселенности в среде UltraCHO (Lonza, Walkersville, MD) с добавлением 1% диализированной фетальной телячьей сыворотки (FBS), 250 мкг/мл зеоцина, 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина и 400 мкг/мл генетицина. Клетки отделяли от сосудов, используя 0,05% трипсин, ресуспендированный в среде для замораживания культуры клеток RecoveryTM (Invitrogen, Carlsbad, CA), и хранили в жидком азоте перед использованием. Эксперименты с определением выделения кальция выполняли с использованием замороженных клеток. Клетки разбавляли в среде, содержащей 1% диализированную FBS и 100 единиц/мл пенициллина и 100 мкг/мл стрептомицина, и высеивали в 384-луночные планшеты, покрытые поли-D-лизином (15000 клеток/лунка). Затем планшеты инкубировали в течение ночи в клеточном инкубаторе при 37°C, 5% CO2. На следующий день питательную среду заменяли на среду без FBS и дополнительно инкубировали в течение ночи. На третий день определяли изменения внутриклеточного Ca2+, используя чувствительный к кальцию флуоресцентный краситель, Ca4 (MDS Analytical Technologies, Sunnyvale, CA), загружая 15 мкл разбавленного красителя в http://www.multitran.ru/c/m.exe?t=2738969_2_1 и 20 мМ буфер Hepes (pH 7,4) с конечной концентрацией 2,5 мМ пробенецида в содержащую клетки среду. Далее клетки инкубировали в темноте при комнатной температуре в течение 60 минут.
После инкубирования клеточные планшеты переносили в FLIPRTM (MDS), и измерения их флуоресценции считывали при длине волны возбуждения 480 нм и длине волны эмиссии 530 нм при 25°C. Базовый уровень флуоресценции измеряли в течение первых 10 секунд и затем к клеткам добавляли 15 мкл 4× концентрации смеси серотонин/исследуемое соединение. Интенсивность флуоресценции фиксировали каждую секунду в течение первой 1 минуты, затем каждые 5 секунд в течение еще 2 минут. Увеличение флуоресцентного ответа на исследуемое соединение нормировали к ответу серотонина и использовали для определения активности агониста. Ответ на концентрацию соединений выполняли исходя из начальной концентрации 10 мкм, 1:10 растворение через 6 лунок, до конечной концентрации сульфоксида этана 0,2%, и наносили по точкам с использованием четырехпараметрового логистического уравнения. Концентрация, при которой соединение проявляет половину своего максимального эффекта, называется «эффективной концентрацией 50» или «EC50». Emax является максимальным функциональным ответом или эффективностью, выраженной в процентах относительно эффекта серотонина.
|
|
|
|
|
|
|
|
|
|
|
|
(iv) Функциональный анализ 5-HT2C человека в клетках CHO-K1
Функциональную активность определяли путем тестирования эффекта соединений по внутриклеточному содержанию кальция в клетках CHO-K1, стабильно трансфицированных 5-HT2C рецептором человека. Клетки высевали в 96-луночные планшеты с плотностью 60000 клеток/лунка и выращивали в течение ночи в среде для культуры тканей (UltraCHO™ (Lonza), содержащей 1% dFCS, 250 мкг/мл зеоцина, 400 мкг/мл генетицина) при 37°C и 5% CO2. Питательную среду заменяли средой без dFCS для инкубации в течение ночи. Клетки подвергали воздействию чувствительного к кальцию флуоресцентного красителя в присутствии пробеницида в соответствии с протоколом производителя (набор FLIPR Ca4 Assay, Molecular Devices). В клетки добавляли серийные разведения соединений (конечные концентрации 10-10-10-5 M) и определяли максимальный кальциевый ответ с использованием устройства FLIPR (Molecular Devices). Кривые концентрация-эффект строили с использованием четырехпараметрового логистического уравнения (GraphPad Prism). Концентрация, при которой соединение проявляет половину своего максимального эффекта, называется «эффективной концентрацией 50» или «EC50» и приведена в таблице 5.
|
(v) Анализ радиолигандного связывания 5-HT6 рецептора человека
Получение мембран обработкой ультразвуком и дифференциальным центрифугированием
Клетки из стабильных клональных клеточных линий, экспрессирующих соответствующий рецептор (5-HT6), промывали PBS (без Ca++, Mg++) и собирали в PBS с 0,02% EDTA. Клетки собирали центрифугированием при 500 g в течение 10 минут при 4°C, промывали PBS и центрифугировали (500 g, 10 минут при 4°C). Осадок хранили при -80°C до использования. Для получения мембран размороженный клеточный осадок повторно суспендировали в ледяном сахарозном буфере (0,25 M сахарозы, 10 мМ HEPES (pH 7,4), 1 мМ фенилметилсульфонилфторида (PMSF) в ДМСО, 5 мкг/мл пепстатина-A, 3 мМ EDTA, 0,025% бацитрацина) и гомогенизировали на Sonifier W-250 фирмы Branson (установки: таймер 4; управление выходом 3; коэффициент заполнения постоянный; 2-3 цикла). Разрушение клеток проверяли с помощью микроскопа. Оставшиеся неразрушенные клетки осаждали при 1000 g в течение 10 минут при 4°C. Затем супернатант сахарозного буфера центрифугировали при 60000 g в течение 1 часа при 4°C (Beckman Ultracentrifuge XL 80). Осадок повторно суспендировали в 30 мл ледяного Трис-буфера (20 мМ Трис (pH 7,4), 5 мкг/мл перстатина-A, 0,1 мМ PMSF, 3 мМ EDTA) пипетированием посредством 10-мл серологической пипетки и центрифугировали в течение 1 часа при 4°C при 60000 g. Конечную повторную суспензию получали в небольшом объеме ледяного Трис-буфера (см. выше) путем выдавливания через серологическую пипетку после обработки ультразвуком на Sonifier W-250 Branson (установки: таймер 1; управление выходом 3; коэффициент заполнения постоянный; 1 цикл). Определяли концентрацию белка (BCA-Kit; Pierce) и аликвоты хранили при -80°C или в жидком азоте длительное время.
Эксперименты по связыванию рецепторов
Все эксперименты по связыванию рецепторов выполняли в соответствующем аналитическом буфере общим объемом 200 мкл в присутствии различных концентраций тестируемого соединения (10-5 M - 10-9 M, десятикратное серийное разведение, определение в двух повторениях). Анализы заканчивались фильтрацией на пропитанных полиэтиленимином (0,1% или 0,3% PEI) пластинах Packard Unifilter (GF/C или GF/B) с 96-луночным планшетом для сбора клеток Tomtec MachIII с U-образным дном. После высушивания планшетов в течение 2 часов при 55°C в сушильной камере добавляли сцинтилляционный коктейль (BetaPlate Scint; PerkinElmer). Радиоактивность измеряли на Microbeta Trilux через два часа после добавления сцинтилляционной смеси.
Анализ связывания 5-HT6 рецептора
Клетки HEK293, стабильно экспрессирующие рецептор h-5-HT6 (NCBI Reference Sequence XM 001435), культивировали в среде RPMI1640 с 25 мМ HEPES, 10% эмбриональной телячьей сыворотки и 1-2 мМ глутамина. Получение мембран осуществляли, как описано выше. Для этих мембран определяли KD 1,95 нМ для [3H]-LSD (Lysergic Acid Diethylamide; Amersham, TRK1038) посредством экспериментов по насыщению связывания. В день анализа мембраны растапливали, разбавляли аналитическим буфером (50 мМ Трис-HCl, 5 мМ CaCl2, 0,1% аскорбиновой кислоты, 10 мкм паргилина, pH 7,4) до концентрации 8 мкг белка/анализ и гомогенизировали осторожным перемешиванием на вортексе. Для исследований ингибирования инкубировали 1 нМ диэтиламида [3H]-лизергиновой кислоты в присутствии различных концентраций тестируемого соединения в аналитическом буфере. Неспецифическое связывание определяли с помощью 1 мкм метиотепина. Реакцию связывания выполняли в течение 3,5 часов при комнатной температуре. Во время инкубации планшеты встряхивали на встряхивателе планшетов при 100 оборотов в минуту и реакцию прекращали путем фильтрации на пластине Packard Unifilter GF/C (0,1% PEI) с последующими 2 циклами промывания 50 мМ ледяного Трис-HCl, 5 мМ CaCl2.
Анализ данных
Полученные подсчетом импульсов в жидкой фазе данные анализировали итерационным анализом нелинейной регрессии с применением системы статистического анализа (SAS) - программы, подобной «LIGAND», как описано Munson and Rodbard (Anal. Biochem. 1980, 107, 220-239). Подгонку выполняли в соответствии с формулой, описанной Feldman (Anal. Biochem. 1972, 48, 317-338). Значения IC50 и Ki выражали в виде среднего геометрического. Для рецепторов с низким сродством к тестируемому соединению, причем самая высокая концентрация тестируемого соединения ингибировала менее чем на 30% специфичное радиолигандное связывание, значения Ki определяли по уравнению Cheng and Prusoff (Biochem. Pharmacol. 1973, 22, 2099-2108) и выражали как «более чем» (>).
Результаты исследований связывания рецепторов выражали как постоянные связывания рецепторов Ki(5-HT6), как ранее описано в настоящем документе и приведено в таблице 6.
|
В этих тестах соединения в соответствии с настоящим изобретением проявляют удовлетворительное сродство к рецептору 5-HT6 (Ki<1000 нМ или <50 нМ).
(vi) Анализ радиолигандного связывания 5-HT6 рецептора человека
Определяли сродство соединений к сайту ангониста 5-HT6 рецептора в трансфицированных клетках CHO анализом радиолигандного связывания, как описано в основном Monsma, F.J., et al., Mol. Pharmacol. (1993) 43, 320-327. Вкратце, гомогенаты клеточных мембран инкубировали в течение 120 минут при 37°C с 2 нМ диэтиламида [3H]-лизергиновой кислоты (LSD) с тестируемыми соединениями или без таковых. Неспецифичное связывание определяли в присутствии 100 мкМ серотонина. Количество сайтов связывания определяли подсчетом радиоактивности с помощью сцинцилляционного счетчика. Значения IC50 определяли по стандартной кривой эталонного соединения серотонина. Значения Ki, показанные в таблице 7, получали из IC50 стандартным способом.
|
(vii) Оценка эффектов на индуцированную психостимулятором гиперлокомоцию у крысы
Известно, что у людей фенциклидин (PCP) вызывает синдром поведенческих эффектов, которые имеют много общих с шизофренией характеристик. Поэтому антагонизм эффектов PCP может служить доказательством противопсихотической эффективности соединения.
Способы
В этом исследовании использовали самцов крыс CD с массой тела 316-394 г от фирмы Charles River (Portage, Michigan). Крыс приучали к лабораторному помещению в течение 60 минут. Затем крыс размещали в камерах для изучения двигательной активности (AccuScan Instruments) на 30 минут, а потом внутрибрюшинно вводили дозами 0, 1, 3 и 10 мг/кг соединения согласно примеру 115. Через 30 минут крысам подкожно вводили PCP дозами 0 или 2 мг/кг. Активность измеряли общей сложностью в течение 150 минут и 90 минут после введения PCP.
Результаты
Как показано на фиг.1, у PCP обработанной группы проявлялась значительная гиперлокомоция (p<0,01, по сравнению с Veh-Veh обработанной группой). Соединение согласно примеру 115 при 1 мг/кг и 10 мг/кг было способно значительно ослаблять индуцированную PCP гиперлокомоцию.
(viii) Торможение избегания у мыши
Показано, что глутамат играет основную роль в нейропластичности, обучении, памяти и нейродегенеративных заболеваниях. Известно, что особенно в зоне CA1 гиппокампа рецепторы N-метил-D-аспарагиновой кислоты (NMDA) регулируют синаптическую пластичность, долговременную потенциацию (LTP) и процессы обучения и памяти, в том числе кратковременной и долговременной памяти. Показано, что неконкурентный NMDA антагонист MK-801 нарушает процессы обучения и памяти при различных задачах. Задача задерживающего избегания предполагает применение двухотсекового проходного устройства (Ugo Basile, Collegeville, PA), которое измеряет способность животного запоминать короткий болевой раздражитель (раздражение лап), что считается мерой обучения методом проб и памяти (Bitner, R.S., et al. J. Neurosci. 2007, 27(39), 10578-10587). Целью этого эксперимента было тестирование способности агониста 5-HTc ослаблять индуцированные недостаточности MK-801 в 24-часовом тесте торможения избегания. Эффекты против индуцированного MK-801 когнитивного нарушения могут указывать на потенциальную эффективность в лечении когнитивных расстройств при шизофрении.
Способы
После 2-часового ознакомительного периода мышей CD1 сначала внутрибрюшинно обрабатывали тестируемым соединением при 0, 1, 3, 10 мг/кг. Затем через 20 минут мыши получали либо MK-801 при 0,1 мг/кг (растворенный в 0,3%-й виннокаменной кислоте), либо носитель (Veh, вода). Через 20 минут после введения MK-801 начинали сеанс обучения мышей. Для сеанса обучения мышей помещали на освещенную сторону 2-камерного отсека. Регистрировали задержку на входе в соседнюю темную камеру и осуществляли неизбежное раздражение лап мыши (0,3 мА, длительностью 1 секунда). Мышь извлекали из камеры и возвращали в домашнюю клетку. Через двадцать четыре часа мышь тестировали с использованием способов, аналогичных используемым в день обучения, без введения доз или раздражения. Регистрировали задержку на входе в темную камеру и измеряли зависимую переменную для оценки сохранения памяти. Если мышь не входила в темную камеру через 180 секунд, тестовое испытание останавливали и мыши давали оценку 180 секунд.
Результаты
Однократное введение соединения согласно примеру 115 с высокой дозой 10 мг/кг значительно увеличивало задержки перемещения по сравнению с Veh-MK-801, что указывает на прокогнитивный эффект (фиг.2).
(ix) Модель торможения избегания/импульсивности из 5 испытаний у детенышей крысы со спонтанной гипертензией
У крыс со спонтанной гипертензией (SHR) проявляются многочисленные поведенческие особенности, характерные для синдрома дефицита внимания с гиперактивностью (ADHD), в том числе гиперактивность, нарушенное оттормаживание ответной реакции, нарушенное длительное внимание и сниженная когнитивная функция по сравнению с соответствующими по возрасту и полу контролями из одного и того же генетического фона или из других пород крыс. Однако взрослые крысы характеризовались спонтанной гипертензией, которая могла исказить оценивание поведения. Для данного исследования использовали молодых крыс SHR, поскольку у этих детенышей наблюдались подобные расстройства поведения, но при этом у них не было гипертензии. Целью было исследование эффективности агонистов 5-HT2C у детенышей крыс SHR на модели торможения избегания, как показателя усиления контроля торможения/или антиимпульсивности.
Способы
Детенышам крыс SHR на 21-28 день после рождения за 30 минут до теста подкожно вводили либо носитель, либо соединение согласно примеру 115 (дозами 1, 3 и 10 мг/кг; растворенное в виннокаменной кислоте/PH4-6). В начале тестирования детенышей помещали на освещенную сторону контролируемого с помощью компьютера 2-камерного отсека. Регистрировали задержку на входе в соседнюю темную камеру и осуществляли неизбежное раздражение лап детеныша (0,1 мА, длительностью 1 секунда). Детеныша извлекали и помещали обратно в домашнюю клетку на приблизительно 1 минуту, а процесс испытания повторяли общей сложностью 5 раз. В качестве зависимой переменной для анализа данных использовали общую задержку перемещения от испытания 2 до испытания 5.
Результаты
Однократное введение соединения согласно примеру 115 не приводило к зависимому от дозы увеличению задержек перемещения в испытаниях с обучением 2-5 со всеми тремя тестируемыми дозами по сравнению с носителем (фиг.3). Исследование показало, что соединение согласно примеру 115 улучшало характеристику детенышей крыс SHR в этой модели торможения избегания/импульсивности из 5 испытаний.
(x) Оценивание эффектов на индуцированную психостимулятором гиперлокомоцию у мыши
И у людей, и у экспериментальных животных амфетамин (AMP) серьезно влияет на двигательную активность, сенсомоторную функцию, сон, внимание, агрессивное и половое поведение, обучение и память, функциональное поведение, аппетит и потребление корма. Кроме того, амфетамин индуцирует психотические реакции у нормальных индивидуумов и обостряет симптомы шизофрении у больных. Считается, что у экспериментальных животных некоторые различия в поведении коррелируют с вызванным амфетамином психозом. Например, предполагается, что индуцированная амфетамином гиперактивность у грызунов является моделью психотических симптомов шизофрении. Устранение такого поведения используется для прогнозирования потенциальной противопсихотической активности лекарственных средств в доклинических исследованиях.
Известно, что у людей фенциклидин (PCP) вызывает синдром поведенческих эффектов, которые обладают многими общими с шизофренией характеристиками. Поэтому антагонизм эффектов PCP может служить доказательством противопсихотической эффективности соединения.
Животные
Самцов мышей ЯМРI (возрастом 5 недель, Janvier, France) или мышей C57BL/6J (возрастом 6 недель, Janvier, France) размещали группами и обеспечивали неограниченный доступ к корму и воде. Применяли 12-часовый цикл освещение/темнота с периодом освещения от 05.30 до 17.30 часов. Все тесты выполняли от 7.00 до 13.00 часов. Все процедуры были одобрены Комитетом по содержанию и использованию лабораторных животных Abbott (США) или службой защиты прав животных (Германия) и проводились в соответствии с нормативами Национальных институтов по содержанию и использованию лабораторных животных и соответствующего национального права в аккредитованных помещениях Ассоциацией оценки и аккредитации содержания лабораторных животных.
Способы
В день эксперимента животных переносили из помещения для животных в экспериментальную комнату и обеспечивали привыкание в течение по меньшей мере 30 минут. Затем животных помещали в клетки для тестирования на 60-минутный период привыкания. Далее животным внутрибрюшинно вводили тестируемое соединение и возвращали их в клетки для тестирования. Через 30 минут мышам вводили d-амфетамин (2,0 мг/кг, AMP, Sigma, № A5880, подкожно) или фенциклидин (2,0 мг/кг, PCP, Sigma, № P3029, подкожно) Sigma и возвращали в клетки для теста на 90 минут. Каждая опытная группа состояла из 8-10 животных. Данные получили с помощью системы Cage Rack Photobeam (SDI, San Diego Instruments, CA). Аналитические данные предусматривали малые перемещения, ходьбу и общие движения (малые перемещения + ходьба). Данные подвергали одно- или двухфакторному не зависящему от распределения ANOVA с последующими апостериорными тестами Даннетта и Тьюки.
Результаты
Соединение согласно примеру 44 значительно ослабляло индуцированную PCP гиперактивность у мышей, причем зависимым от дозы образом (обработка × зависимое от времени взаимодействие F(3,26)=1,47, p<0,01), без воздействия на спонтанную активность (фиг.4A и 4B).
Соединение согласно примеру 106 умеренно ослабляло индуцированную AMP гиперактивность у мышей, причем зависимым от дозы образом (обработка × зависимое от времени взаимодействие F(3,29)=1,48, p<0,01), без воздействия на спонтанную активность (фиг.5A и 5B).
Соединение согласно примеру 115 значительно ослабляло индуцированную AMP гиперактивность у мышей, причем зависимым от дозы образом (обработка × зависимое от времени взаимодействие F(3,29)=2,65, p<0,001), без воздействия на спонтанную активность (фиг.6A и 6B).
Соединение согласно примеру 158 значительно ослабляло индуцированную AMP гиперактивность у мышей, причем зависимым от дозы образом (обработка × зависимое от времени взаимодействие F(3,29)=9,51, p<0,0001) (фиг.7A и 7B).
Соединение согласно примеру 225 умеренно ослабляло индуцированную AMP гиперактивность у мышей без воздействия на спонтанную активность (фиг.8A и 8B).
(xi) Оценка эффектов на выработку реакции избегания у крыс
Обнаружено, что противопсихотические средства обладают уникальной способностью селективно подавлять поведение с условной реакцией избегания (CAR) у крыс. Тот факт, что противопсихотические средства обладают уникальной способностью селективно подавлять поведение CAR, делает тест CAR применимым инструментом для поиска новых, потенциальных противопсихотических соединений. Показано, что все клинически эффективные противопсихотические средства (типичные и нетипичные) селективно подавляют CAR.
Животные
Самцов крыс Wistar (возрастом 9-11 недель, Charles River, Germany) размещали попарно и обеспечивали неограниченный доступ к корму и воде. Применяли 12-часовой цикл освещение/темнота с периодом освещения от 05.30 до 17.30 часов. Все тесты выполняли от 7.00 до 13.00 часов. Все процедуры были одобрены Комитетом по содержанию и использованию лабораторных животных Abbott (США) или службой защиты прав животных (Германия) и проводились в соответствии с нормативами Национальных институтов по содержанию и использованию лабораторных животных и соответствующего национального права в аккредитованных помещениях Ассоциацией оценки и аккредитации содержания лабораторных животных.
Способы
На крыс Wistar воздействовали условным раздражителем CS (звук 2,9 кГц длительностью 10 секунд), который являлся для животного сигналом к необходимости движения в другую камеру во избежание немедленно следующего раздражения лап US (0,5 мА, 10 секунд, звук продолжался во время подачи раздражения). Как только начиналось раздражение, животное все же могло избежать его, передвигаясь в другую камеру. Каждый сеанс ограничивался максимум 40 испытаниями (с интервалами между ними 10-90 секунд). Как правило, животные быстро обучались переходить в камеры при условном раздражителе и, таким образом, избегать последующих раздражений. Оценками являлись
реакции избегания = переходы в другой отсек в течение 10 секунд подачи звука;
реакции уклонения = переходы в течение 10-20 секунд подачи звука;
отказы = переходы после прекращения подачи звука-раздражения или отсутствие перехода.
Животных тренировали в течение 2 недель по одной сессии в день или до тех пор, пока они не достигали в течение по меньшей мере 3 дней характеристики стабильного избегания 75% (= 30 испытаний с избеганием из 40). В сессиях теста (= сопряжения CS-раздражение) животных предварительно обрабатывали тестируемым лекарственным средством или носителем за 30 минут до начала сессии.
Результаты
Соединение согласно примеру 115 значительно подавляло условное поведение избегания у крыс (p<0,05), не влияя на число отказов, что говорит о том, что причиной наблюдаемого эффекта не являются седативный эффект или экстрапирамидальные побочные эффекты (фиг.9A - реакции избегания; фиг.9B - реакции уклонения; фиг.9C - реакции отказа).
Соединение согласно примеру 158 значительно подавляло условное поведение избегания у крыс (p<0,01), не влияя на число отказов, что говорит о том, что причиной наблюдаемого эффекта не являются седативный эффект или экстрапирамидальные побочные эффекты (фиг.10A - реакции избегания; фиг.10B - реакции уклонения; фиг.10C - реакции отказа).
d. Способы применения соединений
Соединения в соответствии с настоящим изобретением являются модуляторами 5-HT2C рецептора или 5-HT6 рецептора или модуляторами обоих, 5-HT2C и 5-HT6, рецепторов. В определенных вариантах осуществления настоящего изобретения соединения формулы (I) являются агонистами и частичными агонистами 5-HT2C рецептора или антагонистами 5-HT6 рецептора. В других вариантах осуществления настоящего изобретения соединения формулы (I) являются агонистами и частичными агонистами 5-HT2C рецептора, а также антагонистами 5-HT6 рецептора. Таким образом, такие соединения представляют интерес при профилактике или лечении болезненных состояний, ассоциированных с одним из 5-HT2C и 5-HT6 рецепторов или с обоими. Следовательно, настоящее изобретение относится к способу предотвращения или лечения такого болезненного состояния у субъекта, нуждающегося в таком лечении. Субъектом, нуждающимся в таком лечении, может быть млекопитающее, такое как, без ограничения, человек.
В одном аспекте состоянием болезни является когнитивная дисфункция, синдром дефицита внимания/гиперактивности, расстройство личности, аффективные расстройства, нарушения походки или двигательные нарушения, мигрень, расстройства сна, нарушения питания, желудочно-кишечные нарушения, заболевания, ассоциированные с нейродегенерацией, зависимости, ожирение, диабет, псориаз или глазная гипертензия. Примерами когнитивной дисфункции являются нарушения памяти, когнитивной функции и обучения, болезнь Альцгеймера, возрастное снижение когнитивных способностей и умеренное когнитивное нарушение или какие-либо их комбинации. Примерами расстройств личности являются шизофрения и родственные шизофрении когнитивные расстройства. Примерами аффективных расстройств являются депрессия, тревога, биполярное расстройство и обсессивно-компульсивные расстройства или какие-либо их комбинации. Примерами нарушений походки или двигательных нарушений являются болезнь Паркинсона и эпилепсия. Примерами нарушений питания являются анорексия и булимия. Примерами желудочно-кишечных нарушений является синдром раздраженного кишечника. Примерами ассоциированных с нейродегенерацией заболеваний являются удар, травма позвоночника или головы, а также повреждение головы.
В определенных вариантах осуществления болезненным состоянием является болевое состояние, в том числе ноцицептивная боль, невропатическая боль или их комбинация. Такие болевые состояния или нарушения могут включать, без ограничения, боль после хирургического вмешательства, остеоартритную боль, боль из-за воспаления, боль при ревматоидном артрите, боль опорно-двигательного аппарата, боль при ожоге (в том числе солнечном ожоге), глазную боль, боль, ассоциированную с состояниями зубов (такими как кариес зубов и гингивит), послеродовую боль, перелом кости, герпес, ВИЧ, травматическое повреждением нерва, удар, постишемическое состояние, фибромиалгию, рефлекторную симпатическую дистрофию, комплексный региональный болевой синдром, повреждение спинного мозга, ишиас, фантомную боль, диабетическую невропатию, гипералгезию и рак. В других определенных вариантах осуществления состоянием болезни является нарушение функции мочевого пузыря, в том числе недержание мочи.
В еще одном варианте осуществления настоящее изобретение относится к способу предотвращения (развития) болезненного состояния, такого как когнитивная дисфункция, синдром дефицита внимания/гиперактивности, расстройство личности, аффективные расстройства, нарушения походки или двигательные нарушения, мигрень, боль, недержание мочи, расстройства сна, пищевые нарушения, желудочно-кишечные нарушения, заболевания, ассоциированные с нейродегенерацией, зависимости, ожирение, диабет, псориаз или глазная гипертензия. Используемый в настоящем документе термин «предотвращение» болезненного состояния, такого как когнитивная дисфункция, синдром дефицита внимания/гиперактивности, расстройство личности, аффективные расстройства, нарушения походки или двигательные нарушения, мигрень, расстройства сна, пищевые нарушения, желудочно-кишечные нарушения, заболевания, ассоциированные с нейродегенерацией, зависимости, ожирение, диабет, псориаз или глазная гипертензия, путем введения какого-либо из описанных в настоящем документе соединений, означает, что выявляемые физические характеристики или симптомы заболевания или состояния не развиваются после введения описанного в настоящем документе соединения. В частности, способ в соответствии с настоящим изобретением предусматривает введение субъекту, нуждающемуся в таком лечении (например, млекопитающему, такому как человек), терапевтически эффективного количества какого-либо из описанных в настоящем документе соединений или его фармацевтически приемлемой соли. Альтернативно, способ предусматривает введение субъекту терапевтически эффективного количества какого-либо из описанных в настоящем документе соединений или его фармацевтически приемлемой соли в комбинации с терапевтически эффективным количеством по меньшей мере одного улучшающего когнитивную функцию лекарственного средства.
В следующем варианте осуществления настоящее изобретение относится к способу предотвращения развития (например, усугубления) болезненного состояния, такого как когнитивная дисфункция, синдром дефицита внимания/гиперактивности, расстройство личности, аффективные расстройства, нарушения походки или двигательные нарушения, мигрень, боль, недержание мочи, расстройства сна, нарушения питания, желудочно-кишечные нарушения, заболевания, ассоциированные с нейродегенерацией, зависимости, ожирение, диабет, псориаз или глазная гипертензия. Способ предусматривает введение субъекту, нуждающемуся в таком лечении (например, млекопитающему, такому как человек), терапевтически эффективного количества какого-либо из описанных в настоящем документе соединений или его фармацевтически приемлемой соли. Альтернативно, способ предусматривает введение субъекту терапевтически эффективного количества какого-либо из описанных в настоящем документе соединений или его фармацевтически приемлемой соли.
Имеются некоторые данные, свидетельствующие о том, что 5-HT2C агонисты или частичные агонисты будут применимы при лечении ряда заболеваний, нарушений и состояний.
Модели нокаутных мышей, не имеющих 5-HT2C рецептора, характеризуются гиперфагией, ожирением и более склонны к судорогам и внезапной смерти [Tecott LH, Sun LM, Akana SF, Strack AM, Lowenstein DH, Dallman MF, Julius D. (1995) Eating disorder and epilepsy in mice lacking 5-HT2C serotonin receptors. Nature 374: 542-546]. У них также проявляется подобное компульсивному поведение [Chou-Green JM, Holscher TD, Dallman MF, Akana SF (2003). Compulsive behavior in the 5-HT2C receptor knockout mouse. Phys. Behav. 78: 641-649], гиперчувствительность к повторному стрессу [Chou-Green JM, Holscher TD, Dallman MF, Akana SF (2003). Repeated stress in young and old 5-HT2C receptor knockout mouse. Phys. Behav. 79: 217-226], инсомния [Frank MG, Stryker MP, Tecott LH (2002). Sleep and sleep homeostasis in mice lacking the 5-HT2C receptor. Neuropsychopharmacology 27: 869-873], гиперактивность и зависимость от лекарственных средств [Rocha BA, Goulding EH O'Dell LE. Mead AN, Coufal NG, Parsons LH, Tecott LH (2002). Enhanced locomotor, reinforcing and neurochemical effects of cocaine in serotonin 5-hydroxytryptamine 2C receptor mutant mice. J. Neurosci. 22: 10039-10045].
5-HT2C является уникальным среди других сопряженных с G-белком рецепторов (GPCR) в том, что его пре-мРНК является субстратом для модификации оснований путем гидролитического дезаминирования аденозинов с получением инозинов. Пять аденозинов, расположенных в последовательности, кодирующей предполагаемый второй внутриклеточный домен, могут быть превращены в инозины. Такое «редактирование» может изменить кодирующий потенциал триплетных кодонов и обеспечивает образование нескольких различных изоформ рецептора. Было показано, что редактированные изоформы рецептора обладают пониженной способностью взаимодействовать с G-белками в отсутствие агонистической стимуляции [Werry, TD, Loiacono R., Sexton PΛ, Christopoulos A. (2008). RNA editing of the serotonin 5-HT2C receptor and its effects on cell signaling, pharmacology and brain function. Pharmac. Therap. 119: 7-23].
Редактированные изоформы 5-HT2C с пониженной функцией существенно экспрессируются в головном мозге депрессивных жертв суицида [Schmauss C (2003) Serotonin 2C receptors: suicide, serotonin, and runaway RNA editing. Neuroscientist 9: 237-242. Iwamoto K., Kato T. (2003). RNA editing of serotonin 2C receptor in human postmortem brains of major mental disorders. Neurosci. Lett. 346: 169-172], а также у крыс с приобретенной беспомощностью (хорошо признанной животной модели депрессии) [Iwamotoa K., Nakatanib N., Bundoa M., Yoshikawab T., Katoa T. (2005). Altered RNA editing of serotonin 2C receptor in a rat model of depression. Neurosci. Res. 53: 69-76], что предполагает существование связи между функцией 5-HT2C и депрессией. Существует также условная связь между редактированными изоформами 5-HT2C и пространственной памятью [Du Y., Stasko M., Costa AC, Davissone MT, Gardiner KJ (2007). Editing of the serotonin 2C receptor pre-mRNA Effects of the Morris Water Maze. Gene 391: 186-197]. Кроме того, полностью редактированные изоформы 5-HT2C рецептора человека проявляют неожиданное снижение чувствительности к диэтиламиду лизергиновой кислоты (LSD) и к атипичным противопсихотическим лекарственным средствам клозапину и локсапину, что говорит о возможной роли рецептора в этиологии и фармакологии шизофрении [Niswender CM, Herrick-Davis K., Dilley GE, Meltzer HY, Overholser JC, Stockmeier CA, Emeson RB, Sanders-Bush E. (2001). RNA Editing of the Human Serotonin 5-HT2C Receptor: Alterations in Suicide and Implications for Serotonergic Pharmacotherapy. Neuropsychopharm. 24: 478-491].
В последнее время доступность мощных и селективных агонистов 5-HT2C рецептора делает возможным непосредственно изучить эффекты агонистов 5-HT2C, а также их терапевтический потенциал. Таким образом, последние исследования продемонстрировали, что селективные агонисты 5-HT2C рецептора приводили к снижению потребления корма и массы тела у нормальных крыс и крыс с ожирением [Smith BM, et al. (2008). Discovery and structure-activity relationship of (1R)-8-chloro-2,3,4,5-tetrahydro-1-methyl-1H-3-benzazepine (Lorcaserin), a selective serotonin 5-HT2C receptor agonist for the treatment of obesity. J. Med. Chem. 51: 305-313. Thomsen WJ, Grottick AJ, Menzaghi F., Reyes-Saldana H., Espitia S., Yuskin D., Whelan K., Martin M., Morgan M., Chen W., Al-Shama H., Smith B., Chalmers D., Behan D. (2008) Lorcaserin, A Novel Selective Human 5-HT2C Agonist: In Vitro and In Vivo Pharmacological Characterization. J. Pharmacol Exp. Ther. 325: 577-587. Rosenzweig-Lipson S., Zhang J., Mazandarani H., Harrison BL, Sabb A., Sabalski J., Stack G., Welmaker G., Barrett JE, Dunlop J. (2006) Antiobesity-like effects of the 5-HT2C receptor agonist WAY-161503. Brain Res. 1073-1074: 240-251. Duniop J., Sabb AL, Mazandarani H., Zhang J., Kalgaonker S., Shukhina E., Sukoff S., Vogel RL, Stack G., Schechter L., Harrison BL, Rosenzweig-Lipson S. (2005). WAY-163909 [97bR, 10aR)-1,2,3,4,8,9,10,10a-octahydro-7bH-cyclopenta-[b][1,4]diazepino[6,7,lhi]indole], a novel 5-hydroxytryptamine 2C receptor-selective agonist with anorectic activity. J. Pharmacol. Exp. Ther. 313: 862-869].
Более того, селективные агонисты рецептора 5-HT2C характеризуются антидепрессантными эффектами у животных моделей депрессии, сравнимыми с таковыми SSRI, но с намного более быстрым наступлением действия и терапевтическим диапазоном, что позволяет избежать индуцированной антидепрессантом половой дисфункции. Эти агонисты также были эффективны у животных моделей компульсивного поведения, таких как индуцированная лекарственными средствами полидипсия, и они также вызывали пониженную гиперактивность и агрессию у грызунов [Rosenzweig-Lipson S., Sabb A., Stack G., Mitchell P., Lucki I., Malberg JE, Grauer S., Brennan J., Cryan JF, Sukoff Rizzo SJ, Dunlop J., Barrett JE, Marquis KL (2007) Antidepressant-like effects of the novel, selective, 5-HT2C receptor agonist WAY-163909 in rodents. Psychopharmacology (Berlin) 192: 159-170. Rosenzweig-Lipson S., Dunlop J., Marquis KL (2007) 5-HT2C receptor agonists as an innovative approach for psychiatric disorders. Drug news Perspect, 20: 565-571. Cryan, JF, Lucki I. (2000). Antidepressant-like behavioral effects mediated by 5-Hydroxytryptamine 2C receptors. J. Pharm. Exp. Ther. 295: 1120-1126].
Однократное или постоянное введение агонистов 5-HT2C снижает частоту импульсов дофаминовых нейронов в вентральной области покрышки, но не в черном веществе. Кроме того, агонисты 5-HT2C снижают содержание дофамина в прилежащем ядре, но не в полосатом теле (области головного мозга, наиболее ассоциированной с экстрапирамидальными побочными эффектами) [Di Matteo, V., Di Giovanni, G., Di Mascio, M., & Esposito, E. (1999). SB 242084, a selective serotonin 2C receptor antagonist, increases dopaminergic transmission in the mesolimbic system. Neuropharmacology 38, 1195-1205. Di Giovanni, G., Di Matteo, V., Di Mascio, M., & Esposito, E. (2000). Preferential modulation of mesolimbic vs. nigrostriatal dopaminergic function by serotonin2C/2B receptor agonists: a combined in vivo electrophysiological and microdialysis study. Synapse 35, 53-61. Marquis KL, Sabb AL, Logue SF, Brennan JA, Piesla MJ, Comery TA, Grauer SM, Ashby CR, Jr., Nguyen HQ, Dawson LA, Barrett JE, Stack G., Meltzer HY, Harrison BL, Rosenzweig-Lipson S. (2007) WAY-163909 [(7bR,10aR)-1,2,3,4,8,9,10,10a-octahydro-7bH-cyclopenta-[b][1,4]diazepino[6,7,lhi]indole]: A novel 5-hydroxytryptamine 2C receptor-selective agonist with preclinical antipsychotic-like activity. J. Pharmacol. Exp. Ther. 320: 486-496]. Поэтому ожидается, что агонисты 5-HT2C рецептора будут селективно снижать содержание мезолимбического дофамина без влияния на нигростриарный путь, обходя, таким образом, побочные эффекты EPS типичных противопсихотических средств. Некоторые агонисты 5-HT2C рецептора показали противопсихотическую активность у животных моделей шизофрении без EPS на основании отсутствия эффекта на каталепсию [Marquis KL, Sabb AL, Logue SF, Brennan JA, Piesla MJ, Comery TA, Grauer SM, Ashby CR, Jr., Nguyen HQ, Dawson LA, Barrett JE, Stack G., Meltzer HY, Harrison BL, Rosenzweig-Lipson S. (2007) WAY-163909 [(7bR,10aR)-1,2,3,4,8,9,10,10a-octahydro-7bH-cyclopenta-[b][1,4]diazepino[6,7,1hi]indole]: A novel 5-hydroxy tryptamine 2C receptor-selective agonist with preclinical antipsychotic-like activity. J. Pharmacol. Exp. Ther. 320: 486-496. Siuciak JA, Chapin DS, McCarthy SA, Guanowsky V., Brown J., Chiang P., Marala R., Patterson T., Seymour PA, Swick A., Iredale PA (2007) CP-809,101, a selective 5-ΗT2C agonist, shows activity in animal models of antipsychotic activity. Neuropharmacology 52: 279-290]. Противопсихотическая активность агонистов 5-HT2C рецептора без EPS в сочетании с их полезными эффектами при расстройствах настроения и когнитивной функции, а также их подобные средствам от ожирения эффекты делают агонисты 5-HT2C рецептора уникальными средствами для лечения шизофрении [Rosenzweig-Lipson S., Dunlop J., Marquis KL (2007) 5-HT2C receptor agonists as an innovative approach for psychiatric disorders. Drug news Perspect, 20: 565-571. Dunlop J., Marquis KL, Lim HK, Leung L., Kao J., Cheesman C., Rosenzweig-Lipson S. (2006). Pharmacological profile of the 5-HT2C receptor agonist WAY-163909; therapeutic potential in multiple indications. CNS Dug. Rev. 12: 167-177].
Кроме того, модуляция 5-HT2C вовлечена в эпилепсию [Isaac M. (2005). Serotonergic 5-HT2C receptors as a potential therapeutic target for the antiepileptic drugs. Curr. Topics Med. Chem. 5: 59-67], псориаз [Thorslund K., Nordlind K. (2007). Serotonergic drugs-a possible role in the treatment of psoriasis? Drug News Perspect 20: 521-525], болезнь Паркинсона и родственные двигательные нарушения [Esposito E., Di Matteo V., Pierucci M., Benigno A., Di Giavanni, G. (2007). Role of central 5-HT2C receptor in the control of basal ganglia functions. The Basal Ganglia Pathophysiology: Recent Advances 97-127], расстройства поведения [Barr AM, Lahmann-Masten V., Paulus M., Gainetdinov RP, Caron MG, Geyer MA (2004). The selective serotonin-2A receptor antagonist M100907 reverses behavioral deficits in dopamine transporter knockout mice. Neuropsychopharmacology, 29: 221-228], тревогу [Dekeyne А., Mannoury 1a Cour C., Gobert А., Brocco M., Lejuene F., Serres F., Sharp T., Daszuta A., Soumier A., Papp M., Rivet JM, Flik G., Cremers TI, Muller O., Lavielle G., Millan MJ (2208). S32006, a novel 5-HT2C receptor antagonists displaying broad-based antidepressant and anxiolytic properties in rodent models. Psychopharmacology 199: 549-568. Nunes-de-Souza V., Nunes-de-Souza RL, Rodgers RJ, Canto-de-Souza A. (2008). 5-HT2 receptor activation in the midbrain periaqueductal grey (PAG) reduces anxiety-like behavior in mice. Behav. Brain Res. 187: 72-79], мигрень [Leone M., Rigamonti A., D'Amico D., Grazzi L., Usai S., Bussone G. (2001). The serotonergic system in migraine. Journal of Headache and Pain 2(Suppl. 1):S43-S46], болезнь Альцгеймера [Arjona AA, Pooler AM, Lee RK, Wurtman RJ (2002). Effect of a 5-HT2C serotonin agonist, dexnorfenfluramine, on amyloid precursor protein metabolism in guinea pigs. Brain Res. 951: 135-140], боль и повреждение спинного мозга [Nakae A., Nakai K., Tanaka T., Hagihira S., Shibata M., Ueda K., Masimo T. (2008). The role of RNA editing of the serotonin 2C receptor in a rat model of oro-facial neuropathic pain. The European Journal of Neuroscience 27: 2373-2379. Nakae A., Nakai K., Tanaka T., Takashina M., Hagihira S., Shibata M., Ueda K., Mashimo T. (2008). Serotonin 2C receptor mRNA editing in neuropathic pain model. Neurosci. Res. 60: 228-231. Kao T., Shumsky JS, Jacob-Vadakot S., Timothy HB, Murray M., Moxon, KA (2006). Role of the 5-HT2C receptor in improving weight-supported stepping in adult rats spinalized as neonates. Brain Res. 1112: 159-168], половую дисфункцию [Motofei IG (2008). A dual physiological character for sexual function: the role of serotonergic receptors. BJU International 101: 531-534. Shimada I., Maeno K., Kondoh Y., Kaku Н., Sugasawa K., Kimura Y., Hatanaka K.; Naitou Y., Wanibuchi F., Sakamoto S.; Tsukamoto S. (2008). Synthesis and structure-activity relationships of a series of benzazepine derivatives as 5-HT2C receptor agonists. Bioorg. Med. Chem. 16: 3309-3320], прекращение курения [Fletcher PJ, Le AD, Higgins GA (2008). Serotonin receptors as potential targets for modulation of nicotine use and dependence. Progress Brain Res. 172: 361-83], зависимость от химических веществ [Bubar MJ, Cunningham KA (2008). Prospects for serotonin 5-HT2R pharmacotherapy in psychostimulant abuse. Progress Brain Res. 172: 319-46] и глазную гипертензию [Sharif NA, McLaughlin MA, Kelly CR (2006). AL-34662: a potent, selective, and efficacious ocular hypotensive serotonin-2 receptor agonist. J. Ocul. Pharmacol. Ther. 23: 1-13].
Кроме того, модуляция 5-НТ может быть применима при лечении боли, и невропатической, и ноцицептивной боли, см., например, публикацию заявки на получение патента США US2007/0225277; Obata, Hideaki; Ito, Naomi; Sasaki, Masayuki; Saito, Shigeru; Goto, Fumio. Possible involvement of spinal noradrenergic mechanisms in the antiallodynic effect of intrathecally administered 5-HT2C receptor agonists in the rats with peripheral nerve injury. European Journal of Pharmacology (2007), 567(1-2), 89-94. Serotonin 2C receptor mRNA editing in neuropathic pain model. Nakae, Aya; Nakai, Kunihiro; Tanaka, Tatsuya; Takashina, Masaki; Hagihira, Satoshi; Shibata, Masahiko; Ueda, Koichi; Mashimo, Takashi. Department of Anesthesiology & Intensive Care Medicine, Graduate School of Medicine, Osaka University, Neuroscience Research (Amsterdam, Netherlands) (2008), 60(2), 228-231. Antiallodynic effects of intrathecally administered 5-HT2C receptor agonists in rats with nerve injury. Obata, Hideaki; Saito, Shigeru; Sakurazawa, Shinobu; Sasaki, Masayuki; Usui, Tadashi; Goto, Fumio. Department of Anesthesiology, Gunma University Graduate School of Medicine, Maebashi, Gunma, Japan. Pain (2004), 108(1-2), 163-169. Influence of 5,7-dihydroxytryptamine (5,7-DHT) on the antinociceptive effect of serotonin (5-HT) 5-HT2C receptor agonist in male and female rats. Bras, Ryszard; Kasperska, Alicja; Oswiecimska, Joanna; Szkilnik, Ryszard. Department of Pharmacology, Silesian Medical University, Zabrze, Pol. Medical Science Monitor (1997), 3(5), 654-656.
Модуляция 5-НТ2 рецепторов может быть полезной при лечении состояний, связанных с функцией мочевого пузыря, в частности, с недержанием мочи [Discovery of a novel azepine series of potent and selective 5-HT2C agonists as potential treatments for urinary incontinence. Brennan, Paul E.; Whitlock, Gavin A.; Ho, Danny K. H.; Conlon, Kelly; McMurray, Gordon. Bioorganic & Medicinal Chemistry Letters (2009), 19(17), 4999-5003. Investigation of the role of 5-HT2 receptor subtypes in the control of the bladder and the urethra in the anesthetized female rat. Mbaki, Y.; Ramage, A. G. Department of Pharmacology, University College London, London, UK. British Journal of Pharmacology (2008), 155(3), 343-356]. В частности, было показано, что соединения с агонистической активностью по отношению к 5-HT2C применимы в лечении недержания мочи, см., например, публикации заявок на получение патентов США US2008/0146583 и US2007/0225274.
Благодаря своему профилю связывания соединения могут быть использованы для лечения заболеваний, которые обусловлены лигандами рецептора 5-HT6 (или которые поддаются лечению лигандом рецептора 5-HT6), т.e. они эффективны в лечении тех медицинских нарушений или заболеваний, при которых влияние (модуляция) на рецепторы 5-HT6 приводит к улучшению клинической картины или излечению заболевания. Примерами таких заболеваний являются нарушения или заболевания центральной нервной системы.
Нарушения или заболевания центральной нервной системы следует понимать как нарушения, которые поражают спинной мозг и, в частности, головной мозг. В контексте настоящего изобретения термин «нарушение» означает расстройства и/или аномалии, которые, как правило, рассматриваются как патологические состояния или функции и которые могут проявляться в виде конкретных признаков, симптомов и/или дисфункций. В то время как лечение в соответствии с настоящим изобретением может быть направлено на отдельные нарушения, т.e. аномалии или патологические состояния, также несколько аномалий, которые могут быть казуально связаны друг с другом, можно объединить в паттерны, т.e. синдромы, которые можно лечить в соответствии с настоящим изобретением.
Нарушениями, которые можно лечить в соответствии с настоящим изобретением, являются, в частности, нарушения, которые отвечают на модуляцию 5-HT6 рецептора. Они представляют собой когнитивные нарушения, такие как нарушение памяти, когнитивной функции и обучения, в частности, ассоциированные с болезнью Альцгеймера, возрастное снижение когнитивных способностей и умеренное снижение когнитивных способностей, нарушение дефицита внимания/синдром гиперактивности, расстройства личности, такие как шизофрения, в частности, связанные с шизофренией когнитивные нарушения, аффективные расстройства, такие как депрессия, тревога и обсессивно-компульсивные расстройства, нарушения походки или двигательные нарушения, такие как болезнь Паркинсона и эпилепсия, мигрень, нарушения сна (в том числе расстройства циркадного ритма), пищевые нарушения, такие как анорексия и булимия, некоторые желудочно-кишечные нарушения, такие как синдром воспаленного кишечника, заболевания, ассоциированные с нейродегенерацией, такие как удар, травма позвоночника или головы и повреждения головы, такие как гидроцефалия, зависимость от химических веществ и ожирение.
Связанные с зависимостями заболевания включают психиатрические нарушения и нарушения поведения, которые вызваны злоупотреблением психотропных веществ, таких как фармацевтические препараты или наркотические средства, а также другие связанные с зависимостями заболевания, такие как зависимость от азартных игр (не отнесенные к другим категориям расстройства контроля над побуждениями). Примерами вызывающих зависимость веществ являются опиоиды (например, морфин, героин и кодеин), кокаин; никотин; спирт; вещества, которые взаимодействуют с комплексом GABA-канал переноса ионов хлора, седативные средства, гипнотические средства и транквилизаторы, например, бензодиазепины; LSD; каннабиноиды; психомоторные стимуляторы, такие как 3,4-метилендиокси-N-метиламфетамин (экстази); амфетамин и подобные амфетамину вещества, такие как метилфенидат и другие стимуляторы, в том числе кофеин. Вызывающими зависимость веществами, которые привлекают особое внимание, являются опиоиды, кокаин, амфетамин или подобные амфетамину вещества, никотин и спирт.
Что касается лечения связанных с зависимостями заболеваний, особое предпочтение отдается соединениям в соответствии с настоящим изобретением, характеризующимся формулой (I), которые сами по себе не обладают психотропным действием. Это также можно наблюдать в тесте с использованием крыс, у которых после введения соединений, которые могут быть использованы в соответствии с настоящим изобретением, снижается самовведение психотропных веществ, например кокаина.
Согласно другому аспекту настоящего изобретения соединения в соответствии с настоящим изобретением приемлемы для лечения заболеваний, причиной которых может быть, по меньшей мере частично, аномальная активность 5-HT6 рецепторов.
Согласно другому аспекту настоящего изобретения лечение направлено, в частности, на такие нарушения, которые могут находиться под влиянием, в смысле целесообразного лекарственного лечения, связывания предпочтительно экзогенно вводимых партнеров связывания (лигандов) с 5-HT6 рецепторами.
Заболевания, которые можно лечить соединениями в соответствии с настоящим изобретением, зачастую характеризуются прогрессирующим развитием, т.e. вышеупомянутые состояния меняются со временем; как правило, тяжесть усиливается, и состояния, возможно, могут сливаться друг с другом, или могут проявляться другие состояния в дополнение к тем, которые уже имеются.
Соединения формулы (I) могут быть использованы для лечения большого числа признаков, симптомов и/или дисфункций, которые связаны с заболеваниями центральной нервной системы и, в частности, с вышеупомянутыми состояниями. Такими признаками, симптомами и/или дисфункциями являются, например, нарушенное отношение к реальности, недостаточность самооценки и способности отвечать общепринятым социальным нормам или предъявляемым жизнью требованиям, изменения темперамента, изменения индивидуальных потребностей, таких как голод, сон, жажда и т.п., а также настроения, нарушения способности наблюдать и объединять, изменения личности, в частности эмоциональная неустойчивость, галлюцинации, эгоизм, рассеянность, амбивалентность, аутизм, деперсонализация и ложные восприятия, иллюзорные идеи, произносимая нараспев речь, недостаточная синкинезия, походка короткими шагами, согнутое положение туловища и конечностей, тремор, отсутствие выражения лица, монотонная речь, депрессии, апатия, затрудненная спонтанность и решительность, обедненная способность к ассоциации, тревога, нервное возбуждение, заикание, социальная фобия, панические нарушения, синдромы отмены в ассоциации с зависимостью, маниакальные синдромы, состояния возбуждения и спутанности сознания, дисфория, дискинетические синдромы и тиковые расстройства, например, хорея Хантингтона и синдром Жилль де ла Туретта, синдромы вертиго, например, периферического позиционного, вращательного и качательного вертиго, меланхолия, истерия, ипохондрия и т.п.
В контексте настоящего изобретения лечение также предусматривает профилактическое лечение (профилактику), в частности профилактику рецидива или профилактику фазы, а также лечение острых или хронических признаков, симптомов и/или дисфункций. Лечение может быть ориентировано симптоматически, например, может подавлять симптомы. Оно может осуществляться в течение короткого времени, может быть ориентировано на средний промежуток времени или может быть долговременным лечением, например, в контексте поддерживающей терапии.
Соединения в соответствии с настоящим изобретением предпочтительно являются приемлемыми для лечения заболеваний центральной нервной системы, более предпочтительно для лечения когнитивных нарушений и, в частности, для лечения когнитивных нарушений, ассоциированных с шизофренией или с болезнью Альцгеймера.
Согласно другому аспекту настоящего изобретения соединения формулы (I) являются особенно приемлемыми для лечения связанных с зависимостями заболеваний, вызванных, например, злоупотреблением психотропных веществ, таких как фармацевтические препараты, наркотические вещества, никотин или спирт, в том числе психических расстройств и связанных с ними нарушений поведения.
Согласно другому аспекту настоящего изобретения соединения формулы (I) являются особенно приемлемыми для лечения нарушений питания, таких как ожирение, а также связанных с ним заболеваний, таких как сердечно-сосудистые заболевания, заболевания пищеварительного тракта, респираторные заболевания, злокачественное заболевание или диабет 2 типа.
В контексте лечения применение в соответствии с настоящим изобретением описанных соединений предусматривает способ. В этом способе эффективное количество одного или нескольких соединений, как правило, составленное в соответствии с фармацевтической и ветеринарной практикой, вводится подлежащему лечению индивидууму, предпочтительно млекопитающему, в частности, человеку, продуктивному животному или домашнему животному. Если не указано, в какой форме будет осуществляться лечение, оно будет зависеть от конкретного случая и сопровождаться медицинским обследованием (диагностикой) с учетом присутствующих признаков, симптомов и/или дисфункций, риска развития конкретных признаков, симптомов и/или дисфункций и других факторов.
Уровни однократной дозировки активных ингредиентов в фармацевтических композициях в соответствии с настоящим изобретением можно варьировать так, чтобы получалось количество активного(ых) соединения(ий), эффективное для достижения желаемого терапевтического ответа для конкретного субъекта (например, млекопитающего, предпочтительно человека (пациента)), композиций и способа введения. Выбранный уровень дозировки будет зависеть от активности конкретного соединения, пути введения, тяжести подлежащего лечению состояния, а также от состояния и предшествующей истории болезни подлежащего лечению пациента. Однако специалисту в данной области понятно, что начальные дозы соединения будут ниже требуемых для достижения желаемого терапевтического эффекта, и дозировка будет постепенно повышаться до достижения желаемого эффекта.
Соединения в соответствии с настоящим изобретением также могут вводиться субъекту в виде фармацевтической композиции, содержащей представляющие интерес соединения в комбинации по меньшей мере с одним фармацевтически приемлемым носителем. Фраза «терапевтически эффективное количество» соединения в соответствии с настоящим изобретением означает достаточное количество соединения для лечения нарушений при разумном соотношении пользы и риска, применимом к любому медицинскому лечению. Однако будет понятно, что общее суточное потребление соединений и композиций в соответствии с настоящим изобретением будет определяться лечащим врачом в рамках обоснованного медицинского заключения. Уровень конкретной терапевтически эффективной дозы для какого-либо конкретного пациента будет зависеть от ряда факторов, в том числе подлежащего лечению нарушения и тяжести нарушения; активности конкретного используемого соединения; конкретной используемой композиции; возраста, массы тела, общего состояния здоровья, пола и диеты пациента; времени введения, пути введения и скорости выведения конкретного используемого соединения; длительности лечения; лекарственных средств, применяемых в комбинации или совместно с конкретным используемым соединением; а также от подобных факторов, хорошо известных в медицинской области. Например, специалисту в данной области понятно, что начальные дозы соединения будут ниже требуемых для достижения желаемого терапевтического эффекта, и дозировка будет постепенно повышаться до достижения желаемого эффекта.
Общая суточная доза соединений в соответствии с настоящим изобретением, вводимых субъекту (а именно млекопитающему, такому как человек), варьирует от приблизительно 0,01 мг/кг веса тела до приблизительно 100 мг/кг веса тела. Более предпочтительные дозы могут варьировать от приблизительно 0,01 мг/кг веса тела до приблизительно 30 мг/кг веса тела. При желании эффективная суточная доза может быть поделена на несколько доз для введения. Следовательно, композиции однократной дозы могут содержать такие количества или их дольные единицы, составляющие суточную дозу.
e. Фармацевтические композиции
В еще одном варианте осуществления настоящее изобретение предполагает фармацевтические композиции. Фармацевтические композиции по настоящему изобретению содержат соединения по настоящему изобретению или их фармацевтически приемлемые соли или сольваты. Фармацевтические композиции по настоящему изобретению включают соединения по настоящему изобретению, которые могут быть объединены в лекарственном препарате вместе с по меньшей мере одним нетоксичным фармацевтически приемлемым носителем.
В еще одном варианте осуществления настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединения по настоящему изобретению или их фармацевтически приемлемые соли, и один или несколько фармацевтически приемлемых носителей, самостоятельно или в сочетании с одним или несколькими соединениями, которые не являются соединениями по настоящему изобретению. Примеры одного или нескольких соединений, которые могут быть объединены с соединениями по настоящему изобретению в фармацевтических композициях, включают, но ими не ограничиваются, одно или несколько лекарственных средств для усиления когнитивных способностей.
Фармацевтические композиции по настоящему изобретению могут быть введены субъекту (например, млекопитающему, такому как человек) перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (например, в виде порошков, мазей или капель), буккально или в виде орального или назального спрея. Используемый в настоящем документе термин "парентерально" относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и вливание.
Используемый в настоящем документе термин "фармацевтически приемлемый носитель" обозначает нетоксичное, инертное твердое вещество, полутвердый или жидкий наполнитель, разбавитель, инкапсулированное вещество или вспомогательное вещество любого типа. Некоторыми примерами веществ, которые могут служить в качестве фармацевтически приемлемых носителей, являются сахара, такие как, но ими не ограничиваясь, лактоза, глюкоза и сахароза; крахмалы, такие как, но ими не ограничиваясь, кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как, но ими не ограничиваясь, натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как, но ими не ограничиваясь, масло какао и воски; масла, такие как, но ими не ограничиваясь, арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль; сложные эфиры, такие как, но ими не ограничиваясь, этилолеат и этиллаурат; агар; буферные агенты, такие как, но ими не ограничиваясь, гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как, но ими не ограничиваясь, лаурилсульфат натрия и стеарат магния, а также красители, антиадгезив, образующие покрытие вещества, подслащивающие вещества, придающие вкус вещества и ароматизаторы, консерванты и антиокислители, могут также присутствовать в композиции, в соответствии с суждением разработчика композиции.
Фармацевтические композиции по настоящему изобретению для парентеральной инъекции включают фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для восстановления в стерильные инъецируемые растворы или дисперсии непосредственно перед применением. Примеры подходящих водных и неводных носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.), растительные масла (такие как оливковое масло), инъецируемые органические сложные эфиры (такие как этилолеат) и подходящие их смеси. Подходящая текучесть может быть сохранена, например, при помощи образующих покрытие веществ, таких как лецитин, обеспечением необходимого размера частиц в случае дисперсии и при помощи поверхностно-активных веществ.
Эти композиции могут также содержать вспомогательные вещества, такие как консерванты, смачивающие вещества, эмульгаторы и диспергирующие вещества. Предотвращение действия микроорганизмов может быть обеспечено включением различных антибактериальных и противогрибковых веществ, например, парабена, хлорбутанола, сорбиновой кислоты фенола и т.п. Может также быть желательным включение изотонических веществ, таких как сахара, хлорид натрия и т.п. Пролонгированное всасывание инъецируемой фармацевтической формы может быть обеспечено включением веществ, которые задерживают всасывание, таких как моностеарат алюминия и желатин.
В некоторых случаях, для того чтобы продлить эффект действия соединения по настоящему изобретению, желательным является замедление всасывания соединения из места подкожной или внутримышечной инъекции. Это может быть достигнуто использованием жидкой суспензии кристаллических или аморфных веществ, плохо растворимых в воде. Скорость всасывания соединения в этом случае будет зависеть от скорости его растворения, что, в свою очередь, зависит от размеров кристаллов и кристаллической структуры. В качестве альтернативы, замедленное всасывание парентерально вводимого соединения достигается путем растворения или суспендирования соединения в масляном растворителе.
Инъекционные депо-формы получают путем формирования микрокапсульных матриц препарата на биодеградируемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения препарата и полимера, а также природы конкретного используемого полимера может регулироваться скорость высвобождения препарата. Примеры других биодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные депо-формы также готовят путем заключения препарата в липосомы или микроэмульсии, совместимые с тканями тела.
Композици для инъекционного введения могут быть стерилизованы, например, путем фильтрации через бактериальные фильтры или путем добавления стерилизующих агентов к стерильным твердым композициям, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде, пригодной для инъекций, непосредственно перед применением.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых формах активное соединение может быть смешано с по меньшей мере одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат или дикальция фосфат, и/или a) наполнители или сухие разбавители, такие как крахмалы, лактоза, глюкоза, маннитол и кремниевая кислота, b) связующие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, c) увлажнители, такие как глицерин, d) разрыхлители, такие как агар-агар, карбонат кальция, картофельный крахмал или крахмал из тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, e) замедляющие растворение агенты, такие как парафин, f) вещества, ускоряющие всасывание, такие как соединения четвертичного аммония, g) смачивающие агенты, такие, например, как цетиловый спирт и глицерол моностеарат, h) адсорбенты, такие как каолин и бентонитовая глина, и i) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смесь. В случае капсул, таблеток и пилюль, лекарственная форма может также содержать также буферные агенты.
Твердые композиции подобного типа могут также быть заключены в мягкие и твердые желатиновые капсулы с использованием таких наполнителей, как лактоза или молочный сахар, так же как и высокомолекулярные полиэтиленгликоли и им подобные.
Твердые лекарственные формы: таблетки, драже, капсулы, пилюли и гранулы - могут быть получены с использованием покрытий и оболочек, таких как кишечнорастворимые оболочки и другие оболочки, хорошо известные специалистам в области фармации. Они могут необязательно содержать опалесцирующие агенты и также включать композиции, которые высвобождают активный(е) компонент(ы) только или предпочтительно в определенной части желудочно-кишечного тракта по необходимости в замедленном темпе. Примеры «встраиваемых» композиций, которые могут быть использованы, включают полимерные субстанции и воски.
Активные соединения могут быть также в форме микрокапсул, при необходимости, с одним или несколькими наполнителями, описанными выше.
Жидкие лекарственные формы для перорального назначения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений, жидкие лекарственные формы могут содержать инертные наполнители, наиболее часто используемые в данной области, например воду или другие растворители, повышающие растворимость агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло пшеничных зародышей, оливковое, касторовое и кунжутовое масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоль и эфиры жирных кислот и сорбитана, и их смеси.
Помимо инертных наполнителей, в композиции для перорального введения могут быть добавлены вспомогательные вещества, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, вкусовые добавки и ароматизаторы.
Суспензии, в дополнение к активным соединениям, могут содержать суспендирующие агенты как, например, этоксилированные изостеариловые спирты, сложные эфиры полиоксиэтилен сорбита и сорбитана, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар, трагакантовую камедь или смесь этих соединений.
Композиции для ректального или вагинального введения преимущественно являются суппозиториями, которые могут быть получены смешиванием соединений по настоящему изобретению с приемлемыми не вызывающими раздражения наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые находятся в твердом состоянии при комнатной температуре, но становятся жидкими при температуре тела и, как следствие, тают в прямой кишке или во влагалище и высвобождают активное соединение.
Соединения по настоящему изобретению могут также быть введены в виде липосом. Как известно из уровня техники, липосомы, как правило, образованы из фосфолипидов или других липидных соединений. Липосомы образуются одно- и многослойными гидратированными кристаллами, диспергированными в водной среде. Может быть использован любой нетоксичный, физиологически приемлемый метаболизируемый липид, способный образовывать липосомы. Настоящие композиции в форме липосом могут содержать, помимо соединения по настоящему изобретению, стабилизаторы, консерванты, наполнители и т.п. Предпочтительными липидами являются природные и синтетические фосфолипиды и фосфатидилхолины (лецитины), используемые раздельно или совместно.
Способы образования липосом хорошо известны из уровня техники. См., например, Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (l976), p. 33 et seq.
Лекарственные формы для местного введения соединения по настоящему изобретению включают порошки, спреи, мази и ингаляторы. Активное соединение может быть смешано в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами, буферами или распыляющими веществами, которые могут потребоваться. Офтальмологические препараты, глазные мази, порошки и растворы также включены в объем настоящего изобретения.
Соединения по настоящему изобретению могут быть использованы в форме фармацевтически приемлемых солей, полученных из неорганических и органических кислот. Фраза "фармацевтически приемлемая соль" относится к тем солям, которые в рамках действующего медицинского заключения могут быть использованы в контакте с тканями человека и низших животных без проявления чрезмерной токсичности, раздражения, аллергической реакции и подобных явлений, а также с приемлемым соотношением польза/риск.
Фармацевтически приемлемые соли хорошо известны специалистам в соответствующей области. Например, S. M. Berge и др. детально описывают фармацевтически приемлемые соли в (J. Pharmaceutical Sciences, 1977, 66: 1 et seq.) Соли могут быть получены in situ в процессе окончательного выделения и очистки соединений по данному изобретению или отдельно путем взаимодействия функциональной группы свободного основания с подходящей органической кислотой. Типичные соли присоединения кислот включают, но ими не ограничиваются, ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат (изотионат), лактат, малат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоционат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы можно кватернизировать такими агентами, как низшие алкилгалогениды, такие как, но ими не ограничиваются, метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинной цепью, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, аралкилгалогениды, такие как бензил- и фенетилбромиды и др. При этом получают водо- или маслорастворимые или диспергируемые продукты. Примеры кислот, которые можно использовать для образования фармацевтически приемлемых солей добавления кислот, включают такие неорганические кислоты, как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как уксусная кислота, фумаровая кислота, малеиновая кислота, 4-метилбензолсульфоновая кислота, янтарная кислота и лимонная кислота.
Основные аддитивные соли можно получить in situ в процессе конечного выделения и очистки соединений по настоящему изобретению взаимодействием группы, содержащей карбоновую кислоту, с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла или с аммонием, или с органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают, но ими не ограничиваются, соли на основе катионов щелочных металлов или щелочноземельных металлов, такие как, но ими не ограничиваясь, соли лития, натрия, калия, кальция, магния и алюминия и т.п., и нетоксичные катионы четвертичного аммония и катионы аминов, включая аммоний, тетраметиламмоний, тетраэтиламмоний, метиламмоний, диметиламмоний, триметиламмоний, триэтиламмоний, диэтиламмоний, этиламмоний и другие. Другие типичные органические амины, пригодные для образования основных аддитивных солей, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин и другие.
Используемый в настоящем документе термин "фармацевтически приемлемое пролекарство" или "пролекарство" обозначает пролекарства соединений по изобретению, которые в рамках действующего медицинского заключения пригодны для применения в контакте с тканями людей и низших животных, не вызывая чрезмерной токсичности, раздражения, аллергической реакции и т.п., в соответствии с приемлемым соотношением польза/риск, и эффективны для своего предполагаемого применения.
Настоящее изобретение также относится к соединениям по настоящему изобретению, образованным путем синтеза, либо образованные in vivo путем биотрансформации пролекарства.
Соединения по настоящему изобретению могут существовать в несольватированных, а также сольватированных формах, включая гидратные формы, такие как полугидраты. Обычно сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода и этанол и другие, эквивалентны несольватированным формам для целей изобретения.
f. Общие синтезы
Данное изобретение предназначено для охвата соединений по настоящему изобретению либо получением синтетическими способами, либо метаболическими методами. Получение соединений метаболическими методами включают такие, которые протекают в организме человека или животного (in vivo) или методами, протекающими in vitro.
Соединения по настоящему изобретению могут быть получены различными способами, хорошо известными при получении соединений данного класса. Например, соединения по настоящему изобретению, где группы A и G1 имеют значения, указанные в разделе Описание изобретения, если не указано иного, могут быть синтезированы, как показано на схемах 1-30.
Абревиатуры, которые используются в описании схем, являются следующими: Ac - ацетил; Ac2O - уксусный ангидрид; Bn - бензил; Boc - трет-бутоксикарбонил; Boc2O - ди-трет-бутилдикарбонат; Bu - бутил; t-Bu - трет-бутил; (CH2O)p - параформальдегид; DMAP - 4-(диметиламино)пиридин; dppf - 1,1'-бис(дифенилфосфино)ферроцен; Et - этил; EtOH - этанол; HOAc - уксусная кислота; KOtBu - трет-бутоксид калия; LDA - диизопропиламид лития; MP-BH3CN - макропористая цианоборгидридная смола; NEt3 - триэтиламин, OAc - ацетат; Ph - фенил; OTf - трифторметансульфонат; L-Pro - L-пролин; TBAF - тетрабутиламмонийфторид; TBS - трет-бутилдиметилсилил; TBTU - O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат; Tf - трифторметансульфонил; ТФУ - трифторуксусная кислота и Ts - п-толуолсульфонил.
Схема 1
Как указано на схеме 1, соединения формул (1-4) и (1-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (1-1). Соединения формулы (1-1) могут быть обработаны (трифенилфосфоранилиден)ацетонитрилом в растворителе, таком как нагретый толуол, с получением соединения формулы (1-2). Соединения формулы (1-2) могут быть подвергнуты взаимодействию с N-бензил-1-метокси-N-((триметилсилил)метил)метанамином в присутствии кислоты, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, при температуре окружающей среды с получением соединения формулы (1-3). Соединения формулы (1-3) могут быть восстановлены с помощью водорода в присутствии никеля Ренея® в смеси аммиака в метаноле, что давало соединение формулы (1-4). В некоторых случаях промежуточный амин не циклизуется. В этих случаях обработка с помощью основания, такого как метоксид натрия, в необязательно нагретом метаноле дает соединения формулы (1-4). Бензильная группа соединения формулы (1-4) может быть удалена каталитическим гидрированием в присутствии гидроксида палладия(II) на углероде, необязательно, в нагретом растворителе, таком как метанол, что давало соединение формулы (1-5). Альтернативно, соединения формулы (1-4) могут быть преобразованы в соединения формулы (1-5) путем способа с переносом водорода, используя 1,4-циклогексадиен или формиат аммония в присутствии катализатора, такого как 10%-й палладий-на-углероде в присутствии уксусной кислоты в необязательно нагретом растворителе, таком как этанол.
Схема 2
Как указано на схеме 2, соединения формулы (1-1), где A имеет значения, определенные в описании изобретения, могут быть получены из соединений формулы (2-1). Соответственно, ангидриды формулы (2-1) могут быть обработаны алкоксидом, таким как метоксид натрия, в метаноле при температуре окружающей среды или около того, что давало после подкисления соединения формулы (2-2). Соединения формулы (2-2) преобразовывали в соответствующий хлорангидрид кислоты (2-3) при обработке оксалилхлоридом или тионилхлоридом в растворителе, таком как дихлорметан, и каталитическим количеством N,N-диметилформамида. Затем группа хлорангидрида кислоты может быть избирательно восстановлена с помощью агента, такого как литий три-трет-бутоксиалюминийгидрид в растворителе, таком как диглим, сначала при температуре -70°C, затем градиентно нагревая до комнатной температуры, что давало соединение формулы (1-1). Соединения формулы (1-1) могут быть использованы, как описано на схеме 1.
Схема 3
Как указано на схеме 3, соединения формулы (3-2), где A имеет значения, определенные в описании изобретения, могут быть получены из соединений формулы (3-1). Соединения формулы (3-1) могут быть подвергнуты взаимодействию с акрилонитрилом в присутствии катализатора, такого как ацетат палладия(II), лиганда, такого как три(o-толил)фосфин, и основания, такого как ацетат натрия, в растворителе, таком как N,N-диметилформамид, при нагревании до 120-135°C в течение времени от 15 до 60 часов, что давало соединение формулы (3-2). Альтернативные условия получения соединения формулы (3-2) из (3-1) включают взаимодействие соединения формулы (3-1) с акрилонитрилом в присутствии катализатора, такого как трис(дибензилиденацетон)дипалладий(0), лиганда, такого как три-трет-бутилфосфин или три-трет-бутилфосфоний тетрафторборат, и основания, такого как N,N-дициклогексилметиламин, в растворителе, таком как 1,4-диоксан, нагретый от 40 до 80°C в течение от 1 до 5 часов в атмосфере азота. Йод или трифторметансульфонатная группы могут быть заменены на бром в соединениях формулы (3-1). Соединения формулы (3-2) могут быть использованы согласно схеме 1 для соединения формулы (1-2).
Схема 4
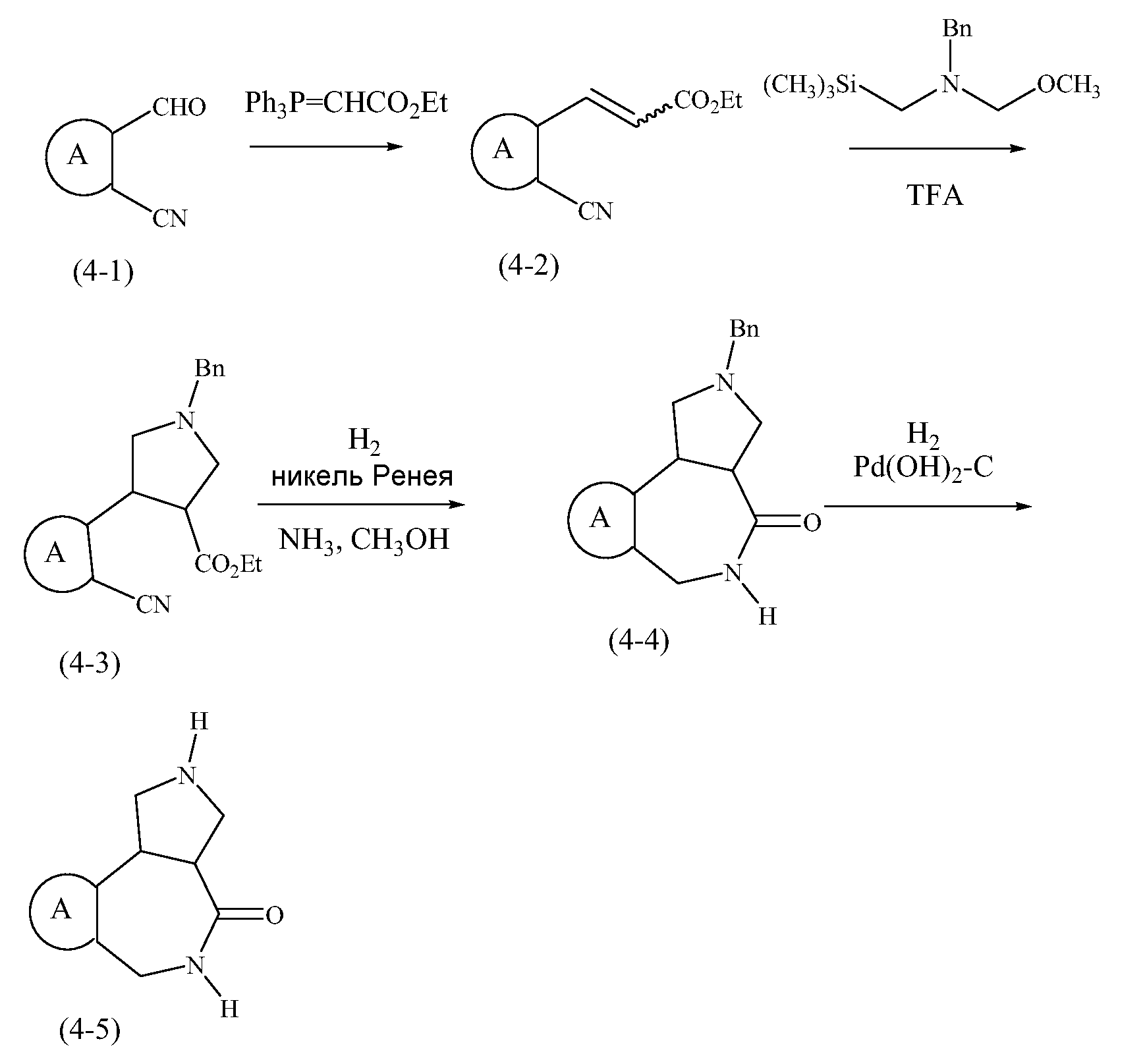
Как указано на схеме 4, соединения формул (4-4) и (4-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (4-1). Соединения формулы (4-1) могут быть обработаны (карбоэтоксиметилен)трифенилфосфораном в растворителе, таком как нагреваемый толуол, с получением соединения формулы (4-2). Соединения формулы (4-2) могут быть подвергнуты взаимодействию с N-бензил-1-метокси-N-((триметилсилил)метил)метанамином в присутствии кислоты, такой как трифторуксусная кислота, в растворителе, таком как дихлорметан, при температуре окружающей среды с получением соединения формулы (4-3). Соединения формулы (4-3) могут быть восстановлены с помощью водорода в присутствии никеля Ренея® в смеси аммиака в метаноле, что давало соединение формулы (4-4). Бензильная группа соединения формулы (4-4) может быть удалена каталитическим гидрированием в присутствии гидроксида палладия(II) на углероде, необязательно с нагревом в растворителе, таком как метанол, что давало соединение формулы (4-5).
Схема 5
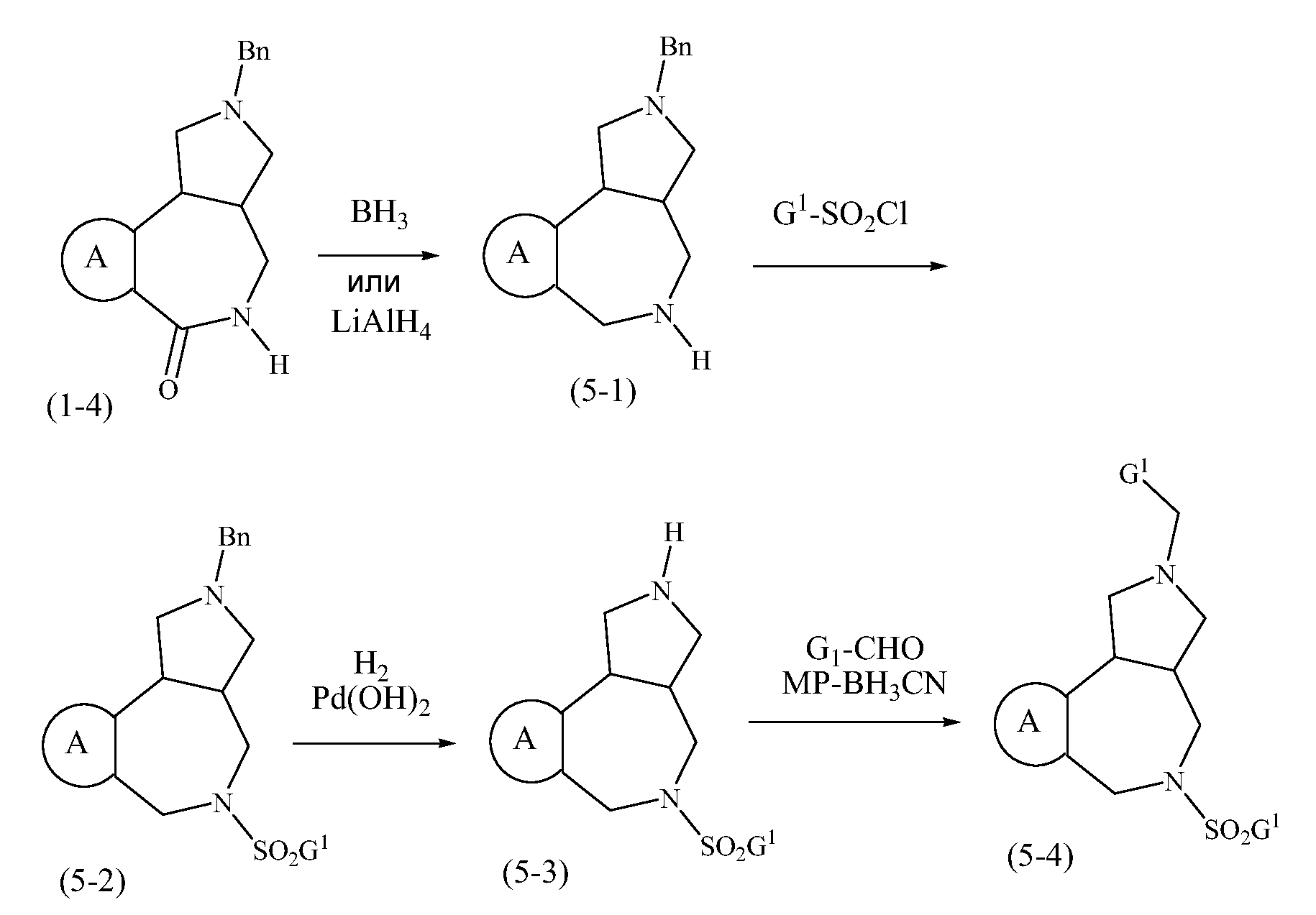
Как указано на схеме 5, соединения формул (5-1), (5-2), (5-3) и (5-4), где A и G1 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (1-4). Соединения формулы (1-4) могут быть обработаны комплексом боран тетрагидрофуран в нагреваемом тетрагидрофуране с получением соединения формулы (5-1). Альтернативно, соединения формулы (1-4) могут быть обработаны литийалюминийгидридом сначала при температуре -78°C, затем нагреванием до комнатной температуры в тетрагидрофуране, что давало соединения формулы (5-1). Соединения формулы (5-1) могут быть подвергнуты взаимодействию с сульфонилхлоридами формулы G1-SO2Cl в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан, в течение от 8 до 24 часов при комнатной температуре, что давало соединения формулы (5-2). Альтернативно, соединения формулы (5-1) могут быть подвергнуты взаимодействию с сульфонилхлоридами формулы G1-SO2Cl в присутствии основания, такого как триэтиламин, в смеси растворителей, таких как дихлорметан и N,N-диметилформамид, в течение от 8 до 24 часов при комнатной температуре, что давало соединения формулы (5-2). Затем бензильная группа соединений формулы (5-2) может быть удалена путем восстановления водородом (30 фунтов на квадратный дюйм) в присутствии катализатора, такого как гидроксид палладия в растворителе, таком как трифторэтанол, в течение от 24 до 48 часов при комнатной температуре, что давало соединения формулы (5-3). Соединения формулы (5-3) могут быть затем подвергнуты восстановительному аминированию, что давало соединения формулы (5-4) путем взаимодействия с альдегидами формулы G1-CHO в присутствии макропористой цианоборгидридной смолы или цианоборгидрида натрия в присутствии уксусной кислоты в растворителе, таком как метанол или этанол, при комнатной температуре в течение от 8 до 24 часов.
Схема 6
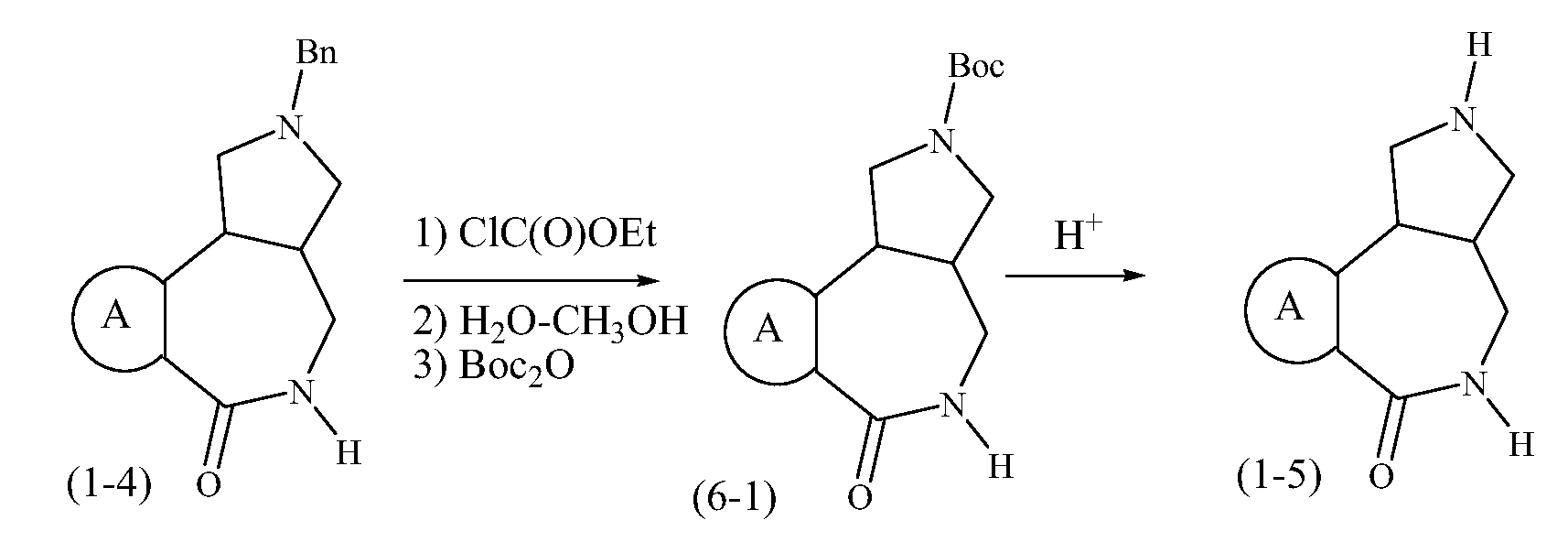
Как указано на схеме 6, соединения формулы (1-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены альтернативным способом из соединений формулы (1-4). Соединения формулы (1-4) могут быть обработаны на первой стадии 1-хлорэтилхлорформиатом в дихлорэтане при температуре 80°C в течение от 8 до 24 часов. На второй стадии промежуточный этилкарбамат гидролизуют путем взаимодействия с подогретой смесью воды и метанола в течение от 2 до 8 часов. трет-Бутоксикарбонильную группу вводят на третьей стадии путем взаимодействия с ди-трет-бутилдикарбонатом в растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, что давало соединение формулы (6-1). Соединения формулы (6-1) затем могут быть обработаны кислотой, такой как трифторуксусная кислота или хлористоводородная кислота, в растворителе, таком как диоксан или дихлорметан, при комнатной температуре в течение 4 до 36 часов, что давало соединение формулы (1-5).
Схема 7
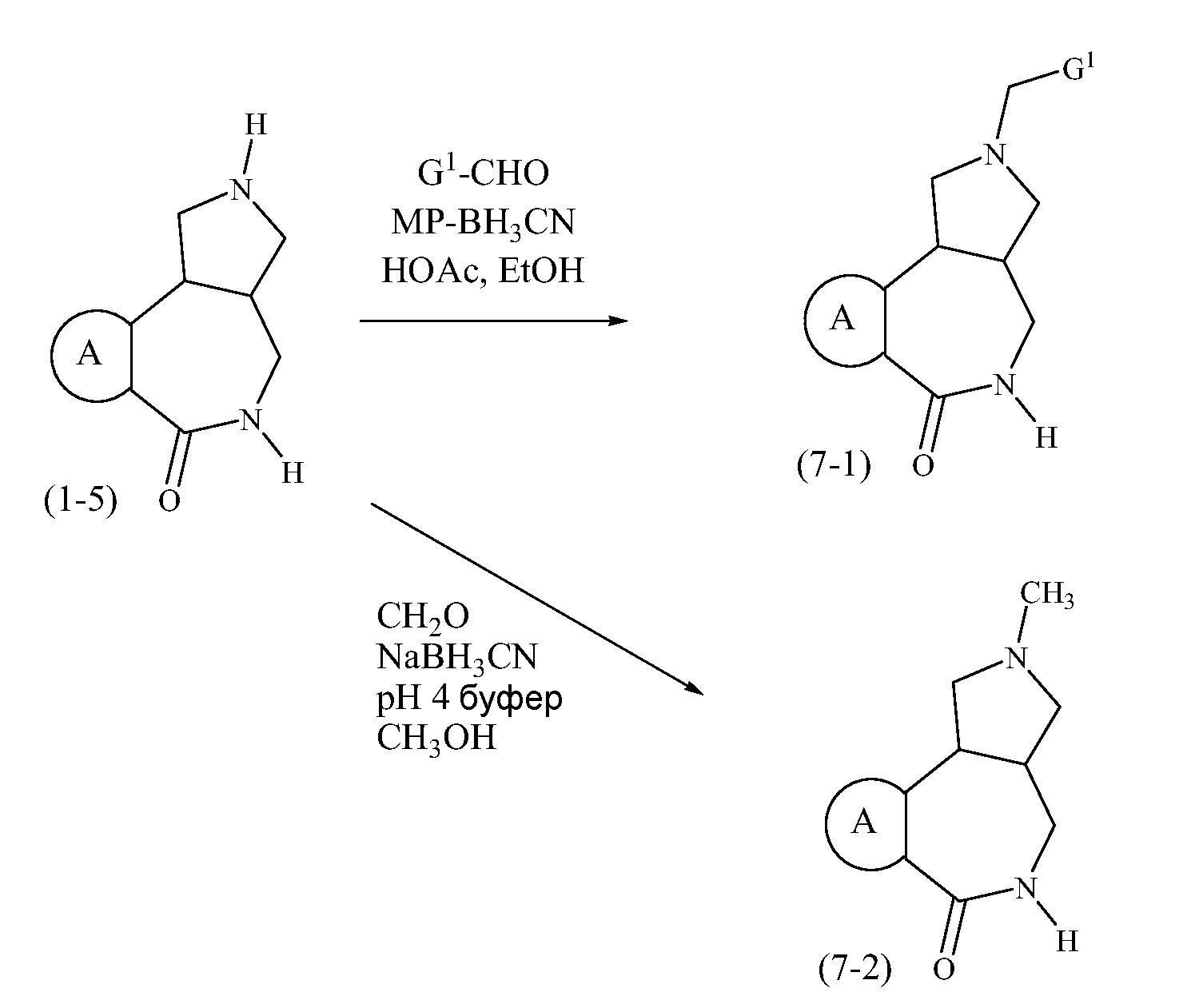
Как указано на схеме 7, соединения формулы (7-1) и (7-2), где A и G1 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (1-5). Соединения формулы (1-5) могут быть подвергнуты взаимодействию с альдегидом формулы G1-CHO в присутствии макропористой цианоборгидридной смолы и уксусной кислоты в растворителе, таком как этанол, нагреванием при или около 65°C в течение от 4 до 24 часов, что давало соединение формулы (7-1). Формальдегид может быть заменен на G1-CHO при получении соединения формулы (7-2). Альтернативно, соединения формулы (1-5) могут быть подвергнуты взаимодействию с формальдегидом в присутствии цианоборгидрида натрия в метаноле в ацетатном буфере, что давало соединение формулы (7-2). Помимо альдегидов формулы G1-CHO и формальдегида, алкилальдегидов и галогеналкилальдегидов могут быть использованы в данных преобразованиях.
Схема 8
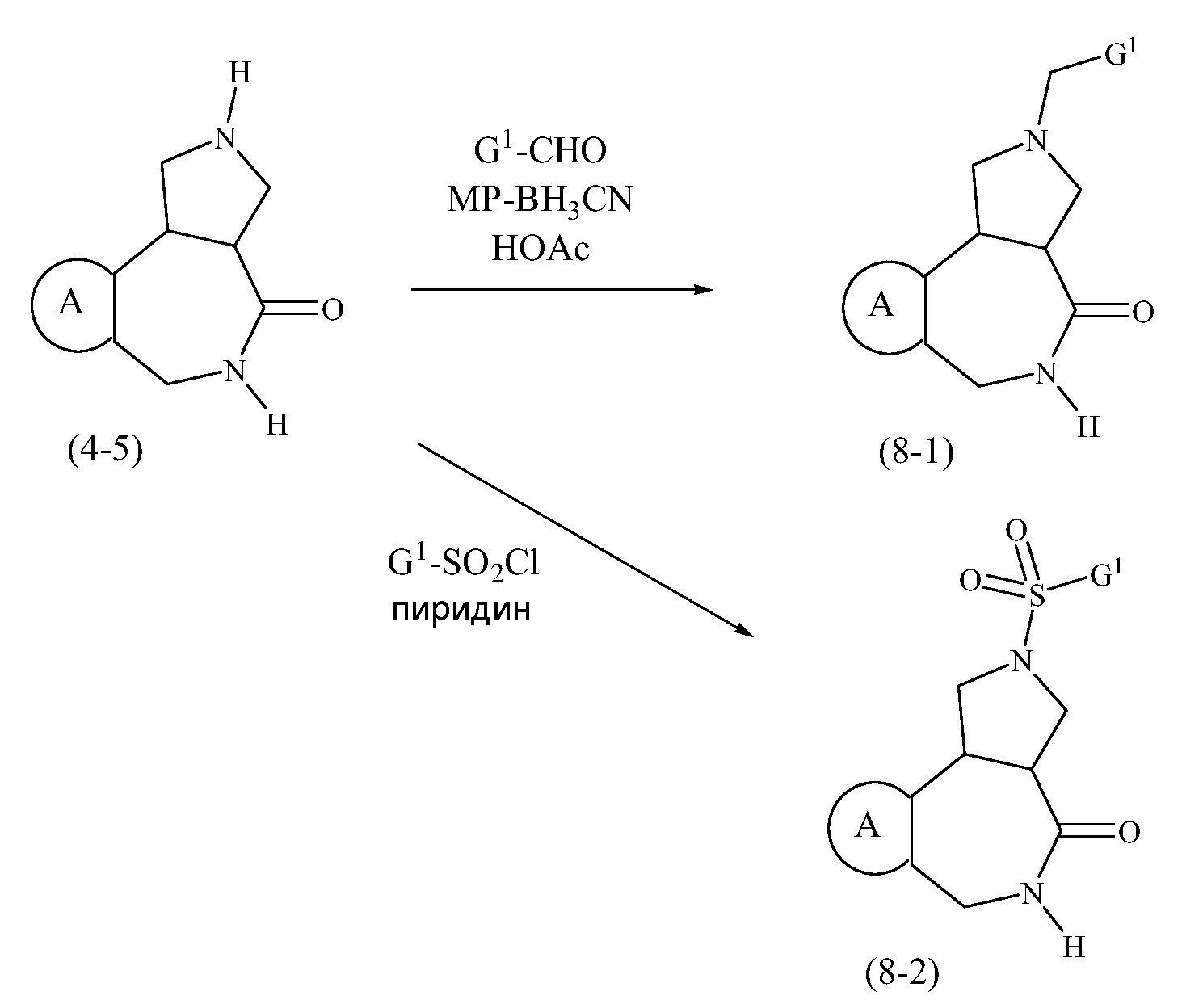
Как указано на схеме 8, соединения формулы (8-1) и (8-2), где A и G1 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I) могут быть получены из соединений формулы (4-5). Соединения формулы (4-5) могут быть подвергнуты взаимодействию с альдегидом формулы G1-CHO в присутствии макропористой цианоборгидридной смолы и уксусной кислоты в растворителе, таком как этанол, что давало соединение формулы (8-1). Формальдегид также может быть использован в данном способе восстановительного аминирования с получением метиламинового аналога, соответствующего соединениям формулы (8-1). Соединения формулы (4-5) также могут быть подвергнуты взаимодействию с сульфонилхлоридами формулы G1-SO2Cl в присутствии пиридина в дихлорметане при комнатной температуре в течение 8-24 часов, что давало соединение формулы (8-2).
Схема 9
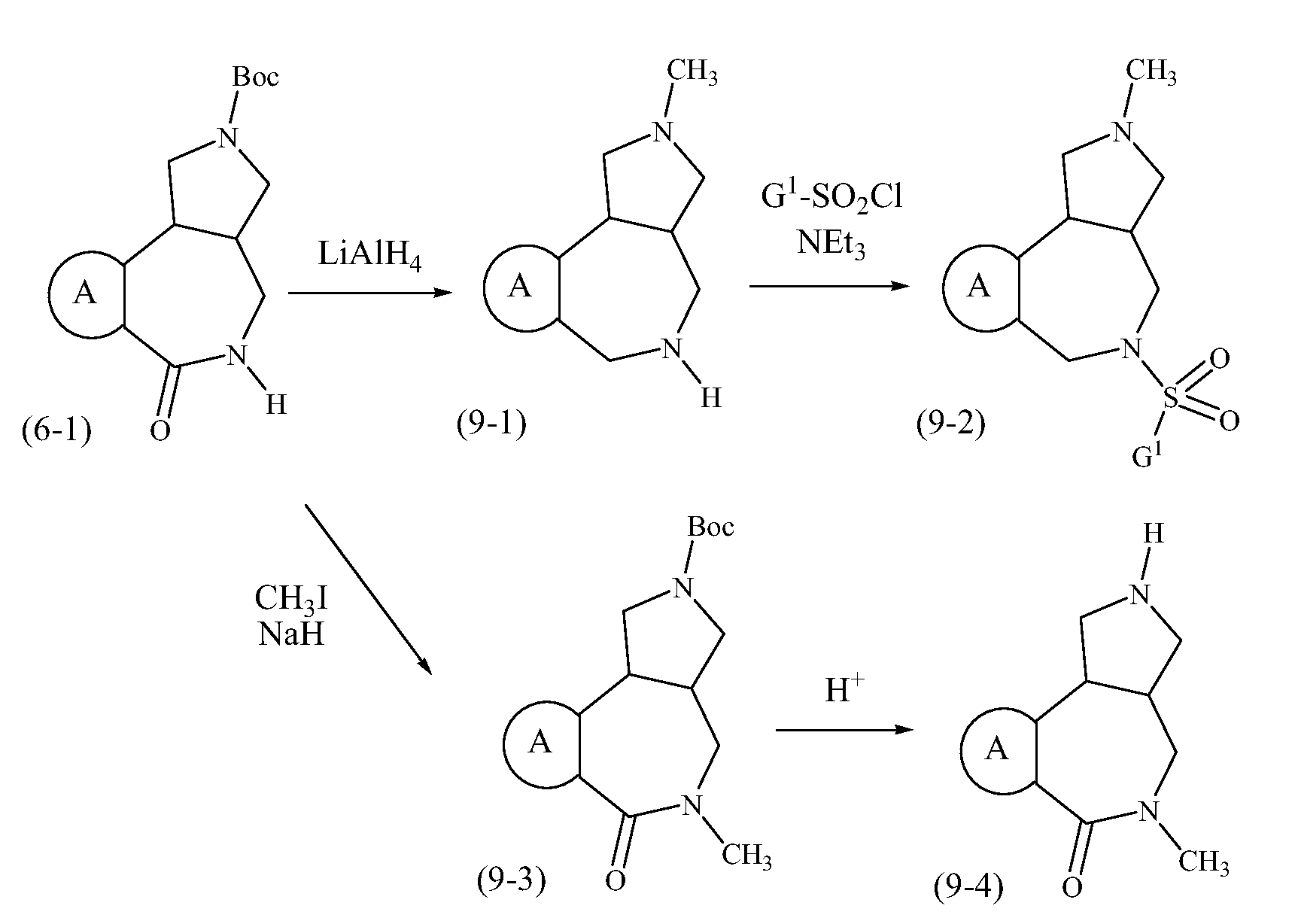
Как указано на схеме 9, соединения формулы (9-2), где A и G1 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (6-1). Соединения формулы (6-1) могут быть подвергнуты взаимодействию с литийалюминийгидридом в растворителе, таком как тетрагидрофуран, при комнатной температуре в течение от 12 до 36 часов, что давало соединение формулы (9-1). Соединения формулы (9-1) затем могут быть подвергнуты взаимодействию с сульфонилхлоридами формулы G1-SO2Cl и основанием, таким как триэтиламин или пиридин, в дихлорметане при комнатной температуре с получением соединений формулы (9-2). Соединения формулы (6-1) могут быть обработаны основанием, таким как гидрид натрия, в растворителе, таком как N,N-диметилформамид, затем йодметаном, что давало соединения формулы (9-3). Соединения формулы (9-3) могут быть обработаны хлористоводородной кислотой в диоксане или трифторуксусной кислотой в дихлорметане с получением соединений формулы (9-4).
Схема 10
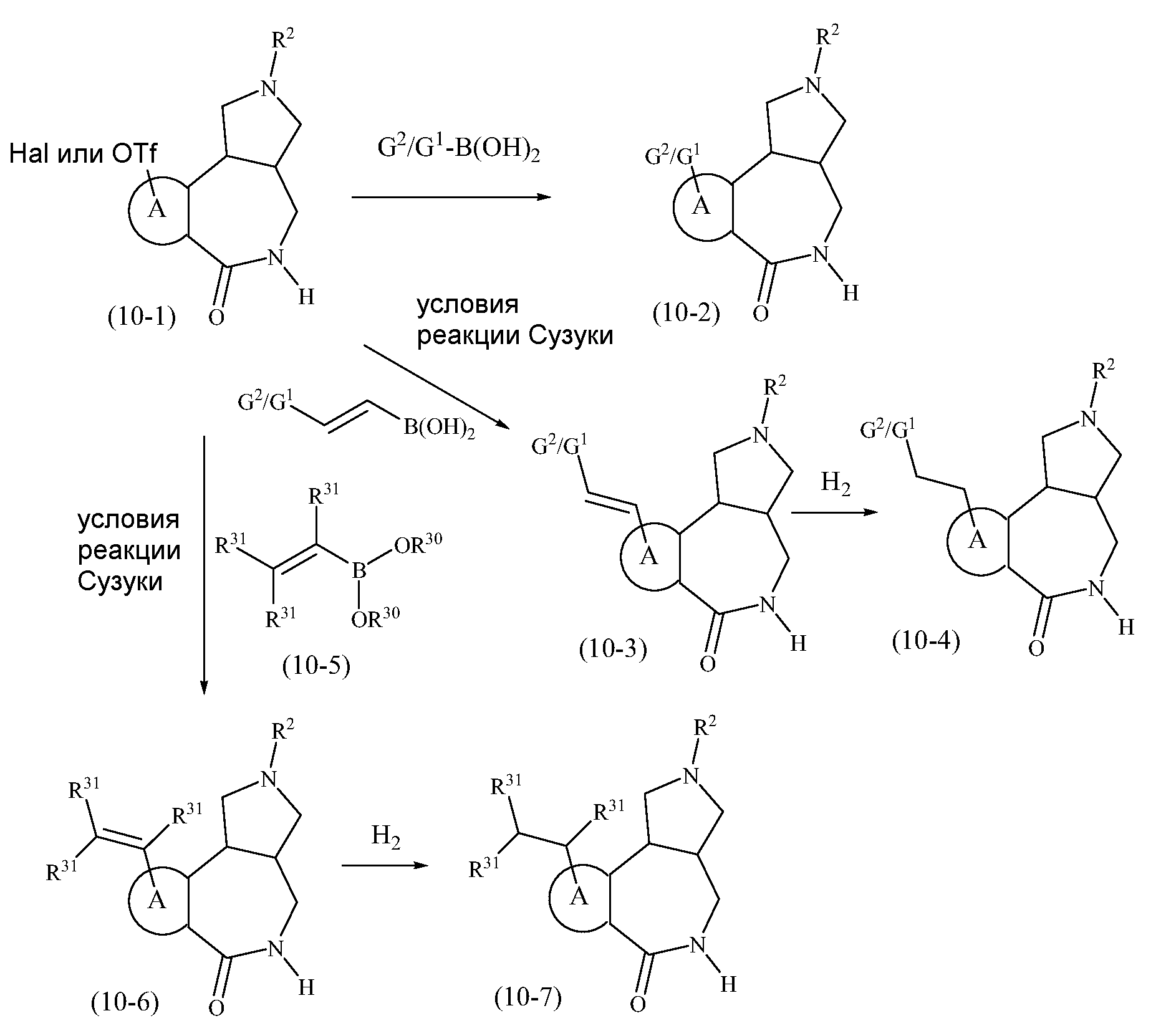
Как указано на схеме 10, соединения формулы (10-2), (10-3), и (10-4), где A, G1, G2 и R2 имеют значения, определенные в описании изобретения, за исключением того, что R2 является иным, чем водород, эти соединения являются представительными соединениями формулы (I) и могут быть получены из соединений формулы (10-1). Соединения формулы (10-1), где Hal представляет собой хлор, бром или йод и OTf обозначает трифторметансульфонат, могут быть подвергнуты взаимодействию с бороновой кислотой формулы G2/G1-B(OH)2 или соответствующим боронатом в условиях реакции Сузуки, что давало соединение формулы (10-2). Условия реакции Сузуки включают одно или несколько оснований, такие как карбонат цезия, карбонат калия или 1,8-диазабицикло[5.4.0]ундец-7-ен, катализатор, такой как ацетат палладия(II), лиганд, такой как три-трет-бутилфосфин или 2-дициклогексилфосфино-2',6'-диметоксибифенил, в растворителе, таком как N,N-диметилформамид или диметоксиэтан, нагревая либо обычно, либо в микроволновой печи реактора, либо около 150°C в течение 30 до 70 минут. Альтернативные условия реакции Сузуки включают основания, такие как карбонат калия, палладиевый катализатор на твердой подложке, такой как FC-1007, в растворителе, таком как этанол, нагревая в микроволновом реакторе при 150°C в течение от 30 до 60 минут. Подобным же образом, соединения формулы (10-1) могут быть перобразованы в соединения формулы (10-3), используя условия реакции Сузуки, описанные ранее, за исключением использования стирил-бороновой кислоты или бороната. Соединения формулы (10-3) могут быть восстановлены с помощью водорода (30 фунтов на квадратный дюйм) в присутствии катализатора, такого как 5% палладий-на-углероде, в растворителе, таком как метанол, при комнатной температуре с получением соединений формулы (10-4). Соединения формулы (10-1) также могут быть подвергнуты взаимодействию с соединениями формулы (10-5), где каждый R30 представляет собой водород, алкил, или вместе с атомами кислорода и соседним атомом бора, к которому они присоединены, образуют диоксаборолан или диоксаборинан, и каждый R31 выбран из водорода, алкила или галогеналкила, или две R31 группы, взятые вместе с атомом углерода, к которому они присоединены, образуют замещенный или незамещенный циклоалкил или гетероцикл, в условиях реакции Сузуки, что давало соединения формулы (10-6). Соединения формулы (10-6) могут быть восстановлены с помощью водорода и соответствующего катализатора, что давало соединения формулы (10-7). Соединения формул (10-2), (10-3) и (10-6) также могут быть получены из соединений формулы (10-1) и соответствующих MIDA боронатов в присутствии катализаторов, таких как ацетат меди(II) и трис(дибензилиденацетон)дипалладий(0), лиганда, такого как 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (X-phos), и основания, такого как карбонат калия, в необязательно нагреваемом растворителе, таком как N,N-диметилформамид.
Схема 11
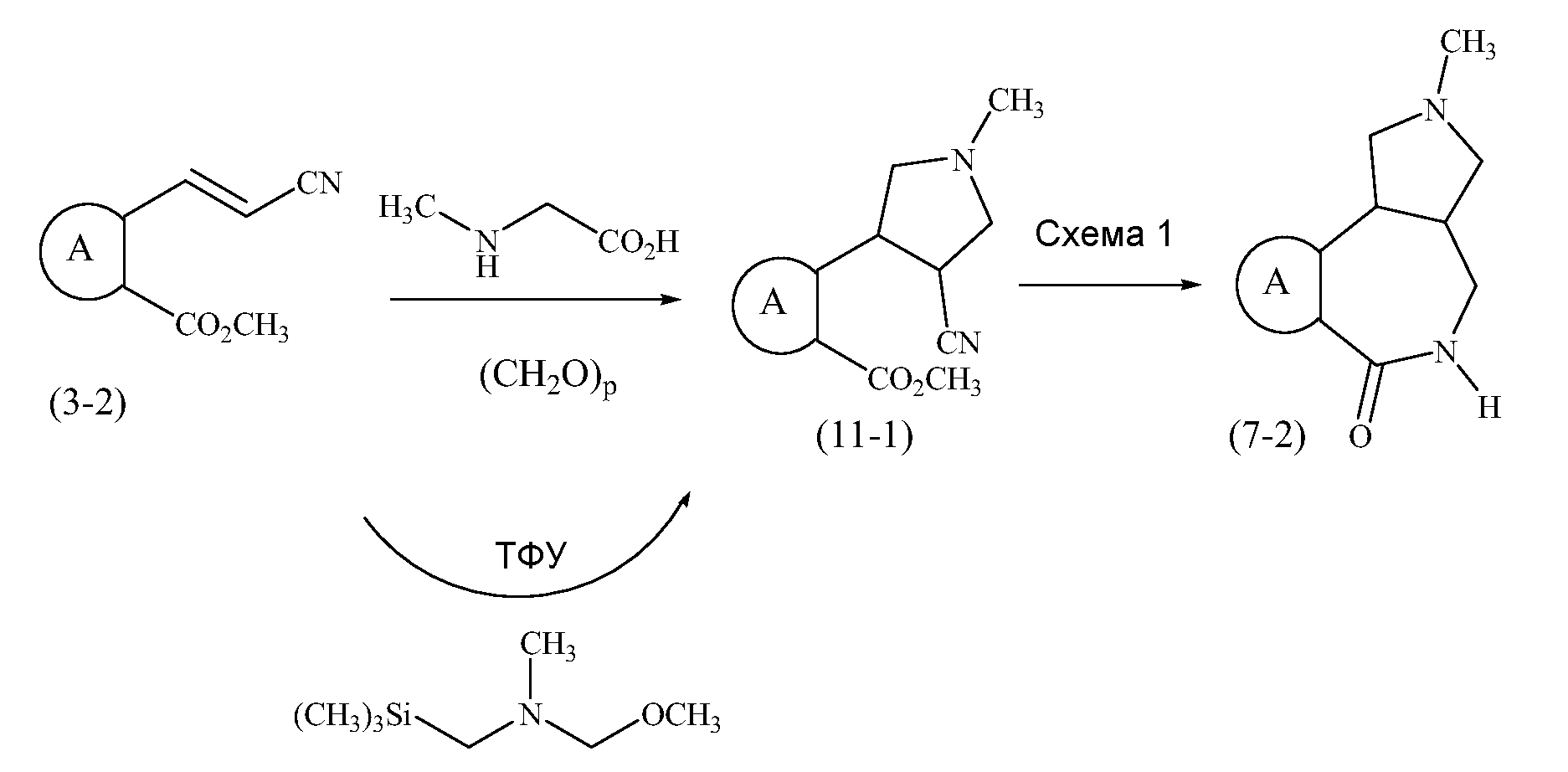
Как указано на схеме 11, соединения формулы (7-2), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), альтернативно могут быть получены из соединений формулы (3-2). Соединения формулы (3-2) могут быть подвергнуты взаимодействию с 2-(метиламино)уксусной кислотой в присутствии параформальдегида в нагреваемом толуоле в течение четыре часов с получением соединения формулы (11-1). Альтернативно, соединения формулы (3-2) могут быть подвергнуты взаимодействию с 1-метокси-N-метил-N-((триметилсилил)метил)метанамином в присутствии кислоты, такой как трифторуксусная кислота, что давало соединение формулы (11-1). Соединения формулы (11-1) могут быть обработаны в условиях, указанных на схеме 1, с получением соединений формулы (7-2).
Схема 12
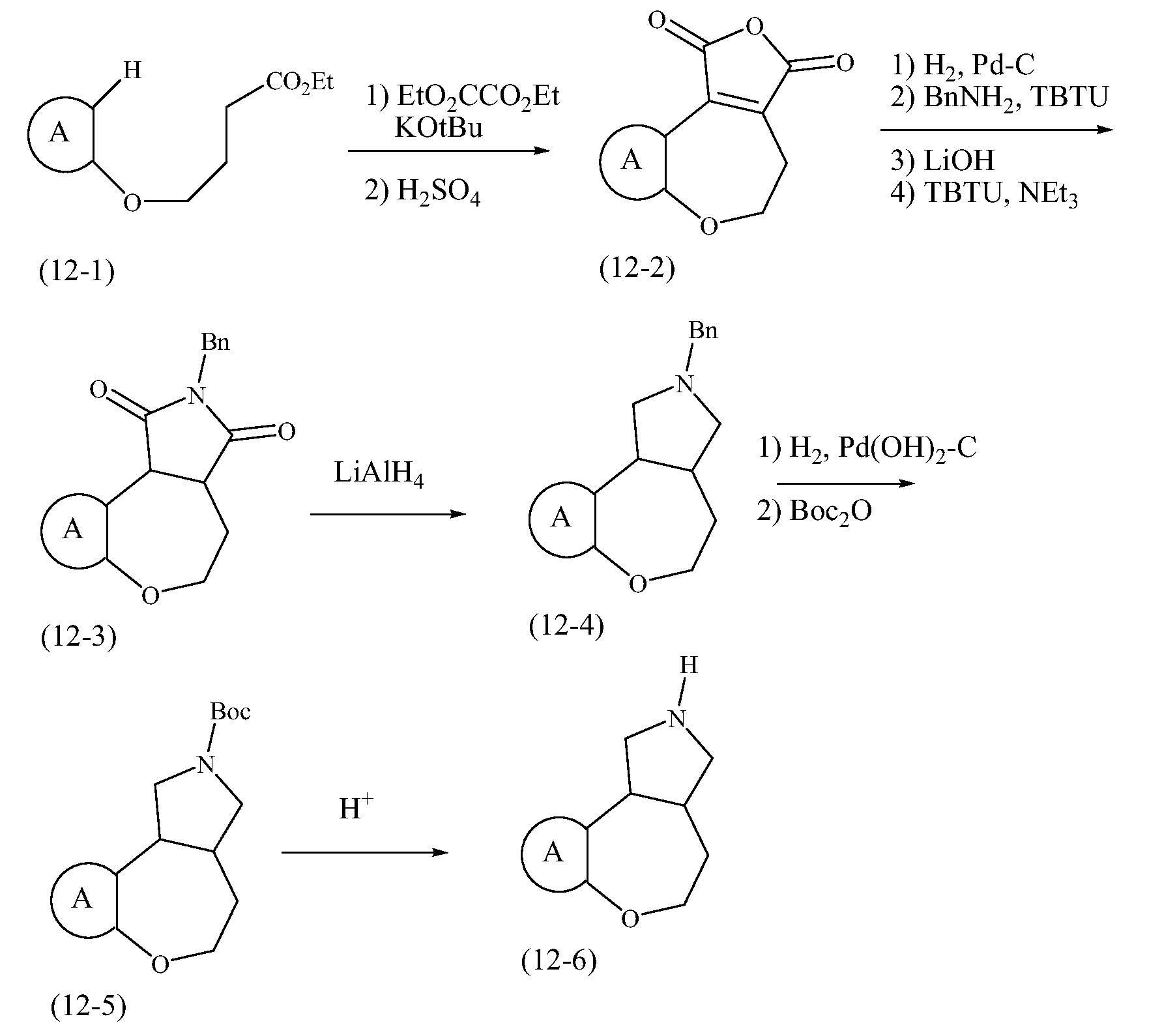
Как указано на схеме 12, соединения формул (12-4) и (12-6), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (12-1). Соединения формулы (12-1) могут быть сначала подвергнуты взаимодействию с диэтилоксалатом в присутствии основания, такого как калия трет-бутоксид, при температуре приблизительно 0°C в тетрагидрофуране. Затем промежуточное соединение обрабатывали концентрированной серной кислотой при температуре 0°C с получением соединений формулы (12-2). Соединения формулы (12-2) подвергают обработке в последовательных четырех стадиях, что давало соединения формулы (12-3). Сначала соединения формулы (12-2) обрабатывают водородом (30 фунтов на квадратный дюйм) в присутствии 5%-го палладия-на-углероде в подогреваемом метаноле. После обработки вещество помещают в N,N-диметилформамид и обрабатывают бензиламином в присутствии триэтиламина и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторбората. Вновь после обработки вещество обрабатывают гидроксидом лития в смеси растворителей, таких как метанол и вода, в течение от 2 до 6 часов. В заключение, вещество помещают в подогреваемый N,N-диметилформамид и обрабатывают O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборатом в присутствии триэтиламина, что давало соединения формулы (12-3). Соединения формулы (12-3) могут быть восстановлены с помощью литийалюминийгидрида в течение от 8 до 24 часов в тетрагидрофуране, что давало соединения формулы (12-4). Соединения формулы (12-4) могут быть восстановлены с помощью водорода (30 фунтов на квадратный дюйм) в присутствии гидроксида палладия-на-углероде в растворителе, таком как подогреваемый трифторэтанол. Последовательная обработка ди-трет-бутил дикарбонатом в дихлорметане дает соединения формулы (12-5). Соединения формулы (12-5) могут быть обработаны хлористоводородной кислотой в диоксане или трифторуксусной кислотой в дихлорметане при комнатной температуре с получением соединений формулы (12-6).
Схема 13
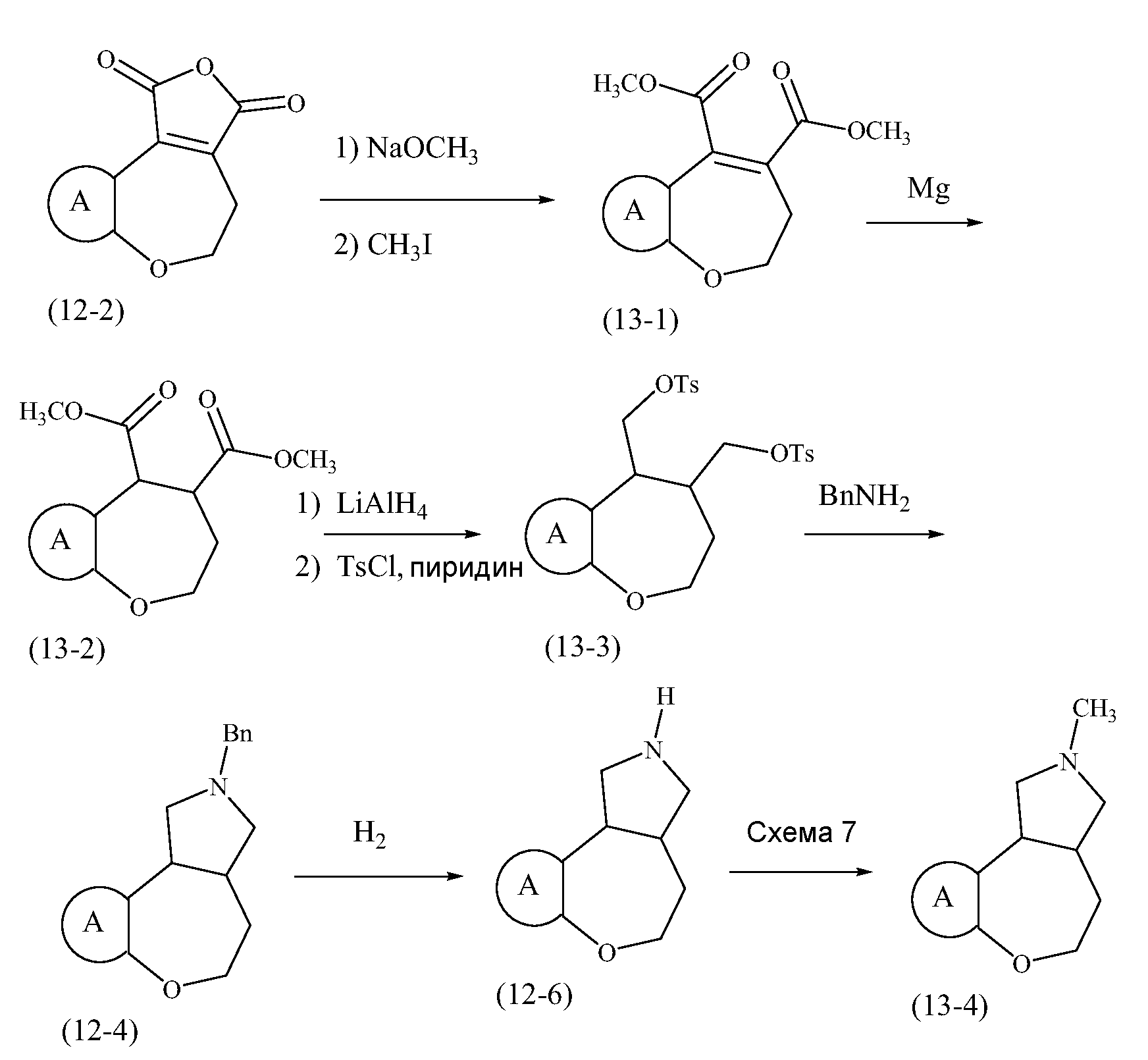
Как указано на схеме 13, соединения формулы (12-4), (12-6) и (13-4), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (12-2). Соединения формулы (12-2) могут быть обработаны последовательно метоксидом натрия в метаноле и затем йодметаном в N,N-диметилформамиде с высвобождением соединений формулы (13-1). Соединения формулы (13-1) могут быть восстановлены в присутствии магниевой стружки в метаноле, что давало соединения формулы (13-2). Сложноэфирные группы в соединениях формулы (13-2) могут быть восстановлены с помощью литийалюминийгидрида и промежуточные спирты сульфонилированы с помощью п-толуолсульфонилхлорида в присутствии пиридина, что давало соединения формулы (13-3). Соединения формулы (13-3) могут быть обработаны бензиламином в присутствии основания, такого как триэтиламин, в необязательно нагреваемом N,N-диметилформамиде, что давало соединения формулы (12-4). Соединения формулы (12-4) могут быть обработаны водородом в присутствии катализатора, такого как гидроксид палладия-на-углероде, что давало соединения формулы (12-6). Соединения формулы (12-6) могут быть алкилированы, как указано на схеме 7, что давало соединения формулы (13-4).
Схема 14
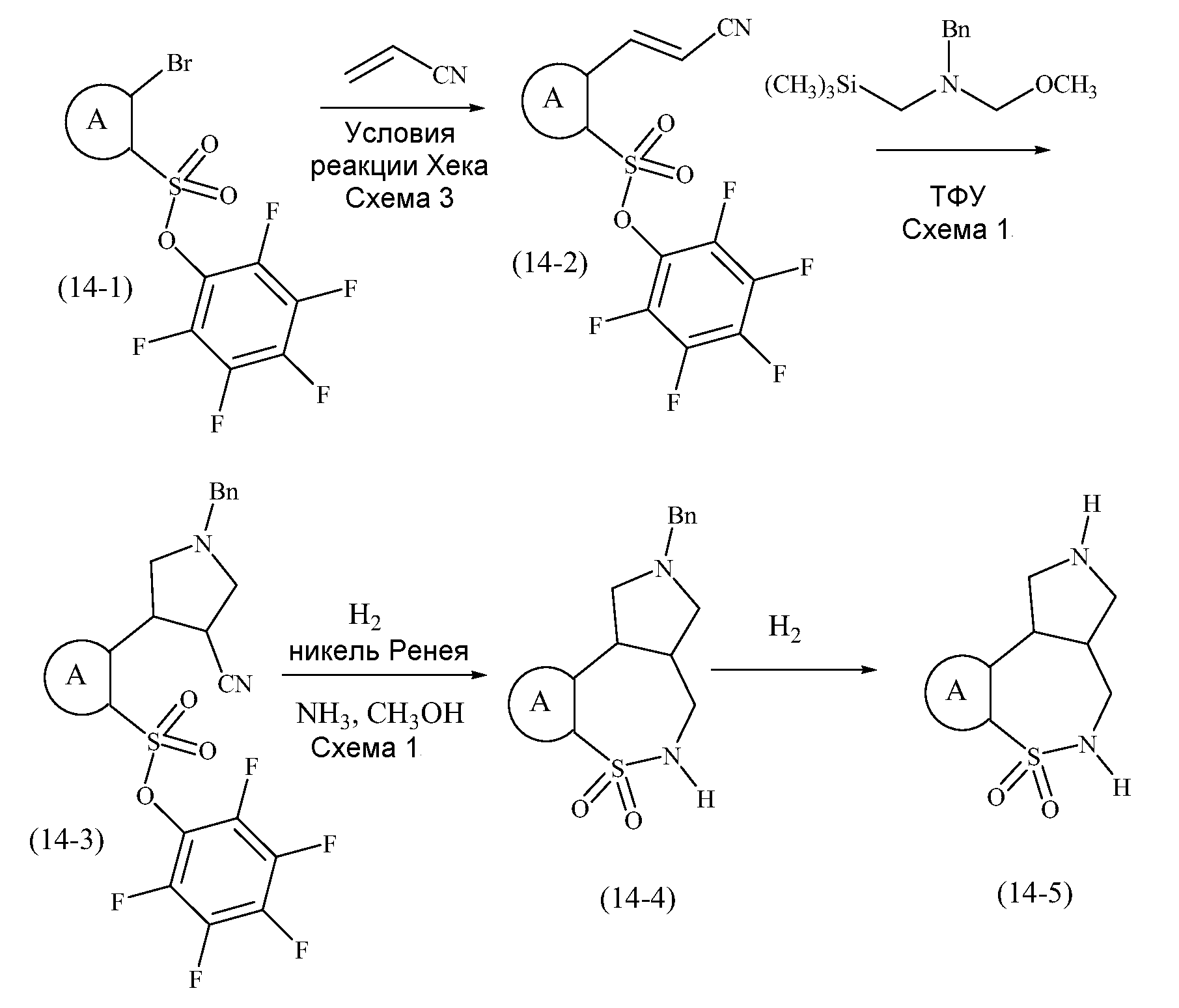
Как указано на схеме 14, соединения формул (14-4) и (14-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (14-1). Соединения формулы (14-1) могут быть обработаны акрилонитрилом в условиях реакции Хека, указанных на схеме 3, получением соединений формулы (14-2). Соединения формулы (14-2) затем могут быть обработаны N-бензил-1-метокси-N-((триметилсилил)метил)метанамином, как указано на схеме 1, что давало соединения формулы (14-3). Нитрильная группа соединений формулы (14-3) может быть восстановлена с помощью водорода в присутствии никеля Ренея®, как указано на схеме 1, с получением сульфонамидов формулы (14-4). Бензильная группа соединений формулы (14-4) может быть удалена с получением соединений формулы (14-5) с использованием условий для удаления бензильной группы, указанных на схеме 1.
Схема 15
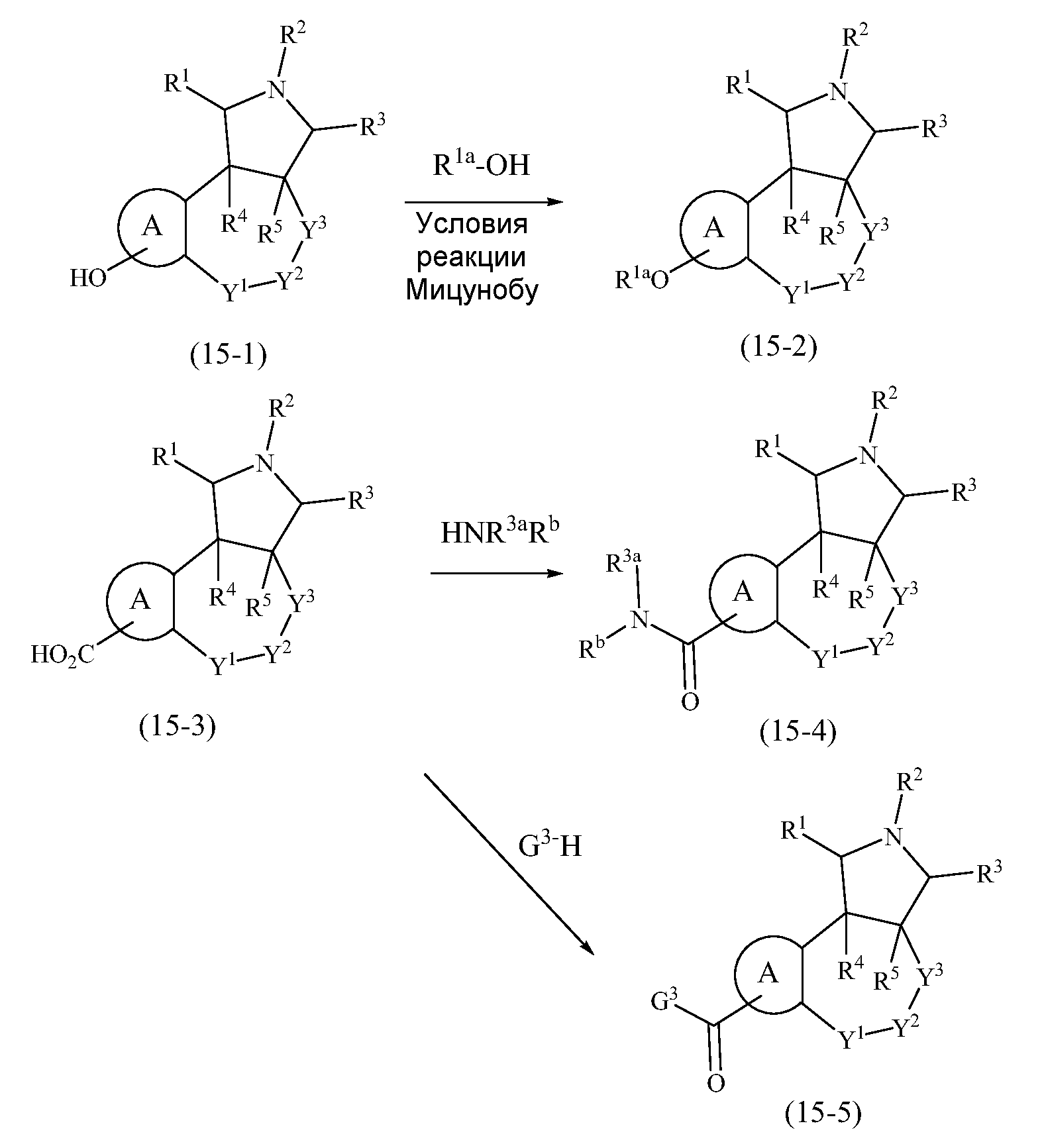
Как указано на схеме 15, соединения формулы (15-2), где R1, R2, R3, R4, R5, R1a, A, Y1, Y2 и Y3 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (15-1). Соединения формулы (15-1) могут быть обработаны спиртом, R1a-OH, в присутствии азодикарбоксилата, такого как ди-трет-бутил азодикарбоксилат (DBAD) и трифенилфосфин, которые необязательно могут быть на полимерных подложках, в растворителе, таком как тетрагидрофуран, что давало соединения формулы (15-2).
Также, как указано на схеме 15, соединения формулы (15-4) и формулы (15-5), где R1, R2, R3, R4, R5, Rb, R3a, A, G3, Y1, Y2 и Y3 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (15-3). Соединения формулы (15-3) могут быть связаны с амином, HNR3aRb, или азотсодержащим гетероциклом, G3-H, в условиях образования амидной связи с получением соединений формулы (15-4) и формулы (15-5), соответственно. Примеры условий, которые известны для образования амидов, исходя из смеси карбоновой кислоты и амина или азотсодержащего гетероцикла включают, но этим не ограничиваются, добавление конденсирующего агента, такого как, но этим не ограничивается, гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI, EDAC), 1,3-дициклогексилкарбодиимид (DCC), хлорангидрида бис(2-оксо-3-оксазолидинил)фосфиновой кислоты (BOPCl), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфата (HATU), 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоуроний тетрафторборат (TBTU). Конденсирующие средства могут быть добавлены в виде твердого продукта, раствора или реагента, присоединенного к твердой смоле подложки. Помимо конденсирующего агента, вспомогательные конденсирующие агенты могут способствовать реакции конденсации. Вспомогательные конденсирующие агенты, которые часто используются в реакциях конденсации, включают, но этим не ограничиваются, 4-диметиламинопиридин (DMAP), 1-гидрокси-7-азабензотриазол (HOAT) и 1-гидроксибензотриазол (HOBT). Реакция конденсации может быть осуществлена в присутствии основания, такого как триэтиламин или диизопропилэтиламин. Реакция конденсации может быть осуществлена в растворителях, таких как, но этим не ограничивается, тетрагидрофуран, N,N,-диметилформамид, пиридин и этилацетат или их сочетание. Взаимодействие может быть осуществлено при температуре окружающей среды или при повышенной температуре.
Альтернативно, соединения формулы (15-4) и формулы (15-5) могут быть получены из соединения формулы (15-3) сначала путем преобразования (15-3) в соответствующий хлорангидрид кислоты. Хлорангидрид кислоты обычно может быть получен путем суспендирования карбоновой кислоты (15-3) в растворителе, таком как дихлорметан, и затем добавления оксалилхлорида и каталитического количества N,N-диметилформамида. Растворитель может быть удален путем упаривания, и хлорангидрид кислоты вновь растворяли в растворителе, таком как тетрагидрофуран или пиридин. Добавление амина, HNR3aRb, или азотсодержащего гетероцикла, G3-H, в присутствии основания Ханига (Hunig) будет приводить к соединениям формулы (15-4) или формулы (15-5), соответственно. Взаимодействие может быть осуществлено при температуре окружающей среды или при повышенной температуре в течение периода от нескольких часов до нескольких дней.
Схема 16
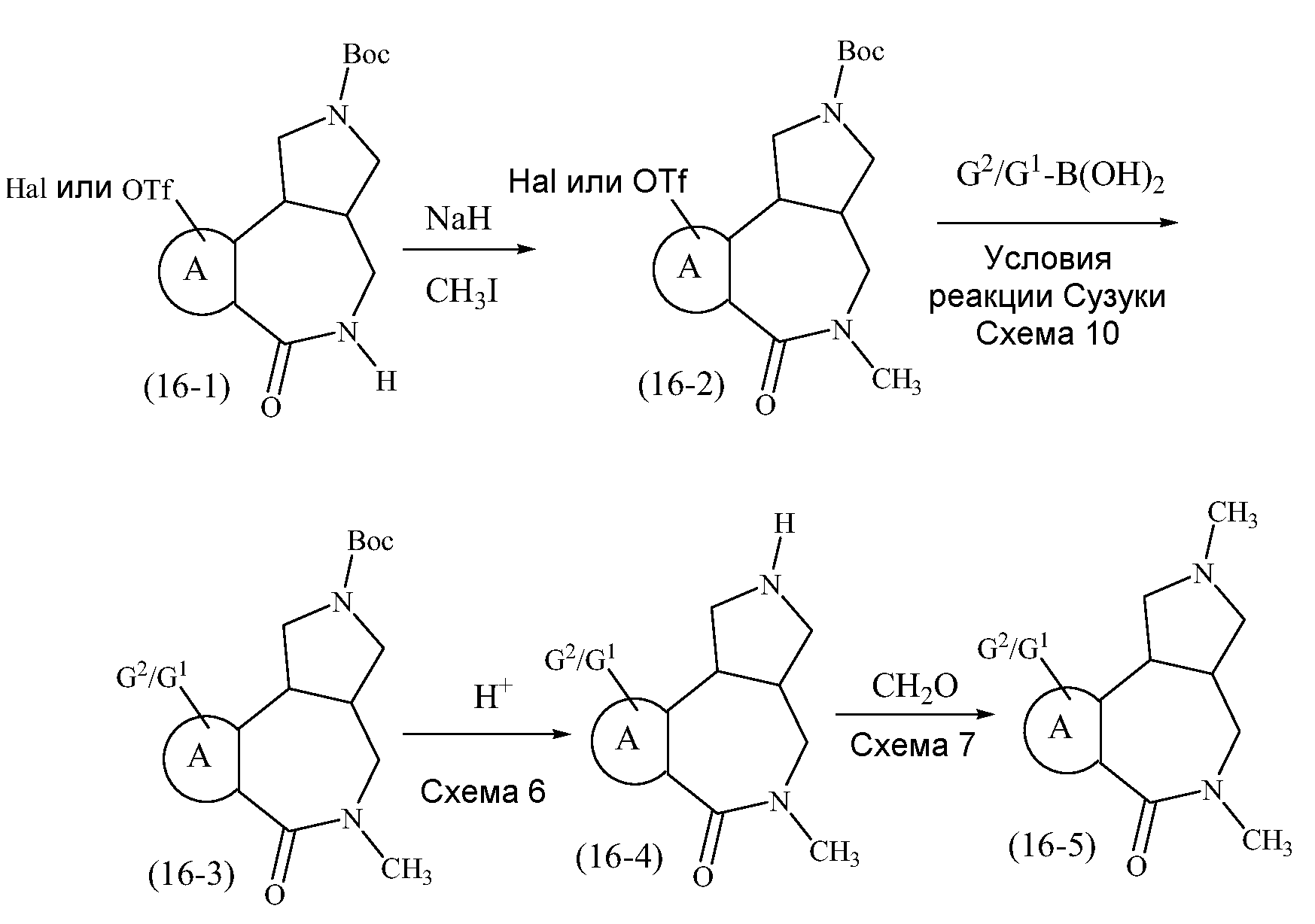
Как указано на схеме 16, соединения формулы (16-4) и формулы (16-5), где A, G1 и G2 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (16-1). Соединения формулы (16-1), где Hal представляет собой хлор, бром или йод, и OTf представляет собой трифторметансульфонат, могут быть обработаны йодметаном в присутствии гидрида натрия в растворителе, таком как N,N-диметилформамид, что давало соединения формулы (16-2). Соединения формулы (16-2) могут быть подвергнуты взаимодействию с бороновыми кислотами, G1-B(OH)2, G2-B(OH)2, или соответствующими боронатами, или диоксабороланами в условиях реакции Сузуки, как указано на схеме 10, что давало соединение формулы (16-3). трет-Бутоксикарбонильная группа в соединениях формулы (16-3) может быть удалена в кислотных условиях, как указано на схеме 6, с получением соединений формулы (16-4). Пирролидиновый азот в соединениях формулы (16-4) может быть восстановительно алкилирован, как указано на схеме 7, с получением соединений формулы (16-5).
Схема 17
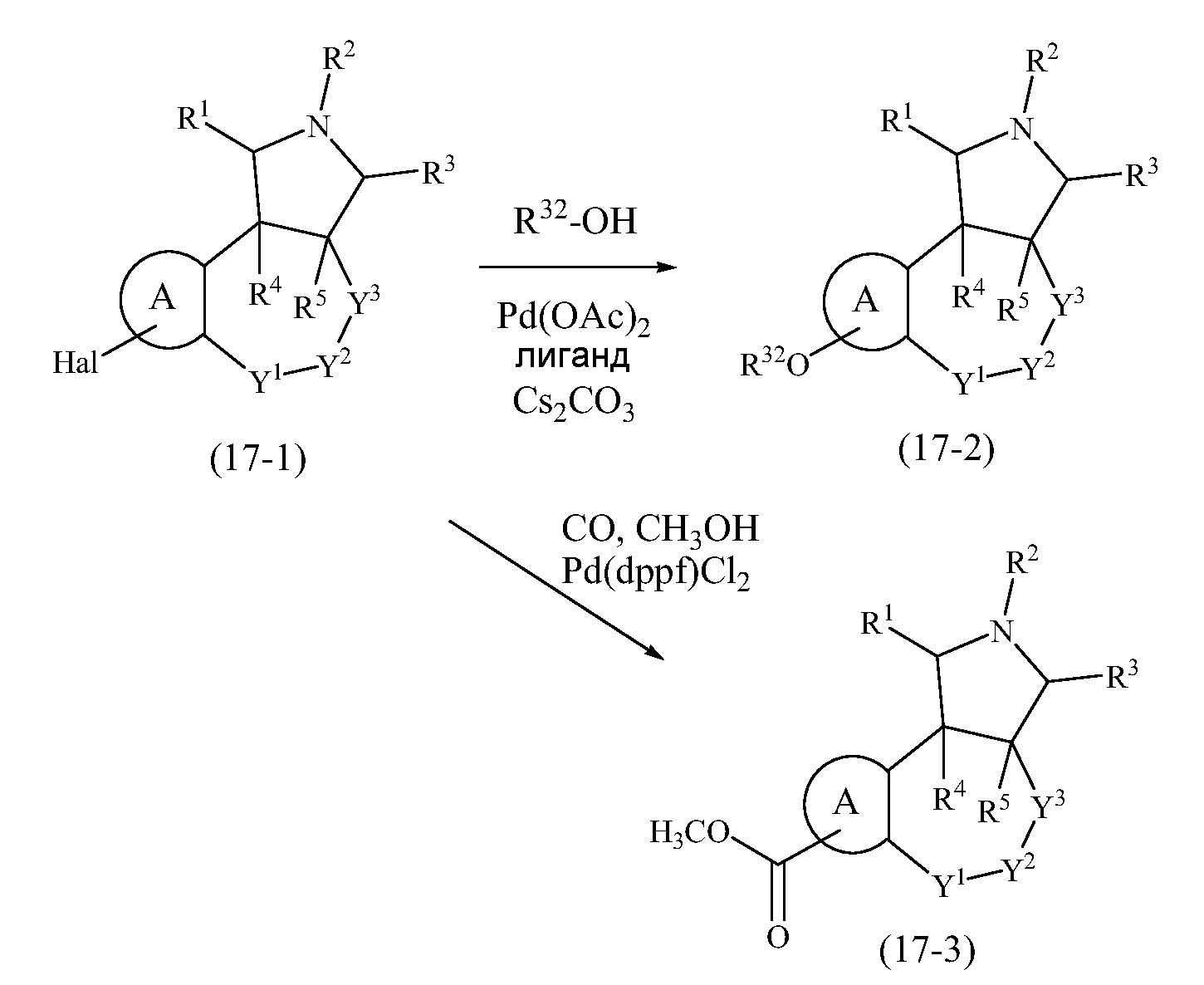
Как указано на схеме 17, соединения формулы (17-2); где R1, R2, R3, R4, R5, A, Y1, Y2 и Y3 имеют значения, определенные в описании изобретения, и R32 представляет собой алкил, G1, -(CR4aR5a)m-G1, G2 или -(CR4aR5a)m-G2, где G1, G2, R4a, R5a и m имеют значения, определенные в описании изобретения; которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (17-1). Соединения формулы (17-1), где Hal представляет собой хлор, бром или йод, могут быть обработаны спиртами или фенолами, R32-OH, в присутствии ацетата палладия(II), лиганда, такого как 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенил, основания, такого как карбонат цезия, и в нагреваемом растворителе, таком как толуол, в инертной атмосфере, что давало соединения формулы (17-2). Соединения формулы (17-2) являются представительными соединениями формулы (I). Соединения формулы (17-1) могут быть подвергнуты взаимодействию с монооксидом углерода в присутствии метанола и катализатора, такого как [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), что давало соединение формулы (17-3). Соединения формулы (17-3) являются представительными соединениями формулы (I).
Схема 18
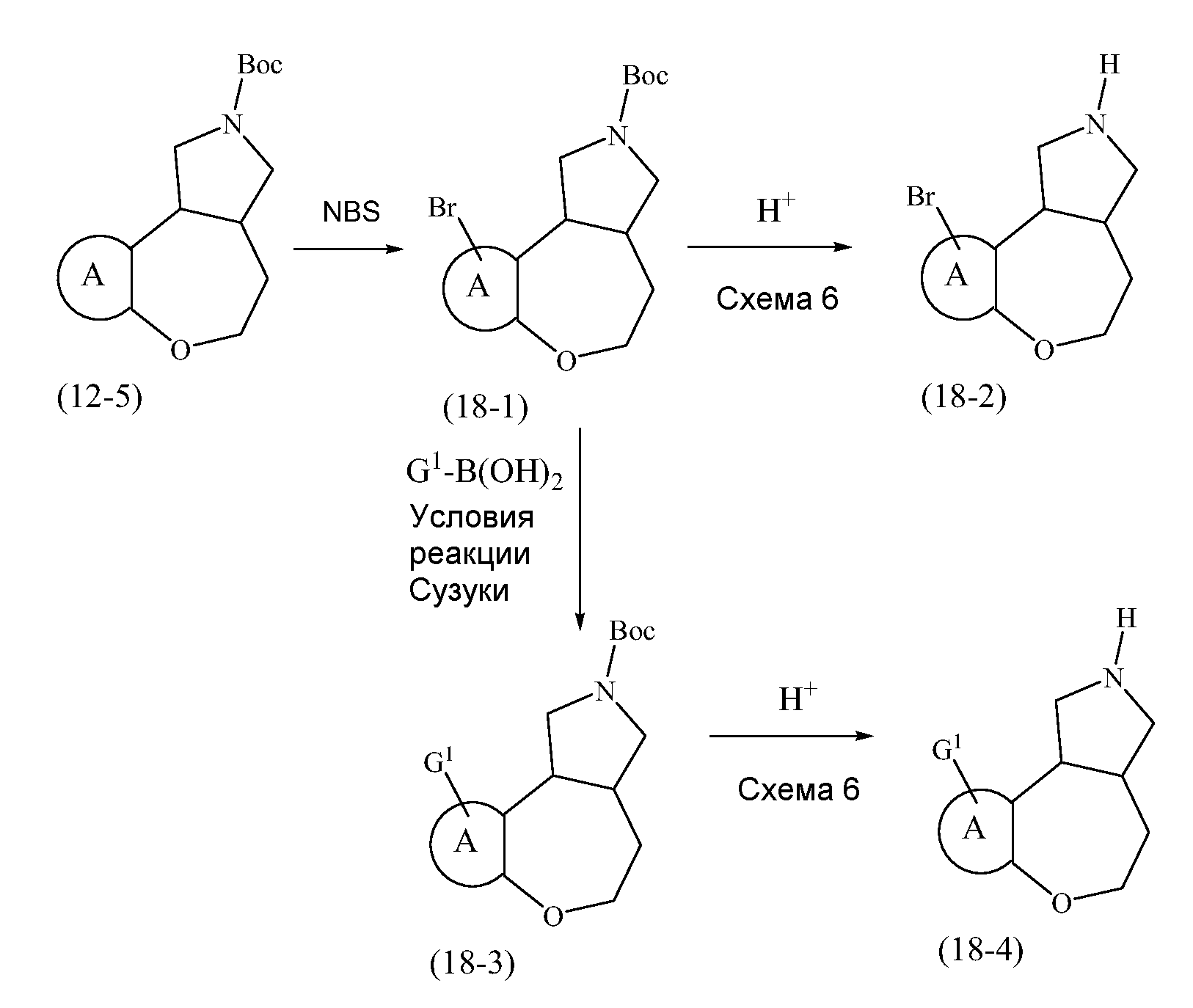
Как указано на схеме 18, соединения формулы (18-2) и формулы (18-4); где A и G1 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (12-5). Соединения формулы (12-5) могут быть обработаны N-бромсукцинимидом (NBS) в нагреваемом N,N-диметилформамиде с получением соединений формулы (18-1). Соединения формулы (18-1) могут быть обработаны в кислотных условиях, описанных на схеме 6, что давало соединения формулы (18-2). Соединения формулы (18-1) могут быть подвергнуты взаимодействию с бороновыми кислотами, G1-B(OH)2, или соответствующими боронатами или диоксабороланами в условиях реакции Сузуки, как указано на схеме 10, что давало соединения формулы (18-3). Нагревание по реакции Сузуки может осуществляться либо обычным способом, либо с помощью воздействия микроволнового излучения. Соединения формулы (18-3) также могут быть получены исходя из аналогов соединений формулы (18-1), где бром заменен хлором, йодом или трифлатом. Соединения формулы (18-3) могут быть обработаны в кислотных условиях, описанных на схеме 6, что давало соединения формулы (18-4). Соединения формулы (18-2) и формулы (18-4) являются представительными соединениями формулы (I).
Схема 19
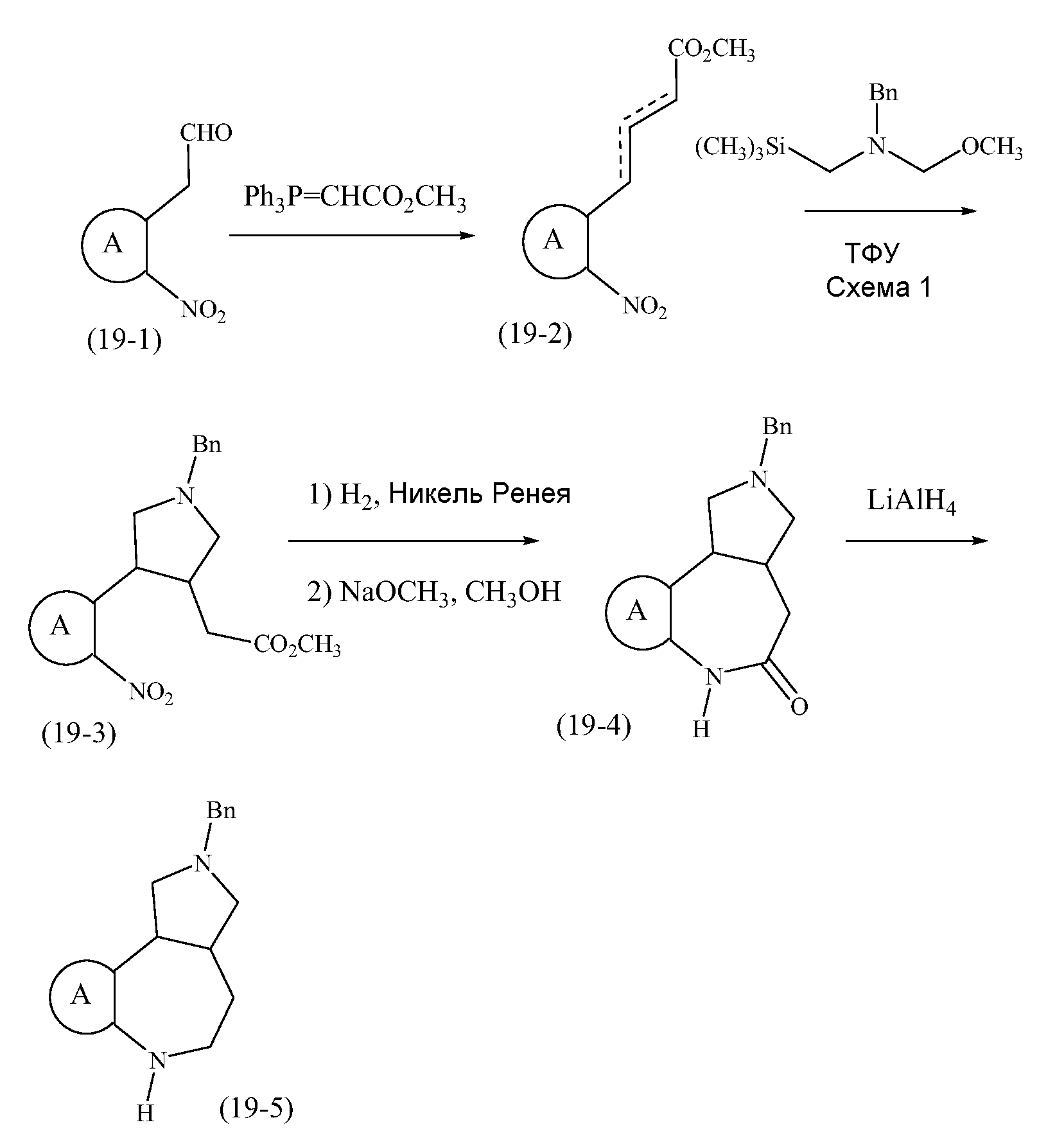
Как указано на схеме 19, соединения формулы (19-4) и формулы (19-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (19-1). Соединения формулы (19-1) могут быть обработаны метоксилкарбонилметилентрифенилфосфораном в необязательно нагретом толуоле, что давало соединения формулы (19-2). Соединения формулы (19-2) могут быть подвергнуты взаимодействию с N-бензил-1-метокси-N-((триметилсилил)метил)метанамином, как указано на схеме 1, что давало соединения формулы (19-3). Обработка соединений (19-3) водородом в присутствии никеля Ренея® восстанавливает нитрогруппу до соответствующего амина. Циклизация достигается путем последующей обработки с помощью основания, такого как метоксид натрия, в необязательно нагретом метаноле с получением соединений формулы (19-4). Соединения формулы (19-4) могут быть восстановлены с помощью реагента, такого как литийалюминийгидрид, что давало соединения формулы (19-5).
Схема 20
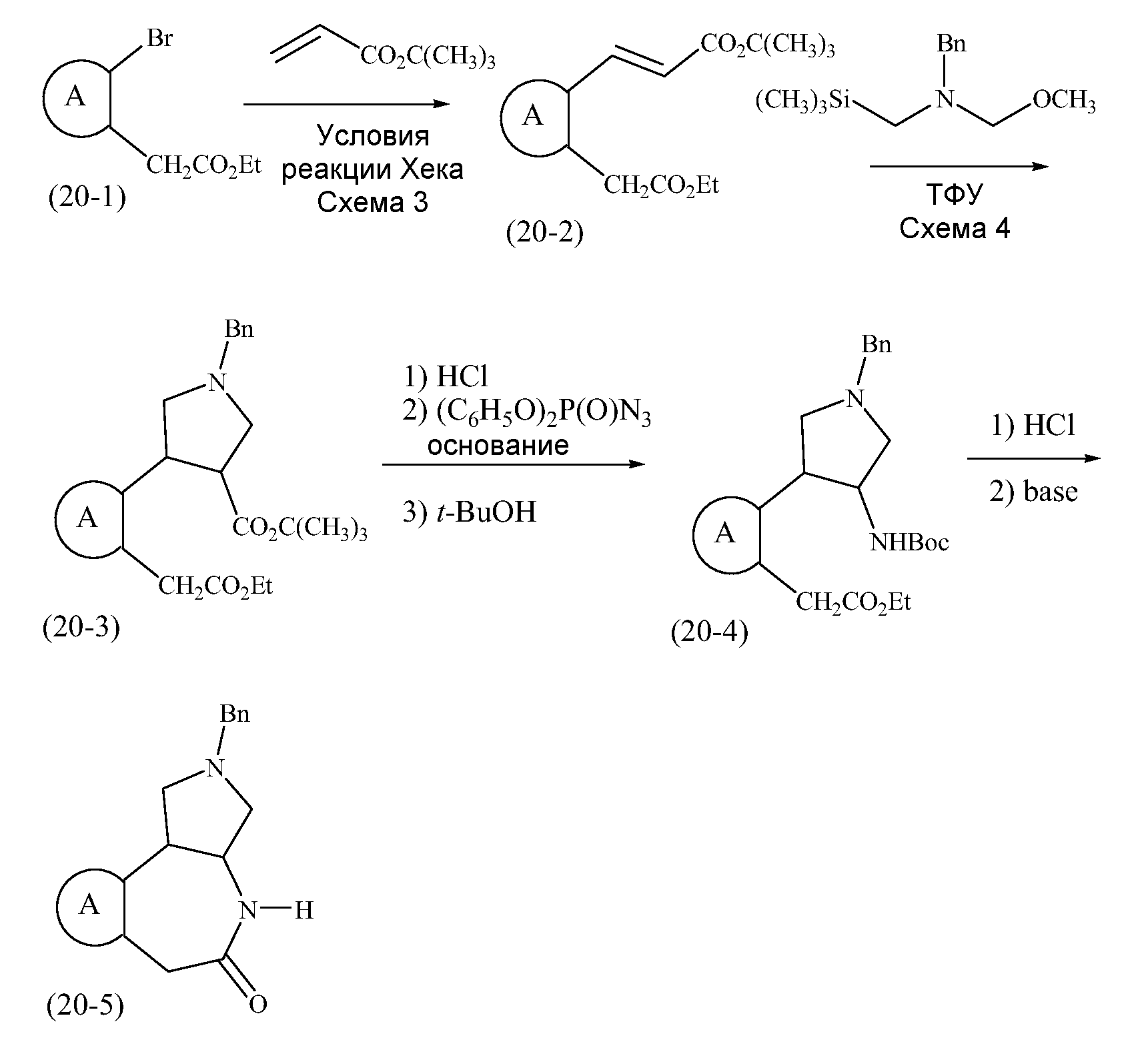
Как указано на схеме 20, соединения формулы (20-5), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (20-1). Соединения формулы (20-1) могут быть обработаны трет-бутилакрилатом в условиях реакции Хека, как указано на схеме 3, с получением соединений формулы (20-2). Соединения формулы (20-2) могут быть подвергнуты взаимодействию с N-бензил-1-метокси-N-((триметилсилил)метил)метанамином, как указано на схеме 4, что давало соединения формулы (20-3). Соединения формулы (20-3) могут быть обработаны кислотой, такой как хлористоводородная кислота или трифторуксусная кислота, с целью селективного отщепления трет-бутилового эфира. Обработка образовавшейся карбоновой кислоты дифенилфосфорилазидом в присутствии основания, такого как триэтиламин, дает соответствующий ацилазид. Обработка ацилазида трет-бутанолом в нагреваемом толуоле дает карбаматы формулы (20-4). Удаление трет-бутоксикарбонильной группы в кислотных условиях подобно используемым для отщепления трет-бутилового эфира с последующей обработкой с помощью основания, такого как метоксид натрия, в метаноле приводит к циклизации соединений формулы (20-5).
Схема 21
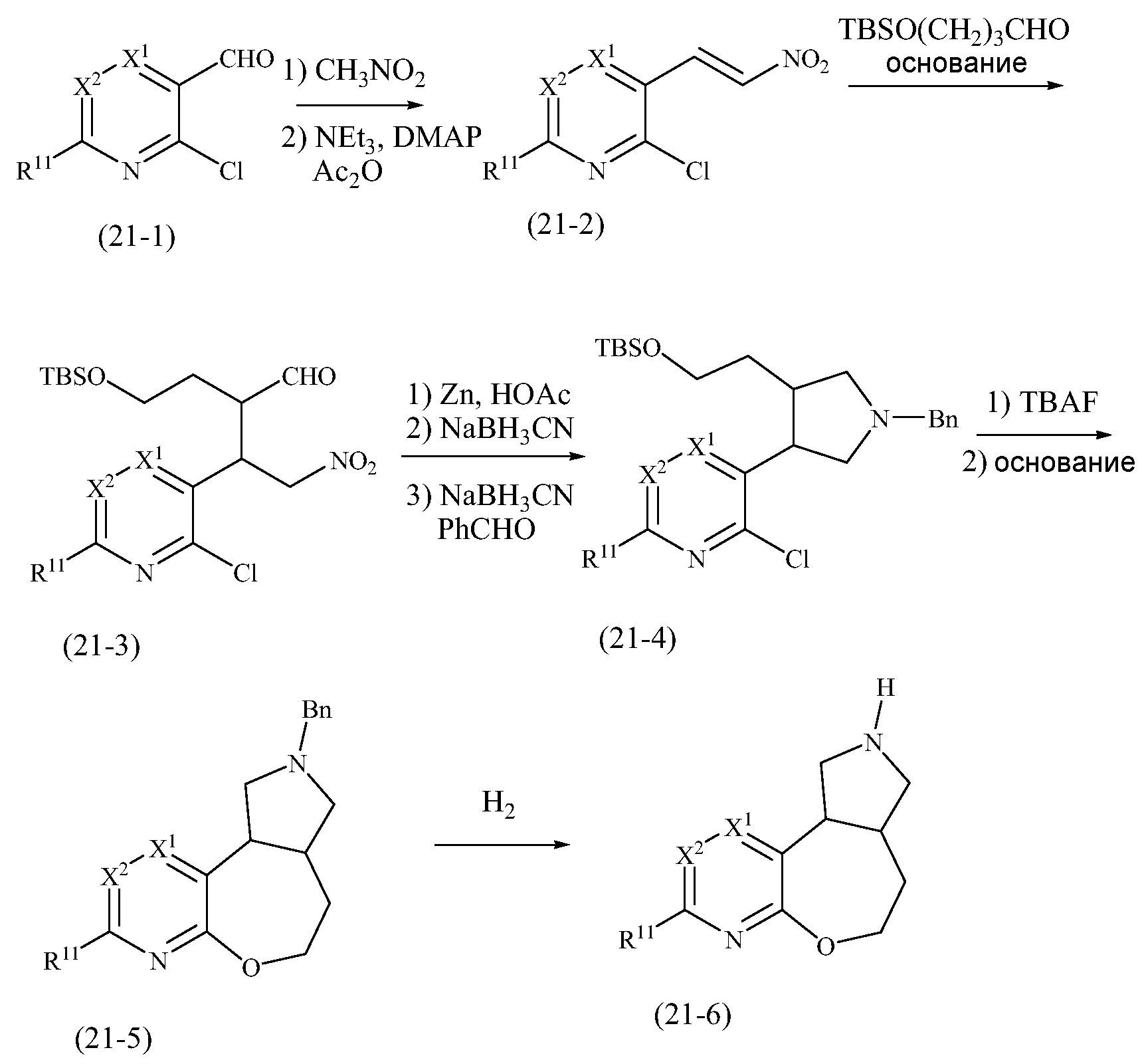
Как показано на схеме 21, соединения формулы (21-5) и формулы (21-6), где R11, X1 и X2 имеют значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (21-1). Соединения формулы (21-1) могут быть обработаны нитрометаном в присутствии гидрохлорида этиламина и гидроксида натрия в этаноле. Последующая обработка уксусным ангидридом в присутствии 4-(диметиламино)пиридина и триэтиламина дает соединения формулы (21-2). Соединения формулы (21-2) могут быть подвергнуты взаимодействию с 4-(трет-бутилдиметилсилилокси)бутаналем в присутствии основания, такого как пиперидин, дает соединения формулы (21-3). Соединения формулы (21-3) могут быть обработаны цинком в присутствии уксусной кислоты для восстановления нитрогруппы одновременно с циклизацией альдегидной группы. Восстановление промежуточного пирролидиния с помощью цианоборгидрида натрия дает пирролидиновую группу. Восстановительное алкилирование с помощью бензальдегида в присутствии цианоборгидрида натрия дает соединения формулы (21-4). Обработка соединений формулы (21-4) тетрабутиламмонийфторидом приводит к удалению силилокси защитной группы. Обработка образовавшейся спиртовой функциональной группы основанием, таким как трет-бутоксид калия, приводит к циклизации соединений формулы (21-5). Воздействие соединений формулы (21-5) водородом и катализатором, таким как гидроксид палладия, дает соединения формулы (21-6).
Схема 22
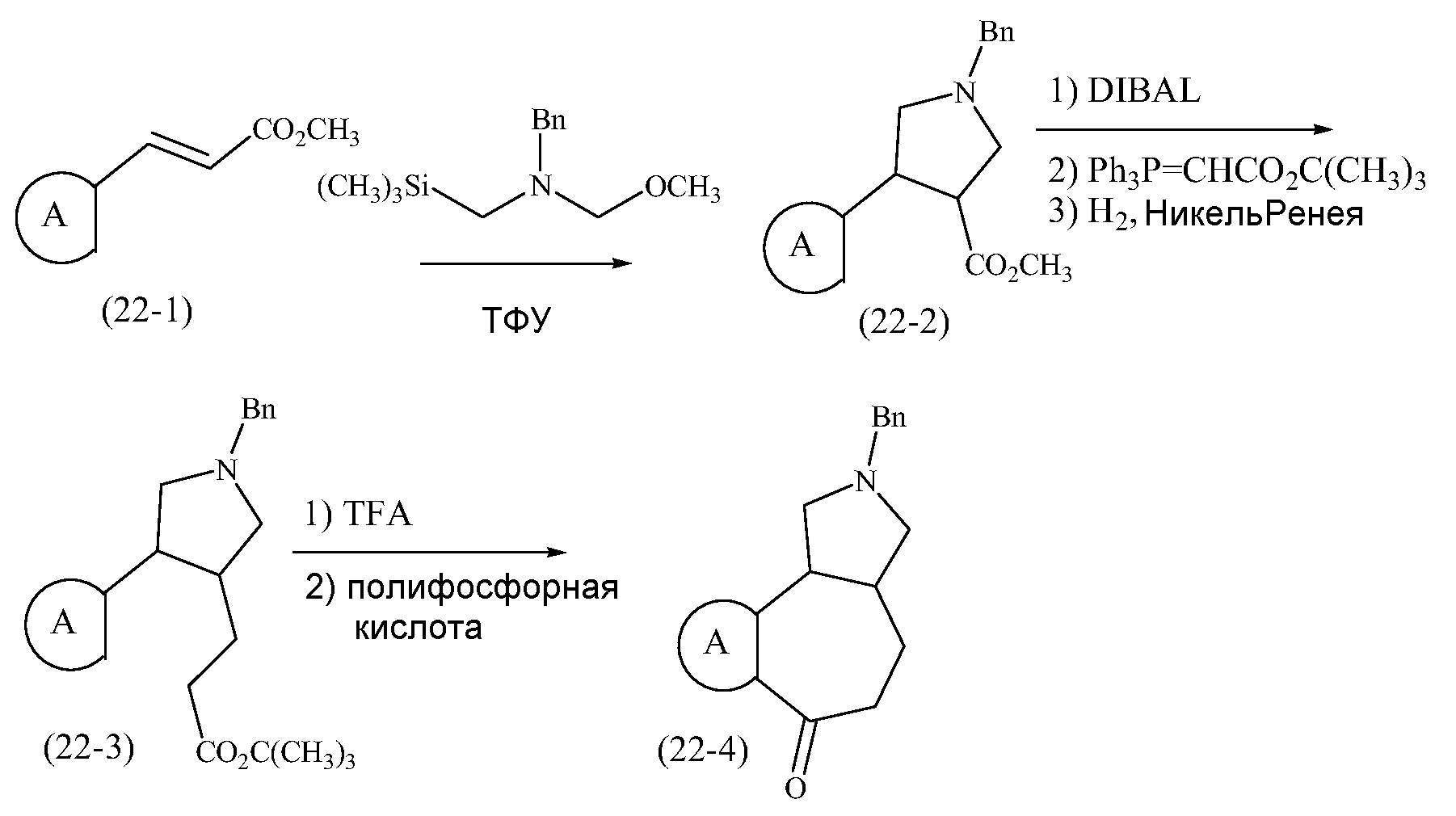
Как показано на схеме 22, соединения формулы (22-4), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (22-1). Соединения формулы (22-1) могут быть обработаны N-бензил-1-метокси-N-((триметилсилил)метил)метанамином, как указано на схеме 4, что давало соединения формулы (22-2). Соединения формулы (22-2) могут быть обработаны сначала диизобутилалюминийгидридом в толуоле с получением соответствующего альдегида. Затем альдегид может быть обработан трет-бутоксилкарбонилметилентрифенилфосфораном в нагреваемом толуоле. Полученный ненасыщенный сложный эфир далее может быть гидрирован в присутствии никеля Ренея®, что давало соединения формулы (22-3). Соединения формулы (22-3) затем могут быть подвергнуты взаимодействию с кислотой, такой как трифторуксусная кислота в метиленхлориде или хлористоводородная кислота в диоксане, с отщеплением трет-бутилового эфира с образованием карбоновой кислоты. Карбоновая кислота затем может быть обработана нагреваемой полифосфорной кислотой для индуцирования циклизации с получением соединений формулы (22-4).
Схема 23
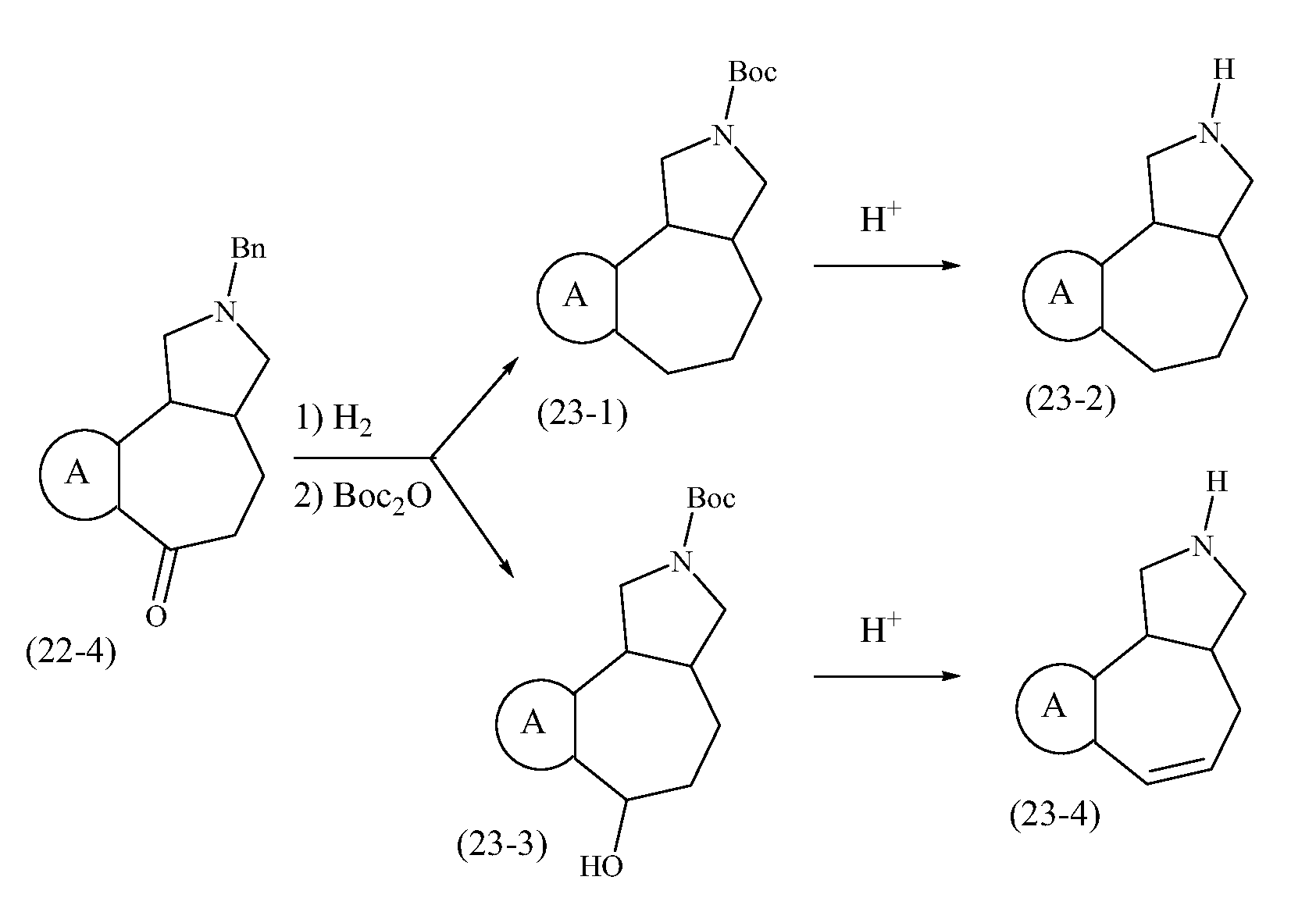
Как показано на схеме 23, соединения формулы (23-2) и формулы (23-4), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (22-4). Соединения формулы (22-4) могут быть гидрированы в присутствии катализатора, такого как гидроксид палладия-на-углероде, что приводит к восстановлению карбонила до соответствующих метиленовой и спиртовой групп. Обработка ди-трет-бутилдикарбонатом дает соединения формул (23-1) и (23-3). Соединения формулы (23-1) и формулы (23-3) затем могут быть подвергнуты взаимодействию с кислотой, такой как трифторуксусная кислота в метиленхлориде или хлористоводородная кислота в диоксане, с целью удаления трет-бутоксикарбонил защитной группы, что давало соединения формулы (23-2) и формулы (23-4), соответственно.
Схема 24
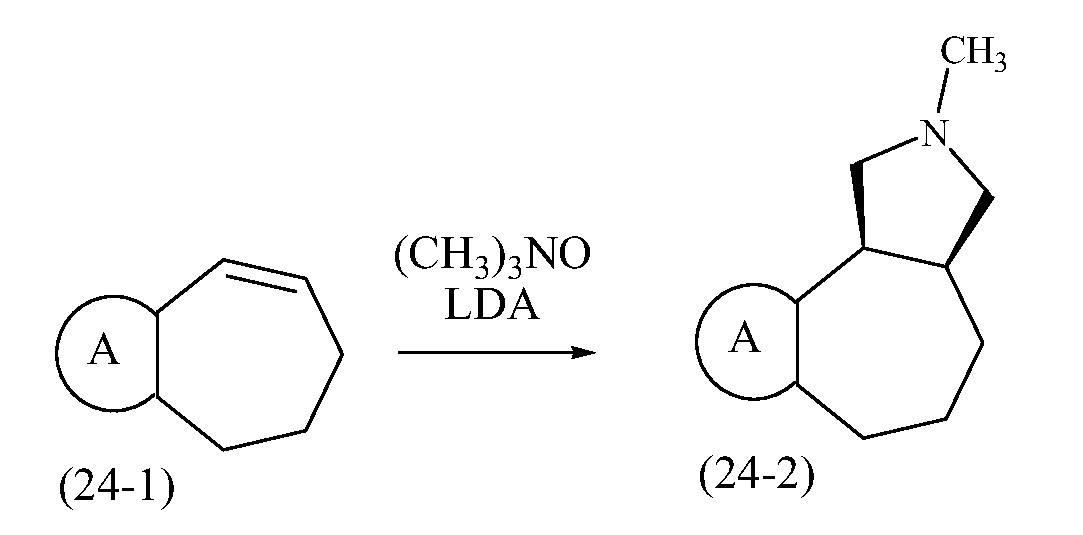
Как показано на схеме 24, соединения формулы (24-2), где A имеет значения, определенные в описании изобретения, которые являются представительными соединениями формулы (I), могут быть получены исходя из соединений формулы (24-1). Соединения формулы (24-1) могут быть обработаны триметиламин оксидом в присутствии литийдиизопропиламида (LDA) сначала при температуре -78°C, затем нагревая и продолжая реакцию при температуре окружающей среды, что давало соединения формулы (24-2).
Схема 25
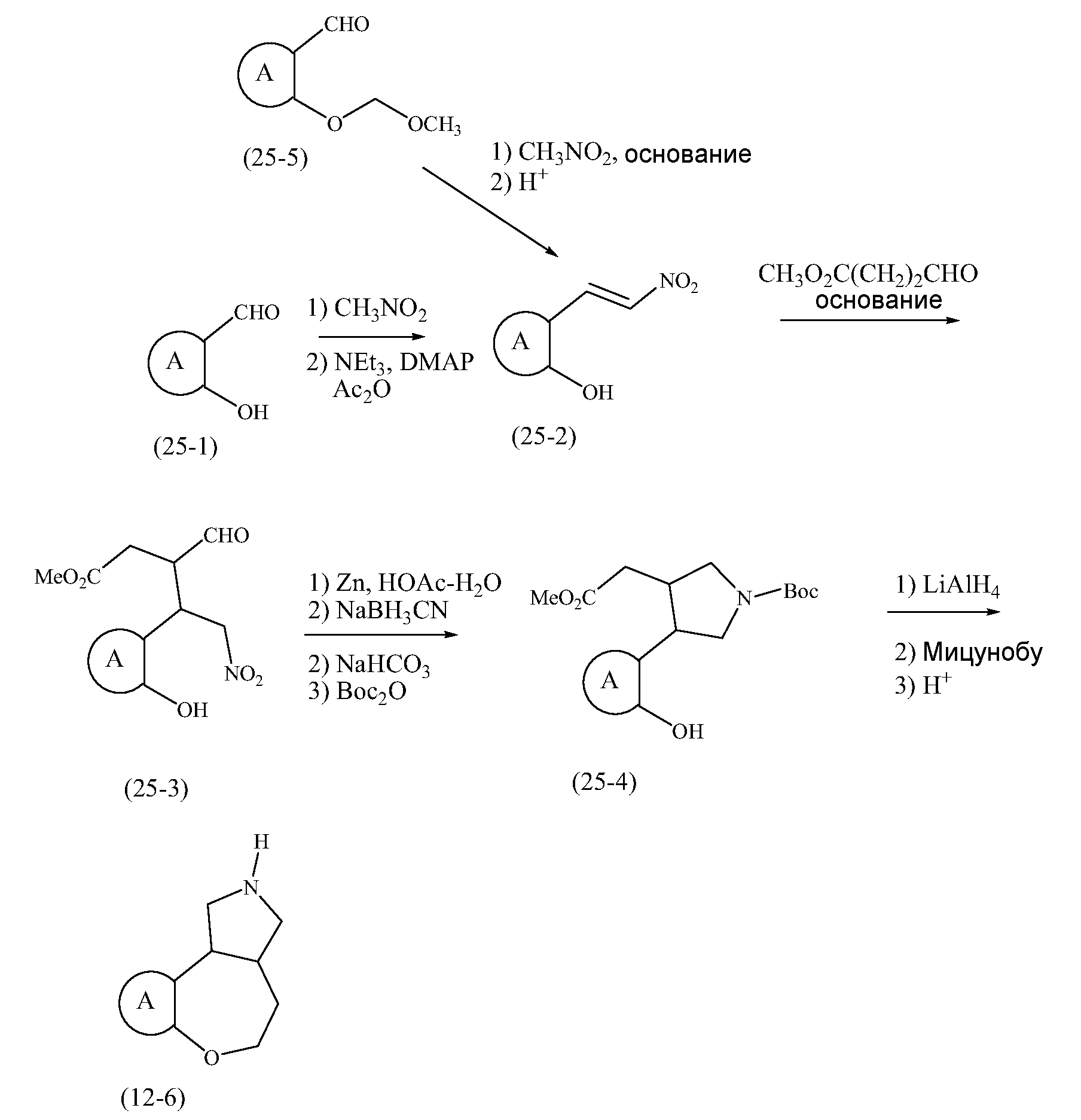
Как показано на схеме 25, соединения формулы (12-6), которые являются представительными соединениями формулы (I), где A имеет значения, описанные в разделе Сущность изобретения, могут быть также получены из соединений формулы (25-1). Соединения формулы (25-1) могут быть обработаны нитрометаном в присутствии гидрохлорида этиламина и гидроксида натрия в этаноле. Последующая обработка уксусным ангидридом в присутствии 4-(диметиламино)пиридина и триэтиламина дает соединения формулы (25-2). Соединения формулы (25-2) также могут быть получены из соединений формулы (25-5). Соединения формулы (25-5) сначала могут быть обработаны нитрометаном в присутствии основания и затем удаляют защитные группы в кислотных условиях, что давало соединения формулы (25-2). Соединения формулы (25-2) могут быть подвергнуты взаимодействию с метил 4-оксобутаноатом в присутствии основания, такого как пиперидин, дают соединения формулы (25-3). Нитрогруппа соединений формулы (25-3) может быть восстановлена с помощью цинка в присутствии уксусной кислоты и воды с последующей циклизацией и восстановлением промежуточного иминия с помощью восстановителя, такого как цианоборгидрид натрия с получением пирролидина. После установления pH равным 8 с помощью основания, такого как бикарбонат натрия, обработка ди-трет-бутилдикарбонатом дает соединения формулы (25-4). Сложноэфирная группа соединений формулы (25-4) может быть восстановлена с помощью литийалюминийгидрида с получением соответствующего спирта. Циклизация до бензоксепинопиррола достигается в условиях реакции Мицунобу. Удаление трет-бутоксикарбонильной группы в кислотных условиях дает соединения формулы (12-6).
Схема 26
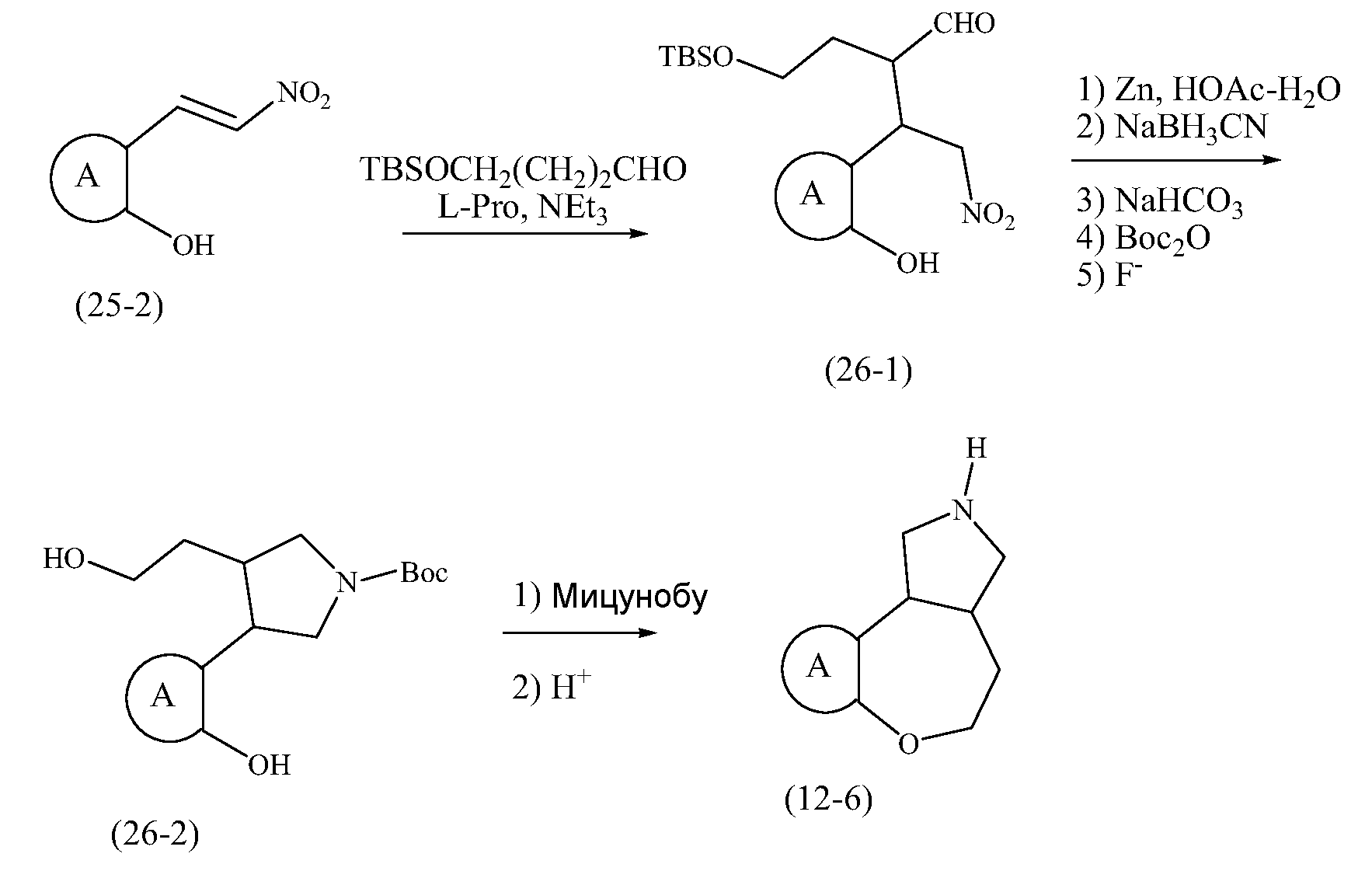
Как показано на схеме 26, соединения формулы (12-6), которые являются представительными соединениями формулы (I), где A имеет значения, описанные в разделе Сущность изобретения, также могут быть получены из соединений формулы (25-2). Соединения формулы (25-2) могут быть подвергнуты взаимодействию с метил 4-(трет-бутилдиметилсилилокси)бутаналем в присутствии триэтиламина и L-пролина, что давало соединения формулы (26-1). Нитрогруппа соединений формулы (26-1) может быть восстановлена с помощью цинка в присутствии уксусной кислоты и воды с последующей циклизацией и восстановлением промежуточного иминия в присутствии восстановителя, такого как цианоборгидрид натрия, с получением пирролидина. После установления pH равным 8 с помощью основания, такого как бикарбонат натрия, обработка ди-трет-бутилдикарбонатом позволяет ввести трет-бутоксикарбонил защитную группу на азот пирролидина. Удаление силильной эфирной защитной группы с помощью источника фтора, такого как тетрабутиламмонийфторид, дает соединения формулы (26-2). Циклизация до бензоксепинопиррола достигается в условиях реакции Мицунобу. Удаление трет-бутоксикарбонильной группы в кислотных условиях дает соединения формулы (12-6).
Схема 27
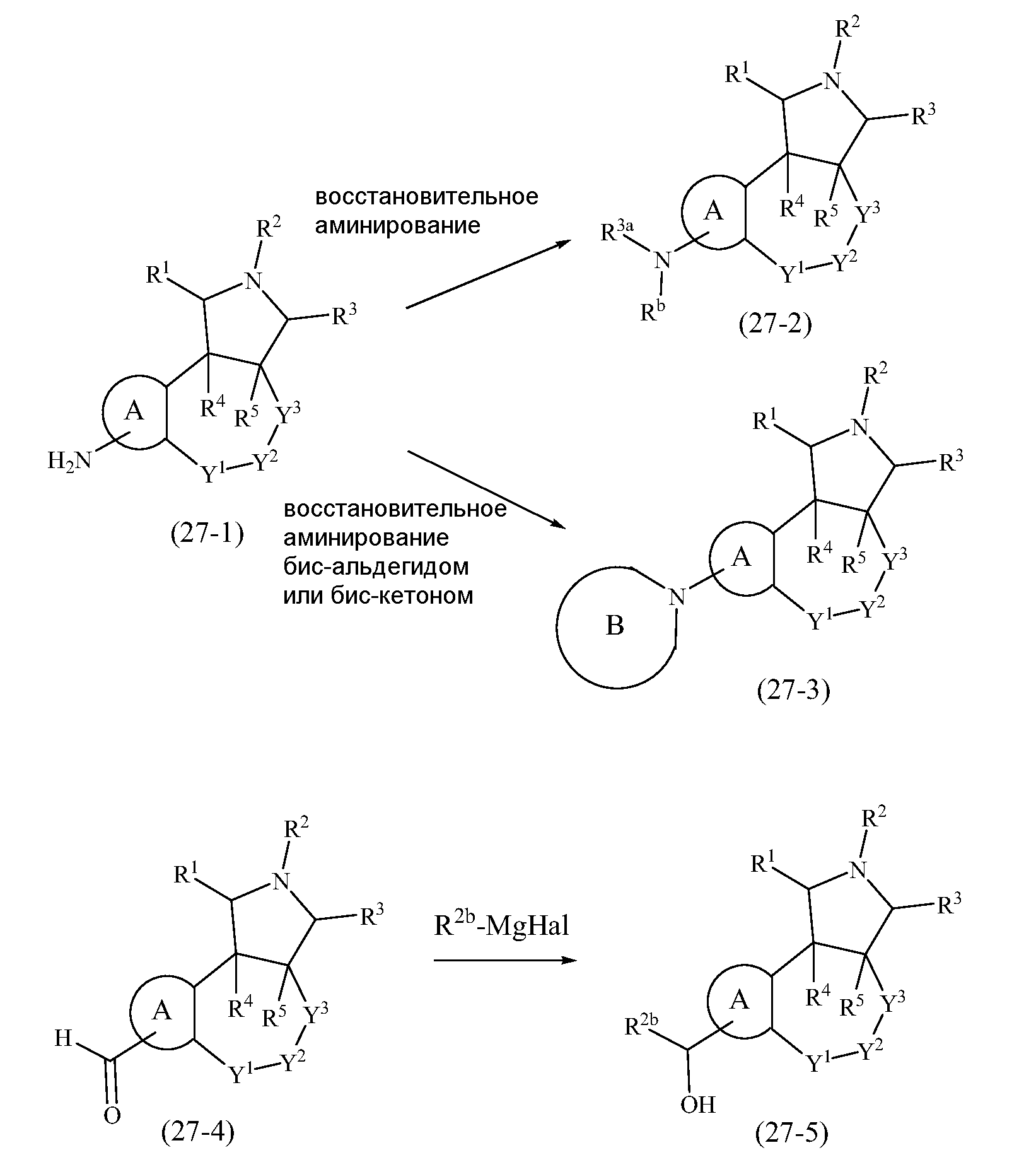
Как показано на схеме 27, соединения формул (27-2) и (27-3), которые являются представительными соединениями формулы (I), где A, R1, R2, R3, R4, R5, R3a, Rb, Y1, Y2 и Y3 имеют значения, описанные в разделе Сущность изобретения, могут быть получены из соединений формулы (27-1). Альдегид или кетон может быть подвергнут взаимодействию с соединениями формулы (27-1) в условиях восстановительного аминирования, что давало соединения формулы (27-2). Условия восстановительного аминирования включают обработку цианоборгидридом натрия или присоединенным к смоле эквивалентом в присутствии кислоты, такой как уксусная кислота, в необязательно нагреваемом растворителе, таком как этанол. В соединениях формулы (27-2) по меньшей мере один из R3a и Rb является иным, чем водород, и R3a является иным, чем G1, где R3a, Rb и G1 имеют значения, определенные в описании изобретения. Соединения формулы (27-1) также могут быть подвергнуты взаимодействию с бис-альдегидом или кетоном, что давало соединения формулы (27-3), где B представляет собой необязательно замещенный гетероцикл. Условия реакции для преобразования соединений формулы (27-1) в (27-3) являются такими же, какие используются для преобразования соединений формулы (27-1) в (27-2).
Также, как показано на схеме 27, соединения формулы (27-4) могут быть преобразованы в соединения формулы (27-5), где A, R1, R2, R3, R4, R5, R2b, Y1, Y2 и Y3 имеют значения, описанные в разделе Сущность изобретения. Соединения формулы (27-4) могут быть подвергнуты взаимодействию с реактивом Гриньяра формулы R2b-MgHal, где R2b имеет значения, описанные в разделе Сущность изобретения, и Hal представляет собой хлор, бром или йод. Реакционную смесь можно необязательно охлаждать до менее чем 0°C при добавлении реактива Гриньяра, и затем необязательно подогревая до температуры окружающей среды. Реакцию обычно проводят в растворителе, таком как тетрагидрофуран. Соединения формулы (27-5) являются представительными соединениями формулы (I).
Схема 28
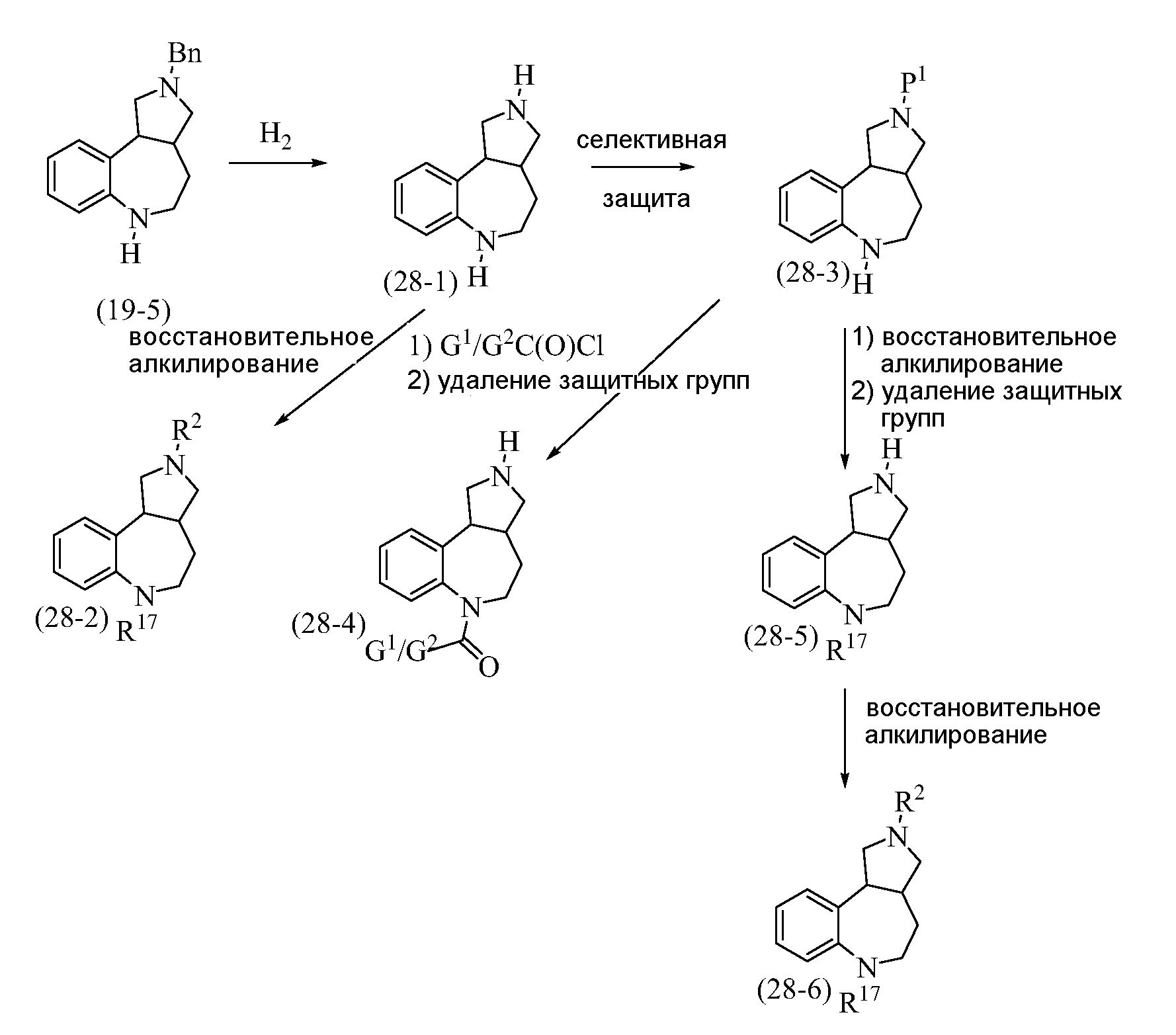
Как показано на схеме 28, соединения формул (28-2), (28-4) и (28-6), которые являются представительными соединениями формулы (I), могут быть получены из соединений формулы (19-5). Соединения формулы (19-5) могут быть гидрированы в присутствии палладиевого катализатора, такого как гидроксид палладия-на-углероде, что давало соединения формулы (28-1). Соединения формулы (28-1) могут быть восстановительно алкилированы в условиях, хорошо известных специалистам в данной области, что давало соединения формулы (28-2), где R2 и R17 являются обинаковыми и выбраны из алкила, галогеналкила, -(CR4aR5a)m-G1 и -(CR4aR5a)m-G2, где G1, G2, m, R4a и R5a имеют значения, определенные в описании изобретения. Соединения формулы (28-1) могут быть селективно защищены по азоту пирролидина, что давало соединения формулы (28-3), где P1 представляет собой азотзащитную группу. Соединения формулы (28-3) могут быть подвергнуты взаимодействию с хлорангидридом кислоты формулы G1C(O)Cl или G2C(O)Cl, и затем P1 группа может быть удалена в условиях, подходящих для конкретной защитной группы с высвобождением соединений формулы (28-4). Соединения формулы (28-3) также могут быть восстановительно алкилированы, и затем P1 группа может быть удалена в условиях, подходящих для конкретной защитной группы с высвобождением соединения формулы (28-5), где R17 выбран из алкила, галогеналкила, -(CR4aR5a)m-G1 и -(CR4aR5a)m-G2. Восстановительное алкилирование соединений формулы (28-5) дает соединения формулы (28-6), где R2 выбран из алкоксиалкила, алкила, галогеналкила, -(CR4aR5a)m-G1, -(CR4aR5a)p-O-G1, -(CR4aR5a)m-G2 и -(CR4aR5a)p-O-G2.
Схема 29
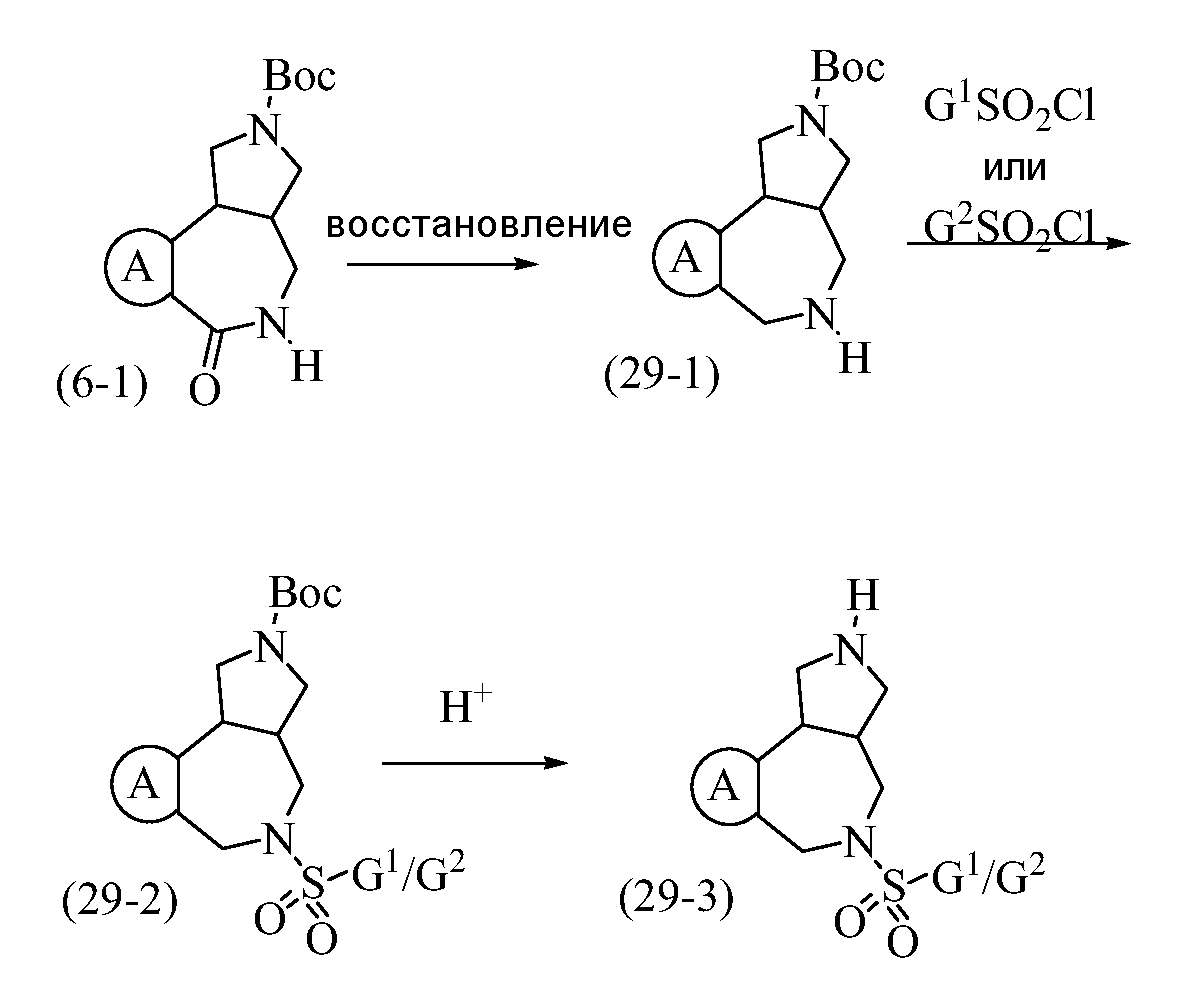
Как показано на схеме 29, соединения формулы (29-3), где A, G1 и G2 имеют значения, описанные в разделе Сущность изобретения, могут быть получены из соединений формулы (6-1). Соединения формулы (6-1) могут быть охлаждены до температуры 0°C в растворителе, таком как тетрагидрофуран, и затем обработаны восстановителем, таким как литийалюминийгидрид, с последующим нагреванием до температуры в интервале между 0°C и 20°C, что давало соединение формулы (29-1). Соединения формулы (29-1) могут быть обработаны сульфонилхлоридами формулы G1SO2Cl или G2SO2Cl в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в растворителе, таком как дихлорметан, что давало соединения формулы (29-2). Соединения формулы (29-2) затем могут быть обработаны в кислотных условиях для удаления трет-бутоксикарбонильной защитной группы, что давало соединение формулы (29-3). Подходящие кислоты включают, но этим не ограничиваются, хлористоводородную кислоту в диоксане, трифторуксусную кислоту в дихлорметане или п-толуолсульфоновую кислоту в дихлорэтане. Кислота необязательно может быть присоединена с помощью полимера. Соединения формулы (29-3) являются представительными соединениями формулы (I).
Схема 30
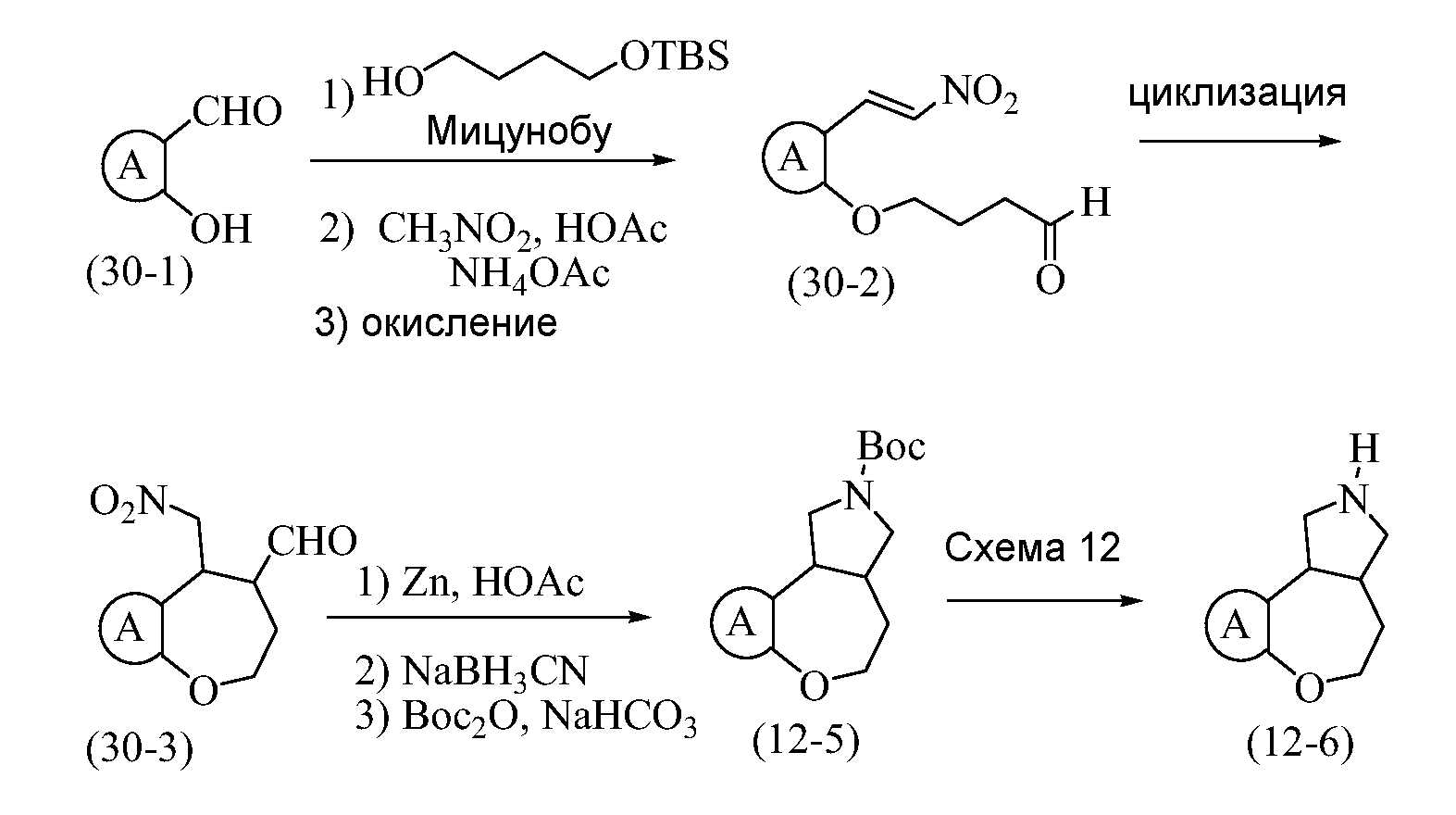
Как показано на схеме 30, соединения формулы (12-6), где A имеет значения, описанные в разделе Сущность изобретения, могут быть получены из соединений формулы (30-1). Соединения формулы (30-1) могут быть подвергнуты взаимодействию в условиях реакции Мицунобу с 4-(трет-бутилдиметилсилилокси)бутан-1-олом. Взаимодействие с нитрометаном в присутствии ацетата аммония и уксусной кислоты позволяет ввести винилнитрогруппу и удалить силильную эфирную защитную группу. В заключение, окисление с помощью окислителя, такого как, но этим не ограничивается, перйодинан Десс-Мартина, дает соединения формулы (30-2). Циклизация соединений формулы (30-2) до соединений формулы (30-3) достигается при или около комнатной температуры в присутствии L-пролина и триэтиламина в растворителях, таких как смеси тетрагидрофурана и дихлорметана. Соединения формулы (30-3) могут быть обработаны цинком в кислотных условиях для восстановления функциональной нитрогруппы до соответствующего первичного амина с последующим взаимодействием с альдегидной группой с получением пирролидина в присутствии восстановителя, такого как цианоборгидрид натрия. Пирролидин может быть защищен азотзащитной группой, такой как, но этим не ограничивается, трет-бутоксикарбонил, что давало соединения формулы (12-5). Соединения формулы (12-5) могут быть преобразованы в соединения формулы (12-6), как указано на схеме 12. Соединения формулы (12-6) являются представительными соединениями формулы (I).
Следует иметь в виду, что синтетические схемы и конкретные примеры, как показано в разделе Примеры, являются иллюстративными и не должны рассматриваться как ограничивающие объем изобретения, как оно определено в формуле изобретения. Все альтернативы, модификации и эквиваленты синтетических способов и конкретные примеры включены в объем формулы изобретения.
Оптимальные условия реакции и время реакции для каждой отдельной стадии могут варьироваться в зависимости от конкретных используемых реагентов и заместителей, имеющихся в используемых реагентах. Если не указано иное, растворители, температура и другие условия реакции могут быть легко выбраны специалистом в данной области. Конкретные способы представлены в разделе Примеры. Реакции могут быть осуществлены обычным способом, например, путем удаления растворителя из остатка и последующей очистки в соответствии с методами в общем известными в данной области, таких как, но этим не ограничиваются, кристаллизация, дистилляция, экстракция, растирание и хроматография. Если не указано иное, исходные материалы и реагенты являются либо коммерчески доступными, либо могут быть получены специалистом в данной области из коммерчески доступных материалов с использованием методов, описанных в химической литературе.
Обычные методы проведения экспериментов, включая подходящие операции с условиями реакции, реагентами и последовательностью пути синтеза, защита химических функциональных групп, которые могут быть не совместимы с условиями реакции, и удаление защитных групп в подходящей точке реакционной последовательности способа входят в объем изобретения. Подходящие защитные группы и способы защиты и удаления защитных групп у различных заместителей с использованием таких подходящих защитных групп хорошо известны специалистам в данной области, примеры которых можно найти в обзоре T. Greene and P. Wuts, Protective Groups in Organic Synthesis (3rd ed.), John Wiley & Sons, NY (1999), который включен в настоящее описание в качестве ссылки в полном объеме. Синтез соединений по изобретению может быть осуществлен методами, аналогичными описанным в синтетических схемах, описанных выше, и в конкретных примерах.
Исходные материалы, если не они не являются коммерчески доступными, могут быть получены с помощью способов, выбранных из стандартных органических химических методов, приемов, аналогичных синтезам известных, структурно подобных соединений, или методов, аналогичных описанным выше схемам или способам, описанных в разделе примеров синтеза.
Когда требуется оптически активная форма соединения по изобретению, она может быть получена путем осуществления одного из способов, описанных в настоящем описании, с использованием оптически активных исходных веществ (полученных, например, путем асимметрической индукции подходящей стадии реакции) или путем разделения смеси стереоизомеров соединения или промежуточных соединений, используя обычные способы (такие как хроматографическое разделение, перекристаллизация или ферментное разделение).
Подобным же образом, когда необходим чистый геометрический изомер по изобретению, он может быть получен путем осуществления одного из вышеуказанных способов с использованием чистого геометрического изомера в качестве исходного веществ, или путем разделения смеси геометрические изомеров соединения или промежуточных соединений с использованием обычного способа, такого как хроматографическое разделения.
g. Примеры
Соединения и способы по настоящему изобретению будут лучше понятны со ссылкой на следующие примеры, которые предназначены в качестве иллюстрации, а не для ограничения объема заявки.
Абревиатуры: АА - ацетат аммония; APCI - химическая ионизация при атмосферном давлении; водн. - водный; DCI - химическая ионизация десорбцией; ДМСО - диметилсульфоксид; экв. - эквивалент(ы); ESI - ионизация электрораспылением; ВЭЖХ - высокоэффективная жидкостная хроматография; LC/MS - жидкостная хроматография/масс-спектрометрия; PS - полимерная подложка, psi - фунты на квадратный дюйм; ТФУ - трифторуксусная кислота; ТСХ - тонкослойная хроматография.
Способ аналитической ВЭЖХ (LC/MS): Аналитическую LC/MS осуществляли на масс-спектрометре Finnigan Navigator и системе Agilent 1100 ВЭЖХ running Xcalibur 1.2, Open-Access 1.3, и вход специальное программное обеспечение. Масс-спектрометр работал в условиях положительной ионизации APCI. Система ВЭЖХ включала насос Agilent Quaternary, дегазатор, колоночный отсек, автоматический пробоотборник и диодно-матричный детектор, с детектором испарительного рассеяния света Sedere Sedex 75. Используемой колонкой была Phenomenex® Luna® Combi-HTS C8(2) 5 мкм 100Å (2,1×30 мм).
Способ с трифторуксусной кислотой (ТФУ): использовали градиент 10-100% ацетонитрил (A) и 0,1% трифторуксусную кислоту в воде (B), со скоростью потока 2,0 мл/минута (0-0,1 минута 10% A, 0,1-2,6 минуты 10-100% A, 2,6-2,9 минуты 100% A, 2,9-3,0 минуты 100-10% A. 0,5-минутная задержка после пробега).
Способ с ацетатом аммония (AA): использовали градиент 10-100% ацетонитрил (A) и 10 мМ ацетата аммония в воде (B), со скоростью потока 2,0 мл/минута (0-0,1 минуты 10% A, 0,1-2,6 минуты 10-100% A, 2,6-2,9 минуты 100% A, 2,9-3,0 минуты 100-10% A. 0,5-минутная задержка после пробега).
Способ препаративной ВЭЖХ: Если не указано иного, соединения очищали путем ВЭЖХ с использование следующего протокола. Образцы очищали путем препаративной ВЭЖХ на аппарате Phenomenex Luna C8(2) 5 мкм 100Å AXIA колонка (30 мм × 75 мм). Использовали градиент ацетонитрил (A) и 0,1% трифторуксусная кислота в воде (B), со скоростью потока 50 мл/минута (0-0,5 минуты 10% A, 0,5-7,0 минут линейный градиент 10-95% A, 7,0-10,0 минут 95% A, 10,0-12,0 минут линейный градиент 95-10% A). Образцы инъектировали в 1,5 мл смеси диметилсульфоксид:метанол (1:1). В указанных образцах вместо трифторуксусной кислоты использовался ацетат аммония. Использовали отсроченную систему очистки, состоящую из следующих модулей: препаративный насос Waters LC4000; диодно-матричный детектор Waters 996; Waters 717 + пробоотборник; модуль Waters SAT/IN, детектор испарительного рассеяния света Alltech Varex III; интерфейс бокс Gilson 506C; и два коллектора фракций Gilson FC204. Систему контролировали с помощью программного обеспечения Waters Millennium32, автоматизированную с помощью Abbott, усовершенствованную Visual Basic приложением для контроля сбора фракций и ослеживания фракций. Фракции собирали, основываясь на УФ пороговом сигнале, и выбранные фракции затем анализировали с помощью масс-спектрометрического анализа проточной инъекции, используя положительную ионизацию APCI на Finnigan LCQ с использованием 70:30 метанол:10 мМ NH4OH(водный) со скоростью потока 0,8 мл/минута. Масс-спектры Loop-инъекции были получены с помощью аппарата Finnigan LCQ с работой программного обеспечения LCQ Navigator 1,2 и обработчиком жидких фракций для инъекций Gilson 215, контролируемого Abbott разработанным приложением Visual Basic.
Пример 1
Транс-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 1A
Метил 2-(2-циановинил)бензоат
Метил 2-формилбензоат (10 г, 60,9 ммоль) растворяли в толуоле (200 мл). Затем к смеси добавляли (трифенилфосфоранилиден)ацетонитрил (20,19 г, 67,0 ммоль). Реакционную смесь нагревали при температуре 110°C в течение 20 часов, затем охлаждали до комнатной температуры, концентрировали в вакууме и остаток обрабатывали эфиром (2×). Эфирный раствор пропускали через слой из силикагеля с получением Примера 1A (смесь E- и Z-изомеров). Смесь E- и Z-изомеров использовали непосредственно на следующей стадии. MS (DCI+) m/z 205,0 [M+NH3]+.
Пример 1B
Транс-метил 2-(1-бензил-4-цианопирролидин-3-ил)бензоат
В 50-миллилитровой круглодонной колбе объединяли метил 2-(2-циановинил)бензоат (Пример 1A, 11,03 г, 58,9 ммоль) трифторуксусную кислоту (0,045 мл, 0,589 ммоль) и дихлорметан (100 мл). N-Бензил-1-метокси-N-((триметилсилил)метил)метанамин (64,8 ммоль) добавляли в виде раствора в дихлорметане (100 мл) по каплям в течение 15 минут при перемешивании в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов, затем гасили водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органические промывки объединяли и промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и растворитель удаляли в вакууме с получением сырого продукта. Смесь изомеров помещали на колонку с силикагелем и элюировали смесью этилацетат/гексаны (градиент 0-20%, 40 минут) с получением указанного в заголовке соединения в виде более быстро элюируемого (менее полярный) изомера. 1H ЯМР (500 МГц, CDCl3) δ м.д. 2,82 (дд, 1H, J=9,09 Гц, J=7,81 Гц), 2,88 (дд, 1H, J=9,74 Гц, J=4,27 Гц), 2,99-3,03 (м, 1H), 3,05-3,09 (м, 1H), 3,29 (т, 1H, J=8,37 Гц), 3,71 (м, 2H), 3,94 (с, 3H), 4,51 (ддд, 1H, J=8,29 Гц, J=6,36 Гц, J=4,35 Гц), 7,25-7,40 (м, 6H), 7,50 (дт, 1H, J=7,65 Гц, J=1,45 Гц), 7,62 (д, 1H, J=7,24 Гц), 7,81 (дд, 1H, J=7,89 Гц, J=1,29 Гц); MS (DCI+) m/z 321,2 [M+H]+.
Пример 1C
Транс-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 1B (9,25 г, 30,2 ммоль), и 100 мл раствора смеси 7 M NH3/метанол, добавляли к никелю Ренея® (смоченный водой, 19 г) в сосуде для работы под давлением и перемешивали при комнатной температуре в течение 18 часов в атмосфере водорода под давлением 40 фунтов на квадратный дюйм. После завершения реакции согласно данным ВЭЖХ раствор фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. Сырое вещество обрабатывали этилацетатом (3×50 мл). Полученный твердый продукт собирали с помощью фильтрации на колонке Бюхнера и промывали этилацетатом. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,23-2,27 (м, 1H), 2,69 (д, 2H, J=8,54 Гц), 3,00 (дд, 1H, J=10,53 Гц, J=9,00 Гц), 3,13 (дд, 1H, J=8,54 Гц, J=6,41 Гц), 3,20-3,25 (м, 1H), 3,30-3,35 (м, 1H), 3,45-3,50 (м, 1H), 3,69-3,72 (м, 1H), 7,08 (д, 1H, J=7,32 Гц), 7,32-7,38 (м, 2H), 7,40-7,45 (м, 3H), 7,53 (д, 1H, J=7,32 Гц), 8,40 (дд, 1H, J=7,48 Гц, J=1,07 Гц), 8,77 (ушир. с, 1H); MS (DCI+) m/z 293,2 [M+H]+.
Пример 2
Транс-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Раствор Примера 1 (10,91 г, 37,3 ммоль) в 200 мл метанола добавляли к 20% Pd(OH)2/углерод (смоченный водой, 1,1 г) в сосуде для работы под давлением и перемешивали при температуре 50°C в течение 32 часов в атмосфере водорода (30 фунтов на квадратный дюйм). Когда данные ВЭЖХ показывали, что реакция завершилась, раствор охлаждали, фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,10-2,17 (м, 1H), 2,91 (т, 1H, J=10,07 Гц), 3,12-3,40 (м, 6H), 7,16 (д, 1H, J=7,32 Гц), 7,38 (т, 1H, J=7,02 Гц), 7,42 (дт, 1H, J=7,40 Гц, J=1,37 Гц), 8,25 (дд, 1H, J=7,48 Гц, J=1,07 Гц), 8,80 (ушир. с, 1H); MS (DCI+) m/z 203,0 [M+H]+.
Пример 3
Цис-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 3A
Метил цис-2-(1-бензил-4-цианопирролидин-3-ил)бензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 1B, в виде элюируемого с более медленной скоростью (более полярного) изомера. 1H ЯМР (500 МГц, CDCl3) δ м.д. 2,87 (дд, 2H, J=9,5 Гц, J=7,73 Гц), 2,97-3,01 (м, 2H), 3,04-3,08 (м, 2H), 3,88 (с, 3H), 4,45 (м, 1H), 7,25-7,40 (м, 6H), 7,55 (дт, 1H, J=7,65 Гц, J=1,29 Гц), 7,70 (д, 1H, J=7,89 Гц), 7,91 (дд, 1H, J=7,89 Гц, J=1,13 Гц); MS (DCI+) m/z 321,2 [M+H]+.
Пример 3B
Цис-2-бензил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 3A (7 г, 21,85 ммоль), и 100 мл раствора смеси 7 M NH3/метанол, добавляли к никелю Ренея® (смоченный водой, 14 г) в сосуде для работы под давлением и перемешивали при температуре 50°C в течение 16 часов в атмосфере водорода (50 фунтов на квадратный дюйм). После того, как данные ВЭЖХ показывали, что реакция завершилась, раствор охлаждали, фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,59 (т, 1H, J=9,51 Гц), 2,65-2,67 (м, 1H), 2,73-2,81 (м, 1H), 2,93-2,99 (м, 2H), 3,15-3,25 (м, 2H), 3,54 (с, 2H), 3,59-3,66 (м, 1H), 7,23-7,43 (м, 8H), 8,15-8,18 (м, 1H), 9,12 (т, 1H, J=5,83 Гц); MS (DCI+) m/z 293,2 [M+H]+.
Пример 4
Цис-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 3 (12,3 г, 42,1 ммоль), растворенное в метаноле (150 мл), добавляли к 20% Pd(OH)2/углерод (смоченный водой, 2,46 г) в сосуде для работы под давлением и перемешивали при комнатной температуре в течение 22 часов в атмосфере водорода (30 фунтов на квадратный дюйм). Когда данные ВЭЖХ показывали, что реакция завершилась, смесь фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 3,10-3,15 (м, 1H), 3,17-3,26 (м, 1H), 3,58 (т, 1H, J=3,58 Гц), 3,88-4,00 (м, 2H), 4,11-4,20 (м, 2H), 7,31 (ушир. с, 1H), 7,40 (дт, 2H, J=3,97 Гц), 8,03-8,05 (м, 1H), 9,40 (т, 1H, J=5,95 Гц); MS (DCI+) m/z 203,0 [M+H]+.
Пример 5
Транс-2-бензил-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он
Пример 5A
(E)-Этил 3-(2-цианофенил)акрилат
2-Формилбензонитрил (5 г, 38,1 ммоль) помещали в круглодонную колбу, снабженную механической мешалкой, и растворяли в толуоле (50 мл). Затем к смеси добавляли (карбетоксиметилен)трифенилфосфоран (14,6 г, 41,9 ммоль). Реакционную смесь нагревали при температуре 110°C в течение 20 часов. Раствор концентрировали в вакууме, и остаток вновь растворяли в дихлорметане. Раствор пропускали через слой из диоксида кремния (элюент дихлорметан) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, CDCl3) δ м.д. 1,37 (т, 3H, J=7,12 Гц), 4,30 (кв, 2H, J=7,12 Гц), 6,61 (д, 1H, J=15,94 Гц), 7,47 (дт, 1H, J=7,71 Гц, J=1,19 Гц), 7,62 (дт, 1H, J=7,80 Гц, J=1,36 Гц), 7,7-7,75 (м, 2H), 7,97 (д, 1H, J=15,94 Гц); MS (DCI+) m/z 218,9 [M+NH3]+.
Пример 5B
Транс-этил 1-бензил-4-(2-цианофенил)пирролидин-3-карбоксилат
Соединение, полученное в Примере 5A (12,12 г, 60,3 ммоль), объединяли с трифторуксусной кислотой (4,6 мл, 0,603 ммоль) и дихлорметаном (300 мл). Добавляли по каплям с помощью капельной воронки в течение 1 часа N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (15,74 г, 66,3 ммоль) в виде раствора в дихлорметане (6 мл) при перемешивании в атмосфере аргона. Реакционную смесь перемешивали при комнатной температуре в течение 20 часов, затем гасили водным раствором бикарбоната натрия и экстрагировали дихлорметаном. Органические промывки объединяли и промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали, и растворитель удаляли в вакууме с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, CDCl3) δ м.д. 1,24 (т, 3H, J=7,12 Гц), 2,85 (м, 2H), 3,00 (т, 1H, J=8,48 Гц), 3,06-3,13 (м, 1H), 3,20 (т, 1H, J=8,48 Гц), 3,69 (д, 2H), 4,02-4,08 (м, 1H), 4,15 (дкв, 2H, J=7,12 Гц, J=2,3 Гц), 7,25-7,40 (м, 6H), 7,55-7,70 (м, 3H); MS (DCI+) m/z 335,2 [M+H]+.
Пример 5C
Транс-2-бензил-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он
Соединение, полученное в Примере 5B (20,14 г, 60,2 ммоль), и 200 мл раствора смеси 7 M NH3/метанол, добавляли к никелю Ренея® (смоченный водой, 40 г) в сосуде для работы под давлением и перемешивали при комнатной температуре в течение 16 часов в атмосфере водорода (60 фунтов на квадратный дюйм). После того, как данные ВЭЖХ показывали, что реакция завершилась, раствор фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,68 (т, 1H, J=9,31 Гц), 2,84 (т, 1H, J=9,15 Гц), 3,53 (т, 1H, J=8,24 Гц), 3,59-3,64 (м, 1H), 3,72-3,82 (м, 3H), 3,97 (дд, 1H, J=9,31 Гц, J=6,87 Гц), 4,28 (дд, 1H, J=16,78 Гц, J=6,71 Гц), 4,93 (д, 1H, J=18,00 Гц) 7,00 (д, 1H, J=7,63 Гц), 7,11-7,12 (м, 1H), 7,16-7,24 (м, 5H), 7,31 (т, 1H, J=7,48 Гц), 7,40 (т, 1H, J=7,48 Гц), 7,54 (д, 1H, J=6,31 Гц); MS (DCI+) m/z 293,2 [M+H]+.
Пример 6
Транс-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он
Соединение, полученное в Примере 5 (6,74 г, 20,05 ммоль), растворенное в метаноле (80 мл), добавляли к 20% Pd(OH)2/углерод (смоченный водой, 1,2 г) в сосуде для работы под давлением и перемешивали при комнатной температуре в течение 30 часов в атмосфере водорода (30 фунтов на квадратный дюйм). Когда данные ВЭЖХ показывали, что реакция завершилась, смесь охлаждали, фильтровали через нейлоновую мембрану и концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 3,07 (т, 1H, J=10,07 Гц), 3,45-3,62 (м, 3H), 3,89 (дд, 1H, J=10,22 Гц, J=6,87 Гц), 4,07 (дд, 1H, J=10,68 Гц, J=7,93 Гц), 4,26 (дд, 1H, J=16,78 Гц, J=7,02 Гц), 4,96 (дд, 1H, J=16,94 Гц, J=3,51 Гц), 7,12-7,27 (м, 4H), 8,82 (ушир. с, 1H); MS (DCI+) m/z 203,0 [M+H]+.
Пример 7
Транс-2-бензил-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
К 1 M раствору комплекса боран тетрагидрофуран (46,1 мл, 46,1 ммоль) в тетрагидрофуране (10 мл) добавляли Пример 5 (3,37 г, 11,53 ммоль) при комнатной температуре. Смесь кипятили с обратным холодильником в течение 3 часов в атмосфере азота. Осторожно добавляли метанол (6 мл), и смесь кипятили с обратным холодильником в течение 1 часа. Добавляли 2 M HCl (10 мл) и смесь нагревали при температуре 80°C в течение ночи. Реакционную смесь упаривали, и остаток разбавляли H2O, подщелачивали с помощью K2CO3 (pH 10) и экстрагировали дихлорметаном (2×). Органические фракции объединяли и промывали насыщенным солевым раствором, сушили над Mg2SO4 и упаривали с получением сырого продукта. Сырой продукт очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,63-2,71 (м, 1H), 3,03-3,07 (м, 1H), 3,15 (т, 1H, J=10,37 Гц), 3,45 (т, 1H, J=10,22 Гц), 3,65 (дд, 1H, J=9,31 Гц, J=6,26 Гц), 3,72 (т, 1H, J=12,51 Гц), 3,98-4,04 (м, 2H), 4,07-4,10 (м, 1H), 4,19-4,21 (м, 1H), 4,61-4,64 (м, 1H), 4,70-4,73 (м, 1H), 7,11 (д, 1H, J=7,63 Гц), 7,18 (т, 1H, J=7,32 Гц), 7,28-7,33 (м, 2H), 7,38 (т, 1H, J=7,32 Гц), 7,42 (т, 2H, J=7,32 Гц), 7,64 (д, 2H, J=7,32 Гц); MS (DCI+) m/z 279,2 [M+H]+.
Пример 8
Транс-2-бензил-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
Соединение, полученное в Примере 7 (106,5 мг, 0,383 ммоль), добавляли в сосуд и растворяли в смеси 1:1 пиридина и дихлорметана (2 мл). В реакционную смесь добавляли 3-фторбензол-1-сульфонилхлорид (56 мкл, 0,421 ммоль) и смесь встряхивали в течение ночи при комнатной температуре. Растворитель концентрировали досуха, и остаток вновь растворяли в смеси 1:1 метанол/диметилсульфоксид и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (300 МГц, пиридин-d5) δ м.д. 2,10-2,19 (м, 1H), 2,80 (д, 1H, J=8,54 Гц), 3,06 (т, 1H, J=9,92 Гц), 3,16 (т, 1H, J=12,21 Гц), 3,44-3,47 (м, 1H), 3,60-3,65 (м, 1H), 3,84 (д, 1H, J=12,84 Гц), 4,01 (д, 1H, J=12,82 Гц), 4,23-4,26 (м, 2H), 4,98 (д, 1H, J=15,26 Гц), 6,98 (д, 1H, J=8,24 Гц), 7,2-7,6 (м, 10H), 7,77 (д, 1H, J=8,24 Гц), 7,81 (дт, 1H, J=8,31 Гц, J=2,10 Гц); MS (DCI+) m/z 437,2 [M+H]+.
Пример 9
Транс-2-бензил-5-(2,3-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2,3-дихлорбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,03-2,11 (м, 1H), 2,67 (т, 1H, J=9,92 Гц), 2,91 (т, 1H, J=9,76 Гц), 3,17-3,21 (м, 2H), 3,26 (дд, 1H, J=13,27 Гц, J=11,44 Гц), 3,47-3,52 (м, 1H), 3,63 (д, 1H, J=12,82 Гц), 3,85 (дд, 1H, J=13,43 Гц, J=2,75 Гц), 4,50-4,53 (м, 1H), 4,59-4,62 (м, 1H), 7,09 (д, 1H, J=7,63 Гц), 7,24-7,28 (м, 2H), 7,32-7,37 (м, 4H), 7,57 (т, 1H, J=8,09 Гц), 7,93 (дд, 1H, J=8,09 Гц, J=1,37 Гц), 7,99 (дд, 1H, J=7,93 Гц, J=1,53 Гц); MS (DCI+) m/z 487,1 [M+H]+.
Пример 10
Транс-2-бензил-5-(2,5-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2,5-дихлорбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,00-2,10 (м, 1H), 2,55-2,59 (м, 1H), 2,65-2,73 (м, 1H), 2,89-2,96 (м, 1H), 3,25 (дд, 1H, J=13,43 Гц, J=11,6 Гц), 3,47-3,53 (м, 1H), 3,65 (д, 1H, J=12,51 Гц), 3,81 (д, 1H, J=12,82 Гц), 3,90 (дд, 1H, J=12,82 Гц, J=2,75 Гц), 4,36-4,39 (м, 2H), 4,52 (д, 1H, J=15,56 Гц), 4,66 (д, 1H, J=15,56 Гц), 7,07 (д, 1H, J=7,32 Гц), 7,16-7,19 (м, 1H), 7,22-7,37 (м, 7H), 7,68-7,72 (м, 2H), 7,92 (д, 1H, J=2,14 Гц); MS (DCI+) m/z 487,1 [M+H]+.
Пример 11
Транс-2-бензил-5-(2-бромфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2-бромбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,05-2,13 (м, 1H), 2,66 (т, 1H, J=10,07 Гц), 2,90 (т, 1H, J=9,76 Гц), 3,18-3,26 (м, 2H), 3,50 (тд, 1H, J=10,37 Гц, J=6,1 Гц), 3,63 (д, 1H, J=13,12 Гц), 3,75-3,85 (м, 3H), 4,50 (д, 1H, J=15,87 Гц), 4,62-4,65 (м, 2H), 7,08 (д, 1H, J=7,93 Гц), 7,15-7,19 (м, 2H), 7,23-7,28 (м, 2H), 7,32-7,37 (м, 4H), 7,53-7,60 (м, 2H), 7,86 (дд, 1H, J=7,63 Гц, J=1,53 Гц), 8,00 (дд, 1H, J=7,63 Гц, J=1,83 Гц); MS (DCI+) m/z 497,1 [M+H]+.
Пример 12
Транс-2-бензил-5-(3-бромфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 3-бромбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,85 (ушир., 1H), 2,61 (ушир., 1H), 2,75 (ушир., 1H), 2,93 (ушир., 1H), 3,09 (т, 1H, J=12,21 Гц), 3,25 (ушир., 1H), 3,42 (ушир., 1H), 3,87 (ушир., 2H), 3,98 (д, 1H, J=13,43 Гц), 4,32 (д, 1H, J=15,26 Гц), 4,68 (д, 1H, J=15,26 Гц), 7,02 (д, 1H, J=6,71 Гц), 7,21-7,41 (м, 8H), 7,49 (т, 1H, J=7,93 Гц), 7,74-7,77 (м, 2H), 7,82 (д, 1H, J=7,02 Гц); MS (DCI+) m/z 497,1 [M+H]+.
Пример 13
Транс-2-бензил-5-(нафталин-1-илсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и нафталин-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,02-2,12 (м, 1H), 2,57-2,64 (м, 1H), 2,79 (ушир., 1H), 3,02 (ушир., 1H), 3,18-3,33 (м, 2H), 3,46-3,52 (м, 1H), 4,49 (д, 1H, J=15,56 Гц), 4,71 (д, 1H, J=15,56 Гц), 7,05 (д, 1H, J=7,05 Гц), 7,17-7,41 (м, 8H), 7,64-7,70 (м, 3H), 8,07-8,12 (м, 2H), 8,24 (д, 1H, J=8,54 Гц), 8,44-8,47 (м, 1H); MS (DCI+) m/z 469,2 [M+H]+.
Пример 14
Транс-2-бензил-5-(3-хлор-4-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 3-хлор-4-фторбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл). Этот раствор промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,86 (ушир., 1H), 2,60 (ушир., 1H), 2,76 (ушир., 1H), 2,95 (ушир., 1H), 3,09 (т, 1H, J=12,21 Гц), 3,18 (с, 1H), 3,23 (ушир., 1H), 3,42 (ушир., 1H), 3,86 (ушир., 1H), 3,98 (д, 1H, J=12,82 Гц), 4,32 (д, 2H, J=15,56 Гц), 4,68 (д, 1H, J=15,26 Гц), 7,02 (д, 1H, J=7,32 Гц), 7,21-7,39 (м, 8H), 7,55 (т, 1H, J=8,07 Гц), 7,76-7,79 (м, 1H), 7,82 (дд, 1H, J=6,87 Гц, J=2,29 Гц); MS (DCI+) m/z 471,2 [M+H]+.
Пример 15
Транс-2-бензил-5-(2,5-диметоксифенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2,5-диметоксибензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали с помощью тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,12 (ушир., 1H), 2,73 (ушир., 1H), 3,02 (т, 1H, J=11,90 Гц), 3,41 (ушир., 1H), 3,51 (ушир., 1H), 3,77 (с, 3H), 3,81-4,1 (м, 6H), 4,31 (д, 1H, J=15,56 Гц), 4,63 (д, 1H, J=15,87 Гц), 7,07 (д, 1H, J=7,07 Гц), 7,16-7,22 (м, 4H), 7,24-7,27 (м, 2H), 7,33-7,44 (м, 5H); MS (DCI+) m/z 479,2 [M+H]+.
Пример 16
Транс-2-бензил-5-(3-(трифторметил)фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 3-(трифторметил)бензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,77 (ушир., 1H), 2,69 (ушир., 1H), 2,84 (ушир., 1H), 3,12-3,19 (м, 3H), 3,39 (ушир., 1H), 3,64 (ушир., 1H), 3,80 (ушир., 1H), 4,02 (д, 1H, J=11,60 Гц), 4,39 (д, 1H, J=15,56 Гц), 4,72 (д, 1H, J=15,26 Гц), 6,98 (д, 1H, J=7,32 Гц), 7,17-7,23 (м, 2H), 7,27-7,31 (м, 2H), 7,34-7,38 (м, 4H), 7,76 (т, 1H, J=7,78 Гц), 7,84 (с, 1H), 7,98 (д, 1H, J=7,93 Гц), 8,03 (д, 1H, J=7,63 Гц); MS (DCI+) m/z 487,2 [M+H]+.
Пример 17
Транс-2-бензил-5-(2,5-диметилфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2,5-диметилбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,27 (ушир., 1H), 2,33 (с, 3H), 2,42 (т, 3H), 2,90 (ушир., 1H), 3,29 (ушир., 2H), 3,83 (д, 1H, J=12,21 Гц), 4,23 (ушир. д, 2H), 4,44 (д, 1H, J=15,56 Гц), 4,61 (д, 1H, J=15,56 Гц), 7,10 (с, 1H, J=7,32 Гц), 7,18-7,20 (м, 1H), 7,24 (т, 1H, J=7,32 Гц), 7,29-7,32 (м, 2H), 7,35-7,37 (м, 1H), 7,40-7,46 (м, 3H), 7,49-7,52 (м, 2H), 7,57 (с, 1H); MS (DCI+) m/z 447,2 [M+H]+.
Пример 18
Транс-2-бензил-5-(3-метоксифенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 3-метоксибензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,91 (ушир., 1H), 2,63 (ушир., 1H), 2,81 (ушир., 1H), 2,98-3,02 (м, 2H), 3,16 (с, 1H), 3,28 (ушир., 1H), 3,42 (ушир., 1H), 3,76 (с, 3H), 3,85-3,98 (м, 2H), 4,26 (д, 1H, J=15,26 Гц), 4,66 (д, 1H, J=15,26 Гц), 7,03 (д, 1H, J=7,32 Гц), 7,13 (с, 1H), 7,18-7,41 (м, 10H), 7,47 (т, 1H, J=7,93 Гц); MS (DCI+) m/z 449,2 [M+H]+.
Пример 19
Транс-2-бензил-5-(2-дихлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2-хлорбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 2,15 (ушир., 1H), 2,68 (ушир., 1H), 3,05-3,24 (м, 2H), 3,37 (ушир., 1H), 3,55 (ушир., 1H), 3,77-4,05 (м, 3H), 4,47 (д, 1H, J=15,56 Гц), 4,63 (д, 1H, J=15,87 Гц), 7,09 (д, 1H, J=7,63 Гц), 7,13-7,21 (м, 2H), 7,25-7,28 (м, 2H), 7,31-7,42 (м, 5H), 7,55 (ддд, 1H, J=8,16 Гц, J=6,22 Гц, J=1,98 Гц), 7,64-7,69 (м, 2H), 7,98-7,99 (м, 1H); MS (DCI+) m/z 453,2 [M+H]+.
Пример 20
Транс-2-бензил-5-(3-хлорфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 3-хлорбензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,83 (ушир., 1H), 2,55 (ушир., 1H), 2,70 (ушир., 1H), 2,88 (ушир., 1H), 3,08 (т, 1H, J=12,51 Гц), 3,19 (ушир., 1H), 3,66 (ушир., 1H), 3,82 (ушир., 1H), 3,96 (д, 1H, J=13,73 Гц), 4,32 (д, 1H, J=15,26 Гц), 4,67 (д, 1H, J=14,95 Гц), 7,02 (д, 1H, J=87,02 Гц), 7,20-7,31 (м, 4H), 7,56 (т, 1H, J=7,93 Гц), 7,63-7,65 (м, 1H), 7,69 (дт, 1H, J=7,86 Гц, J=1,37 Гц); MS (DCI+) m/z 453,2 [M+H]+.
Пример 21
Транс-2-бензил-5-(2-цианофенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 7 (75 мг, 0,269 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2-цианобензол-1-сульфонилхлорид (0,296 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме, и остаток растворяли в дихлорметане (2 мл) и промывали последовательно водой и водным раствором бикарбоната натрия, и затем очищали путем препаративной тонкослойной хроматографии с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 1,97-2,07 (м, 1H), 2,66-2,73 (м, 1H), 2,86-2,94 (м, 1H), 3,16-3,22 (м, 1H), 3,45-3,50 (м, 1H), 3,64 (д, 1H, J=11,90 Гц), 3,80 (д, 1H, J=13,12 Гц), 3,97 (дд, 1H, J=13,43 Гц, J=3,05 Гц), 4,49 (д, 1H, J=15,56 Гц), 4,68 (д, 1H, J=15,56 Гц), 7,05 (д, 1H, J=7,05 Гц), 7,16-7,29 (м, 4H), 7,33-7,37 (м, 4H), 7,81 (дт, 1H, J=7,55 Гц, J=1,07 Гц), 7,81 (дт, 1H, J=7,70 Гц, J=1,37 Гц), 8,02 (дд, 1H, J=7,93 Гц, J=0,92 Гц), 8,07 (дд, 1H, J=7,48 Гц, J=1,07 Гц); MS (DCI+) m/z 444,2 [M+H]+.
Пример 22
Транс-2-(3,5-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль) растворяли в этаноле (0,4 мл), затем добавляли 3,5-диметилбензальдегид (23 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Далее добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), затем добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,27-2,33 (с, 6H), 2,72-2,89 (м, 1H), 3,13-3,23 (м, 1H), 3,47-3,55 (м, 1H), 3,61-3,73 (м, 1H), 3,85-4,04 (м, 3H), 4,13-4,24 (м, 1H), 4,70-4,85 (м, 2H), 7,11-7,18 (м, 1H), 7,28-7,32 (м, 2H), 7,37-7,44 (с, 2H), 7,66-7,71 (с, 1H), 8,03-8,10 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 23
Транс-2-(2,5-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль) растворяли в этаноле (0,4 мл), затем добавляли 2,5-диметилбензальдегид (27 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,28-2,35 (с, 3H), 2,46-2,51 (с, 3H), 2,68-2,81 (м, 1H), 3,15-3,27 (м, 1H), 3,47-3,55 (м, 1H), 3,61-3,67 (м, 1H), 3,78-4,02 (м, 3H), 4,10-4,22 (м, 1H), 4,67-4,76 (м, 2H), 7,15-7,22 (м, 2H), 7,36-7,49 (м, 2H), 7,62-7,71 (м, 2H), 8,03-8,13 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 24
Транс-2-(2,4-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2,4-диметилбензальдегид (27 мг, 0,2 ммоль) растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл) добавляли, затем добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,23-2,26 (с, 3H), 2,47-2,53 (с, 3H), 2,72-2,83 (м, 1H), 3,16-3,28 (м, 1H), 3,49-3,57 (м, 1H), 3,61-3,67 (м, 1H), 3,81-4,00 (м, 3H), 4,11-4,23 (м, 1H), 4,70-4,77 (м, 2H), 7,06-7,11 (м, 1H), 7,18-7,23 (м, 1H), 7,37-7,50 (м, 2H), 7,66-7,69 (м, 1H), 7,71-7,76 (м, 1H), 8,03-8,14 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 25
Транс-2-(3,4-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3,4-диметилбензальдегид (27 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), затем добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,12-2,20 (м, 6H), 2,69-2,78 (м, 1H), 3,14-3,23 (м, 1H), 3,47-3,55 (м, 1H), 3,61-3,65 (м, 1H), 3,81-3,97 (м, 3H), 4,07-4,16 (м, 1H), 4,68-4,77 (м, 2H), 7,13-7,21 (м, 2H), 7,37-7,44 (м, 2H), 7,55-7,63 (м, 2H), 8,02-8,11 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 26
Транс-2-(3-метилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3-метилбензальдегид (24 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), затем добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,26-2,33 (с, 3H), 2,67-2,80 (м, 1H), 3,13-3,24 (м, 1H), 3,46-3,53 (м, 1H), 3,60-3,64 (м, 1H), 3,80-3,97 (м, 3H), 4,06-4,16 (м, 1H), 4,72-4,77 (м, 2H), 7,10-7,16 (м, 1H), 7,20-7,25 (м, 1H), 7,32-7,46 (м, 3H), 7,59-7,66 (м, 2H), 8,04-8,10 (м, 1H); MS (ESI+) 307 [M+H]+.
Пример 27
Транс-2-(2,3-диметилбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2,3-диметилбензальдегид (27 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,13-2,18 (с, 3H), 2,35-2,40 (с, 3H), 2,70-2,82 (м, 1H), 3,17-3,25 (м, 1H), 3,48-3,56 (м, 1H), 3,60-3,66 (м, 1H), 3,79-4,01 (м, 3H), 4,08-4,23 (м, 1H), 4,75-4,81 (м, 2H), 7,17-7,27 (м, 3H), 7,36-7,49 (м, 2H), 7,68-7,71 (м, 1H), 8,04-8,13 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 28
Транс-2-(3-метоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3-метоксибензальдегид (27 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,73-2,86 (м, 1H), 3,14-3,22 (м, 1H), 3,46-3,55 (м, 1H), 3,60-3,67 (м, 1H), 3,82-3,85 (м, 3H), 3,85-3,91 (м, 2H), 3,91-3,99 (м, 1H), 4,10-4,23 (м, 1H), 4,77-4,85 (м, 2H), 7,04-7,10 (м, 1H), 7,11-7,16 (м, 1H), 7,37-7,49 (м, 4H), 7,52-7,57 (м, 1H), 8,02-8,08 (м, 1H); MS (ESI+) 323 [M+H]+.
Пример 29
Транс-2-(2-метоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2-метоксибензальдегид (27 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,69-2,82 (м, 1H), 3,12-3,22 (м, 1H), 3,48-3,57 (м, 1H), 3,63-3,71 (м, 1H), 3,82-3,88 (м, 3H), 3,88-4,02 (м, 3H), 4,15-4,24 (м, 1H), 4,70-4,82 (м, 2H), 6,99-7,10 (м, 2H), 7,12-7,20 (м, 1H), 7,37-7,53 (м, 3H), 7,76-7,86 (м, 1H), 7,98-8,11 (м, 1H); MS (ESI+) 323 [M+H]+.
Пример 30
Транс-2-(3,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3,5-дихлорбензальдегид (35 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,37-2,46 (м, 1H), 3,03-3,20 (м, 2H), 3,22-3,30 (м, 1H), 3,35-3,50 (м, 3H), 3,51-3,57 (м, 1H), 4,05-4,26 (м, 2H), 7,08-7,14 (м, 1H), 7,36-7,50 (м, 3H), 7,61-7,65 (м, 2H), 8,16-8,22 (м, 1H); MS (ESI+) 361 [M+H]+.
Пример 31
Транс-2-(2,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2,5-дихлорбензальдегид (35 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,23-2,48 (м, 1H), 2,91-3,04 (м, 2H), 3,22-3,42 (м, 4H), 3,41-3,53 (м, 1H), 4,02-4,10 (м, 2H), 7,07-7,17 (м, 1H), 7,37-7,53 (м, 4H), 7,78-7,83 (м, 1H), 8,20-8,27 (м, 1H); MS (ESI+) 361 [M+H]+.
Пример 32
Транс-2-(3-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3-хлорбензальдегид (28 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,57-2,68 (м, 1H), 3,18-3,29 (м, 1H), 3,37-3,50 (м, 2H), 3,53-3,58 (м, 1H), 3,71-3,82 (м, 2H), 3,85-3,92 (м, 1H), 4,48-4,60 (м, 2H), 7,10-7,17 (м, 1H), 7,35-7,48 (м, 4H), 7,70-7,74 (м, 1H), 7,83-7,90 (м, 1H), 8,08-8,16 (м, 1H); MS (ESI+) 327 [M+H]+.
Пример 33
Транс-2-(2-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2-хлорбензальдегид (28 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,49-2,58 (м, 1H), 3,22-3,36 (м, 2H), 3,40-3,52 (м, 2H), 3,62-3,82 (м, 3H), 4,38-4,55 (м, 2H), 7,13-7,21 (м, 1H), 7,35-7,55 (м, 5H), 7,86-7,94 (м, 1H), 8,12-8,25 (м, 1H); MS (ESI+) 321 [M+H]+.
Пример 34
Транс-2-(3-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3-фторбензальдегид (25 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,54-2,65 (м, 1H), 3,17-3,25 (м, 1H), 3,34-3,56 (м, 3H), 3,68-3,78 (м, 2H), 3,81-3,88 (м, 1H), 4,51-4,61 (м, 2H), 7,10-7,22 (м, 2H), 7,36-7,51 (м, 3H), 7,57-7,65 (м, 2H), 8,11-8,16 (м, 1H); MS (ESI+) 311 [M+H]+.
Пример 35
Транс-2-(2-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2-фторбензальдегид (25 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,53-2,62 (м, 1H), 3,17-3,27 (м, 1H), 3,35-3,50 (м, 2H), 3,53-3,59 (м, 1H), 3,68-3,78 (м, 2H), 3,81-3,90 (м, 1H), 4,49-4,60 (м, 2H), 7,10-7,18 (м, 1H), 7,18-7,27 (м, 2H), 7,36-7,50 (м, 3H), 7,81-7,91 (м, 1H), 8,11-8,19 (м, 1H); MS (ESI+) 311 [M+H]+.
Пример 36
3-((Транс-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-ил)метил)бензонитрил
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3-формилбензонитрил (26 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,53-2,62 (м, 1H), 3,20-3,34 (м, 2H), 3,41-3,49 (м, 2H), 3,63-3,81 (м, 3H), 4,39-4,61 (м, 2H), 7,12-7,20 (м, 1H), 7,38-7,49 (м, 2H), 7,56-7,61 (м, 1H), 7,69-7,74 (м, 1H), 7,99-8,05 (м, 1H), 8,07-8,12 (м, 1H), 8,13-8,16 (м, 1H); MS (ESI+) 318 [M+H]+.
Пример 37
Транс-2-(2,5-диметоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 2,5-диметоксибензальдегид (33 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,70-2,83 (м, 1H), 3,13-3,21 (м, 1H), 3,46-3,56 (м, 1H), 3,62-3,71 (м, 1H), 3,80-3,85 (м, 6H), 3,85-4,05 (м, 3H), 4,16-4,27 (м, 1H), 4,74-4,81 (м, 2H), 6,99-7,06 (м, 1H), 7,10-7,20 (м, 2H), 7,36-7,46 (м, 2H), 7,52-7,58 (м, 1H), 8,02-8,10 (м, 1H); MS (ESI+) 353 [M+H]+.
Пример 38
Транс-2-(3,5-диметоксибензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 2 (36 мг, 0,2 ммоль), растворяли в этаноле (0,4 мл), затем добавляли 3,5-диметоксибензальдегид (33 мг, 0,2 ммоль), растворенный в этаноле (0,9 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в этаноле (0,4 мл), далее добавляли макропористую цианоборгидридную смолу (253 мг, 3 эквивалента; замещение 2,15 ммоль/г). Полученную смесь встряхивали в течение ночи при температуре 65°C. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,69-2,83 (м, 1H), 3,15-3,28 (м, 1H), 3,47-3,65 (м, 2H), 3,82-3,86 (м, 2H), 3,86-3,89 (м, 6H), 3,91-3,97 (м, 1H), 4,06-4,19 (м, 1H), 4,65-4,82 (м, 2H), 6,72-6,77 (м, 1H), 7,16-7,18 (м, 1H), 7,27-7,31 (м, 2H), 7,37-7,50 (м, 2H), 8,02-8,14 (м, 1H); MS (ESI+) 353 [M+H]+.
Пример 39
Транс-2-(2,3-дихлорфенилсульфонил)-1,2,3,3a,5,6-гексагидробензо[c]пирроло[3,4-e]азепин-4(10bH)-он
В 8-миллилитровый сосуд помещали соединение, полученное в Примере 6 (75 мг, 0,371 ммоль), дихлорметан (1,2 мл), сухой пиридин (1,2 мл) и 2,3-дихлорбензол-1-сульфонилхлорид (0,408 ммоль). Сосуд герметически закрывали и встряхивали в течение ночи при комнатной температуре. Растворитель упаривали в вакууме. К остатку добавляли воду (1,5 мл) по каплям, и затем смесь энергично встряхивали. Образовавшийся осадок фильтровали и промывали смесью 2:1 вода/метанол с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6/D2O) δ м.д. 3,31 (дд, 1H, J=10,68 Гц, J=9,15 Гц), 3,47-3,54 (м, 1H), 3,63 (т, 1H, J=8,85 Гц), 3,89 (дт, 1H, J=12,89 Гц, J=8,96 Гц), 3,98 (д, 1H, J=16,78 Гц), 4,39 (дд, 1H, J=8,85 Гц, J=7,63 Гц), 4,85 (д, 1H, J=16,78 Гц), 7,16-7,22 (м, 1H), 7,60 (т, 1H, J=8,09 Гц), 7,96 (дд, 1H, J=8,09 Гц, J=1,37 Гц), 8,03 (дд, 1H, J=7,93 Гц, J=1,53 Гц); MS (DCI+) m/z 411,1 [M+H]+.
Пример 40
Цис-2-(3,5-дихлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 4 (39 мг, 0,2 ммоль), растворяли в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл), затем добавляли 3,5-дихлорбензальдегид (42 мг, 0,24 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (1,2 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл). Смесь встряхивали и добавляли макропористую цианоборгидридную смолу (239 мг, 3 эквивалента; замещение 2,44 ммоль/г), и полученную смесь встряхивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,59-2,68 (м, 1H), 2,88-3,00 (м, 2H), 3,03-3,10 (м, 1H), 3,11-3,19 (м, 2H), 3,33-3,52 (м, 1H), 3,66-3,82 (м, 3H), 7,25-7,28 (м, 1H), 7,34-7,37 (м, 1H), 7,37-7,41 (м, 2H), 7,43-7,52 (м, 2H), 8,05-8,14 (м, 1H); MS (ESI+) m/z 361 [M+H]+.
Пример 41
Цис-2-(3-хлорбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 4 (39 мг, 0,2 ммоль), растворяли в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл), затем добавляли 3-хлорбензальдегид (34 мг, 0,24 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (1,2 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл). Смесь встряхивали и добавляли макропористую цианоборгидридную смолу (239 мг, 3 эквивалента; замещение 2,44 ммоль/г), и полученную смесь встряхивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,68-2,76 (м, 1H), 2,91-3,10 (м, 2H), 3,11-3,24 (м, 3H), 3,44-3,59 (м, 1H), 3,77-3,90 (м, 3H), 7,25-7,28 (м, 1H), 7,33-7,36 (м, 2H), 7,37-7,42 (м, 1H), 7,42-7,49 (м, 2H), 7,52-7,57 (м, 1H), 8,03-8,15 (м, 1H); MS (ESI+) m/z 327 [M+H]+.
Пример 42
Цис-2-(3-фторбензил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 4 (39 мг, 0,2 ммоль), растворяли в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл), затем добавляли 3-фторбензальдегид (30 мг, 0,24 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (1,2 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл). Смесь встряхивали и затем добавляли макропористую цианоборгидридную смолу (239, 3 эквивалента; замещение 2,44 ммоль/г), и полученную смесь встряхивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,71-2,85 (м, 1H), 2,95-3,06 (м, 1H), 3,07-3,29 (м, 4H), 3,55-3,63 (м, 1H), 3,73-4,01 (м, 3H), 7,04-7,16 (м, 1H), 7,27-7,29 (м, 2H), 7,33-7,40 (м, 2H), 7,43-7,50 (м, 2H), 8,05-8,14 (м, 1H); MS (ESI+) m/z 311 [M+H]+.
Пример 43
Цис-2-(нафталин-1-илметил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 4 (39 мг, 0,2 ммоль), растворяли в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл), затем добавляли 1-нафтальдегид (37 мг, 0,24 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (1,2 мл). Затем добавляли раствор уксусной кислоты (60 мг, 1,0 ммоль), растворенный в смеси дихлорметан/метанол (1:1 раствор) (0,7 мл). Смесь встряхивали и далее добавляли макропористую цианоборгидридную смолу (239, 3 эквивалента; замещение 2,44 ммоль/г), и полученную смесь встряхивали в течение ночи при комнатной температуре. Реакционную смесь фильтровали, проверяли с помощью LC/MS и концентрировали досуха. Остатки растворяли в смеси 1:1 диметилсульфоксид/метанол и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5/D2O) δ м.д. 2,76-3,02 (м, 2H), 3,10-3,28 (м, 4H), 3,59-3,68 (м, 1H), 3,70-3,80 (м, 1H), 4,20-4,49 (м, 2H), 7,16-7,25 (м, 1H), 7,37-7,65 (м, 6H), 7,84-8,00 (м, 2H), 8,05-8,13 (м, 1H), 8,40-8,52 (м, 1H); MS (ESI+) m/z 343 [M+H]+.
Пример 44
(3aR,10bS)-1,2,3,3a,4,5-Гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 1, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии: колонка ChiralPak® OD-H 21×250 мм SN 711141, элюирование смесью метанол/суперкритический CO2, и чистый энантиомер (200 мг, 0,68 ммоль) растворяли в трифторэтаноле (20 мл) в 50-миллилитровом сосуде для работы под давлением. Добавляли 20% Pd(OH)2/углерод (влажн., 40,0 мг, 0,285 ммоль), и смесь перемешивали в течение 2 часов в атмосфере водорода (30 фунтов на квадратный дюйм) и 50°C. Смесь фильтровали через нейлоновую мембрану и фильтрат концентрировали и растворяли в 1 мл CH2Cl2. Добавляли ди-трет-бутил дикарбонат (218 мг, 1 ммоль). Смесь очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 50% этилацетат/гексан, и чистый (3aS,10bS)-трет-бутил 6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат обрабатывали 1 мл 4н HCl в диоксане. Смесь перемешивали при комнатной температуре в течение 4 часов и концентрировали с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,32 (с, 2H), 8,06 (м, 1H), 7,65 (дд, J=1,6, 7,6 Гц, 1H), 7,51 (дт, J=1,2, 7,6 Гц, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,26 (д, J=7,6 Гц, 1H), 3,62 (м, 1H), 3,53 (м, 1H), 3,43 (м, 1H), 3,23 (м, 1H), 3,17 (м, 1H), 3,05 (м, 1H), 2,96 (м, 1H) и 2,45 (м, 1H); MS (ESI+) m/z 203 [M+H]+.
Пример 45
Транс-2-бензил-8-хлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 45A
(E)-Метил 5-хлор-2-(2-циановинил)бензоат
В N,N-диметилформамидный раствор (100 мл) метил 2-бром-5-хлорбензоата (25, 100 ммоль) добавляли ацетат палладия(II) (480 мг, 2,1 ммоль) три(o-толил)фосфин (1,2 г, 3,9 ммоль), акрилонитрил (6 г, 113 ммоль), и безводный ацетат натрия (10 г, 122 ммоль). Смесь нагревали при температуре 120°C. Добавляли дополнительное количество ацетата палладия(II) (224 мг, 1 ммоль) и три(o-толил)фосфин (600 мг, 2 ммоль), через 36 часов. Смесь нагревали при температуре 120°C в течение 24 часов. N,N-Диметилформамид удаляли в вакууме и оставшуюся смесь гасили с помощью 1н HCl (водн.) и экстрагировали этилацетатом. Этилацетатные экстракты концентрировали, и остаток растворяли в смеси 1:1 дихлорметан:метанол (50 мл). Добавляли по каплям (триметилсилил)диазометан (30 мл, 2н в диэтиловом эфире, 60 ммоль). После перемешивания в течение ночи смесь гасили уксусной кислотой, концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 2:1 гексаны:этилацетат с получением указанного в заголовке соединения (2:1 E/Z-изомеры). 1H ЯМР (E-изомер, Пример 45A, 300 МГц, ДМСО-d6) δ м.д. 8,08 (д, J=16,2 Гц, 1H), 7,91 (д, J=2,1 Гц, 1H), 7,84 (д, J=8,7 Гц, 1H), 7,78 (дд, J=2,1, 8,4 Гц, 1H), 6,45 (д, J=16,5 Гц, 1H) и 3,88 (с, 3H).
Пример 45В
Транс-метил 2-(1-бензил-4-цианопирролидин-3-ил)-5-хлорбензоат
К соединению, полученному в Примере 45A (3,7 г, 16,7 ммоль) в дихлорметане (30 мл), добавляли трифторуксусную кислоту (10 мг). Добавляли по каплям N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (4,0 г, 16,7 ммоль). Через 4 часа добавляли дополнительное количество данного реагента (2 г, 8,4 ммоль), и смесь оставляли перемешиваться в течение ночи. Смесь концентрировали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 3:1 гексаны:этилацетат с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,71 (м, 3H), 7,34 (м, 4H), 7,27 (м, 1H), 4,25 (кв, J=6,0 Гц, 1H), 3,86 (с, 3H), 3,69 (с, 2H), 3,36 (м, 1H), 3,16 (т, J=9,0 Гц, 1H), 3,00 (т, J=9,3 Гц, 1H), 2,78 (дд, J=6,3, 9,3 Гц, 1H) и 2,59 (дд, J=5,7, 9,6 Гц, 1H).
Пример 45C
Транс-2-бензил-8-хлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
К соединению, полученному в Примере 45B в смеси 7 M NH3-метанол (56,4 мл), добавляли к никелю Ренея® (смоченный водой, 14,0 г, 239 ммоль), промывали один раз метанолом и смесь перемешивали в 250 мл стальном баллоне под давлением 30 фунтов на квадратный дюйм водорода при комнатной температуре в течение 60 минут. Никель Ренея® отфильтровывали, фильтрат концентрировали и остаток обрабатывали этилацетатом с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,05 (с, 1H), 7,77 (д, J=2,5 Гц, 1H), 7,48 (дд, J=2,5, 8,5 Гц, 1H), 7,33 (м, 4H), 7,25 (т, J=7,0, 1H), 7,17 (д, J=8,5 Гц, 1H), 3,79 (д, J=13,5 Гц, 1H), 3,70 (д, J=13,0 Гц, 1H), 3,19 (м, 2H), 3,15 (м, 1H), 3,05 (м, 1H), 2,97 (т, J=9,5 Гц, 1H), 2,72 (т, J=8,5 Гц, 1H), 2,60 (т, J=8,5 Гц, 1H) и 2,19 (м, 1H); MS (ESI+) m/z 327 [M+H]+.
Пример 46
Транс-8-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 46A
Транс-трет-бутил 8-хлор-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Во взвесь соединения, полученного в Примере 45 (1,5 г, 4,6 ммоль) в дихлорэтане (10 мл), добавляли 1-хлорэтилхлорформиат (1,1 г, 8 ммоль) при комнатной температуре. Эту смесь нагревали при температуре 80°C в течение 16 часов. Добавляли метанол (10 мл) и H2O (0,3 мл) и смесь нагревали при температуре 80°C в течение 4 часов и затем смесь концентрировали. Остаток растворяли в 5 мл CH2Cl2 и добавляли триэтиламин до pH10. Добавляли ди-трет-бутил дикарбонат (1,6 г, 7,3 ммоль). Спустя 1 час, смесь концентрировали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 1:2 гексаны:этилацетат с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,16 (м, 1H), 7,59 (д, J=2,4 Гц, 1H), 7,52 (дт, J=2,4, 8,4 Гц, 1H), 7,28 (дд, J=4,2, 8,4 Гц, 1H), 3,71 (дд, J=6,9, 9,6 Гц, 1H), 3,62 (т, J=11,7 Гц, 1H), 3,50 (т, J=7,5 Гц, 1H), 3,05 (м, 4H) и 2,21 (м, 1H); MS (ESI+) m/z 337 [M+H]+.
Пример 46B
Гидрохлорид транс-8-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-она
Соединение, полученное в Примере 46A (190 мг, 0,56 ммоль), обрабатывали 4н HCl в диоксане (3 мл, 12 ммоль) с добавлением диоксана (6 мл). Смесь оставляли перемешиваться в течение 24 часов и концентрировали с получением указанного в заголовке соединения в виде гидрохлоридной соли (сольватированной 1 эквивалентом диоксана). 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,40 (с, 1H), 9,35 (с, 1H), 8,25 (м, 1H), 7,63 (д, J=2,0 Гц, 1H), 7,58 (дд, J=2,0, 8,0 Гц, 1H), 7,31 (д, J=8,5 Гц, 1H), 3,62 (м, 1H), 3,51 (м, 1H), 3,43 (м, 1H), 3,20 (м, 1H), 3,16 (м, 1H), 3,09 (м, 1H), 2,94 (м, 1H) и 2,25 (м, 1H); MS (ESI+) m/z 237 [M+H]+.
Пример 47
(3aR,10bS)-1,2,3,3a,4,5-Гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 46A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии: колонка ChiralPak® OD-H 21×250 мм SN 711141, элюируя смесью метанол/суперкритический CO2 и чистый энантиомер (190 мг, 0,56 ммоль) обрабатывали HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение 24 часов и образовавшиеся осадки собирали с получением указанного в заголовке соединения в виде гидрохлоридной соли (сольватированной 1 эквивалентом диоксана). 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,40 (с, 1H), 9,35 (с, 1H), 8,25 (м, 1H), 7,63 (д, J=2,0 Гц, 1H), 7,58 (дд, J=2,0, 8,0 Гц, 1H), 7,31 (д, J=8,5 Гц, 1H), 3,62 (м, 1H), 3,51 (м, 1H), 3,43 (м, 1H), 3,20 (м, 1H), 3,16 (м, 1H), 3,09 (м, 1H), 2,94 (м, 1H) и 2,25 (м, 1H); MS (ESI+) m/z 237 [M+H]+.
Пример 48
Транс-2-бензил-10-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 48A
(E)-Метил 3-хлор-2-(2-циановинил)бензоат
К 4-хлоризобензофуран-1,3-диону (1,82 г, 10 ммоль) в тетрагидрофуране (20 мл) при температуре -20°C добавляли литий три-трет-бутоксиалюминий гидрид (0,5 M, 20 мл, 10 ммоль, диглим). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли (трифенилфосфоранилиден)ацетонитрил (3,0 г, 10 ммоль) и полученную смесь нагревали при температуре 120°C в течение 16 часов. Добавляли 2н гидроксид натрия (водн.) и смесь экстрагировали этилацетатом (2×). К водному слою добавляли HCl (водн.) (1 M) до pH 3 и смесь экстрагировали этилацетатом. Органические экстракты сушили и концентрировали. Остаток растворяли в 20 мл смеси 1:1 CH2Cl2:метанол, затем добавляли (триметилсилил)диазометан (4 мл, 2н в диэтиловом эфире, 8 ммоль). Смесь перемешивали в течение 1 часа и гасили уксусной кислотой. Смесь концентрировали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью 2:1 гексаны:этилацетат с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,85 (дд, J=1,0, 7,5 Гц, 1H), 7,81 (дд, J=1,0, 8,0 Гц, 1H), 6,04 (д, J=17 Гц, 1H) и 3,84 (с, 3H).
Пример 48B
Транс-2-бензил-10-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 45B и 45C, заменяя соединение, полученное в Примере 48A, на соединение, полученное в Примере 45A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,24 (т, J=5,0 Гц, 1H), 7,50 (дд, J=1,5, 7,5 Гц, 1H), 7,48 (дд, J=1,0, 8,0 Гц, 1H), 7,33 (м, 5H), 7,24 (м, 1H), 3,86 (д, J=13,5 Гц, 1H), 3,73 (д, J=13,0 Гц, 1H), 3,58 (дд, J=8,5, 11,5 Гц, 1H), 3,28 (м, 1H), 3,16 (м, 1H), 2,97 (дд, J=6,5, 14,5 Гц, 1H), 2,89 (дт, J=15,0, 6,0 Гц, 1H), 2,65 (д, J=9,5 Гц, 2H) и 2,38 (м, 1H); MS (ESI+) m/z 327 [M+H]+.
Пример 49
Транс-7-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46, заменяя соединение, полученное в Примере 48, на соединение, полученное в Примере 45. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,55 (с, 1H), 9,40 (с, 1H), 8,35 (т, J=5,5 Гц, 1H), 7,55 (дд, J=1,5, 8,0 Гц, 1H), 7,52 (дд, J=1,0, 7,5 Гц, 1H), 7,41 (т, J=8,0 Гц, 1H), 4,00 (м, 1H), 3,80 (м, 1H), 3,38 (м, 1H), 3,14 (м, 2H), 2,92 (м, 2H) и 2,48 (м, 1H); MS (ESI+) m/z 237 [M+H]+.
Пример 50
Транс-7-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 45 и Примере 46, заменяя метил 2-бром-6-хлорбензоат на метил 2-бром-5-хлорбензоат. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,42 (с, 1H), 9,34 (с, 1H), 8,42 (т, J=6,5 Гц, 1H), 7,48 (м, 2H), 7,26 (дд, J=2,0, 6,5 Гц, 1H), 3,62 (м, 31H), 3,50 (м, 1H), 3,43 (м, 1H), 3,15 (м, 1H), 3,04 (м, 1H), 3,00 (м, 1H), 2,95 (м, 1H) и 2,15 (м, 1H); MS (ESI+) m/z 237 [M+H]+.
Пример 51
Транс-2-бензил-9-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 45, заменяя метил 2-бром-4-хлорбензоат на метил 2-бром-5-хлорбензоат. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,05 (т, J=4,0 Гц, 1H), 7,81 (д, J=8,0 Гц, 1H), 7,35 (м, 5H), 7,25 (дт, J=7,0, 2,0 Гц, 1H), 7,17 (д, J=2,0 Гц, 1H), 3,79 (д, J=13 Гц, 1H), 3,70 (д, J=13,5 Гц, 1H), 3,23 (м, 1H), 3,16 (м, 2H), 3,05 (м, 1H), 2,99 (т, J=10 Гц, 1H), 2,72 (т, J=9,0 Гц, 1H), 2,60 (т, J=9,0 Гц, 1H) и 2,21 (м, 1H); MS (ESI+) m/z 327 [M+H]+.
Пример 52
Транс-9-хлор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46, заменяя соединение, полученное в Примере 51, на соединение, полученное в Примере 45. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,34 (с, 1H), 9,27 (с, 1H), 8,18 (м, 1H), 7,65 (д, J=8,5 Гц, 1H), 7,48 (дд, J=2,0, 8,5 Гц, 1H), 7,37 (д, J=1,5 Гц, 1H), 3,60 (м, 1H), 3,55 (м, 2H), 3,22 (м, 1H), 3,14 (м, 1H), 3,05 (м, 1H), 2,94 (м, 1H) и 2,29 (м, 1H); MS (ESI+) m/z 237 [M+H]+.
Пример 53
Транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 46 (27 мг, 0,1 ммоль), добавляли формальдегид (8 мг, 37% в H2O, 0,1 ммоль) в метанольном ацетатном буфере при pH 4 (0,5 мл, 1 M), затем добавляли цианоборгидрид натрия (6,2 мг, 0,1 ммоль). Спустя 3 часа смесь гасили с помощью 2 M NaOH (водн.) и экстрагировали этилацетатом. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,12 (с, 1H), 7,81 (д, J=2,0 Гц, 1H), 7,49 (дд, J=2,5, 8,0 Гц, 1H), 7,18 (д, J=8,0 Гц, 1H), 3,26 (м, 1H), 3,20 (м, 1H), 3,11 (м, 1H), 3,08 (м, 1H), 2,84 (дд, J=9,0, 10,5 Гц, 1H), 2,62 (м, 2H) и 2,18 (м, 1H); MS (ESI+) m/z 251 [M+H]+.
Пример 53 (Альтернативное получение)
Транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 45A (Альтернативное получение)
(E)-Метил 5-хлор-2-(2-циановинил)бензоат
В сосуд в инертной атмосфере загружали трис(дибензилиленацетон)дипалладий(0) (14,3 г), три-трет-бутилфосфоний тетрафторборат (9,1 г) и дегазированный диоксан (1,1 л). В отдельную колбу загружали метил 2-бром-5-хлорбензоат (420 г), дегазированный диоксан (420 мл), N,N-дициклогексилметиламин (378 г) и акрилонитрил (98 г). Затем колбу, содержащую акрилонитрил, дегазировали путем барботирования аргона в течение 1 часа. Часть (приблизительно 15%) содержащего акрилонитрил раствора добавляли в сосуд с палладием и затем смесь нагревали до температуры 60°C. Остаток акрилонитрильного раствора добавляли в течение 1 часа, поддерживая температуру при 60°C. Через 1,5 часа реакционную смесь охлаждали до комнатной температуры, фильтровали через слой диатомовой земли и затем концентрировали в вакууме до твердого вещества. Твердый продукт растворяли в этилацетате (4 л) и обрабатывали активированным углем (30 г). После удаления угля путем фильтрования, раствор два раза экстрагировали 1н HCl, водой, затем два раза насыщенным солевым раствором. После упаривания растворителя остаток кристаллизовали путем добавления этилацетата (2,4 л), нагревая до температуры 45°C и затем охлаждая до температуры -5°C. В течение 1 часа добавляли гептан (1,2 л) и затем продукт вновь выделяли путем фильтрации, промывали смесью гептан/этилацетат (соотношение 2:1, 500 мл) и сушили в вакууме при температуре 40°C (140 г). Данные ЯМР идентичны Примеру 45A.
Пример 53 (Альтернативное получение)
Транс-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
В сосуд, содержащий соединение, полученное в Примере 45A (128 г), 2-метилтетрагидрофуран (1,1 кг) и трифторуксусную кислоту (3,2 г), добавляли 1-метокси-N-метил-N-((триметилсилил)метил)метанамин (178 г) в течение приблизительно 2,5 часов. Добавляли этилацетат (650 мл) и смесь экстрагировали два раза 9%-м водным раствором бикарбоната натрия (1 л) и затем 25%-м солевым раствором (0,8 л). Органический слой концентрировали в вакууме и остаток растворяли в этилацетате (1 л) и затем фильтровали для удаления неорганических солей. Продукт выделяли путем концентрирования фильтрата в вакууме, заменяя растворитель на изопропанол (500 мл). Взвесь охлаждали до температуры 0°C, фильтровали и промывали холодным изопропанолом. Твердый продукт сушили в вакууме при температуре 50°C с получением транс-метил 5-хлор-2-(4-циано-1-метилпирролидин-3-ил)бензоата (154 г).
В сосуд Парра объемом 2 галлона загружали Никель Ренея® (77 г, Grace 2800 (воду декантировали)) и 7 M раствор аммиака в метаноле (3 л) и транс-метил 5-хлор-2-(4-циано-1-метилпирролидин-3-ил)бензоат (152,7 г). Реактор герметически закрывали, продували азотом, затем продували водородом и устанавливали давление водорода равным 30 фунтов на квадратный дюйм. Спустя 2 часа реакционную смесь фильтровали через полипропиленовый картридж и промывали метанолом (1 л). Растворитель удаляли в вакууме с получением указанного в заголовке соединения (сырое) используемого как в Примере 199.
Пример 54
Транс-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
Пример 54A
Транс-2-бензил-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
К раствору соединения, полученного в Примере 7 (397 мг, 1,43 ммоль) в растворе смеси 1:1 N,N-диметилформамид:дихлорметан (20 мл), добавляли триэтиламин (506 мг, 5,0 ммоль), затем 3-фторбензолсульфонилхлорид (311 мг, 1,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь распределяли между этилацетатом и водой. Водную часть экстрагировали дополнительным количеством этилацетата и объединенные органические экстракты промывали насыщенным солевым раствором и сушили (Na2SO4). Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (3:1 этилацетат:гексан) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,75-1,90 (м, 1H), 2,52-2,63 (м, 2H), 2,75-2,86 (м, 1H), 3,04 (д, J=13,09 Гц, 1H), 3,09-3,17 (м, 1H), 3,41 (тд, J=10,31, 5,95 Гц, 1H), 3,57 (д, J=13,09 Гц, 1H), 3,77 (д, J=13,09 Гц, 1H), 3,95 (дд, J=13,09, 3,17 Гц, 1H), 4,31 (д, J=15,07 Гц, 1H), 4,64 (д, J=15,47 Гц, 1H), 6,97-7,07 (м, 1H), 7,18-7,33 (м, 8H), 7,46-7,60 (м, 4H); MS (DCI+) m/z 437,2 [M+H]+.
Пример 54B
Транс-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
Раствор соединения, полученного в Примере 54A (3,39 г, 7,77 ммоль) в растворе смеси 4:1 2,2,2-трифторэтанол:тетрагидрофуран (50 мл), помещали в сосуд для работы под давлением и добавляли влажный 20%-й гидроксид палладия (тип Дегусса, 747 мг) и сосуд герметически закрывали. Реакционную смесь перемешивали в течение 32 часов в атмосфере водорода под давлением 30 фунтов на квадратный дюйм при температуре окружающей среды. Смесь фильтровали через нейлоновую мембрану и концентрировали. Остаток очищали посредством флэш-хроматографии на колонке с силикагелем (раствор 95:5 дихлорметан: 2 M аммиак в метаноле) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,61-1,76 (м, 1H), 2,97-3,10 (м, 4H), 3,18-3,28 (м, 3H), 4,02 (дд, J=13,22, 2,71 Гц, 1H), 4,25 (д, J=15,26 Гц, 1H), 4,67 (д, J=15,26 Гц, 1H), 7,00-7,08 (м, 1H), 7,16-7,30 (м, 3H), 7,45-7,61 (м, 4H); MS (DCI+) m/z 347,1 [M+H]+.
Пример 55
Транс-2-бензил-8-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 55A
Метил-2-бром-5-фторбензоат
К раствору 2-бром-5-фторбензойной кислоты (7,92 г, 36,2 ммоль) в N,N-диметилформамиде (75 мл) добавляли карбонат калия (6,91 г, 50,0 ммоль) в виде твердого продукта одной порцией при комнатной температуре. Смесь перемешивали в течение 5 минут и добавляли одной порцией йодметан (6,39 г, 45,0 ммоль). Смесь перемешивали при температуре окружающей среды в течение 22 часов. Реакционную смесь распределяли между этилацетатом и водой. Водную часть экстрагировали дополнительным количеством этилацетата (3×) и объединенные органические экстракты промывали последовательно 10%-м раствором карбоната калия, водой и насыщенным солевым раствором. Органическую часть сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,87 (с, 3H), 7,41 (тд, J=8,56, 3,22 Гц, 1H), 7,65 (дд, J=8,99, 3,22 Гц, 1H), 7,81 (дд, J=9,16, 5,09 Гц, 1H); MS (+DCI/NH3) m/z 250,0 [M+NH4]+.
Пример 55B
(E)-Метил 2-(2-циановинил)-5-фторбензоат
Смесь продукта по Примеру 55A (8,25 г, 35,6 ммоль), ацетата натрия (3,28 г, 40,0 ммоль) и акрилонитрила (2,39 г, 45,0 ммоль) в N,N-диметилформамиде (65 мл) обрабатывали раствором ацетата палладия(II) (112 мг, 0,50 ммоль) и три(o-толил)фосфином (609 мг, 2,0 ммоль) в N,N-диметилформамиде (5 мл) в атмосфере азота. Реакционную смесь нагревали при температуре 135°C в течение 24 часов и затем охлаждали до температуры окружающей среды и распределяли между этилацетатом и водой. Водную часть экстрагировали дополнительным количеством этилацетата (3×) и объединенные органические экстракты промывали водой (2×) и насыщенным солевым раствором (1×) и сушили (Na2SO4). Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (15:85 этилацетат:гексан) с получением указанного в заголовке соединения в виде смеси приблизительно 4:1 с соответствующим Z-изомером. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,88 (с, 3H), 6,40 (д, J=16,61 Гц, 1H), 7,59 (тд, J=8,39, 2,54 Гц, 1H), 7,65-7,72 (м, 1H), 7,78-7,91 (м, 2H); MS (+DCI/NH3) m/z 223,0 [M+NH4]+.
Пример 55C
Метил 2-транс(1-бензил-4-цианопирролидин-3-ил)-5-фторбензоат
Раствор продукта по Примеру 55B (2,05 г, 10,0 ммоль) и одну каплю трифторуксусной кислоты в дихлорметане (50 мл) обрабатывали раствором N-бензил-1-метокси-N-((триметилсилил)метил)метанамина (2,61 г, 11,0 ммоль) в дихлорметане (25 мл), добавляемого по каплям в течение 30 минут в атмосфере азота при температуре окружающей среды. Реакционную смесь перемешивали в течение 20 часов и затем гасили насыщенным раствором бикарбоната натрия (25 мл). Слои разделяли и водную часть экстрагировали дополнительным количеством дихлорметана. Объединенные органические экстракты промывали насыщенным солевым раствором и сушили (Na2SO4). Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 1:9) с получением указанного в заголовке соединения и соответствующего цис-изомера. Транс-изомер 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,60 (дд, J=9,72, 5,75 Гц, 1H), 2,80 (дд, J=9,12, 6,35 Гц, 1H), 2,97-3,05 (м, 1H), 3,16 (т, J=8,72 Гц, 1H), 3,32-3,42 (м, 2H), 3,69 (с, 2H), 3,86 (с, 3H), 4,21-4,30 (м, 1H), 7,22-7,32 (м, 1H), 7,35 (д, J=4,36 Гц, 4H), 7,45-7,54 (м, 2H), 7,72 (дд, J=8,73, 5,55 Гц, 1H); MS (DCI+) m/z 339,2 [M+H]+. Цис-изомер 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,75 (дд, J=9,72, 7,73 Гц, 1H), 2,81-2,88 (м, 1H), 2,96 (дт, J=9,62, 2,92 Гц, 2H), 3,70 (с, 2H), 3,78-3,84 (м, 1H), 3,85 (с, 3H), 4,21 (ддд, J=9,82, 7,63, 5,16 Гц, 1H), 7,25-7,37 (м, 3H), 7,37-7,40 (м, 2H), 7,46-7,58 (м, 2H), 7,77 (дд, J=8,72, 5,55 Гц, 1H).
Пример 55D
Транс-2-бензил-8-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К раствору соединения, полученного в Примере 55C (370 мг, 1,09 ммоль) в 7 M аммиаке в метаноле (10 мл) добавляли влажный никель Ренея® (1,85 г) в 50-миллилитровом сосуде для работы под давлением. Сосуд герметически закрывали и реакционную смесь перемешивали в атмосфере водорода под давлением 30 фунтов на квадратный дюйм при температуре окружающей среды в течение 20 часов. Смесь фильтровали через нейлоновую мембрану и концентрировали. Остаток очищали посредством флэш-хроматографии на колонке с силикагелем (98:2 дихлорметан:2н аммиак в метаноле) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,04 (тд, J=7,24, 3,37 Гц, 1H), 2,69 (т, J=10,11 Гц, 1H), 2,98-3,03 (м, 1H), 3,05-3,15 (м, 3H), 3,25 (дд, J=9,52, 6,35 Гц, 2H), 7,19-7,34 (м, 2H), 7,45 (дд, J=9,91, 2,78 Гц, 1H), 8,14 (с, 1H); MS (DCI+) m/z 311,2 [M+H]+.
Пример 56
Транс-2-бензил-8,9-дихлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 56A
4,5-Дихлор-2-(метоксикарбонил)бензойная кислота
В метанол (200 мл) порциями добавляли гидрид натрия (2,72 г, 60%-я дисперсия, 68,0 ммоль) в атмосфере азота при температуре окружающей среды. В раствор затем добавляли по каплям раствор 4,5-дихлорфталевого ангидрида (5,90 г, 27,2 ммоль) в метаноле (50 мл) в атмосфере азота при комнатной температуре. Реакционную смесь перемешивали в течение одного часа и затем концентрировали для удаления метанола. Остаток обрабатывали в водном растворе 10%-го карбоната калия и экстрагировали этилацетатом (2×). Водную часть подкисляли до pH 2 с помощью 10%-й соляной кислоты и экстрагировали этилацетатом (3×), сушили (Na2SO4) и концентрировали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,81 (с, 3H), 7,94-8,01 (м, 2H), 13,60-13,70 (ушир., 1H); MS (+DCI/NH3) m/z 266,0 [M+NH4]+.
Пример 56B
Метил 4,5-дихлор-2-(хлоркарбонил)бензоат
В смесь соединения, полученного в Примере 56A (5,5 г, 22,2 ммоль) и оксалилхлорида (3,17 г, 25,0 ммоль) в дихлорметане (50 мл), добавляли одну каплю N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение 4 часов и концентрировали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,81 (с, 3H), 7,97 (с, 1H), 8,01 (с, 1H); MS (+DCI/NH3) m/z 266,0 [M+NH4-H2O]+.
Пример 56C
Метил 4,5-дихлор-2-формилбензоат
Раствор соединения, полученного в Примере 56B (5,7 г, 21,4 ммоль) в диглиме (50 мл), обрабатывали по каплям раствором литий три-трет-бутоксиалюминий гидрида (44 мл 0,5 M раствора в диглиме, 22,0 ммоль) при температуре -70°C в атмосфере азота. После завершения добавления, реакционной смеси давали нагреться до комнатной температуры и затем большую часть растворителя удаляли в вакууме. Остаток распределяли между этилацетатом и 10%-й соляной кислотой. Водную часть экстрагировали дополнительным количеством этилацетата (2×) и объединенные органические экстракты промывали насыщенным солевым раствором и сушили (Na2SO4). Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 5:95) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,91 (с, 3H), 8,04 (с, 1H), 8,14 (с, 1H), 10,32 (с, 1H); MS (DCI+) m/z 232,9 [M+H]+.
Пример 56D
(E)-Метил 4,5-дихлор-2-(2-циановинил)бензоат
Смесь продукта по Примеру 56C (2,0 г, 8,6 ммоль) и (трифенилфосфоранилиден)ацетонитрила (2,87 г, 9,5 ммоль) в толуоле (30 мл) кипятили с обратным холодильником в течение 24 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали через тонкий слой силикагеля, элюируя диэтиловым эфиром для удаления трифенилфосфиноксида. Фильтрат концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 5:95) с получением указанного в заголовке соединения и соответствующего Z-изомера. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,88 (с, 3H), 6,55 (д, J=16,27 Гц, 1H), 8,05 (д, J=16,95 Гц, 1H), 8,09 (с, 1H), 8,13 (с, 1H); MS (DCI+) m/z 273,0 [M+H]+.
Пример 56E
Метил 2-транс-(1-бензил-4-цианопирролидин-3-ил)-4,5 дихлорбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55C, заменяя соединение, полученное в Примере 56D, на соединение, полученное в Примере 55B. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,63-2,77 (м, 2H), 2,93 (дд, J=9,83, 7,80 Гц, 1H), 3,24 (т, J=8,82 Гц, 1H), 3,38-3,47 (м, 1H), 3,63-3,76 (м, 2H), 3,86 (с, 3H), 4,26 (ддд, J=7,88, 5,51, 5,26 Гц, 1H), 7,24-7,33 (м, 1H), 7,33-7,37 (м, 4H), 7,95 (д, J=6,44 Гц, 2H); MS (DCI+) m/z 389,2 [M+H]+.
Пример 56F
Транс-2-бензил-8,9-дихлор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55D, заменяя соединение, полученное в Примере 56E, на соединение, полученное в Примере 55C. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,15-2,30 (м, 1H), 2,59 (т, J=8,53 Гц, 1H), 2,72 (т, J=8,92 Гц, 1H), 2,91-3,01 (м, 1H), 3,08 (ддд, J=13,88, 6,74, 4,36 Гц, 1H), 3,15-3,29 (м, 3H), 3,66-3,82 (м, 2H), 7,22-7,31 (м, 1H), 7,32-7,38 (м, 5H), 7,97 (с, 1H), 8,18 (т, J=3,57 Гц, 1H); MS (DCI+) m/z 361,2 [M+H]+.
Пример 57
Транс-8-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 54B, заменяя соединение, полученное в Примере 55D, на соединение, полученное в Примере 54A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,99-2,14 (м, 1H), 2,73 (т, J=10,17 Гц, 1H), 2,97-3,12 (м, 4H), 3,19-3,33 (м, 3H), 7,19-7,34 (м, 2H), 7,38-7,47 (м, 1H), 8,15 (т, J=4,58 Гц, 1H); MS (DCI+) m/z 221,0 [M+H]+.
Пример 58
Транс-2-бензил-7-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 58A
3-Фтор-2-(метоксикарбонил)бензойная кислота
В метанол (175 мл) порциями добавляли гидрид натрия (3,36 г, 60%-я дисперсия, 84,0 ммоль) при температуре окружающей среды в атмосфере азота. К раствору добавляли по каплям раствор 3-фторфталевого ангидрида (5,56 г, 33,5 ммоль) в метаноле (50 мл) в атмосфере азота при комнатной температуре. Реакционную смесь затем обрабатывали, как описано в Примере 56A с получением указанного в заголовке соединения. Данные ЯМР показали, что продукт загрязнен на 20% 6-фтор изомером. Вещество использовали на следующей стадии без дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,79-3,84 (два с, 3H), 7,53-7,69 (м, 2H), 7,76 (ддд, J=15,60, 7,29, 1,53 Гц, 1H), 13,56 (с, 1H); MS (+DCI/NH3) m/z 216,0 [M+NH4]+.
Пример 58B
Метил-2-(хлоркарбонил)-6-фторбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 56B, заменяя соединение, полученное в Примере 58A, на соединение, полученное в Примере 56A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,82-3,85 (два с, 3H), 7,57-7,69 (м, 2H), 7,76 (ддд, J=15,17, 7,21, 1,70 Гц, 1H); MS (+DCI/NH3) m/z 216,0 [M+NH4-H2O]+.
Пример 58C
Метил 2-фтор-6-формилбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 56C, заменяя соединение, полученное в Примере 58B, на соединение, полученное в Примере 56B. Сырую реакционную смесь очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 5:95) с получением чистого индивидуального изомера. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,89 (с, 3H), 7,66-7,75 (м, 1H), 7,78-7,91 (м, 2H), 10,04 (д, J=2,03 Гц, 1H); MS (+DCI/NH3) m/z 200,0 [M+NH4]+.
Пример 58D
(E)-Метил 2-(2-циановинил)-6-фторбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 56D, заменяя соединение, полученное в Примере 58C, на соединение, полученное в Примере 56C. Сырой продукт очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 7:93) с получением продукта в виде смеси E- и Z-изомеров (примерное соотношение E/Z: 5,5/1). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,87-3,94 (м, 3H), 6,54 (д, J=16,27 Гц, 1H), 7,44-7,53 (м, 1H), 7,57-7,72 (м, 3H); MS (+DCI/NH3) m/z 223,0 [M+NH4]+.
Пример 58E
Метил 2-транс-(1-бензил-4-цианопирролидин-3-ил)-6-фторбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55C, заменяя соединение, полученное в Примере 58D, на соединение, полученное в Примере 55B. Сырой продукт очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 15:85) с получением как транс-, так и цис-изомеров в соотношении 5/1. Транс-изомер 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,62 (дд, J=9,49, 6,10 Гц, 1H), 2,80 (дд, J=9,16, 6,44 Гц, 1H), 2,96-3,03 (м, 1H), 3,13 (т, J=8,65 Гц, 1H), 3,33-3,42 (м, 1H), 3,56-3,65 (м, 1H), 3,69 (д, J=2,37 Гц, 2H), 3,89 (с, 3H), 7,23-7,31 (м, 2H), 7,33-7,36 (м, 4H), 7,44-7,48 (м, 1H), 7,59 (тд, J=8,14, 6,10 Гц, 1H); MS (DCI+) m/z 339,2 [M+H]+.
Пример 58F
Цис-метил 2-(1-бензил-4-цианопирролидин-3-ил)-6-фторбензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 58E. Цис-изомер 1H ЯМР (501 МГц, ДМСО-d6) δ м.д. 2,77-2,86 (м, 2H), 2,92 (тд, J=9,66, 4,38 Гц, 2H), 3,64-3,72 (м, 4H), 3,87 (с, 3H), 7,21-7,28 (м, 2H), 7,31-7,36 (м, 4H), 7,49 (д, J=7,82 Гц, 1H), 7,54-7,60 (м, 1H); MS (DCI+) m/z 339,2 [M+H]+.
Пример 58G
Транс-2-бензил-7-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55D, заменяя соединение, полученное в Примере 58E, на соединение, полученное в Примере 55C. В этом случае лактамное кольцо не раскрывалось. Реакционную смесь концентрировали и остаток обрабатывали 5%-м раствором метоксида натрия в метаноле при температуре 65°C в течение 3 часов. Реакционную смесь концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (дихлорметан:2н аммиак/метанол 97,5:2,5). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,05-2,19 (м, 1H), 2,58-2,68 (м, 1H), 2,79 (т, J=8,33 Гц, 1H), 2,95-3,11 (м, 4H), 3,14-3,23 (м, 1H), 3,75-3,88 (м, 2H), 7,02 (д, J=7,93 Гц, 1H), 7,11-7,18 (м, 1H), 7,24 (тд, J=6,15, 2,38 Гц, 1H), 7,30-7,38 (м, 4H), 7,44 (тд, J=8,03, 5,75 Гц, 1H), 8,25 (с, 1H); MS (DCI+) m/z 311,1 [M+H]+.
Пример 59
Цис-2-бензил-7-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55D, заменяя соединение, полученное в Примере 58F, на соединение, полученное в Примере 55C. В этом случае лактамное кольцо не раскрывалось. Реакционную смесь концентрировали и остаток обрабатывали 5%-м раствором метоксида натрия в метаноле при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (дихлорметан:2н аммиак/метанол 97,5:2,5). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,16-2,30 (м, 1H), 2,46 (с, 2H), 2,67-2,74 (м, 1H), 2,81 (с, 1H), 2,88-3,04 (м, 1H), 3,11 (т, J=8,82 Гц, 1H), 3,52-3,67 (м, 3H), 7,13-7,21 (м, 2H), 7,22-7,29 (м, 1H), 7,32 (д, J=4,41 Гц, 4H), 7,36-7,45 (м, 1H), 8,38 (т, J=5,93 Гц, 1H); MS (DCI+) m/z 311,2 [M+H]+.
Пример 60
Транс-7-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 54B, заменяя соединение, полученное в Примере 58, на соединение, полученное в Примере 54A. 1H ЯМР (501 МГц, ДМСО-d6) δ м.д. 2,01 (ддд, J=7,77, 4,18, 3,98 Гц, 1H), 2,71-2,79 (м, 1H), 2,88-2,96 (м, 1H), 3,00-3,08 (м, 4H), 3,21-3,28 (м, 2H), 7,04 (д, J=7,56 Гц, 1H), 7,14-7,21 (м, 1H), 7,47 (тд, J=7,93, 5,71 Гц, 1H), 8,29 (т, J=5,55 Гц, 1H); MS (DCI+) m/z 221,0 [M+H]+.
Пример 61
(3aS,10bS)-2-Бензил-8-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Соединение, полученное в Примере 55, подвергали хиральному разрешению с использованием сверхкритической жидкостной хроматографии (SFC). Очистку с помощью хиральной препаративной SFC проводили с использованием модифицированной системы Berger Instruments MultigramIITM. Ручная версия системы Berger была интегрирована для автоматического пробоотборника образца инъекций Gilson 232 и устройства для пипетирования, настроенного для отбора фракций при атмосферном давлении Cavro MiniPrepTM (Olson, J.; Pan, J.; Hochlowski, J.; Searle, P.; Blanchard, D. JALA 2002, 7, 69-74). Специально разработанный лоток, позволяющий собирать в 18×150 мм пробирки, и система промывки метанолом позволяет промывать лоток в промежутках между фракциями для максимального выделения и избежать взаимного загрязнения фракций. Используемой колонкой являлась ChiralPak® AS (Chiral Technologies Inc., West Chester, PA), 10 мкм (21,2 мм вн.д. × 250 мм). Использовали градиент 10-30% метанола с 0,1% диэтиламином и диоксидом углерода, при скорости потока 40 мл/минуту, давление на входном отверстии 100 бар и температура печи 35°C. Образец вводили в виде раствора в 1,5 мл метанола. Система препаративной SFC управлялась с помощью SFC ProNToTM программного обеспечения (версия 1.5.305.15 Berger Instruments, Inc.) и специальным программным обеспечением для автоматического пробоотборника и контроля сбора фракций. Фракции собирали, основываясь на пороге УФ сигнала. Полученный продукт подвергали дополнительной очистке посредством флэш-хроматографии на колонке с силикагелем (97:3 дихлорметан:2н аммиак/метанол) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,18 (дд, J=6,35, 3,97 Гц, 1H), 2,60 (т, J=8,72 Гц, 1H), 2,73 (т, J=8,72 Гц, 1H), 2,97-3,11 (м, 2H), 3,13-3,26 (м, 3H), 3,67-3,74 (м, 1H), 3,77-3,84 (м, 1H), 7,15-7,20 (м, 1H), 7,22-7,37 (м, 6H), 7,55 (дд, J=9,91, 2,78 Гц, 1H), 8,10 (с, 1H); MS (DCI+) m/z 311,2 [M+H]+.
Пример 62
Транс-7-фтор-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 54B, заменяя соединение, полученное в Примере 58, на соединение, полученное в Примере 54A. Выделенный продукт не требовал дополнительной очистки. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,04 (тд, J=7,24, 3,37 Гц, 1H), 2,69 (т, J=10,11 Гц, 1H), 2,98-3,03 (м, 1H), 3,05-3,15 (м, 3H), 3,25 (дд, J=9,52, 6,35 Гц, 2H), 7,19-7,34 (м, 2H), 7,45 (дд, J=9,91, 2,78 Гц, 1H), 8,14 (с, 1H); MS (DCI+) m/z 221,1 [M+H]+.
Пример 63
Транс-2-бензил-9-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 55, заменяя метил 2-бром-4-фторбензойную кислоту на 2-бром-5-фторбензойную кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,14-2,28 (м, 1H), 2,59 (т, J=8,65 Гц, 1H), 2,73 (т, J=8,65 Гц, 1H), 2,96-3,09 (м, 2H), 3,12-3,28 (м, 3H), 3,67-3,83 (м, 2H), 6,97 (дд, J=10,00, 2,54 Гц, 1H), 7,13 (тд, J=8,56, 2,54 Гц, 1H), 7,21-7,28 (м, 1H), 7,30-7,38 (м, 4H), 7,85 (дд, J=8,82, 6,10 Гц, 1H), 7,98 (т, J=3,90 Гц, 1H); MS (DCI+) m/z 311,2 [M+H]+.
Пример 64
Транс-9-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 54B, заменяя соединение, полученное в Примере 63, на соединение, полученное в Примере 54A. Препаративную ВЭЖХ использовали для получения указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,05 (тд, J=6,95, 3,39 Гц, 1H), 2,67 (т, J=9,83 Гц, 1H), 2,95-3,11 (м, 5H), 3,13-3,21 (м, 2H), 6,99 (дд, J=10,00, 2,54 Гц, 1H), 7,14 (тд, J=8,65, 2,71 Гц, 1H), 7,75 (дд, J=8,48, 6,10 Гц, 1H), 8,02 (с, 1H); MS (DCI+) m/z 221,1 [M+NH4]+.
Пример 65
Транс-2-бензил-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали исходя из 2-бром-3-фторбензойной кислоты, используя ту же последовательность стадий, что описана при получении Примера 55. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,33 (с, 1H), 2,57-2,72 (м, 2H), 3,01-3,06 (м, 2H), 3,12-3,23 (м, 2H), 3,25-3,29 (м, 1H), 3,68-3,77 (м, 1H), 3,79-3,87 (м, 1H), 7,21-7,38 (м, 7H), 7,51 (дд, J=7,46, 1,36 Гц, 1H), 8,14 (т, J=4,75 Гц, 1H); MS (DCI+) m/z 311,2 [M+H]+.
Пример 66
Цис-2-бензил-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали исходя из 2-бром-3-фторбензойной кислоты, используя последовательность стадий, которая описана для получения Примеров 55A, 55B, 58E и 58F. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,13 (дд, J=10,91, 8,53 Гц, 1H), 2,74-2,82 (м, 1H), 2,84-2,94 (м, 2H), 3,01 2,45-2,55 (м, 2H), (ддд, J=14,67, 5,55, 2,38 Гц, 1H), 3,12 (т, J=8,72 Гц, 1H), 3,53-3,67 (м, 2H), 3,94 (тд, J=10,91, 7,14 Гц, 1H), 7,28-7,35 (м, 6H), 7,41-7,44 (м, 1H), 8,31 (т, J=6,15 Гц, 1H); MS (DCI+) m/z 311,3 [M+H]+.
Пример 67
Транс-10-фтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 54B, заменяя соединение, полученное в Примере 65, на соединение, полученное в Примере 54A. Продукт перекристаллизовывали из этанола. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,37-2,48 (м, 1H), 2,87 (т, J=11,50 Гц, 1H), 3,03-3,17 (м, 4H), 3,58 (тд, J=11,50, 4,36 Гц, 1H), 3,77 (дд, J=10,31, 6,35 Гц, 1H), 7,33-7,48 (м, 3H), 8,19-8,32 (м, 1H), 9,15 (с, 1H); MS (DCI+) m/z 221,1 [M+H]+.
Пример 68
Транс-метил-3-((6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-ил)метил)бензоат
В 50-миллилитровую круглодонную колбу помещали соединение, полученное в Примере 2 (80 мг, 0,396 ммоль), метил 3-формилбензоат (64,9 мг, 0,396 ммоль), уксусную кислоту (119 мг, 1,978 ммоль), макропористый цианоборгидрид (0,55 г, 1,18 ммоль 2,15 ммоль/г) и этанол (3 мл). Реакционную смесь нагревали при температуре 65°C в течение 5 часов и завершение реакции контролировали с помощью LC/MS. Реакционную смесь охлаждали, фильтровали, промывали этанолом и концентрировали. Сырое вещество очищали путем препаративной ВЭЖХ в нейтральной среде с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,96 (м, 2H), 7,89-7,81 (м, 1H), 7,76 (дд, J=1,4, 7,7, 1H), 7,64 (д, J=7,7 Гц, 1H), 7,49 (т, J=7,6 Гц, 1H), 7,42 (тд, J=1,5, 7,5 Гц, 1H), 7,31 (т, J=7,0 Гц, 1H), 7,15 (д, J=7,5 Гц, 1H), 3,97-3,73 (м, 4H), 3,29-2,98 (м, 5H), 2,75 (т, J=8,7, 1H), 2,62 (т, J=8,9 Гц, 1H), 2,22 (дд, J=8,8, 15,8 Гц, 1H); MS (APCI+) m/z 351,0 [M+H]+.
Пример 69
Транс-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 68, заменяя формальдегид на метил 3-формилбензоат. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,98 (с, 1H), 7,84-7,77 (м, 1H), 7,43 (дт, J=3,8, 7,5 Гц, 1H), 7,31 (т, J=7,2 Гц, 1H), 7,16 (д, J=7,6 Гц, 1H), 3,29-2,98 (м, 1H), 2,98-2,87 (м, 5H), 2,64 (дд, J=3,1, 8,3 Гц, 1H), 2,39 (с, 3H), 2,16 (м, 1H); MS (APCI+) m/z 216,9 [M+H]+.
Пример 70
Транс-2-(5-хлор-2-фторбензил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 68, заменяя 5-хлор-2-фторбензальдегид на метил 3-формилбензоат. 1H ЯМР (300 МГц, ДМСО) δ м.д. 8,04-7,95 (м, 1H), 7,75 (дд, J=1,4, 7,7 Гц, 1H), 7,54 (дд, J=2,7, 6,3 Гц, 1H), 7,48-7,12 (м, 5H), 3,90-3,73 (м, 2H), 3,31-2,98 (м, 5H), 2,78 (т, J=8,6 Гц, 1H), 2,66 (т, J=8,9 Гц, 1H), 2,21 (т, J=12,2 Гц, 1H); MS (APCI+) m/z 344,9 [M+H]+.
Пример 71
Транс-2-метил-5-(фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
Пример 71A
Транс-трет-бутил 6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
К суспензии соединения, полученного в Примере 2 (2 г, 9,89 ммоль) в дихлорметане (49,4 мл), добавляли триэтиламин (2,76 мл, 19,78 ммоль) и ди-трет-бутил дикарбонат (2,76 мл, 11,87 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь гасили водой и два раза экстрагировали дихлорметаном. Органические слои промывали один раз водой, сушили над Na2SO4 и растворитель упаривали с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,02 (с, 1H), 7,61 (дд, J=1,1, 7,6 Гц, 1H), 7,52-7,44 (м, 1H), 7,36 (т, J=7,5 Гц, 1H), 7,31-7,18 (м, 1H), 3,70 (дт, J=7,7, 15,3 Гц, 1H), 3,62 (дд, J=8,9, 20,0 Гц, 1H), 3,50 (т, J=8,5 Гц, 1H), 3,26-3,09 (м, 1H), 3,09-2,93 (м, 3H), 2,25-2,11 (м, 1H), 1,42-1,45 (ушир. д, 9H); MS (ESI-) m/z 301,0 [M-H]-.
Пример 71B
Транс-2-метил-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
К раствору соединения, полученного в Примере 71A (2,62 г, 8,66 ммоль) в тетрагидрофуране (87 мл), небольшими порциями добавляли литийалюминийгидрид в тетрагидрофуране (13,00 мл, 26,0 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Осторожно добавляли воду и продукт экстрагировали один раз дихлорметаном, сушили над Na2SO4 и концентрировали с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 7,31 (д, J=7,4 Гц, 1H), 7,20-7,17 (м, 2H), 7,13 (д, J=7,7 Гц, 1H), 4,58 (дд, J=14,5, 48,4 Гц, 2H), 4,01-3,90 (м, 2H), 3,71-3,57 (м, 2H), 3,40 (т, J=10,4 Гц, 1H), 3,19-3,05 (м, 2H), 2,71 (с, 3H), 2,66-2,52 (м, 1H); MS (ESI+) m/z 203,0 [M+H]+.
Пример 71C
Транс-2-метил-5-(фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
К раствору соединения, полученного в Примере 71B (,11 г, 0,544 ммоль) в дихлорметане (1,088 мл), добавляли триэтиламин (0,114 мл, 0,816 ммоль) и бензолсульфонилхлорид (0,087 мл, 0,680 ммоль). Раствор перемешивали в течение 10 минут при комнатной температуре и затем растворитель упаривали. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО) δ м.д. 7,80-7,70 (м, 2H), 7,69-7,59 (м, 1H), 7,58-7,48 (м, 2H), 7,34-7,20 (м, 3H), 7,11-6,97 (м, 1H), 4,69 (д, J=15,5 Гц, 1H), 4,25 (д, J=15,5 Гц, 1H), 4,05 (дд, J=3,9, 13,2 Гц, 1H), 3,96-3,80 (м, 1H), 3,80-3,49 (м, 3H), 3,14-3,05 (м, 1H), 2,93 (с, 3H), 2,30 (ушир.с, 1H); MS (ESI+) m/z 342,9 [M+H]+.
Пример 72
Цис-2-метил-5-(фенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в виде соли трифторуксусной кислоты в соответствии со способом, описанным в Примере 71, заменяя соединение, полученное в Примере 4, на соединение, полученное в Примере 2. 1H ЯМР (400 МГц, ДМСО) δ м.д. 7,85-7,73 (м, 2H), 7,64 (т, J=7,4 Гц, 1H), 7,56 (т, J=7,5 Гц, 2H), 7,28 (т, J=7,6 Гц, 1H), 7,21-7,03 (м, 3H), 4,60 (д, J=14,4 Гц, 1H), 4,39 (д, J=14,5 Гц, 1H), 4,05-3,76 (м, 2H), 3,73-3,55 (м, 1H), 3,50 (д, J=12,1 Гц, 1H), 2,91 (с, 5H), 2,83-2,60 (м, 3H); MS (ESI+) m/z 342,9 [M+H]+.
Пример 73
Транс-5-(3-фторфенилсульфонил)-2-(4-метоксибензил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 20-миллилитровый сцинтилляционный флакон помещали соединение, полученное в Примере 54 (30 мг, 0,0866 ммоль, 1,0 эквивалент), растворенный в 1,0 мл метанола, 4-метоксибензальдегид (10,41 мг, 0,104 ммоль, 1,20 эквивалента) и уксусную кислоту (24,79 мкл, 0,433 ммоль, 5,0 эквивалентов). Содержимое флакона перемешивали при комнатной температуре в течение одного часа. Затем добавляли макропористую цианоборгидридную смолу (38,66 мг, 2,24 ммоль/г); флакон закрывали и перемешивали в течение ночи при комнатной температуре. Смесь затем фильтровали, концентрировали и вновь растворяли в 1,4 мл смеси диметилсульфоксид/метанол (1:1 об./об.). Сырое вещество очищали, используя ВЭЖХ с обращенной фазой, с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5) δ м.д. 2,25-2,35 (м, 1H), 3,07 (т, 1H), 3,20 (т, 1H), 3,31 (т, 1H), 3,40 (т, 1H), 3,72-3,76 (м, 4H), 3,77-3,84 (м, 1H), 4,15 (д, 1H), 4,31 (ддд, 3H), 4,97 (д, 1H), 7,03 (д, 3H), 7,23 (д, 2H), 7,35 (ддд, 1H), 7,44-7,48 (м, 1H), 7,52-7,57 (м, 1H), 7,64-7,65 (м, 1H), 7,79 (т, 2H); MS (ESI+) m/z 467,1 [M+H]+.
Пример 74
Транс-2-(4-фторбензил)-5-(3-фторфенилсульфонил)-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин
В 20-миллилитровый сцинтилляционный флакон помещали соединение, полученное в Примере 54 (30 мг, 0,0866 ммоль, 1,0 эквивалент), растворенный в 1,0 мл метанола, 4-фторбензальдегид (12,90 мг, 0,104 ммоль, 1,20 эквивалента) и уксусную кислоту (24,79 мкл, 0,433 ммоль, 5,0 эквивалентов). Содержимое флакона перемешивали при комнатной температуре в течение одного часа. Затем добавляли макропористую цианоборгидридную смолу (38,66 мг, 2,24 ммоль/г); флакон закрывали и перемешивали в течение ночи при комнатной температуре. Смесь затем фильтровали, концентрировали и вновь растворяли в 1,4 мл смеси диметилсульфоксид/метанол (1:1 об./об.). Сырое вещество очищали, используя ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, пиридин-d5) 2,18-2,29 (м, 1H), 2,98 (тт, 2H), 3,23-3,30 (м, 2H), 3,60 (кв, 1H), 3,69-3,76 (м, 1H), 4,03 (д, 1H), 4,17 (д, 1H), 4,27-4,34 (м, 2H), 4,98 (д, 1H), 7,02 (дд, 1H), 7,21 (т, 2H), 7,24-7,25 (м, 2H), 7,37 (ддд, 1H), 7,47 (дд, 1H), 7,53-7,59 (м, 1H), 7,66 (д, 2H), 7,80 (т, 2H); MS (ESI+) m/z 455,1 [M+H]+.
Пример 75
Транс-8-(4-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
В микроволновый сосуд помещали смесь соединения, полученного в Примере 53 (750 мг, 2,99 ммоль), 4-фторфенилбороновой кислоты (1674 мг, 11,97 ммоль), Cs2CO3 (1170 мг, 3,59 ммоль) и N,N-диметилформамида (6,5 мл). Затем последовательно в атмосфере азота добавляли три-трет-бутилфосфин (0,179 мл, 0,179 ммоль, 1,0 M в толуоле), ацетат палладия(II) (20,15 мг, 0,09 ммоль) и 1,8-диазабицикло[5,4,0]ундец-7-ен (0,067 мл, 0,449 ммоль). Сосуд герметически закрывали и эту смесь затем подвергали облучению с помощью микроволнового аппарата Biotage Initiator™ 2.0 в течение 50 минут при температуре 150°C. Завершение реакции отслеживали с помощью LC/MS. Другую партию обрабатывали в таком же масштабе. После охлаждения реакционных смесей до комнатной температуры две реакционные смеси объединяли и разбавляли этилацетатом и затем фильтровали через слой диатомовой земли. Фильтрат промывали насыщенным солевым раствором (2×) и объединенные водные фазы экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4, затем концентрировали и очищали с помощью флэш-хроматографии метанолом в дихлорметане (0-20%, 0,5% триэтиламин). Получали твердый продукт, который вновь очищали путем кристаллизации из этилацетата с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,07 (д, J=2,1 Гц, 1H), 8,03 (с, 1H), 7,74-7,66 (м, 3H), 7,34-7,22 (м, 3H), 3,34-3,21 (м, 2H), 3,19-3,04 (м, 2H), 2,93 (дд, J=8,9, 10,3 Гц, 1H), 2,71-2,59 (м, 2H), 2,39 (с, 3H), 2,30-2,14 (м, 1H); MS (ESI+) m/z 310,9 [M+H]+.
Пример 76
Транс-8-(3-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 3-фторфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,11 (д, J=2,1 Гц, 1H), 8,05 (с, 1H), 7,77 (дд, J=2,2, 8,0 Гц, 1H), 7,50 (тд, J=2,5, 5,9 Гц, 3H), 7,26 (д, J=8,1 Гц, 1H), 7,21 (тд, J=3,2, 5,9 Гц, 1H), 3,42-3,20 (м, 2H), 3,19-3,05 (м, 2H), 2,97-2,87 (м, 1H), 2,67-2,61 (м, 2H), 2,38 (с, 3H), 2,30-2,15 (м, 1H); MS (ESI+) m/z 310,9 [M+H]+.
Пример 77
Транс-8-(2-фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 2-фторфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,02 (д, J=1,7 Гц, 2H), 7,62 (д, J=8,0 Гц, 1H), 7,53 (дд, J=6,9, 8,9 Гц, 1H), 7,47-7,39 (м, 1H), 7,31 (дт, J=5,7, 14,9 Гц, 3H), 3,39-3,23 (м, 2H), 3,20-3,06 (м, 2H), 2,97-2,88 (м, 1H), 2,68-2,61 (м, 2H), 2,38 (с, 3H), 2,26 (с, 1H); MS (ESI+) m/z 311,0 [M+H]+.
Пример 78
Транс-8-(3,4-дифторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 3,4-дифторфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,08 (т, J=5,0 Гц, 2H), 7,81-7,70 (м, 2H), 7,52 (дд, J=4,6, 9,7 Гц, 2H), 7,26 (д, J=8,1 Гц, 1H), 3,32-3,21 (м, 3H), 3,19-3,03 (м, 2H), 2,97-2,86 (м, 1H), 2,68-2,59 (м, 2H), 2,38 (с, 3H), 2,30-2,13 (м, 1H); MS (ESI+) m/z 328,9 [M+H]+.
Пример 79
Транс-2-метил-8-(4-(трифторметил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 4-(трифторметил)фенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,17 (д, J=2,1 Гц, 1H), 8,07 (с, 1H), 7,85 (дт, J=5,3, 10,9 Гц, 5H), 7,31 (д, J=8,0 Гц, 1H), 3,37-3,23 (м, 2H), 3,20-3,06 (м, 2H), 2,99-2,88 (м, 1H), 2,69-2,62 (м, 2H), 2,39 (с, 3H), 2,22 (с, 1H); MS (ESI+) m/z 361,1 [M+H]+.
Пример 80
Транс-2-метил-8-(нафталин-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя нафталин-2-илбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,26 (д, J=2,1, 1H), 8,23 (с, 1H), 8,02 (д, J=8,2, 3H), 7,98-7,82 (м, 3H), 7,58-7,50 (м, 2H), 7,31 (д, J=8,0, 1H), 3,29 (дд, J=6,8, 10,2 Гц, 3H), 3,16 (дд, J=8,5, 13,5 Гц, 2H), 3,01-2,92 (м, 1H), 2,67 (дд, J=3,2, 8,3 Гц, 1H), 2,40 (с, 3H), 2,27 (с, 1H); MS (ESI+) m/z 343,0 [M+H]+.
Пример 81
Транс-2-метил-8-м-толил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя м-толилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,08 (д, J=2,1 Гц, 1H), 8,03 (с, 1H), 7,71 (дд, J=2,1, 7,9 Гц, 1H), 7,50-7,41 (м, 2H), 7,35 (т, J=7,5 Гц, 1H), 7,24 (д, J=8,0 Гц, 1H), 7,19 (д, J=7,3 Гц, 1H), 3,34-3,21 (м, 2H), 3,19-3,05 (м, 2H), 2,97-2,87 (м, 1H), 2,68-2,61 (м, 2H), 2,38 (с, 6H), 2,25 (дд, J=9,5, 17,0 Гц, 1H); MS (ESI+) m/z 307,0 [M+H]+.
Пример 82
Транс-2-метил-8-p-толил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя п-толилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,07 (д, J=2,1 Гц, 1H), 8,02 (с, 1H), 7,70 (дд, J=2,1, 8,0 Гц, 1H), 7,55 (д, J=8,1 Гц, 2H), 7,25 (дд, J=8,0, 14,2 Гц, 3H), 3,26 (дд, J=9,7, 16,0 Гц, 2H), 3,10 (ддд, J=6,5, 9,5, 13,7 Гц, 2H), 2,97-2,88 (м, 1H), 2,67-2,61 (м, 2H), 2,38 (с, 3H), 2,34 (с, 3H), 2,30-2,18 (м, 1H); MS (ESI+) m/z 307,0 [M+H]+.
Пример 83
Транс-2-метил-8-(4-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 4-(метилсульфонил)фенилбороновую кислоту на 4-фторфенилбороновую кислоту. Кроме того, указанное в заголовке соединение очищали путем препаративной ВЭЖХ. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,04 (д, J=44,5 Гц, 1H), 8,19 (т, J=4,7 Гц, 1H), 8,00 (кв, J=8,7 Гц, 6H), 7,37 (дд, J=8,0, 18,7 Гц, 1H), 4,03 (с, 1H), 3,76 (с, 1H), 3,70-3,45 (м, 1H), 3,26 (с, 4H), 3,18 (д, J=4,8 Гц, 2H), 3,00 (с, 3H), 2,65 (д, J=20,0 Гц, 1H), 2,32 (д, J=12,7 Гц, 1H); MS (ESI+) m/z 371,0 [M+H]+.
Пример 84
Транс-2-метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя 3-(метилсульфонил)фенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,19 (д, J=2,1 Гц, 1H), 8,15 (т, J=1,7 Гц, 1H), 8,09 (с, 1H), 8,06-8,01 (м, 1H), 7,96-7,89 (м, 1H), 7,84 (дд, J=2,1, 8,0 Гц, 1H), 7,76 (т, J=7,8 Гц, 1H), 7,31 (д, J=8,0 Гц, 1H), 3,30 (м, 3H), 3,26 (д, J=3,1 Гц, 2H), 3,20-3,06 (м, 2H), 2,98-2,89 (м, 1H), 2,65 (дд, J=2,0, 8,2 Гц, 2H), 2,39 (с, 3H), 2,23 (дд, J=7,3, 17,7 Гц, 1H); MS (ESI+) m/z 371,0 [M+H]+.
Пример 85
Транс-2-метил-8-стирил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали таким же образом, как описано в Примере 75, заменяя (E)-стирилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,04 (д, J=1,9 Гц, 1H), 8,00 (с, 1H), 7,70-7,59 (м, 3H), 7,42-7,32 (м, 2H), 7,31-7,23 (м, 3H), 7,17 (д, J=8,0 Гц, 1H), 3,30-3,19 (м, 2H), 3,15-3,03 (м, 3H), 2,95-2,86 (м, 1H), 2,63 (дд, J=3,0, 8,3 Гц, 2H), 2,36 (д, J=8,8 Гц, 3H), 2,25-2,12 (м, 1H); MS (ESI+) m/z 319,0 [M+H]+.
Пример 86
Транс-2-метил-8-фенил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
В сосуд для микроволнового воздействия помещали соединение, полученное в Примере 53 (40 мг, 0,16 ммоль), фенилбороновую кислоту (42,8 мг, 0,35 ммоль), K2CO3 (2 M водный раствор, 0,25 мл), FC-1007 (Pd катализатор Johnson Matthey на полимерной подложке, 44,4 мг, 0,36 ммоль/г) и этанол (1 мл). Сосуд герметически закрывали и эту смесь затем подвергали облучению с помощью микроволнового излучателя Biotage Initiator™ 2.0 в течение 40 минут при температуре 150°C. Завершение реакции отслеживали с помощью LC/MS. После охлаждения реакционной смеси до комнатной температуры реакционную смесь фильтровали через слой диатомовой земли и промывали этилацетатом. Фильтрат концентрировали и очищали путем препаративной ВЭЖХ с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,09 (д, J=2,1 Гц, 1H), 8,02 (с, 1H), 7,73 (дд, J=2,1, 7,9 Гц, 1H), 7,68-7,62 (м, 2H), 7,47 (т, J=7,4 Гц, 2H), 7,38 (д, J=7,4 Гц, 1H), 7,25 (д, J=8,0 Гц, 1H), 3,28 (дд, J=8,5, 18,8 Гц, 2H), 3,18-3,04 (м, 2H), 2,97-2,88 (м, 1H), 2,68-2,62 (м, 2H), 2,38 (с, 3H), 2,24 (дд, J=9,6, 16,7, 1H); MS (ESI+) m/z 292,9 [M+H]+.
Пример 87
Транс-2-метил-8-фенетил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
В 50-миллилитровый сосуд для работы под давлением помещали смесь соединения, полученного в Примере 85 (31,8 мг, 0,100 ммоль), 5%-й палладий-на-углероде, влажный (7,95 мг, 0,075 ммоль) и метанол (10 мл). Смесь перемешивали в течение 5 часов в атмосфере водорода (30 фунтов на квадратный дюйм) при комнатной температуре. Завершение реакции контролировали с помощью LC/MS. Смесь фильтровали через нейлоновую мембрану, концентрировали и очищали путем хроматографии на силикагеле, элюируя градиентом метанола в дихлорметане (0-20%) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,90 (т, J=3,6 Гц, 1H), 7,71 (д, J=1,9 Гц, 1H), 7,32-7,12 (м, 6H), 7,06 (д, J=7,8 Гц, 1H), 3,27-3,13 (м, 2H), 3,07 (дт, J=9,2, 18,4 Гц, 2H), 2,92-2,82 (м, 5H), 2,65-2,56 (м, 2H), 2,35 (д, J=3,9 Гц, 3H), 2,20-2,06 (м, 1H); MS (ESI+) m/z 321,0 [M+H]+.
Пример 88
Транс-метил 2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксилат
Пример 88A
Диметил 4-бромизофталат
К раствору 4-бромизофталевой кислоты (5,13 г, 20,94 ммоль) в метаноле (55 мл) при температуре 0°C добавляли по каплям тионилхлорид (6,09 мл, 84 ммоль). Реакционную смесь оставляли перемешиваться 24 часа при комнатной температуре. Затем реакционную смесь концентрировали. Полученный осадок обрабатывали этилацетатом и промывали насыщенным раствором NaHCO3 (водн.). Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, концентрировали и сушили при лабораторном вакууме с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,28 (д, J=2,0 Гц, 1H), 7,97 (дт, J=5,2, 16,5 Гц, 2H), 3,89 (с, 3H), 3,31 (с, 3H).
Пример 88B
Диметил 4-(транс-4-циано-1-метилпирролидин-3-ил)изофталат
В сосуд для микроволнового облучения в атмосфере азота помещали диметил 4-бромизофталат (Пример 88A, 500 мг, 1,83 ммоль), акрилонитрил (117 мг, 2,20 ммоль), N,N-дициклогексилметиламин (429 мг, 2,20 ммоль), три-трет-бутилфосфин (0,11 мл, 0,11 ммоль, 1,0 M в толуоле), трис(дибензилиленацетон)дипалладий(0) (50,3 мг, 0,055 ммоль) и 1,4-диоксан (1,4 мл). Реакционную смесь нагревали при температуре 80°C на масляной бане в течение 4 часов. Реакция протекала полностью, как определялось с помощью тонкослойной хроматографии (40% этилацетат/гексан). Реакционную смесь охлаждали до комнатной температуры и разбавляли этилацетатом. HBr соли удаляли путем фильтрования. Фильтрат концентрировали. Остаток обрабатывали этилацетатом/гексан(1:6) с получением диметил 4-(2-циановинил)изофталата в виде смеси транс- и цис-изомеров (соотношение 5,5:1), который использовали на следующей стадии без дополнительной очистки.
В 100-миллилитровую круглодонную колбу помещали диметил 4-(2-циановинил)изофталат (380 мг, 1,55 ммоль), 2-(метиламино)уксусную кислоту (276 мг, 3,1 ммоль), параформальдегид (326 мг, 10,85 ммоль) и толуол (5 мл). Реакционную смесь нагревали при температуре 125°C в атмосфере азота в течение 2 часов. Затем раствор переносили в другой сосуд, оставляя темную смолу. Добавляли 2-(метиламино)уксусную кислоту (276 мг, 3,1 ммоль) и параформальдегид (326 мг, 10,85 ммоль). Реакционную смесь нагревали при температуре 125°C в атмосфере азота в течение еще 2 часов. Затем смесь охлаждали и концентрировали и распределяли между насыщенным раствором NaHCO3 (водн.) и этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, концентрировали и очищали путем флэш-хроматографии с помощью смеси 80-100% этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,30 (д, J=1,9 Гц, 1H), 8,13 (дд, J=2,0, 8,3 Гц, 1H), 7,81 (д, J=8,3 Гц, 1H), 4,43-4,33 (м, 1H), 3,89 (д, J=5,7 Гц, 3H), 3,36 (кв, J=8,1 Гц, 1H), 3,30 (с, 3H), 3,20-3,10 (м, 1H), 3,02-2,92 (м, 1H), 2,75 (дд, J=6,4, 9,2 Гц, 1H), 2,62 (дд, J=5,5, 9,5 Гц, 1H), 2,34 (с, 3H); MS (ESI+) m/z 302,9 [M+H]+.
Пример 88C
Транс-метил 2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксилат
Указанное в заголовке соединение получали таким же образом, как показано в Примере 45C, заменяя соединение, полученное в Примере 88B, на соединение, полученное в Примере 45B. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (д, J=1,9 Гц, 1H), 8,12 (с, 1H), 7,99 (дд, J=1,9, 8,0 Гц, 1H), 7,32 (д, J=8,0 Гц, 1H), 3,92-3,81 (м, 3H), 3,31-3,23 (м, 2H), 3,13 (ддд, J=4,4, 6,9, 9,8 Гц, 2H), 2,94-2,83 (м, 1H), 2,62 (д, J=8,2 Гц, 2H), 2,36 (с, 3H), 2,20 (тд, J=7,6, 15,4 Гц, 1H); MS (ESI+) m/z 274,9 [M+H]+.
Пример 89
Транс-10-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88, заменяя 2-бром-3-фторбензойную кислоту на 4-бромизофталевую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,14 (т, J=1,0 Гц, 1H), 7,55 (дд, J=1,0, 6,5 Гц, 1H), 7,33 (м, 1H), 7,28 (м, 1H), 3,22 (ддд, J=1,5, 6,5, 8,0 Гц, 1H), 3,13 (ддд, J=6,0, 10,5, 10,5 Гц, 1H), 3,08 (м, 1H), 3,03 (м, 2H), 2,62 (т, J=9,0 Гц, 1H), 2,58 (т, J=9,0 Гц, 1H), 2,37 (с, 3H) и 2,31 (м, 1H); MS (ESI+) m/z 235 [M+H]+.
Пример 90
Транс-9-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88, заменяя 2-бром-4-фторбензойную кислоту на 4-бромизофталевую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,96 (т, J=0,9 Гц, 1H), 7,90 (дд, J=6,3, 8,7 Гц, 1H), 7,12 (дт, J=2,7, 8,7 Гц, 1H), 6,97 (дд, J=2,4, 9,9 Гц, 1H), 3,27 (м, 1H), 3,23 (м, 1H), 3,08 (м, 2H), 2,85 (дд, J=8,7, 10,2 Гц, 1H), 2,64 (т, J=9,0 Гц, 1H), 2,57 (т, J=9,0 Гц, 1H) 2,35 (с, 3H) и 2,20 (м, 1H); MS (ESI+) m/z 235 [M+H]+.
Пример 91
Транс-8-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88, заменяя 2-бром-5-фторбензойную кислоту на 4-бромизофталевую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,10 (т, J=1,0 Гц, 1H), 7,59 (дд, J=3,0, 10,5 Гц, 1H), 7,27 (дт, J=3,0, 8,5 Гц, 1H), 7,18 (дд, J=5,5, 8,5 Гц, 1H), 3,25 (м, 1H), 3,19 (м, 1H), 3,12 (м, 1H), 3,09 (м, 1H), 2,84 (дд, J=9,0, 10,5 Гц, 1H), 2,61 (м, 2H), 2,37 (с, 3H) и 2,17 (м, 1H); MS (ESI+) m/z 235 [M+H]+.
Пример 92
Транс-7-фтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88, заменяя 2-бром-6-фторбензойную кислоту на 4-бромизофталевую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,26 (т, J=1,0 Гц, 1H), 7,45 (м, 1H), 7,14 (т, J=9,5 Гц, 1H), 7,03 (д, J=7,5 Гц, 1H), 3,09 (м, 1H), 3,04 (м, 2H), 2,97 (м, 2H), 2,72 (т, J=8,5 Гц, 1H), 2,60 (т, J=9,0 Гц, 1H), 2,40 (с, 3H) и 2,10 (м, 1H); MS (ESI+) m/z 235 [M+H]+.
Пример 93
Транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 93A
4,5-Дигидробензо[b]фуро[3,4-d]оксепин-1,3-дион
К трет-бутоксиду калия (1,35 г, 12 ммоль) в тетрагидрофуране (30 мл) добавляли по каплям диэтилоксалат (2,2 г, 15 ммоль) и этил 4-феноксибутаноат (2,08 г, 10 ммоль) в тетрагидрофуране (30 мл) при температуре 0°C. Смесь оставляли перемешиваться в течение ночи, концентрировали, гасили с помощью 1н HCl (водн.), экстрагировали этилацетатом и концентрировали. Фракцию этого вещества (308 мг, 1 ммоль) добавляли к концентрированной H2SO4 при температуре 0°C. Смесь перемешивали в течение 1,5 часов и выливали на дробленый лед. Образовавшийся осадок собирали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,44 (дд, J=1,5, 8,1 Гц, 1H), 7,48 (т, J=8,1 Гц, 1H), 7,25 (т, J=7,8 Гц, 1H), 7,14 (д, J=8,4 Гц, 1H), 4,28 (т, J=5,1 Гц, 2H) и 3,02 (т, J=5,1 Гц, 2H).
Пример 93B
Цис-N-бензил-4,5-дигидробензо[b]пиро[3,4-d]оксепин-1,3-дион
и
Пример 93C
Транс-N-бензил-4,5-дигидробензо[b]пиро[3,4-d]оксепин-1,3-дион
К соединению, полученному в Примере 93A (3,1 г, 14 ммоль) в метаноле (60 мл), добавляли 5%-й палладий-на-углероде, влажный (0,93 г, 8,7 ммоль) в 250-миллилитровом стальном сосуде для работы под давлением и смесь перемешивали в течение 16 часов в атмосфере водорода (30 фунтов на квадратный дюйм) при температуре 50°C. Смесь фильтровали через нейлоновую мембрану и концентрировали. Это сырое вещество растворяли в N,N-диметилформамиде (30 мл), затем добавляли бензиламин (1,3 г, 12,5 ммоль), триэтиламин (1,5 г, 15 ммоль) и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат (4 г, 12,5 ммоль). Смесь перемешивали при комнатной температуре в течение 5 часов. Добавляли этилацетат и смесь промывали водой (3×) и концентрировали. Сырой продукт обрабатывали 1н гидроксидом лития в смеси метанол:вода (5:3, 20 мл) и гасили с помощью HCl (водн.) (1 M) спустя 4 часа. Смесь экстрагировали этилацетатом и концентрировали. Сырой продукт растворяли в N,N-диметилформамиде (20 мл), затем добавляли триэтиламин (2 г, 20 ммоль) и O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторборат (4 г, 12,5 ммоль). Смесь нагревали при температуре 80°C в течение 1 часа. Добавляли этилацетат и смесь промывали водой (3×). Очистка с помощью колоночной хроматографии, элюируя смесью 30% этилацетат/гексан, давала указанные в заголовке соединения.
Пример 93B: 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,27-7,38 (м, 7H), 7,19 (дт, J=1,2, 7,2 Гц, 1H), 7,02 (д, J=7,2 Гц, 1H), 4,68 (д, J=15,3 Гц, 1H), 4,63 (д, J=15,3 Гц, 1H), 4,23 (д, J=9,6 Гц, 1H), 3,80 (дд, J=3,0, 9,3 Гц, 2H), 3,42 (м, 1H), 1,94 (м, 1H) и 1,72 (м, 1H).
Пример 93C: 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,68 (д, J=8,4 Гц, 1H), 7,20-7,37 (м, 6H), 7,11 (дт, J=1,2, 7,5 Гц, 1H), 7,05 (дд, J=1,5, 7,8 Гц, 1H), 4,67 (д, J=15,0 Гц, 1H), 4,62 (д, J=15,0 Гц, 1H), 4,51 (м, 2H), 3,58 (м, 1H), 2,94 (м, 1H) и 2,23 (м, 2H).
Пример 93D
Транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
К соединению, полученному в Примере 93C (200 мг, 0,65 ммоль) в тетрагидрофуране (1,5 мл), добавляли литийалюминийгидрид (1,5 мл, 1н в толуоле, 1,5 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и гасили метанолом и NaHCO3 (водн.). Добавляли этилацетат и смесь фильтровали через диатомовую землю. Фильтрат концентрировали и очищали путем флэш-хроматографии, элюируя с помощью смеси 50% этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,34 (м, 4H), 7,24 (м, 1H), 7,12 (т, J=7,5 Гц, 1H), 7,03 (т, J=7,0 Гц, 1H), 6,98 (т, J=7,5 Гц, 1H), 6,94 (д, J=8,0 Гц, 1H), 4,35 (дт, J=2,5, 12,5 Гц, 1H), 3,79 (д, J=13 Гц, 1H), 3,64 (д, J=13 Гц, 1H), 3,23 (д, J=10 Гц, 1H), 3,22 (м, 1H), 3,13 (дд, J=6,4, 8,5 Гц, 1H), 2,90 (дд, J=9,0, 10 Гц, 1H), 2,76 (т, J=9,5 Гц, 1H), 2,59 (дд, J=7,0, 9,0 Гц, 1H), 1,96 (м, 1H) и 1,84 (м, 2H); MS (ESI+) m/z 280 [M+H]+.
Пример 94
Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 94A
трет-Бутил транс-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
К соединению, полученному в Примере 93 (90 мг, 0,32 ммоль) в трифторэтаноле (20 мл), добавляли 20% Pd(OH)2-углерод, влажный, (18 мг, 0,13 ммоль) в 50-миллилитровом сосуде для работы под давлением и смесь перемешивали в течение 2 часов в атмосфере водорода (30 фунтов на квадратный дюйм) при температуре 50°C. Смесь фильтровали через нейлоновую мембрану и концентрировали. Это сырое вещество растворяли в дихлорметане (3 мл) и добавляли ди-трет-бутил дикарбонат (218 мг, 1 ммоль). Смесь перемешивали при комнатной температуре в течение ночи и очищали путем флэш-хроматографии, элюируя с помощью смеси 20% этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,18 (м, 1H), 7,06 (м, 2H), 6,97 (д, J=7,5 Гц, 1H), 4,37 (дт, J=2,4, 12,3 Гц, 1H), 3,83 (дд, J=7,5, 10,2 Гц, 1H), 3,58 (м, 3H), 3,22 (м, 1H), 3,01 (кв, J=10,2 Гц, 1H), 2,02 (м, 2H), 1,83 (м, 1H) и 1,42 (с, 9H).
Пример 94B
Гидрохлорид транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррола
Соединение, полученное в Примере 94A (30 мг, 0,10 ммоль), обрабатывали 4н HCl в диоксане (1 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали и растирали в этилацетате с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,25 (с, 2H), 7,22 (дт, J=1,5, 6,5 Гц, 1H), 7,11 (т, J=6,0 Гц, 1H), 7,07 (д, J=7,0 Гц, 1H), 7,01 (д, J=7,0 Гц, 1H), 4,00 (дт, J=3,5, 12,5 Гц, 1H), 3,71 (дд, J=7,0, 11 Гц, 1H), 3,54 (м, 2H), 3,46 (т, J=11,5 Гц, 1H), 3,29 (м, 1H), 2,94 (т, J=11 Гц, 1H), 2,09 (д, J=7,0 Гц, 1H), 2,00 (м, 1H) и 1,80 (м, 1H); MS (ESI+) m/z 180 [M+H]+.
Пример 95
Транс-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Соединение, полученное в Примере 94A (29 мг, 0,1 ммоль) и N-хлорсукцинимид (27 мг, 0,2 ммоль) нагревали в N,N-диметилформамиде (0,3 мл) при температуре 80°C в течение 3 часов. Реакционную смесь разбавляли этилацетатом, промывали водой (3×) и концентрировали. Сырой остаток перемешивали с 4н HCl в диоксане (1 мл) в течение 2 часов, концентрировали и растирали в этилацетате с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,21 (с, 2H), 7,27 (дд, J=2,5, 8,5 Гц, 1H), 7,17 (д, J=2,0 Гц, 1H), 7,04 (д, J=8,5 Гц, 1H), 4,00 (дт, J=3,5, 12,0 Гц, 1H), 3,72 (дд, J=7,0, 11 Гц, 1H), 3,54 (м, 2H), 3,47 (т, J=11,5 Гц, 1H), 3,29 (м, 1H), 2,94 (т, J=11 Гц, 1H), 2,06 (м, 2H) и 1,82 (м, 1H); MS (ESI+) m/z 224 [M+H]+.
Пример 96
Цис-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 94, заменяя соединение, полученное в Примере 93B, на соединение, полученное в Примере 93C. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,37 (с, 2H), 7,26 (м, 2H), 7,11 (дт, J=1,0, 7,5 Гц, 1H), 6,69 (дд, J=1,0, 7,0 Гц, 1H), 4,17 (дт, J=3,5, 12,0 Гц, 1H), 3,83 (ддд, J=4,0, 9,0, 12,5 Гц, 1H), 3,62 (кв, J=8,5 Гц, 1H), 3,49 (дд, J=8,0, 11,5 Гц, 1H), 3,42 (дд, J=7,0, 11,5 Гц, 1H), 3,25 (т, J=10,5 Гц, 1H), 2,96 (дд, J=7,0, 11,5 Гц, 1H), 2,68 (м, 1H) и 1,70 (м, 2H); MS (ESI+) m/z 180 [M+H]+.
Пример 97
Транс-2-бензил-2,3,3a,4,5,11c-гексагидро[1]бензотиено[2,3-c]пирроло[3,4-e]азепин-6(1H)-он
Пример 97A
Метил 3-бромбензо[b]тиофен-2-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 55A, заменяя 3-бромбензо[b]тиофен-2-карбоновую кислоту на 2-бром-5-фторбензойную кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,92 (с, 3H), 7,59-7,69 (м, 2H), 7,93-8,00 (м, 1H), 8,14 (д, J=7,12 Гц, 1H).
Пример 97B
(E)-Метил 3-(2-циановинил)бензо[b]тиофен-2-карбоксилат
В колбу в атмосфере азота помещали трис(дибензилиленацетон)дипалладий(0) (313 мг, 0,34 ммоль) в 25 мл 1,4-диоксана, затем продукт, полученный в Примере 97A (4,5 г, 16,7 ммоль), N-метилдициклогексиламин (3,91 г, 20,0 ммоль), три-трет-бутилфосфин (0,68 мл 1,0 M раствора в толуоле, 0,68 ммоль) и акрилонитрил (1,06 г, 20,0 ммоль). Смесь перемешивали и нагревали при температуре 50°C в атмосфере азота в течение 90 минут и затем охлаждали и разбавляли 100 мл этилацетата и перемешивали в течение 15 минут. Смесь фильтровали и образовавшийся осадок промывали 25 мл этилацетата. Фильтрат концентрировали и обрабатывали, как описано в Примере 55B, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,92 (с, 3H), 6,55 (д, J=17,29 Гц, 1H), 7,54-7,66 (м, 2H), 8,13-8,25 (м, 3H).
Пример 97C
Транс-2-бензил-2,3,3a,4,5,11c-гексагидро[1]бензотиено[2,3-c]пирроло[3,4-e]азепин-6(1H)-он
Указанное в заголовке соединение получали, как описано в Примерах 45B и 45C, исходя из продукта, полученного в Примере 97B. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,51-2,62 (м, 2H), 2,85-2,98 (м, 2H), 3,52 (д, J=7,80 Гц, 1H), 3,76-3,91 (м, 3H), 7,21-7,27 (м, 1H), 7,30-7,45 (м, 7H), 7,81-7,94 (м, 2H), 8,27 (дд, J=5,43, 2,37 Гц, 1H); MS (DCI+) m/z 349,1 [M+H]+.
Пример 98
Транс-2-бензил-8,10-диметокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как описано в Примере 1, заменяя метил 2-формил-3,5-диметоксибензоат на метил 2-формилбензоат. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,13-2,28 (м, 1H), 2,52-2,66 (м, 2H), 2,89-3,02 (м, 3H), 3,17 (дд, J=8,99, 5,93 Гц, 1H), 3,31-3,42 (м, 1H), 3,67-3,80 (м, 8H), 6,63 (д, J=2,37 Гц, 1H), 6,73 (д, J=2,71 Гц, 1H), 7,20-7,35 (м, 5H), 8,02 (т, J=5,43 Гц, 1H); MS (DCI+) m/z 353,2 [M+H]+.
Пример 99
Транс-2,3,3a,4,5,11c-гексагидро[1]бензотиено[2,3-c]пирроло[3,4-e]азепин-6(1H)-он
Продукт по Примеру 97 (315 мг, 0,90 ммоль) растворяли в смеси 10 мл этанола в атмосфере азота и обрабатывали уксусной кислотой (162 мг, 2,70 ммоль), 1,4-циклогександиеном (361 мг, 4,50 ммоль) и 10%-м палладием-на-углероде (300 мг). Смесь перемешивали и нагревали при температуре 51°C в течение 16 часов. Реакционную смесь охлаждали и фильтровали через слой диатомовой земли, промывали этанолом (10 мл) и фильтрат концентрировали. Остаток очищали посредством флэш-хроматографии на колонке с силикагелем (95:5 дихлорметан:2 M аммиак в метаноле) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,39 (дд, J=10,85, 7,12 Гц, 1H), 2,63-2,77 (м, 3H), 3,08 (дд, J=9,49, 7,46 Гц, 2H), 4,07 (дд, J=9,66, 7,63 Гц, 1H), 7,35-7,47 (м, 3H), 7,92 (д, J=7,80 Гц, 3H), 8,28 (д, J=3,73 Гц, 1H); MS (DCI+) m/z 259,1 [M+H]+.
Пример 100
Транс-8,10-диметокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как указано в Примере 2, заменяя продукт, полученный по Примеру 98, на продукт по Примеру 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,00-2,14 (м, 1H), 2,56-2,65 (м, 1H), 2,71 (тд, J=11,90, 5,95 Гц, 1H), 2,84-2,99 (м, 3H), 3,16-3,28 (м, 1H), 3,39-3,48 (м, 2H), 3,73 (с, 3H), 3,76 (с, 3H), 6,64 (д, J=2,38 Гц, 1H), 6,72 (д, J=2,78 Гц, 1H), 8,04 (т, J=5,35 Гц, 1H); MS (DCI+) m/z 263,1 [M+H]+.
Пример 101
Транс-8-бензил-6,6a,7,8,9,9a-гексагидропирроло[3,4-e]тиено[3,2-c]азепин-4(5H)-он
Указанное в заголовке соединение получали, как описано в Примере 97, заменяя 2-бром-3-тиофенкарбоновую кислоту на 3-бромбензо[b]тиофен-2-карбоновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,20 (т, J=8,99 Гц, 1H), 2,25-2,33 (м, 1H), 2,76-2,85 (м, 1H), 2,87-3,01 (м, 2H), 3,03-3,15 (м, 2H), 3,55 (с, 2H), 3,65-3,76 (м, 1H), 7,18 (д, J=5,09 Гц, 1H), 7,22-7,35 (м, 6H), 7,95 (т, J=5,76 Гц, 1H); MS (DCI+) m/z 299,1 [M+H]+.
Пример 102
Транс-2-бензил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как описано в Примере 97, заменяя 2-бром-6-(трифторметокси)бензойную кислоту на 3-бромбензо[b]тиофен-2-карбоновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,13 (д, J=5,76 Гц, 1H), 2,60-2,69 (м, 1H), 2,79 (т, J=8,14 Гц, 1H), 2,92-3,01 (м, 2H), 3,02-3,12 (м, 2H), 3,16-3,26 (м, 1H), 3,76-3,89 (м, 2H), 7,21-7,27 (м, 2H), 7,30-7,38 (м, 5H), 7,49-7,59 (м, 1H), 8,32 (т, J=5,76 Гц, 1H); MS (DCI+) m/z 377,2 [M+H]+.
Пример 103
Транс-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как указано в Примере 2, заменяя продукт, полученный по Примеру 102, на продукт, полученный по Примеру 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,92-2,06 (м, 1H), 2,73 (дд, J=11,53, 9,49 Гц, 1H), 2,88-3,04 (м, 5H), 3,19-3,25 (м, 2H), 7,25 (д, J=7,46 Гц, 1H), 7,34 (д, J=8,48 Гц, 1H), 7,56 (т, J=7,97 Гц, 1H), 8,35 (т, J=5,59 Гц, 1H); MS (DCI+) m/z 287,1 [M+H]+.
Пример 104
Транс-6,6a,7,8,9,9a-гексагидропирроло[3,4-e]тиено[3,2-c]азепин-4(5H)-он
Указанное в заголовке соединение получали, как описано в Примере 99, заменяя продукт, полученный по Примеру 101, на продукт, полученный по Примеру 97. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,92-2,06 (м, 1H), 2,73 (дд, J=11,53, 9,49 Гц, 1H), 2,88-3,04 (м, 4H), 3,19-3,25 (м, 2H), 7,25 (д, J=7,46 Гц, 1H), 7,34 (д, J=8,48 Гц, 1H), 7,56 (т, J=7,97 Гц, 1H), 8,35 (т, J=5,59 Гц, 1H); MS (DCI+) m/z 209,1 [M+H]+.
Пример 105
(3aS,10bS)-2-Бензил-8,10-дифтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как указано в Примере 97, заменяя 2-бром-3,5-дифторбензойную кислоту на 3-бромбензо[b]тиофен-2-карбоновую кислоту. Рацемическую смесь подвергали хиральной очистке, используя колонку Chiralpak® AS, 5 см вн. диам. × 50 см (мобильная фаза: гексаны/этилацетат/метанол/диэтиламин 70:15:15:0,1, скорость потока 75 мл/минута, температура колонки 40°C, определение при УФ 230 нм), время удерживания 39 минут, получая указанное в заголовке соединение. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,26-2,41 (м, 1H), 2,56-2,71 (м, 2H), 3,01-3,14 (м, 4H), 3,28 (с, 1H), 3,67-3,74 (м, 1H), 3,79-3,86 (м, 1H), 7,20-7,28 (м, 1H), 7,29-7,35 (м, 5H), 7,36-7,39 (м, 1H), 8,26 (т, J=4,75 Гц, 1H); MS (DCI+) m/z 329,2 [M+H]+.
Пример 106
(3aR,10bS)-8,10-Дифтор-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как описано в Примере 2, заменяя продукт, полученный по Примеру 105, на продукт, полученный по Примеру 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,18 (дд, J=11,53, 3,39 Гц, 1H), 2,59-2,67 (м, 1H), 2,82 (ддд, J=11,61, 5,68, 5,43 Гц, 1H), 2,87-2,95 (м, 1H), 3,05 (т, J=4,75 Гц, 2H), 3,16-3,26 (м, 2H), 7,27-7,38 (м, 2H), 8,29 (с, 1H); MS (DCI+) m/z 239,1 [M+H]+.
Пример 107
Транс-2-бензил-8-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 107A
Этил 4-(3-фторфенокси)бутаноат
Смесь 3-фторфенола (10,0 г, 89,2 ммоль), этил-4-бромбутаноата (21,5 г, 110 ммоль), карбоната калия (17,3 г, 125 ммоль) и 100 мл N,N-диметилформамида перемешивали и нагревали при температуре 100°C в атмосфере азота в течение 16 часов. Реакционную смесь охлаждали и распределяли между этилацетатом и водой. Водную часть отделяли и экстрагировали 2×50 мл этилацетата. Объединенные органические экстракты промывали 3×50 мл воды и 1×50 мл насыщенного солевого раствора и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (95:5 гексан:этилацетат) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,18 (т, J=7,12 Гц, 3H), 1,91-2,00 (м, 2H), 2,44 (т, J=7,29 Гц, 2H), 4,00 (т, J=6,44 Гц, 2H), 4,07 (кв, J=7,12 Гц, 2H), 6,71- 6,82 (м, 3H), 7,25-7,34 (м, 1H); MS (DCI+) m/z 244,1 [M+NH4]+.
Пример 107B
8-Фтор-4,5-дигидробензо[b]фуро[3,4-d]оксепин-1,3-дион
Указанное в заголовке соединение получали, как указано в Примере 93A, заменяя продукт по Примеру 107A на этил 4-феноксибутаноат. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,02 (т, J=5,16 Гц, 2H), 4,32 (т, J=5,16 Гц, 2H), 7,05 (дд, J=10,11, 2,58 Гц, 1H), 7,16 (тд, J=8,53, 2,78 Гц, 1H), 8,51 (дд, J=9,12 6,74 Гц, 1H).
Пример 107C
(Z)-Диметил 8-фтор-2,3-дигидробензо[b]оксепин-4,5-дикарбоксилат
В суспензию продукта по Примеру 107B (2,34 г, 10,0 ммоль) в 20 мл метанола одной порцией добавляли метоксид натрия (594 мг, 11,0 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа и затем концентрировали. Остаток обрабатывали 25 мл N,N-диметилформамида при комнатной температуре и добавляли одной порцией метилйодид (2,28 г, 15,0 ммоль) и перемешивание продолжали в течение 2,5 часов. Реакционную смесь распределяли между 1н водной соляной кислотой и этилацетатом. Водную часть отделяли и экстрагировали 2×50 мл этилацетата. Объединенные органические экстракты промывали 2×50 мл воды и 1×50 мл насыщенным солевым раствором и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали путем флэш-хроматографии на колонке с силикагелем (15:85 этилацетат:гексан) с получением указанного в заголовке соединения 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,70 (т, J=5,76 Гц, 2H), 3,74 (с, 3H), 4,48 (т, J=5,76 Гц, 2H), 6,99-7,09 (м, 2H), 7,26 (дд, J=8,82, 6,44 Гц, 1H); MS (DCI+) m/z 298,1 (M+NH4)+.
Пример 107D
Транс-диметил 8-фтор-2,3,4,5-тетрагидробензо[b]оксепин-4,5-дикарбоксилат
В высушенную в печи колбу помещали магниевую стружку (1,46 г, 60,0 ммоль) в атмосфере азота и затем одной порцией добавляли раствор продукта по Примеру 107C (1,70 г, 6,1 ммоль) в 50 мл метанола при комнатной температуре. Реакционную смесь перемешивали при температуре окружающей среды в течение 16 часов и затем концентрировали. Остаток распределяли между 2н водным раствором HCl и этилацетатом. Водную часть отделяли и экстрагировали 2×50 мл этилацетата и объединенные органические экстракты промывали 50 мл 10%-го водного раствора бикарбоната натрия и 50 мл насыщенного солевого раствора и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (9:1 гексан:этилацетат с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,03-2,15 (м, 2H), 3,38 (кв, J=5,55 Гц, 1H), 3,55 (с, 3H), 3,61 (с, 3H), 3,83-3,92 (м, 1H), 4,07-4,15 (м, 1H), 4,32 (д, J=5,55 Гц, 1H), 6,80 6,93 (м, 2H), 7,17 (дд, J=8,33, 6,74 Гц, 1H); MS (DCI+) m/z 300,2 [M+NH4]+.
Пример 107E
(Транс-8-фтор-2,3,4,5-тетрагидробензо[b]оксепин-4,5-диил)диметанол
Раствор продукта по Примеру 107D (695 мг, 2,46 ммоль) в 10 мл тетрагидрофурана охлаждали до температуры -70°C в атмосфере азота и обрабатывали по каплям литийалюминийгидридом (5,0 мл 1,0 M раствора в тетрагидрофуране). После завершения добавления реакционной смеси давали нагреться до комнатной температуры в течение 3 часов и затем гасили с помощью 5 мл этилацетата, затем 15 мл 2н раствора водной соляной кислоты. Слои разделяли и водную часть экстрагировали 4×10 мл этилацетата и объединенные органические экстракты сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем, (100%) этилацетат, с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,71 (дд, J=12,89, 2,03 Гц, 1H), 2,01-2,15 (м, 2H), 2,86 (тд, J=7,71, 3,90 Гц, 1H), 3,16-3,29 (м, 2H), 3,52 (ддд, J=10,51, 7,12, 5,43 Гц, 1H), 3,66-3,78 (м, 2H), 4,12 (дт, J=12,12, 4,11 Гц, 1H), 4,48 (т, J=5,09 Гц, 1H), 4,59 (т, J=5,43 Гц, 1H), 6,71 (дд, J=10,17, 2,71 Гц, 1H), 6,81 (тд, J=8,31, 2,71 Гц, 1H), 7,12 (дд, J=8,48, 6,78 Гц, 1H); MS (DCI+) m/z 226,1 [M+NH4]+.
Пример 107F
(Транс-8-фтор-2,3,4,5-тетрагидробензо[b]оксепин-4,5-диил)бис(метилен)бис(4-метилбензолсульфонат)
К раствору продукта по Примеру 107E (410 мг, 1,81 ммоль) в 10 мл пиридина в атмосфере азота и охлаждая на ледяной бане одной порцией добавляли тозилхлорид (715 мг, 3,75 ммоль). Перемешивание продолжали в течение 16 часов при комнатной температуре. Реакционную смесь гасили с помощью 10 мл воды и водную часть отделяли и экстрагировали 2×10 мл этилацетата. Объединенные органические экстракты промывали 2×10 мл воды и 1×10 мл насыщенного солевого раствора и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (3:7 этилацетат:гексан с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,58 (д, J=13,48 Гц, 1H), 1,85-1,95 (м, 1H), 2,30 (тд, J=7,54, 3,17 Гц, 1H), 2,40 (с, 2H), 2,41 (с, 1H), 3,09 (тд, J=7,54, 3,97 Гц, 1H), 3,40-3,51 (м, 1H), 3,83 (дд, J=7,54, 1,98 Гц, 2H), 3,97-4,06 (м, 1H), 4,10-4,19 (м, 1H), 4,31 (дд, J=9,52, 6,74 Гц, 1H), 6,62 (дд, J=9,91, 2,78 Гц, 1H), 6,75 (тд, J=8,53, 2,78 Гц, 1H), 6,88-6,95 (м, 1H), 7,41 (дд, J=17,25, 8,13 Гц, 4H), 7,58 (д, J=8,33 Гц, 2H), 7,71 (д, J=8,33 Гц, 2H).
Пример 107G
Транс-2-бензил-8-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Раствор продукта, полученный по Примеру 107F (570 мг, 1,07 ммоль), бензиламин (375 мг, 3,50 ммоль), триэтиламин (465 мг, 4,60 ммоль) и 5 мл N,N-диметилформамида нагревали при температуре 110°C в атмосфере азота в течение 3 часов. Реакционную смесь охлаждали и распределяли между 20 мл воды и 20 мл этилацетата. Водную часть отделяли и экстрагировали 2×10 мл этилацетата и объединенные органические экстракты промывали 2×10 мл воды и 1×10 мл насыщенного солевого раствора и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (этилацетат:гексан 1:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,81-1,90 (м, 1H), 1,92-2,00 (м, 1H), 2,59 (дд, J=9,16, 7,12 Гц, 1H), 2,77 (т, J=8,82 Гц, 1H), 2,83-2,91 (м, 1H), 3,11-3,18 (м, 2H), 3,56-3,67 (м, 2H), 3,75-3,82 (м, 1H), 4,37 (дт, J=12,21, 3,73 Гц, 1H), 6,78-6,86 (м, 2H), 6,99-7,08 (м, 1H), 7,24 (ддд, J=6,95, 5,26, 2,37 Гц, 1H), 7,31-7,36 (м, 4H); MS (DCI+) m/z 298,2 [M+H]+.
Пример 108
Транс-8-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 108A
Транс-2-бензил-8-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 107, заменяя бифенил-3-ол на 3-фторфенол по Примеру 107A.
Пример 108B
Транс-8-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 2, заменяя продукт, полученный по Примеру 108A, на продукт, полученный по Примеру 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,78-1,93 (м, 2H), 2,04-2,13 (м, 1H), 2,74-2,88 (м, 1H), 3,16 (тд, J=10,81, 6,94 Гц, 2H), 3,51-3,67 (м, 3H), 4,43 (дт, J=12,29, 3,37 Гц, 1H), 7,17 (д, J=7,93 Гц, 1H), 7,28 (д, J=1,98 Гц, 1H), 7,32-7,39 (м, 2H), 7,45 (т, J=7,34 Гц, 2H), 7,65 (с, 2H); MS (DCI+) m/z 266,2 [M+H]+.
Пример 109
Транс-8-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 2, заменяя продукт, полученный по Примеру 107G, на продукт, полученный по Примеру 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,67-1,83 (м, 2H), 1,96-2,09 (м, 1H), 2,61 (дд, J=10,31, 8,73 Гц, 1H), 2,83-2,96 (м, 1H), 3,06 (т, J=10,51 Гц, 1H), 3,17 (дд, J=10,71, 7,93 Гц, 1H), 3,51-3,66 (м, 2H), 4,38 (дт, J=12,20, 3,42 Гц, 1H), 6,84 (ддд, J=16,26, 9,12, 2,78 Гц, 2H), 7,02-7,14 (м, 1H); MS (DCI+) m/z 208,1 [M+H]+.
Пример 110
Транс-2-метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 110A
Метил 2-((3S,4R)-4-циано-1-метилпирролидин-3-ил)-6-(трифторметокси)бензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88B, заменяя (E)-метил 2-(2-циановинил)-6-(трифторметокси)бензоат на диметил 4-(2-циановинил)изофталат.
Пример 110B
Метил 2-((3S,4S)-4-(аминометил)-1-метилпирролидин-3-ил)-6-(трифторметокси)бензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 45C, заменяя продукт, полученный по Примеру 110A, на продукт, полученный по Примеру 45B. В этом случае аминоэфир не циклизуется. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,42 (с, 1H), 2,10-2,21 (м, 1H), 2,32-2,48 (м, 4H), 2,55-2,63 (м, 1H), 2,73 (т, J=8,48 Гц, 1H), 2,79-2,87 (м, 3H), 3,87 (с, 3H), 7,28-7,36 (м, 1H), 7,55-7,64 (м, 3H); MS (DCI+) m/z 333,2 [M+H]+.
Пример 110C
Транс-2-метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Продукт, полученный по Примеру 110B (5,5 г), растворяли в 25 мл метанола и обрабатывали 5 мл 25 масс.% метоксида натрия в метаноле. Реакционную смесь перемешивали и нагревали при температуре 70°C в течение 16 часов. Реакционную смесь охлаждали и концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (дихлорметан:2н аммиак в метаноле 95:5) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,04-2,20 (м, 1H), 2,41 (с, 3H), 2,62 (дд, J=10,85 Гц, 8,82 Гц, 1H), 2,73 (т, J=8,31 Гц, 1H), 2,93-3,01 (м, 3H), 3,03-3,14 (м, 2H), 7,24 (д, J=7,80 Гц, 1H), 7,32 (д, J=8,14 Гц, 1H), 7,51-7,59 (м, 1H), 8,33 (т, J=5,76 Гц, 1H); MS (DCI+) m/z 301,1 [M+H]+.
Пример 111
Транс-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3,4-d][1,2]бензотиазепин 6,6-диоксид
Пример 111A
(E)-Перфторфенил 2-(2-циановинил)бензолсульфонат
Указанное в заголовке соединение получали, как описано в Примере 97B, заменяя пентафторфенил 2-бромбензолсульфонат на продукт, полученный по Примеру 97A.
Пример 111B
Перфторфенил 2-((3S,4R)-1-бензил-4-цианопирролидин-3-ил))бензолсульфонат
Указанное в заголовке соединение получали, как описано в Примере 45B, заменяя продукт, полученный по Примеру 111A, на продукт, полученный по Примеру 45A.
Пример 111C
Транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3,4-d][1,2]бензотиазепин 6,6-диоксид
Указанное в заголовке соединение получали, как описано в Примере 55D, заменяя продукт, полученный по Примеру 111B, на продукт, полученный по Примеру 55C. Сырой реакционный продукт обрабатывали 1,1 эквивалента тетра-н-бутиламмоний хлорида в тетрагидрофуране при температуре окружающей среды в течение одного часа и затем распределяли между этилацетатом и водой. Органическую часть промывали водой и насыщенным солевым раствором и сушили над сульфатом натрия. Органическую часть концентрировали и очищали посредством флэш-хроматографии на колонке с силикагелем, элюируя смесью этилацетат/гексан (1:1), с получением указанного в заголовке соединения.
Пример 111D
Транс-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3,4-d][1,2]бензотиазепин 6,6-диоксид
Указанное в заголовке соединение получали, как описано в Примере 54B, заменяя продукт, полученный по Примеру 111C, на продукт, полученный по Примеру 54A. Сырой продукт очищали посредством флэш-хроматографии на колонке с силикагелем (9:1 дихлорметан:2 M раствор аммиака в метаноле) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,76-1,91 (м, 1H), 2,58 (дд, J=11,36, 6,61 Гц, 1H), 3,03 (ддд, J=17,12, 10,51, 10,34 Гц, 2H), 3,17 (д, J=3,73 Гц, 2H), 3,52 (тд, J=10,43, 5,93 Гц, 1H), 4,07 (д, J=5,09 Гц, 1H), 7,30-7,43 (м, 2H), 7,53 (тд, J=7,63, 1,36 Гц, 2H), 7,89 (дд, J=7,63, 1,53 Гц, 1H); MS (+ESI) m/z 239,2 [M+H]+.
Пример 112
(3aR,10bR)-2-Метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, подвергая продукт, описанный в Примере 110, хиральному разделению, как указано в Примере 61 (время удерживания 6,25 минут). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,04-2,19 (м, 1H), 2,41 (с, 3H), 2,56-2,65 (м, 1H), 2,73 (т, J=8,31 Гц, 1H), 2,93-3,01 (м, 3H), 3,03-3,17 (м, 2H), 7,24 (д, J=7,80 Гц, 1H), 7,33 (д, J=8,14 Гц, 1H), 7,51-7,61 (м, 1H), 8,34 (т, J=5,59 Гц, 1H); MS (DCI+) m/z 301,1 [M+H]+.
Пример 113
(3aS,10bS)-2-Метил-7-(трифторметокси)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, подвергая продукт, описанный в Примере 110, хиральному разделению, как указано в Примере 61 (время удерживания 8,2 минут). 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,04-2,19 (м, 1H), 2,41 (с, 3H), 2,56-2,65 (м, 1H), 2,73 (т, J=8,31 Гц, 1H), 2,93-3,01 (м, 3H), 3,03-3,17 (м, 2H), 7,24 (д, J=7,80 Гц, 1H), 7,33 (д, J=8,14 Гц, 1H), 7,51-7,61 (м, 1H), 8,34 (т, J=5,59 Гц, 1H); MS (DCI+) m/z 301,1 [M+H]+.
Пример 114
Транс-2-метил-7-фенил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 114A
Метил 2,6-дибромбензоат
Указанное в заголовке соединение получали, как указано в Примере 55A, заменяя 2,6-дибромбензойную кислоту на 2-бром-5-фторбензойную кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,91 (с, 3H), 7,34-7,40 (м, 1H), 7,75 (д, J=8,14 Гц, 2H).
Пример 114B
Метил 3-бромбифенил-2-карбоксилат
Смесь продукта по Примеру 114A (2,2 г, 7,5 ммоль), фенилбороновую кислоту (919 мг, 7,5 ммоль), карбонат натрия (7,55 мл, 2 M водный раствор, 15,1 ммоль) тетракис(трифенилфосфин)палладий(0) (261 мг, 0,23 ммоль) и 50 мл толуола кипятили с обратным холодильником в течение 16 часов в атмосфере азота. Реакционную смесь охлаждали и распределяли между 50 мл воды и 50 мл этилацетата. Водную часть отделяли и экстрагировали 2×25 мл этилацетата и объединенные органические экстракты промывали 2×25 мл воды и 1×25 мл насыщенного солевого раствора и сушили над сульфатом натрия. Органический раствор концентрировали и остаток очищали посредством флэш-хроматографии на колонке с силикагелем (гексан:этилацетат 95:5) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,63 (с, 3H), 7,35-7,60 (м, 6H), 7,71-7,79 (м, 2H); MS (DCI+) m/z 308,0 [M+NH4]+.
Пример 114C
(E)-Метил 3-(2-циановинил)бифенил-2-карбоксилат
Указанное в заголовке соединение получали, как указано в Примере 97B, заменяя продукт, полученный по Примеру 114B, на продукт, полученный по Примеру 97A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,58 (с, 3H), 6,57 (д, J=16,62 Гц, 1H), 7,30-7,36 (м, 2H), 7,40-7,49 (м, 3H), 7,53-7,59 (м, 2H), 7,65 (т, J=7,80 Гц, 1H), 7,89 (д, J=7,12 Гц, 1H); MS (DCI+) m/z 281,1 [M+NH4]+.
Пример 114D
Метил 3-(транс-циано-1-метилпирролидин-3-ил)бифенил-2-карбоксилат
Указанное в заголовке соединение получали, как указано в Примере 88B, заменяя продукт, полученный по Примеру 114C, на диметил 4-бромизофталат. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 2,33 (с, 3H), 2,59 (дд, J=9,49, 6,10 Гц, 1H), 2,80 (дд, J=9,49, 6,10 Гц, 1H), 2,93-3,01 (м, 1H), 3,04-3,12 (м, 1H), 3,35-3,42 (м, 1H), 3,49-3,56 (м, 1H), 3,58 (с, 3H), 7,30-7,47 (м, 6H), 7,55-7,61 (м, 2H); MS (DCI+) m/z 321,2 [M+H]+.
Пример 114E
Транс-2-метил-7-фенил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали исходя из продукта, полученного по Примеру 114D, используя способы, описанные в Примере 110B, затем указанные в Примере 110C. 1H ЯМР (300 МГц, ДМСО-d6) 2,10-2,24 (м, 1H), 2,45 (с, 3H), 2,64-2,73 (м, 1H), 2,80 (т, J=8,33 Гц, 1H), 2,98-3,12 (м, 3H), 3,14-3,27 (м, 2H), 7,17 (д, J=7,54 Гц, 1H), 7,28-7,41 (м, 6H), 7,45 (т, J=7,54 Гц, 1H), 8,20 (т, J=5,95 Гц, 1H); MS (DCI+) m/z 293,1 [M+H]+.
Пример 115
(3aS,10bS)-8-(4-Фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 75, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-50% метанол с 0,1% диэтиламин-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 10,2 минут) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,07 (д, J=2,1 Гц, 1H), 8,03 (с, 1H), 7,74-7,66 (м, 3H), 7,34-7,22 (м, 3H), 3,34-3,21 (м, 2H), 3,19-3,04 (м, 2H), 2,93 (дд, J=8,9, 10,3 Гц, 1H), 2,71-2,59 (м, 2H), 2,39 (с, 3H), 2,30-2,14 (м, 1H); MS (ESI+) m/z 310,9 [M+H]+.
Пример 116
(3aR,10bR)-8-(4-Фторфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 75, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-50% метанол с 0,1% диэтиламин-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 15,8 минут) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,07 (д, J=2,1 Гц, 1H), 8,03 (с, 1H), 7,74-7,66 (м, 3H), 7,34-7,22 (м, 3H), 3,34-3,21 (м, 2H), 3,19-3,04 (м, 2H), 2,93 (дд, J=8,9, 10,3 Гц, 1H), 2,71-2,59 (м, 2H), 2,39 (с, 3H), 2,30-2,14 (м, 1H); MS (ESI+) m/z 310,9 [M+H]+.
Пример 117
Транс-2-бензил-8-гидрокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 117A
Транс-2-бензил-8-метокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 45A-C, заменяя метил 2-бром-5-метоксибензоат на метил 2-бром-5-хлорбензоат по Примеру 45A. (10:1 транс/цис-изомеры).
Пример 117B
Транс-2-бензил-8-гидрокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 117A (2,66 г, 8,25 ммоль), добавляли по каплям BBr3 (1,0 M в дихлорметане, 10,73 мл, 10,73 ммоль) при температуре -78°C. Смесь перемешивали при температуре -78°C в течение 3 часов. Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Поскольку ТСХ (дихлорметан/метанол (9:1)) все еще показывал наличие исходного вещества, смесь опять охлаждали до температуры -78°C, в реакционную смесь добавляли еще BBr3 (1,0 M в дихлорметане, 5,5 мл). Смесь перемешивали при температуре -78°C в течение 2 часов, затем нагревали и перемешивали при комнатной температуре в течение 2 часов, при этом завершение реакции контролировали с помощью ТСХ. Реакционную смесь гасили с помощью насыщенного раствора NaHCO3 до pH=6-7 и фазы разделяли. Органическую фазу затем промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали. Остаток очищали с помощью фреш колонки с 10-20% метанолом в дихлорметане (с добавленными 0,5% триэтиламина) с получением указанного в заголовке соединения. Объединенные H2O фазы концентрировали и затем экстрагировали смесью 10% метанол/дихлорметан с получением второй партии указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,42 (с, 1H), 7,85-7,87 (м, 1H), 7,25-7,36 (м, 5H), 7,19 (д, J=2,5 Гц, 1H), 6,93 (д, J=8,3 Гц, 1H), 6,80 (дд, J=8,3, 2,7 Гц, 1H), 3,89-3,68 (м, 2H), 3,22-2,94 (м, 5H), 2,63 (м, 2H), 2,12-2,16 (м, 1H); MS (ESI+) m/z 308,9 [M+H]+.
Пример 118
Транс-2-бензил-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 117 (60 мг, 0,195 ммоль), добавляли (S)-1-фенилпропан-2-ол (34,4 мг, 0,253 ммоль), ди-трет-бутил азодикарбоксилат (DBAD, 67,2 мг, 0,292 ммоль), PS-трифенилфосфин (134 мг, 0,428 ммоль, 3,2 ммоль/г) и 2 мл сухого тетрагидрофурана. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Завершение реакции контролировали с помощью LC/MS. Реакционную смесь фильтровали через разделитель фаз (Biotage), затем промывали метанолом. Фильтрат концентрировали и очищали с помощью флэш колонки с (0-20%) метанолом в дихлорметане с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,95 (м, 1H), 7,38-7,16 (м, 11H), 6,98 (дт, J=8,5, 5,0 Гц, 2H), 4,65 (дт, J=12,5, 6,3 Гц, 1H), 3,84-3,66 (м, 2H), 3,21-3,07 (м, 3H), 2,99 (м, 3H), 2,89-2,80 (м, 1H), 2,71 (т, J=8,7 Гц, 1H), 2,59 (т, J=8,9 Гц, 1H), 2,14 (м, 1H), 1,25-1,17 (м, 3H); MS (ESI+) m/z 427,3 [M+H]+.
Пример 119
Транс-2-бензил-8-(3-фторфенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 118, заменяя 2-(3-фторфенил)этанол на (S)-1-фенилпропан-2-ол. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,00-7,93 (м, 1H), 7,38-7,29 (м, 6H), 7,24 (т, J=6,8 Гц, 1H), 7,18 (дд, J=11,8, 4,7 Гц, 2H), 7,08-6,96 (м, 3H), 4,26-4,16 (м, 2H), 3,85-3,67 (м, 2H), 3,21-3,10 (м, 3H), 3,08-2,94 (м, 4H), 2,72 (т, J=8,5 Гц, 1H), 2,60 (т, J=8,9 Гц, 1H), 2,18-2,08 (м, 1H); MS (ESI+) m/z 431,5 [M+H]+.
Пример 120
Транс-2-бензил-8-((S)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя (R)-1-фенилпропан-2-ол на (S)-1-фенилпропан-2-ол. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,60 (д, J=71,4 Гц, 1H), 8,06 (с, 1H), 7,59 (с, 2H), 7,48 (д, J=5,9 Гц, 3H), 7,28-7,26 (дд, J=5,1, 3,3 Гц, 4H), 7,25-7,00 (м, 4H), 4,73-4,68 (м, 1H), 4,52 (м, 2H), 3,86-3,50 (м, 4H), 3,25-2,91 (м, 4H), 2,86 (дт, J=13,6, 5,7 Гц, 1H), 2,19 (с, 1H), 1,23 (дд, J=6,0, 2,3 Гц, 3H); MS (ESI+) m/z 427,4 [M+H]+.
Пример 121
Транс-2-бензил-8-фенетокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2-фенилэтанол на (S)-1-фенилпропан-2-ол. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,26 (д, J=56,9 Гц, 1H), 8,06 (м, 1H), 7,60-7,57 (т, J=6,6 Гц, 2H), 7,49 (т, J=5,9 Гц, 3H), 7,31 (дд, J=8,7, 5,3 Гц, 4H), 7,24-7,20 (м, 2H), 7,15 (м, 1H), 7,06 (дт, J=8,5, 5,8 Гц, 1H), 4,53 (дд, J=20,8, 3,6 Гц, 2H), 4,23-4,20 (м, 2H), 3,83-3,59 (м, 2H), 3,58-3,46 (м, 1H), 3,18-3,08 (м, 3H), 3,03 (дд, J=13,8, 7,1 Гц, 3H), 2,61-2,11 (м, 1H); MS (ESI+) m/z 413,5 [M+H]+.
Пример 122
Транс-2-метил-8-(пиперидин-1-карбонил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 122A
Транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоновую кислоту
К соединению, полученному в Примере 88 (2,115 г, 7,71 ммоль), в растворе смеси метанола/вода (10 мл/5 мл) добавляли моногидрат LiOH (0,324 г, 7,71 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Завершение реакции контролировали с помощью аналитической LC/MS (способ с ТФУ). Смесь концентрировали для удаления метанола и затем нейтрализовали с помощью 1н HCl до pH=4-5. Смесь концентрировали с получением указанного в заголовке соединения, которое использовали на следующей стадии без дополнительной очистки.
Пример 122B
Транс-2-метил-8-(пиперидин-1-карбонил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
В 20-миллилитровый сосуд помещали соединение, полученное в Примере 122A (100 мг, 0,384 ммоль), 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоуроний тетрафторборат (185 мг, 0,576 ммоль), триэтиламин (117 мг, 1,153 ммоль), пиперидин (39,3 мг, 0,461 ммоль) и 1,5 мл N,N-диметилформамида. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Завершение реакции контролировали с помощью аналитической LC/MS (способ ТФУ). Реакционную смесь фильтровали и сначала очищали с помощью ВЭЖХ с обращенной фазой и затем опять очищали путем флэш-хроматографии на колонке с 10-20% метанолом в дихлорметане с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,26 (д, J=66,5 Гц, 1H), 8,17 (т, J=4,9 Гц, 1H), 7,63 (с, 1H), 7,53 (д, J=7,8 Гц, 1H), 7,26 (м, 1H), 4,01 (с, 1H), 3,82-3,46 (м, 4H), 3,14 (д, J=25,9 Гц, 3H), 2,95 (д, J=25,5 Гц, 4H), 2,64 (м, 1H), 2,34 (м, 1H), 1,56 (дд, J=57,6, 25,7 Гц, 7H). MS (ESI+) m/z 328,6 [M+H]+.
Пример 123
Транс-8-фенетокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 121 (146,4 мг, 0,355 ммоль), растворенное в трифторэтаноле (10 мл), добавляли к 20% Pd(OH)2/углерод (смоченный водой, 29,3 мг, 0,208 ммоль) в 50-миллилитровом сосуде для работы под давлением и перемешивали в течение 2 часов в атмосфере водорода (30 фунтов на квадратный дюйм) и при температуре 50°C. Затем смесь охлаждали и фильтровали через нейлоновую мембрану. Полученный раствор концентрировали и остаток обрабатывали дихлорметаном с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,88 (д, J=31,0 Гц, 2H), 8,07 (дд, J=6,3, 3,9 Гц, 1H), 7,44-6,94 (м, 8H), 4,22 (тд, J=6,7, 1,5 Гц, 2H), 3,59 (м, 1H), 3,56-3,36 (м, 2H), 3,21-2,99 (м, 5H), 2,88 (с, 1H), 2,29-2,10 (м, 1H); MS (ESI+) m/z 323,5 [M+H]+.
Пример 124
Транс-8-(3-фторфенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 123, заменяя соединение, полученное в Примере 119, на соединение, полученное в Примере 121. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,03-8,91 (м, 2H), 8,09-8,07 (м, 1H), 7,38-7,31 (м, 1H), 7,22-7,13 (м, 4H), 7,10-7,01 (м, 2H), 4,30-4,18 (м, 2H), 3,65-3,57 (м, 1H), 3,55-3,38 (м, 3H), 3,19-3,09 (м, 2H), 3,06 (т, J=6,6 Гц, 3H), 2,25-2,13 (м, 1H); MS (ESI+) m/z 341,6 [M+H]+.
Пример 125
Транс-N,2-диметил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 122, заменяя метанамин на пиперидин. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,63-8,56 (м, 1H), 8,22-8,14 (м, 2H), 7,96 (дд, J=7,9, 2,0 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 3,62 (д, J=8,2 Гц, 4H), 3,27-2,96 (м, 3H), 2,82 (с, 3H), 2,79 (д, J=4,5 Гц, 3H), 2,42 (м, 1H); MS (ESI+) m/z 291,3 [M+NH4]+.
Пример 126
Транс-2-метил-6-оксо-N-фенетил-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 122, заменяя 2-фенилэтанамин на пиперидин. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,73 (т, J=5,6, 1H), 8,22-8,16 (м, 2H), 7,96 (дд, J=7,9, 2,0, 1H), 7,32-7,26 (м, 3H), 7,27-7,16 (м, 3H), 3,69(м, 2H), 3,54 (м, 3H), 3,19-3,02 (м, 4H), 2,94-2,81 (м, 5H), 2,44 (м, 1H); MS (ESI+) m/z 364,9 [M+H]+.
Пример 127
Транс-2-метил-6-оксо-N-(3-(трифторметил)фенетил)-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 122, заменяя 2-(3-(трифторметил)фенил)этанамин на пиперидин. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,77-8,70 (м, 1H), 8,22-8,14 (м, 2H), 7,96-7,90 (м, 1H), 7,62-7,48 (м, 4H), 7,33-7,26 (м, 1H), 3,68-3,59 (м, 1H), 3,53 (дт, J=6,6, 5,3 Гц, 3H), 3,21-3,10 (м, 4H), 3,00-2,93 (м, 3H), 2,87-2,79 (м, 3H), 2,47-2,37 (м, 1H); MS (ESI+) m/z 432,7 [M+H]+.
Пример 128
Транс-2-метил-6-оксо-N-фенил-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксамид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 122, заменяя анилин на пиперидин. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,37 (с, 1H), 8,40 (с, 1H), 8,21-8,14 (м, 1H), 8,06 (дд, J=8,0, 1,9 Гц, 1H), 7,78 (т, J=7,5 Гц, 2H), 7,35 (т, J=8,0 Гц, 3H), 7,11 (т, J=7,4 Гц, 1H), 3,46-3,30 (м, 4H), 3,27-3,10 (м, 3H), 2,81 (т, J=9,3 Гц, 1H), 2,56 (с, 3H), 2,32 (дд, J=15,3, 9,2 Гц, 1H); MS (ESI+) m/z 336,8 [M+H]+.
Пример 129
Транс-метил 2-бензил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоксилат
Указанное в заголовке соединение получали, используя способы, описанные в Примерах 55B-55D, заменяя диметил 4-бромизофталат на метил-2-бром-5-фторбензоат в Примере 55B. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,40 (ушир.с, 1H), 8,12 (ушир.с, 1H), 8,02-7,94 (м, 1H), 7,38-7,22 (м, 6H), 3,88-3,81 (м, 3H), 3,71 (д, J=13,2 Гц, 2H), 3,29-2,96 (м, 5H), 2,79-2,52 (м, 2H), 2,41-2,13 (м, 1H). MS (ESI+) m/z 351,8 [M+H]+.
Пример 130
Цис-2-бензил-8-метокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 45A-C, заменяя метил 2-бром-5-метоксибензоат на метил 2-бром-5-хлорбензоат в Примере 45A (10:1 транс/цис-изомеров). Указанное в заголовке соединение отделяли от соответствующего транс-изомера путем флэш-хроматографией на силикагеле (1-15% метанол/дихлорметан). 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,19 (т, J=6,1, 1H), 7,31 (д, J=4,4, 4H), 7,25-7,20 (м, 2H), 7,10 (д, J=2,8 Гц, 1H), 6,97 (дд, J=8,4, 2,9 Гц, 1H), 3,76 (с, 3H), 3,64-3,53 (м, 2H), 3,49 (тд, J=10,6, 7,3 Гц, 1H), 3,07 (дд, J=9,5, 7,7 Гц, 1H), 2,99 (ддд, J=14,4, 5,5, 2,7 Гц, 1H), 2,87 (т, J=7,8 Гц, 1H), 2,82-2,67 (м, 2H), 2,48-2,42 (м, 1H), 2,15 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 131
Транс-8-(4-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,02 (м, 2H), 7,69 (дд, J=8,0, 2,1 Гц, 1H), 7,63-7,57 (м, 2H), 7,22 (д, J=8,1 Гц, 1H), 7,07-7,00 (м, 2H), 3,80 (с, 3H), 3,26-3,02 (м, 5H), 2,94-2,67 (м, 5H), 2,25 (д, J=9,2 Гц, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 132
Транс-2-метил-8-(3-(трифторметокси)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-(трифторметокси)фенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,09 (м, 2H), 7,81 (дд, J=8,0, 2,1 Гц, 1H), 7,73 (д, J=8,1 Гц, 1H), 7,62 (дд, J=10,5, 5,3 Гц, 2H), 7,43-7,36 (м, 1H), 7,29 (д, J=8,0 Гц, 1H), 3,29-3,08 (м, 5H), 2,90 (м, 4H), 2,75 (дд, J=13,4, 5,4 Гц, 1H), 2,27 (м, 1H); MS (ESI+) m/z 377,2 [M+H]+.
Пример 133
Транс-8-(3-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,05 (дд, J=7,3, 2,9 Гц, 2H), 7,74 (дд, J=8,0, 2,1 Гц, 1H), 7,39 (т, J=7,9 Гц, 1H), 7,28-7,14 (м, 3H), 6,95 (дд, J=7,9, 2,3 Гц, 1H), 3,82 (с, 3H), 3,36-2,96 (м, 4H), 2,70 (м, 4H), 2,44 (с, 3H), 2,26 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 134
Транс-8-(3-изобутоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-изобутоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,05 (д, J=2,0 Гц, 2H), 7,74 (дд, J=8,0, 2,1 Гц, 1H), 7,37 (т, J=7,9 Гц, 1H), 7,22 (дд, J=12,6, 8,0 Гц, 2H), 7,18-7,13 (м, 1H), 6,94 (дд, J=7,9, 2,3 Гц, 1H), 3,82 (д, J=6,5 Гц, 2H), 3,37-3,19 (м, 6H), 3,18-3,00 (м, 3H), 2,87-2,67 (м, 4H), 2,47 (с, 3H), 2,33-2,20 (м, 1H), 2,02 (дкв, J=13,1, 6,5 Гц, 1H). MS (ESI+) m/z 365,3 [M+H]+.
Пример 135
Цис-8-метокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 123, заменяя соединение, полученное в Примере 130, на соединение, полученное в Примере 121. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,15 (т, J=3,5 Гц, 1H), 7,19 (д, J=8,4 Гц, 1H), 7,10 (дд, J=11,2, 1,9 Гц, 1H), 7,01-6,96 (м, 1H), 3,76 (с, 3H), 3,24-3,15 (м, 3H), 3,06-2,97 (м, 2H), 2,89-2,81 (м, 1H), 2,80-2,75 (м, 1H), 2,65-2,56 (м, 1H), 2,41 (т, J=10,6 Гц, 1H); MS (ESI+) m/z 233,1 [M+H]+.
Пример 136
Транс-2-бензил-8-(1,3,4-оксадиазол-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 136A
Транс-2-бензил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбоновую кислоту
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 122A, заменяя соединение, полученное в Примере 129, на соединение, полученное в Примере 88.
Пример 136B
Транс-2-бензил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-карбогидразид
К соединению, полученному в Примере 136A (300 мг, 0,892 ммоль) в дихлорэтане (3 мл), добавляли тионилхлорид (1,3 мл, 18 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 6 часов, в течение этого времени данные анализа LC/MS (способ с ТФУ) показывали завершение реакции. Реакционную смесь охлаждали и концентрировали. Полученный остаток добавляли к 3 мл дихлорэтана и затем смесь охлаждали до температуры 0°C. Добавляли гидразин (0,28 мл, 8,92 ммоль) и полученную смесь перемешивали при температуре 0°C в течение 15 минут и затем при комнатной температуре в течение 3 часов, за это время данные LC/MS показывали завершение реакции. Реакционную смесь фильтровали и затем промывали дихлорметаном. Фильтрат концентрировали и остаток растворяли в этилацетате. Смесь промывали водой и разделяли. Этилацетатный слой концентрировали с получением первой партии указанного в заголовке соединения. Водную фазу концентрировали и остаток растворяли в смеси дихлорметан/этилацетат (объемное соотношение 1:1) и фильтровали. Фильтрат концентрировали с получением второй партии указанного в заголовке соединения.
Пример 136C
Транс-2-бензил-8-(1,3,4-оксадиазол-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 136B (114,7 мг, 0,327 ммоль), добавляли триэтил ортоформиат (3 мл, 18 ммоль) и 1,25 мг моногидрата п-толуолсульфоновой кислоты (0,655 мкмоль). Смесь нагревали до 120°C в течение 6 часов. ТСХ (дихлорметан/метанол (9:1) с 0,5% триэтиламин) показывала завершение реакции. Реакционную смесь охлаждали и затем концентрировали. Очистка путем флэш-хроматографии на колонке с 0-10% метанолом в дихлорметане (0,5% триэтиламин) давала указанное в заголовке соединение. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,36 (с, 1H), 8,44 (д, J=1,9 Гц, 1H), 8,19 (т, J=3,7 Гц, 1H), 8,06 (дд, J=8,0, 1,9 Гц, 1H), 7,42-7,31 (м, 5H), 7,26 (т, J=6,9 Гц, 1H), 3,77 (ддд, J=45,5, 13,2, 6,1 Гц, 2H), 3,26 (ддд, J=14,0, 6,6, 3,3 Гц, 1H), 3,21 (дд, J=8,6, 6,5 Гц, 1H), 3,17 (с, 1H), 3,12 (ддд, J=13,8, 6,5, 4,7 Гц, 1H), 3,06-3,00 (м, 1H), 2,75 (т, J=8,8 Гц, 1H), 2,63 (т, J=8,6 Гц, 1H), 2,29-2,22 (м, 1H); MS (ESI+) m/z 361,2 [M+H]+.
Пример 137
Транс-8-(2-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,05 (м, 1H), 7,84 (д, J=1,8 Гц, 1H), 7,59 (дд, J=7,9, 1,9 Гц, 1H), 7,40-7,34 (м, 1H), 7,33-7,27 (м, 1H), 7,22 (д, J=8,0 Гц, 1H), 7,14 (д, J=7,9 Гц, 1H), 7,04 (т, J=7,4 Гц, 1H), 3,77 (д, J=3,7 Гц, 3H), 3,26-3,10 (м, 6H), 2,94 (м, 1H), 2,70 (с, 3H), 2,38 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 138
Транс-8-(4-изопропилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-изопропилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,06 (м, 1H), 8,03 (д, J=2,0 Гц, 1H), 7,73 (дд, J=8,0, 2,1 Гц, 1H), 7,61-7,56 (м, 2H), 7,35 (д, J=8,2 Гц, 2H), 7,25 (д, J=8,0 Гц, 1H), 3,37-3,20 (м, 5H), 3,20-3,09 (м, 4H), 2,97-2,86 (м, 4H), 2,78 (т, J=9,2 Гц, 1H), 2,54 (с, 3H), 2,34-2,25 (м, 1H); MS (ESI+) m/z 335,3 [M+H]+.
Пример 139
Транс-8-(4-этилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-этилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,06 (м, 1H), 8,03 (д, J=2,1 Гц, 1H), 7,73 (дд, J=8,0, 2,1 Гц, 1H), 7,58 (д, J=8,2 Гц, 2H), 7,31 (д, J=8,2 Гц, 2H), 7,25 (д, J=8,0 Гц, 1H), 3,37-3,21 (м, 3H), 3,19-3,08 (м, 4H), 2,94-2,84 (м, 4H), 2,77 (т, J=9,1 Гц, 1H), 2,53 (с, 3H), 2,29 (дд, J=20,4, 11,0 Гц, 1H); MS (ESI+) m/z 321,2 [M+H]+.
Пример 140
Транс-2-метил-8-(4-(трифторметокси)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-(трифторметокси)фенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,08 (м, 1H), 7,81-7,78 (м, 2H), 7,78-7,75 (м, 1H), 7,46 (д, J=8,2 Гц, 2H), 7,28 (д, J=8,0 Гц, 1H), 3,37-3,21 (м, 1H), 3,16-3,09 (м, 2H), 3,08-3,02 (м, 1H), 2,80 (дт, J=11,8, 8,0 Гц, 3H), 2,75-2,68 (м, 1H), 2,47 (с, 3H), 2,31-2,23 (м, 1H); MS (ESI+) m/z 377,2 [M+H]+.
Пример 141
Транс-8-амино-2-бензил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 45A-C, заменяя метил 2-бром-5-нитробензоат на метил 2-бром-5-хлорбензоат в Примере 45A (7:1 транс/цис-изомеры). Указанное в заголовке соединение отделяли от соответствующего цис-изомера путем флэш-хроматографии на силикагеле, элюируя с помощью 0-7% метанола в дихлорметане, содержащем 0,5% триэтиламин. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,74 (м, 1H), 7,37-7,29 (м, 4H), 7,28-7,20 (м, 1H), 7,02 (д, J=2,5 Гц, 1H), 6,77 (д, J=8,2 Гц, 1H), 6,59 (дд, J=8,1, 2,5 Гц, 1H), 5,04 (с, 2H), 3,75 (дд, J=30,4, 13,3 Гц, 2H), 3,20-2,89 (м, 5H), 2,76-2,66 (м, 1H), 2,58 (т, J=9,0 Гц, 1H), 2,16-2,00 (м, 1H). MS (ESI+) m/z 308,4 [M+H]+.
Пример 142
Цис-8-амино-2-бензил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 45A-C, заменяя метил 2-бром-5-нитробензоат на метил 2-бром-5-хлорбензоат в Примере 45A (7:1 транс/цис-изомеры). Указанное в заголовке соединение отделяли от соответствующего транс изомера путем флэш-хроматографии на силикагеле, элюируя с помощью 0-7% метанола в дихлорметане, содержащем 0,5% триэтиламина. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,96 (т, J=6,0 Гц, 1H), 7,31 (м, 4H), 7,28-7,18 (м, 1H), 6,90 (д, J=8,2 Гц, 1H), 6,83 (д, J=2,5 Гц, 1H), 6,56 (дд, J=8,1, 2,5 Гц, 1H), 5,12 (с, 2H), 3,56 (м, 2H), 3,12-2,93 (м, 3H), 2,73 (м, 4H), 2,09 (м, 1H); MS (ESI+) m/z 308,4 [M+H]+.
Пример 143
Транс-2-метил-8-(пиридин-3-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя пиридин-3-илбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,33 (д, J=59,8 Гц, 1H), 9,05 (д, J=2,0 Гц, 1H), 8,71 (дд, J=5,1, 1,4 Гц, 1H), 8,38 (д, J=8,0 Гц, 1H), 8,22 (т, J=4,8 Гц, 1H), 8,04 (дд, J=14,3, 2,0 Гц, 1H), 8,00-7,92 (м, 1H), 7,72 (дд, J=8,0, 5,0 Гц, 1H), 7,39 (дд, J=25,5, 8,0 Гц, 1H), 3,80-3,59 (м, 2H), 3,58-3,31 (м, 2H), 3,28-3,08 (м, 2H), 3,06-2,91 (м, 2H), 2,66 (д, J=7,1 Гц, 1H), 2,41-2,30 (м, 1H), 1,64 (д, J=10,2 Гц, 1H); MS (ESI+) m/z 294,6 [M+H]+.
Пример 144
Транс-8-амино-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 123, заменяя соединение, полученное в Примере 141, на соединение, полученное в Примере 121. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,82 (т, J=4,8 Гц, 1H), 6,90 (д, J=2,4 Гц, 1H), 6,84 (д, J=8,2 Гц, 1H), 6,63 (дд, J=8,2, 2,5 Гц, 1H), 5,14 (с, 2H), 3,36-3,10 (м, 4H), 3,04 (дд, J=11,5, 6,3 Гц, 2H), 2,92 (тд, J=11,8, 6,6 Гц, 1H), 2,81-2,71 (м, 1H), 2,01 (м, 1H); MS (ESI+) m/z 218,3 [M+H]+.
Пример 145
Цис-8-амино-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 123, заменяя соединение, полученное в Примере 142, на соединение, полученное в Примере 121. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,95 (т, J=6,0 Гц, 1H), 6,92 (д, J=8,1 Гц, 1H), 6,84 (т, J=9,0 Гц, 1H), 6,60 (дд, J=8,1, 2,5 Гц, 1H), 5,18 (с, 2H), 3,18 (м, 5H), 3,01 (ддд, J=14,4, 5,5, 3,0 Гц, 1H), 2,94 (дд, J=11,7, 6,7 Гц, 1H), 2,82-2,75 (м, 1H), 2,62 (м, 1H); MS (ESI+) m/z 218,6 [M+H]+.
Пример 146
Транс-8-(3-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 227F (80 мг, 0,251 ммоль), добавляли 3-фторбензиловый спирт (41,2 мг, 0,327 ммоль), ди-трет-бутил азодикарбоксилат (DBAD, 87 мг, 0,377 ммоль), PS-трифенилфосфин (173 мг, 0,553 ммоль, 3,2 ммоль/г) и 2 мл сухого тетрагидрофурана. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Завершение реакции контролировали с помощью LC/MS (способ с ТФУ). Реакционную смесь фильтровали с последующей промывкой метанолом. Фильтрат концентрировали и к остатку добавляли 0,3 мл 1,4-диоксана и 0,4 мл 4 M HCl в диоксане. Реакционную смесь перемешивали при комнатной температуре в течение 3 часов и LC/MS указывала на завершение реакции за это время. Реакционную смесь концентрировали и сырой продукт очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,02 (м, 2H), 8,14-8,08 (м, 1H), 7,48-7,41 (м, 1H), 7,32-7,25 (м, 3H), 7,22-7,13 (м, 3H), 5,19 (с, 2H), 3,49-3,39 (м, 3H), 3,22-3,12 (м, 2H), 3,10-3,03 (м, 1H), 2,99-2,89 (м, 1H), 2,27-2,16 (м, 1H); MS (ESI+) m/z 327,5 [M+H]+.
Пример 147
Транс-8-(2-фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-фторбензиловый спирт на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,99 (д, J=46,0 Гц, 2H), 8,10 (дд, J=6,6, 3,8 Гц, 1H), 7,56 (тд, J=7,5, 1,6 Гц, 1H), 7,47-7,39 (м, 1H), 7,30-7,13 (м, 5H), 5,18 (с, 2H), 3,59-3,37 (м, 3H), 3,22-3,02 (м, 3H), 2,94 (дт, J=17,7, 9,6 Гц, 1H), 2,21 (м, 1H); MS (ESI+) m/z 327,5 [M+H]+.
Пример 148
Транс-8-(2-(трифторметил)бензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-(трифторметил) бензиловый спирт на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,96 (д, J=45,9 Гц, 2H), 8,11 (дд, J=6,4, 3,9 Гц, 1H), 7,84-7,69 (м, 3H), 7,60 (т, J=7,5 Гц, 1H), 7,27 (д, J=2,7 Гц, 1H), 7,21 (д, J=8,5 Гц, 1H), 7,14 (дд, J=8,5, 2,7 Гц, 1H), 5,28 (д, J=12,6 Гц, 2H), 3,67-3,56 (м, 2H), 3,22-3,02 (м, 2H), 2,93 (т, J=12,2 Гц, 1H), 2,30-2,15 (м, 1H); MS (ESI+) m/z 377,4 [M+H]+.
Пример 149
Транс-8-((S)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 123, заменяя соединение, полученное в Примере 120, на соединение, полученное в Примере 121. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,10-7,90 (м, 1H), 7,30-7,27 (м, 4H), 7,22-7,16 (м, 2H), 7,07 (д, J=8,1 Гц, 1H), 6,99 (дд, J=8,4, 2,6 Гц, 1H), 4,73-4,63 (м, 1H), 3,30-3,21 (м, 2H), 3,21-3,14 (м, 1H), 3,10-3,01 (м, 3H), 3,01-2,90 (м, 2H), 2,90-2,81 (м, 1H), 2,77-2,67 (м, 1H), 2,09-1,96 (м, 1H), 1,22 (дд, J=6,0, 2,8 Гц, 3H); MS (ESI+) m/z 337,4 [M+H]+.
Пример 150
Транс-8-((R)-1-фенилэтокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя (S)-(-)-1-фенилэтанол на 3-фторбензиловый спирт. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,97 (д, J=48,5 Гц, 2H), 8,04 (м, 1H), 7,41 (м, 2H), 7,38-7,31 (м, 2H), 7,29-7,22 (м, 1H), 7,16 (т, J=2,4 Гц, 1H), 7,09 (дд, J=8,5, 3,6 Гц, 1H), 7,07-6,99 (м, 1H), 5,60-5,48 (м, 1H), 3,64-3,52 (м, 1H), 3,51-3,35 (м, 2H), 3,16-2,85 (м, 4H), 2,25-2,09 (м, 1H), 1,54 (дт, J=17,9, 8,9 Гц, 3H); MS (ESI+) m/z 323,5 [M+H]+.
Пример 151
Транс-9-бензил-7,7a,8,9,10,10a-гексагидропиридо[2,3-e]пирроло[3,4-c]азепин-5(6H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 154A-C, заменяя метил 2-бромникотинат на метил 3-бромпиколинат в качестве исходного продукта. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,52 (дд, J=4,7, 1,7 Гц, 1H), 8,27 (дд, J=7,9, 1,7 Гц, 1H), 8,13 (с, 1H), 7,39-7,21 (м, 6H), 3,70 (дд, J=30,6, 13,0 Гц, 2H), 3,47 (дд, J=17,2, 9,0 Гц, 1H), 3,41-3,35 (м, 2H), 3,17 (ддд, J=13,0, 9,6, 3,1 Гц, 1H), 3,08-3,01 (м, 1H), 2,80 (т, J=8,6 Гц, 1H), 2,55 (д, J=8,1 Гц, 1H), 2,29 (дд, J=14,2, 8,4 Гц, 1H); MS (ESI+) m/z 294,4 [M+H]+.
Пример 152
Транс-2-бензил-1,2,3,3a,4,5-гексагидропиридо[3,4-e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 154A-C, заменяя метил 3-бромизоникотинат на метил 3-бромпиколинат в качестве исходного продукта. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,56 (д, J=5,0 Гц, 1H), 8,40 (с, 1H), 8,25 (т, J=1,2 Гц, 1H), 7,78 (д, J=5,0 Гц, 1H), 7,40-7,21 (м, 5H), 3,75 (дд, J=38,8, 13,2 Гц, 2H), 3,25-3,10 (м, 4H), 3,08-2,96 (м, 1H), 2,77-2,61 (м, 1H), 2,64 (дд, J=33,9, 9,0 Гц, 1H), 2,30-2,20 (м, 1H); MS (ESI+) m/z 294,6 [M+H]+.
Пример 153
Транс-7,7a,8,9,10,10a-гексагидропиридо[2,3-e]пирроло[3,4-c]азепин-5(6H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 157, заменяя соединение, полученное в Примере 151, на соединение, полученное в Примере 154. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,62 (дд, J=4,9, 1,7 Гц, 1H), 8,27 (м, 1H), 8,15 (дд, J=7,8, 1,7 Гц, 1H), 7,47 (дд, J=7,8, 4,8 Гц, 2H), 3,77 (т, J=11,3 Гц, 1H), 3,67 (дд, J=11,0, 7,0 Гц, 1H), 3,62-3,49 (м, 3H), 3,25 (дд, J=8,7, 4,4 Гц, 1H), 3,03 (т, J=11,3 Гц, 1H), 2,43 (м, 1H); MS (ESI+) m/z 204,0 [M+H]+.
Пример 154
Транс-2-бензил-1,2,3,3a,4,5-гексагидропиридо[3,2-e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 154A
(E)-Метил 3-(2-циановинил)пиколинат
В сосуд для микроволнового облучения помещали метил 3-бромпиколинат (2,84 г, 13,15 ммоль), акрилонитрил (0,907 г, 17,09 ммоль), N,N-дициклогексилметиламин (3,08 г, 15,78 ммоль), три-трет-бутилфосфин (0,789 мл, 0,789 ммоль, 1 M в толуоле), трис(дибензилиленацетон)дипалладий (0) (0,361 г, 0,394 ммоль) и 10 мл 1,4-диоксана в атмосфере азота. Реакционный сосуд закрывали и нагревали при температуре 80°C на масляной бане в течение 20 часов. Реакционную смесь разбавляли этилацетатом и фильтровали. Фильтрат концентрировали и остаток обрабатывали этилацетатом с получением указанного в заголовке соединения в виде твердого продукта в качестве первой партии. Анализ 1H ЯМР показывал наличие только одного изомера. Маточную жидкость концентрировали и остаток очищали путем флэш-хроматографии на колонке, элюируя с помощью 20-50% этилацетата в гексане с получением второй партии указанного в заголовке соединения. Анализ 1H ЯМР показывал наличие только транс продукта. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,70 (дд, J=4,6, 1,6 Гц, 1H), 8,27 (дд, J=8,1, 1,6 Гц, 1H), 8,04-7,94 (м, 1H), 7,71 (дд, J=8,1, 4,6 Гц, 1H), 6,53 (д, J=16,5 Гц, 1H), 3,91 (с, 3H).
Пример 154B
Транс-метил 3-(1-бензил-4-цианопирролидин-3-ил)пиколинат
Соединение, полученное в Примере 154A (1,26 г, 6,70 ммоль), трифторуксусную кислоту (5,16 мкл, 0,067 ммоль) и дихлорметан (15 мл) объединяли. Добавляли по каплям N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (2,06 мл, 8,03 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи и анализ LC/MS показывал, что реакция завершилась. Реакционную смесь концентрировали и очищали путем флэш-хроматографии на колонке с помощью 20-50% этилацетата в гексане с получением указанного в заголовке соединения.
Пример 154C
Транс-2-бензил-1,2,3,3a,4,5-гексагидропиридо[3,2-e]пирроло[3,4-c]азепин-6(10bH)-on
Соединение, полученное в Примере 154B (1,35 г, 4,20 ммоль), и смесь 7 M аммиак-метанол (7,50 мл) добавляли к никелю Ренея®, смоченному водой, A-7000 (6,75 г, 115 ммоль) в 50-миллилитровом сосуде для работы под давлением. Реакционную смесь перемешивали в течение 16 часов в атмосфере водорода (30 фунтов на квадратный дюйм) при комнатной температуре. ВЭЖХ показывала отсутствие исходного вещества. Смесь фильтровали через нейлоновую мембрану и концентрировали. Остаток обрабатывали смесью этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,53 (дд, J=4,7, 1,5 Гц, 1H), 8,25-8,18 (м, 1H), 7,65-7,60 (м, 1H), 7,41 (дд, J=7,6, 4,5 Гц, 1H), 7,38-7,29 (м, 4H), 7,24 (ддд, J=8,5, 3,6, 1,8 Гц, 1H), 3,80 (дд, J=30,8, 13,4 Гц, 2H), 3,19-3,12 (м, 2H), 3,10-3,01 (м, 3H), 2,79 (т, J=8,3 Гц, 1H), 2,64 (дд, J=16,8, 6,8 Гц, 1H), 2,21-2,12 (м, 1H); MS (ESI+) m/z 294,2 [M+H]+.
Пример 155
Транс-8-((S)-1-фенилэтокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 146, и заменяя (R)-(+)-1-фенилэтанол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,00-8,76 (м, 2H), 8,08-7,99 (м, 1H), 7,43-7,38 (м, 2H), 7,38-7,31 (м, 2H), 7,29-7,22 (м, 1H), 7,16 (дд, J=5,0, 2,6 Гц, 1H), 7,09 (дд, J=8,6, 3,3 Гц, 1H), 7,04 (м, 2), 3,62-3,52 (м, 2), 3,17-2,95 (м, 4H), 2,96-2,83 (м, 1H), 2,23-2,10 (м, 1H), 1,59-1,51 (м, 3H); MS (ESI+) m/z 323,7 [M+H]+.
Пример 156
Транс-8-((R)-1-фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 146, и заменяя (S)-(-)-1-фенилпропан-2-ол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,03 (д, J=47,2 Гц, 2H), 8,12-8,04 (м, 1H), 7,33-7,26 (м, 4H), 7,25-7,17 (м, 1H), 7,17-7,10 (м, 2H), 7,08-7,00 (м, 1H), 4,71 (тт, J=12,4, 6,0 Гц, 2H), 3,66-3,56 (м, 1H), 3,56-3,36 (м, 2H), 3,20-3,01 (м, 3H), 3,02-2,80 (м, 3H), 2,27-2,04 (м, 1H), 1,23 (дд, J=6,0, 2,0 Гц, 3H); MS (ESI+) m/z 337,5 [M+H]+.
Пример 157
Транс-1,2,3,3a,4,5-гексагидропиридо[3,2-e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 154 (690 мг, 2,352 ммоль), и трифторэтанол (10 мл) добавляли к 20% Pd(OH)2-C, влажный (138 мг, 0,983 ммоль) в 50-миллилитровом сосуде для работы под давлением и перемешивали в атмосфере водорода (30 фунтов на квадратный дюйм) при температуре 50°C. Реакцию отслеживали с помощью ВЭЖХ до завершения реакции, о чем судили по отсутствию исходного продукта. Смесь фильтровали через нейлоновую мембрану и концентрировали с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,56-8,51 (м, 1H), 8,25 (м, 1H), 7,68 (д, 1H), 7,43 (м, 1H), 3,22-3,02 (м, 5H), 3,02-2,90 (м, 2H), 2,70 (т, J=10,2 Гц, 1H), 2,01 (м, 1H); MS (ESI+) m/z 204,2 [M+H]+.
Пример 158
(3aS,10bS)-8-(4-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 158A
Транс-8-(4-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту.
Пример 158B
(3aS,10bS)-8-(4-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 158A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанол с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 12,05 минут) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,04 (д, J=2,1 Гц, 1H), 8,01 (м, 1H), 7,67 (дд, J=8,0, 2,1 Гц, 1H), 7,63-7,56 (м, 2H), 7,21 (д, J=8,0 Гц, 1H), 7,03 (д, J=8,8 Гц, 2H), 3,80 (с, 3H), 3,31-3,21 (м, 3H), 3,17-3,06 (м, 2H), 2,95-2,88 (м, 1H), 2,68-2,60 (м, 2H), 2,38 (с, 3H), 2,27-2,15 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 159
(3aR,10bR)-8-(4-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 158A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанол с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 16,87 минут) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,04 (д, J=2,2 Гц, 1H), 8,04-7,99 (м, 1H), 7,67 (дд, J=7,9, 2,2 Гц, 1H), 7,62-7,56 (м, 2H), 7,21 (д, J=8,0, 1H), 7,06-7,00 (м, 2H), 3,80 (с, 3H), 3,30-3,20 (м, 3H), 3,21-3,04 (м, 2H), 2,91 (дд, J=10,4, 8,7 Гц, 1H), 2,67-2,60 (м, 2H), 2,38 (с, 3H), 2,28-2,14 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 160
(3aS,10bS)-8-(3-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 160A
Транс-8-(3-метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту.
Пример 160B
(3aS,10bS)-8-(3-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 160A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанол с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 14,0 минут) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,08 (д, J=2,1 Гц, 1H), 8,07-8,02 (м, 1H), 7,73 (дд, J=7,9, 2,1 Гц, 1H), 7,39 (т, J=7,9 Гц, 1H), 7,23 (дд, J=12,3, 7,9 Гц, 1H), 7,16 (д, J=2,4 Гц, 1H), 6,95 (дд, J=8,2, 2,5 Гц, 1H), 3,83 (с, 3H), 3,35-3,23 (м, 3H), 3,18-3,05 (м, 2H), 2,96-2,88 (м, 1H), 2,67-2,61 (м, 1H), 2,38 (с, 3H), 2,37-2,15 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 161
(3aR,10bR)-8-(3-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 160A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанол с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 16,5 минут) с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,08 (д, J=2,1 Гц, 1H), 8,04 (т, J=3,7 Гц, 1H), 7,73 (дд, J=7,9, 2,1 Гц, 1H), 7,39 (т, J=7,9 Гц, 1H), 7,23 (дд, J=15,4, 8,2 Гц, 1H), 7,18-7,14 (м, 1H), 6,98-6,92 (м, 1H), 3,82 (с, 3H), 3,32-3,23 (м, 3H), 3,17-3,07 (м, 2H), 2,92 (дд, J=10,3, 8,9 Гц, 1H), 2,68-2,60 (м, 1H), 2,38 (с, 3H), 2,27-2,18 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 162
(3aS,10bS)-8,10-Дифтор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 68, заменяя формальдегид на метил 3-формилбензоат и заменяя соединение, полученное в Примере 106, на соединение, полученное в Примере 2. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,28 (с, 1H), 7,43-7,31 (м, 2H), 3,29-3,21 (м, 1H), 3,18-2,96 (м, 4H), 2,61 (дд, J=8,7, 2,7 Гц, 2H), 2,37 (с, 3H), 2,36-2,27 (м, 1H); MS(ESI+) m/z 253,2 [M+H]+.
Пример 163
(3aR,10bS)-8-Фтор-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 68, заменяя формальдегид на метил 3-формилбензоат и заменяя (3aR,10bS)-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он гидрохлорид (соединение, полученное в Примере 225B) на соединение, полученное в Примере 2. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,46 (дт, J=16,6, 8,3 Гц, 1H), 7,27 (тд, J=8,5, 2,8 Гц, 1H), 7,18 (дд, J=8,5, 5,6 Гц, 1H), 3,36 (ддд, J=19,2, 14,5, 5,7 Гц, 3H), 3,15-2,92 (м, 5H), 2,71 (дт, J=25,9, 9,0 Гц, 2H), 2,41 (д, J=6,1 Гц, 3H), 2,24-2,07 (м, 1H); MS (ESI+) m/z 249,1 [M+H]+.
Пример 164
Транс-8-(2-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 164A
Транс-8-метокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88B и Примере 88C, заменяя метил 2-бром-5-метоксибензоат на диметил 4-бромизофталат.
Пример 164B
Транс-8-гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 117B, заменяя соединение, полученное в Примере 164A, на соединение, полученное в Примере 117A.
Пример 164C
Транс-8-(2-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2-фторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,14 (дд, J=6,8, 3,9 Гц, 1H), 7,56 (тд, J=7,6, 1,5 Гц, 1H), 7,47-7,40 (м, 1H), 7,29-7,21 (м, 4H), 7,19-7,15 (м, 1H), 5,22-5,15 (м, 2H), 4,27 (дд, J=11,1, 7,7 Гц, 1H), 3,82 (дт, J=23,9, 12,4 Гц, 2H), 3,64 (тд, J=12,6, 7,6 Гц, 1H), 3,49-3,41 (м, 1H), 3,29 (с, 3H), 3,21-3,13 (м, 1H), 3,09 (ддд, J=15,2, 7,2, 3,9 Гц, 1H), 2,87-2,74 (м, 1H); MS (ESI+) m/z 341,4 [M+H]+.
Пример 165
Транс-8-втор-бутокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-бутанол на 3-фторбензиловый спирт. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,90 (д, J=32,7 Гц, 2H), 8,10-8,01 (м, 1H), 7,15 (дд, J=5,5, 2,9 Гц, 2H), 7,04 (дд, J=8,4, 2,5 Гц, 1H), 4,49-4,34 (м, 1H), 3,69-3,55 (м, 1H), 3,58-3,36 (м, 2H), 3,23-3,01 (м, 3H), 2,93 (дт, J=17,2, 9,3 Гц, 1H), 2,31-2,13 (м, 1H), 1,74-1,50 (м, 2H), 1,22 (дт, J=6,0, 3,0 Гц, 3H), 0,92 (тд, J=7,3, 1,0 Гц, 3H); MS (ESI+) m/z 275,1 [M+H]+.
Пример 166
Транс-8-изобутокси-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-метилпропан-1-ол на 3-фторбензиловый спирт. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,90 (д, J=32,5 Гц, 2H), 8,12-8,02 (м, 1H), 7,16 (дд, J=5,4, 2,7 Гц, 2H), 7,06 (дд, J=8,4, 2,7 Гц, 1H), 3,78 (м, 1H), 3,52-3,38 (м, 4H), 3,21-3,02 (м, 3H), 3,00-2,85 (м, 1H), 2,22 (м, 1H), 2,09-1,91 (м, 1H), 0,99 (с, 3H), 0,97 (с, 3H); MS (ESI+) m/z 275,1 [M+H]+.
Пример 167
Транс-8-(циклогексилметокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя циклогексил метанол на 3-фторбензиловый спирт. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,85 (д, J=34,0 Гц, 2H), 8,12-8,02 (м, 1H), 7,15 (дд, J=5,5, 2,8 Гц, 2H), 7,05 (дд, J=8,5, 2,6 Гц, 1H), 3,80 (д, J=6,0 Гц, 2H), 3,66-3,54 (м, 1H), 3,22-3,03 (м, 3H), 2,92 (с, 1H), 2,28-2,12 (м, 2H), 1,75 (дд, J=26,1, 12,0 Гц, 6H), 1,10-1,20 (м, 6H); MS (ESI+) m/z 315,2 [M+H]+.
Пример 168
Транс-8-(2,6-дифторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя (2,6-дифторфенил)метанол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,96 (д, J=44,8 Гц, 2H), 8,16-8,05 (м, 1H), 7,61-7,49 (м, 1H), 7,46-7,34 (м, 1H), 7,29 (д, J=2,6 Гц, 1H), 7,26-7,14 (м, 3H), 7,11-7,02 (м, 1H), 5,15 (с, 2H), 4,50 (с, 1H), 3,68-3,58 (м, 1H), 3,11 (м, 3H), 2,93 (м, 1H), 2,22 (м,1H); MS (ESI+) m/z 345,1 [M+H]+.
Пример 169
Транс-8-(изопентилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 3-метилбутан-1-ол на 3-фторбензиловый спирт. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,85 (д, J=34,0, 2H), 8,15-7,98 (м, 1H), 7,15 (дд, J=5,5, 2,8, 2H), 7,05 (дд, J=8,5, 2,6, 1H), 3,80 (д, J=6,0, 2H), 3,69-3,55 (м, 2H), 3,23-3,01 (м, 3H), 2,92 (м, 1H), 2,29-2,11 (м, 1H), 1,75 (дд, J=26,1, 12,0, 5H), 1,17 (м, 5H); MS (ESI+) m/z 289,2 [M+H]+.
Пример 170
Транс-8-втор-бутокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя бутан-2-ол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,33 (д, J=54,9 Гц, 1H), 8,06 (т, J=4,7 Гц, 1H), 7,27-6,95 (м, 3H), 4,40 (дт, J=11,9, 6,0 Гц, 1H), 3,94 (дд, J=14,4, 8,4 Гц, 1H), 3,81-3,69 (м, 1H), 3,44-3,01 (м, 4H), 3,02-2,81 (м, 4H), 2,32-2,16 (м, 1H), 1,73-1,53 (м, 2H), 1,22 (дд, J=6,0, 1,8 Гц, 3H), 0,92 (тд, J=7,4, 1,4 Гц, 3H); MS (ESI+) m/z 289,2 [M+H]+.
Пример 171
Транс-8-(изопентилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 3-метилбутан-1-ол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,33-10,07 (м, 1H), 8,14-8,01 (м, 1H), 7,25-7,00 (м, 3H), 4,07-3,90 (м, 3H), 3,81-3,70 (м, 1H), 3,40-2,81 (м, 8H), 2,30-2,16 (м, 1H), 1,84-1,72 (м, 1H), 1,66-1,57 (м, 2H), 0,93 (д, J=6,6 Гц, 6H); MS (ESI+) m/z 303,2 [M+H]+.
Пример 172
Транс-8-изобутокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2-метилпропан-1-ол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,05 (д, J=42,4 Гц, 1H), 8,07 (с, 1H), 7,13 (ддд, J=28,6, 12,3, 7,0 Гц, 3H), 3,96 (с, 1H), 3,77 (д, J=6,5 Гц, 3H), 3,30-2,81 (м, 7H), 2,22 (с, 1H), 2,01 (дт, J=13,1, 6,5 Гц, 2H), 0,98 (д, J=6,7 Гц, 6H); MS (ESI+) m/z 289,2 [M+H]+.
Пример 173
Транс-8-(2-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-(2-метоксифенил)этанол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,91 (д, J=47,2 Гц, 2H), 8,14-8,05 (м, 1H), 7,28-7,11 (м, 4H), 7,07 (дд, J=8,4, 2,7 Гц, 1H), 6,99 (д, J=8,0 Гц, 1H), 6,95-6,81 (м, 2H), 4,20-4,11 (м, 2H), 3,82 (с, 3H), 3,60 (м, 1H), 3,56-3,38 (м, 2H), 3,21-2,85 (м, 4H), 2,71 (т, J=7,3 Гц, 1H), 2,20 (д, J=6,1 Гц, 1H); MS (ESI+) m/z 353,2 [M+H]+.
Пример 174
Транс-8-(3-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-(3-метоксифенил)этанол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,94 (д, J=42,2 Гц, 2H), 8,08 (дд, J=6,5, 3,8 Гц, 1H), 7,27-7,19 (м, 1H), 7,20 (м, 2H), 7,07 (дд, J=8,4, 2,7 Гц, 1H), 6,89 (т, J=4,1 Гц, 2H), 6,83-6,76 (м, 1H), 4,27-4,16 (м, 2H), 3,74 (с, 3H), 3,66-3,42 (м, 5H), 3,20-3,04 (м, 3H), 3,01 (т, J=6,7 Гц, 2H), 2,93 (с, 1H), 2,19 (дд, J=12,3, 5,7 Гц, 1H); MS (ESI+) m/z 353,2 [M+H]+.
Пример 175
Транс-8-(4-метоксифенетокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-(4-метоксифенил)этанол на 3-фторбензиловый спирт. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,87 (ушир.с, 1H), 8,08 (м, 1H), 7,23 (д, J=8,6 Гц, 2H), 7,16 (дд, J=5,5, 2,8 Гц, 2H), 7,06 (дд, J=8,5, 2,7 Гц, 1H), 6,87 (д, J=8,6 Гц, 2H), 4,16 (дд, J=9,9, 6,7 Гц, 2H), 3,71 (д, J=5,4 Гц, 3H), 3,67-3,39 (м, 3H), 3,21-3,01 (м, 3H), 3,01-2,88 (м, 3H), 2,18 (с, 1H); MS (ESI+) m/z 353,2 [M+H]+.
Пример 176
Транс-8-(циклогексилметокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя циклогексилметанол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,10 (д, J=43,9 Гц, 1H), 8,06 (м, 1H), 7,26-7,00 (м, 3H), 4,02-3,90 (м, 1H), 3,84-3,70 (м, 2H), 3,41-3,00 (м, 3H), 2,94 (дд, J=22,5, 17,4 Гц, 4H), 2,21 (с, 1H), 1,85-1,59 (м, 5H), 1,33-0,95 (м, 5H); MS (ESI+) m/z 329,2 [M+H]+.
Пример 177
Транс-8-(пиридин-4-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227I, заменяя пиридин-4-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,58 (д, J=21,0 Гц, 2H), 8,91 (д, J=6,5 Гц, 2H), 8,32 (д, J=5,8 Гц, 3H), 8,20 (д, J=2,0 Гц, 1H), 8,14 (дд, J=8,0, 2,1 Гц, 1H), 7,53 (д, J=8,1 Гц, 1H), 3,40-3,20 (м, 4H), 3,18-2,89 (м, 3H), 2,33 (дд, J=16,7, 9,6 Гц, 1H); MS (ESI+) m/z 280,2 [M+H]+.
Пример 178
Транс-8-(2-метоксипиримидин-5-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227I, заменяя 2-метоксипиримидин-5-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,38 (с, 2H), 8,97 (с, 1H), 8,78 (с, 1H), 8,35-8,13 (м, 1H), 8,02-7,76 (м, 2H), 7,38 (дд, J=21,2, 8,0 Гц, 1H), 3,59-3,38 (м, 6H), 3,31-2,91 (м, 4H), 2,36-2,20 (м, 1H); MS (ESI+) m/z 311,2 [M+H]+.
Пример 179
(3aR,10bS)-8-(2-Фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 179A
(3aS,10bS)-трет-Бутил 8-(2-фторбензилокси)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146 и заменяя 2-фторбензиловый спирт на 3-фторбензиловый спирт и стадию удаления защитной кислотной группы не осуществляли.
Пример 179B
(3aR,10bS)-8-(2-Фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 179A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанола с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 14,1 минут), и чистый энантиомер (140 мг, 0,328 ммоль) обрабатывали 3 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,42 (с, 2H), 8,12 (м, 1H), 7,56 (т, J=7,6 Гц, 1H), 7,43 (дт, J=7,3, 3,7 Гц, 1H), 7,34-7,12 (м, 5H), 5,27-5,11 (м, 2H), 3,67-3,43 (м, 2H), 3,25-3,02 (м, 3H), 2,92 (дд, J=14,8, 9,2 Гц, 1H), 2,20 (дт, J=11,9, 6,3 Гц, 1H); MS (ESI+) m/z 327,1 [M+H]+.
Пример 180
(3aS,10bR)-8-(2-Фторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 179A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанола с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 16,2 минут), и чистый энантиомер (150 мг, 0,352 ммоль) обрабатывали 3 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,34-9,25 (м, 2H), 8,14-8,08 (м, 1H), 7,56 (тд, J=7,5, 1,8 Гц, 1H), 7,48-7,39 (м, 1H), 7,30-7,13 (м, 5H), 5,17 (ушир. с, 2H), 3,65-3,55 (м, 2H), 3,21-3,01 (м, 3H), 3,00-2,87 (м, 1H), 2,27-2,11 (м, 1H); MS (ESI+) m/z 327,1 [M+H]+.
Пример 181
(3aR,10bS)-8-((R)-1-Фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 181A
(3aS,10bS)-трет-Бутил 6-оксо-8-((R)-1-фенилпропан-2-илокси)-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя (S)-1-фенилпропан-2-ол на 3-фторбензиловый спирт, и стадию удаления защитной кислотной группы не осуществляли.
Пример 181B
(3aR,10bS)-8-((R)-1-Фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 181A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанола с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 9,2 минут), и чистый энантиомер (140 мг, 0,321 ммоль) обрабатывали 3 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,30-9,15 (м, 2H), 8,11-8,04 (м, 1H), 7,33-7,26 (м, 4H), 7,27-7,10 (м, 3H), 7,04 (дд, J=8,4, 2,7 Гц, 1H), 4,76-4,66 (м, 1H), 3,62-3,54 (м, 1H), 3,50-3,36 (м, 3H), 3,20-2,82 (м, 5H), 2,41-2,11 (м, 1H), 1,23 (д, J=5,9 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 182
(3aS,10bR)-8-((R)-1-Фенилпропан-2-илокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 181A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 10-30% метанола с 0,1% диэтиламином-CO2 в течение 20 минут, при 40 мл/минута, время удерживания = 12,2 минут), и чистый энантиомер (150 мг, 0,344 ммоль) обрабатывали 3 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение 2 часов, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,28-9,08 (м, 2H), 8,08 (дд, J=6,6, 3,9 Гц, 1H), 7,31-7,26 (м, 4H), 7,25-7,16 (м, 1H), 7,18-7,11 (м, 2H), 7,04 (дд, J=8,4, 2,7 Гц, 1H), 4,76-4,64 (м, 1H), 3,58 (дд, J=10,5, 6,5 Гц, 1H), 3,50-3,35 (м, 3H), 3,19-2,81 (м, 4H), 2,90 (д, J=11,3 Гц, 1H), 2,35-1,97 (м, 1H), 1,23 (д, J=6,0 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 183
Транс-8-(2-метоксифенетокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2-(2-метоксифенил)этанол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 164B, на соединение, полученное в Примере 117. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,06 (д, J=44,9 Гц, 1H), 8,07 (м, 1H), 7,30-7,18 (м, 3H), 7,17-7,05 (м, 2H), 6,99 (д, J=8,0 Гц, 1H), 6,89 (дд, J=7,3, 6,5 Гц, 1H), 4,22-4,10 (м, 2H), 3,95 (дд, J=9,5, 4,8 Гц, 1H), 3,82(с, 3H), 3,75 (дд, J=10,8, 6,1 Гц, 1H), 3,40-3,09 (м, 4H), 3,09-2,83 (м, 6H), 2,20 (д, J=6,5 Гц, 1H); MS (ESI+) m/z 397,3 [M+H]+.
Пример 184
Транс-8-(тиофен-3-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H и Примере 227I, заменяя тиофен-3-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,02 (д, J=51,8 Гц, 2H), 8,16 (дд, J=6,5, 3,8 Гц, 1H), 8,00-7,92 (м, 2H), 7,86 (дд, J=8,0, 2,0 Гц, 1H), 7,67 (дд, J=5,0, 2,9 Гц, 1H), 7,59 (дд, J=5,1, 1,4 Гц, 1H), 7,31 (д, J=8,0 Гц, 1H), 3,59-3,42 (м, 2H), 3,16 (м, 4H), 2,98 (дд, J=15,9, 9,2 Гц, 1H), 2,34-2,21 (м, 1H); MS (ESI+) m/z 285,1 [M+H]+.
Пример 185
Транс-2-метил-8-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 185A
Транс-8-(3-ацетилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75 3-ацетилфенилбороновую кислоту на 4-фторфенилбороновую кислоту.
Пример 185B
Транс-2-метил-8-(3-(1,1,1-трифтор-2-гидроксипропан-2-ил)фенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К соединению, полученному в Примере 185A (60 мг, 0,179 ммоль) и 1,44 мл 0,5 M (в тетрагидрофуране) (трифторметил)триметилсилана, добавляли 0,197 мл 1,0 M тетрабутиламмоний фторида в тетрагидрофуране при температуре 0°C. Реакционную смесь затем нагревали до комнатной температуры и перемешивали в течение ночи. Данные LC/MS показывали неполное преобразование. Добавляли еще (трифторметил)триметилсилан (0,72 мл, 0,5 M в тетрагидрофуране) и тетрабутиламмоний фторид (0,19 мл, 1,0 M в тетрагидрофуране) при температуре 0°C, и затем реакционную смесь перемешивали на следующий день при комнатной температуре. Реакционную смесь разбавляли насыщенным водным раствором Na2CO3 и экстрагировали дихлорметаном (3×). Объединенный органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,11 (д, J=50,9 Гц, 1H), 8,17 (м, 1H), 7,99-7,77 (м, 3H), 7,68 (д, J=7,5 Гц, 1H), 7,60 (д, J=7,9 Гц, 1H), 7,52 (т, J=7,7 Гц, 1H), 7,44-7,28 (м, 1H), 6,72 (с, 1H), 4,03 (м, 1H), 3,69 (м, 2H), 3,39-3,28 (м, 3H), 3,18 (д, J=6,8 Гц, 2H), 2,98 (дд, J=17,5, 12,4 Гц, 2H), 2,67-2,32 (м, 1H), 1,75 (с, 3H); MS (ESI+) m/z 405,1 [M+H]+.
Пример 186
Транс-8-(3-(2-гидроксипропан-2-ил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К охлажденному (-10°C) и перемешиваемому в сухом тетрагидрофуране (0,7 мл) соединению, полученному в Примере 185A (83,5 мг, 0,25 ммоль), добавляли по каплям метилмагнийбромид (0,54 мл, 1,4 M в смеси толуол/тетрагидрофуран). Реакционную смесь затем медленно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь гасили с помощью насыщенного водного раствора хлорида аммония и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4 и концентрировали. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,27-10,05 (м, 1H), 8,19-8,11 (м, 1H), 7,93 (дд, J=15,5, 2,0 Гц, 1H), 7,85-7,76 (м, 2H), 7,53-7,44 (м, 2H), 7,41 (т, J=7,5 Гц, 1H), 7,37-7,25 (м, 1H), 4,07-3,95 (м, 1H), 3,83-3,48 (м, 2H), 3,42-3,26 (м, 5H), 3,23-2,90 (м, 3H), 2,56-2,27 (м, 1H), 1,48 (с, 6H); MS (ESI+) m/z 351,3 [M+H]+.
Пример 187
Транс-8-(3-ацетилфенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 187A
Транс-трет-бутил 5-метил-6-оксо-8-(трифторметилсульфонилокси)-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
К соединению, полученному в Примере 227G (500 мг, 1,11 ммоль), и йодметану (354 мг, 2,493 ммоль) в 5 мл N,N-диметилформамида добавляли NaH (101 мг, 2,53 ммоль, 60% в минеральном масле) при комнатной температуре. Полученную смесь перемешивали в течение 30 минут, и затем реакционную смесь гасили с помощью насыщенного водного раствора хлорида аммония. Смесь экстрагировали этилацетатом (2×). Объединенные органические слои концентрировали и очищали с помощью флэш-хроматографии на силикагеле, элюируя с помощью этилацетата (50-80%) в гексане с получением указанного в заголовке соединения.
Пример 187B
Транс-трет-бутил 8-(3-ацетилфенил)-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-ацетилфенилбороновую кислоту на 3-(метилсульфонил) фенилбороновую кислоту и заменяя соединение, полученное в Примере 187A, на соединение, полученное в Примере 227G.
Пример 187C
Транс-8-(3-ацетилфенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 187B, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,24 (д, J=61,6 Гц, 2H), 8,19 (д, J=1,6 Гц, 1H), 7,97 (т, J=7,3 Гц, 2H), 7,93 (д, J=2,0 Гц, 1H), 7,88 (дд, J=7,9, 2,0 Гц, 1H), 7,65 (т, J=7,8 Гц, 1H), 7,39 (д, J=8,0 Гц, 1H), 3,62 (д, J=39,0 Гц, 2H), 3,44 (дт, J=15,5, 11,1 Гц, 3H), 3,28-3,06 (м, 5H), 2,67 (с, 3H), 2,29 (дд, J=16,2, 9,8 Гц, 1H); MS (ESI+) m/z 335,2 [M+H]+.
Пример 188
Транс-8-метокси-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 188A
Транс-трет-бутил 8-метокси-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в виде побочного продукта в соответствии со способом, описанным в Примере 187A.
Пример 188B
Транс-8-метокси-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 188A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,53-9,23 (м, 2H), 7,20-7,10 (м, 2H), 7,09-7,02 (м, 1H), 3,77 (с, 3H), 3,63-3,54 (м, 1H), 3,54-3,37 (м, 3H), 3,09 (с, 3H), 3,02-3,07 (м, 2H), 2,22-2,09 (м, 2H); MS (ESI+) m/z 247,1 [M+H]+.
Пример 189
Транс-8-(3-(2-гидроксиэтил)фенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 189A
Транс-трет-бутил 8-(3-(2-гидроксиэтил)фенил)-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(2-гидроксиэтил)фенилбороновую кислоту на 3-(метилсульфонил) фенилбороновую кислоту и заменяя соединение, полученное в Примере 187A, на соединение, полученное в Примере 227G.
Пример 189B
Транс-8-(3-(2-гидроксиэтил)фенил)-5-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 189A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,24-9,10 (м, 2H), 7,86-7,82 (м, 1H), 7,81-7,76 (м, 1H), 7,55-7,46 (м, 2H), 7,42-7,32 (м, 2H), 7,28-7,21 (м, 1H), 4,71-4,62 (м, 1H), 3,71-3,63 (м, 3H), 3,62-3,52 (м, 3H), 3,54-3,36 (м, 3H), 3,24-3,06 (м, 3H), 2,85-2,77 (м, 2H), 2,34-2,20 (м, 1H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 190
Транс-8-метокси-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 188, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,39-10,17 (м, 1H), 7,17-7,02 (м, 3H), 3,78 (с, 5H), 3,58-3,41 (м, 4H), 3,41-3,26 (м, 3H), 3,10 (д, J=7,0, 6H), 2,97 (дд, J=8,3, 4,8 Гц, 3H), 2,48-2,12 (м, 1H); MS (ESI+) m/z 261,1 [M+H]+.
Пример 191
Транс-8-(3-ацетилфенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 187, на соединение, полученное в Примере 46. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,25 (д, J=55,7 Гц, 1H), 8,20 (с, 1H), 8,03-7,85 (м, 4H), 7,65 (т, J=7,8 Гц, 1H), 7,34 (дд, J=18,5, 8,0 Гц, 1H), 4,11-3,97 (м, 3H), 3,87-3,77 (м, 1H), 3,72-3,19 (м, 3H), 3,15 (д, J=6,7 Гц, 3H), 3,11-2,95 (м, 4H), 2,67 (с, 3H), 2,37-2,23 (м, 1H); MS (ESI+) m/z 349,2 [M+H]+.
Пример 192
Транс-8-(3-(2-гидроксиэтил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 189, на соединение, полученное в Примере 46. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,30-10,08 (м, 1H), 7,92-7,75 (м, 2H), 7,65-7,47 (м, 2H), 7,47-7,35 (м, 1H), 7,37-7,22 (м, 2H), 4,06-3,99 (м, 1H), 3,74-3,23 (м, 6H), 3,17-3,11 (м, 5H), 3,00 (дд, J=8,9, 4,8 Гц, 3H), 2,80 (т, J=6,8 Гц, 2H), 2,48-2,22 (м, 1H); MS (ESI+) m/z 351,2 [M+H]+.
Пример 193
Транс-8-(3-(1-гидроксиэтил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 238, заменяя соединение, полученное в Примере 191, на соединение, полученное в Примере 237. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,95 (д, J=2,0 Гц, 1H), 7,71 (дд, J=7,9, 2,0 Гц, 1H), 7,63 (с, 1H), 7,53-7,47 (м, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,34 (д, J=7,6 Гц, 1H), 7,25 (д, J=8,0 Гц, 1H), 5,23 (д, J=3,1 Гц, 1H), 4,86-4,75 (м, 1H), 3,49-3,39 (м, 4H), 3,21-3,04 (м, 2H), 2,76 (дт, J=18,4, 8,9 Гц, 2H), 2,44 (с, 3H), 2,28-2,15 (м, 1H), 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 351,2 [M+H]+.
Пример 194
Транс-8-(3-(2-гидроксипропан-2-ил)фенил)-2,5-диметил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя соединение, полученное в Примере 191, на соединение, полученное в Примере 185A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,95 (д, J=2,0 Гц, 1H), 7,75 (д, J=1,7 Гц, 1H), 7,71 (дд, J=7,9, 2,0 Гц, 1H), 7,46 (дд, J=11,4, 4,6 Гц, 2H), 7,40 (д, J=7,6 Гц, 1H), 7,25 (д, J=8,0 Гц, 1H), 5,09 (с, 1H), 3,52-3,38 (м, 2H), 3,22-3,05 (м, 6H), 2,78 (дт, J=18,4, 8,9 Гц, 2H), 2,46 (с, 3H), 2,22 (с, 1H), 1,47 (с, 6H); MS (ESI+) m/z 365,3 [M+H]+.
Пример 195
Транс-8-(бензо[c][1,2,5]оксадиазол-5-ил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 195A
Транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-ил трифторметансульфонат
Во взвесь соединения, полученного в Примере 164B (850 мг, 3,66 ммоль) в 10 мл дихлорметана, добавляли триэтиламин (459 мг, 4,54 ммоль), затем 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (1361 мг, 3,81 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали, и к остатку добавляли воду, и смесь экстрагировали дихлорметаном (3×). Органические промывки объединяли, сушили над Na2SO4, концентрировали и очищали с помощью флэш-хроматографии на силикагеле, элюируя метанолом (1-10%) в дихлорметане с получением указанного в заголовке соединения.
Пример 195B
Транс-8-(бензо[c][1,2,5]оксадиазол-5-ил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя бензо[c][1,2,5]оксадиазол-5-илбороновую кислоту на 3-(метилсульфонил) фенилбороновую кислоту и заменяя соединение, полученное в Примере 195A, на соединение, полученное в Примере 227G. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,37 (д, J=65,5 Гц, 1H), 8,38 (с, 1H), 8,23 (д, J=4,5 Гц, 1H), 8,18 (д, J=9,5 Гц, 1H), 8,12 (дд, J=15,0, 2,0 Гц, 1H), 8,08-8,00 (м, 2H), 7,41 (дд, J=25,6, 8,1 Гц, 1H), 4,18-3,99 (м, 2H), 3,87-3,31 (м, 3H), 3,31 (м, 2H), 3,09-2,90 (м, 3H), 2,68-2,27 (м, 1H); MS (ESI+) m/z 335,0 [M+H]+.
Пример 196
Транс-8-изопропил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 196A
Транс-2-метил-8-(проп-1-en-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-изопропенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан на 4-фторфенилбороновую кислоту.
Пример 196B
Транс-8-изопропил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Соединение, полученное в Примере 196A (85 мг, 0,332 ммоль), и метанол (10 мл) добавляли к 5% Pd-C, влажный, (17,00 мг, 0,160 ммоль) в 50-миллилитровом сосуде для работы под давлением и перемешивали в течение 70 минут в атмосфере водорода (40 фунтов на квадратный дюйм) при комнатной температуре. Смесь фильтровали через нейлоновую мембрану и концентрировали. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,28 (д, J=56,0 Гц, 1H), 8,05 (д, J=3,9 Гц, 1H), 7,61-7,49 (м, 1H), 7,44-7,37 (м, 1H), 7,19-7,04 (м, 1H), 3,98 (дт, J=10,6, 8,2 Гц, 1H), 3,82-3,19 (м, 4H), 3,19-2,84 (м, 5H), 2,58 (дд, J=17,2, 9,6 Гц, 1H), 2,35-2,20 (м, 1H), 1,21 (д, J=6,9 Гц, 6H); MS (ESI+) m/z 259,0 [M+H]+.
Пример 197
Транс-2-метил-8-(2-метилпроп-1-енил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-метилпроп-1-енилбороновую кислоту на 4-фторфенилбороновую кислоту. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,28 (д, J=53,1 Гц, 1H), 8,06 (д, J=4,3 Гц, 1H), 7,60-7,46 (м, 1H), 7,36 (д, J=7,9 Гц, 1H), 7,16 (дд, J=22,0, 7,9 Гц, 1H), 6,29 (с, 1H), 4,00 (дд, J=14,0, 8,2 Гц, 1H), 3,66-3,23 (м, 4H), 3,21-3,02 (м, 2H), 2,93 (дт, J=18,3, 8,9 Гц, 3H), 2,60-2,22 (м, 1H), 1,93-1,81 (м, 6H); MS (ESI+) m/z 271,2 [M+H]+.
Пример 198
Транс-3-(2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-ил)бензальдегид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-формилфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и Примере 195A, на соединение, полученное в Примере 227G. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,12 (м, 2H), 8,35-8,22 (м, 1H), 8,23-8,16 (м, 1H), 8,13-7,99 (м, 2H), 7,98-7,89 (м, 2H), 7,73 (т, J=7,6 Гц, 1H), 7,37 (дд, J=24,7, 8,0 Гц, 1H), 4,12-4,00 (м, 1H), 3,62-3,45 (м, 3H), 3,44-3,31 (м, 2H), 3,26-3,08 (м, 2H), 3,00 (дд, J=7,7, 5,0 Гц, 2H), 2,68-2,30 (м, 1H); MS (ESI+) m/z 321,3 [M+H]+.
Пример 199
(3aS,10bS)-8-Хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
12 литровую 4-горлую колбу снабжали механической мешалкой, датчиком температуры и затем в атмосфере азота загружали дибензоил-D-виннокаменную кислоту (189,7 г) и метанол (5,5 кг). Пример 53 (126,3 г) растворяли в метаноле (1,48 кг) в отдельной колбе. Часть раствора (13,5%) Примера 53 в метаноле в течение 1 часа добавляли к раствору дибензоил-D-тартрат/метанол. В раствор вносили затравку (затравочные кристаллы получали, как описано далее) продукта (250 мг). Остаток раствора Примера 53 добавляли в течение 7,5 часов. Для промывки остатков остального исходного вещества использовали метанол (278 мл) в 2 л колбе Эрленмейера, и полученную смесь закачивали в реакционный сосуд в течение 1 часа. Реакции давали протекать в течение 14 часов. Суспензию фильтровали, промывали трет-бутил метиловым эфиром (0°C, 2 л) и сушили в вакууме с получением указанного в заголовке соединения в виде дибензоил-D-тартрата. Продукт показывал эи (ее) равным 98,2%, как можно судить по данным анализа ВЭЖХ с обращенной фазой [Способ: Изократическое элюирование: 70% воды (5 мМ фосфатный буфер, pH 6,9): 30% ацетонитрил в течение 15 минут. Колонка: Chiralpak® AS-RH (4,6 мм × 150 мм). Температура 35°C. Используемая для расчетов длина волны была 210 нм.]. Соль переводили в свободное основание путем добавления этилацетата (1 л) и два раза экстракцией 15% водным K3PO4 (600 мл). Объединенные щелочные водные слои затем экстрагировали этилацетатом (500 мл). Объединенные органические слои далее два раза экстрагировали 20% насыщенным солевым раствором (500 мл). Указанное в заголовке соединение получали путем упаривания органического слоя в вакууме (47,5 г). 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,12 (с, 1H), 7,81 (д, J=2,0 Гц, 1H), 7,49 (дд, J=2,5, 8,0 Гц, 1H), 7,18 (д, J=8,0 Гц, 1H), 3,26 (м, 1H), 3,20 (м, 1H), 3,11 (м, 1H), 3,08 (м, 1H), 2,84 (дд, J=9,0, 10,5 Гц, 1H), 2,62 (м, 2H) и 2,18 (м, 1H); MS (ESI+) m/z 251 [M+H]+.
Пример 199
(3aS,10bS)-8-Хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он: Получение затравочных кристаллов
Затравочные кристаллы, используемые в эксперименте, описанном в данном патенте, получали из предшествующего эксперимента, в котором использовали нанесение затравочных кристаллов и т.д. Такой же эксперимент может быть осуществлен без затравки, в ущерб энантиомерной чистоте продукта:
В 4-миллилитровый сосуд с перегородкой загружали дибензоил-D-виннокаменную кислоту (72 мг, 0,20 ммоль, 1,0 эквив.), метанол (0,5 мл) и помещали магнитную мешалку. К перемешиваемой соли быстро добавляли 0,1 г/мл этанольный раствор Примера 53 (0,5 мл = 50 мг, 0,20 ммоль, 1,0 эквив.). Раствор оставляли перемешиваться в течение ночи. Образование твердого продукта делало раствор неперемешиваемым, поэтому добавляли метанол (2,0 мл). Твердый продукт собирали путем фильтрации с получением указанного в заголовке соединения в виде дибензоил-D-тартрата, и лепешку на фильтре и фильтрат анализировали с помощью как хиральной, так и нехиральной системы ВЭЖХ. Анализ с использованием ранее описанного метода хиральные показывает, что желаемый продукт имеет эи 84%.
Пример 200
(3aS,10bS)-8-Гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 200A
(3aS,10bS)-8-(Бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Ацетат палладия(II) (1,075 г, 4,79 ммоль), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенил (2,76 г, 5,74 ммоль), карбонат цезия (58,5, 179 ммоль) и (3aS,10bS)-8-хлор-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он (соединение, полученное в Примере 199, 30,0 г, 120 ммоль) помещали в 2 литровую трехгорлую круглодонную колбу, снабженную механической мешалкой, термопарой и обратным холодильником. Колбу продували аргоном в течение около 2 часов. Объединяли толуол (240 мл) и бензиловый спирт (248 мл, 2393 ммоль) в отдельной 1-литровой круглодонной колбе, которую продували аргоном в течение приблизительно 60 минут. Данную смесь переносили с помощью канюли в содержащую вещество колбу, в атмосфере аргона. Температуру повышали до 95°C, и реакционный раствор перемешивали при данной температуре в течение 1 часа. Реакционную смесь охлаждали до комнатной температуры и фильтровали. Реакционную колбу и воронку промывали этилацетатом. Раствор разбавляли этилацетатом (1 л) и затем промывали H2O (210 мл). Органический слой затем промывали насыщенным водным раствором NaCl (220 мл). Объединенные водные слои подщелачивали с помощью водного раствора 2 M KOH до нейтральной pH (7) и затем вносили затравочные кристаллы (Затравочные кристаллы были получены способом, описанным в Примере 199.), около 20 мг продукта. Раствор затем далее подщелачивали с помощью 2 M KOH до pH = 12. Раствор энергично перемешивали в течение 30 минут и затем фильтровали. Твердые продукты сушили в токе воздуха в течение 1,5 часов. Твердые продукты затем сушили в вакууме при комнатной температуре. Вещество растворяли в теплом метаноле и раствор фильтровали. Фильтрат концентрировали при пониженном давлении с получением твердого продукта. К твердому продукту добавляли смесь этилацетата и трет-бутил метилового эфира (100 мл каждого). После энергичного перемешивания в течение 30 минут продукт собирали путем фильтрации и промывали трет-бутил метиловым эфиром (200 мл), предварительно охлажденным до 0°C. Твердые продукты помещали в вакуумную печь при комнатной температуре в токе азота, высушивая в течение ночи. Твердый продукт харвестировали с получением указанного в заголовке соединения (18,0 г). Альтернативное получение указанного в заголовке соединения описано в Примере 274. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,96 (дд, J=8,9, 5,3 Гц, 1H), 7,46-7,28 (м, 6H), 7,08-7,02 (м, 2H), 5,10 (с, 2H), 3,25-3,00 (м, 4H), 2,83 (дд, J=10,3, 8,6 Гц, 1H), 2,64-2,55 (м, 2H), 2,35 (с, 3H), 2,18-2,05 (м, 1H).
Пример 200B
(3aS,10bS)-8-Гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
(3aS,10bS)-8-(Бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он (соединение, полученное в Примере 200A, 18 г, 96,9% содержание) и катализатор JM UK # 3: 3,54 г (10% масс. сухого основания, катализатор в 50,9% воды) помещали в 1,8-литровый аппарат Парра, затем добавляли 900 мл метанола. Реактор герметически закрывали и продували азотом, затем продували водородом. В реакторе поднимали давление водорода до 30 фунтов на квадратный дюйм. Реакция казалась завершенной в течение 5 минут, но ей давали выдержаться в течение ночи. После выдерживания в течение ночи не наблюдалось исходного вещества, что подтверждалось с помощью анализа ВЭЖХ с обращенной фазой. Раствор фильтровали, концентрировали при пониженном давлении с получением остатка и затем два раза обрабатывали 2-метилтетрагидрофураном (150 мл). Конечную взвесь быстро охлаждали на ледяной бане и твердый продукт затем харвестировали путем фильтрации с получением после сушки (вакуум, 50°C) указанного в заголовке соединения (12,2 г). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,86 (т, J=3,8 Гц, 1H), 7,23 (т, J=2,9 Гц, 1H), 6,91 (д, J=8,3 Гц, 1H), 6,79 (дд, J=8,2, 2,7 Гц, 1H), 3,18 (ддд, J=13,3, 6,5, 3,1 Гц, 3H), 3,13-2,98 (м, 3H), 2,84-2,76 (м, 1H), 2,64-2,53 (м, 2H), 2,49 (дт, J=3,7, 1,8 Гц, 1H), 2,15-2,03 (м, 1H); MS (ESI+) m/z 233,3 [M+H]+.
Пример 201
Транс-8-циклопентенил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 2-циклопентенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 195A, на соединение, полученное в Примере 227G. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,28 (д, J=51,9 Гц, 1H), 8,10 (с, 1H), 7,70 (дд, J=12,7, 1,8 Гц, 1H), 7,65-7,56 (м, 1H), 7,17 (дд, J=22,1, 8,0 Гц, 1H), 6,35 (с, 1H), 3,99 (дт, J=10,4, 8,0 Гц, 1H), 3,82-3,45 (м, 2H), 3,43-3,22 (м, 2H), 3,21-2,83 (м, 7H), 2,66 (дд, J=10,6, 4,3 Гц, 2H), 2,59-2,21 (м, 1H), 2,04-1,92 (м, 2H); MS (ESI+) m/z 283,2 [M+H]+.
Пример 202
Транс-2-метил-8-(3,3,3-трифторпроп-1-ен-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4,4,6-триметил-2-(3,3,3-трифторпроп-1-ен-2-ил)-1,3,2-диоксаборинан на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 195A, на соединение, полученное в Примере 227G. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,23 (д, J=58,0 Гц, 1H), 8,21 (д, J=4,4 Гц, 1H), 7,78 (д, J=17,8 Гц, 1H), 7,67 (дд, J=14,9, 7,7 Гц, 1H), 7,39-7,26 (м, 1H), 6,17 (д, J=13,7 Гц, 2H), 3,85-3,69 (м, 2H), 3,68-3,44 (м, 2H), 3,39 (дд, J=25,4, 8,3 Гц, 2H), 3,24-3,04 (м, 2H), 3,03-2,88 (м, 2H), 2,67 (м, 1H), 2,33 (м, 1H); MS (ESI+) m/z 311,1 [M+H]+.
Пример 203
Транс-2-метил-8-(5-метилфуран-2-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя пинаколовый эфир 5-метилфуран-2-бороновой кислоты на 4-фторфенилбороновую кислоту. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,34-10,08 (м, 1H), 8,19-8,12 (м, 1H), 7,92 (д, J=6,2 Гц, 1H), 7,76 (дд, J=8,0, 1,8 Гц, 1H), 7,29-7,17 (м, 1H), 6,91 (д, J=3,2 Гц, 1H), 6,25-6,17 (м, 1H), 3,23-3,06 (м, 4H), 3,02-2,93 (м, 6H), 2,40-2,31 (м, 3H), 2,2 (м, 1H); MS (ESI+) m/z 297,2 [M+H]+.
Пример 204
Транс-8-циклогексил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 204A
Транс-8-циклогексенил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 2-циклогексенил-4,4,5,5-тетраметил-1,3,2-диоксаборолан на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 195A, на соединение, полученное в Примере 227G.
Пример 204B
Транс-8-циклогексил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 196B, заменяя соединение, полученное в Примере 204A, на соединение, полученное в Примере 196A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,00 (с, 1H), 7,58 (с, 1H), 7,34 (дд, J=7,8, 1,7 Гц, 1H), 7,09 (д, J=7,9 Гц, 1H), 3,37 (дд, J=14,4, 7,2 Гц, 1H), 3,20-3,08 (м, 3H), 3,01 (кв, J=7,2 Гц, 3H), 2,73 (с, 3H), 2,33 (с, 1H), 1,91 (с, 1H), 1,82-1,65 (м, 5H), 1,46-1,30 (м, 5H); MS (ESI+) m/z 299,3 [M+H]+.
Пример 205
Транс-8-циклопентил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 196B, заменяя соединение, полученное в Примере 201, на соединение, полученное в Примере 196A. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,27 (д, J=71,1 Гц, 1H), 8,04 (д, J=4,3 Гц, 1H), 7,54 (д, J=18,8 Гц, 1H), 7,44-7,37 (м, 1H), 7,18-7,06 (м, 1H), 3,97 (д, J=10,6 Гц, 1H), 3,80-3,70 (м, 1H), 3,39-3,22 (м, 3H), 3,19-2,81 (м, 5H), 2,56 (д, J=21,0 Гц, 1H), 2,27 (м, 1H), 2,01 (дд, J=14,1, 10,8 Гц, 2H), 1,82-1,71 (м, 2H), 1,71-1,61 (м, 2H), 1,57-1,47 (м, 2H); MS (ESI+) m/z 285,2 [M+H]+.
Пример 206
(3aS,10bS)-8-(3-Фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 3-фторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,01 (д, J=48,2 Гц, 1H), 8,09 (д, J=4,1 Гц, 1H), 7,45 (дд, J=13,9, 8,1 Гц, 1H), 7,35-7,25 (м, 3H), 7,15 (ддд, J=22,5, 14,1, 5,5 Гц, 3H), 5,18 (с, 2H), 3,95 (дд, J=10,3, 5,6 Гц, 1H), 3,80-3,54 (м, 2H), 3,36-3,04 (м, 3H), 2,92 (ддд, J=29,9, 12,9, 8,2 Гц, 4H), 2,60-2,16 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 207
(3aS,10bS)-8-(2-Фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 118, заменяя 2-фторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,22 (д, J=49,8 Гц, 1H), 8,08 (д, J=4,4 Гц, 1H), 7,56 (т, J=7,7 Гц, 1H), 7,48-7,38 (м, 1H), 7,22 (дддд, J=32,1, 28,8, 21,2, 5,6 Гц, 5H), 5,18 (с, 2H), 3,71-3,10 (м, 7H), 3,10-2,82 (м, 3H), 2,61-2,16 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 208
(3aS,10bS)-8-(3,5-Дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 3,5-дифторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,50-10,22 (м, 1H), 8,10 (т, J=4,9 Гц, 1H), 7,21 (м, 6H), 5,19 (с, 2H), 3,83-3,16 (м, 5H), 3,18-2,83 (м, 5H), 2,64-2,16 (м, 1H); MS (ESI+) m/z 359,2 [M+H]+.
Пример 209
(3aS,10bS)-8-(2,6-Дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя (2,6-дифторфенил)метанол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,17 (д, J=48,7 Гц, 1H), 8,09 (д, J=4,2 Гц, 1H), 7,59-7,48 (м, 1H), 7,31 (дд, J=16,4, 5,5 Гц, 1H), 7,25-7,02 (м, 4H), 5,15 (с, 2H), 3,96 (д, J=4,2 Гц, 1H), 3,74 (дд, J=14,1, 9,1 Гц, 1H), 3,40-3,02 (м, 4H), 3,01-2,81 (м, 4H), 2,62-2,14 (м, 1H); MS (ESI+) m/z 359,1 [M+H]+.
Пример 210
(3aS,10bS)-8-(3,4-Дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 3,4-дифторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,22 (д, J=51,0 Гц, 1H), 8,09 (д, J=4,2 Гц, 1H), 7,59-7,42 (м, 2H), 7,37-7,28 (м, 2H), 7,20-7,08 (м, 2H), 5,14 (с, 2H), 4,02-3,92 (м, 2H), 3,70-3,41 (м, 4H), 3,40-3,15 (м, 2H), 3,16 (с, 2H), 2,62-2,17 (м, 1H); MS (ESI+) m/z 359,2 [M+H]+.
Пример 211
(3aS,10bS)-8-(4-Фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 4-фторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,22 (д, J=50,3 Гц, 1H), 8,08 (д, J=4,3 Гц, 1H), 7,50 (дд, J=8,4, 5,7 Гц, 2H), 7,33-7,05 (м, 5H), 5,12 (с, 2H), 4,02-3,89 (м, 1H), 3,62-2,82 (м, 9H), 2,62-2,16 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 212
(3aS,10bS)-8-(2,3-Дифторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2,3-дифторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,16 (д, J=47,8 Гц, 1H), 8,10 (м, 1H), 7,52-7,36 (м, 2H), 7,28 (ддд, J=19,8, 13,4, 5,4 Гц, 2H), 7,23-7,09 (м, 2H), 5,22 (д, J=12,6 Гц, 2H), 3,96 (дт, J=12,6, 6,6 Гц, 1H), 3,60-3,04 (м, 6H), 2,92 (м, 3H), 2,64-2,15 (м, 1H); MS (ESI+) m/z 359,2 [M+H]+.
Пример 213
(3aS,10bS)-2-Метил-8-(2,3,6-трифторбензилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 2,3,6-трифторбензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,25 (д, J=51,2 Гц, 1H), 8,10 (д, J=4,3 Гц, 1H), 7,61 (квд, J=9,5, 5,1 Гц, 1H), 7,38-7,06 (м, 4H), 5,21 (д, J=12,1 Гц, 2H), 4,02-3,91 (м, 2H), 3,71-2,80 (м, 8H), 2,63-2,17 (м, 1H); MS (ESI+) m/z 377,2 [M+H]+.
Пример 214
Транс-9-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 214A
трет-Бутил транс-9-бром-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
В круглодонную колбу, содержащую соединение, полученное в Примере 94A (0,198 г, 0,684 ммоль) в сухом N,N-диметилформамиде (5 мл), при температуре 80°C, добавляли 1-бромпирролидин-2,5-дион (0,244 г, 1,368 ммоль). Реакционную смесь перемешивали при температуре 80°C в течение 2 часов. Реакционную смесь затем разбавляли водой (30 мл) и экстрагировали CH2Cl2 (3×30 мл). Органические слои объединяли и растворитель упаривали в вакууме. Полученное масло очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексан:этилацетат 2:1 с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,40-7,26 (м, 1H), 7,13 (т, J=15,9 Гц, 1H), 7,00-6,88 (м, 1H), 4,42-4,31 (м, 1H), 3,90-3,75 (м, 1H), 3,69-3,43 (м, 3), 3,28-3,15 (м, 1), 3,05-2,95 (м, 1), 2,08-1,9 (м, 2H), 1,9-1,55 (м, 1H), 1,43 (д, J=7,9 Гц, 9H).
Пример 214B
Транс-9-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
В круглодонную колбу, содержащую соединение, полученное в Примере 214A (0,062 мг, 0,168 ммоль) в дихлорметане (3 мл), добавляли 4н HCl в диоксане. Смесь перемешивали в течение 8 часов, затем растворитель упаривали и продукт кристаллизовали из этилацетата с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,37 (ддд, J=8,5, 2,4, 0,5, 1H), 7,23 (дд, J=2,4, 0,9 Гц, 1H), 6,96 (д, J=8,5 Гц, 1H), 4,46 (ддд, J=12,4, 3,8, 3,0 Гц, 1H), 3,86-3,80 (м, 1H), 3,76-3,56 (м, 3), 3,43 (д, J=7,1 Гц, 1H), 3,09 (дд, J=11,9, 10,3 Гц, 1H), 2,21-2,10 (м, 2), 1,95 (дд, J=8,3, 7,1 Гц, 1H); MS (DCI+) m/z 268,1 [M+H]+.
Пример 215
Транс-9-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 215A
трет-Бутил транс-9-фенил-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
В сосуд для микроволнового воздействия, содержащий соединение, полученное в Примере 214A (,08 г, 0,217 ммоль) в диметоксиэтане (1 мл), добавляли фенилбороновую кислоту (0,029 г, 0,239 ммоль), затем 2-дициклогексилфосфино-2',6'-диметоксибифенил (0,045 г, 0,109 ммоль), ацетат палладия(II) (4,87 мг, 0,022 ммоль) и карбонат калия (0,217 мл, 0,434 ммоль). Смесь нагревали в микроволновом CEM Explorer® 48, при температуре 150°C (максимум 300 В) в течение 25 минут. Спустя это время растворитель удаляли при пониженном давлении, и полученное масло очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны:этилацетат 3:1 с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,60 (дд, J=11,9, 7,9 Гц, 2H), 7,69-7,51 (м, 3H), 7,42 (д, J=7,7 Гц, 1H), 7,32 (т, J=7,0 Гц, 1H), 7,05 (д, J=8,2 Гц, 1H), 4,37 (т, J=13,2 Гц, 1H), 3,93 (м, 1H), 3,77-3,51 (м, 3H), 3,23 (м, 1H), 3,35-2,66 (м, 30H), 3,02 (м, 1H), 2,08-1,92 (м, 2H), 1,91-1,75 (м, 1H), 1,42 (с, 12H).
Пример 215B
Транс-9-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
В круглодонную колбу, содержащую соединение, полученное в Примере 215A (0,55 мг, 0,150 ммоль) в дихлорметане (3 мл), добавляли 4н HCl в диоксане. Смесь перемешивали в течение 6 часов, затем растворитель упаривали и продукт кристаллизовали из этилацетата с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,61-7,55 (м, 2H), 7,49-7,38 (м, 3H), 7,35-7,25 (м, 2H), 7,13-7,06 (м, 1H), 4,48 (дт, J=12,4, 3,1 Гц, 1H), 3,90 (дд, J=11,0, 6,9 Гц, 1H), 3,87-3,70 (м, 2H), 3,68-3,55 (м, 1H), 3,55-3,45 (м, 1H), 3,17-3,08 (м, 1H), 2,23-2,10 (м, 2H), 2,09-1,87 (м, 1H); MS (DCI+) m/z 266,1 [M+H]+.
Пример 216
Транс-8-(бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
В сосуд, заполненный аргоном, помещали соединение, полученное в Примере 53 (0,125 г, 5 ммоль), 2-ди-трет-бутилфосфино-3,4,5,6-тетраметил-2',4',6'-триизопропил-1,1'-бифенил (0,019 г, 0,040 ммоль), карбонат цезия (0,060 мл, 0,750 ммоль), бензиловый спирт (1,035 мл, 10,00 ммоль) и толуол (0,1 мл) и в суспензию барботировали аргон. Добавляли ацетат палладия (II) (4,49 мг, 0,020 ммоль), сосуд закрывали, и смесь нагревали при перемешивании при температуре 90°C в течение 3 часов. Растворители упаривали, и сырое вещество растворяли в смеси диметилсульфоксид/метанол, фильтровали и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,98 (м, 1H), 8,07 (с, 1H), 7,47-7,37 (м, 4H), 7,36-7,27 (м, 4H), 7,19-7,08 (м, 2H), 5,22-5,11 (м, 2H), 3,94 (с, 1H), 3,80-3,42 (м, 2H), 3,26-2,79 (м, 8H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 217
Транс-8-(3-фторбензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 216, заменяя 3-фторбензиловый спирт на бензиловый спирт. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,09 (м, 1H), 8,09 (м, 1H), 7,48-7,41 (м, 1H), 7,38-7,27 (м, 3H), 7,20-7,01 (м, 4H), 5,18 (с, 2H), 3,95 (м, 1H), 3,80-3,70 (м, 1H), 3,39-2,82 (м, 9H).
MS (ESI+) m/z 341,2 [M+H]+
Пример 218
Транс-2-бензил-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя соединение, полученное в Примере 45, на соединение, полученное в Примере 53. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,04 (т, J=4,0 Гц, 1H), 8,01 (м, 1H), 7,68 (м, 3H), 7,36-7,21 (м, 8H), 3,81 (д, J=13,5 Гц, 1H), 3,72 (д, J=13,5, 1H), 3,28-3,15 (м, 3H), 3,09-3,04 (м, 2H), 2,74 (дд, J=9,0, 9,0 Гц, 1H), 2,62 (дд, J=9,0 Гц, 1H) и 2,21 (м, 1H); MS (ESI+) m/z 387 [M+H]+.
Пример 219
Транс-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 219A
Транс-трет-бутил 8-(4-фторфенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 94A, заменяя соединение, полученное в Примере 218, на соединение, полученное в Примере 93.
Пример 219B
Транс-8-(4-фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 219A, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,42 (уширенный с, 1H), 9,37 (уширенный с, 1H), 8,18 (дд, J=3,5, 6,5 Гц, 1H), 7,88 (д, J=2,0 Гц, 1H), 7,80 (дд, J=2,0, 8,0 Гц, 1H), 7,74 (м, 2H), 7,36 (д, J=8,0 Гц, 1Н), 7,31 (дд, J=8,5, 8,5 Гц, 2H), 3,64 (м, 1H), 3,56 (м, 1H), 3,45 (м, 1H), 3,26 (м, 1H), 3,19 (м, 1H), 3,11 (м, 1H), 2,97 (м, 1H) и 2,28 (м, 1H); MS (ESI+) m/z 297 [M+H]+.
Пример 220
(3aR,10bS)-8-(4-Фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 220A
(3aS,10bS)-трет-Бутил 8-(4-фторфенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 44, заменяя соединение, полученное в Примере 219A, на соединение, полученное в Примере 1 (время удерживания 6,5 минут).
Пример 220B
(3aR,10bS)-8-(4-Фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 220A, на соединение, полученное в Примере 46A. Данные ЯМР и MS являются идентичными данным по Примеру 219.
Пример 221
(3aS,10bR)-8-(4-Фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 221A
(3aR,10bR)-трет-Бутил 8-(4-фторфенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 44, заменяя соединение, полученное в Примере 219A, на соединение, полученное в Примере 1 (время удерживания 11,9 минут).
Пример 221B
(3aS,10bR)-8-(4-Фторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 221A, на соединение, полученное в Примере 46A. Данные ЯМР и MS являются идентичными данным по Примеру 219B.
Пример 222
Транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[b]пирроло[3,4-d]азепин-5(6H)-он
Пример 222A
(E)-Метил 4-(2-нитрофенил)бут-3-еноат
Смесь 2-(2-нитрофенил)ацетальдегида (760 мг, 4,6 ммоль) и метоксилкарбонилметилентрифенилфосфоран (1,5 г, 4,6 ммоль) в толуоле (10 мл) нагревали при температуре 110°C в течение 3 часов. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (2:1) с получением указанного в заголовке соединения с (E)-метил 4-(2-нитрофенил)бут-2-еноат.
Пример 222B
Метил 2-(транс-1-бензил-4-(2-нитрофенил)пирролидин-3-ил)ацетат
К соединению, полученному в Примере 222A (460 мг, 2,1 ммоль) в CH2Cl2 (5 мл), добавляли трифторуксусную кислоту (5 мкл), затем добавляли N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (700 мг, 3,0 ммоль) в CH2Cl2 (3 мл) по каплям. Смесь перемешивали при комнатной температуре в течение ночи и затем отдельными порциями добавляли еще N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (700 мг, 3,0 ммоль). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (5:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,83 (м, 1H), 7,74 (м, 1H), 7,68 (м, 1H), 7,43 (м, 1H), 7,34 (м, 4H), 7,23 (м, 1H), 3,65 (м, 2H), 3,42 (с, 2H), 3,06 (м, 1H), 2,92 (м, 1H), 2,58 (м, 3H) и 2,45 (м, 1H).
Пример 222C
Транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[b]пирроло[3,4-d]азепин-5(6H)-он
К соединению, полученному в Примере 222B (470 мг, 1,3 ммоль) в метаноле (10 мл), добавляли водную взвесь никеля Ренея® 2800 (470 мг, 8,0 ммоль) в сосуде для работы под давлением. Смесь перемешивали в течение 16 часов под давлением 30 фунтов на квадратный дюйм водорода при комнатной температуре. Смесь фильтровали через нейлоновую мембрану и концентрировали. Сырой продукт в метаноле (20 мл) обрабатывали 5 мл 25%-го метоксида натрия в метаноле, и смесь кипятили с обратным холодильником в течение 4 часов. Смесь концентрировали и распределяли между этилацетатом и водой. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (5:1) с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,67 (с, 1H), 7,33 (м, 4H), 7,25 (м, 1H), 7,12 (т, J=7,0 Гц, 1H), 7,07 (д, J=7,0 Гц, 1H), 7,01 (д, J=7,5 Гц, 1Гц), 6,95 (т, J=8,0 Гц, 1H), 3,74 (д, J=13,0 Гц, 1H), 3,62 (д, J=13,0 Гц, 1H), 3,19 (м, 1H), 3,13 (м, 1H), 2,85 (т, J=9,0 Гц, 1H), 2,79 (дд, J=5,5, 17,5 Гц, 1H), 2,70 (т, J=9,0 Гц, 1H), 2,64 (дд, J=11, 17,5 Гц, 1H), 2,47 (дд, J=6,5, 9,0 Гц, 1H) и 2,21 (м, 1H); MS (ESI+) m/z 293 [M+H]+.
Пример 223
Транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[d]пирроло[3,4-b]азепин-5(6H)-он
Пример 223A
(E)-трет-Бутил 3-(2-(2-этокси-2-оксоэтил)фенил)акрилат
К смеси этил 2-(2-бромфенил)ацетата (0,97 г, 4 ммоль), трет-бутил акрилата (0,51 г, 4 ммоль), трис(дибензилиленацетон)дипалладия(0) (91 мг, 0,1 ммоль), дициклогексилметиламина (0,98 г, 5 ммоль) в диоксане (5 мл) добавляли три-трет-бутилфосфин (0,2 мл, 1н в толуоле, 0,2 ммоль). Смесь нагревали при температуре 70°C в течение 30 минут в атмосфере N2. Добавляли этилацетат, и смесь фильтровали через диатомовую землю. Фильтрат концентрировали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (10:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,79 (м, 1H), 7,72 (д, J=15,6 Гц, 1H), 7,34 (м, 3H), 6,40 (д, J=15,7 Гц, 1H), 4,06 (кв, J=7,2 Гц, 2H), 3,84 (с, 2H), 1,48 (с, 9H) и 1,17 (т, J=2 Гц, 3H).
Пример 223B
Транс-трет-бутил 1-бензил-4-(2-(2-этокси-2-оксоэтил)фенил)пирролидин-3-карбоксилат
К соединению, полученному в Примере 223A (1,3 г, 4,4 ммоль) в CH2Cl2 (10 мл), добавляли трифторуксусную кислоту (10 мкл), затем добавляли N-бензил-1-метокси-N-((триметилсилил)метил)метанамин (1,0 г, 4,2 ммоль) в CH2Cl2 (5 мл) по каплям. Смесь перемешивали при комнатной температуре в течение 2 часов и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (5:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,49 (д, J=7,7 Гц, 1H), 7,31 (м, 4H), 7,25 (м, 2H), 7,14 (м, 2H), 4,03 (кв, J=7,2 Гц, 2H), 3,86 (д, J=16,2 Гц, 1H), 3,80 (д, J=16,5 Гц, 1H), 3,55 (д, J=12,9 Гц, 1H), 3,66 (д, J=12,9 Гц, 1H), 2,98 (м, 2H), 2,84 (т, J=8,6 Гц, 1H), 2,75 (м, 1H), 1,34 (с, 9H) и 1,17 (т, J=7,2 Гц, 3H).
Пример 223C
Этил 2-(2-(транс-1-бензил-4-(трет-бутоксикарбониламино)пирролидин-3-ил)фенил)ацетат
К соединению, полученному в Примере 223B (1,2 г, 2,83 ммоль) в диоксане (3 мл), добавляли HCl (3 мл, 4н в диоксане). Смесь перемешивали при комнатной температуре в течение 24 часов и концентрировали с получением промежуточной карбоновой кислоты (1 г, 96%). К этой карбоновой кислоте (1 г, 2,5 ммоль) в CH3CN (10 мл) добавляли триэтиламин (1 мл, 7,2 ммоль) и дифенилфосфорилазид (0,69 г, 2,5 ммоль) при температуре 0°C. Смесь перемешивали в течение 1 часа и концентрировали. К этому сырому веществу добавляли толуол (3 мл), и смесь нагревали при температуре 115°C в течение 30 минут, затем добавляли трет-бутанол (1 мл). Смесь перемешивали в течение 20 минут, затем добавляли этилацетат и 1н NaOH (водн.). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексаны и этилацетат (5:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,45 (м, 1H), 7,31 (м, 4H), 7,25 (м, 2H), 7,12 (м, 2H), 3,99 (кв, J=7,2 Гц, 2H), 3,94 (м, 1H), 3,61 (м, 2H), 3,27 (с, 2H), 2,98 (м, 1H), 2,82 (м, 1H), 2,44 (м, 2H), 1,32 (с, 9H), 1,12 (т, J=7,2 Гц, 3H), 1,07 (м, 1H).
Пример 223D
Транс-2-бензил-1,2,3,3a,4,10b-гексагидробензо[d]пирроло[3,4-b]азепин-5(6H)-он
К соединению, полученному в Примере 223C (240 мг, 0,55 ммоль) в диоксане (1 мл), добавляли HCl (1,5 мл, 4н в диоксане). Смесь перемешивали в течение 6 часов и концентрировали. Сырое вещество растворяли в метаноле (2 мл), затем добавляли 25% метоксид натрия в метаноле (3 мл). Смесь перемешивали в течение 1 часа и концентрировали. Добавляли этилацетат и смесь промывали водой. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,88 (д, J=4,5 Гц, 1H), 7,33 (м, 4H), 7,24 (м, 1H), 7,14 (м, 3H), 7,06 (д, J=7,0 Гц, 1H), 4,13 (д, J=15,5 Гц, 1Н), 4,04 (м, 1H), 3,83 (д, J=13,5 Гц, 1H), 3,68 (д, J=13,0 Гц, 1H), 3,57 (д, J=16,0 Гц, 1H), 3,43 (м, 1H), 3,33 (м, 1H), 2,88 (т, J=9,0 Гц, 1H), 2,84 (т, J=9,5 Гц, 1H), 2,81 (т, J=9,0 Гц, 1H); MS (ESI+) m/z 293 [M+H]+.
Пример 224
Транс-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 224A
Транс-трет-бутил 8-фтор-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
К соединению, полученному в Примере 57 (4,0 г, 12,9 ммоль) в CH2Cl2 (50 мл), добавляли ди-трет-бутилдикарбонат (3,3 г, 15 ммоль). Смесь перемешивали в течение ночи, концентрировали и растирали в гексане. Образовавшиеся осадки собирали с получением указанного в заголовке соединения.
Пример 224B
Транс-трет-бутил 8-фтор-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
К суспензии соединения, полученного в Примере 224A (3,8 г, 11,9 ммоль) и йодметана (2,1 г, 15 ммоль) в тетрагидрофуране (15 мл), порциями добавляли NaH (0,6 г, 60%, 15 ммоль) при температуре 0°C. Смесь перемешивали в течение 2 часов и затем добавляли воду. Образовавшиеся осадки собирали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,33 (м, 1H), 7,29 (м, 1H), 7,28 (м, 1H), 3,69 (м, 1H), 3,60 (м, 1H), 3,54 (м, 1H), 3,35 (м, 2H), 3,17 (м, 1H), 3,10 (с, 3H), 3,00 (м, 1H), 2,16 (м, 1H) и 1,43 (с, 9H).
Пример 224C
Гидрохлорид транс-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 224B, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,43 (широкий с, 1H), 9,28 (широкий с, 1H), 7,34 (м, 3H), 3,62 (м, 1Гц), 3,47 (м, 4H), 3,10 (с, 3H), 3,09 (м, 1H) и 2,21 (м, 1H); MS (ESI+) m/z 235 [M+H]+.
Пример 225
(3aR,10bS)-8-Фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 225A
(3aS,10bS)-трет-Бутил 8-фтор-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали, используя методику хиральной хроматографии, описанную в Примере 44, заменяя соединение, полученное в Примере 224B, на соединение, полученное в Примере 1 (время удерживания 6,0 минут).
Пример 225B
Гидрохлорид (3aR,10bS)-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 225A, на соединение, полученное в Примере 46A. Данные ЯМР и MS являются идентичными данным по Примеру 224.
Пример 226
(3aS,10bR)-8-Фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 226A
(3aR,10bR)-трет-Бутил 8-фтор-5-метил-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали, используя методику хиральной хроматографии, описанную в Примере 44, заменяя соединение, полученное в Примере 224B, на соединение, полученное в Примере 1 (время удерживания 6,5 минут).
Пример 226B
Гидрохлорид (3aS,10bR)-8-фтор-5-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 226A, на соединение, полученное в Примере 46A. Данные ЯМР и MS являются идентичными данным по Примеру 224.
Пример 227
Транс-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 227A
Метил 5-ацетокси-2-бромбензоат
К метил 2-бром-5-гидроксибензоату (20 г, 87 ммоль) в пиридине (100 мл) добавляли уксусный ангидрид (10,2 г, 100 ммоль) при температуре 0°C. Смесь перемешивали при температуре окружающей среды в течение 16 часов, концентрировали и добавляли этилацетат. Смесь промывали насыщенным раствором NH4Cl(водн.) с получением сырого указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,79 (д, J=8,7 Гц, 1H), 7,58 (д, J=2,8 Гц, 1H), 7,30 (дд, J=8,7, 2,8 Гц, 1H), 3,86 (с, 3H) и 2,28 (с, 3H).
Пример 227B
(E)-Метил 5-ацетокси-2-(2-циановинил)бензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 223A, заменяя соединение, полученное в Примере 227A на этил 2-(2-бромфенил)ацетат и акрилонитрил на трет-бутилакрилат.
Пример 227C
Метил 5-ацетокси-2-(транс-1-бензил-4-цианопирролидин-3-ил)бензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 223B, заменяя соединение, полученное в Примере 227B, на соединение, полученное в Примере 223A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,71 (д, J=8,6 Гц, 1H), 7,49 (д, J=2,6 Гц, 1H), 7,39 (м, 2H), 7,34 (м, 4H), 7,27 (м, 1H), 4,29 (кв, J=6,3 Гц, 1H), 3,85 (с, 2H), 3,40 (м, 1H), 3,15 (м, 1H), 3,02 (м, 1H), 2,82 (дд, J=9,3, 6,2 Гц, 1H), 2,60 (дд, J=9,5, 6,0 Гц, 1H), 2,28 (с, 3H).
Пример 227D
Транс-2-бензил-8-гидрокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 1C, заменяя соединение, полученное в Примере 227C, на соединение, полученное в Примере 1B.
Пример 227E
Транс-8-гидрокси-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 2, заменяя соединение, полученное в Примере 227D, на соединение, полученное в Примере 1. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,44 (м, 1H), 7,89 (дд, J=4,9, 4,4 Гц, 1H), 7,10 (д, J=2,7 Гц, 1H), 6,96 (дд, J=7,7, 2,9 Гц, 1H), 6,81 (дд, J=8,2, 2,6 Гц, 1H), 3,14 (м, 2H), 3,04 (м, 1H), 2,96 (м, 2H), 2,85 (дт, J=10,3, 4,0 Гц, 1H), 2,66 (м, 1H) и 1,95 (м, 1H).
Пример 227F
Транс-трет-бутил 8-гидрокси-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Во взвесь соединения, полученного в Примере 227E (1,1 г, 5,0 ммоль) в N,N-диметилформамиде (20 мл), добавляли ди-трет-бутил дикарбонат (1,1 г, 5,0 ммоль) в N,N-диметилформамиде (1 мл). Смесь перемешивали в течение 1 часа и добавляли воду. Образовавшиеся осадки собирали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,54 (с, 1H), 7,92 (м, 1H), 7,03 (д, J=4,8 Гц, 1H), 7,01 (д, J=5,7 Гц, 1H), 6,83 (дт, J=8,4, 2,1 Гц, 1H), 3,65 (дд, J=6,9, 9,6 Гц, 1H), 3,55 (т, J=11,4 Гц, 1H), 3,48 (дд, J=7,5, 9,6 Гц, 1H), 3,04 (м, 4H), 2,10 (м, 1H) и 1,42 (с, 9H).
Пример 227G
Транс-трет-бутил 6-оксо-8-(трифторметилсульфонилокси)-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Во взвесь соединения, полученного в Примере 227F (0,77 г, 2,4 ммоль) в CH2Cl2 (10 мл), добавляли триэтиламин (0,3 г, 3,0 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (0,9 г, 2,5 ммоль). Смесь перемешивали в течение ночи, концентрировали и обрабатывали водой. Образовавшиеся осадки собирали с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,28 (м, 1H), 7,65 (м, 1H), 7,60 (м, 1H), 7,45 (дд, J=8,4, 3,7 Гц, 1H), 3,75 (дд, J=9,6, 6,9 Гц, 1H), 3,63 (дд, J=21,3, 10,4 Гц, 1H), 3,52 (дд, J=10,0, 7,4 Гц, 1H), 3,19 (д, J=13,6 Гц, 1H), 3,04 (м, 3H), 2,27 (м, 1H) и 1,43 (с, 9H).
Пример 227H
Транс-трет-бутил 8-(3-(метилсульфонил)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Во взвесь соединения, полученного в Примере 227G (90 мг, 0,2 ммоль) и мета-метилсульфонилфенилбороновой кислоты (40 мг, 0,2 ммоль) в диметоксиэтане (0,3 мл) добавляли тетракис(трифенилфосфин)палладий(0) (23 мг, 0,02 ммоль) и 3н Na2CO3 (водн.) (0,2 мл). Смесь нагревали при температуре 100°C в течение 1 часа и разбавляли водой, после чего охлаждали до комнатной температуры. Образовавшиеся осадки собирали с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,18 (с, 1H), 8,15 (м, 1H), 8,06 (д, J=7,7 Гц, 1H), 7,98 (с, 1H), 7,93 (д, J=7,9 Гц, 1H), 7,87 (т, J=6,3 Гц, 1H), 7,76 (т, J=7,8 Гц, 1H), 7,31 (м, 1H), 3,76 (м, 1H), 3,67 (м, 1H), 3,53 (м, 1H), 3,24 (м, 1H), 3,07 (м, 3H), 2,25 (м, 1H), 1,45 (с, 4H) и 1,44 (с, 5H).
Пример 227I
Гидрохлорид транс-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 227H, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,39 (широкий с, 1H), 9,35 (широкий с, 1H), 8,24 (м, 1H), 8,19 (м, 1H), 8,07 (д, J=8,0 Гц, 1H), 8,01 (д, J=2,0 Гц, 1H), 7,94 (дт, J=2,0, 8,4 Гц, 2Н), 7,77 (т, J=8,0 Гц, 1H), 7,43 (д, J=8,0 Гц, 1H), 3,68 (м, 1H), 3,59 (м, 1H), 3,46 (м, 1H), 3,12 (с, 3H), 3,24 (м, 1H), 3,19 (м, 1H), 3,11 (м, 1H), 2,99 (м, 1H) и 2,32 (м, 1H); MS (ESI+) m/z 357 [M+H]+.
Пример 228
(3aS,10bS)-2-Метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 228A
Транс-2-метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 227, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,19 (д, J=2,1 Гц, 1H), 8,13 (м, 1H), 8,11 (т, J=2,0 Гц, 1H), 8,04 (ушир.д, J=8,4 Гц, 1H), 7,93 (ушир.д, J=8,4 Гц, 1H), 7,84 (дд, J=2,0, 7,6 Гц, 1H), 7,76 (т, J=8,0 Гц, 1H), 7,32 (д, J=8,4 Гц, 1H), 3,30 (с, 3H), 3,28 (м, 2H), 3,15 (м, 1H), 3,10 (м, 1H), 2,93 (дд, J=10,4, 10,8 Гц, 1H), 2,65 (м, 1H), 2,63 (м, 1H), 2,39 (с, 3H) и 2,22 (м, 1H); MS (ESI+) m/z 371 [M+H]+.
Пример 228B
(3aS,10bS)-2-Метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали методом хиральной хроматографии, описанной в Примере 44, заменяя соединение, полученное в Примере 228A, на соединение, полученное в Примере 1. Данные ЯМР и MS являются такими же, что и данные для Примера 228A (время удерживания 13,3 минут).
Пример 229
(3aR,10bR)-2-Метил-8-(3-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали методом хиральной хроматографии, описанной в Примере 44, заменяя соединение, полученное в Примере 228A, на соединение, полученное в Примере 1. Данные ЯМР и MS являются такими же, что и данные для Примера 228A (время удерживания 18,3 минут).
Пример 230
N,N-Диметил-3-(Транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензамид
Пример 230A
Транс-трет-бутил 8-(3-(диметилкарбамоил)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(диметилкарбамоил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 230B
Гидрохлорид N,N-диметил-3-(транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензамида
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 230A, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,37 (с, 1H), 9,31 (с, 1H), 8,19 (дд, J=6,6, 3,8 Гц, 1H), 7,92 (д, J=2,0 Гц, 1H), 7,85 (дд, J=8,0, 2,0 Гц, 1H), 7,77 (д, J=8,2 Гц, 1H), 7,68 (с, 1H), 7,55 (т, J=7,7 Гц, 1H), 7,41 (д, J=8,0 Гц, 1H), 7,38 (д, J=8,0 Гц, 1H), 3,66 (м, 1H), 3,57 (м, 1H), 3,46 (м, 1H), 3,26 (м, 2H), 3,20 (м, 1H), 3,13 (м, 1H), 3,01 (с, 3H), 2,94 (с, 3H) и 2,30 (м, 1H); MS (ESI+) m/z 350 [M+H]+.
Пример 231
Транс-8-(2-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 231A
Транс-трет-бутил 8-(2-(метилсульфонил)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 2-(метилсульфонил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 231B
Транс-8-(2-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 231A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,40 (широкий с, 1H), 9,34 (широкий с, 1H), 8,18 (дд, J=6,2, 3,6 Гц, 1H), 8,11 (д, J=7,9 Гц, 1H), 7,78 (т, J=7,5 Гц, 1H), 7,70 (т, J=7,7 Гц, 1H), 7,65 (д, J=1,8 Гц, 1H), 7,56 (дд, J=7,9, 1,8 Гц, 1H), 7,41 (д, J=7,3 Гц, 1H), 7,36 (д, J=7,9 Гц, 1H), 3,69 (м, 1H), 3,60 (м, 1H), 3,48 (м, 1H), 3,28 (м, 1H), 3,21 (м, 1H), 3,11 (м, 1H), 2,99 (м, 1H), 2,89 (с, 3H) и 2,33 (м, 1H); MS (ESI+) m/z 357 [M+H]+.
Пример 232
Транс-2-метил-8-(2-(метилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 231, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,10 (дд, J=7,9, 1,2 Гц, 1H), 8,04 (с, 1H), 7,86 (д, J=2,0 Гц, 1H), 7,77 (тд, J=7,5, 1,3 Гц, 1H), 7,69 (тд, J=7,7, 1,3 Гц, 1H), 7,48 (дд, J=7,8, 2,0 Гц, 1H), 7,40 (дд, J=7,5, 1,2 Гц, 1H), 7,24 (д, J=7,9 Гц, 1H), 3,28 (м, 1H), 3,20 (м, 1H), 3,16 (м, 1H), 3,14 (м, 1H), 2,95 (т, J=9,6 Гц, 1H), 2,86 (с, 3H), 2,68 (p, J=9,1 Гц, 2H), 2,41 (с, 3H) и 2,30 (м, 1H); MS (ESI+) m/z 371 [M+H]+.
Пример 233
(3aR,10bS)-9-Хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 233A
трет-Бутил (3aR,10bS)-9-хлор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом хлорирования, описанным в Примере 95, заменяя соединение, полученное в Примере 270A, на соединение, полученное в Примере 94A.
Пример 233B
(3aR,10bS)-9-Хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 233A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,40 (с, 2H), 7,27 (дд, J=8,5, 2,6 Гц, 1H), 7,16 (м, 1H), 7,04 (д, J=8,5 Гц, 1H), 4,40 (дт, J=12,3, 3,5 Гц, 1H), 3,71 (м, 1H), 3,54 (м, 2H), 3,47 (м, 1H), 3,30 (м, 1H), 2,94 (м, 1H), 2,06 (м, 2H) и 1,82 (м, 1H); MS (ESI+) m/z 224, 226 (3:1) [M+H]+.
Пример 234
(3aR,10bS)-9-Хлор-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 233, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,18 (дд, J=8,4, 2,1 Гц, 1H), 7,06 (д, J=1,8 Гц, 1H), 6,97 (д, J=8,5 Гц, 1H), 4,37 (дт, J=12,1, 3,4 Гц, 1H), 3,53 (м, 1H), 3,20 (м, 1H), 3,04 (дд, J=8,7, 6,5 Гц, 1H), 2,77 (м, 1H), 2,67 (т, J=8,9 Гц, 1H), 2,60 (дд, J=9,1, 6,9 Гц, 1H), 2,33 (с, 3H) и 1,88 (м, 3H); MS (ESI+) m/z 238, 240 (3:1) [M+H]+.
Пример 235
(3aR,10bS)-2-Метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 270, на соединение, полученное в Примере 46. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 11,31 (с, 1H), 7,22 (м, 1H), 7,11 (м, 1H), 7,03 (т, J=7,8 Гц, 2H), 4,40 (дт, J=12,3, 3,4 Гц, 1H), 4,04-3,85 (м, 1H), 3,83-3,65 (м, 1H), 3,62-3,43 (м, 4H), 2,90 (м, 3H), 2,31-2,03 (м, 2H) и 1,87 (м, 1H); MS (ESI+) m/z 204 [M+H]+.
Пример 236
Транс-8-(3-ацетилфенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он гидрохлорид
Пример 236 A
Транс-трет-бутил 8-(3-ацетилфенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-ацетил фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 236B
Гидрохлорид транс-8-(3-ацетилфенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 236A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,29 (с, 2H), 8,21 (м, 2H), 7,98 (м, 3H), 7,89 (м, 1H), 7,65 (т, J=7,7 Гц, 1H), 7,41 (д, J=8,0 Гц, 1H), 3,67 (м, 1H), 3,58 (м, 1H), 3,47 (м, 1), 3,29 (м, 1H), 3,20 (м, 1H), 3,14 (м, 1H), 2,98 (т, J=11,2 Гц, 1H), 2,67 (с, 3H) и 2,30 (м, 1H). MS (ESI+) m/z 321 [M+H]+.
Пример 237
Транс-8-(3-ацетилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 236, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,17 (м, 1H), 8,16 (м, 1H), 8,08 (м, 1H), 7,97 (д, J=7,8 Гц, 1H), 7,94 (д, J=8,3 Гц, 1H), 7,81 (дд, J=8,0, 2,1 Гц, 1H), 7,64 (т, J=7,7 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 3,28 (м, 3H), 3,13 (м, 2H), 2,92 (т, J=8,8 Гц, 1H), 2,67 (с, 3H), 2,64 (м, 1H), 2,39 (с, 3H) и 2,23 (м, 1H). MS (ESI+) m/z 335 [M+H]+.
Пример 238
Транс-8-(3-(1-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
К соединению, полученному в Примере 237 (31 мг, 0,093 ммоль) в метаноле (0,5 мл) добавляли NaBH4 (3,5 мг, 0,093 ммоль). Смесь перемешивали в течение 10 минут и затем гасили 1н HCl (водн.). Добавляли 1н NaOH (водн.) для установления значения pH равным 10. Смесь экстрагировали этилацетатом, и сырой продукт обрабатывали в гексане и этилацетате (1:1). Образовавшиеся осадки собирали с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,10 (д, J=2,1 Гц, 1H), 8,05 (м, 1H), 7,72 (дд, J=8,0, 2,1 Гц, 1H), 7,63 (с, 1H), 7,50 (д, J=7,8 Гц, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,33 (д, J=7,6 Гц, 1H), 7,26 (д, J=8,0 Гц, 1H), 5,23 (д, J=4,3 Гц, 1H), 4,79 (м, 1H), 3,27 (м, 2H), 3,16 (м, 1H), 3,10 (м, 1H), 2,94 (т, J=9,2 Гц, 1H), 2,65 (м, 2H), 2,39 (с, 3H), 2,24 (с, 1H) и 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 336 [M+H]+.
Пример 239
3-(Транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензонитрил
Пример 239A
Транс-трет-бутил 8-(3-цианофенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-цианофенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 239B
3-(Транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензонитрил гидрохлорид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 239A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,21 (с, 2H), 8,20 (м, 2H), 8,06 (м, 1H), 7,98 (д, J=2,4 Гц, 1H), 7,91 (дт, J=5,4, 2,7 Гц, 1H), 7,86 (дт, J=1,2, 7,6 Гц, 1H), 7,69 (т, J=8,0 Гц, 1H), 7,40 (д, J=8,0, 1H), 3,66 (дд, J=6,8, 8,4 Гц, 1H), 3,57 (т, J=8,4 Гц, 1H), 3,45 (дд, J=7,6, 10,8 Гц, 1H), 3,24 (м, 1H), 3,19 (м, 1H), 3,10 (м, 1H), 2,97 (т, J=11,2 Гц, 1H) и 2,29 (м, 1H); MS (ESI+) m/z 304 [M+H]+.
Пример 240
3-(Транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[c]пирроло[3,4-e]азепин-8-ил)бензонитрил
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в примере 239, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,15 (д, J=2,0 Гц, 2H), 8,08 (т, J=3,7 Гц, 1H), 8,05-7,99 (м, 1H), 7,83 (м, 2H), 7,68 (т, J=7,8 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 3,30 (м, 1H), 3,26 (м, 1H), 3,14 (м, 1H), 3,09 (м, 1H), 2,93 (дд, J=10,3, 8,9 Гц, 1H), 2,66 (м, 1H), 2,63 (м, 1H), 2,38 (с, 3H) и 2,21 (м, 1H); MS (ESI+) m/z 318 [M+H]+.
Пример 241
Транс-8-(3,6-дигидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 241A
Транс-трет-бутил 8-(3,6-дигидро-2H-пиран-4-ил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3,6-дигидро-2H-пиран-4-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 241B
Гидрохлорид транс-8-(3,6-дигидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 241A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,27 (м, 2H), 8,10 (м, 1H), 7,69 (м, 1H), 7,58 (дд, J=2,0, 8,0 Гц, 1H), 7,26 (д, J=8,0 Гц, 1H), 6,33 (с, 1H), 4,21 (м, 2H), 3,81 (т, J=5,6 Гц, 2H), 3,60 (дд, J=6,4, 10,4 Гц, 1H), 3,51 (т, J=10,8 Гц, 1H), 3,41 (дд, J=7,2, 10,4 Гц, 1H), 3,16 (м, 2H), 3,05 (м, 1H), 2,92 (д, J=11,5 Гц, 1H), 2,43 (м, 2H) и 2,22 (м, 1H); MS (ESI+) m/z 285 [M+H]+.
Пример 242
Транс-8-(3,6-дигидро-2H-пиран-4-ил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 241, на соединение, полученное в Примере 46. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,98 (м, 1H), 7,87 (т, J=4,9 Гц, 1H), 7,52 (дд, J=2,0, 8,0 Гц, 1H), 7,14 (д, J=8,0 Гц, 1H), 6,25 (м, 1H), 4,21 (кв, J=2,5 Гц, 2H), 3,82 (т, J=5,5 Гц, 2H), 3,22 (м, 2H), 3,09 (м, 2H), 2,89 (дд, J=1,0, 9,0 Гц, 1H), 2,64 (м, 1H), 2,61 (м, 1H), 2,44 (м, 2H), 2,37 (с, 3H) и 2,16 (м, 1H); MS (ESI+) m/z 299 [M+H]+.
Пример 243
Транс-8-(4-фторфенокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Смесь Примера 53 (125 мг, 0,5 ммоль), 4-фторфенола (168 мг, 1,5 ммоль), ди-трет-бутил(2',4',6'-триизопропил-3,4,5,6-тетраметилбифенил-2-ил)фосфина (24 мг, 0,05 ммоль), карбоната цезия (228 мг, 0,7 ммоль) и диацетоксипалладия (5,6 мг, 0,025 ммоль) в толуоле (0,5 мл) заполняли N2 и нагревали при температуре 110°C в течение 3 часов. Добавляли этилацетат и смесь промывали водой. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,02 (т, J=3,5 Гц, 1H), 7,39 (д, J=2,8 Гц, 1H), 7,24 (м, 2H), 7,16 (д, J=8,4 Гц, 1H), 7,08 (м, 3H), 3,26 (м, 1H), 3,19 (тд, J=10,4, 6,4 Гц, 1H), 3,09 (м, 2H), 2,83 (дд, J=10,3, 8,8 Гц, 1H), 2,61 (м, 2H), 2,36 (с, 3H) и 2,18 (м, 1H); MS (ESI+) m/z 327 [M+H]+.
Пример 244
Транс-8-изобутил-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 196B, заменяя соединение, полученное в Примере 197, на соединение, полученное в Примере 196A. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,42-10,15 (м, 1H), 8,10-7,98 (м, 1H), 7,54-7,41 (м, 1H), 7,35-7,27 (м, 1H), 7,18-7,06 (м, 1H), 4,04-3,92 (с, 1H), 3,60 (д, J=1,1 Гц, 1H), 3,60-3,22 (м, 2H), 3,20-3,09 (м, 4H), 3,08-2,85 (м, 3H), 2,65-2,21 (м, 2H), 1,89-1,76 (м, 1H), 0,92-0,81 (м, 6H); MS (ESI+) m/z 273,3 [M+H]+.
Пример 245
Транс-8-(3,5-диметилизоксазол-4-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 245A
Транс-трет-бутил 8-(3,5-диметилизоксазол-4-ил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоксазол на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 245B
Транс-8-(3,5-диметилизоксазол-4-ил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
К 55 мг (0,138 ммоль) соединения, полученного в Примере 245A, добавляли 1 мл дихлорметана и 0,3 мл трифторуксусной кислоты. Смесь перемешивали при комнатной температуре в течение ночи. Затем смесь концентрировали, и остаток очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО) δ м.д. 9,06 (д, J=56,1 Гц, 2H), 8,18 (дд, J=6,4, 4,0 Гц, 1H), 7,61 (д, J=1,9 Гц, 1H), 7,54 (дд, J=7,9, 1,9 Гц, 1H), 7,37 (д, J=7,9 Гц, 1H), 3,74-3,64 (м, 1H), 3,64-3,53 (м, 1H), 3,53-3,43 (м, 1H), 3,19 (кв.дд, J=10,8, 9,5, 5,3 Гц, 2H), 2,99 (дт, J=17,5, 9,7 Гц, 1H), 2,41 (с, 3H), 2,32 (ддд, J=19,9, 12,5, 7,4 Гц, 1H), 2,23 (с, 3H); MS (ESI+) m/z 298,1 [M+H]+.
Пример 246
Транс-8-(4,4-диметилциклогексилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 246A
Транс-трет-бутил 8-(4,4-диметилциклогексилокси)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя 4,4-диметилциклогексанол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 227F, на соединение, полученное в Примере 117B.
Пример 246B
Транс-8-(4,4-диметилциклогексилокси)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 246A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО) δ м.д. 9,23 (с, 2H), 8,08 (дд, J=6,4, 3,9 Гц, 1H), 7,18-7,11 (м, 2H), 7,09-7,02 (м, 1H), 4,42-4,28 (м, 1H), 3,67-3,53 (м, 1H), 3,44 (дд, J=31,4, 11,7 Гц, 3H), 3,21-3,01 (м, 2H), 2,93 (д, J=6,0 Гц, 1H), 2,20 (дд, J=16,3, 9,8 Гц, 1H), 1,78 (с, 2H), 1,65-1,51 (м, 2H), 1,44 (д, J=12,0 Гц, 2H), 1,28 (т, J=11,4 Гц, 2H), 0,93 (д, J=4,3 Гц, 6H); MS (ESI+) m/z 329,2 [M+H]+.
Пример 247
Транс-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 247A
Транс-трет-бутил 6-оксо-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-инден-1-он на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 247B
Гидрохлорид транс-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 247A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,38 (с, 2H), 8,20 (дд, J=6,4, 3,8 Гц, 1H), 8,02 (дд, J=8,0, 1,8 Гц, 1H), 7,94 (д, J=2,0 Гц, 1H), 7,91-7,84 (м, 2H), 7,71 (д, J=8,1 Гц, 1H), 7,39 (д, J=8,0 Гц, 1H), 3,67 (м, 1H), 3,58 (м, 1H), 3,46 (м, 1H), 3,28 (м, 1H), 3,16 (м, 4H), 3,08 (м, 1H), 2,99 (т, J=11,5 Гц, 1H), 2,71 (м, 2H) и 2,30 (м, 1H); MS (ESI+) m/z 333 [M+H]+.
Пример 248
(3aS,10bS)-8-(3-((S)-1-Гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 248A
(3aS,10bS)-2-Метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидробензо[e]пирроло[3,4-c]азепин-8-ил трифторметансульфонат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 195A, заменяя (3aS,10bS)-8-гидрокси-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он (Пример 200), на соединение, полученное в Примере 164B.
Пример 248B
(S)-1-(3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)этанол
В 100-миллилитровую круглодонную колбу помещали [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (146 мг, 0,199 ммоль), ацетат калия (1464 мг, 14,92 ммоль), (S)-1-(3-бромфенил)этанол (1000 мг, 4,97 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (1642 мг, 6,47 ммоль) и 10 мл диоксана. Реакционную смесь нагревали с обратным холодильником в атмосфере азота в течение 20 часов. Затем реакционную смесь охлаждали до комнатной температуры. Реакционную смесь распределяли между этилацетатом и водой. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали. Остаток очищали путем флэш-хроматографии, элюируя с помощью смеси 20-40% этилацетат/гексан с получением указанного в заголовке соединения.
Пример 248C
(3aS,10bS)-8-(3-((S)-1-Гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя соединение, полученное в Примере 248B на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G 1H ЯМР (400 МГц, ДМСО) δ м.д. 8,14 (т, J=4,5 Гц, 1H), 7,98 (д, J=1,7 Гц, 1H), 7,79 (дд, J=7,9, 1,8 Гц, 1H), 7,65 (с, 1H), 7,53 (д, J=7,7 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,35 (д, J=7,6 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 5,24 (д, J=4,1 Гц, 1H), 4,88-4,74 (м, 1H), 3,50 (д, J=52,2 Гц, 3H), 3,18 (с, 3H), 3,03 (с, 1H), 2,78 (с, 3H), 2,42 (с, 1H), 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 249
(3aS,10bS)-8-(3-((R)-1-Гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 249A
(R)-1-(3-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)фенил)этанол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 248B, заменяя (R)-1-(3-бромфенил)этанол на (S)-1-(3-бромфенил)этанол
Пример 249B
(3aS,10bS)-8-(3-((R)-1-Гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя соединение, полученное в Примере 249A на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G 1H ЯМР (400 МГц, ДМСО) δ м.д. 8,08 (дд, J=8,1, 4,5 Гц, 1H), 8,05 (д, J=2,0 Гц, 1H), 7,75 (дд, J=8,0, 2,1 Гц, 1H), 7,64 (с, 1H), 7,51 (дд, J=6,3, 1,4 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,34 (д, J=7,6 Гц, 1H), 7,27 (д, J=8,0 Гц, 1H), 5,26 (т, J=14,0 Гц, 1H), 4,80 (д, J=4,2 Гц, 1H), 3,27-3,07 (м, 5H), 2,91 (т, J=8,9 Гц, 1H), 2,80 (т, J=9,3 Гц, 1H), 2,56 (с, 3H), 2,37-2,22 (м, 1H), 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 250
Транс-8-(3-(этилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 250A
Транс-трет-бутил 8-(3-(этилтио)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(этилтио)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 250B
Транс-трет-бутил 8-(3-(этилсульфонил)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
К сырому 250A (220 мг, 0,5 ммоль) в 5 мл CH2Cl2 добавляли м-хлорпероксибензойную кислоту (77%, 270 мг, 1,2 ммоль), и наблюдалось выделение тепла. Смесь перемешивали в течение 30 минут и разбавляли CH2Cl2 и промывали 1н NaOHводн. Сырой продукт обрабатывали в гексанах и этилацетате (1:1) и образовавшиеся осадки собирали с получением указанного в заголовке соединения.
Пример 250C
Гидрохлорид транс-8-(3-(этилсульфонил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 250B, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО) δ м.д. 9,23 (с, 1H), 9,19 (w, 1H), 8,23 (м, 1H), 8,13 (д, J=1,7 Гц, 1H), 8,10 (д, J=7,9 Гц, 1H), 8,00 (д, J=2,0 Гц, 1H), 7,92 (м, 2H), 7,78 (т, J=7,8 Гц, 1H), 7,43 (д, J=8,0 Гц, 1H), 3,68 (м, 1H), 3,59 (м, 1H), 3,47 (м, 1H), 3,41 (кв, J=7,3 Гц, 2H), 3,19 (м, 1H), 3,14 (м, 2H), 2,98 (м, 1H), 2,31 (м, 1H), 1,14 (т, J=7,3 Гц, 3H); MS (ESI+) m/z 371 [M+H]+.
Пример 251
Транс-2-метил-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 247, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,12 (д, J=2,1 Гц, 1H), 8,08 (м, 1H), 7,99 (дд, J=8,0, 1,9 Гц, 1H), 7,84 (д, J=1,5 Гц, 1H), 7,81 (дд, J=7,9, 2,2 Гц, 1H), 7,70 (д, J=8,2 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 3,25 (м, 4H), 3,14 (м, 3H), 3,04 (м, 1H), 2,77 (м, 1H), 2,70 (м, 2H), 2,47 (с, 3H) и 2,27 (м, 1H); MS (ESI+) m/z 347 [M+H]+.
Пример 252
Транс-8-(3-(2-гидроксиэтил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 252A
Транс-трет-бутил 8-(3-(2-гидроксиэтил)фенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(2-гидроксиэтил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 252B
Гидрохлорид транс-8-(3-(2-гидроксиэтил)фенил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 252A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,36 (с, 1H), 9,29 (м, 1H), 8,17 (м, 1H), 7,89 (д, J=2,0 Гц, 1H), 7,79 (дд, J=8,0, 2,0 Гц, 1H), 7,51 (м, 2H), 7,38 (м, 2H), 7,25 (д, J=7,6 Гц, 1H), 3,66 (т, J=6,9 Гц, 2H), 3,45 (м, 1H), 3,22 (м, 2H), 3,13 (м, 1H), 2,97 (м, 1H), 2,80 (т, J=6,9 Гц, 2H) и 2,29 (м, 1H); MS (ESI+) m/z 323 [M+H]+.
Пример 253
Транс-8-(3-(2-гидроксиэтил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 252, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,09 (д, J=2,1 Гц, 1H), 8,04 (т, J=3,3 Гц, 1H), 7,71 (дд, J=7,9, 2,1 Гц, 1H), 7,49 (м, 1H), 7,47 (т, J=7,6 Гц, 1H), 7,24 (т, J=8,8 Гц, 1H), 7,27-7,21 (м, 2H), 4,65 (т, J=4,8 Гц, 1H), 3,64 (кв, J=6,8 Гц, 2H), 3,26 (м, 2H), 3,12 (м, 2H), 2,92 (дд, J=8,4, 10,4 Гц, 1H), 2,80 (т, J=7,2 Гц, 2H), 2,62 (м, 2H), 2,37 (с, 3H) и 2,20 (м, 1H). MS (ESI+) m/z 337 [M+H]+.
Пример 254
Транс-2-бензил-1,2,3,3a,4,5,6,10b-октагидробензо[b]пирроло[3,4-d]азепин
К соединению, полученному в Примере 222 в тетрагидрофуране (0,5 мл) добавляли литийалюминийгидрид (0,2 мл, 1 M в толуоле, 0,2 ммоль) при температуре -78°C. Смесь перемешивали при комнатной температуре в течение 2 часов и последовательно гасили этилацетатом, метанолом и насыщенным раствором NaHCO3 (водн.). Добавляли этилацетат, и смесь фильтровали через диатомовую землю. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью метанола и этилацетата (1:10) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,33 (м, 4H), 7,24 (м, 1H), 6,94 (т, J=7,5 Гц, 1H), 6,89 (д, J=7,6 Гц, 1H), 6,81 (дд, J=7,8, 1,2 Гц, 1H), 6,71 (дт, J=1,2, 7,6 Гц, 1H), 5,19 (д, J=5,3 Гц, 1H), 3,77 (д, J=13,1 Гц, 1H), 3,60 (д, J=13,1 Гц, 1H), 3,27 (м, 1H), 3,14 (м, 1H), 3,01 (м, 1H), 2,84 (дд, J=10,2, 8,6 Гц, 1H), 2,71 (т, J=9,4 Гц, 1H), 2,58 (м, 2H), 1,81 (м, 2H) и 1,50 (м, 1H). MS (ESI+) m/z 279 [M+H]+.
Пример 255
Транс-8-(3-(этилсульфонил)фенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 250, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО) δ м.д. 8,18 (д, J=1,9 Гц, 1H), 8,10 (с, 2H), 8,06 (д, J=7,8 Гц, 1H), 7,89 (д, J=7,7 Гц, 1H), 7,84 (дд, J=7,9, 1,9 Гц, 1H), 7,77 (т, J=7,8 Гц, 1H), 7,31 (д, J=8,0 Гц, 1H), 3,40 (кв, J=7,3 Гц, 2H), 3,27 (м, 1H), 3,14 (м, 2H), 3,09 (м, 1H), 2,93 (м, 1H), 2,65 (м, 2H), 2,38 (с, 3H), 2,25 (м, 1H) и 1,13 (т, J=7,3 Гц, 3H); MS (ESI+) m/z 385 [M+H]+.
Пример 256
Транс-2-бензил-1,2,3,3a,4,5-гексагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он
Пример 256A
Метил 3-(трифторметилсульфонилокси)-2-нафтоат
К метил 3-гидрокси-2-нафтоату (0,40 г, 2 ммоль) в CH2C2 (3 мл) добавляли триэтиламин (0,25 г, 2,5 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (0,74 г, 2,1 ммоль). Смесь перемешивали в течение ночи и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексана и этилацетата (10:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,80 (с, 1H), 8,26 (д, J=7,9 Гц, 1H), 8,21 (с, 1H), 8,18 (д, J=8,1 Гц, 1H), 7,72 (дт, J=1,5, 6,9 Гц, 1H), 7,75 (дт, J=1,2, 6,9 Гц, 1H) и 3,94 (с, 3H).
Пример 256B
(E)-Метил 3-(2-циановинил)-2-нафтоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 97B, заменяя метил 3-(трифторметилсульфонилокси)-2-нафтоат, на соединение, полученное в Примере 97A (3:1 транс:цис). Транс-изомер: 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,61 (с, 1H), 8,36 (с, 1H), 8,26 (д, J=16,5 Гц, 1H), 8,15 (м, 1H), 8,03 (м, 1H), 7,72 (м, 2H), 6,42 (т, J=9,6 Гц, 1H) и 3,93 (с, 3H).
Пример 256C
Метил 3-(транс-1-бензил-4-цианопирролидин-3-ил)-2-нафтоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 223B, заменяя соединение, полученное в Примере 256B, на соединение, полученное в Примере 223A. Транс-изомер: 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 8,44 (с, 1H), 8,18 (с, 1H), 8,06 (д, J=7,7 Гц, 1H), 7,95 (д, J=8,2 Гц, 1H), 7,67 (ддд, J=8,2, 6,9, 1,3 Гц, 1H), 7,59 (ддд, J=8,1, 6,9, 1,3 Гц, 1H), 7,35 (м, 4H), 7,29 (м, 1H), 4,40 (м, 1H), 4,03 (м, 3H), 3,91 (с, 3H), 3,79 (с, 1H), 3,59 (м, 1H), 3,19 (м, 1H) и 2,96 (м, 1H).
Пример 256D
Транс-2-бензил-1,2,3,3a,4,5-гексагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 1C, заменяя соединение, полученное в Примере 256C, на соединение, полученное в Примере 1B. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,35 (с, 1H), 8,06 (т, J=5,0 Гц, 1H), 8,00 (д, J=7,9 Гц, 1H), 7,92 (д, J=8,1 Гц, 1H), 7,65 (с, 1H), 7,57 (ддд, J=8,2, 6,9, 1,2 Гц, 1H), 7,51 (ддд, J=8,1, 6,9, 1,2 Гц, 1H), 7,40 (д, J=6,0 Гц, 2H), 7,35 (т, J=8,0 Гц, 2H), 7,26 (дт, J=7,0, 1,5 Гц, 1H), 3,85 (д, J=13,3 Гц, 1H), 3,77 (д, J=13,3 Гц, 1H), 3,39 (м, 1H), 3,22 (м, 2H), 3,18 (м, 1H), 3,10 (дт, J=14,2, 5,2 Гц, 1H), 2,78 (т, J=8,6 Гц, 1H), 2,67 (т, J=8,9 Гц, 1H) и 2,21 (м, 1H). MS (ESI+) m/z 343 [M+H]+.
Пример 257
Транс-1,2,3,3a,4,5-гексагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он
Трифторэтанол (4 мл) добавляли к соединению, полученному в Примере 256 (411 мг, 1,2 ммоль), и 20% Pd(OH)2-C (влажн., 40 мг, 0,029 ммоль) в 20-миллилитровой колбе для работы под давлением. Смесь перемешивали под давлением 60 фунтов на квадратный дюйм водорода при температуре 50°C в течение 19 часов. Смесь фильтровали через полипропиленовую мембрану и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения и Примера 258. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,25 (с, 1H), 8,09 (т, J=1,2 Гц, 1H), 8,01 (д, J=8,1 Гц, 1H), 7,94 (д, J=7,8 Гц, 1H), 7,69 (с, 1H), 7,58 (т, J=6,9 Гц, 1H), 7,52 (т, J=6,9 Гц, 1H), 3,36 (м, 2H), 3,12 (м, 4H), 2,77 (т, J=11,6 Гц, 1H), 2,06 (м, 1H); MS (ESI+) m/z 253 [M+H]+.
Пример 258
Транс-1,2,3,3a,4,5,8,9,10,11-декагидронафто[2,3-c]пирроло[3,4-e]азепин-6(12bH)-он
Трифторэтанол (4 мл) добавляли к соединению, полученному в Примере 256 (411 мг, 1,2 ммоль) и 20% Pd(OH)2-C (влажн., 40 мг, 0,029 ммоль) в 20-миллилитровой колбе для работы под давлением. Смесь перемешивали под давлением 60 фунтов на квадратный дюйм водорода при температуре 50°C в течение 19 часов. Смесь фильтровали через полипропиленовую мембрану очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения и Примера 257. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,86 (т, J=5,2 Гц, 1H), 7,36 (с, 1H), 6,85 (с, 1H), 3,21 (м, 1H), 3,07 (м, 4H), 2,98 (м, 1H), 2,71 (м, 4H), 2,02 (м, 1H) и 1,73 (м, 4H); MS (ESI+) m/z 257 [M+H]+.
Пример 259
(3aR,10bS)-9-Метокси-2,3,3a,4,5,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 94, заменяя соединение, полученное в Примере 261, на соединение, полученное в Примере 93. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,56 (с, 1H), 9,40 (с, 1H), 7,66 (д, J=8,7 Гц, 1H), 6,97 (дд, J=8,7, 2,4 Гц, 1H), 6,79 (д, J=1,5 Гц, 1H), 4,04 (м, 1H), 3,64 (м, 1H), 3,49 (м, 1H), 3,28 (м, 1H), 3,03 (м, 1H), 2,93 (м, 1H), 2,58 (м, 1H), 2,22 (м, 1H), 2,04 (м, 1H) и 1,76 (м, 1H); MS (ESI+) m/z 232 [M+H]+.
Пример 260
2,3,3a,4,5,10b-Гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Пример 260A
(E)-2-Хлор-3-(2-нитровинил)пиридин
К 2-хлорникотинальдегиду (2,8 г, 19,8 ммоль) в нитрометане (6,1 г) добавляли гидрохлорид этиламина (100 мг, 1,2 ммоль) и NaOH (25 мг) в этаноле (1,5 мл). Смесь перемешивали в течение 1 часа и концентрировали. Сырой продукт растворяли в CH2Cl2 (30 мл) и обрабатывали триэтиламином (2,8 г, 28 ммоль), 4-(диметиламино)пиридином (20 мг) и уксусным ангидридом (2,0 г, 20 ммоль) при температуре 0°C. Смесь перемешивали в течение 15 минут и добавляли концентрированный насыщенный NaHCO3 (водн.), и образовавшиеся осадки собирали с получением указанного в заголовке соединения.
Пример 260B
2-(2-(трет-Бутилдиметилсилилокси)этил)-3-(2-хлорпиридин-3-ил)-4-нитробутаналь
К соединению, полученному в Примере 260A (1,66 г, 9,0 ммоль) в тетрагидрофуране (10 мл) добавляли 4-(трет-бутилдиметилсилилокси)бутаналь (1,82 г, 9,0 ммоль) и пиперидин (0,34 г, 4,0 ммоль). Смесь перемешивали в течение 5 часов, и сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения.
Пример 260C
3-(1-Бензил-4-(2-(трет-бутилдиметилсилилокси)этил)пирролидин-3-ил)-2-хлорпиридин
К соединению, полученному в Примере 260B в метаноле (25 мл) добавляли воду (1 мл) и уксусную кислоту (1 мл) и порошок Zn (5×330 мг, 25 ммоль), по частям. Смесь перемешивали в течение 3 часов, затем добавляли NaBH3CN (180 мг, 3 ммоль). Смесь перемешивали в течение 15 минут, затем добавляли бензальдегид (1,1 г) и NaBH3CN (180 мг, 3 ммоль). Смесь перемешивали в течение 30 минут и фильтровали через диатомовую землю. Фильтрат распределяли между этилацетатом и 1н NaOH (водн.). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения.
Пример 260D
2-(1-Бензил-4-(2-хлорпиридин-3-ил)пирролидин-3-ил)этанол
К соединению, полученному в Примере 260C (1,8 г, 4,2 ммоль) в тетрагидрофуране (10 мл) добавляли тетрабутиламмоний фторид (1,1 г, 4,2 ммоль). Смесь перемешивали в течение ночи и концентрировали. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения. Фракции чистого транс-изомера объединяли с получением Примера 262A.
Пример 260E
2-Бензил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 262B, заменяя соединение, полученное в Примере 260D, на соединение, полученное в Примере 262A.
Пример 260F
2,3,3a,4,5,10b-Гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Указанное в заголовке соединение получали в виде бис-гидрохлоридной соли в соответствии со способом, описанным в Примере 264, заменяя соединение, полученное в Примере 260E, на соединение, полученное в Примере 262. 2:1 смесь транс/цис-изомеров. Транс-изомер: 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,55 (с, 2H), 8,17 (дд, J=4,9, 1,7 Гц, 1H), 7,72 (д, J=7,5 Гц, 1H), 7,23 (дд, J=7,5, 5,0 Гц, 1H), 4,48 (дт, J=12,4, 3,8 Гц, 1H), 3,87 (ддд, J=2,4, 10,4, 12,3 Гц, 1H), 3,56 (м, 1H), 3,42 (м, 1H), 3,31 (м, 1H), 2,96 (м, 1H), 2,12 (м, 2H) и 1,85 (м, 1H). Цис-изомер: 9,75 (с, 1H), 9,45 (с, 1H), 8,24 (дд, J=1,6, 4,8 Гц, 1H), 7,94 (дд, J=1,6, 5,6 Гц, 1H), 7,29 (дд, J=4,0, 6,4 Гц, 1H), 4,35 (дт, J=11,6, 4,4 Гц, 1H), другие пики были экранированы пиками транс-изомера. MS (ESI+) m/z 191 [M+H]+.
Пример 261
Транс-2-бензил-9-метокси-2,3,3a,4,5,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-6(1H)-он
Пример 261A
(E)-Метил 3-(3-метоксифенил)акрилат
Смесь (E)-3-(3-метоксифенил)акриловой кислоты (3,56 г, 20 ммоль). K2CO3 (3,1 г, 22 ммоль) и йодметан (4,0 г, 28 ммоль) в ацетоне (20 мл) нагревали при температуре 70°C в течение 16 часов. Смесь концентрировали и распределяли между водой и этилацетатом с получением сырого указанного в заголовке соединения.
Пример 261B
Транс-метил 1-бензил-4-(3-метоксифенил)пирролидин-3-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 223B, заменяя соединение, полученное в Примере 261A, на соединение, полученное в Примере 223A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,33 (д, J=4,4 Гц, 4H), 7,27 (м, 1H), 7,20 (т, J=8,1 Гц, 1H), 6,87 (м, 2H), 6,77 (ддд, J=8,2, 2,4, 0,9 Гц, 1H), 3,73 (с, 3H), 3,67 (д, J=13,0 Гц, 1H), 3,58 (с, 3H), 3,57 (д, J=12,9 Гц, 1H), 3,49 (т, J=7,3 Гц, 1H), 3,09 (дт, J=8,4, 6,6 Гц, 1H), 2,93 (м, 2H), 2,82 (дд, J=9,1, 6,4 Гц, 1H) и 2,55 (дд, J=8,9, 6,9 Гц, 1H).
Пример 261C
Транс-1-бензил-4-(3-метоксифенил)пирролидин-3-карбальдегид
К соединению, полученному в Примере 261B (5,7 г, 17,5 ммоль) в толуоле (40 мл), добавляли диизобутилаоюминий гидрид (без примесей, 2,5 г, 17,5 ммоль) при температуре -78°C. Смесь перемешивали в течение 40 минут и гасили последовательно метанолом и насыщенным NaHCO3 (водн.). Добавляли этилацетат и смесь фильтровали через диатомовую землю. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 9,64 (д, J=1,6 Гц, 1H), 7,32 (д, J=4,4 Гц, 4H), 7,25 (м, 1H), 7,20 (т, J=8,4 Гц, 1H), 6,89 (м, 2H), 6,78 (ддд, J=8,3, 2,4, 1,0 Гц, 1H), 3,74 (с, 3H), 3,66 (д, J=13,0 Гц, 1H), 3,60 (д, J=12,9 Гц, 1H), 3,57 (дд, J=8,0, 5,6 Гц, 1H), 3,04 (м, 2H), 2,79 (т, J=10,3 Гц, 1H), 2,45 (т, J=8,7 Гц, 1H).
Пример 261D
(E)-трет-Бутил 3-(транс-1-бензил-4-(3-метоксифенил)пирролидин-3-ил)акрилат
Смесь соединения, полученного в Примере 261C (1,86 г, 6,3 ммоль) и трет-бутоксилкарбонилметилентрифенилфосфоран (2,37 г, 6,3 ммоль) в толуоле (15 мл), нагревали при температуре 110°C в течение 1 часа. Легко летучие продукты удаляли и сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (3:1) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,32 (м, 4H), 7,25 (м, 1H), 7,18 (д, J=8,4 Гц, 1H), 6,85 (м, 2H), 6,76 (д, J=15,3 Гц, 1H), 5,69-5,61 (м, 1H), 3,73 (с, 3H), 3,70 (д, J=15,0 Гц, 1H), 3,59 (д, J=15,0 Гц, 1H), 3,13 (м, 1H), 2,98 (м, 3H), 2,62 (м, 1H), 2,53 (м, 1H), 1,39 (с, 9H).
Пример 261E
трет-Бутил 3-(транс-1-бензил-4-(3-метоксифенил)пирролидин-3-ил)пропаноат
К соединению, полученному в Примере 261D (1,85 г, 4,70 ммоль) в тетрагидрофуране (20 мл), добавляли никель Ренея® 2800 (взвесь в воде, 1,85 г, 31,5 ммоль). Смесь перемешивали в течение 2 часов в атмосфере водорода (40 фунтов на квадратный дюйм) и фильтровали через нейлоновую мембрану с получением сырого указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 7,32 (м, 4H), 7,24 (м, 1H), 7,18 (д, J=8,1 Гц, 1H), 6,86 (м, 2H), 6,4 (м, 1H), 3,73 (с, 3H), 3,64 (д, J=13,0 Гц, 1H), 3,55 (д, J=13,0 Гц, 1H), 2,89 (т, J=8,2 Гц, 1H), 2,80 (м, 2H), 2,58 (м, 1H), 2,23 (м, 1H), 2,11 (т, J=7,4 Гц, 2H), 2,11 (м, 1H), 1,59 (м, 2H), и 1,28 (с, 9H).
Пример 261F
Транс-2-бензил-9-метокси-2,3,3a,4,5,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-6(1H)-он
К соединению, полученному в Примере 261E в CH2Cl2 (20 мл), добавляли трифторуксусную кислоту (10 мл). Смесь перемешивали в течение 2 часов и концентрировали. Добавляли полифосфорную кислоту (50 мл), и смесь нагревали при температуре 100°C в течение 30 минут. Смесь охлаждали до комнатной температуры и добавляли 1н NaOH (водн.) до pH=8. Смесь экстрагировали этилацетатом, промывали 1н NaOH (водн.), и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,66 (д, J=8,4 Гц, 1H), 7,33 (м, 4H), 7,25 (м, 1H), 6,89 (дд, J=8,7, 2,5 Гц, 1H), 6,67 (д, J=2,1 Гц, 1H), 3,80 (с, 3H), 3,75 (д, J=13,2 Гц, 1H), 3,55 (д, J=12,8 Гц, 1H), 3,48 (м, 2H), 3,03 (м, 1H), 2,63 (дд, J=4,4, 9,2 Гц, 1H), 2,55 (м, 1H), 2,53 (м, 2H), 1,96 (м, 2H), 1,65 (м, 1H); MS (ESI+) m/z 322 [M+H]+.
Пример 262
Транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Пример 262A
2-(Транс-1-бензил-4-(2-хлорпиридин-3-ил)пирролидин-3-ил)этанол
К соединению, полученному в Примере 260C (1,8 г, 4,2 ммоль) в тетрагидрофуране (10 мл), добавляли тетрабутиламмоний фторид (1,1 г, 4,2 ммоль). Смесь перемешивали в течение ночи и концентрировали. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения.
Пример 262B
Транс-2-бензил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
К соединению, полученному в Примере 262A (680 мг, 2,1 ммоль) в диоксане (10 мл), добавляли трет-бутоксид калия (350 мг, 3,1 ммоль). Смесь нагревали при температуре 75°C в течение 30 минут и гасили водой. Смесь экстрагировали этилацетатом. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,04 (дд, J=4,7, 1,6 Гц, 1H), 7,49 (м, 1H), 7,33 (м, 4H), 7,24 (м, 1H), 7,06 (дд, J=7,4, 4,8 Гц, 1H), 4,41 (дт, J=12,3, 4,1 Гц, 1H), 3,78 (д, J=13,2 Гц, 1H), 3,73 (ддд, J=2,4, 9,6, 12,4 Гц, 1H), 3,65 (д, J=13,2 Гц, 1H), 3,19 (м, 2H), 2,86 (м, 1H), 2,78 (т, J=9,1 Гц, 1H), 2,59 (дд, J=9,3, 7,7 Гц, 1H), 1,99 (м, 2H), и 1,81 (м, 1H). MS (ESI+) m/z 281 [M+H]+.
Пример 263
Транс-9-метокси-1,2,3,3a,4,5,6,10b-октагидробензо[3,4]циклогепта[1,2-c]пиррол
Пример 263A
трет-Бутил (транс)-9-метокси-3,3a,4,5,6,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-2(1H)-карбоксилат
К соединению, полученному в Примере 261 (300 мг, 0,93 ммоль) в 2,2,2-трифторэтаноле (10 мл), добавляли 20% Pd(OH)2-C (влажн., 60 мг, 0,43 ммоль). Смесь перемешивали в течение 36 часов под давлением 30 фунтов на квадратный дюйм водорода при температуре 50°C. Смесь фильтровали через нейлоновую мембрану, и сырой продукт растворяли в CH2Cl2 (3 мл). Добавляли ди-трет-бутил дикарбонат (300 мг) и смесь перемешивали в течение 1 часа. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (1:1) с получением указанного в заголовке соединения и Примера 266A.
Пример 263B
Транс-9-метокси-1,2,3,3a,4,5,6,10b-октагидробензо[3,4]циклогепта[1,2-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 263A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,27 (м, 2H), 7,09 (д, J=8,4 Гц, 1H), 6,72 (дд, J=8,2, 2,6 Гц, 1H), 6,62 (д, J=2,4 Гц, 1H), 3,73 (с, 3H), 3,65 (м, 1H), 3,50 (м, 2H), 3,25 (м, 1H), 2,89 (м, 1H), 2,77 (м, 1H), 2,67 (м, 1H), 2,09 (м, 1H), 1,93 (м, 1H), 1,82 (м, 1H), 1,53 (м, 1H) и 1,20 (м, 1H). MS (ESI+) m/z 218 [M+H]+.
Пример 264
Транс-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 94, заменяя соединение, полученное в Примере 262, на соединение, полученное в Примере 93. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,55 (с, 2H), 8,17 (дд, J=4,9, 1,7 Гц, 1H), 7,72 (д, J=7,5 Гц, 1H), 7,23 (дд, J=7,5, 5,0 Гц, 1H), 4,48 (дт, J=12,4, 3,8 Гц, 1H), 3,87 (ддд, J=2,4, 10,4, 12,3 Гц, 1H), 3,56 (м, 1H), 3,42 (м, 1H), 3,31 (м, 1H), 2,96 (м, 1H), 2,12 (м, 2H) и 1,85 (м, 1H); MS (ESI+) m/z 191 [M+H]+.
Пример 265
Транс-8-(тетрагидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Пример 265A
Транс- трет-бутил 6-оксо-8-(тетрагидро-2H-пиран-4-ил)-1,3a,4,5,6,10b-гексагидробензо[c]пирроло[3,4-e]азепин-2(3H)-карбоксилат
К соединению, полученному в Примере 241A (160 мг, 0,42 ммоль) в тетрагидрофуране (5 мл) и этаноле (5 мл), добавляли 5% Pd-C (влажн., 32,0 мг, 0,30 ммоль). Смесь перемешивали в течение 16 часов под давлением 30 фунтов на квадратный дюйм водорода при комнатной температуре. Смесь фильтровали через нейлоновую мембрану с получением указанного в заголовке соединения.
Пример 265B
Гидрохлорид транс-8-(тетрагидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-она
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 265A, на соединение, полученное в Примере 46A. (78%). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,31 (м, 2H), 8,10 (м, 1H), 7,52 (д, J=1,9 Гц, 1H), 7,41 (дд, J=2,0, 8,0 Гц, 1H), 7,20 (д, J=7,9 Гц, 1H), 3,93 (м, 2H), 3,60 (м, 1H), 3,45 (м, 4H), 3,18 (м, 2H), 3,06 (м, 1H), 2,94 (м, 1H), 2,81 (м, 1H), 2,20 (м, 1H) и 1,65 (м, 4H); MS (ESI+) m/z 287 [M+H]+.
Пример 266
Транс-9-метокси-1,2,3,3a,4,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол
Пример 266A
трет-Бутил (транс)-6-гидрокси-9-метокси-3,3a,4,5,6,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол-2(1H)-карбоксилат
К соединению, полученному в Примере 261 (300 мг, 0,93 ммоль) в 2,2,2,-трифторэтаноле (10 мл), добавляли 20% Pd(OH)2-C (влажн., 60 мг, 0,43 ммоль). Смесь перемешивали в течение 36 часов под давлением 30 фунтов на квадратный дюйм водорода при температуре 50°C. Смесь фильтровали через нейлоновую мембрану, и сырой продукт растворяли в CH2Cl2 (3 мл). Ди-трет-бутил дикарбонат (300 мг) добавляли, и смесь перемешивали в течение 1 часа. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (1:1) с получением указанного в заголовке соединения и Примера 263A.
Пример 266B
Транс-9-метокси-1,2,3,3a,4,10b-гексагидробензо[3,4]циклогепта[1,2-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 266A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,62 (с, 1H), 9,36 (с, 1H), 7,18 (д, J=8,5 Гц, 1H), 6,82 (дд, J=8,4, 2,5 Гц, 1H), 6,61 (д, J=2,3 Гц, 1H), 6,37 (д, J=12,6 Гц, 1H), 5,68 (ддд, J=12,5, 5,2, 3,1 Гц, 1H), 3,85 (м, 1H), 3,77 (с, 3H), 3,53 (м, 1H), 3,46 (м, 1H), 3,25 (м, 1H), 2,95 (м, 1H), 2,60 (дт, J=18,6, 4,6 Гц, 1H), 2,44 (м, 1H) и 2,31 (м, 1H); MS (ESI+) m/z 216 [M+H]+.
Пример 267
Транс-2-метил-8-(тетрагидро-2H-пиран-4-ил)-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 265, на соединение, полученное в Примере 46. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,93 (т, J=3,6 Гц, 1H), 7,71 (д, J=1,9 Гц, 1H), 7,32 (дд, J=7,9, 2,0 Гц, 1H), 7,09 (д, J=7,9 Гц, 1H), 3,94 (дд, J=10,8, 3,6 Гц, 2H), 3,43 (тд, J=11,5, 2,3 Гц, 2H), 3,21 (м, 2H), 3,07 (м, 2H), 2,87 (дд, J=10,4, 8,9 Гц, 1H), 2,79 (м, 1H), 2,62 (м, 2H), 2,37 (с, 3H), 2,16 (м, 1H) и 1,64 (м, 4H); MS (ESI+) m/z 301 [M+H]+.
Пример 268
Транс-2-метил-2,3,3a,4,5,10b-гексагидро-1H-пирроло[3',4':4,5]оксепино[2,3-b]пиридин
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 264, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,04 (дд, J=4,8, 1,8 Гц, 1H), 7,52 (м, 1H), 7,08 (дд, J=7,5, 4,8 Гц, 1H), 4,41 (дт, J=12,4, 4,1 Гц, 1H), 3,73 (ддд, J=12,4, 9,8, 2,6 Гц, 1H), 3,18 (тд, J=10,1, 6,7 Гц, 1H), 3,07 (дд, J=8,7, 6,6 Гц, 1H), 2,77 (дд, J=9,8, 8,9 Гц, 1H), 2,69 (т, J=9,0 Гц, 1H), 2,61 (дд, J=9,1, 7,4 Гц, 1H), 2,34 (с, 3H), 2,03 (м, 1H), 1,94 (м, 1H) и 1,83 (м, 1H); MS (ESI+) m/z 205 [M+H]+.
Пример 269
Цис-2-метил-1,2,3,3a,4,5,6,10b-октагидробензо[3,4]циклогепта[1,2-c]пиррол
К диизопропиламину (808 мг, 8,0 ммоль) в тетрагидрофуране (3 мл) добавляли н-бутиллитий (4,0 мл, 2,0н в гексане, 8,0 ммоль) при температуре -78°C, затем добавляли нитрометан (300 мг, 4,0 ммоль). Смесь перемешивали в течение 10 мин и добавляли (Z)-6,7-дигидро-5H-бензо[7]аннулен (288 мг, 2,0 ммоль) в тетрагидрофуране (1 мл). Смесь нагревали до комнатной температуры в течение 10 минут и перемешивали при комнатной температуре в течение 4 часов. Добавляли воду и смесь экстрагировали этилацетатом. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя этилацетатом с получением указанного в заголовке соединения. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,14 (м, 2H), 7,07 (м, 2H), 3,55 (дд, J=17,4, 10,0 Гц, 1H), 3,21 (т, J=8,1 Гц, 1H), 2,97 (т, J=8,3 Гц, 1H), 2,75 (тд, J=12,7, 6,9 Гц, 1H), 2,56 (м, 1H), 2,38 (дт, J=11,1, 5,6 Гц, 1H), 2,36 (м, 1H), 2,26 (с, 3H), 1,66 (м, 2H), 1,44 (м, 1H), 1,33 (дд, J=13,7, 6,4 Гц, 1H) и 0,87 (м, 1H); MS (ESI+) m/z 202 [M+H]+.
Пример 270
(3aR,10bS)-2,3,3a,4,5,10b-Гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 270A
трет-Бутил (3aR,10bS)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Пример 94A растворяли, используя трифункциональную (R,R) колонку Kromasil (Whelk-O 10 мкм, 2,54 мм вн. диам. × 25 см), элюируя с помощью гексанов и изопропиламина (95/5) со скоростью потока 30 мл/минута с использованием УФ детектора (220 нм) с получением указанного в заголовке соединения (время удерживания 4,6 минут).
Пример 270B
Гидрохлорид (3aR,10bS)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 270A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,36 (с, 2H), 7,23 (м, 1H), 7,11 (м, 1H), 7,07 (дд, J=7,6, 1,1 Гц, 1H), 7,01 (дд, J=7,9, 1,1 Гц, 1H), 4,40 (дт, J=12,3, 3,5 Гц, 1H), 3,71 (дд, J=11,0, 7,0 Гц, 1H), 3,54 (м, 2H), 3,46 (м, 1H), 3,30 (м, 1H), 2,5 (т, J=10,8 Гц, 1H), 2,09 (м, 1H), 1,99 (м, 1H) и 1,82 (м, 1H); MS (ESI+) m/z 190 [M+H]+.
Пример 271
(3aS,10bR)-2,3,3a,4,5,10b-Гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 271A
трет-Бутил (3aS,10bR)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Пример 94A растворяли, используя трифункциональную (R,R) колонку Kromasil (Whelk-O 10 мкм, 2,54 мм вн. диам. × 25 см), элюируя с помощью гексанов и изопропиламина (95/5) со скоростью потока 30 мл/минута с использованием УФ детектора (220 нм) с получением указанного в заголовке соединения (время удерживания 5,2 минут).
Пример 271B
(3aS,10bR)-2,3,3a,4,5,10b-Гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 271A, на соединение, полученное в Примере 46A. Данные ЯМР и MS являются идентичными данным по Примеру 270.
Пример 272
Транс-10-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 272A
(E)-3-Метокси-2-(2-нитровинил)фенол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260A, заменяя 2-гидрокси-6-метоксибензальдегид на 2-хлорникотинальдегиду.
Пример 272B
Транс-метил 3-формил-4-(2-гидрокси-6-метоксифенил)-5-нитропентаноат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260B, заменяя соединение, полученное в Примере 272A, на соединение, полученное в Примере 260A и метил 4-оксобутаноат на 4-(трет-бутилдиметилсилилокси)бутаналь.
Пример 272C
Транс-трет-бутил 3-(2-гидрокси-6-метоксифенил)-4-(2-метокси-2-оксоэтил)пирролидин-1-карбоксилат
К соединению, полученному в Примере 272B (3,2 г, 10,3 ммоль) в метаноле (50 мл), уксусной кислоте (5 мл) и H2O (5 мл) добавляли порошок цинка (5×800 мг) в течение 1 часа, затем цианоборгидрид натрия (620 мг, 10 ммоль). Смесь перемешивали в течение ночи и добавляли этилацетат (100 мл). Добавляли насыщенный NaHCO3 (водн.) для установления pH равным 8. Смесь фильтровали через диатомовую землю и к фильтрату добавляли ди-трет-бутил дикарбонат (4,36 г, 20 ммоль). Смесь перемешивали в течение 1 часа и затем распределяли между водой и этилацетатом. Этилацетатный слой очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (2:1) с получением указанного в заголовке соединения.
Пример 272D
Транс-трет-бутил 3-(2-гидрокси-6-метоксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
К соединению, полученному в Примере 272C (2,4 г, 6,6 ммоль) в тетрагидрофуране (15 мл), добавляли литийалюминийгидрид (5 мл, 2 M в тетрагидрофуране, 1 ммоль) при температуре -78°C. Смесь перемешивали при комнатной температуре в течение 1 часа и последовательно гасили этилацетатом и насыщенным NaHCO3 (водн.). Смесь фильтровали через диатомовую землю и этилацетатный слой концентрировали с получением сырого указанного в заголовке соединения.
Пример 272E
трет-Бутил (транс)-10-метокси-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
К соединению, полученному в Примере 272D (170 мг, 0,50 ммоль) в тетрагидрофуране (3 мл), добавляли трифенилфосфин (132 мг, 0,50 ммоль) и (E)-ди-трет-бутил диазен-1,2-дикарбоксилат (116 мг, 0,50 ммоль). Смесь перемешивали в течение 3 часов. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения.
Пример 272F
Транс-10-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 272E, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,26 (с, 1H), 7,12 (т, J=8,2 Гц, 1H), 6,72 (д, J=8,3 Гц, 1H), 6,56 (д, J=8,3 Гц, 1H), 4,11 (м, 1H), 4,05 (м, 1H), 3,97 (м, 1H), 3,76 (с, 3H), 3,44 (м, 2H), 3,11 (м, 1H), 2,85 (м, 1H), 2,43 (м, 1H), 2,26 (м, 1H) и 1,69 (м, 1H); MS (ESI+) m/z 220 [M+H]+.
Пример 273
Транс-10-метокси-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 272, на соединение, полученное в Примере 46. 1H ЯМР (свободное основание): (400 МГц, ДМСО-d6) δ м.д. 7,04 (дд, J=10,3, 6,0 Гц, 1H), 6,66 (д, J=8,1 Гц, 1H), 6,52 (д, J=8,1 Гц, 1H), 4,13 (м, 1H), 3,87 (м, 1H), 3,70 (с, 3H), 3,23 (м, 3H), 2,73 (м, 1H), 2,54 (м, 1H), 2,21 (м, 1H), 2,08 (м, 1H) и 1,72 (м, 1H); MS (ESI+) m/z 234 [M+H]+.
Пример 274
(3aS,10bS)-8-(Бензилокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя бензиловый спирт на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. Альтернативное получение указанного в заголовке соединения описано в Примере 200A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,28 (д, J=51,0 Гц, 1H), 8,08 (д, J=4,4 Гц, 1H), 7,52-7,24 (м, 6H), 7,22-7,06 (м, 2H), 5,16 (д, J=12,4 Гц, 2H), 3,95 (дт, J=11,2, 6,3 Гц, 2H), 3,81-3,68 (м, 1H), 3,66-2,85 (м, 7H), 2,53-2,15 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 275
(3aS,10bS)-8-(2-Метоксифенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, 2-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту и заменяя соединение, полученное в Примере 199, на соединение, полученное в Примере 53. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,03-7,97 (м, 1H), 7,89 (д, J=1,9 Гц, 1H), 7,56 (дд, J=7,9, 2,0 Гц, 1H), 7,39-7,32 (м, 1H), 7,28 (дд, J=7,5, 1,7 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 7,12 (д, J=7,7 Гц, 1H), 7,04 (тд, J=7,4, 0,9 Гц, 1H), 3,76 (с, 3H), 3,28-3,19 (м, 2H), 3,17-3,05 (м, 3H), 2,91-2,71 (м, 2H), 2,52 (д, J=3,1 Гц, 3H), 2,37-2,23 (м, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 276
Транс-8-(2,6-дифторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Пример 276A
Транс-трет-бутил 8-(2,6-дифторфенил)-6-оксо-1,3a,4,5,6,10b-гексагидробензо[e]пирроло[3,4-c]азепин-2(3H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 2,6-дифторфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 276B
Транс-8-(2,6-дифторфенил)-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 276A, на соединение, полученное в Примере 46A. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,00 (д, J=52,7 Гц, 2H), 8,23-8,16 (м, 1H), 7,72 (с, 1H), 7,62 (д, J=7,9 Гц, 1H), 7,51 (тт, J=8,3, 6,6 Гц, 1H), 7,42 (д, J=8,0 Гц, 1H), 7,30-7,21 (м, 2H), 3,75-3,53 (м, 4H), 3,49 (дд, J=9,4, 6,0 Гц, 1H), 3,36-3,10 (м, 3H), 2,98 (дд, J=15,0, 9,4 Гц, 1H), 2,35 (дд, J=11,3, 5,9 Гц, 1H); MS (ESI+) m/z 323,2 [M+H]+.
Пример 277
(3aS,10bS)-8-(Циклопропилметокси)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя циклопропанеметанол на (S)-1-фенилпропан-2-ол и заменяя соединение, полученное в Примере 200B, на соединение, полученное в Примере 117. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,10 (с, 1H), 8,06 (т, J=5,0 Гц, 1H), 7,17 (с, 1H), 7,08 (с, 2H), 3,94 (с, 1H), 3,89-3,79 (м, 4H), 3,45 (м, 4H), 3,11 (с, 2H), 2,96 (с, 3H), 1,21 (ддд, J=12,7, 7,7, 4,9 Гц, 1H), 0,62-0,53 (м, 2H), 0,38-0,29 (м, 2H); MS (ESI+) m/z 287,2 [M+H]+.
Пример 278
(3aS,10bS)-8-(3-Ацетилфенил)-2-метил-1,2,3,3a,4,5-гексагидробензо[e]пирроло[3,4-c]азепин-6(10bH)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-ацетилфенилбороновую кислоту на 4-фторфенилбороновую кислоту и заменяя соединение, полученное в Примере 199, на соединение, полученное в Примере 53. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,17 (т, J=1,7 Гц, 1H), 8,15 (д, J=2,1 Гц, 1H), 8,08 (т, J=3,7 Гц, 1H), 8,00-7,91 (м, 2H), 7,81 (дд, J=8,0, 2,1 Гц, 1H), 7,64 (т, J=7,8 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 3,31-3,23 (м, 1H), 3,22-3,08 (м, 3H), 3,02-2,94 (м, 1H), 2,73-2,62 (м, 6H), 2,42 (с, 3H), 2,24 (дд, J=17,6, 7,1 Гц, 1H); MS (ESI+) m/z 335,2 [M+H]+.
Пример 279
Цис-8-фтор-9-метил-1,2,3,3a,4,5-гексагидробензо[c]пирроло[3,4-e]азепин-6(10bH)-он
Указанное в заголовке соединение получали, как описано в Примере 97, заменяя 2-бром-4-метил-5-фторбензойную кислоту на 3-бромбензо[b]тиофен-2-карбоновую кислоту в Примере 97A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,94-2,08 (м, 1H), 2,26 (д, J=1,70 Гц, 3H), 2,66 (т, J=9,83 Гц, 1H), 2,91-3,01 (м, 2H), 3,04-3,13 (м, 3H), 3,15-3,21 (м, 2H), 7,08 (д, J=7,46 Гц, 1H), 7,41 (д, J=10,51 Гц, 1H), 8,03 (с, 1H); MS (+DCI) m/z 235,1 [M+H]+.
Пример 280
Транс-8-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 280A
(E)-5-Метокси-2-(2-нитровинил)фенол
Смесь 2-гидрокси-4-метоксибензальдегид (5,0 г, 32,9 ммоль), нитрометан (5,5 г, 90,0 ммоль), ацетат аммония (6,9 г, 90,0 ммоль) и 40 мл ледяной уксусной кислоты нагревали при температуре 100°C в течение 4 часов. Реакционную смесь затем охлаждали, концентрировали и распределяли между этилацетатом и водой. Органический экстракт промывали 10%-м раствором бикарбоната натрия, водой и насыщенным солевым раствором и сушили над сульфатом натрия. Органический раствор концентрировали и хроматографировали на колонке с силикагелем, элюируя с помощью смеси 1:4 этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 3,78 (с, 3H), 6,49-6,55 (м, 2H), 7,65 (д, J=8,33 Гц, 1H), 8,00-8,06 (д, J=13,5 Гц, 1H), 8,13-8,19 (д, J=13,5 Гц 1H), 11,00 (с, 1H).
Пример 280B
Син-2-(2-(бензилокси)этил)-3-(2-гидрокси-4-метоксифенил)-4-нитробутаналь
Триэтиламин (195 мг, 1,93 ммоль) добавляли к раствору продукта по Примеру 280A (377 мг, 1,93 ммоль), 4-бензилоксибутиральдегид (891 мг, 5,00 ммоль), L-пролин ( 46 мг, 0,40 ммоль), 5 мл тетрагидрофурана и 5 мл метиленхлорида. Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение ночи. Реакционную смесь распределяли между этилацетатом и 1н HCl, и органический экстракт промывали водой (2×) и насыщенным солевым раствором и сушили над сульфатом натрия. Органический раствор концентрировали и очищали на колонке с силикагелем, элюируя с помощью смеси 15:85 этилацетат/гексан с получением указанного в заголовке соединения, которое элюировалось после соответствующего анти изомера. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,14-2,33 (м, 3H), 3,48-3,62 (м, 2H), 3,69 (с, 3H), 4,47 (д, J=11,53 Гц, 2H), 4,63-4,89 (м, 1H), 4,93-5,13 (м, 1H), 5,35-5,46 (м, 1H), 6,35 (д, J=2,37 Гц, 1H), 6,40-6,48 (м, 1H), 6,67-6,93 (м, 1H), 7,24-7,36 (м, 5H).
Пример 280C
Транс-трет-бутил 3-(2-(бензилокси)этил)-4-(2-гидрокси-4-метоксифенил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 272C, заменяя продукт, полученный по Примеру 280B на продукт по Примеру 272B.
Пример 280D
Транс-трет-бутил 3-(2-гидрокси-4-метоксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
К раствору продукта по Примеру 280C (450 мг, 1,05 ммоль) в 20 мл тетрагидрофурана добавляли влажный 20% Pd(OH)2 в 250-миллилитровом стальном сосуде для работы под давлением. Сосуд закрывали и перемешивали в течение трех часов в атмосфере водорода (30 фунтов на квадратный дюйм) при комнатной температуре. Реакционную смесь фильтровали через нейлоновую мембрану и концентрировали. Сырой продукт хроматографировали на колонке с силикагелем, элюируя с помощью смеси 3:1 этилацетат/гексан с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,24-1,59 (м, 11H), 2,35 (д, J=7,12 Гц, 1H), 2,86-2,98 (м, 1H), 3,06-3,18 (м, 2H), 3,48-3,71 (м, 5H), 3,96-4,06 (м, 2H), 4,36 (с, 1H), 6,32-6,41 (м, 2H), 7,03 (д, J=8,48 Гц, 1H), 9,42 (с, 1H).
Пример 280E
трет-Бутил транс-8-метокси-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 272E, заменяя продукт по Примеру 280D на продукт по Примеру 272D.
Пример 280F
Транс-8-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, как описано в Примере 272F, заменяя продукт по Примеру 280E на продукт, полученный по Примеру 272E. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,69-1,86 (м, 1H), 1,86-2,03 (м, 1H), 2,03-2,14 (м, 1H), 2,84-3,03 (м, 1H), 3,12-3,27 (м, 1H), 3,35-3,47 (м, 1H), 3,47-3,63 (м, 2H), 3,64-3,76 (м, 4H), 4,31-4,47 (м, 1H), 6,53-6,73 (м, 2H), 7,00 (д, J=8,33 Гц, 1H), 9,26 (с, 2H); MS (DCI+) m/z 220,1 [M+H]+.
Пример 281
Транс-7-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 281A
(E)-2-Фтор-6-(2-нитровинил)фенол
Указанное в заголовке соединение получали, как описано в Примере 280A, заменяя 3-фторсалицилальдегид на 2-гидрокси-4-метоксибензальдегид.
Пример 281B
Syn-2-(2-(трет-бутилдиметилсилилокси)этил)-3-(3-фтор-2-гидроксифенил)-4-нитробутаналь
Указанное в заголовке соединение получали, как описано в Примере 280B, заменяя продукт, полученный по Примеру 281A на 280A и 4-(трет-бутилдиметилсилилокси)бутаналь на 4-бензилоксибутиральдегид.
Пример 281C
Транс-трет-бутил 3-(2-(трет-бутилдиметилсилилокси)этил)-4-(3-фтор-2-гидроксифенил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 280C, заменяя продукт, полученный по Примеру 281B на 280B.
Пример 281D
Транс-трет-бутил 3-(3-фтор-2-гидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 260D, заменяя продукт, полученный в Примере 281C, на продукт, полученный в Примере 260C.
Пример 281E
трет-Бутил транс-7-фтор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали, как описано в Примере 272E, соединение, полученное в Примере 281D, на соединение, полученное в Примере 272D.
Пример 281F
Транс-7-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя тот же способ, что описан в Примере 280F, заменяя продукт, полученный по Примеру 281E на 280E. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,78-1,98 (м, 1H), 1,98-2,17 (м, 2H), 2,87-3,05 (м, 1H), 3,28-3,77 (м, 5H), 4,41-4,54 (м, 1H), 6,94 (д, J=7,93 Гц, 1H), 7,03-7,13 (м, 1H), 7,18 (м, 1H), 9,44 (с, 2H); MS (DCI+) m/z 208,1 [M+H]+.
Пример 282
Транс-9-(трифторметокси)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что в Примере 281, заменяя 5-трифторметоксисалицилальдегид в Примере 281A на 3-фторсалицилальдегид. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,74-1,94 (м, 1H), 2,00-2,16 (м, 2H), 2,87-3,06 (м, 1H), 3,33-3,64 (м, 4H), 3,67-3,81 (м, 1H), 4,33-4,53 (м, 1H), 7,08-7,18 (м, 2H), 7,19-7,31 (м, 1H), 9,18-9,63 (м, 2H); MS (DCI+) m/z 274,1 [M+H]+.
Пример 283
Транс-7,9-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли с использованием той же последовательности стадий, что и в Примере 281, заменяя 3,5-дифторсалицилальдегид в Примере 281A на 3-фторсалицилальдегид. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,80-1,94 (м, 1H), 1,98-2,17 (м, 2H), 2,96 (с, 1H), 3,26-3,75 (м, 5H), 4,39-4,54 (м, 1H), 6,91 (д, J=9,52 Гц, 1H), 7,15-7,36 (м, 1H), 9,32 (с, 2H); MS (DCI+) m/z 226,1 [M+H]+.
Пример 284
Цис-9-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 284A
(E)-4-Фтор-2-(2-нитровинил)фенол
Указанное в заголовке соединение получали, как описано в Примере 280A, заменяя 5-фторсалицилальдегид на 2-гидрокси-4-метоксибензальдегид.
Пример 284B
анти-2-(2-(трет-бутилдиметилсилилокси)этил)-3-(5-фтор-2-гидроксифенил)-4-нитробутаналь
Указанное в заголовке соединение получали, как описано в Примере 280B, заменяя продукт, полученный по Примеру 284A на продукт по Примеру 280A и заменяя 4-(трет-бутилдиметилсилилокси)бутаналь на 4-бензилоксибутиральдегид. Хроматография на колонке с силикагелем, элюируя с помощью смеси 15:85 этилацетат/гексан, приводила к разделению анти- и син-изомеров, где анти-изомер элюировался первым.
Пример 284C
Цис-9-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли с использованием способов, описанных в Примерах 281C-281F, заменяя анти-изомер, полученный по Примеру 284B, на продукт, полученный по Примеру 281B. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 1,62 (дд, J=9,92, 4,73 Гц, 1H), 1,70-1,79 (м, 1H), 2,68 (д, J=7,93 Гц, 1H), 2,89 (дд, J=11,29, 6,71 Гц, 1H), 3,22-3,74 (м, 4H), 3,83-3,94 (м, 1H), 4,05-4,17 (м, 1H), 6,99-7,05 (м, 1H), 7,05-7,12 (м, 1H), 7,16 (дд, J=9,46, 2,75 Гц, 1H), 9,54 (с, 2H); MS (DCI+) m/z 208,1 [M+H].
Пример 285
Транс-7-(трифторметокси)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что и в Примере 281, заменяя 3-трифторметоксисалицилальдегид на 3-фторсалицилальдегид. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,80-1,95 (м, 1H), 2,01-2,18 (м, 2H), 2,90-3,00 (м, 1H), 3,34-3,38 (м, 1H), 3,44-3,65 (м, 3H), 3,68-3,79 (м, 1H), 4,42-4,56 (м, 1H), 7,13-7,23 (м, 2H), 7,27-7,40 (м, 1H), 9,24 (с, 2H); MS (DCI+) m/z 274,1 [M+H]+.
Пример 286
Транс-9-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли с использованием способов, описанных в Примере 281C-281F, заменяя син-изомер, полученный по Примеру 284B, на продукт, полученный по Примеру 281B. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,72-1,90 (м, 1H), 1,93-2,14 (м, 2H), 2,85-3,04 (м, 1H), 3,25-3,60 (м, 4H), 3,63-3,78 (м, 1H), 4,32-4,44 (м, 1H), 6,94-7,10 (м, 3H), 9,43 (с, 2H); MS (DCI+) m/z 208,1 [M+H]+.
Пример 287
Транс-10-фтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что и в Примере 281, заменяя 6-фторсалицилальдегид на 3-фторсалицилальдегид в Примере 281A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,69-1,93 (м, 1H), 2,14-2,28 (м, 1H), 2,37 (д, J=3,57 Гц, 1H), 2,83-2,96 (м, 1H), 3,33-3,55 (м, 3H), 3,67-3,94 (м, 2H), 4,20-4,41 (м, 1H), 6,77-7,05 (м, 2H), 7,16-7,35 (м, 1H), 9,28 (с, 2H); MS (DCI+) m/z 208,1 [M+H]+.
Пример 288
Цис-7,10-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что описана в Примере 284, заменяя 3,6-дифтор-2-гидроксибензальдегид на 5-фторсалицилальдегид. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,84-2,05 (м, 2H), 2,67-2,79 (м, 1H), 3,10 (т, J=11,50 Гц, 1H), 3,21 (дд, J=11,70, 4,96 Гц, 1H), 3,41-3,56 (м, 2H), 3,77-3,92 (м, 2H), 4,34-4,47 (м, 1H), 6,97-7,08 (м, 1H), 7,21-7,35 (м, 1H), 9,01-9,45 (м, 2H); MS (DCI+) m/z 226,1 [M+H]+.
Пример 289
Транс-7,10-дифтор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, как описано в Примере 281, заменяя 3,6-дифтор-2-гидроксибензальдегид на 3-фторсалицилальдегид в Примере 281A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,76-1,97 (м, 1H), 2,17-2,28 (м, 1H), 2,34-2,47 (м, 1H), 2,85-2,96 (м, 1H), 3,39-3,55 (м, 3H), 3,78-3,97 (м, 2H), 4,30-4,45 (м, 1H), 6,89-7,04 (м, 1H), 7,19-7,32 (м, 1H), 9,25 (с, 2H); MS (DCI+) m/z 226,1 [M+H]+.
Пример 290
Транс-9-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что описана в Примере 281, заменяя 2-гидрокси-5-метилбензальдегид на 3-фторсалицилальдегид в Примере 281A. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,73-1,86 (м, 1H), 1,92-2,12 (м, 2H), 2,26 (с, 3H), 2,93 (т, J=10,51 Гц, 1H), 3,20-3,26 (м, 1H), 3,43-3,59 (м, 3H), 3,70 (дд, J=10,85, 6,78 Гц, 1H), 4,30-4,41 (м, 1H), 6,85-6,93 (м, 2H), 6,97-7,04 (м, 1H), 9,18 (с, 2H); MS (DCI+) m/z 204,1 [M+H]+.
Пример 291
Транс-7-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли, используя ту же последовательность стадий, что описана в Примере 281, заменяя 2-гидрокси-3-метилбензальдегид на 3-фторсалицилальдегид. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 1,78-2,01 (м, 2H), 2,08 (дд, J=13,05, 2,20 Гц, 1H), 2,19 (с, 3H), 2,94 (т, J=10,51 Гц, 1H), 3,23-3,36 (м, 1H), 3,40-3,59 (м, 3H), 3,62-3,71 (м, 1H), 4,39-4,51 (м, 1H), 6,89-7,01 (м, 2H), 7,08-7,17 (м, 1H), 9,21 (с, 2H); MS (DCI+) m/z 204,1 [M+H]+.
Пример 292
Транс-8-(3,5-диметил-1,2-oxазоl-4-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 292A
трет-Бутил транс-8-(3,5-диметил-1,2-oxазоl-4-ил)-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3,5-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоксазол на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 292B
Транс-8-(3,5-диметил-1,2-oxазоl-4-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 292A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,06 (д, J=56,1 Гц, 2H), 8,18 (дд, J=6,4, 4,0 Гц, 1H), 7,61 (д, J=1,9 Гц, 1H), 7,54 (дд, J=7,9, 1,9 Гц, 1H), 7,37 (д, J=7,9 Гц, 1H), 3,74-3,64 (м, 1H), 3,63-3,52 (м, 1H), 3,52-3,43 (м, 1H), 3,32-3,20 (м, 1H), 3,20-3,09 (м, 2H), 2,99 (дт, J=17,5, 9,7 Гц, 1H), 2,41 (с, 3H), 2,32 (ддд, J=19,9, 12,5, 7,4 Гц, 1H), 2,23 (с, 3H); MS (ESI+) m/z 298,1 [M+H]+.
Пример 293
(3aS,10bS)-8-{3-[(1S)-1-Гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя (S)-1-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)этанол на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,17-8,11 (м, 1H), 7,98 (д, J=2,1 Гц, 1H), 7,79 (дд, J=7,9, 2,1 Гц, 1H), 7,65 (ушир. с 1H), 7,56-7,50 (м, 1H), 7,42 (т, J=7,5 Гц, 1H), 7,38-7,32 (м, 1H), 7,29 (д, J=7,9 Гц, 1H), 5,24 (д, J=4,3 Гц, 1H), 4,85-4,77 (м, 1H), 3,50 (д, J=50,4 Гц, 2H), 3,62-3,15 (м, 2H), 3,03 (с, 2H), 2,81-2,76 (м, 3H), 2,42 (с, 1H), 2,45-2,35 (м, 1H), 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 294
(3aS,10bS)-8-{3-[(1R)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя (R)-1-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)этанол на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,11-8,05 (м, 1H), 8,06 (д, J=2,1 Гц, 1H), 7,75 (дд, J=7,9, 2,1 Гц, 1H), 7,64 (ушир. с 1H), 7,51 (дт, J=7,6, 1,5 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,34 (д, J=7,6 Гц, 1H), 7,27 (д, J=8,0 Гц, 1H), 5,27-5,21 (м, 1H), 4,83-4,75 (м, 1H), 4,10 (с, 1H), 3,17 (с, 2H), 3,14 (д, J=5,5 Гц, 2H), 2,91 (т, J=8,9 Гц, 1H), 2,80 (т, J=9,3 Гц, 1H), 2,56 (с, 3H), 2,48-2,23 (м, 1H), 1,37 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 295
Цис-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 295A
трет-Бутил цис-7-хлор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 376D, на соединение, полученное в Примере 272B. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения с более длительным временем удерживания, чем по Примеру 376E.
Пример 295B
Цис-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 295A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,39 (с, 2H), 7,43 (дд, J=8,0, 1,3 Гц, 1H), 7,23 (д, J=6,5 Гц, 1H), 7,13 (т, J=7,8 Гц, 1H), 4,24 (м, 1H), 3,96 (м, 1H), 3,71 (м, 1H), 3,56 (м, 1H), 3,44 (м, 2H), 2,92 (м, 1H), 2,71 (м, 1H), 1,75 (м, 1H), 1,62 (м, 1H); MS (ESI+) m/z 224/226 (3:1) [M+H]+.
Пример 296
Транс-8-(5-ацетил-2-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 296A
трет-Бутил транс-8-(5-ацетил-2-тиенил)-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в примере 227H, заменяя 5-ацетилтиофен-2-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 296B
Транс-8-(5-ацетил-2-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 296A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,29 (д, J=27,4 Гц, 2H), 8,24 (дд, J=6,4, 3,9 Гц, 1H), 8,01-7,94 (м, 2H), 7,91 (дд, J=8,0, 2,1 Гц, 1H), 7,73 (д, J=4,0 Гц, 1H), 7,38 (д, J=8,0 Гц, 1H), 3,71-3,61 (м, 2H), 3,57 (т, J=6,0 Гц, 1H), 3,42 (д, J=16,4 Гц, 1H), 3,32-3,07 (м, 3H), 2,97 (с, 1H), 2,55 (с, 3H), 2,36-2,21 (м, 1H); MS (ESI+) m/z 327,1 [M+H]+.
Пример 297
Транс-8-(изобутиламино)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 297A
(E)-Метил 2-(2-циановинил)-5-нитробензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 45A, заменяя метил 2-бром-5-нитробензоат на метил 2-бром-5-хлорбензоат.
Пример 297B
Метил 2-(транс-4-циано-1-метилпирролидин-3-ил)-5-нитробензоат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 88B, заменяя соединение, полученное в Примере 297A, на соединение, полученное в Примере 88A.
Пример 297C
Транс-8-амино-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали таким же способом, как показано в Примере 45C, заменяя соединение, полученное в Примере 297B, на соединение, полученное в Примере 45B.
Пример 297D
Транс-8-(изобутиламино)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
К соединению, полученному в Примере 297C (80 мг, 0,346 ммоль) в этаноле (2 мл) добавляли изобутиральдегид (26,2 мг, 0,363 ммоль), MP-BH3CN (2,19 ммоль/г, используемый 0,47 г, 3 экв.) и уксусную кислоту (104 мг, 1,729 ммоль). Реакционную смесь нагревали при температуре 57°C в течение ночи. Смесь охлаждали до комнатной температуры и фильтровали, и твердые продукты промывали метанолом. Фильтрат концентрировали, и остаток очищали с помощью ВЭЖХ с обращенной фазой (0,1% трифторуксусная кислота (водн.):ацетонитрил) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,33 (д, J=50,3 Гц, 1H), 7,90 (т, J=4,8 Гц, 1H), 6,98-6,83 (м, 2H), 6,68 (дд, J=7,8, 1,8 Гц, 1H), 3,96-3,83 (м, 1H), 3,57-3,22 (м, 3H), 3,15-3,02 (м, 3H), 2,95 (т, J=5,7 Гц, 3H), 2,89-2,79 (м, 3H), 1,82 (др, J=13,3, 6,6 Гц, 1H), 0,93 (д, J=6,6 Гц, 6H); MS (ESI+) m/z 288,1 [M+H]+.
Пример 298
Транс-2-метил-8-(piperidin-1-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 297D, заменяя глутаральдегид на изобутиральдегид. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,34 (д, J=58,2 Гц, 1H), 8,05 (д, J=4,7 Гц, 1H), 7,34 (д, J=9,8 Гц, 1H), 7,21 (д, J=8,0 Гц, 1H), 7,09 (дд, J=22,8, 8,4 Гц, 1H), 4,01-3,90 (м, 1H), 3,81-3,71 (м, 3H), 3,66-3,29 (м, 3H), 3,30-2,84 (м, 8H), 2,23 (дд, J=12,5, 6,0 Гц, 1H), 1,74-1,50 (м, 6H); MS (ESI+) m/z 300,2 [M+H]+.
Пример 299
Транс-8-(4-фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-фтор-2-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту.
1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,16 (д, J=71,0 Гц, 1H), 8,11 (д, J=4,7 Гц, 1H), 7,73 (дд, J=18,9, 1,9 Гц, 1H), 7,60 (дт, J=7,9, 1,9 Гц, 1H), 7,37-7,29 (м, 1H), 7,31-7,18 (м, 1H), 7,05 (дд, J=11,4, 2,4 Гц, 1H), 6,88 (тд, J=8,4, 2,5 Гц, 1H), 4,02 (дт, J=9,6, 8,0 Гц, 1H), 3,58-3,47 (м, 2H), 3,25-3,08 (м, 3H), 3,06-2,87 (м, 3H), 2,64 (с, 1H), 2,40-2,28 (м, 1H), 1,14 (д, J=13,7 Гц, 2H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 300
Транс-8-(5-фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 5-фтор-2-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,26 (д, J=75,2 Гц, 1H), 8,13 (д, J=4,3 Гц, 1H), 7,79 (дд, J=19,4, 1,8 Гц, 1H), 7,65 (дт, J=8,0, 2,0 Гц, 1H), 7,34-7,11 (м, 4H), 4,03 (дт, J=10,5, 8,6 Гц, 1H), 3,58 (м, 2H), 3,46-3,29 (м, 2H), 3,25-3,07 (м, 3H), 3,06-2,89 (м, 4H), 2,66-2,29 (м, 1H), 1,15 (дд, J=14,2, 7,1 Гц, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 301
Транс-8-(5-изопропил-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 5-изопропил-2-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,37 (д, J=78,5 Гц, 1H), 8,11 (т, J=4,9 Гц, 1H), 7,75 (д, J=17,6 Гц, 1H), 7,63 (дд, J=7,9, 1,7 Гц, 1H), 7,32-7,18 (м, 2H), 7,14 (д, J=2,2 Гц, 1H), 7,05 (д, J=8,5 Гц, 1H), 4,02 (с, 1H), 3,84-3,67 (м, 4H), 3,60 (д, J=7,2 Гц, 1H), 3,50 (дд, J=20,5, 13,1 Гц, 1H), 3,25-3,07 (м, 2H), 3,06-2,84 (м, 5H), 2,73-2,29 (м, 1H), 1,21 (д, J=6,9 Гц, 6H); MS (ESI+) m/z 365,2 [M+H]+.
Пример 302
Транс-8-(2-метокси-4-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-метокси-4-метилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,21 (д, J=55,4 Гц, 1H), 8,10 (д, J=4,4 Гц, 1H), 7,75 (дд, J=15,6, 1,9 Гц, 1H), 7,62 (д, J=7,9 Гц, 1H), 7,20 (ддд, J=15,9, 10,4, 5,0 Гц, 2H), 7,11 (с, 1H), 7,02 (д, J=8,4 Гц, 1H), 3,85-3,75 (м, 2H), 3,58 (ддд, J=32,4, 20,0, 9,5 Гц, 2H), 3,46-3,27 (м, 2H), 3,25-3,07 (м, 2H), 3,05-2,89 (м, 4H), 2,67-2,33 (м, 1H), 2,30 (д, J=11,6 Гц, 3H), 1,14 (д, J=13,6 Гц, 1H); MS (ESI+) m/z 337,2 [M+H]+.
Пример 303
Транс-8-(2,4-диметоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2,4-диметоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,00-7,92 (м, 1H), 7,88 (д, J=2,0 Гц, 1H), 7,49 (дд, J=7,9, 2,0 Гц, 1H), 7,20 (д, J=8,4 Гц, 1H), 7,16 (д, J=8,0 Гц, 1H), 6,66 (д, J=2,4 Гц, 1H), 6,62 (дд, J=8,4, 2,4 Гц, 1H), 3,80 (с, 3H), 3,76 (д, J=4,5 Гц, 3H), 3,31-2,88 (м, 5H), 2,66 (дд, J=8,3, 5,3 Гц, 2H), 2,40 (с, 3H), 2,31-2,16 (м, 1H); MS (ESI+) m/z 353,1 [M+H]+.
Пример 304
(3aS,10bS)-8-[3-(1-Гидрокси-2-метилпропил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 304A
3-[(3aS,10bS)-2-Метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензальдегид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-формилфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G.
Пример 304B
(3aS,10bS)-8-[3-(1-Гидрокси-2-метилпропил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя изопропилмагний хлорид на метилмагнийбромид и заменяя соединение, полученное в Примере 304A, на соединение, полученное в Примере 185A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,09 (д, J=2,0 Гц, 1H), 8,08-8,02 (м, 1H), 7,72 (дд, J=7,9, 2,0 Гц, 1H), 7,72 (дд, J=7,9, 2,0 Гц, 1H), 7,57 (с, 1H), 7,51 (д, J=7,8 Гц, 1H), 7,40 (т, J=7,6 Гц, 1H), 7,32-7,21 (м, 2H), 3,35-3,23 (м, 3H), 3,20-3,07 (м, 2H), 3,00-2,88 (м, 1H), 2,72-2,58 (м, 2H), 2,38 (д, J=15,6 Гц, 2H), 2,23 (ддд, J=25,6, 15,2, 7,7 Гц, 1H), 1,89-1,80 (м, 2H), 0,87 (т, J=8,3 Гц, 3H), 0,80 (дд, J=14,7, 4,7 Гц, 3H); MS (ESI+) m/z 365,2 [M+H]+.
Пример 305
Транс-8-[(E)-2-циклопропилвинил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя пинаколовый эфир (E)-2-циклопропилвинилбороновой кислоты на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,98-7,93 (м, 1H), 7,75 (д, J=1,9 Гц, 1H), 7,49-7,29 (м, 1H), 7,22-6,95 (м, 1H), 6,50 (т, J=15,3 Гц, 1H), 6,00-5,73 (м, 1H), 3,25-3,14 (м, 2H), 3,15-3,00 (м, 2H), 2,91 (дд, J=10,4, 8,9 Гц, 1H), 2,72-2,55 (м, 2H), 2,39 (с, 2H), 2,16 (кв.д, J=14,6, 7,2 Гц, 1H), 1,90 (с, 1H), 1,65-1,50 (м, 1H), 0,85-0,72 (м, 2H), 0,58-0,46 (м, 2H); MS (ESI+) m/z 283,2 [M+H]+.
Пример 306
(3aS,10bS)-2-Метил-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-инден-1-он на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,13 (д, J=1,9 Гц, 1H), 8,08 (с, 1H), 7,99 (дд, J=8,0, 1,6 Гц, 1H), 7,84 (с, 1H), 7,81 (дд, J=7,9, 2,0 Гц, 1H), 7,70 (д, J=8,0 Гц, 1H), 7,28 (д, J=8,0 Гц, 1H), 3,30-3,19 (м, 4H), 3,19-3,06 (м, 3H), 3,00 (т, J=9,7 Гц, 1H), 2,70 (дт, J=15,9, 7,9 Гц, 3H), 2,43 (с, 3H), 2,25 (дд, J=17,7, 7,2 Гц, 1H); MS (ESI+) m/z 347,2 [M+H]+.
Пример 307
(3aS,10bS)-8-[4-Фтор-3-(1-гидроксиэтил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 307A
2-Фтор-5-[(3aS,10bS)-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензальдегид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4-фтор-3-формилфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G.
Пример 307B
(3aS,10bS)-8-[4-Фтор-3-(1-гидроксиэтил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя соединение, полученное в Примере 307A, на соединение, полученное в Примере 185A 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,14 (т, J=4,5 Гц, 1H), 7,97 (д, J=6,3 Гц, 1H), 7,80 (дд, J=7,4, 5,4 Гц, 1H), 7,78 (с, 1H), 7,60-7,55 (м, 1H), 7,28 (т, J=7,2 Гц, 1H), 7,23 (дд, J=10,2, 8,5 Гц, 1H), 5,41 (т, J=11,2 Гц, 1H), 5,10-4,98 (м, 1H), 4,10 (с, 1H), 3,61-3,43 (м, 3H), 3,29-3,12 (м, 2H), 3,00 (с, 1H), 2,76 (с, 3H), 2,49-2,35 (м, 1H), 1,37 (дт, J=22,7, 11,4 Гц, 3H); MS (ESI+) m/z 355,2 [M+H]+.
Пример 308
(3aR-10bS)-8-Изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 308A
трет-Бутил транс-8-изобутокси-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 146, заменяя 2-метилпропан-1-ол на 3-фторбензиловый спирт, и стадию удаления защитной кислотной группы не осуществляли.
Пример 308B
(3aR-10bS)-8-Изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Соединение, полученное в Примере 308A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 5-50% метанол с 0,1% диэтиламин-CO2 в течение 10 минут, при 3 мл/минута, время удерживания = 2,95 минут) и чистый энантиомер (135 мг, 0,361 ммоль) обрабатывали 1 мл диоксана и 0,6 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,18 (с, 2H), 8,08 (дд, J=6,4, 3,6 Гц, 1H), 7,16 (дд, J=5,5, 2,8 Гц, 2H), 7,06 (дд, J=8,5, 2,7 Гц, 1H), 3,82-3,72 (м, 2H), 3,60 (дд, J=10,4, 6,6 Гц, 1H), 3,42 (ддд, J=19,2, 18,3, 9,4 Гц, 2H), 3,20-3,01 (м, 3H), 2,92 (т, J=11,5 Гц, 1H), 2,26-2,11 (м, 1H), 2,01 (дт, J=13,3, 6,6 Гц, 1H), 0,98 (д, J=6,7 Гц, 6H); MS (ESI+) m/z 275,1 [M+H]+.
Пример 309
(3aS,10bR)-8-Изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Соединение, полученное в Примере 308A, разделяли на чистые энантиомеры с использованием сверхкритической жидкостной хроматографии (ChiralPak® AS, 21×250 мм, 5 мкм, градиент 5-50% метанол с 0,1% диэтиламин-CO2 в течение 10 минут, при 3 мл/минута, время удерживания = 4,80 минут) и чистый энантиомер (135,2 мг, 0,352 ммоль) обрабатывали 1 мл диоксана и 0,6 мл HCl (4н в диоксане). Смесь перемешивали при комнатной температуре в течение ночи, концентрировали и растирали в смеси гексан:этилацетат (1:4) с получением указанного в заголовке соединения в виде гидрохлоридной соли. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,25 (с, 2H), 8,09 (дд, J=6,5, 3,8 Гц, 1H), 7,16 (дд, J=5,6, 2,8 Гц, 2H), 7,06 (дд, J=8,5, 2,7 Гц, 1H), 3,82-3,72 (м, 2H), 3,57 (д, J=6,5 Гц, 1H), 3,53-3,37 (м, 3H), 3,21-3,00 (м, 3H), 2,92 (с, 1H), 2,26-2,12 (м, 1H), 2,01 (дт, J=13,3, 6,6 Гц, 1H), 0,98 (д, J=6,7, 6H); MS (ESI+) m/z 275,1 [M+H]+.
Пример 310
(3aS,10bS)-8-(3-Гидрокси-2,3-дигидро-1H-инден-5-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 310A
(3aS,10bS)-2-Метил-8-(3-оксо-2,3-дигидро-1H-инден-5-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-инден-1-он на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G.
Пример 310B
(3aS,10bS)-8-(3-Гидрокси-2,3-дигидро-1H-инден-5-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 238, заменяя соединение, полученное в Примере 310A, на соединение, полученное в Примере 237. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,14-8,08 (м, 1H), 8,03 (т, J=3,6 Гц, 1H), 7,72-7,67 (м, 1H), 7,60 (д, J=4,4 Гц, 1H), 7,52-7,46 (м, 1H), 7,32 (т, J=7,3 Гц, 1H), 7,27-7,22 (м, 1H), 5,17-5,04 (м, 1H), 3,34-3,21 (м, 3H), 3,21-3,05 (м, 2H), 2,96-2,87 (м, 2H), 2,69 (д, J=0,9 Гц, 1H), 2,69-2,58 (м, 2H), 2,43-2,33 (м, 4H), 2,29-2,16 (м, 1H), 1,91-1,73 (м, 1H); MS (ESI+) m/z 349,2 [M+H]+.
Пример 311
(3aS,10bS)-8-[3-(1-Гидроксипропил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя этилмагнийбромид на метилмагнийбромид и заменяя соединение, полученное в Примере 304A, на соединение, полученное в Примере 185A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,11 (с, 1H), 8,01 (д, J=1,9 Гц, 1H), 7,77 (дд, J=7,9, 2,0 Гц, 1H), 7,61 (с, 1H), 7,53 (д, J=7,8 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,30 (дд, J=14,0, 7,8 Гц, 2H), 5,20 (дд, J=4,5, 1,3 Гц, 1H), 4,53 (дд, J=10,7, 6,1 Гц, 1H), 4,04 (с, 1H), 3,27-3,10 (м, 5H), 3,08-2,87 (м, 3H), 2,71 (с, 3H), 2,38 (с, 1H), 1,66 (p, J=7,2 Гц, 2H), 1,16 (т, J=7,3 Гц, 2H); MS (ESI+) m/z 351,2 [M+H]+.
Пример 312
(3aS,10bS)-8-[3-(1-Гидрокси-3-метилбутил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя изобутилмагний хлорид на метилмагнийбромид и заменяя соединение, полученное в Примере 304A, на соединение, полученное в Примере 185A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,15 (т, J=4,8 Гц, 1H), 7,96 (с, 1H), 7,80 (д, J=8,9 Гц, 1H), 7,63 (с, 1H), 7,53 (д, J=7,7 Гц, 1H), 7,42 (т, J=7,6 Гц, 1H), 7,31 (дд, J=12,1, 7,9 Гц, 2H), 5,16 (дд, J=4,8, 1,4 Гц, 1H), 4,76-4,57 (м, 1H), 3,66 (с, 1H), 3,47 (с, 4H), 3,18 (т, J=4,8 Гц, 3H), 2,87 (с, 3H), 1,78-1,65 (м, 1H), 1,59 (ддд, J=14,1, 8,9, 5,5 Гц, 1H), 1,45-1,33 (м, 1H), 1,18 (т, J=7,3 Гц, 6H); MS (ESI+) m/z 379,2 [M+H]+.
Пример 313
(3aS,10bS)-8-[3-(1-Гидроксибутил)фенил]-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 186, заменяя н-пропилмагнийбромид на метилмагнийбромид и заменяя соединение, полученное в Примере 304A, на соединение, полученное в Примере 185A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,10-8,04 (м, 2H), 7,74 (дд, J=8,0, 2,0 Гц, 1H), 7,60 (с, 1H), 7,51 (д, J=7,8 Гц, 1H), 7,41 (т, J=7,6 Гц, 1H), 7,29 (дд, J=17,3, 7,8 Гц, 2H), 5,18 (дд, J=4,5, 1,0 Гц, 1H), 4,60 (дд, J=11,9, 5,0 Гц, 1H), 3,24 (дд, J=7,1, 3,8 Гц, 3H), 3,20-3,08 (м, 1H), 2,84 (д, J=43,9 Гц, 3H), 2,54 (с, 3H), 2,31 (д, J=14,6 Гц, 1H), 1,71-1,51 (м, 2H), 1,45-1,18 (м, 3H), 1,12 (т, J=7,2 Гц, 2H); MS (ESI+) m/z 365,2 [M+H]+.
Пример 314
Транс-8-(4-фтор-3-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-фтор-3-метилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,21 (д, J=58,8 Гц, 1H), 8,16 (д, J=3,9 Гц, 1H), 7,91 (дд, J=15,6, 2,0 Гц, 1H), 7,84-7,76 (м, 1H), 7,67-7,60 (м, 1H), 7,58-7,50 (м, 1H), 7,33 (д, J=8,0 Гц, 1H), 7,30-7,19 (м, 2H), 4,03 (дд, J=11,4, 6,6 Гц, 1H), 3,84-3,73 (м, 2H), 3,47-3,27 (м, 1H), 3,24-3,05 (м, 1H), 3,04-2,89 (м, 2H), 2,63 (с, 1H), 2,32 (д, J=1,6 Гц, 3H); MS (ESI+) m/z 325,2 [M+H]+.
Пример 315
Транс-8-(4-метокси-3-метилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-метокси-3-метилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,15 (д, J=52,8 Гц, 1H), 8,13 (д, J=4,4 Гц, 1H), 7,88 (дд, J=15,4, 2,0 Гц, 1H), 7,85-7,69 (м, 1H), 7,50 (д, J=6,5 Гц, 2H), 7,26 (дд, J=23,0, 8,0 Гц, 1H), 7,13-6,95 (м, 1H), 4,02 (дт, J=10,5, 8,1 Гц, 1H), 3,83 (с, 3H), 3,77 (дд, J=15,6, 10,2 Гц, 2H), 3,34 (ддд, J=17,8, 15,2, 6,3 Гц, 3H), 3,23-3,06 (м, 2H), 2,97-2,87 (м, 1H), 2,64 (д, J=21,3 Гц, 1H), 2,37-2,26 (м, 1H), 2,22 (с, 3H); MS (ESI+) m/z 337,1 [M+H]+.
Пример 316
Транс-8-(3-фтор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3-фтор-4-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,09 (д, J=54,6 Гц, 1H), 8,15 (с, 1H), 7,90 (дд, J=14,3, 2,1 Гц, 1H), 7,82 (д, J=2,1 Гц, 1H), 7,60 (дд, J=12,9, 2,2 Гц, 1H), 7,51 (д, J=8,5 Гц, 1H), 7,35-7,21 (м, 2H), 4,02 (дд, J=10,7, 5,6 Гц, 1H), 3,89 (с, 3H), 3,78 (с, 2H), 3,35 (д, J=6,8 Гц, 3H), 3,17 (д, J=5,0 Гц, 2H), 2,99 (дд, J=7,9, 5,1 Гц, 1H), 2,67 (с, 1H), 2,33 (с, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 317
Транс-8-(4-метокси-3,5-диметилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-метокси-3,5-диметилфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,15 (д, J=64,4 Гц, 1H), 8,14 (д, J=4,5 Гц, 1H), 7,88 (дд, J=20,0, 2,0 Гц, 1H), 7,77 (тд, J=8,2, 2,0 Гц, 1H), 7,36 (с, 2H), 7,27 (дд, J=28,7, 8,0 Гц, 1H), 4,08-3,98 (м, 1H), 3,79 (дт, J=11,2, 8,9 Гц, 1H), 3,72-3,67 (м, 3H), 3,66-3,57 (м, 2H), 3,41-3,27 (м, 3H), 3,10 (ддд, J=15,1, 7,2, 3,5 Гц, 1H), 2,98-2,89 (м, 2H), 2,68-2,58 (м, 1H), 2,34-2,26 (м, 6H); MS (ESI+) m/z 351,2 [M+H]+.
Пример 318
(3aS,10bS)-8-(6-Метоксипиридин-3-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 6-метоксипиридин-3-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,28-10,02 (м, 1H), 8,55-8,48 (м, 1H), 8,21-8,13 (м, 1H), 8,09-8,00 (м, 1H), 7,95-7,86 (м, 1H), 7,86-7,79 (м, 1H), 7,39-7,24 (м, 1H), 6,98-6,90 (м, 1H), 4,09-3,98 (м, 1H), 3,94-3,87 (м, 1H), 3,57-3,46 (м, 1H), 3,45-3,29 (м, 3H), 3,15 (д, J=0,7, 2H), 3,15-3,07 (м, 1H), 2,97 (с, 3H), 2,93 (дддд, J=12,7, 9,1, 5,3, 1,5 Гц, 1H), 2,70-2,26 (м, 1H); MS (ESI+) m/z 324,2 [M+H]+.
Пример 319
(3aS,10bS)-8-(3-Хлор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-хлор-4-метоксифенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,38-10,12 (м, 1H), 8,19-8,11 (м, 1H), 7,94-7,87 (м, 1H), 7,86-7,79 (м, 1H), 7,80-7,73 (м, 1H), 7,71-7,63 (м, 1H), 7,34-7,23 (м, 2H), 4,09-3,99 (м, 1H), 3,92 (д, J=14,8 Гц, 3H), 3,83-3,75 (м, 1H), 3,57-3,48 (м, 2H), 3,45-3,30 (м, 1H), 3,22-3,07 (м, 1H), 3,04-2,97 (м, 3H), 2,96-2,87 (м, 1H), 2,68-2,26 (м, 1H); MS (ESI+) m/z 357,1 [M+H]+.
Пример 320
Транс-8-(4-фтор-3-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 4-фтор-3-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,14-8,08 (м, 1H), 8,01 (д, J=2,0 Гц, 1H), 7,77 (дд, J=8,0, 2,1 Гц, 1H), 7,39 (дд, J=8,3, 2,1 Гц, 1H), 7,33-7,24 (м, 2H), 7,21 (ддд, J=8,4, 4,3, 2,2 Гц, 1H), 3,94 (д, J=5,6 Гц, 3H), 3,22 (ддд, J=14,2, 6,9, 3,4 Гц, 2H), 3,19-3,10 (м, 2H), 2,97 (д, J=6,9 Гц, 1H), 2,85 (д, J=9,5 Гц, 1H), 2,62 (д, J=16,4 Гц, 3H), 2,38-2,27 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 321
Транс-8-(2,3-дигидро-1-бензофуран-5-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2,3-дигидробензофуран-5-илбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,09-8,03 (м, 1H), 7,96 (д, J=1,7 Гц, 1H), 7,68 (дд, J=8,0, 2,1 Гц, 1H), 7,54 (с, 1H), 7,39 (дд, J=8,3, 1,9 Гц, 1H), 7,22 (д, J=8,1 Гц, 1H), 6,84 (д, J=8,3 Гц, 1H), 4,57 (т, J=8,7 Гц, 2H), 3,29-3,17 (м, 3H), 3,17-3,07 (м, 3H), 2,94 (д, J=7,0 Гц, 1H), 2,83 (т, J=9,2 Гц, 2H), 2,58 (с, 3H), 2,31 (с, 1H); MS (ESI+) m/z 335,2 [M+H]+.
Пример 322
Транс-2-метил-8-(3,4,5-трифторфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 3,4,5-трифторфенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,23-8,17 (м, 1H), 7,99 (д, J=2,0 Гц, 1H), 7,88 (дд, J=8,0, 2,0 Гц, 1H), 7,74 (дд, J=9,2, 6,7 Гц, 2H), 7,32 (д, J=8,1 Гц, 1H), 3,71 (с, 1H), 3,26 (с, 6H), 3,21-3,12 (м, 3H), 2,89 (с, 1H); MS (ESI+) m/z 347,1 [M+H]+.
Пример 323
Транс-8-(2-фтор-5-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-фтор-5-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 10,18 (д, J=67,2 Гц, 1H), 8,22-8,13 (м, 1H), 7,84 (д, J=19,1 Гц, 1H), 7,77-7,67 (м, 1H), 7,30 (ддд, J=19,4, 15,2, 8,5 Гц, 2H), 7,09-6,96 (м, 2H), 4,11-3,98 (м, 1H), 3,87-3,70 (м, 3H), 3,63 (дд, J=18,6, 11,0 Гц, 1H), 3,52 (дд, J=17,8, 8,2 Гц, 1H), 3,25-3,07 (м, 3H), 2,97 (ддд, J=22,9, 13,7, 7,7 Гц, 4H), 2,71-2,30 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 324
Транс-8-(2,3-дигидро-1-бензофуран-6-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-(2,3-дигидробензофуран-6-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,11-8,05 (м, 1H), 7,96 (д, J=2,1 Гц, 1H), 7,72 (дд, J=8,0, 2,1 Гц, 1H), 7,31 (д, J=7,6 Гц, 1H), 7,24 (д, J=8,1 Гц, 1H), 7,12 (дт, J=7,7, 3,9 Гц, 1H), 7,03 (д, J=1,4 Гц, 1H), 4,57 (т, J=8,7 Гц, 2H), 3,28-3,08 (м, 6H), 3,01 (дд, J=15,6, 7,7 Гц, 2H), 2,87 (т, J=9,6 Гц, 1H), 2,64 (с, 3H), 2,33 (с, 1H); MS (ESI+) m/z 335,2 [M+H]+.
Пример 325
(3aS,10bS)-8-(2-Фтор-4-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя 2-фтор-4-метоксифенилбороновую кислоту на 4-фторфенилбороновую кислоту и заменяя соединение, полученное в Примере 199, на соединение, полученное в Примере 53. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,09-8,02 (м, 1H), 7,93 (д, J=1,6 Гц, 1H), 7,62-7,56 (м, 1H), 7,50-7,41 (м, 1H), 7,25 (д, J=8,0 Гц, 1H), 7,00-6,86 (м, 2H), 3,82 (д, J=3,2 Гц, 3H), 3,32-3,21 (м, 4H), 3,17-3,03 (м, 3H), 2,88-2,70 (м, 3H), 2,35-2,23 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 326
(3aS,10bS)-8-(4-Фтор-2-метоксифенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4-фтор-2-метоксифенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и заменяя соединение, полученное в Примере 248A, на соединение, полученное в Примере 227G. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,03 (т, J=3,9 Гц, 1H), 7,85 (д, J=2,0 Гц, 1H), 7,53 (дд, J=7,9, 2,0 Гц, 1H), 7,31 (дд, J=8,4, 6,9 Гц, 1H), 7,20 (д, J=8,0 Гц, 1H), 7,03 (дд, J=11,4, 2,5 Гц, 1H), 6,86 (тд, J=8,4, 2,5 Гц, 1H), 3,78 (с, 3H), 3,25-3,06 (м, 5H), 2,95-2,75 (м, 2H), 2,55 (с, 3H), 2,40-2,24 (м, 1H); MS (ESI+) m/z 341,2 [M+H]+.
Пример 327
Транс-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 327A
трет-Бутил транс-6-метил-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 389B, на соединение, полученное в Примере 46.
Пример 327B
Транс-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 327A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,50 (ушир. с, 2H), 7,41-7,01 (м, 4H), 4,10-3,93 (м, 4H), 3,75-2,91 (м, 7H), 2,11-1,93 (м, 1H), 1,93-1,68 (м, 2H); MS (ESI+) m/z 203,2 [M+H]+.
Пример 328
1-[Транс-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][1]бензазепин-6(1H)-ил]этанон
Пример 328A
трет-Бутил транс-6-ацетил-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 389B (100 мг, 0,347 ммоль) в 1,4 мл тетрагидрофурана, добавляли триэтиламин (0,097 мл, 0,694 ммоль) при комнатной температуре, затем ацетилхлорид (32,7 мг, 0,416 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли дихлорметаном и затем экстрагировали водой. Органический слой концентрировали с получением указанного в заголовке соединения, которое использовали без дополнительной очистки.
Пример 328B
1-[Транс-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][1]бензазепин-6(1H)-ил]этанон
К соединению, полученному в Примере 328A, добавляли 1,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты, и эту смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и очищали с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,10-8,77 (м, 2H), 7,42-7,34 (м, 2H), 7,33-7,25 (м, 2H), 4,59-4,47 (м, 1H), 3,75-3,56 (м, 4H), 3,31-3,17 (м, 2H), 3,00-2,88 (м, 1H), 2,66-2,52 (м, 1H), 2,04-1,90 (м, 2H), 1,79-1,62 (м, 3H); MS (ESI+) m/z 231,1 [M+H]+.
Пример 329
Транс-6-бензил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 329A
трет-Бутил транс-6-бензил-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 389B (100 мг, 0,347 ммоль) в 1,5 мл этанола, добавляли бензальдегид (47,8 мг, 0,451 ммоль), MP-BH3CN (2,19 ммоль/г, 0,48 г, 3 эквивалента) и уксусную кислоту (104 мг, 1,734 ммоль). Реакционную смесь нагревали при температуре 65°C на масляной бане в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и фильтровали, и смолу промывали метанолом. Фильтрат концентрировали и очищали путем флэш-хроматографии на колонке, элюируя с помощью 10-25% этилацетата в гексане. Густое масло выделяли в качестве указанного в заголовке соединения.
Пример 329B
Транс-6-бензил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 329A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,57-9,37 (м, 2H), 7,46-7,38 (м, 2H), 7,34 (кв, J=7,9 Гц, 2H), 7,28-7,22 (м, 1H), 7,21-7,05 (м, 3H), 6,94 (дд, J=9,4, 3,6 Гц, 1H), 4,50-4,39 (м, 1H), 4,33-4,20 (м, 1H), 3,73-3,61 (м, 1H), 3,61-3,38 (м, 4H), 3,23-3,11 (м, 1H), 3,02-2,88 (м, 1H), 2,60-2,52 (м, 1H), 1,94-1,78 (м, 2H), 1,50-1,33 (м, 1H); MS (ESI+) m/z 279,1 [M+H]+.
Пример 330
Транс-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 329A, заменяя формальдегид на бензальдегид и соединение, полученное в Примере 327B, на соединение, полученное в Примере 389B. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,14-9,86 (м, 1H), 7,25-7,18 (м, 1H), 7,09-7,03 (м, 1H), 6,99-6,90 (м, 2H), 3,92-3,82 (м, 1H), 3,48-3,16 (м, 5H), 3,00-2,89 (м, 3H), 2,89-2,81 (м, 3H), 2,58-2,52 (м, 1H), 1,97 (д, J=0,7 Гц, 1H), 1,97-1,82 (м, 1H), 1,74-1,58 (м, 1H); MS (ESI+) m/z 217,2 [M+H]+.
Пример 331
Транс-8-(2,4-дифторфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 75, заменяя пинаколовый эфир 2,4-дифторфенилбороновой кислоты на 4-фторфенилбороновую кислоту. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,29 (т, J=5,9 Гц, 1H), 7,72 (с, 1H), 7,67-7,54 (м, 2H), 7,46-7,33 (м, 2H), 7,20 (тд, J=8,4, 2,3 Гц, 1H), 3,21-2,97 (м, 4H), 2,99-2,88 (м, 1H), 2,83 (дд, J=14,3, 7,0 Гц, 1H), 2,50-2,36 (м, 1H), 2,28 (с, 3H), 2,15 (с, 1H); MS (ESI+) m/z 329,1 [M+H]+.
Пример 332
Цис-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 332A
трет-Бутил 3-(3-бром-2-гидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 281B - примере 281D, заменяя соединение, полученное в Примере 383C в качестве исходного продукта на соединение, полученное в Примере 281B.
Пример 332B
трет-Бутил цис-7-бром-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 332A, на соединение, полученное в Примере 272D. В качестве указанного в заголовке соединения выделяли только цис изомер.
Пример 332C
Цис-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 332B, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,49-9,20 (м, 2H), 7,68-7,51 (м, 1H), 7,37-7,17 (м, 1H), 7,16-7,00 (м, 1H), 4,27-4,16 (м, 1H), 4,02-3,90 (м, 1H), 3,76-3,66 (м, 1H), 3,61-3,51 (м, 1H), 3,49-3,41 (м, 2H), 2,99-2,85 (м, 1H), 2,79-2,65 (м, 1H), 1,81-1,69 (м, 1H), 1,67-1,52 (м, 1H); MS (ESI+) m/z 268,1 [M+H]+.
Пример 333
1-[Транс-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][1]бензазепин-6(1H)-ил]-2-метилпропан-1-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 328A и Примере 328B, заменяя изобутирилхлорид на ацетилхлорид. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,95 (д, J=75,1 Гц, 2H), 7,44-7,32 (м, 3H), 7,33-7,26 (м, 1H), 4,65-4,55 (м, 1H), 3,79-3,66 (м, 1H), 3,65-3,48 (м, 2H), 3,17 (тд, J=11,4, 6,9 Гц, 1H), 2,95 (ддд, J=16,4, 12,0, 4,3 Гц, 1H), 2,56 (дд, J=23,4, 10,8 Гц, 1H), 2,45-2,31 (м, 1H), 2,05-1,89 (м, 2H), 1,64 (дд, J=23,2, 12,1 Гц, 1H), 1,01 (д, J=6,6 Гц, 3H), 0,83 (т, J=10,0 Гц, 3H); MS (ESI+) m/z 259,2 [M+H]+.
Пример 334
Транс-6-[(3,4-дихлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Пример 334A
трет-Бутил транс-5-оксо-6,7,7a,8,10,10a-гексагидропиридо[3,2-c]пирроло[3,4-e]азепин-9(5H)-карбоксилат
Смесь соединения, полученного в Примере 153 (4,2 г, 20,6 ммоль), ди-трет-бутил дикарбоната (4,9 г, 22,7 ммоль) и Na2CO3 (3,3 г, 31,2 ммоль) в 50 мл смеси 1,4-диоксан:H2O (2:1), перемешивали в течение ночи при комнатной температуре. Твердые продукты удаляли путем фильтрации и промывали этилацетатом (50 мл). Фильтрат концентрировали в вакууме с получением липкого твердого продукта. Добавляли воду (50 мл), и остаток экстрагировали этилацетатом (2×50 мл). Объединенные органические экстракты сушили над Na2SO4 и концентрировали в вакууме. Полученный твердый продукт обрабатывали диэтиловым эфиром с получением указанного в заголовке соединения.
Пример 334B
трет-Бутил транс-6,7,7a,8,10,10a-гексагидропиридо[3,2-c]пирроло[3,4-e]азепин-9(5H)-карбоксилат
В 500-миллилитровой 2-горлой колбе в сухом тетрагидрофуране (125 мл) в атмосфере аргона растворяли соединение, полученное в Примере 334A (2,5 г, 8,24 ммоль). Медленно при температуре 0°C добавляли 1 M раствор литийалюминийгидрида в тетрагидрофуране (16,5 мл, 16,5 ммоль). Реакционную смесь перемешивали при температуре 10-20°C в течение 3-4 часов. Медленно и осторожно при температуре 0°C в атмосфере аргона добавляли охлажденную воду (5 мл), затем этилацетат (50 мл). Образовавшийся твердый продукт фильтровали и промывали этилацетатом (50 мл). Фильтрат концентрировали в вакууме, и полученный сырой продукт очищали с помощью флэш-хроматографии, элюируя с помощью 10-20% метанола в этилацетате с получением указанного в заголовке соединения.
Пример 334C
трет-Бутил транс-6-[(3,4-дихлорфенил)сульфонил]-6,7,7a,8,10,10a-гексагидропиридо[3,2-c]пирроло[3,4-e]азепин-9(5H)-карбоксилат
Смесь соединения, полученного в Примере 334B (100 мг, 0,34 ммоль) и триэтиламина (0,097 мл, 0,69 ммоль) в дихлорметане (2 мл), перемешивали при температуре окружающей среды в течение 10 минут. Добавляли 3,4-дихлорбензол-1-сульфонилхлорид (0,52 ммоль, 1,5 эквивалента), и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли 10%-й раствор NaOH (2 мл); дихлорметановый слой отделяли, обрабатывали водой (2 мл) и сушили над Na2SO4. Растворитель удаляли в вакууме с получением указанного в заголовке соединения.
Пример 334D
Транс-6-[(3,4-дихлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Соединение, полученное в Примере 334C, растворяли в дихлорэтане (1 мл)/метанол (несколько капель) и смолу п-толуолсульфоновой кислоты (260 мг, приблизительно 4 эквивалента), а также добавляли каталитическое количество п-толуолсульфоновой кислоты. Реакционную смесь встряхивали в течение 2 дней при комнатной температуре и расход продукта подтверждали данными LCMS. Смолу п-толуолсульфоновой кислоты удаляли путем фильтрации и промывали метанолом (2 мл). Продукт, присоединенный к смоле, высвобождали с использованием 2н раствора NH3 в MeOH. Органические промывки концентрировали в вакууме с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,43 (дд, J=4,9, 1,5 Гц, 1H), 7,75 (с, 1H), 7,60 (дд, J=7,5, 1,5 Гц, 1H), 7,53 (т, J=4,1 Гц, 2H), 7,27 (с, 1H), 7,16 (дд, J=7,5, 5,0 Гц, 1H), 4,79 (д, J=15,4 Гц, 1H), 4,18 (д, J=15,3 Гц, 2H), 3,79 (т, J=10,6 Гц, 1H), 3,55-3,44 (м, 1H), 3,40-3,27 (м, 2H), 3,04 (дд, J=13,4, 11,3 Гц, 1H), 2,76-2,64 (м, 1H), 2,10-1,98 (м, 1H); MS (ESI+) m/z 399 [M+H]+.
Пример 335
Транс-6-{[4-(дифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-(дифторметокси)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,41 (дд, J=4,9, 1,6 Гц, 1H), 7,77-7,68 (м, 2H), 7,58 (дд, J=7,5, 1,6 Гц, 1H), 7,22-7,11 (м, 3H), 4,79 (д, J=15,4 Гц, 1H), 4,25-4,07 (м, 2H), 3,86-3,74 (м, 1H), 3,56-3,45 (м, 1H), 3,40-3,27 (м, 2H), 2,98 (дд, J=13,3, 11,2 Гц, 1H), 2,70 (дд, J=11,0, 9,3 Гц, 1H), 2,06 (ддд, J=21,5, 14,2, 7,9 Гц, 2H); MS (ESI+) m/z 396 [M+H]+.
Пример 336
Транс-6-[(3-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-метоксибензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,35 (с, 1H), 7,70 (д, J=6,2 Гц, 1H), 7,27 (ддд, J=45,9, 34,2, 8,0 Гц, 5H), 4,90-4,80(м, 2H), 4,33-4,15 (м, 2H), 3,80 (т, J=7,6 Гц, 3H), 3,69 (т, J=13,7 Гц, 2H), 3,44 (д, J=6,0 Гц, 2H), 3,15-2,98 (м, 1H), 2,80-2,62 (м, 1H), 2,02 (д, J=29,8 Гц, 1H); MS (ESI+) m/z 360 [M+H]+.
Пример 337
Транс-6-[(3-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-фторбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 7,06 (дд, J=5,0, 1,6 Гц, 1H), 6,42 (дд, J=7,6, 1,6 Гц, 1H), 6,34-6,18 (м, 3H), 6,07 (тдд, J=8,4, 2,5, 1,1 Гц, 1H), 5,95 (дд, J=7,5, 5,0 Гц, 1H), 3,63-3,51 (м, 2H), 3,06-2,87 (м, 2H), 2,41-2,29 (м, 1H), 2,11 (ддд, J=22,3, 13,2, 7,9 Гц, 2H), 1,94 (дд, J=11,3, 8,5 Гц, 1H), 1,80 (дд, J=13,4, 11,2 Гц, 1H), 1,37 (дд, J=11,2, 9,6 Гц, 1H), 0,75-0,59 (м, 1H); MS (ESI+) m/z 348 [M+H]+.
Пример 338
Транс-6-(фенилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя бензолсульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 7,05 (дд, J=5,0, 1,6 Гц, 1H), 6,50-6,44 (м, 2H), 6,43-6,38 (м, 1H), 6,34-6,27 (м, 1H), 6,26-6,19 (м, 2H), 5,94 (дд, J=7,5, 5,0 Гц, 1H), 3,59-3,48 (м, 2H), 3,02-2,86 (м, 2H), 2,32 (дд, J=16,4, 10,1 Гц, 1H), 2,15-2,04 (м, 2H), 1,94 (тд, J=11,5, 5,1 Гц, 1H), 1,76 (дд, J=13,3, 11,2 Гц, 1H), 1,41-1,29 (м, 1H), 0,73-0,60 (м, 1H); MS (ESI+) m/z 330 [M+H]+.
Пример 339
Транс-6-[(5-хлор-2-тиенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 5-хлортиофен-2-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,44 (д, J=4,9 Гц, 1H), 7,59 (д, J=7,5 Гц, 1H), 7,22 (дд, J=4,0, 1,2 Гц, 1H), 7,19-7,12 (м, 1H), 6,87 (дд, J=4,0, 1,3 Гц, 1H), 4,78 (д, J=15,3, 1H), 4,26-4,12 (м, 2H), 3,81 (т, J=10,4 Гц, 1H), 3,57-3,46 (м, 1H), 3,42-3,28 (м, 2H), 3,11-2,96 (м, 1H), 2,71 (т, J=9,9 Гц, 1H), 2,07 (дд, J=22,6, 10,3 Гц, 2H); MS (ESI+) m/z 370 [M+H]+.
Пример 340
Транс-6-[(4-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-хлорбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,36 (дд, J=5,0, 1,5 Гц, 1H), 7,78-7,68 (м, 3H), 7,53 (д, J=8,7 Гц, 2H), 7,24 (дд, J=7,5, 5,0 Гц, 1H), 4,34-4,19 (м, 2H), 3,76 (дд, J=16,8, 10,2 Гц, 1H), 3,56-3,43 (м, 2H), 3,38-3,31 (м, 3H), 3,09 (дд, J=13,4, 11,2 Гц, 1H), 2,81-2,69 (м, 1H), 2,04 (дд, J=17,0, 6,7 Гц, 1H); MS (ESI+) m/z 364 [M+H]+.
Пример 341
Транс-6-[(2-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-метилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,36 (дд, J=5,0, 1,6 Гц, 1H), 7,89 (дд, J=5,6, 2,9 Гц, 1H), 7,53 (ддд, J=15,2, 7,6, 1,4 Гц, 2H), 7,38 (дт, J=7,3, 3,4 Гц, 2H), 7,20 (дд, J=7,5, 5,0 Гц, 1H), 4,75-4,66 (м, 1H), 4,43 (д, J=15,8 Гц, 1H), 4,00 (дд, J=13,9, 2,8 Гц, 1H), 3,78-3,67 (м, 1H), 3,59-3,40 (м, 2H), 3,22 (ддд, J=20,2, 12,5, 9,8 Гц, 2H), 2,71-2,61 (м, 1H), 2,55 (д, J=13,5 Гц, 3H), 2,27-2,12 (м, 1H); MS (ESI+) m/z 344 [M+H]+.
Пример 342
Транс-6-[(3-хлор-2-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-хлор-2-метилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,37 (дд, J=5,0, 1,6 Гц, 1H), 7,87 (д, J=8,0 Гц, 1H), 7,68 (д, J=8,1 Гц, 1H), 7,54 (дд, J=7,6, 1,6 Гц, 1H), 7,38 (т, J=8,0 Гц, 1H), 7,20 (дд, J=7,6, 5,0 Гц, 1H), 4,69 (д, J=15,9 Гц, 1H), 4,47 (д, J=15,8 Гц, 1H), 4,04 (дд, J=13,4, 3,2 Гц, 1H), 3,77 (т, J=10,4 Гц, 1H), 3,64-3,42 (м, 2H), 3,25 (дд, J=16,5, 8,1 Гц, 4H), 2,68 (дт, J=14,1, 7,1 Гц, 1H), 2,57 (с, 3H), 2,30-2,13 (м, 1H); MS (ESI+) m/z 378 [M+H]+.
Пример 343
Транс-6-[(2,5-диметоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2,5-диметоксибензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 7,05 (дд, J=5,0, 1,7 Гц, 1H), 6,32 (дд, J=7,6, 1,6 Гц, 1H), 6,11 (д, J=3,0 Гц, 1H), 5,94-5,80 (м, 3H), 3,53 (дд, J=15,7, 11,7 Гц, 1H), 3,04 (д, J=15,8 Гц, 1H), 2,83 (дд, J=13,5, 3,1 Гц, 1H), 2,55 (с, 3H), 2,55-2,49 (м, 3H), 2,47-2,38 (м, 1H), 2,26-2,12 (м, 2H), 2,09-2,04 (м, 1H), 2,00-1,93 (м, 1H), 1,78 (дд, J=13,5, 11,0 Гц, 1H), 1,46-1,34 (м, 1H), 0,85 (дд, J=10,4, 6,4 Гц, 1H); MS (ESI+) m/z 390 [M+H]+.
Пример 344
Транс-6-[(4-трет-бутилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-трет-бутилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,40 (д, J=4,8 Гц, 1H), 7,65 (д, J=8,4 Гц, 2H), 7,57 (д, J=7,5 Гц, 1H), 7,47 (д, J=8,4 Гц, 2H), 7,12 (дд, J=7,3, 5,1 Гц, 1H), 4,78 (д, J=15,2 Гц, 1H), 4,20 (д, J=10,5 Гц, 1H), 4,07 (д, J=15,2 Гц, 1H), 3,77 (т, J=10,6 Гц, 1H), 3,38-3,23 (м, 2H), 3,02-2,87 (м, 1H), 2,66 (дд, J=21,8, 11,1 Гц, 1H), 2,17-2,02 (м, 1H), 1,92 (с, 2H), 1,33 (с, 9H); MS (ESI+) m/z 386 [M+H]+.
Пример 345
Транс-6-{[3-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-(трифторметил)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,41 (дд, J=4,9, 1,6 Гц, 1H), 7,96-7,86 (м, 2H), 7,78 (д, J=7,8 Гц, 1H), 7,65-7,57 (м, 2H), 7,14 (дд, J=7,5, 5,0 Гц, 1H), 4,84 (д, J=15,5 Гц, 1H), 4,30-4,16 (м, 2H), 3,81-3,69 (м, 1H), 3,53-3,43 (м, 1H), 3,38-3,25 (м, 2H), 3,06 (дд, J=13,6, 11,3 Гц, 1H), 2,76-2,62 (м, 1H), 1,94 (д, J=7,0 Гц, 3H); MS (ESI+) m/z 398 [M+H]+.
Пример 346
Транс-6-[(4-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-метоксибензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,41 (д, J=4,7 Гц, 1H), 7,61 (дд, J=15,1, 8,0 Гц, 3H), 7,14 (дд, J=7,5, 5,0 Гц, 1H), 6,91 (д, J=8,6 Гц, 2H), 4,79 (д, J=15,2 Гц, 1H), 4,17 (дд, J=13,4, 3,4 Гц, 1H), 4,06 (д, J=15,3 Гц, 1H), 3,86 (с, 3H), 3,77 (т, J=10,6 Гц, 1H), 3,48 (дд, J=11,7, 6,5 Гц, 1H), 3,36-3,24 (м, 2H), 2,99-2,87 (м, 1H), 2,74-2,61 (м, 1H), 2,05-1,94 (м, 2H); MS (ESI+) m/z 360 [M+H]+.
Пример 347
Транс-6-{[4-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-(трифторметил)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,34 (дд, J=5,0, 1,6 Гц, 1H), 7,97 (д, J=8,2 Гц, 2H), 7,83 (д, J=8,3 Гц, 2H), 7,69 (дт, J=11,4, 5,7 Гц, 1H), 7,22 (дт, J=15,1, 7,5 Гц, 1H), 4,88-4,77 (м, 2H), 4,42-4,17 (м, 2H), 3,70-3,59 (м, 1H), 3,48-3,35 (м, 2H), 3,25 (дд, J=11,3, 8,5 Гц, 1H), 3,10 (дд, J=13,3, 11,2 Гц, 1H), 2,74-2,60 (м, 1H), 2,08-1,91 (м, 1H); MS (ESI+) m/z 398 [M+H]+.
Пример 348
Транс-6-[(3-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-метилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,41 (дд, J=4,9, 1,5 Гц, 1H), 7,61 (дд, J=7,5, 1,5 Гц, 1H), 7,52 (дд, J=5,7, 2,9 Гц, 1H), 7,46 (с, 1H), 7,38-7,31 (м, 2H), 7,15 (дд, J=7,5, 5,0 Гц, 1H), 4,81 (д, J=15,3 Гц, 1H), 4,24-4,05 (м, 2H), 3,76 (т, J=10,6 Гц, 1H), 3,52-3,42 (м, 1H), 3,36-3,25 (м, 2H), 2,96 (дд, J=13,2, 11,2 Гц, 1H), 2,68 (дд, J=10,8, 9,5 Гц, 1H), 2,37 (с, 3H), 2,06-1,91 (м, 2H); MS (ESI+) m/z 344 [M+H]+.
Пример 349
Транс-6-{[4-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 334C и 334D, заменяя 4-(трифторметокси)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,38 (д, J=3,7 Гц, 1H), 7,87 (д, J=8,7 Гц, 1H), 7,78 (д, J=8,8 Гц, 1H), 7,58 (д, J=6,3 Гц, 1H), 7,30 (д, J=8,2 Гц, 2H), 7,24-7,14 (м, 1H), 4,75 (д, J=15,5 Гц, 1H), 4,22 (д, J=11,0 Гц, 1H), 4,17-3,97 (м, 2H), 3,83 (дд, J=11,6, 6,9 Гц, 1H), 3,64 (дд, J=13,9, 7,0 Гц, 3H), 3,15-3,01 (м, 2H), 2,38-2,23 (м, 1H); MS (ESI+) m/z 414 [M+H]+.
Пример 350
Транс-7-[3-(метилсульфонил)фенил]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 350A
трет-Бутил транс-7-[3-(метилсульфонил)фенил]-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя соединение, полученное в Примере 383G, на соединение, полученное в Примере 227G.
Пример 350B
Транс-7-[3-(метилсульфонил)фенил]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 350A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,38 (с, 2H), 7,97 (т, J=1,6 Гц, 1H), 7,95-7,89 (м, 1H), 7,84-7,77 (м, 1H), 7,73 (т, J=7,8 Гц, 1H), 7,43-7,35 (м, 1H), 7,23 (дд, J=7,8, 5,7 Гц, 2H), 4,36-4,26 (м, 1H), 3,73 (д, J=5,8 Гц, 1H), 3,68-3,49 (м, 3H), 3,44-3,35 (м, 2H), 3,27 (с, 3H), 2,97 (с, 1H), 2,07 (дд, J=23,9, 12,9 Гц, 2H), 1,85 (кв, J=11,4 Гц, 1H); MS (ESI+) m/z 344,1 [M+H]+.
Пример 351
1-{3-[Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанон
Пример 351A
трет-Бутил транс-7-(3-ацетилфенил)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-ацетилфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 383G, на соединение, полученное в Примере 227G.
Пример 351B
1-{3-[транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанон
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 351A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,29 (с, 2H), 8,00 (т, J=1,6 Гц, 1H), 7,98-7,92 (м, 1H), 7,73-7,67 (м, 1H), 7,59 (т, J=7,7 Гц, 1H), 7,35 (дд, J=6,7, 2,5 Гц, 1H), 7,24-7,16 (м, 2H), 4,35-4,25 (м, 1H), 3,74 (дд, J=11,0, 7,0 Гц, 1H), 3,58 (ддд, J=23,5, 21,9, 11,8 Гц, 3H), 3,44-3,36 (м, 1H), 3,03-2,93 (м, 1H), 2,63 (с, 3H), 2,07 (дд, J=21,8, 11,8 Гц, 1H), 1,85 (т, J=11,2, 1H); MS (ESI+) m/z 308,1 [M+H]+.
Пример 352
(3aS,10bS)-8-{4-Фтор-3-[(1S)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Соединение, полученное в Примере 307 (246 мг), растворяли в этаноле (4 мл) и хроматографировали на колонке Chiralpak® AD-H 2×25 см (5-мкм частицы) в смеси гексан-этанол-метанол-диэтиламин = 20:40:40:0,1 при 20 мл/минута и определении при 254 нм, вводя ~20 мг смеси за цикл. Фракции, содержащие первый элюированный пик, концентрировали при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,11-8,04 (м, 2H), 7,78 (дд, J=7,1, 2,4 Гц, 1H), 7,70 (дд, J=8,0, 2,1 Гц, 1H), 7,59-7,53 (м, 1H), 7,29-7,18 (м, 2H), 5,41 (д, J=4,7 Гц, 1H), 5,11-4,96 (м, 1H), 3,33-3,22 (м, 1H), 3,19-3,03 (м, 3H), 2,98-2,87 (м, 1H), 2,71-2,58 (м, 2H), 2,38 (с, 3H), 2,28-2,16 (м, 1H), 1,38 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 355,2 [M+H]+.
Пример 353
(3aS,10bS)-8-{4-Фтор-3-[(1R)-1-гидроксиэтил]фенил}-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Соединение, полученное в Примере 307 (246 мг), растворяли в этаноле (4 мл) и хроматографировали на колонке Chiralpak® AD-H 2×25 см (5-мкм частицы) в смеси гексан-этанол-метанол-диэтиламин = 20:40:40:0,1 при 20 мл/минута и определении при 254 нм, вводя ~20 мг смеси за цикл. Фракции, содержащие второй элюированный пик, концентрировали при пониженном давлении с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,07 (дд, J=13,0, 1,9 Гц, 2H), 7,78 (дд, J=7,1, 2,5 Гц, 1H), 7,70 (дд, J=7,9, 2,2 Гц, 1H), 7,59-7,51 (м, 1H), 7,29-7,18 (м, 2H), 5,41 (д, J=4,6 Гц, 1H), 5,08-4,97 (м, 1H), 3,22-3,06 (м, 3H), 2,92 (т, J=9,5 Гц, 1H), 2,67-2,61 (м, 2H), 2,38 (с, 3H), 2,33-2,15 (м, 1H), 1,38 (д, J=6,4 Гц, 3H); MS (ESI+) m/z 355,2 [M+H]+.
Пример 354
Транс-6-[(2-метоксифенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-метоксибензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,50 (д, J=5,2 Гц, 1H), 8,20 (д, J=7,5 Гц, 1H), 7,80 (дд, J=7,8, 1,5 Гц, 1H), 7,74-7,66 (м, 1H), 7,59-7,51 (м, 1H), 7,14 (д, J=8,3 Гц, 1H), 7,01 (т, J=7,5 Гц, 1H), 4,92-4,69 (м, 5H), 4,45 (д, J=16,2 Гц, 1H), 4,16-3,93 (м, 4H), 3,70-3,56 (м, 1H), 3,24 (д, J=11,0 Гц, 1H), 3,12-2,99 (м, 1H), 2,59 (с, 1H); MS (ESI+) m/z 360 [M+H]+.
Пример 355
2-[Транс-7,7a,8,9,10,10a-гексагидропиридо[3,2-c]пирроло[3,4-e]азепин-6(5H)-илсульфонил]бензонитрил
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-цианобензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,48 (с, 1H), 8,08 (с, 2H), 7,94 (с, 1H), 7,78 (д, J=24,5 Гц, 2H), 7,56 (с, 1H), 5,37 (д, J=20,2 Гц, 2H), 4,68-4,44 (м, 2H), 3,66 (с, 2H), 3,42 (с, 2H), 3,08 (с, 2H), 2,71 (с, 2H); MS (ESI+) m/z 355 [M+H]+.
Пример 356
Транс-6-[(4-метилфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-метилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,45 (д, J=4,9 Гц, 1H), 8,09 (с, 1H), 7,61 (т, J=9,1 Гц, 3H), 7,29 (д, J=8,1 Гц, 2H), 4,28 (д, J=15,8 Гц, 1H), 4,14 (д, J=12,2 Гц, 1H), 4,03-3,78 (м, 3H), 3,58 (дд, J=19,8, 9,0 Гц, 1H), 3,18-2,95 (м, 3H), 2,40 (д, J=20,4 Гц, 1H), 2,33 (с, 3H); MS (ESI+) m/z 344 [M+H]+.
Пример 357
Транс-6-[(4-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 4-фторбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,50 (дд, J=5,3, 1,5 Гц, 1H), 8,05 (дд, J=7,7, 1,4 Гц, 1H), 7,93-7,86 (м, 2H), 7,55 (дд, J=7,6, 5,3 Гц, 1H), 7,35-7,26 (м, 2H), 4,38 (д, J=15,8 Гц, 1H), 4,27 (д, J=10,2 Гц, 1H), 4,09 (т, J=10,3 Гц, 1H), 4,02-3,84 (м, 2H), 3,67 (дт, J=15,0, 7,5 Гц, 1H), 3,50(с, 1H), 3,22 (дд, J=13,6, 11,0 Гц, 2H), 3,10 (т, J=11,4, Гц 1H), 2,43 (т, J=9,3 Гц, 1H); MS (ESI+) m/z 348 [M+H]+.
Пример 358
Транс-6-(2-тиенилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя тиофен-2-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,50-8,44 (м, 1H), 8,10 (д, J=7,7 Гц, 1H), 7,74 (дд, J=5,0, 1,2 Гц, 1H), 7,63-7,54 (м, 2H), 7,08 (дд, J=5,0, 3,8 Гц, 1H), 4,93-4,84 (м, 2H), 4,33 (д, J=15,9 Гц, 1H), 4,18 (д, J=10,6 Гц, 1H), 3,92 (ддд, J=26,0, 17,6, 9,0 Гц, 3H), 3,61 (дд, J=11,9, 8,7 Гц, 1H), 3,24 (д, J=7,0 Гц, 1H), 3,20-3,11 (м, 2H), 3,05 (т, J=11,2 Гц, 1H), 2,43 (с, 1H); MS (ESI+) m/z 336 [M+H]+.
Пример 359
Транс-6-[(3-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 5 3-хлорбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,61 (с, 1H), 8,42 (с, 1H), 7,86 (с, 3H), 7,63 (д, J=29,0 Гц, 2H), 5,47 (с, 1H), 4,52 (с, 1H), 4,14 (д, J=81,1 Гц, 4H), 3,75 (с, 1H), 3,32 (с, 3H), 3,18 (с, 1H), 2,71 (с, 1H); MS (ESI+) m/z 364 [M+H]+.
Пример 360
Транс-6-[(5-бром-2-тиенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 5-бромтиофен-2-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CDCl3) δ м.д. 8,68 (с, 1H), 7,91 (с, 1H), 7,55 (с, 1H), 7,29 (с, 1H), 5,52 (с, 1H), 4,59-4,50 (м, 1H), 4,28 (с, 1H), 4,09 (с, 2H), 3,79 (с, 2H), 3,43-3,25 (м, 4H), 2,77 (с, 1H); MS (ESI+) m/z 414/416 [M+H]+.
Пример 361
Транс-6-[(2-фторфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-фторбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 7,01 (дд, J=5,6, 1,2 Гц, 1H), 6,70 (д, J=7,7 Гц, 1H), 6,34 (тд, J=7,6, 1,6 Гц, 1H), 6,21-6,08 (м, 2H), 5,78 (дт, J=10,7, 8,0 Гц, 2H), 3,42-3,33 (м, 2H), 2,99 (д, J=16,2 Гц, 1H), 2,72-2,37 (м, 4H), 2,13 (дд, J=12,0, 8,9 Гц, 1H), 1,80 (дд, J=13,8, 11,1 Гц, 1H), 1,74 (д, J=5,9 Гц, 1H), 1,57 (т, J=11,1 Гц, 1H), 1,17-1,02 (м, 1H); MS (ESI+) m/z 347 [M+H]+.
Пример 362
Транс-6-[(2-хлорфенил)сульфонил]-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-хлорбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,54 (с, 1H), 8,24 (с, 1H), 8,05 (с, 1H), 7,71 (с, 1H), 7,56 (с, 2H), 7,47 (с, 1H), 5,47-5,33 (м, 2H), 4,72-4,47 (м, 2H), 4,33-3,85 (м, 3H), 3,67 (с, 1H), 3,36 (с, 1H), 3,10 (с, 1H), 2,78 (с, 1H); MS (ESI+) m/z 364 [M+H]+.
Пример 363
Транс-6-(мезитилсульфонил)-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2,4,6-триметилбензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,57 (с, 1H), 8,24 (с, 1H), 7,78 (с, 1H), 6,99 (с, 2H), 5,37 (д, J=19,2 Гц, 1H), 4,59 (с, 1H), 4,24 (с, 1H), 4,03 (с, 3H), 3,80 (с, 1H), 3,65 (с, 1H), 3,09 (с, 1H), 2,88 (с, 1H), 2,48 (с, 6H), 2,24 (с, 3H); MS (ESI+) m/z 372 [M+H]+.
Пример 364
Транс-6-{[2-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-(трифторметокси)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,64 (с, 1H), 8,35 (с, 1H), 8,09 (с, 1H), 7,82 (д, J=17,8 Гц, 2H), 7,58 (д, J=6,1 Гц, 2H), 5,47 (д, J=17,8 Гц, 1H), 4,67 (с, 1H), 4,37-3,95 (м, 3H), 3,75 (с, 1H), 3,47 (с, 1H), 3,34 (д, J=15,2 Гц, 3H), 3,18 (с, 1H), 2,79 (с, 1H); MS (ESI+) m/z 414 [M+H]+.
Пример 365
Транс-6-{[2-(трифторметил)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 2-(трифторметил)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 7,04 (дд, J=5,6, 1,3 Гц, 1H), 6,74 (дд, J=7,8, 1,2 Гц, 1H), 6,61-6,55 (м, 1H), 6,41 (дд, J=8,3, 6,0 Гц, 1H), 6,32-6,26 (м, 2H), 6,22 (дд, J=7,7, 5,7 Гц, 1H), 3,14 (д, J=16,3 Гц, 1H), 2,73-2,40 (м, 4H), 2,14 (дд, J=12,0, 9,0 Гц, 1H), 1,95 (дд, J=14,1, 11,0 Гц, 1H), 1,75 (с, 1H), 1,64-1,53 (м, 1H), 1,25-1,10 (м, 1H); MS (ESI+) m/z 397 [M+H]+.
Пример 366
Транс-6-{[3-(трифторметокси)фенил]сульфонил}-5,6,7,7a,8,9,10,10a-октагидропиридо[3,2-c]пирроло[3,4-e]азепин
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примере 334C и Примере 334D, заменяя 3-(трифторметокси)бензол-1-сульфонилхлорид на 3,4-дихлорбензол-1-сульфонилхлорид. 1H ЯМР (400 МГц, CD3OD) δ м.д. 8,57 (с, 1H), 8,34 (с, 1H), 7,72 (т, J=60,4, 5H), 4,50 (с, 1H), 4,12 (д, J=87,0, 5H), 3,65 (д, J=51,0, 1H), 3,15 (с, 2H), 2,69 (с, 1H), 1,38-1,12 (м, 1H); MS (ESI+) m/z 414 [M+H]+.
Пример 367
1-{3-[Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанол
Пример 367A
трет-Бутил транс-7-[3-(1-гидроксиэтил)фенил]-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя (R)-1-(3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)этанол на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 399A, на соединение, полученное в Примере 227G.
Пример 367B
1-{3-[Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]фенил}этанол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 367A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,16 (с, 2H), 7,50-7,24 (м, 6H), 7,24-7,07 (м, 2H), 5,26-5,12 (м, 1H), 4,88-4,69 (м, 1H), 4,29 (д, J=12,2 Гц, 1H), 4,03 (кв, J=7,1 Гц, 1H), 3,73 (дд, J=11,0, 7,0 Гц, 1H), 3,65-3,49 (м, 5H), 2,97 (т, J=10,9 Гц, 1H), 2,07 (т, J=11,8 Гц, 2H), 1,83 (д, J=10,3 Гц, 1H), 1,36 (дд, J=6,4, 1,6 Гц, 3H); MS (ESI+) m/z 310,1 [M+H]+.
Пример 368
Транс-7-(пиридин-3-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 368A
трет-Бутил транс-7-(пиридин-3-ил)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя пиридин-3-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 399A, на соединение, полученное в Примере 227G.
Пример 368B
Транс-7-(пиридин-3-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 368A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,57 (с, 2H), 8,95 (с, 1H), 8,85 (д, J=5,2 Гц, 1H), 8,53 (д, J=8,1 Гц, 1H), 8,02 (дд, J=8,0, 5,5 Гц, 1H), 7,54-7,45 (м, 1H), 7,39-7,21 (м, 2H), 4,38-4,27 (м, 1H), 3,52-3,33 (м, 4H), 3,05-2,91 (м, 2H), 2,09 (дд, J=20,2, 10,8 Гц, 3H), 1,88 (дд, J=19,8, 8,5 Гц, 1H); MS (ESI+) m/z 267,1 [M+H]+.
Пример 369
Транс-7-(пиридин-4-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 369A
трет-Бутил транс-7-(пиридин-4-ил)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя пиридин-4-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 399A, на соединение, полученное в Примере 227G.
Пример 369B
Транс-7-(пиридин-4-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 369A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,41 (д, J=3,4 Гц, 2H), 8,90-8,84 (м, 2H), 8,00-7,94 (м, 2H), 7,50 (дд, J=7,4, 1,8 Гц, 1H), 7,38-7,26 (м, 2H), 4,40-4,04 (м, 1H), 3,78-3,47 (м, 4H), 3,05-2,93 (м, 3H), 2,15-2,04 (м, 2H), 1,90-1,84 (м, 1H); MS (ESI+) m/z 267,2 [M+H]+.
Пример 370
Транс-2-метил-7-(пиридин-3-ил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 68, заменяя формальдегид на метил 3-формилбензоат и соединение, полученное в Примере 368B, на соединение, полученное в Примере 2. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,31 (с, 1H), 8,81 (с, 1H), 8,71 (дд, J=5,1, 1,3 Гц, 1H), 8,19 (дд, J=8,0, 1,6 Гц, 1H), 7,75 (дд, J=8,0, 5,1 Гц, 1H), 7,43 (дд, J=7,8, 4,4 Гц, 1H), 7,30-7,22 (м, 1H), 7,18 (д, J=7,2 Гц, 1H), 4,31 (д, J=12,0 Гц, 1H), 4,16-3,95 (м, 2H), 3,93-3,71 (м, 1H), 3,69-3,55 (м, 2H), 3,54-3,36 (м, 1H), 3,03-2,93 (м, 3H), 2,38-2,25 (м, 1H), 2,07 (д, J=14,2 Гц, 1H), 1,90 (дд, J=12,8, 8,8 Гц, 1H); MS (ESI+) m/z 281,2 [M+H]+.
Пример 371
4-[Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]-N-метилбензамид
Пример 371A
трет-Бутил транс-7-[4-(метилкарбамоил)фенил]-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4-(метилкарбамоил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 399A, на соединение, полученное в Примере 227G.
Пример 371B
4-[Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-7-ил]-N-метилбензамид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 371A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (с, 2H), 8,48 (д, J=4,5 Гц, 1H), 7,96-7,83 (м, 2H), 7,58-7,47 (м, 2H), 7,32 (дд, J=6,7, 2,6 Гц, 1H), 7,26-7,13 (м, 2H), 4,37-4,22 (м, 1H), 3,73 (дд, J=10,9, 7,0 Гц, 1H), 3,56 (дт, J=18,6, 11,7 Гц, 3H), 3,37 (дд, J=15,9, 8,6 Гц, 2H), 2,97 (т, J=10,6 Гц, 1H), 2,81 (д, J=4,5 Гц, 3H), 2,07 (т, J=11,3 Гц, 2H), 1,85 (т, J=11,1 Гц, 1H); MS (ESI+) m/z 323,1 [M+H]+.
Пример 372
Транс-7-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 372A
трет-Бутил транс-7-метокси-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способами, описанными в Примерах 272A-272E, заменяя 2-гидрокси-3-метоксибензальдегид на 2-гидрокси-6-метоксибензальдегид. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,88 (дд, J=22,0, 8,5 Гц, 1H), 6,78-6,67 (м, 1H), 6,61-6,45 (м, 1H), 4,39-4,22 (дт, J=11, 4 Гц, 1H), 3,88-3,75 (м, 2H), 3,78-3,65 (с, 3H), 3,62-3,50 (м, 2H), 3,23-3,08 (м, 1H), 3,00 (дд, J=23,6, 10,4 Гц, 1H), 1,98 (т, J=14,8 Гц, 2H), 1,87-1,70 (м, 1H), 1,45-1,35 (с, 9H); MS (ESI+) m/z 320,1 [M+H]+.
Пример 372B
Транс-7-метокси-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 372A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,20 (с, 2H), 6,95 (д, J=8,7 Гц, 1H), 6,77 (дд, J=8,7, 2,9 Гц, 1H), 6,62 (д, J=2,8 Гц, 1H), 4,41-4,32 (м, 1H), 3,72 (с, 3H), 3,64-3,50 (м, 2H), 3,51-3,39 (м, 2H), 3,28 (дд, J=11,3, 4,4 Гц, 1H), 3,03-2,89 (м, 1H), 2,10-1,92 (м, 2H), 1,80 (дд, J=13,7, 3,6 Гц, 1H); MS (ESI+) m/z 220,1 [M+H]+.
Пример 373
Транс-8-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 373A
трет-Бутил транс-8-метил-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примерах 272A-272E, заменяя 2-гидрокси-4-метилбензальдегид на 2-гидрокси-6-метоксибензальдегид. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 6,90 (д, J=12,6 Гц, 1H), 6,85 (д, J=7,8 Гц, 1H), 6,80 (с, 1H), 4,35 (дт, J=12,0, 3,0 Гц, 1H), 3,80 (дд, J=10,0, 7,0 Гц, 1H), 3,68-3,56 (м, 1H), 3,57-3,37 (м, 3H), 3,20-3,07 (м, 1H), 3,01 (с, 1H), 2,23 (с, 3H), 1,95-1,69 (м, 2H), 1,43 (с, 9H); MS (ESI+) m/z 304,1 [M+H]+.
Пример 373B
Транс-8-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 373A, на соединение, полученное в Примере 46B. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,22 (с, 2H), 6,98 (д, J=7,8 Гц, 1H), 6,89 (д, J=7,8 Гц, 1H), 6,84 (с, 1H), 4,38 (дт, J=12,3, 3,5 Гц, 1H), 3,76-3,65 (м, 1H), 3,59-3,49 (м, 3H), 3,29-3,16 (м, 1H), 2,93 (т, J=10,4 Гц, 1H), 2,25 (с, 3H), 2,14-2,03 (м, 1H), 2,02-1,72 (м, 2H); MS (ESI+) m/z 204,1 [M+H]+.
Пример 374
Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-10-ол
Пример 374A
трет-Бутил транс-10-гидрокси-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Смесь соединения, полученного в Примере 272E (2,0 г, 6,3 ммоль), и пиридин-HBr (8,0 г, 50 ммоль) нагревали при температуре 135°C в течение 72 часов. Смесь охлаждали до комнатной температуры, добавляли воду и добавляли насыщенный NaHCO3(водный) для установления pH равным 7. Добавляли ди-трет-бутил дикарбонат (3,0 г, 13,8 ммоль) и смесь перемешивали в течение 16 часов. Реакционную смесь экстрагировали этилацетатом, сушили и концентрировали. Смесь очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексана и этилацетата (5:1) с получением смеси Примера 374A и трет-бутил транс-10-[(трет-бутоксикарбонил)окси]-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилата, побочного продукта. Смесь растворяли в метаноле (10 мл) и добавляли метоксид натрия (25%, 1,5 мл). Смесь нагревали при температуре 50°C в течение 1 часа, добавляли 1н HCl (водн.) для установления pH равным 2 и смесь экстрагировали этилацетатом. Сырое вещество обрабатывали ацетоном, выпавший осадок собирали с получением указанного в заголовке соединения.
Пример 374B
Транс-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол-10-ол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 374A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,75 (с, 1H), 9,01 (с, 2H), 6,94 (т, J=8,0 Гц, 1H), 6,56 (дд, J=8,1, 1,2 Гц, 1H), 6,40 (дд, J=8,0, 1,2 Гц, 1H), 4,09 (ддд, J=12,9, 8,1, 5,1 Гц, 1H), 3,98 (м, 2H), 3,44 (дд, J=11,4, 7,9 Гц, 1H), 2,80 (м, 1H), 2,35 (д, J=20,0 Гц, 1H), 2,22 (ддт, J=10,3, 7,9, 5,2 Гц, 1H), 1,69 (м, 1H); MS (ESI+) m/z 206 [M+H]+.
Пример 375
Транс-7-хлор-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 375A
трет-Бутил транс-7-хлор-6-метил-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 392A (64 мг, 0,2 ммоль), в метанольном буфере с pH4 (1 мл) добавляли формальдегид (30 мг, 37%, 0,3 ммоль) и NaBH3CN (20 мг, 0,3 ммоль). Смесь перемешивали в течение 30 минут и распределяли между этилацетатом и 1н NaOH (водн.). Органический экстракт сушили, концентрировали и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения.
Пример 375B
Транс-7-хлор-6-метил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 375A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,37 (м, 2H), 7,33 (м, 1H), 7,07 (м, 2H), 3,75 (м, 1H), 3,36 (м, 4H), 2,99 (м, 1H), 2,88 (м, 1H), 2,84 (с, 3H), 2,01 (м, 1H), 1,91 (м, 1H), 1,78 (м, 1H); MS (ESI+) m/z 237/239 (3:1) [M+H]+.
Пример 376
Транс-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 376A
2-(4-(трет-Бутилдиметилсилилокси)бутокси)-3-хлорбензальдегид
К 3-хлор-2-гидроксибензальдегиду (313 мг, 2 ммоль) в тетрагидрофуране (4 мл) добавляли 4-(трет-бутилдиметилсилилокси)бутан-1-ол (409 мг, 2 ммоль), трифенилфосфин (524 мг, 2 ммоль) и (E)-ди-трет-бутил диазен-1,2-дикарбоксилат (460 мг, 2 ммоль). Смесь перемешивали в течение 20 минут и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения (170 мг; 25%).
Пример 376B
(E)-4-(2-Хлор-6-(2-нитровинил)фенокси)бутан-1-ол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 280A, заменяя соединение, полученное в Примере 376A на 2-гидрокси-4-метоксибензилальдегид.
Пример 376C
(E)-4-(2-Хлор-6-(2-нитровинил)фенокси)бутаналь
К соединению, полученному в Примере 376B (130 мг, 0,48 ммоль) в CH2Cl2 (1 мл), добавляли перйодинан Десс-Мартина (203 мг, 0,48 ммоль). Смесь перемешивали в течение 2 часов и очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения.
Пример 376D
9-Хлор-5-(нитрометил)-2,3,4,5-тетрагидробензо[b]оксепин-4-карбальдегид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 280B, заменяя соединение, полученное в Примере 376D, на соединение, полученное в Примере 280A и 4-бензилоксибутиральдегид.
Пример 376E
трет-Бутил транс-7-хлор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 376D, на соединение, полученное в Примере 272B. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (4:1) с получением указанного в заголовке соединения с более коротким временем удерживания по сравнению с Примером 295A.
Пример 376F
Транс-7-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 376E, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,42 (с, 2H), 7,42 (м, 1H), 7,13 (м, 2H), 4,50 (ддд, J=12,2, 3,8, 2,9 Гц, 1H), 3,70 (дд, J=10,6, 6,7 Гц, 1H), 3,54 (ддд, J=12,9, 6,3, 1,7 Гц, 2H), 3,45 (дд, J=22,0, 11,2 Гц, 2H), 2,95 (дт, J=8,0, 6,8 Гц, 1H), 2,11 (м, 1H), 2,00 (м, 1H), 1,89 (м, 1H); MS (ESI+) m/z 224/226 (3:1) [M+H]+.
Пример 377
Транс-10-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 377A
(E)-3-Бром-2-(2-нитровинил)фенол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260A, заменяя 2-гидрокси-6-бромбензальдегид на 2-хлорникотинальдегиду.
Пример 377B
Метил 4-(2-бром-6-гидроксифенил)-3-формил-5-нитропентаноат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260B, заменяя соединение, полученное в Примере 377A, на соединение, полученное в Примере 260A и метил 4-оксобутаноат на 4-(трет-бутилдиметилсилилокси)бутаналь.
Пример 377C
Транс-трет-бутил 3-(2-бром-6-гидроксифенил)-4-(2-метокси-2-оксоэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 377B, на соединение, полученное в Примере 272B.
Пример 377D
Транс-трет-бутил 3-(2-бром-6-гидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272D, заменяя соединение, полученное в Примере 377C, на соединение, полученное в Примере 272C.
Пример 377E
трет-Бутил транс-10-бром-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 377D, на соединение, полученное в Примере 272D.
Пример 377F
Транс-10-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 377E, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,19 (с, 2H), 7,34 (дд, J=7,9, 1,3 Гц, 1H), 7,11 (т, J=8,0 Гц, 1H), 6,97 (дд, J=8,1, 1,3 Гц, 1H), 4,36 (м, 2H), 3,96 (ддд, J=12,1, 10,6, 6,3 Гц, 1H), 3,53 (м, 1H), 3,48 (м, 1H), 3,06 (м, 1H), 2,91 (м, 1H), 2,70 (м, 1H), 2,31 (м, 1H), 1,75 (м, 1H); MS (ESI+) m/z 268/270 (1:1) [M+H]+.
Пример 378
Транс-8-(3-изопропилфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 378A
трет-Бутил транс-8-(3-изопропилфенил)-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(изопропил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 378B
Транс-8-(3-изопропилфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 378A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,34 (с, 2H), 8,18 (дд, J=6,5, 3,8 Гц, 1H), 7,88 (д, J=2,0 Гц, 1H), 7,80 (дд, J=8,0, 2,0 Гц, 1H), 7,52 (с, 1H), 7,47 (м, 1H), 7,40 (т, J=7,6 Гц, 1H), 7,36 (д, J=8,0 Гц, 1H), 7,28 (д, J=7,6 Гц, 1H), 3,66 (дд, J=10,4, 6,7 Гц, 1H), 3,56 (м, 1H), 3,46 (дд, J=10,8, 7,6 Гц, 1H), 3,24 (м, 2H), 3,13 (м, 2H), 2,98 (м, 2H), 2,29 (м, 1H), 1,26 (д, J=6,9 Гц, 6H); MS (ESI+) m/z 321 [M+H]+.
Пример 379
Транс-8-(3-изопропилфенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 378, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,07 (д, J=2,1 Гц, 1H), 8,04 (с, 1H), 7,72 (дд, J=7,9, 2,1 Гц, 1H), 7,49 (с, 1H), 7,44 (дд, J=5,4, 4,0 Гц, 1H), 7,39 (т, J=7,6 Гц, 1H), 7,25 (дд, J=7,7, 4,3 Гц, 2H), 3,26 (м, 2H), 3,21 (м, 2H), 2,95 (м, 2H), 2,64 (м, 2H), 2,38 (с, 3H), 2,22 (м, 1H), 1,25 (д, J=6,9 Гц, 6H); MS (ESI+) m/z 335 [M+H]+.
Пример 380
Транс-2-(2-фторэтил)-8-изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 380A
2-Фторацетальдегид
К 2-фторэтанолу (64 мг, 1 ммоль) в CH2Cl2 (1 мл) добавляли перйодинан Десс-Мартина (424 мг, 1 ммоль). Смесь перемешивали в течение ночи, и нерастворимые вещества отфильтровывали, и в Примере 380B использовали маточную жидкость.
Пример 380B
Транс-2-(2-фторэтил)-8-изобутокси-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Маточную жидкость, содержащую Пример 380A, добавляли в метанольный буфер (3 мл, pH 4), затем добавляли Пример 166 (51 мг, 0,2 ммоль) и NaBH3CN (12 мг, 0,2 ммоль). Смесь перемешивали в течение 30 минут, разбавляли этилацетатом и промывали 1н NaOH (водн.). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью метанола и этилацетата (1:10) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,96 (м, 1H), 7,31 (д, J=2,7 Гц, 1H), 7,06 (м, 1H), 6,99 (дд, J=8,4, 2,7 Гц, 1H), 4,53 (м, 2H), 3,73 (т, J=7,8 Гц, 2H), 3,18 (м, 2H), 3,03 (м, 3H), 2,95-2,75 (м, 3H), 2,68 (м, 1H), 2,22 (м, 1H), 1,98 (м, 1H), 0,97 (д, J=6,7 Гц, 6H); MS (ESI+) m/z 321 [M+H]+.
Пример 381
N-Метил-3-[транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензамид
Пример 381A
трет-Бутил транс-8-[3-(метилкарбамоил)фенил]-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 3-(метиламинокарбонил)фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 381B
N-Метил-3-[ Транс-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензамид
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 381A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,49 (с, 2H), 8,65 (д, J=4,5 Гц, 1H), 8,21 (дд, J=6,4, 3,7 Гц, 1H), 8,15 (с, 1H), 8,00 (д, J=1,9 Гц, 1H), 7,86 (м, 3H), 7,57 (т, J=7,7 Гц, 1H), 7,40 (д, J=8,0 Гц, 1H), 3,69 (м, 1H), 3,48 (м, 1H), 3,34-2,94 (м, 5H), 2,82 (д, J=4,4 Гц, 3H), 2,29 (тд, J=12,4, 6,8 Гц, 1H); MS (ESI+) m/z 336 [M+H]+.
Пример 382
N-Метил-3-[Транс-2-метил-6-оксо-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][2]бензазепин-8-ил]бензамид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 381, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,60 (м, 1H), 8,17 (д, J=2,0 Гц, 1H), 8,11 (с, 1H), 8,07 (м, 1H), 7,82 (м, 3H), 7,56 (т, J=7,7 Гц, 1H), 7,29 (д, J=8,0 Гц, 1H), 3,27 (м, 2H), 3,14 (м, 1H), 3,10 (м, 1H), 2,94 (м, 1H), 2,81 (д, J=4,5 Гц, 3H), 2,65 (м, 2H), 2,39 (с, 3H), 2,24 (м, 1H); MS (ESI+) m/z 350 [M+H]+.
Пример 383
Транс-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 383A
3-Бром-2-(метоксиметокси)бензальдегид
К 3-бром-2-гидроксибензальдегиду (1,33 г, 6,6 ммоль) в CH2Cl2 (10 мл) при температуре 0°C добавляли триэтиламин (0,81 г, 8 ммоль), затем хлорметил метиловый эфир (0,56 г, 7 ммоль). Смесь перемешивали в течение 45 минут и распределяли между CH2Cl2 и насыщенным NaHCO3 (водн.). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения.
Пример 383B
(E)-1-Бром-2-(метоксиметокси)-3-(2-нитровинил)бензол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260A, заменяя соединение, полученное в Примере 383A на 2-хлорникотинальдегид.
Пример 383C
(E)-2-Бром-6-(2-нитровинил)фенол
К суспензии соединения, полученного в Примере 383B в метаноле (15 мл), добавляли 4н HCl в диоксане (1 мл). Смесь перемешивали в течение 4 часов, концентрировали и разбавляли водой. Образовавшиеся осадки собирали с получением указанного в заголовке соединения.
Пример 383D
Метил 4-(3-бром-2-гидроксифенил)-3-формил-5-нитропентаноат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260B, заменяя соединение, полученное в Примере 383C, на соединение, полученное в Примере 260A и метил 4-оксобутаноат на 4-(трет-бутилдиметилсилилокси)бутаналь.
Пример 383E
Транс-трет-бутил 3-(3-бром-2-гидроксифенил)-4-(2-метокси-2-оксоэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 383D, на соединение, полученное в Примере 272B.
Пример 383F
Транс-трет-бутил 3-(3-бром-2-гидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272D, заменяя соединение, полученное в Примере 383E, на соединение, полученное в Примере 272C.
Пример 383G
трет-Бутил транс-7-бром-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 383F, на соединение, полученное в Примере 272D.
Пример 383H
Транс-7-бром-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 383G, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,39 (с, 2H), 7,55 (д, J=7,9 Гц, 1H), 7,14 (д, J=7,6 Гц, 1H), 7,03 (т, J=7,8 Гц, 1H), 4,49 (м, 1H), 3,69 (м, 1H), 3,60-3,48 (м, 4H), 2,95 (м, 1H), 2,10 (м, 1H), 2,00 (м, 1H), 1,90 (м, 1H); MS (ESI+) m/z 268/270 (1:1) [M+H]+.
Пример 384
Транс-2-(2-фторэтил)-8-(4-фторфенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 380B, заменяя соединение, полученное в Примере 219, на соединение, полученное в Примере 166. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,07 (м, 1H), 8,02 (д, J=2,1 Гц, 1H), 7,71 (м, 3H), 7,28 (м, 3H), 4,54 (дт, J=47,7, 5,0 Гц, 2H), 3,24 (м, 4H), 3,08 (м, 2H), 2,92 (м, 2H), 2,76 (ддд, J=27,8, 18,2, 9,5 Гц, 2H), 2,21 (м, 1H); MS (ESI+) m/z 343 [M+H]+.
Пример 385
Транс-8-(2-хлор-3-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 385A
трет-Бутил транс-6-оксо-8-(3-тиенил)-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя тиофен-3-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 385B
трет-Бутил транс-8-(2-хлор-3-тиенил)-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 385A (175 мг, 0,46 ммоль) в N,N-диметилформамиде (1 мл) добавляли N-хлорсукцинимид (67 мг, 0,5 ммоль). Смесь нагревали при температуре 80°C в течение 1 часа и распределяли между этилацетатом и водой. Этилацетатный слой концентрировали, и образовавшийся осадок собирали с получением указанного в заголовке соединения.
Пример 385C
Транс-8-(2-хлор-3-тиенил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 385B, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,33 (м, 2H), 8,20 (м, 1H), 7,86 (д, J=1,9 Гц, 1H), 7,74 (дд, J=7,9, 1,9 Гц, 1H), 7,59 (д, J=5,8 Гц, 1H), 7,39 (д, J=8,0 Гц, 1H), 7,28 (д, J=5,8 Гц, 1H), 3,65 (м, 1H), 3,56 (м, 1H), 3,45 (м, 1H), 3,25 (м, 2H), 3,14 (м, 2H), 2,97 (м, 1H), 2,32 (м, 1H); MS (ESI+) m/z 319/321 (3:1) [M+H]+.
Пример 386
Транс-8-(3-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он и
Транс-8-(5-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 386A
трет-Бутил транс-8-[1-(трет-бутоксикарбонил)-1H-пиррол-2-ил]-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 1-(трет-бутоксикарбонил)-1H-пиррол-2-илбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту
Пример 386B
трет-Бутил транс-8-[1-(трет-бутоксикарбонил)-3-хлор-1H-пиррол-2-ил]-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат и
трет-Бутил транс-8-[1-(трет-бутоксикарбонил)-5-хлор-1H-пиррол-2-ил]-6-оксо-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 385B, заменяя соединение, полученное в Примере 386A, на соединение, полученное в Примере 385A.
Пример 386C
Транс-8-(3-хлор-1H-пиррол-2-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он и
Транс-8-(5-хлор-1H-пиррол-2-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 386B, на соединение, полученное в Примере 46A.
Пример 386D
Транс-8-(3-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он и
Транс-8-(5-хлор-1H-пиррол-2-ил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 386C, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,97 (с, 1H), 8,05 (т, J=2,5 Гц, 1H), 8,00 (м, 1H), 7,66 (дд, J=8,0, 2,1 Гц, 1H), 7,14 (дд, J=8,0, 5,1 Гц, 1H), 6,50 (дд, J=3,4, 2,9 Гц, 1H), 6,06 (дд, J=3,6, 2,2 Гц, 1H), 3,22 (м, 2H), 3,10 (м, 2H), 2,92 (дд, J=10,3, 9,0 Гц, 1H), 2,64 (м, 2H), 2,38 (с, 3H), 2,13 (м, 1H); MS (ESI+) m/z 316/318 (3:1) [M+H]+.
Пример 387
Транс-8-(2-хлор-3-тиенил)-2-метил-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 385, на соединение, полученное в Примере 46. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,06 (д, J=2,0 Гц, 1H), 8,03 (м, 1H), 7,65 (дд, J=7,9, 2,1 Гц, 1H), 7,57 (д, J=5,8 Гц, 1H), 7,27 (д, J=8,1 Гц, 1H), 7,24 (д, J=5,8 Гц, 1H), 3,27 (м, 2H), 3,12 (м, 2H), 2,92 (м, 1H), 2,64 (м, 2H), 2,38 (с, 3H), 2,24 (м, 1H); MS (ESI+) m/z 333/335 (3:1) [M+H]+.
Пример 388
(3aS,10bS)-2-Метил-8-(пиридин-2-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Смесь соединения, полученного в Примере 199 (125 мг, 0,5 ммоль), K2CO3 (346 мг, 2,5 ммоль), ацетат меди(II) (45 мг, 0,25 ммоль), 2-пиридил MIDA борат (176 мг, 0,75 ммоль), трис(дибензилиленацетон)дипалладий(0) (46 мг, 0,05 ммоль) и 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (X-phos, 96 мг, 0,2 ммоль) в N,N-диметилформамиде (4 мл) нагревали при температуре 100°C в течение 2 часов. Реакционную смесь охлаждали, разбавляли этилацетатом и промывали водой. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой (0,1% трифторуксусную кислоту (водн.):ацетонитрил) с получением указанного в заголовке соединения. 1H ЯМР (300 МГц, ДМСО-d6) δ м.д. 10,46 (с, 0,5H), 10,31 (с, 0,5H), 8,69 (д, J=4,3 Гц, 1H), 8,40 (дд, J=11,9, 1,5 Гц, 1H), 8,24 (м, 1H), 8,15 (д, J=4,0 Гц, 1H), 8,02 (д, J=8,0 Гц, 1H), 7,91 (тд, J=7,8, 1,7 Гц, 1H), 7,36 (м, 2H), 4,07 (м, 1H), 3,52 (м, 1H), 3,37 (м, 2H), 3,17 (м, 1H), 2,97 (м, 1H), 2,66 (м, 1H), 2,54 (с, 3H), 2,32 (м, 1H); MS (ESI+) m/z 294 [M+H]+.
Пример 389
Транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 389A
Транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Соединение, полученное в Примере 254 (13,30 г, 47,8 ммоль), и 20% Pd(OH)2 (2,68 г, 19,1 ммоль) в EtOH (230 мл) помещали в атмосферу H2 (30 фунтов на квадратный дюйм), и реакционную смесь перемешивали при температуре 55°C в течение ночи. После охлаждения до комнатной температуры смесь фильтровали через слой диатомовой земли и промывали метанолом (3×150 мл). Фильтрат концентрировали в вакууме с получением указанного в заголовке соединения.
Пример 389B
трет-Бутил транс-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
Соединение, полученное в Примере 389A (9,0 г, 47,8 ммоль), растворяли в CHCl3 (150 мл) и добавляли по каплям раствор ди-трет-бутил дикарбоната (10,43 г, 47,8 ммоль) в CHCl3 (100 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После упаривания в вакууме полученный сырой продукт очищали с помощью флэш-хроматографии, элюируя с помощью 20%-го этилацетата в н-гексане с получением указанного в заголовке соединения.
Пример 389C
Транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 389B, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,54 (с, 2H), 7,58 (с, 1H), 7,36 (с, 2H), 7,26 (д, J=7,0 Гц, 1H), 3,75 (м, 2H), 3,65 (м, 3H), 2,92 (м, 2H), 2,18 (м, 1H), 2,04 (м, 2H); MS (ESI+) m/z 189 [M+H]+.
Пример 390
Транс-2-метил-8-(4-оксо-3,4-дигидро-2H-хромен-6-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Пример 390A
трет-Бутил транс-6-оксо-8-(4-оксо-4H-хромен-6-ил)-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4H-хромен-4-он на 3-(метилсульфонил)фенилбороновую кислоту.
Пример 390B
трет-Бутил транс-6-оксо-8-(4-оксо-3,4-дигидро-2H-хромен-6-ил)-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][2]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 390A (150 мг, 0,34 ммоль) в тетрагидрофуране (20 мл) добавляли никель Ренея® 2800 (750 мг, 12,78 ммоль, взвесь в воде) в 50-миллилитровом сосуде для работы под давлением и смесь перемешивали под давлением 30 фунтов на квадратный дюйм водорода при комнатной температуре в течение 2 часов. Смесь фильтровали через нейлоновую мембрану и концентрировали с получением указанного в заголовке соединения
Пример 390C
Транс-8-(4-оксо-3,4-дигидро-2H-хромен-6-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 390B, на соединение, полученное в Примере 46A.
Пример 390D
Транс-2-метил-8-(4-оксо-3,4-дигидро-2H-хромен-6-ил)-2,3,3a,4,5,10b-гексагидропирроло[3,4-d][2]бензазепин-6(1H)-он
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 390C, на соединение, полученное в Примере 46. Сырое вещество очищали с помощью ВЭЖХ с обращенной фазой (0,1% трифторуксусную кислоту (водн.):ацетонитрил) с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 10,15 (с, 0,5H), 10,03 (с, 0,5H), 8,16 (с, 1H), 8,00 (д, J=2,4 Гц, 1H), 7,91 (м, 2H), 7,82 (т, J=8,0 Гц, 1H), 7,33 (д, J=8,0 Гц, 0,5H), 7,27 (д, J=8,0 Гц, 0,5H), 7,17 (д, J=8,7 Гц, 1H), 4,60 (т, J=6,4 Гц, 2H), 4,02 (м, 1H), 3,72 (м, 1H), 3,61 (м, 0,5H), 3,52 (м, 0,5H), 3,17 (м, 2H), 3,00 (м, 2H), 2,85 (м, 2H), 2,67 (с, 0,5H), 2,33 (с, 0,5H); MS (ESI+) m/z 363 [M+H]+.
Пример 391
Транс-9-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 391A
трет-Бутил транс-9-хлор-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К раствору соединения, полученного в Примере 389B (172 мг, 0,60 ммоль) в N,N-диметилформамиде (1 мл), добавляли N-хлорсукцинимид (80 мг, 0,60 ммоль). Смесь нагревали при температуре 50°C в течение 2 часов и очищали с помощью ВЭЖХ с обращенной фазой (0,1% трифторуксусная кислота (водн.):ацетонитрил) с получением указанного в заголовке соединения с более коротким временем удерживания, чем Пример 392A.
Пример 391B
Транс-9-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
К соединению, полученному в Примере 391A (80 мг, 0,36 ммоль) в CH2Cl2 (1 мл) добавляли трифторуксусную кислоту (1 мл). Смесь перемешивали в течение ночи и концентрировали с получением указанного в заголовке соединения в виде соли трифторуксусной кислоты. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 8,99 (с, 1H), 8,92 (с, 1H), 7,13 (дд, J=8,4, 2,3 Гц, 1H), 7,01 (д, J=1,9 Гц, 1H), 6,95 (д, J=8,5 Гц, 1H), 3,73 (м, 1H), 3,57 (м, 1H), 3,49 (ддд, J=14,7, 9,4, 5,7 Гц, 1H), 3,32 (дт, J=13,3, 4,0 Гц, 1H), 3,06 (тд, J=11,5, 6,9 Гц, 1H), 2,94 (ддд, J=16,4, 12,0, 4,6 Гц, 1H), 2,56 (ддд, J=11,1, 7,6, 2,2 Гц, 1H), 1,91 (м, 1H), 1,48 (квд, J=11,3, 3,5 Гц, 1H); MS (ESI+) m/z 223/225 (3:1) [M+H]+.
Пример 392
Транс-7-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 392A
трет-Бутил транс-7-хлор-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К раствору соединения, полученного в Примере 389B (172 мг, 0,60 ммоль) в N,N-диметилформамиде (1 мл), добавляли N-хлорсукцинимид (80 мг, 0,60 ммоль). Смесь нагревали при температуре 50°C в течение 2 часов и очищали с помощью ВЭЖХ с обращенной фазой (0,1% трифторуксусная кислота (водн.):ацетонитрил) с получением указанного в заголовке соединения с более длительным временем удерживания, чем Пример 391A..
Пример 392B
Транс-хлор-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде соли трифторуксусной кислоты в соответствии со способом, описанным в Примере 391B, заменяя соединение, полученное в Примере 392A, на соединение, полученное в Примере 391A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,41 (с, 2H), 7,28 (д, J=7,7 Гц, 1H), 6,99 (д, J=7,7 Гц, 1H), 6,83 (т, J=7,8 Гц, 1H), 3,68 (м, 1H), 3,55 (м, 2H), 3,41 (м, 1H), 3,18 (м, 1H), 2,95 (м, 1H), 2,60 (м, 1H), 1,99 (м, 2H), 1,50 (м, 1H); MS (ESI+) m/z 223/225 (1 :1) [M+H]+.
Пример 393
Цис-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 393A
3-Бром-5-хлор-2-(метоксиметокси)бензальдегид
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 383A, заменяя 3-бром-5-хлор-2-гидроксибензальдегид на 3-бром-2-гидроксибензальдегид.
Пример 393B
(E)-1-Бром-5-хлор-2-(метоксиметокси)-3-(2-нитровинил)бензол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260A, заменяя соединение, полученное в Примере 393A, на 2-хлорникотинальдегид.
Пример 393C
(E)-2-Бром-4-хлор-6-(2-нитровинил)фенол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 383C, заменяя соединение, полученное в Примере 393B, на соединение, полученное в Примере 383B.
Пример 393D
3-(3-Бром-5-хлор-2-гидроксифенил)-2-(2-(трет-бутилдиметилсилилокси)этил)-4-нитробутаналь
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 280B, заменяя соединение, полученное в Примере 393C, на соединение, полученное в Примере 280A и 4-(трет-бутилдиметилсилилокси)бутаналь на 4-бензилоксибутиральдегид.
Пример 393E
трет-Бутил 3-(3-бром-5-хлор-2-гидроксифенил)-4-(2-(трет-бутилдиметилсилилокси)этил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 393D, на соединение, полученное в Примере 272B.
Пример 393F
(трет-Бутил 3-(3-бром-5-хлор-2-гидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260D, заменяя соединение, полученное в Примере 393E, на соединение, полученное в Примере 260C.
Пример 393G
трет-Бутил цис-7-бром-9-хлор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 393F, на соединение, полученное в Примере 272D. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения с более длительным временем удерживания, чем Пример 394A.
Пример 393H
Цис-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 393G, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,55 (с, 2H), 7,71 (д, J=2,4 Гц, 1H), 7,40 (д, J=2,4 Гц, 1H), 4,19 (м, 1H), 3,99 (ддд, J=11,2, 9,3, 4,1 Гц, 1H), 3,74 (кв, J=8,4 Гц, 1H), 3,55 (м, 1H), 3,41 (м, 1H), 3,33 (м, 1H), 2,87 (м, 1H), 2,74 (м, 1H), 1,76 (м, 1H), 1,19 (м, 1H); MS (ESI+) m/z 302/304/306 (3:4:1) [M+H]+.
Пример 394
Транс-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 394A
трет-Бутил транс-7-бром-9-хлор-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 393F, на соединение, полученное в Примере 272D. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (5:1) с получением указанного в заголовке соединения с более коротким временем удерживания, чем Пример 393G.
Пример 394B
Транс-7-бром-9-хлор-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 394A, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,30 (с, 2H), 7,71 (д, J=2,4 Гц, 1H), 7,23 (д, J=2,3 Гц, 1H), 4,49 (дт, J=12,1, 3,2 Гц, 1H), 3,69 (дд, J=11,0, 7,0 Гц, 1H), 3,54 (дд, J=11,1, 9,2 Гц, 2H), 3,48 (м, 1H), 3,40 (м, 1H), 2,95 (м, 1H), 2,10 (д, J=12,1 Гц, 1H), 2,03 (м, 1H), 1,89 (ддд, J=25,3, 11,6, 3,9 Гц, 1H); MS (ESI+) m/z 302/304/306 (3:4:1) [M+H]+.
Пример 395
Транс-9-хлор-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин (3:1 двух диастеремеров
Пример 395A
Транс-9-хлор-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 391, на соединение, полученное в Примере 46 и 2 эквивалента формальдегида на 1 эквивалент Примера 391.
Пример 395B
Транс-9-хлор-2,6-диметил-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 395A обрабатывали HCl в диоксане (4н). Реакционную смесь перемешивали в течение 5 минут и концентрировали с получением указанного в заголовке соединения в виде HCl соли (3:1 смесь двух диастеремеров, обусловленных хиральностью протонированной пирролидин амино группы). 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,29 (м, 1H), 11,06 (м, 0,3H), 7,26 (м, 1,3H), 7,15 (м, 0,3H), 7,08 (м, 1,3H), 7,00 (м, 1H), 4,02 (м, 0,7H), 3,80 (м, 2H), 3,50 (м, 0,7H), 3,37 (м, 3H), 3,22 (м, 1,3H), 2,87 (с, 1H), 2,86 (с, 1H), 2,85 (с, 3H), 2,84 (с, 3H), 2,07 (м, 1H), 1,91 (м, 1,8H), 1,81-1,58 (м, 1,3H); MS (ESI+) m/z 251/253 (3:1) [M+H]+.
Пример 396
Транс-9-бром-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 396A
трет-Бутил транс-9-бром-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 391A, заменяя N-бромсукцинимид на N-хлорсукцинимид.
Пример 396B
Транс-9-бром-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 396A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,24 (с, 2H), 7,35 (д, J=8,0 Гц, 1H), 7,20 (с, 1H), 7,09 (с, 1H), 3,73 (м, 1H), 3,25 (м, 2H), 2,93 (м, 1H), 2,65 (м, 1H), 2,05 (д, J=13,2 Гц, 1H), 1,95 (м, 1H), 1,65 (м, 1H); MS (ESI+) m/z 267/269 (1:1) [M+H]+.
Пример 397
Транс-7-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 397A
трет-Бутил транс-7-фенил-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя фенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и соединение, полученное в Примере 383G, на соединение, полученное в Примере 227G.
Пример 397B
Транс-фенил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 397A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,33 (с, 2H), 7,42 (м, 4H), 7,35 (м, 1H), 7,27 (дд, J=7,1, 2,0 Гц, 1H), 7,16 (м, 2H), 4,27 (дд, J=12,1, 2,9 Гц, 1H), 3,72 (дт, J=11,6, 5,9 Гц, 1H), 3,59 (м, 1H), 3,52 (м, 2H), 2,97 (т, J=10,8 Гц, 1H), 2,07 (м, 2H), 1,83 (м, 1H); MS (ESI+) m/z 266 [M+H]+.
Пример 398
Транс-7-[(4-фторбензил)окси]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 398A
(E)-3-(2-Нитровинил)бензол-1,2-diol
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 280A, заменяя 2,3-дигидроксибензилальдегид на 2-гидрокси-4-метоксибензилальдегид.
Пример 398B
2-(2-(трет-Бутилдиметилсилилокси)этил)-3-(2,3-дигидроксифенил)-4-нитробутаналь
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 280B, заменяя соединение, полученное в Примере 398A, на соединение, полученное в Примере 280A и 4-(трет-бутилдиметилсилилокси)бутаналь на 4-бензилоксибутиральдегид.
Пример 398C
Транс-трет-бутил 3-(2-(трет-бутилдиметилсилилокси)этил)-4-(2,3-дигидроксифенил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272C, заменяя соединение, полученное в Примере 398B, на соединение, полученное в Примере 272B.
Пример 398D
Транс-трет-бутил 3-(2,3-дигидроксифенил)-4-(2-гидроксиэтил)пирролидин-1-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 260D, заменяя соединение, полученное в Примере 398C, на соединение, полученное в Примере 260C.
Пример 398E
трет-Бутил транс-7-гидрокси-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 272E, заменяя соединение, полученное в Примере 398D, на соединение, полученное в Примере 272D.
Пример 398F
трет-Бутил транс-7-[(4-фторбензил)окси]-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 118, заменяя соединение, полученное в Примере 398E, на соединение, полученное в Примере 117, и 4-фторбензиловый спирт на (S)-1-фенилпропан-2-ол.
Пример 398G
Транс-7-[(4-фторбензил)окси]-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 398F, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 9,38 (с, 2H), 7,48 (м, 2H), 7,21 (м, 2H), 7,02 (м, 2H), 6,70 (д, J=6,5 Гц, 1H), 4,43 (д, J=11,6 Гц, 1H), 3,44 (м, 1H), 3,33 (м, 1H), 2,94 (с, 2H), 2,08 (д, J=13,8 Гц, 1H), 1,98 (м, 1H), 1,84 (м, 1H); MS (ESI+) m/z 314 [M+H]+.
Пример 399
Транс-7-(4-фторфенил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Пример 399A
трет-Бутил транс-7-{[(трифторметил)сульфонил]окси}-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227G, заменяя соединение, полученное в Примере 398E, на соединение, полученное в Примере 227F.
Пример 399B
трет-Бутил транс-7-(4-фторфенил)-1,3,3a,4,5,10b-гексагидро-2H-[1]бензоксепино[4,5-c]пиррол-2-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4-фторфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и Пример 399A, на соединение, полученное в Примере 227G.
Пример 399C
Транс-7-(4-фторфенил)-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 399B, на соединение, полученное в Примере 46A. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 9,41 (с, 2H), 7,47 (м, 2H), 7,27 (м, 3H), 7,15 (м, 2H), 4,26 (м, 1H), 3,72 (дд, J=11,0, 7,0 Гц, 1H), 3,55 (м, 3H), 3,38 (м, 1H), 2,97 (м, 1H), 2,03 (м, 2H), 1,82 (м, 1H); MS (ESI+) m/z 284 [M+H]+.
Пример 400
Транс-7-(4-фторфенил)-2-метил-2,3,3a,4,5,10b-гексагидро-1H-[1]бензоксепино[4,5-c]пиррол
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 53, заменяя соединение, полученное в Примере 399, на соединение, полученное в Примере 46. 1H ЯМР (500 МГц, ДМСО-d6) δ м.д. 7,45 (м, 2H), 7,23 (м, 2H), 7,19 (м, 1H), 7,10 (м, 2H), 4,24 (дт, J=11,8, 3,0 Гц, 1H), 3,50 (т, J=11,5 Гц, 1H), 3,27 (ддд, J=11,4, 7,3, 2,3 Гц, 1H), 3,05 (дд, J=8,6, 6,4 Гц, 1H), 2,85 (дд, J=10,2, 8,8 Гц, 1H), 2,68 (т, J=9,0 Гц, 1H), 2,63 (дд, J=9,2, 6,7 Гц, 1H), 2,35 (с, 3H), 1,90 (м, 2H); MS (ESI+) m/z 298 [M+H]+.
Пример 401
Транс-7-(4-фторфенил)-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Пример 401A
трет-Бутил транс-9-йод-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 389B (144 мг, 0,5 ммоль) в диоксане (1 мл) и пиридин (0,2 мл) добавляли I2 (254 мг, 1 ммоль). Смесь перемешивали в течение 2 часов, разбавляли этилацетатом и промывали 1н HCl (водн.). Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (2:1) с получением указанного в заголовке соединения.
Пример 401B
трет-Бутил транс-7-бром-9-йод-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 391A, заменяя соединение, полученное в Примере 401A соединение, полученное в Примере 389A, и N-бромсукцинимид на N-хлорсукцинимид.
Пример 401C
трет-Бутил транс-7-бром-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
К соединению, полученному в Примере 401B (110 мг, 0,22 ммоль) в тетрагидрофуране (0,5 мл) добавляли изопропилмагний хлорид (0,2 мл, 2 н тетрагидрофуран, 0,4 ммоль) при температуре -78°C. Смесь перемешивали при температуре -78°C в течение 1 часа и затем при комнатной температуре в течение 1 часа. Реакционную смесь затем гасили метанолом и насыщенным NH4Cl (водн.). Смесь экстрагировали этилацетатом. Органические экстракты концентрировали и сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (2:1) с получением указанного в заголовке соединения с 50% Примера 401B.
Пример 401D
трет-Бутил транс-7-(4-фторфенил)-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2(1H)-карбоксилат
Указанное в заголовке соединение получали в соответствии со способом, описанным в Примере 227H, заменяя 4-фторфенилбороновую кислоту на 3-(метилсульфонил)фенилбороновую кислоту и Пример 401C, на соединение, полученное в Примере 227G.
Пример 401E
Транс-7-(4-фторфенил)-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 401D, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,95 (с, 2H), 7,32 (м, 4H), 7,05 (м, 2H), 6,93 (т, J=7,6 Гц, 1H), 3,57 (м, 3H), 3,33 (м, 1H), 3,15 (м, 1H), 2,98 (м, 1H), 2,58 (т, J=11,5 Гц, 1H), 1,98 (м, 2H), 1,48 (м, 1H); MS (ESI+) m/z 284 [M+H]+.
Пример 402
Метил транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин-7-карбоксилат
Пример 402A
2-трет-Бутил 7-метил транс-3,3a,4,5,6,10b-гексагидропирроло[3,4-d][1]бензазепин-2,7(1H)-дикарбоксилат
К соединению, полученному в Примере 392A (110 мг, 0,34 ммоль) в смеси метанол/N,N-диметилформамид (1:1, 10 мл) добавляли [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II) (5,0 мг, 6,8 мкмоль), и смесь перемешивали в течение 16 часов под давлением 60 фунтов на квадратный дюйм моноксида углерода при температуре 110°C. Сырое вещество очищали с помощью колоночной хроматографии на силикагеле, элюируя смесью гексанов и этилацетата (1:1) с получением указанного в заголовке соединения.
Пример 402B
Метил транс-1,2,3,3a,4,5,6,10b-октагидропирроло[3,4-d][1]бензазепин-7-карбоксилат
Указанное в заголовке соединение получали в виде гидрохлоридной соли в соответствии со способом, описанным в Примере 46B, заменяя соединение, полученное в Примере 402A, на соединение, полученное в Примере 46A. 1H ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,92 (с, 2H), 7,77 (д, J=7,9 Гц, 1H), 7,57 (с, 1H), 7,25 (д, J=7,5 Гц, 1H), 6,84 (т, J=7,8 Гц, 1H), 3,82 (с, 3H), 3,51 (м, 2H), 3,42 (м, 1H), 3,22 (м, 1H), 2,99 (м, 1H), 2,76 (м, 1H), 2,10 (м, 2H), 1,51 (м, 1H); MS (ESI+) m/z 247 [M+H]+.
Понятно, что приведенное выше подробное описание и сопровождающие примеры являются только иллюстративными и не должны рассматриваться как ограничивающие объем изобретения, который определяется исключительно формулой изобретения и ее эквивалентами. Различные изменения и модификации раскрытых вариантов осуществления будут очевидны специалистам в данной области. Такие изменения и модификации, включая, без ограничения, связанные с химическими структурами, заместителями, производными, промежуточными продуктами, синтезами, препаратами и/или способами использования изобретения, могут быть осуществлены без отступления от сущности и объема изобретения.