Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2-ФЕНИЛ-3-АЛКИЛХИНОЛИНОВ
Вид РИД
Изобретение
Изобретение относится к области органической химии, в частности к способу получения замещенных хинолинов.
Хинолин и его производные - важный класс азотгетероциклов. Хинолиновый фрагмент входит в состав многих природных соединений и лекарственных препаратов [1. Balasubramanian M., Keay J.G. In Comprehensive Heterocyclic Chemistry II; 2. Katriztky A.R., Rees C.W., Scriven E.F.V., Eds., Pergamon Press: Oxford, 1996, 5, 245-265]. В частности, 2-арилхинолины используются для синтеза антималярийных и противоопухолевых препаратов [Atwell G.J., Baguley В.С, Denny W.A. // J. Med. Chem., 1989, 32, 396-401; Vu A.T., Cohn S.T., Manas E.S., Harris H.A. Mewshaw R.E. // Bioorg. Med. Chem. Lett 2005, 15, 4520-4525].
2-Фенилхинолин получают арилированием непосредственно самого хинолина или 2-хлорхинолина с помощью ZnPh2, MgPh2 или PhB(OH)2 в присутствии металлокомплексных катализаторов [Yang J. Liu S., Zheng J.-F., Zhou J. // E.J. Org. Chem., 2012 (31), 6248-6259; Tobisu M., Hyodo I., Chatani N. // J. Am. Chem. Soc., 2009, 131 (34), 12070-12071; Iglesias M.J., Prieto A., Nicasio M.C. // Org. Lett., 2012, 14, 4318-4321; Hyodo I., Tobisu M., Chatani N. // Chem.As. J., 2012, 7(6), 1357-1365; Vuoti S., Autio J., Laitila M., Haukka M., Pursiainen J.// Eur. J. Inorg. Chem. 2008 (3), 397-407]
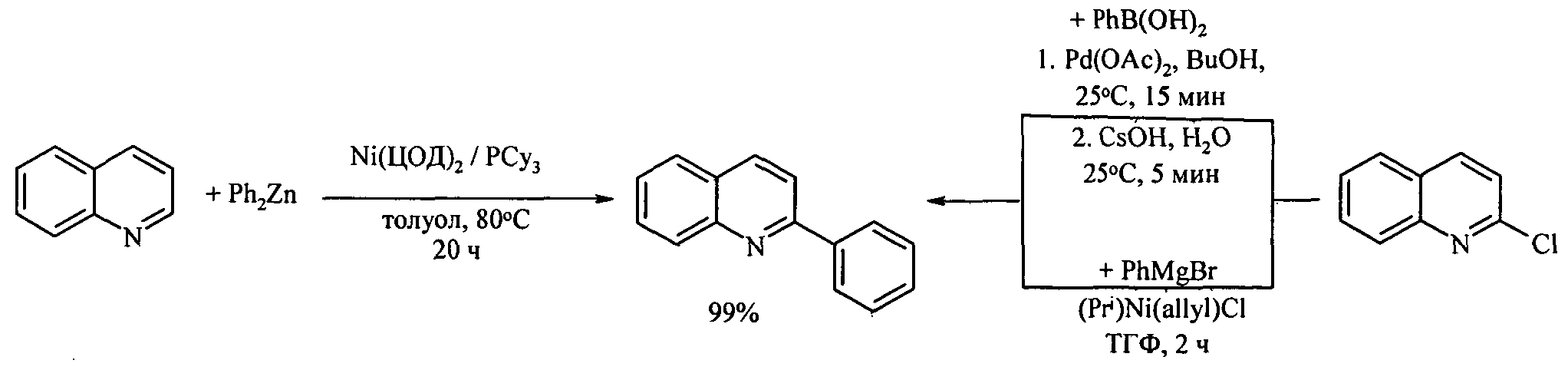
Недостатки методов:
1. Необходимость применения дорогостоящих катализаторов на основе никеля и палладия.
2. Использование труднодоступных исходных реагентов - 2-хлорхинолина и CsOH.
3. Пожароопасность из-за применения реактива Гриньяра.
В ряде работ 2-фенилхинолин синтензируют по Фридлендеру - циклоконденсацией о-нитробензальдегида с ацетофеноном в условиях кислотного или основного катализа[Li А.-Н., Beard DJ., Coate H., Honda A, Kadalbajoo M., Kleinberg A., Laufer R., Mulvihill K.M., Nigro A., Rastogi P., Sherman D., Siu K.W., Steinig A.G., Wang Т., Wemer D., Crew A.P., Mulvihill MJ. // Synthesis, 2010, 10, 1678-1686; Li А.-Н., Ahmed E., Chen X., Cox M., Crew A.P., Dong H.-Q., Jin M., Ma L., Panicker В., Sm K.W., Steinig A.Q., Stolz K.M., Tavares P.A.R., Volk В., Weng Q., Wemer D., Mulvihill M.J. Org. Biomol. Chem., 2007, 5 (1), 61-64],
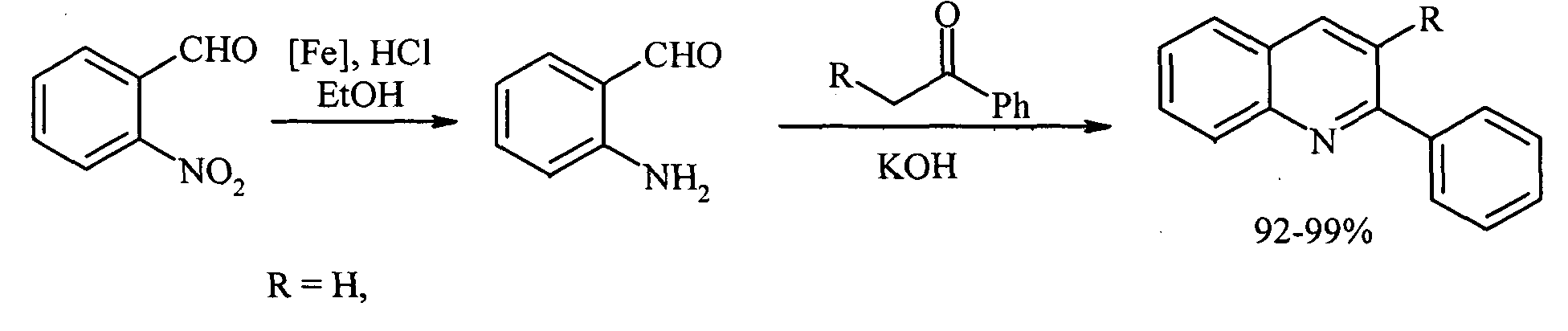
Недостатки метода:
1. Склонность о-аминобензальдегида к самоконденсации.
2. Труднодоступность о-аминобензальдегида.
3. Ограниченный набор заместителей, которые могут быть введены в 3 положение молекулы хинолина.
4. Использование в качестве катализаторов сильных оснований приводит к снижению выхода целевых продуктов.
5. Кетоны для конденсации должны иметь симметричное строение, так как в противном случае образуется трудноразделимая смесь продуктов.
В работах [Mierde H.V., Van Der Voort P., De Vos D., Verpoort F. // E. J. Org. Chem., 2008, (9), 1625-1631; Mierde H.V., Ledoux N., Allaert В., Van Der Voort P., Drozdzak R., De Vos D., Verpoort F. // New J. Chem. 2007, 31(9), 1572-1574; Martmez R., Ramon D.J., Yus M. // Tetrahedron, 2006, 62(38), 8982-8987] осуществлен синтез 2-фенилхинолина и его производных взаимодействием о-аминобензилового спирта с ацетофеноном под действием рутениевых катализаторов.
Недостатки метода:
1. Высокая стоимость рутенийсодержащего катализатора.
2. Труднодоступность о-аминобензилового спирта.

Другой метод синтеза производных 2-фенилхинолина основан на конденсации анилинов с бензальдегидами и акриловой кислотой под действием палладиевого катализатора [Ji X., Huang H., Li Y., Chen H., Jiang Н. // Angew. Chem., Int. Ed., 2012, 51(29), 7292-7296].
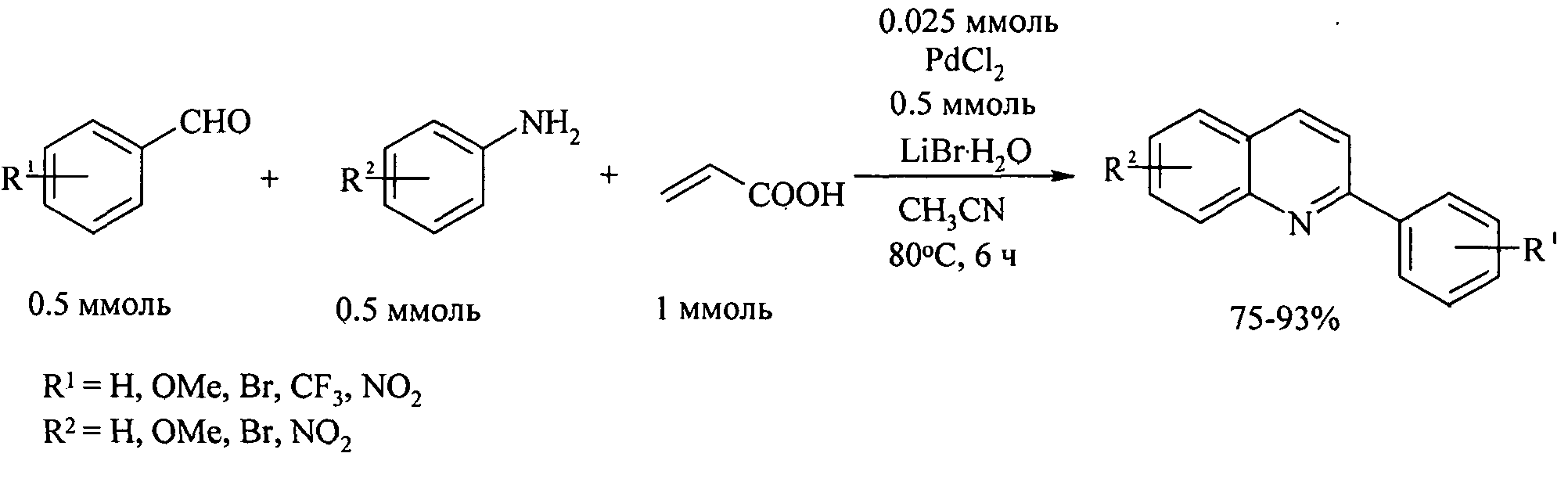
Недостатки метода:
1. Применение дорогостоящего палладиевого катализатора.
2. Необходимость использования в качестве исходного соединения склонной к полимеризации акриловой кислоты.
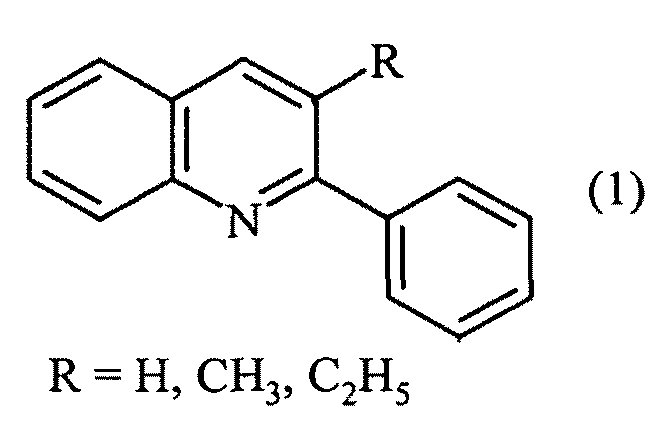
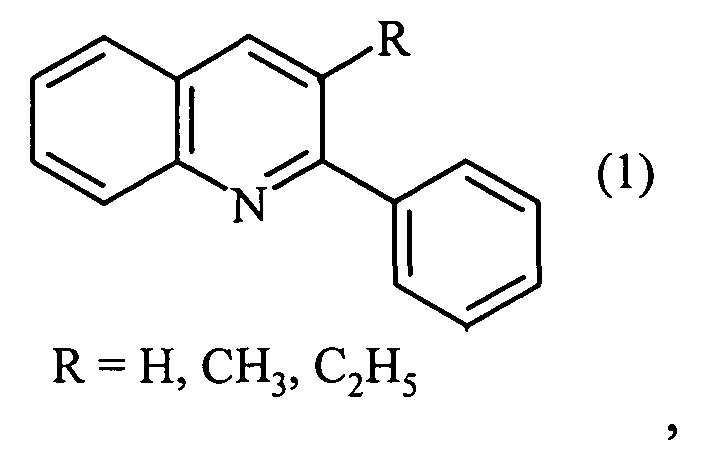
Авторами предлагается новый способ получения 2-фенил-3-алкилзамещенных хинолинов, не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является удешевление себестоимости конечного продукта за счет использования доступных и недорогих исходных реагентов - анилина, бензиламина и алифатических спиртов.
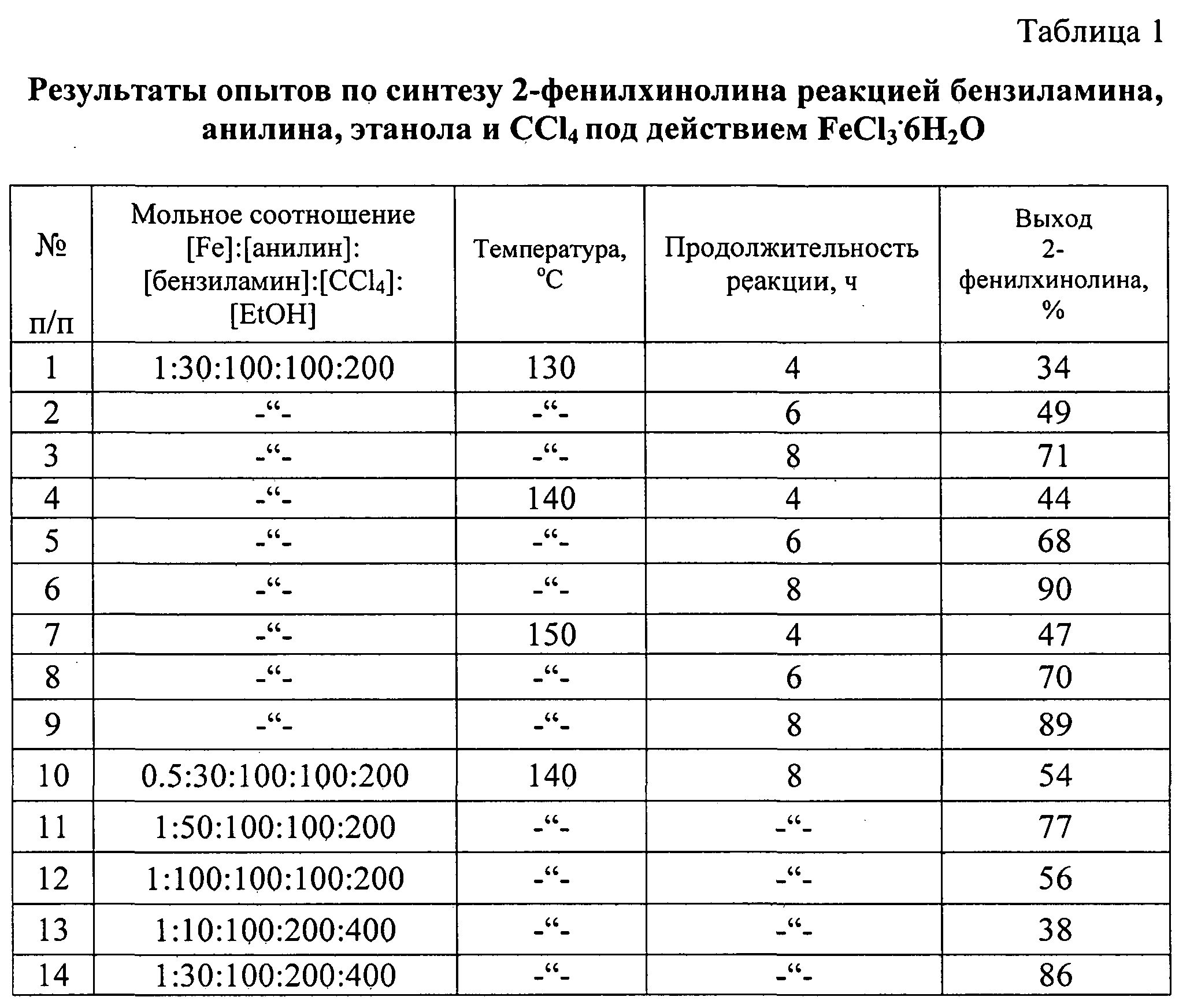
Сущность предлагаемого способа заключается во взаимодействии бензиламина, анилина, алифатических спиртов и четыреххлористого углерода под действием железосодержащего катализатора, выбранного из ряда FеСl3, FеСl3·6Н2O, FeCl2·4H2O, Fe(C5H5)2, Fе(асас)3, Fe(OAc)2 и Fe2(CO)9 при температуре 130-150°С в течение 4-8 ч при мольном соотношении: [Fе]:[бензиламин]:[анилин]:[спирт]:[CCl4]=[0.5-1]:[100]:[10-100]:[200-400]:[100-200]. Реакцию проводили в автоклаве под аргоном.
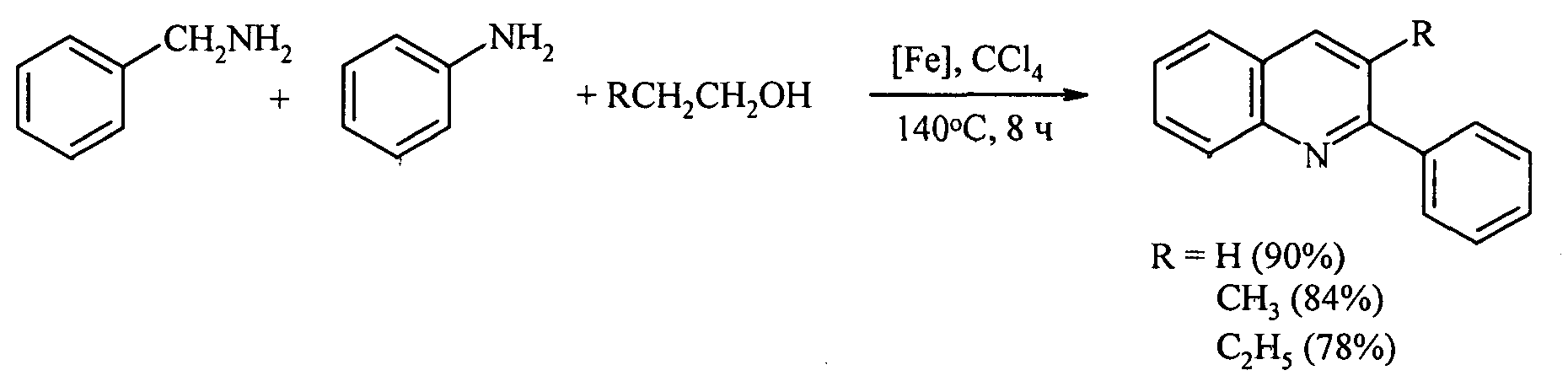
При проведении реакции при температуре 140°С в течение 8 ч и использовании следующих мольных соотношений катализатора и реагентов: [FеСl3·6Н3О]:[бензиламин]:[анилин]:[спирт]:[CCl3]=[1]:[100]:[30]:[200]:[100] общий выход 2-фенил-3-алкилхинолинов составил 78-90%. При использовании других железосодержащих катализаторов FеСl3, FeCL2·H2O, Fe(C5H5)2, Fе(асас)3, Fe(OAc)2 и Fe2(CO)9 выход 2-фенил-3-алкилхинолинов был меньше и составил 20-50%.
Преимущества предлагаемого метода.
1. Доступность и дешевизна исходных реагентов - бензиламина, анилина, ССl4, спиртов и катализатора FеСl2·6Н2О, удешевление себестоимости и упрощение технологии.
2. Высокий выход замещенных хинолинов до 90%.
3. Высокий выход целевых продуктов и отсутствие побочных продуктов облегчает выделение и очистку целевых замещенных хинолинов.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Получение 2-фенилхинолина.
В ампулу в токе аргона загружали 0.028 ммоль железосодержащего катализатора (FeCl3·6H2O 7.5 мг, FeCl3 4.6 мг, FeCl2·4H2O 5.5 мг, Fe(C5H5)2 5.2 мг, Fе(асас)3 10 мг, Fe(OAc)2 8.4 мг и Fe2(CO)9 10.2 мг) 0.3 мл (2.8 ммоль) бензиламина, 0.08 мл (0.86 ммоль) анилина, 0.27 мл (2.8 ммоль) CCl4 и 0,33 мл (5.6 ммоль) EtOH. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 140°С в течение 8 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом.
Выход 90%. Т кип. 143-144°С/0.2 мм рт. ст. (Т пл. 80-82°С). Спектр ЯМР 13С (δ, м.д.): 119.52(С3), 127.15(С6), 127.21 (С4a), 127.67 (С5), 127.80 (С7), 131.83 (С8), 139.01 (С4), 145.91 (С8a), 157.89 (С2), 128.21 (С3′,5′), 129.07 (С2′,6′), 130.40 (С4′), 137.16 (С1′). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.76 д (1Н, С3H J 8 Гц), 7.83 д (1Н, С5Н J 8 Гц), 7.85 т (1Н, С7H J 8 Гц), 7.40-7.60 м (1Н, С6H), 8.33 д (1Н, С8H J 8.8 Гц), 8.50 д (1Н, С4H J 8.4 Гц), 8.18 д (1Н, С2′Н, J 7.6 Гц), 8.18 д (1Н, С6′Н, J 7.6 Гц), 7.40-7.60 м (3Н, С2′,4′,5′H). Масс-спектр, m/z (Iотн. (%)): 205.00[M]+ (100), 102 (10), 176 (5), 76 (4), 51 (2).
ПРИМЕР 2. Получение 2-фенил-3-метилхинолина.
В ампулу в токе аргона загружали 0.028 ммоль железосодержащего катализатора (FеСl3·6H2O 7.5 мг, FеСl3 4.6 мг, FeCl2·4H2O 5.5 мг, Fe(C5H5)2 5.2 мг, Fе(асас)3 10 мг, Fe(OAc)2 8.4 мг и Fe2(CO)9 10.2 мг) 0.3 мл (2.8 ммоль) бензиламина, 0.08 мл (0.86 ммоль) анилина, 0.27 мл (2.8 ммоль) ССl4 и 0,42 мл (5.6 ммоль) н-РrОН. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 140°С в течение 8 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Nа2СО3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом.
Выход 84%. Т кип. 137-138°С/0.2 мм рт. ст. Спектр ЯМР 13С (5, м.д.): 20.53 (СН3), 126.23 (С3), 126.50 (С6), 127.45 (С5), 127.96 (С7), 128.11 (С4a), 129.19 (С8), 136.61 (С4), 146.40 (С8a), 160.30 (С2), 128.65 (С3′,5′), 128.79 (С2′,6′), 129.04 (С4′), 140.73 (С1′). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.41 с (3Н, СН3), 7.38-7.48 м (5Н, С5,7,3′,4′,5′H), 7.55-7.58 м (1Н, С6H), 7.60-7.64 м (1Н, С8H), 7.93 с (1Н, С4H), 8.13 д (2Н, С2′,6′Н,78 Гц). Масс-спектр, m/z (Iотн. (%)): 218.05[M]+ (100), 209 (5), 75 (4), 63 (4), 40(3).
ПРИМЕР 3. Получение 2-фенил-3-этилхинолина.
В ампулу в токе аргона загружали 0.028 ммоль железосодержащего катализатора (FeCl3·6H2O 7.5 мг, FeCl3 4.6 мг, FeCl2·4H2O 5.5 мг, Fе(С5Н5)2 5.2 мг, Fе(асас)3 10 мг, Fe(OAc)2 8.4 мг и Fe2(CO)9 10.2 мг) 0.3 мл (2.8 ммоль) бензиламина, 0.08 мл (0.86 ммоль) анилина, 0.27 мл (2.8 ммоль) CCl4 и 0,51 мл (5.6 ммоль) н-ВuОН. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 140°С в течение 8 ч. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом.
Выход 78%. Т кип. 150-152°С/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 14.75 (СН3), 26.04 (СН2), 126.20 (С3), 127.15 (С6), 127.67 (С5), 127.80 (С7), 129.72 (С4a), 131.83 (С8), 134.96 (С4), 146.38 (С8a), 160.66 (С2) 128.32 (С3′,5′), 128.76 (С2′,6′), 129.27 (С4′), 140.94 (С1′). Спектр ЯМР 1Н (СDСl3, δ, м.д.): 1.22 т (3Н, СН3, J 8 Гц), 2.66 к (2Н, СН3, J 8 Гц), 7.35-7.65 м (5Н, С5,7,3′,4′,5′), 7.62-7.68 м (1Н, С6H, 7.75-7.80 м (1Н, С8H), 8.06 с (1Н, С4H, 8.17 д (2Н, С2′,6′H J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 232.00[М]+ (100), 217 (35), 109 (21), 77 (8), 63 (6), 52 (2).
Другие примеры, подтверждающие способ, приведены в таблице 1.