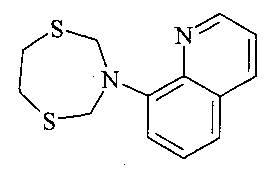
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ (1,5,3-ДИТИАЗЕПАН-3-ИЛ)-ХИНОЛИНОВ
Вид РИД
Изобретение
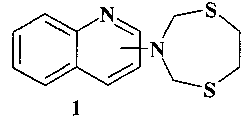
Предлагаемое изобретение относится к области органической химии, в частности к способу получения (1,5,3-дитиазепан-3-ил)-хинолинов общей формулы (1):
S,N-Содержащие гетероциклы известны как антиоксидантные (А.С. Березин, Е.А. Ломкова, Ю.А. Скорик, Изв. АН. Сер. хим., 778, 2012), фунгицидные (V. Ambrogi, G. Grandolini, L. Perioli, M. Ricci, C. Rossi, L. Tuttobello, European Journal of Medicinal Chemistry, 25, 403, 1990), противомикробные агенты (А.А. Bialy Serry, A.M. Abdelal, A. El-Shorbagi, M.M. Kheira Samy, Archiv der Pharmazie, 338, 38, 2005), а также как селективные комплексообразователи (J.C. Gálvez-Ruiz, Ε. Solano-Ruiz, S.A. Sánchez-Ruiz, R. Contreras, A. Flores-Parra, ARKIVOC, v, 81, 2008).
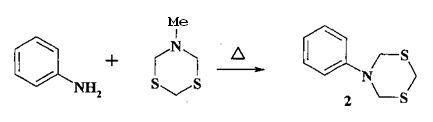
Известен способ (Ахметова В.Р., Ниатшина З.Т., Хабибуллина Г.Р., Бушмаринов И.С, Борисова А.О., Старикова З.Α., Коржова Л.Ф., Кунакова Р.В. Изв. АН. Сер. хим., 2010, 980) получения N-фенил-1,3,5-дитиазинана (2) реакцией метил-1,3,5-дитиазинана с анилином в кипящем хлороформе.
Известным способом не могут быть получены (1,5,3-дитиазепан-3-ил)-хинолины общей формулы (1).
Известен способ (Murzakova N.N., Rakhimova Е.В., Vasilieva I.V., Prokof'yev K.I., Ibragimov A.G., Dzhemilev U.M. Tetrahedron Lett, 2011, 52, 4090) получения 2- и 4-(1,5,3-дитиазинан-3-ил)фенолов (3) реакцией 1,3,5-тритиана с o-, n-аминофенолами в ацетонитриле при 60°C под действием FeCl3·6H2O.
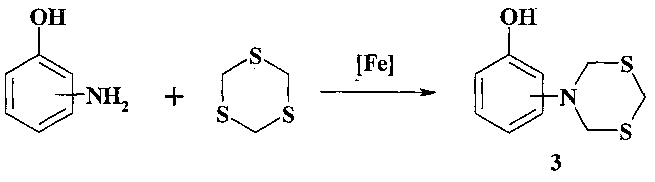
Известным способом не могут быть получены (1,5,3-дитиазепан-3-ил)-хинолины общей формулы (1).
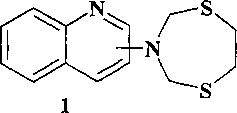
Известен способ (Е.Б. Рахимова, И.В. Васильева, Л.М. Халилов, А.Г. Ибрагимов, У.М. Джемилев. ХГС, 2012, 7, 1132) получения 2- и 4-(1,5,3-дитиазепан-3-ил)фенолов (4) реакцией каталитического переаминирования N-трет-бутил-1,5,3-дитиазепана с помощью o- и n-аминофенолов под действием Sm(NO3)3·6H2O.
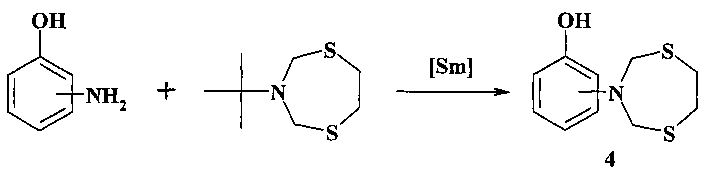
Известным способом не могут быть получены (1,5,3-дитиазепан-3-ил)-хинолины общей формулы (1).
Таким образом, в литературе отсутствуют сведения по получению (1,5,3-дитиазепан-3-ил)-хинолинов общей формулы (1).
Предлагается новый способ получения (1,5,3-дитиазепан-3-ил)-хинолинов общей формулы (1).
Сущность способа заключается во взаимодействии 2-, или 3-, или 6-, или 8-аминохинолина с 1-окса-3,6-дитиациклогептаном в присутствии катализатора Sm(NO3)3·6H2O, взятыми в мольном соотношении аминохинолин: 1-окса-3,6-дитиациклогептан: Sm(NO3)3·6H2O=1:1:(0.03-0.07), предпочтительно 1:1:0.05, при комнатной температуре (~20°C) и атмосферном давлении в среде растворителей этанол-хлороформ (1:1, объемное соотношение) в течение 2.5-3.5 ч. Выход (1,5,3-дитиазепан-3-ил)-хинолинов (1) составляет 80-95%. Реакция протекает по схеме:
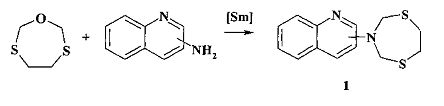
(1,5,3-Дитиазепан-3-ил)-хинолины общей формулы (1) образуются только лишь с участием 2-, или 3-, или 6-, или 8-аминохинолина и 1-окса-3,6-дитиациклогептана, взятых в стехиометрических количествах. При другом соотношении исходных реагентов снижается выход целевых продуктов (1). Без катализатора Sm(NO3)3·6H2O реакция идет с выходом, не превышающим 35%. Проведение реакции в присутствии катализатора Sm(NO3)3·6H2O больше 7 мол.% по отношению к аминохинолину не приводит к существенному увеличению выхода целевого продукта (1). Использование в реакции катализатора Sm(NO3)3·6H2O менее 3 мол.% снижает выход (1), что связано с уменьшением каталитически активных центров в реакционной массе. Реакции проводили при комнатной температуре ~20°C. При более высокой температуре (например, 60°C) увеличиваются энергозатраты, при меньшей температуре (например, 0°C) снижается скорость реакции. Опыты проводили в среде растворителей этанол-хлороформ (1:1, объемное соотношение), т.к. в них хорошо растворяются исходные реагенты и целевые продукты.
Существенные отличия предлагаемого способа.
В известном способе реакция идет с участием в качестве исходных реагентов o- и n-аминофенолов и N-трет-бутил-1,5,3-дитиазепана с образованием 2- и 4-(1,5,3-дитиазепан-3-ил)фенолов (4). Известный способ не позволяет получать (1,5,3-дитиазепан-3-ил)-хинолины общей формулы (1).
В предлагаемом способе в качестве исходных реагентов применяются 2-, или 3-, или 6-, или 8-аминохинолин и 1-окса-3,6-дитиациклогептан.
Предлагаемый способ обладает следующими преимуществами.
Способ позволяет получать с высокой селективностью индивидуальные (1,5,3-дитиазепан-3-ил)-хинолины общей формулы (1), синтез которых в литературе не описан.
Способ поясняется следующими примерами.
ПРИМЕР 1. В сосуд Шленка, установленный на магнитной мешалке, помещают 0.14 г (1 ммоль) 2-аминохинолина в 5 мл этанола, 0.022 г (0.05 ммоль) Sm(NO3)3·6H2O и 0.14 г (1 ммоль) 1-окса-3,6-дитиациклогептана в 5 мл хлороформа. Реакционную смесь перемешивают при температуре ~20°C в течение 3 ч, колоночной хроматографией на SiO2 выделяют 2-(1,5,3-дитиазепан-3-ил)-хинолин с выходом 88%.
Другие примеры, подтверждающие способ, приведены в таблице 1.
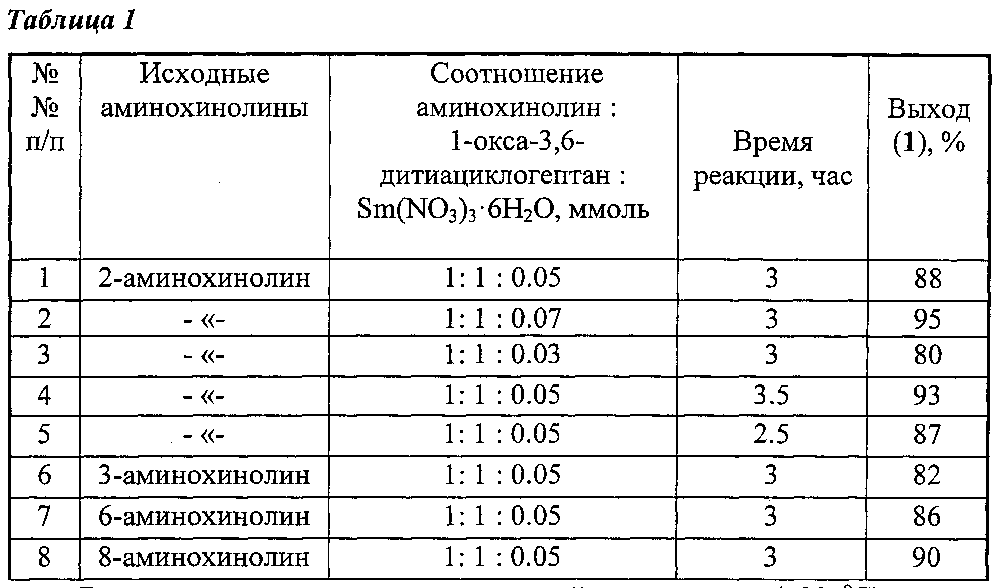
Все опыты проводили при комнатной температуре (~20°C) в среде растворителей этанол-хлороформ (1:1, объемное соотношение), т.к. в них растворяются исходные и целевые продукты.
Спектральные характеристики 2-(1,5,3-дитиазепан-3-ил)-хинолина1(1Контроль реакции осуществляли методом TCX на пластинах Sorbfíl (ПТСХ-АФ-В), проявляли парами I2. Для колоночной хроматографии использовали силикагель КСК (100-200 мкм). Спектры ЯМР ID (1H, 13С) и 2D (COSY, HSQC, НМВС) сняты на спектрометре Bruker Avance 400 (100.62 МГц для 13C и 400.13 МГц для 1H) по стандартным методикам фирмы Bruker, внутренний стандарт Me4Si, растворитель - CDC13. Масс-спектры получены на приборе MALDI TOF/TOF AUTOFLEX III фирмы Bruker.):
Спектр ЯМР 1H, δ, м.д. (J, Гц): 3.14 уш. с (4H, CH2, H-6′, H-7′), 5.14 уш. с (4H, CH2, H-2′, H-4′), 7.05 д (1H, CH, H-4, J=9), 7.30 т (1H, CH, H-6, J=8), 7.59 т (1H, CH, H-7, J=8.5), 7.67 д (1H, CH, H-5, J=8), 7.81 д (1H, CH, H-8, J=8.5), 8.00 д (1H, CH, H-3, J=9). Спектр ЯМР 13C, δ, м.д.: 35.75 (C-6′, C-7′), 51.69 (C-2′, C-4′), 110.12 (C-4), 123.16 (C-6), 123.54 (C-4a), 127.25 (C-5, C-8), 129.65 (C-7), 137.75 (C-3), 147.60 (C-8a), 154.86 (C-2). Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %): 263 [M+H]+ (100), 261 [M-H]+ (29).
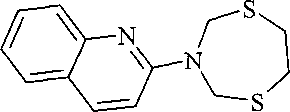
Спектральные характеристики 3-(1,5,3-дитиазепан-3-ил)-хинолина:
Спектр ЯМР 1H, δ, м.д. (J, Гц): 3.11 уш. с (4H, CH2, H-6′, H-7′), 4.91 уш. с (4H, CH2, H-2′, H-4′), 7.52-7.60 м (3H, CH, H-6, H-7, H-2), 7.76 д (1H, CH, H-5, J=8), 8.11 д (1H, CH, H-8, J=8.5), 8.79 д (1H, CH, H-4, J=3). Спектр ЯМР 13C, δ, м.д.: 35.72 (C-6′, C-7′), 54.87 (C-2′, C-4′), 119.11 (C-6), 126.75 (C-5, C-4a), 127.30 (C-7), 127.51 (C-2), 128.04 (C-8), 128.69 (C-8a), 139.53 (C-3), 141.86 (C-4). Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %): 263 [M+H]+(100), 261 [M-H]+ (35).
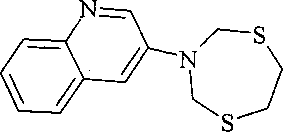
Спектральные характеристики 6-(1,5,3-дитиазепан-3-ил)-хинолина:
Спектр ЯМР 1H, δ, м.д. (J, Гц): 3.11 уш. с (4H, CH2, H-6′, H-7′), 4.90 уш. с (4H, CH2, H-2′, H-4′), 7.14 д (1H, CH, H-5, J=2.4), 7.37 д. д (1H, CH, H-8, J=6.8 и 3.6), 7.50 д. д (1H, CH, H-7, J=7.6 и 2.4), 8.09 т (2H, CH, H-3, H-4, J=7.6), 8.75 д. д (1H, CH, H-2, J=3.6 и 1.2). Спектр ЯМР 13C, δ, м.д.: 35.70 (C-6′, C-7′), 54.93 (C-2′, C-4′), 110.12 (C-5), 121.34 (C-7), 121.48 (C-8), 129.39 (C-4a), 129.98 (C-3), 135.35 (C-4), 143.02 (C-8a), 144.03 (C-6), 147.32 (C-2). Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %): 263 [M+H]+(100), 261 [M-H]+ (31).
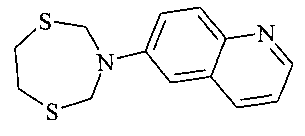
Спектральные характеристики 8-(1,5,3-дитиазепан-3-ил)-хинолина:
Спектр ЯМР 1H, δ, м.д. (7, Гц): 3.18 уш. с (4H, CH2, H-6′, H-7′), 5.15 уш. с (4H, CH2, H-2′, H-4′), 7.43 д. д (1H, CH, H-3, J=8 и 4), 7.51-7.55 м (2H, CH, H-5, H-6, 7.63 д (1H, CH, H-7, J=8), 8.17 д (1H, CH, H-4, J=8), 8.92 д (1H, CH, H-2, J=4). Спектр ЯМР 13C, δ, м.д.: 36.63 (C-6′, C-7′), 58.98 (C-2′, C-4′), 119.98 (C-7, 121.08 (C-3), 123.06 (C-5)), 126.64 (C-6), 129.68 (C-4a), 137.01 (C-4), 142.20 (C-8a), 145.31 (C-8), 148.33 (C-2). Масс-спектр (MALDI TOF/TOF), m/z (Iотн, %): 263 [M+H]+ (100), 261 [M-H]+ (12).