Результат интеллектуальной деятельности: РТН-СОДЕРЖАЩИЙ ТЕРАПЕВТИЧЕСКИЙ/ПРОФИЛАКТИЧЕСКИЙ АГЕНТ ПРОТИВ ОСТЕОПОРОЗА, ХАРАКТЕРИЗУЮЩИЙСЯ ТЕМ, ЧТО РТН ВВОДЯТ ОДИН РАЗ В НЕДЕЛЮ В СТАНДАРТНОЙ ДОЗЕ 100-200 ЕДИНИЦ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к терапевтическому или профилактическому агенту против остеопороза, который содержит PTH в качестве активного ингредиента. Данное изобретение относится также к агенту для ингибирования или предупреждения переломов костей, который содержит PTH в качестве активного ингредиента. В частности, данное изобретение относится к вышеуказанному лекарственному средству, характеризующемуся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц.
УРОВЕНЬ ТЕХНИКИ
Остеопороз является “заболеванием, характеризующимся уменьшением прочности кости, которое создает увеличенный риск переломов костей”. Препараты PTH (гормона паращитовидной железы) известны в настоящее время в качестве одного агента для лечения остеопороза.
PTH является гормоном, который способствует регуляции концентрации кальция крови, вместе с кальцитонинами и витамином D. Например, известно, что PTH стимулирует абсорбцию кальция в кишечнике увеличением продуцирования активного витамина D3 в почке in vivo (непатентная ссылка 1).
Патентная ссылка 1 описывает способ лечения остеопороза, который увеличивает плотность костной ткани губчатого вещества кости имеющего остеопороз пациента без уменьшения плотности костной ткани кортикального слоя кости подкожным введением стандартной дозы 100 или 200 единиц PTH имеющему остеопороз пациенту один раз в неделю на протяжении периода 26 недель.
Таким образом, хотя патентная ссылка 1 утверждает, что эти способы лечения приводят лишь к увеличению плотности костной ткани, она не демонстрирует, способен или не способен этот способ лечения увеличивать прочность кости имеющего остеопороз пациента или уменьшать риск переломов костей. Кроме того, PTH вводят только отдельно, не в комбинации с кальцийсодержащими агентами.
Непатентная ссылка 1 описывает, что гиперкальциемию наблюдали у 11% пациентов и что стойкую гиперкальциемию наблюдали у 3% из них при взятии проб крови при 4-6 часах после введения PTH (20 мкг/день) пациентам в клиническом исследовании PTH при лечении остеопороза. Кроме того, непатентная ссылка 1 описывает также, что лечение прекращали вследствие стойкого повышения кальция сыворотки у одного из 541 пациентов, даже хотя кальций сыворотки возвращался к нормальному уровню фактически у всех пациентов перед следующим введением PTH.
Хотя непатентная ссылка 2 описывает, что не было клинической проблемы с сывороточным кальцием после введения этого лекарственного средства при ежедневном введении подкожного препарата PTH вместе с кальцийсодержащим агентом, она сообщает также, что кальций сыворотки повышался после введения. Непатентная ссылка 3 является вкладышем упаковки вводимого один раз в день подкожного препарата, описанного в непатентной ссылке 2. Этот вкладыш сообщает в описании различных вредных побочных событий после введения этого препарата, что наблюдали транзиторную гиперкальциемию после введения этого препарата. Кроме того, непатентная ссылка 3 описывает, что имелись сообщения о вредной побочной реакции на это лекарственное средство в виде гиперкальциемии в постмаркетинговых исследованиях этого препарата.
Таким образом, непатентные ссылки 1-3 описывают случаи гиперкальциемии в качестве вредной побочной реакции лекарственного средства при лечении остеопороза с использованием PTH и т.п., и описанные в них способы не могут быть названы адекватными в отношении безопасности.
При таком уровне техники, желательным является высоко безопасный и эффективный способ лечения остеопороза при помощи PTH.
ССЫЛКИ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ССЫЛКИ
Патентная ссылка 1: JP Kokai H08-77376
Патентная ссылка 2: WO00/10596
Патентная ссылка 3: JP Kokai Н05-306235
Патентная ссылка 4: JP Kokai S64-16799
Патентная ссылка 5: WO02/002136
Патентная ссылка 6: JP Kokai 2003-095974
НЕПАТЕНТНЫЕ ССЫЛКИ
Непатентная ссылка 1: Paul D. Miller, MD, Current Osteoporosis reports, Vol. 6, 12-16, 2008
Непатентная ссылка 2: CLINICAL CALCIUM, Vol. 17, No. 1, 48-55, 2007
Непатентная ссылка 3: FORTEO (registered trademark) teriparatide (rDNA origin) injection 750 mcg/3 ml, 2008
Непатентная ссылка 4: ADVANCES IN ENZYMOLOGY, 32, 221-296, 1969
Непатентная ссылка 5: Hoppe Seyler's Z. Physiol Chem., 355, 415, 1974
Непатентная ссылка 6: J. Biol. Chem., Vol. 259, No. 5, 3320, 1984
Непатентная ссылка 7: Pthobiology annual, 11, 53, 1981
Непатентная ссылка 8: J. Biol. Chem., Vol. 266, 2831-2835, 1991
Непатентная ссылка 9: Marcus. & Aurbach, G.D., Endocrinology 85, 801-810, 1969
Непатентная ссылка 10: “2006 Ostroporosis Prevention and Treatment Guidelines” (Life Sciences Publishing Co., Ltd.)
Непатентная ссылка 11: M. Takai et al., Peptide Chemistry 1979, 187-192, 1980
Непатентная ссылка 12: H. Orimo, et al., Diagnostic criteria for primary osteoporosis (1996 revised edition) (1997) Journal of Bone And Mineral Metabolism 14; 219-233
Непатентная ссылка 13: Diagnostic criteria for primary osteoporosis and osteoporosis prevention and treatment guidelines (H. Orimo, et al., 2006 Osteoporosis prevention and treatment guidelines (2006) 34-35)
Непатентная ссылка 14: Genant H.K. et al., J. Bone Miner. Res., 8, 1137-1148, 1993
Непатентная ссылка 15: N. Engl. J. Med., Vol. 344, No. 19, 1434-1441, 2001
Непатентная ссылка 16: Clinical Diabetes, Vol. 22, No. 1, 10-20, 2004
Непатентная ссылка 17: Kawasaki Medical Journal, 36(1), 23-33, 2010
Непатентная ссылка 18: Bone, Vol. 32, 86-95, 2003
Непатентная ссылка 19: Reports on Dentistry, 102(11): 853-868, 2002
Непатентная ссылка 20: Miner. Electrolyte Metab. 1995; 21(1-3); 201-4
Непатентная ссылка 21: Nippon Seikeigeka Gakkai Zasshi 1995 Oct; 69 (10): 1027-36
Непатентная ссылка 22: Calcif. Tissue Int. 2000 Mar; 66(3): 229-33
Непатентная ссылка 23: N. Engl. J. Med., Vol. 358, No. 12, 1302-1304, 2008
Непатентная ссылка 24: N. Engl. J. Med., Vol. 357, No. 20, 2028-2039, 2007
Непатентная ссылка 25: Osteoporos. Int. 2003 Jan; 14(1): 77-81
Непатентная ссылка 26: Osteoporos. Int. 2000; 11(5): 434-42
Непатентная ссылка 27: J. Bone Miner. Res. 2000 May; 15(5): 944-51
Непатентная ссылка 28: J. Clin. Invest. 1998 Oct 15; 102(8): 1627-33
Непатентная ссылка 29: J. Clin. Endocrinol. Metab. 2001 Feb; 86(2): 511-6
Непатентная ссылка 30: J. Bone Miner. Res. 2004 May; 19(5): 745-51. Epub 2004 Jan 19
Непатентная ссылка 31: J. Clin. Endocrinol. Metab. 2009 Oct; 94(10): 3772-80. Epub 2009 Jul 7
Непатентная ссылка 32: Osteoporos. Int. 2007; 18; 59-68
Непатентная ссылка 33: J. Bone Miner. Res., Vol. 25, No. 3, 472-481 (2010)
Непатентная ссылка 34: Osteoporos. Int. 1999; 9; 296-306
Непатентная ссылка 35: T. Inoue et al., Diagnostic criteria for osteoporosis-Assessment of degree of bone loss and vertebral deformity by simple vertebral roentgenogram, Ministry of Health and Welfare Life Science Research Fund Silver Science Research 1988 report, 1990, 3
Непатентная ссылка 36: J. Bone Miner. Metab. 1998; 16(1): 27-33
Непатентная ссылка 37: Proceedings of the 26th Meeting of the Japanese Society for Bone and Mineral Research, O-025, 147 (Oct. 2008)
Непатентная ссылка 38: ASBMR 31st Annual Meeting, “Weekly treatment with human parathyroid hormone (1-34) for 18 months increases bone strength via the amelioration of microarchitecture, degree of mineralization, enzymatic and non-enzymatic cross-links formation in ovariectomized cynomolgus monkeys” (Sa0044, FR0044).
Непатентная ссылка 39: IOF World Congress on Osteoporosis & 10th European Congress on Clinical and Economic Aspects of Osteoporosis and Osteoarthritis “ONCE-WEEKLY TREATMENT WITH TERIPARATIDE FOR 18 MONTHS INCREASES BONE STRENGTH VIA AMELIORATE TRABECULAR ARCHITECTURE, COLLAGEN ENZYMATIC AND NON-ENZYMATIC CROSS-LINK FORMATION IN OVARIECTOMIZED CYNOMOLGUS MONKEYS”
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ПОСРЕДСТВОМ ЭТОГО ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает высоко безопасный и эффективный способ для лечения или предотвращения остеопороза при помощи PTH. Кроме того, данное изобретение обеспечивает высоко безопасный способ ингибирования или предотвращения переломов костей при помощи PTH.
СРЕДСТВА ДЛЯ РЕШЕНИЯ ЭТИХ ПРОБЛЕМ
В результате интенсивного исследования и развития, осуществленных для решения вышеуказанных проблем, авторы этого изобретения изобрели высоко безопасный и эффективный способ лечения или предотвращения остеопороза, довольно неожиданно, ограничением дозы и интервала введения PTH. Они изобрели также высоко безопасный способ ингибирования/предотвращения переломов костей, описав эти дозу и интервал введения PTH. Кроме того, они обнаружили также, что эти способы особенно эффективны у пациентов с высоким риском.
Конкретно, данное изобретение раскрывает следующее.
[1] Агент для лечения или предотвращения остеопороза, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что его используют вместе с кальцийсодержащим агентом, и PTH вводят один раз в неделю в стандартной дозе 100-200 единиц.
[2] Агент для лечения или предотвращения остеопороза по [1] выше, характеризующийся тем, что кальцийсодержащий агент, используемый в комбинации, вводят один или несколько раз в неделю.
[3] Агент для лечения или предотвращения остеопороза по [1] или [2] выше, характеризующийся тем, что кальцийсодержащий агент, используемый в комбинации, вводят в дозе 200-800 мг/день в виде кальция.
[4] Агент для лечения или предотвращения остеопороза по любому из [1]-[3] выше, где вышеуказанный PTH является PTH человека (1-34).
[5] Агент для лечения или предотвращения остеопороза по любому из [1]-[4] выше для введения на протяжении периода, превышающего 24 недели или 48 недель.
[6] Агент для лечения или предотвращения остеопороза по любому из [1]-[5] выше для лечения пациентов с остеопорозом, которые удовлетворяют всем из следующих условий (1)-(3) ниже:
(1) Возраст 65 лет или более,
(2) Преобладающие переломы костей,
(3) Плотность костей менее 80% средней плотности молодого взрослого и/или степень атрофии костей I или более высокая.
[7] Агент для лечения или предотвращения остеопороза по любому из [1]-[6] выше для лечения или предотвращения вторичного остеопороза, вызываемого глюкокортикоидом, или диабетического остеопороза.
[8] Агент для лечения или предотвращения остеопороза по любому из [1]-[6] выше для лечения или предотвращения остеопороза у пациентов, имеющих по меньшей мере одно из заболеваний (1)-(8) ниже в качестве осложнения:
(1) Диабет,
(2) Гипертензию,
(3) Гиперлипидемию,
(4) Артралгию,
(5) Остеоартрит позвоночника,
(6) Метатипическую боль в нижней части спины,
(7) Остеоартрит бедра,
(8) Остеоартрит челюсти.
[9] Агент для лечения или предотвращения остеопороза по любому из [1]-[6] выше для введения пациенту с остеопорозом, имеющим историю введения по меньшей мере одного из терапевтических агентов остеопороза по (1) - (6) ниже:
(1) L-аспартата кальция,
(2) Альфакальцидола,
(3) Элкатонина,
(4) Гидрохлорида ралоксифена,
(5) Менатетренона,
(6) Лактата кальция.
[10] Агент для лечения или предотвращения остеопороза по любому из [1]-[6] выше для введения пациенту с остеопорозом, имеющим легкую почечную дисфункцию или умеренную почечную дисфункцию.
[11] Агент для лечения или предотвращения остеопороза по любому из [6]-[10] выше, где вышеуказанный PTH является PTH человека (1-34).
[12] Агент для лечения или предотвращения остеопороза по любому из [6]-[11] выше, где вышеуказанный терапевтический агент против остеопороза, содержащий PTH в качестве активного ингредиента, является подкожным инъекционным раствором.
[13] Комбинированный препарат или набор для лечения, состоящий из агента для лечения или предотвращения остеопороза, указанного в любом из [1]-[12] выше, и по меньшей мере одного лекарственного средства по (1)-(6) ниже:
(1) Метоклопрамида,
(2) Домперидона,
(3) Фамотидина,
(4) Цитрата мозаприда,
(5) Лансопразола,
(6) Рокушингана.
[14] Агент для лечения или предотвращения остеопороза, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц, причем этот агент для лечения или предотвращения остеопороза используют для лечения пациентов с остеопорозом, которые удовлетворяют всем из следующих условий (1)-(3):
(1) Возраст 65 лет или более,
(2) Преобладающие переломы костей,
(3) Плотность костей менее 80% средней плотности молодого взрослого и/или степень атрофии костей I или более высокая.
[15] Агент для лечения или предотвращения остеопороза при высоком риске в отношении переломов костей, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц.
[16] Агент для лечения или предотвращения остеопороза, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц, причем этот агент для лечения или предотвращения остеопороза используют для лечения или предотвращения вторичного остеопороза, вызываемого глюкокортикоидом, или диабетического остеопороза.
[17] Агент для лечения или предотвращения остеопороза, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц, причем этот агент для лечения или предотвращения остеопороза вводят пациентам с остеопорозом, имеющим легкую почечную дисфункцию или умеренную почечную дисфункцию.
[18] Агент для ингибирования или предотвращения переломов костей, который содержит PTH в качестве активного ингредиента, характеризующийся тем, что его используют вместе с кальцийсодержащим агентом и PTH вводят один раз в неделю в стандартной дозе 100-200 единиц.
[19] Агент для ингибирования или предотвращения переломов костей по [18] выше, характеризующийся тем, что кальцийсодержащий агент, используемый в комбинации, вводят один или несколько раз в неделю.
[20] Агент для ингибирования или предотвращения переломов костей по [18] или [19] выше, характеризующийся тем, что кальцийсодержащий агент, используемый в комбинации, вводят в дозе 200-800 мг/день в виде кальция.
[21] Агент для ингибирования или предотвращения переломов костей по [18]-[20] выше, где вышеуказанный PTH является PTH человека (1-34).
[22] Агент для ингибирования или предотвращения переломов костей по [18]-[21] выше для введения субъектам, которые удовлетворяют всем из следующих условий (1)-(3):
(1) Возраст 65 лет или более,
(2) Преобладающие переломы костей,
(3) Плотность костей менее 80% средней плотности молодого взрослого и/или степень атрофии костей I или более высокая.
[23] Агент для ингибирования или предотвращения переломов костей по [22] выше, где этот вышеуказанный PTH является PTH человека (1-34).
[24] Агент для ингибирования или предотвращения переломов костей по [22] или [23] выше, где вышеуказанный агент для ингибирования или предотвращения переломов костей, который содержит PTH в качестве активного ингредиента, является подкожным инъекционным раствором.
[25] Агент для ингибирования или предотвращения переломов костей по любому из [18]-[24] выше, где вышеуказанный агент для ингибирования или предотвращения переломов костей является агентом для ингибирования множественных переломов костей или предотвращения множественных переломов костей.
[26] Агент для ингибирования или предотвращения переломов костей по любому из [18]-[25] выше, где вышеуказанный агент для ингибирования или предотвращения переломов костей является агентом для ингибирования ухудшения переломов или предотвращения ухудшения переломов.
[27] Агент для лечения или предотвращения остеопороза по [14] или [15] выше, причем этот агент для лечения или предотвращения остеопороза используют для лечения или предотвращения вторичного остеопороза, вызываемого глюкокортикоидом, или диабетического остеопороза.
[28] Агент для лечения или предотвращения остеопороза по [14] или [15] выше, причем этот агент для лечения или предотвращения остеопороза вводят пациентам с остеопорозом, имеющим легкую почечную дисфункцию или умеренную почечную дисфункцию.
[29] Агент для лечения или предотвращения остеопороза по [27] выше, причем этот агент для лечения или предотвращения остеопороза вводят пациентам с остеопорозом, имеющим легкую почечную дисфункцию или умеренную почечную дисфункцию.
[30] Агент для лечения или предотвращения остеопороза по [16] выше, причем этот агент для лечения или предотвращения остеопороза вводят пациентам с остеопорозом, имеющим легкую почечную дисфункцию или умеренную почечную дисфункцию.
[31] Способ предотвращения или лечения с использованием агента лечения, агента предотвращения, лекарственного средства, комбинации лекарственного средства или набора по любому из [1]-[30] выше.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Терапевтический агент для использования при остеопорозе, согласно данному изобретению, является высоко безопасным и имеет превосходную эффективность. Агент для ингибирования или предотвращения переломов костей согласно данному изобретению является также высоко безопасным и полезным.
КРАТКОЕ ОПИСАНИЕ ФИГУР
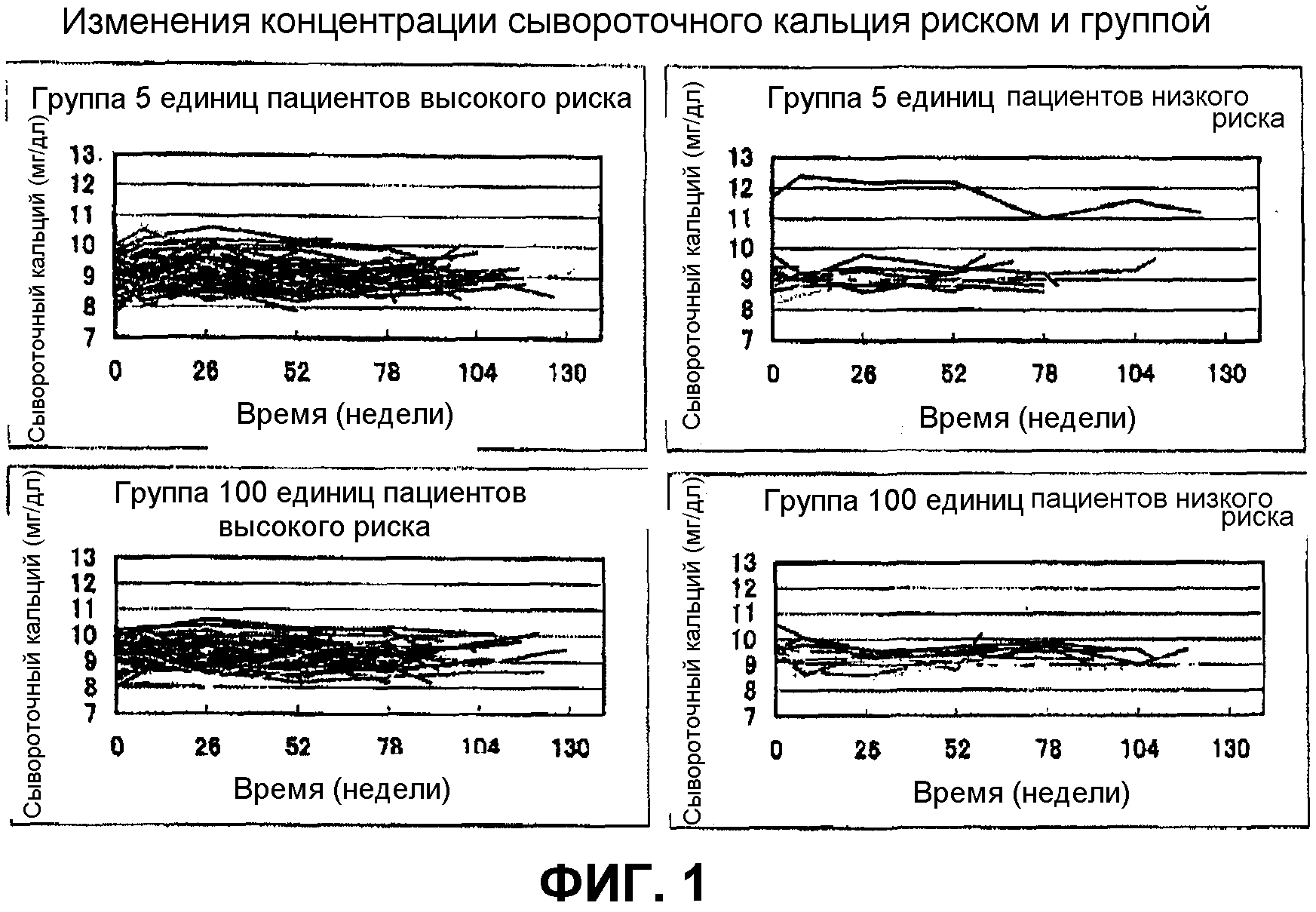
Фиг.1 является графиком, показывающим изменения в сывороточной концентрации кальция в группе введения (пациентов высокого риска, пациентов низкого риска);
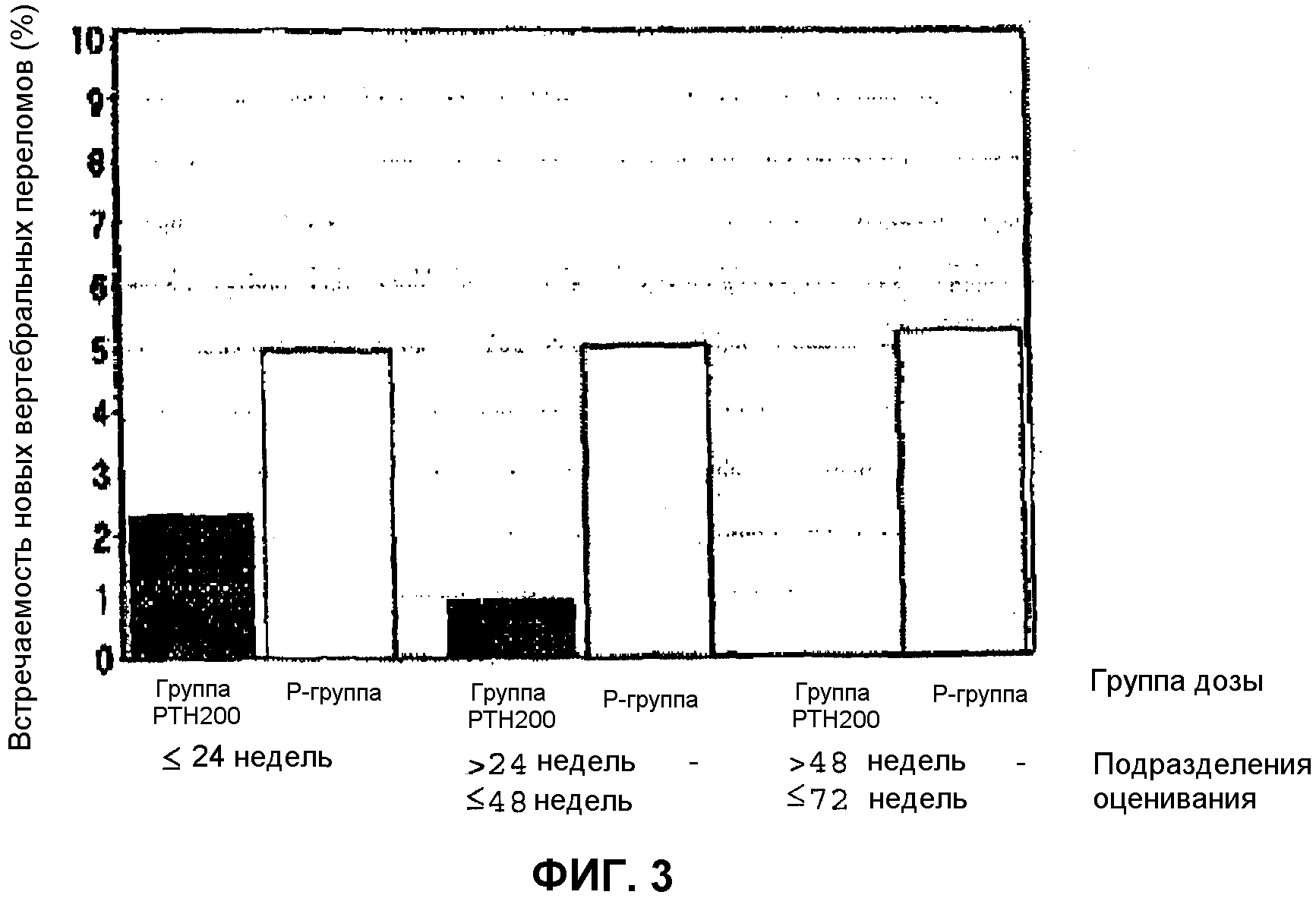
Фиг.2 показывает действия введения тестируемого лекарственного средства на протяжении времени в случае новых позвоночных переломов. Эта тест-группа лекарственного средства указана в списке как “группа PTH200” и контрольная группа указана как “Р-группа”;
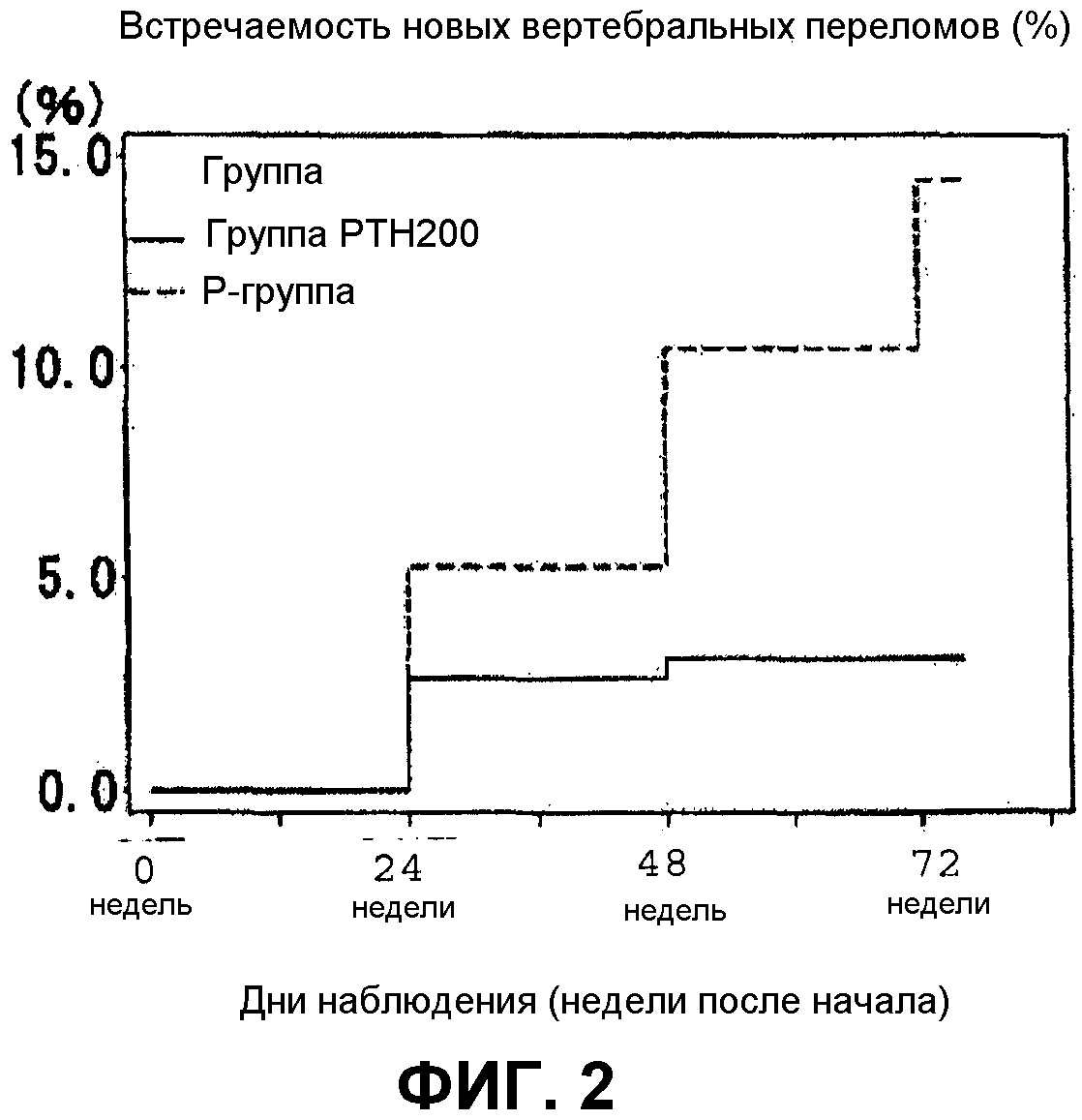
Фиг.3 показывает действия тестируемого лекарственного средства на изменения на протяжении времени в случае новых позвоночных переломов. Эта тест-группа лекарственного средства указана в списке как “группа PTH200” и контрольная группа указана как “Р-группа”;
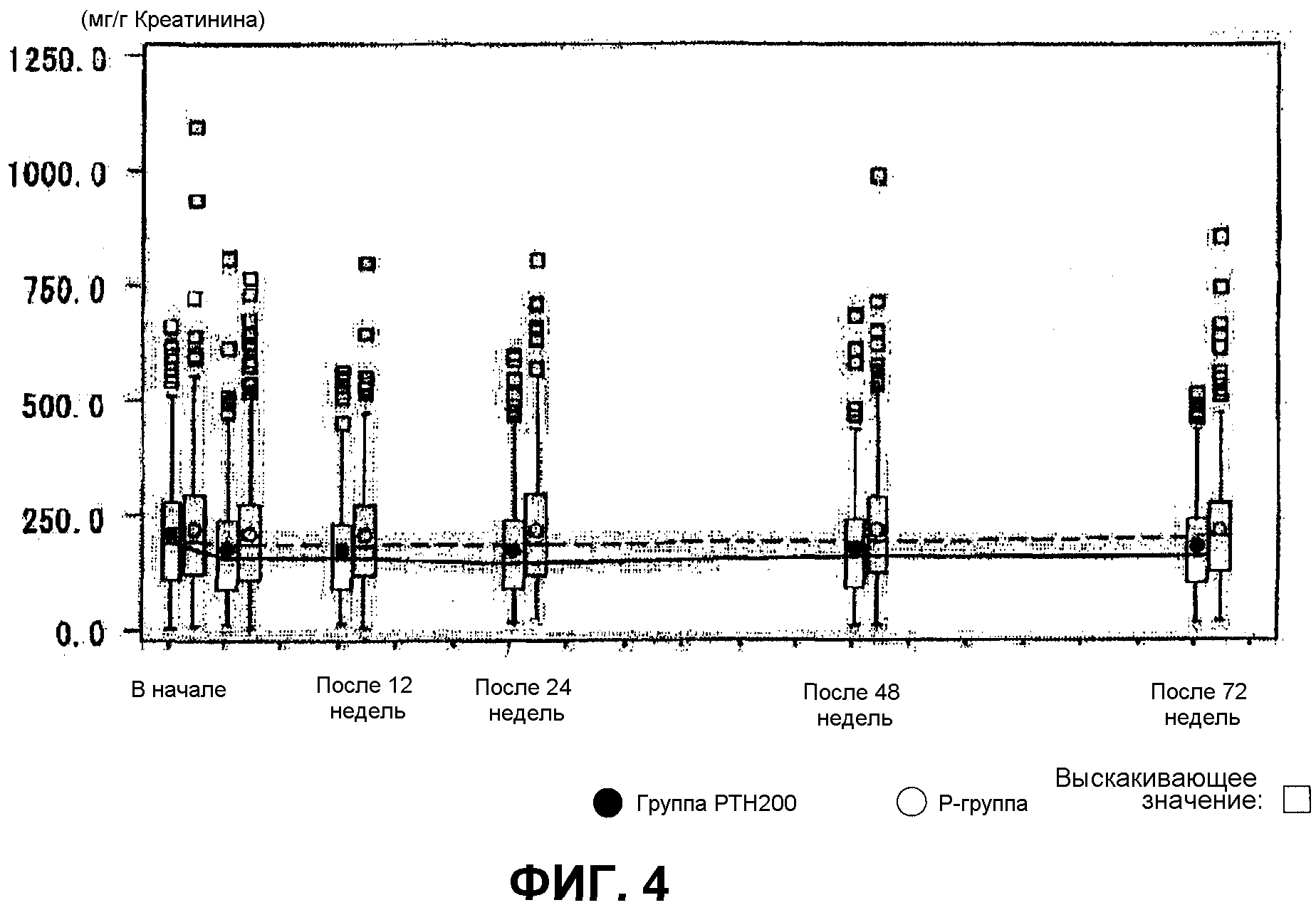
Фиг.4 показывает результаты на изменениях величины кальция мочи, при введении тестируемого лекарственного средства (“группы PTH200”) и контроля (“Р-группы”) пациентам один раз в неделю в течение 72 недель. Отношение величина кальция мочи/величина креатинина мочи сравнивали перед началом введения и во время недель наблюдения. Кальций мочи измеряли в начале (на старте), после 12 недель, после 24 недель, после 48 недель и после 72 недель. Стандартное сопутствующее лекарственное средство (610 мг кальция, 400 МЕ витамина D3 и 30 мг магния) принимали один раз в день после обеда со времени согласия пациента до конца этого исследования; и
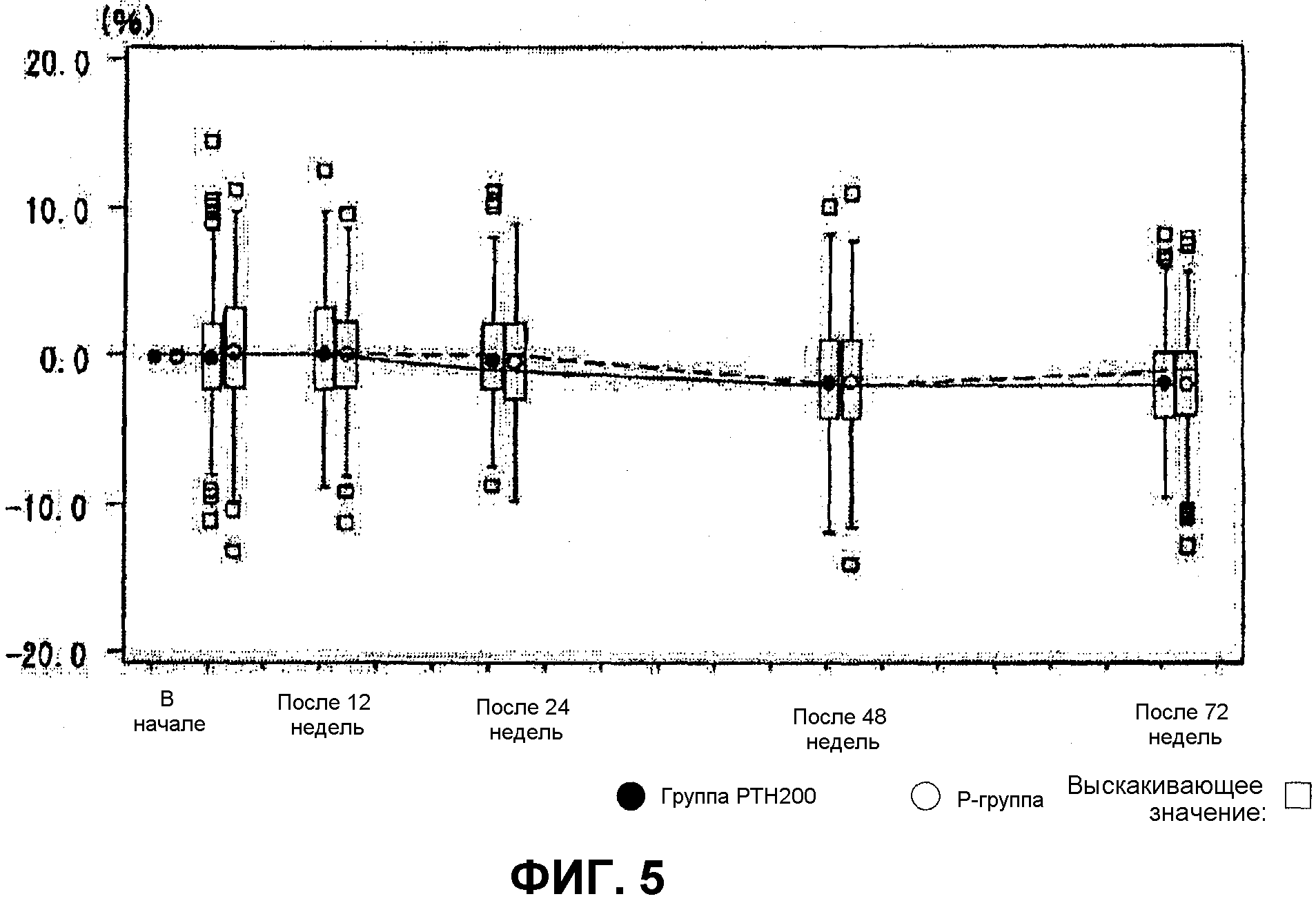
Фиг.5 показывает результаты на изменениях в корректированной величине сывороточного кальция при введении тестируемого лекарственного средства (“группе PTH200”) или контроля (“Р-группе”) пациентам один раз в неделю в течение 72 недель. Сывороточный кальций измеряли на старте, после 12 недель, после 24 недель, после 48 недель и после 72 недель. Стандартная величина сывороточного кальция: 8,4-10,4 мг/дл. Стандартное сопутствующее лекарственное средство (610 мг кальция, 400 МЕ витамина D3 и 30 мг магния) принимали один раз в день после обеда со времени согласия пациентов до конца этого исследования.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Данное изобретение подробно объясняется ниже.
Данное изобретение предоставляет способ для лечения или предотвращения остеопороза или способ для ингибирования или предотвращения переломов костей с использованием PTH, характеризующийся тем, что PTH вводят один раз в неделю в стандартной дозе 100-200 единиц (вместо “один раз в неделю” здесь иногда употребляется “каждую неделю”). Данное изобретение также предоставляет агент для лечения или предотвращения остеопороза или агент для ингибирования или предотвращения переломов костей, имеющий PTH в качестве активного ингредиента, характеризующийся тем, что PTH вводят каждую неделю в стандартной дозе 100-200 единиц. Кроме того, данное изобретение обеспечивает применение PTH для получения вышеуказанного агента для лечения или предотвращения остеопороза или вышеуказанного агента для ингибирования или предотвращения переломов костей.
I. Активный ингредиент
PTH, который является активным ингредиентом согласно данному изобретению (иногда называемый здесь далее просто “PTH”), включает в себя PTH человека (1-84), который является паращитовидным (паратиреоидным) гормоном человека и пептидами с молекулярной массой приблизительно 4000-10000, имеющими активность, эквивалентную PTH человека (1-84).
PTH включает в себя все из природного PTH, PTH, продуцируемого способами генетической инженерии, и PTH, синтезированного способами химического синтеза. PTH может быть получен способами генетической инженерии, которые сами по себе являются известными (непатентная ссылка 8). Альтернативно, PTH может быть синтезирован способами пептидного синтеза, которые сами по себе являются известными (непатентная ссылка 11). Например, он может быть синтезирован твердофазным способом, который удлиняет пептидную цепь от С-конца на нерастворимом полимерном носителе (непатентная ссылка 4). Кроме того, происхождение PTH данного изобретения не ограничивается человеком и может включать в себя PTH крысы, коровы, свиньи и т.п.
В этом описании, PTH человека (n-m) обозначает пептид, показанный частичной аминокислотной последовательностью от номера n до номера m в аминокислотной последовательности PTH человека (1-84). Например, PTH (1-34) человека обозначает пептид, показанный частичной аминокислотной последовательностью, состоящей из части от 1 до 34 в аминокислотной последовательности PTH человека (1-84).
PTH, который является активным ингредиентом в соответствии с данным изобретением, может быть также солью, образованной с одним, двумя или более типами летучих органических кислот. Примеры летучих органических кислот включают в себя трифторуксусную кислоту, муравьиную кислоту, уксусную кислоту и т.п. Уксусная кислота может быть представлена в качестве предпочтительного примера. Отношение этих двух компонентов, когда свободный PTH и летучая органическая кислота образуют соль, особо не ограничивается, пока образуется соль. Например, поскольку PTH (1-34) человека имеет девять основных аминокислотных остатков и четыре кислых аминокислотных остатка в его молекуле, с учетом образования соли в этих молекулах, основный аминокислотный остаток 5 может быть превращен в химический эквивалент уксусной кислоты. Например, если содержание уксусной кислоты, представленное отношением масса уксусной кислоты × 100 (%)/масса пептида PTH человека (1-34), используется в качестве количества уксусной кислоты, по одной теории, химический эквивалент уксусной кислоты против свободного PTH человека (1-34) становится приблизительно 7,3% (% масс.). В этом описании, свободный PTH человека (1-34) называют иногда терипаратидом и ацетат терипаратида также называют иногда терипаратидацетатом. Содержание уксусной кислоты в терипаратидацетате не ограничивается особо, пока этот терипаратид и уксусная кислота образуют соль. Например, это содержание может быть равно 7,3%, что выше теоретического химического эквивалента, или более высоким, или оно может быть 0-1%. Более конкретные примеры содержания уксусной кислоты в терипаратиде равны 1-7%, предпочтительно 2-6%. Эти соли могут быть получены способами, которые сами по себе известны (патентные ссылки 4 и 5).
Примеры PTH включают в себя PTH человека (1-84), PTH человека (1-34), PTH человека (1-38), hPTH (непатентная ссылка 5), PTH человека (1-34) NH2, [Nle8,18]PTH человека (1-34), [Nle8,18, Tyr34]PTH человека (1-34), [Nle8,18]PTH человека (1-34) NH2, [Nle8,18, Tyr34]PTH человека (1-34) NH2, мышиный PTH (1-84), мышиный PTH (1-34), бычий PTH (1-84), бычий PTH (1-34), бычий PTH (1-34) NH2 и т.п. Примерами предпочтительных PTH являются PTH человека (1-84), PTH человека (1-38), PTH человека (1-34) и PTH человека (1-34) NH2 (патентная ссылка 3, и т.д.). PTH человека (1-34) является примером особенно предпочтительного PTH. PTH человека (1-34), полученный химическим синтезом, является примером даже более предпочтительного PTH, а терипаратидацетат (Рабочий Пример 1) является примером наиболее предпочтительного PTH.
II. Объединенное применение с другими лекарственными средствами
В результатах двойного слепого сравнительного клинического исследования PTH, используемого в комбинации с кальцийсодержащими агентами, проводимого авторами данного изобретения, с присутствием переломов костей в качестве первичной точки, это действие проявлялось рано (после 24 или 26 недель), и гиперкальциемия не подтверждалась в качестве вредного побочного события (рабочие примеры 1 и 2). Таким образом, комбинированное применение с другими лекарственными средствами является одной характеристикой этого терапевтического агента против остеопороза или агента для ингибирования/предотвращения переломов костей согласно данному изобретению. Комбинированное применение с другими лекарственными средствами означает, что этот терапевтический агент против остеопороза или агент для ингибирования/предотвращения переломов костей согласно данному изобретению используется в комбинации с другим лекарственным средством (другими лекарственными средствами).
Кальций может рассматриваться в качестве предпочтительного примера другого лекарственного средства в данном изобретении. Однако утверждение о комбинированном применении с другими лекарственными средствами в данном изобретении не исключает дополнительного комбинированного применения с лекарственными средствами, отличными от указанных здесь. Таким образом, предпочтительные примеры комбинированного применения с кальцием включают в себя:
комбинированное применение только с кальцием и
комбинированное применение с кальцием и витамином D (в том числе его производными) и/или только магнием.
Кальцийсодержащие агенты могут рассматриваться в качестве примеров конкретных вариантов других лекарственных средств, и предпочтительные примеры включают в себя:
(1) Кальцийсодержащий агент, содержащий кальций в качестве активного фармацевтического ингредиента, и
(2) Кальцийсодержащий агент, содержащий кальций, витамин D (в том числе его производные) и магний в качестве активных фармацевтических ингредиентов.
Способ вышеуказанного комбинированного применения терапевтического агента против остеопороза или агента для ингибирования/предотвращения переломов костей согласно данному изобретению и других лекарственных средств (частота введения, способ введения, место введения, доза и т.п.) не являются ограниченными и могут определяться предписанием доктора и т.п. в согласии с пациентом.
Например, при применении кальцийсодержащего агента в комбинации с вышеуказанным другим лекарственным средством, этот кальцийсодержащий агент может вводиться одновременно с терапевтическим агентом против остеопороза или агентом для ингибирования/предотвращения переломов костей согласно данному изобретению, имеющим PTH в качестве активного ингредиента (другими словами, один раз в неделю) или может вводиться более часто от одного до нескольких раз в день. Таким образом, вышеуказанное другое лекарственное средство может быть приготовлено в виде комбинированного препарата в комбинации с терапевтическим/профилактическим агентом против остеопороза или агентом для ингибирования/предотвращения переломов костей согласно данному изобретению или может быть отдельным препаратом от терапевтического/профилактического агента против остеопороза или агента для ингибирования/предотвращения переломов костей согласно данному изобретению. Примеры таких кальцийсодержащих агентов включают в себя “New Calcichew (trademark) D3” (продаваемый: Daiichi Sankyo Health Care, изготовляемый и продаваемый: Nitto Pharmaceutical Industries, Ltd.).
Другие лекарственные средства могут также вводиться тем же самым или отличным способом введения вместе или последовательно (то есть, в разное время) с терапевтическим/профилактическим агентом против остеопороза или агентом для ингибирования/предотвращения переломов костей согласно данному изобретению. Таким образом, форма этих других лекарственных средств конкретно не ограничивается. Примеры включают в себя таблетки, капсулы, гранулы и т.п. Когда этим другим лекарственным средством является кальцийсодержащий агент, он является предпочтительно кальцийсодержащим агентом, содержащим стандартную дозу 100-400 (предпочтительно 150-350) мг кальция. Если вводится кальцийсодержащий агент, содержащий стандартную дозу 100-400 мг в виде кальция, например, в дозе двух таблеток в день в соответствии с рабочим примером данного изобретения, 200-800 мг в день будут введены в виде кальция. Однако возможности не ограничиваются этим.
Конкретные примеры вышеуказанных других лекарственных средств, например, в случае кальцийсодержащих агентов, включают в себя известные лекарственные средства, имеющие в качестве активного ингредиента осажденный карбонат кальция, лактат кальция, карбонат кальция, хлорид кальция, глюконат кальция, аспартат кальция, фосфат кальция, гидрофосфат кальция, цитрат кальция и т.п. Предпочтительными являются лекарственные средства, которые содержат осажденный карбонат кальция. Кроме того, это лекарственное средство может содержать, в случае необходимости, эксципиенты, связывающие агенты, дезинтегрирующие агенты, матирующие агенты, антациды и т.п.
Известно, что рвота, тошнота, недомогание, ощущение тупости в желудке, желудочный дискомфорт, изжога и другие подобные желудочно-кишечные симптомы наблюдались транзиторно у некоторого процента пациентов, которым вводили PTH (патентная ссылка 6).
В результате тестирования количества точек времени введения и эффективности различных противорвотных средств для противодействия тошноте и рвоте, ассоциированным с введением этого тестируемого лекарственного средства, авторы данного изобретения подтвердили, что Примперан (родовое название этого активного ингредиента: метоклопрамид), Наузелин (родовое название этого активного ингредиента: домперидон), Гастер D (родовое название этого активного ингредиента: фамотидин), гасмотин (родовое название этого активного ингредиента: мозаприда цитрат), Такепрон OD (родовое название этого активного ингредиента: лансопразол) и рокушинган являются эффективными против тошноты и рвоты, ассоциированными с введением PTH (рабочий пример 2). Таким образом, эти противорвотные средства являются предпочтительными в качестве других лекарственных средств, и Наузелин (родовое название этого активного ингредиента: домперидон), гасмотин (родовое название этого активного ингредиента: мозаприда цитрат) и/или рокушинган могут рассматриваться как предпочтительные примеры. Доза и введение этих противорвотных средств могут устанавливаться подходящим способом лечащим врачом или другим медицинским персоналом в соответствии с симптомами пациента и другими подобными факторами.
III. Период введения
Период введения терапевтического/профилактического агента против остеопороза или агента для ингибирования/предотвращения переломов костей согласно данному изобретению не ограничивается конкретно и может определяться соответствующим образом лечащим врачом или подобным медицинским персоналом в соответствии с конкретным пациентом. Авторы этого изобретения проводили двойное слепое сравнительное клиническое исследование с появлением переломов костей в качестве первичной точки с использованием периодов введения 156 недель или 72 недель. Удалось подтвердить значимое ингибирующее действие на переломы костей таким введением в этом исследовании, и это действие проявлялось рано (спустя 24 недели или спустя 26 недель) (рабочие примеры 1 и 2). Кроме того, не обнаруживали новых позвоночных переломов при продолжении введения в течение более 48 недель (рабочий пример 2). Таким образом, примеры периодов введения включают в себя 24 недели или более, 26 недель или более, 48 недель или более, 52 недели или более, 72 недели или более и 78 недель или более. Наиболее предпочтительным является введение в течение семидесяти восьми недель или более. В этом исследовании не наблюдали гиперкальциемии в качестве вредного побочного события (рабочий пример 1).
IV. Доза
В результате двойного слепого сравнительного клинического исследования с использованием стандартной дозы 100 или 200 единиц PTH, авторы этого изобретения обнаружили значимое ингибирующее действие на переломах костей, вызываемое этим введением, и показали, что этот эффект появлялся рано (спустя 24 недели или 26 недель) и что не было гиперкальциемии в качестве побочного вредного события (рабочие примеры 1 и 2).
Таким образом, одним из признаков данного изобретения является то, что стандартная доза равна 100-200 единицам. Здесь, одна единица PTH может измеряться способами измерения активности, которые сами по себе известны (непатентная ссылка 9). Эта стандартная доза предпочтительно равна 100 или 200 единицам, наиболее предпочтительно 200 единицам.
V. Интервал введения
В результате двойного слепого сравнительного клинического исследования, в котором PTH вводили один раз в неделю, авторы этого изобретения обнаружили значимое ингибирующее действие на переломах костей, вызываемое этим введением, и показали, что это действие появлялся рано (спустя 24 недели или 26 недель) и что не было гиперкальциемии в качестве побочного вредного события (рабочие примеры 1 и 2). Таким образом, интервал введения один раз в неделю является одним из признаков данного изобретения.
VI. Способ введения
Терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению могут вводиться способом введения, который соответствует форме этого препарата. Например, когда терапевтический или профилактический агент против остеопороза или агент для ингибирования или предотвращения переломов костей согласно данному изобретению является инъекционным раствором, он может вводиться внутривенно, внутриартериально, подкожно, внутримышечно и т.п. Авторы этого изобретения установили, что подкожная инъекция PTH имеет превосходную эффективность и безопасность (рабочие примеры 1 и 2). Таким образом, подкожное введение может рассматриваться как предпочтительный пример способа введения в данном изобретении.
VII. Заболевания-мишени
Остеопороз в данном изобретении не является конкретно ограниченным и включает в себя как первичный остеопороз, так и вторичный остеопороз. Примеры первичного остеопороза включают в себя инволюционный остеопороз (постменопаузальный остеопороз и возрастной (старческий) остеопороз)) и идиопатический остеопороз (остеопороз после беременности, ювенильный остеопороз и т.п.). Вторичный остеопороз является остеопорозом, вызываемым конкретным заболеванием, конкретным лекарственным средством или другой подобной причиной. Примеры причин включают в себя конкретные лекарственные средства, ревматоидный артрит, диабет, гипертиреоидизм, половую дисфункцию, неподвижность, питание, наследственные заболевания и т.п. Примером конкретного лекарственного средства является глюкокортикоид. Остеопороз, который создает высокий риск переломов костей, является предпочтительным примером остеопороза в данном изобретении. Показание данного изобретения против остеопороза, создающего высокий риск переломов костей, означает, что данное изобретение показано для следующих пациентов высокого риска.
Авторы данного изобретения подтвердили эффективность и безопасность данного изобретения в клиническом исследовании, проводимом у пациентов с первичным остеопорозом (рабочие примеры 1 и 2). Таким образом, первичный остеопороз может считаться предпочтительным примером остеопороза в данном изобретении, и инволюционный остеопороз может считаться особенно предпочтительным примером.
Авторы данного изобретения подтвердили действие данного изобретения в клиническом исследовании, проводимом у пациентов с первичным остеопорозом, которые принимали глюкокортикоид, который вызывает вторичный остеопороз (рабочий пример 2). Таким образом, пациенты с первичным остеопорозом, которые принимают глюкокортикоид, вызывающий вторичный остеопороз, могут считаться предпочтительным примером пациентов с первичным остеопорозом в данном изобретении.
Авторы данного изобретения подтвердили действие данного изобретения в клиническом исследовании, проводимом у пациентов с первичным остеопорозом, имеющих осложнения (диабет, гипертензию или гиперлипидемию) (рабочий пример 2). Таким образом, пациенты с остеопорозом, имеющие по меньшей мере одно осложнение из диабета, гипертензии и гиперлипидемии, могут рассматриваться как предпочтительный пример пациентов с остеопорозом в данном изобретении, и пациенты с первичным остеопорозом, имеющие по меньшей мере одно осложнение из диабета, гипертензии и гиперлипидемии, могут рассматриваться как более предпочтительный пример.
Известно, что диабет является, очень вероятно, фактором риска остеопорозных переломов костей (непатентная ссылка 16).
Следующие сообщения взаимосвязи между диабетическим остеопорозом и PTH основаны на исследованиях с использованием животных.
1) Сообщается, что введение PTH получающим стрептозотоцин крысам, которые обнаруживали диабетическую потерю костей, увеличивает “объем костей”, “толщину костных трабекул”, “остеоидную поверхность”, “минерализованную поверхность”, “скорость аппозиции минеральных веществ” и скорость образования костей” в губчатой оболочке и увеличивает “остеоидную поверхность”, “минерализованную поверхность”, “скорость аппозиции минеральных веществ” и “толщину кортикального слоя кости” в эндокортикальной оболочке (непатентная ссылка 21). Однако, в отличие от крыс с потерей костей вследствие других причин, у этих крыс не наблюдали заметного уменьшения в разъеденной поверхности.
2) Сообщается восстановление объема губчатого вещества и метаболизма костной ткани как результат введения PTH на протяжении восьми недель получающим стрептозотоцин крысам (непатентная ссылка 22).
3) Сообщается, что реакция на hPTH (1-34) уменьшается (истощение эффективности PTH) после воздействия высококонцентрированной глюкозы в экспериментах в культивируемых клетках (непатентная ссылка 20).
Авторы данного изобретения обнаружили, что многие лечащие врачи и т.п. ожидают, что PTH будет эффективным у пациентов-людей с диабетическим остеопорозом (например, http://www.richbone.com/kotsusoshosho/basic_shindan/tonyo.htm), но, с другой стороны, не обнаружили статей, которые доказывают это действие.
Таким образом, важно, что эти исследования доказали, что терапевтический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению уменьшает риск позвоночных переломов у пациентов, имеющих первичный остеопороз, осложненный диабетом.
Костные переломы в данном изобретении не ограничиваются конкретно. Они включают в себя как позвоночные, так и непозвоночные переломы (рабочий пример 1) и патологические переломы, вызываемые остеопорозом, несовершенным остеогенезом (osteogenesis imperfecta), костными опухолями и т.п., и травматические переломы, вызываемые дорожно-транспортными происшествиями, ударами и т.п. Предпочтительными примерами являются применения к переломам, связанным с остеопорозом, более предпочтительно позвоночным переломам, связанным с остеопорозом. Место перелома также не ограничивается конкретно. Типичные примеры включают в себя компрессионные переломы позвонков, переломы шейки бедренной кости, межвертельные переломы шейки бедра, переломы тела бедренной кости, переломы шейки плечевой кости и переломы дистального отдела лучевой кости. Компрессионные переломы позвонков могут рассматриваться в качестве конкретного примера.
Количество переломов костей не ограничивается конкретно в данном изобретении и включает в себя как единственные переломы, так и множественные переломы. Термин «единственный перелом» означает патологическое состояние, в котором кость является сломанной или треснутой только в одном местоположении. Множественные переломы обозначают патологическое состояние, в котором кость является сломанной или треснутой в двух или более местоположениях. Количество переломов во множественных переломах не ограничивается конкретно, но предпочтительным является применение к 2-4 переломам.
Позвоночные переломы в данном изобретении включают в себя также как новые переломы, так и ухудшающиеся переломы. Например, степень деформации может быть классифицирована по стадиям исследованием формы всего позвоночника и обычно классифицируется как стадия 0 (нормальная), стадия 1 (уменьшение приблизительно 20-25% в высоте позвоночника и уменьшение 10-20% в площади позвоночника), стадия 2 (уменьшение приблизительно 25-40% в высоте позвоночника и уменьшение 20-40% в площади позвоночника) и стадия 3 (уменьшение приблизительно 40% или более в высоте позвоночника и уменьшение 40% или более в площади позвоночника). Новые и ухудшающиеся (переломы) могут быть классифицированы по распределению увеличения стадий согласно критериям Genant. Конкретно, перелом диагностируется как новый перелом, когда обнаруживается изменение от стадии 0 к стадии 1, 2 или 3. Перелом может рассматриваться как ухудшающийся перелом, когда обнаруживается изменение от стадии 1 к стадии 2 или 3 или от стадии 2 к стадии 3. Высоту позвоночника измеряют в соответствии со способом Inoue et al. (непатентная ссылка 35) и со способом Hayashi et al. (непатентная ссылка 36) для точного оценивания этих изменений по стадии.
В клиническом исследовании, проводимом у пациентов, имеющих преобладающие (широко распространенные) переломы, данное изобретение показало ингибирующее действие данного изобретения на ухудшающиеся переломы (рабочий пример 2). Таким образом, пациенты, имеющие преобладающие переломы костей, могут рассматриваться как предпочтительные примеры, и пациенты, имеющие преобладающие переломы костей и возможность ухудшающихся переломов, могут быть даже более предпочтительными примерами в качестве пациентов с остеопорозом в данном изобретении.
Многие аспекты механизма этого усиливающего прочность костей действия PTH остаются неясными. Прочность костей отражает не только плотность костей, но также качество костей. Это означает, что не только плотность костей, но также микроструктуры костей, минерализация и другие подобные факторы качества костей определяют прочность кости (непатентная ссылка 17). Авторы данного изобретения считают, что на качество кости может влиять не только прочность кости, но также риск развития заболеваний, других, чем остеопороз, и лечебные результаты их осложнений. Предполагалась возможность, что терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей является лучшим, чем существующие терапевтические агенты (патентная ссылка 2), в этом отношении.
Патентная ссылка 2 описывает, что не только минеральный состав кости (ВМС) и минеральная плотность кости (BMD), но также площадь кости поясничного отдела позвоночника, бедренной кости и т.п. увеличивались в результате введения rhPTH (1-34) пациентам с остеопорозом. Увеличение площади кости означает утолщение наружной стороны этой кости.
Однако, толщина кортикального слоя кости увеличивалась скорее на внутренней стороне кости, а не снаружи в результате введения терапевтического/профилактического агента против остеопороза и агента для ингибирования/предотвращения переломов костей согласно данному изобретению пациентам с остеопорозом. Другими словами, фактически не обнаруживалось изменение в толщине кости как целого. Авторы изобретения считают, что этот механизм имеет следующее клиническое значение.
(1) Нет повреждения сустава вследствие утолщения длинных костей
Бедренная кость, которая является одной из длинных костей (длинных костей, которые конструируют четыре конечности), имеет ее эпифиз в контакте с хрящом сустава и образует коленный сустав вместе с синовиальной капсулой и мениском. Поверхность контакта называют поверхностью сустава, и она покрыта хрящом с толщиной нескольких миллиметров. Остеоартрит колена может быть примером заболевания, которое вызывает боль коленного сустава.
С другой стороны, известно, что Forteo (PTH для ежедневного введения) имеет более сильное усиливающее кость действие, чем Fosamax, у пациентов, имеющих индуцированный преднизоном остеопороз, осложненный артралгией (непатентные ссылки 23 и 24).
Однако это введение Forteo является общепринятым способом лечения, по существу эквивалентным введению PTH, описанному в патентной ссылке 2, и общепринятые способы являются способами лечения, которые утолщают наружную часть кости, как упомянуто выше. Утолщение снаружи бедренной кости означает увеличение площади поверхности сустава. Поскольку количество клеток хряща не увеличивается пропорционально утолщению этой кости, утолщение снаружи бедренной кости, индуцируемое этим общепринятым способом лечения, может стимулировать разрушение этого сустава через повреждение клеток хряща, запускаемое или обостряемое увеличением поверхности сустава.
Однако утолщение на внутренней стороне бедренной кости, как описано в данном изобретении, стабилизирует хрящ без увеличения площади сустава. Авторы этого изобретения считают, что в результате имеется возможность, что нагрузка на хрящ не увеличивается и по существу не стимулирует разрушение сустава. Это предполагает возможность, что лечение остеопороза этим лекарственным средством является лучшим лечением для этих суставов в сравнении с лечением остеопороза вышеуказанным общепринятым способом.
(2) Остеоартрит позвоночника не обостряется или не индуцируется утолщением позвонков
Нормальная костная масса позвонков уменьшается и позвонки становятся нестабильными по некоторым причинам, таким как старение. Дестабилизация начинается с деформации концевых пластинок. Дестабилизация позвонков обозначает конкретно истончение концевых пластинок и расширение отверстий концевых пластинок (центральных (Гаверсовых) каналов)). По мере прогрессирования этой дестабилизации, наблюдается проникновение межпозвонковых дисков в отверстия концевых пластинок и сужение этих межпозвонковых дисков. По мере дальнейшего прогрессирования этих симптомов, образуются остеофиты вследствие сжатия между позвонками. Такая дегенерация позвоночника является состоянием, называемым остеоартритом позвоночника. При развитии остеоартрита позвоночника остеоартрит продуцирует боль, вызываемую проникновением межпозвонковых дисков вследствие межпозвонковой стабилизации, боль, вызываемую опуханием окружающей мышцы, и т.п.
Однако когда кость утолщается ежедневным введением PTH, как описано в патентной ссылке 2, существует возможность, что достаточное ингибирующее действие на расширение отверстий концевых пластинок не будет наблюдаться. Существует также возможность, что увеличение в области контакта между позвонками и межпозвонковыми дисками будет сокращать расстояние между позвонками и стимулировать дестабилизацию позвонков, приводя к увеличенному риску развития или обострения остеоартрита позвоночника.
С другой стороны, поскольку терапевтический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению увеличивают толщину кортикального слоя кости внутри кости, а не снаружи, существует возможность, что расширение отверстий концевых пластинок и проникновение межпозвонковых дисков в эти отверстия концевых пластинок может адекватно ингибироваться.
(3) Не обостряется или не стимулируется развитие остеоартрита бедра или остеоартрита челюсти
Остеоартрит бедра является состоянием, в котором вертлужная впадина, которая образует тазобедренный сустав, и хрящ сустава этой контактной поверхности с бедренной головкой становятся изношенными, дегенерируют и подвергаются необратимым изменениям, вызываемым слабым кровотоком к этому суставу и высокой массой и перегрузкой. Площадь кортикального слоя тазобедренного сустава пациентов с остеоартритом тазобедренного сустава является значимо большей, чем площадь кортикального слоя тазобедренного сустава нормальных субъектов (непатентная ссылка 18). Увеличение площади кортикального слоя тазобедренного сустава означает утолщение наружной части этой бедренной кости. Таким образом, существует возможность, что это будет способствовать развитию или обострению остеоартрита этого тазобедренного сустава. Когда внутренняя часть этой бедренной кости утолщается, как в данном изобретении, имеется возможность, что риск развития или обострения остеоартрита этого тазобедренного сустава не будет увеличиваться, так как наружная сторона этой бедренной кости не утолщается. Деформация челюстного сустава является главным признаком остеоартрита челюсти, но утолщение кортикального слоя кости является одним из этих клинических открытий (непатентная ссылка 19). Таким образом, существует возможность, что дальнейшее утолщение снаружи этого кортикального слоя кости будет обострять эти симптомы или индуцировать появление этих симптомов. Когда внутренняя сторона этой кости утолщается, как в данном изобретении, предполагается, что имеется возможность, что такой риск развития или обострения остеоартрита челюсти не будет увеличиваться.
Чтобы свести вместе (1)-(3), описанные выше, пациенты с остеопорозом, имеющие по меньшей мере одно осложнение, состоящее из артралгии, остеоартрита позвоночника, метатипической боли в нижней части спины, остеоартрита тазобедренного сустава и остеоартрита челюсти (предпочтительно пациенты с первичным остеопорозом среди них), могут рассматриваться в качестве предпочтительных примеров пациентов, для которых показан терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению.
Авторы данного изобретения оценивали действия других лекарственных средств против остеопороза, принимаемых в пределах одного года, на эффективность этого лекарственного средства. В результате, стало ясным, что эффективность тестируемого лекарственного средства является более высокой у пациентов с первичным остеопорозом, которые имеют в истории болезни прием других терапевтических агентов против остеопороза, чем у пациентов, которые не принимали эти лекарственные средства (рабочий пример 2). Таким образом, пациенты с остеопорозом, которые имеют в истории болезни прием других терапевтических агентов против остеопороза, могут рассматриваться в качестве предпочтительного примера пациентов с остеопорозом в данном изобретении, и применение у пациентов с первичным остеопорозом, которые имеют в истории болезни прием других терапевтических агентов, является даже более предпочтительным.
Примеры других терапевтических агентов против остеопороза включают в себя L-аспартат кальция, Альфакальцидол, гидрохлорид ралоксифена, элкатонин, менатетренон и лактат кальция. Предпочтительными примерами являются L-аспартат кальция, Альфакальцидол и элкатонин. Другие терапевтические агенты против остеопороза могут предоставляться отдельно или в комбинации.
Терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению вводят предпочтительно в течение 24-72 недель или более продолжительно пациентам с остеопорозом, которые имеют в истории болезни прием других терапевтических агентов против остеопороза. Введение в течение 24 недель или более является особенно предпочтительным для пациентов, имеющих высокий риск переломов поясничных позвонков, а введение в течение 72 недель или более является особенно предпочтительным для пациентов, имеющих высокий риск переломов шейки бедренной кости или проксимальной части бедренной кости.
Частота поражения остеопорозом и почечной дисфункцией увеличивается с возрастом. Отчет широкомасштабного эпидемиологического исследования сообщает, что 85% пациентов-женщин с остеопорозом имеют легкую - умеренную почечную недостаточность (непатентная ссылка 32). Таким образом, важно обеспечить лекарственное средство, которое является безопасным и эффективным для пациентов с остеопорозом, которые имеют почечную недостаточность.
Авторы данного изобретения продемонстрировали, что этот терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению является эффективным у пациентов с остеопорозом, имеющих нормальную почечную функцию, пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и пациентов, имеющих умеренную почечную дисфункцию (рабочий пример 2). Кроме того, они выяснили, что этот терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению имеет одинаковую безопасность в отношении сывороточного кальция во всех этих группах.
Нормальная почечная функция, дисфункция и степень дисфункции могут классифицироваться на основе клиренса креатинина. Конкретно, клиренс креатинина 80 мл/мин или более высокий может оцениваться как нормальная почечная функция, от 50 до менее 80 мл/мин как легкая почечная дисфункция и от 30 до менее 50 мл/мин как умеренная почечная дисфункция.
Верхний предел нормы сывороточного кальция равен обычно 10,6 мг/мл. Выше этого, 11,0 мг/мл, могут быть названы слегка высоким уровнем. В общепринятом ежедневном введении PTH было обнаружено, что 11,76% пациентов с остеопорозом, имеющих умеренную почечную дисфункцию, имеют сывороточный кальций, превышающий 11,0 мг/мл, что является слегка высоким, после введения (непатентная ссылка 32). Однако даже ни один пациент с сывороточным кальцием, превышающим 11,0 мг/мл, не мог быть обнаружен в любое время тестирования от начала до конца введения, когда этот терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению вводили пациентам с остеопорозом, имеющим умеренную почечную дисфункцию в данном изобретении (рабочий пример 2). Другими словами, этот терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению является, по-видимому, превосходным не только в отношении эффективности, но также в отношении безопасности. Таким образом, пациенты с остеопорозом, имеющие легкую почечную дисфункцию, и/или пациенты с остеопорозом, имеющие умеренную почечную дисфункцию, могут рассматриваться в качестве примеров пациентов, для которых показано данное изобретение. Более предпочтительные примеры включают в себя пациентов с первичным остеопорозом, имеющих легкую почечную дисфункцию, и/или пациентов с остеопорозом, имеющих умеренную почечную дисфункцию.
Раса, возраст, пол, высота (рост), масса и т.п. субъектов, для которых показаны введение лекарственного средства или способ лечения согласно данному изобретению, не ограничиваются особо, но пациенты с остеопорозом являются примерами этих субъектов. Желательно применять способ данного изобретения или вводить этот терапевтический агент против остеопороза или агент для ингибирования или предотвращения переломов костей согласно данному изобретению пациентам с остеопорозом, имеющим многие факторы риска в отношении переломов костей при остеопорозе. Факторы риска в отношении переломов костей при остеопорозе включают в себя возраст, пол, низкую плотность костной ткани, преобладающие переломы костей, курение, потребление алкоголя, использование стероидов, семейный анамнез костных переломов, физические нагрузки, факторы, касающиеся падений, маркеры костного метаболизма, массу, поглощение кальция и т.п. (непатентная ссылка 10). Однако пациенты с остеопорозом (или субъекты), которые удовлетворяют всем из следующих условий (1)-(3), определяются как “пациенты высокого риска” в данном изобретении.
(1) Возраст 65 лет или более,
(2) Преобладающие переломы костей,
(3) Плотность костей менее 80% средней плотности молодого взрослого и/или степень атрофии костей I или более высокая.
Здесь, плотность костной ткани обычно обозначает минеральную плотность костной ткани поясничного отдела позвоночника. Однако когда трудно оценивать минеральную плотность костной ткани поясничного отдела позвоночника, эта плотность костной ткани может быть представлена минеральной плотностью лучевой кости, второй пястной кости, шейки бедра или пяточной кости. Среднее молодого взрослого субъекта обозначает усредненную плотность костной ткани 20-44-летних субъектов. Плотность костной ткани может быть измерена способами, которые сами по себе известны, например, двухэнергетической рентгеновской абсорбциометрией, фотоденситометрией, фотонной абсорбциометрией, количественным компьютеро-томографическим сканированием (СТ), количественной ультразвуковой томографией и т.п. Степень атрофии кости означает степень потери массы костной ткани при использовании рентгеновского излучения в данном изобретении. Степень атрофии костной ткани классифицируется как отсутствие атрофии костной ткани, стадия I атрофии костной ткани, стадия II атрофии костной ткани и стадия III атрофии костной ткани. Ни одна атрофия по этой шкале не означает нормального состояния, то есть, состояния, в котором трабекулярная структура не может быть распознана, так как эти поперечные и продольные трабекулы являются плотными. Атрофия костной ткани стадии I означает, что продольные трабекулы являются выступающими. Обычно продольные трабекулы являются тонкими и видимыми, но все еще плотно размещенными. Это означает также состояние, в котором вертебральные концевые пластинки являются выступающими. Атрофия костной ткани стадии II по этой шкале означает состояние, в котором продольные трабекулы стали грубыми, кажутся толстыми и неровно размещенными, и эти вертебральные концевые пластинки являются также более светлыми. Атрофия костной ткани стадии III по этой шкале означает, что продольные трабекулы стали неотчетливыми, тени позвонков повсюду кажутся расплывчатыми, и это отличие от теней межпозвонковых дисков уменьшается (Osteoporosis Treatment, 5/3, July 2006 number, “Diagnosis of osteoporosis by simple x-ray”). Степень атрофии костной ткани может оцениваться, например, по латеральному затемнению на рентгенограмме поясничного отдела позвоночника. Количество вертебральных переломов в данном изобретении может быть легко измерено, например, по способу Genant et al., (непатентная ссылка 14). Переломы костей в местоположениях, других, чем позвонки, могут быть подтверждены легко, например, с использованием рентгеновской пленки.
В данном изобретении особенно предпочтительно применять способ данного изобретения или вводить терапевтический агент, профилактический агент против остеопороза или агент для ингибирования или предотвращения переломов костей согласно данному изобретению, в частности, пациентам с высоким риском (рабочий пример 1).
С другой стороны, обычно предпочтительно избегать применения способа данного изобретения или введения терапевтического агента, профилактического агента против остеопороза или агента для ингибирования или предотвращения переломов костей согласно данному изобретению к пациентам (субъектам), к которым относится любой из следующих (1)-(6).
(1) Пациенты с бронхиальной астмой или тенденцией к сыпи (эритемой, крапивницей и т.п.) и другими подобными аллергическими реакциями
(2) Пациенты с гиперкальциемией
(3) Женщины, которые беременны или могут стать беременными
(4) Пациенты с гипотиреоидизмом или гиперпаратиреоидизмом
(5) Пациенты, которые обнаруживали аллергию к лекарственным средствам в прошлом
(6) Пациенты, имеющие сердечное заболевание, заболевание печени, заболевание почки или другие подобные серьезные осложнения
Таким образом, вышеуказанные пациенты высокого риска и пациенты с остеопорозом, к которым не относится ни один из вышеуказанных (1)-(6), являются предпочтительными субъектами в данном изобретении.
VIII. Приготовление
Этот терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению (иногда называемый здесь далее просто “этим лекарственным средством”) может принимать форму различных препаратов. Это лекарственное средство обычно готовят в виде инъекционного раствора одного PTH или вместе с обычным фармакологически приемлемым носителем. Инъекционный раствор является предпочтительной формой этого лекарственного средства.
Например, когда это лекарственное средство является инъекционным раствором, оно может быть приготовлено растворением PTH в подходящем растворителе (стерилизованной воде, буфере, физиологическом солевом растворе или т.п.), стерилизацией этого раствора фильтрованием при помощи фильтра или т.п. и/или другим подходящим способом и разливанием его в стерильные контейнеры. В этом случае предпочтительно добавлять любые необходимые добавки (например, эксципиенты, стабилизаторы, способствующие растворению агенты, антиоксиданты, анальгетики, изотонирующие агенты, регуляторы рН, консерванты и т.п.) вместе с PTH. Примеры таких добавок включают в себя сахара, аминокислоты, хлорид натрия и т.п. При использовании в качестве добавок сахаров предпочтительно добавлять одну массовую часть или более (предпочтительно 50-100 массовых частей) маннита, глюкозы, сорбита, инозита, сахарозы, мальтозы, лактозы или трегалозы в качестве сахаров на массовую часть PTH. При использовании в качестве добавок сахаров и хлорида натрия, предпочтительно добавлять 1/1000-1/5 массовых частей (предпочтительно 1/100-1/10 массовых частей) хлорида натрия на массовую часть сахаров.
Например, когда это лекарственное средство является инъекционным раствором, это лекарственное средство может быть отверждено лиофилизацией или другими подобными способами (с получением лиофилизированного препарата или т.п.) и может быть растворено в подходящем растворителе в момент использования. Альтернативно, когда это лекарственное средство является инъекционным раствором, это лекарственное средство может быть растворено в жидкости заранее.
Это лекарственное средство содержится предпочтительно в упаковке, которая имеет указания, что стандартная доза 100-200 единиц PTH человека (1-34) должна вводиться один раз в неделю в качестве терапевтического агента против остеопороза и агента для ингибирования/предотвращения переломов костей или содержится в упаковке вместе с вкладышем упаковки, который содержит это указание.
Кроме того, применимость данного изобретения может быть легко подтверждена статистической обработкой результатов клинических исследований, которые представлены в рабочих примерах, обычными способами. Данное изобретение объясняется более конкретно ниже посредством рабочих примеров, но объем данного изобретения не ограничивается следующими рабочими примерами.
РАБОЧИЕ ПРИМЕРЫ
Рабочий пример 1
Пациентам мужского и женского пола, диагностированным как имеющих первичный остеопороз (непатентная ссылка 12), вводили подкожно 5 или 100 единиц терипаратидацетата, приготовленного по способу Takai (патентные ссылки 4 и 5 и непатентная ссылка 11), один раз в неделю (обозначаемым соответственно как группа 5 единиц или группа 100 единиц). Кроме того, активность этого терипаратидацетата измеряли согласно статье Marcus et al. (непатентная ссылка 9).
В этих группах 5 единиц и 100 единиц, лиофилизированный препарат, содержащий 5 или 100 единиц терипаратидацетата на флакон, растворяли в 1 мл физиологического солевого раствора и весь объем раствора вводили. Как группе 5, так и группе 100 единиц вводили две таблетки кальцийсодержащего агента (содержащего 500 мг осажденного карбоната кальция [200 мг в виде кальция] на таблетку) один раз в день.
Пациентов с остеопорозом классифицировали в виде состояния, показанного в таблице 1, на основе присутствующих факторов риска переломов костей, как в непатентной ссылке 13, и сравнивали. Пациенты высокого риска определялись как имеющие все три фактора, включающие в себя возраст, преобладающие переломы позвонков и плотность костной ткани или атрофию костной ткани; пациенты низкого риска определялись как другие, чем вышеописанные.
|
|
Таблицы 2 и 3 показывают фон пациента. Не были обнаружены статистически значимые различия в фоне этих двух групп (р<0,5).
|
|
Одновременное использование препаратов кальцитонина, препаратов активного витамина D3, препаратов витамина К, препаратов иприфлавона, препаратов бисфосфоната, препаратов эстрогена, препаратов усиливающих синтез белка гормонов, препаратов кальция, предписанных лечащим врачом (однако, за исключением вышеуказанного кальцийсодержащего агента, вводимого в дозе двух таблеток один раз в день) и других лекарственных средств, которые могут влиять на метаболизм костей, был запрещен во время периода введения. Минеральную плотность костной ткани поясничного отдела позвоночника и встречаемость переломов кости определяли в качестве оцениваний костной ткани. Для минеральной плотности костной ткани поясничного отдела позвоночника измеряли плотность костной ткани второго - четвертого позвонков поясничного отдела позвоночника в начале и каждые шесть месяцев после этого с использованием двухэнергетической рентгеновской абсорбциометрии (DXA). Для частоты переломов костей рентгеновские снимки получали с передней и задней сторон четвертого торакального позвонка - пятого поясничного позвонка в начале и каждые шесть месяцев после этого, и новые переломы позвонков оценивали сравнением рентгеновских пленок в начале и в каждой точке времени после этого с использованием способа Genant et al. (непатентная ссылка 14) в качестве ссылки. В местоположениях, других, чем позвонки, переломы оценивали исследованием рентгеновских пленок. Брали также пробы крови у всех пациентов в начале и во время введения, и измеряли величины общих лабораторных анализов, в том числе концентрацию кальция. Период введения у пациентов высокого риска (DXA и новые переломы позвонков оценивали коллективно в центре; переломы, другие, чем переломы позвонков, оценивались исследователем на основе рентгеновских пленок) был равен 85,1±20,8 недель в группе 5 единиц и 83,7±19,8 недель в группе 100 единиц. Не было обнаружено значимое различие между этими двумя группами (р<0,05). Период введения у пациентов низкого риска был равен 72,7±19,4 недель в группе 5 единиц и 88,3±21,3 недель в группе 100 единиц. Не было обнаружено значимое различие между этими двумя группами (р<0,05).
Таблицы 4 и 5 показывают изменения в плотности костной ткани позвонков группы пациентов высокого риска и пациентов низкого риска. У пациентов высокого риска было обнаружено значимое увеличение в плотности костной ткани группы 100 единиц в сравнении с началом введения, и эта величина была также значимо более высокой, чем эта же величина в группе 5 единиц (р<0,05). С другой стороны, не было обнаружено значимое различие в сравнении с началом введения и в сравнении между группами у пациентов с низким риском (р<0,05).
|
|
Таблицы 6 и 7 показывают результаты по встречаемости новых переломов позвонков группы пациентов с высоким риском и низким риском. У пациентов с высоким риском встречаемость переломов была значимо более низкой в группе 100 единиц, чем в группе 5 единиц (р<0,05). С другой стороны, не могло быть обнаружено значимое различие между группами у пациентов с низким риском (р<0,05).
|
|
Таблицы 8 и 9 показывают результаты по встречаемости новых переломов позвонков группой каждые 26 недель у пациентов с высоким риском и пациентов с низким риском. У пациентов с высоким риском встречаемость переломов была подавлена от времени после 26 недель в группе 100 единиц в сравнении с группой 5 единиц. С другой стороны, не могло быть обнаружено значимое различие между группами у пациентов с низким риском.
|
|
|
Таблицы 10 и 11 показывают результаты по встречаемости переломов в местах, других чем позвонки, группы пациентов с высоким риском и пациентов с низким риском. У пациентов с высоким риском встречаемость переломов была значимо более низкой в группе 100 единиц, чем в группе 5 единиц. С другой стороны, не могло быть обнаружено значимое различие между группами у пациентов с низким риском.
|
|
Фиг.1 показывает результаты по изменениям в концентрации сывороточного кальция группы пациентов с высоким риском и пациентов с низким риском. Ни в одном случае не обнаруживали гиперкальциемии, за исключением одного пациента с низким риском в группе 5 единиц, который имел высокую величину в сравнении с величиной перед началом введения лекарственного средства, в результатах величин лабораторных анализов, и не наблюдали тенденции к повышению в отношении сывороточного кальция.
Как видно из приведенных выше таблиц, подкожное введение 100 единиц терипаратидацетата один раз в неделю значимо увеличивало плотность костной массы поясничного отдела позвоночника и ингибировало новые переломы позвонков у пациентов с первичным остеопорозом, имеющих факторы риска в отношении новых переломов. Другими словами, было подтверждено, что введение 100 единиц терипаратидацетата один раз в неделю обеспечивает полезный терапевтический агент против остеопороза и агент для ингибирования или предотвращения переломов костей у пациентов данного изобретения при высоком риске в отношении новых переломов.
Введение терипаратидацетата один раз в неделю данного изобретения также не вызывает гиперкальциемии при любой дозе во время периода введения и, по-видимому, является более полезным, чем известное введение один раз в день терипаратидацетата.
Рабочий пример 2
Тестируемое лекарственное средство (один флакон; инъекционный лиофилизированный препарат, содержащий 200 единиц терипаратидацетата на флакон), приготовленное по способу Takai (патентные ссылки 4 и 5 и непатентная ссылка 11) и контроль (один флакон; препарат плацебо, по существу не содержащий терипаратидацетата на флакон), каждые, растворяли в момент использования в 1 мл физиологического солевого раствора и вводили перемежающимся образом при частоте один раз в неделю на протяжении периода 72 недель пациентам высокого риска мужского и женского пола, диагностированным как имеющие первичный остеопороз.
Вышеуказанные пациенты принимали также две таблетки кальцийсодержащего агента один раз в день после обеда. Этот кальцийсодержащий препарат был мягким жевательным препаратом, который содержал 610 мг кальция, 400 МЕ витамина D3 и 30 мг магния в двух таблетках. Этот препарат содержал осажденный карбонат кальция, карбонат магния, холекальциферол (витамин D3) и т.п. в качестве компонентов, и он продается под товарным названием “New Calcichew (trademark) D3” (продаваемый: Daiichi Sankyo Health Care, изготовляемый и продаваемый: Nitto Pharmateutical Industries, Ltd.).
Кроме того, вышеуказанные пациенты были все амбулаторными пациентами, которые были способны ходить самостоятельно, к которым не имели отношения (1)-(19), представленные ниже.
(1) Пациенты, диагностированные как имеющие вторичный остеопороз вследствие конкретной причины. Здесь, конкретные причины включают в себя эндокринные (гипертиреоидизм, гонадную недостаточность, синдром Кушинга), питательные (цингу, другие причины (белковую недостаточность, избыток витамина А или D)), лекарственные средства (адренокортикальные гормоны, метотрексат (МТХ), гепарин, ингибиторы ароматазы, агонисты GnRH), неподвижность (системная (постельный режим, параплегия, путешествие на самолете), локализованные (после перелома кости и т.п.), наследственные (несовершенный остеогенез, синдром Марфана и т.п.), другие заболевания (ревматоидный артрит, диабет, заболевание печени, желудочно-кишечное заболевание (резекция желудка) и т.п.).
(2) Пациенты, имеющие конкретные заболевания, другие чем остеопороз, которые предоставляют потерю костной ткани. Здесь, конкретные заболевания включают в себя различные остеомаляции, первичный, вторичный гиперпаратиреоидизм, костные метастазы злокачественных опухолей, множественную миелому, вертебральную гемангиому, болезнь Потта, пиогенный спондилит и другие.
(3) Пациенты, имеющие специфические рентгеновские результаты, которые могут влиять на прочность позвонка. Здесь, специфические означает соединение мостиком шести или более последовательных позвонков, тяжелую оссификацию связок, окружающих позвонок, тяжелую деформацию позвоночного столба и наличие в прошлом операции на позвонках.
(4) Пациенты, которые носят корсет, покрывающий весь торакальный и поясничный отдел позвоночника.
(5) Пациенты, которым вводили препараты бисфосфоната в пределах 52 недель (364 дней) с момента согласия.
(6) Пациенты, которым вводили следующие терапевтические агенты против остеопороза в момент согласия (однако, они могут быть выбраны в качестве субъектов, если возможен период промывания в течение 8 недель (56 дней) или более перед началом лечения): препараты кальцитонина, препараты активного витамина D3, препараты витамина К, препараты иприфлавона, препараты эстрогена, препараты SERM, препараты анаболических, усиливающих синтез белка гормонов.
(7) Пациенты с бронхиальной астмой или тенденцией к образованию сыпи (эритемой, крапивницей и т.п.), и другими подобными симптомами аллергии.
(8) Пациенты с аллергией к препаратам PTH в анамнезе.
(9) Пациенты с болезнью Педжета костей.
(10) Пациенты с существующими злокачественными костными опухолями или имевшие злокачественные опухоли в пределах последних пяти лет.
(11) Пациенты со множественной миеломой.
(12) Пациенты с внутренней или наружной лучевой терапией скелета в анамнезе.
(13) Пациенты с величиной кальция в сыворотке 11,0 мг/дл или более высокой.
(14) Пациенты с величиной щелочной фосфатазы в два или более раз превышающей верхний предел стандартной величины.
(15) Пациенты с серьезным заболеванием почек, заболеванием печени или сердечным заболеванием. Критерии для каждого заболевания являются следующими:
Заболевание почек: Величина сывороточного креатинина 2 мг/дл или более высокая
Заболевание печени: Величина AST (GOT) или ALT (GPT) в 2,5 раз больше верхнего предела стандартной величины или является более высокой или равна 100 МЕ/л или является более высокой
Сердечное заболевании: оцениваемое с использованием стадии 2, показанной в: “Severity classification criteria for side effects of pharmaceutical products (June 29, 1992 Drug Safety Notification No, 80)” в качестве ссылки.
(16) Пациенты, оцениваемые как имеющие низкую достоверность в медицинском интервью (определенно исключаются по меньшей мере пациенты с деменцией).
(17) Пациенты, которым вводили другие тестируемые лекарственные средства в пределах 26 недель (182 дней) перед согласием.
(18) Пациенты, которым вводили препараты PTH в прошлых исследованиях.
(19) Другие пациенты, считающиеся неподходящими для этого исследования, по мнению исследователя.
Введение любого из следующих лекарственных средств (1)-(6) вышеуказанным пациентам запрещается со времени согласия на исследование до окончания этого исследования.
(1) Терапевтические агенты против остеопороза, другие чем терипаратидацетат (конкретно, препараты бисфосфоната, препараты кальцитонина, препараты активного витамина D3, кальцийсодержащие агенты (однако, за исключением вышеуказанного кальцийсодержащего агента, принимаемого один раз в день после обеда), препараты витамина К, препараты иприфлавона, препараты эстрогена, препараты SERM и препараты анаболического гормона)
2) Препараты адренокортикальных гормонов (однако, когда средняя недельная доза превышает 5 мг/день, суточная доза превышает 10 мг/день или общая доза превышает 450 мг, рассчитывали на преднизолон, вводимый внутримышечно, внутривенно или перорально)
(3) Ингибиторы ароматазы
(4) Агонисты GnRH
(5) Другие тестируемые лекарственные средства
Количества пациентов, которым вводили тестируемое лекарственное средство и контроль, были равны 290 (также иногда называемые группой тестируемого лекарства в рабочем примере) и 288 (также иногда называемые контрольной группой в рабочем примере), соответственно. Общее количество пациентов, которым вводили тестируемое лекарственное средство или контроль, было равно 578. Однако это количество в каждой группе иногда различается в зависимости от типа теста и выражается, например, как (n=**) или оцениваемым количеством или т.п.
Плотность костной ткани, геометрию костной ткани и встречаемость переломов костей исследовали в виде оценок костной ткани.
Для плотности костной ткани поясничного отдела позвоночника плотность второго - четвертого позвонков поясничного отдела позвоночника измеряли в начале и каждые 24 недели после этого с использованием двухэнергетической рентгеновской абсорбциометрии (DXA).
Для плотности костной ткани бедренной кости только левую сторону проксимальной части этой бедренной кости, повернутой на 20º измеряли в начале и каждые 24 недели после этого с использованием двухэнергетической рентгеновской абсорбциометрии (DXA).
Геометрию DXA оценивали с использованием результатов плотности костной массы бедренной кости, измеренной исследователем в начале и каждые 24 недели после этого.
Для КТ-геометрии, проксимальную часть бедренной кости измеряли в начале и после 48 и 72 недель с использованием многослойного компьютерно-томографического сканирования (КТ).
Встречаемость переломов костей проверяли фронтальными и латеральными рентгеновскими изображениями четвертого торакального - пятого поясничного позвонков, полученными в начале введения и каждые 24 недели после этого. Рентгеновские пленки в начале и в каждой точке во времени после этого сравнивали с использованием способа Genant et al. (непатентная ссылка 14) в качестве ссылки, и оценивали новые и ухудшающиеся переломы позвонков. Местоположения, другие чем эти позвонки, оценивали исследованием рентгеновской пленки (DXA, геометрии костной ткани и новых и ухудшающихся переломов позвонков оценивали вместе в центре; фракции, другие чем позвонки, оценивались исследователем на основе рентгеновских пленок).
(А) Эффективность тестируемого лекарственного средства против множественных вертебральных переломов
Здесь, “множественные вертебральные переломы” определяются как два или более новых вертебральных переломов. При сравнении встречаемости множественных вертебральных переломов (количества случаев) в группе тестируемого лекарственного средства (n = 261) и контрольной группе (n=281) после 72 недель введения, в контрольной группе были 2,1% (6 случаев) и в группе тестируемого лекарственного средства были 0,8% (2 случая). Другими словами, тестируемое лекарственное средство демонстрировало ингибирующее или предотвращающее действие против множественных вертебральных переломов.
Количество случаев с каждым количеством переломов представлено в таблице ниже.
|
(В) Эффективность тестируемого лекарственного средства у пациентов с остеопорозом, принимающих глюкокортикоид
Исследовали действие введения тестируемого лекарственного средства пациентам с первичным остеопорозом, принимающим глюкокортикоид. Эти результаты были результатами, показанными в таблице ниже. Было показано, что это тестируемое лекарственное средство является эффективным у пациентов с первичным остеопорозом, принимающих глюкокортикоид.
|
|
Поскольку глюкокортикоиды являются лекарственными средствами, которые вызывают вторичный остеопороз, приведенные выше результаты предполагают, что тестируемое лекарственное средство может быть эффективным против вторичного остеопороза, вызываемого лекарственными средствами, которые запускают вторичный остеопороз, такими как глюкокортикоиды.
(С) Эффективность этого тестируемого лекарственного средства на трех частях бедренной кости
Действия этого лекарственного средства на трех частях бедренной кости (шейке бедра, вертеле и диафизе бедренной кости) исследовали с использованием обычных КТ-сканирований. Эти результаты были такими, как результаты, представленные в таблице ниже. Было показано, что тестируемое лекарственное средство является эффективным на каждой части этой бедренной кости.
|
|
|
(D) Исследование предписаний для тошноты и рвоты, ассоциированных с введением этого тестируемого лекарственного средства
Исследовали период введения и эффективность различных лекарственных средств для лечения тошноты и рвоты, ассоциированных с введением этого тестируемого лекарственного средства.
|
|
Как показано выше, примперан, Наузелин, Gaster D, Гасмотин, Такепрон OD и рокушинган были эффективными. Наузелин, гасмотин и рокушинган были особенно предпочтительными.
(Е) Оценивание эффектов этих типов и наличия осложнений на действия тестируемого лекарственного средства
Некоторые из вышеуказанных пациентов имели осложнения. Таким образом, оценивали эффекты этого типа (диабет, гипертензию, гиперлипидемию) и наличие осложнений на действия тестируемого лекарственного средства. Эти результаты были такими, как результаты, показанные в таблице ниже. Было выяснено, что это тестируемое средство ингибирует развитие новых вертебральных переломов после 24 недель введения независимо от типа или наличия осложнений.
|
|
Диабетический остеопороз, при котором диабет является лежащим в основе заболеванием, является одной из форм вторичного остеопороза, но тот факт, что было обнаружено, что тестируемое лекарственное средство влияет на пациентов с первичным остеопорозом, имеющих диабет в качестве осложнения, предполагает возможность того, что это тестируемое лекарственное средство будет также оказывать терапевтическое действие в случае диабетического остеопороза.
(F) Эффективность тестируемого лекарственного средства в случае ухудшения переломов костей
Исследовали эффективность тестируемого лекарственного средства на ухудшающихся переломах костей. Эти результаты были такими, как приведенные в таблице ниже. Было показано, что тестируемое лекарственное средство является эффективным в случае ухудшающихся переломов костей.
|
(G) Оценивание влияния приема других терапевтических агентов против остеопороза в истории болезни на эффективность тестируемого лекарственного средства
Как утверждалось выше, вышеуказанным пациентам, в качестве основного правила, запрещалось принимать любые терапевтические агенты против остеопороза, другие чем терипаратидацетат, со времени согласия на участие в этом исследовании до конца этого исследования. Таким образом, влияния приема в истории болезни других терапевтических агентов против остеопороза на эффективность этого тестируемого лекарственного средства оценивали с точек зрения встречаемости новых вертебральных переломов и процентного изменения плотности костной ткани.
Таблица ниже показывает результаты, полученные оцениванием встречаемости новых вертебральных переломов. В этой таблице, встречаемость переломов была 2,9% в группе тестируемого лекарственного средства и 16,1% в контрольной группе после 72 недель введения в пациентов с историей болезни с приемом других терапевтических агентов против остеопороза. Встречаемость переломов костей была 3,2% в группе тестируемого лекарственного средства и 12,9% в контрольной группе у пациентов без такой истории болезни. Другими словами, было выяснено, что тестируемое лекарственное средство имеет более высокую эффективность у пациентов с историей болезни с приемом других терапевтических агентов, чем у пациентов, не имеющих такой истории болезни.
|
Таблица ниже показывает результаты, полученные оцениванием процентного изменения плотности костной ткани. В этой таблице, увеличение минеральной плотности костной ткани в поясничном отделе позвоночника после 48 недель введения тестируемого лекарственного средства было удивительным даже у пациентов с историей приема других терапевтических агентов против остеопороза. В частности, заметное увеличение минеральной плотности костной ткани поясничного отдела позвоночника наблюдали так рано, как после 24 недель введения, в группе тестируемого лекарственного средства, когда другими терапевтическими агентами против остеопороза были L-аспартат кальция, элкатонин, Альфакальцидол, менатетренон и кальцитриол. В частности, особенно заслуживает внимания то, что заметные увеличения плотности костной ткани шейки бедренной кости и проксимальной бедренной кости наблюдали после 72 часов введения тестируемого лекарственного средства, когда другими терапевтическими агентами против остеопороза были L-аспартат кальция и элкатонин. В частности, когда другим терапевтическим агентом против остеопороза был элкатонин, заслуживает особого упоминания то, что наблюдали огромное увеличение плотности костной ткани проксимальной бедренной кости так рано, как после 24 недель введения тестируемого лекарственного средства.
|
|
|
Действия истории болезни с приемом других терапевтических агентов против остеопороза на эффективность тестируемого лекарственного средства оценивали также подробно с точки зрения встречаемости новых вертебральных переломов для каждого из других терапевтических агентов против остеопороза. Эти результаты показаны в таблице ниже. Как понятно из этой таблицы, удивительное ингибирование новых переломов вследствие введения этого тестируемого лекарственного средства наблюдали у пациентов с историей болезни с приемом терапевтических агентов против остеопороза, других чем кальцитриол.
|
|
(Н) Эффективность и безопасность тестируемого лекарственного средства для пациентов с остеопорозом, имеющих ренальную (почечную) дисфункцию
Эффективность и безопасность тестируемого лекарственного средства исследовали в группе пациентов с остеопорозом, имеющих нормальную почечную функцию, в группе пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и в группе пациентов с остеопорозом, имеющих умеренную почечную дисфункцию.
(Н-1) Распределение факторов фона каждой группы (подробности)
Группу пациентов с остеопорозом, имеющих нормальную почечную функцию, регистрировали как “нормальную (≥80)”, группу пациентов с остеопорозом, имеющих легкую почечную дисфункцию, как “слабое нарушение (≥50-<80)” и группу пациентов с остеопорозом, имеющих умеренную почечную дисфункцию как “умеренное нарушение (<50)”. Группу тестируемого лекарственного средства регистрировали как “группу PTH200” и контрольную группу как “Р-группу”. Группу пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и группу пациентов с остеопорозом, имеющих умеренную почечную дисфункцию, регистрируют иногда также вместе в виде “патологической (<80)”. Каждый пациент классифицируется в приведенные выше группы на основе его клиренса креатинина. Конкретно, клиренс креатинина 80 мл/мин или более высокий, рассматривается как нормальная почечная функция, от 50 до менее 80 мл/мин как легкая почечная дисфункция и от 30 до менее 50 мл/мин как умеренная почечная дисфункция.
(Н-1) Распределение факторов фона каждой группы
Распределение факторов фона каждой группы является следующим.
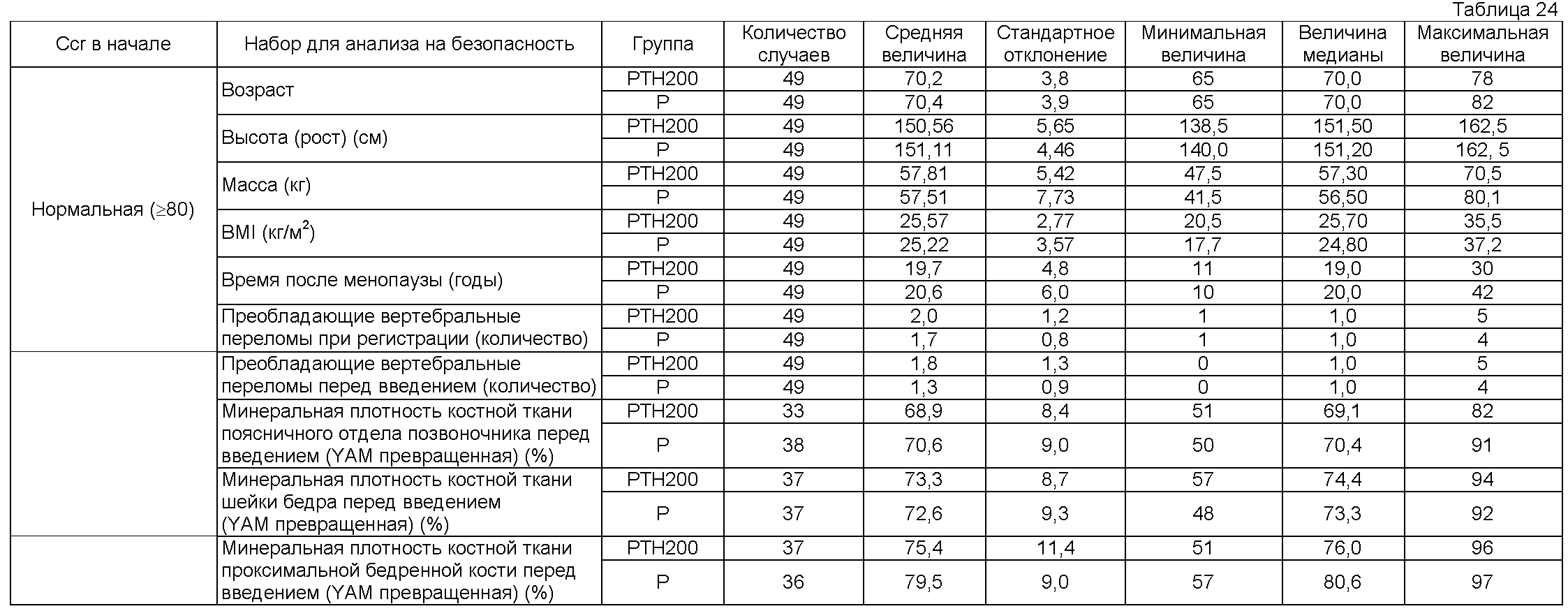
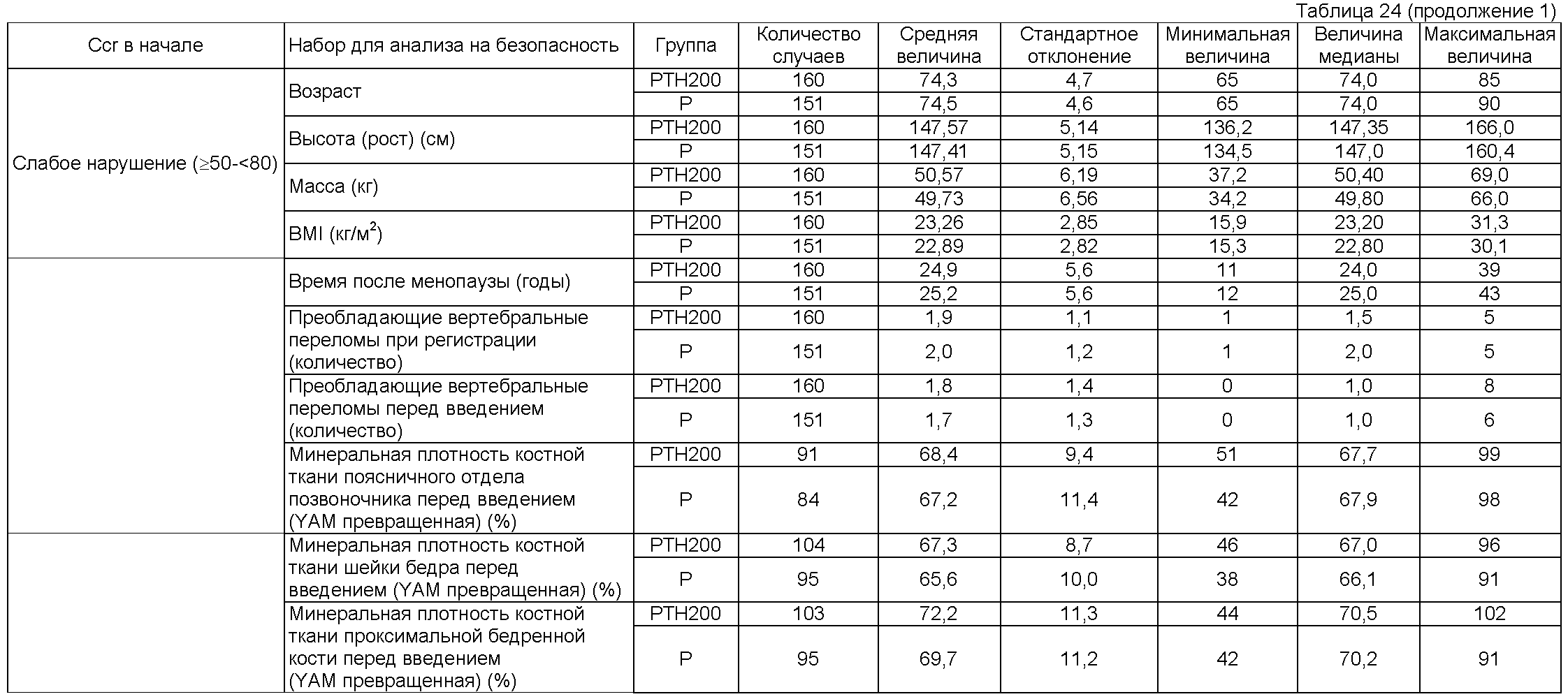
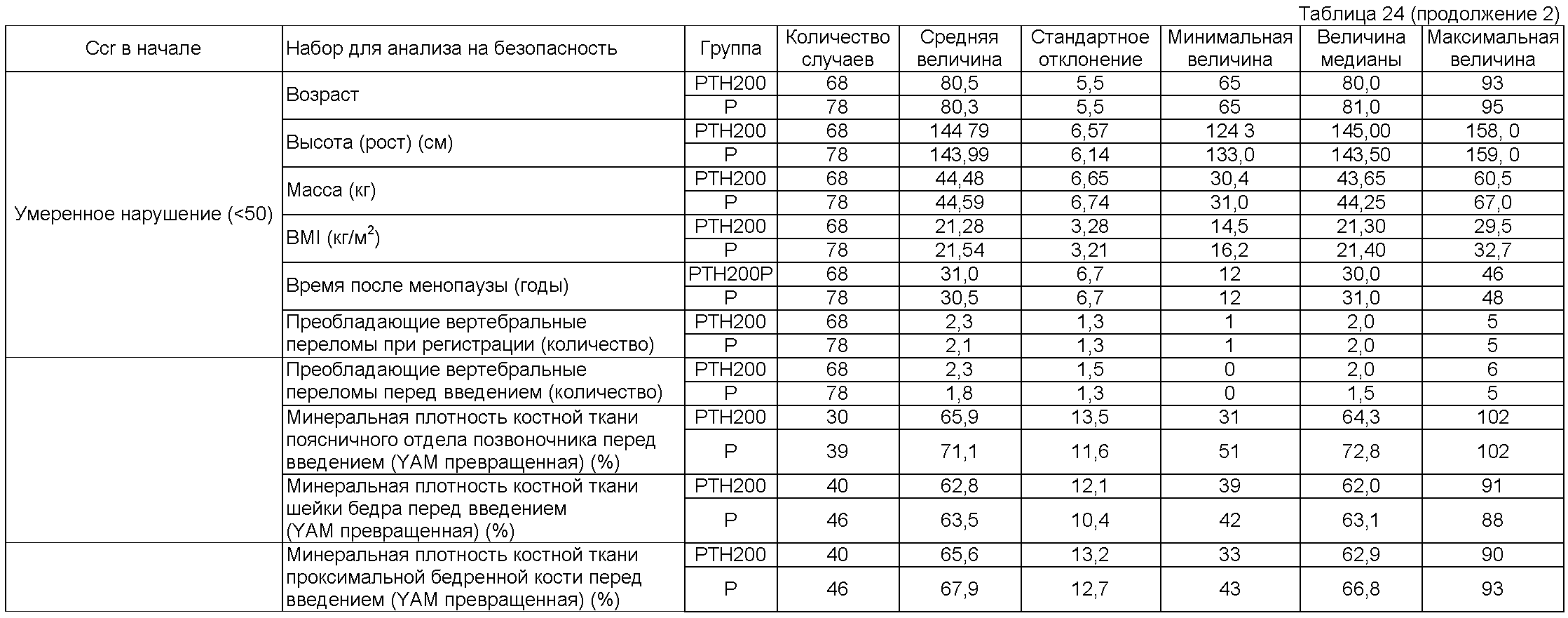
(Н-2) Эффективность тестируемого лекарственного средства в каждой группе (ингибирование переломов костей)
Было выяснено, что это тестируемое лекарственное средство оказывает ингибирующее действие при новых вертебральных переломах в группе пациентов с остеопорозом, имеющих нормальную почечную функцию, и группах пациентов с остеопорозом, имеющих почечную дисфункцию (легкую и умеренную).
|
(Н-3) Эффективность тестируемого лекарственного средства в каждой группе (увеличенная плотность костной ткани)
Было выяснено, что тестируемое лекарственное средство оказывает увеличивающее действие на плотность позвонков поясничного отдела позвоночника в группе пациентов с остеопорозом, имеющих нормальную почечную функцию, группе пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и группе пациентов с остеопорозом, имеющих умеренную почечную дисфункцию.
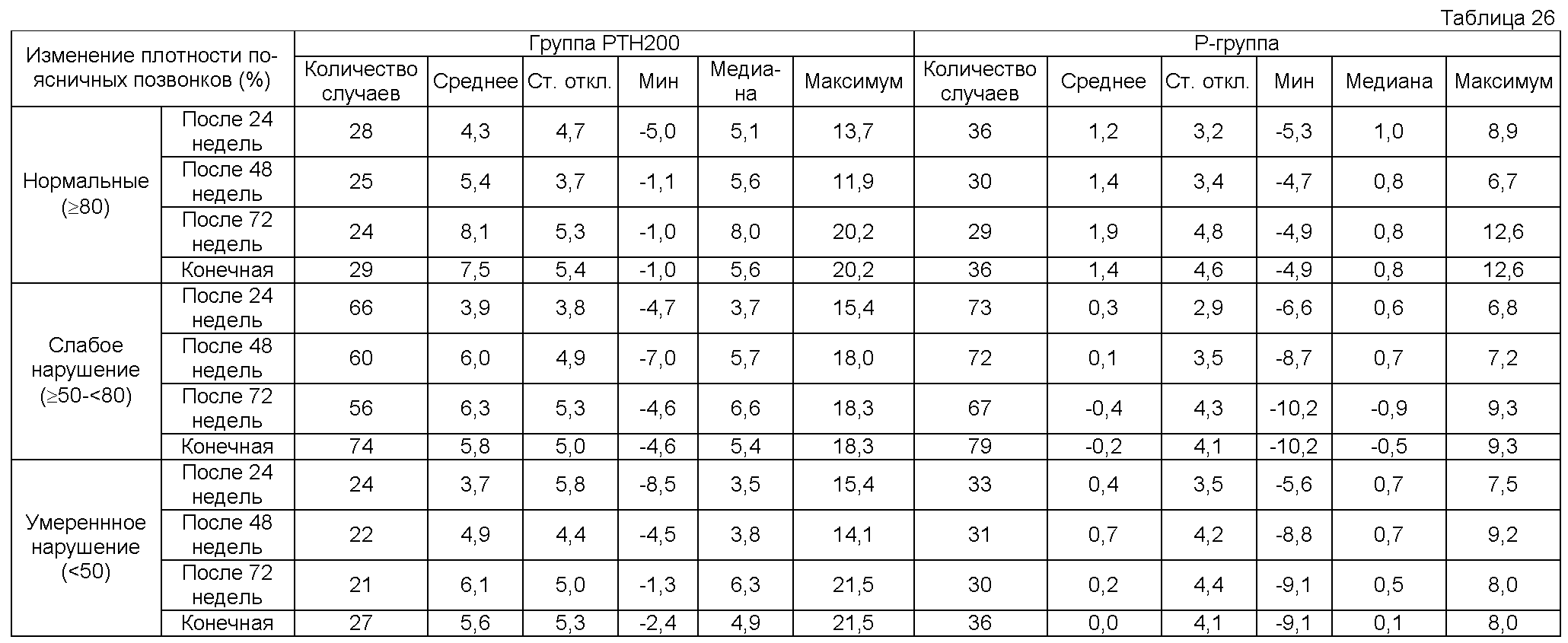
(Н-4) Безопасность тестируемого лекарственного средства в каждой группе (корректированный сывороточный кальций)
Не удалось обнаружить значимых различий между любыми группами, которым вводили тестируемое лекарственное средство, и контрольной группой в результате введения тестируемого лекарственного средства группе пациентов с остеопорозом, имеющих нормальную почечную функцию, группе пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и группе пациентов с остеопорозом, имеющих умеренную почечную дисфункцию. Более конкретно, было выяснено, что это тестируемое лекарственное средство имеет эквивалентную безопасность в отношении сывороточного кальция во всех группах.
|
|
(Н-5) Безопасность тестируемого лекарственного средства в каждой группе (встречаемость вредных событий)
Встречаемость вредных событий исследовали после введения тестируемого лекарственного средства группе пациентов с остеопорозом, имеющих нормальную почечную функцию, группе пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и группе пациентов с остеопорозом, имеющих умеренную почечную дисфункцию.

|

(Н-6) Безопасность тестируемого лекарственного средства в каждой группе (встречаемость побочных эффектов)
Встречаемость побочных эффектов под действием этого тестируемого лекарственного средства в каждой группе была приблизительно в 2 раза более высокой, чем в контроле, в результате введения тестируемого лекарственного средства группе пациентов с остеопорозом, имеющих нормальную почечную функцию, группе пациентов с остеопорозом, имеющих легкую почечную дисфункцию, и группе пациентов с остеопорозом, имеющих умеренную почечную дисфункцию. Другими словами, было выяснено, что безопасность этого тестируемого лекарственного средства в отношении побочных эффектов является эквивалентной во всех группах.



(I) Действия введения тестируемого лекарственного средства на изменения на протяжении времени встречаемости новых вертебральных переломов
Группа этого тестируемого лекарственного средства была внесена в списки как “Группа PTH200”, а контрольная группа как “Р-группа”.

|
Как показано в приведенных выше таблицах, встречаемость новых вертебральных переломов каждые шесть месяцев была в основном постоянной при приблизительно 5% во всех подразделениях Р-группы. В отличие от этого, встречаемость каждого подразделения уменьшалась по мере удлинения периода введения в группе PTH200, и после 48 недель не появлялись новые вертебральные переломы. Встречаемость новых вертебральных переломов была также более низкой, чем встречаемость в Р-группе во всех подразделениях, состоящих из введения в пределах 24 недель, 24-48 недель и 48-72 недель, и уменьшение относительного риска (RRR) в сравнении с плацебо увеличивалось по мере продолжения введения. Таким образом, еженедельное введение 200 единиц этого лекарственного средства ингибировало появление новых вертебральных переломов с раннего времени, и риск переломов уменьшался уже до 53,9% против плацебо после 24 недель. Это ингибирующее действие данного лекарственного средства на переломы костной ткани имело также тенденцию к усилению по мере продолжения введения.
Встречаемость вертебральных переломов (новых + ухудшающихся) после 72 недель с использованием оценивания Каплана-Мейера в FAS исследования переломов, была 3,5% в группе PTH200 и 16,3% в Р-группе. Встречаемость с 200 единицами этого лекарственного средства была более низкой, чем в группе плацебо (логарифмический ранговый критерий, р<0,0001). Двести единиц этого лекарственного средства понижали также риск вертебральных переломов (новых+ухудшающихся) до 78,6% в сравнении с плацебо после 72 недель. При сравнении встречаемости шестимесячного вертебрального перелома (нового+ухудшающегося) между группами, встречаемость группы PTH200 была более низкой, чем встречаемость Р-группы во всех подразделениях, состоящих из введения в пределах 24 недель, 24-48 недель и 48-72 недель.
(J) Действия введения тестируемого лекарственного средства на кальций мочи и кальций сыворотки пациентов с остеопорозом
Группа тестируемого лекарственного средства была зачислена как “группа PTH200” и контрольная группа как “Р-группа”. Показаны результаты исследования изменений величины кальция мочи и корректируемой величины кальция сыворотки при введении тестируемого лекарственного средства или контроля пациентам один раз в неделю в течение 72 недель (фиг.4 и 5).
Среднее (и медианное) процентное изменение величины кальция мочи было 3,2% (-14,7%) в группе PTH200 и 23,6% (1,6%) в Р-группе после 72 недель в сравнении с этими показателями в начале введения. Тенденцию уменьшения наблюдали в группе PTH200 в сравнении с Р-группой.
Корректируемая величина кальция сыворотки флуктуировала с диапазоном среднего 9,3-9,6 мг/дл в обеих группах. Корректируемая величина кальция сыворотки группы PTH200 после введения имела минимум 8,5 мг/дл (после 48 и 72 недель) и максимум 11,6 мг/дл (после 4 недель). В Р-группе она имела минимум 8,5 мг/дл (после 4 недель) и максимум 12,1 мг/дл (после 12 недель). В каждой группе не обнаруживали больших флуктуаций.
В этом исследовании не обнаруживали побочных эффектов повышения или снижения кальция сыворотки.
В группе PTH200 не обнаруживали проявления гиперкальциемии или гиперкальциурии в сравнении с Р-группой.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Способ лечения/предотвращения остеопороза и ингибирования/предотвращения переломов костей согласно данному изобретению является превосходным как в отношении эффективности, так и в отношении безопасности, и способ ингибирования переломов костей согласно данному изобретению является высоко безопасным. Оба способа являются прокладывающими новые пути к созданию медицинских способов, которые в значительной степени способствуют лечению остеопороза и т.п. и ингибированию/предотвращению переломов костной ткани. Таким образом, терапевтический/профилактический агент против остеопороза и агент для ингибирования/предотвращения переломов костей согласно данному изобретению являются чрезвычайно полезными в фармацевтической промышленности для этих целей.