Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ПРОЛИФЕРАТИВНОЙ ВИТРЕОРЕТИНОПАТИИ У КРЫС
Вид РИД
Изобретение
Область техники
Изобретение относится к области медицины, в частности к офтальмологии, и может быть использовано при разработке методов профилактики и лечения пролиферативной витреоретинопатии (ПВР).
Уровень техники
ПВР - это патологическое состояние, возникающее вследствие травмы, диабетической ретинопатии и регматогенной отслойки сетчатки. ПВР характеризуется пролиферацией клеток пигментного эпителия, глиальных клеток, макрофагов и фибробластов на поверхности сетчатки, что приводит к образованию мембран, приобретающих в дальнейшем сократительную способность. Процесс сопровождается формированием складчатости отслоенной сетчатки и ее выраженным укорочением. ПВР является наиболее распространенной причиной рецидива отслойки сетчатки после хирургического вмешательства.
Профилактика и консервативное лечение этой патологии не разработаны. Весьма перспективным является разработка лечения на экспериментальных моделях.
Существуют различные подходы к моделированию ПВР: введение в стекловидное тело различных видов клеток (Запускалов И.В. с соавт. Патент RU 2182369. Хорошилова И.П. с соавт. Патент RU 2161335. Sugita G. et al. Intravitreal autotransplantation of fibroblasts. // Am J Ophthalmol. 1980. Vol. 89, №1. P. 121-130. Fastenberg D. et al. A comparison of different cellular inocula in an experimental model of massive periretinal proliferation. // Am. J. Ophthalmol. 1982. Vol.93, №5. P. 559-564. Hui Y.N., Sorgente N., Ryan S. Posterior vitreous separation and retinal detachment induced by macrophages // Graefe′s Arch. Clin. Exp. Ophthalmol. 1987. Vol. 225. P. 279-284. García-Layana A. et al. Porcine model of proliferative vitreoretinopathy with platelets // Curr Eye Res. 1997. Vol. 16, №6. P. 556-563), проведение хирургических манипуляций с глазом (Chinn С. et al. Strain-dependent gene expression in a lens extraction PVR model // Invest Ophthalmol Vis Sci. 2005. Vol.46. P. E-Abstract 5528. Cleary P., Ryan S.. Experimental posterior penetrating eye injury in the rabbit. II. Histology of wound, vitreous, and retina. // Br J Ophthalmol. 1979. Vol.63, №5. P. 312-321), введение ферментов (Frenzel E.M. et al. A new model of proliferative vitreoretinopathy. // Invest. Ophthalmol. Vis. Sci. 1998. Vol.39, №11. P. 2157-2164. Valeria Canto Soler M. et al. A Mouse Model of Proliferative Vitreoretinopathy Induced by Dispase. // Experimental Eye Research 2002. 75 (5), 491-504. Tan J. et al. Ocular pathogenesis and immune reaction after intravitreal dispase injection in mice. // Mol Vis. 2012; 18: 887-900).
Все перечисленные выше методы моделирования ПВР имеют недостатки.
В моделях с интравитреальным введением клеток, как правило, вводят только один их тип, и инициация патологии начинается с той стадии процесса, в которой эти клетки принимают участие. Пролиферативный процесс в организме затрагивает различные типы клеток, и их пролиферация в образовании мембран не является первым звеном патологического процесса, т.е. механизмы инициации на таких моделях изучать невозможно, невозможно исследовать механизмы и терапевтические подходы постоперационных осложнений. Метод моделирования ПВР с использованием различных хирургических манипуляций (удаление хрусталика и стекловидного тела, криопексия, отслоение сетчатки или ее удаление, проникающая травма глаза) приводит к сильному повреждению глаза и нарушению его строения и целостности. Эти модели могут быть использованы для изучения рисков развития ПВР только при конкретных патологиях глаза. Введение ферментов внутрь глаза приводит к деструкции межклеточного матрикса и нарушению гемато-офтальмического барьера, причем гемофтальм, как дополнительный фактор риска, увеличивает агрессивность модели и вероятность развития ПВР. Однако воспаление является ключевым звеном развития ПВР во всех этих моделях, и пусковым механизмом развития ПВР может являться воспалительная реакция. Конканавалин позволит привести к активации медиаторов воспаления с минимальным нарушением проницаемости гематоофтальмического барьера (с минимальной вероятностью развития гемофтальмов) и с минимальным деструктивным компонентом.
Наиболее близким к заявленному способу является способ моделирования пролиферативной витреоретинопатии у крыс путем интравитреального введения взвеси клеточных элементов в физиологическом растворе (Запускалов И.В. с соавт. Патент RU 2182369). Более близких способов моделирования ПВР к заявленному не существует.
Основным недостатком прототипа является то, что инициирование процесса образования эпиретинальных мембран начинается с введения клеток в стекловидное тело, в то время как при реальной патогенетической картине у человека миграция клеток не является ранним этапом процесса. Кроме этого, при введении в стекловидное тело клеток определенного типа, на начальных этапах набор выделяемых факторов этими клетками лимитирован, поскольку это клетки одного типа. Таким образом данная модель не отражает развернутую динамику полноценного патогенетического механизма ПВР.
Конканавалиновая модель наиболее актуальна, поскольку отражает именно воспалительный патогенез ПВР, обеспечивая селективность развития воспалительной реакции путем активации лимфоцитов различных групп (Dwyer JM, Johnson С.The use of concanavalin A to study the immunoregulation of human T cells. // Clin Exp Immunol. 1981 Nov; 46 (2): 237-49. Lei HY, Chang CP. Lectin of Concanavalin A as an anti-hepatoma therapeutic agent. // J Biomed Sci. 2009 Jan 19; 16:10. Toshiaki Nakano et al. Immunological aspects and therapeutic significance of an autoantibody against histone HI in a rat model of concanavalin A-induced hepatitis. // Immunology. 2010 April; 129 (4): 547-555). Конканавалин А использовался в модели катарактогенеза для формирования задней субкапсулярной катаракты у кроликов-альбиносов; при этом все глаза, в которые вводился конканавалин, содержали фибрин в стекловидном теле. В некоторых случаях наблюдалось кровоизлияние в эпиретинальное пространство (Gwon A. et al. Concanavalin A-induced posterior subcapsular cataract: a new model of cataractogenesis. // Invest Ophthalmol Vis Sci. 1993 Dec; 34 (13): 3483-8). Аналогов конканавалиновой модели ПВР на настоящее время нет.
Раскрытие изобретения
Задачей изобретения является создание нового способа моделирования пролиферативной витреоретинопатии у крыс с минимальным деструктивным компонентом, которая будет вызвана эндогенными клетками и факторами; добиться высокой результативности и стабильности получаемого результата, а именно разрастания на поверхности сетчатки мембран. Результат достигается за счет введения в витреальную полость глаза крысы раствора конканавалина А, что приводит к развитию воспаления в глазу практически без нарушения гематоофтальмического барьера.
Техническим результатом изобретения является получение ПВР в глазу крыс, отражающей патогенез процесса, близкий к изменениям у человека, и обеспечивающей стабильность получаемого результата. При этом развивается относительно «чистая» воспалительная реакция с минимальным деструктивным компонентом. Технический результат достигается за счет использования конканавалина A - маннозо-связывающего лектина растительного происхождения.
Согласно настоящему изобретению способ моделирования пролиферативной витреоретинопатии у крыс характеризуется тем, что в полость стекловидного тела глаза крысы вводят раствор конканавалина А в диапазоне доз 0,5 мкг - 0,5 мг в объеме 2 мкл, при этом образование мембран на поверхности сетчатки наблюдается через 8 недель после введения провоспалительного агента. Начальные этапы развития пролиферативной витреоретинопатии отмечаются на 1-2 неделе после введения конканавалина А.
Через 8 недель после введения лектина может быть проведена энуклеация глаза для последующего гистологического анализа образовавшихся на поверхности сетчатки мембран.
Конканавалин А обладает Т-митогенной активностью и активирует тучные клетки, вызывая псевдоаллергическую реакцию. Это приводит к активации воспалительного процесса и пролиферации глиальных клеток, фибробластов и иммунных клеток с минимальным нарушением гематоофтальмического барьера. Образование провоспалительных факторов стимулирует развитие пролиферативного ответа, что является одним из ключевых моментов в патогенезе пролиферативной витреоретинопатии.
Краткое описание чертежей
Изобретение поясняется фигурами 1-5.
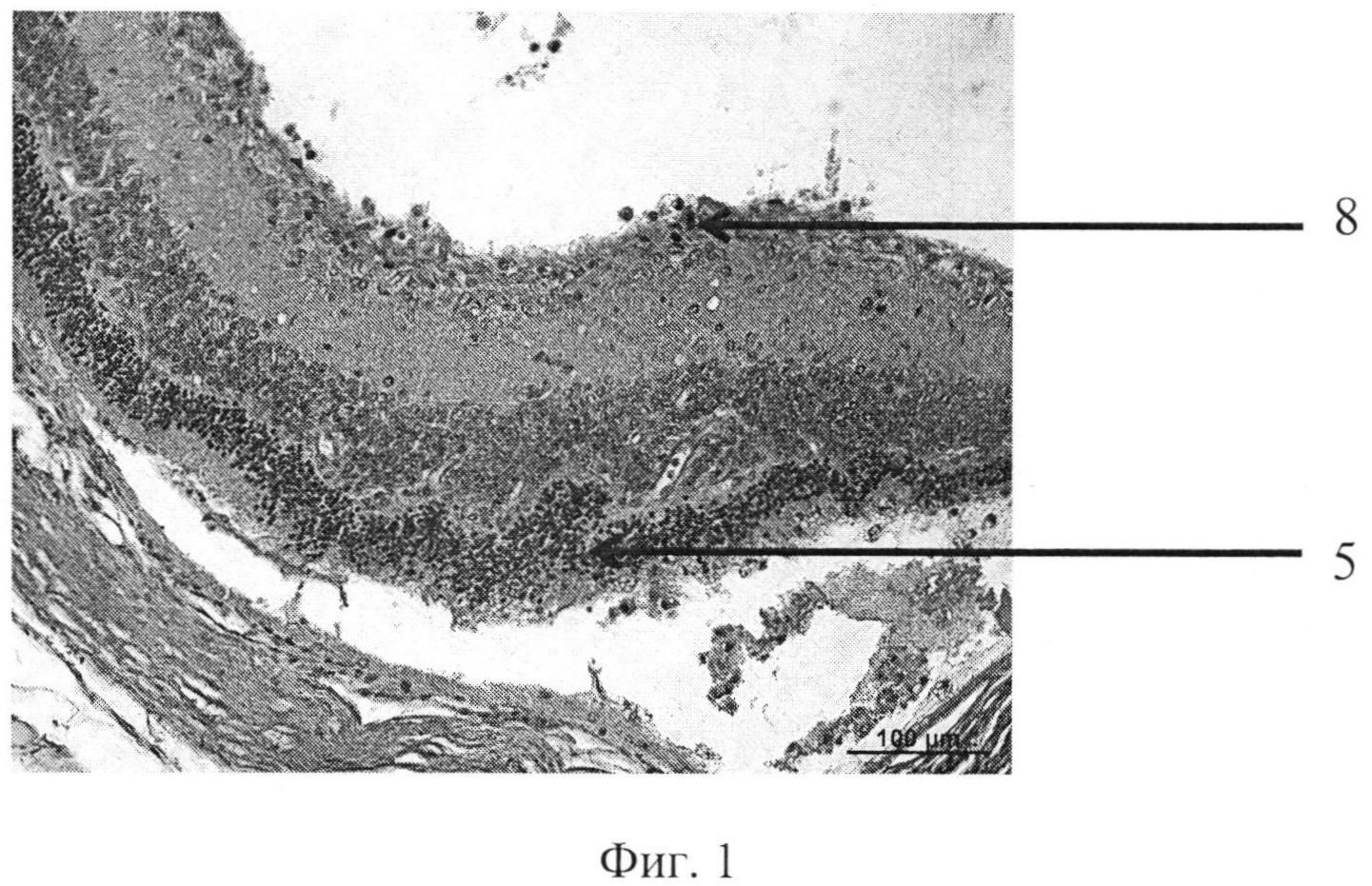
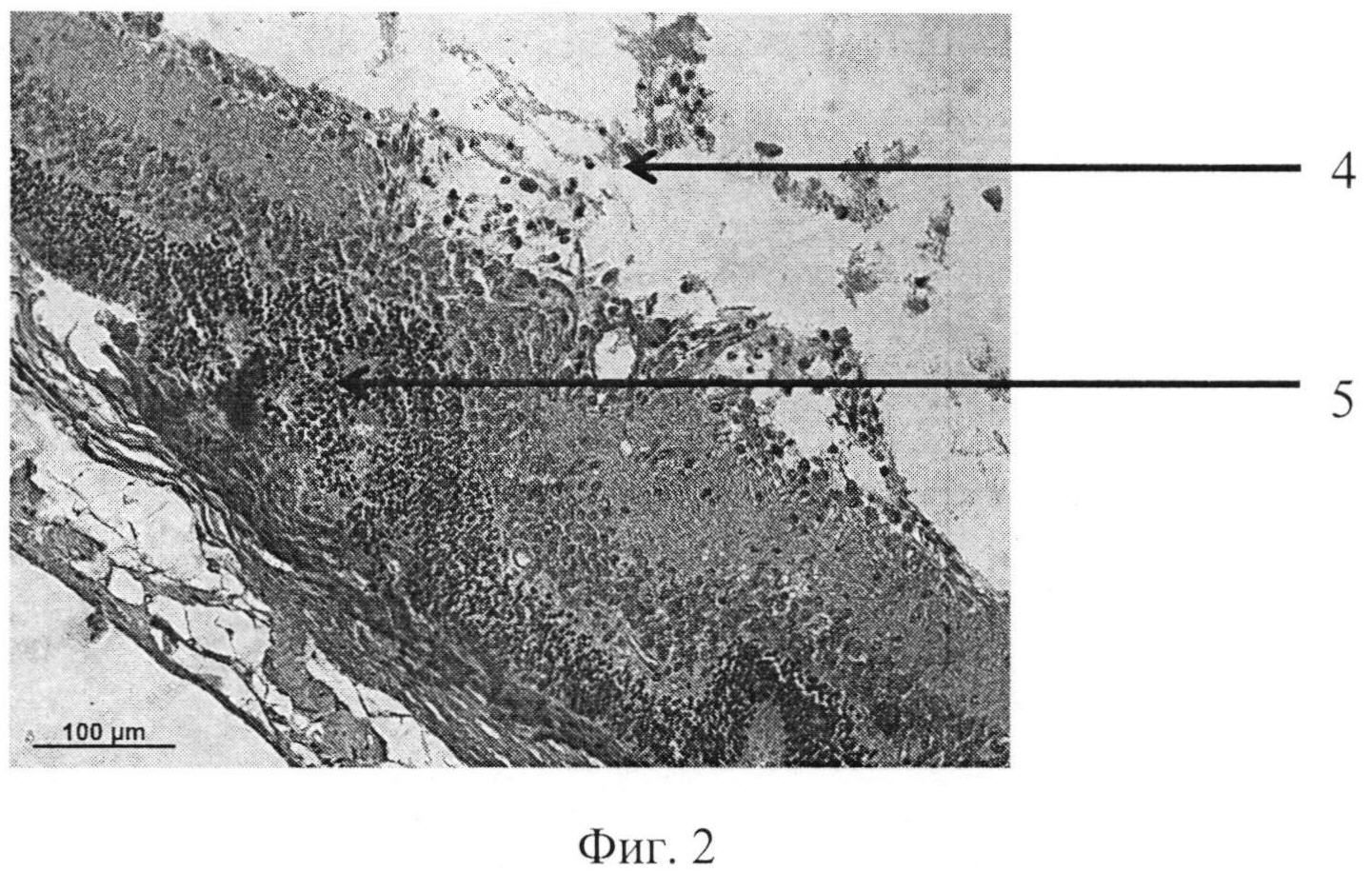
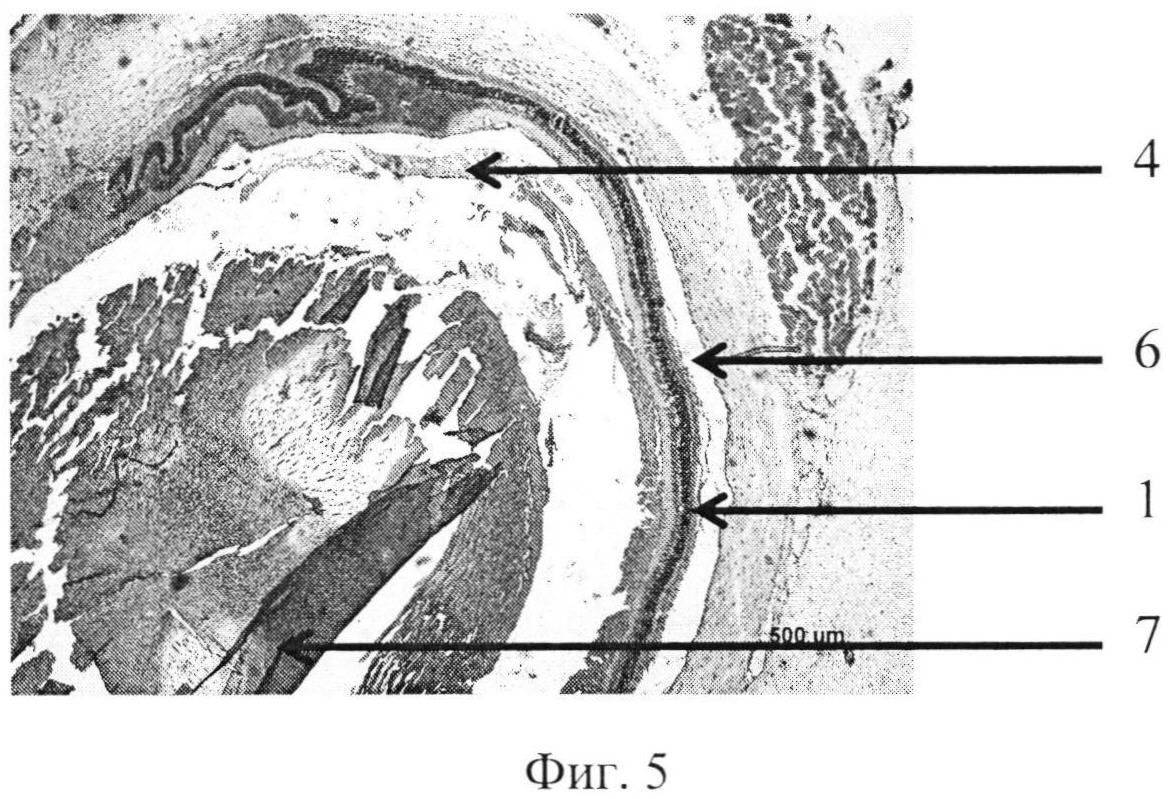
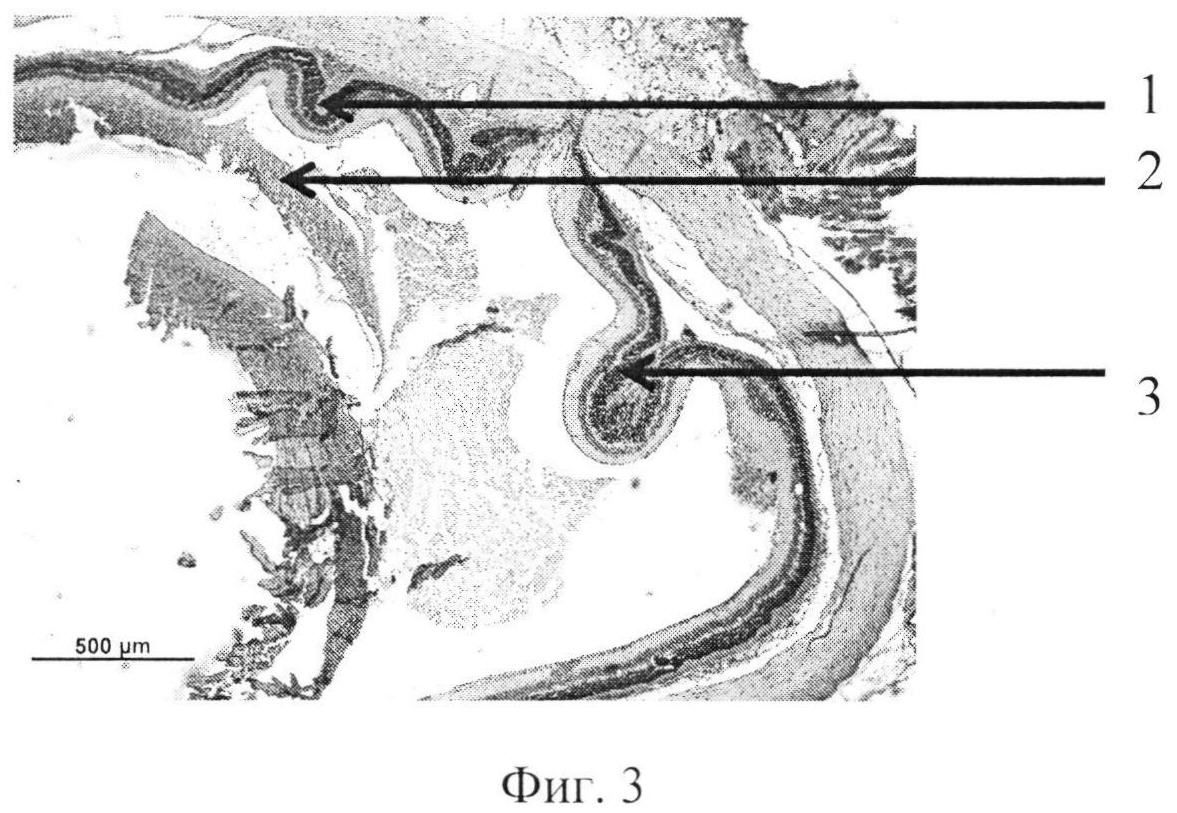
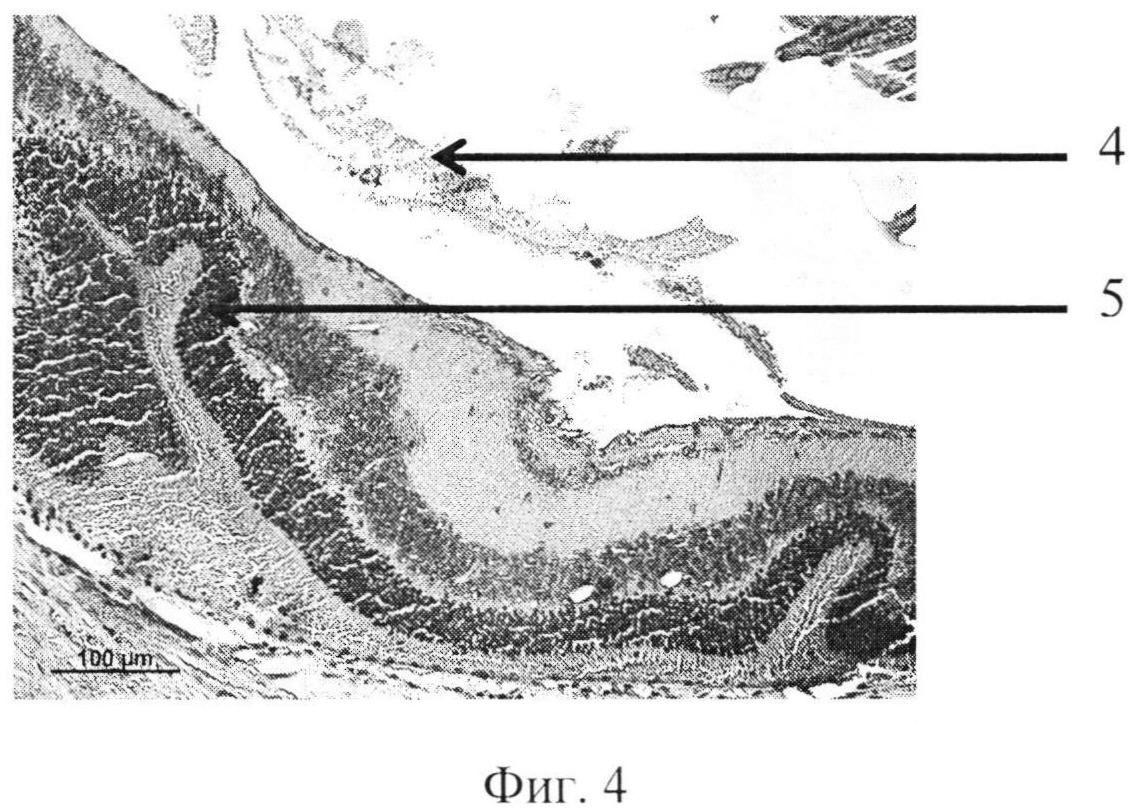
На фиг. 1 изображена пролиферация слоя глиальных клеток сетчатки и развитие волнистых изменений, особенно затрагивающих наружный слой. На фиг. 2 - уплотнение структур кортикальных слоев стекловидного тела, формирование розеточных структур. На фиг. 3 изображена эпиретинальная мембрана, образовавшаяся на поверхности сетчатки в ответ на введение конканавалина в витреальную полость, на фиг. 4 изображены выраженные волнистые изменения сетчатки и начало формирования розеточных структур, на фиг. 5 - отслойка сетчатки.
Позицией 1 обозначена сетчатка, позицией 2 - эпиретинальная мембрана, позицией 3 - тракция сетчатки, позицией 4 - стекловидное тело, позицией 5 - волнистые изменения сетчатки, начало формирования розеточных структур, позицией 6 - отслойка сетчатки, позицией 7 - хрусталик, позицией 8 - пролиферация слоя глиальных клеток.
Примеры
Крыса №20. Под общим обезболиванием в правый глаз инстилировали алкаин 0,5%, тропикамид 1,0% и витабакт 0,05%. Конканавалин, разведенный в изотоническом растворе, дозой 0,5 мг в объеме 2 мкл ввели в витреальную полость через прокол в плоской части цилиарного тела иглой 30G. В послеоперационном периоде, в первые дни, наблюдался небольшой мидриаз, в стекловидном теле плавающие помутнения. Через 5 дней формировались волнистые изменения слоев сетчатки, в стекловидном теле - начальное уплотнение структур кортикальных слоев. Роговица не изменена. Заднекапсулярная катаракта.
Гистологически. В стекловидном теле вблизи внутренней поверхности сетчатки - уплотнение структур кортикальных слоев, в сетчатке - пролиферация слоя глиальных клеток. Наблюдается развитие волнистых изменений, особенно затрагивающих наружный слой (фиг. 1-2).
Патогистологический диагноз: начальная стадия ПВР.
Крыса №12. Под общим обезболиванием в правый глаз инстилировали алкаин 0,5%, тропикамид 1,0% и витабакт 0,05%. Конканавалин, разведенный в изотоническом растворе, дозой 0,5 мкг в объеме 2 мкл ввели в витреальную полость через прокол в плоской части цилиарного тела иглой 30G. В послеоперационном периоде, в первые дни, наблюдался небольшой мидриаз, в стекловидном теле плавающие помутнения. Через 8 недель в стекловидном теле формировались тяжи, складчатость сетчатки и формирование розеточных структур, локальная отслойка. Роговица не изменена. Заднекапсулярная катаракта. Гистологически. В стекловидном теле вблизи внутренней поверхности сетчатки - уплотнение структур кортикальных слоев. Наблюдается нарушение целостности некоторых слоев, в том числе локальная деградация слоя палочек и колбочек; развитие волнистых изменений, особенно затрагивающих наружный ядерный и внутренний ядерный слои. Видны реципрокное проникновение слоев сетчатки и формирование розеточных структур. На срезе видна отслойка сетчатки. Над сетчаткой выявляются эпиретинальные мембраны, которые организуют «тянущий» тракционный компонент (фиг. 4).
Контрактильные свойства в новообразованной эпиретинальной мембране проявлялись в формировании складок и очагов отслоенной сетчатки (фиг. 4, 5).
Патогистологический диагноз: пролиферативная витреоретинопатия, отслойка сетчатки.
Осуществление изобретения
Способ осуществляется следующим образом.
1. Все манипуляции выполняли на наркотизированных хлоралгидратом на самцах крыс популяции Вистар (400 мг/кг внутрибрюшинно).
2. В правый глаз крысы закапывали местный анестетик алкаин 0,5% (Alcon), зрачок расширяли с помощью 1,0% раствора тропикамида (Ромфарм компани), в качестве антисептика использовали витабакт 0,05% (Novartis).
3. Конканавалин, разведенный в изотоническом растворе, в количестве 0,5 мкг - 0,5 мг в объеме 2 мкл вводили в витреальную полость через прокол в плоской части цилиарного тела иглой 30G.
Предложенный способ применен в эксперименте на 35 крысах в случае вводимой дозы 0,5 мг для оценки начального этапа развития ПВР (1-7 сутки) и на 15 крысах в случае вводимой дозы 0,5 мкг для оценки длительных последствий введения провоспалительного агента (14, 28 и 56 сутки). У всех экспериментальных животных на 1-7 сутки получен идентичный результат - начальные этапы уплотнения структур кортикальных слоев в стекловидном теле и волнистые изменения сетчатки, что подтверждается гистологическим исследованием. На 56 сутки у всех экспериментальных животных наблюдается развитие ПВР, что также подтверждается гистологическим исследованием.
После эксперимента клиническое наблюдение проводилось в течение 1-7 суток (доза 0,5 мг) и 1, 2, 4 и 8 недель (доза 0,5 мкг). Затем производили энуклеацию глаза и декапитацию животного. Глаза фиксировали в растворе Дэвидсона и подвергали гистологическому исследованию. После фиксации глаза обезвоживались в спиртах восходящей концентрации и заливались в парафин. Парафиновые срезы окрашивались гематоксилин-эозином. Клинически после введения конканавалина А в глаз экспериментальных животных в первые три дня отмечался легкий мидриаз, у 100% животных наблюдалось развитие катаракт. Максимальное регистрируемое число гемофтальмов (20% глаз) приходится на 1 и 7 сутки после введения провоспалительного агента. Через 8 недель у 100% крыс наблюдалось образование выраженных эпиретинальных мембран, гемофтальм был в 20% глаз, а катаракта к 8 неделе эксперимента наблюдалась у 100%.
В качестве контроля мы использовали крыс (N=20), которые получили инравитреальную инъекцию изотонического раствор хлорида натрия (0,9%). У этих крыс на протяжении всего эксперимента не наблюдалось развития ПВР.
Способ моделирования пролиферативной витреоретинопатии у крыс, характеризующийся тем, что в полость стекловидного тела глаза крысы вводят 2 мкл изотонического раствора, содержащего 0,5 мкг - 0,5 мг конканавалина А.