Результат интеллектуальной деятельности: НОВЫЕ ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОПИРИМИДО{1,2-a}ПИРИМИДИН-6-ОНА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Изобретение относится к новым химическим соединениям типа 1,2,3,4-тетрагидропиримидо{1,2-a}пиримидин-6-она, представляющим собой производные пиримидинонов, способу их получения, полученным новым промежуточным соединениям, их применению в качестве лекарственных средств, фармацевтическим композициям, содержащим их, и новому применению таких производных.
Настоящее изобретение относится также к применению упомянутых производных для получения лекарственного средства, предназначенного для лечения человека. Более предпочтительно изобретение относится к новым производным пиримидинонов и их фармацевтическому применению для профилактики и лечения заболеваний, течение которых можно модулировать ингибированием пути PI3K/AKT/mTOR. AKT представляет собой ключевой агент в данном сигнальном пути. Высокий уровень фосфорилирования AKT представляет собой маркер активации пути, который обнаружен в случае многих видов раковых заболеваний человека.
Соединения по настоящему изобретению также могут быть предпочтительно использованы для профилактики или лечения заболеваний, течение которых можно модулировать ингибированием фосфорилирования AKT (P-AKT). Ингибирование P-AKT может быть предпочтительно достигнуто ингибированием пути PI3K/AKT/mTOR, в частности, ингибированием киназ, причастных к данному пути в качестве рецепторов активности тирозинкиназы, таких как EGFR, IGFR, ErbB2, 3'-фосфоинозитид-зависимая протеинкиназа-1 (PDK1), фосфоинозитидкиназа PI3K, серин-треонинкиназа AKT, киназа mTOR.
Ингибирование и регуляция пути PI3K/AKT/mTOR образуют, в частности, новый и мощный механизм воздействия при лечении многих видов раковых заболеваний, включая солидные опухоли и лейкозы. Такими заболеваниями, которые можно излечивать соединениями по настоящему изобретению, являются солидные опухоли человека или лейкозы.
Это изобретение относится также к новым производным пиримидинонов и их фармацевтическому применению для профилактики и лечения заболеваний, на которые можно влиять модуляцией аутофагии. Ингибирование и регуляция аутофагии образует новый механизм воздействия при лечении многих видов раковых заболеваний, включая солидные опухоли и лейкозы.
Это изобретение относится также к новым производным пиримидинонов и их фармацевтическому применению для лечения паразитарных заболеваний, таких как малярия, сонная болезнь, болезнь Шагаса, лейшманиозы.
Роль пути PI3K/AKT/mTOR
Сигнальный путь PI3K/AKT/mTOR представляет собой сложную систему, которая регулирует многие клеточные функции, такие как рост, выживание, пролиферация и подвижность клеток, представляющие собой ключевые процессы опухолеобразования.
Этот сигнальный путь представляет собой важную мишень при лечении рака, поскольку значительная часть его эффекторов изменяется в опухолях человека. Главные эффекторы, способствующие активации пути, представляют собой: i) онкогены, такие как ErbB1 (EGFR), ErbB2 (HER2), PIK3CA и AKT, активируемые мутацией, амплификацией или суперэкспрессией; ii) недостаточность генов, подавляющих опухоли, таких как PTEN, TSC1/2, LKB и PML, инактивируемых вследствие мутаций или делеций (Jiang L.-Z. & Liu L.-Z., Biochim. Biophys. Acta, 2008, 1784:150; Vivanco I. & Sawyers C.L., 2002, Nat. Rev. Cancer, 2:489; Cully M. et al., Nature Rev. Cancer, 2006, 6:184).
Активация онкогенов этого сигнального пути обнаружена во многих случаях раковых заболеваний человека:
- мутации, активирующие PIK3CA, имеются в 15-30% случаев раковых опухолей толстой кишки, молочной железы, эндометрия, печени, яичника и предстательной железы (T.L. Yuan and L.C. Cantley, Oncogene, 2008, 27:5497; Y. Samuels et al. Science, 2004, 304:554; K.E. Bachman et al. Cancer Biol. Ther., 2004, 3:772; D.A. Levine et al. Clin. Canc. Res. 2005, 11:2875; C. Hartmann et al. Acta Neuropathol. 2005, 109:639);
- амплификация, активирующие мутации и суперэкспрессия RTK, таких как EGFR и HER2, в случае раковых опухолей головного мозга, молочной железы и легких (NSCLC);
- амплификация и суперэкспрессия, активирующая AKT в случае раковых опухолей головного мозга, легких (NSCLC), молочной железы, почек, яичника и поджелудочной железы (Testa J.R. and Bellacosa A., Proct. Natl. Acad. Sci. USA 2001, 98:10983; Cheng et al., Proct. Natl. Acad. Sci. USA 1992, 89:9267; Bellacosa et al., Int. J. Cancer, 1995, 64:280; Cheng et al., Proct. Natl. Acad. Sci. USA 1996, 93:3636; Yuan et al., Oncogene, 2000, 19:2324).
Недостаточность генов, подавляющих опухоли этого сигнального пути, обнаружена также во многих случаях раковых заболеваний человека:
- делеция PTEN в 50% случаев раковых опухолей легких (NSCLC), печени, почек, предстательной железы, молочной железы, головного мозга, поджелудочной железы, эндометрия и толстой кишки (Maxwell G.L. et al. Canc. Res. 1998, 58:2500; Zhou X.-P. et al. Amer. J. Pathol., 2002, 161:439; Endersby R. & Baker S.J., Oncogene, 2008, 27:5416; Li et al. Science, 1997, 275:1943; Steack P.A. et al., Nat. Genet., 1997, 15:356);
- мутации TSC1/2 более чем в 50% случаев туберозного склероза;
- мутации или делеции LKB1 (или STK11), предрасполагающие к раковым заболеваниям желудочно-кишечного тракта и рака поджелудочной железы и обнаруживаемые, в частности, в 10-38% случаев аденокарциномы легких (Shah U. et al. Cancer Res. 2008, 68:3562);
- изменение PML, в частности, транслокацией в опухолях человека (Gurrieri C. et al., J. Natl. Cancer Inst. 2004, 96:269).
Кроме того, этот сигнальный путь представляет собой основной фактор резистентности к химиотерапии, радиотерапии и целенаправленной терапии, например, ингибиторами EGFR и HER2 (C. Sawyers et al. Nat. Rev. 2002).
Роль AKT
AKT (протеинкиназа B; PKB) представляет собой серин-треонинкиназу, которая занимает центральное место в основных клеточных сигнальных путях, в частности, в пути PI3K/AKT. AKT участвует, в частности, в росте, пролиферации и выживании опухолевых клеток. Активация AKT происходит в две стадии: (1) фосфорилирование треонина 308 (P-T308) посредством PDK1 и (2) фосфорилирование серина 473 (P-S473) посредством mTORC2 (или комплексом mTOR-Rictor), дающие в результате общую активацию. AKT, в свою очередь, регулирует большое число белков, среди которых mTOR (mammalian target of Rapamycin (мишень рапамицина у млекопитающих), BAD, GSK3, p21, p27, FOXO или FKHRL1 (Manning B.D. & Cantley L.C., Cell, 2007 129:1261). Активация AKT способствует внедрению питательных веществ, что запускает процессы анаболизирующей метаболизации, поддерживающей рост и пролиферацию клеток. В частности, AKT контролирует инициацию синтеза протеинов через каскад взаимодействий, которая осуществляется посредством TSC1/2 (комплекс туберозного склероза), Rheb и TOR с достижением двух критических мишеней сигнальных путей p70S6K и 4EBP. AKT индуцирует также фосфорилирование, ингибирующее транскрипционный фактор Forkhead, и инактивацию GSK3β, которые ведут к ингибированию апоптоза и прогрессии клеточного цикла (Franke T.F., Oncogene, 2008, 27:6473). Таким образом, AKT представляет собой мишень для противораковой терапии, а ингибирование активации AKT ингибированием ее фосфорилирования может индуцировать апоптоз злокачественных клеток и, тем самым, представлять собой вид лечения рака.
Рецепторы активности тирозинкиназы, такие как IGF1R
Аномально повышенные уровни активности протеинкиназы наблюдались во многих случаях заболеваний, являющихся следствием аномального функционирования клеток. Это может происходить как прямо, так и косвенно, в виде дисфункции механизмов управления активностью киназы, связанной, например, с мутацией, повышенной экспрессией или несоответствующей активацией фермента, или в виде повышенного или пониженного продуцирования цитокинов или факторов роста, также участвующих в трансдукции сигналов в путях до киназ или после них. Во всех этих случаях селективное ингибирование действия киназ позволяет надеяться на благоприятный эффект.
Рецептор типа 1 инсулиноподобного фактора роста (IGF-I-R) представляет собой трансмембранный рецептор активности тирозинкиназы, который в первую очередь связывается с IGFI, а также с более слабым сродством связывается с IGFII и инсулином. Связывание IGF1 с его рецептором вызывает олигомеризацию рецептора, активацию тирозинкиназы, межмолекулярное аутофосфорилирование и фосфорилирование клеточных субстратов (главные субстраты: IRS1 и Shc). Рецептор, активированный своим лигандом, индуцирует митогенную активность в нормальных клетках. Тем самым, IGF-I-R играет важную роль в так называемом аномальном росте.
В большом числе отчетов о клинических испытаниях подчеркивается важная роль пути IGF-I в развитии раковых заболеваний человека.
IGF-I-R часто обнаруживается с повышенным уровнем во многих типах опухолей (опухоли молочной железы, толстой кишки, легких, саркома, опухоль предстательной железы, множественная миелома), и его присутствие часто ассоциируется с наиболее агрессивным фенотипом.
Большая концентрация циркулирующего IGF-1 находится в сильной корреляции с риском рака предстательной железы, легких и молочной железы.
Более того, во многих отчетах было зафиксировано, что IGF-I-R является необходимым для установления и поддержания трансформированного фенотипа как in vitro, так и in vivo [Baserga R., Exp. Cell. Res., 1999, 253, pages 1-6]. Активность киназы IGF-I-R является существенной для трансформирующей активности многих онкогенов: EGFR, PDGFR, большой T-антиген вируса SV40, активный Ras, Raf и v-Src. Экспрессия IGF-I-R в нормальных фибробластах индуцирует неопластический фенотип, который затем может вызывать образование опухоли in vivo. Экспрессия IGF-I-R играет важную роль в росте, независимом от субстрата. IGF-I-R показал себя также в качестве протектора при апоптозе, индуцированном химио- и радиотерапией, и апоптозе, индуцированном цитокинами. К тому же, при ингибировании эндогенного IGF-I-R негативной доминантой образование спиральных триплексов или антисмысловая экспрессия провоцирует подавление трансформирующей активности in vitro и уменьшение роста опухолей в моделях на животных.
PDK1
3'-Фосфоинозитид-зависимая протеинкиназа-1 (PDK1) представляет собой один из существенных компонентов сигнальных путей PI3K-AKT. Такая протеинкиназа представляет собой серин-треонинкиназу (Ser/Thr-киназа), роль которой состоит в фосфорилировании и активировании других Ser/Thr-киназ группы AGC, участвующих в регуляции роста, пролиферации, выживании клеток и регуляции метаболизма. Такие киназы включают протеинкиназу B (PKB или AKT), SGK (или сывороточная и глюкокортикоид-регулируемая киназа), RSK (или S6-киназа рибосомного белка p90)), p70S6K (или S6-киназа рибосомного белка p70), а также различные изоформы протеинкиназы C (PKC) (Vanhaesebroeck B. & Alessi D.R., Biochem. J., 2000, 346:561). Таким образом, одна из ключевых ролей PDK1 представляет собой активацию AKT: в присутствии PIP3, представляющего собой вторичный мессенджер, порождаемый PI3K, PDK-1 присоединяется к плазматической мембране через свой домен PH (плекстрин-гомологичный домен) и фосфорилирует AKT по треонину 308, расположенному в петле активации, существенно изменяя активацию AKT. PDK1 экспрессируется убиквитарно и представляет собой конститутивно активную киназу. PDK1 представляет собой ключевой элемент в сигнальных путях PI3K/AKT для регуляции ключевых процессов в опухолеобразовании, таких как пролиферация и выживание клеток. Поскольку такой путь активирован более чем в 50% случаев раковых заболеваний человека, PDK1 представляет собой мишень для противораковой терапии. Ингибирование PDK1 возможно должно иметь следствием эффективное ингибирование пролиферации и выживания раковых клеток и, таким образом, давать благоприятный терапевтический эффект в случае раковых заболеваний человека (Bayascas J.R., Cell cycle, 2008, 7:2978; Peifer C. & Alessi D.R., ChemMedChem, 2008, 3:1810).
Фосфоинозитид-3-киназы (PI3K)
Липидкиназа PI3K представляет собой важную мишень в этом сигнальном пути в отношении онкологии. PI3K класса I подразделяют на класс Ia (PI3Kα,β,δ), активируемый рецепторами активности тирозинкиназы (RTK), рецепторами, связанными с протеинами G (GPCR), GTPазами группы Rho, p21-Ras, и на класс Ib (PI3Kγ), активируемый посредством GPCR и p21-Ras. PI3K класса Ia представляют собой гетеродимеры, которые состоят из каталитической субъединицы p110α, β или δ и регулирующей субъединицы p85 или p55. Класс Ib (p110γ) составляют мономеры. PI3K класса I представляют собой липид/протеинкиназы, активируемые посредством RTK, GPCR или Ras после присоединения к мембране. Такие PI3K класса I фосфорилируют фосфатидилинозитол-4,5-дифосфат (PIP2) в положении 3 инозитола с получением фосфатидилинозитол-3,4,5-трифосфата (PIP3), представляющего собой ключевой вторичный мессенджер этого сигнального пути. В свою очередь, PIP3 присоединяет AKT и PDK1 к мембране, где они фиксируются по своему домену, гомологичному плекстрину (домен PH), приводя к активации AKT фосфорилированием PDK1 по треонину 308. AKT фосфорилирует многие субстраты, играя, таким образом, ключевую роль во многих процессах, ведущих к трансформации клеток, таких как пролиферация, рост и выживание клеток, а также ангиогенез.
PI3Ks класса I участвуют в раковых заболеваниях человека: соматические мутации гена PIK3CA, кодирующего PI3K, обнаруживаются в 15-35% случаев опухолей человека, в частности, с двумя главными онкогенными мутациями H1047R (в домене киназы) и E545K/E542K (в спиральном домене) (Y. Samuels et al. Science, 2004, 304:554; T.L. Yuan and L.C. Cantley, Oncogene, 2008, 27:5497). Ожидается, что ингибиторы PI3K будут эффективными в лечении многих видов раковых заболеваний человека, в которых имеют место генетические изменения, ведущие к активации пути PI3K/AKT/mTOR (Vogt P. et al., Virology, 2006, 344:131; Zhao L. & Vogt P.K., Oncogene, 2008, 27:5486).
mTOR
mTOR (мишень рапамицина у млекопитающих)) представляет собой серин-треонинкиназу, родственную липидкиназам группы PI3K. mTOR участвуют в различных биологических процессах, включающих рост, пролиферацию, подвижность и выживание клеток. mTOR представляет собой многофункциональную киназу, одновременно интегрирующую сигналы, приходящие от факторов роста, и сигналы, приходящие от питательных веществ, для регуляции трансляции белков, улавливания питательных веществ, аутофагии и митохондриальной функции. mTOR существует в виде двух различных комплексов, называемых mTORC1 и mTORC2. mTORC1 содержит раптор-субъединицу, а mTORC2 содержит риктор-субъединицу. Оба этих комплекса регулируются различным образом: mTORC1 фосфорилирует киназу S6 (S6K) и 4EBP1, стимулирующую таким образом трансдукцию и биогенез рибосом для облегчения роста клеток и прогрессии в клеточном цикле. S6K действует также в пути обратной связи для ослабления активации AKT. mTORC1 чувствителен к рапамицину, тогда как mTORC2, в общем случае, не чувствителен к рапамицину. mTORC2 возможно модулирует сигнализацию факторов роста, фосфорилируя AKT по сериновому остатку 473. mTOR участвует в различных патологиях, включающих, в частности, рак, диабет, ожирение, сердечно-сосудистые заболевания и неврологические нарушения. mTOR модулирует многие биологические процессы, включающие трансдукцию, аутофагию и биогенез рибосом и интегрирующие внутри- и внеклеточные сигналы, такие как сигналы, транспортируемые факторами роста, питательными веществами, уровнями энергии и клеточным стрессом (Guertin D.A. and Sabatini D., Cancer Cell, 2007, 12:9; Menon S. and Manning B.D., Oncogene, 2009, 27:S43).
Роль аутофагии
Аутофагия представляет собой механизм внутриклеточной деградации (органеллы, долгоживущие белки и т.д.), зависящей от лизосом. Процесс аутофагии ведет к образованию особых везикул, называемых аутофагосомами. Липидкиназа PI3K класса III (Vps34) участвует в образовании аутофагосом. Эта PI3K класса III фосфорилирует фосфатидилинозитол (PI) в положении 3 инозитола с получением фосфатидилинозитол-3-трифосфата (PI3P). PI3P представляет собой ключевой вторичный мессенджер в образовании аутофагосом через привлечение белков, таких как WIPI, DFCP1 и Alfy. Аутофагия представляет собой механизм выживания клеток, позволяющий клетке выживать в ситуации стресса, например, в случае метаболического стресса. В случае рака аутофагия участвует в устойчивости опухолевых клеток к стрессу, действующему извне, такому как гипоксия, окислительные стрессы, дефицит питательных веществ, а также к терапевтическому стрессу: лечение противораковыми средствами и ионизирующим излучением.
Применение в противомалярийной химиотерапии
Малярия представляет собой одну из главных причин смертности от инфекций в мире и затрагивает каждый год от 100 до 200 миллионов человек. Тяжелое обострение течения болезни, наблюдаемое через несколько лет, обязано нескольким факторам, среди которых:
- переносчики, а именно, комары рода анофелес, которые становятся резистентными к традиционным и широко продающимся инсектицидам;
- увеличение численности населения в зонах риска; и главным образом,
- резистентность многих штаммов Plasmodium falciparum, представляющего собой паразит, ответственный за смертельные формы болезни, к традиционно используемым лекарственным средствам, таким как хлорохин и мефлохин.
Распространение резистентности среди штаммов Plasmodium, в частности P. falciparum, к большей части противомалярийных лекарственных средств свидетельствует о настоятельной необходимости разрабатывать новые соединения, обладающие новым способом действия и обеспечивающие, таким образом, уменьшение риска перекрестной резистентности. Киназы человека представляют собой приемлемые мишени в лечении многих патологий, поэтому кином P. falciparum был предложен в качестве совокупности новых мишеней для разработки новых лекарственных средств, еще не исследованных при лечении малярии.
Кином Plasmodium falciparum состоит из 64 киназ, некоторые из которых ортологичны киназам человека. Ингибиторы сигнальных путей киназ испытаны в отношении их способности ингибировать in vitro и in vivo рост P. falciparum и других видов, патогенных в отношении малярии.
Соединения по настоящему изобретению ингибируют рост P. falciparum (высокостойкий к хлорохину штамм Fcm29-Cameroun) при 1 мкМ и 0,1 мкМ в испытании in vitro с инфицированными эритроцитами человека соответственно указанному в таблице 2.
Подобные киномы содержатся во всех видах Plasmodium, таких как P. falciparum, P. vivax, P. malariae, P. ovale и P. knowlesi. Таким образом, соединения по настоящему изобретению могут быть приемлемыми для лечения малярии, вызываемой всеми указанными выше паразитами. Кроме того, киназы находятся в других паразитах, таких как Trypanosoma (например, T. brucei, T. cruzei) и Leishmania (например, L. major, L. donovani). Таким образом, соединения по настоящему изобретению могут быть использованы при лечении сонной болезни, болезни Шагаса, различных форм лейшманиоза и других паразитарных инфекций.
Производные морфолинопиримидинона, ингибирующие киназы, известны специалистам в данной области техники.
В WO 2008/148074 описаны соединения, обладающие ингибирующей активностью в отношении mTOR. Такие соединения представляют собой пиридо[1,2-a]пиримидин-4-оны, которые отличаются от соединений по настоящему изобретению своим полностью ароматическим характером и заместителями.
В WO 2008/064244 описано применение соединений TGX-221 и TGX-155, ингибирующих PI3Kβ и являющихся приемлемыми при лечении рака и предпочтительно рака молочной железы. Такие соединения представляют собой пиридо[1,2-a]пиримидин-4-оны, описанные ранее в WO 2004/016607 и WO 2001/053266 и отличающиеся от соединений по настоящему изобретению своим полностью ароматическим характером и заместителями.
В WO 2006/109081, WO 2006/109084 и WO 2006/126010 описаны соединения, ингибирующие DNA-PK (ДНК-ПК) и являющиеся приемлемыми для лечения раковых дефицитарных опухолей ATM. Эти соединения представляют собой пиридо[1,2-a]пиримидин-4-оны, которые отличаются от соединений по настоящему изобретению своим полностью ароматическим характером и заместителями.
В WO 2003/024949 описаны соединения, ингибирующие ДНК-ПК и являющиеся приемлемыми для лечения раковых дефицитарных опухолей ATM. Эти соединения представляют собой пиридо[1,2-a]пиримидин-4-оны, которые отличаются от соединений по настоящему изобретению своим полностью ароматическим характером и заместителями.
Объектами настоящего изобретения являются соединения формулы (I):
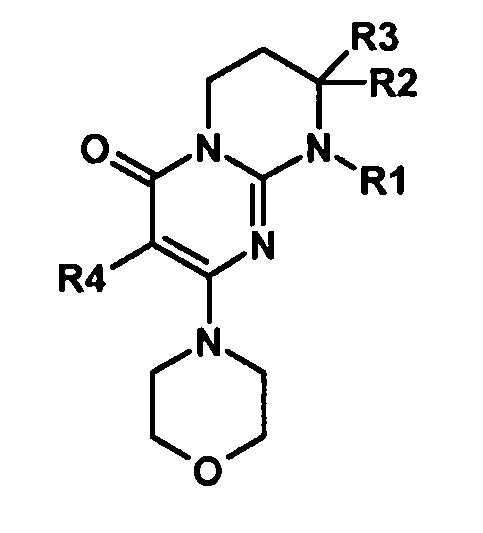
где R1 представляет собой -L-арил или -L-гетероарил, где L представляет собой:
или простую связь;
или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода и имеющий при необходимости в качестве заместителя гидроксигруппу;
или группу CO или -CO-Alk-;
или группу L'-X, где L' представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, а X означает атом кислорода или серы;
причем арилы и гетероарилы при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов, гидроксигруппы, CN, нитрогруппы, -COOH, -COOalk, -NRxRy, -CONRxRy, -NRxCORy, -NRxCO2Rz, -CORy, алкокси-, фенокси-, алкилтиогрупп, алкилов, циклоалкилов и гетероциклоалкилов;
причем указанные последними алкокси-, фенокси-, алкилтиогруппы, алкилы и гетероциклоалкилы, в свою очередь, при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов и NRvRw;
кроме того, гетероциклоалкилы и гетероарилы могут содержать оксогруппу;
R2 представляет собой атом водорода или алкил;
R3 представляет собой алкил, имеющий при необходимости в качестве заместителей один или несколько атомов галогенов;
R4 представляет собой атом водорода или галогена;
причем NRxRy является таким, что Rx представляет собой атом водорода или алкил, а Ry представляет собой атом водорода, циклоалкил или алкил, имеющий при необходимости один или несколько заместителей, являющихся одинаковыми или разными и выбранных из гидрокси-, алкоксигрупп, NRvRw и гетероциклоалкилов; или Rx и Ry с атомом азота, с которым они связаны, образуют цикл, содержащий от 3 до 10 членов и при необходимости один или несколько других гетероатомов, выбранных из O, S, NH и N-алкилов, причем этот цикл при необходимости является замещенным;
причем NRvRw является таким, что Rv представляет собой атом водорода или алкил, а Rw представляет собой атом водорода, циклоалкил или алкил, имеющий при необходимости один или несколько заместителей, являющихся одинаковыми или разными и выбранных из гидрокси-, алкоксигрупп и гетероциклоалкилов; или Rv и Rw с атомом азота, с которым они связаны, образуют цикл, содержащий от 3 до 10 членов и при необходимости один или несколько других гетероатомов, выбранных из O, S, NH и N-алкилов, причем этот цикл при необходимости является замещенным;
причем циклы, которые могут быть образованы Rx и Ry или Rv и Rw соответственно с атомом азота, с которым они связаны, при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов, алкилов, гидрокси-, оксо-, алкоксигрупп, NH2, NHalk и N(alk)2;
Rz имеет значения, принимаемые Ry, за исключением атома водорода;
причем Rx, Ry и Rz в -NRxCORy, -CORy и NRxCO2Rz имеют значения, выбранные из значений, указанных выше для Rx, Ry и Rz;
причем указанные соединения формулы (I) представляют собой любые возможные изомерные формы рацематов, энантиомеров и диастереоизомеров, а также аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Объектами настоящего изобретения являются также определенные выше соединения формулы (I), в которой:
R1 представляет собой -L-арил или -L-гетероарил, где L представляет собой:
или простую связь;
или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода и имеющий при необходимости в качестве заместителя гидроксигруппу;
или группу CO;
или группу L'-X, где L' представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, а X означает атом кислорода или серы;
причем арилы и гетероарилы при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов, гидроксигруппы, CN, нитрогруппы, -COOH, -COOalk, -NRxRy, -CONRxRy, -NRxCORy, -NRxCO2Rz, -CORy, алкокси-, фенокси-, алкилтиогрупп, алкилов, циклоалкилов и гетероциклоалкилов;
причем указанные последними алкокси-, фенокси-, алкилтиогруппы, алкилы и гетероциклоалкилы, в свою очередь, при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов и NRvRw;
кроме того, гетероциклоалкилы и гетероарилы могут содержать оксогруппу;
R2 представляет собой атом водорода или алкил;
R3 представляет собой алкил, имеющий при необходимости в качестве заместителей один или несколько атомов галогенов;
R4 представляет собой атом водорода или атом галогена;
причем NRxRy является таким, что Rx представляет собой атом водорода или алкил, а Ry представляет собой атом водорода, циклоалкил или алкил, имеющий при необходимости один или несколько заместителей, являющихся одинаковыми или разными и выбранных из гидрокси-, алкоксигрупп, NRvRw и гетероциклоалкилов; или Rx и Ry с атомом азота, с которым они связаны, образуют цикл, содержащий от 3 до 10 членов и при необходимости один или несколько других гетероатомов, выбранных из O, S, NH и N-алкилов, причем этот цикл при необходимости является замещенным;
причем NRvRw является таким, что Rv представляет собой атом водорода или алкил, а Rw представляет собой атом водорода, циклоалкил или алкил, имеющий при необходимости один или несколько заместителей, являющихся одинаковыми или разными и выбранных из гидрокси-, алкоксигрупп и гетероциклоалкилов; или Rv и Rw с атомом азота, с которым они связаны, образуют цикл, содержащий от 3 до 10 членов и при необходимости один или несколько других гетероатомов, выбранных из O, S, NH и N-алкилов, причем этот цикл при необходимости является замещенным;
причем циклы, которые могут быть образованы Rx и Ry или Rv и Rw соответственно с атомом азота, с которым они связаны, при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов, алкилов, гидрокси-, оксо-, алкоксигрупп, NH2, NHalk и N(alk)2;
Rz имеет значения, принимаемые Ry, за исключением атома водорода;
причем Rx, Ry и Rz в -NRxCORy, -CORy и NRxCO2Rz имеют значения, выбранные из значений, указанных выше для Rx, Ry и Rz;
причем указанные соединения формулы (I) представляют собой любые возможные изомерные формы рацематов, энантиомеров и диастереоизомеров, а также аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
В соединениях формулы (I):
- термин "алкил" (или "alk") означает линейные и при необходимости разветвленные радикалы, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил и также гептил, октил, нонил и децил и их линейные или разветвленные изомеры; предпочтительными являются алкилы, содержащие от 1 до 6 атомов углерода, и более предпочтительно алкилы, содержащие от 1 до 4 атомов углерода, из перечня, приведенного выше;
- термин "алкоксигруппа" означает линейные и при необходимости разветвленные радикалы, такие как метокси-, этокси-, пропокси-, изопропоксигруппа, линейная вторичная или третичная бутоксигруппа, пентокси- или гексоксигруппа, а также их линейные или разветвленные изомеры; предпочтительными являются алкоксигруппы, содержащие от 1 до 4 атомов углерода, из перечня, приведенного выше;
- термин "алкилтиогруппа" означает линейные и при необходимости разветвленные радикалы, такие как метилтио-, этилтио-, пропилтио-, изопропилтиогруппа, линейная вторичная или третичная бутилтиогруппа, пентилтио- или гексилтиогруппа и их линейные или разветвленные изомеры; предпочтительными являются алкилтиогруппы, содержащие от 1 до 4 атомов углерода, из перечня, приведенного выше;
- термин "галоген" означает атомы хлора, брома, йода или фтора и предпочтительно атомы хлора, брома или фтора;
- термин "циклоалкил" означает насыщенный карбоцикл, содержащий от 3 до 10 атомов углерода, и предпочтительно циклопропил, циклобутил, циклопентил и циклогексил и более предпочтительно циклопропил, циклопентил и циклогексил;
- циклоалкил в -O-циклоалкиле имеет определенные выше значения;
- термин "гетероциклоалкил" означает моноциклический или бициклический карбоцикл, содержащий от 3 до 10 членов, перемежаемых одним или несколькими гетероатомами, являющимися одинаковыми или разными и выбранными из атомов кислорода, азота или серы; можно указать, например, морфолинил, тиоморфолинил, гомоморфолинил, азиридил, азетидил, пиперазинил, пиперидил, гомопиперазинил, пирролидинил, имидазолидинил, пиразолидинил, тетрагидрофурил, тетрагидротиенил, тетрагидропиран, оксодигидропиридазинил или также оксетанил, причем все эти радикалы при необходимости являются замещенными; предпочтительно можно указать морфолинил, тиоморфолинил, гомоморфолинил, пиперазинил, пиперидил, гомопиперазинил или также пирролидинил;
- термины "арил" и "гетероарил" означают ненасыщенные или частично ненасыщенные моноциклические или бициклические карбоциклы и гетероциклы, которые содержат не более 12 членов и при необходимости могут содержать группу -C(O), причем гетероциклы содержат один или несколько гетероатомов, являющихся одинаковыми или разными и выбранных из O, N или S, при этом N при необходимости является замещенным;
- термин "арил" означает, таким образом, моноциклы или бициклы, содержащие от 6 до 12 членов, такие как, например, фенил, нафтил, бифенил, инденил, флуоренил и антраценил, более предпочтительно фенил и нафтил и наиболее предпочтительно фенил. Можно отметить, что карбоцикл, содержащий группу -C(O), представляет собой, например, тетралон;
- термин "гетероарил" означает, таким образом, моноциклы или бициклы, содержащие от 5 до 12 членов: моноциклические гетероарилы, такие как, например, тиенилы, такие как 2-тиенил и 3-тиенил, фурилы, такие как 2-фурил, 3-фурил, пиранил, пирролил, пирролинил, пиразолинил, имидазолил, пиразолил, пиридилы, такие как 2-пиридил, 3-пиридил и 4-пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил, тиазолил, изотиазолил, диазолил, тиадиазолил, тиатриазолил, оксадиазолил, изоксазолилы, такие как 3- или 4-изоксазолил, фуразанил, тетразолил, находящийся в свободном виде или в виде соли, причем все эти радикалы при необходимости являются замещенными, среди них более предпочтительными являются тиенилы, такие как 2-тиенил и 3-тиенил, фурилы, такие как 2-фурил, пирролил, пирролинил, пиразолинил, имидазолил, пиразолил, оксазолил, изоксазолил, пиридил, пиридазинил, причем эти радикалы при необходимости являются замещенными; бициклические гетероарилы, такие как, например, бензотиенилы, такие как 3-бензотиенил, бензотиазолил, хинолил, изохинолил, дигидрохинолил, хинолон, тетралон, адамантил, бензофурил, изобензофурил, дигидробензофуран, этилендиоксифенил, тиантренил, бензопирролил, бензимидазолил, бензоксазолил, тионафтил, индолил, азаиндолил, индазолил, пуринил, тиенопиразолил, тетрагидроиндазолил, тетрагидроциклопентапиразолил, дигидрофуропиразолил, тетрагидропирролопиразолил, оксотетрагидропирролопиразолил, тетрагидропиранопиразолил, тетрагидропиридинопиразолил или оксодигидропиридинопиразолил, причем все эти радикалы при необходимости являются замещенными.
В качестве примеров гетероарилов или бициклов более предпочтительно можно указать пиримидинил, пиридил, пирролил, азаиндолил, индазолил или пиразолил, бензотиазолил или бензимидазолил, имеющие при необходимости один или несколько заместителей, являющихся одинаковыми или разными соответственно указанному выше.
Одна или несколько карбоксильных групп соединений формулы (I) могут быть переведены в солевую форму или этерифицированы различными группами, которые известны специалистам в данной области техники и среди которых можно, например, указать:
- соединения, используемые для перевода в солевую форму: неорганические основания, такие как, например, основания натрия, калия, лития, кальция, магния или аммония, или органические основания, такие как, например, метиламин, пропиламин, триметиламин, диэтиламин, триэтиламин, N,N-диметилэтаноламин, трис(гидроксиметил)аминометан, этаноламин, пиридин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин;
- соединения, используемые для этерификации: алкилы для образования алкоксикарбонильных групп, таких как, например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил или бензилоксикарбонил, причем эти алкилы могут иметь заместители, выбранные, например, из атомов галогенов, гидроксигруппы, алкоксигрупп, ацилов, ацилокси-, алкилтио-, аминогрупп или арилов, таких как, например, хлорметил, гидроксипропил, метоксиметил, пропионилоксиметил, метилтиометил, диметиламиноэтил, бензил или фенетил.
Аддитивными солями соединений формулы (I) с неорганическими или органическими кислотами могут быть, например, соли, образованные с соляной, бромоводородной, йодоводородной, азотной, серной, фосфорной, пропионовой, уксусной, трифторуксусной, муравьиной, бензойной, малеиновой, фумаровой, янтарной, винной, лимонной, щавелевой, глиоксиловой, аспарагиновой, аскорбиновой кислотами, с алкилмоносульфоновыми кислотами, такими как, например, метансульфоновая, этансульфоновая, пропансульфоновая кислота, с алкилдисульфоновыми кислотами, такими как, например, метандисульфоновая, альфа-, бета-этандисульфоновая кислота, с арилмоносульфоновыми кислотами, такими как бензолсульфоновая кислота, и с арилдисульфоновыми кислотами.
Можно напомнить, что стереоизомерия может быть определена в широком смысле как изомерия соединений, имеющих совпадающие структурные формулы, но разные группы которых расположены в пространстве по-разному, как, в частности, в монозамещенных циклогексанах, в которых заместитель может находиться в аксиальном или экваториальном положении и в которых возможны различные вращательные конформации, как у производных этана. Однако существует другой тип стереоизомерии, которая обусловлена различными пространственными положениями фиксированных заместителей как относительно двойных связей, так и относительно циклов и которую часто называют геометрической изомерией или цис-транс-изомерией. Термин "стереоизомеры" в настоящей заявке употребляется в самом широком смысле и относится, таким образом, к совокупности соединений, указанных выше.
Объектами настоящего изобретения являются определенные выше соединения формулы (I), в которой:
R1 представляет собой -L-фенил или -L-гетероарил, где L представляет собой:
или простую связь;
или линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода и имеющий при необходимости в качестве заместителя гидроксигруппу;
или группу CO или -CO-Alk-;
или группу L'-X, где L' представляет собой линейный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, а X означает атом кислорода или серы;
причем фенил и гетероарил при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов и -NRxRy, алкоксигрупп и алкилов;
причем указанные последними алкоксигруппы и алкилы, в свою очередь, при необходимости имеют один или несколько заместителей, выбранных из атомов галогенов;
R2 представляет собой алкил;
R3 представляет собой алкил, имеющий при необходимости в качестве заместителей один или несколько атомов галогенов;
R4 представляет собой атом водорода или фтора;
причем NRxRy является таким, что Rx представляет собой атом водорода или алкил, а Ry представляет собой атом водорода или алкил; или Rx и Ry образуют с атомом азота, с которым они связаны, морфолиногруппу;
причем все алкилы (alk) или алкоксигруппы, указанные выше, являются линейными или разветвленными и содержат от 1 до 6 атомов углерода;
причем указанные соединения формулы (I) представляют собой любые возможные изомерные формы рацематов, энантиомеров и диастереоизомеров, а также аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
В частности, в случае когда NRxRy или NRvRw образует описанный выше цикл, такой циклический амин может быть выбран предпочтительно из таких радикалов, как пирролидинил, пиразолидинил, пиразолинил, пиперидил, азепинил, морфолинил, гомоморфолинил, пиперазинил или гомопиперазинил, причем эти радикалы, в свою очередь, при необходимости являются замещенными соответственно указанному выше или ниже.
Цикл NRxRy или NRvRw более предпочтительно может быть выбран из пирролидинила и морфолинила, имеющих при необходимости в качестве заместителя один или два алкила, или пиперазинила, имеющего при необходимости в качестве заместителя у второго атома азота алкил, фенил или CH2-фенил, которые, в свою очередь, при необходимости имеют один или несколько заместителей, являющихся одинаковыми или разными и выбранных из атомов галогенов, алкилов, гидрокси- и алкоксигрупп.
Объектами настоящего изобретения более предпочтительно являются определенные выше соединения формулы (I), соответствующие следующим формулам:
- (8S)-9-[2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- 9-[2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(2-фенилэтил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-бензил-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2S)-2-гидрокси-2-фенилэтил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2R)-2-гидрокси-2-фенилэтил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2S)-2-гидрокси-2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-[(1R)-1-фенилэтил]-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[1-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1S)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-фенил-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R)-1-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(фенилкарбонил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(пиридин-3-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(пиридин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2-хлорбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(2-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-метоксибензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-метоксифенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2-фторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3,5-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2,4-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(2,3,4-трифторбензил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(5-хлор-1-бензотиофен-3-ил)метил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-хлорфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-8-(трифторметил)-9-[4-(трифторметил)фенил]-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-бензил-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3,5-дифторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2,6-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2,4-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(фенилацетил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-хлорфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- 9-((R)-2-бензо[b]тиофен-2-ил-2-гидроксиэтил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-гидрокси-2-(3-гидроксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 2-диметиламино-N-{3-[(S)-1-гидрокси-2-((S)-8-морфолин-4-ил-6-оксо-2-трифторметил-3,4-дигидро-2H,6H-пиримидо[1,2-a]пиримидин-1-ил)этил]фенил}ацетамид;
- 9-[(S)-2-гидрокси-2-(2-метоксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(4-фтор-2-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(4-хлор-2-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(2-хлор-4-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-(2-гидрокси-3-фенилпропил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[2-(4-гидроксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
а также аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Настоящее изобретение относится также к любому способу получения определенных выше соединений формулы (I).
Соединения по настоящему изобретению могут быть получены обычными способами органической химии.
Получение соединений общей формулы (I)
Следующие далее общие схемы 1 и 2 приведены для пояснения способов, использованных для получения соединений формулы (I). В данном качестве они не представляют собой ограничения объема охраны настоящего изобретения в том, что относится к способам получения заявленных соединений.
Таким образом, определенные выше соединения формулы (I) по настоящему изобретению могут быть предпочтительно получены способами, описанными на схемах 1 и 2.
Таким образом, настоящее изобретение относится также к способу получения соединений формулы (I) согласно схеме 1, описанной ниже.
Таким образом, настоящее изобретение относится также к способу получения соединений формулы (I) согласно общей схеме 2, описанной ниже.
Общая схема 1
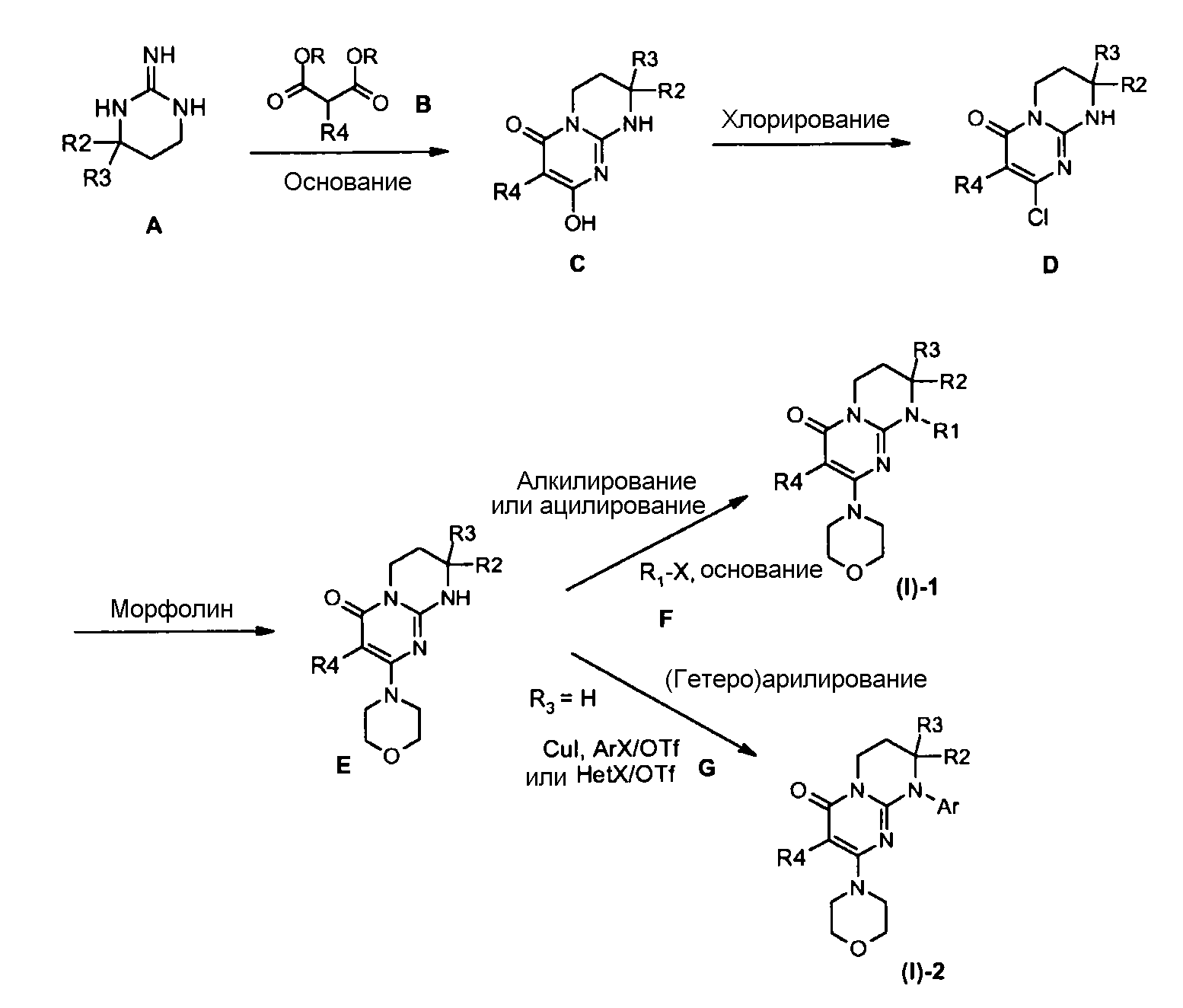
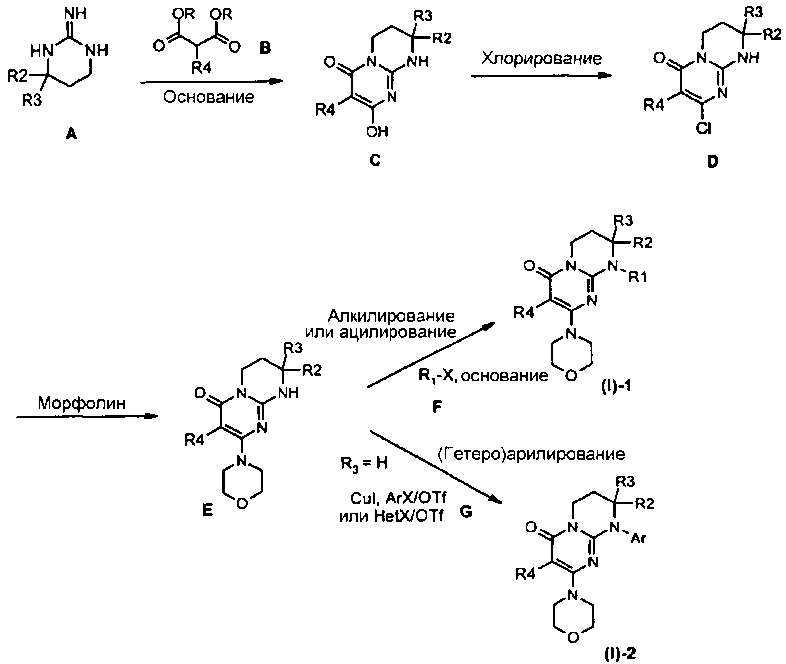
Соответственно общей схеме 1:
Гуанидины A являются коммерчески доступными или их получают способами, описанными Lochead A.W. et coll. (EP 1460076 2002), Lochead A.W. et coll. (EP 1340761 2003), Lochead, A.W. et coll. (EP 1454909 2004) и Lochead A.W. et coll. (WO 2005058908 2005).
Соединения C могут быть получены конденсацией гуанидина A с диалкилкилмалонатом B (предпочтительно с диэтилмалонатом) в присутствии основания, такого как метилат натрия, при температуре в интервале от 60 до 100°C в условиях, описанных, например, Badawey E.-S.A.M. et coll. (Eur. J. Med. Chem., 1998, 33(5), 349-361).
Соединения D могут быть получены исходя из соединения C обработкой хлорирующим агентом, таким как оксихлорид фосфора, в отсутствие растворителя при температуре в интервале от 20 до 120°C или в присутствии растворителя, такого как дихлорэтан, при температуре в интервале от 20°C до температуры кипения растворителя, например, в условиях, описанных Yamashita A. et coll. (Syn. Commun. (2004), 34(5), 795-803).
Соединения E могут быть получены исходя из соединения D взаимодействием с морфолином в отсутствие растворителя при температуре в интервале от 20 до 120°C или в присутствии растворителя, такого как ацетонитрил, при температуре в интервале от 20°C до температуры отгонки растворителя соответственно описанному, например, Aliabiev S.B. (Lett. Org. Chem. (2007), 4(4), 273-280).
Соединения (I)-1 могут быть получены по реакции алкилирования или ацилирования добавлением соединения F (R1-X, где R1=L-арил или гетероарил, определенный выше, а X=Cl, Br, I или OTf в случае алкилирования и X=Cl в случае ацилирования) к смеси соединения E и избытка основания, такого как гидрид натрия или карбонат цезия, в растворителе, таком как тетрагидрофуран, N,N-диметилформамид или ацетонитрил, при температуре в интервале от 0 до 80°C соответственно описанному, например, Ting P.C. et coll. (J. Med. Chem. (1990), 33(10), 2697-2706) в случае реакции алкилирования.
По методике, описанной E.P. Seest et al. в Tet. Assymetry, 17 (2006), 2154-2182, соединения F, соответствующие хиральным 1-арил-2-хлорэтанолу или 1-гетероарил-2-хлорэтанолу, синтезируют исходя из соответствующих производных хлоркетона, которые, в свою очередь, получают хлорированием в стандартных условиях коммерчески доступных ацетилпроизводных.
Соединения (I)-2 могут быть получены взаимодействием соединения E с галогенидом (X=Cl, Br или I) или арил- или гетероарилтрифлатом G в присутствии связывающего агента, такого как йодид меди, необязательно в присутствии лиганда меди, такого как (+/-)-транс-1,2-диаминоциклогексан или 4,7-диметокси-1,10-фенантролин, в присутствии основания, такого как фосфат калия, в растворителе, таком как N-метилпирролидон или N,N-диметилформамид, при микроволновом нагревании при температуре в интервале от 100 до 200°C соответственно описанному, например, Lianbo Z. et coll. (J. Org. Chem. (2009), 74(5), 2200-2202).
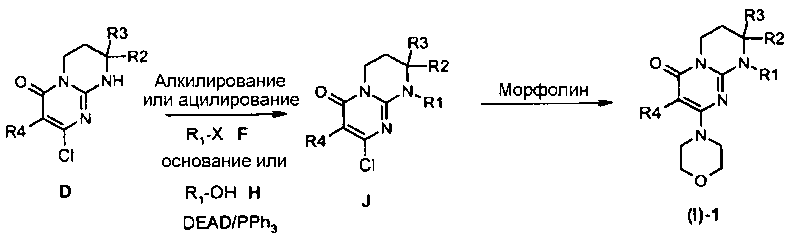
Альтернативным образом, соединения (I)-1 могут быть получены согласно общей схеме 2.
Общая схема 2
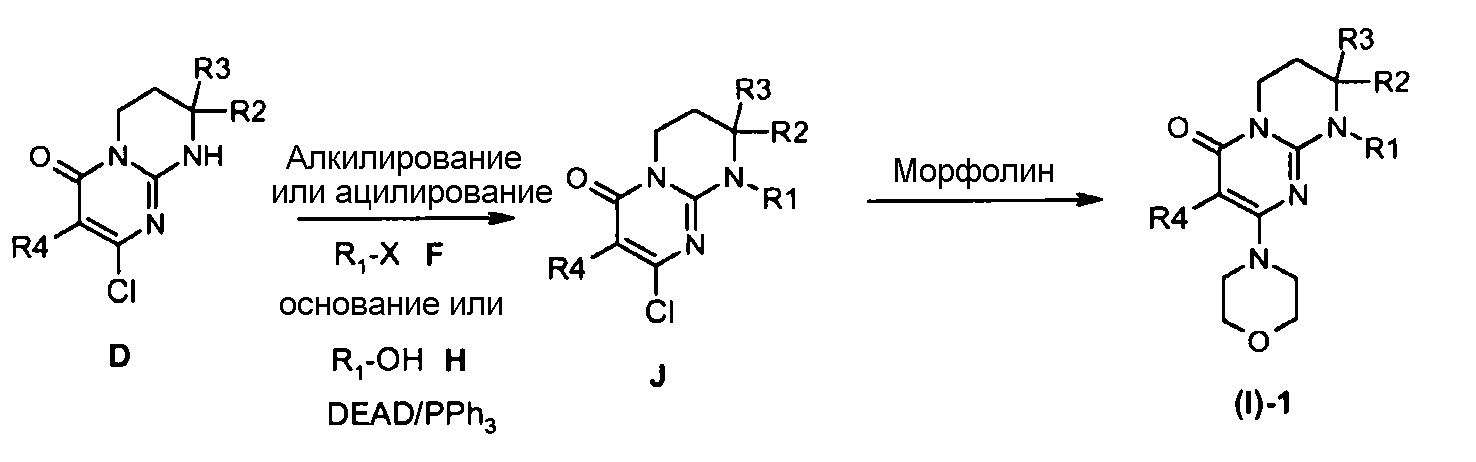
Соединения (I)-1 могут быть получены исходя из соединения J взаимодействием с морфолином в отсутствие растворителя при температуре в интервале от 20 до 120°C или в присутствии растворителя, такого как ацетонитрил, при температуре в интервале от 20°C до температуры отгонки растворителя соответственно описанному, например, Aliabiev S.B. (Lett. Org. Chem. (2007), 4(4), 273-280).
Соединения J могут быть получены по реакции алкилирования или ацилирования добавлением соединения F (R1-X, где R1=L-арил или гетероарил, определенный выше, а X=Cl, Br, I или OTf в случае алкилирования и X=Cl в случае ацилирования) к смеси соединения E и избытка основания, такого как гидрид натрия или карбонат цезия, в растворителе, таком как тетрагидрофуран, N,N-диметилформамид или ацетонитрил, при температуре в интервале от 0 до 80°C соответственно описанному, например, Ting P.C. et coll. (J. Med. Chem. (1990), 33(10), 2697-2706) в случае реакции алкилирования.
Альтернативным образом, соединения J могут быть получены по реакции Мицунобу между соединением D и спиртом H в присутствии диэтилазодикарбоксилата и трифенилфосфина (при необходимости нанесенного на смолу) в растворителе, таком как тетрагидрофуран, при температуре в интервале от 0 до 65°C соответственно описанному, например, Mitsunobu O. et coll. (Synthesis (1981), 1-28).
В случае когда R2 отличается от R3 и синтез не является стереоселективным, энантиомеры или возможные диастереоизомеры промежуточных соединений, получаемых в синтезе, или соединений (H) могут быть разделены хроматографией с хиральной фазой.
Настоящее изобретение пояснено приведенными далее примерами соединений формулы (I) без ограничения объема охраны.
Среди исходных соединений формулы A или B некоторые соединения известны и могут быть коммерчески доступны или получены обычными способами, известными специалистам в данной области техники, например, исходя из коммерческих реактивов.
Специалистам в данной области техники понятно, что для осуществления описанных ранее способов по настоящему изобретению может оказаться необходимым введение групп, защищающих функциональные аминогруппы, карбоксильные и спиртовые группы, чтобы избежать побочных реакций.
Можно привести не ограничивающий перечень примеров защиты реакционноспособных функциональных групп:
- гидроксильные группы могут быть защищены, например, алкилами, такими, как трет-бутил, триметилсилил, трет-бутилдиметилсилил, метоксиметил, тетрагидропиранил, бензил или ацетил;
- аминогруппы могут быть защищены, например, такими радикалами, как ацетил, тритил, бензил, трет-бутоксикарбонил, BOC, бензилоксикарбонил, фталимидо, или другими радикалами, известными в химии пептидов;
- кислотные группы могут быть защищены, например, в форме легко расщепляемых сложных эфиров, таких как бензиловые или трет-бутиловые сложные эфиры, или сложные эфиры, известные в химии пептидов.
Перечень различных защитных групп, приемлемых для использования, можно найти в справочниках, известных специалистам в данной области техники, и, например, в BF 2499995.
Можно отметить, что, если требуется и является необходимым, с промежуточными соединениями или соединениями формулы (I), полученными, например, способами, указанными выше, для получения других промежуточных соединений или других соединений формулы (I) можно осуществлять одну или несколько реакций преобразований, известных специалистам в данной области техники, таких как, например:
a) реакция образования сложного эфира с карбоксигруппой;
b) реакция омыления группы сложного эфира с высвобождением карбоксигруппы;
c) реакция восстановления свободной или этерифицированной карбоксигруппы до спиртовой группы;
d) реакция преобразования алкоксигруппы в гидроксигруппу или гидроксигруппы в алкоксигруппу;
e) реакция удаления защитных групп, которые могут быть связаны с защищенными реакционноспособными функциональными группами;
f) реакция образования соли с неорганической или органической кислотой или основанием с получением соответствующей соли;
g) реакция разделения рацематов на индивидуальные соединения;
причем указанные соединения формулы (I), полученные таким образом, могут находиться в любых возможных изомерных формах рацематов, энантиомеров и диастереоизомеров.
Реакции по пунктам a)-g) могут быть осуществлены в обычных условиях, известных специалистам в данной области техники, таких как, например, условия, указанные ниже.
a) Описанные выше соединения при возможном наличии в них карбоксигрупп можно подвергать, при необходимости, реакциям этерификации, которые могут быть осуществлены обычными способами, известными специалистам в данной области техники.
b) Возможные преобразования сложноэфирных групп описанных выше соединений в кислотные группы могут быть, при необходимости, осуществлены в обычных условиях, известных специалистам в данной области техники, предпочтительно кислотным или щелочным гидролизом, например, гидроксидом натрия или калия в среде спирта, такого как, например, метанол, или также соляной или серной кислотой.
Реакция омыления может быть осуществлена обычными способами, известными специалистам в данной области техники, такими как, например, способы, осуществляемые в растворителе, таком как метанол или этанол, диоксан или диметоксиэтан, в присутствии гидроксида натрия или калия.
c) Возможные свободные или этерифицированные карбоксигруппы описанных выше соединений могут быть, при необходимости, восстановлены до спиртовых групп способами, известными специалистам в данной области техники: возможные этерифицированные карбоксигруппы могут быть, при необходимости, восстановлены до спиртовых групп способами, известными специалистам в данной области техники, предпочтительно гидридом лития-алюминия в растворителе, таком как, например, тетрагидрофуран или также диоксан, или диэтиловый эфир.
Возможные свободные карбоксигруппы описанных выше соединений могут быть, при необходимости, восстановлены до спиртовых групп предпочтительно гидридом бора.
d) Возможные алкоксигруппы, такие как, в частности, метоксигруппы, описанных выше соединений могут быть, при необходимости, преобразованы в гидроксигруппы в обычных условиях, известных специалистам в данной области техники, например, действием трибромида бора в растворителе, таком как, например, метиленхлорид, действием гидробромида или гидрохлорида пиридина или также бромоводородной или соляной кислоты в воде или в трифторуксусной кислоте при нагревании с обратным холодильником.
e) Удаление защитных групп, таких как, например, группы, указанные выше, может быть осуществлено в обычных условиях, известных специалистам в данной области техники, предпочтительно кислотным гидролизом, осуществляемым с кислотой, такой как соляная, бензолсульфоновая или пара-толуолсульфоновая, муравьиная или трифторуксусная кислота, или также каталитическим гидрированием.
Фталимидогруппа может быть удалена гидразином.
f) Описанные выше соединения можно вводить, при необходимости, в реакции солеобразования, например, с неорганической или органической кислотой, или неорганическим или органическим основанием обычными способами, известными специалистам в данной области техники: такие реакции солеобразования могут быть осуществлены, например, в присутствии соляной или также винной, лимонной или метансульфоновой кислоты в спирте, таком как, например, этанол или метанол.
g) Возможные оптически активные формы описанных выше соединений могут быть получены разделением рацематов обычными способами, известными специалистам в данной области техники.
Определенные выше соединения формулы (I), а также их кислотно-аддитивные соли обладают представляющими интерес фармакологическими свойствами, в частности, по причине их свойств ингибирования киназ, а также соответственно указанному выше.
Соединения по настоящему изобретению являются предпочтительно приемлемыми для терапии опухолей.
Соединения по настоящему изобретению также могут, например, увеличивать терапевтическое действие обычно используемых противоопухолевых средств.
Эти свойства оправдывают их применение в терапии, поэтому объектами настоящего изобретения в качестве лекарственных средств предпочтительно являются определенные выше соединения формулы (I), причем указанные соединения формулы (I) представляют собой любые возможные изомерные формы рацематов, энантиомеров и диастереоизомеров, а также фармацевтически приемлемые аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Более предпочтительно объектами настоящего изобретения в качестве лекарственных средств являются соединения, соответствующие следующим формулам:
- (8S)-9-[2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- 9-[2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(2-фенилэтил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-бензил-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2S)-2-гидрокси-2-фенилэтил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2R)-2-гидрокси-2-фенилэтил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2S)-2-гидрокси-2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-[(1R)-1-фенилэтил]-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[1-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1S)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-фенил-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R)-1-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(фенилкарбонил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(пиридин-3-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(пиридин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2-хлорбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(2-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-метоксибензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-метоксифенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2-фторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3,5-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(2,4-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(2,3,4-трифторбензил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(5-хлор-1-бензотиофен-3-ил)метил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(4-хлорфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-8-(трифторметил)-9-[4-(трифторметил)фенил]-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-бензил-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-(3,5-дифторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2,6-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[(2,4-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-2-(морфолин-4-ил)-9-(фенилацетил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- (8S)-9-[2-(3-хлорфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он;
- 9-((R)-2-бензо[b]тиофен-2-ил-2-гидроксиэтил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-гидрокси-2-(3-гидроксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 2-диметиламино-N-{3-[(S)-1-гидрокси-2-((S)-8-морфолин-4-ил-6-оксо-2-трифторметил-3,4-дигидро-2H,6H-пиримидо[1,2-a]пиримидин-1-ил)этил]фенил}ацетамид;
- 9-[(S)-2-гидрокси-2-(2-метоксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(4-фтор-2-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(4-хлор-2-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[(S)-2-(2-хлор-4-метоксифенил)-2-гидроксиэтил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-(2-гидрокси-3-фенилпропил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
- 9-[2-(4-гидроксифенил)этил]-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он;
а также фармацевтически приемлемые аддитивные соли указанных соединений формулы (I) с неорганическими и органическими кислотами или с неорганическими и органическими основаниями.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим в качестве активного вещества по меньшей мере одно из определенных выше соединений формулы (I) или фармацевтически приемлемую соль такого соединения или пролекарство такого соединения и, при необходимости, фармацевтически приемлемый носитель.
Таким образом, настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества по меньшей мере одно из определенных выше лекарственных средств.
Такие фармацевтические композиции по настоящему изобретению могут также, при необходимости, содержать активные вещества других антимитотических лекарственных средств, таких как, в частности, средства на основе таксола, цисплатина, интеркалянтов ДНК и других соединений.
Такие фармацевтические композиции можно вводить трансбуккально, парентерально или местно путем топического нанесения на кожу и слизистые оболочки, или путем внутривенной или внутримышечной инъекции.
Эти композиции могут быть твердыми или жидкими и находиться в любых обычно используемых в медицине фармацевтических формах, таких как, например, простые или дражированные таблетки, пилюли, лепешки, желатиновые капсулы, капли, гранулы, препараты для инъекций, мази, кремы или гели, которые получают обычными способами. Активное вещество может быть введено в обычно используемые в этих фармацевтических композициях эксципиенты, такие как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные эксципиенты, жиры животного или растительного происхождения, производные парафинов, гликоли, различные смачивающие агенты, диспергаторы или эмульгаторы, консерванты.
Обычная доза, варьирующая в зависимости от используемого соединения, пациента, подлежащего лечению, и конкретного заболевания, может составлять, например, для взрослого человека от 0,05 до 5 г и предпочтительно от 0,1 до 2 г в день.
Настоящее изобретение относится также к применению определенных выше соединений формулы (I) для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, характеризующегося нарушением активности протеин- или липидкиназы.
Такое лекарственное средство может быть предпочтительно предназначено для лечения или профилактики заболевания у млекопитающего.
Настоящее изобретение предпочтительно относится к применению определенного выше соединения формулы (I) для получения лекарственного средства, предназначенного для профилактики или лечения различных заболеваний, таких как сердечно-сосудистые заболевания, включающие, в частности, тромбоз.
Настоящее изобретение предпочтительно относится к применению определенного выше соединения формулы (I) для получения лекарственного средства, предназначенного для профилактики или лечения заболеваний, связанных с неконтролируемой пролиферацией.
Таким образом, настоящее изобретение более предпочтительно относится к применению определенного выше соединения формулы (I) для получения лекарственного средства, предназначенного для лечения или профилактики онкологических заболеваний и предпочтительно предназначенного для лечения раковых опухолей.
Относительно таких раковых опухолей интерес представляет лечение солидных опухолей или лейкозов и лечение раковых опухолей, резистентных к цитотоксическим агентам.
Указанные соединения по настоящему изобретению могут быть предпочтительно использованы для лечения первичных опухолей и/или метастазов предпочтительно в случае раковых опухолей желудка, печени, почек, яичников, толстой кишки, предстательной железы, эндометрия, легких (NSCLC и SCLC), глиобластом, раковых опухолей щитовидной железы, мочевого пузыря, молочной железы, в случае меланом, в случае лимфоидных или миелоидных опухолей кроветворной системы, в случае сарком, в случае раковых опухолей головного мозга, гортани, лимфатической системы, раковых опухолей костей и поджелудочной железы, в случае гамартом. Предпочтительными являются заболевания, при которых проявляются генетические аномалии, ведущие к активации пути PI3K/AKT/mTOR и/или активации пути MAP-киназы.
Настоящее изобретение относится также к применению определенных выше соединений формулы (I) для получения лекарственных средств, предназначенных для химиотерапии раковых опухолей.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I) для применения в лечении раковых опухолей.
Настоящее изобретение относится к определенным выше соединениям формулы (I), предназначенным для применения в лечении солидных опухолей или лейкозов.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I) для применения в лечении раковых опухолей, резистентных к цитотоксическим агентам.
Таким образом, настоящее изобретение относится к определенным выше соединением формулы (I) для применения в лечении первичных опухолей и/или метастазов предпочтительно в случае раковых опухолей желудка, печени, почек, яичников, толстой кишки, предстательной железы, эндометрия, легких (NSCLC и SCLC), глиобластом, раковых опухолей щитовидной железы, мочевого пузыря, молочной железы, в случае меланом, в случае лимфоидных или миелоидных опухолей кроветворной системы, в случае сарком, в случае раковых опухолей головного мозга, гортани, лимфатической системы, раковых опухолей костей и поджелудочной железы, в случае гамартом.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I), предназначенным для применения в химиотерапии раковых опухолей.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I), предназначенным для применения в химиотерапии раковых опухолей индивидуально или в комбинации.
Такие лекарственные средства, предназначенные для химиотерапии раковых опухолей, могут быть использованы индивидуально или в комбинации.
Соединения по настоящему изобретению предпочтительно можно вводить индивидуально или в комбинации с химиотерапией или радиотерапией, или также в комбинации, например, с другими терапевтическими средствами.
Такие терапевтические средства могут представлять собой противоопухолевые средства, используемые в общем порядке.
Можно, в частности, ожидать благоприятный терапевтический эффект при введении соединений по настоящему изобретению в комбинации с различными курсами направленной терапии. Такими курсами направленной терапии предпочтительно являются: i) терапия, при которой ингибируют сигнальные пути MAP-киназы, например, терапия, при которой ингибируют RAS, RAF, MEK или ERK; ii) направленная терапия, при которой ингибируют киназы или псевдокиназы пути PI3K/AKT/mTOR, такие как EGFR, HER2, HER3, ALK, MET, PI3K, PDK1, AKT, mTOR и S6K.
Настоящее изобретение предпочтительно относится к применению определенного выше соединения формулы (I) для получения лекарственного средства, предназначенного для профилактики или лечения лизосомальных заболеваний, таких как гликогеноз типа II или болезнь Помпе. Такие лекарственные средства, предназначенные для лечения лизосомальных заболеваний, могут быть использованы индивидуально или в комбинации, например, с другими терапевтическими средствами.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I), предназначенным для профилактики или лечения лизосомальных заболеваний, таких как гликогеноз типа II или болезнь Помпе.
Настоящее изобретение относится также к применению определенных выше соединений формулы (I) для получения лекарственного средства, предназначенного для профилактики или лечения лизосомальных заболеваний, таких как гликогеноз типа II или болезнь Помпе.
Таким образом, настоящее изобретение относится к определенному выше применению, при котором соединения формулы (I) используют индивидуально или в комбинации.
Настоящее изобретение относится также к применению определенного выше соединения формулы (I) для получения лекарственного средства, предназначенного для лечения паразитарных заболеваний, таких как малярия, сонная болезнь, болезнь Шагаса, лейшманиозы. Такие лекарственные средства, предназначенные для лечения паразитарных инфекций, могут быть использованы индивидуально или в комбинации, например, с другими терапевтическими средствами.
Таким образом, настоящее изобретение относится к определенным выше соединениям формулы (I), предназначенным для профилактики или лечения паразитарных заболеваний, таких как малярия, сонная болезнь, болезнь Шагаса, лейшманиозы.
Настоящее изобретение относится также к применению определенных выше соединений формулы (I) для получения лекарственного средства, предназначенного для лечения паразитарных заболеваний, таких как малярия, сонная болезнь, болезнь Шагаса, лейшманиозы.
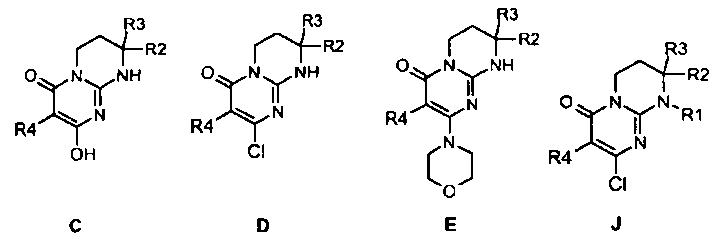
Объектами настоящего изобретения в качестве новых промышленных продуктов являются синтетические промежуточные соединения формул C, D, E и J, определенные выше и указанные ниже:
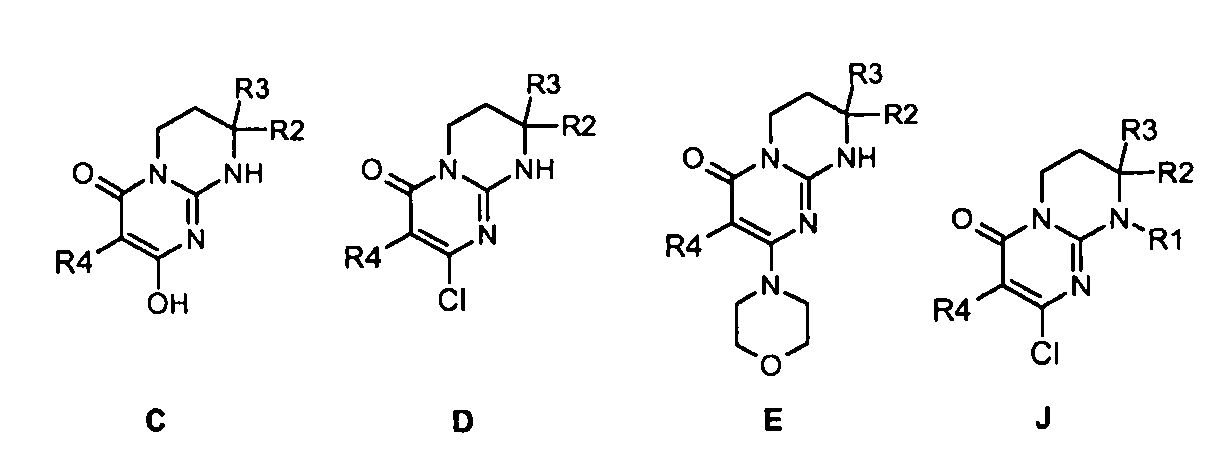
где R1, R2, R3 и R4 имеют значения, определенные по п.1 или 2.
Настоящее изобретение пояснено приведенными далее примерами, относящимися к соединениям формулы (I), без ограничения объема охраны.
Экспериментальная часть
Номенклатурные названия соединений в настоящем изобретении определены посредством программы ACDLABS, версия 10.0.
Использованная микроволновая печь представляет собой прибор Biotage, Initiator™ 2.0, 400 Вт макс., 2450 МГц.
Спектры 1H ЯМР при 400 МГц и 500 МГц были записаны на спектрометре BRUKER AVANCE DRX-400 или BRUKER AVANCE DPX-500 с определением химических сдвигов (δ, м.д.) в эталонном растворителе диметилсульфоксид-d6 (ДМСО-d6) со сдвигом 2,5 м.д. при температуре 303 K.
Масс-спектры (SM (МС)) были получены по методике A или по методике B, или по методике E.
Методика A
Прибор WATERS UPLC-SQD; ионизация: электрораспыление в положительном и/или отрицательном режиме (ES+/-); условия хроматографирования: колонка: ACQUITY BEH C18, 1,7 мкм, 2,1×50 мм; растворители: A: H2O (0,1% муравьиной кислоты); B: CH3CN (0,1% муравьиной кислоты); температура колонки: 50°C; подача: 1 мл/мин; градиент (2 мин): от 5 до 50% B в течение 0,8 мин; 1,2 мин: 100% B; 1,85 мин: 100% B; 1,95 мин: 5% B; время удерживания=Tr (мин).
Методика B
Прибор WATERS ZQ; ионизация: электрораспыление в положительном и/или отрицательном режиме (ES+/-); условия хроматографирования: колонка: XBridge C18, 2,5 мкм, 3×50 мм; растворители: A: H2O (0,1% муравьиной кислоты); B: CH3CN (0,1% муравьиной кислоты); температура колонки: 70°C; подача: 0,9 мл/мин; градиент (7 мин): от 5 до 100% B в течение 5,3 мин; 5,5 мин: 100% B; 6,3 мин: 5% B; время удерживания=Tr (мин).
Методика E
Прибор WATERS UPLC-SQD; ионизация: электрораспыление в положительном и/или отрицательном режиме (ES+/-); условия хроматографирования: колонка: Ascentis express C18, 2,7 мкм, 2,1×50 мм; растворители: A: H2O (0,02% трифторуксусной кислоты); B: CH3CN (0,014% трифторуксусной кислоты); температура колонки: 55°C; подача: 1 мл/мин; градиент: T=0 мин: 2% B, T=1 мин: 98% B, T=1,3 мин: 98% B, T=1,33 мин: 2% B, T=1,5 мин: другой ввод; время удерживания=Tr (мин).
Оптическое вращение (PR) измеряли на поляриметре модели 341 компании Perkin Elmer. Длина волны: спектральная линия α натрия (589 нм).
Очистка способом препаративной ВЭЖХ/МС
Методика C
Колонка с обращенной фазой C18 SunFire (Waters), 30×100, 5 мкм
Градиент ацетонитрила (+0,07% ТФУК) в воде (+0,07% ТФУК)
T0: 20% ацетонитрила (+0,07% ТФУК)
T1: 20% ацетонитрила (+0,07% ТФУК)
T11,5: 95% ацетонитрила (+0,07% ТФУ%)
T15: 95% ацетонитрила (+0,07% ТФУК)
T15,5: 20% ацетонитрила (+0,07% ТФУК)
Подача: 30 мл/мин
Масс-спектроскопия: 130_800 UMA=; ESP+, ESP
Методика D
Колонка с обращенной фазой C18 SunFire (Waters), 30×100, 5 мкм
Градиент ацетонитрила (+0,07% ТФУК) в воде (+0,07% ТФУК)
T0: 40% ацетонитрила (+0,07% ТФУК)
T1: 40% ацетонитрила (+0,07% ТФУК)
T11: 95% ацетонитрила (+0,07% ТФУК)
T14,5: 95% ацетонитрила (+0,07% ТФУК)
T15: 10% ацетонитрила (+0,07% ТФУК)
Подача: 30 мл/мин
Масс-спектроскопия: 130_800 UMA=; ESP+, ESP
Пример 1: (S)-9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
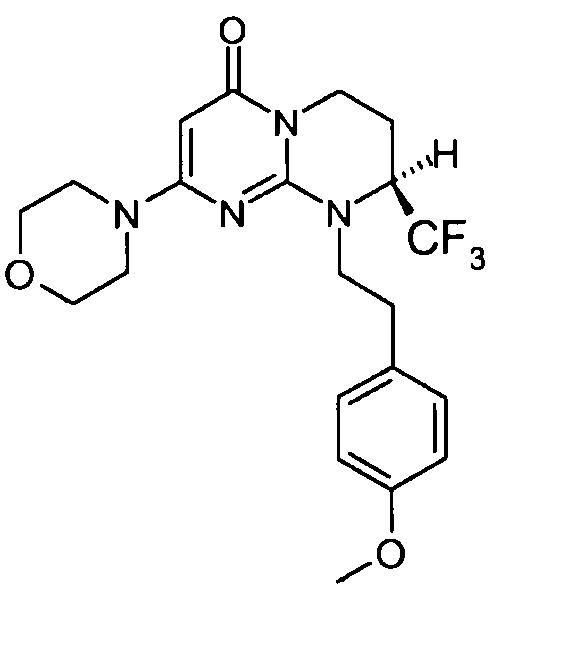
Стадия f: (S)-9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
К раствору 150 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в 5 мл безводного диметилформамида при комнатной температуре и в атмосфере аргона добавляют 0,5 г карбоната цезия, 0,23 г 4-метоксифенетилбромида и 5 мг бензилтриэтиламмонийхлорида (BTEAC). Реакционную смесь нагревают при 80°C в течение 18 часов.
После охлаждения к полученной смеси добавляют 10 мл холодной воды и 50 мл этилацетата. Органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают методом хроматографии на диоксиде кремния (градиент от 0 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане), с получением 160 мг (S)-9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
1,82-2,05 (м, 1H); 2,25-2,39 (м, 1H); 2,73-2,83 (м, 1H); 2,88-2,99 (м, 1H); 3,10-3,21 (м, 1H); 3,34-3,41 (м, 1H); 3,43-3,46 (м, 4H); 3,65 (м, 4H); 3,72 (с, 3H); 4,03-4,23 (м, 2H); 4,47-4,60 (м, 1H); 4,99 (с, 1H); 6,87 (д, J=8,6 Гц, 2H); 7,12 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,93 мин
[M+H]+: m/z 439
Оптическое вращение: PR=+91; C=2,426 мг/0,5 мл MeOH
Стадия e: (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
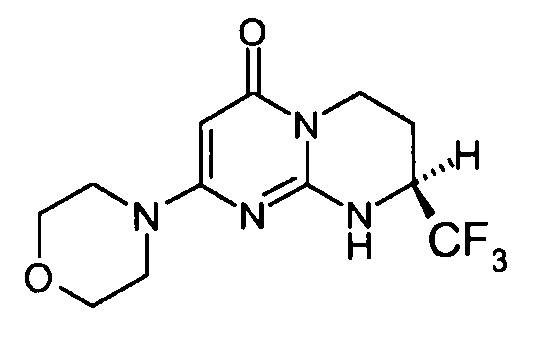
Смесь 1 г (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 15 мл морфолина нагревают при 80°C. После нагревания в течение полутора часов и контроля способом ЖХ/МС реакцию прекращают. После охлаждения реакционную смесь концентрируют при пониженном давлении. К полученному остатку добавляют 10 мл холодной воды и 100 мл этилацетата. Полученную органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением 1,2 г (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,49 мин
[M+H]+: m/z 305; [M-H]-: m/z 303
Оптическое вращение: PR=+14,2+/-0,6; C=2,25 мг/0,5 мл MeOH
Стадия d: (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он

Разделение двух энантиомеров (R,S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (17 г) осуществляют методом хроматографии на хиральной фазе: неподвижная фаза: Chiralpak AD; подвижная фаза: EtOH (20%)/гептан (80%).
Левовращающий энантиомер концентрируют с получением 8,52 г (R)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде порошка белого цвета.
Правовращающий энантиомер концентрируют с получением 8,21 г (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде порошка белого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,51 мин
[M+H]+: m/z 254; [M-H]-: m/z 252
Оптическое вращение: PR=+21,3+/-0,5, MeOH
Стадия c: (R,S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
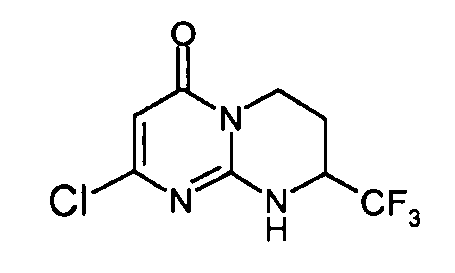
К суспензии 34 г (R,S)-2-гидрокси-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в 500 мл 1,2-дихлорэтана при комнатной температуре и в атмосфере аргона добавляют 60 мл оксихлорида фосфора. Затем полученную смесь нагревают при 65°C. После нагревания в течение трех часов при 65°C реакцию прекращают после контроля способом ЖХ/МС. После охлаждения реакционную смесь упаривают досуха при пониженном давлении. Полученный остаток обрабатывают 100 мл холодной воды и 400 мл этилацетата. К полученной смеси добавляют 32% раствор гидроксида натрия до pH=6. Полученную органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением остатка оранжевого цвета. Этот остаток очищают методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH: 97/03) с получением 20 г (R,S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,51 мин
[M+H]+: m/z 254; [M-H]-: m/z 252
Стадия b: (R,S)-2-гидрокси-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
К смеси 50 мл диэтилмалоната добавляют 10 г гидрохлорида 6-трифторметил-1,4,5,6-тетрагидропиримидин-2-иламина и 10 г метилата натрия. Полученную смесь нагревают при 100°C в течение 75 минут. Гетерогенная смесь сгущается и приобретает желтый цвет при небольшом выделении газов. После охлаждения реакционную смесь упаривают досуха при пониженном давлении. Полученный остаток растирают с диэтиловым эфиром. Образовавшееся твердое вещество отделяют фильтрованием через пористый стеклянный фильтр и затем обрабатывают 20 мл холодной воды. К полученной густой суспензии добавляют 12 н. раствор соляной кислоты до pH=5-6. Полученную суспензию фильтруют через пористый стеклянный фильтр и не растворившееся вещество промывают диэтиловым эфиром с получением 11,5 г (R,S)-2-гидрокси-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,26 мин
[M+H]+: m/z 236; [M-H]-: m/z 234
Стадия a: гидрохлорид (R,S)-6-трифторметил-1,4,5,6-тетрагидропиримидин-2-иламина
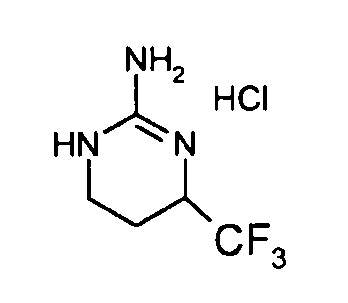
В автоклаве при 3 бар и 22°C в течение 24 часов гидрируют смесь 1,1 г Pd/C, 10%, и 22 г 2-амино-4-(трифторметил)пиримидина, растворенного в 200 мл воды, 50 мл метанола и 50 мл 12 н. раствора HCl. Затем полученную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток сушат в сушильном шкафу в присутствии P2O5 с получением 27 г гидрохлорида (R,S)-6-трифторметил-1,4,5,6-тетрагидропиримидин-2-иламина в виде твердого вещества серого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,17 мин
[M+H]+: m/z 168
Пример 2: (R,S)-9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
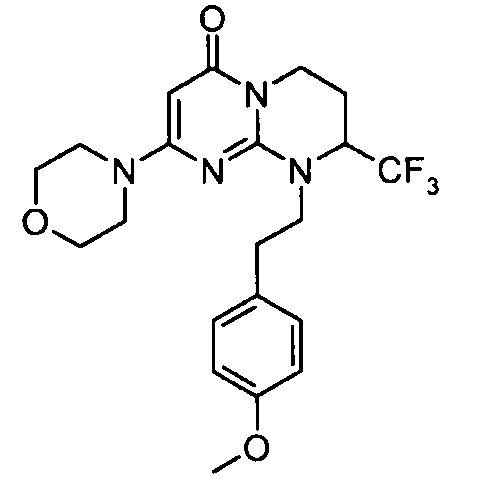
Стадия b: (R,S)-9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
К раствору 120 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в 5 мл безводного диметилформамида при комнатной температуре и в атмосфере аргона добавляют 0,5 г карбоната цезия, 0,23 г 4-метоксифенетилбромида и 10 мг бензилтриэтиламмонийхлорида (BTEAC). Полученную смесь нагревают при 80°C в течение 18 часов.
После охлаждения реакционную смесь концентрируют при пониженном давлении. Полученный остаток обрабатывают 50 мл этилацетата и полученный раствор промывают 3 мл воды. Органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и упаривают при пониженном давлении. После очистки методом хроматографии на диоксиде кремния (градиент от 0 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 80 мг (R,S)-(9-[2-(4-метоксифенил)этил]-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
1,85-2,02 (м, 1H); 2,27-2,35 (м, 1H); 2,72-2,84 (м, 1H); 2,88-2,98 (м, 1H); 3,09-3,20 (м, 1H); 3,37-3,42 (м, 1H); 3,45 (м, 4H); 3,63-3,67 (м, 4H); 3,72 (с, 3H); 4,08 (м, 1H); 4,14-4,21 (м, 1H); 4,51-4,63 (м, 1H); 5,00 (с, 1H); 6,88 (д, J=8,6 Гц, 2H); 7,13 (д, J=8,6 Гц, 2H)
Масс-спектрометрия: методика A
Время удерживания: Tr=0,93 мин
[M+H]+: m/z 439
Стадия a: (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
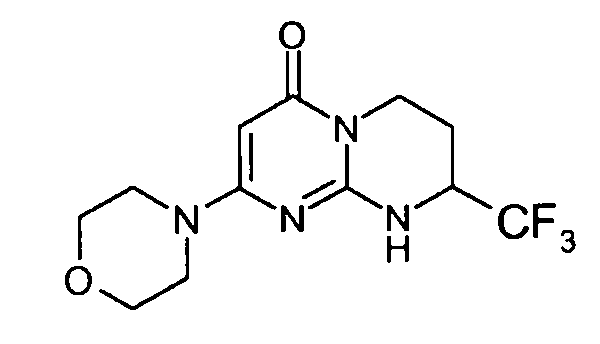
Смесь 220 мг (R,S)-2-хлор-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в 5 мл морфолина нагревают при 80°C. После нагревания в течение полутора часов реакцию прекращают после контроля способом ЖХ/МС. После охлаждения реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) с получением 270 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Масс-спектрометрия: методика B
Время удерживания: Tr=2,53 мин
[M+H]+: m/z 305; [M-H]-: m/z 303
Пример 3: (S)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
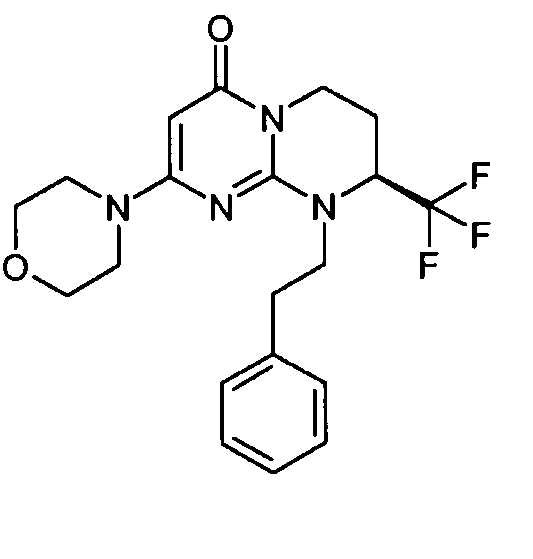
Стадия а:
(R,S)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он получают по методике, описанной в примере 2, исходя из 80 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 240 мг (2-бромэтил)бензола. После очистки методом хроматографии на диоксиде кремния (элюент: градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 75 мг (R,S)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
1,85-2,01 (м, 1H); 2,27-2,35 (м, 1H); 2,86 (м, 1H); 2,95-3,05 (м, 1H); 3,11-3,21 (м, 1H); 3,39-3,49 (м, 5H); 3,63-3,68 (м, 4H); 4,08-4,23 (м, 2H); 4,53-4,62 (м, 1H); 5,00 (с, 1H); 7,18-7,25 (м, 3H); 7,29-7,34 (м, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,95 мин
[M+H]+: m/z 409
Стадия b:
Разделение двух энантиомеров (R,S)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она осуществляют методом хроматографии на хиральной фазе: колонка Chiralpak IC, 20 мкм; элюент: 75% гептана, 20% EtOH, 5% MeOH.
Правовращающий энантиомер концентрируют с получением 27 мг (S)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
1,94 (м, 1H); 2,23-2,35 (м, 1H); 2,83-2,91 (м, 1H); 2,96-3,04 (м, 1H); 3,16 (м, 1H); 3,40-3,52 (м, 5H); 3,65 (м, 4H); 4,07-4,21 (м, 2H); 4,50-4,62 (м, 1H); 5,00 (с, 1H); 7,18-7,25 (м, 3H); 7,29-7,35 15 (м, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,95 мин
[M+H]+: m/z 409
Оптическое вращение: PR=положительное (+40); C=1,093 мг/0,5 мл ДМСО
После очистки методом хроматографии получают также 30 мг левовращающего энантиомера (R)-2-морфолин-4-ил-9-фенетил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она.
Пример 4: (S)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
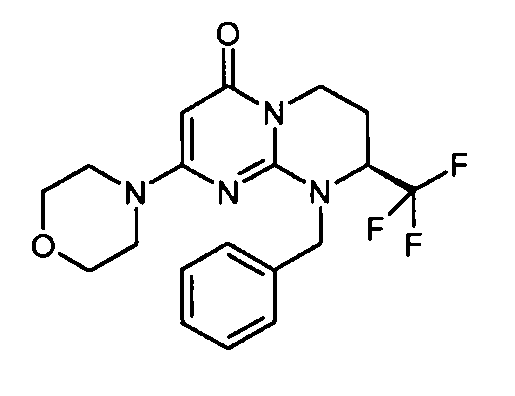
Стадия b:
Разделение двух энантиомеров (R,S)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она осуществляют методом хроматографии на хиральной фазе: колонка 6×35 см; подвижная фаза: 60% EtOH, 40% гептана.
Правовращающий энантиомер концентрируют с получением 36 мг (S)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,10-2,25 (м, 1H); 2,35-2,43 (м, 1H); 3,19-3,27 (м, 5H); 3,39-3,53 (м, 4H); 4,16-4,27 (м, 1H); 4,51 (д, J=15,9 Гц, 1H); 4,57-4,72 (м, 1H); 4,96 (с, 1H); 5,23 (д, J=15,9 Гц, 1H); 7,20-7,27 (м, 3H); 7,28-7,34 (м, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,88 мин
[M+H]+: m/z 395
Оптическое вращение: PR=+16,3+/-0,7. C=1,960 мг/0,5 мл ДМСО
После очистки методом хроматографии, описанным выше, получают также 38 мг левовращающего энантиомера (R)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она.
Стадия a: (R,S)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
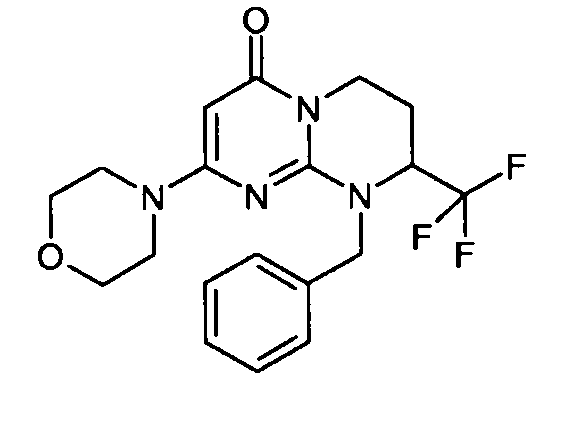
Соединение получают по методике, описанной в примере 2, исходя из 140 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 0,270 мл бензилбромида. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 32 мг (R,S)-9-бензил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,11-2,25 (м, 1H); 2,35-2,44 (м, 1H); 3,17-3,27 (м, 5H); 3,40-3,53 (м, 4H); 4,18-4,29 (м, 1H); 4,51 (д, J=15,9 Гц, 1H); 4,58-4,72 (м, 1H); 4,96 (с, 1H); 5,22 (д, J=15,9 Гц, 1H); 7,20-7,27 (м, 3H); 7,28-7,36 (м, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,88 мин
[M+H]+: m/z 395
Пример 5: 9-((S)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
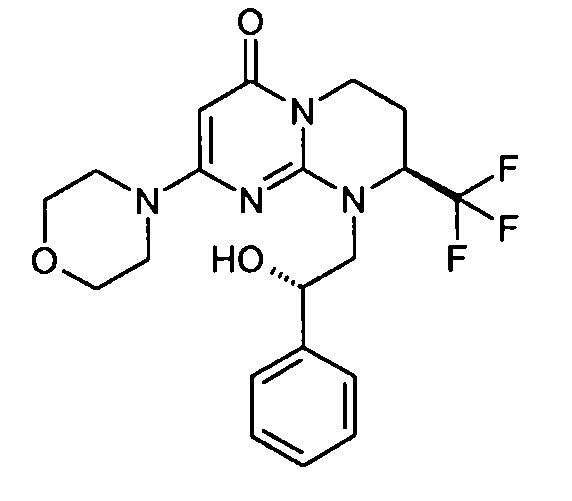
Соединение получают по методике, описанной в примере 2, исходя из 135 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 342 мг (S)-2-хлор-1-фенилэтанола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 26 мг 9-((S)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-(R)трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 18 мг (S)-9-((S)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,24 (м, 1H); 2,36-2,46 (м, 1H); 3,08 (дд, J=10,0 и 14,2 Гц, 1H); 3,17-3,27 (м, 1H); 3,40-3,48 (м, 4H); 3,63-3,69 (м, 4H); 4,17-4,32 (м, 2H); 4,74-4,85 (м, 1H); 4,99 (м, 1H); 5,02 (с, 1H); 5,67 (д, J=5,1 Гц, 1H); 7,22-7,44 (м, 5H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,85 мин
[M+H]+: m/z 425; [M-H+HCO2H]-: m/z 469
Оптическое вращение: PR=+7,4+/-0,6; C=1,959 мг/0,5 мл CH3OH
Пример 6: 9-((R)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
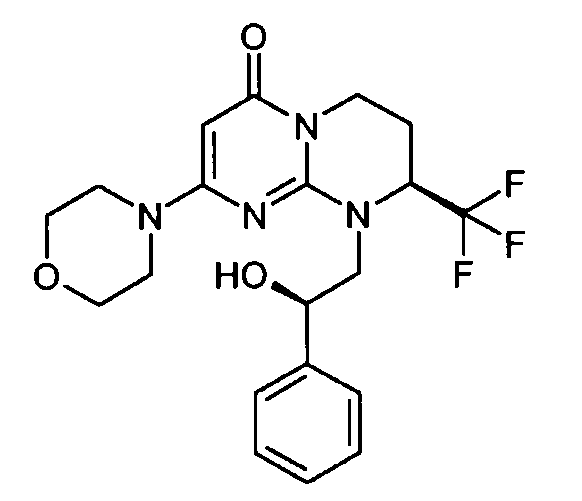
Соединение получают по методике, описанной в примере 2, исходя из 135 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 342 мг (R)-2-хлор-1-фенилэтанола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 25 мг 9-((R)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-(S)-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
1,40-1,56 (м, 1H); 2,05-2,17 (м, 1H); 3,05-3,20 (м, 2H); 3,36-3,47 (м, 4H); 3,62-3,67 (м, 4H); 3,84-3,94 (м, 1H); 3,96-4,03 (м, 1H); 4,54 (дд, J=6,0 и 13,8 Гц, 1H); 4,96 (с, 1H); 4,99-5,04 (м, 1H); 5,56 (уш.с, 1H); 7,18-7,37 (м, 5H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,73 мин
[M+H]+: m/z 425; [M-H+HCO2H]-: m/z 469
Оптическое вращение: PR=+63,3+/-1,4 в MeOH
После очистки, описанной выше, получают также 20 мг 9-((R)-2-гидрокси-2-фенилэтил)-2-морфолин-4-ил-8-(R)трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она.
Пример 7: (8S)-9-[(2S)-2-гидрокси-2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
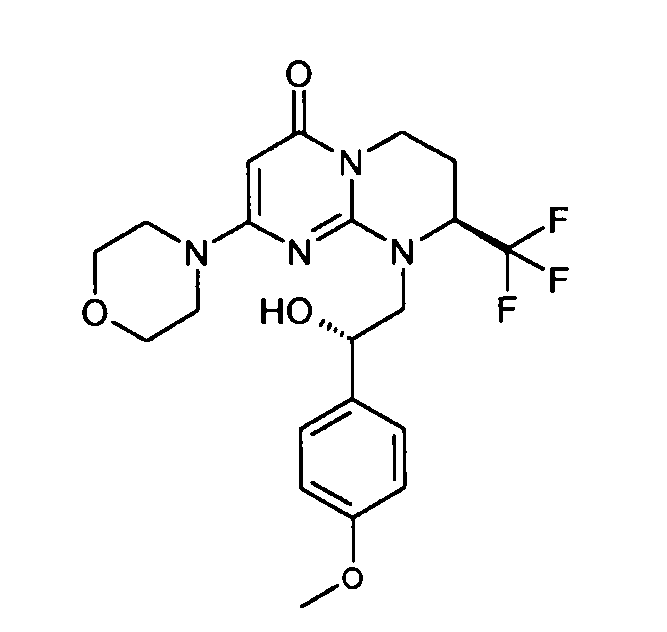
Соединение получают по методике, описанной в примере 2, исходя из 135 мг (R,S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она и 760 мг (S)-2-хлор-1-(4-метоксифенил)этанола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 66 мг (8S)-9-[(2S)-2-гидрокси-2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,14-2,29 (м, 1H); 2,35-2,44 (м, 1H); 3,06 (дд, J=9,8 и 13,9 Гц, 1H); 3,14-3,27 (м, 1H); 3,37-3,50 (м, 4H); 3,62-3,69 (м, 4H); 3,74 (с, 3H); 4,14-4,28 (м, 2H); 4,79 (м, 1H); 4,90-4,98 (м, 1H); 5,01 (с, 1H); 5,57 (д, J=4,9 Гц, 1H); 6,93 (д, J=8,6 Гц, 2H); 7,25 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,84 мин
[M+H]+: m/z 499
Оптическое вращение: PR=+4; C=1,397 мг/0,5 мл CH3OH
Получают также 36 мг (8R)-9-[(2S)-2-гидрокси-2-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она.
Пример 8: (8S)-2-(морфолин-4-ил)-9-[(1R или 1S)-1-фенилэтил]-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
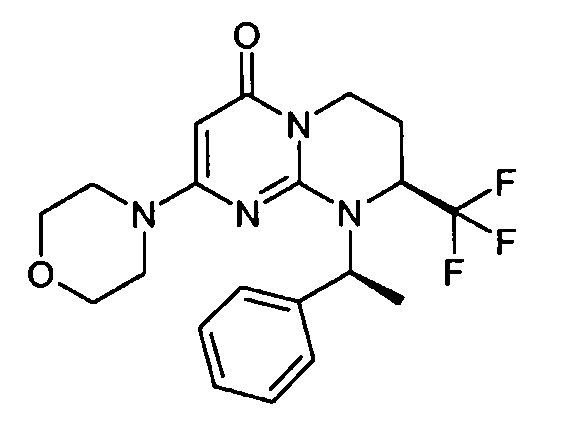
Соединение получают по методике, описанной в примере 1f, исходя из 135 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1d) в 5 мл ацетонитрила и 520 мг (1-бромэтил)бензола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 23 мг (8S)-2-(морфолин-4-ил)-9-[1-фенилэтил]-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде единственного диастереоизомера неопределенной конфигурации в цепи фенетила со следующими характеристиками:
Спектр 1H ЯМР:
1,65 (д, J=7,0 Гц, 3H); 1,72-1,84 (м, 1H); 2,29-2,38 (м, 1H); 3,15-3,26 (м, 5H); 3,43-3,55 (м, 4H); 4,08 (м, 1H); 4,31-4,44 (м, 1H); 4,96 (с, 1H); 5,67 (кв, J=7,0 Гц, 1H); 7,23-7,40 (м, 5H).
Масс-спектрометрия: методика A
Время удерживания: Tr=4,07 мин
[M+H]+: m/z 409
Оптическое вращение: PR=+54,5+/-0,6; C=1,594 мг/0,5 мл CH3OH
Пример 9: (8S)-9-[(1R и 1S)-1-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
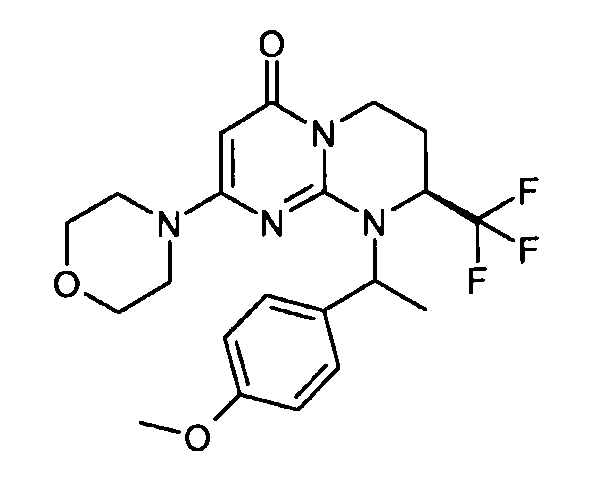
В колбу вносят 130 мг (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1d) в 3 мл тетрагидрофурана, 250 мг трифенилфосфина, нанесенного на смолу (3 ммоль/г), и 116 мг 1-(4-метоксифенил)этанола. Затем по каплям добавляют 0,12 мл диэтилазодикарбоксилата. По окончании добавления реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Затем к реакционной смеси добавляют 250 мг трифенилфосфина, нанесенного на смолу (3 ммоль/г). После дополнительного перемешивания в течение 18 часов при комнатной температуре полученную смесь фильтруют через фильтр Millex и затем полученный фильтрат концентрируют при пониженном давлении.
Остаток растворяют в 5 мл морфолина и полученную смесь нагревают при 80°C в течение 2 часов. Затем реакционную смесь концентрируют при пониженном давлении. После очистки методом хроматографии на диоксиде кремния (градиент от 0 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 40 мг (8S)-9-[1-(4-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде смеси двух диастереоизомеров с соотношением 60/40 со следующими характеристиками:
Спектр 1H ЯМР:
1,61 (д, J=7,1 Гц, 1,8H); 1,68 (д, J=7,1 Гц, 1,2H); 2,09-2,47 (м, 2H); 3,10-3,65 (м, частично маскированный, 9H); 3,72 (с, 1,2H); 3,74 (с, 1,8H); 3,85-4,34 (м, 1,6H); 4,68-4,87 (м, 0,4H); 4,93 (с, 0,4H); 4,98 (с, 0,6H); 5,47 (кв, J=7,1 Гц, 0,4H); 5,79 (кв, J=7,1 Гц, 0,6H); 6,86 (д, J=8,6 Гц, 0,8H); 6,92 (д, J=8,6 Гц, 1,2H); 7,26 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,94 и 0,89 мин (смесь двух диастереоизомеров с соотношением 60/40)
[M+H]+: m/z 439
Пример 10: (8S)-9-[(1R или 1S)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
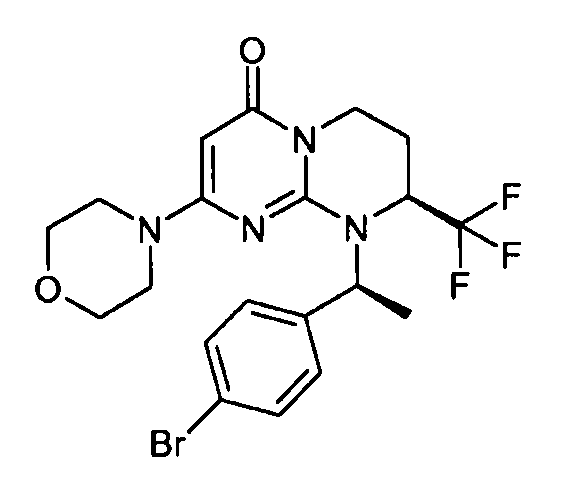
Соединение получают по методике, описанной в примере 9, исходя из 300 мг (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в 6 мл тетрагидрофурана, 600 мг трифенилфосфина, нанесенного на смолу (3 ммоль/г), и 354 мг 1-(4-бромфенил)этанола. Затем по каплям добавляют 0,28 мл диэтилазодикарбоксилата. По окончании добавления реакционную смесь перемешивают в течение 18 часов при комнатной температуре. Затем к реакционной смеси добавляют 600 мг трифенилфосфина, нанесенного на смолу (3 ммоль/г). После дополнительного перемешивания в течение 18 часов при комнатной температуре полученную смесь фильтруют через фильтр Millex и затем полученный фильтрат концентрируют при пониженном давлении.
Остаток после упаривания растворяют в 5 мл морфолина и полученную смесь перемешивают при комнатной температуре в течение 4 дней. Затем реакционную смесь концентрируют при пониженном давлении. После очистки методом хроматографии на диоксиде кремния (градиент от 0 до 20% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 15 мг одного из диастереоизомеров (8S)-9-[1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она (неопределенной конфигурации в цепи фенетила) со следующими характеристиками:
Спектр 1H ЯМР:
1,73 (д, J=7,1 Гц, 3H); 2,16-2,31 (м, 1H); 2,39-2,47 (м, 1H); 3,12-3,25 (м, 5H); 3,35-3,51 (м, 4H); 4,15 (м, 1H); 4,82-4,90 (м, 1H); 4,92 (с, 1H); 5,33 (кв, J=7,1 Гц, 1H); 7,27 (д, J=8,6 Гц, 2H); 7,49 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,26 мин
[M+H]+: m/z 487
Пример 11: (8S)-9-[(1S или 1R)-1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
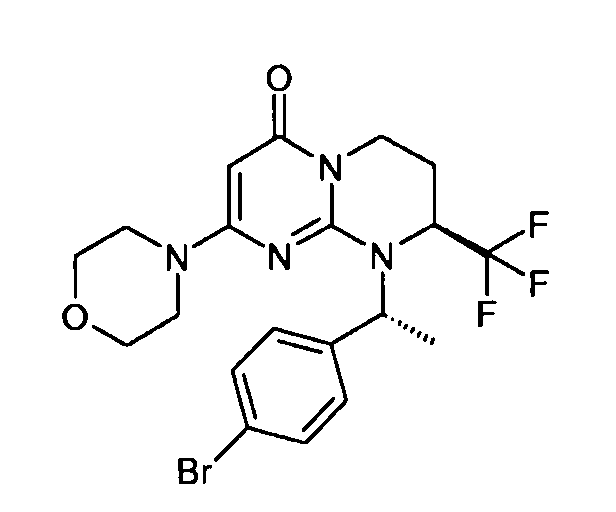
После осуществленной ранее очистки получают также 60 мг второго диастереоизомера (8S)-9-[1-(4-бромфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она (неопределенной конфигурации в цепи фенетила) со следующими характеристиками:
Спектр 1H ЯМР:
1,64 (д, J=7,1 Гц, 3H); 1,78-1,94 (м, 1H); 2,30-2,40 (м, 1H); 3,08-3,26 (м, 5H); 3,39-3,52 (м, 4H); 4,11 (м, 1H); 4,52 (м, 1H); 4,95 (с, 1H); 5,50 (кв, J=7,1 Гц, 1H); 7,25 (д, J=8,6 Гц, 2H); 7,53 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,37 мин
[M+H]+: m/z 487
Пример 12: (8S)-2-(морфолин-4-ил)-9-фенил-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
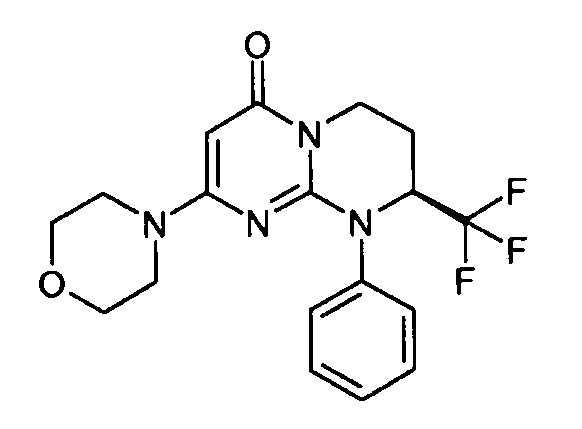
В пробирку для микроволнового нагревания вносят 425 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) в 1 мл диметилформамида, 422 мг трикалийфосфата, 380 мг йодида меди и 2 мл йодбензола. Полученную смесь нагревают в микроволновой печи в течение 30 минут при 150°C. Затем реакционную смесь центрифугируют. Далее отделенный супернатант промывают этилацетатом и затем упаривают досуха. Остаток обрабатывают этилацетатом и полученный раствор промывают водой. Органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют в вакууме. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 15% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 150 мг (8S)-2-(морфолин-4-ил)-9-фенил-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,40-2,48 (м, 2H); 3,00-3,13 (м, 4H); 3,31-3,37 (м, 1H); 3,38-3,48 (м, 4H); 4,33-4,40 (м, 1H); 4,93 (м, 1H); 4,99 (с, 1H); 7,28-7,37 (м, 3H); 7,43 (т, J=7,7 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,83 мин
[M+H]+: m/z 381
Пример 13: (8S)-9-(4-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
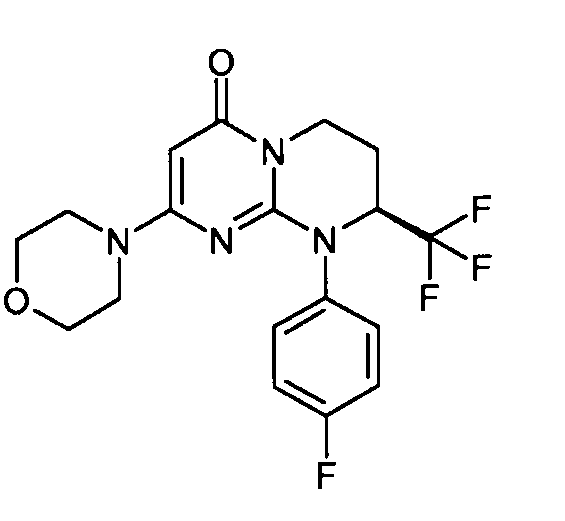
Соединение получают по методике, описанной в примере 12, исходя из 140 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 0,66 мл 1-фтор-4-йодбензола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 15% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 125 мг (8S)-9-(4-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,41-2,48 (м, 2H); 3,01-3,15 (м, 4H); 3,33-3,37 (м, 1H); 3,40-3,50 (м, 4H); 4,35 (м, 1H); 4,82-4,94 (м, 1H); 5,00 (с, 1H); 7,25 (т, J=8,8 Гц, 2H); 7,40 (дд, J=5,6 и 8,8 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,86 мин
[M+H]+: m/z 399
Пример 14: (8S)-9-(3-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
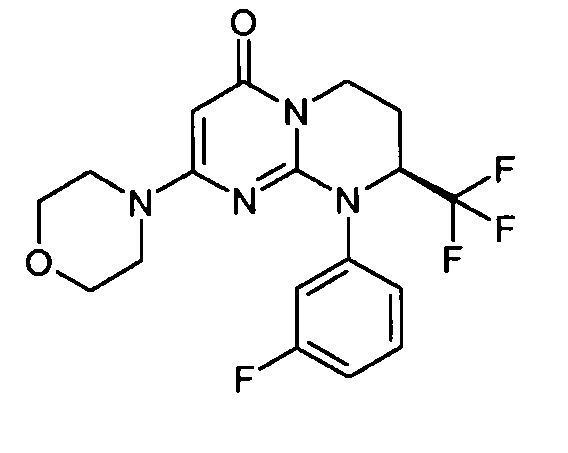
Соединение получают по методике, описанной в примере 12, исходя из 140 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 0,66 мл 1-фтор-3-йодбензола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 15% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 60 мг (8S)-9-(3-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,41-2,48 (м, 2H); 3,03-3,15 (м, 4H); 3,25-3,27 (м, 1H); 3,42-3,49 (м, 4H); 4,32-4,41 (м, 1H); 4,93-5,00 (м, 1H); 5,02 (с, 1H); 7,14-7,24 (м, 2H); 7,30 (тд, J=2,2 и 10,5 Гц, 1H); 7,46 (дт, J=6,7 и 8,1 Гц, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,86 мин
[M+H]+: m/z 399
Пример 15: (8S)-9-(2-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
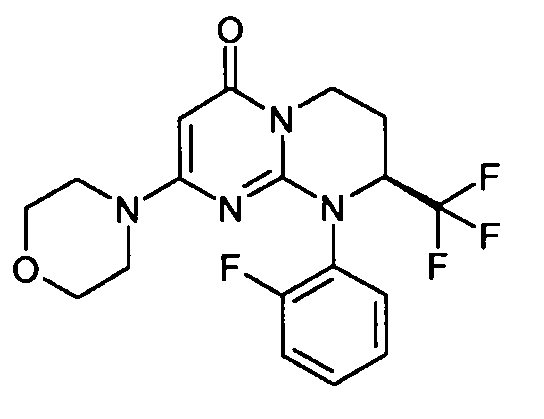
Соединение получают по методике, описанной в примере 12, исходя из 140 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 0,66 мл 1-фтор-2-йодбензола. После очистки методом хроматографии на диоксиде кремния (градиент от 5 до 15% элюента CH2Cl2/MeOH/NH4OH, 28%, 38/17/2, в дихлорметане) получают 12 мг (8S)-9-(2-фторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР:
2,37-2,47 (м, 2H); 3,05-3,09 (м, 5H); 3,41-3,47 (м, 4H); 4,35-4,44 (м, 1H); 4,89 (м, 1H); 5,02 (с, 1H); 7,24-7,33 (м, 2H); 7,36-7,45 (м, 1H); 7,51 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,83 мин
[M+H]+: m/z 399
Пример 16: (8S)-9-[(1R или 1S)-1-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
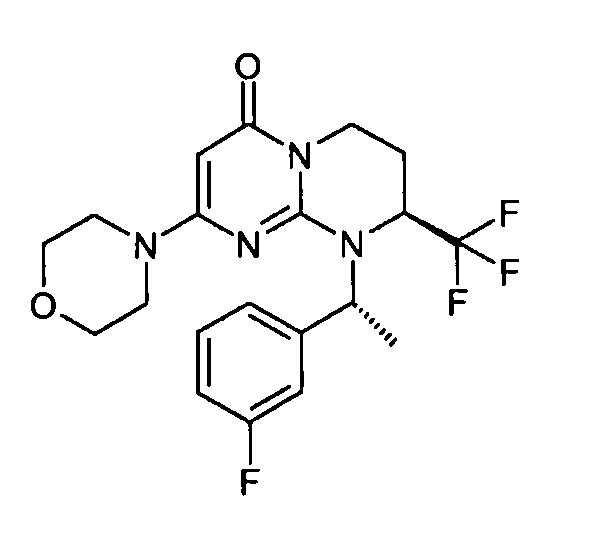
Стадия b:
В колбе при 80°C в течение 30 минут нагревают смесь 300 мг (S)-2-хлор-1-[1-(3-фторфенил)этил]-8-трифторметил-1,6,7,8-тетрагидропиримидо[1,2-a]пиримидин-4-она и 3 мл морфолина. После охлаждения реакционную смесь концентрируют при пониженном давлении. Остаток обрабатывают этилацетатом и водой. Органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. После очистки методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 97,5/2,5) получают 152 мг (8S)-9-[(1-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде единственного диастереоизомера (неопределенной конфигурации на уровне цепи фенетила) со следующими характеристиками:
Спектр 1H ЯМР:
1,66 (д, J=7,0 Гц, 3H); 1,80-1,95 (м, 1H); 2,33-2,41 (м, 1H); 3,09-3,28 (м, 5H); 3,40-3,52 (м, 4H); 4,06-4,16 (м, 1H); 4,56 (м, 1H); 4,95 (с, 1H); 5,51 (кв, J=7,0 Гц, 1H); 7,00-7,17 (м, 3H); 7,33-7,42 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,94 мин
[M+H]+: m/z 427
Стадия a:
В колбу вносят 400 мг (S)-2-хлор-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1d) в 20 мл тетрагидрофурана, 1,6 г трифенилфосфина, нанесенного на смолу (3 ммоль/г), и 663 мг 1-(3-фторфенил)этанола. Затем реакционную смесь перемешивают при комнатной температуре в течение 5 минут и добавляют 0,790 мл диэтилазодикарбоксилата. После перемешивания в течение 1 часа при комнатной температуре реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении.
Остаток обрабатывают этилацетатом и водой. Органическую фракцию отделяют и затем сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. После очистки методом хроматографии на диоксиде кремния (элюент CH2Cl2/AcOEt, 96/04) получают 150 мг (S)-2-хлор-1-[1-(3-фторфенил)этил]-8-трифторметил-1,6,7,8-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде единственного диастереоизомера (неопределенной конфигурации на уровне цепи фенетила) со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=1,11 мин
[M+H]+: m/z 376; [M-H]-: m/z 253 (пик молекулярного иона)
Пример 17: (8S)-9-(4-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
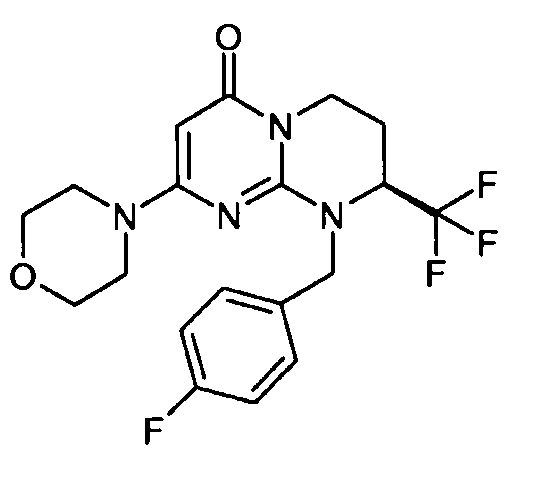
К раствору 300 мг 2(S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) в 3 мл ацетонитрила в атмосфере аргона добавляют 0,536 г карбоната цезия и 0,44 мл 1-(бромметил)-4-фторбензола. Затем полученную смесь нагревают при 80°C в течение двух часов. Далее реакционную смесь упаривают при пониженном давлении и полученный остаток очищают методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 98/02) с получением 61 мг (8S)-9-(4-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,09-2,25 (м, 1H); 2,34-2,44 (м, 1H); 3,18-3,32 (м, 5H); 3,41-3,53 (м, 4H); 4,21 (м, 1H); 4,51 (д, J=15,2 Гц, 1H); 4,60-4,72 (м, 1H); 4,96 (с, 1H); 5,17 (д, J=15,2 Гц, 1H); 7,13 (т, J=8,7 Гц, 2H); 7,30 (дд, J=5,4 и 8,7 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,89 мин
[M+H]+: m/z 413
Пример 18: (S)-9-бензоил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
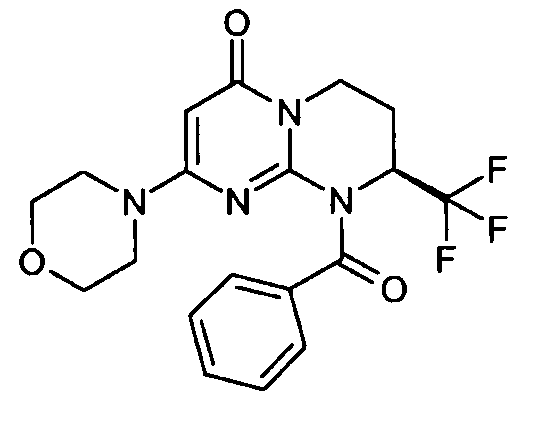
К раствору 300 мг 2(S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) в 3 мл тетрагидрофурана в атмосфере аргона добавляют 35,7 мг гидрида натрия, а затем после перемешивания в течение 10 минут добавляют 0,135 мл бензоилхлорида. После перемешивания в течение шести часов при комнатной температуре к реакционной смеси добавляют насыщенный раствор бикарбоната натрия и этилацетат. Органическую фракцию отделяют и затем промывают насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают методом хроматографии на диоксиде кремния (элюент: CH2Cl2) с получением 74 мг (S)-9-бензоил-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,20-2,31 (м, 1H); 2,68-2,82 (м, 3H); 2,86-2,96 (м, 2H); 3,15-3,44 (м частично маскированный, 4H); 3,75-3,87 (м, 1H); 4,17-4,30 (м, 1H); 5,15 (с, 1H); 5,38-5,53 (м, 1H); 7,37-7,43 (м, 2H); 7,45-7,53 (м, 3H).
Масс-спектрометрия: методика B
Время удерживания: Tr=3,59 мин
[M+H]+: m/z 409
Оптическое вращение: PR=-15,8+/-0,8; C=1,650 мг/0,5 мл ДМСО
Пример 19: (S)-2-морфолин-4-ил-9-пиридин-3-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он
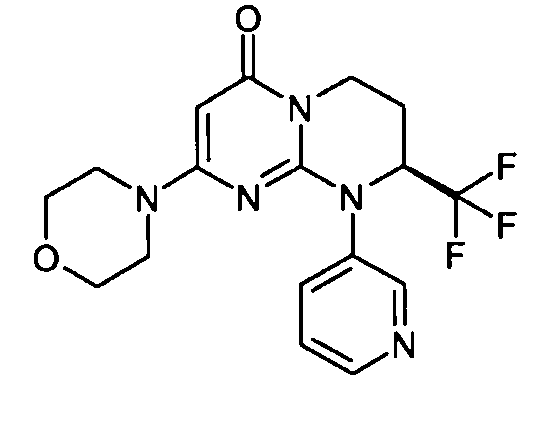
Соединение получают по методике, описанной в примере 12, исходя из 200 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 380 мг 3-йодпиридина. После очистки методом хроматографии на диоксиде кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 96/04) получают 48 мг (S)-2-морфолин-4-ил-9-пиридин-3-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде твердого вещества желтого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,44-2,48 (м, 2H); 3,00-3,13 (м, 4H); 3,31-3,37 (м, 1H); 3,41-3,47 (м, 4H); 4,37 (д, J=16,1 Гц, 1H); 4,97-5,09 (м, 2H); 7,48 (дд, J=4,9 и 8,3 Гц, 1H); 7,80-7,85 (м, 1H); 8,50 (дд, J=1,4 и 4,9 Гц, 1H); 8,57 (д, J=2,2 Гц, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,55 мин
[M+H]+: m/z 382
Оптическое вращение: PR=-40+/-1,6, C=0,2% в ДМСО
Пример 20: (S)-2-морфолин-4-ил-9-пиридин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-он SAR236152
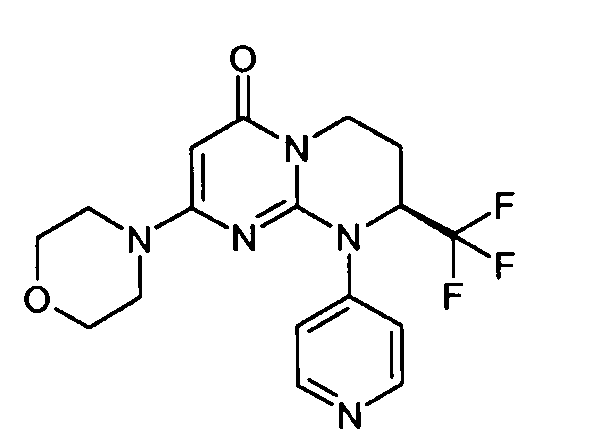
Соединение получают по методике, описанной в примере 12, исходя из 200 мг (S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 380 мг 4-йодпиридина. После очистки методом хроматографии на диоксиде кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 96/04) получают 26 мг (S)-2-морфолин-4-ил-9-пиридин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она в виде твердого вещества желтого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,43-2,48 (м, 2H); 3,07-3,19 (м, 4H); 3,33-3,39 (м, 1H); 3,45-3,50 (м, 4H); 4,30-4,38 (м, 1H); 5,06 (с, 1H); 5,09-5,17 (м, 1H); 7,45 (д, J=6,1 Гц, 2H); 8,62 (д, J=6,1 Гц, 2H).
Масс-спектрометрия: методика A
[M+H]+: m/z 382; [M-H]-: m/z 380
Время удерживания: Tr=0,42 мин
Оптическое вращение: PR=-31+/-1,3, C=0,2% в ДМСО
Пример 21: (8S)-9-(4-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
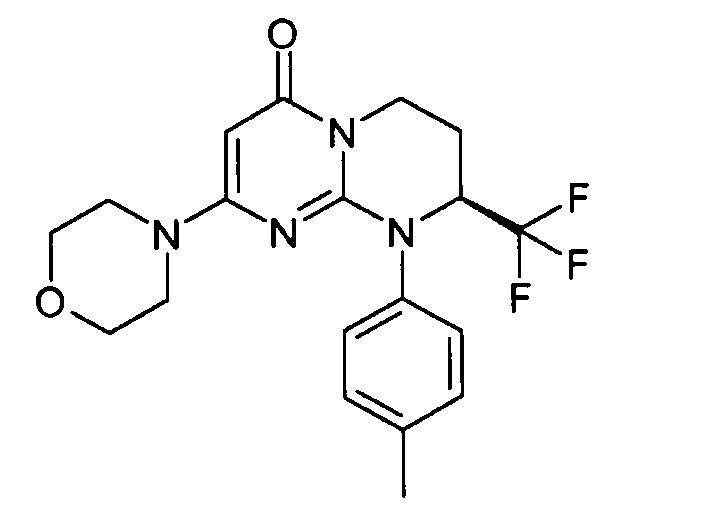
Соединение получают по методике, описанной в примере 12, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) и 100 мг 1-йод-4-метилбензола. После очистки методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 98/02) получают 23 мг (8S)-9-(4-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества кремового цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,32 (с, 3H); 2,44 (м, 2H); 2,97-3,15 (м, 4H); 3,33-3,50 (м частично маскированный, 5H); 4,34 (м, 1H); 4,86 (м, 1H); 4,98 (с, 1H); 7,22 (с, 4H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,90 мин
[M+H]+: m/z 395
Пример 22: (8S)-9-(2-хлорбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
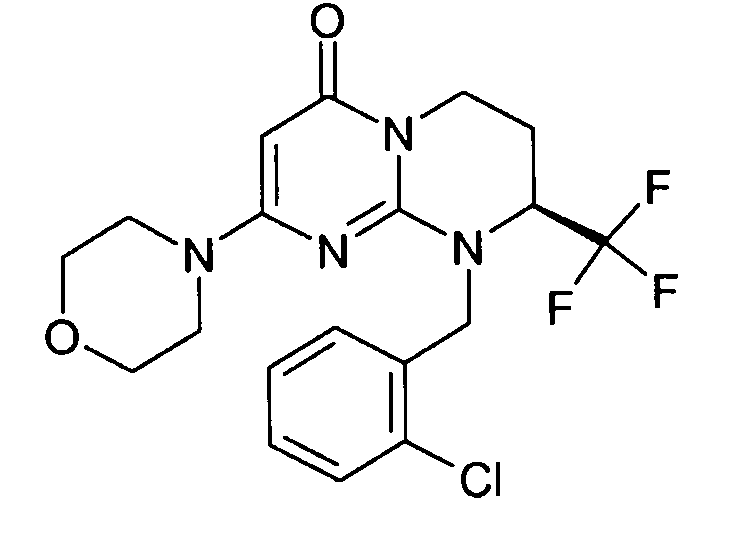
К раствору 100 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она (пример 1e) в 2 мл диметилформамида добавляют 214 мг карбоната цезия и 74 мг 1-(бромметил)-2-хлорбензола. После выдерживания в течение 16 часов при температуре около 20°C реакционную смесь выливают в воду. Органическую фракцию отделяют, а из водной фракции осуществляют экстракцию этилацетатом. Объединенные органические фракции концентрируют досуха при пониженном давлении. Остаток очищают методом препаративной ВЭЖХ/МС (методика C). После выпаривания ацетонитрила и лиофилизации получают 94 мг (8S)-9-(2-хлорбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,29-2,66 (м, 2H); 3,09-3,18 (м, 4H); 3,23-3,50 (м частично маскированный, 5H); 4,27 (м, 1H); 4,68 (д, J=16,6 Гц, 1H); 4,74 (м, 1H); 4,96 (с, 1H); 5,12 (д, J=16,6 Гц, 1H); 7,16-7,22 (м, 1H); 7,24-7,32 (м, 2H); 7,41-7,48 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,96 мин
[M+H]+: m/z 429
Пример 23: (8S)-9-(3-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
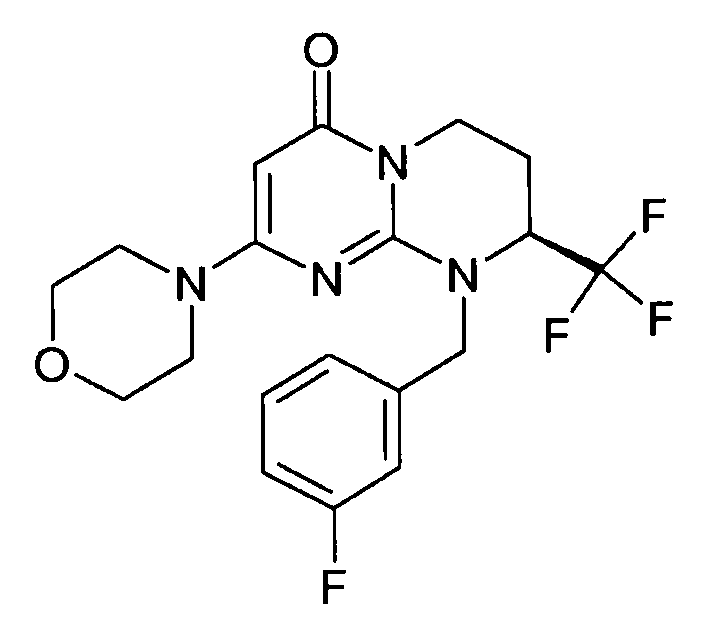
Соединение получают по методике, описанной в примере 22, исходя из 100 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она, 214 мг карбоната цезия и 68 мг 1-(бромметил)-3-фторбензола. После очистки методом препаративной ВЭЖХ/МС (методика C) получают 102 мг (8S)-9-(3-фторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,17-2,45 (м, 2H); 3,15-3,31 (м, 5H); 3,39-3,49 (м, 4H); 4,23 (м, 1H); 4,58 (д, J=16,1 Гц, 1H); 4,66-4,78 (м, 1H); 4,97 (с, 1H); 5,13 (д, J=16,1 Гц, 1H); 6,98-7,15 (м, 3H); 7,35 (дт, J=6,0 и 8,1 Гц, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,89 мин
[M+H]+: m/z 413
Пример 24: (8S)-9-[2-(2-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он

К раствору 100 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она (пример 1e) в 2 мл диметилформамида добавляют 214 мг карбоната цезия и 78 мг 1-(2-бромэтил)-3-метоксибензола. После выдерживания в течение 18 часов при температуре 60°C добавляют 78 мг 1-(2-бромэтил)-3-фторбензола. После выдерживания в течение 2 дней при температуре 60°C полученную реакционную смесь выливают в воду. Органическую фракцию отделяют, а из водной фракции осуществляют экстракцию этилацетатом. Объединенные органические фракции концентрируют досуха при пониженном давлении. Остаток очищают методом препаративной ВЭЖХ/МС (методика C). После выпаривания ацетонитрила и лиофилизации получают 25 мг (8S)-9-[2-(2-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
1,84-2,00 (м, 1H); 2,25-2,35 (м, 1H); 2,83-3,03 (м, 2H); 3,06-3,30 (м, 2H); 3,44 (м, 4H); 3,61-3,67 (м, 4H); 3,76 (с, 3H); 4,08-4,24 (м, 2H); 4,37-4,52 (м, 1H); 4,99 (с, 1H); 6,88 (дт, J=0,9 и 7,6 Гц, 1H); 6,96 (уш.д, J=7,9 Гц, 1H); 7,14 (дд, J=1,5 и 7,6 Гц, 1H); 7,18-7,26 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,98 мин
[M+H]+: m/z 439
Пример 25: (8S)-9-[2-(3-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
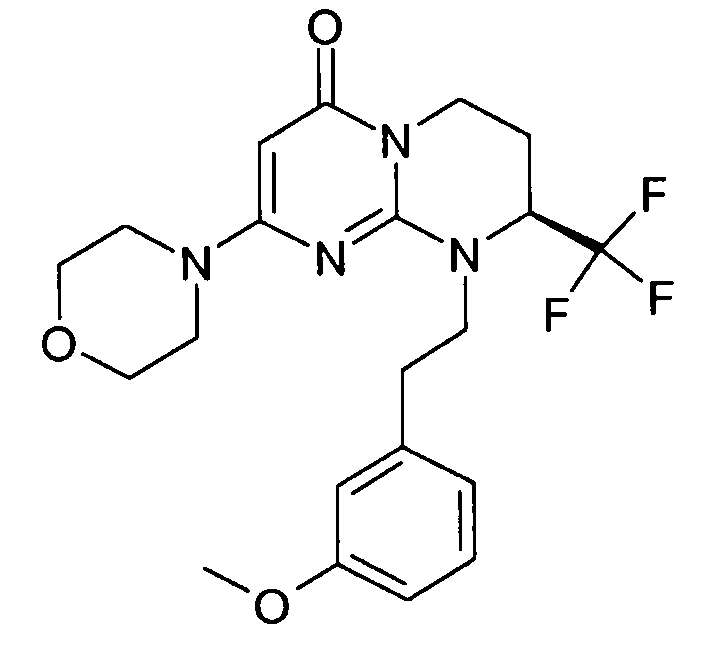
Соединение получают по методике, описанной в примере 24, но исходя из 100 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она, 78 мг 1-(2-бромэтил)-3-метоксибензола и 214 мг карбоната цезия в 2 мл диметилформамида. После осуществления реакции в течение 3 дней при температуре 60°C, обработки соответственно описанию примера 24 и очистки методом препаративной ВЭЖХ/МС (методика C) получают 20 мг (8S)-9-[2-(3-метоксифенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
1,88-2,01 (м, 1H); 2,32 (м, 1H); 2,74-2,90 (м, 1H); 2,96 (м, 1H); 3,10-3,22 (м, 1H); 3,26-3,39 (м, частично маскированный, 1H); 3,43-3,48 (м, 4H); 3,62-3,68 (м, 4H); 3,73 (с, 3H); 4,02-4,23 (м, 2H); 4,49-4,65 (м, 1H); 5,00 (с, 1H); 6,70-6,88 (м, 3H); 7,14-7,26 (м, 1H)
Масс-спектрометрия: методика A
Время удерживания: Tr=0,94 мин
[M+H]+: m/z 439
Пример 26: (8S)-9-(3-метоксибензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
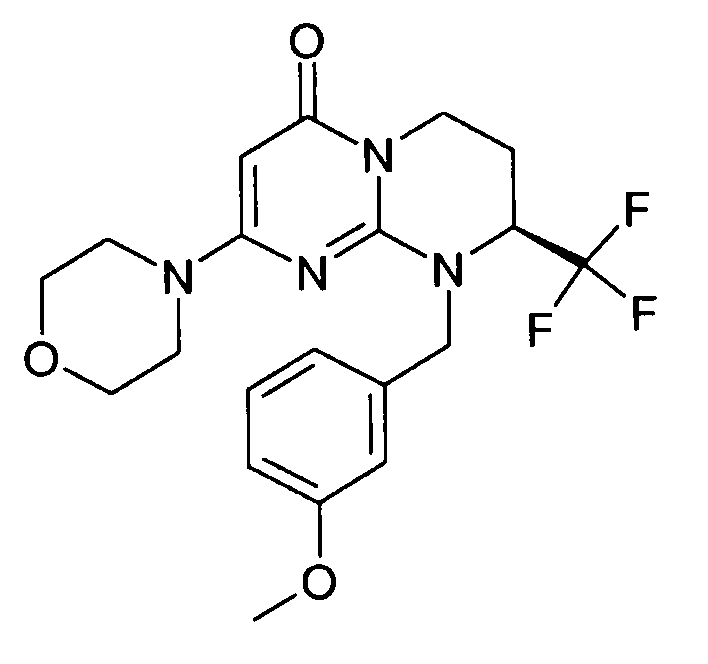
Соединение получают по методике, описанной в примере 22, но исходя из 100 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она, 57 мг 1-(хлорметил)-3-метоксибензола и 214 мг карбоната цезия в 2 мл диметилформамида. После обработки остаток перемешивают в ацетонитриле. Твердое вещество отделяют от жидкости, промывают диэтилоксидом и затем сушат в вакуумируемом эксикаторе. Таким образом, получают 111 мг (8S)-9-(3-метоксибензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,07-2,23 (м, 1H); 2,35-2,44 (м, 1H); 3,19-3,28 (м, 5H); 3,40-3,55 (м, 4H); 3,72 (с, 3H); 4,22 (м, 1H); 4,45 (д, J=15,9 Гц, 1H); 4,56-4,70 (м, 1H); 4,96 (с, 1H); 5,21 (д, J=15,9 Гц, 1H); 6,75-6,88 (м, 3H); 7,19-7,27 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,88 мин
[M+H]+: m/z 425
Пример 27: (8S)-9-(4-метоксифенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
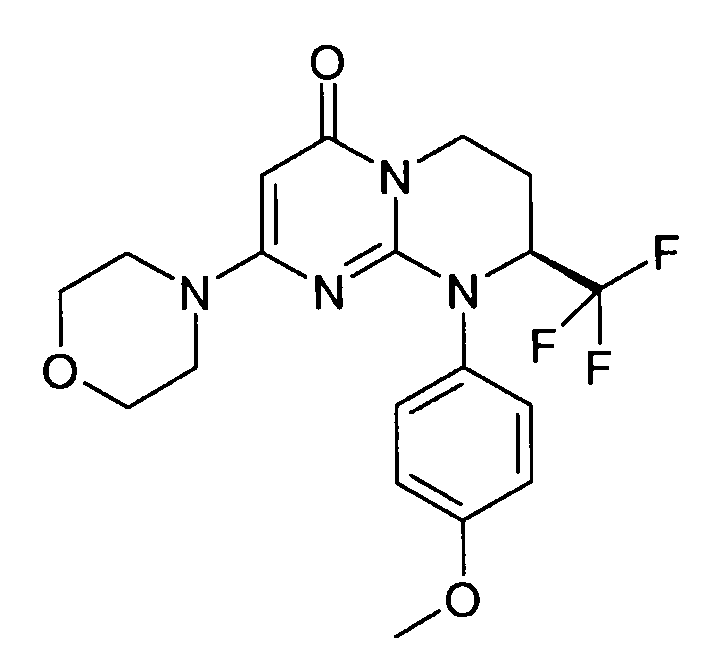
Соединение получают по методике, описанной в примере 12, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 108 мг 1-йод-4-метоксибензола и 79 мг 4,7-диметокси-1,10-фенантролина. После очистки методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 98/02) получают 31 мг (8S)-9-(4-метоксифенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде пористой массы кремового цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,38-2,46 (м, 2H); 3,04-3,15 (м, 4H); 3,20-3,35 (м частично маскированный, 1H); 3,45 (м, 4H); 3,77 (с, 3H); 4,34 (м, 1H); 4,83 (м, 1H); 4,98 (с, 1H); 6,95 (д, J=8,8 Гц, 2H); 7,25 (д, J=8,8 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,83 мин
[M+H]+: m/z 411
Пример 28: (8S)-9-[(2-фторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
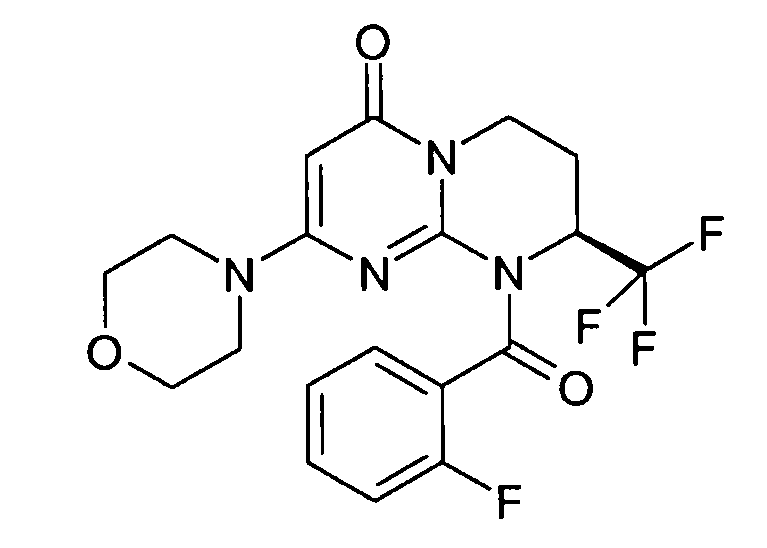
Соединение получают по методике, описанной в примере 18, исходя из 300 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 47 мг гидрида натрия и 156 мг 2-фторбензоилхлорида в 5 мл тетрагидрофурана. После очистки методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 98/02) получают 35 мг (8S)-9-[(2-фторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде пористой массы белого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,13-2,26 (м, 1H); 2,65-2,85 (м, 3H); 2,94-3,02 (м, 2H); 3,20-3,40 (м частично маскированный, 4H); 3,43-3,55 (м, 1H); 4,42 (м, 1H); 5,19 (с, 1H); 5,55-5,69 (м, 1H); 7,18-7,31 (м, 2H); 7,49-7,64 (м, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,79 мин
[M+H]+: m/z 427
Пример 29: (8S)-9-(3,5-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
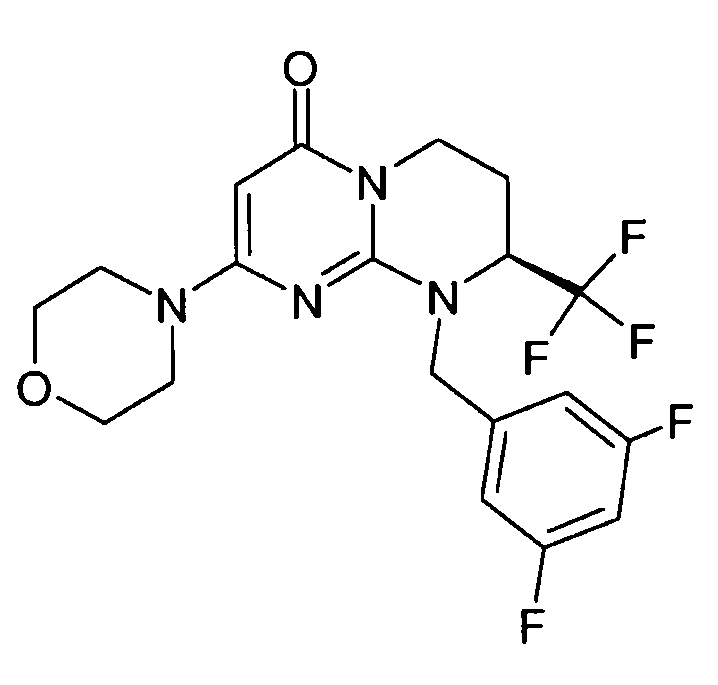
Соединение получают по методике, описанной в примере 22, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 214 мг карбоната цезия и 75 мг 1-(бромметил)-3,5-дифторбензола в 2 мл диметилформамида. После очистки методом препаративной ВЭЖХ/МС (методика C) получают 85 мг (8S)-9-(3,5-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,21-2,44 (м, 2H); 3,14-3,33 (м, 5H); 3,36-3,52 (м, 4H); 4,23 (м, 1H); 4,61 (д, J=16,4 Гц, 1H); 4,68-4,81 (м, 1H); 4,98 (с, 1H); 5,07 (д, J=16,4 Гц, 1H); 6,90-7,02 (м, 2H); 7,07 (тт, J=2,3 и 9,3 Гц, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=3,93 мин
[M+H]+: m/z 431
Пример 30: (8S)-9-(2,4-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
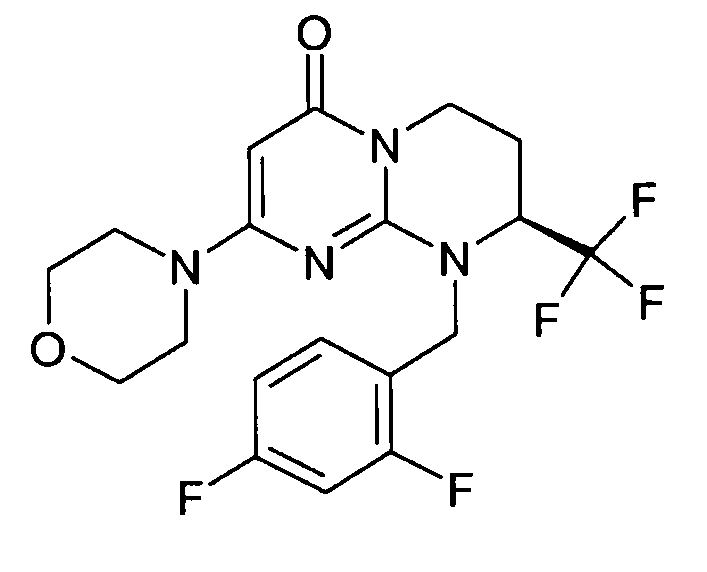
Соединение получают по методике, описанной в примере 22, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 214 мг карбоната цезия и 75 мг 1-(бромметил)-2,4-дифторбензола в 2 мл диметилформамида. После очистки методом препаративной ВЭЖХ/МС (методика C) получают 86 мг (8S)-9-(2,4-дифторбензил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,16-2,30 (м, 1H); 2,35-2,45 (м, 1H); 3,17-3,32 (м, 5H); 3,41-3,49 (м, 4H); 4,22 (дд, J=5,9 и 14,2 Гц, 1H); 4,60 (д, J=16,1 Гц, 1H); 4,66-4,76 (м, 1H); 4,97 (с, 1H); 5,11 (д, J=16,1 Гц, 1H); 7,03 (ддт, J=1,1-2,6 и 9,0 Гц, 1H); 7,22 (ддд, J=2,6-9,0 и 10,9 Гц, 1H); 7,30 (дт, J=6,7 и 9,0 Гц, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=3,96 мин
[M+H]+: m/z 431
Пример 31: (8S)-2-(морфолин-4-ил)-9-(2,3,4-трифторбензил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
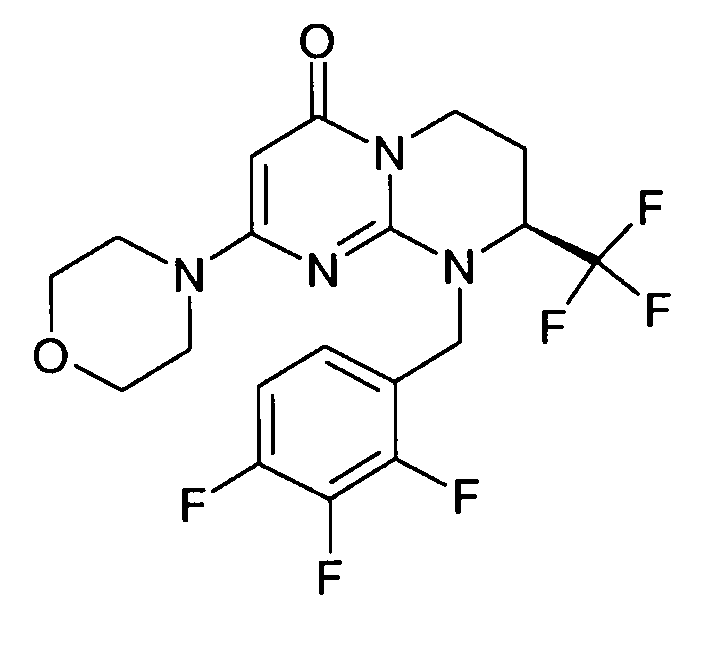
Соединение получают по методике, описанной в примере 22, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 214 мг карбоната цезия и 82 мг 1-(бромметил)-2,3,4-трифторбензола в 2 мл диметилформамида. После очистки методом препаративной ВЭЖХ/МС (методика C) получают 76 мг (8S)-2-(морфолин-4-ил)-9-(2,3,4-трифторбензил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,15-2,31 (м, 1H); 2,35-2,44 (м, 1H); 3,18-3,32 (м, 5H); 3,42-3,54 (м, 4H); 4,22 (дд, J=5,5 и 14,3 Гц, 1H); 4,65 (д, J=16,1 Гц, 1H); 4,73 (м, 1H); 4,98 (с, 1H); 5,16 (д, J=16,1 Гц, 1H); 7,05-7,17 (м, 1H); 7,20-7,32 (м, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,08 мин
[M+H]+: m/z 449
Пример 32: (8S)-9-[(5-хлор-1-бензотиофен-3-ил)метил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
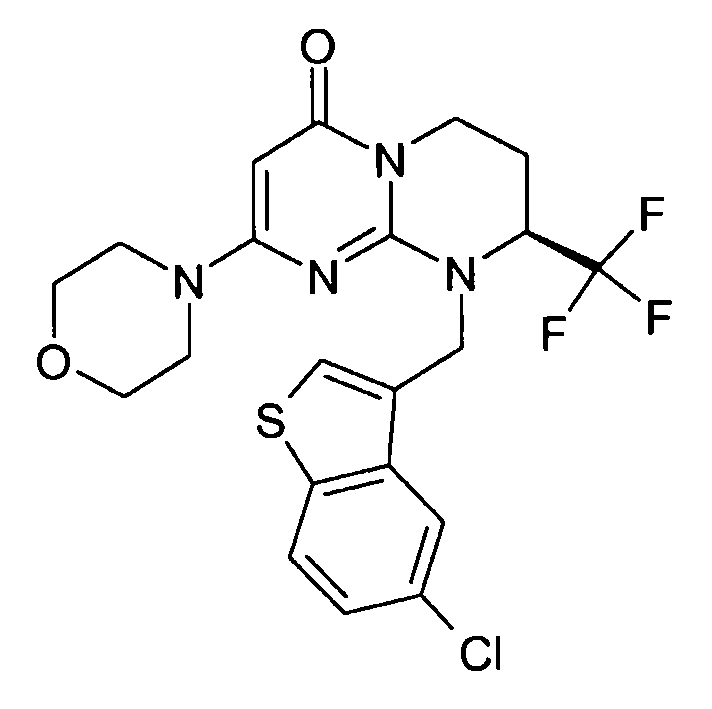
Соединение получают по методике, описанной в примере 22, исходя из 100 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 214 мг карбоната цезия и 95 мг 3-(бромметил)-5-хлор-1-бензотиофена в 2 мл диметилформамида. После очистки методом препаративной ВЭЖХ/МС (методика C) получают 72 мг (8S)-9-[(5-хлор-1-бензотиофен-3-ил)метил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде подобного маслу вещества со следующими характеристиками:
Спектр 1H ЯМР:
2,13-2,25 (м, 1H); 2,34-2,43 (м, 1H); 3,16-3,32 (м, 5H); 3,35-3,48 (м, 4H); 4,21 (дд, J=6,0 и 14,3 Гц, 1H); 4,62-4,74 (м, 2H); 5,00 (с, 1H); 5,52 (д, J=16,1 Гц, 1H); 7,42 (дд, J=2,0 и 8,6 Гц, 1H); 7,67 (с, 1H); 8,01 (д, J=2,0 Гц, 1H); 8,03 (д, J=8,6 Гц, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,42 мин
[M+H]+: m/z 485
Пример 33: (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
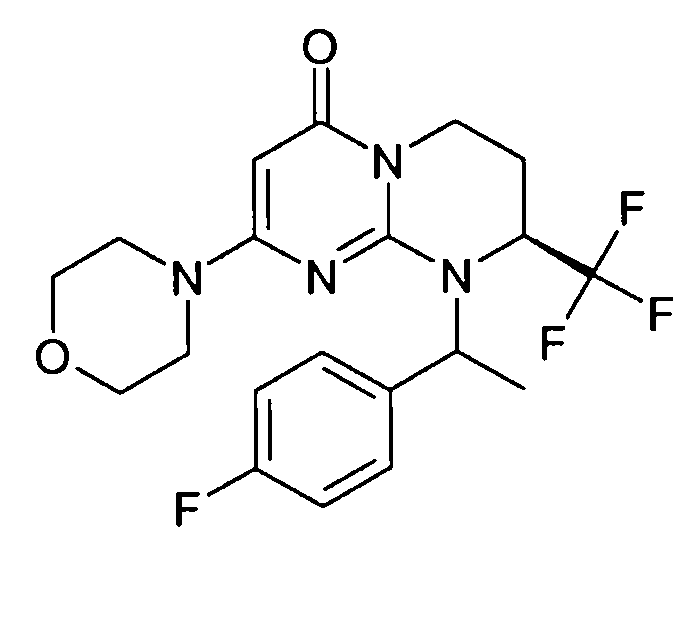
Стадия a:
Разделение двух диастереоизомеров (8S)-9-[(1R и 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она осуществляют методом хроматографии на хиральной фазе (колонка Chiralpak IC, 20 мкм; элюирование смесью 70% гептана и 30% EtOH), исходя из 130 мг смеси двух диастереоизомеров с соотношением 70/30.
Первый диастереоизомер концентрируют с получением 42 мг (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде бесцветного твердого вещества со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,72 (д, J=6,8 Гц, 3H); 2,22 (м, 1H); 2,43 (м, 1H); 3,14-3,27 (м, 5H); 3,39-3,54 (м, 4H); 4,13 (дд, J=5,6 и 14,4 Гц, 1H); 4,80-4,88 (м, 1H); 4,93 (с, 1H); 5,43 (кв, J=6,8 Гц, 1H); 7,12 (т, J=8,8 Гц, 2H); 7,36 (дд, J=5,6 и 8,8 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,95 мин
[M+H]+: m/z 427
Стадия b: (8S)-9-[(1R и 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
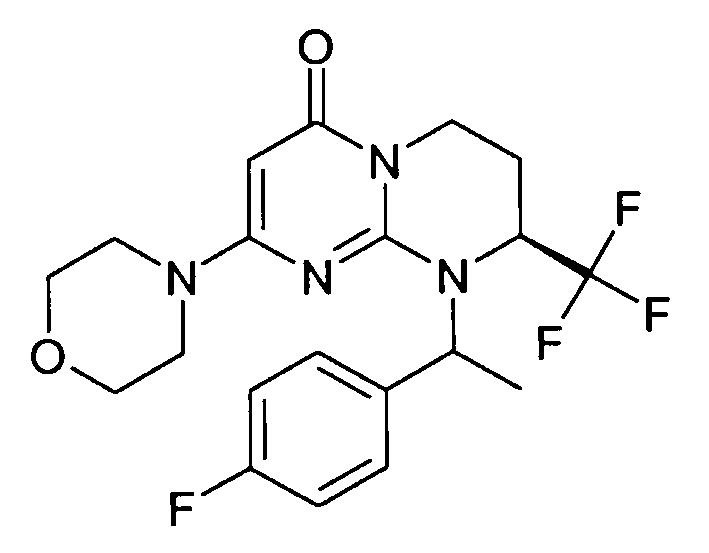
Смесь (8S)-9-[(1R и 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она получают по методике, описанной в примере 24, исходя из 500 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она, 1 г карбоната цезия и 391 мг 1-(1-хлорэтил)-4-фторбензола в 20 мл ацетонитрила. После очистки методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, 97/3) получают 130 мг (8S)-9-[(1R и 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде смеси двух диастереоизомеров с соотношением 70/30 со следующими характеристиками:
Спектр 1H ЯМР:
Смесь двух изомеров с соотношением 70/30: 1,65 (д, J=7,0 Гц, 2,1H); 1,72 (д, J=7,0 Гц, 0,9H); 1,75-1,86 (м, 0,7H); 2,25-2,48 (м, 1,3H); 3,12-3,27 (м, 5H); 3,40-3,56 (м, 4H); 4,00-4,22 (м, 1H); 4,42 (м, 0,7H); 4,80-4,87 (м, 0,3H); 4,93 (с, 0,3H); 4,96 (с, 0,7H); 5,44 (кв, J=7,0 Гц, 0,3H); 5,65 (кв, J=7,0 Гц, 0,7H); 7,06-7,21 (м, 2H); 7,32-7,40 (м, 2H).
Пример 34: (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
После осуществленной ранее очистки (пример 33, стадия a) получают также 85 мг (8S)-9-[(1R или 1S)-1-(4-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде бесцветного твердого вещества со следующими характеристиками:
Спектр 1H ЯМР:
1,65 (д, J=7,0 Гц, 3H); 1,69-1,86 (м, 1H); 2,29-2,37 (м, 1H); 3,14-3,28 (м, 5H); 3,44-3,58 (м, 4H); 4,08 (дд, J=5,9 и 14,7 Гц, 1H); 4,42 (м, 1H); 4,96 (с, 1H); 5,64 (кв, J=7,0 Гц, 1H); 7,17 (т, J=8,8 Гц, 2H); 7,35 (дд, J=5,6 и 8,8 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,95 мин
[M+H]+: m/z 427
Пример 35: (8S)-9-(3-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
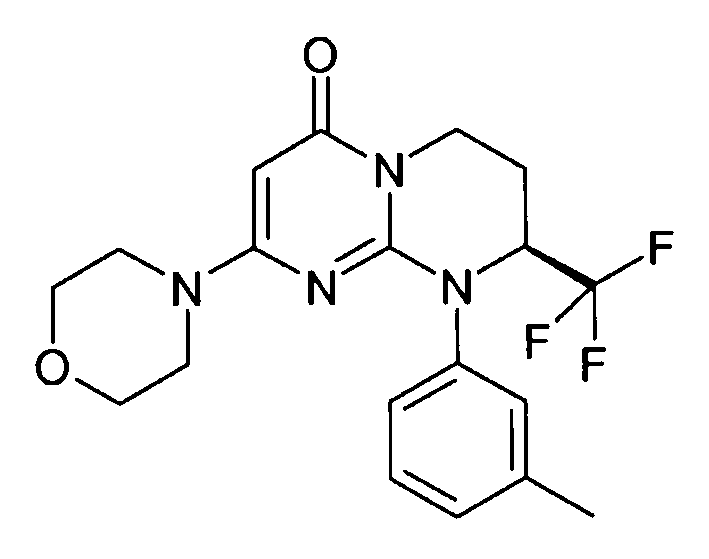
Соединение получают по методике, описанной в примере 12, но исходя из 250 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e) в 4 мл диметилформамида, 251 мг 1-йод-3-метилбензола, 349 мг трикалийфосфата, 156 мг йодида меди и 93 мг (1S,2S)-циклогексан-1,2-диамина. После микроволнового нагревания в течение 1 часа при 150°C и очистки полученной реакционной смеси на колонке с диоксидом кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 98/02) получают 195 мг (8S)-9-(3-метилфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества зеленого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,31 (с, 3H); 2,37-2,47 (м, 2H); 3,02-3,16 (м, 4H); 3,19-3,39 (м частично маскированный, 1H); 3,40-3,53 (м, 4H); 4,28-4,40 (м, 1H); 4,93 (м, 1H); 4,99 (с, 1H); 7,13 (м, 2H); 7,19 (уш.с, 1H); 7,29 (т, J=7,5 Гц, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,90 мин
[M+H]+: m/z 395
Пример 36: (8S)-9-(4-хлорфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
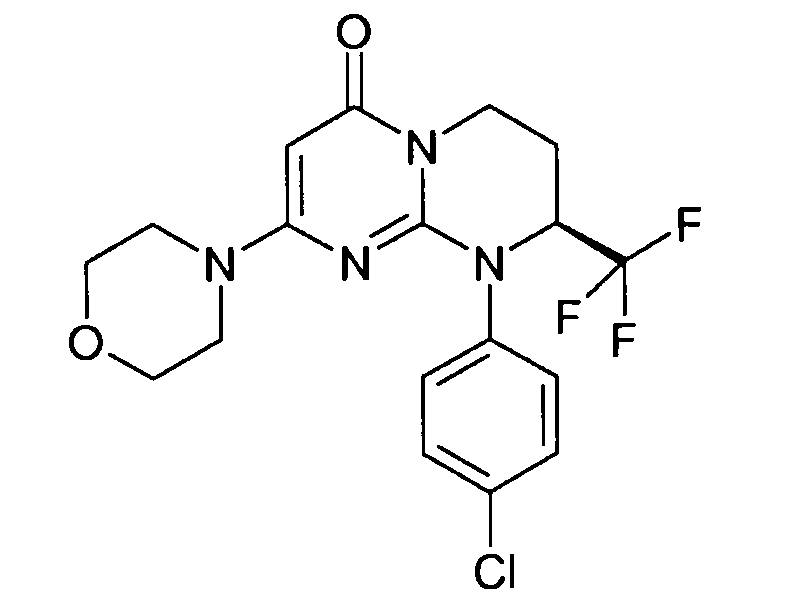
Соединение получают по методике, описанной в примере 12, но исходя из 250 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 274 мг 1-хлор-4-йодбензола, 349 мг трикалийфосфата, 156 мг йодида меди и 93 мг (1S,2S)-циклогексан-1,2-диамина. После микроволнового нагревания в течение 1 часа при 150°C и очистки полученной реакционной смеси на колонке с диоксидом кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 98/02) получают 145 мг (8S)-9-(4-хлорфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде пористой массы зеленого цвета со следующими характеристиками:
Спектр 1H ЯМР:
2,41-2,47 (м, 2H); 3,07-3,12 (м, 4H); 3,20-3,43 (м частично маскированный, 1H); 3,46 (м, 4H); 4,35 (м, 1H); 4,94 (м, 1H); 5,01 (с, 1H); 7,39 (д, J=8,8 Гц, 2H); 7,49 (д, J=8,8 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,94 мин
[M+H]+: m/z 415
Пример 37: (8S)-2-(морфолин-4-ил)-8-(трифторметил)-9-[4-(трифторметил)фенил]-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
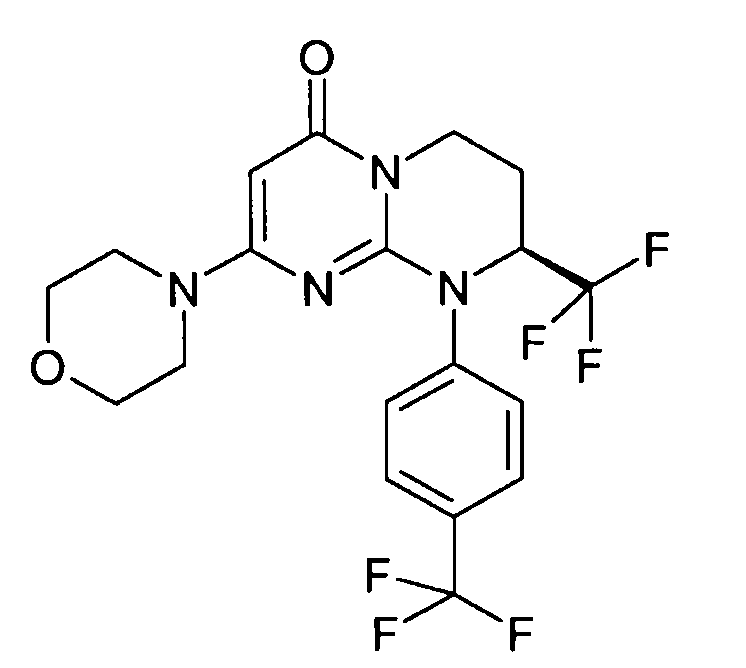
Соединение получают по методике, описанной в примере 12, но исходя из 250 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 313 мг 1-йод-4-(трифторметил)бензола, 349 мг трикалийфосфата, 156 мг йодида меди и 93 мг (1S,2S)-циклогексан-1,2-диамина. После микроволнового нагревания в течение 1 часа при 150°C и очистки полученной реакционной смеси на колонке с диоксидом кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 98/02) получают 120 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-9-[4-(трифторметил)фенил]-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества зеленоватого цвета со следующими характеристиками:
Спектр ЯМР 1H (400 МГц):
2,42-2,53 (м частично маскированный, 2H); 3,01-3,13 (м, 4H); 3,22-3,39 (м частично маскированный, 1H); 3,41-3,46 (м, 4H); 4,37 (м, 1H); 5,03 (с, 1H); 5,05 (м, 1H); 7,62 (д, J=8,6 Гц, 2H); 7,81 (д, J=8,6 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,98 мин
[M+H]+: m/z 449
Пример 38: (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Стадия c:
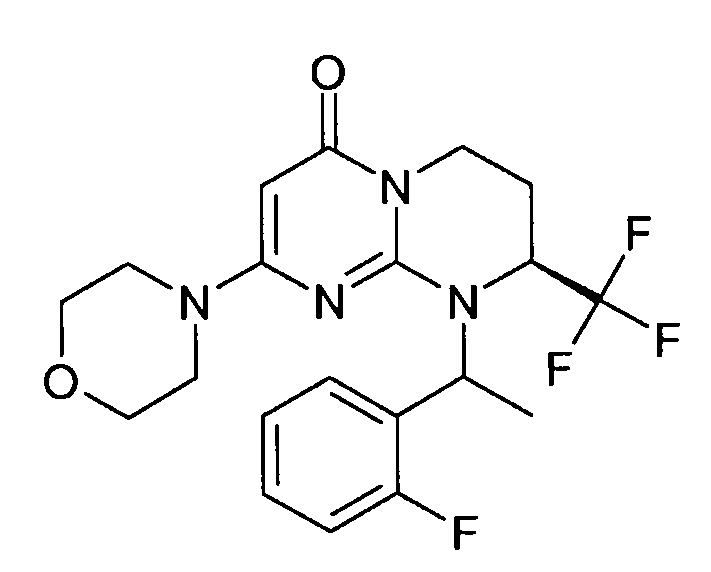
Разделение двух диастереоизомеров (8S)-9-[(1R и 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она осуществляют методом хроматографии на хиральной фазе (колонка Chiralpak AD, 20 мкм; элюирование смесью 80% гептана, 10% EtOH, 10% MeOH), исходя из 70 мг смеси двух диастереоизомеров с соотношением 70/30.
Таким образом, получают 41,5 мг (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,62 (д, J=7,2 Гц, 3H); 1,68-1,85 (м, 1H); 2,30-2,39 (м, 1H); 3,20-3,42 (м, 5H); 3,50-3,65 (м, 4H); 4,03 (м, 1H); 4,22-4,36 (м, 1H); 4,99 (с, 1H); 6,05 (кв, J=7,2 Гц, 1H); 7,14-7,29 (м, 2H); 7,35-7,43 (м, 1H); 7,47 (м, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,02 мин
[M+H]+: m/z 427
Оптическое вращение: PR=+33; C=2,543 мг/1 мл ДМСО
Стадия b: (8S)-9-[(1R и 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
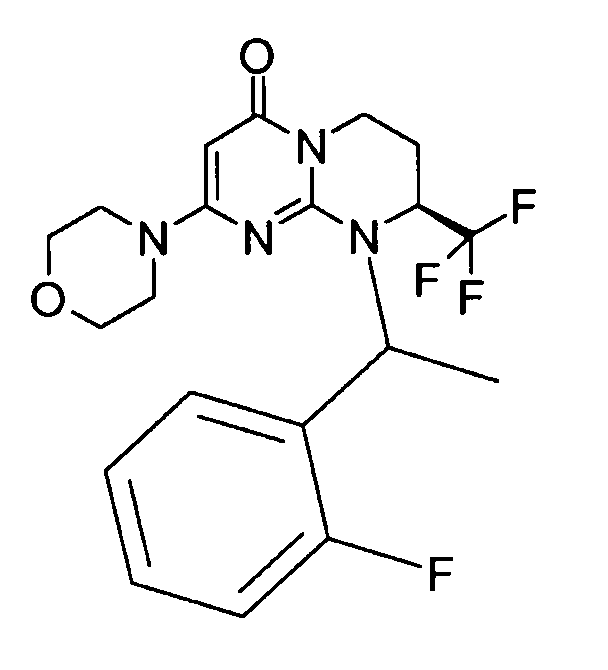
Соединение может быть получено по методике, описанной в примере 17, но исходя из 500 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она, 1 г карбоната цезия, 391 мг 1-(1-хлорэтил)-2-фторбензола (см. стадию, описанную ниже) в 22 мл ацетонитрила. После очистки на колонке с диоксидом кремния (элюент: CH2Cl2/MeOH, 97/03) получают 70 мг смеси двух диастереоизомеров (8S)-9-[(1R и 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она с соотношением 70/30 в виде порошка светло-желтого цвета со следующими характеристиками:
Время удерживания: Tr=0,93 и 0,90 мин: смесь изомеров с соотношением 70%-30%
[M+H]+: m/z 427
Стадия а: 1-(1-хлорэтил)-2-фторбензол
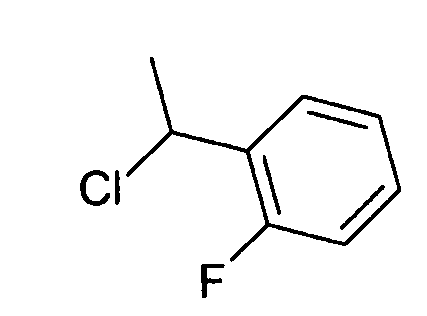
К раствору 1 г коммерческого 1-(2-фторфенил)этанола в 20 мл хлороформа добавляют 767 мг тионилхлорида. После перемешивания в течение ночи при температуре около 20°C реакционную смесь промывают насыщенным водным раствором бикарбоната натрия и затем сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. Таким образом, получают 780 мг 1-(1-хлорэтил)-2-фторбензола, который используют в таком виде на следующей стадии.
Пример 39: (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
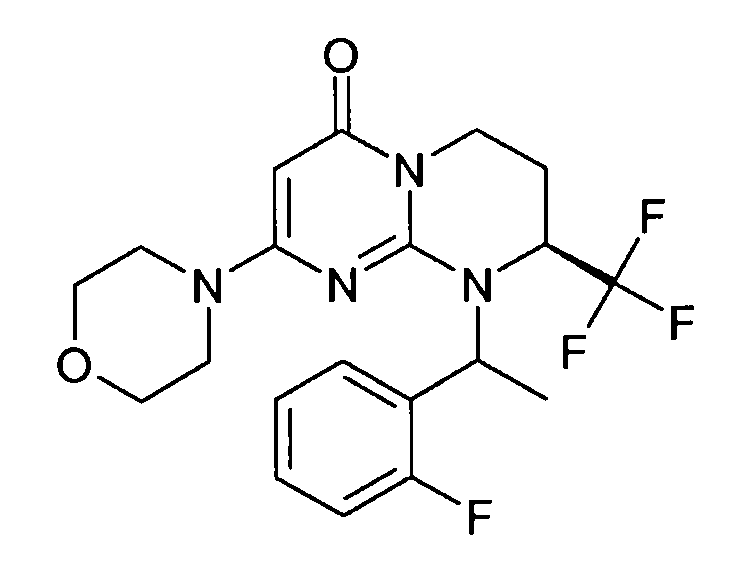
После осуществленной ранее очистки (пример 38, стадия c) получают также 17,9 мг (8S)-9-[(1R или 1S)-1-(2-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества янтарного цвета со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,69 (д, J=7,0 Гц, 3H); 1,97-2,12 (м, 1H); 2,36-2,46 (м, 1H); 3,15-3,35 (м частично маскированный, 5H); 3,43-3,59 (м, 4H); 4,09 (м, 1H); 4,72 (м, 1H); 4,93 (с, 1H); 5,73 (кв, J=7,0 Гц, 1H); 7,07-7,25 (м, 2H); 7,28-7,40 (м, 1H); 7,51 (м, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=3,93 мин
[M+H]+: m/z 427
Оптическое вращение: PR=-96,3+/-1,4; C=2,812 мг/0,5 мл ДМСО
Пример 40: (8S)-9-[2-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
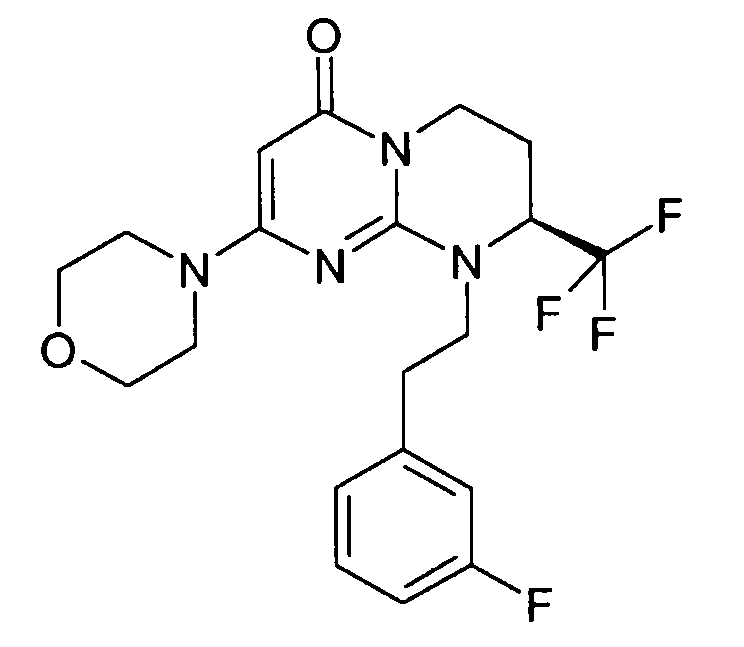
К раствору 150 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в 2,5 мл толуола добавляют 296 мг гидроксида натрия в 2,5 мл воды, 33 мг гидросульфата тетрабутиламмония и 200 мг 1-(2-бромэтил)-3-фторбензола. После микроволнового нагревания (мощность 100 Вт на приборе CEM discover) в течение одного часа при 60°C, затем еще в течение одного часа при 60°C и далее в течение двух циклов по шесть часов при 70°C реакционную смесь разбавляют этилацетатом. Полученную смесь промывают водой. Органическую фракцию отделяют и затем концентрируют досуха при пониженном давлении. После очистки полученного остатка методом препаративной ВЭЖХ/МС (методика D) получают 43 мг (8S)-9-[2-(3-фторфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,87-2,05 (м, 1H); 2,29-2,38 (м, 1H); 2,82-3,24 (м, 3H); 3,38-3,50 (м, 5H); 3,60-3,66 (м, 4H); 4,11-4,25 (м, 2H); 4,50-4,69 (м, 1H); 4,99 (с, 1H); 6,96-7,15 (м, 3H); 7,28-7,41 (м, 1H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,10 мин
[M+H]+: m/z 427
Пример 41: (8S)-9-бензил-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
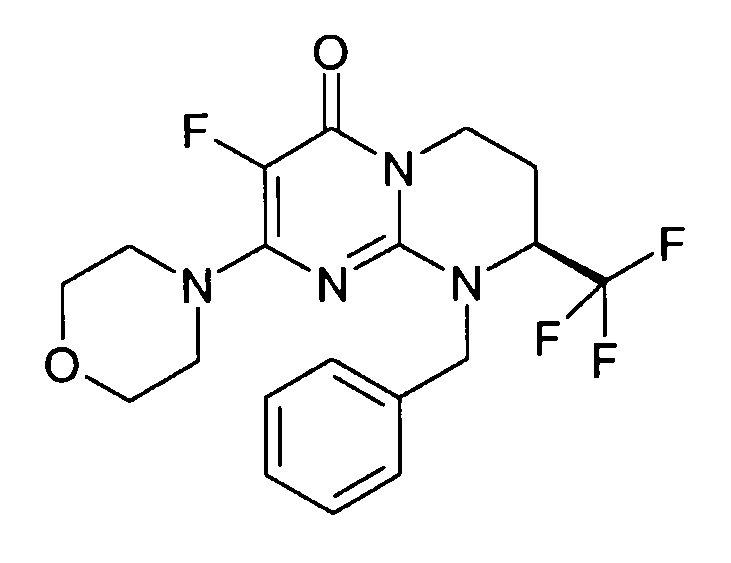
Стадия e:
К суспензии 1 г (8S)-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в 11,8 мл ацетонитрила добавляют 4 г карбоната цезия и 796 мг бензилбромида. После перемешивания в течение ночи при температуре около 20°C образовавшуюся суспензию фильтруют и полученный фильтрат концентрируют досуха при пониженном давлении. Маслянистый остаток желтого цвета очищают на колонке с диоксидом кремния (элюент: CH2Cl2/MeOH, 98/02). Требуемые фракции объединяют и концентрируют досуха при пониженном давлении. Остаток обрабатывают диэтилоксидом, отделяют от жидкости и затем сушат в вакууме. Таким образом, получают 600 мг (8S)-9-бензил-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде порошка белого цвета со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
2,17-2,30 (м, 1H); 2,39-2,46 (м, 1H); 3,31-3,52 (м, 9H); 4,23 (м, 1H); 4,55 (д, J=16,1 Гц, 1H); 4,61-4,73 (м, 1H); 5,13 (д, J=16,1 Гц, 1H); 7,20-7,26 (м, 3H); 7,28-7,36 (м, 2H).
Масс-спектрометрия: методика B
Время удерживания: Tr=4,01 мин
[M+H]+: m/z 413
Стадия d: (8S)-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
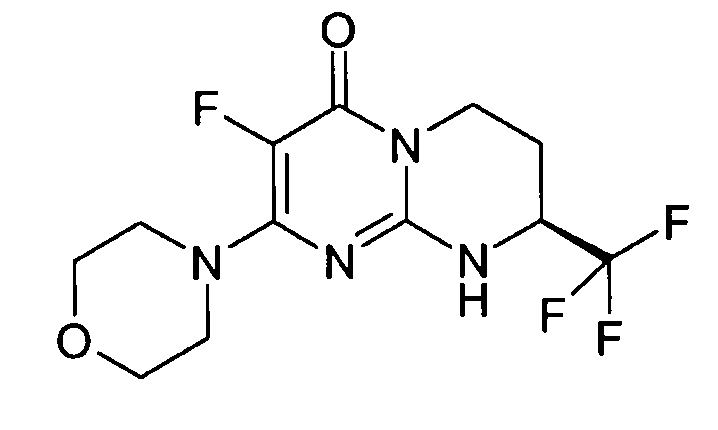
Соединение может быть получено по методике, описанной в примере 16, стадия b, но исходя из 1 г (8S)-2-хлор-3-фтор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в 5 мл ацетонитрила и 1,6 мл морфолина. После выдерживания в течение ночи при 65°C получают 1,1 г (8S)-3-фтор-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде порошка бежевого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,56 мин
[M+H]+: m/z 323; [M-H]-: m/z 321
Стадия c: (8S)-3-фтор-2-хлор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
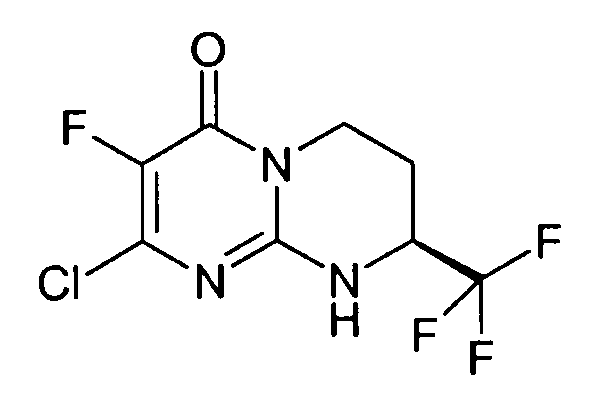
Разделение энантиомеров (8R,8S)-2-хлор-3-фтор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она осуществляют методом хроматографии на хиральной фазе (Chiralpak AD, 20 мкм, 80×350 мм, 250 мл/мин, 254 нм; 5% EtOH, 5% MeOH, 90% гептана+0,1% TEA), исходя из 6,8 г рацемической смеси.
Правовращающий энантиомер концентрируют с получением 3,13 г (8S)-2-хлор-3-фтор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,62 мин
[M+H]+: m/z 272; [M-H]-: m/z 270
Оптическое вращение: PR=+19,6+/-0,6; C=2,488 мг/0,5 мл CH3OH
Стадия b: (8R,8S)-2-хлор-3-фтор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
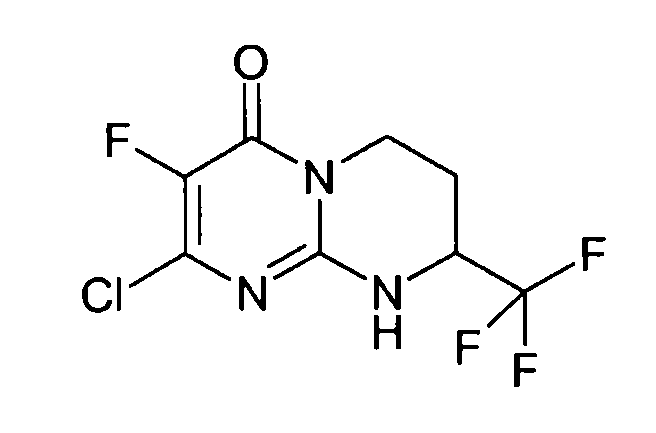
К раствору 6,5 г (8R,8S)-3-фтор-2-гидрокси-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в 20 мл 1,2-дихлорэтана добавляют 8 мл трихлорида фосфора. После перемешивания в течение 4 часов при температуре 65°C и охлаждения до температуры около 20°C реакционную смесь концентрируют досуха при пониженном давлении. Остаток растворяют в 150 мл этилацетата и 10 мл ледяной воды. При температуре в интервале от 0 до 10°C добавляют концентрированный раствор гидроксида натрия до pH в интервале от 6 до 7. Образовавшееся твердое вещество отделяют фильтрованием с получением 3,5 г твердого вещества S1 бежевого цвета. Фильтрат разделяют после расслаивания и органическую фракцию сушат над безводным сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении. После очистки остатка на колонке с диоксидом кремния (элюент: CH2Cl2/MeOH, 97/03) получают 3,3 г твердого вещества S2 светло-желтого цвета. Обе фракции твердых веществ S1 и S2 объединяют с получением 6,8 г (8R,8S)-2-хлор-3-фтор-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде порошка светло-желтого цвета со следующими характеристиками:
Масс-спектрометрия: методика B
Время удерживания: Tr=2,90 мин
[M+H]+: m/z 272; [M-H]-: m/z 270
Стадия a: (8R,8S)-3-фтор-2-гидрокси-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
К суспензии 7 г гидрохлорида 6-(трифторметил)-1,4,5,6-тетрагидропиримидин-2-амина (пример 1, стадия a) в 35 мл диметилфторпропандиоата добавляют 5,6 г метилата натрия. После перемешивания суспензии в течение 3 часов при температуре 100°C полученную смесь концентрируют досуха при пониженном давлении. Остаток обрабатывают диэтилоксидом и отделяют от жидкости под вакуумом. Полученное твердое вещество растворяют в 14 мл воды, полученную смесь охлаждают на льду и подкисляют до pH=5-6 добавлением концентрированной соляной кислоты (25%). После перемешивания в течение 2 часов при температуре 0°C и затем в течение ночи при температуре около 20°C, суспензию фильтруют, твердое вещество отделяют от жидкости и сушат в вакууме над P2O5. Получают 6,5 г (8R,8S)-3-фтор-2-гидрокси-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде порошка желтого цвета со следующими характеристиками:
Масс-спектрометрия: методика A
Время удерживания: Tr=0,28 мин
[M+H]+: m/z 254; [M-H]-: m/z 252
Пример 42: (8S)-9-(3,5-дифторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Хиральное соединение
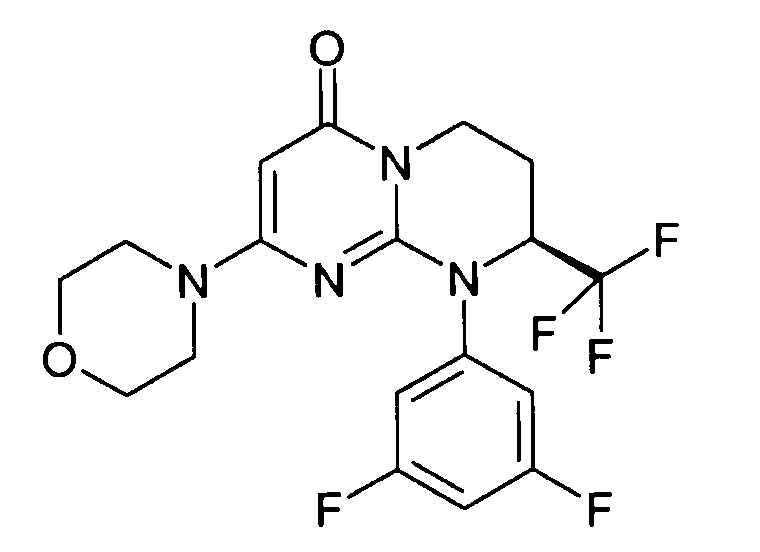
Соединение получают по методике, описанной в примере 12, но исходя из 250 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 276 мг 1,3-дифтор-5-йодбензола, 349 мг трикалийфосфата, 156 мг йодида меди и 93 мг (1S,2S)-циклогексан-1,2-диамина. После микроволнового нагревания в течение 1 часа при 150°C и очистки реакционной смеси на колонке с диоксидом кремния (градиент элюирования от CH2Cl2 до CH2Cl2/MeOH, 98/02) получают 91 мг (8S)-9-(3,5-дифторфенил)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде пористой массы охрового цвета со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
2,45 (м, 2H); 3,07-3,16 (м, 4H); 3,32-3,37 (м, 1H); 3,45-3,55 (м, 4H); 4,36 (м, 1H); 5,01 (м, 1H); 5,04 (с, 1H); 7,18-7,34 (м, 3H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,95 мин
[M+H]+: m/z 417; [M-H+HCO2H]-: m/z 461
Пример 43: (8S)-9-[(2,6-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
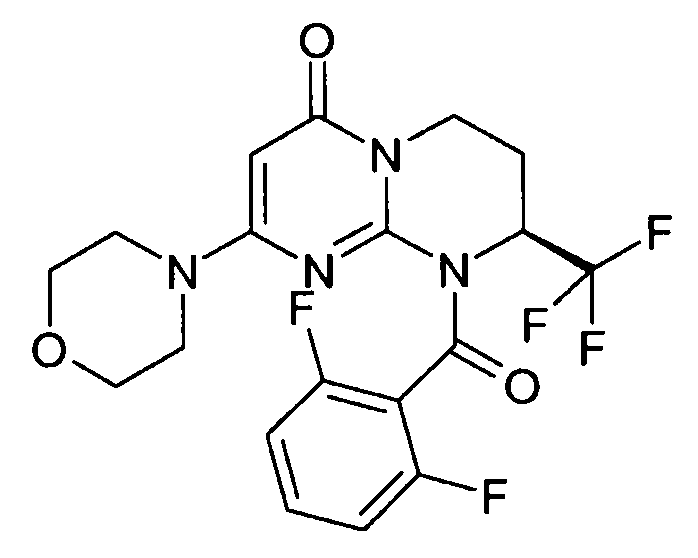
Соединение получают по методике, описанной в примере 18, исходя из 300 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 47 мг гидрида натрия и 174 мг 2,6-дифторбензоилхлорида в 4 мл тетрагидрофурана. После трех последовательных очисток методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH; градиент от 100/0 до 98/02, затем 98/1 и 98/2) получают 22 мг (8S)-9-[(2,6-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде твердого вещества белого цвета со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
2,06-2,23 (м, 1H); 2,69-2,79 (м, 1H); 2,91 (м, 2H); 3,06 (м, 2H); 3,18-3,34 (м частично маскированный, 1H); 3,37-3,50 (м, 4H); 4,52-4,61 (м, 1H); 5,23 (с, 1H); 5,62-5,86 (м, 1H); 7,04-7,35 (м, 2H); 7,50-7,67 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,93 мин
[M+H]+: m/z 445
Пример 44: (8S)-9-[(2,4-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
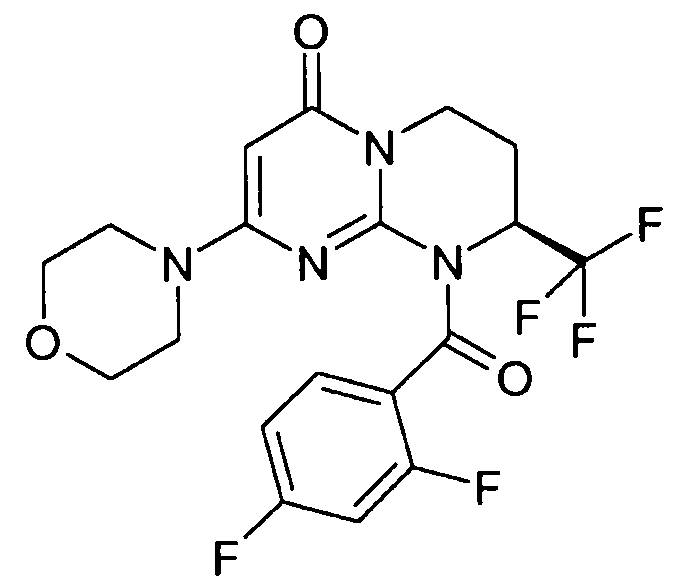
Соединение получают по методике, описанной в примере 18, исходя из 300 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 47 мг гидрида натрия и 174 мг 2,4-дифторбензоилхлорида в 4 мл тетрагидрофурана. После двух последовательных очисток методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, градиент от 100/0 до 98/02, затем 99/01) получают 24 мг (8S)-9-[(2,4-дифторфенил)карбонил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде бесцветного лака со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
2,20 (м, 1H); 2,67-2,77 (м, 1H); 2,81-2,91 (м, 2H); 3,03 (м, 2H); 3,24-3,45 (м частично маскированный, 2H); 3,37-3,46 (м, 2H); 3,52 (м, 1H); 4,30-4,48 (м, 1H); 5,21 (с, 1H); 5,53-5,67 (м, 1H); 7,18 (дт, J=2,5 и 8,6 Гц, 1H); 7,35 (ддд, J=2,5 и 9,3 и 11,2 Гц, 1H); 7,61-7,71 (м, 1H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,94 мин
[M+H]+: m/z 445
Пример 45: (8S)-2-(морфолин-4-ил)-9-(фенилацетил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
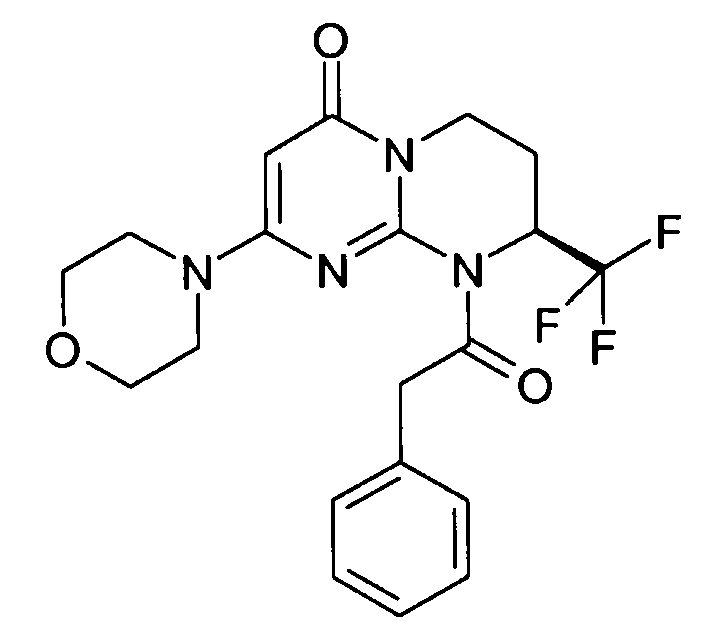
Соединение получают по методике, описанной в примере 18, исходя из 300 мг (8S)-2-морфолин-4-ил-8-трифторметил-6,7,8,9-тетрагидропиримидо[1,2-a]пиримидин-4-она (пример 1e), 47 мг гидрида натрия и 152 мг фенилацетилхлорида в 4 мл тетрагидрофурана. После двух последовательных очисток методом хроматографии на диоксиде кремния (элюент: CH2Cl2/MeOH, градиент от 100/0 до 98/02, затем CH2Cl2/AcOEt, 95/05) получают 12 мг (8S)-2-(морфолин-4-ил)-9-(фенилацетил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в виде бесцветного лака со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,91 (м, 1H); 2,59-2,69 (м, 1H); 2,88 (м, 1H); 3,33-3,45 (м, 4H); 3,60 (м, 4H); 4,07 (д, J=16,0 Гц, 1H); 4,16 (д, J=16,0 Гц, 1H); 4,43-4,52 (м, 1H); 5,30 (с, 1H); 5,48-5,61 (м, 1H); 7,11 (д, J=7,7 Гц, 2H); 7,17-7,23 (т, J=7,7 Гц, 1H); 7,28 (т, J=7,7 Гц, 2H).
Масс-спектрометрия: методика A
Время удерживания: Tr=0,99 мин
[M+H]+: m/z 423
[M-H]-: m/z 421; пик молекулярного иона: m/z 303
Пример 46: (8S)-9-[2-(3-хлорфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-он
Соединение получают по методике, описанной в примере 40, при этом к 150 мг (8S)-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она в 2,5 мл толуола добавляют 296 мг гидроксида натрия в 2,5 мл воды, 33 мг гидросульфата тетрабутиламмония и 216 мг 1-(2-бромэтил)-3-хлорбензола и нагревают в течение 44 часов при 60°C. После охлаждения реакционную смесь разбавляют этилацетатом. Органическую фракцию отделяют, а из водной фракции осуществляют экстракцию этилацетатом. Объединенные органические фракции концентрируют досуха при пониженном давлении и остаток очищают методом препаративной ВЭЖХ/МС (методика D). Таким образом, получают 42 мг (8S)-9-[2-(3-хлорфенил)этил]-2-(морфолин-4-ил)-8-(трифторметил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-a]пиримидин-4-она со следующими характеристиками:
Спектр 1H ЯМР (400 МГц):
1,91-2,05 (м, 1H); 2,34 (м, 1H); 2,81-2,92 (м, 1H); 2,94-3,04 (м, 1H); 3,17 (м, 1H); 3,38-3,50 (м, 5H); 3,65 (м, 4H); 4,09-4,22 (м, 2H); 4,57-4,71 (м, 1H); 4,99 (с, 1H); 7,17 (д, J=7,8 Гц, 1H); 7,25-7,38 (м, 3H).
Масс-спектрометрия: методика A
Время удерживания: Tr=1,03 мин
[M+H]+: m/z 443; [M-H+HCO2H]-: m/z 487
Пример 47. Фармацевтическая композиция
Были изготовлены таблетки, соответствующие следующему составу:
соединение примера 1 0,2 г;
эксципиент, дополняющий массу таблетки до 1 г
(ингредиенты эксципиента: лактоза, тальк, крахмал, стеарат магния).
Соединение примера 1 взято в качестве варианта фармацевтического препарата, при этом такой препарат при необходимости может быть получен с другими соединениями формулы (I) по настоящему изобретению и предпочтительно с соединениями примеров 2-46 и 48-56 настоящей заявки.
Соединения, указанные в приведенной ниже таблице, представляют собой определенные выше соединения формулы (I) и относятся к примерам 48-56 настоящего изобретения. Соединения 48-56 получают соответственно приведенному выше описанию в экспериментальной части.
|
Фармакологическая часть
Методики экспериментов
Методики экспериментов in vitro
Ингибирующую активность соединений в отношении фосфорилирования AKT определяют как вестерн-блоттингом по описанной ниже методике, так и по методике MSD Multi-spot Biomarker detection компании Meso Scale Discovery, также описанной ниже. На группе соединений было показано, что 2 способа дают сопоставимые результаты.
Исследование экспрессии pAKT в клетках человека PC3 карциномы предстательной железы, определяемой способом вестерн-блоттинга (испытание A)
Данное испытание основано на определении экспрессии белка AKT, фосфорилированного по серину 473. Фосфорилирование AKT (pAKT) определяют способом вестерн-блоттинга в линии карциномы предстательной железы человека PC3 (ATCC CRL-1435) при использовании антитела, специфически распознающего pAKT-S473.
В 1-й день клетки PC3 высевают в 6-луночные планшеты (TPP, № 92006) в количестве 0,8×106 клеток на лунку в 1800 мкл среды DMEM (DMEM Gibco, № 11960-044), содержащей 10% эмбриональной телячьей сыворотки (SVF Gibco, № 10500-056) и 1% глутамина (L-Glu Gibco, № 25030-024), и инкубируют при 37°C в атмосфере с 5% CO2 в течение ночи.
Во 2-й день клетки инкубируют в присутствии или в отсутствие испытуемых соединений в течение от 1 до 2 часов при 37°C в атмосфере с 5% CO2. Соединения, растворенные в диметилсульфоксиде (DMSO Sigma, № D2650), добавляют исходя из основного раствора с 10-кратной концентрацией, причем конечное процентное содержание ДМСО составляет 0,1%. Соединения испытывают только при одной концентрации, меньшей или равной 10 мкМ, или с возрастающими концентрациями в интервале, который может простираться от значений менее 1 нМ до 10 мкМ.
После инкубации клетки лизируют для получения белков. После удаления культуральной среды аспирацией клетки промывают 1 мл PBS (DPBS Gibco, № 14190-094), собирают соскабливанием в 200 мкл буферного раствора HNTG, переносят в 96-луночный планшет (Greiner, № 651201) и лизируют в течение 1 ч на льду. Буферный раствор HNTG представляет собой следующую смесь: 50 мМ Hepes, 150 мМ NaCl, 1% Triton, 10% глицерина с добавлением перед использованием таблетки Protease Inhibitor Cocktail Mini (Roche, 1836153) и таблетки Phosphatase Inhibitor Cocktail (Roche, 104906837001) на 10 мл буферного раствора.
Лизат центрифугируют в течение 10 мин при 6000 об/мин. Выделяют 155 мкл надосадочной жидкости. Инкубируют 150 мкл для денатурации в течение 5 мин при 95°C в буферном растворе NuPAGE LDS Sample Buffer 4X, разбавленном в 4 раза (позиция по каталогу InVitrogen NP0007), и NuPAGE Sample Reducing Agent 10X, разбавленном в 10 раз (позиция по каталогу InVitrogen NP0009). Затем эти образцы замораживают при -20°C. 5 мкл количественно анализируют по методике microBCA согласно техническим условиям MicroBCA Proteine Assay Kit (Pierce, № 23235).
Для разделения 20 мкг белков наносят на гель NU-PAGE 4-12% Bis Tris Gel в 12 лунок (позиция по каталогу InVitrogen NP0322BOX) и осуществляют миграцию в течение 1 ч 30 мин в буферном растворе для миграции NU-PAGE MOPS SDS Running Buffer 20X, разбавленном в 20 раз (позиция по каталогу InVitrogen NP0001), при 150 В.
Затем из геля осуществляют перенос на мембрану Invitrolon PVDF (Invitrogen, № LC2007), предварительно замоченную в течение нескольких секунд в этаноле (Ethanol Fischer Scientific, № E/0600DF/15).
Перенос осуществляют в кювете Biorad при 30 В в течение ночи или при 60 В в течение 3 часов в буферном растворе для переноса NUPAGE Transfer Buffer 20X, разбавленном в 20 раз (позиция по каталогу InVitrogen NP0006).
Затем мембрану насыщают в насыщающем растворе, содержащем TBS (Tris Buffer Saline 10x, Sigma, № T5912 Sigma, разбавленный в 10 раз), 0,1% Tween 20 (№ P5927 Sigma) и 3% BSA (Bovine Albumin Serum Fraction V, Sigma, № A4503) в течение 6 ч после переноса, осуществляемого в течение ночи или в течение 1 ч после переноса, осуществляемого в течение 3 ч.
Первичные антитела растворяют с соотношением 1/1000 в случае антитела anti-phospho AKT-Ser473 (193H2, моноклональное антитело кролика, позиция по каталогу № 4058, Cell Signaling Technology Abcam) в насыщающем растворе, содержащем PBS, 0,1% Tween 20, 3% BSA, и затем перемешивают в течение ночи при 4°C.
Перед гибридизацией вторичных антител осуществляют две промывки в течение 5 мин в промывочным растворе, содержащем TBS и 0,1% Tween 20.
Вторичные антитела растворяют в насыщающем растворе с соотношением 1/10000 в случае анти-мышиного антитела кролика IgG HRP (W402 Promega) и с соотношением 1/10000 в случае анти-кроличьего антитела козы IgG HRP (W401 Promega) и затем перемешивают в течение 1 ч при комнатной температуре.
Осуществляют две промывки в течение 30 мин в промывочным растворе и затем промывают в течение 5 мин в Η2O для удаления остаточного Tween 20.
Проявляющий раствор готовят исходя из объема на объем согласно техническим условиям на реактив Western Lightning Chemiluminescence Reagent Plus (Western Lightning Chemiluminescence Reagent Plus, Perkin Elmer, № NEL104).
Мембрану помещают на 1 мин в проявляющий раствор, дают раствору стечь, вкладывают между двумя прозрачными пластинами и затем помещают в измерительный прибор для определения люминесценции и количественного определения сигнала. Определение люминесценции осуществляют на приборе FujiFilm (Ray Test).
На приборе FUJI измеряют сигнал общей люминесценции (AU), получаемый для каждой выбранной полосы. Затем вычитают фоновый шум (BG) пропорционально размеру выбранной полосы (Area), т.е. фоновый шум, рассчитанный исходя из полосы удельного фонового шума, с целью получения удельного сигнала (AU-BG) для каждой полосы. Полосу, полученную в отсутствие соединения и в присутствии 0,1% ДМСО, принимают за источник 100%-го сигнала. Посредством программы рассчитывают удельную активность в % (Ratio), получаемую для каждой выбранной полосы в зависимости от данного 100%-го сигнала. Расчет процентной степени ингибирования выполняют для каждой концентрации по формуле (100% - Ratio).
Результаты 2 независимых опытов позволяют рассчитать среднее значение процентной степени ингибирования, получаемой с заданной концентрацией для соединений, испытываемых только при одной концентрации.
При необходимости активность соединений выражают в приближенной CI50, получаемой исходя из кривой "доза-ответ" при различных испытуемых концентрациях и представляющей собой дозу, обеспечивающую 50% удельного ингибирования (абсолютная CI50). Результаты 2 независимых опытов позволяют рассчитать среднее значение CI50.
Исследование экспрессии pAKT в клетках человека PC3 карциномы предстательной железы, определяемой по методике MSD Multi-spot Biomarker Detection компании Meso Scale Discovery (испытание B)
Это испытание основано на определении экспрессии белка AKT, фосфорилированного по серину 473 (P-AKT-S473), в линии клеток человека PC3 карциномы предстательной железы по методике, основанной на иммунологическом сэндвич-анализе, с использованием набора MSD Multi-spot Biomarker Detection компании Meso Scale Discovery: наборы phospho-Akt (Ser473) whole cell lysate (№ K151 CAD) или phospho-Akt (Ser473)/Total Akt whole cell lysate (№ K151 OOD). Специфическое первичное антитело P-AKT-S473 (набор № K151 CAD) наносят на электрод в каждой из лунок 96-луночных планшетов набора MSD: после добавления лизата белков в каждую из лунок измерение сигнала осуществляют путем добавления детектирующего вторичного антитела, меченного электрохемилюминесцирующим соединением. Приведенная далее процедура представляет собой процедуру, описанную в наборе.
В 1-й день клетки PC3 высевают в 96-луночные планшеты (TPP, № 92096) в количестве 35000 клеток на лунку в 200 мкл среды DMEM (DMEM Gibco, № 11960-044), содержащей 10% эмбриональной телячьей сыворотки (SVF Gibco, № 10500-056) и 1% глутамина (L-Glu Gibco, № 25030-024), и инкубируют при 37°C в атмосфере с 5% CO2 в течение ночи.
Во 2-й день клетки инкубируют в присутствии или в отсутствие испытуемых соединений в течение от 1 до 2 ч при 37°C в атмосфере с 5% CO2. Соединения, растворенные в диметилсульфоксиде (DMSO Sigma, № D2650), добавляют исходя из основного раствора с 20-кратной концентрацией, причем конечное процентное содержание ДМСО составляет 0,1%. Соединения испытывают только при одной концентрации, меньшей или равной 10 мкМ, или с возрастающими концентрациями в интервале, который может простираться от значений менее 1 нМ до 10 мкМ.
После инкубации клетки лизируют для получения белков. С этой целью после удаления культуральной среды аспирацией в лунки добавляют по 50 мкл лизирующего буферного раствора Tris Lysis Buffer complet из набора MSD, содержащего растворы ингибиторов протеаз и фосфатаз, и клетки лизируют при 4°C в течение 1 ч при перемешивании. На этой стадии планшеты, содержащие лизаты, могут быть заморожены при температуре -20°C или -80°C.
Лунки 96-луночных планшетов из набора MSD насыщают в течение 1 ч при комнатной температуре блокирующим раствором из набора MSD. Осуществляют четыре промывки 150 мкл промывочного раствора Tris Wash Buffer из набора MSD. Полученные ранее лизаты переносят в 96-луночные планшеты Multi-spot из набора MSD и инкубируют при комнатной температуре в течение 1 ч при перемешивании. Осуществляют четыре промывки 150 мкл промывочного раствора Tris Wash Buffer из набора MSD. В лунки добавляют по 25 мкл раствора MSD sulfo-tag detection antibody и инкубируют при комнатной температуре в течение 1 ч при перемешивании. Осуществляют четыре промывки 150 мкл промывочного раствора Tris Wash Buffer из набора MSD. В лунки добавляют по 150 мкл проявляющего буферного раствора Read Buffer из набора MSD и немедленно осуществляют анализ планшетов на приборе S12400 компании Meso Scale Discovery.
На приборе измеряют сигнал для каждой из лунок. Лунки без клеток, содержащие лизирующий буферный раствор, служат для определения значения фонового шума, которое вычитают из всех измеренных значений (min). Лунки, содержащие клетки в отсутствие соединения и в присутствии 0,1% ДМСО, принимают за источник 100%-го сигнала (max). Расчет процентной степени ингибирования выполняют для каждой концентрации испытуемого соединения по следующей формуле: (1-(essai-min)/(max-min))×100.
Активность соединения выражают в CI50, получаемой исходя из кривой "доза-ответ" при различных испытуемых концентрациях и представляющей собой дозу, обеспечивающую 50% удельного ингибирования (абсолютная CI50). Результаты 2 независимых опытов позволяют рассчитать среднее значение CI50.
Ингибирующую активность соединений в отношении аутофагии определяют по транслокации белка LC3 цитоплазмы к аутофагосомам. С этой целью клетки Hela трансфицировали вектором, кодирующим химерный белок GFP-LC3. Был выбран клон Hela, экспрессирующий белок GFP-LC3 стабильным образом. Транслокацию белка LC3 определяли, подсчитывая число клеток, имевших грануляции LC3 после метаболического стресса, посредством цитометра с автоматическим анализом изображений iCyte (Compucyte).
Исследование транслокации белка LC3 в клетках человека Hela, определяемой цитометром с анализом изображений (испытание C):
В 1-й день клетки Hela GFP-LC3 высевают в 96-луночные планшеты, покрытые поли-D-лизином (Greiner, № 655946), в количестве 15000 клеток на лунку в 200 мкл среды DMEM (DMEM Gibco, № 11960-044), содержащей 10% эмбриональной телячьей сыворотки (SVF Gibco, № 10500-056) и 1% глутамина (L-Glu Gibco, № 25030-024), и инкубируют при 37°C в атмосфере с 5% CO2 в течение ночи.
Во 2-й день клетки промывают два раза посредством EBSS (Sigma, № E3024). Затем клетки инкубируют в EBSS с 10 мкМ гидроксихлорохина и испытуемыми соединениями в течение 2 ч при 37°C в атмосфере с 5% CO2. Соединения растворяют в диметилсульфоксиде (DMSO Sigma, № D2650), причем конечное процентное содержание ДМСО составляет 0,1%. Соединения испытывают с возрастающими концентрациями в интервале, который может простираться от 10 нМ до 1 мкМ.
После инкубации клетки фиксируют 4% параформальдегида (Sigma, № HT501128 4L) в течение 10 мин. Затем клетки промывают 2 раза PBS и ядра окрашивают посредством 2 мкг/мл реактива Hoechst 33342 (Invitrogen, № H3570). Затем 96-луночные планшеты анализируют на цитометре с анализом изображений iCyte (Compucyte). На анализаторе количественно определяют число клеток, имеющих грануляции LC3. Клетку считают положительной, если она содержит по меньшей мере 4 грануляции LC3. Процентное содержание клеток, имеющих больше 4 грануляций, рассчитывают по отношению к общему числу клеток.
Активность соединения выражают в CI50, получаемой исходя из кривой "доза-ответ" при различных испытуемых концентрациях и представляющей собой дозу, обеспечивающую 50% удельного ингибирования (абсолютная CI50). Результаты 2 независимых опытов позволяют рассчитать среднее значение CI50.
Результаты, полученные для соединений по примерам экспериментальной части, представлены в таблице результатов фармакологических испытаний, приведенной ниже.
|
|
|
Испытание на противомалярийную активность
Испытания на противомалярийную активность осуществляли радиоизотопным микрометодом Дежардена (R.E. Desjardins, C.J. Canfield, J.D. Haynes, J.D. Chulay, Antimicrob. Agents Chemother., 1979, 16, 710-718). Испытания осуществляли в 96-луночных микропланшетах (испытательные чашки, позиция по каталогу 92696, Techno Plastic Products Ag, Zollsrasse 155, CH-8219 Trasadingen). Штаммы P. falciparum культивировали в растворах RPMI 1640, дополненных 5% сыворотки человека с гематокритом 2% и паразитемией 1,5%. В каждом опыте паразитов инкубировали с выбранными концентрациями лекарственных средств в течение 48 ч при 37°C во влажной атмосфере с 5% CO2. В качестве сравнительных соединений использовали артемизинин, артезунат и дифосфат хлорохина. Первое разведение лекарственного средства осуществляли до концентрации 1 мг/мл в диметилсульфоксиде. Серию разведений для последующих производных растворов также осуществляли в диметилсульфоксиде. Затем каждое последующее разведение разбавляли в соотношении 1/50 в RPMI 1640, дополненной 5% сыворотки человека, при этом разведения осуществляли при 37°C. Затем эти разведения добавляли к культурам паразитов в микропланшетах. После добавления лекарственного средства паразитов культивировали в RPMI 1640 с 5% сыворотки человека и 1% диметилсульфоксида. Рост паразитов определяли по включению тритийзамещенного гипоксантина (добавленного через 24 ч после начала воздействия лекарственным средством) при сравнении с включением в отсутствие лекарственного средства.
Активность соединения выражают в степени ингибирования в % роста P. falciparum (высокоустойчивый к хлорохину штамм Fcm29-Cameroun) при дозе 1 и 0,1 мкМ в испытании in vitro с использованием инфицированных эритроцитов человека.
Результаты, полученные для соединений по примерам экспериментальной части, представлены в таблице 2 результатов фармакологических испытаний, приведенной ниже.
|