Результат интеллектуальной деятельности: ПРОТЕАЗЫ, СОДЕРЖАЩИЕ ОДНУ ИЛИ НЕСКОЛЬКО КОМБИНИРУЕМЫХ МУТАЦИЙ
Вид РИД
Изобретение
По настоящей заявке испрашивается приоритет предварительной заявки на патент США № 61/113545, поданной 11 ноября 2008 г., и предварительной заявки на патент США № 61/218802, поданной 19 июня 2009 г., которые включены в настоящее описание изобретения в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к сконструированным вариантам протеаз. Варианты протеаз, в частности, включают комбинируемые мутации в выбранных положениях на поверхности фермента, которые влияют на заряд и/или гидрофобность фермента, усиливая по меньшей мере одно требуемое свойство полученного вариантного фермента в выбранном применении. Настоящее изобретение относится к композициям, содержащим варианты протеаз, и к способам их применения.
Уровень техники
Сериновые протеазы представляют собой подгруппу карбонилгидролаз, содержащих разнообразный класс ферментов, обладающих широким диапазоном специфичностей и биологических функций. Было выполнено много исследований субтилизинов главным образом в связи с возможностью их применения в качестве очищающих средств и пищевых добавок. Дополнительные исследования были сфокусированы на неблагоприятных окружающих условиях (например, воздействие оксидантов, хелатообразователей, экстремальных температур и/или значений рН), которые могут снизить функциональность указанных ферментов в разных применениях. Тем не менее, в данной области по-прежнему сохраняется потребность в ферментных системах, устойчивых к воздействию неблагоприятных условий и сохраняющих или обладающих более высокой активностью по сравнению с ферментами, известными в настоящее время в данной области.
Сущность изобретения
Настоящее изобретение относится к сконструированным вариантам протеаз. Варианты протеаз, в частности, включают комбинируемые мутации в выбранных положениях на поверхности фермента, которые влияют на заряд и/или гидрофобность фермента, усиливая по меньшей мере одно требуемое свойство полученного вариантного фермента в выбранном применении. Настоящее изобретение относится к композициям, содержащим варианты протеаз, и к способам их применения.
В одном варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-R45Q-S101Q-G118Q-T213Q, R45Q-S101Q-G118Q-T213Q, S101Q-G118Q-T213Q, G118Q-T213Q, S24E-R45Q-S101Q-G118Q-T213Q, S24E-R45E-S101Q-G118Q-T213Q, S24E-R45E-S101E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118E-T213Q, S24E-R45E-S101E-Q109E-G118E-T213E, S24L-R45Q-S101Q-G118Q-T213Q, S24L-R45L-S101Q-G118Q-T213Q, S24L-R45L-S101L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118L-T213Q, S24L-R45L-S101L-Q109L-G118L-T213L, S24R-R45Q-S101Q-G118Q-T213Q, S24R-S101Q-G118Q-T213Q, S24R-S101R-G118Q-T213Q, S24R-S101R-Q109R-G118Q-T213Q, S24R-S101R-Q109R-G118R-T213Q, S24R-S101R-Q109R-G118R-T213R, S24E-S101R-Q109R-G118R-T213R, S24E-R45E-S101R-Q109R-G118R-T213R, S24E-R45E-S101E-Q109R-G118R-T213R, S24E-R45E-S101E-Q109E-G118R-T213R, S24E-R45E-S101E-Q109E-G118E-T213R, S24E-R45E-S101E-Q109E-G118E-T213E, S24Q-R45Q-S101Q-G118Q-T213Q-L217Q и S24Q-R45Q-S101Q-G118Q-T213Q-L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего замену T213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-A45Q-S101Q-N109Q-N118Q-K213Q, A45Q-S101Q-N109Q-N118Q-K213Q, S101Q-N109Q-N118Q-K213Q, N109Q-N118Q-K213Q, N118Q-K213Q, S24E-A45Q-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109E-N118Q-K213Q, S24E-A45E-S101E-N109E-N118E-K213Q, S24E-A45E-S101E-N109E-N118E-K213E, S24L-A45Q-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109L-N118Q-K213Q, S24L-A45L-S101L-N109L-N118L-K213Q, S24L-A45L-S101L-N109L-N118L-K213L, S24R-A45Q-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109R-N118Q-K213Q, S24R-A45R-S101R-N109R-N118R-K213Q, S24R-A45R-S101R-N109R-N118R-K213R, S24E-A45R-S101R-N109R-N118R-K213R, S24E-A45E-S101R-N109R-N118R-K213R, S24E-A45E-S101E-N109R-N118R-K213R, S24E-A45E-S101E-N109E-N118R-K213R, S24E-A45E-S101E-N109E-N118E-K213R, S24E-A45E-S101E-N109E-N118E-K213E, S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217Q и S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217E, которые соответствуют положениям субтилизина BPN' SEQ ID NO:1.
В другом варианте осуществления изобретения вариант протеазы является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего замену K213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
Другой вариант осуществления изобретения относится к выделенной нуклеиновой кислоте, кодирующей любые вышеуказанные варианты протеаз.
Другой вариант осуществления изобретения относится к экспрессирующему вектору, содержащему выделенную нуклеиновую кислоту, кодирующую любые вышеуказанные варианты протеаз.
Другой вариант осуществления изобретения относится к клетке-хозяину, содержащей экспрессирующий вектор, который в свою очередь содержит выделенную нуклеиновую кислоту, кодирующую любые вышеуказанные варианты протеаз.
Другой вариант осуществления изобретения относится к очищающей композиции, содержащей по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-R45Q-S101Q-G118Q-T213Q, R45Q-S101Q-G118Q-T213Q, S101Q-G118Q-T213Q, G118Q-T213Q, S24E-R45Q-S101Q-G118Q-T213Q, S24E-R45E-S101Q-G118Q-T213Q, S24E-R45E-S101E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118E-T213Q, S24E-R45E-S101E-Q109E-G118E-T213E, S24L-R45Q-S101Q-G118Q-T213Q, S24L-R45L-S101Q-G118Q-T213Q, S24L-R45L-S101L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118L-T213Q, S24L-R45L-S101L-Q109L-G118L-T213L, S24R-R45Q-S101Q-G118Q-T213Q, S24R-S101Q-G118Q-T213Q, S24R-S101R-G118Q-T213Q, S24R-S101R-Q109R-G118Q-T213Q, S24R-S101R-Q109R-G118R-T213Q, S24R-S101R-Q109R-G118R-T213R, S24E-S101R-Q109R-G118R-T213R, S24E-R45E-S101R-Q109R-G118R-T213R, S24E-R45E-S101E-Q109R-G118R-T213R, S24E-R45E-S101E-Q109E-G118R-T213R, S24E-R45E-S101E-Q109E-G118E-T213R, S24E-R45E-S101E-Q109E-G118E-T213E, S24Q-R45Q-S101Q-G118Q-T213Q-L217Q и S24Q-R45Q-S101Q-G118Q-T213Q-L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего замену T213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
Другой вариант осуществления изобретения относится к очищающей композиции, содержащей по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-A45Q-S101Q-N109Q-N118Q-K213Q, A45Q-S101Q-N109Q-N118Q-K213Q, S101Q-N109Q-N118Q-K213Q, N109Q-N118Q-K213Q, N118Q-K213Q, S24E-A45Q-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109E-N118Q-K213Q, S24E-A45E-S101E-N109E-N118E-K213Q, S24E-A45E-S101E-N109E-N118E-K213E, S24L-A45Q-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109L-N118Q-K213Q, S24L-A45L-S101L-N109L-N118L-K213Q, S24L-A45L-S101L-N109L-N118L-K213L, S24R-A45Q-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109R-N118Q-K213Q, S24R-A45R-S101R-N109R-N118R-K213Q, S24R-A45R-S101R-N109R-N118R-K213R, S24E-A45R-S101R-N109R-N118R-K213R, S24E-A45E-S101R-N109R-N118R-K213R, S24E-A45E-S101E-N109R-N118R-K213R, S24E-A45E-S101E-N109E-N118R-K213R, S24E-A45E-S101E-N109E-N118E-K213R, S24E-A45E-S101E-N109E-N118E-K213E, S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217Q и S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217E, которые соответствуют положениям субтилизина BPN' SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего замену K213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, целлюлаз, пероксидаз, протеаз, металлопротеаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, пектат-лиаз, маннаназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-R45Q-S101Q-G118Q-T213Q, R45Q-S101Q-G118Q-T213Q, S101Q-G118Q-T213Q, G118Q-T213Q, S24E-R45Q-S101Q-G118Q-T213Q, S24E-R45E-S101Q-G118Q-T213Q, S24E-R45E-S101E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118E-T213Q, S24E-R45E-S101E-Q109E-G118E-T213E, S24L-R45Q-S101Q-G118Q-T213Q, S24L-R45L-S101Q-G118Q-T213Q, S24L-R45L-S101L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118L-T213Q, S24L-R45L-S101L-Q109L-G118L-T213L, S24R-R45Q-S101Q-G118Q-T213Q, S24R-S101Q-G118Q-T213Q, S24R-S101R-G118Q-T213Q, S24R-S101R-Q109R-G118Q-T213Q, S24R-S101R-Q109R-G118R-T213Q, S24R-S101R-Q109R-G118R-T213R, S24E-S101R-Q109R-G118R-T213R, S24E-R45E-S101R-Q109R-G118R-T213R, S24E-R45E-S101E-Q109R-G118R-T213R, S24E-R45E-S101E-Q109E-G118R-T213R, S24E-R45E-S101E-Q109E-G118E-T213R, S24E-R45E-S101E-Q109E-G118E-T213E, S24Q-R45Q-S101Q-G118Q-T213Q-L217Q и S24Q-R45Q-S101Q-G118Q-T213Q-L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего замену T213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-A45Q-S101Q-N109Q-N118Q-K213Q, A45Q-S101Q-N109Q-N118Q-K213Q, S101Q-N109Q-N118Q-K213Q, N109Q-N118Q-K213Q, N118Q-K213Q, S24E-A45Q-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109E-N118Q-K213Q, S24E-A45E-S101E-N109E-N118E-K213Q, S24E-A45E-S101E-N109E-N118E-K213E, S24L-A45Q-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109L-N118Q-K213Q, S24L-A45L-S101L-N109L-N118L-K213Q, S24L-A45L-S101L-N109L-N118L-K213L, S24R-A45Q-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109R-N118Q-K213Q, S24R-A45R-S101R-N109R-N118R-K213Q, S24R-A45R-S101R-N109R-N118R-K213R, S24E-A45R-S101R-N109R-N118R-K213R, S24E-A45E-S101R-N109R-N118R-K213R, S24E-A45E-S101E-N109R-N118R-K213R, S24E-A45E-S101E-N109E-N118R-K213R, S24E-A45E-S101E-N109E-N118E-K213R, S24E-A45E-S101E-N109E-N118E-K213E, S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217Q и S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217E, которые соответствуют положениям субтилизина BPN' SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В других вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере один вариант протеазы, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего замену K213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, и очищающая композиция дополнительно содержит один или несколько дополнительных ферментов или производных ферментов. Дополнительные ферменты или производные ферментов выбирают из гемицеллюлаз, пероксидаз, протеаз, металлопротеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, пергидролаз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидаз, хондроитиназ, лакказ и амилаз или их смесей. В некоторых вариантах осуществления изобретения очищающая композиция является детергентом. В некоторых вариантах осуществления изобретения детергент является детергентом для мытья посуды. В других вариантах осуществления изобретения детергент является стиральным детергентом, например, сверхсильным жидким или сухим стиральным детергентом. В альтернативных вариантах осуществления изобретения очищающая композиция дополнительно содержит по меньшей мере один стабилизатор.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина Bacillus, обладающего протеолитической активностью и включающего замену в двух или более положениях, выбираемых из положений 24, 45, 101, 109, 118, 213 и 217, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, R45Q, R45E, R45L, S101Q, S101E, S101L, S101R, Q109E, Q109L, Q109R, G118Q, G118E, G118L, G118R, T213Q, T213L, T213R, T213E, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего две или более замены в двух или более положениях, выбираемых из S24Q, S24E, S24L, S24R, A45Q, A45E, A45L, A45R, S101Q, S101E, S101L, S101R, N109Q, N109E, N109L, N109R, K213Q, K213E, K213L, K213R, L217Q и L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1, при этом указанный вариант имеет относительный индекс продуктивности уровня экспрессии белка (ТСА PI) и/или индекс продуктивности активности по удалению пятен (BMI PI), который выше или равен 0,5.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-R45Q-S101Q-G118Q-T213Q, R45Q-S101Q-G118Q-T213Q, S101Q-G118Q-T213Q, G118Q-T213Q, S24E-R45Q-S101Q-G118Q-T213Q, S24E-R45E-S101Q-G118Q-T213Q, S24E-R45E-S101E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118Q-T213Q, S24E-R45E-S101E-Q109E-G118E-T213Q, S24E-R45E-S101E-Q109E-G118E-T213E, S24L-R45Q-S101Q-G118Q-T213Q, S24L-R45L-S101Q-G118Q-T213Q, S24L-R45L-S101L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118Q-T213Q, S24L-R45L-S101L-Q109L-G118L-T213Q, S24L-R45L-S101L-Q109L-G118L-T213L, S24R-R45Q-S101Q-G118Q-T213Q, S24R-S101Q-G118Q-T213Q, S24R-S101R-G118Q-T213Q, S24R-S101R-Q109R-G118Q-T213Q, S24R-S101R-Q109R-G118R-T213Q, S24R-S101R-Q109R-G118R-T213R, S24E-S101R-Q109R-G118R-T213R, S24E-R45E-S101R-Q109R-G118R-T213R, S24E-R45E-S101E-Q109R-G118R-T213R, S24E-R45E-S101E-Q109E-G118R-T213R, S24E-R45E-S101E-Q109E-G118E-T213R, S24E-R45E-S101E-Q109E-G118E-T213E, S24Q-R45Q-S101Q-G118Q-T213Q-L217Q и S24Q-R45Q-S101Q-G118Q-T213Q-L217E, нумерация которых соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина GG36 Bacillus, обладающего протеолитической активностью и включающего замену T213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего комбинацию замен, выбираемых из положений S24Q-A45Q-S101Q-N109Q-N118Q-K213Q, A45Q-S101Q-N109Q-N118Q-K213Q, S101Q-N109Q-N118Q-K213Q, N109Q-N118Q-K213Q, N118Q-K213Q, S24E-A45Q-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101Q-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109Q-N118Q-K213Q, S24E-A45E-S101E-N109E-N118Q-K213Q, S24E-A45E-S101E-N109E-N118E-K213Q, S24E-A45E-S101E-N109E-N118E-K213E, S24L-A45Q-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101Q-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109Q-N118Q-K213Q, S24L-A45L-S101L-N109L-N118Q-K213Q, S24L-A45L-S101L-N109L-N118L-K213Q, S24L-A45L-S101L-N109L-N118L-K213L, S24R-A45Q-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101Q-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109Q-N118Q-K213Q, S24R-A45R-S101R-N109R-N118Q-K213Q, S24R-A45R-S101R-N109R-N118R-K213Q, S24R-A45R-S101R-N109R-N118R-K213R, S24E-A45R-S101R-N109R-N118R-K213R, S24E-A45E-S101R-N109R-N118R-K213R, S24E-A45E-S101E-N109R-N118R-K213R, S24E-A45E-S101E-N109E-N118R-K213R, S24E-A45E-S101E-N109E-N118E-K213R, S24E-A45E-S101E-N109E-N118E-K213E, S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217Q и S24Q-A45Q-S101Q-N109Q-N118Q-K213Q-L217E, которые соответствуют положениям субтилизина BPN' SEQ ID NO:1.
В другом варианте осуществления изобретения очищающая композиция содержит по меньшей мере 0,0001 мас.% по меньшей мере одного варианта субтилизина, который является зрелой формой выделенного варианта субтилизина FNA Bacillus, обладающего протеолитической активностью и включающего замену K213Q, нумерация которой соответствует аминокислотной последовательности субтилизина BPN' B. amyloliquefaciens, представленной как SEQ ID NO:1.
Другой вариант осуществления изобретения относится к способу очистки, который включает контактирование поверхности и/или изделия, включающего ткань, с любыми вышеуказанными очищающими композициями и необязательно промывание и/или прополаскивание указанной поверхности или изделия.
Краткое описание чертежей
На фигуре 1 показано сравнение зрелой формы исходных протеаз GG36 (SEQ ID NO:4) и FNA (SEQ ID NO:7) с BPN' (SEQ ID NO:1). За исключением особо оговоренных случаев положения замен указаны по отношению к BPN'.
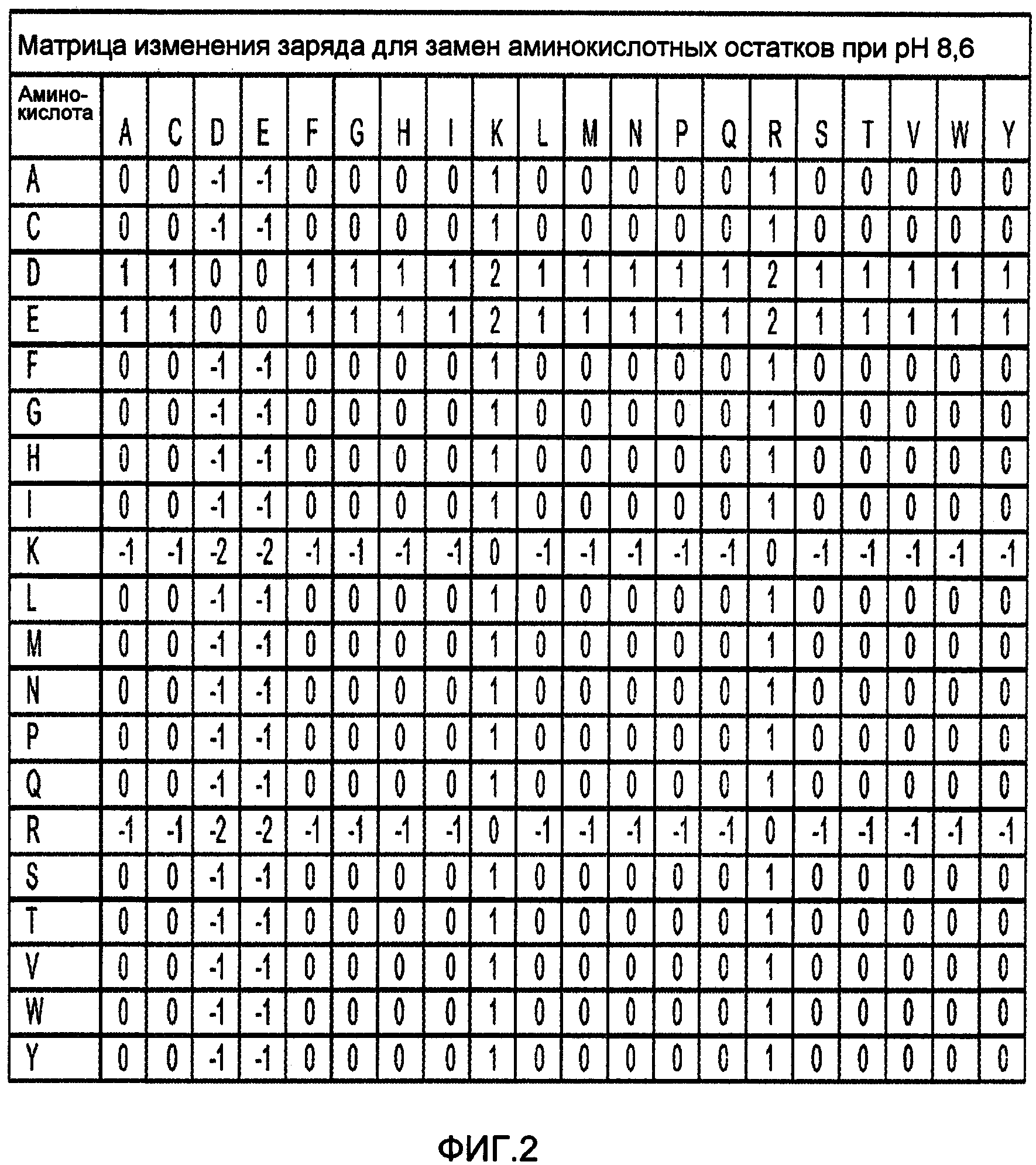
На фигуре 2 изображена матрица изменения заряда, показывающая изменение заряда для замен аминокислотных остатков при рН 8,6. На основании указанной матрицы можно легко определить изменение суммарного заряда вариантного фермента по сравнению с исходным ферментом.
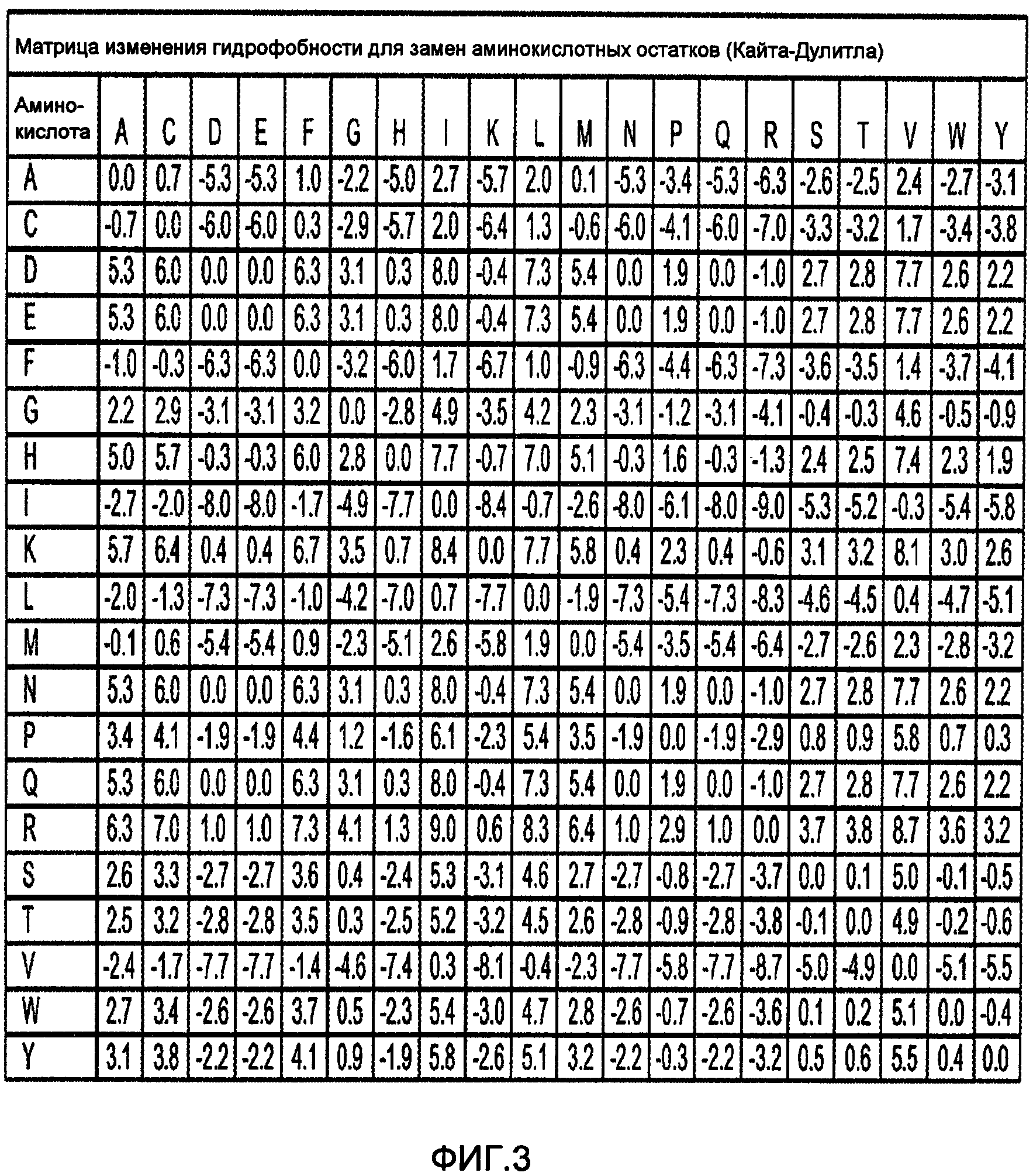
На фигуре 3 изображена матрица изменения гидрофобности Кайта-Дулитла, показывающая изменение гидрофобности для замен аминокислотных остатков. На основании указанной матрицы можно легко определить изменение суммарной гидрофобности вариантного фермента по сравнению с исходным ферментом.
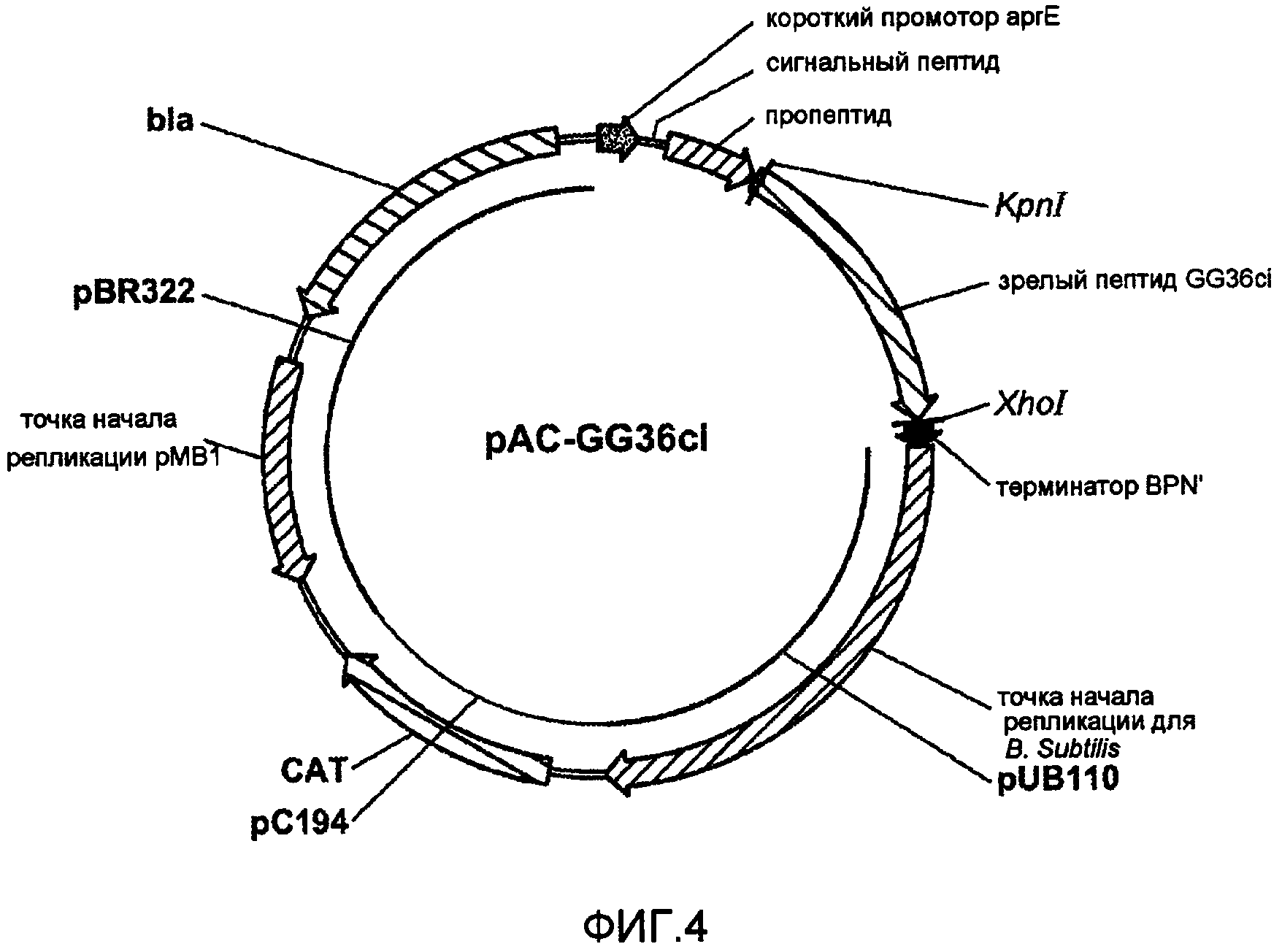
На фигуре 4 изображена карта pAC-GG36ci.
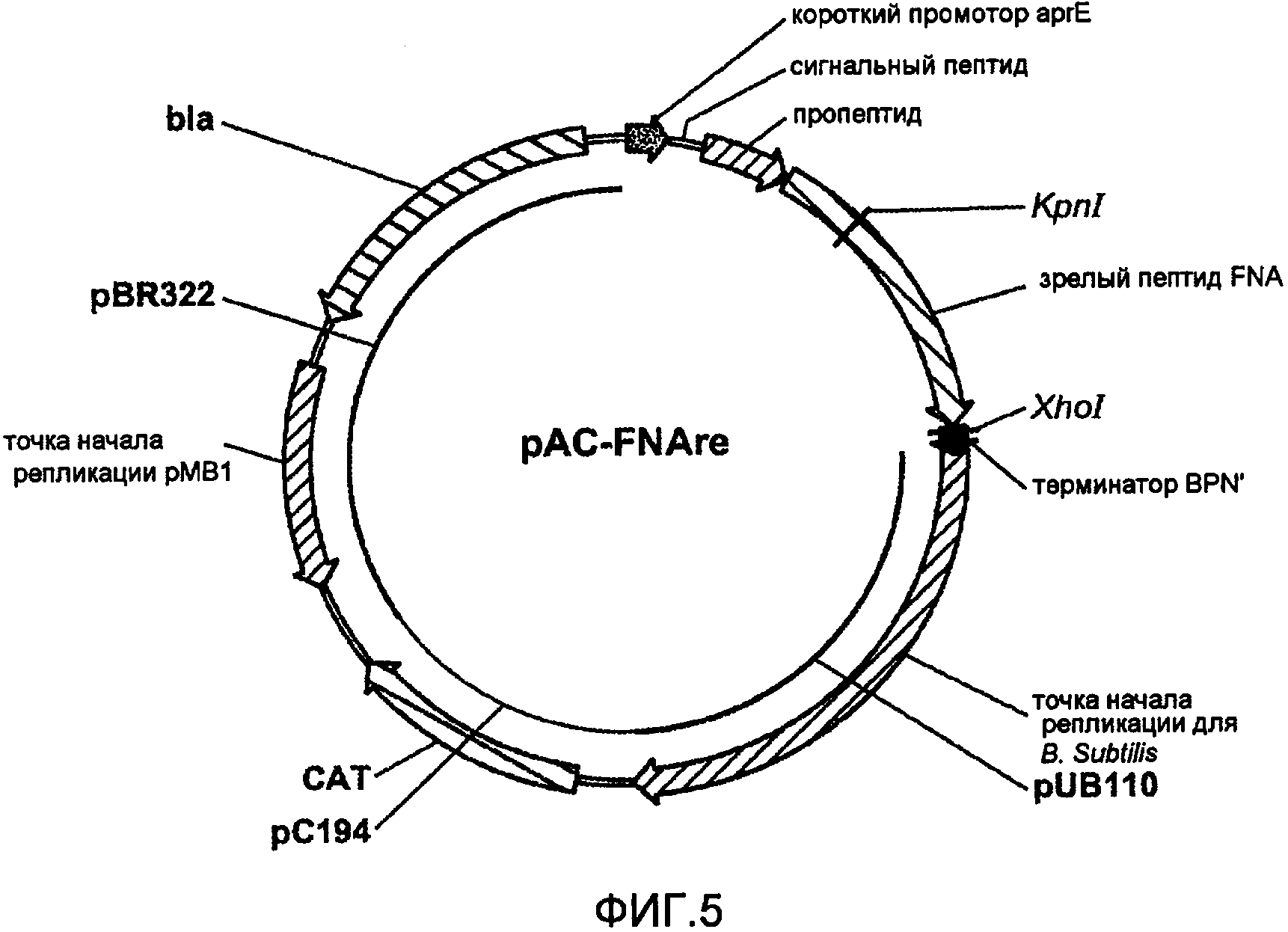
На фигуре 5 изображена карта pAC-FNAre.
Подробное описание изобретения
Настоящее изобретение относится к сконструированным вариантам протеаз. Варианты протеаз, в частности, включают комбинируемые мутации в выбранных положениях на поверхности фермента, которые влияют на заряд и/или гидрофобность фермента, усиливая по меньшей мере одно требуемое свойство полученного вариантного фермента в выбранном применении. Настоящее изобретение относится к композициям, содержащим варианты протеаз, и к способам их применения.
Как указано в настоящем описании изобретения, введение замен, влияющих на заряд и/или гидрофобность субтилизина, позволяет получить фермент, содержащий по меньшей мере одну комбинируемую мутацию, в результате чего образуется вариантная протеаза, имеющая индекс продуктивности по меньшей мере одного представляющего интерес свойства >0,5 по сравнению с исходным ферментом. Комбинируемые мутации повышают индекс продуктивности по меньшей мере одного требуемого свойства фермента в разных применениях. Представляющие интерес свойства включают, не ограничиваясь ими, заряд, гидрофобность, растворимость, продуктивность очистки, например, удаление пятен с ткани и/или твердых поверхностей, теплостойкость, устойчивость при хранении, устойчивость детергента, связывание с субстратом, ингибирование ферментов, уровень экспрессии, скорость реакции и разрушение субстрата. В некоторых вариантах осуществления изобретения представляющее интерес свойство является одним или несколькими свойствами, выбираемыми из заряда, гидрофобности, уровня экспрессии (ТСА PI) и продуктивности очистки, например, удаления пятен (BMI PI). Несмотря на то, что настоящее изобретение описано по отношению к протеазам, пятнам крови, молока и чернил (BMI), предполагается, что варианты протеаз по настоящему изобретению оптимизированы для любого взаимодействия фермента и субстратом в разных реакционных средах, определяемых применением, например, применениями, связанными с очисткой.
Ранее при создании более эффективных белков особое внимание уделялось минимизации связывания ферментов с поверхностями. Например, некоторые методы предполагали изменение последовательности субтилизина для получения вариантных ферментов с более низкой адсорбцией нерастворимыми субстратами (см., например, публикацию WO 95/07991). В другом методе было изменено значение pI субтилизина с целью получения вариантных ферментов с суммарным зарядом, равным нулю, при определенном значении рН (см., например, публикацию WO 91/00345). Однако в процессе разработки настоящего изобретения было установлено, что такие методы не всегда бывают успешными. При создании настоящего изобретения было обнаружено, что оптимальные значения поверхностных свойств ферментов обычно зависят от изменения поверхностного заряда и/или гидрофобности. Даже в случае ферментов, которые обычно являются достаточно активными, поверхностные свойства могут в значительной степени замедлять взаимодействие в некоторых условиях и с некоторыми субстратами по сравнению с другими условиями и/или другими субстратами. Некоторые варианты осуществления настоящего изобретения относятся к вариантным протеазам, у которых поверхностные свойства изменены в результате замены одной или нескольких аминокислот на поверхности фермента. При выполнении указанных изменений на сайтах поверхности, которые не взаимодействуют с любыми другими аминокислотами и не являются обязательными для функционирования фермента, свойства белка можно прогнозировать на основании свойств аминокислот, замененных в положениях, рассмотренных в настоящем описании изобретения.
Сайты можно легко определить на основании данных структуры; альтернативно можно произвести сравнительный анализ гомологичных последовательностей, исследовать данные библиотеки оценки сайтов и/или использовать любую комбинацию указанных методов. Для определения замен аминокислот и установления физических свойств белка, соответствующих свойствам замененных аминокислот, можно использовать матрицы оценки аминокислот (например, фигура 1) и/или шкалы гидрофобности (например, фигура 2).
Определения терминов
За исключением особо оговоренных случаев при осуществлении настоящего изобретения использованы стандартные методы, обычно применяемые в молекулярной биологии, микробиологии и методах рекомбинантных ДНК в данной области. Такие методы известны специалистам в данной области и описаны во многих публикациях и библиографических материалах, хорошо известных специалистам в данной области. Все патенты, заявки на патент, статьи и публикации, приведенные в настоящем изобретении, включены в настоящее описание изобретения в качестве ссылки.
За исключением особо оговоренных случаев все технические и научные термины, использованные в настоящем описании изобретения, имеют значения, известные специалистам в данной области, которым предназначено настоящее изобретение. Несмотря на то, что при осуществлении настоящего изобретения могут быть использованы любые методы и материалы, подобные или эквивалентные описанным в настоящем изобретении, некоторые предпочтительные методы и материалы рассмотрены в настоящем описании изобретения. Таким образом, приведенные ниже термины более полно представлены в полном тексте настоящего описания изобретения.
Формы единственного числа, использованные в настоящем описании изобретения, также включают формы множественного числа за исключением тех случаев, когда из контекста следует обратное. Диапазоны числовых значений охватывают все числа, указанные в таких диапазонах. За исключением особо оговоренных случаев нуклеиновые кислоты представлены слева направо в 5'-3' ориентации; аминокислотные последовательности представлены слева направо в направлении от аминоконца к карбоксильному концу. Очевидно, что настоящее изобретение не ограничено конкретными методами, процедурами и реагентами, описанными в настоящем изобретении, так как методы, процедуры и реагенты могут изменяться в зависимости от применений, осуществляемых специалистами в данной области.
Предполагается, что любое ограничение максимального числового значения, указанное в настоящем описании изобретения, включает ограничение всех более низких числовых значений, как если бы такие ограничения более низких числовых значений были указаны в тексте. Любое ограничение минимального числового значения, указанное в настоящем описании изобретения, включает ограничение всех более высоких числовых значений, как если бы такие ограничения более высоких числовых значений были указаны в тексте. Любой диапазон числовых значений, указанный в настоящем описании изобретения, охватывает все более узкие диапазоны числовых значений, входящие в такой более широкий диапазон числовых значений, как если бы такие более узкие диапазоны числовых значений были указаны в тексте.
Кроме того, заголовки, приведенные в настоящем описании изобретения, не ограничивают разные аспекты или варианты осуществления изобретения, которые могут относиться к настоящему описанию изобретения в целом. Таким образом, приведенные ниже термины более полно представлены в полном тексте настоящего описания изобретения. Тем не менее, чтобы облегчить понимание настоящего изобретения, ниже дано определение ряда терминов.
В настоящем описании термин ”индекс продуктивности (PI)” означает отношение характеристик вариантного фермента к характеристикам исходного или эталонного фермента в данном анализе. Индекс продуктивности (PI) очистки приведен в настоящем описании изобретения в виде способности удалять пятна крови, молока и чернил (BMI) и представлен в виде значения BMI PI. Индекс продуктивности (PI) уровня экспрессии приведен в настоящем описании изобретения в виде уровня продуцируемого белка, измеряемого путем осаждения трихлормолочной (ТСА) кислотой, и представлен в виде значения TCA PI.
В настоящем описании ”комбинируемые мутации” являются такими мутациями, при выполнении которых вариант имеет значение индекса продуктивности (PI) >0,5 по меньшей мере для одного свойства. Комбинируемые мутации являются такими мутациями, которые могут быть скомбинированы для получения белков, имеющих соответствующие индексы продуктивности для одного или нескольких требуемых свойств и включающих изменения заряда и/или гидрофобности. Положения таких мутаций можно классифицировать следующим образом: неограниченные положения = 20% нейтральных мутаций по меньшей мере для одного свойства и ограниченные положения имеют <20% нейтральных мутаций для активности и устойчивости.
Термин ”выделенный” или “очищенный” служит для определения вещества, удаленного из первоначального окружения (например, из естественной среды, в которой такое вещество находится в природе). Например, вещество считается ”очищенным”, когда оно присутствует в определенной композиции в более высокой или более низкой концентрации по сравнению с природным организмом или организмом дикого типа либо в комбинации с компонентами, которые обычно отсутствуют при экспрессии в природном организме или организме дикого типа. Например, природный полинуклеотид или полипептид, присутствующий в живом животном, не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех веществ, присутствующих вместе с ним в природной системе, является выделенным. В некоторых вариантах осуществления изобретения такие полинуклеотиды являются частью вектора и/или такие полинуклеотиды или полипептиды являются частью композиции, при этом они остаются выделенными, так как такой вектор или композиция не является частью природной среды. В предпочтительных вариантах осуществления изобретения нуклеиновая кислота или белок считается очищенным, если он образует по существу одну полосу в электрофорезном геле или блоте.
Термин ”выделенный” применительно к последовательности ДНК служит для определения последовательности ДНК, которая удалена из естественной генетической среды и, таким образом, освобождена от других посторонних или нежелательных кодирующих последовательностей и имеет форму, приемлемую для использования в системах продуцирования генетически созданного белка. Такие выделенные молекулы являются молекулами, отделенными от естественной среды, и включают кДНК и геномные клоны. Выделенные молекулы ДНК по настоящему изобретения не содержат других генов, с которыми они обычно ассоциированы, но могут включают природные 5'- и 3'-концевые нетранслированные области, такие как промоторы и терминаторы. Специалист в данной области может идентифицировать ассоциированные области (см., например, публикацию Dynan and Tijan, Nature 316:774-78 (1985)). Термин ”выделенная последовательность ДНК” альтернативно означает ”клонированную последовательность ДНК”.
Термин ”выделенный” применительно к белку служит для определения белка, находящегося в условиях, отличных от естественной среды. В предпочтительном виде выделенный белок по существу не содержит других белков, в частности, других гомологичных белков. Выделенный белок является чистым более, чем примерно на 10%, предпочтительно более, чем примерно на 20% и еще предпочтительнее более, чем примерно на 30%, при определении методом SDS-PAGE. Другими объектами настоящего изобретения являются белки в высоко очищенном виде (то есть очищенные более, чем примерно на 40%, более, чем примерно на 60%, более, чем примерно на 70%, более, чем примерно на 80%, более, чем примерно на 90%, более, чем примерно на 95%, более, чем примерно на 97% и даже более, чем примерно на 99%) при определении методом SDS-PAGE.
В настоящем описании термин ”исходный” белок означает белок, который модифицирован, например, путем замены одной или нескольких аминокислот с образованием одного или нескольких вариантов исходного белка. Таким образом, термины ”вариант протеазы” и “вариантная протеаза” относятся к исходным протеазам, которые подобны вариантной протеазе, особенно в отношении функции, но содержат мутации в аминокислотной последовательности, благодаря которым их последовательность отличается от исходной протеазы в положениях от одной до 20 аминокислот. Аминокислотные последовательности зрелой области типичных исходных протеаз показаны в сравнительном анализе на фигуре 1. FNA (SEQ ID NO:7) и GG36 (SEQ ID NO:4) являются зрелыми исходными протеазами, которые были модифицированы путем введения одной или нескольких комбинируемых замен с образованием вариантных протеаз по настоящему изобретению. GG36 является протеазой Bacillus lentus дикого типа, и FNA является протеазой BPN' Bacillus amyloliquefaciens, содержащей замену Y217L.
В настоящем описании термины ”протеаза” и “протеолитическая активность” означают белок или пептид, обладающий способностью гидролизовать пептиды или субстраты, имеющие пептидные связи. Хорошо известны многие методы измерения протеолитической активности (Kalisz, ”Microbial Proteinases,” In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology, (1988)). Например, протеолитическую активность можно определить при помощи сравнительных анализов, позволяющих измерить способность соответствующей протеазы гидролизовать коммерческий субстрат. Типичные субстраты, используемые в указанном анализе протеазы или протеолитической активности, включают, не ограничиваясь ими, диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). В данной области хорошо известны колориметрические анализы, в которых использованы указанные субстраты (см., например, публикацию WO 99/34011 и патент США № 6376450, которые включены в настоящее описание изобретения в качестве ссылки). Анализ pNA (см., например, публикацию Del Mar et al., Anal. Biochem., 99:316-320 (1979)) также может быть использован для определения концентрации активного фермента во фракциях, собранных во время градиентного элюирования. С помощью указанного анализа измеряют скорость высвобождения паранитроанилина в процессе гидролиза ферментом растворимого синтетического субстрата, сукцинил-аланин-аланин-пролин-фенилаланин-паранитроанилид (suc-AAPF-pNA). Скорость образования желтого цвета в результате гидролиза, которая пропорциональна концентрации активного фермента, измеряют спектрофотометром при 410 нм. Кроме того, для определения концентрации общего белка может быть измерена оптическая плотность при 280 нм. Чистоту фермента определяют на основании отношения активного фермента к общему белку.
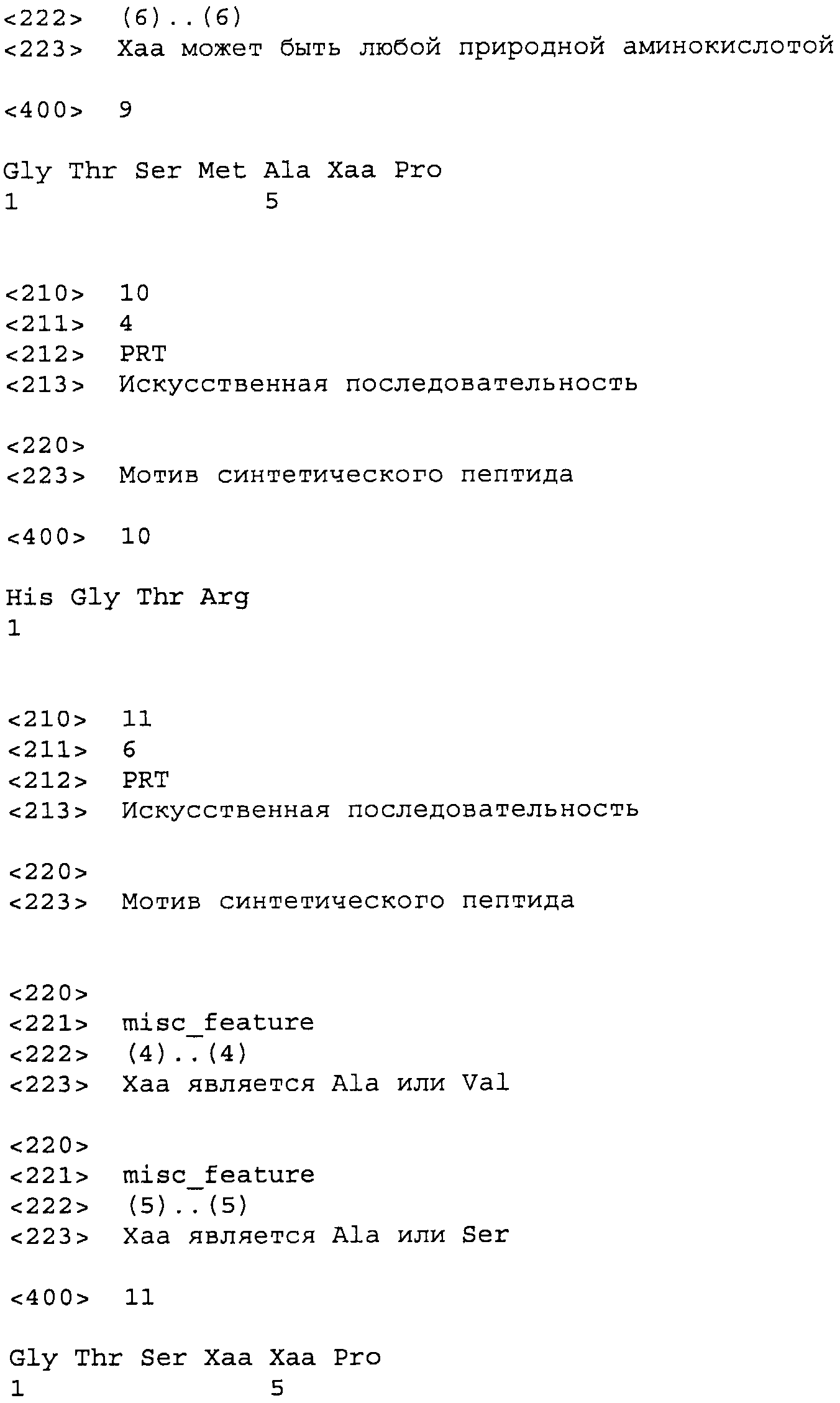
В настоящем описании термин ”субтилизин” означает любой член семейства сериновых протеаз S8, описанного в MEROPS, базе данных пептидаз (Rawlings et al., MEROPS: the peptidase database, Nucleic Acids Res., 34 Database issue, D270-272, 2006, на сайте merops.sanger.ac.uk/cgi-bin/merops.cgi?id=s08;action=.). Из MEROPS - базы данных пептидаз от 6 ноября 2008 г.- была получена следующая информация. Семейство пептидаз S8 содержит субтилизин сериновую эндопептидазу и его гомологи (Biochem. J., 290:205-218, 1993). Семейство S8, известное также как семейство субтилаз, является вторым по величине семейством сериновых пептидаз и может быть разделено на два подсемейства, включающших субтилизин (S08.001), являющийся типичным примером для подсемейства S8A, и кексин (S08.070), являющийся типичным примером для подсемейства S8B. Ранее считалось, что трипептидилпептидаза II (TPP-II; S08.090) является типичным примером третьего подсемейства, но в настоящее время установлено, что такая классификация является неправильной. Члены семейства S8 содержат в последовательности каталитическую триаду, состоящую из остатков Asp, His и Ser, расположенных в другом порядке по сравнению с семействами S1, S9 и S10. В подсемействе S8A остатки активного центра часто встречаются в повторяющемся фрагменте Asp-Thr/Ser-Gly (который подобен повторяющемуся фрагменту последовательности в семействах аспарагиновых эндопептидаз в группе АА), His-Gly-Thr-His и Gly-Thr-Ser-Met-Ala-Xaa-Pro. В подсемействе S8B каталитические остатки часто встречаются в повторяющихся фрагментах Asp-Asp-Gly, His-Gly-Thr-Arg и Gly-Thr-Ser-Ala/Val-Ala/Ser-Pro. Большинство членов семейства S8 являются эндопептидазами, проявляющими активность при нейтральных и средних щелочных значения рН. Многие пептидазы в указанном семействе являются теплостойкими. Казеин часто используется в качестве белкового субстрата, и типичным синтетическим субстратом является suc-AAPF. Большинство членов указанного семейства являются неспецифическими пептидазами, которые предпочтительно расщепляют последовательность после гидрофобных остатков. Однако члены подсемейства S8B, такие как кексин (S08.070) и фурин (S078.071) расщепляют последовательность после двухосновных аминокислот. Большинство членов семейства S8 подавляются ингибиторами сериновых пептидаз, такими как DFP и PMSF. Так как многие члены указанного семейства связываются с кальцием для устойчивости, ингибирование может происходить под воздействием EDTA и EGTA, которые часто считаются специфичными ингибиторами металлопептидаз. Ингибиторы белка включают третий домен овомукоида индейки (I01.003), ингибитор субтилизина Streptomyces (I16.003) и члены семейства 113, такие как эглин С (I13.001) и ингибитор ячменя CI-1A (I13.005), многие из которых также ингибируют химотрипсин (S01.001). Пропептид субтилизина сам по себе обладает ингибирующей активностью, и ингибитор гомологичной протеиназы В из Saccharomyces ингибирует церевизин (S08.052). В настоящее время определены третичные структуры нескольких членов семейства S8. Типичная структура белка S8 состоит из трех слоев с семицепочечной β-складкой между двумя слоями спиралей. Субтилизин (S08.001) имеет типичную структуру для группу SB (SB). Несмотря на разную структуру активные центры субтилизина и химотрипсина (S01.001) могут налагаться друг на друга, из чего следует, что сходство является результатом конвергентной эволюции, а не дивергентной эволюции.
В настоящем описании термины ”Bacillus” и “род Bacillus” включают все виды в роду “Bacillus”, известные специалистам в данной области, которые включают, не ограничиваясь ими, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Известно, что род Bacillus находится в процессе таксономическлй реорганизации. Таким образом, считается, что данный род включает переклассифицированные виды, которые включают, не ограничиваясь ими, такие организмы как B. stearothermophilus, который в настоящее время именуется ”GeoBacillus stearothermophilus”. Образование устойчивых эндоспор в присутствии кислорода считается определяющим признаком рода Bacillus, хотя данная характеристика также применима к организмам, именуемым в настоящее время AlicycloBacillus, AmphiBacillus, AneuriniBacillus, AnoxyBacillus, BreviBacillus, FiloBacillus, GraciliBacillus, HaloBacillus, PaeniBacillus, SaliBacillus, ThermoBacillus, UreiBacillus и VirgiBacillus.
Термины ”белок” и “полипептид” имеют взаимозаменяемые значения в настоящем описании изобретения. В настоящем описании изобретения использован трехбуквенный код для аминокислот, утвержденный Объединенной комиссией по биохимической номенклатуре IUPAC-IUB (JCBN). Кроме того, известно, что полипептид может быть кодирован несколькими нуклеотидными последовательностями вследствие вырожденности генетического кода.
“Пропоследовательность” является аминокислотной последовательностью, расположенной между сигнальным пептидом и зрелой областью протеазы. Пропоследовательность отщепляется в процессе созревания, в результате чего образуется активная зрелая форма протеазы.
Термин ”сигнальная последовательность” или “сигнальный пептид” означает любую последовательность нуклеотидов и/или аминокислот, которые участвуют в секреции зрелых или предшествующих форм белка. Данное определение сигнальной последовательности является функциональным и включает все аминокислотные последовательности, кодированные N-концевой частью гена белка, которые участвуют в секреции белка. Указанные последовательности часто, но не всегда, связаны с N-концевой частью белка или N-концевой частью белка-предшественника. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность может быть связана с белком (например, протеаза) или может относиться к гену, кодирующему другой секретируемый белок. Одна типичная экзогенная сигнальная последовательность включает первые семь аминокислотных остатков сигнальной последовательности субтилизина B. subtilis, гибридизированных с остальной частью сигнальной последовательности субтилизина B. lentus (ATCC 21536).
Термин ”гибридная сигнальная последовательность” означает сигнальные последовательности, в которых часть последовательности получена из экспрессирующего хозяина и гибридизирована с сигнальной последовательностью экспрессируемого гена. В некоторых вариантах осуществления изобретения использованы синтетические последовательности.
Термин ”зрелая” форма белка или пептида означает конечную функциональную форму белка или пептида. В частности, зрелая форма протеазы FNA по настоящему изобретению включает аминокислотную последовательность SEQ ID NO:7, в то время как зрелая форма протеазы GG36 включает аминокислотную последовательность SEQ ID NO:4.
Термин ”предшественник”, использованный в настоящем описании изобретения, означает форму белка или пептида, имеющего пропоследовательность, функционально связанную с аминоконцом или карбоксильным концом зрелого белка. В частности, SEQ ID NO:3 и 6 являются соответственно последовательностями предшественников зрелого GG36 (SEQ ID NO:4) и FNA (SEQ ID NO:7). Предшественник может также иметь ”сигнальную” последовательность, функционально связанную с аминоконцом пропоследовательности. Предшественник может также иметь дополнительные полинуклеотиды, определяющие посттрансляционную активность (например, полинуклеотиды, отщепляемые с образованием зрелой формы белка или пептида).
Термины ”природный фермент” и “природный белок” означают фермент или белок, имеющий немодифицированную аминокислотную последовательность, идентичную последовательности, встречающейся в природе. Природные ферменты включают нативные ферменты, ферменты, экспрессированные естественным путем или обнаруженные в определенном микроорганизме.
Термины ”выделенный из” и “полученный из” относятся не только к ферменту (например, протеазе), продуцированному или продуцируемому рассматриваемым штаммом организма, но также к ферменту, кодированному последовательностью ДНК, выделенной из такого штамма, и продуцированному в организме-хозяине, содержащем такую последовательность ДНК. Кроме того, данный термин относится к ферменту, кодированному синтетической последовательностью ДНК и/или кДНК и обладающему характеристиками, идентифицирующими рассматриваемый фермент.
“Производное” в контексте данного определения обычно сохраняет характерную протеолитическую активность, присущую дикому типу, нативной или исходной форме в той степени, в которой данное производное пригодно для тех же целей, что и форма дикого типа, нативная или исходная форма. Функциональные производные ферментов включают природные, синтетические или рекомбинантно полученные пептиды или фрагменты пептидов, обладающие общими характеристиками исходного фермента.
В настоящем описании фраза ”в соответствии с” относится к остатку, находящемуся в положении в белке или пептиде, определяемому в соответствии с общепринятой нумерацией.
В настоящем описании термины ”замененный” и “замены” означают замену одного или нескольких аминокислотных остатков или оснований нуклеиновой кислоты в исходной последовательности. В некоторых вариантах осуществления изобретения такая замена предполагает замену природного остатка или основания. В некоторых вариантах осуществления изобретения заменяют две или более аминокислоты с образованием вариантной протеазы, включающей комбинацию замен аминокислот. В некоторых вариантах осуществления изобретения комбинации замен обозначены положением аминокислоты, в котором произведена замена. Например, комбинация, обозначенная Е6А-E30G, означает, что глутаминовая кислота (Е) в положении 6 заменена аланином (А) и глутаминовая кислота (Е) в положении 30 заменена глицином (G). Положения аминокислот указаны в соответствии с нумерацией положения в зрелой области субтилизина BPN' (SEQ ID NO:1).
Фраза ”замена в двух или более положениях” означает комбинацию из двух или более замен, выполненных в одном белке. Таким образом, термин ”замена в двух или более положениях” означает любую комбинацию из замен 2, 3, 4, 5, 6 и 7 аминокислот.
В настоящем описании термины ”экспрессирующий кластер” и ”экспрессирующий вектор” означают конструкции на основе нуклеиновой кислоты, созданные рекомбинантными или синтетическими методами при наличии ряда элементов указанной нуклеиновой кислоты, делающих возможной транскрипцию определенной нуклеиновой кислоты в клетке-мишени. Рекомбинантный экспрессирующий кластер может быть введен в плазмиду, хромосому, митохондриальную ДНК, ДНК пластиды, вирус или фрагмент нуклеиновой кислоты. Рекомбинантный экспрессирующий кластер, являющийся частью экспрессирующего вектора, обычно включает, наряду с другими последовательностями, транскрибируемую последовательность нуклеиновой кислоты и промотор. В предпочтительных вариантах осуществления изобретения экспрессирующие векторы способны включать и экспрессировать фрагменты гетерологичной ДНК в клетке-хозяине. Многие прокариотические и эукариотические экспрессирующие векторы являются коммерчески доступными. Специалисты в данной области обладают необходимыми знаниями для выбора соответствующих экспрессирующих векторов. Термин ”экспрессирующий кластер” имеет взаимозаменяемое значение с термином ”конструкция на основе ДНК” и его грамматическими эквивалентами. Специалисты в данной области обладают необходимыми знаниями для выбора соответствующих экспрессирующих векторов.
В настоящем описании термин ”вектор” означает полинуклеотидную конструкцию, созданную для введения нуклеиновых кислот в клетки одного или нескольких типов. Векторы включают клонирующие векторы, экспрессирующие векторы, шаттл-векторы, плазмиды, кластеры и тому подобные. В некоторых вариантах осуществления изобретения полинуклеотидная конструкция включает последовательность ДНК, кодирующую протеазу (например, предшественник или зрелую протеазу), которая функционально связана с приемлемой пропоследовательностью (например, секреторной и т.д.), способной экспрессировать ДНК в приемлемом хозяине.
В настоящем описании термин ”плазмида” означает конструкцию на основе кольцевой двухцепочечной (дц) ДНК, используемую в качестве клонирующего вектора, которая образует внехромосомный самореплицирующийся генетический элемент в некоторых эукариотах или прокариотах или встраивается в хромосому хозяина.
В настоящем описании термин ”штамм-хозяин” или “клетка-хозяин” означает приемлемого хозяина для экспрессирующего вектора, включающего ДНК по настоящему изобретению.
В настоящем описании термины ”очищающие композиции” и “очищающие препараты” означают композиции, которые используются для удаления нежелательных соединений с подлежащих очистке изделий, таких как ткань, посуда, контактные линзы, другие твердые субстраты, волосы (шампуни), кожа (мыла и кремы), зубы (полоскания для рта, зубные пасты) и т.д. В определение данного термина входят любые вещества/соединения, выбираемые для определенного типа очищающей композиции и формы продукта (например, жидкая, гелеобразная, гранулированная, порошкообразная или распыляемая композиция), используемого в композиции. Вещества, входящие в состав очищающей композиции, могут быть легко выбраны с учетом подлежащей очистке поверхности, изделия или ткани и желаемой формы композиции для определенных условий очистки.
Указанные термины далее относятся к любой композиции, пригодной для очистки, отбеливания, дезинфекции и/или стерилизации любого предмета и/или поверхности. Считается, что указанные термины включают, не ограничиваясь ими, детергентные композиции (например, жидкие и/или твердые стиральные детергенты и детергенты для деликатных тканей; препараты для очистки твердых поверхностей, таких как стеклянные, деревянные, керамические и металлические прилавки и окна; средства для очистки ковров; средства для очистки плит; освежители тканей, средства, придающие тканям мягкость, и средства для удаления пятен с тканей, а также средства для мытья посуды).
Термин ”очищающая композиция” в настоящем описании означает, за исключением особо оговоренных случаев, сухие, например, гранулированные или порошкообразные универсальные или сверхсильные моющие средства, в частности, очищающие детергенты; жидкие, гелеобразные или пастообразные универсальные моющие средства, в частности, так называемые сверхсильные жидкие средства (HDL); жидкие детергенты для деликатных тканей; средства для мытья посуды руками или сверхсильные средства для мытья посуды, в частности, сильнопенящиеся средства; средства для мытья посуды в посудомоечных машинах, включающие разные таблетированные, гранулированные, жидкие средства и прополаскивающие средства для использования в домашнем хозяйстве и в учреждениях; жидкие очищающие и дезинфицирующие средства, включающие антибактериальные моющие средства, предназначенные для мытья руками, очищающие бруски, полоскания для рта, средства для очистки зубных протезов, шампуни для машин или ковров, средства для очистки ванных комнат; шампуни и кондиционеры для волос; гели для душа и пены для ванны, средства для очистки металлических поверхностей, а также вспомогательные очищающие средства, такие как отбеливающие добавки, карандаши для удаления пятен или средства для предварительной обработки.
В настоящем описании термин “композиции для очистки ткани” означает детергентные композиции для ручной и машинной стирки, включающие композиции стиральных добавок и композиции, предназначенные для замачивания и/или предварительной обработки тканей с пятнами (например, одежды, простыней и других текстильных изделий).
В настоящем описании термин ”композиции для очистки изделий, отличных от тканей” означает композиции для очистки поверхностей, не являющихся текстильными изделиями (то есть тканями), которые включают, не ограничиваясь ими, детергентные композиции для мытья посуды, композиции для полоскания рта, композиции для очистки зубных протезов и композиции для личной гигиены.
В настоящем описании термины ”детергентная композиция” и “детергентный препарат” означают смеси, предназначенные для использования в качестве моющей среды для очистки загрязненных предметов. В предпочтительных вариантах осуществления изобретения указанный термин означает детергенты, используемые для мытья посуды, ножевых изделий и т.д. (например, ”детергенты для посуды” или “детергенты для мытья посуды”). Настоящее изобретение не ограничено каким-либо конкретным детергентным препаратом или композицией. Предполагается, что, помимо детергентов, содержащих по меньшей мере одну протеазу по настоящему изобретению, в определение данного термина входят детергенты, содержащие поверхностно-активные вещества, трансферазы, гидролитические ферменты, оксидоредуктазы, структурообразователи, отбеливатели, активаторы отбеливания, синьку и флуоресцентные красители, ингибиторы слеживания, маскирующие агенты, активаторы ферментов, антиоксиданты и растворители.
В настоящем описании термин ”композиция для мытья посуды” означает все формы композиций, предназначенных для очистки посуды, в том числе ножевых изделий, которые включают, не ограничиваясь ими, гранулированные и жидкие формы. Настоящее изобретение не ограничено каким-либо конкретным типом композиции для мытья посуды. Настоящее изобретение может быть использовано для очистки посуды (включающей, не ограничиваясь ими, тарелки, чашки, стаканы, кастрюли и т.д.) и ножевых изделий (включающих, не ограничиваясь ими, ложки, ножи, вилки, предметы сервировки и т.д.), изготовленных из любого материала, включающего без каких-либо ограничений керамику, пластики, металлы, фарфор, стекло, акрилы и т.д. Термин ”столовая посуда” в настоящем описании означает как посуду, так и ножевые изделия.
В настоящем описании термин ”не содержащие фосфата детергенты для мытья посуды” означает детергенты, содержащие не более 0,5% фосфора (то есть фосфор является микроэлементом).
В настоящем описании термин ”продуктивность мытья” или ”продуктивность очистки” вариантной протеазы означает вклад, вносимый вариантной протеазой в очищающую способность очищающей композиции по сравнению с композицией, полученной без использования варианта протеазы.
Термин ”приемлемые условия мытья” в настоящем описании означает условия, в частности, температуру мытья, время, моющие устройства, концентрацию мыльной пены, тип детергента и жесткость воды, фактически используемые в домашнем хозяйстве и учитываемые на рынке детергентов для мытья посуды или стиральных детергентов.
Термин ”более высокая продуктивность мытья” означает достижение лучшего конечного результата при удалении пятен в приемлемых условиях мытья или необходимость использования меньшего количества вариантной протеазы в расчете на массу для достижения конечного результата, сравнимого с использованием соответствующей протеазы дикого типа или исходной протеазы.
В использованное здесь значении термин ”дезинфекция” означает удаление грязи с поверхностей, а также ингибирование или уничтожение микробов на поверхностях изделий. Настоящее изобретение не ограничено какой-либо конкретной поверхностью, изделием, загрязнениями или удаляемыми микробами.
В настоящем описании термин ”эффективное количество фермента” означает количество фермента, необходимое для достижения ферментативной активности, требуемой в конкретном применении (например, продукт для личной гигиены, очищающая композиция и т.д.). Такие эффективные количества, которые может легко определить специалист в данной области, зависят от многих факторов, таких как используемый вариант фермента, применение, конкретный состав очищающей композиции, необходимость использования жидкой или сухой композиции (например, в виде гранул или бруска) и тому подобных.
“Компактность” очищающих композиций лучше всего можно определить по плотности и в случае композиции по количеству неорганической наполняющей соли. Неорганические наполняющие соли являются обычными ингредиентами детергентных композиций в порошкообразной форме. В стандартных детергентных композициях наполняющие соли присутствуют в значительных количествах, обычно от около 17% до около 35 мас.% от общей массы композиции. В отличие от этого в компактных композициях наполняющая соль присутствует в количествах, не превышающих примерно 15% от общей массы композиции. В некоторых вариантах осуществления изобретения наполняющая соль присутствует в количествах, не превышающих примерно 10%, или более предпочтительно примерно 5 мас.% композиции. В некоторых вариантах осуществления изобретения неорганические наполняющие соли выбирают из солей щелочных и щелочно-земельных металлов, таких как сульфаты и хлориды. Предпочтительной наполняющей солью является сульфат натрия.
В настоящем описании термин ”дополнительный ингредиент” или “дополнительное вещество” означает очищающие вещества, которые включают, не ограничиваясь ими, поверхностно-активные вещества, структурообразователи, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, системы стабилизации ферментов, хелатообразователи, оптические отбеливатели, грязеотталкивающие полимеры, средства, обеспечивающие перенос красителя, диспергаторы, вещества, уменьшающие мыльную пену, красители, ароматизаторы, пигменты, наполняющие соли, гидротропы, фотоактиваторы, флуоресцентные вещества, кондиционеры ткани, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные средства, средства, снижающие сминаемость, гермициды, фунгициды, усилители цвета, средства для ухода за серебряными изделиями, средства против потускнения и/или коррозии, щелочные средства, растворители, носители, ускорители обработки, пигменты и средства, регулирующие значение рН (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, которые включены в настоящее описание изобретения в качестве ссылки).
В настоящем описании термин ”композиция для мытья посуды” означает все формы композиций для очистки посуды, которые включают, не ограничиваясь ими, гранулированные и жидкие формы.
В настоящем описании термин ”композиция для очистки тканей” означает все формы детергентных композиций для очистки тканей, которые включают, не ограничиваясь ими, гранулированные, жидкие формы и в виде бруска.
В настоящем описании термин ”ткань” означает любой текстильный материал. Таким образом, в определение данного термина входят предметы одежды, а также ткани, пряжа, волокно, нетканые материалы, натуральные материалы, синтетические материалы и любые другие текстильные материалы.
В настоящем описании термин ”текстиль” означает тканые материалы, а также волокно и нити, предназначенные для использования в качестве пряжи, тканых, вязаных и нетканых материалов. В определение данного термина входит пряжа, изготовленная из природных и синтетических волокон (например, произведенных промышленными методами).
В настоящем описании термин ”текстильные материалы” является общим термином для обозначения волокна, материалов, используемых для получения пряжи, пряжи, тканей и изделий, изготовленных из тканей (например, одежды и других изделий).
В большинстве способов, применяемых в настоящее время для улучшения продуктивности белка в промышленных, домашних и фармацевтических областях применения, особое внимание уделяется замене аминокислот в активном центре или рядом с активным центром фермента с целью повышения каталитической эффективности. Однако в процессе создания настоящего изобретения было установлено, что мутации на любом участке поверхности фермента повышают продуктивность фермента значительно выше уровня, достигаемого при улучшении каталитической эффективности. Скорость реакции, определяющая превращение субстратов в продукты, опосредованное ферментами, лишь частично контролируется скоростью химической каталитической конверсии. Ферменты и субстраты взаимодействуют в виде коллоидов до их ассоциации в виде субстрат-ферментных ES комплексов, а также во время диссоциации из продукт-ферментного ЕР комплекса, образующегося после химической конверсии. Даже если данная стадия реакция протекает с высокой скоростью, доступ фермента к субстрату может быть чрезвычайно медленным (например, ограниченным диффузией), как это имеет место в случае одинаково заряженных коллоидов, находящихся под воздействием сил электростатического отталкивания. Аналогичным образом высвобождение фермента из продукт-ферментного ЕР комплекса может быть чрезвычайно медленным (например, ограниченным диффузией), как это имеет место в случае коллоидов, находящихся под воздействием короткодействующих гидрофобных и дисперсионных сил притяжения. Оба состояния увеличивают время перехода фермента из субстрата в продукт и ограничивают скорость реакции по сравнению с химической конверсией. Несмотря на то, что противоположно заряженные коллоиды, по-видимому, будут ускорять образование ES комплексов (например, выше предела диффузии), последующая диссоциация ЕР комплекса будет очень медленной (если предположить, что никакие заряды не будут образованы или потеряны), при этом общая скорость реакции снизится. Поэтому для достижения минимального времени перехода для ES и ЕР комплексов используется асимметрия потенциала парного взаимодействия. Такой подход особенно важен в промышленной биотехнологии, так как желательно превратить весь субстрат в продукт в течение наименьшего времени, возможного в условиях, которые часто ограничены ферментом. В историческом плане создатели белков обращали особое внимание на специфическое взаимодействие фермента с субстратом на стадии химической конверсии и не признавали значения коротких и длительных неспецифических взаимодействий, возникающих в результате воздействия коллоидных и поверхностных сил межмолекулярного взаимодействия, регулирующих стадии ассоциации и диссоциации. Целью настоящего изобретения является создание вариантов протеаз с измененными поверхностными свойствами, полученными в результате изменения природы одной или нескольких аминокислот на поверхности фермента, которые оптимизируют силы межмолекулярного взаимодействия до такого уровня, при котором стадия химической конверсии начинает ограничивать скорость реакции.
Модификация поверхностных свойств достигается путем замен аминокислот, изменяющих заряд и/или гидрофобность фермента, способами по настоящему изобретению. Как только стадия химической конверсии начинает ограничивать скорость реакции, дальнейшее увеличение продуктивности вариантного фермента может быть достигнуто в результате изменений в активном центре фермента. Данная целью может быть достигнута, если субстрат является мелким пептидом в растворе или нерастворимым макроскопическим субстратом. Тем не менее для создания и использования настоящего изобретения необязательно знать механизм, лежащий в его основе. Кроме того, считается, что настоящее изобретение не ограничено каким-либо конкретным механизмом.
Способы, используемые для создания вариантов протеазы по настоящему изобретению, включают (I) анализ белков-зондов в определенном диапазоне физического свойства; (II) определение оптимального значения физического свойства для данного благоприятного результата; и (III) получение вариантных белков с оптимальным значением физического свойства.
I. Анализ белков-зондов
Анализ белков-зондов включает исследование множества белков-зондов (то есть ”укладки цепи белков-зондов”) в определенном диапазоне представляющего интерес физического свойства (то есть ”представляющее интерес свойство”) при выполнении соответствующего анализа. Белки-зонды включают ограниченную совокупность белков и/или их вариантов. В некоторых типичных вариантах осуществления изобретения по меньшей мере одну сериновую протеазу исследуют в отношении одного или нескольких благоприятных свойств. Например, изменяют суммарный заряд варианта по сравнению с исходным ферментом для двух сериновых протеаз, GG36 и FNA. Изменение суммарного заряда для вариантов GG36 и FNA по настоящему изобретению производят в относительном диапазоне изменения суммарного заряда от -7 до 0 по сравнению с соответствующими исходными ферментами.
II. Определение оптимального значения физического свойства
Определение оптимального значения физического свойства, то есть определение оптимального значения представляющего интерес свойства, предполагает определение оптимального значения или диапазона оптимальных значений физического свойства, необходимого для достижения благоприятного результата. В некоторых типичных вариантах осуществления изобретения измеряют индекс продуктивности очистки, определяемый в настоящем описании изобретения как BMI PI вариантов протеаз FNA и GG36. В других вариантах осуществления изобретения измеряют уровень экспрессии, определяемый в настоящем описании изобретения как ТСА PI вариантов протеаз FNA и GG36. В вариантах осуществления настоящего изобретения при сравнении преимуществ, достигаемых при использовании белков с одинаковой укладкой цепи, то есть сериновых протеаз, используют отношение (например, отношение суммарного заряда вариантов протеаз к белку дикого типа или исходному белку). Альтернативно при сравнении преимуществ, достигаемых при использовании белков с разной укладной цепи, например, сериновых протеаз и металлопротеаз, используют шкалу общих физических свойств (например, заряд белка, определяемый как дзета-потенциал). Используют белки-зонды, охватывающие широкий диапазон физического свойства для увеличения вероятности определения оптимального значения для данного физического свойства. После определения оптимального значения или оптимального диапазона для достижения благоприятного результата в результате анализа белков-зондов можно прогнозировать общее направление и величину изменения, необходимые для превращения менее эффективного продукта (например, находящегося за пределами оптимального диапазона) в более эффективный продукт (например, входящий в оптимальный диапазон).
Использование нескольких белков-зондов позволяет идентифицировать разные оптимальные значения физического свойства для достижения требуемого благоприятного результата. Например, в некоторых вариантах осуществления изобретения исследуют изменения суммарного заряда и гидрофобности по сравнению с исходным ферментом детергентных протеаз GG36 и FNS при выполнении анализов очистки пятен крови, молока и чернил. В некоторых случаях одно и то же физическое свойство имеет разные оптимальные значения, необходимые для достижения разных благоприятных результатов. Например, существует оптимальный заряд протеазы, определяющий продуктивность очистки для FNA (BMI PI), который отличается от оптимального заряда протеазы для уровня экспрессии (ТСА PI).
В некоторых вариантах осуществления изобретения физические свойства, определяемые зарядом, сравнивают у исходных и вариантных белков путем измерения дзета-потенциала, суммарного заряда, плотности заряда и/или числа поверхностных ионизируемых групп. Как правило, для сравнения укладки цепи разных белков может быть использован любой метод определения заряда белка, в том числе титрование или электрофоретические измерения. Разные варианты белков сравнивают, вычисляя одну или несколько вышеуказанных величин на основании имеющейся информации о первичных, вторичных и/или третичных последовательностях белка. Типичные устройства, используемые в области биоинформатики для указанных целей, включают устройства для вычисления изоэлектрической точки на основании уравнения Хендерсона-Хассельбаха (например, European Molecular Biology Laboratory) или электростатические счетно-решающие приборы Поиссона-Больцмана (например, DelPhi, MOE).
III. Получение вариантных белков с оптимальным значением физического свойства
После определения оптимального значения или диапазона на предыдущей стадии получают множество белков-кандидатов, обладающих представляющим интерес физическим свойством. Приемлемые методы получения белков-кандидатов включают, не ограничиваясь ими, получение искусственных вариантов ферментов методами рекомбинантных ДНК, а также очистку природных вариантов ферментов (например, гомологов) при помощи хроматографии, синтез in vitro гликозилированных или фосфорилированных вариантов ферментов или получение in vitro конъюгатов ферментов. Другим способом изменения гидрофобности белка путем гликозилирования является создание новых сайтов гликозилирования на поверхности фермента. Указанные варианты будут гликозилированы in vivo во время экспрессии.
В некоторых вариантах осуществления изобретения физические свойства, связанные с гидрофобностью, сравнивают у вариантов протеаз в отношении вклада, вносимого замененными остатками в суммарный заряд и гидрофобность полученного варианта по сравнению с исходным ферментом. В некоторых вариантах осуществления изобретения общий вклад в гидрофобность вычисляют при помощи одной или нескольких шкал гидрофобности аминокислот, представленных в научной литературе и известных специалистам в данной области, с учетом информации о первичной, вторичной и/или третичной структуре белка. В тех случаях, когда физические свойства, связанные с гидрофобностью, сравнивают у белков с разной укладной цепи, измеряют распределение белка между естественной водной средой и гидрофобной фазой. Такие примеры включают, не ограничиваясь ими, поверхностное натяжение на поверхности раздела вода-воздух или вода-гептан, а также краевой угол и смачивание между водной фазой и фазой, содержащей твердый субстрат. Как правило, в настоящем изобретении может быть использован любой метод, пригодный для исследования распределения белка между двумя фазами, в том числе оптическое определение (например, эллипсометрия, резонанс поверхностных плазмонов, интерферометрия и/или коэффициент отражения), акустическое определение (например, кварцевые микровесы), флуоресцентное определение, спектроскопия (например, инфракрасная спектроскопия нарушенного отражения) или определение концентрации (например, активность фермента).
Шкалы заряда и гидрофобности взаимосвязаны друг с другом, так как заряженные остатки увеличивают гидрофобность. Таким образом, вместо простого выбора одной из шкал в некоторых вариантах осуществления настоящего изобретения используют несколько разных шкал (например, созданных теоретическими или экспериментальными методами) для определения зависимости физических свойств. Ниже приведены ссылки на 23 наиболее широко используемые шкалы гидрофобности, которые включают: шкалу гидрофобности (Rao and Argos) для вычисления параметра погружения спирали в мембрану (Rao and Argos, Biochim. Biophys. Acta 869:197-214 (1986)); шкалу гидрофобности (Black and Mould) для вычисления гидрофобности физиологических L-альфа-аминокислот (Black and Mould, Anal. Biochem., 193:72-82 (1991)); шкалу гидрофобности (Bull and Breese) для вычисления гидрофобности (свободная энергия переноса на поверхность в ккал/моль) (Bull and Breese, Arch. Biochem. Biophys. 161:665-670 (1974)); шкалу гидрофобности (Chothia) для вычисления количества 95% погруженных остатков (в 12 белках) (Chothia, J. Mol. Biol., 105:1-14 (1976)); шкалу гидрофобности (Kyte and Doolittle) для вычисления гидрофобности (Kyte and Doolittle, J. Mol. Biol., 157:105-132 (1982)); шкалу гидрофобности (Eisenberg et al.) для вычисления нормализованной консенсусной шкалы гидрофобности (Eisenberg et al., J. Mol. Biol. 179:125-142 (1984)); шкалу гидрофобности (Fauchere and Pliska) для вычисления шкалы гидрофобности (pi-r) (Fauchere and Pliska, Eur. J. Med. Chem. 18:369-375 (1983)); шкалу гидрофобноти (Guy) для вычисления шкалы гидрофобности на основании свободной энергии переноса (ккал/моль) (Guy, Biophys. J., 47:61-70 (1085)); шкалу гидрофобности (Janin) для вычисления свободной энергии переноса с внутренней стороны на наружную поверхность глобулярного белка (Janin, Nature 277: 491-492 (1979)); шкалу гидрофобности (Abraham and Leo) для вычисления гидрофобности (дельта G1/2cal) (Abraham and Leo, Proteins: Structure, Function and Genetics 2:130-152 (1987)); шкалу гидрофобности (Manavalan et al.) для вычисления средней окружающей гидрофобности (Manavalan et al., Nature 275:673-674 (1978)); шкалу гидрофобности (Miyazawa et al.) для вычисления шкалы гидрофобности (энергия контактирования, полученная на основании трехмерных данных) (Miyazawa et al., Macromolecules 18:534-552 (1985)); шкалу гидрофобности (Aboderin) для вычисления подвижности аминокислот на хроматографической бумаге (RF) (Aboderin, Int. J. Biochem., 2:537-544 (1971)); шкалу гидрофобности, полученную методом ВЭЖХ, (Parker et al.) для вычисления шкалы гидрофобности на основании времени удерживания пептида при выполнении ВЭЖХ (Parker et al., Biochem., 25:5425-5431 (1986)); шкалу гидрофобности, полученную методом ВЭЖХ при рН 3,4, для вычисления индексов гидрофобности при рН 3,4, определяемых при помощи ВЭЖХ (Cowan and Whittaker, Peptide Res., 3:75-80 (1990)); шкалу гидрофобности, полученную методом ВЭЖХ при рН 7,5, для вычисления индексов гидрофобности при рН 7,5, определяемых при помощи ВЭЖХ (Cowan and Whittaker, Peptide Res., 3:75-80 (1990)); шкалу гидрофобности (Rose et al.) (AA) для вычисления потери средней доли площади (f) (заглубленная средняя площадь/стандартная площадь) (Rose et al., Science 229:834-838 (1985)) и шкалу гидрофобности (Roseman) для вычисления шкалы гидрофобности (pi-r) (Roseman, J. Mol. Biol., 200:513-522 (1988)).
Другие физические свойства, которые сравнивают у протеаз и их вариантов с одинаковой укладкой цепи белка и с разной укладкой цепи белка, включают, не ограничиваясь ими, физические свойства, связанные с растворимостью, физические свойства, связанные с размером, и температуры плавления белка. Физические свойства, связанные с растворимостью, сравнивают в случае разной укладки цепи белка с использованием вышеописанных шкал заряда и гидрофобности. Как правило, в способах по настоящему изобретению может быть использована любая термодинамическая или кинетическая величина, характеризующая белок-белковое взаимодействие по сравнению с растворитель-белковым взаимодействием. Например, может быть использован второй вириальный коэффициент (см. публикацию Wilson, Acta Crystallographica, D50:361-365 (1994)), chi-параметр, осмотическое давление и коэффициенты активности или летучести, отражающие отклонение от идеального поведения смешения (см., например, публикацию Reid et al., “The Properties of Gases and Liquids”, 4th Ed. McGraw-Hill, (1987)). Физические свойства, связанные с размером, сранивают в случае разной укладки цепи белка при помощи любых экспериментальных методов, пригодных для определения размеров белка или полимеров. Размер определяют на основании молекулярной массы, используя общедоступные корреляции между конформацией белка или полимера (спираль, глобула, разветвление), молекулярную массу и гидродинамический или круговой радиус. Приемлемые методы определения размера или молекулярной массы включают, не ограничиваясь ими, статическое и динамическое рассеяние света, гель-электрофорез, масс-спектроскопию и хроматографию. Альтернативно размер можно легко определить на основании экспериментально установленной кристаллической структуры белка или моделей гомологии структуры.
Температуры плавления белка (Tm) обычно определяют, контролируя физическое свойство репортера сканером температуры. Приемлемые методы включают, не ограничиваясь ими, дифференциальную сканирующую калориметрию, круговой дихроизм, динамическое рассеяние света и УФ-спектроскопию видимой части спектра.
Применения ферментов сериновых протеаз
Комбинируемые мутации, созданные для получения вариантов протеаз, позволяют повысить индекс продуктивности, например, обеспечить оптимальное значение продуктивности по меньшей мере для одного свойства фермента, требуемого в разных применениях. На оптимальное значение продуктивности/свойства в значительной степени влияет используемая среда (например, состав детергента, рН, ионная сила и т.д.), а также суммарный заряд и распределение заряда в аминокислотных остатках представляющего интерес фермента. Таким образом, оптимальный фермент может быть получен для разных препаратов с разным значением рН, ионной силы, типом и соотношением поверхностно-активного вещества, структурообразователями и хелатообразователями, которые влияют на электростатические характеристики. Смеси ферментов, в которых каждый компонент смеси обладает разным оптимальным значением заряда, используют для получения препаратов, пригодных для использования в широком диапазоне условий (например, протеазы в детергентных препаратах, продаваемых в разных географических зонах, отличаются в зависимости от жесткости воды). Смеси ферментов, в которых каждый компонент предназначен для удаления разных пятен, также используют для получения препаратов, пригодных для удаления целого ряда пятен. Кроме того, смеси ферментов, в которых каждый компонент обладает разным оптимальным значением заряда, используют в тех случаях, когда в самом субстрате фермента происходит изменение заряда во время взаимодействия с ферментом.
Несмотря на то, что настоящее изобретение описано применительно к протеазам и пятнам крови, молока и чернил, предполагается, что варианты протеаз по настоящему изобретению оптимально пригодны для любого взаимодействия фермента с субстратом в разных реакционных средах (то есть условиях), определяемых применением, например, применениями, связанными с очисткой.
Как более подробно описано в настоящем описании изобретения, вариантные протеазы по настоящему изобретению обладают важными характеристиками, которые делают их особенно пригодными для определенных применений. Например, в некоторых предпочтительных вариантах осуществления изобретения вариантные протеазы по настоящему изобретению имеют измененный заряд и/или гидрофобность по сравнению с некоторыми протеазами, используемыми в настоящее время. Таким образом, указанные протеазы предпочтительно используются в очищающих композициях. Действительно, в определенных условиях мытья протеазы по настоящему изобретению характеризуются сравнимой или более высокой экспрессией и/или активностью по удалению пятен по сравнению с протеазами субтилизина, используемыми в настоящее время. Таким образом, следует признать, что очищающие и/или ферментные композиции по настоящему изобретению могут быть использованы в разных очищающих композициях. Протеазы по настоящему изобретению могут быть использованы в разных очищающих композициях, а также в корме для животных, при обработке кожи (например, мягчение кожи), гидролизе белка и в текстильной промышленности. Идентифицированные протеазы могут быть также использованы в средствах личной гигиены.
Варианты протеаз по настоящему изобретению могут быть использованы в ряде промышленных применений, в частности, в области очистки, дезинфекции, производства корма для животных и в текстильной/кожевенной промышленности. В некоторых вариантах осуществления изобретения протеазы по настоящему изобретению объединяют с детергентами, структурообразователями, отбеливателями и другими стандартными ингредиентами, получая при этом новые очищающие композиции, предназначенные для стирки и других видов очистки, такие как, например, стиральные детергенты (порошкообразные и жидкие), средства для замачивания перед стиркой, все отбеливатели тканей, детергенты для посудомоечных машин (жидкие и порошкообразные), чистящие средства для домашнего хозяйства, в частности, бруски мыла и жидкое мыло, и средства для устранения засоров в водопроводе. Кроме того, вариантные протеазы могут быть использованы для очистки контактных линз и других предметов при введении таких материалов в соприкосновение с водным раствором очищающей композиции. Указанные вариантные протеазы могут быть также использованы в процессе гидролиза пептидов, при обработке отходов, в текстильной промышленности, для очистки медицинских устройств, удаления биологических пленок и в качестве ферментов для гибридизации-расщепления при получении белков и т.д. Состав указанных продуктов не имеет принципиального значения для настоящего изобретения, если вариантные протеазы сохраняют свою функциональность в данных условиях применения. В некоторых вариантах осуществления изобретения композиции могут быть легко получены в результате объединения эффективного количества варианта протеазы или ферментной композиции, содержащей вариантную протеазу, со стандартными компонентами таких композиций в количествах, известных в данной области.
Очищающие композиции
За исключением особо оговоренных случаев все количества, указанные для компонентов или композиций, приведены в соответствии с активным количеством данного компонента или композиции при отсутствии загрязняющих примесей, таких как, например, остаточные растворители или побочные продукты, которые могут присутствовать в коммерчески доступных источниках. Массы компонентов ферментов указаны в расчете на общую массу активного белка. Все проценты и отношения вычислены в расчете на массу за исключением особо оговоренных случаев. Все проценты и отношения вычислены в расчете на общую массу композиции за исключением особо оговоренных случаев. В типичных детергентных композициях количества ферментов выражены в виде массы чистого фермента в расчете на общую массу композиции, и за исключением особо оговоренных случаев масса ингредиентов детергента выражена в расчете на общую массу композиций.
Как указано в настоящем описании изобретения, в некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению далее содержат дополнительные вещества, которые включают, не ограничиваясь ими, поверхностно-активные вещества, структурообразователи, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, системы стабилизации ферментов, хелатообразователи, оптические отбеливатели, грязеотталкивающие полимеры, средства, обеспечивающие перенос красителя, диспергаторы, вещества, уменьшающие мыльную пену, красители, ароматизаторы, пигменты, наполняющие соли, гидротропы, фотоактиваторы, флуоресцентные вещества, кондиционеры ткани, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные средства, средства, снижающие сминаемость, гермициды, фунгициды, усилители цвета, средства для ухода за серебряными изделиями, средства против потускнения и/или коррозии, щелочные средства, растворители, носители, ускорители обработки, пигменты и средства, регулирующие значение рН (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, которые включены в настоящее описание изобретения в качестве ссылки). Ниже подробно описаны варианты осуществления изобретения, относящиеся к определенным веществам, входящим в состав очищающих композиций. В тех вариантах осуществления изобретения, в которых дополнительные очищающие вещества не совместимы с вариантными протеазами по настоящему изобретению в очищающих композициях, могут быть использованы приемлемые методы отделения дополнительных очищающих веществ от протеаз (то есть методы, препятствующие контактированию указанных веществ друг с другом) до тех пор, пока не понадобится комбинация двух компонентов. Такие методы отделения веществ включают любые приемлемые методы, известные в данной области (например, гелевые колпачки, инкапсулирование, таблетки, физическое разделение и т.д.).
Очищающие композиции по настоящему изобретению могут быть эффективно использованы, например, в областях применения, связанных со стиркой, очисткой твердых поверхностей, мытьем посуды, а также в косметических препаратах, предназначенных для очистки зубных протезов, зубов, волос и кожи. Кроме того, благодаря высокой эффективности в низкотемпературных растворах ферменты по настоящему изобретению идеально подходят для применений, связанных со стиркой. Ферменты по настоящему изобретению могут быть использованы в гранулированных и жидких композициях.
Вариантные протеазы по настоящему изобретению могут быть использованы в очищающих добавках. В некоторых вариантах осуществления изобретения вариантные протеазы могут быть использованы для очистки в низкотемпературных растворах. Некоторые варианты осуществления настоящего изобретения относятся к очищающим добавкам, содержащим по меньшей мере один фермент по настоящему изобретению, которые идеально подходят для мытья, требующего дополнительного отбеливания. Такие применения включают, не ограничиваясь ими, очистку в низкотемпературных растворах. В некоторых вариантах осуществления изобретения добавка содержит одну или несколько протеаз. В некоторых вариантах осуществления изобретения добавка дозирована в упаковке для добавления в процессе очистки. В некоторых вариантах осуществления изобретения добавка дозирована в упаковке для добавления в процессе очистки при использовании пероксида и необходимости более эффективного отбеливания. В настоящем изобретении могут быть использованы любые приемлемые дозированные формы, рассчитанные на одно применение, которые включают, не ограничиваясь ими, гранулы, таблетки, гелевые колпачки или другие дозированные формы, рассчитанные на одно применение, такие как предварительно отмеренные порошки или жидкости. В некоторых вариантах осуществления изобретения использованы наполнители или носители, увеличивающие объем таких композиций. Приемлемые наполнители или носители включают, не ограничиваясь ими, разные соли, такие как сульфат, карбонат и силикат, а также тальк, глину и тому подобные. Наполнители или носители, пригодные для жидких композиций, включают, не ограничиваясь ими, воду или низкомолекулярные первичные и вторичные спирты, такие как полиолы и диолы. Примеры таких спиртов включают, не ограничиваясь ими, метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления изобретения композиции содержат от около 5% до около 90% таких веществ. Для уменьшения значения рН используются кислотные наполнители. Альтернативно в некоторых вариантах осуществления изобретения очищающая добавка включает дополнительные ингредиенты, более подробно описанные ниже.
Очищающие композиции и очищающие добавки по настоящему изобретению требуют использования эффективного количества по меньшей мере одного из вариантов протеаз, рассмотренных в настоящем описании изобретения, применяемого отдельно или в комбинации с другими протеазами и/или дополнительными ферментами. Требуемое содержание фермента достигается путем добавления одного или нескольких вариантов протеаз по настоящему изобретению. Очищающие композиции по настоящему изобретению обычно содержат по меньшей мере около 0,0001 мас.%, от около 0,0001 до около 10, от около 0,001 до около 1 или даже от около 0,01 до около 0,1 мас.% по меньшей мере одной из вариантных протеаз по настоящему изобретению.
Очищающие композиции по настоящему изобретению обычно предназначены для очистки в воде, имеющей значение рН от около 5,0 до около 11,5 или даже от около 7,5 до около 10,5. Жидкие препараты обычно имеют чистое значение рН от около 3,0 до около 9,0 или даже от около 3 до около 5. Гранулированные стиральные продукты обычно имеют значение рН от около 9 до около 11. Методы регулирования значения рН на рекомендуемых уровнях включают использование буферов, щелочей, кислот и т.д. и хорошо известны специалистам в данной области.
Приемлемые очищающие композиции с низким значением рН обычно имеют чистое значение рН от около 3 до около 5 и, как правило, не содержат поверхностно-активных веществ, гидролизуемых в среде с таким значением рН. Такие поверхностно-активные вещества являются поверхностно-активными веществами на основе алкилсульфата натрия, содержащими по меньшей мере одну группу этиленоксида или даже от около 1 до около 16 молей этиленоксида. Такие очищающие композиции обычно содержат достаточное количество модификатора рН, такого как гидроксид натрия, моноэтаноламин или хлористоводородная кислота, для достижения чистого значения рН от около 3 до около 5. Такие композиции обычно включают по меньшей мере один кислотостойкий фермент. В некоторых вариантах осуществления изобретения композиции являются жидкостями, в то время как в других вариантах осуществления изобретения композиции являются твердыми веществами. Значение рН таких жидких композиций обычно измеряют в виде чистого значения рН. Значение рН таких твердых композиций измеряют в виде 10% раствора твердых веществ указанной композиции, при этом растворитель являются дистиллированной водой. В указанных вариантах осуществления изобретения все измерения значений рН выполняют при 20°С за исключением особо оговоренных случаев.
В некоторых вариантах осуществления изобретения при использовании вариантных протеаз в гранулированной или жидкой композиции желательно, чтобы вариантная протеаза представляла собой инкапсулированную частицу для защиты вариантной протеазы от других компонентов гранулированной композиции во время хранения. Кроме того, инкапсулирование является также способом контролирования наличия вариантной протеазы в процессе очистки. В некоторых вариантах осуществления изобретения инкапсулирование улучшает продуктивность вариантной протеазы и/или дополнительных ферментов. Поэтому вариантные протеазы по настоящему изобретению инкапсулируют в любой приемлемый инкапсулирующий материал, известный в данной области. В некоторых вариантах осуществления изобретения в инкапсулирующий материал обычно инкапсулируют по меньшей мере часть катализатора для вариантных протеаз по настоящему изобретению. Инкапсулирующий материал обычно является водорастворимым и/или диспергируемым в воде материалом. В некоторых вариантах осуществления изобретения инкапсулирующий материал имеет температуру стеклования (Tg), равную 0°С или выше. Температура стеклования более подробно описана в публикации WO 97/11151. Инкапсулирующий материал обычно выбирают из углеводов, природных или синтетических камедей, хитина, хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, парафинов и их комбинаций. Инкапсулирующий материал, являющийся углеводом, обычно выбирают из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. В некоторых типичных вариантах осуществления изобретения инкапсулирующий материал является крахмалом (см., например, европейский патент № 0922499, патент США № 4977252, патент США № 5354559 и патент США № 5935826). В некоторых вариантах осуществления изобретения инкапсулирующий материал является микросферой, изготовленной из пластика, такого как термопластик, акрилонитрил, метакрилонитрил, полиакрилонитрил, полиметакрилонитрил и их смеси; коммерчески доступные микросферы, которые могут быть использованы в настоящем изобретении, включают, не ограничиваясь ими, микросферы, поставляемые компанией Expancel® (Stockviksverken, Sweden), РМ 6545, РМ 6550, РМ 7220, РМ 7228, Extendospheres®, Luxsil®, Q-Cel® и Sphericel® (PQ Corp., Valley Forge, PA).
Как указано в настоящем описании изобретения, вариантные протеазы по настоящему изобретению особенно пригодны для использования в очищающей промышленности, которая включает, не ограничиваясь ими, стиральные детергенты и детергенты для мытья посуды. В указанных применениях ферменты подвержены разрушающему воздействию окружающей среды. Преимуществом вариантных протеаз по настоящему изобретению по сравнению со многими ферментами, используемыми в настоящее время, является их устойчивость в разных условиях.
Протеазы в процессе мытья действительно подвергаются разным воздействиям, включающим различные составы детергентов, объемы промывной воды, температуры промывной воды и продолжительность мытья. Кроме того, детергентные препараты, используемые в разных географических зонах, содержат разные концентрации компонентов, присутствующих в промывной воде. Например, европейские детергенты обычно содержат примерно 4500-5000 частей на миллион детергентных компонентов в промывной воде, в то время как японские детергенты обычно содержат примерно 667 частей на миллион детергентных компонентов в промывной воде. В Северной Америке, в частности, в США, детергенты обычно содержат примерно 975 частей на миллион детергентных компонентов в промывной воде.
Системы с низкой концентрацией детергента включают детергенты, содержащие примерно 800 частей на миллион детергентных компонентов в промывной воде. Японские детергенты обычно считаются системами с низкой концентрацией детергента, так как указанные системы содержат примерно 667 частей на миллион детергентных компонентов в промывной воде.
Системы со средней концентрацией детергента включают детергенты, содержащие от около 800 частей на миллион до около 2000 частей на миллион детергентных компонентов в промывной воде. Североамериканские детергенты обычно считаются системами со средней концентрацией детергента, так как указанные системы содержат примерно 975 частей на миллион детергентных компонентов в промывной воде. Бразильские системы обычно содержат примерно 1500 частей на миллион детергентных компонентов в промывной воде.
Системы с высокой концентрацией детергента включают детергенты, содержащие более примерно 2000 частей на миллион детергентных компонентов в промывной воде. Европейские детергенты обычно считаются системами с высокой концентрацией детергента, так как указанные системы содержат примерно 4500-5000 частей на миллион детергентных компонентов в промывной воде.
Латиноамериканские детергенты обычно являются детергентами, содержащими фосфат, вызывающий обильную мыльную пену, при этом детергенты, используемые в Латинской Америке, могут быть классифицированы как системы со средними и высокими концентрациями детергента, так как указанные детергенты содержат от 1500 частей на миллион до 6000 частей на миллион детергентных компонентов в промывной воде. Как было указано выше, бразильские детергенты обычно содержат примерно 1500 частей на миллион детергентных компонентов в промывной воде. Однако детергенты, содержащие фосфат, вызывающий обильную мыльную пену, используемые в других географических зонах, не ограниченных другими латиноамериканскими странами, могут быть системами с высокой концентрацией детергента, содержащими до около 6000 частей на миллион детергентных компонентов в промывной воде.
В свете вышеизложенного очевидно, что концентрации детергентных композиций в типичных промывных растворах, применяемых во всем мире, изменяются от менее, чем примерно 800 частей на миллион детергентной композиции (”географические зоны, в которых используются системы с низкой концентрацией детергента”), например, около 667 частей на миллион в Японии, от около 800 частей на миллион до около 2000 частей на миллион (”географические зоны, в которых используются системы со средней концентрацией детергента”), например, около 975 частей на миллион в США и около 1500 частей на миллион в Бразилии, до более, чем примерно 2000 частей на миллион (“географические зоны, в которых используются системы с высокой концентрацией детергента”), например, от около 4500 частей на миллион до около 5000 частей на миллион в Европе и около 6000 частей на миллион в географических зонах, в которых используется такой структурообразователь как фосфат, вызывающий обильную мыльную пену.
Концентрации типичных промывных растворов определяют эмпирическим путем. Например, в США типичная стиральная машина содержит примерно 64,4 л промывного раствора. Таким образом, чтобы получить концентрацию, равную примерно 975 частям на миллион детергента в промывном растворе, в 64,4 л промывного раствора необходимо добавить примерно 62,79 г детергентной композиции. Такое количество является типичным количеством, добавляемым пользователем в промывную воду при помощи мерного стаканчика, поставляемого с детергентом.
В качестве дополнительного примера можно отметить, что в разных географических зонах используются разные температуры мытья. Температура промывной воды в Японии обычно ниже, чем в Европе. Например, температура промывной воды в Северной Америке и Японии обычно составляет от около 10°С до около 30°С (например, примерно 20°С), в то время как температура промывной воды в Европе обычно составляет от около 30°С до около 60°С (например, примерно 40°С). Однако в интересах экономии энергии многие потребители переходят к мытью в холодной воде. Кроме того, в некоторых других регионах для стирки и мытья посуды обычно используется холодная вода. В некоторых вариантах осуществления изобретения термин ”мытье в холодной воде” по настоящему изобретению означает мытье при температурах от около 10°С до около 40°С, от около 10°С до около 30°С или от около 15°С до около 25°С, а также при всех других комбинациях температур в диапазоне от около 10°С до около 40°С. В качестве еще одного примера можно отметить, что в разных географических зонах вода обычно имеет разную жесткость. Жесткость воды обычно определяется в гранах смеси Са2+/Mg2+ на галлон (3,8 л) воды. Жесткость является мерой содержания кальция (Са2+) и магния (Mg2+) в воде. Большая часть воды в США является жесткой, но степень жесткости варьируется. Вода от умеренно жесткой (60-120 частей на миллион) до жесткой (121-181 часть на миллион) содержит от 60 до 181 части на миллион (для перевода частей на миллион в граны на галлон США количество частей на миллион делят на 17,1, получая при этом граны на галлон) минералов, вызывающих жесткость.
|
В Европе жесткость воды обычно больше примерно 10,5 (например, от около 10,5 до около 20,0) гранов смеси Са2+/Mg2+ на галлон (3,8 л) воды (например, примерно 15 гранов смеси Са2+/Mg2+ на галлон (3,8 л) воды). В Северной Америке жесткость воды обычно больше жесткости воды в Японии, но меньше, чем в Европе. Например, жесткость воды в Северной Америке может составлять от около 3 до около 10 гранов, от около 3 до около 8 гранов или около 6 гранов. Жесткость воды в Японии обычно меньше, чем в Северной Америке, и обычно составляет менее примерно 4, например, около 3 гранов смеси Са2+/Mg2+ на галлон (3,8 л) воды.
Некоторые варианты осуществления настоящего изобретения относятся к вариантным протеазам, которые обладают хорошими характеристиками мытья по меньшей мере в одной совокупности условий мытья (например, температура воды, жесткость воды и/или концентрация детергента). В некоторых вариантах осуществления изобретения вариантные протеазы по настоящему изобретению сравнимы по своим характеристикам мытья с другими протеазами субтилизина. В некоторых вариантах осуществления изобретения вариантные протеазы по настоящему изобретению обладают более высокими характеристиками мытья по сравнению с протеазами субтилизина, коммерчески доступными в настоящее время. Таким образом, в некоторых предпочтительных вариантах осуществления настоящего изобретения вариантные протеазы по настоящему изобретению обладают более высокой устойчивостью к окислению, более высокой теплостойкостью, более высокой очищающей способностью в разных условиях и/или более высокой устойчивостью к хелатообразователям. Кроме того, вариантные протеазы по настоящему изобретению могут быть использованы в очищающих композициях, не включающих детергенты, отдельно или в комбинации со структурообразователями и стабилизаторами.
В некоторых вариантах осуществления настоящего изобретения очищающие композиции содержат по меньшей мере одну вариантную протеазу по настоящему изобретению в количестве от около 0,00001% до около 10 мас.% композиции и сбалансированное количество (например, от около 99,999% до около 90,0%) дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению содержат по меньшей мере одну вариантную протеазу в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5 мас.% композиции и сбалансированное количество (например, от около 99,9999% до около 90,0%, от около 99,999% до около 98%, от около 99,995% до около 99,5 мас.%) дополнительных очищающих веществ.
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению включают один или несколько дополнительных детергентных ферментов, обеспечивающих более эффективную очистку, уход за тканями и/или мытье посуды. Примеры приемлемых ферментов включают, не ограничиваясь ими, гемицеллюлазы, целлюлазы, пероксидазы, протеазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, пектат-лиазы, маннаназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маланазы, β-глюканазы, арабинозидазы, гиалуронидазы, хондроитиназы, лакказы и амилазы или их смеси. В некоторых вариантах осуществления изобретения использована комбинация ферментов (то есть ”коктейль”), включающая обычно применяемые ферменты, такие как протеаза, липаза, кутиназа и/или целлюлаза в сочетании с амилазой.
Помимо вариантов протеаз по настоящему изобретению, в композициях по настоящему изобретению может быть использована любая другая приемлемая протеаза. Приемлемые протеазы включают протеазы животного, растительного или микробного происхождения. В некоторых особенно предпочтительных вариантах осуществления изобретения использованы микробные протеазы. В некоторых вариантах осуществления изобретения использованы химически или генетически модифицированные мутанты. В некоторых вариантах осуществления изобретения протеаза является сериновой протеазой, предпочтительно щелочной микробной протеазой или трипсинподобной протеазой. Примеры щелочных протеаз включают субтилизины, в частности, выделенные из Bacillus (например, субтилизин lentus, amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). В качестве дополнительных примеров можно привести мутантные протеазы, описанные в патентах США №№ RE 34606, 5955340, 5700676, 6312936 и 6482628, которые включены в настоящее описание изобретения в качестве ссылки. Дополнительные примеры протеаз включают, не ограничиваясь ими, трипсин (например, полученный у свиней или крупного рогатого скота) и протеазу Fusarium, описанную в публикации WO 89/06270. В некоторых вариантах осуществления изобретения коммерчески доступные ферменты протеазы, которые могут быть использованы в настоящем изобретении, включают, не ограничиваясь ими, Maxatase®, Maxacal™, Maxapem™, Opticlean®, Optimase®, Properase®, Purafect®, Properase®, Excellase™, Purafast™ и Purafect® Oxp (Genencor); Alcalase®, Savinase®, Primase®, Durazym™, Polarzyme®, Ovozyme®, Liquanase®, Kannase®, Neutrase®, Relase® и Esperase® (Novozymes), Blap™ (Henkel Kommanditgesellschaft auf Aktien, Duesseldorf, Germany). Разные протеазы описаны в публикациях WO 095/23221, WO 92/21760, публикации заявки на патент США № 2008/0090747 и в патентах США №№ 5801039, 5340735, 5500364, 5855625, US RE 34606, 5955340, 5700676, 6312936, 6482628 и в других патентах. В некоторых вариантах осуществления настоящего изобретения использованы металлопротеазы, которые включают, не ограничиваясь ею, нейтральную металлопротеазу, описанную в публикации WO 07/044993.
Кроме того, в настоящем изобретении может быть использована любая приемлемая липаза. Приемлемые липазы включают, не ограничиваясь ими, бактериальные или грибные липазы. В объем настоящего изобретения входят химически или генетически модифицированные мутанты. Примеры приемлемых липаз включают липазу Humicola lanuginosa (см., например, европейские патенты №№ 258068 и 305216), липазу Rhizomucor miehei (см., например, европейский патент № 238023), липазу Candida, такую как липаза C. antarctica (например, липазу А или В C. antarctica; см., например, европейский патент № 214761), липазы Pseudomonas, такие как липаза P. alcaligenes и липаза P. pseudoalcaligenes (см., например, европейский патент № 218272), липазу P. cepacia (см., например, европейский патент № 331376), липазу P. stutzeri (см., например, патент Великобритании № 1372034), липазу P. fluorescens, липазу Bacillus (например, липазу B. cubtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus (см., например, патент Японии № 64/744992) и липазу B. pumilus (см., например, публикацию WO 91/16422).
Кроме того, в некоторых вариантах осуществления настоящего изобретения использован ряд клонированных липаз, которые включают, не ограничиваясь ими, липазу Penicillium camembertii (см. публикацию Yamaguchi et al., Gene 103:61-67 (1991)), липазу Geotricum candidum (см. публикацию Schimada et al., J. Biochem., 106:383-388 (1989)) и разные липазы Rhizopus, такие как липаза R. delemar (см. публикацию Hass et al., Gene 109:117-113 (1991)), липаза R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 (1992)) и липаза R. oryzae.
В некоторых вариантах осуществления настоящего изобретения также использованы липолитические ферменты других типов, которые включают, не ограничиваясь ими, кутиназу, выделенную из Pseudomonas mendocina (см. публикацию WO 88/09367), и кутиназу, выделенную из Fusarium solani pisi (см. публикацию WO 90/09446).
Дополнительные приемлемые липазы включают коммерчески доступные липазы, такие как M1 Lipase™, Luma Fast™ и Lipomax™ (Genencor), Lipolase® и Lipolase® Ultra (Novozymes), Lipase P™ “Amano” (Amano Pharmaceutical Co. Ltd., Japan).
В некоторых вариантах осуществления настоящего изобретения очищающие композиции по настоящему изобретению дополнительно содержат липазы в количестве от около 0,00001% до около 10% дополнительной липазы в расчете на массу композиции и сбалансированное количество дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению также содержат липазы в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5% липазы в расчете на массу композиции.
В некоторых вариантах осуществления настоящего изобретения использована любая приемлемая амилаза по настоящему изобретению. В некоторых вариантах осуществления изобретения может быть также использована любая амилаза (например, альфа и/или бета), пригодная для применения в щелочных растворах. Приемлемые амилазы включают, не ограничиваясь ими, бактериальные или грибные амилазы. В некоторых вариантах осуществления изобретения использованы химически или генетически модифицированные мутанты. Амилазы, используемые в настоящем изобретении, включают, не ограничиваясь ими, α-амилазы, получаемые из B. licheniformis (см., например, патент Великобритании № 1296839). Коммерчески доступные амилазы, используемые в настоящем изобретении, включают, не ограничиваясь ими, Duramyl®, Termamyl®, Fungamyl®, Stainzyme®, Stainzyme Plus®, Stainzyme Ultra®, Natalase® и Ban™ (Novozymes), а также Powerase™, Rapidase® и Maxamyl® P (Genencor).
В некоторых вариантах осуществления настоящего изобретения очищающие композиции по настоящему изобретению дополнительно содержат амилазы в количестве от около 0,00001% до около 10% дополнительной амилазы в расчете на массу композиции и сбалансированное количество дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению также содержат амилазы в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5% амилазы в расчете на массу композиции.
В некоторых других вариантах осуществления изобретения в очищающих композициях по настоящему изобретению использована любая приемлемая целлюлаза. Приемлемые целлюлазы включают, не ограничиваясь ими, бактериальные или грибные целлюлазы. В некоторых вариантах осуществления изобретения использованы химически или генетически модифицированные мутанты. Приемлемые целлюлазы включают, не ограничиваясь ими, целлюлазы Humicola insolens (см., например, патент США № 4435307). Особенно приемлемыми целлюлазами являются целлюлазы, позволяющие сохранять цвет изделия (см., например, европейский патент № 0495257). Коммерчески доступные целлюлазы, используемые в настоящем изобретении, включают, не ограничиваясь ими, Celluzyme®, Carezyme® (Novozymes) и KAC-500(B)™ (Kao Corporation). В некоторых вариантах осуществления изобретения целлюлазы используют в виде частей или фрагментов зрелых целлюлаз дикого типа или вариантных целлюлаз, в которых удалена часть N-конца (см., например, патент США № 5874276). В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению дополнительно содержат целлюлазы в количестве от около 0,00001% до около 10% дополнительной целлюлазы в расчете на массу композиции и сбалансированное количество дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению также содержат целлюлазы в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5% целлюлазы в расчете на массу композиции.
В настоящем изобретении может быть также использована любая маннаназа, пригодная при применении в детергентных композициях. Приемлемые маннаназы включают, не ограничиваясь ими, бактериальные или грибные маннаназы. В некоторых вариантах осуществления изобретения использованы химически или генетически модифицированные мутанты. Известны разные маннаназы, пригодные для использования в настоящем изобретении (см., например, патент США № 6566114, патент США № 6602842 и патент США № 6440991, которые включены в настоящее описание изобретения в качестве ссылки). В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению дополнительно содержат маннаназы в количестве от около 0,00001% до около 10% дополнительной маннаназы в расчете на массу композиции и сбалансированное количество дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению также содержат маннаназы в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5% маннаназы в расчете на массу композиции.
В некоторых вариантах осуществления изобретения в композициях по настоящему изобретению использованы пероксидазы в комбинации с пероксидом водорода или его источником (например, перкарбонат, перборат или персульфат). В некоторых альтернативных вариантах осуществления изобретения оксидазы использованы в сочетании с кислородом. Оба типа ферментов использованы для ”отбеливания раствора” (то есть для предотвращения переноса текстильного красителя с одной окрашенной ткани на другую ткань при совместной стирке разных тканей в промывной жидкости), предпочтительно вместе с усилителем (см., например, публикации WO 94/12621 и WO 95/01426). Приемлемые пероксидазы/оксидазы включают, не ограничиваясь ими, растительные, бактериальные или грибные пероксидазы/оксидазы. В некоторых вариантах осуществления изобретения использованы химически или генетически модифицированные мутанты. В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению далее содержат пероксидазу и/или оксидазу в количестве от около 0,00001% до около 10% дополнительной пероксидазы и/или оксидазы в расчете на массу композиции и сбалансированное количество дополнительных очищающих веществ в расчете на массу композиции. В других аспектах настоящего изобретения очищающие композиции по настоящему изобретению содержат также пероксидазу и/или оксидазу в количестве от около 0,0001% до около 10%, от около 0,001% до около 5%, от около 0,001% до около 2%, от около 0,005% до около 0,5% пероксидазы и/или оксидазы в расчете на массу композиции.
В некоторых вариантах осуществления изобретения использованы дополнительные ферменты, которые включают, не ограничиваясь ими, пергидролазы (см., например, публикацию WO 05/056782). Кроме того, в некоторых особенно предпочтительных вариантах осуществления изобретения использованы смеси вышеуказанных ферментов, в частности, одной или нескольких дополнительных протеаз, амилаз, липаз, маннаназ и/или по меньшей мере одной целлюлазы. В настоящем изобретении могут быть использованы разные смеси указанных ферментов. Композиции по настоящему изобретению могут содержать вариантные протеазы и один или несколько дополнительных ферментов в разных количествах, независимо равных примерно 10%, и сбалансированное количество дополнительных очищающих веществ. Дополнительные очищающие вещества могут быть легко выбраны с учетом очищаемой поверхности, изделия или ткани и желаемой формы композиции для данных условий очистки (например, при использовании моющего детергента).
Примеры приемлемых дополнительных очищающих веществ включают, не ограничиваясь ими, поверхностно-активные вещества, структурообразователи, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, системы стабилизации ферментов, хелатообразователи, оптические отбеливатели, грязеотталкивающие полимеры, средства, обеспечивающие перенос красителя, ингибиторы переноса красителя, катализаторы, пероксид водорода, источники пероксида водорода, предварительно полученные перкислоты, полимерные диспергаторы, средства, удаляющие глину и грязь, эластификаторы структуры, диспергаторы, вещества, уменьшающие мыльную пену, красители, ароматизаторы, пигменты, наполняющие соли, гидротропы, фотоактиваторы, флуоресцентные вещества, кондиционеры ткани, умягчители ткани, носители, гидротропы, ускорители обработки, ратворители, пигменты, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные средства, средства, снижающие сминаемость, гермициды, фунгициды, усилители цвета, средства для ухода за серебряными изделиями, средства против потускнения и/или коррозии, щелочные средства, растворители, носители, ускорители обработки, пигменты и средства, регулирующие значение рН (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, которые включены в настоящее описание изобретения в качестве ссылки). Ниже подробно описаны варианты определенных очищающих композиций. В тех вариантах осуществления изобретения, в которых дополнительные очищающие вещества не совместимы с вариантными протеазами по настоящему изобретению в очищающих композициях, могут быть использованы приемлемые методы отделения дополнительных очищающих вещества от протеаз (то есть методы, препятствующие контактированию указанных веществ друг с другом) до тех пор, пока не понадобится комбинация двух компонентов. Такие методы отделения веществ включают любые приемлемые методы, известные в данной области (например, гелевые колпачки, инкапсулирование, таблетки, физическое разделение и т.д.).
В некоторых предпочтительных вариантах осуществления изобретения в композиции, предназначенные для очистки разных поверхностей, требующих удаления белковых пятей, вводят эффективное количество одной или нескольких вариантных протеаз по настоящему изобретению. Такими очищающими композициями являются очищающие композиции, предназначенные для очистки твердых поверхностей, тканей и посуды. Некоторые варианты осуществления настоящего изобретения относятся к композициям для очистки тканей, в то время как другие варианты осуществления настоящего изобретения относятся к композициям для очистки изделий, отличных от тканей. Настоящее изобретение относится также к очищающим композициям, предназначенным для личной гигиены, включающей уход за полостью рта (включая зубные порошки, зубные пасты, полоскания для рта и т.д., а также композиции для очистки зубных протезов), кожей и волосами. В объем настоящего изобретения входят детергентные композиции в любой форме (то есть жидкие, гранулированные, в виде брусков, полутвердые, гели, эмульсии, таблетки, капсулы и т.д.).
В качестве примера ниже дано более подробное описание нескольких очищающих композиций, в которых использованы вариантные протеазы по настоящему изобретению. В некоторых вариантах осуществления изобретения, в которых очищающие композиции по настоящему изобретению получены в виде композиций, предназначенных для стирки в стиральной машине, композиции по настоящему изобретению предпочтительно содержат по меньшей мере одно поверхностно-активное вещество и по меньшей мере одно структурообразующее соединение, а также одно или несколько дополнительных очищающих веществ, предпочтительно выбираемых из органических полимерных соединений, отбеливателей, дополнительных ферментов, веществ, уменьшающих мыльную пену, диспергаторов, диспергаторов известкового мыла, средств, препятствующих суспендированию и повторному осаждению грязи, и ингибиторов коррозии. В некоторых вариантах осуществления изобретения стиральные композиции также содержат умягчители (то есть в качестве дополнительных очищающих веществ). В композициях по настоящему изобретению также использованы детергентные добавки в твердой или жидкой форме. Такие добавки усиливают и/или стабилизируют характеристики стандартных детергентных композиций и могут быть введены на любой стадии процесса очистки. В некоторых вариантах осуществления изобретения плотность стиральных детергентных композиций составляет от около 400 до около 1200 г/литр, в то время как в других вариантах осуществления изобретения плотность составляет от около 500 до около 950 г/литр композиции при 20°С.
В вариантах осуществления изобретения, относящихся к композициям для мытья посуды руками, композиции по настоящему изобретению предпочтительно содержат по меньшей мере одно поверхностно-активное вещество и предпочтительно по меньшей мере одно дополнительное очищающее вещество, выбираемое из органических полимерных соединений, средств, увеличивающих мыльную пену, ионов металлов группы II, растворителей, гидротропов и дополнительных ферментов.
В некоторых вариантах осуществления изобретения разные очищающие композиции, подобные описанным в патенте США № 6605458, использованы вместе с вариантными протеазами по настоящему изобретению. Таким образом, в некоторых вариантах осуществления изобретения композиция, содержащая по меньшей мере одну вариантную протеазу по настоящему изобретению, является компактной гранулированной композицией для очистки тканей, в то время как в других вариантах осуществления изобретения композиция является гранулированной композицией для очистки тканей, предназначенной для стирки цветных тканей, в других вариантах осуществления изобретения композиция является гранулированной композицией для очистки тканей, обеспечивающей умягчение в процессе стирки, в дополнительных вариантах осуществления изобретения композиция является сверхсильной жидкой композицией для очистки тканей. В некоторых вариантах осуществления изобретения композиции, содержащие по меньшей мере одну вариантную протеазу по настоящему изобретению, являются композициями для очистки тканей, подобными описанным в патентах США №№ 6610642 и 6376450. Кроме того, вариантные протеазы по настоящему изобретению могут быть использованы в гранулированных стиральных детергентных композициях, специально предназначенных для условий мытья, характерных для Европы или Японии (см., например, патент США № 6610642).
Некоторые альтернативные варианты осуществления изобретения относятся к композициям для очистки твердых поверхностей, содержащим по меньшей мере одну вариантную протеазу по настоящему изобретению. Таким образом, в некоторых вариантах осуществления изобретения композиции, содержащие по меньшей мере одну вариантную протеазу по настоящему изобретению, являются композициями для очистки твердых поверхностей, подобными описанным в патентах США №№ 6610642, 6376450 и 6376450.
Другие варианты осуществления настоящего изобретения относятся к композициям для мытья посуды, содержащим по меньшей мере одну вариантную протеазу по настоящему изобретению. Таким образом, в некоторых вариантах осуществления изобретения композиции, содержащие по меньшей мере одну вариантную протеазу по настоящему изобретению, являются композициями для очистки твердых поверхностей, подобными описанным в патентах США №№ 6610642 и 6376450. Другие варианты осуществления настоящего изобретения относятся к композициям для мытья посуды, содержащим по меньшей мере одну вариантную протеазу по настоящему изобретению. В некоторых других вариантах осуществления изобретения композиции, содержащие по меньшей мере одну вариантную протеазу по настоящему изобретению, являются композициями для ухода за полостью рта, подобными описанным в патентах США №№ 6376450 и 6376450. Препараты, соединения и дополнительные очищающие вещества, описанные в вышеуказанных патентах США №№ 6376450, 6605458, 6605458 и 6610642, могут быть использованы с вариантными протеазами по настоящему изобретению.
Очищающие композиции по настоящему изобретению получают в любой приемлемой форме и любым способом, выбираемым специалистом, неограничивающие примеры которых приведены в патентах США №№ 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303, которые включены в настоящее описание изобретения в качестве ссылки. Если необходимо получить очищающую композицию с низким значением рН, показатель рН такой композиции регулируют, добавляя такое вещество как моноэтаноламин или кислое вещество, такое как HCl.
Дополнительные вещества, приведенные в нижеследующем неограничивающем списке, пригодны для использования в очищающих композициях по настоящему изобретению, хотя и не имеют существенного значения для достижения целей настоящего изобретения. В некоторых вариантах осуществления изобретения указанные дополнительные вещества вводят, например, для усиления характеристик очистки, обработки очищаемого субстрата или изменения эстетических показателей очищающей композиции, например, в случае использования ароматизаторов, пигментов, красителей или тому подобных. Очевидно, что такие дополнительные вещества используют в дополнение к вариантным протеазам по настоящему изобретению. Характер и используемые количества дополнительных компонентов зависят от физической формы композиции и типа очистки, для которой предназначены указанные дополнительные компоненты. Приемлемые дополнительные вещества включают, не ограничиваясь ими, поверхностно-активные вещества, структурообразователи, хелатообразователи, ингибиторы переноса красителя, ускорители осаждения, диспергаторы, дополнительные ферменты и стабилизаторы ферментов, катализаторы, активаторы отбеливания, стабилизаторы отбеливания, пероксид водорода, источники пероксида водорода, предварительно полученные перкислоты, полимерные диспергаторы, средства, удаляющие глину и грязь и препятствующие их повторному осаждению, осветлители, средства, подавляющие образование мыльной пены, красители, ароматизаторы, эластификаторы структуры, умягчители ткани, носители, гидротропы, ускорители обработки и/или пигменты. Помимо нижеследующих примеров приемлемые примеры других дополнительных веществ и используемых количеств приведены в патентах США №№ 5576282, 6306812 и 6326348, которые включены в настоящее описание изобретения в качестве ссылки. Вышеуказанные дополнительные ингредиенты могут уравновешивать количество очищающих композиций по настоящему изобретению.
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат по меньшей мере одно поверхностно-активное вещество и/или поверхностно-активную систему, в которой поверхностно-активное вещество выбирают из неионогенных поверхностно-активных веществ, анионогенных поверхностно-активных веществ, катионогенных поверхностно-активных веществ, амфолитных поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, полуполярных неионогенных поверхностно-активных веществ и их смесей. Некоторые очищающие композиции с низким значением рН (например, композиции, имеющие чистое значение рН от около 3 до около 5) обычно не содержат алкилэтоксилированного сульфата, так как считается, что такое поверхностно-активное вещество может быть гидролизовано кислыми компонентами таких композиций. В некоторых вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве от около 0,1% до около 60%, в альтернативных вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве от около 1% до около 50%, в других вариантах осуществления изобретения поверхностно-активное вещество присутствует в количестве от около 5% до около 40% в расчете на массу очищающей композиции.
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат один или несколько структурообразователей или структурообразующих систем детергента. В некоторых вариантах осуществления изобретения очищающие композиции содержат по меньшей мере один структурообразователь в количестве, равном по меньшей мере примерно 1%, от около 3% до около 60% или даже от около 5% до около 40% в расчете на массу очищающей композиции. Структурообразователи включают, не ограничиваясь ими, полифосфаты щелочных металлов, аммония и алканоламмония, силикаты щелочных металлов, карбонаты щелочно-земельных и щелочных металлов, алюмосиликаты, поликарбоксилаты, гидроксиполикарбоксилаты простых эфиров, сополимеры малеинового ангидрида с этиленовым или винилметиловым простым эфиром, 1,3,5-тригидроксибензол-2,4,6-трисульфоновую кислоту и карбоксиметилоксиянтарную кислоту, разные соли щелочных металлов, аммония и замещенного аммония полиуксусных кислот, таких как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли. В разных вариантах осуществления настоящего изобретения может быть использован любой приемлемый структурообразователь.
В некоторых вариантах осуществления настоящего изобретения структурообразователи образуют водорастворимые комплексы жестких ионов (например, связывающие структурообразователи), такие как цитраты и полифосфаты (например, триполифосфат натрия и гексагидрат триполифосфата натрия, триполифосфат калия, смешанный триполифосфат натрия и калия и т.д.). В настоящем изобретении могут быть использованы любые приемлемые структурообразователи, известные в данной области (см., например, европейский патент № 2100949).
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат по меньшей мере один хелатообразователь. Приемлемые хелатообразователи включают, не ограничиваясь ими, агенты, образующие хелаты с медью, железом и/или марганцем и их смесями. В вариантах осуществления изобретения с использованием по меньшей мере одного хелатообразователя очищающие композиции по настоящему изобретению включают от около 0,1% до около 15% или даже от около 3,0% до около 10% хелатообразователя в расчете на массу очищающей композиции по настоящему изобретению.
В некоторых других вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат по меньшей мере один ускоритель осаждения. Приемлемые ускорители осаждения включают, не ограничиваясь ими, полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, грязеотталкивающие полимеры, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, атапульгит, иллит, бентонит, галлоузит и их смеси.
Как указано в настоящем описании изобретения, в некоторых вариантах осуществления изобретения использованы средства, препятствующие повторному осаждению. В некоторых предпочтительных вариантах осуществления изобретения использованы неионогенные поверхностно-активные вещества. Например, в вариантах осуществления изобретения, относящихся к автоматическому мытью посуды, неионогенные поверхностно-активные вещества использованы для модификации поверхности, в частности, для нанесения слоя, препятствующего образованию пленки и пятен, и для усиления блеска. Указанные неиногенные поверхностно-активные вещества могут быть также использованы для предотвращения повторного осаждения грязи. В некоторых предпочтительных вариантах осуществления изобретения средство, препятствующее повторному осаждению грязи, является неионогенным поверхностно-активным веществом, известным в данной области (см., например, европейский патент 2100949).
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат один или несколько ингибиторов переноса красителя. Приемлемые полимерные ингибиторы переноса красителя включают, не ограничиваясь ими, поливинилпирролидоны, полиамино-N-оксиды, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси. В вариантах осуществления изобретения с использованием по меньшей мере одного ингибитора переноса красителя очищающие композиции по настоящему изобретению включают от около 0,0001% до около 10%, от около 0,01% до около 5% или от около 0,1% до около 3% ингибитора переноса красителя в расчете на массу очищающей композиции.
В некоторых вариантах осуществления изобретения композиции по настоящему изобретению включают силикаты. В некоторых таких вариантах осуществления изобретения могут быть использованы силикаты натрия (например, дисиликат натрия, метасиликат натрия и кристаллические филлосиликаты). В некоторых вариантах осуществления изобретения силикаты присутствуют в количестве от около 1% до около 20%. В некоторых предпочтительных вариантах осуществления изобретения силикаты присутствуют в количестве от около 5% до около 15% в расчете на массу композиции.
В некоторых дополнительных вариантах осуществления изобретения очищающие композиции по настоящему изобретению также содержат диспергаторы. Приемлемые водорастворимые органические вещества включают, не ограничиваясь ими, гомополимеры или сополимеры кислот или их соли, при этом поликарбоновая кислота включает по меньшей мере два карбоксильных радикала, отделенных друг от друга не более, чем двумя атомами углерода.
В некоторых других вариантах осуществления изобретения ферменты, используемые в очищающих композициях, стабилизированы любым приемлемым методом. В некоторых вариантах осуществления изобретения используемые ферменты стабилизированы при помощи водорастворимых источников ионов кальция и/или магния, присутствующих в очищающих композициях, которые предоставляют такие ионы ферментам. В некоторых вариантах осуществления изобретения стабилизаторы ферментов включают олигосахариды, полисахариды и неорганические соли двухвалентных металлов, включающие щелочно-земельные металлы, такие как соли кальция. В настоящем изобретении могут быть использованы разные методы стабилизации ферментов. Например, в некоторых вариантах осуществления изобретения используемые ферменты стабилизированы при помощи водорастворимых источников ионов цинка (II), кальция (II) и/или магния (II), присутствующих в очищающих композициях, которые предоставляют такие ионы ферментам, а также ионов других металлов (например, бария (II), скандия (II), железа (II), марганца (II), алюминия (III), олова (II), кобальта (II), меди (II), никеля (II) и оксованадия (IV). В некоторых вариантах осуществления настоящего изобретения могут быть также использованы хлориды и сульфаты. В данной области известны примеры приемлемых олигосахаридов и полисахаридов (например, декстрины) (см., например, публикацию WO 07/145964). В некоторых вариантах осуществления изобретения также могут быть использованы обратимые ингибиторы протеазы, такие как боросодержащие соединения (например, борат, 4-формилфенилбороновая кислота) и/или трипептидальдегид, предназначенные для дальнейшего повышения устойчивости.
В некоторых вариантах осуществления изобретения композиции по настоящему изобретению включают отбеливатели, активаторы отбеливания и/или катализаторы отбеливания. В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению включают неорганические и/или органические отбеливающие соединения. Неорганические отбеливатели включают, не ограничиваясь ими, пергидраты (например, перборат, перкарбонат, перфосфат, персульфат и персиликат). В некоторых вариантах осуществления изобретения неорганические пергидраты являются солями щелочных металлов. В некоторых вариантах осуществления изобретения неорганические пергидраты использованы в виде кристаллических твердых веществ без дополнительной защиты, хотя в некоторых других вариантах осуществления изобретения на соль нанесено покрытие. В настоящем изобретении может быть использована любая приемлемая соль, известная в данной области (см., например, европейский патент № 2100949).
В некоторых вариантах осуществления изобретения в композициях по настоящему изобретению могут быть использованы активаторы отбеливания. Активаторы отбеливания обычно являются предшественниками органических перкислот, усиливающими отбеливание в процессе очистки при температурах 60°С и ниже. Активаторы отбеливания, пригодные для использования в настоящем изобретении, включают соединения, которые в условиях пергидролиза выделяют алифатические пероксикарбоновые кислоты, предпочтительно содержащие от около 1 до около 10 атомов углерода, в частности, от около 2 до около 4 атомов углерода, и/или необязательно замещенную пербензойную кислоту. В данной области известны другие активаторы отбеливания, которые могут быть использованы в настоящем изобретении (см., например, европейский патент № 2100949).
Кроме того, в некоторых нижеописанных вариантах осуществления изобретения очищающие композиции по настоящему изобретению далее содержат по меньшей мере один катализатор отбеливания. В некоторых вариантах осуществления изобретения может быть использован триазациклононан марганца и подобные комплексы, а также комплексы кобальта, меди, марганца и железа. В настоящем изобретении могут быть использованы другие катализаторы отбеливания (см., например, патенты США №№ 4246612, 5227084, 4810410, публикацию WO 99/06521 и европейский патент № 2100949).
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат один или несколько каталитических комплексов металлов. В некоторых вариантах осуществления изобретения может быть использован металлсодержащий катализатор отбеливания. В некоторых предпочтительных вариантах осуществления изобретения могут быть использованы металлсодержащие катализаторы отбеливания, содержащие систему катализаторов, содержащую катион переходного металла, обладающий определенной каталитической активностью отбеливания (например, катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца), вспомогательный катион металла, обладающий небольшой каталитической активностью отбеливания или не обладающий каталитической активностью отбеливания (например, катионы цинка или алюминия) и связывающий агент с определенными константами устойчивости к каталитическим и вспомогательным катионам металлов, в частности, этилендиаминтетрауксусная кислота, этилендиаминтетра(метиленфосфоновая кислота) и их водорастворимые соли (см., например, патент США № 4430243). В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению катализированы соединением магния. В данной области хорошо известны такие соединения и их количества (см., например, патент США № 5576282). В дополнительных вариантах осуществления изобретения в очищающих композициях по настоящему изобретению могут быть использованы кобальтовые катализаторы отбеливания. В данной области известны разные кобальтовые катализаторы отбеливания (см., например, патенты США №№ 5597936 и 5595967), которые могут быть легко получены известными методами.
В дополнительных вариантах осуществления изобретения очищающие композиции по настоящему изобретению включают комплекс переходного металла макрополициклического жесткого лиганда (MRL). В качестве практического примера, не ограничивающего объем изобретения, можно отметить, что в некоторых вариантах осуществления изобретения состав композиций по настоящему изобретению и способы очистки определяют таким образом, чтобы в водной промывной среде присутствовала по меньшей мере одна часть на сто миллионов активного MRL, при этом в некоторых предпочтительных вариантах осуществления изобретения в промывной жидкости присутствует от около 0,005 части на миллион до около 25 частей на миллион, более предпочтительно, от около 0,05 части на миллион до около 10 частей на миллион и, наиболее предпочтительно, от около 0,1 части на миллион до около 5 частей на миллион MRL.
Предпочтительные переходные металлы, используемые в катализаторе отбеливания на основе переходного металла по настоящему изобретению, включают, не ограничиваясь ими, марганец, железо и хром. Предпочтительные MRL также включают, не ограничиваясь ими, специальные сверхжесткие лиганды с поперечными мостиковыми связями (например, 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан). Приемлемые MRL переходных металлов могут быть легко получены известными методами (см., например, публикацию WO 2000/32601 и патент США № 6225464).
В некоторых вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат средства для ухода за металлическими изделиями. Средства для ухода за металлическими изделиями могут быть использованы для предотвращения и/или уменьшения потускнения, коррозии и/или окисления металлов, включающих алюминий, нержавеющую сталь и цветные металлы (например, серебро и медь). Приемлемые средства для ухода за металлическими изделиями включают средства, описанные в европейском патенте № 2100949, публикациях WO 94/26860 и WO 94/26859). В некоторых вариантах осуществления изобретения средство для ухода за металлическими изделиями является солью цинка. В некоторых других вариантах осуществления изобретения очищающие композиции по настоящему изобретению содержат от около 0,1% до около 5 мас.% одного или нескольких средств для ухода за металлическими изделиями.
Как было указано выше, очищающие композиции по настоящему изобретению получают в любой приемлемой форме и любым методом, выбираемым специалистом, неограничивающие примеры которых приведены в патентах США №№ 5879584, 5691297, 5574005, 5569645, 5516448, 5489392 и 5486303, которые включены в настоящее описание изобретения в качестве ссылки. В некоторых вариантах осуществления изобретения, в которых необходимо использование очищающей композиции с низким значением рН, показатель рН такой композиции регулируют путем добавления кислого вещества, такого как HCl.
Очищающие композиции по настоящему изобретению могут быть использованы для очистки предметов (например, поверхности, посуды или ткани). Обычно по меньшей мере часть предмета вводят в соприкосновение с очищающей композицией по настоящему изобретению, используемой в чистом виде или разведенной в промывной жидкости, после чего указанный предмет необязательно промывают и/или прополаскивают. В соответствии с целями настоящего изобретения ”мытье” означает, не ограничиваясь ими, чистку или механическое встряхивание. В некоторых вариантах осуществления изобретения очищающие композиции обычно используют в концентрациях от около 500 частей на миллион до около 15000 частей на миллион в растворе. Когда промывным растворителем является вода, температура воды обычно находится в интервале от около 5°С до около 90°С, и, когда предметом является ткань, отношение воды к массе ткани обычно составляет от около 1:1 до около 30:1.
Экспериментальный раздел
Нижеследующие примеры приведены для дальнейшей иллюстрации определенных предпочтительных вариантов осуществления и аспектах настоящего изобретения и не ограничивают объем изобретения.
В нижеследующем экспериментальном разделе использованы следующие аббревиатуры: °С (градусы по шкале Цельсия); rpm (число оборотов/минуту); Н2О (вода); HCl (хлористоводородная кислота; аа и АА (аминокислота); п.о. (пара оснований); т.п.о. (тысяча пар оснований); кДа (килодальтон); г (граммы); мкг (микрограммы); мг (миллиграммы); нг (нанограммы); мкл (микролитры); мл (миллилитры); мм (миллиметры); нм (нанометры); мкм (микрометры); М (молярный); мМ (миллимолярный); мкМ (микромолярный); ед. (единицы); В (вольты); MW (молекулярная масса); сек. (секунды); мин. (минута/минуты); ч. (час/часы); MgCl2 (хлорид магния); NaCl (хлорид натрия); OD280 (оптическая плотность при 280 нм); OD405 (оптическая плотность при 405 нм); OD600 (оптическая плотность при 600 нм); PAGE (электрофорез в полиакриламидном геле); EtOH (этанол); PBS (физиологический раствор с фосфатным буфером [150 мМ NaCl, 10 мМ натрий-фосфатного буфера, рН 7,2]); LAS (лаурилсульфонат натрия); SDS (додецилсульфат натрия); Трис (трис(гидроксиметил)аминометан); TAED (N,N,N',N'-тетраацетилэтилендиамин); BES (полиэфирсульфон); MES (моногидрат 2-морфолиноэтансульфоновой кислоты, формульная масса 195,24; Sigma № М-3671); CaCl2 (безводный хлорид кальция; формульная масса 110,99; Sigma № С-4901); SRI (индекс удаления пятен); MBI (кровь, молоко, чернила) и BMI PI (индекс продуктивности удаления пятен крови, молока, чернил), ТСА (трихлоруксусная кислота) и ТСА PI (индекс продуктивности трихлоруксусной кислоты).
Кроме того, вещества была получены из некоторых нижеследующих учреждений: TIGR (The Institute for Genomic Research, Rockville, MD); AATCC (American Association of Textile and Coloring Chemists); Amersham (Amersham Life Science, Inc. Arlington Heights, IL); Corning (Corning International, Corning, NY); ICN (ICN Pharmaceuticals, Inc., Costa Mesa, CA); Pierce (Pierce Biotechnology, Rockford, IL); Equest (Equest, Warwick International Group, Inc., Flintshire, UK); EMPA (Eidgenossische Material Prufungs und Versuch Anstalt, St. Gallen, Switzerland); CFT (Center for Test Materials, Vlaardingen, The Netherlands); Amicon (Amicon, Inc., Beverly, MA); ATCC (American Type Culture Collection, Manassas, VA); Becton Dickinson (Becton Dickinson Labware, Lincoln Park, NJ); Perkin-Elmer (Perkin-Elmer, Wellesley, MA); Rainin (Rainin Instrument, LLC, Woburn, MA); Eppendorf (Eppendorf AG, Hamburg, Germany); Waters (Waters, Inc., Milford, MA); Geneart (Geneart GmbH, Regensburg, Germany); Perseptive Biosystems (Perseptive Biosystems, Ramsey, MN); Molecular Probes (Molecular Probes, Eugene, OR); BioRad (BioRad, Richmond, CA); Clontech (CLONTECH Laboratories, Palo Alto, CA); Cargill (Cargill, Inc., Minneapolis, MN); Difco (Difco Laboratories, Detroit, MI); GIBCO BRL or Gibco BRL (Life Technologies, Inc., Gaithersburg, MD); New Brunswick (New Brunswick Scientific Company, Inc., Edison, NJ); Thermoelectron (Thermoelectron Corp., Waltham, MA); BMG (BMG Labtech, GmbH, Offenburg, Germany);Greiner (Greiner Bio-One, Kremsmuenster, Austria); Novagen (Novagen, Inc., Madison, WI); Novex (Novex, San Diego, CA); Finnzymes (Finnzymes OY, Finland) Qiagen (Qiagen, Inc., Valencia, CA); Invitrogen (Invitrogen Corp., Carlsbad, CA); Sigma (Sigma Chemical Co., St. Louis, MO); DuPont Instruments (Asheville, NY); Global Medical Instrumentation or GMI (Global Medical Instrumentation; Ramsey, MN); MJ Research (MJ Research, Waltham, MA); Infors (Infors AG, Bottmingen, Switzerland); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Roche (Hoffmann La Roche, Inc., Nutley, NJ); Agilent (Agilent Technologies, Palo Alto, CA); Merck (Merck & Co., Rahway, NJ); Ion Beam Analysis Laboratory (Ion Bean Analysis Laboratory, The University of Surrey Ion Beam Centre (Guildford, UK); TOM (Terg-o-Meter); BMI (blood, milk, ink); BaChem (BaChem AG, Bubendorf, Switzerland); Molecular Devices (Molecular Devices, Inc., Sunnyvale, CA); Corning (Corning International, Corning, NY); MicroCal (Microcal, Inc., Northhampton, MA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); NCBI (National Center for Biotechnology Information); Beckman (Beckman-Coulter, Fullerton, CA); SeitzSchenk (SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Germany); Pall (Pall Corp., East Hills, NY); Malvern Instruments (Malvern Instruments, Inc., Worcestershire, UK), DNA 2.0 (Menlo Park, CA), Molecular Devices (Sunnyvale, CA), Costar (Cambridge, MA).
Пример 1
Анализы
В нижеследующих примерах были использованы разные анализы, рассмотренные ниже для облегчения понимания изобретения. Ниже указаны любые отклонения от протоколов выполнения.
А. Анализ ТСА для определения содержания белка на 96-луночных титрационных микропланшетах
Для анализа FNA (например, исходной протеазы) и его вариантов использовали фильтрованный супернатант культуры, выращиваемой на титрационных микропланшетах в течение 3-4 дней при 33°С, встряхивании со скоростью 230 оборотов/мин и увлажненной аэрации. Для данного анализа использовали свежий 96-луночный титрационный микропланшет с плоским основанием (МТР). Сначала в каждую лунку вводили 100 мкл/лунку 0,25 н раствора HCl. Затем добавляли 50 мкл фильтрованного культурального бульона. Определяли рассеяние света/оптическую плотность при 405 нм (при смешивании в спектрофотометре для прочтения планшетов в течение 5 секунд), чтобы получить контрольные показания. Для проведения исследования в планшеты вводили 100 мкл/лунку 15% (мас./об.) трихлоруксусной кислоты (ТСА) и инкубировали в течение периода времени от 5 до 30 минут при комнатной температуре. Затем определяли рассеяние света/оптическую плотность при 405 нм (при смешивании в спектрофотометре для прочтения планшетов в течение 5 секунд).
Для анализа GG36 (например, исходной протеазы) и его вариантов использовали фильтрованный супернатант культуры, выращиваемой на титрационных микропланшетах в течение примерно 3 дней при 37°С, встряхивании со скоростью 300 оборотов/мин и увлажненной аэрации. При выполнении данного анализа в каждую лунку 96-луночного титрационного микропланшета с плоским основанием добавляли 100 мкл 0,25 М раствора HCl. Затем в лунки добавляли 25 мкл аликвоты фильтрованных супернатантов культуры (содержащих протеазы). Определяли рассеяние света/оптическую плотность при 405 нм (при смешивании в спектрофотометре для прочтения планшетов в течение 5 секунд), чтобы получить контрольные показания. После выполнения указанного измерения в каждую лунку добавляли 100 мкл 30% (мас./об.) раствора ТСА и титрационные микропланшеты инкубировали в течение периода времени от 5 до 15 минут при комнатной температуре. Затем определяли рассеяние света/оптическую плотность при 405 нм (при смешивании в спектрофотометре для прочтения планшетов в течение 5 секунд).
Был использован спектрофотометр для МТР Biomek FX Robot (Bekman Coulter) и SpectraMAX (тип 340; Molecular Devices); титрационные микропланшеты были предоставлены компанией Costar (тип 9017).
Относительное содержание белка в образцах вычисляли, вычитая контрольное значение (при отсутствии ТСА) из значения, полученного при использовании ТСА. При желании можно построить стандартную кривую, калибруя показания ТСА, полученные при выполнении анализов AAPF клонов, при помощи известных коэффициентов преобразования. Однако результаты ТСА являются линейными при концентрации белка от 50 до 500 микрограммов белка/мл (части на миллион) и, таким образом, можно построить график в зависимости от продуктивности фермента с целью выбора вариантов, обладающих хорошей продуктивностью. Увеличение мутности/рассеяния света в образцах соответствует общему количеству осаждаемого белка в супернатанте культуры.
В. Анализы продуктивности очистки
Продуктивность удаления пятен эталонных сериновых протеаз и их вариантов определяли на микрообразцах ткани, используя титрационный микропланшет (МТР), в коммерчески доступном детергенте TIDE® 2X Cold. При выполнении анализов использовали инактивированный термообработкой детергент TIDE® 2X Cold (имеющийся в продаже детергент), в котором было подтверждено отсутствие активности протеазы. Тепловая инактивация коммерческого детергента позволяет устранить ферментативную активность любых белковых компонентов при сохранении свойств неферментных компонентов. Таким образом, указанный метод может быть использован для подготовки коммерчески доступных детергентов для исследования вариантов ферментов по настоящему изобретению. Были использованы следующие реагенты: 5 мМ буфера HEPES, рН 8,0 или 5 мМ буфера MOPS, рН 7, соотношение Са:Mg равно 3:1 для средней жесткости воды: (CaCl2:MgCl2 .6H2O); 15000 гран/галлон (gpg) исходного раствора, разведенного до 6 гран/галлон. В каждую лунку помещали два образца хлопчатобумажной ткани EMPA-116 с пятнами BMI (кровь/молоко/чернила), обработанных CFT. Микрообразцы ткани предварительно промывали в деионизированной воде в течение 20 минут при комнатной температуре. После предварительной промывки образцы ткани сушили на бумажных салфетках. Подвергнутые воздушной сушке образцы штамповали при помощи кругового штампа размером 0,6 мм (1,4 дюйма) на выталкивающем прессе. Затем в каждую лунку 96-луночного титрационного микропланшета вертикально помещали два микрообразца ткани, чтобы воздействию была подвергнута вся площадь поверхности (то есть не горизонтально на основание лунки). Рабочий раствор детергента представлен в таблице 1-1.
|
Температура в термостате была задана равной 16°С. В планшеты, содержащие в каждой лунке 2 образца ткани (BMI) с 190 мкл вышеуказанного рабочего раствора детергента, добавляли 10 мкл образцы из планшета с основным раствором, содержащим ~10 частей на миллион фермента. Объем доводили до конечной концентрации, равной 0,5 части на миллион вариантов на аналитических планшетах. Планшеты сразу же переносили в термостат/шейкер iEMS (Thermo/Labsystems) и инкубировали в течение 30 минут при встряхивании со скоростью 1400 оборотов/мин при данной температуре. После окончания инкубации 100 мкл супернатанта переносили на новый 96-луночный планшет (Castar, тип 9017, используемый для считывания показаний реакционных планшетов после инкубации) и при помощи спектрофотометра для прочтения планшетов МТР SpectraMAX (тип 340; Molecular Devices) измеряли оптическую плотность при 405 нм и/или 600 нм. В данном исследования были также использованы контрольные лунки, содержащие 2 микрообразца ткани и детергент без добавления образцов протеазы. Измерение при 405 нм позволяет определить качество удаления пигмента, в то время как измерение при 600 нм позволяет определить помутнение и очистку. При выполнении данного анализа протеазы гидролизуют субстрат и высвобождают пигмент и нерастворимые частицы из субстрата. Таким образом, степень помутнения является мерой активности фермента.
Вычисление активности по удалению пятен
Полученные значения оптической плотности корректировали в отношении контрольного значения (субстрат без фермента), измеряя таким образом гидролитическую активность. Для каждого образца (варианта) вычисляли индекс продуктивности. Индекс продуктивности позволяет сравнить продуктивность варианта (действительное значение) и стандартного фермента (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения могут быть вычислены с использованием параметров уравнения Лангмюра для стандартного фермента.
Индекс продуктивности
Индекс продуктивности позволяет сравнить продуктивность варианта (действительное значение) и исходной протеазы (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения могут быть вычислены при использовании параметров кривой связывания (то есть уравнение Лангмюра) стандартной протеазы. Индекс продуктивности (PI), имеющий значение >0,5 по меньшей мере для одного свойства, позволяет идентифицировать вариант, включающий по меньшей мере одну мутацию, которая может быть объединена с одной или несколькими мутациями с целью создания белков, обладающих соответствующими индексами продуктивности для одного или нескольких представляющих интерес свойств, отличающихся или дополняющих представляющее интерес свойство, для которого было получено значение PI >0,5.
Пример 2
Варианты субтилизина GG36 Bacillus subtilis
В данном примере описаны эксперименты, выполненные с целью продуцирования GG36 (определяемого также как субтилизин Bacillus lentus) в B. subtilis. Трансформацию выполняли методами, известными в данной области (см., например, публикацию WO 02/14490).
Продуцирование протеазы GG36 в Bacillus subtilis
Экспрессирующую плазмиду pAC-GG36ci собирали, используя ген с улучшенным кодоном GG36, гибридизированный в положении 8-го кодона сигнальной последовательности aprE под контролем консенсусного промотора aprE и терминатора транскрипции BPN'. В приведенной ниже последовательности (SEQ ID NO:2) жирным курсивом показан консенсусный промотор aprE, обычным шрифтом показана сигнальная последовательность, подчеркнута пропоследовательность, жирным шрифтом показана ДНК, кодирующая зрелую протеазу GG36, и подчеркнутым курсивом показан терминатор BPN'. Последовательность ДНК, кодирующая зрелую область GG36, (SEQ ID NO:4) фланкирована сайтами рестрикции KpnI и XhoI, используемыми для клонирования (см. фигуру 4).
atctcaaaaaaatgggtctactaaaatattactccatctattataataaattcacagaatagtcttttaagtaagtctactctgaatttttttaaaaggagagggtaaaga gtgagaagcaaaaaattgtggatcgtcgcgtcgaccgcattgctgatttctgttgcttttagctcatccatcgcatccgctgctgaagaagcaaaagaaaaatatttaattggctttaatgagcaggaagctgtcagtgagtttgtagaacaagttgaggcaaatgacgaggtagccattctctctgaggaagaggaagtcgaaattgaattgcttcatgaatttgaaacgattcctgttctgtccgttgagttaagcccagaagatgtggacgcgttagagctcgatccagctatttcttatattgaagaggatgcagaagtaactaca atggcgcaatcggtaccatggggaattagcagagtacaagccccagctgcacataaccgtggattgacaggttctggtgtaaaagttgctgtccttgataccggtatttccactcatccagacttaaatattcgtggtggagctagctttgtaccaggggaaccatccactcaagatggcaatggacatggcactcatgttgccggcacaatcgcggctcttaacaattcaattggtgttcttggcgtagcgccaagcgcagaactatacgctgttaaagtattaggagcaagcggttcaggctctgtcagctctattgcccaaggattggaatgggcagggaacaatggcatgcacgttgctaatcttagtttaggatctccttcgccaagtgccacacttgagcaagctgttaatagcgcgacttctagaggcgttcttgttgtagcggcctctggaaattcaggtgcaggctcaatcagctatccggcccgttatgcgaacgctatggcagtcggagctactgaccaaaacaacaaccgcgccagcttttcacagtatggcgcagggcttgacattgtcgcaccaggtgtaaacgtgcagagcacttacccaggttcaacatatgccagcttaaacggtacatcaatggctactcctcatgttgcaggtgcggctgcacttgttaaacaaaagaacccatcttggtccaatgtacaaatccgcaatcatcttaagaatacggcaactagcttaggaagcacaaacttgtatggaagcggacttgtcaatgcagaagctgcaactcgttaa aagcttaactcgagataaaaaaccggccttggccccgccggttttttat (SEQ ID NO: 2).
Плазмида pAC-GG36ci, показанная на фигуре 4, была использована для экспрессии протеазы GG36 в B. subtilis. Плазмида включает следующие элементы: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie T., Hoshino T., Tanaka T., Sueoka N. (1986) The Nucleotide Sequence of pUB110: Some Salient Features in Relation to Replication and Its Regulation. Plasmid 15:93-103), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar F, Rodriguez RL, Greene PJ, Betlach MC, Heyneker HL, Boyer HW. (1977) Construction and characterization of new cloning vehicles. II. A multipurpose cloning system. Gene 2:95-113), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi S., Weisblum B. (1982) Nucleotide sequence and functional map of pC194, a plasmid that specifies inducible chloramphenicol resistance. J. Bacteriol. 150:815-825).
Плазмида имеет следующие признаки: точку начала репликации для B. subtilis = точка начала репликации из pUB110, CAT = ген устойчивости к хлорамфениколу из рС194, точка начала репликации pMB1 = точка начала репликации из pBR322, bla = бета-лактамаза из pBR322, короткий промотор aprE = консенсусный промотор транскрипции, сигнальный пептид = сигнальный пептид, пропептид = прообласть GG36, зрелый пептид GG36ci = зрелый GG36 (заменен кодирующими областями для каждого варианта, экспрессированного в данном исследовании), терминатор BPN' = терминатор транскрипции из субтилизина BPN'.
Ниже приведена аминокислотная последовательности белка-предшественника GG36 (SEQ ID NO:3). В данной последовательности жирным шрифтом показана зрелая протеаза GG36 (дикого типа), которая представлена также как SEQ ID NO:4: MRSKKLWIVASTALLISVAFSSSIASAAEEAKEKYLIGFNEQEAVSEFVEQVEANDEVAILSEEEEVEIELLHEFETIPVLSVELSPEDVDALELDPAISYIEEDAEVTTMAQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPSAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR* (SEQ ID NO: 3)
AQSVPWGISRVQAPAAHNRGLTGSGVKVAVLDTGISTHPDLNIRGGASFVPGEPSTQDGNGHGTHVAGTIAALNNSIGVLGVAPSAELYAVKVLGASGSGSVSSIAQGLEWAGNNGMHVANLSLGSPSPSATLEQAVNSATSRGVLVVAASGNSGAGSISYPARYANAMAVGATDQNNNRASFSQYGAGLDIVAPGVNVQSTYPGSTYASLNGTSMATPHVAGAAALVKQKNPSWSNVQIRNHLKNTATSLGSTNLYGSGLVNAEAATR* (SEQ ID NO:4)
Создание и синтез комбинаторной библиотеки заряда/гидрофобности субтилизина Bacillus lentus (=GG36)
Комбинаторная библиотека заряда/гидрофобности субтилизина Bacillus lentus (CCHL) была создана путем идентификации семи хорошо распределенных поверхностных аминокислот. Указанными остатками являются S24, R45, S101, Q109, G118, T213 и L217. Номер положения замены соответствует нумерации в субтилизине BPN' (нумерация BPN'; фигура 1). Комбинаторная библиотека гидрофобности, состоящая из 33 членов (GH2-GH33), была создана путем составления комбинаций из четырех возможных остатков на каждом сайте: дикий тип, глутамин (Q), глутаминовая кислота (Е), лейцин (L) и аргинин (R), показанных в таблице 2-1.
Плазмида pAC-GG36ci, содержащая ген GG36 с улучшенным кодоном, была отправлена в DNA 2.0 Inc. (Menlo Park, CA) для создания комбинаторной библиотеки гидрофобности. Штамм Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo) был использован в качестве штамма-хозяина для трансформации ДНК, кодирующей вариантные субтилизины GG36. Варианты были получены в виде смеси с глицерином на 96-луночных планшетах.
В таблице 2-2 показаны замены, выполненные в GG36 для создания вариантов. В таблице 2-1 также показано отличие суммарного заряда и гидрофобности у варианта GG36 и протеазы дикого типа.
Экспрессия вариантов протеазы
Клоны Bacillus subtilis, содержащие векторы экспрессии GG36 или FNA, реплицировали при помощи стального 96-луночного репликатора из смесей с глицерином на 96-луночных культуральных планшетах (BD, 353075), содержащих 200 мкл среды LB + 25 мкг/мл хлорамфеникола, выращивали в течение ночи при 37°С и скорости встряхивания 220 оборотов/мин в увлажненной оболочке. 200 мкл культуры, выращенной в течение ночи, использовали для инокуляции 2000 мкл среды определенного состава + 25 мкг/мл хлорамфеникола в 5 мл пластиковых встряхиваемых пробирках. Среда для выращивания была обогащена средой полуопределенного состава на основе буфера МОР с использованием мочевины в качестве основного источника азота, глюкозы в качестве основного источника углерода и содержала 1% сои для устойчивого роста клеток. Встряхиваемые пробирки инкубировали при 37°С и скорости встряхивания 220 оборотов/мин в течение 60 часов. Через 60 часов супернатанты центрифугировали в центрифуге с ускорением более 8000 х RCF. Раствор декантировали в 15 мл полипропиленовые конические пробирки для хранения. Дальнейшую очистку или концентрирование не производили. Супернатант смешивали с 40% пропиленгликоля для достижения длительной устойчивости и хранили при 4°С.
|
Пример 3
Варианты субтилизина FNA Bacillus subtilis
Продуцирование протеазы FNA в B. subtilis
В данном примере описаны эксперименты, выполненные с целью продуцирования FNA (определяемого также как субтилизин Bacillus subtilis BPN'-Y217L (=FNA)) в B. subtilis. Трансформацию выполняли методами, известными в данной области (см., например, публикацию WO 02/14490).
Экспрессирующую плазмиду pAC-FNAre собирали, используя ген FNA, гибридизированный в положении 8-го кодона сигнальной последовательности aprE под контролем консенсусного промотора aprE и терминатора транскрипции BPN'. В приведенной ниже последовательности (SEQ ID NO:5) жирным курсивом показан консенсусный промотор aprE, обычным шрифтом показана сигнальная последовательность, подчеркнута пропоследовательность, жирным шрифтом показана ДНК, кодирующая зрелую протеазу FNA, и подчеркнутым курсивом показан терминатор BPN'. Зрелая область FNA содержит сайты рестрикции KpnI и XhoI, используемые для клонирования (см. фигуру 5).
gaattcatctcaaaaaaatgggtctactaaaatattattccatctattataataaattcacagaatagtcttttaagtaagtctactctgaatttttttaaaaggagagggtaaaga gtgagaagcaaaaaattgtggatcagtttgctgtttgctttagcgttaatctttacgatggcgttcggcagcacatccagcgcgcaggctgcagggaaatcaaacggggaaaagaaatatattgtcgggtttaaacagacaatgagcacgatgagcgccgctaagaagaaagacgtcatttctgaaaaaggcgggaaagtgcaaaagcaattcaaatatgtagacgcagctagcgctacattaaacgaaaaagctgtaaaagaattgaaaaaagacccgagcgtcgcttacgttgaagaagatcacgtagcacacgcgtac gcgcagtccgtgccatatggcgtatcacaaattaaagcccctgctctgcactctcaaggctacaccggttcaaatgttaaagtagcggttatcgacagcggtatcgattcttctcatccagatcttaaagtagcaggcggagccagcatggttccttctgaaacaaatcctttccaagacaacaactctcacggaacacacgttgctggtaccgttgcggctcttaataactcaatcggtgtattaggcgttgcgccaagcgcatcactttacgctgtaaaagttctcggcgccgacggttccggccaatacagctggatcattaacggaatcgagtgggcgatcgcaaacaatatggacgttattaacatgagcctcggcggaccgtccggttctgctgctttaaaagcggcagttgataaagccgttgcatccggcgtcgtagtcgttgcggcagccggcaacgaaggcacttccggcagctcaagcacagtgggctaccctggtaaatacccttctgtcattgcagtaggcgctgtcgacagcagcaaccaaagagcatctttctcaagcgtaggacctgagctcgatgtcatggcacctggcgtatctatccaaagcacgcttcctggaaacaaatacggcgcgttgaacggtacatcaatggcatctccgcacgttgccggagccgcggctttgattctttctaagcacccgaactggacaaacactcaagtccgcagctctctagaaaacaccactacaaaacttggtgattctttctactatggaaaagggctgatcaatgtacaggcggcagctcagtaa aactcgagataaaaaaccggccttggccccgccggttttttat (SEQ ID NO:5).
Плазмида pAC-FNAre, показанная на фигуре 5, была использована для экспрессии протеазы FNA в B. subtilis. Плазмида включает следующие элементы: pUB110 = фрагмент ДНК из плазмиды pUB110 (McKenzie T., Hoshino T., Tanaka T., Sueoka N. (1986) The Nucleotide Sequence of pUB110: Some Salient Features in Relation to Replication and Its Regulation. Plasmid 15:93-103), pBR322 = фрагмент ДНК из плазмиды pBR322 (Bolivar F, Rodriguez RL, Greene PJ, Betlach MC, Heyneker HL, Boyer HW. (1977) Construction and characterization of new cloning vehicles. II. A multipurpose cloning system. Gene 2:95-113), pC194 = фрагмент ДНК из плазмиды pC194 (Horinouchi S., Weisblum B. (1982) Nucleotide sequence and functional map of pC194, a plasmid that specifies inducible chloramphenicol resistance. J. Bacteriol. 150:815-825).
Плазмида имеет следующие признаки: точка начала репликации для B. subtilis = точка начала репликации из pUB110, CAT = ген устойчивости к хлорамфениколу из рС194, точка начала репликации pMB1 = точка начала репликации из pBR322, bla = бета-лактамаза из pBR322, короткий промотор aprE = консенсусный промотор транскрипции, сигнальный пептид = сигнальный пептид [задан], пропептид = прообласть FNA, зрелый пептид FNA = зрелый FNA (заменен кодирующими областями для каждого варианта, экспрессированного в данном исследовании), терминатор BPN' = терминатор транскрипции из субтилизина BPN'.
Ниже приведена аминокислотная последовательности белка-предшественника FNA (SEQ ID NO:6). В данной последовательности жирным шрифтом показана зрелая протеаза FNA (дикого типа), которая представлена также как SEQ ID NO:7: MRSKKLWISLLFALALIFTMAFGSTSSAQAAGKSNGEKKYIVGFKQTMSTMSAAKKKDVISEKGGKVQKQFKYVDAASATLNEKAVKELKKDPSVAYVEEDHVAHAYAQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGVVVVAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGALNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ*(SEQ ID NO:6).
AQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGVVVVAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGALNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ*(SEQ ID NO:7)
Создание и синтез комбинаторных библиотек заряда/гидрофобности субтилизина BPN'-Y217L (=FNA)
Комбинаторная библиотека заряда/гидрофобности субтилизина BPN'-Y217L создана путем идентификации семи хорошо распределенных поверхностных аминокислот. Указанными остатками являются S24, A45, S101, N109, N118, K213 и L217. Комбинаторная библиотека гидрофобности, состоящая из 32 членов (FH2-FH33), была создана путем составления комбинаций из четырех возможных остатков на каждом сайте: дикий тип, глутамин (Q), глутаминовая кислота (Е), лейцин (L) и аргинин (R), показанных в таблице 3-1.
Плазмида pAC-FNAre, содержащая ген FNA, была отправлена в DNA 2.0 Inc. (Menlo Park, CA) для создания комбинаторных библиотек гидрофобности. Штамм Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo) был использован для трансформации ДНК, кодирующей замены вариантов FNA. Варианты были получены в виде смеси с глицерином на 96-луночных планшетах.
В таблице 3-1 показаны замены, выполненные в FNA для создания вариантов. В таблице 3-1 также показано отличие суммарного заряда и гидрофобности у варианта FNA и протеазы дикого типа.
Экспрессия вариантов протеазы
Клоны Bacillus subtilis, содержащие векторы экспрессии GG36 или FNA, реплицировали при помощи стального 96-луночного репликатора из смесей с глицерином на 96-луночных культуральных планшетах (Becton Dickinson, 353075), содержащих 200 мкл среды LB + 25 мкг/мл хлорамфеникола, выращивали в течение ночи при 37°С и скорости встряхивания 220 оборотов/мин в увлажненной оболочке. 200 мкл культуры, выращенной в течение ночи, использовали для инокуляции 2000 мкл среды определенного состава + 25 мкг/мл хлорамфеникола в 5 мл пластиковых встряхиваемых пробирках. Среда для выращивания была обогащена средой полуопределенного состава на основе буфера МОР с использованием мочевины в качестве основного источника азота, глюкозы в качестве основного источника углерода и содержала 1% сои для устойчивого роста клеток. Встряхиваемые пробирки инкубировали при 37°С и скорости встряхивания 220 оборотов/мин в течение 60 часов. Через 60 часов супернатанты центрифугировали в центрифуге с ускорением более 8000 х RCF. Раствор декантировали в 15 мл полипропиленовые конические пробирки для хранения. Дальнейшую очистку или концентрирование не производили. Супернатант смешивали с 40% пропиленгликоля для достижения длительной устойчивости и хранили при 4°С.
|
Пример 4
Оценка удаления пятен и относительной экспрессии
В данном примере описано исследование вариантов GG36 и FNA комбинаторной библиотеки гидрофобности при выполнении анализа BMI микрообразцом ткани. Были использованы методы, описанные в примере 1. Результаты, приведенные в таблицах 4-1 (GG36) и 4-2 (FNA), представляют собой индексы продуктивности, предназначенные для сравнения продуктивности варианта с соответствующим исходным ферментом в отношении относительной экспрессии белка (ТСА PI) и активности по удалению пятен (BMI PI). Варианты, имеющие индекс продуктивности больше 0,5 (PI >0,5), обладают лучшей продуктивностью. Индексы продуктивности, меньше или равные 0,05, были заданы равными 0,05 и указаны жирным курсивом. Аббревиатура ”ND” означает, что определение не производилось.
|
|
|
|
|
|
Все патенты и публикации, представленные в настоящем описании изобретения, приведены для сведения специалистов в данной области, к которой относится настоящее изобретение. Специалистам в данной области должно быть понятно, что настоящее изобретение позволяет легко осуществить аспекты изобретения, достичь конечные цели и реализовать указанные и подразумеваемые преимущества настоящего изобретения. Композиции и способы, рассмотренные в настоящем описании изобретения, являются предпочтительными вариантами осуществления изобретения, служат для иллюстрации изобретения и не ограничивают объем изобретения. Специалисту в данной области должно быть понятно, что в данное изобретение могут быть внесены разные изменения и модификации, не выходящие за пределы существа и объема изобретения.
Настоящее изобретение, иллюстративно рассмотренное в настоящем описании изобретения, может быть осуществлено при отсутствии любого элемента или элементов, ограничения или ограничений, не указанных специально в настоящем описании изобретения. Использованные термины и выражения служат для описания, а не для ограничения изобретения, при этом следует отметить, что в определения таких терминов и выражений входят все возможные эквиваленты описанных признаков или их частей и объем заявленного изобретения предполагает разные модификации. Таким образом, очевидно, что, хотя настоящее изобретение описано со ссылкой на предпочтительные варианты осуществления и необязательные признаки, специалисты в данной области могут вносить модификации и изменения в объекты данного изобретения, и такие модификации и изменения входят в объем настоящего изобретения.
В настоящем описании изобретения дано широкое и общее представление об изобретении. Все более узкие и менее общие объекты, входящие в общее описание, также являются частью настоящего изобретения. Вышеизложенное относится к общему описанию изобретения за исключением негативного признака, удаляющего любой объект из общего описания независимо от его упоминания в настоящем описании изобретения.