Результат интеллектуальной деятельности: ФЕРМЕНТНАЯ КОМПОЗИЦИЯ, СПОСОБНАЯ ЭФФЕКТИВНО РАЗЛАГАТЬ ЦЕЛЛЮЛОЗНЫЙ МАТЕРИАЛ
Вид РИД
Изобретение
ПРИОРИТЕТ
Настоящая заявка заявляет приоритет предварительной заявки на патент США № 61/048807, поданной 29 апреля 2008 года, которая включена в настоящее изобретение посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Композиции и способы относятся к увеличению эффективности целлюлазы при производстве сахаров из целлюлозных биомасс с использованием полипептида сволленина.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
В настоящее время возрастает интерес к этанолу в качестве возобновляемого топлива. Использование этанола в качестве присадки к топливу возросло за последние несколько лет и, как ожидается, продолжит расти в обозримом будущем. Использование этанола уменьшает зависимость от импортной нефти, способствует уменьшению выделения вызывающих парниковый эффект газов, обеспечивает экономические выгоды для сельских жителей и создает основу для экономики на основе биоресурсов.
Возможное сырье для целлюлозного этанола включает кукурузную солому, пшеничную солому, тростниково-сахарную багассу, стебли риса, бумажную массу, древесную стружку и биомассу из сельскохозяйственных культур, используемых в качестве источника топлива, таких как быстрорастущие деревья и травы (просо прутьевидное, спороболус, китайский тростник), значительно расширяющие имеющийся в наличии материал для продукции этанола. Хотя целлюлозная биомасса имеется в наличии в больших количествах, основная трудность при промышленном внедрении заключается в снижении затрат на комплексный процесс получения топлива из биомассы, с помощью которого в конечном счете получают этанол. В отличие от крахмала, который содержит гомогенные и легко гидролизуемые полимеры, типичные целлюлозные субстраты/сырье для использования при получении этанола не являются гомогенными по природе. Помимо поддающейся превращению целлюлозы и гемицеллюлозы, они также содержат лигнин и другие компоненты, которые не могут быть легко превращены в сбраживаемые сахара.
Как правило, сырая биомасса должна быть подвергнута тщательной предварительной обработке химическим, физическим или биологическим способом для получения подходящего субстрата/сырья для продукции этанола. Физические методы предварительной обработки включают один или более различных типов измельчения, дробления, облучения, пропаривания/обработки паром и гидротермолиза. Химические методы предварительной обработки включают кислоту, щелочь, органический растворитель, аммиак, диоксид серы, диоксид углерода и гидротермолиз с контролированием рН.
Сохраняется насущная необходимость в уменьшении количества гидролитических ферментов, необходимых для превращения биомассы в сбраживаемый сахар, и/или уменьшении степени предварительной обработки, необходимой для того, чтобы биомасса стала доступной для гидролитических ферментов.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте предоставляется способ увеличения эффективности целлюлазы, включающий (а) объединение целлюлозного субстрата, количества цельной целлюлазы и количества сволленина и (b) инкубирование целлюлозного субстрата, смешанной целлюлазной композиции и сволленина в условиях, благоприятных для гидролиза целлюлозы. В предпочтительном осуществлении целлюлозный субстрат включает молекулы, связанные водородной связью. Целлюлозный субстрат может быть выбран из группы, состоящей из древесины, древесной массы, пульпы для изготовления бумаги, совокупности отходов всех видов бумажной массы, прессованной древесины, кукурузной соломы, кукурузного волокна, риса, отходов производства бумаги и целлюлозы, древесных или травянистых растений, трав, рисовой шелухи, соломы хлопчатника, стержней кукурузного початка, зерновой барды, листьев, пшеничной соломы, волокна кокосового ореха, проса прутьевидного и их смесей.
В связанном аспекте предоставляется способ увеличения эффективности гидролиза целлюлозы путем использования целлюлазы, включающий (а) объединение целлюлозного субстрата, целлюлазной композиции и рекомбинантного сволленина и (b) инкубирование целлюлозного субстрата, целлюлазной композиции и сволленина в условиях, благоприятных для гидролиза целлюлозы, причем присутствие рекомбинантного сволленина увеличивает эффективность гидролиза целлюлозы целлюлазной композицией по сравнению с эффективностью, получаемой с использованием целлюлазной композиции в отсутствие сволленина.
В некоторых вариантах осуществления целлюлазная композиция являются цельной целлюлазной композицией. В некоторых вариантах осуществления целлюлазная композиция являются смешанной целлюлазной композицией. В некоторых вариантах осуществления целлюлазная композиция включает эндоглюканазу, целлобиогидролазы и β-глюкозидазу.
В некоторых вариантах осуществления целлюлазная композиция включает одну или несколько первичных целлюлаз. В некоторых вариантах осуществления целлюлазная композиция состоит по существу из одной или нескольких первичных целлюлаз. В конкретных вариантах осуществления первичные целлюлазы выбирают из CBH1, CBH2, EG1, EG2 и β-глюкозидазы.
В некоторых вариантах осуществления способ выполняют в отсутствие вспомогательных ферментов, отличных от сволленина.
В некоторых вариантах осуществления способ выполняют в отсутствие EG4 и CIP1. В некоторых вариантах осуществления способ выполняют в отсутствие рекомбинантного EG4 или рекомбинантного CIP1. В некоторых вариантах осуществления способ выполняют в отсутствие рекомбинантного EG4 и рекомбинантного CIP1.
В некоторых вариантах осуществления соотношение целлюлаз в целлюлазной композиция и сволленина (в весовом отношении) составляет между приблизительно 20:1 и приблизительно 1:5. В некоторых вариантах осуществления соотношение целлюлаз в целлюлазной композиция и сволленина (в весовом отношении) составляет между приблизительно 10:1 и приблизительно 1:2. В некоторых вариантах осуществления соотношение целлюлаз в целлюлазной композиция и сволленина (в весовом отношении) составляет между приблизительно 5:1 и приблизительно 1:1,5.
В некоторых вариантах осуществления сволленин и целлюлазы присутствуют в приблизительно равном количестве (в весовом отношении). Приводимые в качестве примеров количества сволленина составляют от приблизительно 30% до приблизительно 70%, от приблизительно 40% до приблизительно 60% и приблизительно 50% от общего количества используемых в способе ферментов (в весовом отношении).
В некоторых вариантах осуществления целлюлозный субстрат выбирают из группы, состоящей из древесины, древесной массы, пульпы для изготовления бумаги, совокупности отходов всех видов бумажной массы, прессованной древесины, кукурузной соломы, кукурузного волокна, риса, отходов производства бумаги и целлюлозы, древесных или травянистых растений, трав, рисовой шелухи, соломы хлопчатника, стержней кукурузного початка, зерновой барды, листьев, пшеничной соломы, волокна кокосового ореха, проса прутьевидного и их смесей. В некоторых вариантах осуществления целлюлозным субстратом является древесина мягких пород деревьев (хвойная древесина). В некоторых вариантах осуществления целлюлозным субстратом является субстрат с высоким содержанием лигнина. В некоторых вариантах осуществления целлюлозный субстрат имеет перманганатное число, составляющее 80 или ее.
В некоторых вариантах осуществления увеличение в процентах эффективности целлюлазы составляет по крайней мере приблизительно 10%, по крайней мере приблизительно 15% или даже по крайней мере приблизительно 20%.
В другом аспекте предоставляется ферментная композиция, включающая смешанную или цельную целлюлазную композицию и сволленин. Соотношение смешанной/цельной целлюлазы и сволленина (в весовом отношении) может находиться между приблизительно 20:1 и приблизительно 1:5, включительно. Соотношение смешанной целлюлазы и сволленина (в весовом отношении) может, кроме того, находиться между приблизительно 10:1 и приблизительно 1:2, включительно. Соотношение смешанной целлюлазы и сволленина (в весовом отношении) может даже находиться между приблизительно 5:1 и приблизительно 1:1,5, включительно.
В связанном аспекте предоставляется ферментная композиция, включающая (а) смешанную целлюлазную композицию, включающую эндоглюканазу, целлобиогидролазы и β-глюкозидазу, и (b) рекомбинантный сволленин.
В некоторых вариантах осуществления композиция не включает EG4 или CIP1. В некоторых вариантах осуществления композиция не включает рекомбинантный EG4 или рекомбинантный CIP1. В некоторых вариантах осуществления композиция не включает рекомбинантный EG4 и не включает рекомбинантный CIP1.
В некоторых вариантах осуществления смешанная целлюлазная композиция состоит по существу из основных целлюлаз.
В другом связанном аспекте предоставляется ферментная композиция, состоящая по существу из (а) смешанной целлюлазной композиции, включающей эндоглюканазу, целлобиогидролазы и β-глюкозидазу, и (b) рекомбинантного сволленина.
В некоторых вариантах осуществления соотношение целлюлаз в любой из смешанных целлюлазных композиций и сволленина (в весовом отношении) находится между приблизительно 20:1 и приблизительно 1:5. В некоторых вариантах осуществления соотношение целлюлаз в любой из смешанных целлюлазных композиций и сволленина (в весовом отношении) находится между приблизительно 10:1 и приблизительно 1:2. Заявлена композиция, в которой соотношение целлюлаз в любой из смешанных целлюлазных композиций и сволленина (в весовом отношении) находится между приблизительно 5:1 и приблизительно 1:1,5. В некоторых вариантах осуществления сволленин и целлюлазы присутствуют в приблизительно равном количестве (в весовом отношении).
В некоторых вариантах осуществления количество сволленина (в весовом отношении) в композиции замещает приблизительно равное количество целлюлаз (в весовом отношении) в композиции относительно эффективности целлюлаз на целлюлозном субстрате.
Эти и другие аспекты композиций и способов будут очевидны из следующего описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 иллюстрируется продукция глюкозы с помощью смешанной целлюлазной композиции в присутствии сволленина и в его отсутствие.
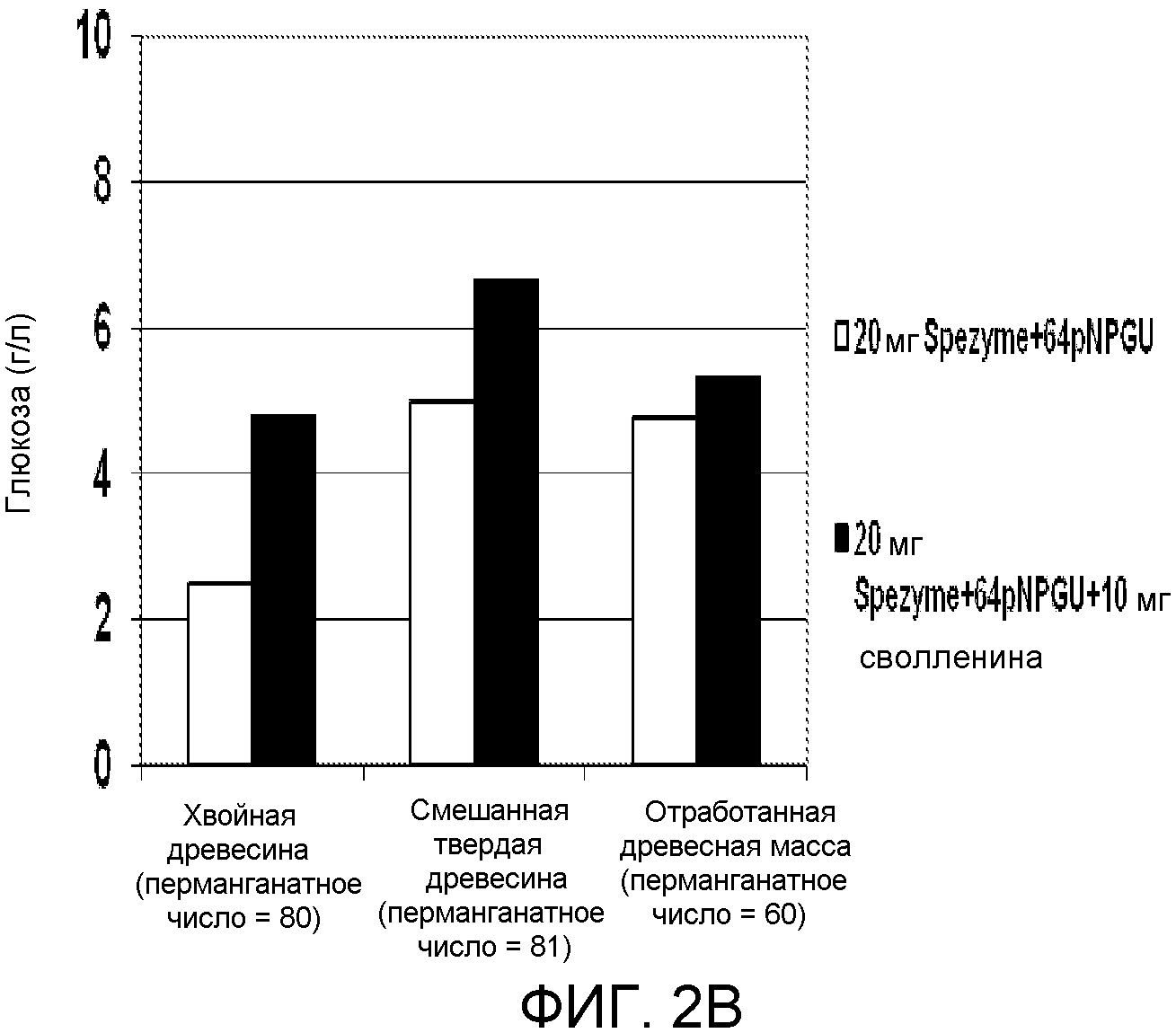
На фиг.2А и 2В иллюстрируется влияние сволленина на гидролиз различных целлюлозных субстратов.
На фиг.3 иллюстрируется получение глюкозы с помощью 30 мг общего фермента на г целлюлозы, при этом для фермента предусматривались различные соотношения смешанной целлюлазы и сволленина.
На фиг.4 иллюстрируется расщепление в процентах хвойной целлюлозы при различных относительных концентрациях смешанной целлюлазы и сволленина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Перед описанием композиций и способов настоящего изобретения даются определения следующих терминов и выражений. Не определенным терминам должно соответствовать их обычное значение, используемое в данной области техники.
Как используется в тексте заявки термин «сволленин» относится к белку/полипептиду, который способствует потере прочности фильтровальной бумаги и набуханию хлопковолокна без проявления целлюлолитической активности, т.е. каталитической активности, включающей расщепление отдельных цепей целлюлозы до мономера (глюкозы) или олигомера (полисахаридов). Хотя он применим для приблизительной характеристики сволленинов в рамках белков экспансинов, описанных McQueen-Mason (1992) в Plant Cell 4: 1425-1433, также очевидно, что микробные сволленины отличаются по свойствам, например микробные сволленины больше, чем экспансины растений, и имеют низкий уровень идентичности последовательностей с экспансинами растений. Кроме того, некоторые микробные белки сволленины существуют в соединении со связывающим целлюлозу доменом и могут, кроме того, существовать в соединении с каталитическим доменом целлюлазы.
Используемый здесь термин «целлюлозный субстрат» или «целлюлозное сырье» относится к материалам, состоящим из целлюлозы, гемицеллюлозы и β-глюканов, которые являются сшитыми друг с другом и с лигнином. Такие целлюлозные субстраты могут также содержать другие материалы, такие как пектины, белки, крахмал и липиды, но предпочтительно будут иметь целлюлозу, гемицеллюлозу и β-глюканы в качестве основных компонентов.
Используемые здесь термины «очистка» и «выделение», со ссылкой на сволленин, относится к отделению сволленина от некоторых или всех встречающихся в природе компонентов, с которыми он связан в природе, или от некоторых или всех компонентов, с которыми он связан после гетерологичной экспрессии. Термин «компоненты» обычно относится к другим белкам, нуклеиновым кислотам, липидам, материалу клеточной стенки и другим клеточным компонентам.
Используемый здесь термин «перманганатное число» относится к степени лигнификации целлюлозного субстрата. Перманганатные числа можно определить, используя, например, документ Международной организации по стандартизации ISO 302: 2004.
Используемый здесь термин «целлюлоза» относится к полисахариду, состоящему из β(1→4)-связанных единиц D-глюкозы, имеющему общую формулу (С6Н10О5)n. Целлюлоза является структурным компонентом первичной клеточной стенки зеленых растений, многих форм водорослей и оомицетов.
Используемый здесь термин «целлюлаза» относится к ферменту, способному к гидролизу полимеров - целлюлозы на более короткие олигомеры и/или глюкозу.
Используемый здесь термин «цельная целлюлазная композиция/препарат/смесь» или т.п. относится как к встречающимся в природе, так и к не встречающимся в природе композициям, которые включают множество целлюлаз, продуцируемых организмом, например нитчатым грибом. Одним примером цельной целлюлазной композиции является среда (т.е. бульон), в которой культивируют нитчатые грибы, которая включает секретируемые целлюлазы, такие как одна или несколько целлобиогидролаз, одна или несколько эндоглюканаз и одна или несколько β-глюкозидаз в заданном соотношении.
Как используется в тексте заявки «эндоглюканаза (EG)» является ферментом (ЕС 3.2.1.4), который воздействует, главным образом, на аморфные части целлюлозного волокна с гидролизом внутренних β-1,4-глюкозидных связей в районах низкой кристалличности.
Как используется в тексте заявки «целлобиогидролаза (СВН)» или «экзоглюканаза является ферментом (ЕС 3.2.1.91), который гидролизует целлобиозу с восстанавливающего или невосстанавливающего конца целлюлозы с деградацией кристаллической целлюлозы.
Как используется в тексте заявки «β-глюкозидаза» или «β-D-глюкозид-глюкогидроза» является ферментом (ЕС 3.2.1.21), который действует с высвобождением единиц D-глюкозы из целлобиозы, целлоолигосахаридов и других глюкозидов.
Как используется в тексте заявки «гемицеллюлаза» является полимерным компонентом растительных материалов, который содержит сахарные мономеры, отличные от глюкозы, в противоположность целлюлозе, которая содержит только глюкозу. Помимо глюкозы, гемицеллюлоза может включать ксилозу, маннозу, галактозу, рамнозу и арабинозу и т.п., при этом самым часто встречающимся сахарным мономером является ксилоза. Гемицеллюлозы содержат большинство из D-пентозных сахаров и изредка небольшие количества L-сахаров. Сахара в гемицеллюлозе могут быть связаны сложноэфирными связями, а также гликозидными связями. Приводимые в качестве примеров формы гемицеллюлозы включают, но без ограничения, галактан, маннан, ксилан, арабанан, арабиноксилан, глюкоманнан, галактоманан и т.п.
Используемый здесь термин «гемицеллюлаза» относится к классу ферментов, способных к разрыву гемицеллюлозы на составляющие его сахара или более короткие полимеры, и включает эндодействующие гидролазы, экзодействующие гидролазы и различные эстеразы.
Как используется в тексте заявки «основная целлюлаза» или «основной целлюлолитический фермент» представляет собой целлюлазу, которая необходима для эффективного гидролиза целлюлозы или для продукции глюкозы из целлюлозного субстрата. Основные целлюлазы включают CBH1, CBH2, EG1, EG2 и β-глюкозидазу.
Используемый термин «вспомогательный фермент» относится к ферменту, который может быть включен в целлюлазную композицию для увеличения эффективности целлюлазы (или комбинации целлюлаз), но не требуется для эффективного гидролиза целлюлозы или продукции глюкозы из целлюлозного субстрата. Вспомогательные ферменты включают сволленин, EG4, стимулируемый целлюлозой белок (CIP1) и ксиланазу.
Как используется в тексте заявки «встречающаяся в природе» композиция является композицией, которая продуцируется в природе или организмом, который встречается в природе.
Как используется в тексте заявки «вариант» белка отличается от «родительского» белка, из которого он происходит, при замене, делеции или добавлении небольшого числа аминокислотных остатков, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более аминокислотных остатков. В некоторых случаях исходным белком является полипептид «дикого типа», «природный» полипептид или полипептид «природного происхождения». Варианты белков можно охарактеризовать как белки, имеющие определенный процент идентичности последовательностей с родительским белком, например, по крайней мере 80%, по крайней мере 81%, по крайней мере 82%, по крайней мере 83%, по крайней мере 84%, по крайней мере 85%, по крайней мере 86%, по крайней мере 87%, по крайней мере 88%, по крайней мере 89%, по крайней мере 90%, по крайней мере 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98%, даже по крайней мере 99%, который можно определить, используя любую подходящую программу, известную в данной области техники, например, программы, описанные в Current Protocols in Molecular Biology (Ausubel et al. (eds.) (1987) Supplement 30, section 7.7.18). Предпочтительные программы включают VECTOR NTI ADVANCETM 9.0 (Invitrogen Corp. Carlbad, CA), программу GCG PILEUP, FASTA (Pearson et al. (1988) Pros. Natl. Acad. Sci. USA 85: 2444-2448) и BLAST (BLAST Manual, Altschul et al., Nat'l. Cent. Biotechnol. Inf., Nat'l Lib. Med. (NCIB NLM NIH), Bethesda, Md., и Altschul et al. (1987) Nucleic Acids Res. 25: 3389-3402). Другой предпочтительной программой совмещения является ALIGN Plus (Scientific and Educational Software, PA), используя предпочтительно параметры по умолчанию. Другой программой для последовательностей, которая находит применение, является программа для поиска данных TFASTA, имеющаяся в версии 6.0 пакета программ для последовательностей (Genetics Computer Group, University of Wisconsin, Madison, WI).
Использование единственного числа включает множественное число, кроме особо оговоренных случаев, а использование «или» означает «и/или», кроме особо оговоренных случаев. Не предполагается, что термины «включают», «включающий» и «включает» являются ограничивающими. Термин «по существу состоящий из» означает, что другие компоненты или стадии могут необязательно присутствовать, но они не являются существенными для вызова описываемого эффекта.
Все упоминаемые здесь патенты и публикации, в том числе все аминокислотные и нуклеотидные последовательности, раскрытые в таких патентах и публикациях, включены посредством ссылки.
Следующие сокращения/акронимы имеют следующие значения, кроме случаев, оговоренных особо:
|
|
|
II. Применение сволленина для увеличения выхода сахара из целлюлозного сырья
Аспект композиций и способов относится к увеличению выхода сахара из целлюлозного сырья/целлюлозных субстратов путем дополнения целлюлазной композиции сволленином. В одном аспекте предоставляется способ усиления ферментативного гидролиза целлюлозы, включающий (а) объединение целлюлозного субстрата, смешанной целлюлазной композиции и сволленина и (b) инкубирование целлюлозного субстрата, смешанной целлюлазной композиции и сволленина в условиях, благоприятных для гидролиза целлюлозы. Композиции и способы основываются на удивительном экспериментальном определении того, что замещение вплоть до 50% смешанной целлюлазной композиции сволленином может в значительной степени увеличить количество сбраживаемого сахара, образуемого из целлюлозного субстрата.
Был идентифицирован ряд белков, названных «экспансинами», в ряде пищевых растений. Полагают, что эти экспансины усиливают поступление воды по осмотическому пути, которое является движущей силой растяжения клеток растений. По мере того как вода поступает в клетку, протопласт увеличивается в объеме, но сдерживается клеточной стенкой, которая удерживается от распада устойчивым комплексом полимеров микрофибрилл целлюлозы, встроенных в клеевидный матрикс из пектинов, гемицеллюлозы и белков. Семейство белков экспансинов, обнаруженных в различных фруктах, овощах, зернах и овсе, функционирует в качестве такого «ослабляющего стенку» фактора, который изменяет механические свойства стенки незрелой клетки и позволяет ей подвергаться процессу растяжения (смотри, например, Shcherban et al. (1995) Proc. Nat'l. Acad. Sci. USA 92: 9245-9249; Wang et al. (1994) Biotech. Lett. 16: 955-958; Keller et al. (1995) The Plant Journal 8: 795-802; Li et al. (1993) Planta, Vol. 191, p. 349-356). Экспансины играют важную роль в росте клеток растений, размягчении мякоти плода, сбрасывании, появлении корневых волосков, проникновении пыльцевых трубок с рыльца и столбика, функционировании меристемы и в других процессах развития, при которых имеет место ослабление клеточной стенки.
Совсем недавно были идентифицированными подобные экспансинам ферменты в микробах в качестве хозяина. Один такой фермент, названный «сволленином», полученный из Trichoderma reesei, описывается в патенте США № 6458928 (включенном сюда посредством ссылки). Последовательность сволленина частично сходна с экспансинами растений, которые, как полагают, разрывают водородные связи между полисахаридами в клеточной стенке. Последовательность природного полипептида, включающая N-концевой сигнальный пептид, представлена как SEQ ID NO: 1. Последовательность зрелого полипептида представлена как SEQ ID NO: 2. В отличие от экспансинов зрелый сволленин включает на своем N-конце связывающий целлюлозу домен (CBD), который связан через линкерный участок с экспансиноподобным доменом. CBD этого вида также встречается в широко известных целлюлазах T.reesei, таких как CBH I и EG II. В отличие от сволленина целлюлазы являются гидролитическими ферментами, по крайней мере в некоторой степени.
MetAlaGlyLysLeuIleLeuValAlaLeuAlaSerLeuValSerLeuSerlleGlnGln AsnCysAlaAlaLeuPheGlyGlnCysGlyGlylleGlyTrpSerGlyThrThrCysCys ValAlaGlyAlaGlnCysSerPheValAsnAspTrpTyrSerGlnCysLeuAlaSerThr GlyGlyAsnProProAsnGlyThrThrSerSerSerLeuValSerArgThrSerSerAla SerSerSerValGlySerSerSerProGlyGlyAsnSerProThrGlySerAlaSerThr TyrThrThrThrAspThrAlaThrValAlaProHisSerGlnSerProTyrProSerlle AlaAlaSerSerCysC-lySerTrpThrLeuValAspAsnValCysCysProSerTyrCys AlaAsnAspAspThrSerGluSerCysSerGlyCysGlyThrCysThrThrProProSer AlaAspCysLysSerC-lyThrMetTyrProGluValHisHisValSerSerAsnGluSer TrpHisTyrSerArgSerThrHisPheGlyLeuThrSerGlyGlyAlaCysGlyPheGly LeuTyrGlyLeuCysThrLysGlySerValThrAlaSerTrpThrAspProMetLeuGly AlaThrCysAspAlaPheCysThrAlaTyrProLeuLeuCysLysAspProThrGlyThr ThrLeuArgGlyAsnPheAlaAlaProAsnGlyAspTyrTyrThrGlnPheTrpSerSer LeuProGlyAlaLeuAspAsnTyrLeuSerCysGlyGluCysIleGluLeuIleGlnThr LysProAspGlyThrAspTyrAlaValGlyGluAlaGlyTyrThrAspProIleThrLeu GluIleValAspSerCysProCysSerAlaAsnSerLysTrpCysCysGlyProGlyAla AspHisCysGlyGluIleAspPheLysTyrGlyCysProLeuProAlaAspSerlleHis LeuAspLeuSerAspIleAlaMetGlyArgLeuGlnGlyAsnGlySerLeuThrAsnGly VallleProThrArgTyrArgArgValGlnCysProLysValGlyAsnAlaTyrlleTrp LeuArgAsnGlyGlyGlyProTyrTyrPheAlaLeuThrAlaValAsnThrAsnGlyPro GlySerValThrLysIleGluIleLysGlyAlaAspThrAspAsnTrpValAlaLeuVal HisAspProAsnTyrThrSerSerArgProGlnGluArgTyrGlySerTrpValllePro GlnGlySerGlyProPheAsnLeuProValGlylleArgLeuThrSerProThrGlyGlu GlnlleValAsnGluC-lnAlalleLysThrPheThrProProAlaThrGlyAspProAsn PheTyrTyrlleAspIleGlyValGlnPheSerGlnAsn (SEQ ID NO: 1)
GlnGlnAsnCysAlaAlaLeuPheGlyGlnCysGlyGlylleGlyTrpSerGlyThrThr CysCysValAlaGlyAlaGlnCysSerPheValAsnAspTrpTyrSerGlnCysLeuAla SerThrGlyGlyAsnProProAsnGlyThrThrSerSerSerLeuValSerArgThrSer SerAlaSerSerSerValGlySerSerSerProGlyGlyAsnSerProThrGlySerAla SerThrTyrThrThrThrAspThrAlaThrValAlaProHisSerGlnSerProTyrPro SerlleAlaAlaSerSerCysGlySerTrpThrLeuValAspAsnValCysCysProSer TyrCysAlaAsnAspAspThrSerGluSerCysSerGlyCysGlyThrCysThrThrPro ProSerAlaAspCysLysSerGlyThrMetTyrProGluValHisHisValSerSerAsn GluSerTrpHisTyrSerArgSerThrHisPheGlyLeuThrSerGlyGlyAlaCysGly PheGlyLeuTyrGlyLeuCysThrLysGlySerValThrAlaSerTrpThrAspProMet LeuGlyAlaThrCysAspAlaPheCysThrAlaTyrProLeuLeuCysLysAspProThr GlyThrThrLeuArgC-lyAsnPheAlaAlaProAsnGlyAspTyrTyrThrGlnPheTrp
SerSerLeuProGlyAlaLeuAspAsnTyrLeuSerCysGlyGluCysIleGluLeuIle GlnThrLysProAspC-lyThrAspTyrAlaValGlyGluAlaGlyTyrThrAspProIle ThrLeuGluIleValAspSerCysProCysSerAlaAsnSerLysTrpCysCysGlyPro GlyAlaAspHisCysGlyGluIleAspPheLysTyrGlyCysProLeuProAlaAspSer IleHisLeuAspLeuSerAspIleAlaMetGlyArgLeuGlnGlyAsnGlySerLeuThr AsnGlyVallleProThrArgTyrArgArgValGlnCysProLysValGlyAsnAlaTyr IleTrpLeuArgAsnC-lyGlyGlyProTyrTyrPheAlaLeuThrAlaValAsnThrAsn GlyProGlySerValThrLysIleGluIleLysGlyAlaAspThrAspAsnTrpValAla LeuValHisAspProAsnTyrThrSerSerArgProGlnGluArgTyrGlySerTrpVal IleProGlnGlySerGlyProPheAsnLeuProValGlylleArgLeuThrSerProThr GlyGluGlnlleValAsnGluGlnAlalleLysThrPheThrProProAlaThrGlyAsp ProAsnPheTyrTyrlleAspIleGlyValGlnPheSerGlnAsn (SEQ ID NO:2)
В некоторых вариантах осуществления сволленин является встречающимся в природе вариантом сволленина T.reesei, аминокислотная последовательность которого идентична на по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98% или даже по крайней мере 99% аминокислотной последовательности SEQ ID NO: 1. В некоторых вариантах осуществления сволленин получен из отличного организма и его аминокислотная последовательность идентична на по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98% или даже по крайней мере 99% аминокислотной последовательности SEQ ID NO: 1.
В дальнейших вариантах осуществления сволленин является искусственно созданным вариантом сволленина, который включает по крайней мере одну замену, вставку или делецию, которая придает выгодное свойство сволленину и в котором оставшаяся часть аминокислотной последовательности (т.е. не включающая одну или несколько замен, вставок или делеций) идентична на по крайней мере 80%, по крайней мере 85%, по крайней мере 90%, по крайней мере 91%, по крайней мере 92%, по крайней мере 93%, по крайней мере 94%, по крайней мере 95%, по крайней мере 96%, по крайней мере 97%, по крайней мере 98% или даже по крайней мере 99% аминокислотной последовательности SEQ ID NO: 1. Замена, вставка или делеция может быть в N-концевом CBD, что оказывает влияние на связывание с целлюлозой, или в части полипептида, отличной от CBD, что оказывает влияние, например, на разрыв водородных связей в целлюлозном субстрате. В связанных вариантах осуществления сволленин представляет собой фрагмент или домен сволленина, который сохраняют описанную здесь биологическую активность. В конкретных вариантах осуществления во фрагменте отсутствует CBD.
Подходящие для использования со сволленином целлюлозные субстраты включают древесину, древесную массу, пульпу для изготовления бумаги, совокупности отходов всех видов бумажной массы, прессованную древесину, кукурузную солому, кукурузное волокно, рис, отходы производства бумаги и целлюлозы, древесные или травянистые растения, травы, рисовую шелуху, солому хлопчатника, стержни кукурузного початка, зерновую барду, листья, пшеничную солому, волокно кокосового ореха, просо прутьевидного и их смеси. Аспектом композиций и способов настоящего изобретения является обнаружение того, что добавление сволленина к целлюлазе увеличивает продукцию сахара при использовании субстратов на основе древесных и травянистых растений. С одной стороны, полагают, что сволленин не является полезным при использовании с субстратами на основе зерен или фруктов. Как правило, благодаря способности сволленина к разрыву водородной связи любой субстрат, в котором водородная связь является преобладающей (например, кристаллическая целлюлоза), по-видимому, является чувствительным к активности сволленина и, следовательно, является подходящим субстратом. Приводимые в качестве примеров целлюлозные субстраты имеют высокое содержание лигнина, как в случае, например, хвойных древесин. В некоторых случаях целлюлозный субстрат имеет перманганатное число, составляющее 80 или больше, например, 80, 81, 82 или больше.
Целлюлозный субстрат может использоваться непосредственно (т.е. без предварительной обработки) или может быть подвергнут предварительной обработке с использованием общепринятых способов, которые известны в данной области техники. Приводимые в качестве примеров варианты осуществления предварительной обработки являются химические, физические и биологические вариант(ы) предварительных обработок. Физические методы предварительной обработки включают, без ограничения, различные типы измельчения, дробления, пропаривания/обработки паром, облучения и гидротермолизиса. Химические методы предварительной обработки включают, без ограничения, разбавленную кислоту, щелочь, органический растворитель, аммиак, диоксид серы, диоксид углерода и гидротермолизис с контролированием рН. Биологические методы предварительной обработки включают, без ограничения, применение растворяющих лигнин микроорганизмов к субстрату.
Ферментативный гидролиз целлюлозы предпочтительно выполняют при температуре в диапазоне от приблизительно 45°С до приблизительно 75°С и при рН от приблизительно 3,5 до приблизительно 7,5. Исходная концентрация целлюлозы в предназначенном для гидролиза реакторе, до начала гидролиза, предпочтительно составляет от приблизительно 4% (в весовом отношении) до приблизительно 15% (в весовом отношении). Объединенная доза всех ферментов в виде основных целлюлаз может составлять от приблизительно 5 до приблизительно 45 мг белка на грамм целлюлозы. Гидролиз может выполняться в течение периода времени, составляющего от приблизительно 12 часов до приблизительно 200 часов. Предпочтительно гидролиз выполняют в течение периода времени, составляющего от приблизительно 15 часов до 100 часов. Должно быть понятно, что условия реакции, как подразумевается, не ограничивают настоящее изобретение никоим образом и могут регулироваться по желанию квалифицированными в данной области техники специалистами.
Предпочтительно процесс гидролиза превращает от приблизительно 80% до приблизительно 100%, или любой занимающий промежуточное положение диапазон, целлюлозы в растворимые сахара. Более предпочтительно процесс ферментативного гидролиза превращает от приблизительно 90% до приблизительно 100% целлюлозы в растворимые сахара или даже от приблизительно 98% до приблизительно 100% целлюлозы в растворимые сахара.
Гидролиз с использованием смешанной целлюлазной композиции и сволленина может быть периодическим гидролизом, непрерывным гидролизом или их комбинацией. Гидролиз может быть с перемешиванием, без перемешивания или их комбинацией. Гидролиз обычно выполняют в предназначенном для гидролиза реакторе. Ферменты в виде основной целлюлазы и сволленина добавляют к предварительного обработанному целлюлозному сырью (также называемому «субстратом») до, во время или после добавления субстрата в предназначенный для гидролиза реактор. Целлюлаза и сволленин могут добавляться одновременно или последовательно в предназначенный для гидролиза реактор. В течение длительного периода времени гидролиза добавляют дополнительную целлюлазу и/или сволленин к частично расщепленному целлюлозному субстрату.
Сволленин можно выделить из микробного штамма, который продуцирует его природно, но предпочтительно он продуцируется генетически модифицированным организмом, в котором кодирующий сволленин или его активный фрагмент ген функционально связан с сильным промотором для сверхэкспрессии белка. Результирующую генную конструкцию (т.е. последовательность нуклеиновой кислоты), включающую по крайней мере часть кодирующего сволленин гена, используют для трансформации гетерологичной или гомологичной клетки-хозяина, которую впоследствии культивируют в условиях, чтобы экспрессировать желаемый белок. Способы экспрессии рекомбинантных белков известны в данной области техники. Подходящие клетки-хозяева включают, например, нитчатые грибы, такие как Trichoderma spp. или Aspergillus spp., и дрожжи. Предпочтительный способ приготовления сволленина осуществляют через трансформацию клетки-хозяина Trichoderma spp. ДНК-конструкцией, включающей по крайней мере фрагмент ДНК, кодирующий часть или весь сволленин, который функционально связан с промотором. Трансформированную клетку-хозяина затем выращивают в условиях, чтобы экспрессировать желаемый белок.
Предпочтительно сволленин продуцируют в виде экстраклеточного белка, который секретируется в среду для культивирования, которую можно использовать в качестве источника сволленина непосредственно (например, в виде бульона) или использовать для дальнейшего выделения и/или очистки сволленина, используя известные в области белков способы. В альтернативном случае, если сволленин экспрессируется в виде внутриклеточного белка, клетки разрушают с последующим выделением и/или очисткой внутриклеточного сволленина.
Если требуется получение белка сволленина в отсутствие целлюлолитической активности, для такого получения применим штамм клетки-хозяина Trichoderma, из которого был делетирован один или несколько генов целлюлаз до введения ДНК-конструкции или плазмиды, содержащей кодирующий сволленин фрагмент ДНК. Такие штаммы можно приготовить с помощью способа, описанного в патенте США № 5246852 и WO 92/06208, сообщенная информация в которых включена таким образом посредством ссылки. При экспрессии сволленина в микроорганизме-хозяине, в котором отсутствует один или несколько генов целлюлаз, процедуры идентификации и последующей очистки упрощаются. Однако для применения в настоящем изобретении нет необходимости в полном удалении целлюлолитических ферментов из очищенного сволленина.
В конкретных вариантах осуществления сволленин или его производное извлекают в активной форме из клетки-хозяина после выращивания в жидких средах. Сволленин может включать соответствующий посттрансляционный процессинг. Экспрессированный сволленин можно извлечь из среды с помощью общепринятых методов, включающих отделения клеток от среды с помощью центрифугирования, фильтрации и преципитации белков в супернатанте или фильтрате с использованием соли, например аммония сульфата. Альтернативно или дополнительно, можно использовать хроматографические способы, такие как ионообменная хроматография или аффинная хроматография. Можно индуцировать антитела (поликлональные или моноклональные) против очищенного сволленина, фрагментов очищенного сволленина или синтетических пептидов, соответствующих частям сволленина.
В некоторых вариантах осуществления белки сволленины отделяют или очищают от других компонентов, с которыми они связаны в природе, или другого компонента клеток, использованных для экспрессии сволленина. Очищенный сволленин не обязательно должен быть лишен всех других компонентов, но имеет более высокое соотношение сволленина и экстраклеточных белков (и/или других компонентов), чем то, которое обнаруживается в природном состоянии, в среде для культивирования или в подвергнутых лизису клетках. Очистку можно выполнить с помощью общепризнанных методов разделения, таких как ионообменная хроматография, аффинная хроматография, разделение на основе гидрофобных взаимодействий, диализ, обработка протеазами, преципитация сульфатом аммония или другой солью, центрифугирование, гель-фильтрация, фильтрация, микрофильтрация, гель-электрофорез или разделение на градиенте для удаления целых клеток, клеточного дебриса, загрязняющих примесей, посторонних белков (в том числе ферментов), которые нежелательны в конечной композиции. Кроме того, возможно последующее добавление компонентов в содержащую сволленин композицию, которые дают дополнительные преимущества, например активирующих агентов, агентов против ингибирования, ионов, соединений для контролирования рН или других ферментов, таких как целлюлаза.
Количество сволленина, добавляемого к гидролитической смеси, может меняться в соответствии с подвергаемой обработке биомассой, но обычно составляет от приблизительно 0,1 до приблизительно 30 мг/г целлюлозы, предпочтительно от приблизительно 2 мг/г до приблизительно 20 мг/г целлюлозы или даже от приблизительно 5 мг/г до приблизительно 15 мг/г целлюлозы. Альтернативно, количество сволленина, используемого в настоящем изобретении, можно определить на основе общего количества целлюлозного субстрата или общего количества сырой или предварительно обработанной биомассы. Обработку сволленином проводят при приблизительно 20 - приблизительно 80°С, предпочтительно при приблизительно 30 - приблизительно 50°С, в диапазоне рН, составляющем от приблизительно 3 до приблизительно 10, предпочтительно от приблизительно 4 до приблизительно 6, в течение от приблизительно 0,1 до приблизительно 24 часов, предпочтительно от приблизительно 2 до приблизительно 6 часов, при загрузке твердых веществ (сухих), составляющей от приблизительно 1% до приблизительно 30%, предпочтительно от приблизительно 15% до приблизительно 25%.
Как правило, ферменты будут использовать в соотношении целлюлаза:сволленин, составляющем от приблизительно 5:1 до приблизительно 1:5. Более предпочтительно, когда ферменты используются в соотношении целлюлаза:сволленин, составляющем от приблизительно 2:1 до приблизительно 1:2. Относительный показатель фермента может меняться в зависимости от типа целлюлозного субстрата. В некоторых случаях сволленин представляет приблизительно равное количество фермента в композиции для обработки целлюлозного материала, по сравнению с количеством целлюлазы в композиции. Приблизительно равное количество означает, что приблизительно 40-60%, например, приблизительно 50%, ферментов представляют собой сволленин. Для микрокристаллического целлюлозного субстрата (т.е. хвойной целлюлозы), богатой водородными связями, может потребоваться больше сволленина, чем для аморфного субстрата (т.е. фосфорная кислота-сволленин-целлюлозы) с относительно более низкой степенью водородных связей.
Смешанная целлюлазная композиция для описанного применения может обладать тремя синергетическими целлюлолитическими активностями: активностями эндо-1,4-β-D-глюканазы, экзо-1,4-β-глюкозидазы и β-D-глюкозидазы. Каждая из этих активностей может обеспечиваться одним или несколькими ферментами целлюлазами, которые являются основными целлюлазами (и их активностями) в композициях и способах настоящего изобретения. Любой фермент целлюлаза в смешанной целлюлазной композиции может обеспечить одну или более из трех целлюлолитических активностей. Приводимые в качестве примеров основные целлюлазы включают CHB1, CBH2, EG1, EG2 и β-глюкозидазу. Целлюлазная композиция может быть раствором белка в воде, суспензией белка в воде, твердым порошком или гранулой или гелем. Смесь, включающая ферменты целлюлазы, может включать добавки, такие как буферы, детергенты, стабилизаторы, наполнители или другие такие добавки, которые хорошо известны квалифицированным в данной области техники специалистам.
В некоторых вариантах осуществления для композиций и способа настоящего изобретения не требуется дополнительный вспомогательный фермент (т.е. отличный от сволленина) в комбинации с основной целлюлазой или комбинацией целлюлаз, которую можно обнаружить в цельном целлюлазном бульоне. Такие дополнительные вспомогательные ферменты включают EG4, CIP1 и ксиланазу. Таким образом, в определенных вариантах осуществления композиции и способы настоящего изобретения по существу состоят из сволленина и одной или нескольких основных целлюлаз в отсутствие вспомогательных ферментов, таких как EG4, CIP1 и/или ксиланаза. В конкретных вариантах осуществления композиции и способы по существу состоят из сволленина и одной или нескольких основных целлюлаз в отсутствие EG4 или CIP1. В более конкретном варианте осуществления композиции и способы по существу состоят из сволленина и одной или нескольких основных целлюлаз в отсутствие EG4 и CIP1.
Целлюлаза и/или сволленин могут происходить из микробов и, в частности, из грибов или бактерий. Микроорганизмы, обладающие целлюлолитическими способностями, могут быть источниками обоих белков целлюлазы и сволленина. В некоторых вариантах осуществления целлюлаза и/или сволленин происходят из Trichoderma spp., в частности, Trichoderma reesei (longibrachiatum). Однако целлюлаза и/или сволленин могут также происходить из гриба, такого как Absidia spp.; Acremonium spp.; Agaricus spp.; Anaeromyces spp.; Aspergillus spp., включающие A. auculeatus, A. awamori, A. flavus, A. foetidus, A. fumaricus, A. fumigatus, A. nidulans, A. niger, A. oryzae, A. terreus и A. versicolor; Aerobasidium spp.; Cepha/osporum spp.; Chaetomium spp.; Chrysosporium spp.; Coprinus spp.; Dactyllum spp.; Fusarium spp., включающие F. conglomerans, F. decemcellulare, F. javanicum, F. lini, Foxysporum и F. solani; Gliocladium spp.; Humicola spp., включающие H. insolens и H. lanuginosa; Mucor spp., Neurospora spp., включающие N. crassa и N. sitophila; Neocallimastix spp.; Orpinomyces spp.; Penicillium spp.; Phanerochaete spp.; Phlebia spp.; Piromyces spp.; Pseudomonas spp.; Rhizopus spp.; Schizophyllum spp.; Trametes spp.; Trichoderma spp., включающие T. reesei, T. reesei (longibrachiatum) и T. viride; и Zygorhynchus spp. Также предусматривается, что сволленин и/или кодирующую сволленин ДНК можно обнаружить в целлюлолитических бактериях, таких как Bacillus spp.; Cellulomonas spp.; Clostridium spp.; Myceliophthora spp.; Thermomonospora spp.; Streptomyces spp., включающие S. olivochromogenes; особенно деградирующих волокна бактериях из рубца жвачных, таких как Fibrobacter succinogenes; и в дрожжах, включающих Candida torresii; C. parapsllosis; C. sake; C. zeylanoides; Pichia minuta; Rhodotorula glutinis; R. mucilaginosa и Sporobolomyces holsaticus.
Аспекты композиций и способов настоящего изобретения могут быть дополнительно поняты с учетом следующих примеров, которые не следует истолковывать как ограничивающие. Квалифицированным в данной области техники специалистам будут очевидны модификации материалов и способов.
ПРИМЕРЫ
Для иллюстрации композиций и способов предоставляются следующие примеры.
Пример 1: Оценка сволленина на хвойно-древесной массе
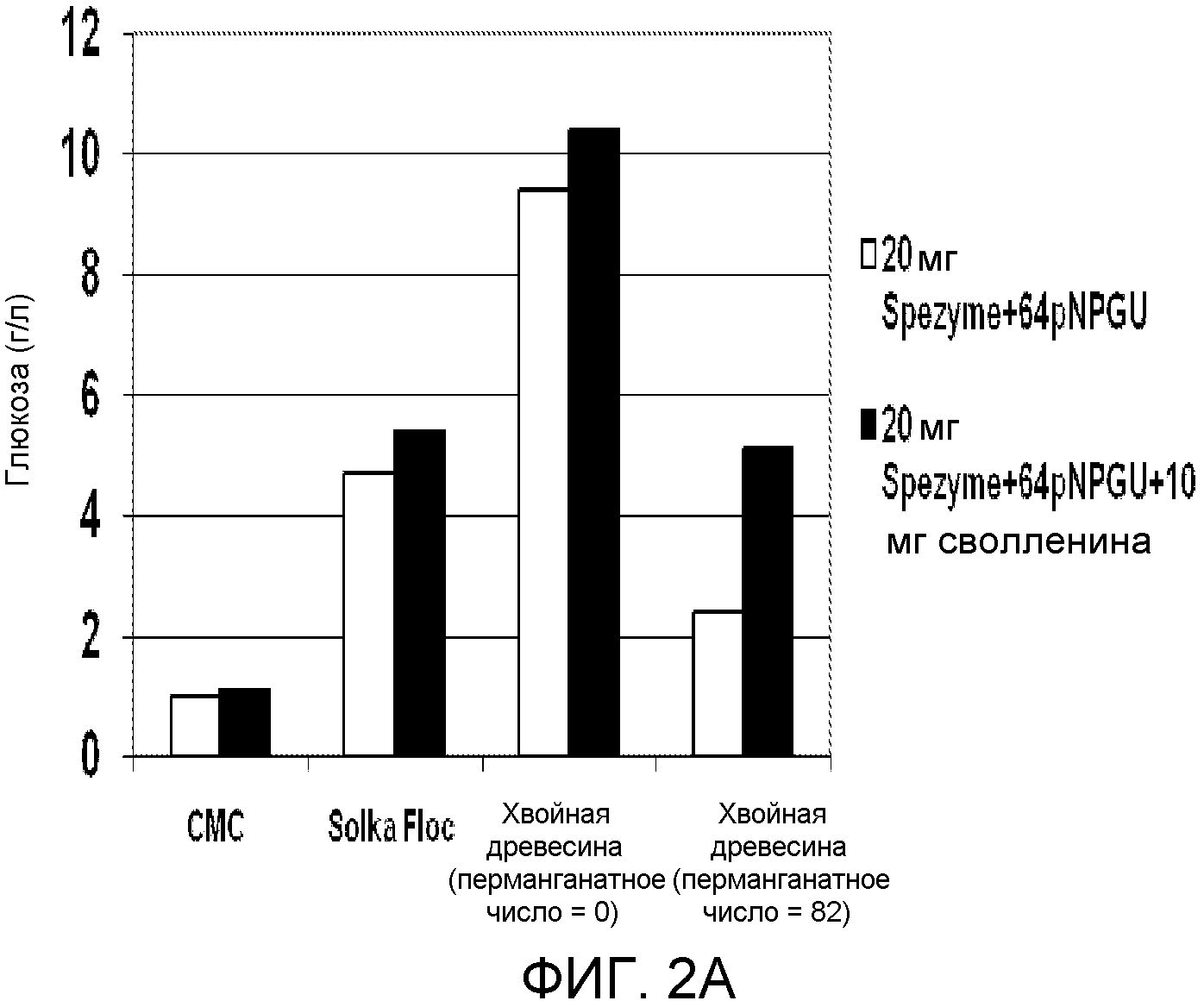
Хвойно-древесную массу в количестве, эквивалентном 0,1 г целлюлозы, добавляли в 20 мл стеклянный сцинтилляционный флакон для каждого анализа. Путем добавления дистиллированной воды каждый флакон доводили до общего объема 10 мл минус количество фермента, добавляемого при каждом анализе. Содержимое каждого флакона доводили до 50οС нагреванием в термостате, установленном на 50±1°С. В каждый флакон добавляли 1 или 2 мг цельной целлюлазной композиции, полученной из Trichoderma, (т.е. SPEZYME® CP, специфическая активность = 3200-4110 МЕ/г; Genencor International, Inc., Palo Alto, CA, США) до конечной концентрации целлюлазы, составляющей 10 мг целлюлазы на г целлюлозы или 20 мг целлюлазы на г целлюлозы (как описано в таблице 1). Очищенный сволленин или бычий сывороточный альбумин (BSA, Sigma) в качестве контроля добавляли до конечной концентрации, составляющей 10 мг/г целлюлозы (таблица 1). Сволленин приготовляли, очищали и определяли характеристики в соответствии со способом, описанным Saloheimo и др. (2002) в Eur. J. Biochem. 269: 4202-4211 (смотри таблицу 5, ниже). Концентрацию белка сволленина определяли с помощью гель-электрофореза, и она составляла приблизительно 3 мг/г в обоих препаратах.
Флаконы закрывали и инкубировали с острожным вращением (180 оборотов в минуту) при 50°С в течение периода времени, составляющего 24 часа. Для анализа отбирали аликвоту. Твердые вещества удаляли центрифугированием. Супернатант подвергали анализу глюкозы, используя или анализатор глюкозы YSI, или систему HPLC Waters Alliance. Результаты представлены в таблице 1 и на фиг.1. После дополнения сволленином целлюлаза увеличивала концентрацию глюкозы и при использовании хвойно-древесного субстрата, и при использовании субстрата PCS через 24 ч. При тех же условиях загрузки общего белка (20 мг) 10 мг сволленина были по существу способны заместить 10 мг целлюлазы. Контрольный белок (BSA) не вызывал тот же эффект.
|
Пример 2: Субстратная избирательность сволленина
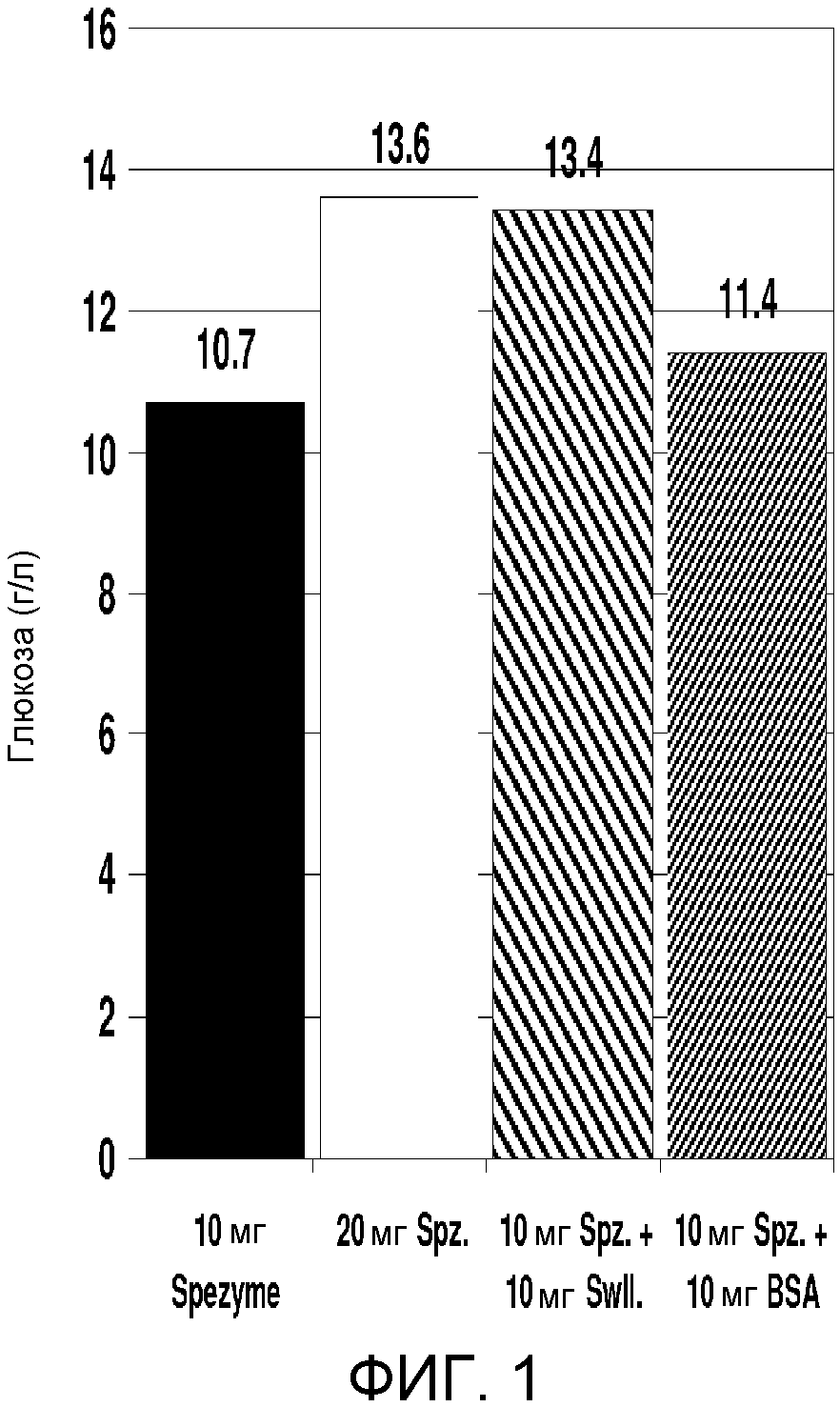
Для увеличения продукции глюкозы после добавления сволленина были проанализированы карбоксиметилцеллюлоза (СМС), 1%; Solka-Floka (синтетическая, чистая микрокристаллическая целлюлоза), 1%; хвойная древесина (перманганатное число = 0); хвойная древесина (перманганатное число = 82); твердая смешанная древесина (перманганатное число = 81); хвойная древесина (перманганатное число = 80) и отработанная древесная масса (перманганатное число = 60). Каждый целлюлозный субстрат в количестве, эквивалентном 0,1 г целлюлозы, добавляли в 20 мл стеклянный сцинтилляционный флакон для каждого анализа. В каждый флакон добавляли 5,0 мл раствора, содержащего 0,1 М натрийцитратный буфер (рН 4,8), 40 мкл (400 мкг) тетрациклина и 30 мкл (300 мкг) циклогексимида. Путем добавления дистиллированной воды каждый флакон доводили до общего объема 10 мл минус количество фермента, добавляемого при каждом анализе. Содержимое каждого флакона доводили до 50°С нагреванием в термостате, установленном на 50±1°С. В каждый флакон добавляли цельную целлюлазную композицию, полученную из Trichoderma, (т.е. SPEZYME® CP, специфическая активность = 3200-4110 МЕ/г; Genencor International, Inc., Palo Alto, CA, США) до конечной концентрации целлюлазы, составляющей 20 мг целлюлазы на г целлюлозы. Кроме того, добавляли β-глюкозидазу до конечной концентрации 64 pNPG Е/г целлюлозы.
Полуочищенный сволленин добавляли до конечной концентрации, составляющей 10 мг/г целлюлозы (ссылаясь на таблицу 1). Как и ранее, сволленин приготовляли, очищали и определяли характеристики в соответствии со способом, описанным Saloheimo и др. (2002) в Eur. J. Biochem. 269: 4202-4211 (смотри пример 5, ниже). Концентрацию белка сволленина определяли с помощью гель-электрофореза, и она составляла приблизительно 2 мг/г в обоих препаратах.
Флаконы закрывали и инкубировали с острожным вращением (180 оборотов в минуту) при 50°С в течение периода времени, составляющего 24 часа. Для анализа отбирали аликвоту. Твердые вещества удаляли центрифугированием. Супернатант подвергали анализу глюкозы, используя или анализатор глюкозы YSI, или систему HPLC Waters Alliance. Результаты представлены в таблице 2 и на фиг.2А и 2В.
|
По сравнению с таким синтетическим субстратом, как СМС или Solka-Floka, больший эффект от присутствия сволленина был получен с использованием такой целлюлозный субстрат, как хвойно-древесная или твердодревесная масса, как подтверждено экспериментальным определением того, что больше сахара глюкозы высвобождается из субстрата. Этот эффект является более выраженным при использовании субстрата с высоким содержанием лигнина (например, хвойно-древесной массы, перманганатное число = 82), чем субстрата с нулевым содержанием лигнина (например, хвойно-древесной массы, перманганатное число = 0). Таким образом, добавление сволленина может быть более полезным в случае в высокой степени стабильного (неразлагаемого) субстрата, например, если процесс предварительной обработки субстрата не был оптимизирован, содержание лигнина является высоким, и/или водородные связи в субстрате все еще являются незатронутыми.
Пример 3: Оценка действия сволленина на гидролитическую характеристику целлюлазы на хвойной целлюлозе
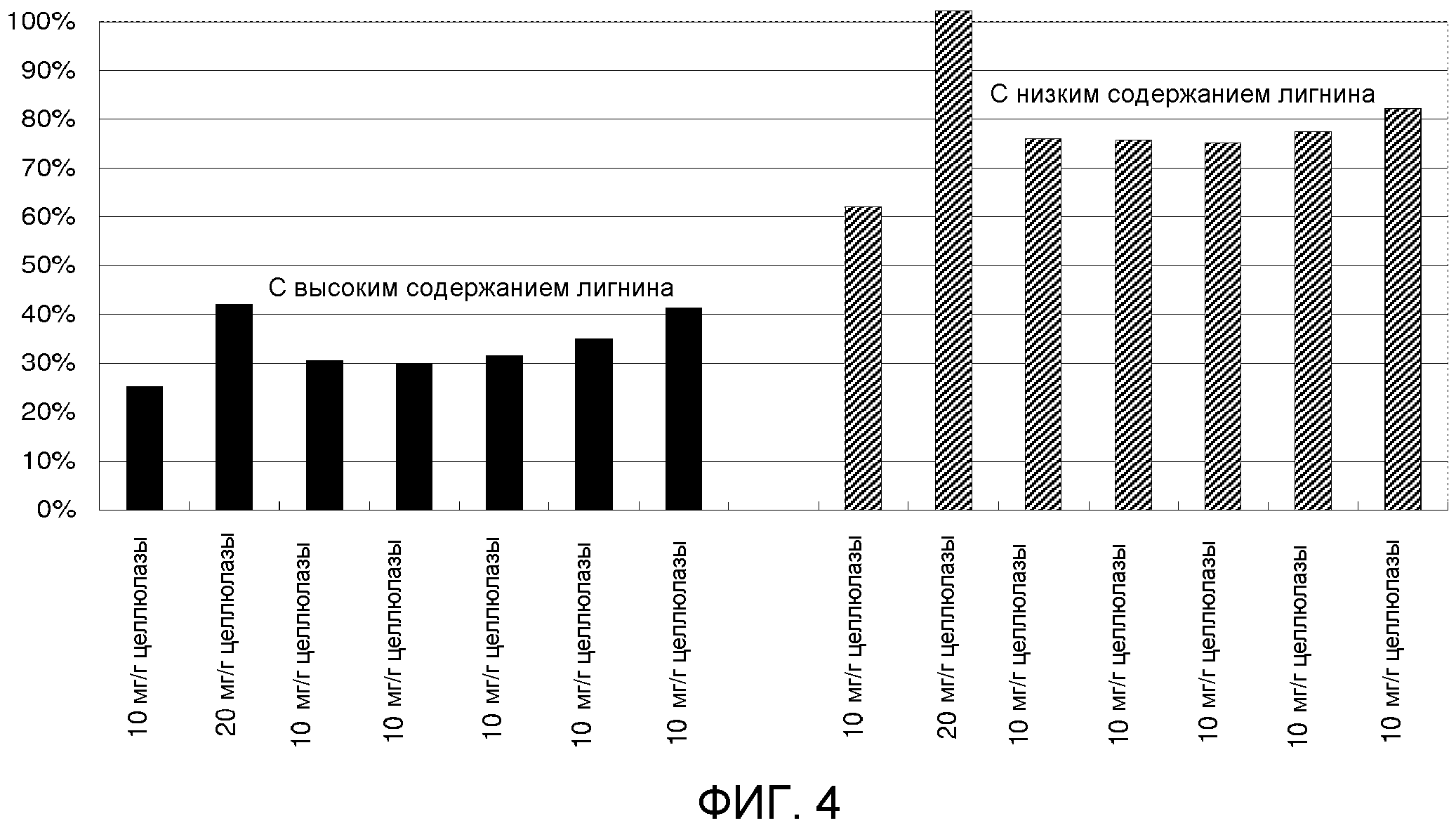
Небеленую хвойную целлюлозу с перманганатным числом 82 получали от Smurft Facture (Biganos, FR). Небеленую целлюлозу получали методом Крафта, мыли и затем сушили на воздухе. Каждый образец готовили для обеспечения конечной композиции, содержащей 4% целлюлозы (глюкана) по сухому весу в 10 мл объеме реакционной смеси. Ферменты добавляли к пробному субстрату (как изложено в таблице 2) в 20 мл сцинтилляционных флаконах до общего объема жидкости 10 мл, который включал 50 мМ натрийцитратный буфер (рН 4,8) и антибиотики (тетрациклин и циклогексимид). Цельную целлюлазную композицию, полученную из Trichoderma, (т.е. SPEZYME® CP, Genencor International, Inc., Palo Alto, CA, США), использовали в качестве источника целлюлазы в экспериментах ферментативного гидролиза. Специфическая активность SPEZYME CP составляет 3200-4110 МЕ/г.
Суспензии инкубировали с острожным вращением (180 оборотов в минуту) при 50°С в течение 72 часов. Анализ содержания глюкозы выполняли через 24 и 72 часа следуя стандартным способам. Результаты представлены в таблице 3 и на фиг.3.
|
Пример 4: Диаграмма дозирования сволленина на целлюлозных и бумажных субстратах
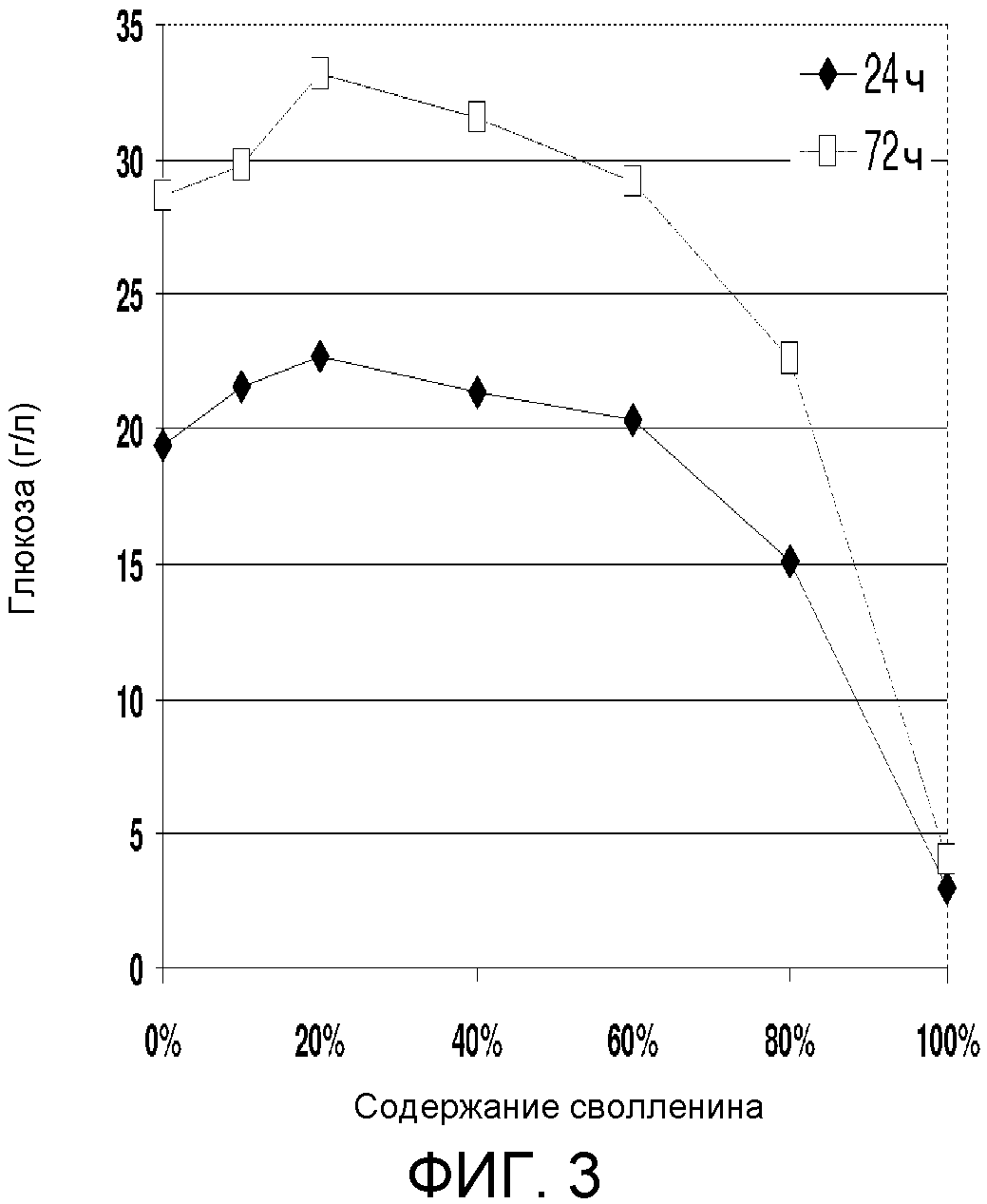
Два образца небеленной хвойной целлюлозы были получены от Smurft Facture (Biganos, FR). Один образец (названый «с высоким содержанием лигнина») имел высокое содержание лигнина (~15%) и перманганатное число (степень лигнификации) 82. Второй образец (названый «с низким содержанием лигнина») имел низкое содержание лигнина (~5%) и перманганатное число (степень лигнификации) 12. Небеленную целлюлозу получали методом Крафта, мыли и затем сушили на воздухе. Каждый образец отвешивали для получения конечной композиции, содержащей 4% целлюлозы (глюкана) по сухому весу в 10 мл объеме реакционной смеси.
Используемую хвойную целлюлозу отвешивали так, чтобы каждый образец содержал точно 0,4 г целлюлозы (глюкана) по сухому весу, и дозировали, как показано в таблице 3. Ферменты добавляли к пробному субстрату в 20 мл сцинтилляционном флаконе до общего объема жидкости 10 мл, который включал 50 мМ натрийцитратный буфер (рН 4,8) и антибиотики (тетрациклин и циклогексимид). Целлюлазный ферментный комплекс, полученный из генетически модифицированного штамма Trichoderma reesei, (т.е. Accellerase 1000TM, Genencor), использовали в качестве источника целлюлазы в экспериментах ферментативного гидролиза. Сволленин использовали в виде очищенного препарата, как указано выше и описано в примере 5. Концентрация сволленина по оценке с помощью гель-электрофореза составляла приблизительно 2 мг/г. Известно, что очищенный экстракт не обладает целлюлазной активностью. Загрузка твердых веществ составляла 0,4 г целлюлозы в общем объеме жидкости 10 мл, что дает 4% целлюлозную (глюкановую) загрузку.
Реакционную смесь инкубировали с острожным встряхиванием (200 оборотов в минуту) при 50°С в течение 72 ч. Анализ концентраций глюкозы и целлобиозы выполняли используя систему HPLC Waters. Используемую для анализа сахара колонку для HPLC покупали у BioRad (Aminex HPX-87H, BioRad Inc., Hercules, CA). Определяли продукцию и глюкозы, и целлобиозы. Расщепление целлюлозы в процентах (образованная глюкоза плюс образованная целлобиоза, разделенные на вводимую целлюлозу) суммировано в таблице 4 и на фиг.4. При тех же условиях загрузки общего белка (30 мг) сволленин был по существу способен заместить 50% целлюлазы из Spezyme CP (таблица 3). Дополнение ACCELLERASE сволленином вызывало благоприятный эффект при использовании субстратов как с высоким, так и с низким содержанием лигнина (таблица 4).
|
Пример 5: Очистка сволленина
Буфер (50 мМ Трис, рН 7,0) и натрия хлорид (200 мм) добавляли к 2 л полученного с помощью ультрафильтрации концентрата (UFC) культуры штамма T. reesei, из которого были делетированы четыре основные целлюлазы (CBH1, CBH2, EG1 и EG2) и в котором ген сволленина сверхэкспресировался под контролем промотора cbh1, при перемешивании. рН доводили до 7,0. К этой смеси добавляли 50 мл агента для аффинной очистки связывающего целлюлозу домена (CDB) (т.е. смолы Cbind 200, каталожный № 70121, Novozymes A/S, Bagsvaerd, DK) с последующим перемешиванием в течение 1 ч. Эту смесь затем подвергали фильтрации, используя фильтрующий элемент из пористого стекла, и собирали несвязавшийся материал. Смолу со связанным сволленином промывали дважды, используя 2 л 50 мМ Трис, рН 7,0 и 200 мМ натрия хлорид. Сволленин элюировали со смолы путем смешивания смолы со связанным сволленином с водой MilliQ (2 л) в течение 0,5 ч и затем фильтрования смеси, используя фильтрующий элемент из пористого стекла, в 2 л резервуар. Этот процесс элюции водой повторяли для обеспечения полной элюции сволленина.
Элюат концентрировали, используя систему для ультрафильтрации с предельным пропусканием М.м. 10 кДа. Концентрат (800 мл) был готов для анализа и дальнейшего использования. Концентрация белка сволленина по оценке с помощью гель-электрофореза составляла приблизительно 3 мг/г. Обратите внимание, что предварительно очищенный экстракт, как известно, не обладает значительной целлюлазной активностью.