Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ДИБЕНЗОСУБЕРЕНИЛЬНЫЙ ФРАГМЕНТ
Вид РИД
Изобретение
Изобретение относится к органической химии, а именно к получению 1,3-дикарбонильных соединений, содержащих дибензосуберенильный (5Н-дибензо[a,d]циклогептен-5-ильный) фрагмент, представляющих интерес в качестве исходных соединений для синтеза биологически активных веществ, а также лигандов, способных координировать металлы.
Дибензосуберенилсодержащие 1,3-дикарбонильные соединения являются малоизученным классом органических соединений, к настоящему времени известен лишь единственный представитель этого ряда веществ - 2-(дибензосуберенил)индан-1,3-дион, а также дибензосуберенилмалоновая кислота, которая формально содержит 1,3-диоксофрагмент.
Известен способ получения 2-(дибензосуберенил)индан-1,3-диона, основыванный на реакции дибензосуберенола с 1,3-индандионом в среде бензола в присутствии 4-толуолсульфокислоты [М. De Winter, W.T. Nauta. Pharmacochemistry of 2-diarylmethyl-1,3-indandiones. I. Synthesis. European Journal of Medicinal Chemistry, 1977, vol. 12, №2 p. 125-130].
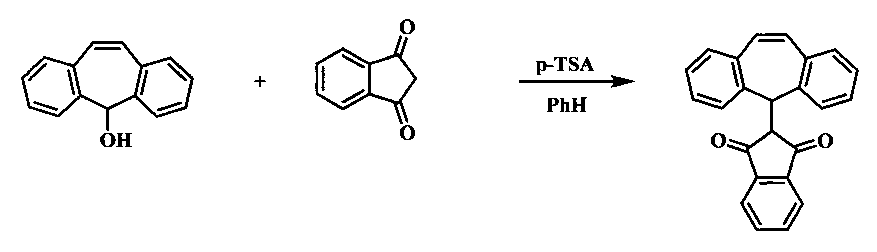
Недостатком известного способа является использование в качестве растворителя высокотоксичного бензола.
Известен способ получения дибензосуберенилмалоновой кислоты из дибензосуберенола и малоновой кислоты в среде уксусной кислоты при нагревании в течение 18 ч при 70°С [P.N. Confalone, Е.М. Huie. Intramolecular [3+2] cycloaddition routes to carbon-bridget dibenzocycloheptanes and dibenzazepines. J. Org. Chem. 1983, 48, 18, p. 2994-2997]. Выход дибензосуберенилмалоновой кислоты составляет 79%.
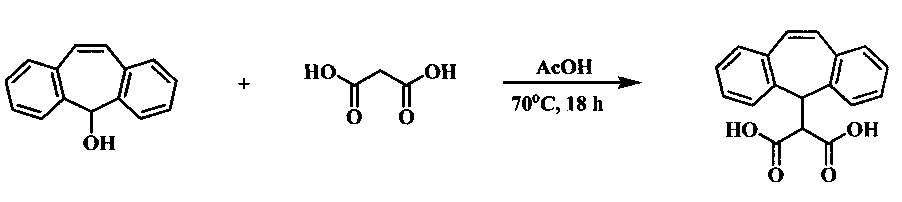
Недостатком способа является длительность процесса, равная 18 часам.
Техническим результатом является создание простого экспрессного способа получения 1,3-дикарбонильных соединений, содержащих дибензосуберенильный фрагмент, с использованием коммерчески доступных исходных соединений с хорошим выходом целевого продукта.
Технический результат достигается путем использования реакции дибензосуберенола с 1,3-дикарбонильными соединениями в присутствии каталитического количества трифлата скандия в соответствии со схемой:
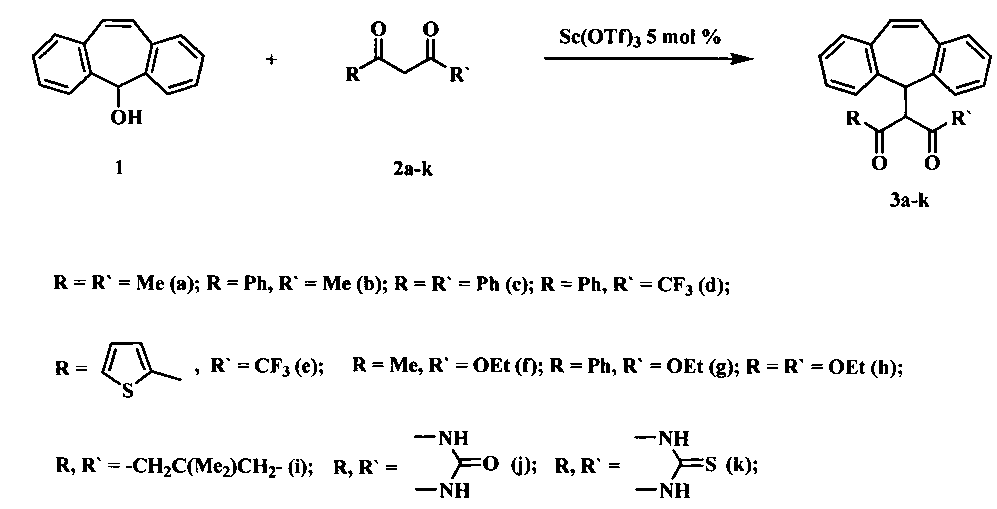
Реакцию осуществляют в среде 1,2-дихлорэтана или нитрометана при перемешивании и термостатировании при 40°С. Проведение мониторинга расходования реактантов и накопления продукта реакции показало, что для получения 1,3-дикарбонильных соединений, содержащих дибензосуберенильный фрагмент, при наиболее полном расходовании исходных веществ, требуется 30-180 минут. Растворитель выбирают таким образом, чтобы содержание енольной формы исходного 1,3-дикарбонильного соединения было максимальным, т.е. для не циклических 1,3-дикетонов и кетоэфиров используют 1,2-дихлорэтан, а для циклических дикетонов используют нитрометан.
Предложенный способ реализован с использование одиннадцати 1,3-дикарбонильных соединений, относящихся к разным классам: 1,3-дикетонам, в том числе содержащим ароматические, гетероароматические, фторированные заместители, кетоэфирам, а также на примере эфира малоновой кислоты.
Выход целевых соединений составляет 63-86%.
Пример получения 3-(5H-дибензо[a,d]циклогептен-5-ил)пентан-2,4-диона (IIIa)
В колбу, снабженную обратным холодильником, помещали 3 мл 1,2-дихлорэтана, 0.018 г (0.036 ммоль) Sc(OTf)3, приливали раствор 0.15 г (0.72 ммоль) дибензосуберенола и 0.072 г (0.72 ммоль) ацетилацетона в 2 мл 1,2-дихлорэтана. Реакционную массу перемешивали при термостатировании (40°С) в течение 30 мин, за это время окраска изменялась от малиновой до соломенно-желтой. Далее раствор переносили в делительную воронку, содержащую 10 мл 2М HCl, органический слой отделяли, водный экстрагировали тремя порциями хлороформа по 10 мл. Объединенные органические фазы упаривали на ротационном испарителе, остаток очищали флэш-хроматографией, проводя элюирование смесью гексана и этилацетата (10:1). Выход 0.18 г (84%). Т.пл. 167°С (бесцветные кристаллы из смеси гексана и этилацетата). ИК спектр (KBr), ν, см-1: 3045, 3026, 3001 (Csp2-H), 2966, 2908 (Csp3-H), 1734, 1699 (C=O). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.83 (6Η, СН3), 4.75 д (1Н, СН, 11.4 Гц), 4.87 (1Н, СН, 11.4 Гц), 7.04 с (2Н, СН), 7.21-7.25 м (2Н, СН), 7.28-7.37 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 30.3 (СН3), 53.7 (СН), 65.8 (СН), 127.1 (СН), 129.1 (СН), 129.8 (СН), 130.5 (СН), 131.3 (СН), 134.1 (С), 136.4 (С), 202.4 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 290 [М+] (3), 202 (5), 191 (100), 165 (9).
Пример получения 2-(5Н-дибензо[a,d]циклогептен-5-ил)-1-фенилбутан-1,3-Диона (IIIb)
Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.116 г (0.72 ммоль) бензоилацетона в среде 1,2-дихлорэтана при перемешивании в течение 30 мин и термостатировании при 40°С получено 0.22 г (86%) бесцветного масла. ИК спектр (KBr), ν, см-1: 3064, 3020 (Csp2-H), 2935 (Csp3-H), 1730, 1712, 1680, 1670 (С=O), 1597, 1490 (Csp2-Csp2). Спектр ЯМР 1H (CDCl3), δ, м.д.: 1.88 (3Н, СН3), 5.15 д (1H, СН, 11 Гц), 5.66 д (1Н, СН, 11.4 Гц), 6.98 д (1Н, СН, 11.4 Гц), 7.04-7.15 м (3Н, СН), 7.20-7.28 м (2Н, СН), 7.29-7.37 м (4Н, СН), 7.39-7.49 м (3Н, СН), 7.65-7.72 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 29.3 (СН3), 53.8 (СН), 60.5 (СН), 126.8 (СН), 127.3 (СН), 128.4 (СН), 128.6 (СН), 129.0 (СН), 129.2 (СН), 129.6 (СН), 129.8 (СН), 130.6 (СН), 131.1 (СН), 131.4 (СН), 131.5 (СН), 133.4 (СН), 133.9 (С), 134.6 (С), 136.5 (С), 136.9 (С), 137.2 (С), 194.5 (С=O), 202.0 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 352 [М+] (2), 191 (100), 165 (7).
Пример получения 3-(5Н-дибензо[a,d]циклогептен-5-ил)-1,3-дифенилпропан-1,3-диона (IIIc). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.161 г (0.72 ммоль) дибензоилметана в среде 1,2-дихлорэтана при перемешивании в течение 30 мин и термостатировании при 40°С получено 0.21 г (71%) бесцветных кристаллов. Т.пл. 157°С (из смеси гексана и этилацетата). ИК спектр (KBr), ν, см-1: 3059, 3018 (Csp2-H), 1699, 1656 (С=O), 1595 (Csp2-Csp2). Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.35 д (1Н, СН, 11.4 Гц), 6.53 (1Н, СН, 11.4 Гц), 7.02-7.10 м (2Н, СН), 7.08 с (2Н, СН), 7.12-7.16 м (2Н, СН), 7.19-7.30 м (6Н, СН), 7.35-7.45 м (4Н, СН), 7.64-7.70 м (4Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 54.8 (СН), 55.0 (СН), 126.8 (СН), 128.3 (СН), 128.3 (СН), 129.0 (СН), 129.4 (СН), 131.3 (СН), 131.6 (СН), 133.0 (СН), 134.2 (С), 136.9 (С), 137.3 (С), 194.0 (С=O).
Пример получения 3-(5Н-дибензо[а,d]циклогептен-5-ил)-1-фенил-4,4,4-трифторбутан-1,3-диона (IIId). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.155 г (0.72 ммоль) 1-фенил-4,4,4-трифторбутан-1,3-диона в среде 1,2-дихлорэтана в течение 1 ч при перемешивании и термостатировании при 40°С. получено 0.23 г (79%) бесцветных кристаллов. Т.пл. 123-125°С (из гексана). ИК спектр (KBr), ν, см-1: 3068, 3049, 3026 (Csp2-H), 1724, 1680 (С=O), 1595, 1492 (Csp2-Csp2). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 5.10 д (1Н, СН, 10.9 Гц), 6.16 д (1Н, СН, 11.5 Гц), 6.89 д (1Н, СН, 11.9 Гц), 6.92-7.01 м (2Н, СН), 7.10 д (1Н, СН, 11.9 Гц), 7.13-7.18 м (1Н, СН), 7.20-7.37 м (6Н, СН), 7.41-7.50 м (2Н, СН), 7.52-7.58 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 52.3 (СН), 54.9 (СН), 115.0 кв (CF3, 292 Гц), 127.2 (СН), 127.5 (СН), 128.2 (СН), 128.3 (СН), 129.0 (СН), 129.4 (СН), 129.4 (СН), 129.8 (СН), 130.7 (СН), 131.1 (СН), 131.4 (СН), 131.4 (СН), 133.6 (СН), 133.9 (С), 134.5 (С), 134.8 (С), 135.7 (С), 136.3 (С), 184.0 кв (С=O, 36 Гц), 191.9 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 406 [М+] (2), 191 (100), 165 (7), 105 (6).
Пример получения 3-(5Н-дибензо[a,d]циклогептен-5-ил)-1-(2-тиенил)-4,4,4-трифторбутан-1,3-диона (IIIe). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.16 г (0.72 ммоль) 1-(2-тиенил)-4,4,4-трифторбутан-1,3-диона в среде 1,2-дихлорэтана при перемешивании в течение 1 ч и термостатировании при 40°С получено 0.24 г (77%) бесцветных кристаллов. Т.пл. 133-134°С (из гексана). ИК спектр (KBr), ν, см-1: 3095, 3064, 3049, 3020 (Csp2-H), 1762, 1654 (С=O). Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.13 д (1H, СН, 11.3 Гц), 5.94 (1H, СН, 11.3 Гц), 6.97-7.01 м (2Н, СН), 7.03-7.14 м (3Н, СН), 7.17-7.21 м (1H, CH), 7.24-7.29 м (2H, CH), 7.31-7.37 м (2H, CH), 7.43-7.49 м (1H, CH), 7.54-7.57 м (2H, CH). Спектр ЯМР 13C (CDCl3), δ, м.д.: 53.9 (CH), 54.8 (CH), 115.1 кв (CF3, 292 Гц), 127.4 (CH), 127.5 (CH), 128.0 (CH), 129.2 (CH), 129.4 (CH), 129.5 (CH), 129.8 (CH), 130.8 (CH), 131.1 (CH), 131.4 (CH), 131.4 (CH), 133.2 (CH), 133.9 (C), 134.3 (C), 135.0 (C), 135.5 (C), 136.0 (CH), 143.3 (C), 183.0 (С=О), 183.7 кв (С=O, 36 Гц).
Пример получения этил 2-(5Н-дибензо[a,d]циклогептен-5-ил)-3-оксобутаноат (IIIf). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.094 г (0.72 ммоль) ацетоуксусного эфира в среде 1,2-дихлорэтана при перемешивании в течение 30 мин и термостатировании при 40°С получено 0.15 г (63%) бесцветных кристаллов. Т.пл. 68-70°С (из смеси гексана и этилацетата). ИК спектр (KBr), ν, см-1: 3066, 3055, 3026 (Csp2-H), 2976, 2931 (Csp3-H), 1743, 1726, 1708 (С=O). Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.95 т (3Н, СН3, 7.4 Гц), 1.86 с (3Н, СН3), 3.83 кв (2Н, СН2, 7,3 Гц), 4.48 д (1Н, CH, 11.5 Гц), 4.85 (1Н, СН, 11.5 Гц), 7.01 д (1Н, СН, 11.4 Гц), 7.05 д (1Н, СН, 11.9 Гц), 7.20-7.24 м (2Н, СН), 7.28-7.32 м (2Н, СН), 7.35-7.42 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 13.8 (СН3), 30.4 (СН3), 53.0 (СН2), 57.5 (СН), 61.1 (СН), 127.0, 127.1, 128.6, 129.0, 129.4, 129.6, 130.8, 130.9, 131.6, 134.0, 134.3, 136.6, 167.6 (С=O), 201.8 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 320 [М+] (4), 191 (100), 165 (7).
Пример получения этил 2-(5Н-дибензо[a,d]циклогептен-5-ил)-3-оксо-3-фенилпропаноата (IIIg). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.14 г (0.72 ммоль) бензоилуксусного эфира в среде 1,2-дихлорэтана при перемешивании в течение 1 ч и термостатировании при 40°С получено 0.18 г (67%) бесцветных кристаллов. Т.пл. 112-113°С (из смеси гексана и этилацетата). ИК спектр (KBr), ν, см-1: 3066, 3055, 3020 (Csp2-H), 2978, 2953, 2937 (Csp3-H), 1722, 1687 (С=O). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.89 т (3Н, СН3, 7 Гц), 3.77 кв (2Н, СН2, 7,3 Гц), 5.13 д (1Н, СН, 11 Гц), 5.38 (1Н, СН, 11.3 Гц), 6.93 д (1Н, СН, 11.9 Гц), 7.06-7.12 м (3Н, СН), 7.22-7.27 м (2Н, СН), 7.29-7.37 м (4Н, СН), 7.41-7.50 м (3Н, СН), 7.70-7.75 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 13.8 (СН3), 52.6, 53.2, 61.3, 126.8, 127.1, 128.4, 128.5, 128.9, 128.9, 129.4, 129.5, 130.9, 131.0, 131.4, 131.7, 133.3, 134.0, 134.8, 136.8, 136.9, 137.1, 167.8 (С=O), 193.6 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, %): 382 [М+] (2), 191 (100), 165 (5), 105 (6).
Пример получения диэтил (5Н-дибензо[а,d]циклогептен-5-ил)малоната (IIIh). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.12 г (0.72 ммоль) диэтилмалоната в среде 1,2-дихлорэтана при перемешивании в течение 1 ч и термостатировании при 40°С получено 0.16 г (64%) бесцветных кристаллов. Т.пл. 87-88°С (из гексана). ИК спектр (KBr), ν, см-1: 3064, 3030 (Csp2-H), 2972, 2929, 2906 (Csp3-H), 1753 (С=O). Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.95 т (6Н, СН3, 6.8 Гц), 3.85 кв (4Н, СН2, 6.8 Гц), 4.22 д (1Н, СН, 11.5 Гц), 4.83 (1H, СН, 11.9 Гц), 7.01 с (2Н, СН), 7.20-7.25 м (2Н, СН), 7.27-7.33 м (4Н, СН), 7.38-7.43 м (2Н, СН). Спектр ЯМР 13С (CDCl3), δ, м.д.: 13.8 (СН3), 50.6, 53.4, 61.1, 127.0, 128.6, 129.5, 130.8, 131.4, 134.4, 136.7, 167.7 (С=O). Масс-спектр (ЭУ, 70 эВ), m/z (Iохн, %): 350 [М+] (5), 202 (4), 191 (100), 165 (6).
Пример получения 2-(5Н-дибензо[а,d]циклогептен-5-ил)-5,5-диметилциклогексан-1,3-диона (IIIi). Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.1 г (0.72 ммоль) димедона в среде нитрометана при перемешивании в течение 1 ч и термостатировании при 40°С получено 0.19 г (79%) бесцветных кристаллов. Т.пл. 192-195°С (из гексана). ИК спектр (KBr), ν, см-1: 3066, 3049, 3022 (Csp2-H), 2954, 2929, 2868 (Csp3-H), 1718, 1703, 1687 (С=O). Спектр ЯМР 1Н (CDCl3), δ, м.д.: 0.87 с (3Н, СН3), 1.04 с (3Н, СН3), 2.33 д (2Н, СН2, 12.4 Гц), 2.57 д (2Н, СН2, 13.3 Гц), 4.19 д (1Н, СН, 11 Гц), 4.65 д (1Н, СН, 11 Гц), 7.00 с (1H, СН), 7.21-7.25 м (2Н, СН), 7.29-7.33 м (6Н, СН). Спектр ЯМР 13С ((CD3)2SO), δ, м.д.: 27.9 (СН3), 28.9 (СН3), 30.7, 53.3, 53.9, 65.2, 127.1, 128.8, 129.8, 129.8, 131.1, 133.8, 136.3, 203.7 (С=O).
Пример получения 5-(5Н-дибензо[a,d]циклогептен-5-ил)пиримидин-2,4,6-трионf IIIj. Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.09 г (0.72 ммоль) барбитуровой кислоты в среде нитрометана при перемешивании в течение 3 ч и термостатировании при 40°С получено 0.18 г (81%) бежевого кристаллического порошка. ИК спектр (KBr), ν, см-1: 3194, 3076 (уш, ΝΗ), 1755, 1726, 1701, 1676 (С=O). Спектр ЯМР 1Н ((CD3)2SO), δ, м.д.: 3.46 д (1Н, СН, 11 Гц), 4.70 д (1Н, СН, 11 Гц), 7.09 с (2Н, СН), 7.25-7.30 м (4Н, СН), 7.31-7.36 м (2Н, СН), 7.36-7.42 м (2Н, СН), 10.87 с (2Н, NH). Спектр ЯМР 13С ((CD3)2SO), δ, м.д.: 49.2 (СН), 55.6 (СН), 126.9 (СН), 128.4 (СН), 129.2 (СН), 129.7 (СН), 130.8 (СН), 134.0 (С), 136.0 (С), 151.2 (С=O), 168.5 (С=O).
Пример получения 5-(5Н-дибензо[a,d]циклогептен-5-ил)-2-тиоксодигидропиримидин-4,6-диона IIIk. Аналогично синтезу соединения IIIa из 0.018 г (0.036 ммоль) Sc(OTf)3, 0.15 г (0.72 ммоль) дибензосуберенола и 0.1 г (0.72 ммоль) тиобарбитуровой кислоты в среде нитрометана при перемешивании в течение 3 ч и термостатировании при 40°С получено 0.17 г (73%) светло-желтого кристаллического порошка. ИК спектр (KBr), ν, см-1: 3169 (уш, ΝΗ), 1734, 1705 (С=O). Спектр ЯМР 1H ((CD3)2SO), δ, м.д.: 3.55 д (1Н, СН, 11.5 Гц), 4.61 д (1Н, СН, 11.4 Гц), 7.10 с (2Н, СН), 7.24-7.33 м (6Н, СН), 7.37-7.44 м (2Н, СН), 11.97 с (2Н, ΝΗ). Спектр ЯМР 13С (((CD3)2SO)), δ, м.д.: 49.5 (СН), 55.4 (СН), 127.0 (СН), 128.5 (СН), 129.2 (СН), 129.7 (СН), 130.8 (СН), 134.1 (С), 135.7 (С), 166.7 (С=O), 179.8 (C=S).
Таким образом, взаимодействие дибензосуберенола с 1,3-дикарбонильными соединениями в присутствии 5 мол.% трифлата скандия в среде 1,2-дихлорэтана или нитрометана обеспечивает получение целевых 1,3-дикарбонильных соединений с дибензосуберенильным фрагментом с хорошим выходом, при этом применяют коммерчески доступные реагенты, а для осуществления процесса требуется существенно меньше времени по сравнению с прототипом, что делает способ промышленно применимым.
Способ получения 1,3-дикарбонильных соединений, содержащих дибензосуберенильный фрагмент из дибензосуберенола и 1,3-дикарбонильных соединений, отличающийся тем, что реакцию осуществляют при 40°C в течение 30-180 мин в среде 1,2-дихлорэтана или нитрометана при катализе 5 мол.% трифлата скандия.
