Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ СТРУКТУРНЫХ ИЗМЕНЕНИЙ МИОКАРДА ПРЕДСЕРДИЙ У БОЛЬНЫХ С НАРУШЕНИЯМИ РИТМА СЕРДЦА
Вид РИД
Изобретение
Изобретение относится к области медицины и может быть использовано для обследования и определения тактики ведения пациентов с мерцательной аритмией.
Мерцательная аритмия (МА) - одно из наиболее распространенных нарушений ритма сердца, которое встречается у 1-2% лиц общей популяции и у 5% лиц старше 65 лет. Однако эффективность лечения МА до сих пор остается недостаточно высокой. В то же время в ряде исследований показано, что тяжесть течения, а также прогноз болезни связаны с тяжестью изменений левого предсердия (ЛП) [Ball J., Carrington M.J., McMurray J.J. et. al. Atrial fibrillation: Profile and burden of an evolving epidemic in the 21st century. Int J Cardiol. 2013 Feb 1)]. Так, расширение предсердий (увеличение переднезаднего размера ЛП и индексированного объема ЛП) влияет, по данным [Marchese P., Malavasi V., Rossi L. et al. Indexed left atrial volume is superior to left atrial diameter in predicting nonvalvular atrial fibrillation recurrence after successful cardioversion: a prospective study. Echocardiography. 2012 Mar; 29(3):276-84] на вероятность рецидивирования MA. Одним из путей оптимизации подходов к лечению МА может быть оценка степени структурных изменений миокарда предсердий. Так, например, продемонстрировано, что эффективность аблации устьев легочных вен при МА зависит от тяжести исходных и постаблационных структурных изменений предсердий. При значительном поражении миокарда предсердий целесообразно проводить медикаментозное лечение заболевания [Akoum N., Daccarett М., McGann С.et al. Atrial fibrosis helps select the appropriate patient and strategy in catheter ablation of atrial fibrillation: a DE-MRI guided approach. J Cardiovasc Electrophysiol. 2011 Jan; 22(1): 16-22].
Для определения прогноза течения заболевания и выбора стратегии лечения используют различные методики, позволяющие, на основании разных признаков, оценить тяжесть структурных изменений миокарда предсердий.
Самым распространенным в клинической практике методом исследования сердца является эхокардиография (ЭхоКГ), позволяющая оценить размер предсердий, их сократительную функцию и деформацию различных сегментов стенки (Hong J., Gu X., An P. et al. Left Atrial Functional Remodeling in Lone Atrial Fibrillation: A Two-Dimensional Speckle Tracking Echocardiographic Study. Echocardiography. 2013 Apr 5). Однако данные ЭхоКГ позволяют лишь косвенно судить об изменении структуры миокарда предсердий.
Внутрисердечное картирование предсердий позволяет определять зоны замедления и/или отсутствия проведения в миокарде предсердий, зоны сниженного электрического потенциала и представлять данные зоны на трехмерной модели предсердия с возможностью подсчета их площади (Spragg D.D., Khurram I., Zimmerman S.L. et al. Initial experience with magnetic resonance imaging of atrial scar and co-registration with electroanatomic voltage mapping during atrial fibrillation: success and limitations. Heart Rhythm. 2012 Dec; 9(12):2003-9). Методика является высокоточной, но инвазивность исследования сопряжена с высоким риском, что ограничивает использование этой методики в широкой клинической практике, а также требует дорогостоящего оборудования и опытного специалиста-электрофизиолога.
Эндомиокардиальная биопсия предсердий (ЭМБ) позволяет напрямую определить гистологическое строение миокарда предсердий биоптата. Однако вследствие высокого риска вмешательства применение его ограничено лишь случаями операций на сердце [Qian Y., Meng J., Tang H. et al. Different structural remodelling in atrial fibrillation with different types of mitral valvular diseases. Europace. 2010 Mar; 12(3):371-7].
Метод магнитно-резонансной томографии (MPT) сердца с отсроченным контрастированием хорошо зарекомендовал себя в диагностике заболеваний, в основе которых лежит поражение миокарда левого желудочка (ЛЖ). Метод не является инвазивным, длится в среднем 40 минут и хорошо переносится пациентами. Исследование предсердий с помощью МРТ с отсроченным контрастированием сопряжено со сложностями, которые вызваны особенностями анатомии и физиологии предсердий, и поэтому в клинической практике до настоящего времени практически не использовался. Появление новых импульсных последовательностей для исследования предсердий позволило изучать с помощью МРТ миокард предсердий. Малая толщина стенок предсердий и меньшая разница в контрастировании здорового и патологического миокарда затрудняет визуальную оценку состояния миокарда предсердий, в связи с чем требуется автоматизированный подход к обработке полученных изображений.
Известен способ оценки изменений предсердий, который является ближайшим аналогом предлагаемого нами способа, в основе которого лежит оценка отношения интенсивности миокарда предсердий к средней интенсивности крови и сопоставление этих результатов с данными эндокардиалыюго картирования. Недостатками данного способа являются: неточности, связанные с позиционированием эндокардиальных электродов, а также отсутствие учета данных от здоровых добровольцев (Khurram I.M., Beinart R., Zipunnikov V. et al. Magnetic Resonance Image Intensity Ratio, A Normalized Measure to Enable Inter-Patient Comparability of Left Atrial Fibrosis. Heart Rhythm. 2013 Oct 3. pii: S1547-5271(13)01144-2).
В настоящем изобретении решалась задача разработки методики, позволяющей отличать патологически измененные участки предсердия от здоровых, а также выполнить количественную и пространственную оценку выявленных изменений.
Достигаемым техническим результатом является выявление патологически измененных участков предсердия, а также осуществление количественной и пространственной оценки выявленных изменений.
Способ осуществляется следующим образом.
Выполняют МРТ исследование, на основании которого оценивают морфологию сердца, функции левого желудочка (ЛЖ) и левого предсердия (ЛП), а при необходимости и функции правых отделов сердца.
Причем вначале исследование проводят бесконтрастно. Затем больному внутривенно вводится контрастный препарат, и через 15-20 мин выполняется сканирование миокарда предсердий. Исследование предсердий проводится на свободном дыхании, с синхронизацией с ЭКГ и дыханием, средняя длительность сканирования предсердий составляет 15 минут.
Результатом исследования является серия изображений предсердий с высоким пространственным разрешением (размер воксела 0,625×0,625×2,5 мм) и незначительными артефактами. На данных изображениях можно выявить очаги задержки контрастного препарата (зоны структурных изменений) во всем объеме миокарда предсердий. Однако из-за малой толщины стенок предсердий (3-4 мм), небольшой разницы в интенсивности MP-сигнала от здорового и пораженного миокарда воспроизводимая визуальная оценка наличия и тяжести структурных изменений миокарда предсердий в большинстве случаев бывает затруднена.
В связи с чем осуществляется обработка изображений с количественной оценкой зон отсроченного контрастирования и построение трехмерных реконструкций предсердий. Обработка изображений проводится с помощью специально созданной нами программы (авторское свидетельство на программу ЭВМ №2013661886, дата публ. 20.01.2014), которая позволяет сравнивать интенсивность MP-сигнала (ИС) миокарда предсердий с ИС от кровотока в полостях предсердий. Разработанная нами программа выполняет количественную оценку зон отсроченного контрастирования, осуществляет построение трехмерных моделей полостей сердца с выделением зон отсроченного контрастирования. Кроме того, программа анализирует серии изображений стенок миокарда в формате DICOM или BMP с построением и анализом гистограммы интенсивности пикселей, производит построение трехмерных моделей.
В процессе обработки, на изображениях вручную выделяется эндокардиальный контур предсердия, а эпикардиальный контур определяется автоматически (2-3 мм от эндокардиального). После этого автоматически проводится анализ гистограммы интенсивности пикселей полости предсердия (крови) с определением средней интенсивности и анализ гистограммы интенсивности пикселей изображений всех слоев миокарда предсердий, с определением максимального значения интенсивности.
На основании анализа предсердий группы здоровых добровольцев ранее нами был получен критерий отличия здорового миокарда от измененного (К1), равный 1,258, который мы приняли за пороговое отношение ИС. Данный критерий был рассчитан по формуле:
К1 = максимальная интенсивность пикселей миокарда предсердий/средняя интенсивность полости предсердий (крови).
В дальнейшем при обработке результатов обследования пациентов в каждом слое предсердия все пиксели разбиваются на 2 группы в зависимости от ИС: выше и ниже средней интенсивности. Каждая группа выше средней интенсивности по слою дополнительно автоматически разбивалась на кластеры по интенсивности сигнала и взаимному расположению пикселей.
Для каждого кластера определялась КОНСТАНТА (К2) по формуле:
К2 = средняя интенсивность пикселей кластера/средняя интенсивность полости предсердий (крови).
Значения К2 сравниваются с пороговым отношением ИС (К1).
При К2>К1 кластер считается патологически измененным участком миокарда предсердий.
Суммирование патологически измененных кластеров и представление их объема в процентном соотношении к общему объему предсердий позволяет оценить тяжесть поражений предсердий.
В завершении обработки изображений строятся трехмерные реконструкции предсердий с выделенными патологическими зонами.
Таким образом, сравнение константы отношения ИС здоровых (К1) и константы конкретного пациента (К2) позволяет выявить патологически измененные предсердия, а также осуществить количественную и пространственную оценку этих изменений.
Клинический пример №1.
Пациент В., 40 лет, с анамнезом мерцательной аритмии в течение 2 лет. Аритмия резистентна к 3 антиаритмическим препаратам в терапевтических дозах.
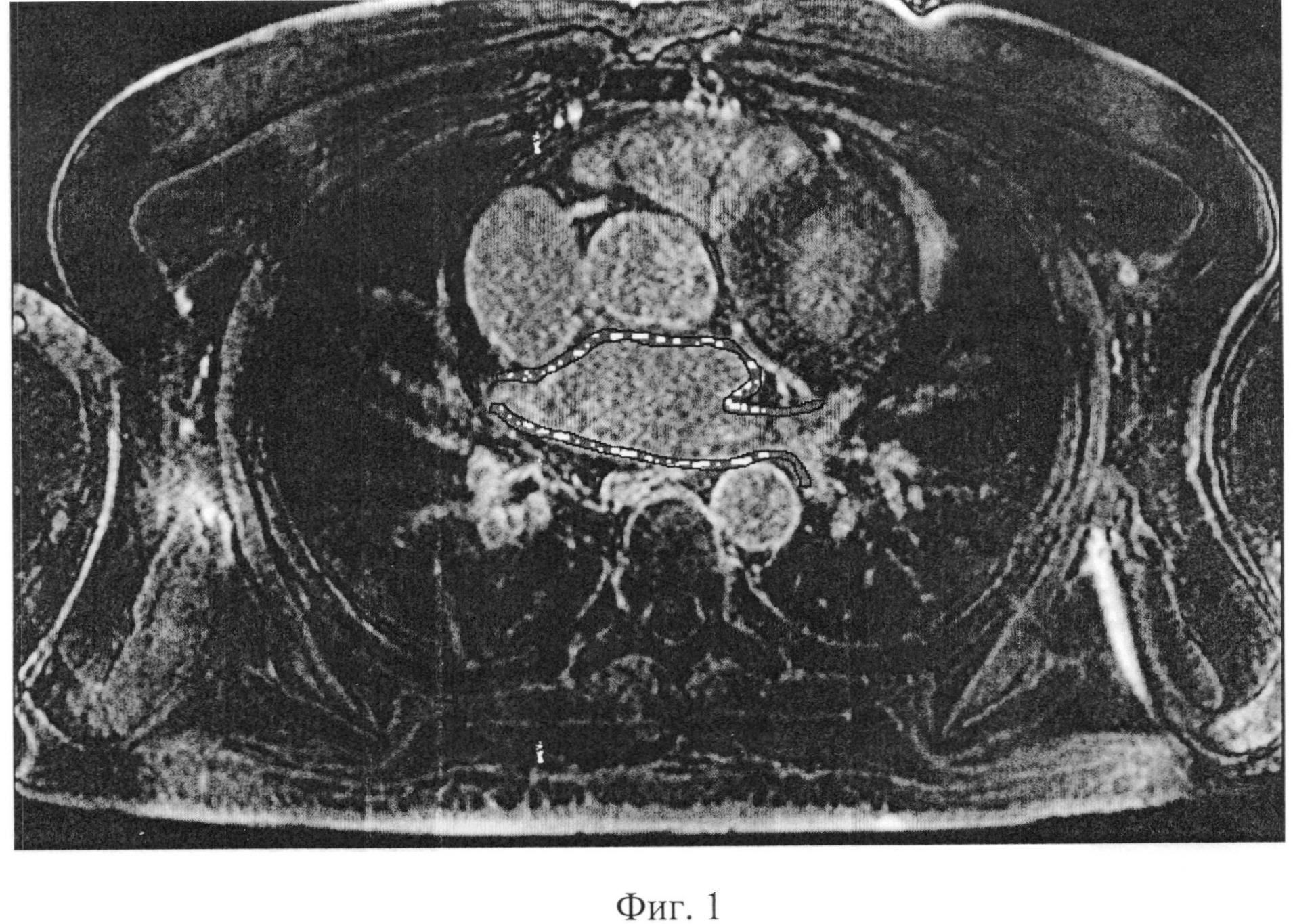
Было проведено МРТ сердца с отсроченным контрастированием для оценки тяжести структурных изменений миокарда предсердий (фиг.1). Выявлены диффузно распределенные зоны отсроченного контрастирования в миокарде предсердий. Суммарно по всем полям предсердий данные зоны составили 40%, что указывает на диффузное поражение миокарда предсердий. На фиг.1 выделены контуры миокарда предсердий, «внутри» которых выделены зоны отсроченного контрастирования (рубца).
Таким образом, по данным исследования выявлено: 40% процентов объема миокарда предсердий диффузно изменено, что объясняет частые рецидивы аритмии, резистентность к антиаритмической терапии.
С учетом значительного поражения миокарда предсердий принято решение о консервативной тактике ведения пациента и стратегии контроля частоты сердечных сокращений. На фоне принятой тактики ведения пациент отмечает хорошее самочувствие, аритмия не беспокоит.
Клинический пример №2.
Пациент П., 56 лет, с анамнезом пароксизмальной формы мерцательной аритмии в течение 6 лет. 2 года назад перенес аблацию устьев легочных вен, после чего через 1,5 года зарегистрирован рецидив мерцательной аритмии.
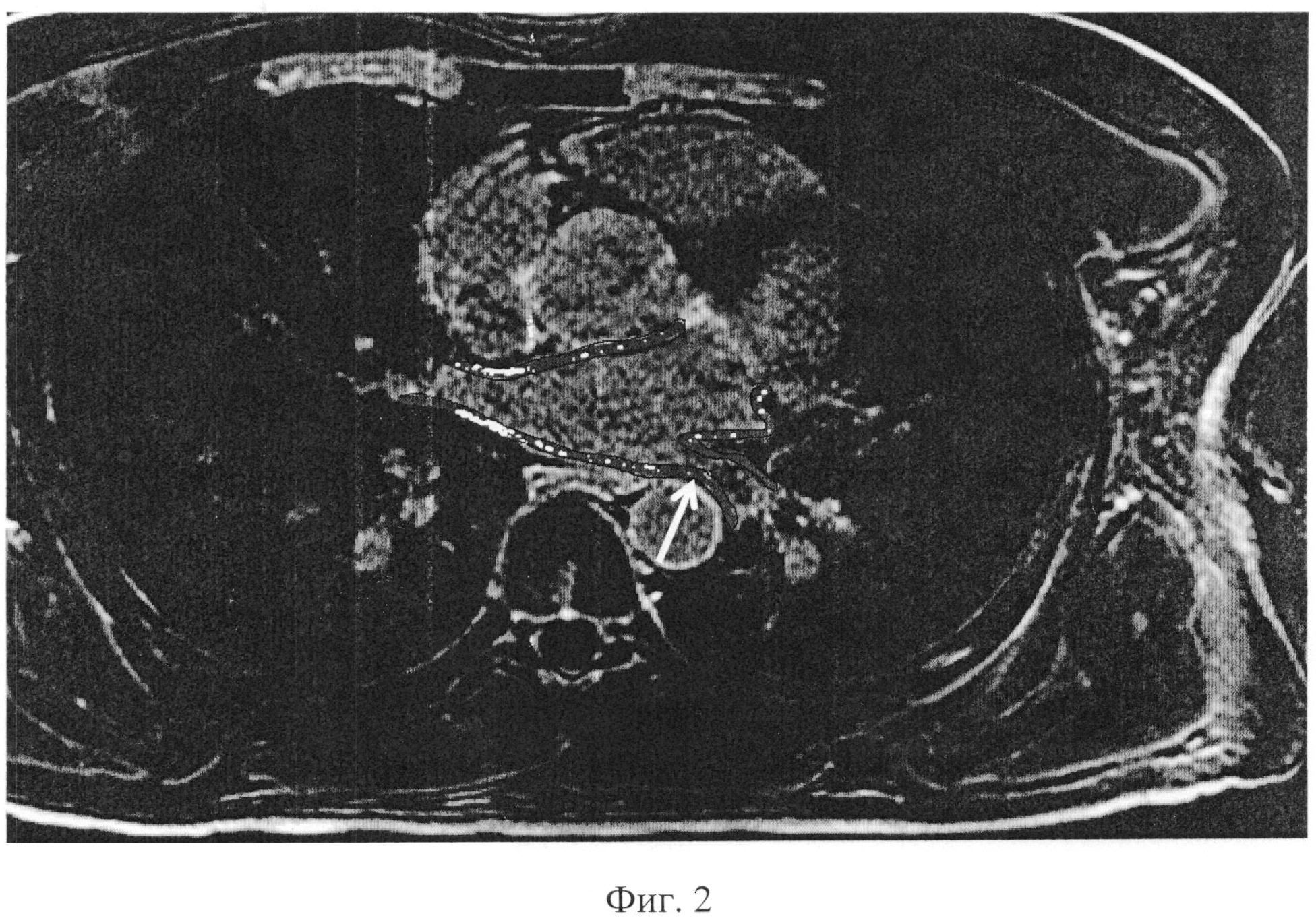
Было проведено МРТ предсердий с отсроченным контрастированием для оценки формирования постаблационных рубцов, определения неизолированных вен (фиг.2). Обращает внимание отстутствие отсроченного контрастирования вокруг левой верхней легочной вены (стрелка), что послужило ориентиром для повторной прицельной изоляции данной вены. На фиг.2 выделены контуры миокарда предсердий, «внутри» которых выделены зоны отсроченного контрастирования (рубца).
Таким образом, выявлена удовлетворительная изоляция правых и левой нижней легочной вен - наличие циркулярных рубцов вокруг устья, в то время как левая верхняя легочная вена изолирована неполно - отсутствие циркулярного рубца.
Данные позволили провести повторную аблацию и оптимизировать технику вмешательства с прицельной изоляцией левой верхней легочной вены.
Через 6 месяцев после повторной аблации рецидивы мерцательной аритмии не зарегистрированы, что позволяет говорить о полной изоляции легочных вен.