ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН
Вид РИД
Изобретение
Область, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции, содержащей в качестве активного фармацевтического ингредиента N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6-[5[[[2-(метилсульфонил)этил]амино]метил]-2-фурил]-4-хиназолинамин, и к способу изготовления подобной композиции.
Предпосылки к созданию изобретения
Соединение N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6-[5[[[2-(метилсульфонил)этил]амино]метил]-2-фурил]-4-хиназолинамин (международное непатентованное название: лапатиниб) является ингибитором тирозинкиназ, который оказывает двойное ингибирующее действие на рецепторы факторов роста ErbB1 (рецептор фактора роста эпидермиса, EGFR) и ErbB2 (HER2). Лапатиниб является членом 4-анилинохиназолинового класса ингибиторов киназ, которые, как было показано, связываются с сайтом связывания аденозинтрифосфата (АТФ) протеинкиназ и конкурируют с субстратом АТФ. Это блокирует фосфорилирование и активацию рецепторов, предотвращая последующую передачу сигналов вниз по соответствующему пути.
Лапатиниб в сочетании с капецитабином показан для лечения пациентов с выраженным или метастазирующим раком молочной железы, у которых опухоли демонстрируют сверхэкспрессию ErbB2 (Her2), и которые подвергались до этого терапии, включая трастузумаб.
Лапатиниб и его фармацевтические эффекты в отношении расстройств, таких как рак, описаны в международной заявке на изобретение WO 1999/035146. Другие медицинские применения лапатиниба и его солей известны, среди прочего, из международных заявок на изобретение WO 2005/120504, WO 2006/002422 и WO 2006/066267.
В международной заявке на изобретение WO 1999/035146 описан способ получения лапатиниба. Согласно этому и другим известным способам получения, лапатиниб получают в твердом виде. Одной из полиморфных форм лапатиниба является кристаллическая дитозилатная соль, как это описано в международной заявке на изобретение WO 2002/002552.
Стандартные фармацевтические препараты лапатиниба для перорального применения описаны в международной заявке на изобретение WO 2006/113649. Согласно общему описанию данного документа, активный ингредиент может присутствовать в широком диапазоне от 5 до 85% по массе. Однако препараты из примеров содержат только 45% активного ингредиента по массе.
Как правило, лапатиниб вводят в дозе 1250 мг один раз в сутки. Таблетки, содержащие 250 мг лапатиниба (в виде моногидрата дитозилатной соли), продают под торговой маркой Тайверб (компания Glaxo Smith Kline). Таким образом, требуемая доза включает пять таблеток Тайверб, которые должны быть введены перорально один раз в сутки. Такая ситуация неудовлетворительна и неудобна для пациента, в особенности потому, что медикаментозное лечение раковых пациентов обычно включает многолекарственный режим, что требует введения большого числа таблеток или капсул, зачастую вместе с внутривенной терапией. Кроме того, эти пациенты часто страдают тошнотой и поражениями слизистой оболочки рта. Поэтому пероральной применение лекарственных средств может быть затруднено приступами рвоты и проблемами с глотанием. Было бы, следовательно, желательно снизить число таблеток, которые необходимо проглотить, облегчая таким образом введение раковым пациентам суточных медикаментов.
Более того, хорошие гомогенность, характеристики сыпучести и слипания, устойчивость и (если то относится к делу) сжимаемость фармацевтической композиции являются предпосылками для успешного изготовления, например, таблеток в промышленном масштабе. Помимо этого, получаемая композиция должна обладать достаточно хорошими свойствами в плане растворимости. Часто трудно обеспечить в точности эти предпосылки при работе с высокими концентрациями активных фармацевтических ингредиентов, как это следует из того факта, что, например, таблетки Тайверб содержат лишь 250 мг лапатиниба, что соответствует содержанию лекарственного вещества менее 50% по массе по отношению к общей массе таблетки.
Вследствие этого, объектом настоящего изобретения является фармацевтическая композиция, содержащая такое количество фармацевтически активного ингредиента, которое достаточно для снижения числа принимаемых таблеток, при этом удовлетворяющая упомянутым выше техническим требованиям.
Для разрешения этих проблем, в частности, в отношении достаточно хороших свойств в плане растворимости для композиций с высоким содержанием лекарственного вещества, делались попытки добавления известных усилителей растворимости, увеличения количества разрыхлителя и/или подбора определенных связующих веществ. Однако эти обычные подходы не привели к успеху.
Как недавно было неожиданно обнаружено, вышеописанные проблемы могут быть преодолены в результате изготовления фармацевтической композиции, содержащей высокий процент лапатиниба, если активный ингредиент соответствует определенным свойствам, как это описано ниже.
Таким образом, объектом настоящего изобретения является фармацевтическая композиция, содержащая N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6-[5[[[2-(метилсульфонил)этил]амино]метил]-2-фурил]-4-хиназолинамин или его фармацевтически приемлемую соль в качестве активного фармацевтического ингредиента, где активный фармацевтический ингредиент присутствует в количестве более 60% по массе, предпочтительно, от 61% до 84% по массе по отношению к общей массе композиции.
Описание изобретения
N-[3-хлор-4-[(3-фторфенил)метокси]фенил]-6-[5[[[2-(метилсульфонил)этил]амино]метил]-2-фурил]-4-хиназолинамин (международное непатентованное название: лапатиниб) характеризуется следующим химическим строением:
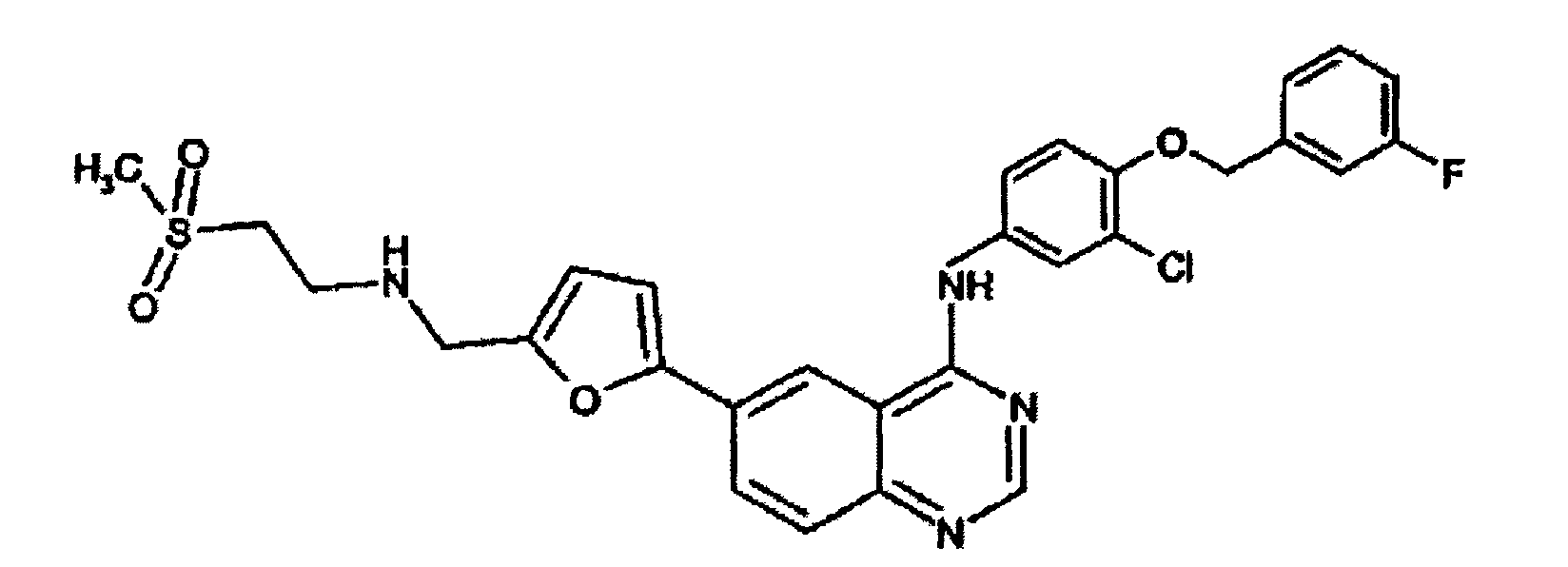
Лапатиниб может быть легко синтезирован с помощью хорошо известных в соответствующей области методик. Синтез лапатиниба описан, например, в международной заявке на изобретение WO 1999/035146.
Формы лапатиниба в виде дитозилатной соли, равно как и способы их получения, описаны в международной заявке на изобретение WO 2002/002552.
Термин «активный фармацевтический ингредиент» (АФИ) относится к лапатинибу и к его фармацевтически приемлемым солям. АФИ может находиться в любой полиморфной форме, включая сольваты и гидраты. Особенно предпочтительным является моногидрат дитозилата лапатиниба.
Термин «фармацевтическая композиция» относится к формам стандартной дозировки, таким как таблетки, капсулы, пилюли и т.п., равно и к порошкам и гранулам, применяемым при изготовлении форм стандартной дозировки. При ссылках на общую массу фармацевтической композиции и фармацевтической композиции в форме стандартной дозировки под общей массой подразумевается масса формы стандартной дозировки за вычетом массы какого-либо покрытия или оболочки капсулы, если таковые присутствуют. Предпочтительной формой дозировки по настоящему изобретению являются таблетки с пленочным покрытием.
Активный фармацевтический ингредиент присутствует в фармацевтической композиции в количестве более 60% по массе, предпочтительно от 61% до 90% по массе, более предпочтительно от 70% до 90% по массе, еще более предпочтительно от 80% до 90% по массе, а наиболее предпочтительно - от 85% до 90% по массе относительно общей массы композиции. Альтернативно, активный фармацевтический ингредиент присутствует в фармацевтической композиции в количестве от более 60% до менее 85% по массе, как, например, от 61% до 84% по массе, предпочтительно от 61% до 80% по массе, более предпочтительно от 61% до 70% по массе, а наиболее предпочтительно - от 61% до 65% по массе относительно общей массы композиции. Особенно предпочтительные количества лежат в диапазоне от 61% до 65% по массе и от 80% до 84% по массе относительно общей массы композиции. Также возможны любые сочетания всех вышеперечисленных диапазонов (в качестве нижних и/или верхних границ).
Благоприятные свойства в части растворимости, гомогенности, устойчивости, сыпучести, прессуемости и отсутствия склонности к расслоению смеси достигаются в том случае, если активный ингредиент, задействованный в изготовлении фармацевтической композиции по настоящему изобретению, характеризуется средним размером частиц от 1 до 30 мкм, предпочтительно от 1 до 20 мкм, более предпочтительно от 1 до 15 мкм. Предпочтительно, АФИ характеризуется размером частиц d(0,5) ниже 8 мкм, более предпочтительно, ниже 7 мкм, 6 мкм или 5 мкм. В одном из вариантов осуществления настоящего изобретения активный фармацевтический ингредиент характеризуется удельной поверхностью от 5 до 10 м2/г. Последнюю величину измеряют по методу адсорбции газа (метод БЭТ согласно Европейской Фармакопее 6.0, 2.9.26, используя в качестве газа - азот), а распределение частиц по размерам определяют посредством лазерного светорассеяния, осуществляемого с АФИ, диспергированным в жидком парафине в качестве среды для суспендирования (перемешивание при 2000 об/мин, затенение 10-20%). Вышеупомянутый диапазон размеров частиц и/или вышеупомянутый диапазон удельной поверхности имеют, в частности, преимущества с точки зрения быстрого растворения фармацевтической композиции с высоким содержанием лекарственного вещества, составляющим более 60% по массе.
Альтернативно, вышеописанные требования могут быть удовлетворены, если активный фармацевтический ингредиент, используемый в изготовлении фармацевтической композиции, характеризуется низким углом смачивания (также именуемым краевым углом). Краевой угол является мерой смачиваемости, и чем ниже краевой угол для данного вещества, тем лучше его смачиваемость. Предпочтительно, угол смачивания составляет менее 55° Предпочтительно, менее 50°, а наиболее предпочтительно - менее 47° Угол смачивания может быть измерен с помощью стандартных способов, известных в соответствующей области, например, с помощью гониометра. Для данного измерения спрессовывают 0,3 г АФИ с помощью пресса для КВг (2000 кг в течение 2 минут) в форму диаметром 1,25 см. Образец хранят при относительной влажности 100% и помещают за час до измерения на стеклообразную фритту, находящуюся в контакте с водой (качество Millipore). После этого измеряют угол смачивания с помощью прибора ОСА40, Dataphysics Instruments GmbH, Фильдерштад, при температуре 22°С и относительной влажности около 34% для трех различных расположений образца и различных позиций капли (3-5 мкл воды, качество Millipore) посредством статического измерения наступающих и отступающих краевых углов с помощью анализа контура капли, используя приближение эллипсом (SCA 20, Dataphysics Instruments GmbH, Фильдерштад). Угол смачивания определяют как наступающий краевой угол. Точность измерения составляет около ±2°.
Благоприятные свойства фармацевтического препарата в отношении, в частности, быстрого растворения достигают в результате применения АФИ с вышеупомянутым определенным размером частиц и/или вышеупомянутой определенной смачиваемостью, как она измерена на основании краевого угла.
Поскольку активный фармацевтический ингредиент, как его получают после процесса изготовления, может различаться размером частиц, его может потребоваться размолоть или измельчить с целью получения искомого среднего размера частиц. Авторы изобретения встретились с проблемами при измельчении моногидрата дитозилата лапатиниба вследствие его формы в виде длинных иголок. Было обнаружено, что эти проблемы могут быть преодолены посредством, например, добавления одного или нескольких наполнителей в ходе процедуры размалывания или измельчения.
Измельчение может быть осуществлено, например, штифтовой или молотковой мельниц. Варьируя скорость вращения мельницы, поступление АФИ и/или продолжительность измельчения, можно получить частицы, характеризуемые искомыми размером частиц и удельной поверхностью.
Предпочтительно применение воздухоструйной мельницы, если требуется достичь удельной поверхности, например более 6 м2/г.
Размер частиц АФИ и/или удельную поверхность можно также регулировать посредством смешения АФИ с разными размерами частиц и/или удельной поверхностью и/или просеивания с помощью сит с подходящими размерами ячеек.
Предпочтительна насыпная плотность фармацевтической композиции в пределах от 0,3 до 0,9 г/мл, предпочтительно от 0,4 до 0,8 г/мл.
Фармацевтическая композиция по настоящему изобретению предпочтительно характеризуется числом Хауснера в пределах от 1,05 до 1,65, более предпочтительно от 1,1 до 1,5. Число Хауснера является соотношением между насыпной плотностью и плотностью утряски.
Фармацевтическая композиция по настоящему изобретению может также содержать один или несколько фармацевтически приемлемых наполнителей, таких как заполнители, связывающие вещества, скользящие вещества, вещества, улучшающие сыпучесть, вещества, предотвращающие слипание, разрыхлители, и солюбилизаторы. В качестве фармацевтически приемлемых наполнителей могут быть использованы общепринятые наполнители, известные специалисту в соответствующей области. См., например, "Lexikon der Hilfsstoffe für Pharmazie, Kosmetik und angrenzende Gebiete" (Справочник по вспомогательным веществам для фармацевтики, косметики и родственных областей), под редакцией Н.Р.Fiedler, 4-е издание, Edito Cantor, Aulendorf, а также более ранние издания и "Handbook of Pharmaceutical Excipients" (Справочник по фармацевтическим наполнителям), третье издание, под редакцией Arthur Н. Kibbe, American Pharmaceutical Association, Washington, USA, и Pharmaceutical Press, London.
Предпочтительными примерами заполнителей являются лактоза, манит, сорбит или микрокристаллическая целлюлоза. Предпочтительно, заполнитель присутствует в количестве от 0 до 30% по массе от общей массы композиции.
Связывающее вещество может быть, например, микрокристаллической целлюлозой (МКЦ) или гидроксипропилметилцеллюлозой (ГПМЦ). Предпочтительно, связывающее вещество присутствует в количестве от 1 до 25% по массе, более предпочтительно от 2 до 10% по массе, от общей массы композиции.
Предпочтительно, скользящее вещество является стеаратом, таким как стеарат щелочноземельного металла, такой как стеарат магния, или стеарилфумарат натрия. Скользящее вещество присутствует, соответствующим образом, в композиции в количестве от 0,5 до 2,5% по массе, от общей массы композиции.
Подходящиими разрыхлителями являются, например, производные целлюлозы, такие как кроскармеллоза натрия, производные крахмала, такие как натрий-карбоксиметилкрахмал, пептизированный крахмал, синтетические полимеры, такие как поперечно-сшитый поивинилпирролидон (кросповидон) или гидрокарбонат натрия. Разрыхлитель или смесь разрыхлителей присутствует, соответствующим образом, в количестве от 1 до 20% по массе, более предпочтительно от примерно 5 до 10% по массе, от общей массы композиции.
В качестве вещества, улучшающего сыпучесть, может, например, выступать коллоидный диоксид кремния. Предпочтительно, вещество, улучшающее сыпучесть, может присутствовать в количестве от 0.5 до 8% по массе, более предпочтительно от 1 до 4% по массе, от общей массы композиции.
Вещество, предотвращающее слипание, может быть, например, тальком и может присутствовать в количествах от 1 до 5% по массе, более предпочтительно в количестве от 1,5 до 3% по массе, от общей массы композиции.
Дополнительное улучшение растворимости активного фармацевтического ингредиента может быть достигнуто, например, посредством добавления комплексообразующих веществ/соединений (например, бензоата натрия, салицилата натрия или циклодекстринов), варьирования свойств растворителя (например, посредством добавления поливинилпирродидона (ПВП) или полиэтиленгликолей) или добавления солюбилизаторов, образующих мицеллы (например, поверхностно-активных веществ).
Подходящими солюбилизаторами являются, например, поверхностно-активные вещества, такие как простые эфиры полиоксиэтиленовых спиртов (например, Бридж), полисорбаты (например, Твин) или сополимеры полиоксипропилена и полиоксиэтилена (полоксамер, например, Плюроник), и могут присутствовать в количествах от 0,5 до 7% по массе, более предпочтительно от 1 до 5% по массе, от общей массы композиции.
Альтернативно, может быть использован псевдоэмульгатор. Его механизм действия главным образом основан на улучшении вязкости. Однако псевдоэмульгаторы обладают также и эмульгирующими свойствами.
Предпочтительными псевдоэмульгаторами являются, например, простые эфиры целлюлозы, камедь акации или трагаканта. Псевдоэмульгаторы могут присутствовать в количествах от 1 до 10% по массе, более предпочтительно от 3 до 7% по массе, от общей массы композиции.
Специалист в соответствующей области может использовать эти или другие наполнители в зависимости от избираемого способа изготовления фармацевтической композиции по настоящему изобретению.
Из фармацевтической композиции по настоящему изобретению может быть любым известным образом изготовлен фармацевтический препарат, предпочтительно, в виде, таблеток, капсул, гранул, пилюль или пакетиков-саше. Особенно предпочтительной является фармацевтическая композиция в форме таблеток. Фармацевтическая композиция может содержать, например, дозировки в 250, 500, 625 или 1250 мг лапатиниба. Таким образом, вводимое количество можно легко варьировать в зависимости от индивидуальной переносимости и безопасности.
Фармацевтическая композиция по настоящему изобретению может быть изготовлена согласно стандартным способам, известным в соответствующей области. Грануляты согласно настоящему изобретению могут быть получены посредством полусухого прессования или мокрой грануляции. Эти грануляты могут быть затем смешаны с, например, подходящими разрыхлителями, регуляторами сыпучести и скользящими веществами, после чего смесь может быть спрессована в таблетки или помещена в пакетики-саше или капсулы походящего размера.
Таблетки могут также быть изготовлены с помощью непосредственного прессования подходящей смеси порошков, т.е. без какой-либо предшествующей грануляции наполнителей.
Подходящие порошковые или гранулятные смеси согласно настоящему изобретению могут также быть изготовлены посредством распылительной сушки, лиофилизации, экструзии расплава, наслоения гранулы, покрытия активного фармацевтического ингредиента или же любого другого подходящего способа. Предпочтительно, условия выбирают таким образом, чтобы предотвратить аморфизацию активного фармацевтического ингредиента. Изготавливаемые таким образом порошки или грануляты могут быть смешаны с одним или несколькими подходящими ингредиентами, а получаемые в результате смеси могут быть либо спрессованы, образуя таблетки, либо помещены в пакетики-саше или капсулы.
Вышеупомянутые способы, известные в соответствующей области, включают также способы измельчения и просеивания, позволяющие регулировать желаемые распределения частиц по размерам.
Фигуры
На фиг.1 представлен профиль растворения таблетки, полученной в примере 1.
На фиг.2 представлен профиль растворения таблетки, полученной в примере 2.
На фиг.3 представлен профиль растворения таблетки, полученной в примере 3.
На фиг.4 представлен профиль растворения таблетки, полученной в примере 4.
На фиг.5 представлен профиль растворения таблетки, полученной в примере 5.
На фиг.6 представлено сравнение профилей растворения таблеток согласно примерам 4 и 5.
На фиг.7 представлено сравнение профилей растворения таблеток согласно настоящему изобретению и не относящихся к нему.
Настоящее изобретение проиллюстрировано нижеследующими примерами, которые не следует понимать как ограничивающие. АФИ, задействованный в примерах 1 и 2, характеризовался краевым углом 56°. АФИ, задействованный в примерах 3-5, характеризовался краевым углом 45°.
Примеры
Пример 1
|
Моногидрат дитозилата лапатиниба, кукурузный крахмал и коллоидный диоксид кремния смешивают и просеивают, после чего подвергают мокрой грануляции с 10% раствором ГПМЦ в очищенной воде. Гранулят сушат, после чего смешивают с кроскармеллозой натрия и стеарилфумаратом натрия. Смесь спрессовывают в таблетки.
Растворение данных таблеток происходит быстрее, чем у продукта сравнения (таблетки Тайверб). По прошествии 5, 10, 15 и 20 минут из препарата оказывается растворено 73,5%, 84,2%, 90,3% и 93,1% активного фармацевтического ингредиента по сравнению с лишь 11,6%, 40%, 63% и 83% из продукта сравнения. Профили растворения представлены на фиг.1.
Пример 2
|
Моногидрат дитозилата лапатиниба, гидрокарбонат натрия и 80% коллоидного диоксида кремния смешивают и просеивают, после чего подвергают мокрой грануляции с 10% раствором ГПМЦ в очищенной воде. Высушенный гранулят смешивают со стеарилфумаратом натрия и остатком коллоидного диоксида кремния. Смесь спрессовывают в таблетки.
Растворение данных таблеток происходит быстрее, чем у продукта сравнения (таблетки Тайверб). По прошествии 5, 10, 15 и 20 минут из препарата оказывается растворено 73,5%, 85,2%, 89,5% и 91,7% активного фармацевтического ингредиента по сравнению с лишь 11,6%, 40%, 63% и 83% из продукта сравнения. Профили растворения представлены на фиг.2.
Пример 3
|
Моногидрат дитозилата лапатиниба и коллоидный диоксид кремния смешивают, измельчают и просеивают. Данную измельченную смесь подвергают мокрой грануляции с раствором ГПМЦ в очищенной воде. Получаемый таким образом гранулят просеивают, после чего смешивают с кроскармеллозой натрия и стеарилфумаратом натрия. Смесь спрессовывают в таблетки.
Растворение данных таблеток происходит быстрее, чем у продукта сравнения (таблетки Тайверб). По прошествии 5, 10, 15 и 20 минут из препарата оказывается растворено 34,4%, 74,5%, 86,8% и 94,8% активного фармацевтического ингредиента по сравнению с лишь 11,6%, 40%, 63% и 83% из продукта сравнения. Профили растворения представлены на фиг.3.
Пример 4
|
Моногидрат дитозилата лапатиниба, 67% кроскармеллозы натрия и 80% коллоидного диоксида кремния просеивают и смешивают. Данную смесь подвергают мокрой грануляции с раствором ГПМЦ в очищенной воде. Получаемый таким образом гранулят просеивают и смешивают с оставшимся количеством кроскармеллозы натрия и коллоидного диоксида кремния. После этого добавляют стеарилфумарат натрия. Эту конечную смесь спрессовывают в таблетки.
Растворение данных таблеток происходит быстрее, чем у продукта сравнения (таблетки Тайверб). По прошествии 5, 10, 15 и 20 минут из препарата оказывается растворено 78,7%, 93,1%, 96,6% и 99,2% активного фармацевтического ингредиента по сравнению с лишь 11,6%, 40%, 63% и 83% из продукта сравнения. Профили растворения представлены на фиг.4.
Пример 5
|
Моногидрат дитозилата лапатиниба и 80% коллоидного диоксида кремния смешивают, измельчают и просеивают. Измельченную смесь подвергают мокрой грануляции с раствором ГПМЦ в очищенной воде. Получаемый таким образом гранулят просеивают, после чего смешивают с кроскармеллозой натрия, оставшимся коллоидным диоксидом кремния и стеарилфумаратом натрия. Смесь спрессовывают в таблетки.
Растворение данных таблеток происходит быстрее, чем у продукта сравнения (таблетки Тайверб). По прошествии 5, 10, 15, 20 и 25 минут из препарата оказывается растворено 76,8%, 91,2%, 96,5%, 97,4 и 98,6% активного фармацевтического ингредиента по сравнению с лишь 11,6%, 40%, 63%, 83% и 94,1% из продукта сравнения. Профили растворения представлены на фиг.5.
На фиг.6 представлены профили растворения таблеток, получаемых в примерах 4 и 5. Хотя в примере 5 АФИ дополнительно измельчают, отличная смачиваемость АФИ приводит к сходному профилю растворения.
Пример 6
Для демонстрации полезного эффекта настоящего изобретения в отношении растворения содержащих лапатиниб таблеток было изготовлено два препарата с высоким содержанием лекарственного вещества (около 84% по массе) и большим размером частиц (d(0,5)>8 мкм) с коллидоном CL в качестве связующего вещества и без него. Профили растворения обоих препаратов практически идентичны (фиг.7, треугольники). Таким образом, против ожидания специалиста в соответствующей области связующее вещество не оказывает влияния на растворение АФИ.
Еще в одном препарате, содержащем около 84% АФИ по массе и коллидон CL в качестве связующего вещества, АФИ был измельчен до размера частиц d(0,5)<8 мкм. Профиль растворения данного препарата также представлен на фиг.7 (квадраты). Растворение происходит гораздо быстрее, чем растворение препаратов с большим размером частиц АФИ.
Наконец, на фиг.7 также представлен для сравнения профиль растворения коммерчески доступных таблеток Тайверб (ромбы).
Все профили растворения были измерены с использованием 900 мл 2% растворе Твин 80 в 0,1 н. HCl, рН 1, в 0,1 мм проточной ячейке при температуре 37°С и 75 об/мин (лопастной метод).
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/16845044a314a5d6c4b4dafc4ad5e312.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/d6479a5ee6c6693a4ea44594a932f304.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/dce6a6286066d5a40dc85dd97483487d.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/06f12c377b29306e153c7b842b068284.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/1fa11cc71e3183f9e8d7f40a9260055f.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/f9f604a5ad793ec00512647615fb6513.png)
![ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ N-[3-ХЛОР-4-[(3-ФТОРФЕНИЛ)МЕТОКСИ]ФЕНИЛ]-6-[5[[[2-(МЕТИЛСУЛЬФОНИЛ)ЭТИЛ]АМИНО]МЕТИЛ]-2-ФУРИЛ]-4-ХИНАЗОЛИНАМИН](https://fips.edrid.ru/images/rid/14/ee/e7/cbab18a7fc6e2cb980499cae54dfc544.png)

