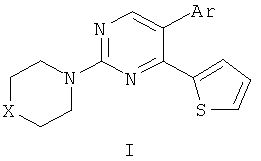
Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 5-(ГЕТ)АРИЛ-4-(2-ТИЕНИЛ)-2-(ТИО)МОРФОЛИЛПИРИМИДИНА
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к 2-тио(морфолил)-4,5-ди(гет)арилзамещенным пиримидинам, которые обладают широким спектром биологической активности, например гербицидной и антибактериальной, регулируют деятельность специфических белков, таких как АТОН-1, влияющий на транскрипционные факторы и участвующий в формировании нейронов, воздействуют на эпидермальный фактор роста (Epidermal growth factor - EGF), стимулирующий клеточный рост и клеточную дифференцировку эпителиального покрова, могут применяться при лечении нейродегеративных заболеваний, когнитивных расстройств и болезни Альцгеймера.
Уровень техники:
Основным способом получения 2-тио(морфолил)-4,5-ди(гет)арилзамещенных пиримидинов (3) является конденсация (тио)морфолилкарбоксамидинов (1) с 1,2-(гет)арил-3-диметиламинопропенонами (2) (Схема 1) [WO 2012/055942. Alpha-7 nicotinic receptor fort he trtreatment of pain, a psychotic disorder, cognitive impaiment or alzheimer desease. / Dean D., Lightfoot A., Roomans S.]
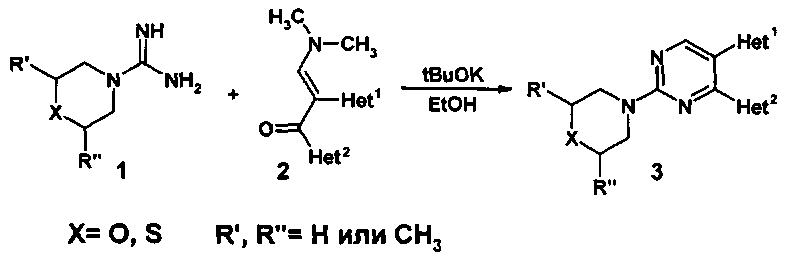
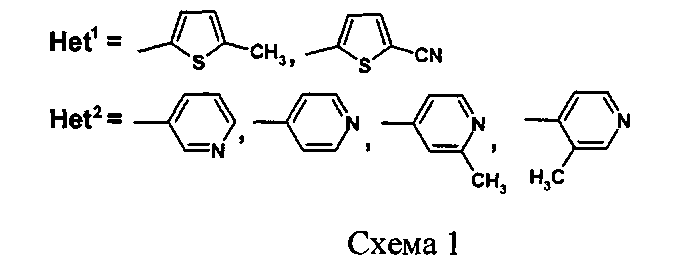
Недостатками данного способа являются: 1) малая доступность исходных (тио)морфолилкарбоксамидинов (1) и 1,2-(гет)арил-3-диметиламинопропенонов (2), вследствие чего необходим их предварительный трудоемкий многостадийный синтез; 2) низкий общий выход конечных 2-тио(морфолил)-4,5-ди(гет)арилзамещенных пиримидинов (3), составляющий в среднем 20-40%.
Известен также способ получения 2,4,5-три(гет)арилзамещенных пиримидинов (4) путем прямой модификации 2-хлор-4,5-ди(гет)арилзамещенных пиримидинов с использованием катализируемых палладием реакций как со вторичными аминами, с образованием соответствующих 2-диалкилзамещенных 4,5,6-трипиримидинов (5), так и при помощи кросс-сочетания по Сузуки с (гет)арилборными кислотами, с образованием соответствующих 2,4,5,6-тетр(гет)арилзамещенных пиримидинов (6) в органическом растворителе (1,4-диоксан, 1,2-диметоксиэтан, N,N-диметилформамид, ацетонитрил) при 80-100°C (Схема 2) [WO 2012/172043. Purine derivatives and their use as pharmaceuticals for prevention or treatment of bacterial infections. / Denis A., Gerusz V., Ledoussal В., Bonvin Y., Desroy N., Gold J., Moreau F., Oxoby M.]. Основным недостатком данного способа является длительное время протекания реакций - 16-48 часов.
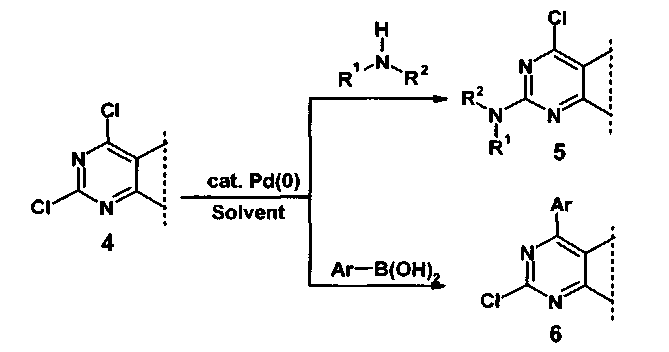
Таким образом, существующие методы являются многостадийными, требуют сложного предварительного синтеза исходных соединений и долгого времени протекания реакций.
Задача изобретения: синтезировать соединения, обладающие биологической активностью, из доступного сырья, в мягких условиях, с высоким выходом.
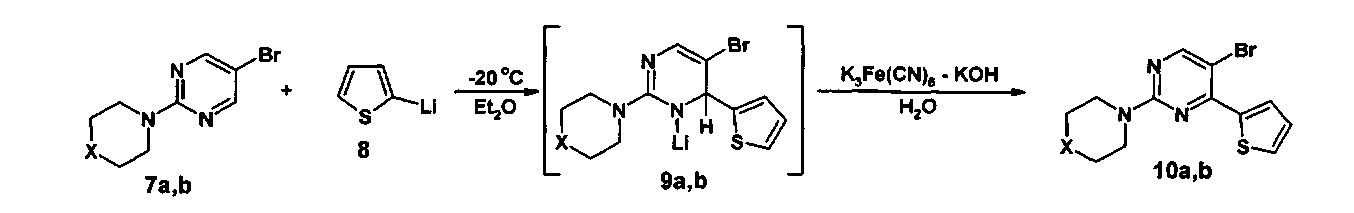
Поставленная задача решается тем, что на первой стадии получают 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидин (10а, b) взаимодействием 5-бром-2-(тио)морфолилпиримидина (7а, b) с избытком 2-тиениллития (8) в абсолютном эфире сначала при -20÷-25°C не менее 1 часа, а затем при комнатной температуре не менее 18 часов, добавляют раствор смеси гексацианоферрата(III) калия и гидроксида калия в воде и перемешивают не менее 4 часов при комнатной температуре, эфирную фазу отделяют и отгоняют, а полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат-гексан 1:3,
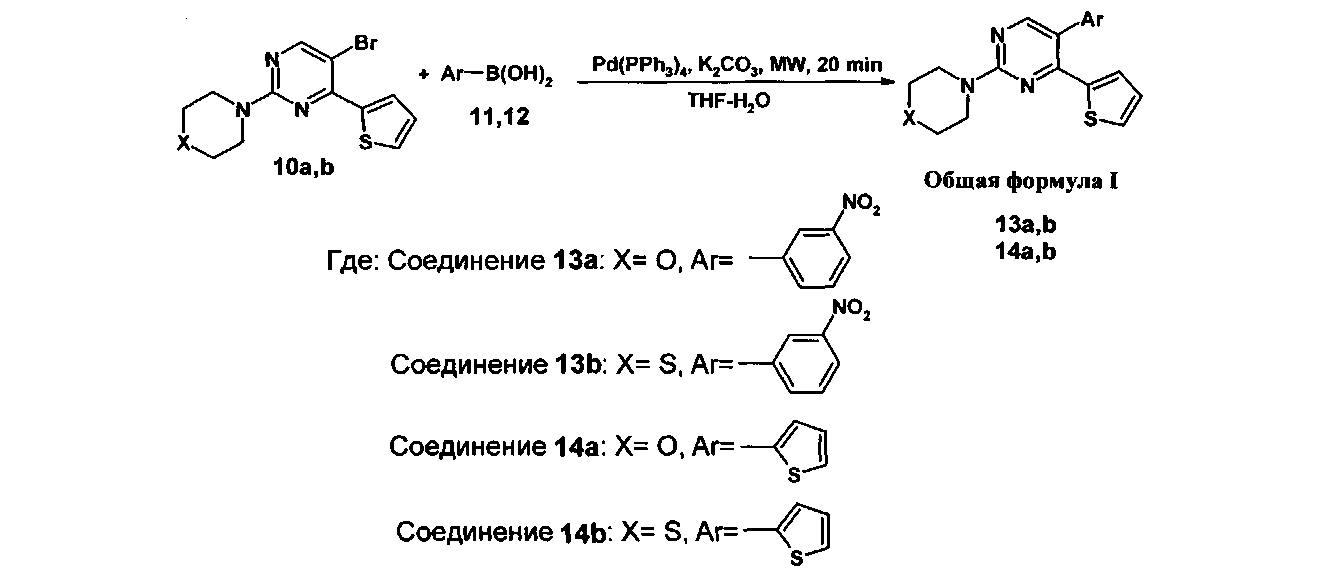
а на второй стадии полученный 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидин смешивают с (гет)арилборной кислотой и тетракис(трифенифосфин)палладием(0) в тетрагидрофуране, добавляют водный раствор карбоната калия и полученную смесь облучают микроволновым излучением при 155°C в течение 20 минут, растворитель отгоняют при пониженном давлении, полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат-гексан 1:2.
Проведение реакции 5-бром-2-(тио)морфолилпиримидина (7а, b) с избытком 2-тиениллития (8) в абсолютном эфире осуществляют в температурном интервале -20÷-25°C в течение не менее 1 часа, поскольку увеличение температуры ведет к разложению 2-тиениллития (8) и резкому снижению выхода промежуточного 5-бром-4-(2-тиенил)-2-(тио)морфолил-1,2-дигидропиримидина (9a, b), в свою очередь уменьшение температуры ниже -25°C приводит к значительному увеличению времени протекания реакции. Время реакции 1 час -20÷-25°C и не менее 18 часов при комнатной температуре достаточно для полного протекания реакции присоединения, тогда как его уменьшение при любой из температур также приводит к снижению выхода промежуточного 5-бром-4-(2-тиенил)-2-(тио)морфолил-1,2-дигидропиримидина (9a, b).
После образования 5-бром-4-(2-тиенил)-2-(тио)морфолил-1,2-дигидропиримидина (9a, b) в реакционную смесь добавляют раствор смеси гексацианоферрата(III) калия и гидроксида калия в воде и перемешивают не менее 4 часов при комнатной температуре, поскольку время протекания реакции менее 4 часов не обеспечивает полного окисления промежуточного 5-бром-4-(2-тиенил)-2-(тио)морфолил-1,2-дигидропиримидина (9a, b) до целевого 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидина (10a, b), то есть приводит к снижению его выхода.
Выделение продукта (10a, b) осуществляют путем хроматографического разделения на силикагеле при соотношении в элюенте этилацетат-гексан 1:3. Увеличение данного соотношения в пользу гексана приведет к необоснованному расходу растворителя, тогда как при увеличении доли этилацетата в элюенте не происходит селективного отделения целевого продукта (10a, b) от побочных примесей.
После очистки на второй стадии реакция 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидина (10a, b) с (гет)арилборной кислотой (11 или 12) протекает при 155°C в течение 20 минут. Данная температура является оптимальной. Времени 20 минут достаточно для протекания реакции, увеличение времени не приводит к существенному увеличению выхода целевого 5-(гет)арил-4-(2-тиенил)-2-(тио)морфолилпиримидина (I), тогда как уменьшение времени менее 20 минут приводит к снижению выхода продукта (I).
Выделение продукта (I) осуществляют путем хроматографического разделения на силикагеле при соотношении в элюенте этилацетат-гексан 1:2. Увеличение данного соотношения в пользу гексана приведет к необоснованному расходу растворителя, тогда как при увеличении доли этилацетата в элюенте не происходит селективного отделения целевого продукта (I) от побочных примесей.
Анализ промежуточных и целевых соединений проводят с использованием ЯМР-спектроскопии (Спектры ЯМР 1H и 13C измерены на спектрометре Bruker AVANCEIII-500 (500 и 126 МГц) в растворе CDCl3, внутренний стандарт ТМС). Полное отнесение сигналов 1H и 13C выполнено с помощью комбинации 2D экспериментов 1H-1H COSY, 1Н-13C HSQC/НМВС), газовой хроматографии/масс-спектрометрии (Газовый хроматограф-масс-спектрометр Agilent GC 7890А MS 5975С Inert XL EI/CI с квадрупольным масс-спектрометрическим детектором) и элементного анализа на автоматическом анализаторе Perkin-Elmer РЕ-2400.
Пример 1
К раствору 5-бром-2-морфолилпиримидина (7a) 732 мг (3 ммоль) в абсолютном эфире при -30°C добавляют избыток 2-тиениллития (2) 405 мг (4.5 ммоль) в 20 мл абсолютного эфира. Реакционную смесь перемешивают при -20°C в течение 1 часа, затем прекращают охлаждение и продолжают перемешивание еще 18 часов при комнатной температуре. Затем к реакционной смеси добавляют раствор смеси гексацианоферрата(III) калия 2 г (6 ммоль) и гидроксида калия 1 г (18 ммоль) в 20 мл воды и перемешивают ее 4 часа при комнатной температуре. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:3). В результате получают 5-бром-4-(2-тиенил)-2-морфолилпиримидин (10a) в виде бежевого порошка.
Выход 499 мг (51%).
Т.пл. 122-124°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 3.77 (м, 4Н, ОСН2); 3.82 (м, 4Н, NCH2); 7.15 (д.д, 1H, H(4′), J=5.1, 3.9); 7.52 (д.д, 1H, H(5′), J=5.1, 1.1); 8.33 (д.д, 1H, H(3′), J=3.9, 1.1); 8.40 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 44.35 (NCH2); 66.73 (ОСН2); 101.89 (C(5)); 127.99 (C(4′)); 130.46 (C(5′)); 131.00 (C(3′)); 142.37 (C(2′)); 155.72 (C(4)), 159.55 (C(2)); 161.38 (C(6)).
Элементный анализ для C12H12BrN3OS:
Вычислено (%): C, 44.18; H, 3.71; N, 12.88.
Найдено (%): C, 44.11; H, 3.70; N, 12.63.
ГЖХ: tR=26.01 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 325 [М]+ (100) для 79Br, 327 [М]+ (100) для 81Br.
5-Бром-2-морфолилпиримидин 326 мг (1 ммоль) (10a) смешивают с 3-нитрофениллборной кислотой (11) 200 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного тетрагидрофурана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 4 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 155°C (250 Вт) в течение 20 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:2). В результате получают 5-(3-нитрофенил)-4-(2-тиенил)-2-морфолилпиримидин (13a) в виде желтого порошка. Выход 258 мг (70%).
Т.пл. 172-174°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 3.82 (м, 4H, ОСН2); 3.92 (м, 4H, NCH2); 6.71 (д.д, 1H, H(3′), J=3.8, 1.0); 6.85 (д.д, 1H, H(4′), J=5.0, 3.8); 7.38 (д.д, 1H, H(5′), J=5.0, 1.0); 7.61 (т, 1H, H(5″), J=7.9); 7.66 (д.т, 1H, H(6″), J=7.7, 1.5); 8.20 (с, 1H, H(4)); 8.21 (т, 1H, H(2″), J=1.9); 8.27 ((д.д.д, 1H, H(4″), J=8.1, 2.1, 1.2).
Спектр ЯМР 13C (δ, м.д.): 44.28 (NCH2); 66.85 (ОСН2); 118.25 (C(5)); 122.76 (C(4″)); 124.67 (C(2″)); 127.80 (C(4′)); 129.74 (C(5′)); 128.82, 129.86 (C(5″), C(3′)); 136.14 (C(6″)); 139.42 (C(1″)); 142.60 (C(2′)); 148.63 (C(3″)); 156.51 (C(6)); 159.30 (C(4)); 160.46 (C(2)).
Элементный анализ для C18H16N4O3S:
Вычислено (%): C, 58.68; H, 4.38; N, 15.21.
Найдено (%): C, 58.75; H, 4.28; N, 15.41.
ГЖХ: tR=33.99 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 368 [М]+ (100).
Пример 2
К раствору 5-бром-2-тиоморфолилпиримидина (7b) 780 мг (3 ммоль) в абсолютном эфире при -30°C добавляют избыток 2-тиениллития (2) 405 мг (4.5 ммоль) в 20 мл абсолютного эфира. Реакционную смесь перемешивают при -20°C в течение 1 часа, затем прекращают охлаждение и продолжают перемешивание еще 18 часов при комнатной температуре. Затем к реакционной смеси добавляют раствор смеси гексацианоферрата(III) калия 2 г (6 ммоль) и гидроксида калия 1 г (18 ммоль) в 20 мл воды и перемешивают ее 4 часа при комнатной температуре. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат - гексан, 1:3). В результате получают 5-бром-4-(2-тиенил)-2-тиоморфолилпиримидин (10b) в виде желтого порошка.
Выход 709 мг (69%).
Т.пл. 105-107°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 2.67 (м, 4H, SCH2); 4.16 (м, 4H, NCH2); 7.15 (д.д, 1H, H(4′), J=5.1, 3.9); 7.52 (д.д, 1H, H(5′), J=5.1, 1.1); 8.33 (д.д, 1H, H(3′), J=3.9, 1.1); 8.39 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 26.84 (SCH2); 46.64 (NCH2); 101.47 (C(5)); 128.00 (C(4′)); 130.43 (C(5′)); 130.95 (C(3′)); 142.45 (C(2′)); 155.78 (C(4)), 159.05 (C(2)); 161.46 (C(6)).
Элементный анализ для C12H12BrN3S2:
Вычислено (%): C, 42.11; H, 3.53; N, 12.28.
Найдено (%): 42.01; H, 3.60; N, 12.09.
ГЖХ: tR=27.87 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 341 [М]+ (100) для 79Br, 343 [М]+ (100) для 81Br.
5-Бром-2-тиоморфолилпиримидин 342 мг (1 ммоль) (10b) смешивают с 3-нитрофениллборной кислотой (11) 200 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного тетрагидрофурана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 4 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 155°C (250 Вт) в течение 20 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:2). В результате получают 5-(3-нитрофенил)-4-(2-тиенил)-2-тиоморфолилпиримидин (13b) в виде светло-желтого порошка. Выход 258 мг (67%).
Т.пл. 163-164°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 2.72 (м, 4H, SCH2); 4.25 (м, 4H, NCH2); 6.70 (д.д, 1H, H(3′), J=3.9, 1.1); 6.85 (д.д, 1H, H(4′), J=5.1, 3.9); 7.37 (д.д, 1H, H(5′), J=5.1, 1.1); 7.60 (т, 1H, H(5″), J=7.9); 7.66 (д.т, 1H, H(6″), J=7.7, 1.5); 8.18 (с, 1H, H(6)); 8.21 (т, 1H, H(2″), J=1.9); 8.27 (д.д.д, 1H, H(4″), J=8.1, 2.2, 1.2).
Спектр ЯМР 13C (δ, м.д.): 27.00 (SCH2); 46.52 (NCH2); 117.90 (C(5)); 122.73 (C(4″)); 124.68 (C(2″)); 127.80 (C(4′)); 129.70 (C(5′)); 129.79, 129.80 (C(3′), C(5″)); 136.14 (C(6″)); 139.43 (C(1″)); 142.69 (C(2′)); 148.63 (C(3″)); 156.57 (C(4)); 159.35 (C(6)); 160.28 (C(2)).
Элементный анализ для C18H16N4O3S:
Вычислено (%): C, 58.68; H, 4.38; N, 15.21.
Найдено (%): C, 58.75; H, 4.28; N, 15.41.
ГЖХ: tR=39.13 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 384 [М]+ (100).
Пример 3
К раствору 5-бром-2-морфолилпиримидина (7а) 732 мг (3 ммоль) в абсолютном эфире при -30°C добавляют избыток 2-тиениллития (2) 405 мг (4.5 ммоль) в 20 мл абсолютного эфира. Реакционную смесь перемешивают при -20°C в течение 1,2 часа, затем прекращают охлаждение и продолжают перемешивание еще 19 часов при комнатной температуре. Затем к реакционной смеси добавляют раствор смеси гексацианоферрата(III) калия 2 г (6 ммоль) и гидроксида калия 1 г (18 ммоль) в 20 мл воды и перемешивают ее 5 часа при комнатной температуре. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент: этилацетат-гексан, 1:3). В результате получают 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидин (10a) в виде бежевого порошка. Выход 514 мг (53%).
Т.пл. 122-124°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 3.77 (м, 4H, ОСН2); 3.82 (м, 4H, NCH2); 7.15 (д.д, 1H, H(4′), J=5.1, 3.9); 7.52 (д.д, 1H, H(5′), J=5.1, 1.1); 8.33 (д.д, 1H, H(3′), J=3.9, 1.1); 8.40 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 44.35 (NCH2); 66.73 (ОСН2); 101.89 (C(5)); 127.99 (C(4′)); 130.46 (C(5′)); 131.00 (C(3′)); 142.37 (C(2′)); 155.72 (C(4)), 159.55 (C(2)); 161.38 (C(6)).
Элементный анализ для C12H12BrN3OS:
Вычислено (%): C, 44.18; H, 3.71; N, 12.88.
Найдено (%): C, 44.11; H, 3.70; N, 12.63.
ГЖХ: tR=26.01 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 325 [М]+ (100) для 79Br, 327 [М]+ (100) для 81Br.
5-Бром-2-морфолилпиримидин 326 мг (1 ммоль) (10а) смешивают с 2-тиенилборной борной кислотой (12) 154 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного тетрагидрофурана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 4 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 155°C (250 Вт) в течение 20 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:2). В результате получают 4,5-ди(2-тиенил)-2-морфолилпиримидин (14а) в виде светло-желтого порошка. Выход 264 мг (80%).
Т.пл. 158-160°C.
Спектр ЯМР 1Н (δ, м.д., J/Гц): 3.81 (м, 4H, ОСН2); 3.90 (м, 4H, NCH2); 6.89 (д.д, 1H, H(4′), J=4.9, 3.8); 6.91 (д.д, 1H, H(3′), J=3.8, 1.3); 7.02 (д.д, 1H, H(3″), J=3.5, 1.2); 7.12 (д.д, 1H, H(4″), J=5.2, 3.5); 7.36 (д.д, 1H, H(5′), J=4.9, 1.3); 7.43 (д.д, 1H, H(5″), J=5.2, 1.2); 8.27 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 44.28 (NCH2); 66.86 (ОСН2); 112.82 (C(5)); 126.85 (C(5″)); 127.58 (C(4″)); 127.84 (C(4′)); 128.14 (C(3″)); 129.58 (C(5′)); 129.95 (C(3′)); 138.20 (C(2″)); 142.83 (C(2′)); 157.53 (C(4)); 160.31 (C(6)); 160.72 (C(2)).
Элементный анализ для C16H15N3OS2:
Вычислено (%): C, 58.33; H, 4.59; N, 12.75.
Найдено (%): C, 58.45; H, 4.44; N, 12.79.
ГЖХ: tR=28.72 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 329 [М]+ (100).
Пример 4
К раствору 5-бром-2-тиоморфолилпиримидина (7b) 780 мг (3 ммоль) в абсолютном эфире при -30°C добавляют избыток 2-тиениллития (2) 405 мг (4.5 ммоль) в 20 мл абсолютного эфира. Реакционную смесь перемешивают при -20°C в течение 1,5 часа, затем прекращают охлаждение и продолжают перемешивание еще 18,5 часов при комнатной температуре. Затем к реакционной смеси добавляют раствор смеси гексацианоферрата(III) калия 2 г (6 ммоль) и гидроксида калия 1 г (18 ммоль) в 20 мл воды и перемешивают ее 4,5 часа при комнатной температуре. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:3). В результате получают 5-бром-4-(2-тиенил)-2-тиоморфолилпиримидин (10b) в виде желтого порошка. Выход 739 мг (72%).
Т.пл. 105-107°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 2.67 (м, 4H, SCH2); 4.16 (м, 4H, NCH2); 7.15 (д.д, 1H, H(4′), J=5.1, 3.9); 7.52 (д.д, 1H, H(5′), J=5.1, 1.1); 8.33 (д.д, 1H, H(3′), J=3.9, 1.1); 8.39 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 26.84 (SCH2); 46.64 (NCH2); 101.47 (C(5)); 128.00 (C(4′)); 130.43 (C(5′)); 130.95 (C(3′)); 142.45 (C(2′)); 155.78 (C(4)), 159.05 (C(2)); 161.46 (C(6)).
Элементный анализ для C12H12BrN3S2:
Вычислено (%): C, 42.11; H, 3.53; N, 12.28.
Найдено (%): 42.01; H, 3.60; N, 12.09.
ГЖХ: tR=27.87 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 341 [М]+ (100) для 79Br, 343 [М]+ (100) для 81Br.
5-Бром-2-тиоморфолилпиримидин 342 мг (1 ммоль) (10b) смешивают с 2-тиенилборной борной кислотой (12) 154 мг (1.2 ммоль) и тетракис(трифенифосфин)палладием(0) 58 мг (0.05 ммоль). Полученную смесь растворяют в 4 мл дегазированного тетрагидрофурана. К образовавшемуся раствору добавляют раствор карбоната калия 346 мг (2.5 ммоль) в 4 мл дегазированной воды. Полученную смесь облучают микроволновым излучением при 155°C (250 Вт) в течение 20 минут. После этого растворитель отгоняют на роторном испарителе при пониженном давлении, полученный остаток подвергают хроматографическому разделению на колонке с силикагелем (элюент : этилацетат-гексан, 1:2). В результате получают 4,5-ди(2-тиенил)-2-тиоморфолилпиримидин (14b) в виде светло-желтого порошка. Выход 252 мг (73%).
Т.пл. 149-152°C.
Спектр ЯМР 1H (δ, м.д., J/Гц): 2.71 (м, 4H, SCH2); 4.24 (м, 4H, NCH2); 6.88-6.90 (м, 2H, H(3′), H(4′)); 7.02 (д.д, 1H, H(3″), J=3.5, 1.1); 7.12 (д.д, 1H, H(4″), J=5.1, 3.5); 7.36 (м, 1H, H(5′)); 7.43 (д.д, 1H, H(5″), J=5.1,1.1); 8.25 (с, 1H, H(6)).
Спектр ЯМР 13C (δ, м.д.): 26.98 (SCH2); 46.53 (NCH2); 112.45 (C(5)); 126.84 (C(5″)); 127.59 (C(4″)); 127.86 (C(4′)); 128.15 (C(3″)); 129.57 (C(5′)); 129.91 (C(3′)); 138.24 (C(2″)); 142.93 (C(2′)); 157.59 (C(4)); 160.26 (C(2)); 160.39 (C(6)).
Элементный анализ для C16H15N3S3:
Вычислено (%): C, 55.62; H, 4.38; N, 12.16.
Найдено (%): С, 55.41; H, 4.45; N, 12.27.
ГЖХ: tR=31.03 мин. Масс-спектр: (ЭУ, 70 эВ), m/z (Iотн, %): 345 [М]+ (100).
Таким образом, нами предложен новый эффективный способ получения 4,5-ди(гет)арил-2-(тио)морфолилпиримидинов, которые могут быть полезны как антибактериальные соединения, а также для лечении нейродегеративных заболеваний, когнитивных расстройств и болезни Альцгеймера.
Преимуществами данного способа являются:
1. Легкость варьирования заместителей благодаря высокой доступности коммерчески доступных (гет)арилборных кислот и простоте получения литийорганический соединений.
2. Мягкие условия проведения реакций и быстрота их проведения, в том числе благодаря использованию микроволнового излучения.
3. Всего две стадии получения и высокие выходы целевых продуктов, в отличие от многостадийных (не менее 3-х стадий), описанных в литературе способов получения аналогичных продуктов с выходами не более 50%.
Способ получения 5-(гет)арил-4-(2-тиенил)-2-(тио)морфолилпиримидина общей формулы (I) где X=O или S, Ar=3-нитрофенил или 2-тиенил,заключающийся в том, что на первой стадии получают 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидин взаимодействием 5-бром-2-(тио)морфолилпиримидина с избытком 2-тиениллития в абсолютном эфире сначала при -20÷-25°C не менее 1 часа, а затем при комнатной температуре не менее 18 часов, добавляют раствор смеси гексацианоферрата(III) калия и гидроксида калия в воде и перемешивают не менее 4 часов при комнатной температуре, эфирную фазу отделяют и отгоняют, а полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат - гексан 1:3, а на второй стадии полученный 5-бром-4-(2-тиенил)-2-(тио)морфолилпиримидин смешивают с (гет)арилборной кислотой и тетракис(трифенифосфин)палладием(0) в тетрагидрофуране, добавляют водный раствор карбоната калия и полученную смесь облучают микроволновым излучением при 155°C в течение 20 минут, растворитель отгоняют при пониженном давлении, полученный остаток подвергают хроматографическому разделению на силикагеле при соотношении в элюенте этилацетат - гексан 1:2.