Результат интеллектуальной деятельности: АЗОЛОАЗИНИЕВЫЕ СОЛИ ФТОРХИНОЛОНОВ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ И ПРОТИВОВИРУСНЫМ ДЕЙСТВИЕМ
Вид РИД
Изобретение
1. Область техники, к которой относится изобретение
Изобретение относится к области биологически активных соединений и касается новых азолоазиниевых солей антибактериальных препаратов фторхинолонового ряда (пефлоксацина, норфлоксацина, энрофлоксацина, левофлоксацина и др.), обладающих антибактериальным и противовирусным действием и предназначенных для лечения и профилактики бактериальных и вирусных заболеваний человека и животных. Изобретение может быть использовано в научно-исследовательских лабораториях, химико-фармацевтической промышленности, лечебных учреждениях, а также в ветеринарии.
2. Уровень техники
Анализ современного состояния санитарно-эпидемиологической обстановки показывает, что в некоторых сопредельных с территорией Российской Федерации странах сохраняется эпидемически неблагополучная ситуация по целому ряду инфекционных заболеваний. При этом наибольшую угрозу представляют особо опасные инфекции (далее - ООИ), к числу которых относятся чума, сибирская язва, туляремия, геморрагические лихорадки, энцефалиты и др. С увеличением миграционных потоков возрастает вероятность завоза и распространения ООИ на территории Российской Федерации.
В современной социально-политической обстановке нельзя исключать возможность применения различных типов биопатогенов в качестве диверсионных средств, а также в ходе локальных вооруженных конфликтов. При этом наиболее высока вероятность использования биологических средств, включающих возбудителей сибирской язвы, туляремии, венесуэльского энцефаломиелита лошадей, лихорадок разных видов.
В этой связи экстренная профилактика и этиотропное лечение, для осуществления которых рекомендован ряд эффективных антибактериальных препаратов фторхинолонового ряда, очень важны. Фторхинолоны прочно вошли в арсенал самых современных антибактериальных средств и широко представлены на фармацевтическом рынке России.
Однако даже самые современные фторхинолоны 4-го поколения с широким спектром действия не обладают защитным эффектом в отношении патогенов вирусной природы (монография В.Н. Чарушина, Э.В. Носовой, Г.Н. Липуновой, О.Н. Чупахина. Фторхинолоны.- М.: Физматлит, 2013). Необходим поиск новых средств и методов экстренной профилактики и раннего этиотропного лечения ООИ - создание комплексного лекарственного средства, обладающего одновременно и антибактериальным и противовирусным действием.
В широком кругу синтетических гетероциклических соединений, обладающих противовирусным действием, значимое место занимают азолоазины, содержащие в структуре молекулы мостиковый атом азота: 1,2,4-триазоло[1,5-а]триазины (1) и 1,2,4-триазоло[1,5-а]пиримидины (2). Интерес к азолоазинам обусловлен, прежде всего, их структурным сходством с нуклеиновыми основаниями. Благодаря этой особенности они могут выступать в роли антиметаболитов, проявляя противовирусное действие.
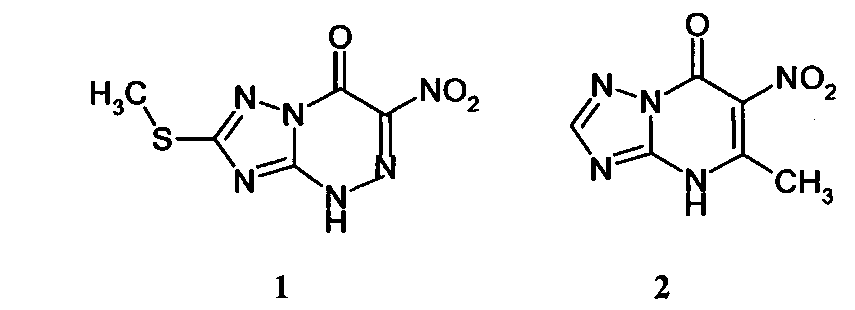
На основе азолоазиниевых соединений разработаны лекарственные препараты с широким спектром противовирусного действия - Триазавирин и Триазид, которые по результатам доклинического и клинического изучения могут быть рекомендованы к медицинскому применению.
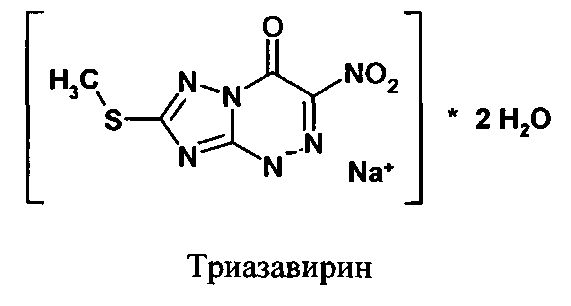
Препарат Триазавирин (7-метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло [5,1-с][1,2,4]триазин-1-ид натрия) эффективен в отношении широкого спектра вирусов гриппа. Препарат Триазавирин® находится на завершающей стадии клинических исследований. (О.Н. Чупахин, В.Л. Русинов, Е.Н. Уломский, В.Н. Чарушин, А.Ю. Петров, О.И. Киселев. Патент РФ №2294936. Опубликован 10.03.2007).
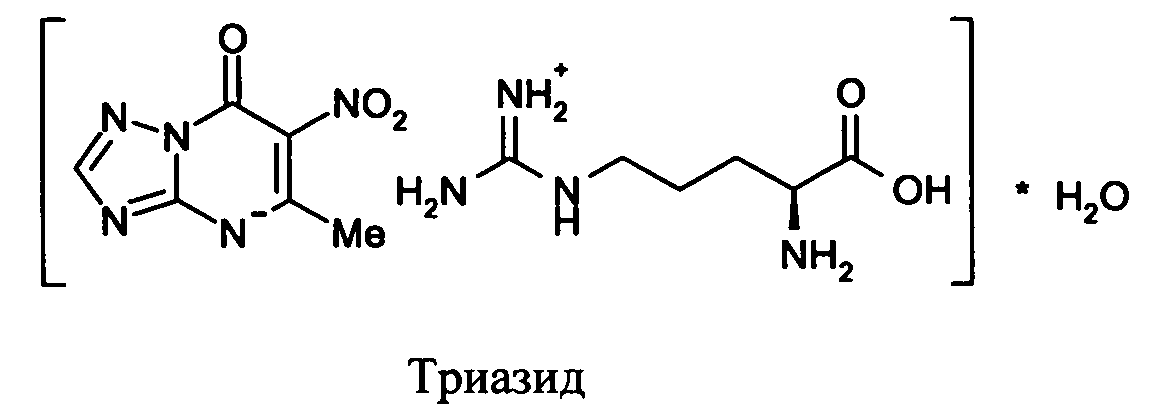
Триазид (5-метил-6-нитро-7-оксо-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидинид l-аргининия моногидрата) рекомендован для клинического изучения (О.Н. Чупахин, В.Н. Чарушин, В.Л. Русинов, Е.Н. Уломский, С.К. Котовская, О.И. Киселев, Э.Г. Деева, К.В. Саватеев, С.С. Борисов. Заявка на патент РФ от 15.04.2013 №2013116765/024823).
Анализ патентной и научной литературы показывает, что комбинации фторхинолонов с противовирусными средствами встречаются достаточно редко. Такие композиции, как правило, представляют собой физические смеси, в которых присутствуют в определенных весовых соотношениях антибактериальный фторхинолон, противовирусный препарат (один и более) и вспомогательные вещества. Так, комбинации фторхинолонов с противовирусными средствами применяются в качестве средств профилактики и лечения вирусных и бактериальных инфекций в ветеринарии [CN 1185318. Pressure-sensitive adhesive sheet and convered structure / Isao S., Tomoo O., Hiroshi K. Lintec Corp) // Appl. 28.08.2002 CN Appl. 20018000796, 05.03.2001. (C09J 7/02). 32 pp.; WO 0145727. Veterinary compositions / Shoa A A.R., Hossny E.-B., Kefah D.A. (New Pharma Res Sweden Ab; Shoa A A.R.; Hossny E.B.; Kefan D.A.) // Appl. 28.06.2001 WO Appl. 2000 EP 13017, 20.12.2000. (A61K 31/70; A61K 45/06; A61K 47/10; A61K 47/12; A61K 47/18; A61K 47/22; A61P 31/12). 31 pp.; CN 101467999. Compound preparation of berberine hydrochloride / Hongyun W., Jianzheng L., Changchao B. (Zhengzhou Houyi Pharmaceutical) // Appl. 01.07.2009 CN Appl. 20071300060, 25.12.2007. (A61K 31/4375). 7 pp.].
При анализе патентной и специальной литературы соединений, полученных химическим синтезом на основе фторированных хинолонов и обладающих одновременно как антибактериальным, так и противовирусным действием, не выявлено.
3. Сущность изобретения
Техническим результатом данного изобретения является создание новых химических соединений - азолоазиниевых солей соединений фторхинолонового ряда. Указанный технический результат достигается тем, что согласно изобретению синтезированы новые азолоазиниевые соли фторхинолонов формул 4а-в, 5а-в, 7а, б и 8а, б, обладающие антибактериальным и противовирусным действием. Данные соединения могут быть использованы для создания отечественных лекарственных средств - комплексных препаратов для экстренной профилактики и лечения инфекций, вызванных патогенами как бактериальной, так и вирусной природы.
В литературе указанные соединения 4а-в, 5а-в, 7а, б и 8а, б, способы их получения и физико-химические характеристики не описаны.
4. Сведения, подтверждающие сущность изобретения
4.1. Синтез азолоазиниевых солей фторхинолонов
В структуре большинства представленных на фармацевтическом рынке фторированных хинолонов содержится остаток замещенной аминогруппы, благодаря чему фторхинолоны проявляют выраженные N-основные свойства. По этой причине некоторые препараты фторхинолонового ряда применяют в виде солей с неорганическими и органическими кислотами (пефлоксацин - метансульфонат, норфлоксацин и ципрофлоксацин - гидрохлориды и т.д.) для повышения растворимости и улучшения биодоступности лекарственного средства. Что касается азолоазинов, то они по своей природе являются NH-кислотами и могут образовывать соли с неорганическими и органическими основаниями (триазавирин - натриевая соль, триазид - аргининиевая соль).
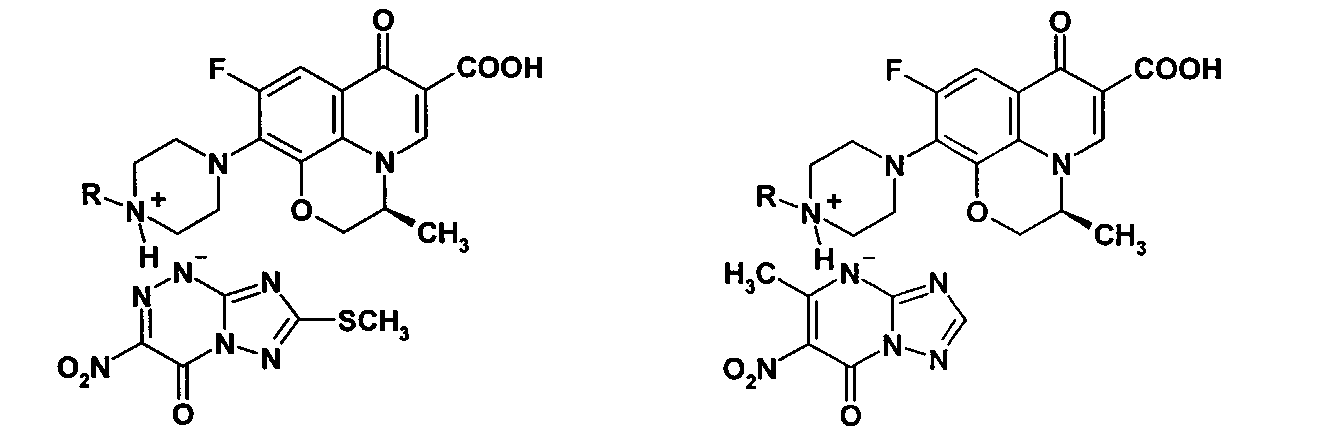
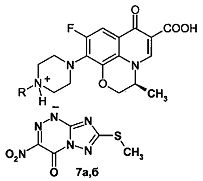
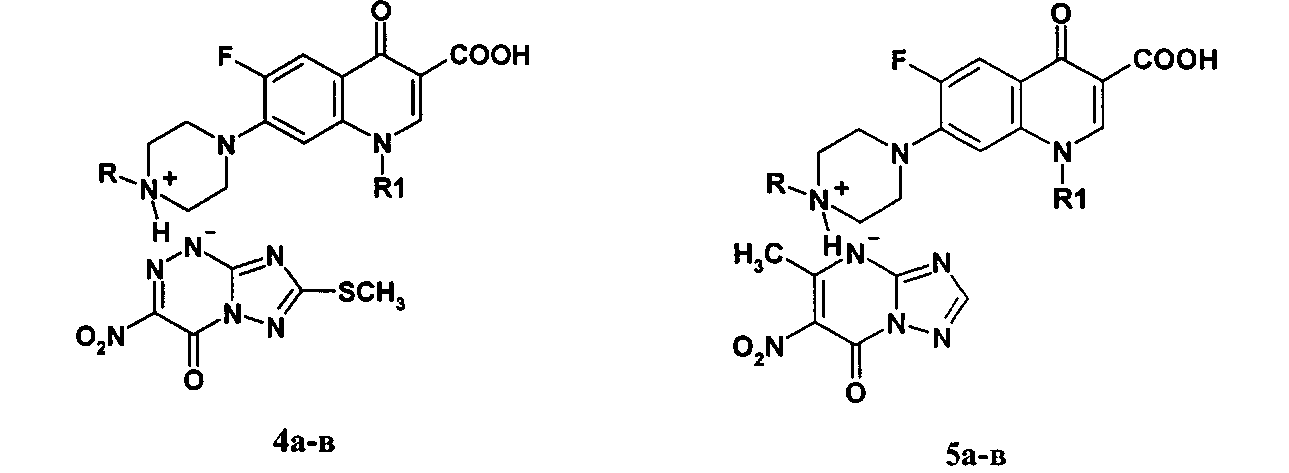
Способность двух сложных органических молекул вступать в реакции солеобразования (N-оснований с NH-кислотами) была нами использована для получения новых химических соединений - азолоазиниевых солей фторхинолонов. В качестве N-оснований использованы бициклические фторхинолоны (пефлоксацин 3а, норфлоксацин 3б, энрофлоксацин 3в) и трициклические фторхинолоны (левофлоксацин 6а и его аналог 6б), а в качестве NH-кислот - азолоазины: 7-метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид (1) и 5-метил-6-нитро-7-оксо-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин (2). Получение азололазиниевых солей на основе бициклических фторхинолонов 3а-в и трициклических фторхинолонов 6а, б представлено схемами 1 и 2.
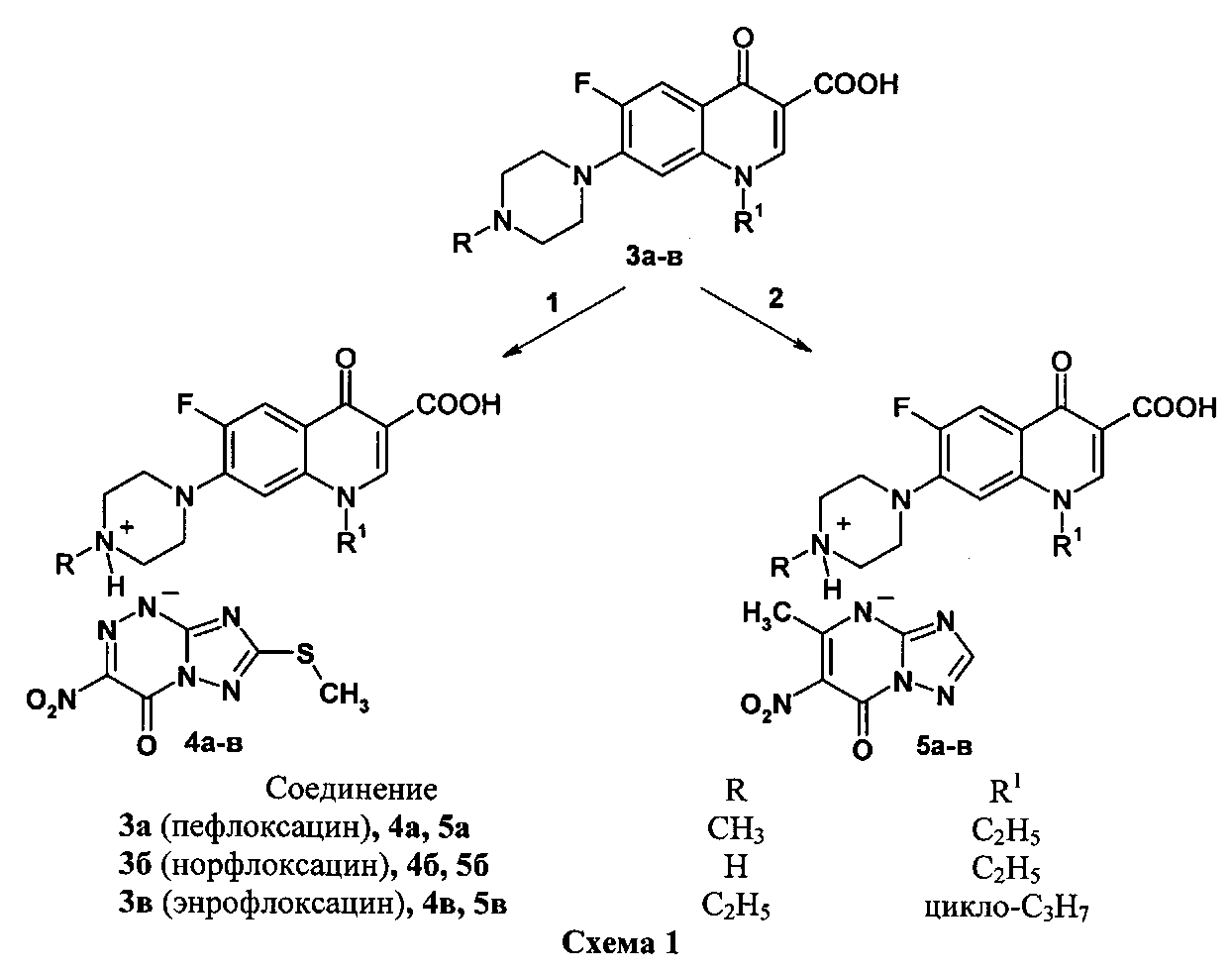
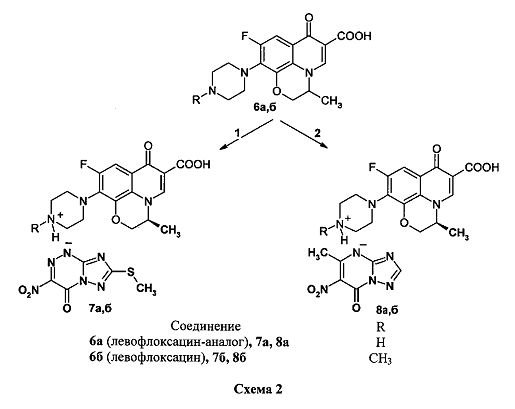
Пример 1. Синтез 7-метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-идов фторхинолонов (4а-в, 7а, б) (солей фторхинолонов 3а-в и 6а, б с NH-кислотой триазавирина 1). В двугорлую колбу, помещенную на магнитную мешалку с нагревом, добавляют 3 ммоль соответствующего фторхинолона 3а-в, 6а, б в 30 мл этанола, смесь нагревают при перемешивании до 50-70°С. К полученной суспензии медленно прикапывают раствор 5 ммоль 7-метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ида (NH-кислоты триазавирина 1) в 30 мл этанола. При этом реакционная масса из суспензии переходит в раствор, из которого начинает выпадать хлопьевидный осадок. Реакционную массу перемешивают 3 ч при комнатной температуре до полного выпадения соответствующей соли 4а-в, 7а, б. Осадок отфильтровывают, промывают на фильтре 80 мл этанола в два приема, высушивают и перекристаллизовывают из смеси этанол: вода.
7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид 1,4-дигидро-7-(4-метилпиперазин-1-ил)-4-оксо-6-фтор-1-этил-3-хинолинкарбоновой кислоты (4а). Выход 76,4%. Т. пл. ≥250°С. Найдено, %: С 47,35; Н 4,44; N 22,24. Брутто-формула C22H24FN9O6S*1,5H2O. Вычислено, %: С 47,48; Н 4,89; N 22,65. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.46 д. (3Н, СН2СН 3), 2.62 с. (3Н, SCH3), 1.94 с. (3Н, NCH3), 2.94-3.58 м. [8Н, 2 N(CH2)2], 4.60 д. (2Н, СН 2СН3), 7.22 д. (1Н, Н-8), 7.89 д. (1Н, Н-5), 8.91 с. (1H, Н-2).
7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид 1,4-дигидро-7-(пиперазин-1-ил)-4-оксо-6-фтор-1-этил-3-хинолинкарбоновой кислоты (4б). Выход 70,6%. Т. пл. ≥250°С. Найдено, %: С 42,91; Н 4,14; N 21,35. Брутто-формула C21H22FN9O6S*2H2O. Вычислено, %: С 43,23; Н 4,49; N 21,60. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.46 д. (3Н, СН2СН 3), 2.62 с. (3Н, SCH3), 3.32 м. [4Н, N(CH2)2], 3.53 м. [4Н, N(CH2)2], 4.59 д. (2Н, СН 2СН3), 7.22 д. (1Н, Н-8), 7.93 д. (1Н, Н-5), 8.92 с. (1Н, Н-2).
7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид 1,4-дигидро-7-(4-этилпиперазин-1-ил)-4-оксо-6-фтор-1-циклопропил-3-хинолинкарбоновой кислоты (4в). Выход 80,0%. Т. пл. ≥250°C. Найдено, %: С 48,99; Н 4,14; N 21,56. Брутто-формула C24H26FN9O6S. Вычислено, %: С 49,06; Н 4,46; N 21,46. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.3-1.4 м. [7Н, СН2СН 3, (СН2)2], 2.61 с. (3Н, SCH3), 3.3-3.8 м. [11Н, СН 2СН3, СН, 2N(CH2)2], 7.56 д. (1Н, Н-8), 7.83 д. (1Н, Н-5), 8.61 с. (1Н, Н-2), 9.48 уш. с. (1H, NH), 14.81 уш. с.(1Н, ОН).
7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид (3S)-(-)-9-фтор-3-метил-10-(пиперазин-1-ил)-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,е][1,4]-бензоксазин-6-карбоновой кислоты (7а). Выход 75,8%. Т. пл. >250°C. Найдено, %: С 45,20; Н 3,97; N 21,96. Брутто-формула C22H22FN9O7S*0,5H2O. Вычислено, %: С 45,20; Н 3,97; N 21,56. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.50 д. (3Н, СН-CH 3), 2.62 с. (3Н, SCH3), 3.24 м. [4Н, N(CH2)2], 3.49 м. [4Н, N(CH2)2], 4.40 д.д. (1H, Н-2а), 4.58 д.д. (1H, Н-2в), 4.95 м. (1Н, Н-3), 7.48 д. (1Н, Н-8), 8.92 с. (1Н, Н-5).
7-Метилтио-3-нитро-4-оксо-1,4-дигидро[1,2,4]триазоло[5,1-с][1,2,4]триазин-1-ид (3S)-(-)-9-фтор-3-метил-10-(4-метилпиперазин-1-ил)-7-оксо-2,3-дигидро-7Н-пиридо [1,2,3-d,е][1,4]-бензоксазин-6-карбоновой кислоты (7б). Выход 71,9%. Т. пл. ≥250°С. Найдено, %: С 46,75; Н 3,92; N 21,27. Брутто-формула C23H24FN9O7S. Вычислено, %: С 46,86; Н 4,10; N 21,39. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.49 д. (3Н, СН-СН 3), 2.62 с. (3Н, SCH3), 2.94 с. (3Н, N-CH3), 2.9-3.5 м. [8Н, 2N(CH2)2], 4.39 д.д. (1Н, Н-2а), 4.58 д.д. (1Н, Н-2в), 4.95 м. (1Н, Н-3), 7.55 д. (1H, Н-8), 8.97 с.(1Н, Н-5), 14.84 уш. с. (1Н, ОН).
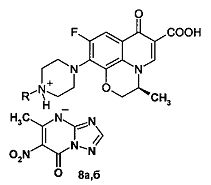
Пример 2. Синтез 5-метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинидов фторхинолонов (5а-в, 8а, б) (солей фторхинолонов 3а-в и 6а, б с NH-кислотой триазида 2). В двугорлую колбу, помещенную на магнитную мешалку с нагревом, добавляют 3 ммоль соответствующего фторхинолона 3а-в, 6а, б в 30 мл этанола, нагревают при перемешивании до 50-70°C. К полученной суспензии медленно прикапывают раствор 5 ммоль 5-метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинида (NH-кислоты триазида 2) в 30 мл этанола. При этом реакционная масса из суспензии переходит в раствор, из которого начинает выпадать хлопьевидный осадок. Реакционную массу перемешивают 3 ч при комнатной температуре до полного выпадения соответствующей соли 5а-в, 8а, б. Осадок отфильтровывают, промывают на фильтре 80 мл этанола в два приема, высушивают и перекристаллизовывают из смеси этанол: вода.
5-Метил-6-нитро-7-оксо-1,2,4-триазоло [1,5-а] пиримидинид 1,4-дигидро-7-(4-метилпиперазин-1-ил)-4-оксо-6-фтор-1-этил-3-хинолинкарбоновой кислоты (5а). Выход 75,0%. Т. пл. ≥250°C. Найдено, %: С 51,12; Н 4,60; N 20,99. Брутто-формула C23H25FN8O6*0,5Н2О.%. Вычислено, %: С 51,40; Н 4,89; N 20,85. Спектр 1Н ЯМР (400 МГц, D2O, δ (м.д.): 1.45 д. (3Н, СН2СН 3), 2.47 с. (3Н, ССН3), 2.90 с. (3Н, NCH3), 3.39 м. [4Н, N(CH2)2], 3.58 м. [4Н, N(CH2)2], 4.59 д. (2Н, СН 2СН3), 7.22 д. (1Н, Н-8), 7.92 д. (1H, Н-5), 8.04 с. (1Н, CH=N), 8.93 с. (1Н, Н-2).
5-Метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинид 1,4-дигидро-7-(пиперазин-1-ил)-4-оксо-6-фтор-1-этил-3-хинолинкарбоновой кислоты (5б). Выход 81,2 %. Т. пл. ≥300°С. Найдено, %: С 50,69; Н 4,34; N 21,39. Брутто-формула C22H23FN8O6. Вычислено, %: С 50,36; Н 4,51; N 21,78. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.45 д. (3Н, СН2СН 3), 2.43 с. (3Н, ССН3), 3.30 м. [4Н, N(CH2)2], 3.54 м. [4Н, N(CH2)2], 4.61 д. (2Н, СН 2СН3), 7.24 д. (1Н, Н-8), 7.90 д. (1H, Н-5), 7.96 с. (1Н, CH=N), 8.95 с.(1Н, Н-2).
5-Метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинид 1,4-дигидро-7-(4-этилпиперазин-1-ил)-4-оксо-6-фтор-1-циклопропил-3-хинолинкарбоновой кислоты (5в). Выход 77,9%. Т. пл. ≥300°C. Найдено, %: С 54,17; Н 4,79; N 19,98. Брутто-формула C25H27FN8O6. Вычислено, %: С 54,15; Н 4,91; N 20,21. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.1-1.6 м. [7Н, СН2СН 3, (СН2)2], 2.7 с. (3Н, ССН3), 3.2-3.8 м. [11Н, CH 2CH3, СН, 2N(CH2)2], 7.59 д. (1Н, Н-8), 7.92 д. (1Н, Н-5), 8.02 с. (1Н, CH=N), 8.67 с.(1Н, Н-2), 14.81 уш. с. (1Н, ОН).
5-Метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинид (3S)-(-)-9-фтор-3-метил-10-(пиперазин-1-ил)-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,e][1,4]-бензоксазин-6-карбоновой кислоты (8а). Выход 72,6%. Т. пл. ≥250°C. Найдено, %: С 49,88; Н 4,32; N 20,10. Брутто-формула C23H23FN8O7*0,5H2O. Вычислено, %: С 50,10; Н 4,39; N 20,30. Спектр 1Н ЯМР (400 МГц, D2O), δ (м.д.): 1.49 д. (3Н, СН-СН 3), 2.46 с. (3Н, ССН3), 3.28 м. [4Н, N(CH2)2], 3.51 м. [4Н, N(CH2)2], 4.38 д.д. (1Н, Н-2а), 4.57 д.д. (1Н, Н-2в), 4.95 м. (1Н, Н-3), 7.58 д. (1H, Н-8), 7.91 с. (1Н, CH=N), 8.96 с. (1H, Н-5), 14.82 уш. с.(1Н, ОН).
5-Метил-6-нитро-7-оксо-1,2,4-триазоло[1,5-а]пиримидинид (3S)-(-)-9-фтор-3-метил-10-(4-метилпиперазин-1-ил)-7-оксо-2,3-дигидро-7Н-пиридо[1,2,3-d,е][1,4]-бензокса-зин-6-карбоновой кислоты (8б). Выход 77,7%. Т. пл. ≥250°С. Найдено, %: С 50,82; Н 4,34; N 19,91. Брутто-формула C24H25FN8O7*0,5H2O. Вычислено, %: С 50,96; Н 4,65; N 19,82. Спектр 1H ЯМР (400 МГц, D2O), δ (м.д.): 1.49 д. (3Н, СН-СН 3), 2.46 с. (3Н, ССН3), 2.95 с. (3Н, N-CH3), 3.0-3.6 м. [8Н, 2N(CH2)2], 4.38 д.д. (1Н, Н-2а), 4.57 д.д. (1Н, Н-2), 4.95 м. (1H, Н-3), 7.55 д. (1Н, Н-8), 8.10 с. (1H, CH=N), 8.95 с. (1Н, Н-5).
Полученные нами азолоазиниевые соли (триазавирина и триазида) фторхинолонов (пефлоксацина, норфлоксацина, энрофлоксацина, левофлоксацина и его аналога) 4а-в, 5а-в, 7а, б и 8а, б исследованы на моделях ООИ бактериальной и вирусной природы и проведена оценка эффективности азолоазиниевых солей фторхинолонов.
4.2. Эффективность азолоазиниевых солей фторхинолонов на экспериментальных моделях особо опасных инфекций бактериальной природы.
4.2.1. Для моделирования ООИ бактериальной природы использованы вирулентные и вакцинные штаммы возбудителей сибирской язвы и туляремии.
Сибирская язва - вторая вакцина Ценковского (штамм 71/12). Споровую форму возбудителя готовят следующим образом: на мясопептонном бульоне (рН 7,2-7,4) при температуре 37°C в течение 24 ч выращивают маточный материал. Суточную бульонную культуру равномерно распределяют по поверхности пшеничного агара, разлитого в матрицы, и культивируют в термостате при температуре (32±0,5)°C в течение 72 ч. По окончании культивирования в термостате матрацы заворачивают в темную бумагу и выдерживают в темном месте при температуре 10°C в течение 5-7 суток. Выросшую культуру смывают с поверхности агара стерильной дистиллированной водой. Полученную суспензию спор переносят в стерильную колбу с притертой пробкой, которую встряхивают в шутель-аппарате в течение 60 мин. По истечении времени встряхивания содержимое колбы фильтруют через стерильный ватно-марлевый фильтр в стерильный флакон с бусами и хранят при температуре (4±0,5)°C.
Туляремия - вакцинный штамм 15 линии НИИЭГ. Сухую туляремийную вакцину, содержащую лиофилизированную живую культуру вакцинного штамма 15 линии НИИЭГ, разводят ампулированной дистиллированной водой, находящейся в комплекте с препаратом, с соблюдением правил асептики. Ампулу встряхивают в течение трех минут до образования гомогенной взвеси, которую равномерно распределяют по 0,2 мл на поверхности Ft-агара в чашках Петри. Чашки помещают в термостат при температуре 37°C и культивируют в течение трех суток. Выросшую культуру смывают с поверхности Ft-агара стерильным физиологическим раствором (рН 7,2-7,4). Полученную суспензию переносят в стерильную колбу и используют для получения различных концентраций взвесей микроба и дальнейшего внутрибрюшинного заражения экспериментальных животных.
4.2.2 Моделирование сибиреязвенной инфекции in vivo осуществляют на белых беспородных мышах массой 18-20 г путем их подкожного заражения взвесью спор штамма 71/12 в объеме 0,5 мл. Модель характеризуется высокой остаточной вирулентностью и вызывает у мышей остротекущую септицемию, заканчивающуюся на 3-4 сутки летальным исходом. Наблюдают за инфицированными животными в течение 14 суток, ежедневно регистрируя число живых и павших в опытных и контрольных группах. Специфичность гибели животных подтверждают бактериологически - посевом селезенки павших животных на специальную питательную среду.
4.2.3 Биологическую (ингибирующую) активность полученных соединений в отношении агентов бактериальной природы оценивают in vitro с использованием вакцинного штамма 71/12 сибирской язвы in vitro по минимальной подавляющей концентрации (МПК) оцениваемых препаратов, которую определяют макрометодом серийных (двукратных) разведений в жидкой питательной среде.
4.2.4 Показатель токсичности (ЛД50) исследуемых соединений определяют по методу Кербера в модификации И.П. Ашмарина и А.А. Воробьева (И.П. Ашмарин, А.А. Воробьев. Статистические методы в микробиологических методах. - Л.: Гос. изд-во мед. лит., 1962. - 178 с.). Эффективность соединений оценивают по выживаемости животных в подопытных (получавших соответствующие препараты) и контрольных группах. Процент выживших животных определяют по таблицам Генеса B.C. (Генес B.C. Некоторые простые методы кибернетической обработки данных диагностических и физиологических исследований. - М.: Наука, 1967. - 208 с.). Определяют защитную эффективность (%) оцениваемых средств экстренной профилактики и этиотропного лечения как разность между количеством выживших инфицированных животных в подопытной группе (%) и количеством выживших инфицированных животных (%) в контрольной группе, а также вычисляют среднюю продолжительность жизни (СПЖ, суток) подопытных и контрольных животных. Среднюю продолжительности жизни Т, суток, инфицированных животных в подопытной и контрольной группах вычисляют по формуле:
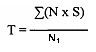 ,
,
где N - количество выживших животных, голов;
S - срок наблюдения, суток;
N1 - количество зараженных мышей в группе, голов.
4.2.5 Статистический анализ результатов исследования произведен с помощью компьютерной программы статистической обработки данных Statistica 6.0 for Windows. Для оценки количественных показателей определяют стандартные количественные характеристики: среднее значение показателя (М), среднеквадратичное отклонение, стандартная ошибка средней величины (m). Сравнение количественных данных проводят при помощи парного и непарного теста Стьюдента с использованием t-критерия Стьюдента. Результаты представлены как М±m. Различия считают достоверными при p≤0,05.
4.2.6 Модель сибиреязвенной инфекции
Результаты исследований in vitro, характеризующие биологическую (ингибирующую) активность оцениваемых азолоазиниевых солей фторхинолонов, представлены в таблице 1.
Представленные в таблице 1 данные свидетельствуют, что наиболее выраженными ингибирующими свойствами в отношении Bacillus anthracis (штамм 71/12) обладают азолоазиниевые соли (триазавирина и триазида) с фторхинолонами (пефлоксацином, энрофлоксацином и левофлоксацином) - соединения: 4а, 5а, 4в, 5в, 7б и 8б. Минимальная подавляющая концентрация (МПК) этих соединений составляет от 0,075 до 0,25 мкг/мл. Полученные результаты находятся на уровне соответствующих показателей собственно фторхинолонов, применяемых в качестве антибактериальных препаратов.
Азолоазиниевые соли (триазавирина и триазида) с фторхинолонами (норфлоксацином и аналогом левофлоксацина) 4б, 5б, 7а и 8а в отношении сибиреязвенных бацилл проявляют менее выраженную антибактериальную активность (МПК 5,0-20,0 мкг/мл), поскольку сами фторхинолоны проявляют не столь выраженную активность в отношении сибиреязвенных бацилл в сравнении с пефлоксацином, энрофлоксацином и левофлоксацином.
Исследования антимикробной активности соединений с учетом особенностей их действия на уровне макроорганизмов проведены in vivo на сибиреязвенной модели с оценкой защитной эффективности соединений, при этом заражающие дозы Bacillus anthracis (штамм 71/12) составляют 10 и 100 ЛД50. Численность каждой опытной и контрольной групп - 10 особей. Оцениваемые соединения вводят животным в различных концентрациях в объеме 0,5 мл per os. Изучают следующие схемы введения оцениваемых соединений - одновременно с заражением, через 24 и 48 ч после заражения. Результаты исследований приведены в таблице 2.
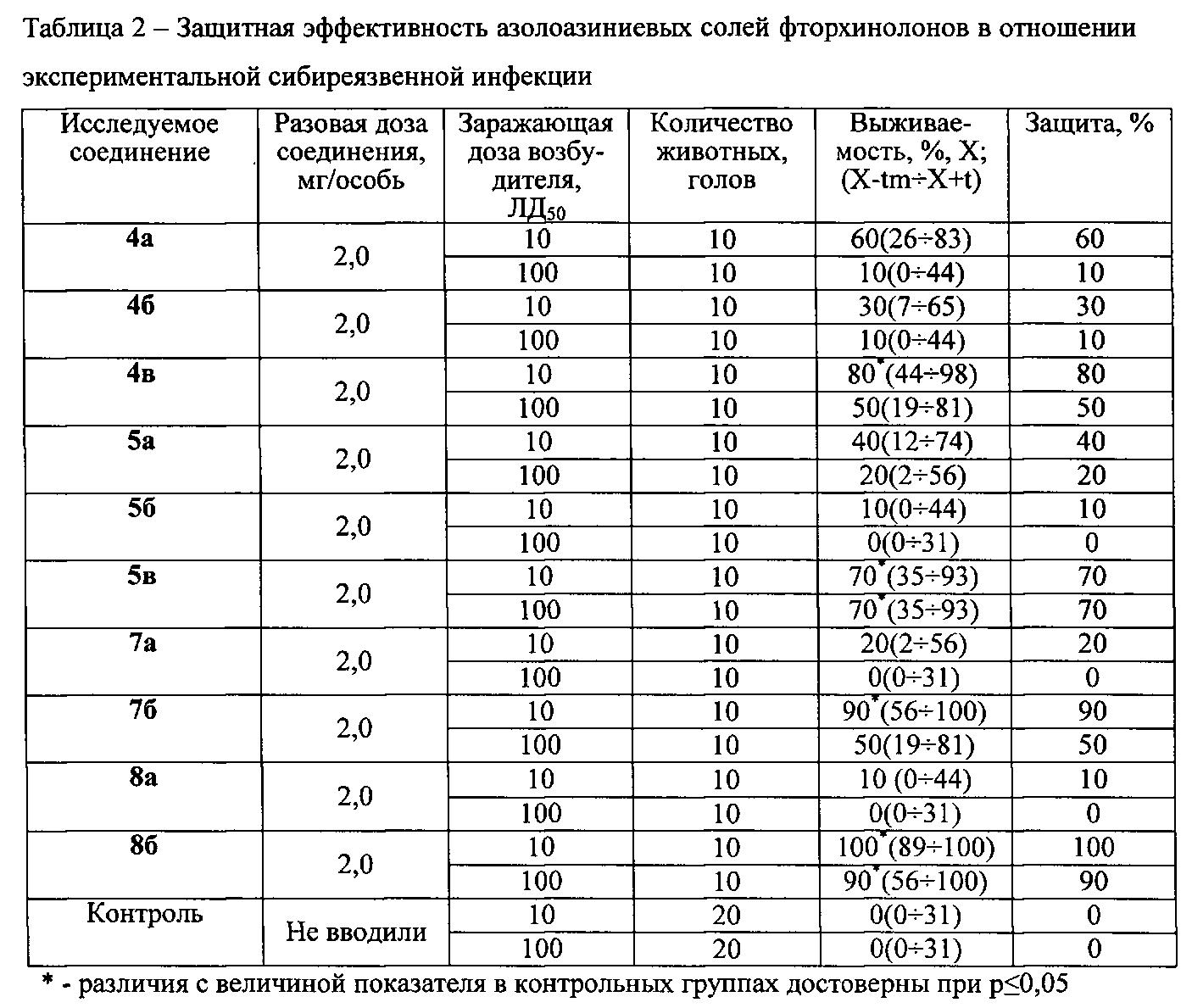
Представленные в таблице 2 данные свидетельствуют, что наибольшим защитным эффектом обладают азолоазиниевые соли фторхинолонов 4в, 7б, и 8б. Уровень защиты составляет 80, 90 и 100% в условиях заражения возбудителем в дозе 10 ЛД50 и 50, 50 и 90% - в условиях заражения возбудителем в дозе 100 ЛД50.
Остальные исследованные соединения проявляют меньшую защитную эффективность в отношении сибиреязвенной инфекции. Так, соединение 5в обеспечивает защиту 70% инфицированных возбудителем Bacillus anthracis (штамм 71/12) животных вне зависимости от его заражающей дозы 10 или 100 ЛД50. Соединения 4а и 5а обеспечивают защиту 40 и 60% животных, инфицированных возбудителем в дозе 10 ЛД50, и соответственно 20 и 10% животных, инфицированных возбудителем в дозе 100 ЛД50. Наименее эффективными оказались азолоазиниевые соли норфлоксацина и аналога левофлоксацина 4б, 5б, 7а и 8а, которые обеспечивают уровень защиты от сибиреязвенной инфекции 30% и менее.
Таким образом, азолоазиниевые соли фторхинолонов следует рассматривать как перспективные средства экстренной профилактики и этиотропного лечения сибиреязвенной инфекции, наиболее перспективными из них являются азолоазиниевые соли на основе энрофлоксацина и левофлоксацина.
4.2.7 Модель туляремийной инфекции
Исследуемые соединения разводят химически чистым 1% водным раствором крахмала с твином и вводят per os по 0,5 мл в дозе 2,0 мг/особь через 4 ч, 24 ч и 48 ч после заражения возбудителем туляремии, который используют в двух заражающих дозах - 10 и 100 ЛД50. Всего в исследовании использованы 340 белых беспородных мышей-самцов массой 18-20 г, по 170 особей на каждой заражающей дозе возбудителя. Результаты исследований приведены в таблице 3.
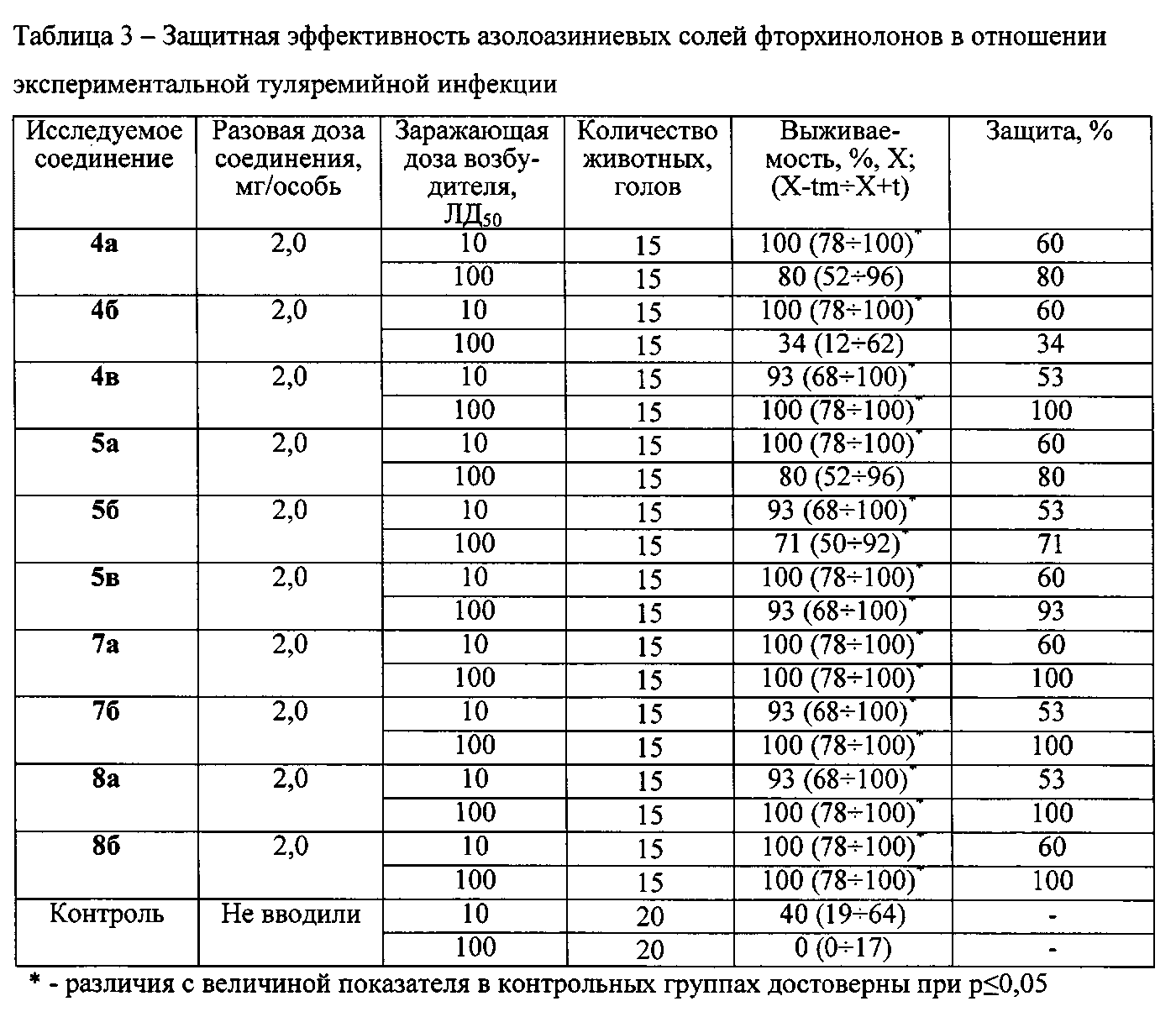
Представленные в таблице 3 данные свидетельствуют, что азолоазиниевые соли фторхинолонов обладают выраженной противотуляремийной активностью. Показатели выживаемости всех соединений, за исключением азолоазиниевых солей (триазавирина и триазида) с норфлоксацином 4б и 5б, в подопытных группах составляют 90-100%, независимо от заражающей дозы возбудителя. Для соединений 4б и 5б среди животных, инфицированных возбудителем в дозе 10 ЛД50, выживаемость составила 100 и 91%, тогда как в дозе 100 ЛД50 - 34 и 71% соответственно. Следует отметить, что соединения 4б и 5б показали менее выраженную защитную эффективность и на модели сибиреязвенной инфекции.
Таким образом, выраженной активностью в отношении ООИ бактериальной природы обладают азолоазиниевые соли (как триазавирина, так и триазида) на основе фторхинолонов - пефлоксацина, энрофлоксацина и левофлоксацина. Противомикробный эффект азолоазиниевых солей фторхинолонов обусловлен фармацевтической природой входящего в состав молекулы антибактериального средства - фторированного хинолона.
4.3 Эффективность азолоазиниевых солей фторхинолонов на экспериментальных моделях особо опасных инфекций вирусной природы
4.3.1. Для моделирования ООИ использованы вирулентные и вакцинные штаммы возбудителей: вирусов венесуэльского энцефаломиелита лошадей (ВЭЛ), лихорадки долины РИФТ (ЛДР), лихорадки Денге типа 1 (ЛД), лихорадки Западного Нила (ЛЗН), оспы коров (ВОК).
Вирус ВЭЛ - патогенный штамм Тринидад. Накопление вируссодержащего материала для последующего заражения лабораторных животных осуществляют с использованием 9-11-дневных развивающихся куриных эмбрионов - 30-50 шт. Первоначально готовят пять последовательных десятикратных разведений вируссодержащей суспензии. По 0,2 мл каждого разведения вируссодержащей суспензии вносят в аллантоисную полость развивающихся куриных эмбрионов. Место инъекции вируссодержащей суспензии покрывают расплавленным парафином. Затем развивающиеся куриные эмбрионы помещают в термостат при температуре (37±0,5)°С на 18 ч, периодически оценивая их жизнеспособность с помощью овоскопа. По истечении времени инкубации в термостате оценивают жизнеспособность развивающихся куриных эмбрионов и из «тушек» живых эмбрионов готовят 10% суспензию вируссодержащего материала с использованием физиологического раствора с добавлением антибиотиков (пенициллин из расчета 100 ЕД на 1 мл, стрептомицин - 200 ЕД на 1 мл). Полученную суспензию центрифугируют в течение 10 мин при 1,5-2,0 тыс.об/мин и температуре (3±0,5)°C. Надосадочную жидкость разливают во флаконы объемом 1,0 мл и используют для дальнейшего заражения экспериментальных животных. Исходный титр вируса 107-108 ЛД50/мл.
Вирус лихорадки долины Рифт (ЛДР) - вирулентный штамм 8-87. Накопление вируссодержащего материала для заражения лабораторных животных осуществляют с использованием 3-5-дневных мышей-сосунков в количестве 10-15 голов. Первоначально готовят пять последовательных десятикратных разведений вируссодержащего материала. Вируссодержащий материал (по 0,02 мл каждого разведения) вводят в мозг мышам-сосункам, за которыми устанавливают наблюдение в течение 24-48 ч. Животных забивают эфиром, извлекают головной мозг и депонируют его по три образца в пенициллиновые флаконы, которые хранят в морозильной камере при температуре минус (20±0,5)°C. В дальнейшем 10% суспензию головного мозга используют в качестве вируссодержащего материала. Исходный титр вируса 105-106 ЛД50/мл.
Вирус лихорадки денге типа 1 (ЛД) - патогенный штамм Гавайский. Накопление вируссодержащего материала для заражения лабораторных животных проводят на мышах-сосунках. Первоначально готовят пять последовательных десятикратных разведений вируссодержащего материала, которым служит центрифугат 10% суспензии мозга зараженных ранее мышей или регидратированный из лиофильного состояния вируссодержащий материал. Вируссодержащий материал (по 0,02 мл каждого разведения) вводят в мозг мышам-сосункам, за которыми устанавливают наблюдение в течение 24-72 ч. Животных забивают эфиром, извлекают головной мозг и депонируют его по три образца в пенициллиновые флаконы, которые хранят в морозильной камере при температуре минус (50±0,5)°С. В дальнейшем 10% суспензию головного мозга используют в качестве вируссодержащего материала. Исходный титр вируса 102-103 ЛД50/мл.
Вирус лихорадки Западного Нила (ЛЗН) - патогенный штамм Нр-91. Накопление вируссодержащего материала для заражения лабораторных животных проводят на мышах-сосунках. Первоначально готовят пять последовательных десятикратных разведений вируссодержащего материала, которым служит центрифугат 10% суспензии мозга зараженных ранее мышей или регидратированный из лиофильного состояния вируссодержащий материал. Вируссодержащий материал (по 0,02 мл каждого разведения) вводят в мозг мышам-сосункам, за которыми устанавливают наблюдение в течение 96-120 ч. Животных забивают эфиром, извлекают головной мозг и депонируют его по три образца в пенициллиновые флаконы, которые хранят в морозильной камере при температуре минус (50±0,5)°С. В дальнейшем 10% суспензию головного мозга используют в качестве вируссодержащего материала. Исходный титр вируса 103-104 ЛД50/мл.
Вирус оспы коров (ВОК) - патогенный штамм Пуменок. Накопление вируссодержащего материала для заражения лабораторных животных осуществляют с использованием 11-12-дневных развивающихся куриных эмбрионов - 30-50 шт. Первоначально готовят пять последовательных десятикратных разведений вируссодержащего материала. Вируссодержащий материал (по 0,2 мл каждого разведения) вносят на хорион-аллантоисную оболочку развивающихся куриных эмбрионов. Место инъекции покрывают расплавленным парафином. Инфицированные развивающиеся куриные эмбрионы помещают в термостат при температуре (35±0,5)°C на 72 ч, ежедневно оценивая их жизнеспособность с помощью овоскопа. По окончании времени инкубации оценивают жизнеспособность развивающихся куриных эмбрионов, из хорион-аллантоисной оболочки которых готовили 60 мл 10% суспензии вируссодержащего материала с использованием физиологического раствора с добавлением антибиотиков (пенициллин из расчета 100 ЕД на 1 мл, стрептомицин - 200 ЕД на 1 мл). Полученную суспензию вируссодержащего материала центрифугируют в течение 10 мин при 1,5-2,0 тыс.об/мин и температуре (3±0,5)°C. Надосадочную жидкость разливают во флаконы объемом 10 мл (пенициллиновые флаконы) и используют для заражения лабораторных животных. Исходный титр вируса 103-104 ЛД50/мл.
4.3.2 Моделирование смертельной инфекции ВЭЛ проводят на белых беспородных мышах массой 18-20 г путем их подкожного заражения вируссодержащим материалом в объеме 0,3 мл. Используют две заражающие дозы возбудителя, вызывающие в контроле гибель 57-100% инфицированных животных. После заражения за мышами устанавливают ежедневное наблюдение в течение 21 суток с регистрацией количества живых и павших особей. Инкубационный период моделируемой инфекции составляет в среднем 5 суток. Заболевания характеризуется следующими признаками: мыши становятся малоподвижными, отказываются от еды и питья, шерсть у них взъерошена. В последующем развиваются и нарастают явления энцефалита (нарушение координации, появление парезов и параличей), и наступает гибель инфицированных животных. Максимальная гибель мышей отмечается, как правило, на 7-9 день после заражения.
4.3.3. Моделирование смертельной инфекции ЛДР проводят на белых беспородных мышах массой 18-20 г путем их подкожного заражения вируссодержащим материалом в объеме 0,5 мл. В эксперименте используют две заражающие дозы, которые различаются на один порядок и в контрольных группах вызывают гибель 40-100% мышей (в зависимости от использованной заражающей дозы вируса). После заражения за инфицированными животными устанавливают ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей. Инкубационный период моделируемой инфекции составил 3 суток. Заболевание характеризовалось следующими признаками: у мышей развивалась адинамия, они отказывались от еды и питья, шерсть у них была взъерошена. В последующем развивались параличи, и наступала гибель животных. Максимальную гибель мышей отмечают, как правило, на 5-7 сутки после инфицирования.
4.3.4. Моделирование смертельной инфекции ЛД проводят на белых беспородных мышах массой 8-10 г путем их подкожного заражения вируссодержащим материалом в объеме 0,5 мл. В эксперименте используют две заражающие дозы, которые различаются на один порядок и в контрольных группах вызывают гибель 40-100% мышей (в зависимости от использованной заражающей дозы вируса). После заражения за инфицированными животными устанавливают ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей. Инкубационный период при моделируемой инфекции составляет 3-4 суток. Заболевание характеризуется следующими признаками: у мышей развивалась адинамия, они отказывались от еды и питья, шерсть у них была взъерошена. В последующем развивались параличи, и наступала гибель животных. Максимальная гибель инфицированных мышей отмечалась, как правило, на 6-9 сутки после инфицирования.
4.3.5. Моделирование смертельной инфекции ЛЗН проводят на белых беспородных мышах массой 8-10 г путем их подкожного заражения вируссодержащим материалом в объеме 0,5 мл. В эксперименте используют две заражающие дозы, которые различаются на один порядок и вызывают гибель 50-100% мышей (в зависимости от использованной заражающей дозы вируса). После заражения за инфицированными животными устанавливают ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей. Инкубационный период при экспериментальной инфекции ЛЗН у экспериментальных животных составляет 5-6 суток. Заболевание характеризуется следующими признаками: у мышей развилась адинамия, они отказывались от еды и питья, шерсть у них была взъерошена. В последующем развивались параличи, и наступала гибель животных. Максимальная гибель мышей отмечалась, как правило, на 6-9 сутки после инфицирования.
4.3.6. Моделирование смертельной инфекции ВОК проводят на белых беспородных мышах массой 8-10 г, предварительно проводя им эфирный рауш-наркоз, и в дальнейшем интраназальное заражение вируссодержащего материала в объеме 0,03 мл в каждую ноздрю. В эксперименте используют две заражающие дозы возбудителя, которые различаются на один порядок. После заражения за инфицированными животными устанавливают ежедневное наблюдение в течение 14 суток с регистрацией количества живых и павших особей.
4.3.7 Показатель токсичности (ЛД50) исследуемых соединений определяют по методу Кербера в модификации И.П. Ашмарина и А.А. Воробьева (И.П. Ашмарин, А.А. Воробьев. Статистические методы в микробиологических методах. - Л.: Гос. изд-во мед. лит., 1962. - 178 с.). Эффективность соединений оценивают по выживаемости животных в подопытных (получавших соответствующие препараты) и контрольных группах. Процент выживших животных определяют по таблицам Генеса B.C. (Генес B.C. Некоторые простые методы кибернетической обработки данных диагностических и физиологических исследований. - М.: Наука, 1967. - 208 с.). Помимо этого определяют защитную эффективность (%) оцениваемых средств экстренной профилактики и этиотропного лечения, представляющую собой разность между количеством выживших инфицированных животных в подопытной группе (%) и количеством выживших инфицированных животных (%) в контрольной группе, а также среднюю продолжительность жизни (СПЖ, суток) подопытных и контрольных животных. Среднюю продолжительность жизни Т, суток, инфицированных животных в подопытной и контрольной группах вычисляют по формуле:
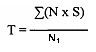 ,
,
где N - количество выживших животных, гол.;
S - срок наблюдения, сут;
N1 - количество зараженных мышей в группе, гол.
4.3.8 Статистический анализ результатов исследования произведен с помощью компьютерной программы статистической обработки данных Statistica 6.0 for Windows. Для оценки количественных показателей определяют стандартные количественные характеристики: среднее значение показателя (М), среднеквадратичное отклонение, стандартная ошибка средней величины (m). Сравнение количественных данных проводят при помощи парного и непарного теста Стьюдента с использованием t-критерия Стьюдента. Результаты представлены как М±m. Различия считают достоверными при р≤0,05.
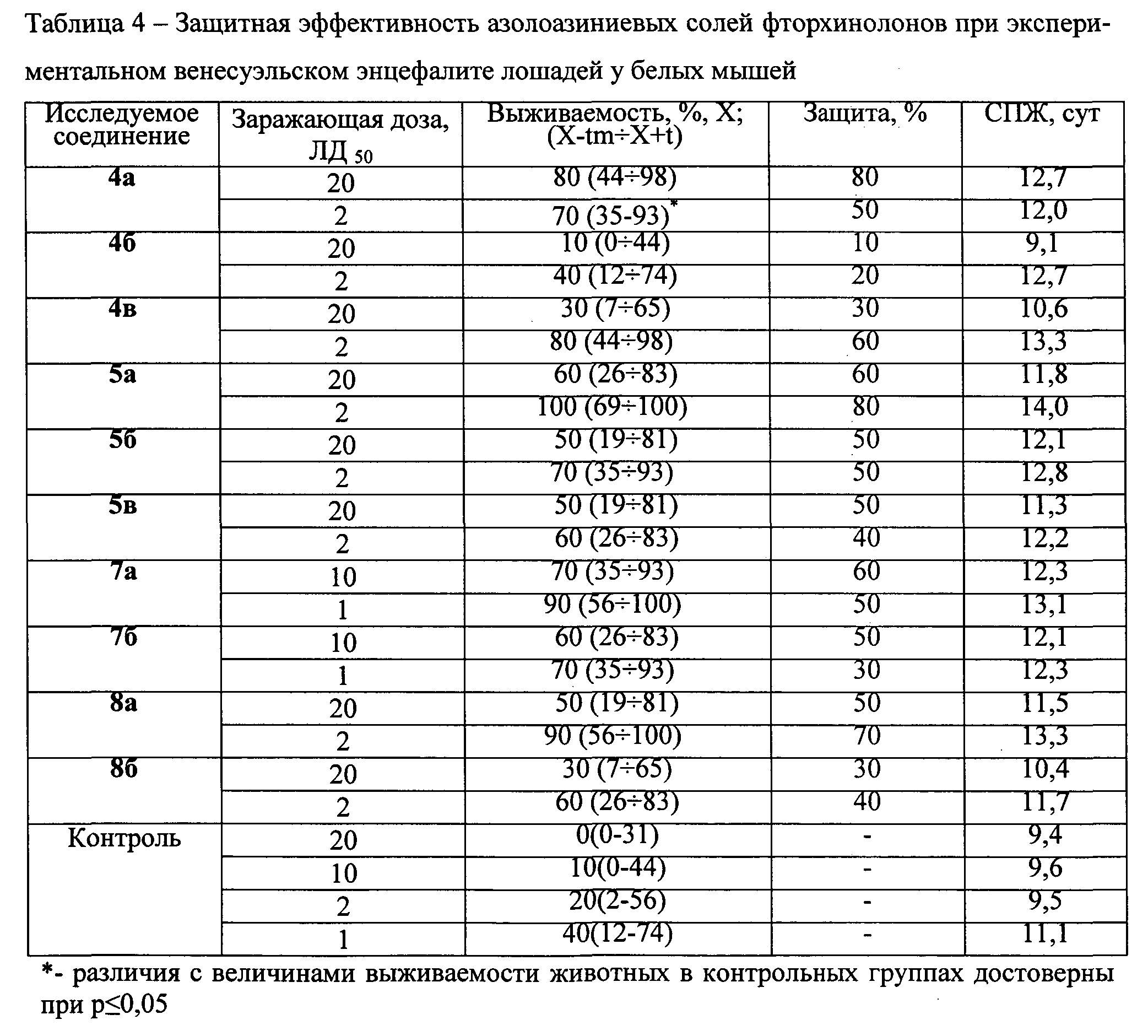
4.3.9 Модель венесуэльского энцефалита лошадей
Азолоазиниевые соли фторхинолонов применяют по одинаковой схеме (через 4 ч, 24 ч и 48 ч после заражения), вводят per os в разовой дозе 2,0 мг/особь. Заражение экспериментальных животных осуществляют вирусом ВЭЛ в дозах 1, 2, 10 или 20 ЛД50. Численность животных в подопытных и контрольных группах - по 10 особей. Полученные результаты представлены в таблице 4.
Представленные в таблице 4 данные свидетельствуют, что наибольшим защитным эффектом обладают азолоазиниевые соли пефлоксацина 4а и 5а - уровень защиты 80 и 60% при заражении возбудителем в дозе 20 ЛД50. Эти соединения обеспечивают достаточно высокий уровень защиты при заражении наиболее высокими дозами вируса ВЭЛ. Остальные соединения проявляют менее выраженную активность в отношении экспериментального ВЭЛ.
4.3.10 Модель лихорадки долины Рифт
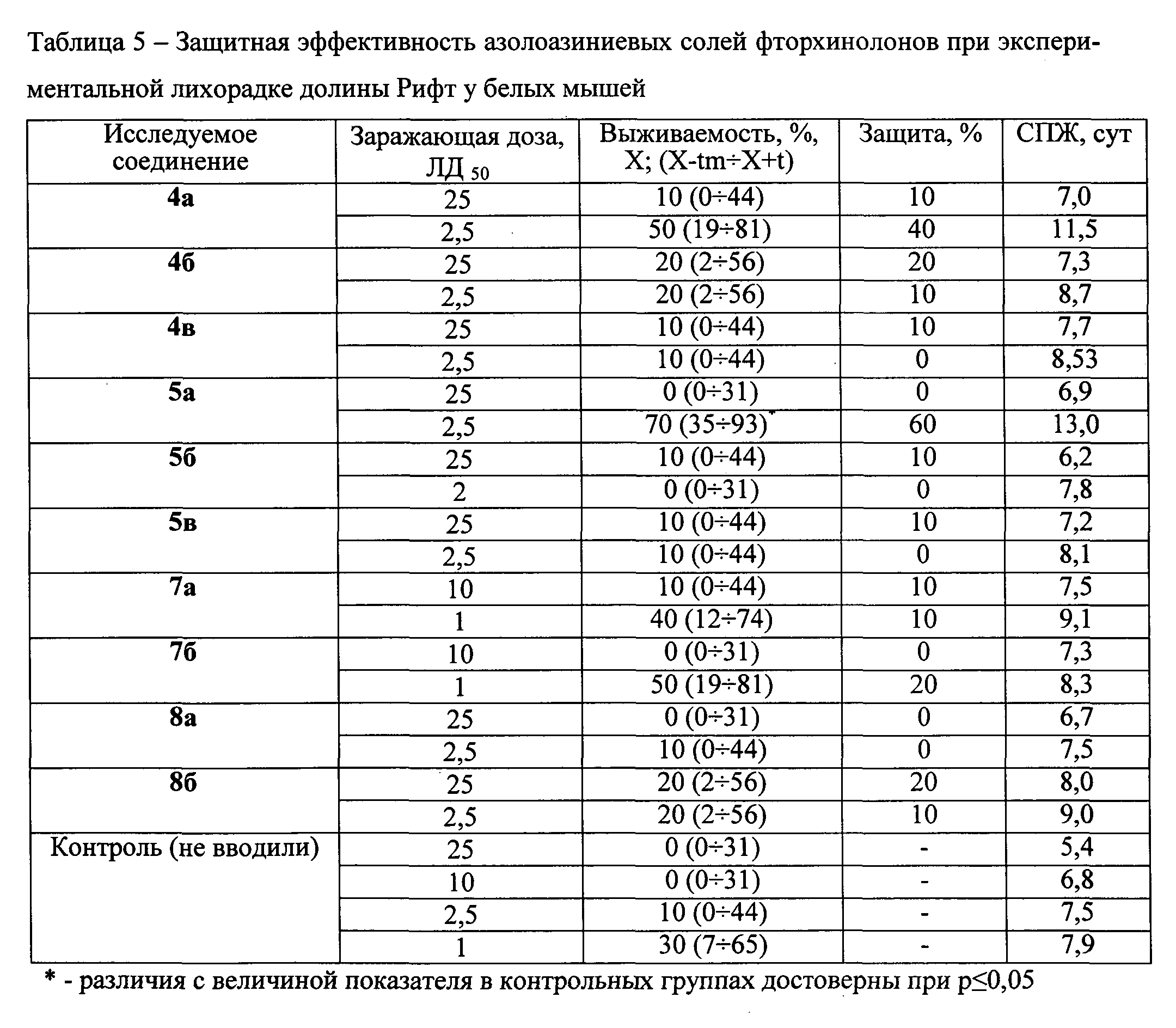
Азолоазиниевые соли фторхинолонов применяют в дозе 2,0 мг/особь per os, начиная через 4 ч и далее один раз в сутки через 24 ч и 48 ч после заражения вирусом ЛДР в диапазоне доз от 1 до 25 ЛД50. Численность животных в группе - по 10 особей. Полученные результаты представлены в таблице 5.
Представленные в таблице 5 данные свидетельствуют, что наибольшим защитным эффектом обладают азолоазиниевые соли пефлоксацина 4а и 5а - защита на уровне 70 и 40% при заражении животных вирусом ЛДР в дозе 2,5 ЛД50. Соединения 4а и 5а увеличивают СПЖ инфицированных животных на 3-4 сутки по сравнению с аналогичным показателем в контроле заражения. Остальные соединения проявляют менее выраженную активность в отношении экспериментального ВЭЛ - уровень защиты 10-20% при заражении животных вирусом ЛДР в диапазоне доз от 2,5-25 ЛД50.
4.3.11 Модель лихорадки Западного Нила
Азолоазиниевые соли используют в разовой дозе 1,0 мг/особь один раз в сутки в течение трех дней подряд, начиная через 4 ч после заражения животных вирусом ЛЗН в дозах 5 и 50 ЛД50. Количество животных в группе - по 10 особей. Полученные результаты представлены в таблице 6.
Наибольшим защитным эффектом обладают азолоазиниевые соли фторхинолонов 4а, 4в и 7б - уровень защиты 50, 60 и 60% при заражении вирусом ЛЗН в дозе 50 ЛД50, а также азолоазиниевые соли 5а, 5в и 8а - уровень защиты 50, 50 и 70% при заражении вирусом ЛЗН в дозе 50 ЛД50. Азолоазиниевые соли 4б, 5б, 7а и 8б проявляют слабую противовирусную активность (уровень защиты 20-30%). Следует отметить, что применение азолоазиниевых солей фторхинолонов способствует увеличению СПЖ инфицированных вирусом ЛЗН мышей на 2-3 суток по сравнению с аналогичным показателем в контрольных группах.
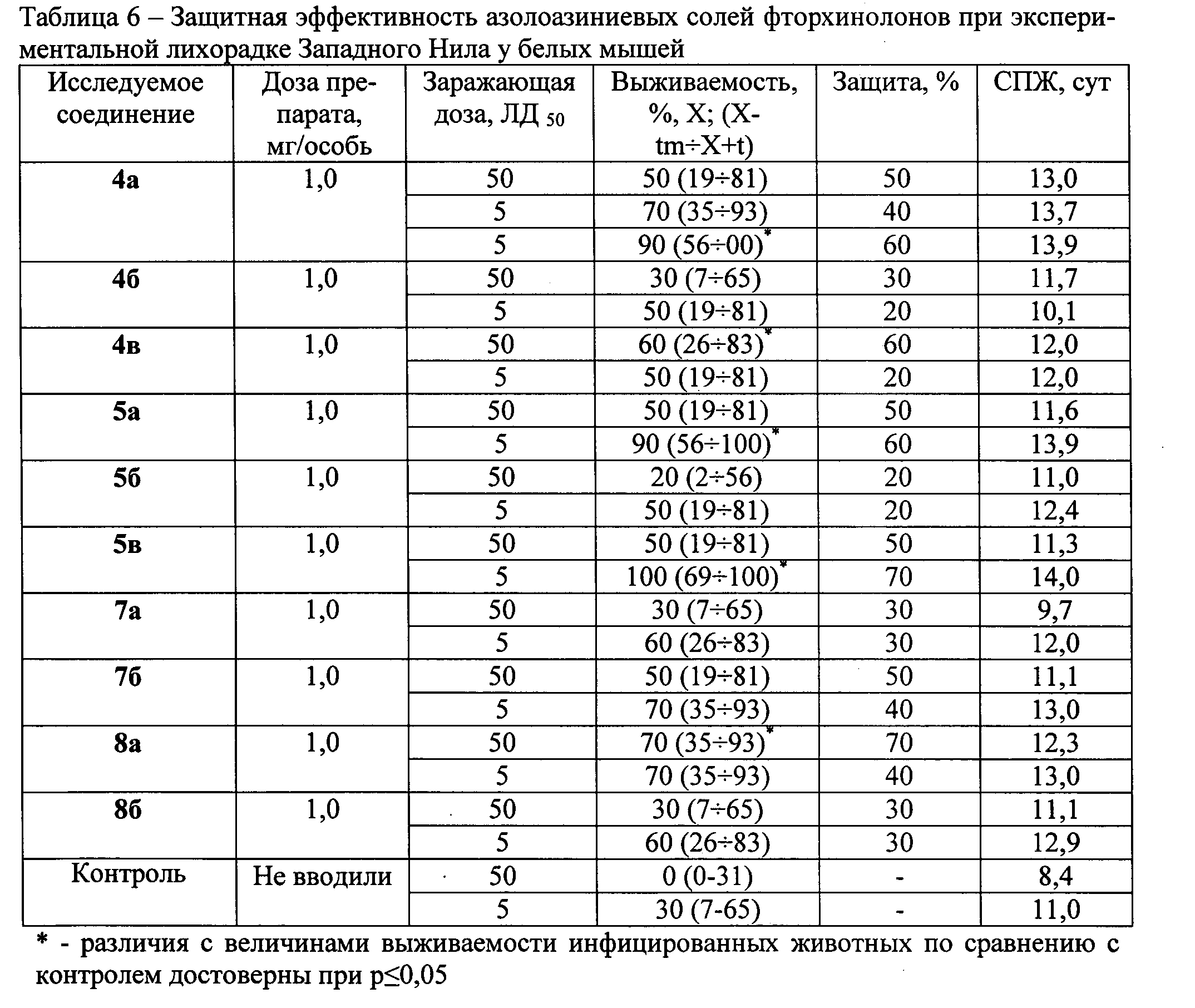
4.3.12 Модель лихорадки Денге
Азолоазиниевые соли вводят экспериментальным животным в разовой дозе 1,0 мг/особь, схема введения: начиная через 4 ч после заражения и далее через 24 ч и 48 ч после заражения вирусом ЛД в дозах 17 и 170 ЛД50. Количество животных в группе - по 10 особей. Полученные результаты представлены в таблице 7.
Выраженным защитным эффектом в отношении экспериментальной ЛД обладают азолоазиниевые соли фторхинолонов 4б, 5в, 7а, 8а и 8б - уровень защиты 90% при заражении животных вирусом в дозе 17 ЛД50 (р≤0,05). Несколько меньший эффект получен при применении в аналогичных условиях соединений 4а и 7б - уровень защиты 70% (р≤0,05). Следует отметить, что применение азолоазиниевых солей фторхинолонов способствует увеличению СПЖ инфицированных вирусом ЛД мышей в 2 и более раз по сравнению с аналогичным показателем в контроле.
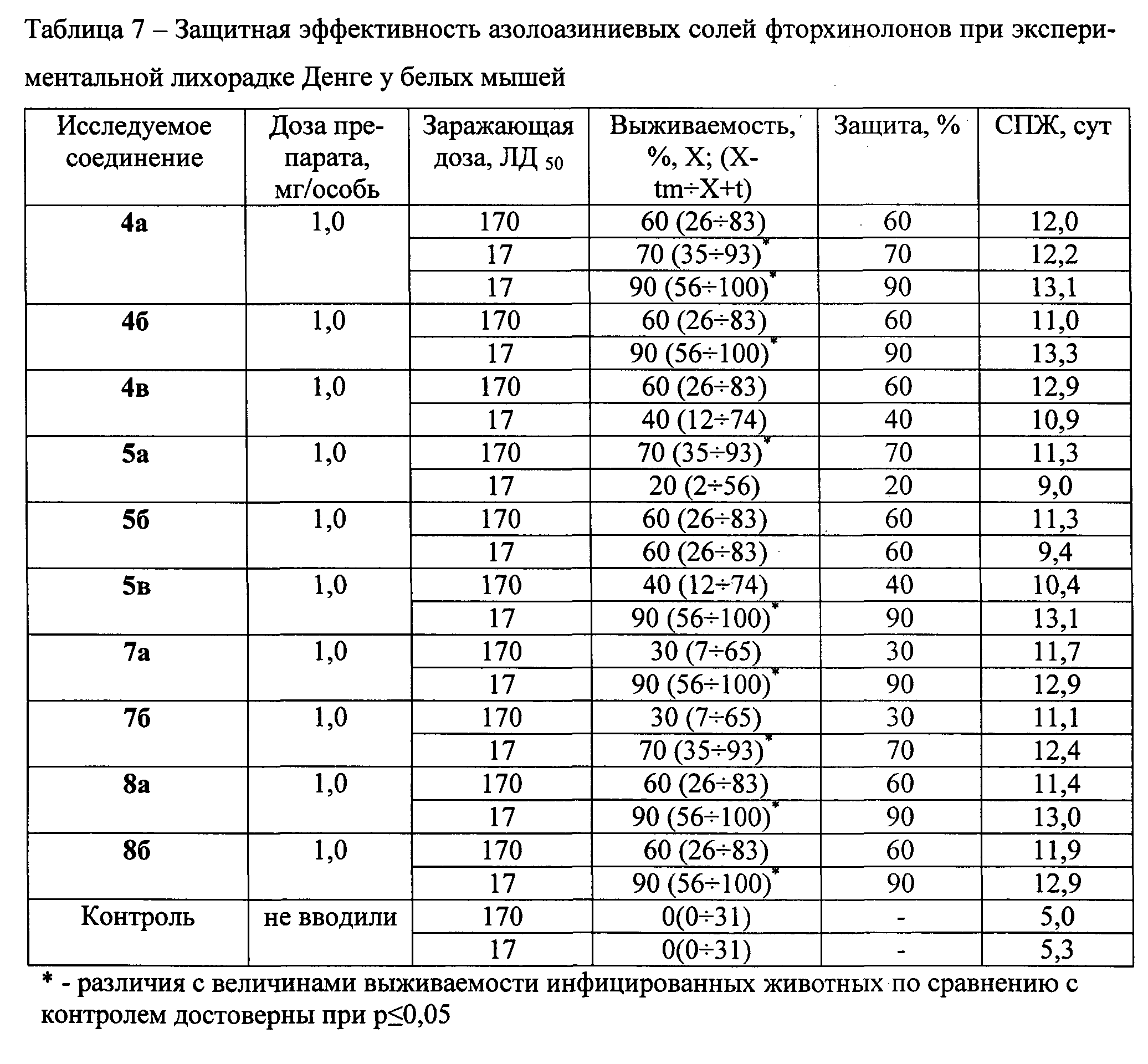
Анализ результатов противовирусной активности азолоазиниевых солей на моделях геморрагических лихорадок показывает, что азолоазиниевые соли фторхинолонов являются перспективным средством экстренной профилактики и раннего этиотропного лечения этих инфекций. Наличие в составе молекулы антибактериального компонента не сказывается отрицательно на его противовирусной активности. Более того, в ряде случаев отмечено даже некоторое увеличение противовирусной активности, хотя и не носящее достоверный характер (р≤0,05).
4.3.13 Модель ортопоксвирусной инфекции
Исследования выполнены на модели оспы коров. Азолоазиниевые соли фторхинолонов применяют в дозе 1,0 мг/особь по единой схеме: начало введения через 4 ч и далее через 24 ч и 48 ч после заражения животных возбудителем в дозах 30 или 300 ЛД50. Полученные результаты представлены в таблице 8.
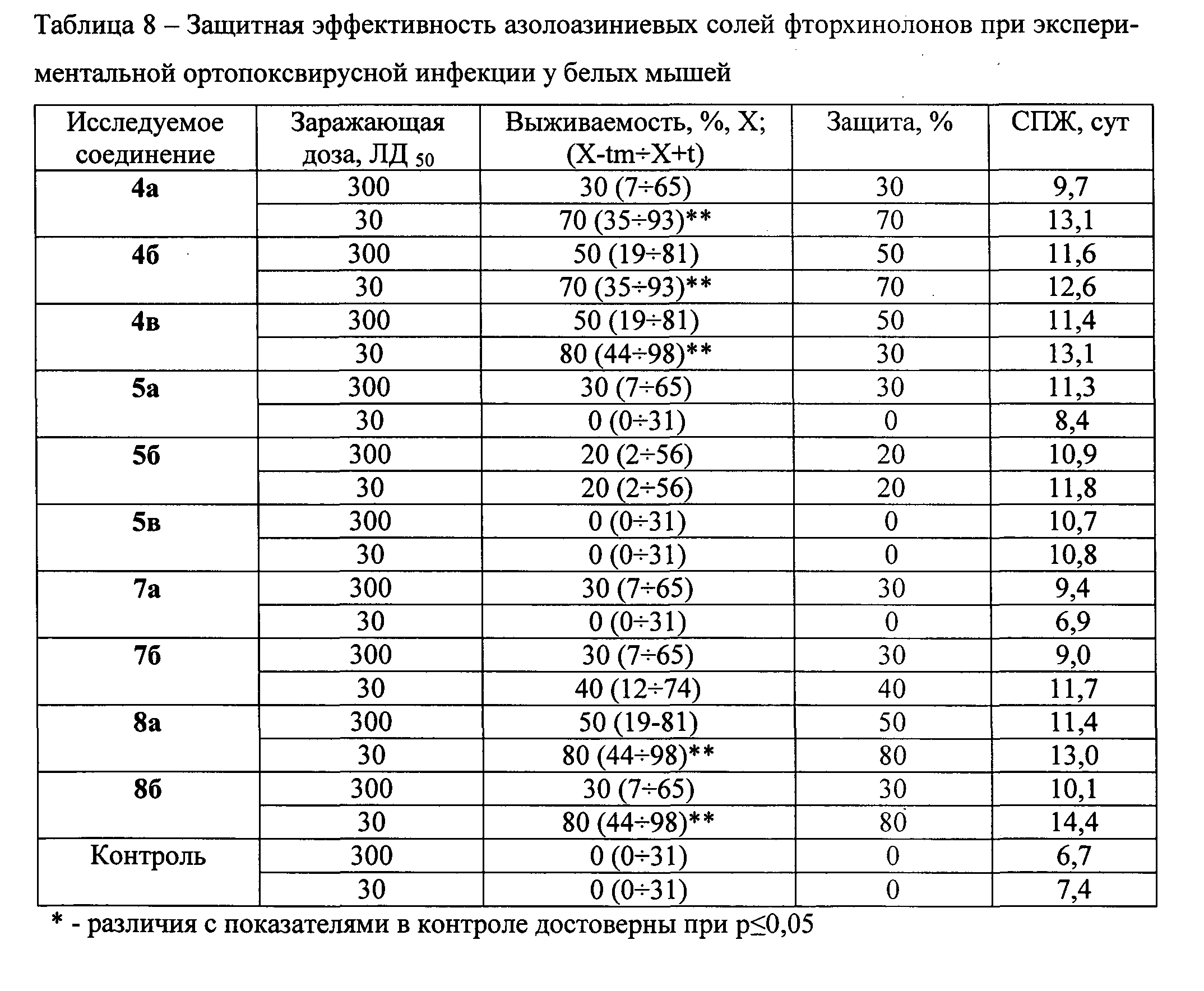
Как свидетельствуют представленные в таблице 8 данные, соли триазавирина с фторхинолонами (пефлоксацина, норфлоксацина, энрофлоксацина) 4а, 4б и 4в, соль триазида с левофлоксацином 8б в условиях заражения животных возбудителем экспериментальной ортопоксвирусной инфекции в дозе 300 ЛД50 обеспечивают защиту на уровне 30-50%, а при заражении в дозе 30 ЛД50 - 70-80% (р≤0,05). Следует отметить, что применение азолоазиниевых солей способствует увеличению в 2-2,5 раза СПЖ инфицированных животных по сравнению с контрольными значениями.
В данной заявке реализована возможность синтеза ранее недоступных химических соединений на основе базовых субстанций антибактериальных препаратов фторхинолонового ряда и противовирусных веществ азолоазинового ряда. Синтез новых молекул химическими методами позволил улучшить растворимость и показатели токсичности исследуемых соединений и, как следствие, биодоступность молекул. Показана эффективность азолоазиниевых солей фторхинолонов на экспериментальных моделях особо опасных инфекций бактериальной и вирусной природы в экспериментах in vitro и in vivo. Выявлено, что азолоазиниевые соли фторхинолонов способствуют увеличению средней продолжительности жизни инфицированных животных по сравнению с контрольными значениями. Полученные результаты могут быть использованы для создания лекарственного средства для экстренной профилактики и лечения инфекций, вызванных патогенами как бактериальной, так и вирусной природы, в том числе особо опасных.
Азолоазиниевые соли фторхинолонов формул: где R=СН R=СН (4а, 5а); R=Н, R=СН (4б, 5б); R=СН, R=цикло-СН (4в, 5в) где R=Н (7а, 8а); R=СН (7б, 8б), обладающие антибактериальным и противовирусным действием.