Результат интеллектуальной деятельности: МИКРОКАПСУЛЬНЫЙ ПРЕПАРАТ НА ОСНОВЕ АЛЬГИНАТА-АЦИЛЬНЫХ ПРОИЗВОДНЫХ ХИТОЗАНА, ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ
Вид РИД
Изобретение
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
1. Область техники
Изобретение относится к микрокапсульному препарату, в частности к микрокапсульному препарату на основе альгината-ацильных производных хитозана для инкапсуляции живых клеток.
2. Описание предшествующего уровня техники
В 1960-е годы Chang сообщал о полупроницаемой микрокапсуле, способной инкапсулировать биологически активные вещества (такие как белки и ферменты) и клетки, для поддержания активности биологических веществ [см. Chang TMS. Semipermeable microcapsules, Science, 1964, 146:524-525]. В начале 1980-х годов для борьбы с заболеваниями, заключающимися в функциональных дефектах в тканях/клетках (такими как диабет), Lim и Sun успешно получили полупроницаемые микрокапсулы альгината натрия/α-полилизина (сокращенно α-АРА микрокапсула). После инкапсуляции инсулоцитов крыс Wistar α-АРА микрокапсулу трансплантировали крысам Wistar Lewis с диабетом, а затем инсулин секретировался и высвобождался для регулирования уровня сахара в крови [см. Lim F, Sun A M. Microencapsulated islets bioartificial endocrine pancreas, Science, 1980, 210:908-910]. Это ускорило быстрое развитие исследования материалов и способов получения, связанных с микрокапсульной технологией, которая широко применяется в доклинических исследованиях в медико-биологических областях, таких как клеточная трансплантация, доставка лекарственных средств и генотерапия [см. Wang W, Liu XD, Ma XJ, et al. Microencapsulation using natural polysaccharides for drug delivery and cell implantation, J. Mater. Chem., 2006, 16:3252-3267]. Среди многочисленных микрокапсул широко применимыми являются микрокапсулы альгината натрия-полилизина (α-АРА). Однако высокая цена (300-400 US$/г), присущая им слабая биосовместимость и токсичность полилизина во многом ограничивают клиническое применение α-АРА микрокапсул [см. Strand В L, Ryan TL, Veld P I, et al. Cell Transplant., 2001, 10:263-275]. Хитозан, природный полисахарид, применяли в качестве заменителя полилизина для получения микрокапсул для инкапсуляции клеток благодаря его низкой стоимости, приемлемому свойству мембранообразования и высокой механической стабильности мембран [см. L. Baruch, M. Machluf, Alginate-chitosan complex coacervation for cell encapsulation: Effect on mechanical properties and on long-term viability, Biopolymers 82 (2006):570-579]. Однако существующая хитозановая микрокапсула для инкапсуляции клеток обладает высокой шероховатостью поверхности и поверхностными зарядами, которые с легкостью вызывают in vivo белковую адсорбцию после трансплантации в организм и в дальнейшем вызывают фиброз организма.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ В КРАТКОМ ИЗЛОЖЕНИИ
Для решения вышеописанной проблемы в настоящем изобретении представлена микрокапсула альгината-ацильных производных хитозана, ее получение и применение.
Техническое решение
Посредством применения ацилированного хитозана для получения микрокапсулы в настоящем изобретении разрабатывают новый полиэлектролитнокомплексный микрокапсульный препарат на основе альгината-ацильных производных хитозана для инкапсуляции биологически активных веществ. Новый микрокапсульный препарат не только способен решить проблемы шероховатости поверхности и поверхностного заряда, но также сохранить стабильность и иммуноизоляционное действие микрокапсулы. Микрокапсульный препарат на основе альгината-ацильных производных хитозана по настоящему изобретению получают посредством смешивания микрокапсул альгината-ацильных производных хитозана с водным раствором, где:
структура микрокапсулы состоит из двух частей: мембраны микрокапсулы и внутреннего ядра; мембрана микрокапсулы является полиэлектролитной композитной гидрогелевой мембраной, образованной хитозаном, альгинатом и ацильными производными хитозана, и внутреннее ядро является альгинатной жидкостью или гидрогелевой средой, содержащей клетки.
В микрокапсульном препарате по настоящему изобретению микрокапсулы являются сферическими микрокапсулами с размером частиц от 10 до 2000 мкм; мембрана имеет толщину от 0,1 до 100 мкм, и молекулярная масса альгината, образующего мембрану, составляет от 10 кДа до 2000 кДа (например, от 50 кДа до 200 кДа; от 200 кДа до 500 кДа; от 600 кДа до 1000 кДа; от 1000 кДа до 2000 кДа); материал на основе хитозана имеет степень деацетилирования 70-98% и молекулярную массу от 1 кДа до 500 кДа (например, от 1 кДа до 50 кДа; от 10 кДа до 100 кДа; от 120 кДа до 300 кДа; от 350 кДа до 500 кДа); молекулярная масса ацильных производных хитозана составляет 1 кДа ~800 кДа (например, от 1 кДа до 50 кДа; от 10 кДа до 100 кДа; от 120 кДа до 300 кДа; от 350 кДа до 500 кДа); отношение массы хитозана, альгината и ацильных производных хитозана составляет от 0:1:0,1 до 10:1:10; концентрация альгината в ядре составляет от 0,1 до 50 г/л, и клетки в ядре составляют от 10 до 98 об./об.%.
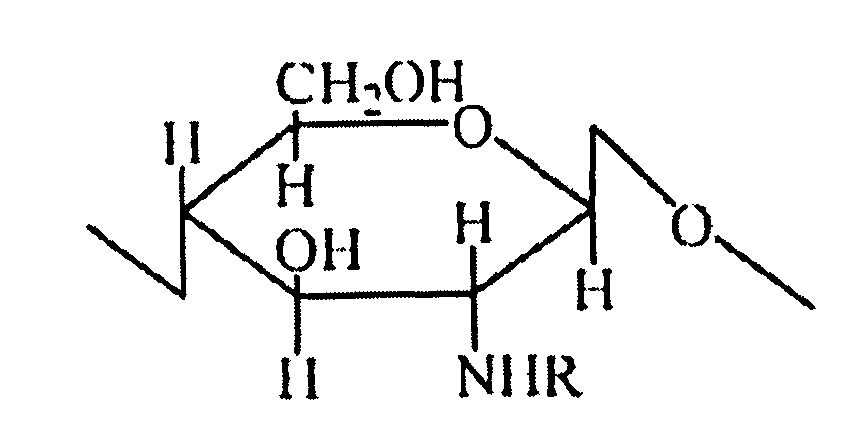
В микрокапсульном препарате ацильные производные хитозана в микрокапсуле являются N-ацильным хитозаном, с мономерной структурой, представленной ниже:
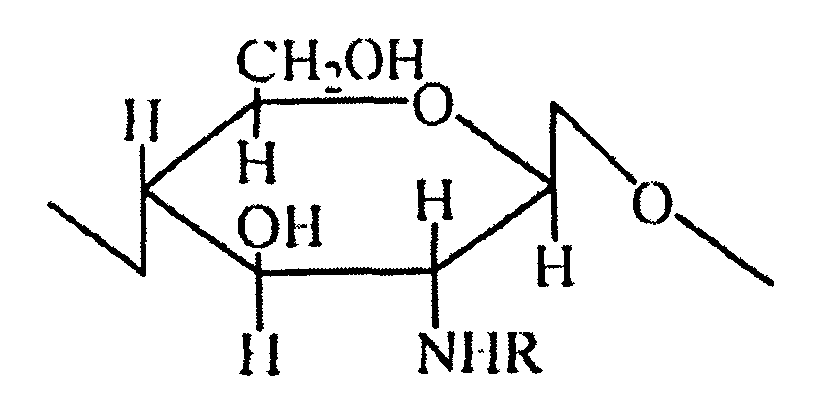
где -R представляет собой формил, ацетил, пропионил, бутирил, валерил или капроил; степень замещения ацильных производных составляет от 10 до 60%; молекулярная масса хитозанового каркасного материала составляет от 1 до 400 кДа; и степень деацетилирования составляет от 90 до 98%.
В микрокапсульном препарате альгинат в качестве компонента микрокапсульной мембраны является альгинатом калия или натрия.
В микрокапсульном препарате альгинатный гель в ядре микрокапсулы является гидрогелем на основе альгината одного, или двух, или более из двухвалентного кальция, бария или цинка, и жидкость на основе альгината является раствором альгината калия или натрия.
В микрокапсульном препарате отношение объема микрокапсул к водному раствору составляет от 10:1 до 1:100, где водный раствор является одним или смесью двух или более из нормального физиологического раствора, раствора N-2-гидроксиэтилпиперазин-N'-2'-этансульфоновой кислоты (HEPES), раствора гиалуроновой кислоты с эффективной вязкостью от 5 до 2000 сП (25°С, в отношении эффективной вязкости, измеренной при температуре 25°С), альгината натрия с эффективной вязкостью от 5 до 2000 сП (25°С), раствора глюкозана с эффективной вязкостью от 5 до 2000 сП (25°С), раствора глицерина с эффективной вязкостью от 5 до 2000 сП (25°С), раствора полиэтиленгликоля с эффективной вязкостью от 5 до 2000 сП (25°С), раствора поливинилпирролидона с эффективной вязкостью от 5 до 2000 сП (25°С), раствора производного целлюлозы с эффективной вязкостью от 5 до 2000 сП (25°С), раствора циклодекстрина с эффективной вязкостью от 5 до 2000 сП (25°С), раствора крахмала с эффективной вязкостью от 5 до 2000 сП (25°С) и раствора производного крахмала с эффективной вязкостью от 5 до 2000 сП (25°С).
В микрокапсульном препарате мембрана микрокапсулы является гидрогелевой мембраной, образованной хитозаном, альгинатом и ацильными производными хитозана посредством реакции полиэлектролитного комплексообразования. Стадии получения препарата следующие (в стерильных условиях):
1) приготовление микросфер на основе альгинатного геля, инкапсулирующих живые клетки, названных микросферами А;
2) замачивание микросфер А, полученных на стадии 1), в растворе хитозана при объемном отношении от 1:1 до 1:40 (т.е. микросферы А : раствор хитозана (об./об.)), предоставление им возможности для взаимодействия в течение от 1 до 60 мин для получения микрокапсул альгинат натрия-хитозан, названных микросферами В, и разделение и промывание микросфер В нормальным физиологическим раствором; где
раствор хитозана получают посредством растворения хитозана в буферном растворе уксусная кислота-ацетат натрия с рН от 5,5 до 7,0 и концентрацией хитозана от 0,1 до 15 г/л;
3) замачивание микросфер В, полученных на стадии 2), в растворе альгината щелочного металла (концентрация альгината составляет от 0,1 до 5 г/л) при объемном отношении от 1:1 до 1:40 (т.е. микросферы В : раствор альгината щелочного металла (об./об.)), предоставление им возможности вступать в реакцию в течение от 1 до 60 мин для получения микрокапсул, названных микросферами С, и разделение и промывание микросфер С нормальным физиологическим раствором;
4) повторение стадии 2) и стадии 3) в течение 1-5 циклов для получения микрокапсул, названных микросферами D, и разделение и промывание микросфер D нормальным физиологическим раствором;
5) замачивание микросфер А, В, С или D, соответственно полученных на стадиях 1), 2), 3) или 4), в растворе ацильного производного хитозана при объемном отношении от 1:1 до 1:40 (т.е. микросферы : раствор ацильного производного хитозана (об./об.)), предоставление им возможности для взаимодействия в течение от 1 до 60 мин для получения микрокапсул, имеющих внутреннее гелевое ядро, названных микросферами Е, и разделение и промывание микросфер Е в нормальном физиологическом растворе, где
раствор ацильного производного хитозана получают посредством растворения ацильных производных хитозана нормальным физиологическим раствором, в буферном растворе N-2-гидроксиэтилпиперазин-N'-2'-этансульфоновой кислоты (HEPES), буферном растворе PBS или буферном растворе уксусная кислота-ацетат натрия с рН от 5,5 до 7,0, и концентрация ацильного производного хитозана составляет от 0,1 до 20 г/л;
6) замачивание микросфер Е, полученных на стадии 5), в растворе альгината щелочного металла и повторение стадии 3) для получения микрокапсул с заряженной нейтрально поверхностью и внутренним гелевым ядром, названных микросферами F;
7) замачивание микросфер F, полученных на стадии 6), в растворе органического металлохелатирующего средства при объемном отношении от 1:1 до 1:40 (т.е. микросферы F : раствор органического металлохелатирующего средства (об./об.)) для превращения в жидкое состояние геля на основе альгината в микрокапсулах, предоставление им возможности для взаимодействия в течение от 1 до 60 мин, разделение препарата, его промывание нормальным физиологическим раствором для получения микрокапсул, имеющих внутреннее жидкое ядро, названных микросферами G;
8) смешивание микросфер Е, F или G, соответственно полученных на стадиях 5), 6) или 7), с вышеописанными водными растворами для получения микрокапсульного препарата на основе альгината-ацильных производных хитозана.
Микросферы на основе альгинатного геля являются альгинатным гидрогелем одного, или двух, или более из двухвалентного кальция, бария или цинка.
Альгинатом щелочного металла для нейтрализации поверхностных зарядов является альгинат калия или натрия с молекулярной массой от 10 кДа до 2000 кДа и концентрацией от 0,1 до 5 г/л.
Раствор органического металлохелатирующего средства, участвующий в реакции превращения в жидкость, представляет собой от 40 до 70 ммоль/л цитрат натрия или от 50 до 200 ммоль/л ЭДТА.
В микрокапсульном препарате по настоящему изобретению микрокапсулы применяют для инкапсуляции клеток.
В них клетки могут быть ex vivo или in vitro клетками от человека или млекопитающих, такими как инсулоциты, клетки печени, клетки щитовидной железы, клетки паращитовидной железы, хромаффинные клетки надпочечников, клетки, способные секретировать биологически активные вещества, и клетки клеточных линий.
Изобретение имеет следующие преимущества:
1. По сравнению с традиционными микрокапсулами альгината натрия-полилизина (АРА) и альгината натрия-хитозана (АСА), новый микрокапсульный препарат на основе альгината-ацильных производных хитозана по настоящему изобретению демонстрирует более высокую биологическую совместимость вследствие того, что шероховатость поверхности мембраны микрокапсулы значительно ниже, чем шероховатость поверхности микрокапсул АРА и шероховатость поверхности микрокапсул АСА.
2. Сохраняя превосходную биологическую совместимость, микрокапсульная мембрана препарата по настоящему изобретению имеет исключительную стабильность мембраны, способную поддерживать интактность при применении при трансплантации ткани/клетки и в клеточной культуре.
3. Микрокапсулы по настоящему изобретению имеют превосходное иммуноизоляционное действие, способное поддерживать иммуноизоляцию при применении при гетеротрансплантации ткани/клетки. Клетки, инкапсулированные в микрокапсуле, не могут выйти из микрокапсул, молекулы антител, молекулы комплемента, и иммунные клетки вне микрокапсулы не могут войти в микрокапсулы для того, чтобы убить клетки, в то время как активные вещества, секретируемые во время клеточного метаболизма, могут свободно проникать в микрокапсулы и покидать их.
4. Процесс получения препарата по настоящему изобретению является мягким; и ацильные производные хитозана являются растворимыми в нормальном физиологическом растворе, который является подходящим для поддержания активности клеток.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
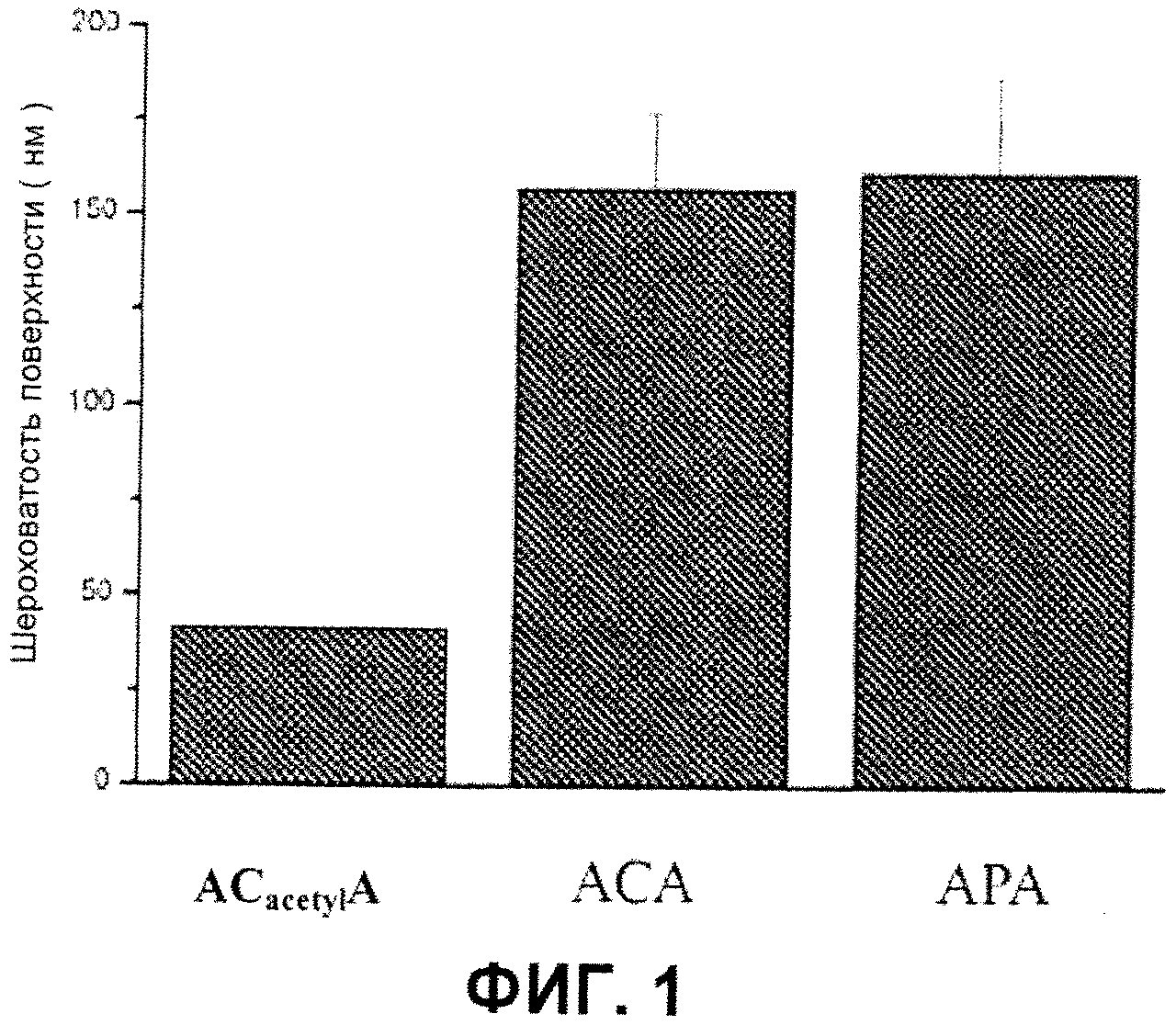
На фигуре 1 представлены сравнительные результаты шероховатости поверхности мембраны на основе альгината-ацильных производных хитозана (ACacetyl), АС мембраны и АР мембраны в примере 1, сравнительном примере 1 и сравнительном примере 2.
На фигуре 2 представлено фотооптическое изображение микрокапсул, извлеченных из брюшной полости мыши после трансплантации нового микрокапсульного препарата на основе альгината-ацильных производных хитозана-хитозана через один месяц в примере 1 (масштаб на фигуре составляет 100 мкм).
На фигуре 3 представлено фотооптическое изображение микрокапсул, извлеченных из брюшной полости мыши через один месяц после трансплантации традиционных АСА микрокапсул в сравнительном примере 1 (масштаб на фигуре составляет 100 мкм).
КОНКРЕТНЫЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Средства для образования микросфер на основе альгинатного геля включают электростатический капельный способ (см. In Vivo Culture of Encapsulated Endostatin - Secreting Chinese Hamster Ovary Cells for Systemic Tumor Inhibition. Human Gene Therapy. 2007, 18:474-481), способ продавливания через отверстие (см. Chinese Application No. 200510136769.7, зарегистрированное тем же заявителем под названием "A Method for Preparing Micro-spherical Initial Fish Baits for Highly Economic Fishes"), эмульгирование - способ внешней желатинизации (см. Preparation of lactic acid bacteria-enclosing alginate beads in emulsion system: effect of preparation parameters on bead characteristics, Polym. Bull., 2009, 63:599-607) или эмульгирование - способ внутренней желатинизации (см. Emulsification - internal Gelation Process for preparation of Immobilized Yeast Microcapsules, CIESC Journal, 2009, 60(3):710-717) или способ мембранного эмульгирования (см. Preparation of uniform calcium alginate gel beads by membrane emulsification coupled with internal gelation. Journal of Applied Polymer Science, 2003, 87(5):848-852).
Пример 1
1) Получите микросферы на основе геля альгината кальция посредством высоковольтного электростатического способа в стерильных условиях.
2) Замочите микросферы в ацетилмодифицированном растворе хитозана (молекулярная масса хитозанового каркаса составляет 50 кДа; степень замещения ацетила составляет 40%; и раствор получают с применением нормального физиологического раствора, с концентрацией 5 г/л) при объемном отношении 1:10 (т.е. микросферы : раствор хитозана (об./об.)), оставьте их для взаимодействия в течение 20 мин, промойте нормальным физиологическим раствором, а затем оставьте препарат для взаимодействия с 2 г/л раствором альгината натрия в течение 10 мин, промойте нормальным физиологическим раствором для получения ACacetylA микрокапсул.
3) Измерьте поверхностную шероховатость полученной ACacetylA полиэлектролитнокомплексной мембраны с применением профилометра, и результат демонстрирует, что минимальная шероховатость поверхности мембраны составляет 42±9 нм, что значительно ниже, чем минимальная шероховатость поверхности АРА мембраны и минимальная шероховатость поверхности АСА мембраны (см. фигуру 1), полученных тем же способом в сравнительных примерах.
4) Смешайте ACacetylA микрокапсулы с нормальным физиологическим раствором при объемном отношении 1:2, трансплантируйте смесь в брюшную полость мыши посредством шприца и извлеките их через один месяц. Установлено, что микрокапсулы могут быть извлечены всего лишь промыванием брюшной полости мыши с применением нормального физиологического раствора; при этом они все еще обладают высокой стабильностью и являются интактными и поверхность микрокапсулы является гладкой и свободной от фиброзной инкапсуляции (см. фигуру 2).
Сравнительный пример 1
1) Замочите микросферы на основе геля альгината кальция, полученные в примере 1, в растворе хитозана (молекулярная масса хитозана составляет 50 кДа; степень деацетилирования составляет 95%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,5; и концентрация хитозана составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : раствор хитозана (об./об.)), оставьте их для взаимодействия в течение 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 0,2% раствором альгината натрия в течение 10 мин и промойте с применением нормального физиологического раствора для получения АСА микрокапсул.
2) Измерьте шероховатость поверхности АСА полиэлектролитической комплексной мембраны с применением профилометра, и результат демонстрирует, что шероховатость поверхности мембраны составляет 157±20 нм, что является значительно более высоким значением, чем шероховатость поверхности мембраны ACacetylA полиэлектролитнокомплексной мембраны (см. фигуру 1), полученную в примере 1.
3) Смешайте АСА микрокапсулы с нормальным физиологическим раствором при объемном отношении 1:2, трансплантируйте смесь в брюшную полость мыши посредством шприца и извлеките их через один месяц. Результаты показывают, что извлечь АСА микрокапсулы посредством промывания брюшной полости мыши нормальным физиологическим раствором является трудным и поверхность микрокапсулы показывает значительную фиброзную инкапсуляцию (см. фигуру 3).
Сравнительный пример 2
1) Замочите микросферы на основе геля альгината кальция, полученного в примере 1, в растворе полилизина (молекулярная масса полилизина составляет 20 кДа; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : раствор полилизина (об./об.)), оставьте их для взаимодействия в течение 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия на 10 мин и промойте с применением нормального физиологического раствора для получения АРА микрокапсул.
2) Измерьте шероховатость поверхности АРА полиэлектролитнокомплексной мембраны с применением профилометра, и результат показывает, что шероховатость поверхности АРА мембраны составляет 161±26 нм, что значительно выше шероховатости поверхности ACacetylA полиэлектролитнокомплексной мембраны (см. фигуру 1), полученной в примере 1.
Пример 2
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие клетки печени свиньи, посредством способа продавливания через отверстие, где содержимое клетки в микросферах составляет 5×107 клеток/мл микросфер.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 20 кДа; степень деацетилирования составляет 90%; хитозан растворен в буферном растворе уксусная кислота-ацетат натрия с рН 6,8; и концентрация хитозана составляет 4 г/л) и растворе ацилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 60 кДа; степень ацильного замещения составляет 30%; и хитозан растворен в растворе уксусная кислота-ацетат натрия с рН 6,8; и концентрация составляет 4 г/л) при объемном отношении 1:10 (т.е. микросферы : раствор хитозана или раствор ацилмодифицированного хитозана (об./об.)) последовательно, оставьте их для взаимодействия в течение 20 мин, промойте их с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 0,2% раствором альгината натрия в течение 10 мин и промойте с применением нормального физиологического раствора для получения ACCformylA микрокапсул.
3) Получите экстракорпоральную систему искусственной печени посредством получения ACCformylA микрокапсул, инкапсулирующих клетки печени свиньи, и примените систему к подопытной собаке с печеночной недостаточностью. Результаты показывают, что уровни глутамин-пировиноградной трансаминазы и глутамин-щавелевоуксусной трансаминазы собаки с печеночной недостаточностью достигают нормальных значений; показатели аммиака в крови возвращаются к нормальным; симптом печеночной недостаточности собаки устраняется; ACCformylA микрокапсулы сохраняют интактность в системе искусственной печени и явление адсорбции белка не обнаруживают после переливания крови.
Пример 3
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие инсулоциты свиньи, посредством высоковольтного электростатического способа, где каждая микросфера содержит 1-2 инсулоцита.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 40 кДа; степень деацетилирования составляет 98%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,5; и концентрация составляет 5 г/л), 0,2% растворе альгината натрия и растворе ацетилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 60 кДа; степень ацетильного замещения составляет 50%; ацетилмодифицированный хитозан растворяют в нормальном физиологическом растворе; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия на 20 мин, промойте нормальным физиологическим раствором и затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия на 10 мин, промойте нормальным физиологическим раствором, превратите в жидкость с применением 55 мМ раствора цитрата натрия и промойте нормальным физиологическим раствором для получения ACCacetylA микрокапсул.
3) После смешивания полученных ACCacetylA микрокапсул с раствором N-2-гидроксиэтилпиперазин-N'-2'-этансульфоновой кислоты (HEPES) при объемном отношении 1:5 примените смесь для проведения клеточной терапии диабета подопытной крысе. Посредством трансплантации микрокапсул в брюшную полость уровень сахара в крови крысы возвращается к нормальному через сутки после трансплантации, и симптом диабета значительно ослабляется; микрокапсулы извлекают через шесть месяцев после in vivo трансплантации, при этом установлено, что микрокапсулы являются интактными; поверхность микрокапсул является гладкой и свободной от фиброзной инкапсуляции и инсулоциты в микрокапсулах сохраняют жизнеспособность с позитивным окрашиванием дитизоном.
Пример 4
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие клетки щитовидной железы крысы, посредством высоковольтного электростатического способа, где содержание клеток в микросферах составляет 3×107 клеток/мл микросфер.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 100 кДа; степень деацетилирования составляет 95%; хитозан растворяют в буфере уксусная кислота-ацетат натрия с рН 6,0; и концентрация составляет 5 г/л) и растворе пропионилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 20 кДа; степень пропионилового замещения составляет 40%; и пропионилмодифицированный хитозан растворен в буферном растворе PBS; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия на 20 мин, промойте нормальным физиологическим раствором, затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия в течение 10 мин, промойте нормальным физиологическим раствором, превратите в жидкость с применением 55 мМ раствора цитрата натрия и промойте нормальным физиологическим раствором для получения ACCpropionylA микрокапсул.
3) После смешивания полученных ACCpropionylA микрокапсул, инкапсулирующих клетки щитовидной железы крысы, с раствором гиалуроновой кислоты (20 г/л) с эффективной вязкостью 500 сП (25°С) при объемном отношении 1:1, трансплантируйте смесь в дельтовидную мышцу гетерогенной модели крысы с гипотиреозом. Результаты демонстрируют, что симптом гипотиреоза у крыс устраняется; уровни Т3 и Т4 возвращаются к нормальным; ACCpropionylA микрокапсулы остаются интактными и поверхность свободна от фиброза, когда их извлекают через три месяца после трансплантации.
Пример 5
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие хромаффинные клетки надпочечников быка, посредством высоковольтного электростатического способа, где содержание клеток в микросферах составляет 2×107 клеток/мл микросфер.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 10 кДа; степень деацетилирования составляет 90%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,8; и концентрация составляет 5 г/л) и растворе бутирилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 10 кДа; степень бутирилового замещения составляет 30%; и бутирилмодифицированный хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,8; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия на 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия в течение 10 мин, промойте с применением нормального физиологического раствора, превратите в жидкость с применением 55 мМ раствора цитрата натрия и промойте с применением нормального физиологического раствора для поддержания ACCbutyrylA микрокапсул.
3) После смешивания полученных ACCbutyrylA микрокапсул, инкапсулирующих хромаффинные клетки надпочечника быка, с раствором альгината натрия (20 г/л) с эффективной вязкостью 1000 сП (25°С) при объемном отношении 1:1, трансплантируйте смесь в фиксированную точку черепа подопытной обезьяны с болезнью Паркинсона. Результаты показывают, что симптомы Паркинсона, такие как гемиплегия у обезьян, страдающих от указанного заболевания, устраняются; ACCbutyrylA микрокапсулы остаются интактными и поверхность свободна от фиброзной инкапсуляции, когда их извлекают через шесть месяцев после трансплантации.
Пример 6
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие хромаффинные клетки надпочечника быка, посредством высоковольтного электростатического способа, где содержание клеток в микросферах составляет 1×107 клеток/мл микросфер.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 70 кДа; степень деацетилирования составляет 98%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,3; и концентрация составляет 5 г/л), 0,2% растворе альгината натрия и растворе валерилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 20кДа; степень валерилового замещения составляет 40%; и валерилмодифицированный хитозан растворяют в буферном растворе N-2-гидроксиэтилпиперазин-N'-2'-этансульфоновой кислоты (HEPES); и концентрация составляет 5 г/л) при объемном отношении 1:10 (микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия в течение 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 2 г/л раствора альгината натрия в течение 10 мин и промойте с применением нормального физиологического раствора для поддержания ACCvalerylA микрокапсул.
3) После смешивания полученных ACCvalerylA микрокапсул, инкапсулирующих хромаффинные клетки надпочечника быка, с раствором альгината натрия (30 г/л) с кажущейся вязкостью 800 сП (25°С) при объемном отношении 1:1, трансплантируйте смесь в субарахноидальное пространство спинного мозга подопытной крысы с некупируемой болью. Результаты показывают, что симптом некупируемой боли у крыс снимается; число движений конечности значительно снижается; ACCvalerylA микрокапсулы остаются интактными и поверхность свободна от фиброзной инкапсуляции, когда их извлекают через шесть месяцев после трансплантации.
Пример 7
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие клетки СНО, содержащие рекомбинантный сосудистый эндотелиальный эндостатин, посредством высоковольтного электростатического способа, где содержание клеток в микросферах составляет 5×107 клеток/мл микросфер.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 20 кДа; степень деацетилирования составляет 92%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,5; и концентрация хитозана составляет 5 г/л) и растворе капроилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 20 кДа; степень капроилового замещения составляет 50%; капроилмодифицированный хитозан растворяют в нормальном физиологическом растворе; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия в течение 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия в течение 10 мин и промойте с применением нормального физиологического раствора для получения ACCcaproylA микрокапсул.
3) После смешивания ACCcaproylA микрокапсул, инкапсулирующих клетки СНО, содержащие рекомбинантный эндостатин с 50% (об./об.) раствора глицерина с эффективной вязкостью 600 сП (25°С) при объемном отношении 1:5, трансплантируйте смесь в брюшную полость подопытной крысы с меланомой. Результаты показывают, что меланома крысы очевидно становится меньше; ACCcaproylA микрокапсулы остаются интактными и поверхность свободна от фиброзной инкапсуляции, когда их извлекают через два месяца после трансплантации.
Пример 8
1) Получите микросферы на основе геля альгината кальция, инкапсулирующие инсулоциты свиньи, посредством высоковольтного электростатического способа, где каждая микросфера содержит 1-2 инсулоцита.
2) Замочите микросферы в растворе хитозана (молекулярная масса хитозана составляет 40 кДа; степень деацетилирования составляет 98%; хитозан растворяют в буферном растворе уксусная кислота-ацетат натрия с рН 6,5; и концентрация составляет 5 г/л), 0,2% растворе альгината натрия и растворе ацетилмодифицированного хитозана (молекулярная масса хитозанового каркаса составляет 60 кДа; степень ацетилового замещения составляет 50%; ацетилмодифицированный хитозан растворяют в нормальном физиологическом растворе; и концентрация составляет 5 г/л) при объемном отношении 1:10 (т.е. микросферы : каждый раствор (об./об.)) последовательно, оставьте их для взаимодействия в течение 20 мин, промойте с применением нормального физиологического раствора, затем оставьте промытый препарат для взаимодействия с 2 г/л раствором альгината натрия в течение 10 мин, промойте с применением нормального физиологического раствора, превратите в жидкость с применением 55 мМ раствора цитрата натрия и промойте с применением нормального физиологического раствора для получения ACCacetylA микрокапсул.
3) После смешивания полученных ACCacetylA микрокапсул с раствором полиэтиленгликоля (100 г/л) с эффективной вязкостью 400 сП (25°С) при объемном отношении 1:2, примените смесь для клеточной терапии подопытной крысы с диабетом. Посредством трансплантации в брюшную полость уровень сахара в крови крысы возвращается к нормальному лишь через одни сутки после трансплантации, и симптом диабета значительно облегчается; когда их извлекают через шесть месяцев после in vivo трансплантации, при этом установлено, что микрокапсулы являются интактными; поверхность микрокапсулы является гладкой и свободной от фиброзной инкапсуляции и инсулоциты в микрокапсулах сохраняют жизнеспособность с позитивным окрашиванием дитизоном.