Результат интеллектуальной деятельности: ДИФОСФИНЫ, КАТАЛИЗАТОР СИНТЕЗА СЛОЖНЫХ ЭФИРОВ НА ИХ ОСНОВЕ И СПОСОБ СИНТЕЗА СЛОЖНЫХ ЭФИРОВ В ЕГО ПРИСУТСТВИИ
Вид РИД
Изобретение
Изобретение относится к получению сложных эфиров, которые широко используются в различных отраслях промышленности и быту.
Известно, что сложные эфиры, например различные эфиры циклогексанкарбоновой кислоты, находят приложение в качестве пластификаторов [К.Colle, J.E.Stanat, J.J.Reinoso, A.D.Godwin, WO Patent 2009/070398 to (2009) ExxonMobil], полупродуктов синтеза фармакологических препаратов [U.Hoffmann, M.Jansen, R.Reents, H.Stahr, US Patent 2009/0253927 (2009) to Hoffmann-La Roch Inc], жидких кристаллов [S.Sugimori, US Patent 4617142 to Chisso Corp.(1986)], душистых веществ [К.Jenni, О.Springer, US Patent 20100068160 to Evonik Goldschmidt GmbH (2010)] и др.
Одним из наиболее эффективных и современных методов синтеза сложных эфиров является каталитическое гидрокарбоалкоксилирование алкенов, которое протекает в одну стадию исходя из широкодоступных алкенов, спиртов и окиси углерода [G.Kiss, Chem. Rev., 2001, 101, pp.3435-3456]. Этот процесс уже нашел свое применение в промышленности. Так, например, несколько лет назад был коммерциализирован процесс гидрокарбометоксилирования этилена [Т.Fanjul, G.Eeastham, N.Fey, А.Hamilton, A.G.Orpen, P.G.Pringle, M. Waugh, Organometallics 2010, 29, pp.2292-2305].

Среди каталитических систем, используемых в гидрокарбоалкоксилировании алкенов, особый интерес представляют производные палладия, промотированные сильными протонными кислотами и различными фосфинами [G.Kiss, Chem. Rev., 2001, 101, pp.3435-3456]. В ряду последних, все большее значение приобретают дифосфины.
Известно использование трифенилфосфина (ТФФ) как промотора катализатора синтеза сложных эфиров, но эффективность полученного катализатора невелика.
Наиболее близким аналогом настоящего изобретения являются транс-2,3-бис(дифенилфосфинометил)-норборнан (ТБДФФМН), отвечающий структурной формуле
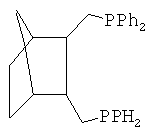
Катализатор синтеза сложных эфиров на основе производных палладия, модифицированный описанным дифосфином, проявляет активность в способе синтеза сложных эфиров, включающем смешение в среде растворителя алкена, СО и спирта с добавлением этого катализатора и кислоты и нагревание до температур 50÷150°C [I.E.Nifant′ev, N.T.Sevostyanova, V.A.Averyanov, S.A.Batashev, A.A.Vorobiev, S.A.Toloraya, V.V.Bagrov, A.N.Tavtorkin. Applied Catalysis, A: General. 2012, v.449, pp.145-152].
Однако для получения достаточно эффективного катализатора синтеза сложных эфиров на его основе требуется использовать существенные избытки дифосфина по отношению к взятому ацетату палладия. Это является важным недостатком из-за того, что стоимость дифосфинов, таких как ТБДФФМН, обычно является высокой.
Задачей настоящего изобретения является создание эффективной каталитической системы для производства сложных эфиров гидрокарбоалкоксилированием алкенов, на основе дифосфина, соли палладия и кислоты, проявляющей высокую активность при более низком содержании дорогостоящего дифосфина.
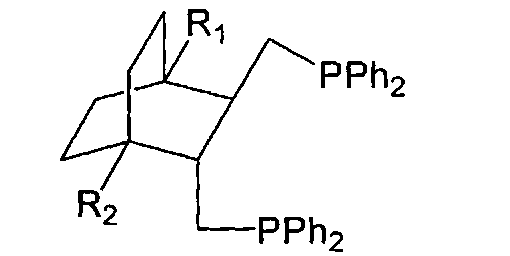
Поставленная задача решается тем, что впервые удалось синтезировать дифосфины общей структурной формулы:
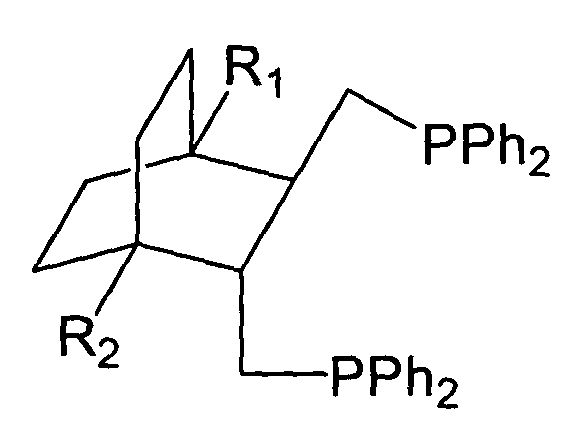
где R1,R2=H, Alk, Ar, ОМе, кроме R1=R2=H, Me - метил.
Структура полученных соединений установлена с помощью данных ЯМР (ядерно-магнитно-резонансной) спектроскопии и элементного анализа, приведенных в каждом конкретном примере получения соединений, а структурные формулы конкретных соединений представлены в табл.1.

Поставленная задача также решается тем, что предложен катализатор синтеза сложных эфиров на основе производных палладия, промотированных кислотами и фосфином, который в качестве фосфина содержит указанный дифосфин при соотношении дифосфин/Pd, равном 1-3.
Поставленная задача также решается тем, что предложен способ синтеза сложных эфиров путем гидрокарбоалкоксилирования алкенов в среде растворителя, СО и спирта в присутствии каталитических систем на основе производных палладия, промотированных кислотами и фосфином при повышенной температуре и давлении, в котором в качестве фосфина используют указанный дифосфин при соотношении дифосфин/Pd, равном 1-3.
В качестве алкенов используют циклические алкены или внутренние алкены, или терминальные алкены, или алкены, содержащие арильный заместитель.
В качестве производных палладия используют ацетат палладия.
В качестве кислот используют толуолсульфокислоту, а температуру гидрокарбоалкоксилирования поддерживают 80-115°C.
Техническим результатом изобретения является повышение степени конверсии реагентов при уменьшении расхода дорогостоящих дифосфинов на синтез сложных эфиров.
Данный результат может быть достигнут и в случае, если дифосфины содержат в структурной формуле OR вместо ОМе, где R - алкил.
Нижеследующие примеры иллюстрируют изобретение, но никоим образом не ограничивают его.
Полученные дифосфины синтезируют по представленным ниже методикам.
1. Синтез транс-({3-[(дифенилфосфино)метил]-1,4-диметил-бицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфина (Дифосфин 1).
Диметиловый эфир транс-1,4-диметилбицикло[2.2.2]окт-5-ен-2,3-дикарбоновой кислоты. К 12.4 г (0.12 моль) 1,4-диметил-1,3-циклогексадиена [Pearson, Anthony J.; Khetani, Vikram D. Journal of the American Chemical Society, 1989, vol. 111, #17, p.6778-6789] прибавляют по каплям 13 мл (0.12 моль) хлорангидрида фумаровой кислоты. Реакционную смесь перемешивают в течение часа, затем при охлаждении водой со льдом прибавляют по каплям 20 мл метанола. Через 16 часов избыток метанола отгоняют в вакууме, остаток растворяют в 100 мл бензола, промывают 100 мл насыщенного раствора Na2CO3, высушивают над MgSO4, отгоняют растворитель в вакууме. Остаток используют в дальнейшем без дополнительной очистки. Выход 30 г (94%).
Спектр ЯМР 31P (161 МГц, CDCl3, δ, м.д.): 6.03 (д, 1Н), 5.96 (д, 1Н), 3.69 (с, 3Н), 3.63 (с, 3Н), 2.78 (d, 1Н), 2.50 (дд, 1Н), 1.88 (м, 2Н), 1.60 (м, 2Н), 1.17 (с, 3Н), 1.18 (с, 3Н).
Диметиловый эфир транс-1,4-диметилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты. Смесь 30 г (0.12 моль) диметилового эфира 1,4-диметилбицикло[2.2.2]окт-5-ен-2,3-дикарбоновой кислоты и 0.70 г Pd/C в 150 мл метанола гидрируют водородом при комнатной температуре в течение 5 часов. По окончании реакции реакционную смесь отфильтровывают, растворитель отгоняют в вакууме, остаток высушивают. Выход 18 г (45%).
Спектр ЯМР 1Н (400МГц, CDCl3): δ=3.66 (с, 6Н), 1.95 (с, 2Н), 1.81 (м, 2Н), 1.54 (м, 2Н), 1.40 (м, 2Н), 1.20 (м, 2Н), 0.87 (с, 6Н).
Транс-2,3-бис(гидроксиметил)-1,4-диметилбицикло[2.2.2]октан. К суспензии 4 г (105 ммоль) LiAlH4 в 80 мл абсолютного эфира прикалывают раствор 18 г (70 ммоль) диметилового эфира 1,4-диметилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты в 40 мл абсолютного диэтилового эфира. Реакционную смесь кипятят в течение 4 часов. Затем при охлаждении обрабатывают 100 мл 10%-го раствора соляной кислоты, промывают 100 мл насыщенного раствора NaHCO3 и 100 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над Na2SO4, растворитель отгоняют в вакууме. Закристаллизовавшийся продукт в дальнейшем используют без дополнительной очистки. Выход 13.5 г (93%).
Спектр ЯМР 1Н (400МГц, CDCl3): δ=4.69 (с, 2Н), 3.85 (дд, 2Н), 3.33 (т, 2Н), 1.44 (м, 2Н), 1.35 (м, 4Н), 1.26 (м, 2Н), 0.84 (с, 6Н).
Дитозилат транс-2,3-бис(гидроксиметил)-1,4-диметилбицикло[2.2.2]октана. Смесь 13.5 г (68 ммоль) транс-2,3-бис(гидроксиметил)-1,4-диметилбицикло[2.2.2]октана, 39 г (204 ммоль) п-толуолсульфохлорида и 16.5 мл (204 ммоль) пиридина в 100 мл диэтилового эфира кипятят в течение 48 ч. Затем реакционную смесь отфильтровывают, обрабатывают 100 мл 10%-го раствора H2SO4, 150 мл насыщенного раствора NaHCO3, 200 мл воды и 100 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель отгоняют в вакууме, остаток перекристаллизовывают из этанола. Выход 33.5 г (94%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.80 (д, 4H), 7.38 (д, 4H), 4.07 (дц, 2H), 3.93 (дд, 2H), 2.47 (с, 6H), 1.45 (м, 2H), 1.30 (м, 4H), 1.22 (м, 4H), 0.73 (с, 6H).
Транс-({3-[(дифенилфосфино)метил]-4-метил-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин. К раствору 45 г (172 ммоль) трифенилфосфина в 230 мл абсолютного тетрагидрофурана добавляют 2.4 г (344 ммоль) мелкоизмельченного металлического лития и перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Затем к реакционной смеси добавляют 33.5 г (66 ммоль) дитозилата 2,3-бис(гидроксиметил)-1,4-диметилбицикло[2.2.2]октана, растворенного в 100 мл абсолютного тетрагидрофурана и перемешивают при комнатной температуре в течение 2 часов. Затем обрабатывают 100 мл насыщенного водного раствора NH4Cl, 200 мл воды и 100 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель отгоняют в вакууме. Остаток перекристаллизовывают из этанола и бензола. Выход 12 г (34%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.56 (м, 4H), 7.39 (м, 10H), 7.33 (м, 6H), 2.42 (дд, 2H), 1.74 (м, 2H), 1.64 (м, 2H), 1.42 (м, 6H), 1.27 (м, 2H), 0.89 (с, 6H). Спектр ЯМР 31P (161МГц, CDCl3): β=-21.62.
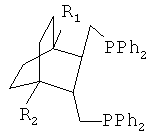
Получают дифосфин 1 - Транс-({3-[(дифенилфосфино)метил]-4-метил-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин, соответствующий структурной формуле
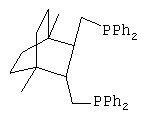
2. Синтез транс-({3-[(дифенилфосфино)метил]-4-метокси-1-метил-бицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфина (Дифосфин 2).
Диметил 1-метил-4-метоксибицикло[2.2.2]окт-5-ен-2,3-дикарбоксилат. К 1-метил-4-метокси-1,3-циклогексадиену [Birch, Journal of the Chemical Society, 1947, p.1642] (2.4 г, 22.6 ммоль) прибавляют по каплям 2.5 мл (23 ммоль) хлорангидрида фумаровой кислоты. Реакционную смесь перемешивают при нагревании (50°C) в течение часа, а затем при охлаждении водой со льдом прибавили по каплям 5 мл метанола. Через 2 часа избыток метанола удаляют в вакууме, а остаток растворяют в бензоле. Органический слой промывают 50 мл насыщенного раствора Na2CO3, затем 100 мл воды, а затем высушивают над MgSO4 и растворитель удаляют в вакууме. Остаток используют в дальнейшем без дополнительной очистки. Выход 6.3 г (96%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=6.40 (д, 1H), 5.90 (д, 1H), 3.70 (с, 3H), 3.62 (с, 3H), 3.42 (с, 3H), 2.98 (дд, 1H), 2.87 (д, 1H), 1.99 (м, 1H), 1.66 (м, 1H), 1.16 (с, 3H).
2,3-Бис(гидроксиметил)-1-метил-4 метоксибицикло[2.2.2]окт-5-ен. К 1.2 г (31 ммоль) суспензии LiAlH4 в 50 мл абсолютного эфира прикапывают раствор диметилового эфира 1-метил-4-метоксибицикло[2.2.2]окт-5-ен-2,3 дикарбоновой кислоты (6.3 г, 23.5 ммоль) в 40 мл абсолютного диэтилового эфира. Реакционную смесь кипятят в течение 3 часов. Затем при охлаждении обрабатывают 100 мл 10%-го раствора HCl, промывают 100 мл насыщенного раствора NaHCO3 и 100 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над Na2SO4, растворитель отгоняют в вакууме. Закристаллизовавшийся продукт используют без дополнительной очистки. Выход 4.7 г (94%).
Спектр ЯМР 1H (400МГц, CSCl3): δ=6.36 (д, 1H), 5.82 д, 1H), 3.90 (м, 1H), 3.73 (м, 2H), 3.61 (уш.с, 3H), 3.47 (м, 1H), 3.37 (с, 3H), 1.50 (м, 8H), 1.25 (м, 2H), 1.13 (с, 3H).
2,3-Бис(гидроксиметил)-1-метил-4-метоксибицикло[2.2.2]октан.
Смесь 4.7 г (22 ммоль) 2,3-Бис(гидроксиметил)-1-метил-4
метоксибицикло[2.2.2]окт-5-ена и 200 мг Pd/C в 30 мл метанола гидрируют водородом в течение 5 часов. По окончании реакции реакционную смесь отфильтровывают, растворитель отгоняют в вакууме. Выход продукта 4.4 г (94%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=4.07 (уш.с, 2H), 3.80 (м, 2H), 3.40 (м, 2H), 3.16 (с, 3H), 1.89 (м, 1H), 1.63 (м, 5H), 1.41 (м, 4H), 0.82 (с, 3H).
Дитозилат 2,3-бис(гидроксиметил)-1-метил-4-метоксибицикло[2.2.2]октана. Смесь 4.4 г (20 ммоль) 2,3-бис(гидроксиметил)-1-метил-4-метоксибицикло[2.2.2]октана, 15.2 г (80 ммоль) п-толуолсульфохлорида и 6.5 мл (80 ммоль) пиридина в 30 мл диэтилового эфира кипятят в течение 48 ч. Затем отфильтровывают выпавший осадок, фильтрат промывают 100 мл 5%-го раствора соляной кислоты, 100 мл насыщенного раствора NaHCO3, 200 мл воды и 50 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель отгоняют в вакууме. Остаток перекристаллизовают из этанола. Выход 4 г (38%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.73 (м, 4H), 7.31 (м, 4H), 4.03 (м, 2H), 3.93 (м, 2H), 2.91 (с, 3H), 2.39 (с, 6H), 1.76 (м, 1H), 1.55 (м, 4H), 1.35 (м, 5H), 0.69 (с, 3H).
({3-[(дифенилфосфино)метил]-4-метокси-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин. К раствору 4 г (15.3 ммоль) трифенилфосфина в 20 мл абсолютного тетрагидрофурана добавляют 0.2 г (31 ммоль) мелкоизмельченного металлического лития и перемешивают реакционную смесь при комнатной температуре в течение 12 ч. Затем прибавляют по каплям раствор 4 г (76.5 ммоль) дитозилата 2,3-бис(гидроксиметил)-1-метил-4-метоксибицикло[2.2.2]октана в 10 мл абсолютного тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Затем обрабатывают 100 мл водного насыщенного раствора NH4Cl, 200 мл воды и 50 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель отгоняют в вакууме. Продукт выделяют флэш-хроматографией на колонке с силикагелем элюированием системой бензол-петролейный эфир (1:5), а затем бензолом. Выход 1.5 г (36%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.60 (м, 4H), 7.36 (м, 16H), 2.83 (с, 3H), 2.53 (м, 2H), 2.10 (м, 1H), 1.95-1.42 (м., 11H), 0.81 (с, 3H). Спектр ЯМР 31P (161МГц, CDCl3, δ, м.д.): -20.21 (d, 1P), -23.15 (d, 1P).
Получают дифосфин 2 - ({3-[(дифенилфосфино)метил]-4-метокси-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин, соответствующий структурной формуле
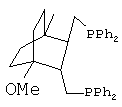
3. Синтез транс-({3-[(дифенилфосфино)метил]-4-изопропил-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфина (Дифосфин 3).
Диметиловый эфир транс-1-изопропил-4-метилбицикло[2.2.2]окт-5-ен-2,3-дикарбоновой кислоты. К 32 г (0.23 моль) а-терпинена прибавляют по каплям 25 мл (0.23 моль) хлорангрида фумаровой кислоты. Реакционную смесь перемешивают в течение часа при нагревании (50°C). Затем к реакционной смеси прибавляют по каплям 50 мл метанола при охлаждении водой со льдом. Реакционную смесь кипятят 1 час, избыток метанола упаривают в вакууме, полученный продукт используют в дальнейшем без очистки. Выход 54 г (83%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=6.15 (дд, 1H), 6.03(дд, 1H), 4.08 (уш.с, 1H), 3.68 (с, 3H), 3.63(с, 1H), 2.71 (м, 2H), 1.81 (м, 2H), 1.58 (м, 3H), 1.18 (с, 3H), 1.04 (м, 3H), 0.95(м, 3H).
Диметиловый эфир транс-1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты. Смесь 54 г (0.19 моль) диметилового эфира 1-изопропил-4-метилбицикло[2.2.2]окт-5-ен-2,3-дикарбоновой кислоты и 1 г катализатора Pd/C в 250 мл метанола гидрируют водородом при комнатной температуре в течение 4 часов. По окончании реакции смесь отфильтровывают, растворитель упаривают в вакууме. Выход продукта 52.5 г (97%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=3.67 (с, 3H), 3.65 (с, 3H), 3.02 (дц, 1H), 2.65 (дд, 1H), 1.75 (м, 2H), 1.55 (м, 4H), 1.38 (м, 2H), 1.21 (м, 1H), 0.87 (д, 3H), 0.84 (с, 3H), 0.80 (д, 3H).
Транс-1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновая кислота. К раствору 24 г (0.085 моль) диметилового эфира 1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты в 200 мл тетрагидрофурана прибавляют небольшими порциями 11.2 г, (0.2 моль) тонкоизмельченного КОН и кипятят смесь в течение 7 часов. По окончании реакции смесь обрабатывают 500 мл воды, добавляют соляной кислоты до кислой реакции среды, выпавший осадок отфильтровывают, промывают гексаном и высушивают. Выход 14 г (64.7%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=3.11 (д, 1H), 2.76 (д, 1H), 1.37-1.18 (группа сигналов, 8H), 0.98 (с, 3H), 0.95 (д, 3H), 0.84 (д, 3H).
Диметиловый эфир 1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты. Смесь 30 г (0.19 моль) 1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты, 26 мл (0.35 моль) SOCl2, 100 мл бензола и нескольких капель ДМФА кипятят в течение часа. Затем растворитель и избыток SOCl2 отгоняют в вакууме, к остатку прибавляют по каплям 20 мл метанола и кипятят смесь в течение 2 часов. Затем бензол и избыток метанола упаривают в вакууме, полученный продукт используют без очистки. Выход 12.5 г (75%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=3.67 (с, 3H), 3.65 (с, 3H), 3.02 (дд, 1H), 2.65 (дд, 1H), 1.75 (м, 2H), 1.55 (м, 4H), 1.38 м, 2H), 1.21 (м, 1H), 0.87 (д, 3H), 0.84 (с, 3H), 0.80 (д, 3H).
Транс-2,3-бис(гидроксиметил)-1-изопропил-4 метилбицикло[2.2.2]октан. К суспензии 2.5 г (66 ммоль) LiAlH4 в 50 мл абсолютного диэтилового эфира добавляют по каплям раствор 12.5 г (44 ммоль) диметилового эфира 1-изопропил-4-метилбицикло[2.2.2]октан-2,3-дикарбоновой кислоты в 30 мл абсолютного диэтилового эфира при перемешивании. Через 12 часов реакционную смесь кипятят в течение 3 часов, охлаждают, обрабатывают 200 мл 20%-го раствора H2SO4, затем 100 мл воды и, наконец, 100 мл насыщенного водного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель упаривают в вакууме, полученный продукт используют без очистки. Выход 8.0 г (80%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=4.43 (с, 2H), 3.86(м, 2H), 3.27 (м, 2H), 1.73 (д, 1H), 1.56 (м, 2H), 1.41 (м, 5H), 1.21 (м, 3H), 0.85 (с, 6H), 0.78 (д, 3H).
Дитозилат./иранс-2,3-бис(гидроксиметил)-1-изопропил-4 метилбицикло[2.2.2]октана. Смесь 4 г (17.7 ммоль) транс-2,3-бис(гидроксиметил)-1-изопропил-4 метилбицикло[2.2.2]октана, 13.5 г (70.8 ммоль) п-толуолсульфохлорида и 5.7 мл (70.8 ммоль) пиридина в 30 мл диэтилового эфира кипятят в течение 48 часов. Затем отфильтровывают выпавший осадок, фильтрат промывают 50 мл 10%-го раствора соляной кислоты, 100 мл насыщенного раствора NaHCO3, 100 мл воды и 50 мл насыщенного раствора NaCl. Органический слой отделяют и высушивают над MfSO4, растворитель упаривают в вакууме. Остаток перекристаллизовывают из этанола. Выход 4.8 г (51%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.80 (дд, 4H), 7.37 (дд, 4H), 4.08 (м, 2H), 3.87 (м, 2H), 2.47 (д, 6H), 1.55 (м, 2H), 1.35 (м, 5H), 1.18 (м, 3H), 1.02 (м, 1H), 0.74 (с, 3H), 0.70 (д, 3H), 0.58 (с, 3H).
({3-[(дифенилфосфино)метил]-4-изопропил-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин. К раствору 11.8 г (45 ммоль) трифенилфосфина в 100 мл абсолютном тетрагидрофуране добавляют 0.63 г (90 ммоль) мелкоизмельченного металлического лития. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. Затем при охлаждении (-70°C) прибавляют раствор 14.5 г (27 ммоль) дитозилата транс-2,3-бис(гидроксиметил)-1 -изопропил-4 метилбицикло[2.2.2]октана в 50 мл абсолютного тетрагидрофурана. Реакционную смесь перемешивают при комнатной температуре в течение 12 часов. Затем обрабатывают 100 мл насыщенного водного раствора хлорида аммония, 30 мл 10%-го раствора H2SO4, 100 мл воды и 50 мл насыщенного водного раствора NaCl. Органический слой отделяют и высушивают над MgSO4, растворитель упаривают в вакууме. Остаток растворяют в петролейном эфире, профильтровывают через слой Al2O3, фильтрат упаривают в вакууме. Остаток промывают пентаном и высушивают. Выход 4.5 г (36%).
Спектр ЯМР 1H (400МГц, CDCl3): δ=7.63 (м, 4H), 7.34 (м, 16H), 2.52 (м, 2H), 1.87 (м, 1H), 1.71 (м, 3H), 1.60 (м, 2H), 1.40 (м, 5H), 1.19 (м, 2H), 0.81 (с, 3H), 0.73 (д, 3H), 0.40 (д, 3H). ЯМР 31Р (161МГц, CDCl3): δ=-23.37 (д, 1P), -25.23 (д, 1P).
Получают дифосфин 3- ({3-[(дифенилфосфино)метил]-4-изопропил-1-метилбицикло[2.2.2]окт-2-ил}метил)(дифенил)фосфин, соответствующий структурной формуле
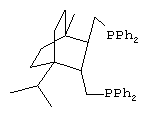
Обнаружено, что синтезированные новые дифосфины обладают промотирующими свойствами по отношению к катализатору гидрокарбометоксилирования алкенов с синтезом сложных эфиров и исследованы в этой реакции.
Методика гидрокарбометоксилирования алкенов и анализа реакционной массы.
Синтез сложных эфиров гидрокарбоалкоксилированием алкенов проводят в периодическом реакторе, который представляет собой автоклав, снабженный рубашкой для обогрева и пробоотборником. В качестве спирта в настоящей работе используют метанол, а в качестве кислоты - толуолсульфокислоту (ТСК).
Гидрокарбоалкоксилирование алкенов (с синтезом сложных эфиров) проводят в периодическом реакторе, который представляет собой автоклав, снабженный рубашкой для обогрева и пробоотборником. Автоклав вместимостью 120 мл изготовлен из диамагнитной нержавеющей стали X18H10T, что обеспечивает возможность эффективного перемешивания с помощью магнитной мешалки. Температуру в автоклаве контролируют с помощью предварительно откалиброванной хромель-копелевой термопары. Поддержание заданной температуры в реакторе обеспечивают циркулированием через рубашку термостатируемого высокотемпературного органического теплоносителя (ВОТ). Давление в автоклаве измеряют образцовым манометром, закрепленным на его крышке.
Эксперимент включает следующую последовательность операций. В автоклав загружают раствор, содержащий все реагенты (см. Таблицу 2) и внутренний стандарт для хроматографии в растворителе (толуоле). Компоненты каталитической системы помещают в корзинку, которая располагается в верхней части автоклава над раствором; автоклав закрывают, дважды продувают инертным газом и дважды CO. Затем автоклав заполняют CO до достижения давления 0,5-1,0 МПа и нагревают реакционную массу до заданной температуры (см. Таблицу 2) при интенсивном ее перемешивании. При достижении заданной температуры давление доводят до установленного значения (2,1 МПа), в реакционную массу опускают шток с корзинкой, содержащей компоненты каталитической системы, обеспечивая ее ввод в реакционное пространство (момент ввода компонентов каталитической системы принимают за время начала реакции). По окончании опыта автоклав охлаждают, сбрасывают давление и извлекают реакционную массу.
Анализ реакционной массы гидрокарбометоксилирования проводят методом газо-жидкостной хроматографии на хроматографе «Цвет 162» с пламенно-ионизационным детектором.
Хроматографические расчеты проводят в программе МультиХром. Хроматографические пики реагентов и продуктов идентифицируют по временам удерживания, а содержание компонентов определяют методом внутреннего стандарта (в случае анализа реакционной массы гидрокарбометоксилирования циклогексена и октена-1) и внутренней нормализации (в случае анализа реакционной массы гидрокарбометоксилирования стирола). В качестве внутреннего стандарта используют о-ксилол. Точность определений концентраций реагентов и продуктов реакции составляет±3%.
Все опыты проводят в среде толуола при Рсо=2,1 МПа; концентрации, моль/л: [Pd(OAc)2]=0,001, [TsOH]=0,012, [мономер]=0,1, [СН3ОН]=0,45.
Примеры 1-4.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, при различных температурах - 80°C, 95°C, 105°C и 115°C соответственно в присутствии каталитической системы, промотированной дифосфином 1 при соотношении дифосфин/Pd, равном 1.
Результаты экспериментов приведены в Таблице 2.
Пример 5.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином 1 при соотношении дифосфин/Pd, равном 1 при 105°C, и времени гидрокарбоалкоксилирования, равном 90 мин.
Результаты экспериментов приведены в Таблице 2.
Пример 6.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием октена-1, как описано выше, в присутствии каталитической системы, промотированной дифосфином 1 при соотношении дифосфин/Pd, равном 1 при 80°C, и времени гидрокарбоалкоксилирования, равном 180 мин.
Результаты экспериментов приведены в Таблице 2.
Пример 7
Проводят синтез сложных эфиров гидрокарбоалкоксилированием стирола, как описано выше, в присутствии каталитической системы, промотированной дифосфином 1 при соотношении дифосфин/Pd, равном 1 при 80°C, и времени гидрокарбоалкоксилирования, равном 360 мин.
Результаты экспериментов приведены в Таблице 2.
Пример 8.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином 2 при соотношении дифосфин/Pd, равном 3 при 105°C, и времени гидрокарбоалкоксилирования, равном 180 мин.
Результаты экспериментов приведены в Таблице 2.
Пример 9.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином 2 при соотношении дифосфин/Pd, равном 1 при 105°C, и времени гидрокарбоалкоксилирования, равном 180 мин.
Результаты экспериментов приведены в Таблице 2.
Примеры 10-11.
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином 3 при соотношении дифосфин/Pd, равном 1 при 105°C, и времени гидрокарбоалкоксилирования, равном 90 и 180 мин соответственно.
Результаты экспериментов приведены в Таблице 2.
Пример 12 (сравнительный).
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином - транс-({3-[(дифенилфосфино)метил] бицикло[2.2.2]окт-2-ил}метил)-(дифенил)фосфина, соответсвующим структурной формуле
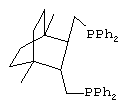 ,
,
и синтезированном по методике, описанной [Dang,T.P. et al. Journal of Organometallic Chemistry, 1975, vol. 91, p.105 - 115].
Этот дифосфин ближе по структуре к новым синтезированным дифосфинам, но хуже по достигаемому результату, чем дифосфин, выбранный за прототип.
Так, при оптимальных условиях гидрокарбоалкоксилирования циклогексена (при температуре 105°C и времени гидрокарбоалкоксилирования 180 мин) в присутствии каталитической системы, промотированной сравнительным дифосфином при соотношении дифосфин/Pd, равном 1, достигается конверсия 94.5% масс.
Результаты экспериментов приведены в Таблице 2.
Пример 13 (сравнительный по прототипу).
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной дифосфином - прототипом - транс-2,3-Бис-(дифенфосфинометил)норборнан, полученным по методике, и отвечающим структурной формуле, как указано ранее.
Так, при оптимальных условиях гидрокарбоалкоксилирования циклогексена (при температуре 105°C и времени гидрокарбоалкоксилирования 180 мин) в присутствии каталитической системы, промотированной дифосфином - прототипом при соотношении дифосфин/Pd, равном 3,5, достигается конверсия 100,0% масс. Однако при снижении соотношения дифосфин/Pd до 1 (пример 14), конверсия падает до 28.0% масс.
Результаты экспериментов приведены в Таблице 2.
Примеры 15-16 (сравнительные).
Проводят синтез сложных эфиров гидрокарбоалкоксилированием циклогексена, как описано выше, в присутствии каталитической системы, промотированной известным фосфином Ph3P при соотношении фосфин/Pd, равном 65/1 и 2/1, достигается конверсия 27,2 и 2,5% масс, соответственно.
Результаты экспериментов приведены в Таблице 2.
|
|
Таким образом, предлагаемое техническое решение позволяет проводить синтез сложных эфиров заданного состава эффективным способом с достижением высокой степени конверсии при отсутствии избытка дифосфина или же избытке не более 3 по отношению к палладию.