Результат интеллектуальной деятельности: ВЫСОКОДИСПЕРСНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ БУДЕСОНИДА С БЕТА-ГЛИЦИНОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области химико-фармацевтической промышленности, в частности к способам создания аэрозольных композиций, используемых для введения лекарственных средств с помощью ингаляции, в том числе фармацевтических аэрозольных композиций, которые включают в качестве лекарственного вещества будесонид.
Для заболеваний с локализацией патологического процесса в дыхательных путях наиболее логичным представляется местное применение лекарственных веществ путем ингаляций. Известно, что существенным преимуществом ингаляционной терапии является достижение высокой концентрации лекарственного средства в дыхательных путях при незначительном общем количестве препарата и низкой его концентрации во всем организме. В настоящее время порошковые ингаляторы получили широкое распространение как средства доставки ингаляционных лекарственных форм вследствие простоты и удобства в использовании, в особенности для комбинированной терапии; кроме того, при их использовании исключается раздражающее действие пропеллентов и вспомогательных растворителей на слизистую оболочку дыхательных путей.
Ингаляционные глюкокортикостероиды являются наиболее эффективным средством лечения бронхиальной астмы. Механизм их лечебного действия связан с мощным противовоспалительным эффектом. Ингаляционные глюкокортикостероиды оказывают влияние на все фазы воспаления, независимо от его природы, при этом ключевой клеточной мишенью могут являться эпителиальные клетки дыхательных путей. Помимо уменьшения воспалительного отека слизистой и гиперреактивности бронхов ингаляционные глюкокортикостероиды улучшают функцию b2-адренорецепторов как путем синтеза новых рецепторов, так и повышая их чувствительность. Ингаляционное применение глюкокортикостероидов создает высокие концентрации препаратов в дыхательных путях, что обеспечивает максимально выраженный местный (желательный) противовоспалительный эффект и минимальные проявления системных (нежелательных) эффектов. Согласно [Середа В.П., Свистов А.С. "Ингаляционная терапия хронических обструктивных заболеваний легких" // ФАРМиндекс: Практик, 2003, вып.4] наибольшим преимуществом с точки зрения выраженности местного противовоспалительного эффекта и минимального риска системных побочных эффектов обладают флютикасона пропионат и будесонид.
Известны способы получения сухих ингаляционных составов для лечения бронхиальной астмы, содержащих микронизированные лекарственные вещества в смеси с наполнителем / наполнителями, такими как лактоза, бензоат натрия, бензойная кислота и др. [Патент РФ №2054932, опубл. 27.02.1996 г.; Патент РФ №2071317, опубл. 10.01.1997 г.; Патент РФ №2242972, опубл. 27.12.2004 г.]. В качестве основных проблем, характерных для данных способов, являются:
1) сложность обеспечения однородности получаемой композиции при смешивании порошков различной морфологии и гранулометрического состава;
2) высокая степень адгезионного и когезионного взаимодействия, что приводит к слеживаемости, снижению сыпучести и неполному разделению смеси при аэрозолизации и, как следствие, снижению количества лекарственного вещества, доставляемого в легкие (респирабельная фракция).
Известен способ получения высокодисперсных композиций сальбутамола (прототип) для использования в порошковых ингаляторах [Ekaterina G. Zevak, Andrey G. Ogienko, Elena V. Boldyreva, Svetlana A. Myz, Anna A. Ogienko, Yuliya E. Kovalenko, Boris A. Kolesov, Valery A. Drebushchak, Nikolay A. Trofimov, Alexander A. Krasnikov, Andrey Y. Manakov, Vladimir V. Boldyrev. Salbutamol-Glycine Composite Microballs for Pulmonary Drug Delivery. // RDD Europe 2013 (2013), Vol 2, pp 329-334], основанный на сублимационной сушке замороженных распылением в емкость с жидким азотом растворов, содержащих одновременно лекарственное вещество (сальбутамол) и носитель (глицин), в смешанном растворителе тетрагидрофуран-вода (~22,5 масс.% тетрагидрофурана). Получаемые по данному способу композиции представляют собой чрезвычайно легкие пушистые порошки, состоящие из пористых сферических агломератов (диаметр 30-70 мкм), состоящих из объединенных в перфорированные слои отдельных частиц, размер которых составляет несколько десятков нанометров. В этих композициях лекарственное вещество равномерно распределено на молекулярном уровне между наноразмерными блоками глицина. Для этих композиций характерны высокие значения удельной площадью поверхности (24,4-29,1 м2/г), низкая насыпная плотность (0,465 г композиции занимает объем ~25 мл, что составляет менее 0,02 г/см3) и чрезвычайно высокие значения респирабельной фракции (67,4±2,3%).
В предлагаемом изобретении вместо сальбутамола в качестве лекарственного вещества предложен будесонид. Из уровня техники подобной двухкомпонентной фармацевтической композиции для создания ингаляционной лекарственной формы для лечения бронхиальной астмы не обнаружено.
Задачей настоящего изобретения является получение высокодисперсной фармацевтической композиции будесонида с низкой насыпной плотностью, где в качестве носителя выступает бета-глицин.
Технический результат состоит в том, что получаемые композиции представляют собой порошки, состоящие из пористых сферических агломератов (диаметр до 50 мкм) и отдельных фрагментов, образовавшихся при разрушении агломератов, которые представляют собой совокупность объединенных в перфорированные слои отдельных частиц, характеризующиеся насыпной плотностью 0,008-0,035 г/см3, при этом будесонид диспергирован между наноразмерными блоками хорошо растворимого вещества-носителя (метастабильной полиморфной модификации глицина). При этом, в отличие от композиций, представляющих собой микронизированные субстанции лекарственных веществ либо их смеси с грубодисперсными носителями, для получаемых по данному способу композиций характерно отсутствие слеживания при хранении.
Таким образом, достигаются повышение однородности получаемой композиции, удобство при создании готовых форм и дозировании, вследствие уже имеющегося разбавления носителем, высокие скорости высвобождения лекарственного вещества в организме, отсутствие у композиций склонности к агломерации.
Поставленная задача была решена быстрым охлаждением растворов исходных веществ (будесонида и α-глицина) в смешанном растворителе тетрагидрофуран-вода с концентрацией тетрагидрофурана 20-25 масс.%, с последующим ступенчатым повышением температуры при пониженном давлении в токе сухого азота при давлении 600 мТорр до падения давления менее 8 мТорр: в интервале от -196°C до -5°C для разложения образующегося в системе тетрагидрофуран-вода клатратного гидрата и удаления компонентов используемой смеси растворителей сублимацией, затем от -5°C до +30°C для удаления остаточной влаги.
При этом используют исходные вещества будесонид и α-глицин в смешанном растворителе тетрагидрофуран-вода (с концентрацией тетрагидрофурана 20-25 масс.%) при соотношении: будесонид от 0,25 до 0,9 мг/г растворителя, α-глицин от 8 до 50 мг/г растворителя.
Обоснование введенных признаков
1. Выбор соотношения компонентов
Вследствие чрезвычайно малой растворимости будесонида в воде, оптимальный для данного метода диапазон концентраций используемого смешанного растворителя тетрагидрофуран (ТГФ) - вода составляет от 20 до 25 масс.% ТГФ (по результатам проведенных нами экспериментов максимальная растворимость будесонида составляет 0,9 мг/г смешанного растворителя (при +30°C)). При меньшем содержании ТГФ растворимость будесонида не будет существенно отличаться от растворимости в воде и использование добавки ТГФ не будет оправдано. При большем содержании ТГФ в используемых растворах, при охлаждении с использованием указанного способа, произойдет смещение фигуративной точки системы в подсистему «клатратный гидрат-тетрагидрофуран», где уже при -109°C произойдет появление некоторых количеств жидкой фазы (раствор воды в тетрагидрофуране), что приведет к растворению и последующей кристаллизации лекарственного вещества и, как следствие, невозможности контролируемого получения композиций с требуемыми свойствами (в первую очередь, размер частиц, удельная площадь поверхности).
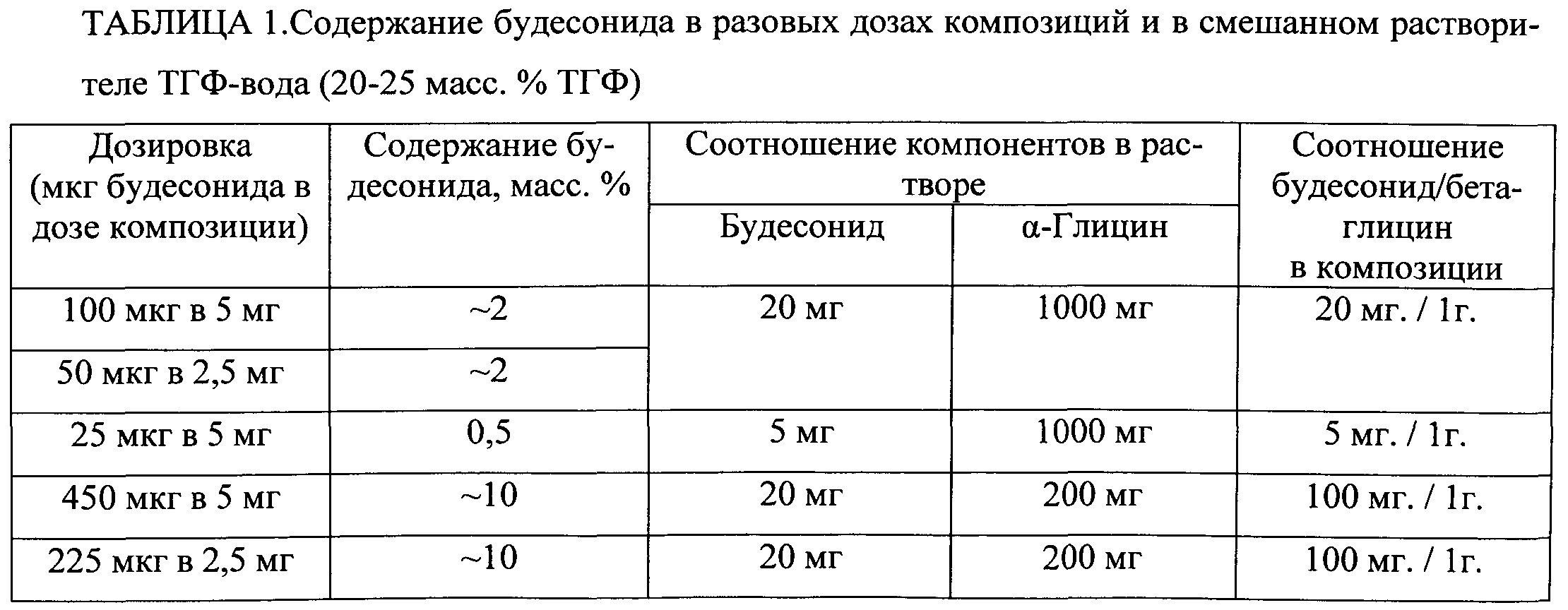
Ориентировочные данные по содержанию будесонида в разовых дозах композиций, которые мы использовали для расчета необходимых концентраций будесонида и α-глицина в смешанном растворителе ТГФ-вода (20-25 масс.% ТГФ), приведены в Табл.1. Соотношение будесонид:бета-глицин в композиции и, следовательно, диапазон используемых концентраций α-глицина в используемом смешанном растворителе ТГФ-вода (20-25 масс.% ТГФ) выбирали таким образом, чтобы содержание будесонида в одной дозе композиции (5 мг либо 2,5 мг в капсуле для ингаляторов сухого порошка) находилось в диапазоне используемых терапевтических доз (от 25 мкг в 5 мг до 450 мкг в 5 мг). Таким образом, поскольку максимальное количество сухих веществ (будесонид и α-глицин) лимитируется растворимостью будесонида в используемом смешанном растворителе ТГФ-вода (20-25 масс.% ТГФ), то для композиций с содержанием будесонида 2 масс.% и менее целесообразно использовать концентрацию глицина 50 мг/г смешанного растворителя (при этом концентрация будесонида может варьироваться от 0,25 до 0,9 мг/г растворителя). Для создания композиций с содержанием будесонида от 2 до 10 масс.% необходимо снижать концентрацию α-глицина (до 8 мг/г растворителя) при использовании максимально возможной концентрации будесонида в растворе (0,9 мг/г растворителя). Снижение одновременно концентрации будесонида (от максимально возможной) и α-глицина для создания фармацевтической композиции с содержанием будесонида от 2 до 10 масс.% экономически нецелесообразно.
2. Определение температуры основной стадии сушки
Эксперименты ДСК с целью определения температуры плавления эвтектики в системе будесонид - вода проводили с использованием DSC-204 (Netzsch). При температуре жидкого азота в ступке растирали будесонид и лед, полученную смесь помещали в стандартный алюминиевый держатель (40 мкл), также охлажденный до температуры жидкого азота, который помещали в предварительно охлажденную до -40°C ячейку калориметра. Эксперимент проводили при нагревании со скоростью 0,5°/мин в токе аргона высокой чистоты (15 мл/мин). Массу загруженного образца определяли как разницу массы тигля до охлаждения и сразу же после окончания эксперимента. Содержание воды в доэвтектической смеси определяли по потере массы при высушивании в течение 2 дней после окончания эксперимента (до постоянной массы). Каждый эксперимент проводили трижды. Согласно результатам проведенных экспериментов температура плавления эвтектики в системе будесонид-вода составляет -0,1±0,05°C.
Известны данные по определению температур плавления эвтектик в системах «полиморфная модификация глицина-вода» [V.A. Drebushchak, A.G. Ogienko, E.V. Boldyreva Polymorphic effects at the eutectic melting in the H2O-glycine system / J. Therm. Analys. Calorim., 2013, 111(3), pp. 2187-2194], согласно которым температура плавления эвтектики в системе «β-глицин-вода» составляет -3,6°C. Однако в работе [Suzuki Т., Franks F. Solid-liquid phase transitions and amorphous states in ternary sucrose-glycine-water systems. // Journal of the Chemical Society, Faraday Transactions, 1993, V.89, p.3283-3288] температура плавления эвтектики в системе глицин-вода была определена как -4,7°C, без указания конкретной полиморфной модификации глицина (возможно, смесь полиморфных модификаций), поэтому мы определяем температуру -5°C как лимитирующую для основной стадии сушки (в случае возможного образования смеси полиморфных модификаций при охлаждении раствора/отжиге получающейся смеси твердых фаз).
Примеры реализации способа
Материалы и методы
В работе использовали товарный реактив будесонида (Sigma Aldrich), очищенный согласно [Boldyreva E.V., Drebushchak V.A., Drebushchak T.N., Paukov I.E., Kovalevskaya Y.A., Shutova E.S. Polymorphism of glycine. Thermodinamic aspects. Part I. Relative stability of the polymorphs // Journal of Thermal Analysis and Calorimetry, 2003, V.73, p.409-418.] α-глицин; очищенный от перекисей тетрагидрофуран и дистиллированную воду.
Пример 1.
Композиция с содержанием 2,3 масс.% будесонида (23,5 мг. будесонида на 1 г бета-глицина)
В 27,5 г раствора ТГФ-вода (21,5 масс.% ТГФ) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 1,0 г α-глицина (36 мг/г растворителя) и 23,5 мг будесонида (0,85 мг/г растворителя). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1,1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до P<8 мТорр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -5°C. Сушку проводили в токе сухого азота (T=-5°C, P=600±20 мТорр) при постоянном откачивании до падения давления в камере до P<8 мТорр при отключении подачи азота. Затем температуру теплоносителя повышали до +30°C, с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до P=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Пример 2.
Композиция с содержанием 0,5 масс.% будесонида (5 мг будесонида на 1 г бета-глицина)
В 20,0 г раствора ТГФ-вода (25,5 масс.% ТГФ) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 1,0 г α-глицина (50,0 мг/г растворителя) и 5,0 мг будесонида (0,25 мг/г растворителя). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1,1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до P<8 мТорр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -5°C. Сушку проводили в токе сухого азота (Т=-5°C, P=600±20 мТорр) при постоянном откачивании до падения давления в камере до P<8 мТорр при отключении подачи азота. Затем температуру теплоносителя повышали до +30°C с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до P=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Пример 3.
Композиция с содержанием 1,9 масс.% будесонида (21 мг будесонида на 1 г бета-глицина)
В 23,0 г раствора ТГФ-вода (22,2 масс.% ТГФ) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 1.0 г α-глицина (43 мг/г растворителя) и 21,0 мг будесонида (0,9 мг/г растворителя). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1,1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до P<8 мТорр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -5°C. Сушку проводили в токе сухого азота (T=-5°C, P=600±20 мТорр) при постоянном откачивании до падения давления в камере до P<8 мТорр при отключении подачи азота. Затем температуру теплоносителя повышали до +30°C с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до P=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Пример 4.
Композиция с содержанием 9,7 масс.% будесонида (100 мг будесонида на 1 г бета-глицина)
В 24,7 г раствора ТГФ-вода (22,3 масс.% ТГФ) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 200 мг α-глицина (8,1 мг/г растворителя) и 21,0 мг будесонида (0,85 мг/г растворителя). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1,1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до P<8 мТорр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -5°C. Сушку проводили в токе сухого азота (T=-5°C, P=600±20 мТорр) при постоянном откачивании до падения давления в камере до P<8 мТорр при отключении подачи азота. Затем температуру теплоносителя повышали до +30°C, с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до P=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Пример 5.
Получение чистого бета-глицина в тех же условиях, что и вышеуказанные фармацевтические композиции
В 20,7 г раствора ТГФ-вода (22,2 масс.% ТГФ) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 1,04 г α-глицина (50 мг/г растворителя). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1,1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до P<8 мТорр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -5°C. Сушку проводили в токе сухого азота (T=-5°C, P=600±20 мТорр) при постоянном откачивании до падения давления в камере до P<8 мТорр при отключении подачи азота. Затем температуру теплоносителя повышали до +30°C, с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до P=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Характеристики получаемых по предлагаемому способу фармацевтических композиций
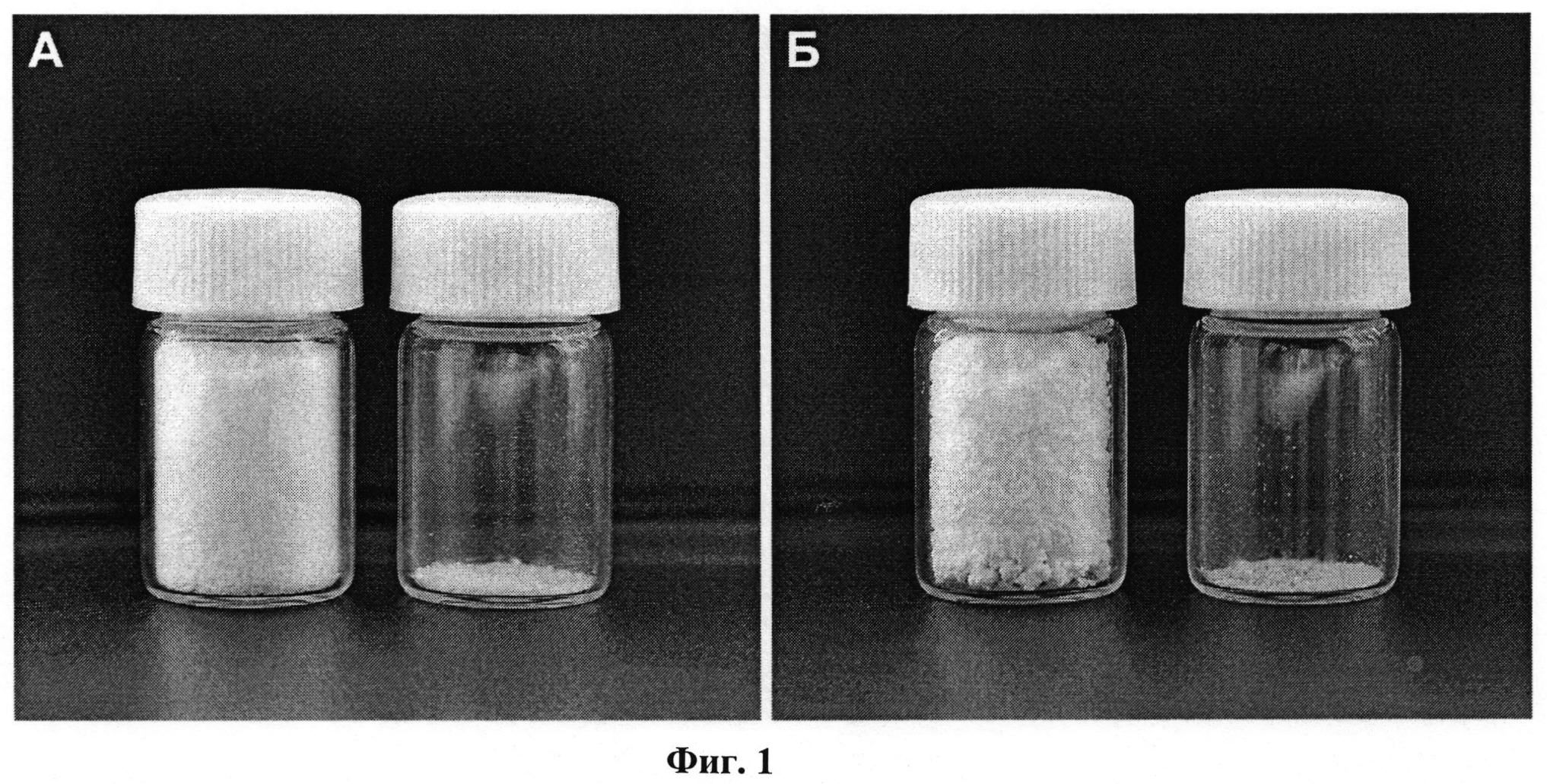
Образцы композиции «будесонид - бета-глицин», полученные по предлагаемому способу, представляют собой чрезвычайно легкие пушистые порошки. На Фиг.1 проиллюстрировано сравнение насыпных объемов полученных композиций и исходных субстанций товарного реактива будесонида и α-глицина (A: образцы композиции «будесонид - бета-глицин» (2,3 масс.% будесонида) (слева) и исходных товарного реактива будесонида и α-глицина (справа). Навески по 0,14 г. В емкости 7 мл содержится более 60 разовых доз по 50 мкг; Б: образцы композиции «будесонид - бета-глицин» (9,7 масс.% будесонида) (слева) и исходных товарного реактива будесонида и α-глицина (справа). Навески по 0.06 г. В емкости 7 мл содержится 25 разовых доз по 200 мкг (или примерно 12 разовых доз по 400 мкг).
Содержание будесонида в композициях контролировалось УФ-спектрофотометрически [Д.А. Кондуба, И.А. Прокопов, Е.Г. Хомутова, В.Л. Багирова. Исследование аэродинамических характеристик порошков с будесонидом для ингаляций. Фармация. 2011. №7, с.36-39], и приведено в примерах реализации способа.
Значения насыпной объемной плотности фармацевтических композиций и бета-глицина, полученного в тех же условиях, приведены в Таблице 2.
|
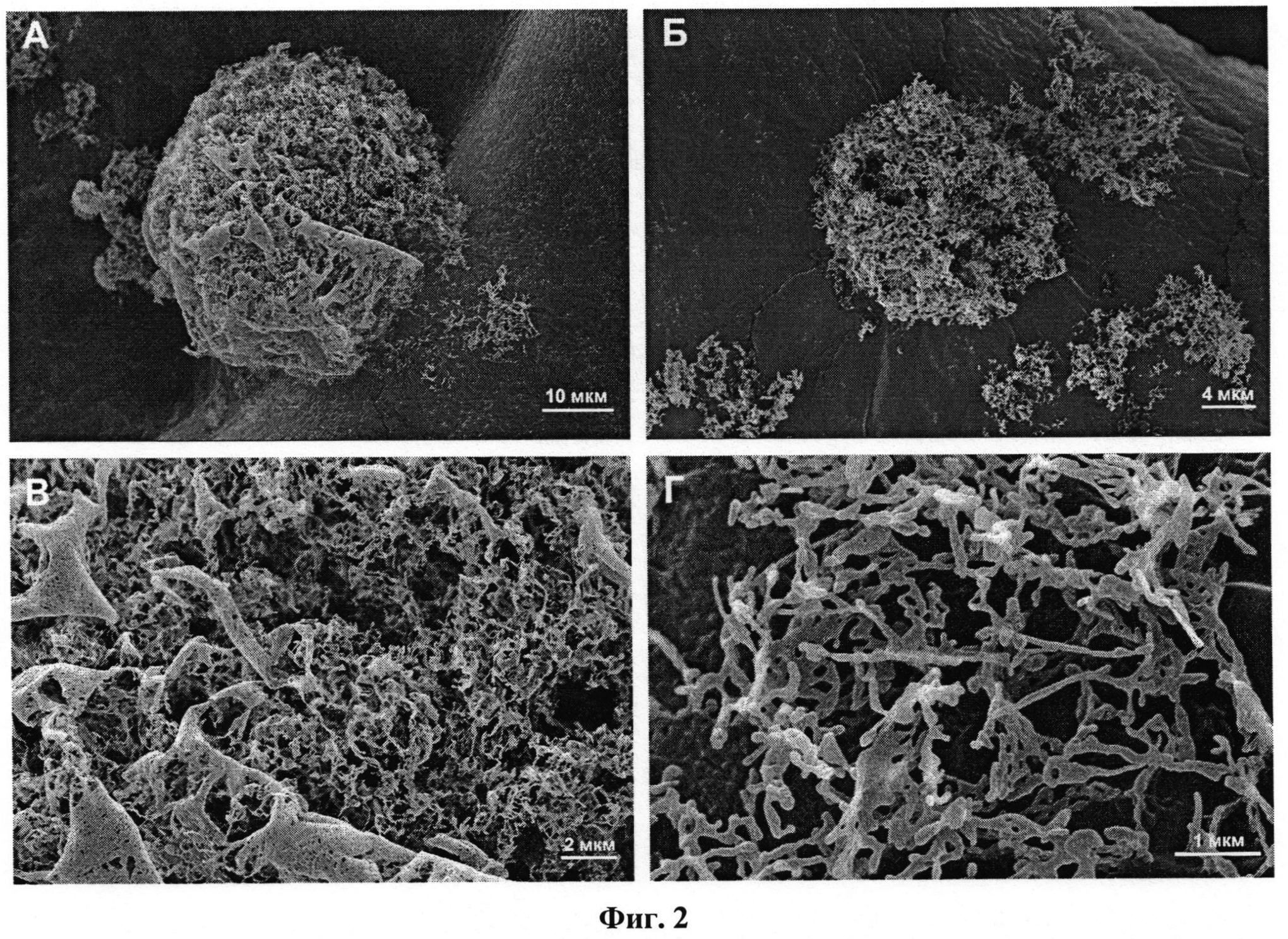
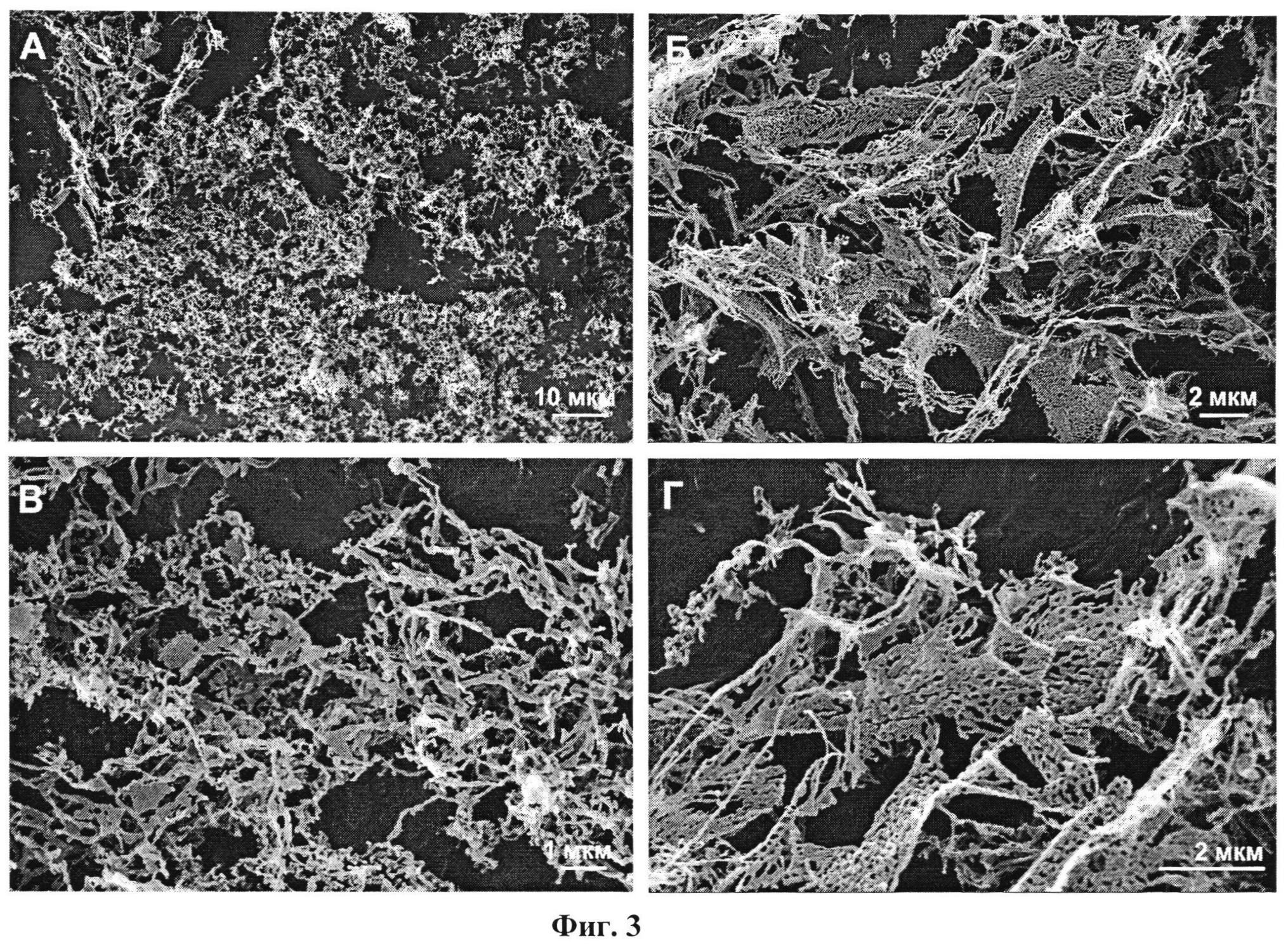
По данным сканирующей электронной микроскопии полученные композиции представляют собой совокупность пористых сферических агломератов (диаметром до 50 мкм) (Фиг.2,А-Д: электронные микрофотографии образцов композиции «будесонид - бета-глицин» (2,3 масс.% будесонида)) и отдельных фрагментов, образовавшихся при разрушении агломератов, (Фиг.3,А-Д: электронные микрофотографии образцов композиции «будесонид - бета-глицин» (9,7 масс.% будесонида)), которые представляют собой совокупность объединенных в перфорированные слои отдельных частиц, размер которых составляет несколько десятков нанометров.
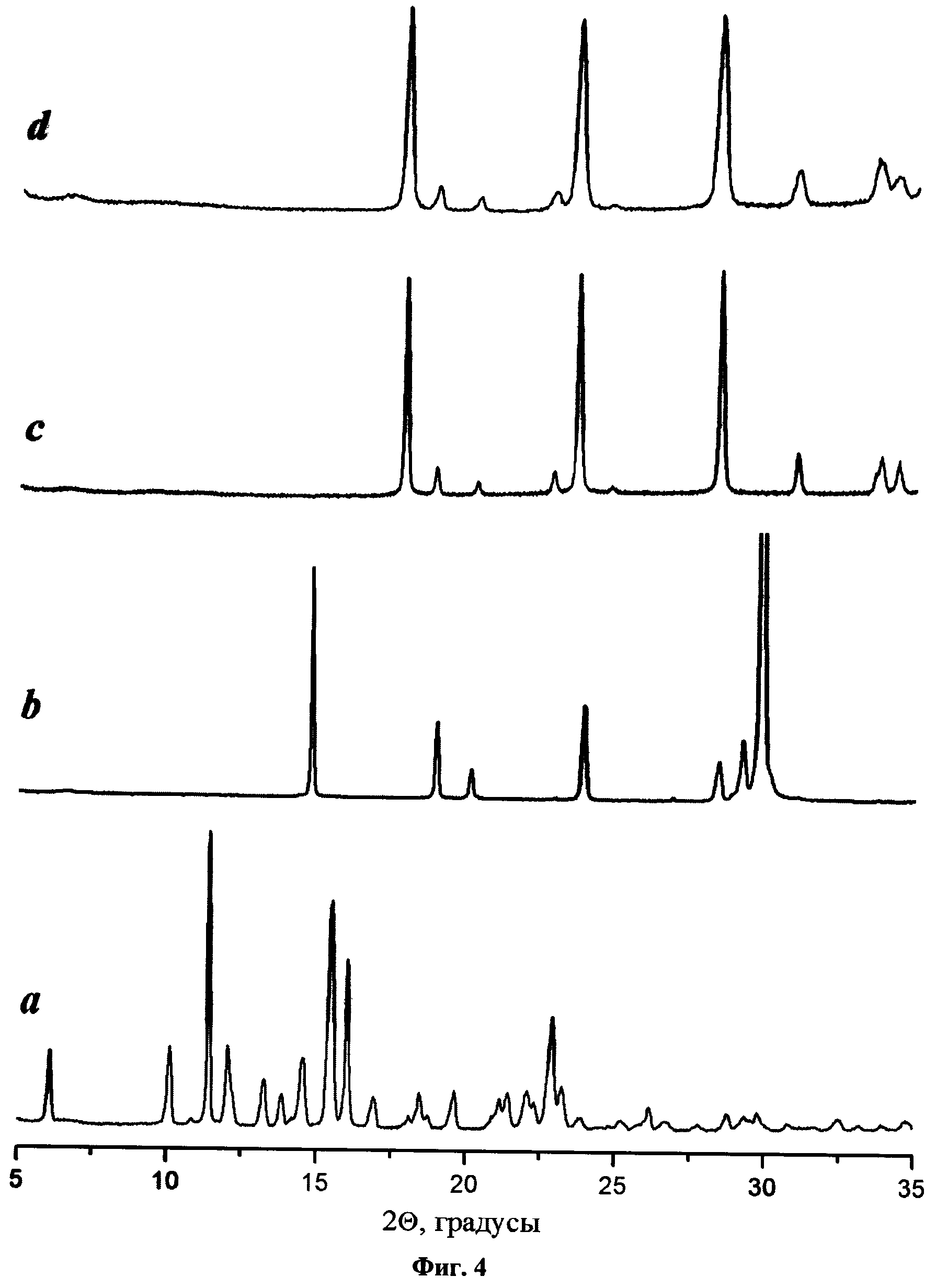
Сравнение порошковых дифрактограмм исходных субстанций и полученных образцов показало (Фиг.4, где а - поликристаллический образец будесонида; b - поликристаллический образец исходного α-глицина; c - образец бета-глицина, полученного в тех же условиях, что и вышеуказанные фармацевтические композиции; d - фармацевтическая композиция «будесонид - бета-глицин»), что во всех полученных образцах носитель присутствует в виде метастабильной β-модификации (бета-глицин), без примеси стабильных полиморфных модификаций; при этом во всех случаях происходит аморфизация будесонида.
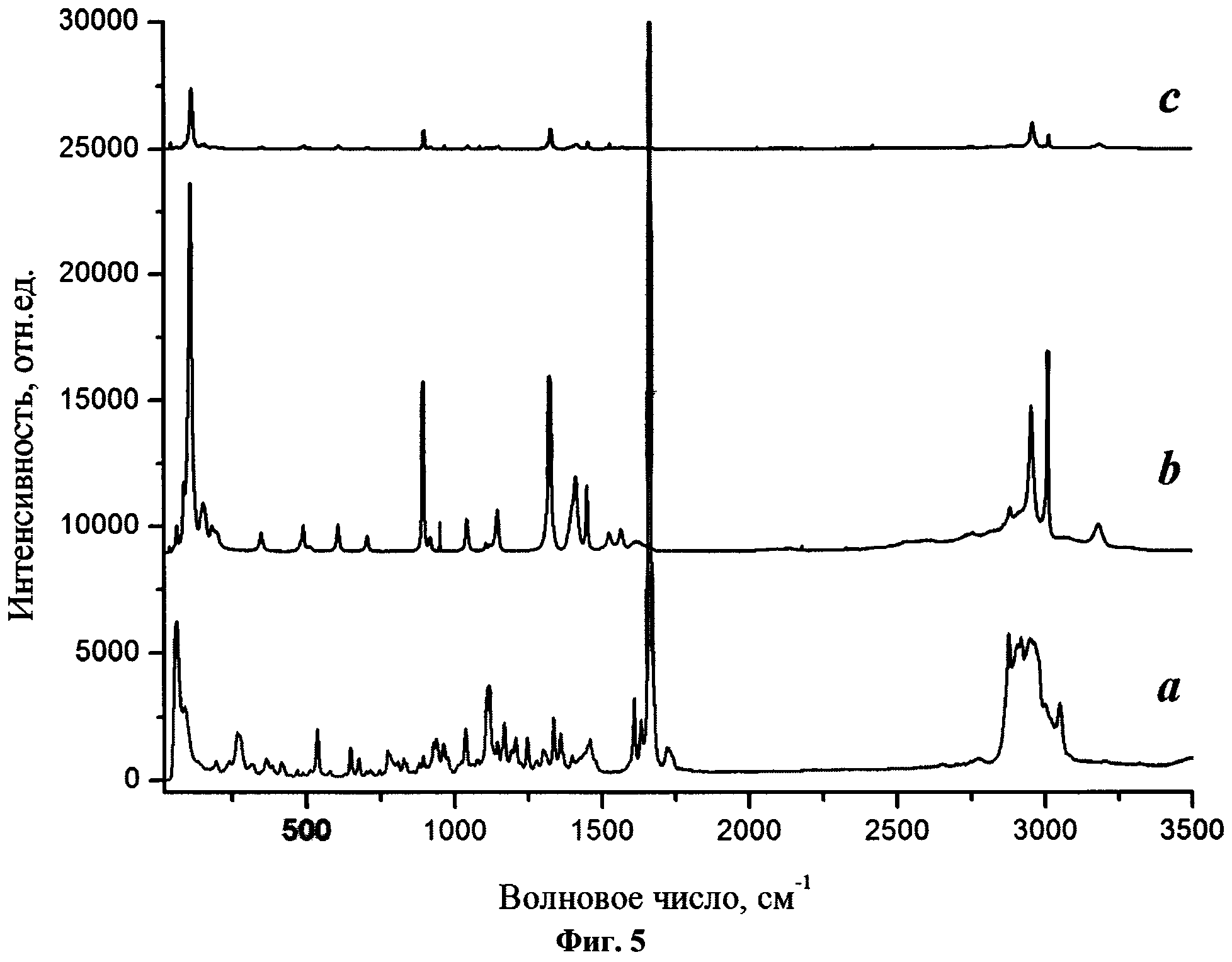
Результаты экспериментов с использованием спектроскопии КР показали (Фиг.5, где а - товарный реактив будесонида; b - образец бета-глицина, полученного в тех же условиях, что и вышеуказанные фармацевтические композиции; c - фармацевтическая композиция «будесонид - бета-глицин»), что каждое из индивидуальных веществ, т.е. бета-глицин и будесонид, характеризуются обычным кристаллическим состоянием, выражающимся наличием в спектрах узких колебательных линий как в области межмолекулярных (кристаллических) (50-200 см-1), так и внутримолекулярных колебаний (выше 200 см-1). В спектрах композиций только колебательные моды бета-глицина остаются в виде узких линий, сохраняя при этом неизменной область кристаллических колебаний. Моды внутримолекулярных колебаний будесонида наблюдаются как очень широкие полосы малой интенсивности, а моды кристаллических колебаний отсутствуют (ниже предела обнаружения).
Таким образом, в композициях:
1) не происходит включения молекул будесонида в кристаллическую решетку вспомогательного вещества, т.е. образования истинного твердого раствора [А.И. Китайгородский, «Молекулярные кристаллы», М., Наука, 1971, 424 с.];
2) молекулы будесонида не образуют собственной кристаллической фазы и, вероятно, равномерно распределены между наноразмерными блоками вспомогательного вещества.
Итак, получаемые по предлагаемому способу фармацевтические композиции гораздо удобнее использовать для создания готовых форм для вдыхания, чем микронизированные с использованием какого-либо способа субстанции лекарственных веществ с последующим разбавлением грубодисперсным либо высокодисперсным носителем, поскольку:
1) вследствие уже имеющегося разбавления носителем существенного увеличения насыпного объема, отсутствия склонности к агломерации - получаемые по предлагаемому способу композиции можно дозировать с гораздо большей точностью;
2) плохо растворимое лекарственное вещество (будесонид) равномерно распределено по всему объему хорошо растворимого носителя, чем достигается чрезвычайно высокие скорости высвобождения лекарственного вещества из композиций, в отличие от физических смесей микронизированных субстанций с растворимыми в воде носителями.