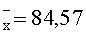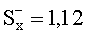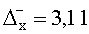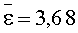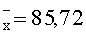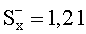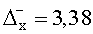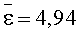Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ N-(4-НИТРО-2-ФЕНОКСИФЕНИЛ)-МЕТАНСУЛЬФОНАМИДА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
Вид РИД
Изобретение
Изобретение относится к биологии и токсикологической химии, а именно к способам определения N-(4-нитро-2-феноксифенил)-метансульфонамида в биологическом материале, и может быть использовано в практике в практике химико-токсикологических, экспертно-криминалистических и клинических лабораторий. Способ относится к числу массовых.
Известен способ определения N-(4-нитро-2-феноксифенил)-метансульфонамида в биологическом материале (ткани печени) на основе изолирования по Стасу-Отто, заключающийся в том, что биологический объект измельчают, настаивают 3-4 раза по 24 часа с органическим изолирующим агентом, которым является этанол, подкисленный щавелевой кислотой, отдельные извлечения объединяют, концентрируют, к концентрату прибавляют этанол, образующийся осадок белковых структур отфильтровывают, процесс концентрирования и прибавления этанола повторяют до тех пор, пока при прибавлении этанола к полученному в очередной раз концентрату не будет наблюдаться отсутствие осадка белковых структур, раствор разбавляют водой, реакцию среды полученного раствора доводят до pH 2, экстрагируют хлороформом, хлороформный экстракт упаривают до сухого остатка, остаток растворяют в этаноле, полученный раствор центрифугируют, вводят в хроматограф и определяют анализируемое вещество методом ВЭЖХ в колонке с сорбентом «Prontosil-120-5-С-18» размерами 75×2 мм, проводя процесс в градиентном режиме с использованием в качестве элюентов 0,1% раствора трифторуксусной кислоты и ацетонитрила, изменяя содержание ацетонитрила в подвижной фазе от 0% до 100% в течение 25 минут (Заздравных Н.А., Стаценко И.В., Воронкова Л.Г. Изолирование и идентификация нимесулида в биологическом материале // Актуальные вопросы судебной медицины и экспертной практики. - 2008. - №13. - С.75-78).
Способ отличается длительностью выполнения, трудоемкостью, недостаточно высокими чувствительностью и селективностью определения.
Известен способ определения N-(4-нитро-2-феноксифенил)-метансульфонамида в биологическом материале (тканях внутренних органов), заключающийся в том, что биологический объект измельчают, настаивают с 1% раствором гидроксида натрия однократно в течение 30 минут при периодическом перемешивании, полученное извлечение отделяют путем процеживания через марлю, подкисляют 6 н. раствором хлороводородной кислоты до pH 1,0-2,0, экстрагируют дважды порциями хлороформа, хлороформные экстракты объединяют, растворитель из объединенного экстракта испаряют, остаток растворяют в хлороформе, полученный раствор вносят в колонку с оксидом алюминия, элюируют вначале хлороформом, а затем этанолом, этанольный элюат собирают, растворитель из этанольного элюата испаряют, остаток растворяют в 0,1 н. растворе гидроксида натрия, исследуют поглощение образующегося окрашенного раствора в интервале длин волн 300-400 нм, анализируемое вещество идентифицируют по положению максимумов полос поглощения и форме спектральной кривой и рассчитывают количественное содержание N-(4-нитро-2-феноксифенил)-метансульфонамида по величине оптической плотности, измеренной при длине волны 392 нм (Доброриз A.M. Обнаружение нимесулида в биологическом материале // Судебно-медицинская экспертизы. - 2009. - Т. 52, №4. - С.32-34).
Способ характеризуется недостаточно высокой чувствительностью.
Наиболее близким является способ определения N-(4-нитро-2-феноксифенил)-метансульфонамида в биологическом материале (тканях внутренних органов), заключающийся в том, что биологический объект измельчают, двукратно по 45 минут настаивают с порциями органического изолирующего агента, которым является ацетон, полученные извлечения объединяют, растворитель из объединенного извлечения испаряют, остаток обрабатывают ацетоном, ацетоновое извлечение отделяют, хроматографируют в макроколонке с силикагелем КСС №3 80/120 мкм с использованием подвижной фазы гексан-ацетон в соотношении 75:25 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 20-22°C до полного удаления растворителя, остаток растворяют в хлороформе и проводят определение комбинированным физико-химическим методом, в качестве которого используется хромато-спектрофотометрия, при этом хроматографируют методом ТСХ на пластине «Сорбфил» марки ПТСХ-АФ-В-УФ, используя подвижную фазу толуол-ацетонитрил в соотношении 7:3 по объему, полученную хроматограмму проявляют в УФ-свете, анализируемое вещество элюируют из сорбента диметилформамидом, элюат спектрофотометрируют, вычисляя количество N-(4-нитро-2-феноксифенил)-метансульфонамида по величине оптической плотности элюата, измеренной при длине волны 439,4 нм (Шорманов В.К., Герасимов Д.А., Сипливая Л.Е., Галушкин С.Г., Симонов Р.Ю. Распределение нимесулида в организме теплокровных животных // Фармация. - 2013. - Т. 62, №1. - С.39-42).
Способ характеризуется недостаточно высокой чувствительностью.
Техническим результатом настоящего изобретения является повышение чувствительности определения.
Технический результат достигается тем, что биологический объект измельчают, двукратно по 45 минут настаивают с порциями органического изолирующего агента, которым является метилацетат, полученные извлечения объединяют, растворитель из объединенного извлечения испаряют, остаток обрабатывают ацетоном, ацетоновое извлечение отделяют, растворитель из объединенного извлечения испаряют, остаток растворяют в диэтиловом эфире, эфирный раствор экстрагируют буферным раствором с pH 9-10, водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, полученный раствор насыщают бромидом натрия, экстрагируют этилацетатом, полученный экстракт упаривают в токе воздуха при температуре 20-22°C до получения сухого остатка, остаток растворяют в смеси гексана и ацетона, взятых в соотношении 8:2 по объему, хроматографируют в макроколонке с силикагелем L 40/100 мкм с использованием подвижной фазы гексан-ацетон в соотношении 8:2 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 20-22°C до полного удаления растворителя, остаток растворяют в метаноле и проводят определение комбинированным физико-химическим методом, в качестве которого используется хромато-масс-спектрометрия, с применением капиллярной колонки DB-5 MS EVIDEX с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, используя масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току, вычисляя количество N-(4-нитро-2-феноксифенил)-метансульфонамида по площади хроматографического пика.
Способ осуществляется следующим образом: биологический объект, содержащий N-(4-нитро-2-феноксифенил)-метансульфонамид, измельчают, двукратно по 45 минут настаивают с порциями органического изолирующего агента, которым является метилацетат, полученные извлечения объединяют, растворитель из объединенного извлечения испаряют, остаток обрабатывают ацетоном, ацетоновое извлечение отделяют, растворитель из объединенного извлечения испаряют, остаток растворяют в диэтиловом эфире, эфирный раствор экстрагируют буферным раствором с pH 9-10, водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, полученный раствор насыщают бромидом натрия, экстрагируют этилацетатом, полученный экстракт упаривают в токе воздуха при температуре 20-22°C до получения сухого остатка, остаток растворяют в смеси гексана и ацетона, взятых в соотношении 8:2 по объему, хроматографируют в макроколонке с силикагелем L 40/100 мкм с использованием подвижной фазы гексан-ацетон в соотношении 8:2 по объему, фракции элюата, содержащие анализируемое вещество, объединяют, элюент испаряют в токе воздуха при температуре 20-22°C до полного удаления растворителя, остаток растворяют в метаноле и проводят определение комбинированным физико-химическим методом, в качестве которого используется хромато-масс-спектрометрия с применением капиллярной колонки DB-5 MS EVIDEX с неподвижной фазой, представляющей собой 5%-фенил-95%-метилполисилоксан, используя масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°С, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току, вычисляя количество N-(4-нитро-2-феноксифенил)-метансульфонамида по площади хроматографического пика.
Пример 1
Определение N-(4-нитро-2-феноксифенил)-метансульфонамида в ткани печени
К 10 г ткани печени прибавляют 5 мг N-(4-нитро-2-феноксифенил)-метансульфонамида, тщательно перемешивают биологический объект с веществом и оставляют на 1,5 часа при температуре 20-22°C. По истечении указанного времени смесь заливают 20 г органического изолирующего агента, которым является метилацетат, и настаивают 45 минут при перемешивании. Извлечение отделяют, операцию настаивания повторяют в вышеописанных условиях. Полученные извлечения объединяют, объединенное органическое извлечение упаривают до полного удаления растворителя в токе воздуха при 20-22°C, остаток неоднократно (трижды по 3 минуты) обрабатывают ацетоном (порциями по 15 г каждая) при энергичном перемешивании, ацетоновые извлечения отделяют, объединяют, растворитель из объединенного извлечения испаряют в токе воздуха при 20-22°C до полного удаления растворителя, остаток растворяют в 10 мл диэтилового эфира, образующийся раствор экстрагируют дважды порциями буферного раствора с pH 9-10 по 10 мл каждая. Отдельные водно-щелочные экстракты объединяют, подкисляют 24%-ным раствором хлороводородной кислоты до pH 2-3, полученный раствор насыщают бромидом натрия и экстрагируют дважды порциями этилацетата по 20 мл каждая. Отдельные этилацетатные экстракты объединяют, упаривают в токе воздуха при температуре 20-22°C до получения сухого остатка.
Остаток растворяют в 2-3 мл смеси гексана и ацетона, взятых в соотношении 8:2 по объему, и вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 10 г силикагеля L 40/100 мкм. Хроматографируют, используя подвижную фазу гексан-ацетон в соотношении 8:2 по объему. Элюат собирают отдельными фракциями по 2 мл каждая.
Фракции с 9 по 17 включительно объединяют, упаривают в токе воздуха при температуре 20-22°C до полного удаления растворителя. Остаток растворяют в 10 мл метанола (раствор А). 1,0 мл раствора А вносят в мерную колбу вместимостью 50 мл и доводят метанолом до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой 5%-фенил-95%-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество N-(4-нитро-2-феноксифенил)-метансульфонамида по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 17,14 мин соответствует N-(4-нитро-2-феноксифенил)-метансульфонамиду. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 51, 77, 78, 128, 154, 169, 183, 199, 229, 308. Наиболее интенсивной является частица с массовым числом 154, интенсивность которой принимается за 100%.
N-(4-нитро-2-феноксифенил)-метансульфонамид идентифицируют по сочетанию времени удерживания в неподвижной фазе колонки и специфического набора сигналов характеристических заряженных частиц в его масс-спектре.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание N-(4-нитро-2-феноксифенил)-метансульфонамида, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,05, 0,2, 0,8, 2,0, 5,0 мл 0,00125% раствора и 0,8, 2,0, 8,0, 12,0, 20,0 мл 0,0125% раствора N-(4-нитро-2-феноксифенил)-метансульфонамида в метаноле и доводят объем содержимого каждой колбы до метки метанолом.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой 5%-фенил-95%-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество N-[-(4-нитро-2-феноксифенил)-метансульфонамида по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества. График линеен в интервале концентраций 5·10-11-2,0·10-7 г.
Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое в данном случае имеет вид:
S=429918·С-7874,
где S - площадь хроматографического пика; C - концентрация определяемого вещества в хроматографируемой пробе, нг.
Результаты количественного определения N-(4-нитро-2-фенокси-фенил)-метансульфонамида в ткани печени представлены в таблице 1.
Пример 2
Определение N-(4-нитро-2-феноксифенил)-метансульфонамида в ткани легких
К 10 г ткани легких прибавляют 5 мг N-(4-нитро-2-феноксифенил)-метансульфонамида, тщательно перемешивают биологический объект с веществом и оставляют на 1,5 часа при температуре 20-22°C. По истечении указанного времени смесь заливают 20 г органического изолирующего агента, которым является метилацетат, и настаивают 45 минут при перемешивании. Извлечение отделяют, операцию настаивания повторяют в вышеописанных условиях. Полученные извлечения объединяют, объединенное органическое извлечение упаривают до полного удаления растворителя в токе воздуха при 20-22°C, остаток неоднократно (трижды по 3 минуты) обрабатывают ацетоном (порциями по 15 г каждая) при энергичном перемешивании, ацетоновые извлечения отделяют, объединяют, растворитель из объединенного извлечения испаряют в токе воздуха при 20-22°C до полного удаления растворителя, остаток растворяют в 10 мл диэтилового эфира, образующийся раствор экстрагируют дважды порциями буферного раствора с pH 9-10 по 10 мл каждая. Отдельные водно-щелочные экстракты объединяют, подкисляют 24%-ным раствором хлороводородной кислоты до pH 2-3, полученный раствор насыщают бромидом натрия и экстрагируют дважды порциями этилацетата по 20 мл каждая. Отдельные этилацетатные экстракты объединяют, упаривают в токе воздуха при температуре 20-22°C до получения сухого остатка.
Остаток растворяют в 2-3 мл смеси гексана и ацетона, взятых в соотношении 8:2 по объему, и вносят в хроматографическую макроколонку размерами 490×11 мм, заполненную 10 г силикагеля L 40/100 мкм. Хроматографируют, используя подвижную фазу гексан-ацетон в соотношении 8:2 по объему. Элюат собирают отдельными фракциями по 2 мл каждая.
Фракции с 9 по 17 включительно объединяют, упаривают в токе воздуха при температуре 20-22°C до полного удаления растворителя.
Остаток растворяют в 10 мл метанола (раствор А). 1,0 мл раствора А вносят в мерную колбу вместимостью 50 мл и доводят метанолом до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой 5%-фенил-95%-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура повышается от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 16 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество N-(4-нитро-2-феноксифенил)-метансульфонамида по площади хроматографического пика.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 17,14 мин соответствует N-(4-нитро-2-феноксифенил)-метансульфонамиду. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 51, 77, 78, 128, 154, 169, 183, 199, 229, 308. Наиболее интенсивной является частица с массовым числом 154, интенсивность которой принимается за 100%.
N-(4-нитро-2-феноксифенил)-метансульфонамид идентифицируют по сочетанию времени удерживания в неподвижной фазе колонки и специфического набора сигналов характеристических заряженных частиц в его масс-спектре.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание N-(4-нитро-2-феноксифенил)-метансульфонамида, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
Построение градуировочного графика и его уравнение приводятся в примере 1.
Результаты количественного определения N-(4-нитро-2-фенокси-фенил)-метансульфонамида в ткани легких представлены в таблице 2.
Предлагаемый способ по сравнению с прототипом в 5,7·104 раз повышает чувствительность определения в детектируемой пробе и в 12 раз - в биологическом материале.
Сравнительные характеристики предлагаемого и известного способов представлены в таблице 3.
|
|
|