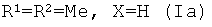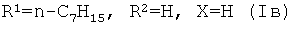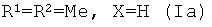Результат интеллектуальной деятельности: 13-Е-(2,4-ДИОКСО-1,2,3,4-ТЕТРАГИДРОПИРИМИДИН-5-ИЛ) ЭВДЕСМАНОЛИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОЯЗВЕННОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
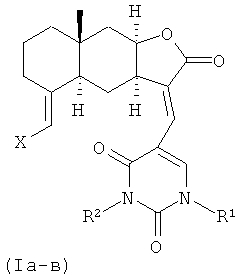
Изобретение относится к органической химии, конкретно, к новым химическим соединениям - 13-E-(2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолидам формулы (Ia-в),
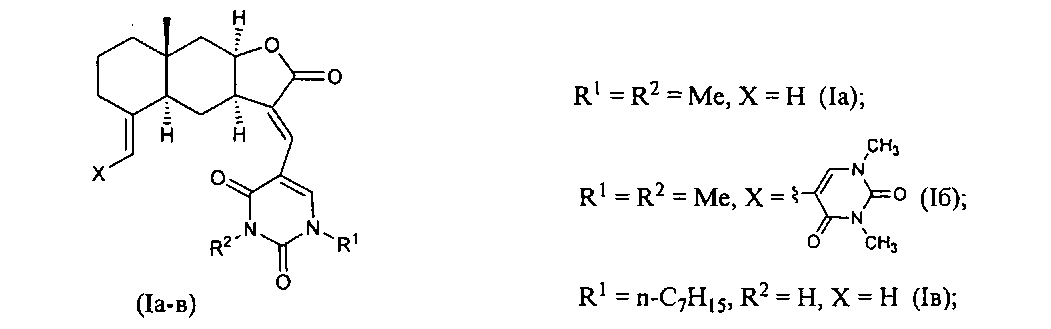
обладающим противоязвенной активностью.
Указанное свойство позволяет предполагать возможность использования соединений в медицине в качестве фармацевтического препарата.
Язвенная болезнь желудка и двенадцатиперстной кишки относятся к числу наиболее распространенных заболеваний пищеварительного тракта. В настоящее время основным компонентом лечения язвенной болезни является фармакотерапия. Все фармакологические средства, применяемые в терапии язвенной болезни, подразделяются на следующие группы:
1. Ингибиторы секреции желудочного сока. В эту группу входят: антагонисты H2 гистаминовых рецепторов (циметидин, ранатидин, фамотидин - производные имидазола, фурана и тиазола соответственно), ингибиторы H+, K+-АТФ-азы или "протонного насоса" желудка (омепразол, лансопразол) и периферические блокаторы ацетилхолина и мускарина M1 (метацин, пиренцепин, синтетические азотсодержащие соединения и растительные алкалоиды).
2. Средства, повышающие защитные свойства слизистой облочки. Эта группа объединяет препараты, образующие искусственные цитопротективные покрытия (коллоидный висмут, денол) и физиологические цитопротекторы (стимуляторы синтеза простагландинов и аналоги и производные простагландина E2 (мизопростол)
3. Антациды и сорбенты.
4. Средства, вызывающие эрадикацию Helicobacter pylori (антибиотики, метронидазол, препараты висмута).
5. Стимуляторы репаративно-регенераторных процессов (метилурацил, витамин U). [Bays D.E., Finch Н. Inhibitors of Gastric Acid Secretion. Nat. Prod. Rep. 1990. V.7. P.409-445; М.Д. Машковский. Лекарственные средства, изд. 15. «Новая Волна». Москва. 2005. С.360; Gupta А.К., Varshney К., Singh N., Mishra V., Saxena M., Palit G., Saxena A.K. Identification of Novel Amino Acid Derived CCK-2R Antagonists As Potential Antiulcer Agent: Homology Modeling, Design, Synthesis, and Pharmacology. J. Chem. Inf. Model, 2013. V.53. P.176-187].
Растительные вещества, в том числе суммарные экстракты [плантаглюцид (экстракт листьев подорожника), калефлон (очищенный экстракт из календулы лекарственной), ликвиритон (сумма флавоноидов солодки)], занимают значительное место в перечне противоязвенных средств [Машковский М.Д. Лекарства XX века. «Новая Волна», Москва. 1998. С.202, 264; Tadic V.M., Dobric S., Markovic G.M., Dordevic S.M., Arsic I.A., Menkovic N.R., Stevic T. Anti-inflammatory, Gastroprotective, Free-Radical-Scavenging, and Antimicrobial Activities of Hawthorn Berries Ethanol Extract. J. Agric. Food Chem. 2008. V.56. P.7700-7709; Adhikary В., Yadav S.K., Bandyopadhyay S.K., Chattopadhyay S. Role of the COX-independent pathways in the ulcer-healing action of epigallocatechin gallate. Food Fund., 2011. V.2. P.338-347]. Давно известна противоязвенная активность сесквитерпеновых лактонов [Giordano O.S., Pestchanker M.J., Guerreiro Е., Saad J.R., Enriz R.D., Rodriguez A.M., Jauregui E.A., Guzman J., Maria A.O.M., Wendel G.H.. Structure-activity relationship in the gastric cytoprotective effect of several sesquiterpene lactones J. Med. Chem. 1992. V.35. P.2452-2458]. Например, смесь сесквитерпеновых лактонов, выделенных из девясила высокого Inula helenium, является действующим началом противоязвенного препарата «Аллантон» [Машковский М.Д. Лекарственные средства, изд. 15. «Новая Волна». Москва. 2005. С.360]. Препарат ускоряет регенерацию слизистой оболочки желудка при язвенных поражениях, оказывает противовоспалительное, капилляроукрепляющее и антисептическое действие. Кроме того, «Аллантон» обладает антибактериальным действием против таких патогенных бактерий, как Staphylococcus aureus и Mycobacterium tuberculosis (IC50 31.2-62.5 и 31.2 мкг/мл соответственно) [Picman A.K., Towers G.H.N. Antibacterial activity of sesquiterpene lactones. Biochem. Syst. Ecol. 1983. V.11. №4. P.321-327]. Однако эффективность суммарного препарата не достигает необходимых требований, то есть агент проявляет недостаточно высокую активность и вместе с ним необходимо назначение других противоязвенных препаратов. Из-за вариабельности состава лактонов в сырье значительно изменяется активность суммарного препарата, теряется его эффективность и возникают проблемы получения однородного препарата [Милман И.А. Аланто- и изоалантолактон. Химия природн. соединений. 1990. С.307-320].
Основными компонентами препарата «Аллантон» являются сесквитерпеновые лактоны эвдесманового типа - изоалантолактон (II) и алантолактон (III) [Милман. И.А. Химия природн. соединений, 1990, 307-320].
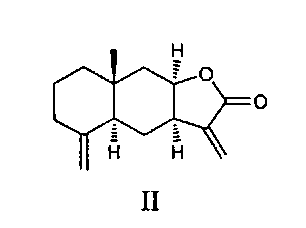
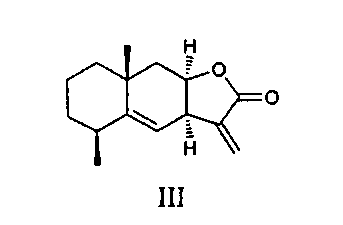
Сесквитерпеновые лактоны (II) и (III) являются доступными соединениями, которые легко выделяются в свободном виде из доступного растительного сырья девясила высокого Inula helenium. Эти соединения представляют значительный интерес в качестве объектов для модификации структуры и введения новых фармакофорных фрагментов. Для изоалантолактона (II) установлена антибактериальная, фунгицидная и антипролиферативная активность [Khan М., Ding С., Rasul A., Yi F., Li Т., Gao Н., Gao R., Zhong L., Zhang K., Fang X., Ma T. Isoalantolactone induces reactive oxygen species mediated apoptosis in pancreatic carcinoma PANC-1 cells. Int. J. Biol. Sci. 2012, 8, 533]. Таким образом, изучение направленных синтетических трансформаций сесквитерпеновых лактонов, входящих в состав противоязвенного средства «Аллантон», и исследование биологической активности синтезированных производных с целью получения агентов с улучшенными свойствами представляет значительный интерес.
Аналогом по структуре и свойствам заявляемых соединений является 13-E-(4-метоксифенил)изоалантолактон формулы (IV) [Шульц Э.Э., Беловодский А.В., Толстикова Т.Г., Долгих М.П., Толстиков Г.А. Патент №2413724. РФ. Приоритет от 07.10.2009 г. (3aR,4aS,8aR,9aR,E)-3-арилиден-8a-метил-5-метилендекагидронафто[2,3-b]фуран-2(3H)-оны, обладающие противоязвенной активностью. Опубл. 10.03.2011, Бюл. №7. С.10].
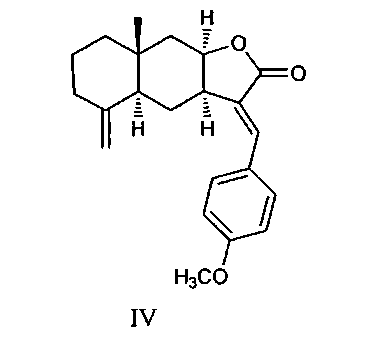
Соединение (IV) получили реакцией Хека изоалантолактона (II) с йоданизолом. Реакция Хека представляет большие возможности модификации метиленлактона (II) и дает возможность введения фармакофорных группировок, в частности урацильного фрагмента. Следует отметить, что введение урацильного заместителя в биомолекулу находит применение в конструировании фармакологически ценных соединений в связи с тем, что за счет более прочного связывания с биомишенью производные урацила часто усиливают физиологический эффект [Pesnot Т., Jurgensen R., Palcic М.М. and Wagner G.K. Structural and mechanistic basis for a newmode of glycosyltransferase inhibition. Nat. Chem. Biol. 2010. V.6. P.321-323]. Кроме того, метилурацил является эффективным стимулятором процессов регенерации [Хендерсон Дж. М. Патофизиология органов пищеварения. Пер. с англ. М.-СПб. БИНОМ. 1999. 286 c.]. Задачей, на решение которой направлено предлагаемое изобретение, является разработка противоязвенных агентов с улучшенными свойствами на основе доступных соединений: изоалантолактона (II) и производных урацила.
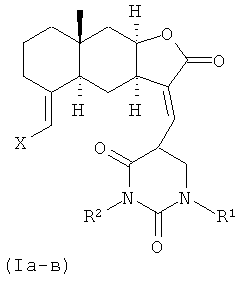
Поставленная задача решается новыми химическими соединениями -13-E-(2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолидами формулы (Ia-в), проявляющими выраженную противоязвенную активность.
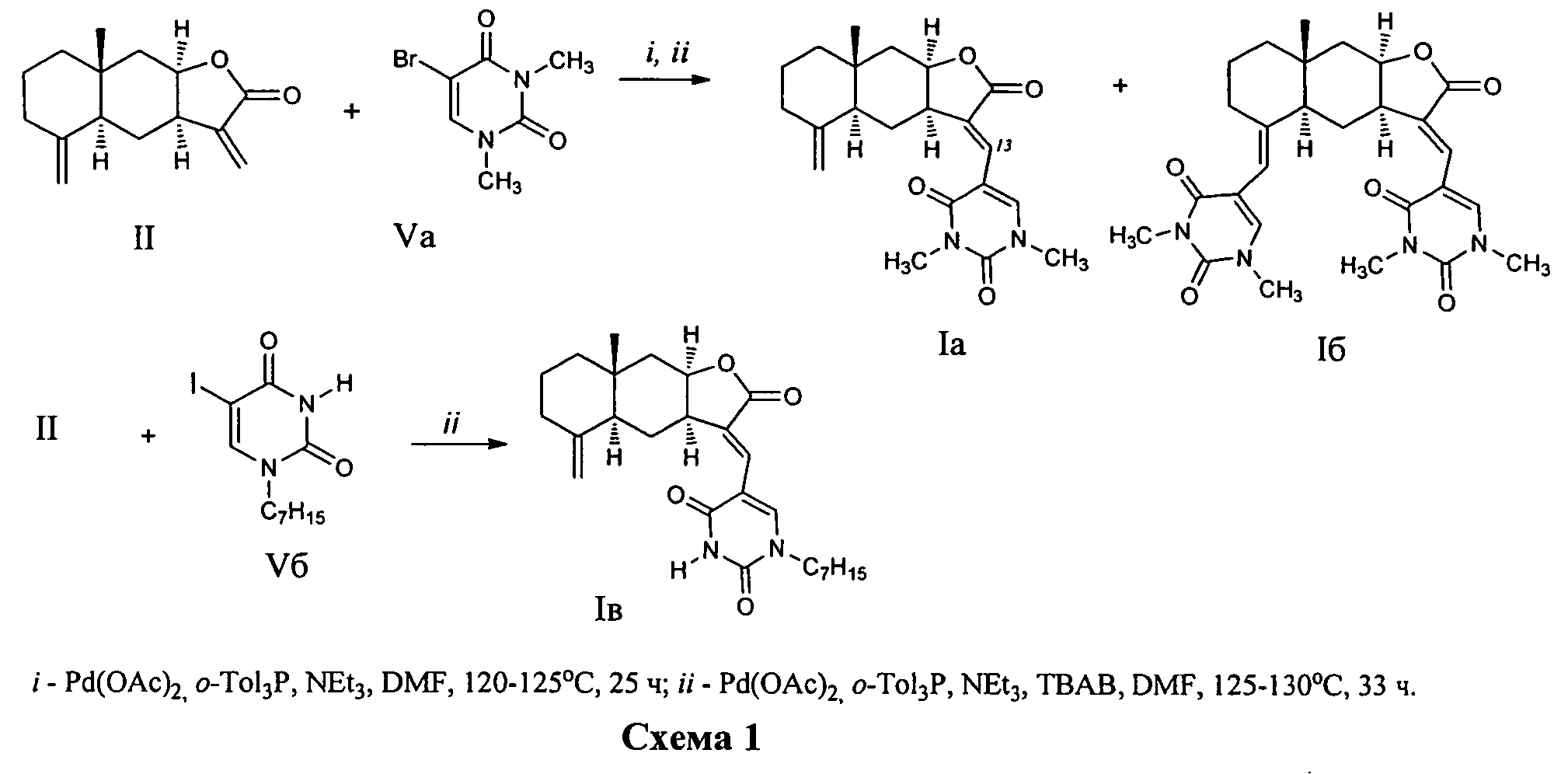
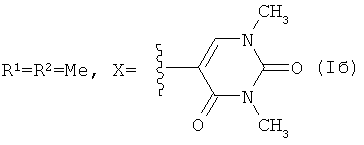
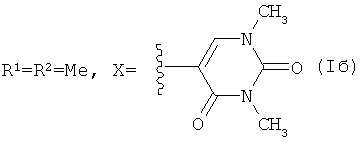
Способ получения соединений (Ia-в) из изоалантолактона (II) реализуется по приведенной схеме 1. Взаимодействие соединения (II) с 5-бром-1,3-диметилурацилом (Va) в ДМФА в присутствии каталитических количеств ацетата палладия и трис-(o-толил)фосфина, а также триэтиламина в качестве основания (120-125°C, 25 ч) (реакция Хека) приводит к 13-E-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолиду (Ia), выделенному с выходом 68%. Если реакцию соединения (II) с 5-бром-1,3-диметилурацилом (Va) в ДМФА проводить в присутствии тетрабутиламмоний бромида (ТВАВ) (условия ii) при увеличении температуры и времени реакции (125-130°C, 33 ч) дополнительно с (Ia) (выход 42%) образуется 13(E),15(E)-бис(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-пиримидин-5-ил)-эвдесманолид (Iб) (выход 18%). Реакция кросс-сочетания изоалантолактона (II) с 1-гептил-5-иодурацилом (Vб) (условия ii) приводит к 13-E-(1-гептил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолиду (Iв), выделенному с выходом 49%.
Техническим результатом изобретения является синтез новых производных сесквитерпеновых лактонов (Ia-в), обладающих противоязвенной активностью. Новые соединения получают путем химической модификации доступного растительного метаболита девясила высокого Inula helenium - изоалантолактона (II). Физико-химические константы новых впервые полученных соединений приведены в примерах 1-3.
Для соединений (Ia-в) проведено изучение противоязвенной активности и определение острой токсичности.
Острую токсичность (LD50) определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера [Саноцкий И.В. Методы определения токсичности и опасности химических веществ. М.: Медицина, 1970, 342 с.]. Установлено, что LD50 соединений (Ia-в) превышает максимально возможную для разового введения дозу 2000 мг/кг. Соединения относятся к 3-му классу умеренно опасных веществ.
Для исследования противоязвенного эффекта была использована стандартная модель экспериментальной язвы, которая воспроизводилась внутрижелудочным введением индометацина в дозе 20 мг/кг на фоне введенного в дозе 30 мг/кг заявляемого соединения. Модель воспроизводилась согласно методическим рекомендациям [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Под редакцией Хабриева Р.У. Москва: Медицина. 2005. 832 с.]. Через 24 ч животных забивали и подсчитывали количество и площадь язв, интегральный Индекс Паулса (ИП, произведение среднего количества язв на количество животных с язвами, в %) и противоязвенную активность (ПА, отношение ИП контрольной группы:ИП опытной группы). Исследуемые агенты считаются эффективными, если ПА составляет 2 и более единиц. Результаты изучения противоязвенной активности приведены в таблице 1.
|
Из данных таблицы видно, что заявляемые соединения (Ia-в) в дозе 30 мг/кг в значительной степени блокировали развитие деструктивных поражений желудка, вызванных индометацином, соответственно уменьшая количество язв, индекс противоязвенной активности ИП и тем самым проявляя высокую противоязвенную активность. Исходное соединение [изоалантолактон (II)] на указанной модели не обладало противоязвенной активностью. Его введение, наоборот, приводило к увеличению числа язв. Наибольшую противоязвенную активность проявил лактон (Iа), активность которого оказалась в 7 раз выше активности аналога по свойствам 13-E-арилизоалантолактона (IV). Особенностью структуры соединения (Iа) является наличие в положении C(13) эвдесманового остова 1,3-диметилурацильного заместителя. Характерно, что активность лактона (Iб), содержащего 1,3-диметилурацильный заместитель в положениях C(13) и C(15) превосходит противоязвенный эффект лактона (IV) более чем в два раза, но в 3 раза ниже, чем у монозамещенного азоалантолактона (Ia). Природа заместителя при атомах азота урацильного фрагмента также оказывает влияние на активность. Эвдесманолид (Iв), содержащий моно-N(3)-гептилзамещенный урацильный заместитель в положении C(13) проявил практически равную противоязвенную активность с аналогом по свойствам (IV). Следует подчеркнуть, что модификация положений C(13) и C(15) метиленлактонов с введением урацильного заместителями и сохранением C-(11, 13) и C-(4, 15) двойных связей в эвдесмановой структуре выполнена нами впервые.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 13-E-(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолида {(3aR,4aS,8aR,9aR,E)-3-[(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-пиримидин-5-ил)метилен]-8a-метил-5-метилен-2-оксододекагидронафто[2,3-b]фурана} (Ia). Двугорлую стеклянную ампулу заполняют аргоном. В токе аргона в ампулу последовательно загружают 232 мг (1.00 ммоль) изоалантолактона (II), 262 мг (1.1 ммоль) 5-бром-(1,3-диметил)урацила (Va), 8 мг (8 мол.% ацетата палладия), 68 мг (16 мол.%) трис-(o-толил)фосфина, 8 мл ДМФА и 0.26 мл (1.9 ммоль) триэтиламина. Добавляют прокаленные молекулярные сита 3Å (2 шт.), ампулу запаивают (небольшое избыточное давление аргона). Реакционную смесь нагревают и выдерживают при 120-125°C в течение 25 ч. По окончании реакции систему охлаждают, ампулу вскрывают, содержимое выливают в воду и экстрагируют этилацетатом (3×20 мл). Объединенные органические вытяжки промывают водой (4×30 мл), сушат над MgSO4 и упаривают под вакуумом. Маслообразный остаток растворяют в минимальном количестве хлороформа и хроматографируют на силикагеле (элюент - хлороформ-этанол, 100:1→100:10). Последовательно элюируют трис-(o-толил)фосфин, исходный лактон (II) и продукты реакции кросс-сочетания [соединение (Ia), (Z)-изомер соединения (Ia) и бис-замещенный продукт (Iб)] (элюент - хлороформ-этанол, 100:0→100:3). Для выделения индивидуального соединения (Ia) используют повторное хроматографирование на силикагеле (элюент - бензол-этилацетат, 30:1→3:1) и перекристаллизацию из диэтилового эфира. Выход 68%. Т.пл. 113-116°C (из диэтилового эфира). [α]D +373° (c 1.3, CHCl3). ИК спектр, ν, см-1: 756, 1167, 1211, 1342, 1369, 1454, 1483, 1626, 1657, 1713, 1747, 2928. УФ спектр (этанол), λмакс., нм, (lgε): 266 (3.85), 317 (4.11). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.82 с (3H, C14H3), 1.23 д.д.д (1H, H1, J 13.6, 13.4, 5.3), 1.30 д.д (1H, H6, J 13.5, 12.4), 1.50 д.д (1H, H9, J 15.9, 5.1), 1.52-1.59 м (3H, H1,1,2), 1.77 д.д.д (1H, H6, J 13.7, 6.9, 2.9), 1.89 д (1H, H5, J 13.0), 1.99 д.д.д (1H, H3, J 12.5, 5.9, 5.3), 2.20 д.д (1H, H9, J 15.9, 1.8), 2.31 д.м (1H, H3, J 12.9), 3.36 с (3H, CH3), 3.47 с (3H, CH3), 3.59 д.д.д (1H, H7 J 11.8, 6.3, 5.3), 4.40 д (1H, H15 J 1.3), 4.49 д.д.д (1H, H8, J 6.3, 4.7, 1.5), 4.75 д (1H, H15 J 1.3), 7.15 д.д (1H, H13 J 1.2, 0.6), 7.47 с (1H, H6′). Спектр ЯМР 13C, δ, м.д.: 17.57 (C14), 22.65 (C2), 26.18 (C6), 28.28 (C7′), 34.35 (C10), 36.79 (C3), 37.63 (C8′), 40.35 (C7), 41.29 (C9), 42.10 (C1), 46.32 (C5), 76.77 (C8), 106.41 (C15), 109.01 (C5′), 126.17 (C13), 132.36 (C11), 144.58 (C6′), 149.27 (C4), 150.74 (C2′), 160.76 (C4′), 172.21 (C12). Найдено, %: C 68.21; H 6.98; N 7.39. C21H26N2O4. Вычислено, %: C 68.11; H 7.07; N 7.56.
Пример 2. Получение 13(E),15(E)-бис(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидро-пиримидин-5-ил)эвдесманолида {(3E,3aR,4aR,5E,8aR,9aR)-3,5-Бис[(1,3-диметил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)метилен]-8a-метил-2-оксододекагидронафто-[2,3-b]фурана} (Iб). Двугорлую стеклянную ампулу заполняют аргоном. В токе аргона в ампулу последовательно загружают 232 мг (1.00 ммоль) изоалантолактона (II), 288 мг (1.2 ммоль) 5-бром-(1,3-диметил)урацила (Va), 8 мг (8 мол.% ацетата палладия), 68 мг (16 мол.%) трис-(o-толил)фосфина, 332 мг (1.00 ммоль) тетрабутиламмоний бромида, 8 мл ДМФА и 0.26 мл (1.9 ммоль) триэтиламина. Добавляют прокаленные молекулярные сита 3Å (2 шт.), ампулу запаивают (небольшое избыточное давление аргона). Реакционную смесь нагревают и выдерживают при 125-130°C в течение 33 ч. По окончании реакции систему охлаждают, ампулу вскрывают, содержимое выливают в воду и экстрагируют этил ацетатом (3×20 мл). Объединенные органические вытяжки промывают водой (4×30 мл), сушат над MgSO4 и упаривают под вакуумом. Маслообразный остаток растворяют в минимальном количестве хлороформа и хроматографируют на силикагеле (элюент - хлороформ-этанол, 100:1→100:10). Последовательно элюируют трис-(o-толил)фосфин, исходный лактон (II) и продукты реакции кросс-сочетания [соединение (Ia), Z-изомер и бис-замещенный продукт (Iб)] (элюент - хлороформ-этанол, 100:0→100:3). Для выделения индивидуального соединения (Iб) используют повторное хроматографирование на силикагеле (элюент - бензол-этилацетат, 30:1→3:1). Выход 18%. Маслообразное вещество. [α]D +322° (c 0.4, CHCl3). ИК спектр, ν, см-1: 756, 1161, 1190, 1207, 1342, 1367, 1454, 1481, 1651, 1707, 1751. УФспектр, λмакс., нм (lgε): 228 (4.17), 277 (4.13), 310 (4.22). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.82 с (3H, C14H3), 1.28-1.36 м (2H, H1,6), 1.50 д.д.д (1H, H2, J 13.6, 5.4, 3.6), 1.54 д.д (1H, H9, J 5.7, 4.6), 1.58 д (1H, H1, J 13.2), 1.67 д (1H, H2, J 13.2), 1.78 д.д.д (1H, H3, J 14.9, 13.6, 3.6), 1.85 д.д.д (1H, H6, J 13.6, 6.8, 2.2), 2.01 д (1H, H5, J 12.5), 2.21 д.д (1H, H9, J 15.6, 0.8), 2.64 д (1H, H3, J 13.2), 3.31 с (3H, CH3), 3.36 с (3H, CH3), 3.38 с (3H, CH3), 3.48 с (3H, CH3), 3.70 д.д.д (1H, H7 J 1.8, 6.8, 6.1), 4.47 д.д.д (1H, H8, J 6.1, 4.6, 0.8), 5.54 с (1H, H15), 6.91 с (1H, H6″), 7.07 с (1H, H13), 7.50 с (1H, H6′). Спектр ЯМР, 13C, δ, м.д.: 17.89 (C14), 22.74 (C2), 26.10 (C6), 27.92 (C7″), 28.27 (C7′), 30.88 (C3), 35.20 (C10), 36.96 (C8″), 37.63 (C8′), 40.31 (C7), 42.21 (C1), 41.42 (C9), 47.34 (C5), 76.40 (C8), 108.82 (C5′), 110.90 (C5′′), 112.14 (C15), 126.43 (C13), 132.23 (C11), 139.78 (C6′′), 144.99 (C4), 145.28 (C6′), 150.70 (C2′), 151.31 (C2′′), 160.63 (C4′), 163.49 (C4′′), 172.19 (C12). Масс-спектр, m/z (Iотн, %): 508 (1), 83 (100), 85 (65), 47 (22), 153 (12), 87 (10), 48 (9), 490 (5), 462 (4), 353 (3), 309 (3), 42 (3), 355 (2). Найдено: [M] 508.2322. Найдено, %: C 63.91; H 6.56; N 11.22. C27H32N4O6. Вычислено, %: C 63.77; H 6.34; N 11.02. Вычислено: [M] 508.2316.
Пример 3. Получение 13-E-(1-гептил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)эвдесманолида {(3aR,4aS,8aR,9aR,E)-3-[(1-Гептил-2,4-диоксо-1,2,3,4-тетрагидропи-римидин-5-ил)-метилен]-8a-метил-5-метилен-2-оксододекагидронафто[2,3-b]фурана} (Iв). Двугорлую стеклянную ампулу заполняют аргоном. В токе аргона в ампулу последовательно загружают 232 мг (1.00 ммоль) изоалантолактона (II), 370 мг (1.1 ммоль) 1-гептил-5-иодурацила (Vб), 8 мг (8 мол.% ацетата палладия), 68 мг (16 мол.%) трис-(o-толил)фосфина, 332 мг (1.00 ммоль) тетрабутиламмоний бромида, 8 мл ДМФА и 0.26 мл (1.9 ммоль) триэтиламина. Добавляют прокаленные молекулярные сит 3Å (2 шт.), ампулу запаивают (небольшое избыточное давление аргона). Реакционную смесь нагревают и выдерживают при 125-130°C в течение 33 ч. По окончании реакции систему охлаждают, ампулу вскрывают, содержимое выливают в воду и экстрагируют этилацетатом (3×20 мл). Объединенные органические вытяжки промывают водой (4×30 мл), сушат над MgS04 и упаривают под вакуумом. Маслообразный остаток растворяют в минимальном количестве хлороформа и хроматографируют на силикагеле (элюент - хлороформ-этанол, 100:1→100:10). Последовательно элюируют трис-(o-толил)фосфин, исходный лактон (II) и продукты реакции кросс-сочетания [соединение (Iв) и Z-изомер] (элюент - хлороформ-этанол, 100:0→100:3). Для выделения индивидуального соединения (Iв) используют повторное хроматографирование на силикагеле (элюент - бензол-этил ацетат, 30:1→3:1) и перекристаллизацию из этилового спирта. Выход 49%. Т.пл. 188-190°C (из этилового спирта). [φ]D +302° (c 0.4, CHCl3). ИК спектр, ν, см-1: 1171, 1209, 1458, 1622, 1649, 1688, 1705, 1738, 2928. УФ спектр, λмакс., нм (lgε): 266 (3.95), 318 (4.26) (EtOH); 266 (3.97), 318 (4.27) (EtOH+HCl); 222 (4.28), 269 (3.96), 330 (4.24) (EtOH+КОН). Спектр ЯМР 1H (CDCl3), δ, м.д. (J, Гц): 0.81 с (3H, C14H3), 0.86 т (3H, CH3, J 6.9), 1.20-1.21 м (10H, H1,6, 4×CH2), 1.48-1.71 м (6H, H1,2,2,9, CH2), 1.80 д.д.д (1H, H6, J 13.9, 6.7, 2.4), 1.88 д (1H, H6, J 12.4), 1.98 д.д.д (1H, H3, J 14.1, 13.2, 5.2), 2.19 д.д (1H, H9, J 15.7, 1.1), 2.30 д.м (1H, H3, J 12.8), 3.64 д.д.д (1H, H7 J 11.4, 6.5, 5.6), 3.76 д.д.д (2H, CH2, J 8.1, 7.1, 2.4), 4.37 д (1H, H15, J 1.0), 4.47 д.д.д (1H, H8, J 5.4, 4.6, 1.4), 4.71 д (1H, H15, J 1.3), 7.05 с (1H, H13), 7.46 с (1H, H6′), 9.11 уш.с (1H, H3). Спектр ЯМР 13C, δ, м.д.: 13.88 (CH3), 17.58 (C14), 22.40 (CH2), 22.66 (C2), 26.25 (C6), 26.41 (CH2), 28.65 (CH2), 28.95 (CH2), 31.45 (CH2), 34.31 (C10), 36.78 (C3), 40.51 (C7), 41.28 (C9), 42.11 (C1), 46.28 (C5), 49.39 (CH2), 76.85 (C8), 106.35 (C15), 109.83 (C5′), 125.24 (C13), 132.74 (C11), 146.70 (C6′), 149.16 (C4), 149.63 (C2′), 160.67 (C4′), 172.27 (C12). Спектр ЯМР 15N, δ, м.д. (J, Гц): -240.26 (N1′), -225.04 (N3′, J 91). Найдено, %: C 70.67; H 8.06; N 6.29. C26H36N2O4. Вычислено, %: C 70.88; H 8.24; N 6.36.
Пример 4. Исследование противоязвенной активности соединения (Ia) в тесте «индометациновые язвы». Экспериментальную модель язвы воспроизводят у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Ia) вводят животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводят водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы формируют по 8 животных в каждой. Через 24 ч животных забивают под эфирным наркозом путем цервикальной дислокации. Противоязвенную активность оценивают по количеству деструктивных поражений в среднем по группе (подсчитывают количество и площадь язв), вычисляют индекс изъязвлений (Индекс Паулса, ИП) и противоязвенную активность (ПА) по формулам
ИП=A·B/100, где A - среднее количество язв на одно животное; B - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения является структурный аналог 5-(4-метоксифенил)изоалантолактон (IV). Статистическую обработку результатов во всех опытах проводят с помощью программы Statistica 8.0, уровень достоверности определяли по t-критерию Стьюдента. Результаты эксперимента представлены в таблице.
Установлено, что соединение (Ia) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Ia) снижает число язв до 6 по сравнению с контрольной группой (число язв 37), а также по сравнению с аналогом по структуре и свойствам (IV) (количество язв 19). По сравнению с препаратом сравнения (IV) соединение (Ia) проявляет более высокую противоязвенную активность и значительно снижает тяжесть поражения, что отражается в значении ИП=0.3 (у аналога по свойствам 1.9) и ПА=16.7 (у аналога по свойствам 2.3).
Пример 5. Исследование противоязвенной активности соединения (Iб) в тесте «индометациновые язвы». Экспериментальную модель язвы воспроизводят у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iб) вводят животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводят водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы формируют по 8 животных в каждой. Через 24 ч животных забивают под эфирным наркозом путем цервикальной дислокации. Противоязвенную активность оценивают по количеству деструктивных поражений в среднем по группе, вычисляли индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам: ИП=A·B/100, где A - среднее количество язв на одно животное; B - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения является структурный аналог 5-(4-метоксифенил)изоалантолактон (IV). Статистическую обработку результатов во всех опытах проводят с помощью программы Statistica 8.0, уровень достоверности определяли по t-критерию Стьюдента. Результаты эксперимента представлены в таблице.
Установлено, что соединение (Ia) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Ia) снижает число язв до 9 по сравнению с контрольной группой (число язв 37), а также по сравнению с аналогом по структуре и свойствам (IV) (количество язв 19). По сравнению с препаратом сравнения (IV) соединение (1а) проявляет более высокую противоязвенную активность и значительно снижает тяжесть поражения, что отражается в значении ИП=1.0 (у аналога по свойствам 1.9) и ПА=5.0 (у аналога по свойствам 2.3).
Пример 6. Исследование противоязвенной активности соединения (Iв) в тесте «индометациновые язвы». Экспериментальную модель язвы воспроизводят у крыс линии Вистар массой 250 г путем однократного внутрижелудочного введения индометацина в токсической дозе 20 мг/кг. Соединение (Iв) вводят животным внутрижелудочно в дозе 30 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения язв. Контрольным животным аналогично вводят водно-твиновую взвесь в эквивалентном объеме. Экспериментальные группы формируют по 8 животных в каждой. Через 24 ч животных забивают под эфирным наркозом путем цервикальной дислокации. Противоязвенную активность оценивают по количеству деструктивных поражений в среднем по группе, вычисляют индекс изъязвлений (ИП) и противоязвенную активность (ПА) по формулам
ИП=A·B/100, где A - среднее количество язв на одно животное; B - количество животных с язвами в группе (%). ПА=ИП контрольной группы / ИП опытной группе. Исследуемое соединение считалось активным, если ПА составляет 2 и более единиц. Препаратом сравнения был взят структурный аналог 5-(4-метоксифенил)изоалантолактон (IV). Статистическую обработку результатов во всех опытах проводят с помощью программы Statistica 8.0, уровень достоверности определяли по t-критерию Стьюдента. Результаты эксперимента представлены в таблице.
Установлено, что соединение (Iв) проявляет достоверный противоязвенный эффект в дозе 30 мг/кг. Соединение (Iв) снижает число язв до 16 (в 2.2 раза меньше изъязвлений, чем в в контрольной группе, 37), аналогично аналогу по структуре и свойствам (IV) (количество язв 19). Соединение (Iв) проявляет высокую противоязвенную активность, его эффект аналогичен действию препарата сравнения (IV) и значительно снижает тяжесть поражения, что отражается в значении ИП=1.8 (в контрольной группе 5.0) и ПА=2.8 (у аналога по свойствам 2.3).
Таким образом, заявляемое изобретение обладает следующими преимуществами, а именно:
- новые 13-E-(1R,3R-2,4-диоксо-l,2,3,4-тетрагидропиримидин-5-ил)эвдесманолиды формулы (Ia-в) обладают низкой токсичностью и высокой противоязвенной активностью на модели «индометациновые» язвы в дозе, составляющей 1/133 от ЛД50;
- заявляемые соединения (Ia-в) синтезируются из доступного лактона растительного эвдесманового типа - изоалантолактона.
(3aR,4aS,8aR,9aR,E)-3-Арилиден-8a-метил-5-метилендекагидронафто[2,3-b]фуран-2(3H)-оны формулы (Ia-в) где обладающие противоязвенной активностью.