Результат интеллектуальной деятельности: НАБОР СИНТЕТИЧЕCКИХ ОЛИГОНУКЛЕОТИДОВ ДЛЯ ВЫЯВЛЕНИЯ ВИДОВОЙ ПРИНАДЛЕЖНОСТИ СУШЕНИЦЫ БОЛОТНОЙ (Filaginella uliginosa (L.) Opiz)
Вид РИД
Изобретение
Изобретение относится к области молекулярной генетики, геносистематики и фармакогнозии. Использование набора синтетических олигонуклеотидов позволяет достоверно идентифицировать видовую принадлежность лекарственного растения - сушеницы болотной (Filaginella uliginosa (L.) Opiz). Изобретение может быть использовано для выявления видовой принадлежности данного растения; в ходе проведения скрининга растительного сырья, для контроля на соответствие состава, декларированного производителем.
Среди большого количества методов генодиагностики с целью идентификации присутствия ДНК интересующего вида растений в образце в качестве основы нашего изобретения был принят формат ПЦР с детекцией в режиме реального времени на основе разрушаемого зонда. ПЦР в реальном времени имеет преимущество перед обычными ПЦР-системами идентификации - отсутствие необходимости последующего анализа, что минимизирует риск контаминации в лаборатории. Характерна также повышенная чувствительность и отсутствие ложноположительного результата при неспецифичном отжиге праймеров. Кроме того, следует отметить обеспеченность практически всех молекулярно-генетических диагностических лабораторий оборудованием, необходимым для проведения ПЦР с детекцией в режиме реального времени, и широкое использование метода в клинической диагностике и органами госконтроля. При проведении анализа методов детекции продукта полимеразной цепной реакции выбран метод на основе разрушаемого зонда, так как он относится к специфичным методам детекции, возможно свободное использование без нарушения авторских и смежных прав (первоначально система разрушаемого зонда предложена в 1991 году, при этом все патенты на настоящий момент закончили свое действие).
Техническим результатом заявляемого изобретения является разработка праймеров и разрушаемых зондов на основе данных видоспецифичных нуклеотидных последовательностей ядерной ДНК растений. В качестве видоспецифичных участков нами используется ITS2 фрагмент ядерной ДНК (internal transcribed spacer 2), обладающий большой копийностью в геноме [Alvarez, I. & Wendel, J. F. (2003) Ribosomal ITS sequences and plant phylogenetic inference // Mol. Phylogenet. Evol. 29, 417-434] и используемый в проектировании системы ДНК-баркодинга. В этом регионе показана высокая вариабельность и потенциальная применимость в качестве маркерного участка [Stoeckle, М. (2003) Use of DNA barcodes to identify flowering plants // Bioscience 53, 2-3].
Прототип - рассмотрим идентификацию лекарственных растений с использованием фрагмента ITS2, амплифицированного специфичными праймерами [Chiou SJ, Yen JH, Fang CL, Chen HL, Lin TY Authentication of medicinal herbs using PCR-amplified ITS2 with specific primers//Planta Med. 2007, Oct; 73(13): 1421-6. Epub 2007 Oct 1]. В прототипе используются специфичные наборы праймеров BEL-1/BEL-3 и BEL-2/BEL-3 для амплификации ITS2 участка рДНК 55 лекарственных растений.
Принципиальные отличия прототипа от заявленного изобретения следующие: идентифицируется лекарственное растение с нуклеотидными последовательностями специфичных праймеров, отличных от заявленных. Набор синтетических олигонуклеотидов для выявления видовой принадлежности лекарственного растения - сушеницы болотной (Filaginella uliginosa (L.) Opiz), включающий проведение полимеразной цепной реакции с фрагментом ITS2 ядерной ДНК, для идентификации данного растения используют специфичные прямой, обратный праймеры и разрушаемый зонд.
Работа над созданием праймеров строится следующим образом. 1) С помощью открытых и коммерческих баз данных нуклеотидных последовательностей различных видов растений либо в результате самостоятельного определения нуклеотидной последовательности растений выбирается участок генома, встречающийся у всех видов.
2) На основании выбранного участка генома с помощью специального программного обеспечения или вручную подбирается последовательность олигонуклеотидов, используемых для проведения ПЦР-реакции (2 праймера и зонд). На данном этапе работа заключается в создании выравнивания многих последовательностей и выборе участка последовательности, где присутствуют отличия для создания прямого, обратного праймеров и зонда. Выравнивание геномных последовательностей означает сравнение последовательностей многих видов друг с другом, поиск гомологичных для растений участков.
3) Изготовление праймеров и зонда производится на автоматических синтезаторах.
4) С помощью практических экспериментов доказывается пригодность подобранных последовательностей для конкретных целей.
Анализ нуклеотидного полиморфизма последовательности ITS2 на основании данных NCBI (http://www.ncbi.nlm.nih.gov/) и секвенированных de novo последовательностей видов, не размещенных в генбанке, позволяет применить данные последовательности в качестве основы для создания праймеров. Для детекции накопления продукта ПЦР в ходе реакции используют технологию с разрушаемым зондом (Holland Р М, Abramson R D, Watson R, Gelfand D H. Detection of specific polymerase chain reaction product by utilizing the 5'-3' exonuclease activity of Thermus aquaticus DNA polymerase.//Proc Natl Acad Sci U S A. 1991 August 15; 88(16): 7276-7280).
В качестве флуоресцентной метки используют, например, FAM, в качестве гасителя - BHQ1 (возможны другие комбинации флуорофоров и гасителей и это не является предметом охраны авторских прав).
Аналогичные наборы, реакционные смеси, праймеры для амплификации и выявления видовой принадлежности сушеницы болотной (Filaginella uliginosa (L.) Opiz) не известны.
Ход работы с применением набора синтетических олигонуклеотидов для амплификации состоит из следующих шагов.
Пример:
1) Растительный материал перед проведением ПЦР с помощью заявляемого набора проводится через процедуру пробоподготовки с использованием набора Diamont DNA kit, в соответствии с инструкцией производителя; в ходе этой процедуры из растительного материала выделяется ДНК, которую в свою очередь используют для ПЦР.
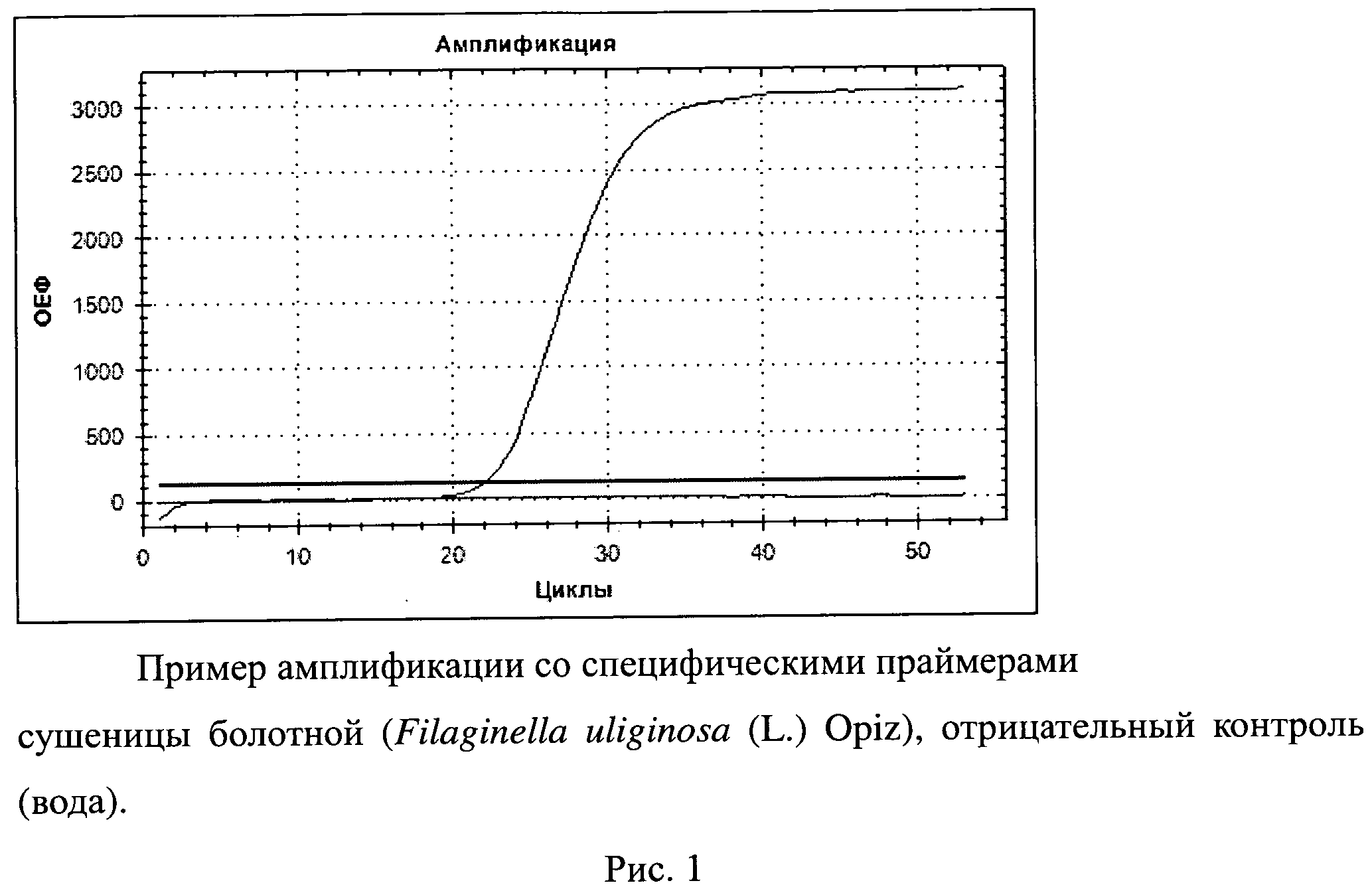
2) Полимеразную цепную реакцию проводят на амплификаторе CFX96 (Bio-Rad, USA). Амплификация проводится по следующей программе: 1 цикл: 95°С - 3 мин; 40 циклов: 95°С - 10 сек, 58°С - 30 сек (на данной стадии производится сканирование уровня флуоресценции). Инкубационная смесь, конечным объемом 25 мкл, содержит: 14,1 мкл Н2O; 2 мкл ДНК; 2,5 мкл 10Х буфер; 2,5 мкл 25 мМ MgC12; по 1 мкл 10 мМ каждого праймера; 0,5 мкл зонда; 1,2 мкл 20 мМ dNTPs; 0,2 мкл Taq-полимеразы. Результат амплификации определяют по нарастанию уровня флуоресценции, рис.1.
Для выявления сушеницы болотной (Filaginella uliginosa (L.) Opiz) в качестве прямого праймера используется последовательность ДНК со следующим нуклеотидным составом: 5'-СAACGGATATCTCGGCTCАС-3', в качестве обратного праймера используется последовательность ДНК со следующим нуклеотидным составом: 5'-GTACGACTCAAGACGCACAA-3', в качестве разрушаемого зонда используется последовательность ДНК со следующим нуклеотидным составом: (флуоресцентная метка)-5'-CCGTGAACC ATCGAGTTTTT-3'-(гаситель).
Гаситель располагается на 5'-конце, а флуоресцентная метка на 3'-конце разрушаемых зондов.
Разработан набор синтетических олигонуклеотидов для выявления видовой принадлежности лекарственного растения - сушеницы болотной (Filaginella uliginosa (L.) Opiz) методом полимеразной цепной реакцией с детекцией в режиме реального времени. Набор обладает высокой чувствительностью и специфичностью, позволяет быстро и достоверно провести идентификацию рассмотренного лекарственного растения.
Набор синтетических олигонуклеотидов для выявления видовой принадлежности сушеницы болотной (Filaginella uliginosa (L.) Opiz), включающий проведение полимеразной цепной реакции с фрагментом ITS2 ядерной ДНК, отличающийся тем, что для идентификации используют видоспецифичные участки для создания прямого, обратного праймеров и разрушаемого зонда, где в качестве прямого праймера - последовательность ДНК со следующим нуклеотидным составом: 5'-CAACGGATATCTCGGCTCAC-3'; обратного праймера - последовательность ДНК со следующим нуклеотидным составом: 5'-GTACGACTC AAGACGC АСАА-3'; разрушаемого зонда - последовательность ДНК со следующим нуклеотидным составом: (флуоресцентная метка)-5'-CCGTGAACC ATCGAGTTTTT-3'-(гаситель).