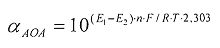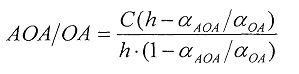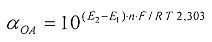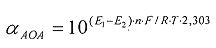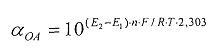Результат интеллектуальной деятельности: СПОСОБ ПОТЕНЦИОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНТИОКСИДАНТНОЙ/ОКСИДАНТНОЙ АКТИВНОСТИ С ИСПОЛЬЗОВАНИЕМ КОМПЛЕКСОВ МЕТАЛЛОВ
Вид РИД
Изобретение
Изобретение относится к области электрохимических методов анализа, в частности к анализу растворов на предмет определения суммарной антиоксидантной/оксидантной активности.
Известен способ количественного определения оксидантов и/или антиоксидантов в коже [Международная публикация WO/1996/013193], заключающийся в определении потенциала тестового раствора, содержащего FeCl3 или комплекс ADP-Fe(III) для определения антиоксидантов и систему I2/Nal для определения оксидантов, введенного в контакт с кожей.
К недостаткам данного способа можно отнести то, что в тестовом растворе используются только водные среды, что не позволяет анализировать широкий круг важных органических антиоксидантов и оксидантов. Кроме того, используется кислый раствор (pH=2), что не моделирует реальные процессы, происходящие в организме в нейтральной среде. Измеряется только одно значение потенциала, которое зависит от множества факторов и не дает достоверной информации о количестве антиоксидантов/оксидантов, т.к. не учитывается исходное состояние системы. Также результат измерения выражают в виде потенциала. Не оценивается собственно величина оксидантной и/или антиоксидантной активности, что усложняет интерпретацию получаемых результатов. Также использование системы I2/Nal снижает достоверность получаемых результатов из-за повышенной летучести I2.
Известен способ определения антиоксидантов в растворе [Международная публикация US 6177260 B1], основанный на использовании в качестве окислителя комплекса Fe(III)-трипиридилтриазина, который при взаимодействии с антиоксидантами восстанавливается до Fe(II)-трипиридилтриазина, окрашенного в синий цвет (максимум поглощения при 593 нм).
Недостатком этого способа является то, что метод является не чувствительным к сульфгидрильным SH-содержащим антиоксидантам, таким как глутатион и цистеин, являющимся одним из основных звеньев антиоксидантной системы защиты организма, поэтому метод не позволяет оценить суммарное содержание антиоксидантов в исследуемом объекте. Кроме того, в способе используется также кислый раствор, что не моделирует реальные процессы, происходящие в организме в нейтральной среде.
Наиболее близким решением служит способ определения оксидантной/антиоксидантной активности растворов (RU 2235998), заключающийся в том, что предварительно готовят исходный раствор, в который вводят медиаторную систему, содержащую одновременно окисленную и восстановленную формы реагента, а оценку оксидантной/антиоксидантной активности проводят по изменению окислительно-восстановительного потенциала раствора, определенного до и после введения в исходный раствор анализируемого вещества.
К недостаткам данного способа можно отнести то, что в данном способе в качестве медиаторной системы могут быть Ox/Red пары химических элементов или соединений. Использование одновременно двух форм системы существенно усложняет выбор компонентов медиаторной системы, которые необходимо варьировать в зависимости от круга анализируемых соединений, особенно в апротонных средах для анализа органических соединений. Кроме того, при предложенном алгоритме не учитывается влияние матрицы изучаемого объекта на изменение потенциала системы. Также в данном способе в органических растворителях предлагается применять систему ферроцен/феррициний, использование которой несмотря на хорошую обратимость крайне затруднительно из-за неустойчивости ионов феррициния. И как было отмечено, использование системы I2/I- снижает точность получаемых результатов.
Задачей, решаемой данным изобретением, служит повышение точности, достоверности и воспроизводимости результатов, увеличение экспрессности анализа, расширение круга используемых реагентов и растворителей, анализируемых веществ.
Задача решается тем, что в качестве реагента используют только одну окисленную или восстановленную форму металла в составе комплексного соединения. Таким образом, расширяется круг используемых реагентов и круг исследуемых объектов в различных растворителях. Благодаря тому, что концентрация исходного раствора окисленной/восстановленной формы значительно больше концентрации антиоксидантов/оксидантов в исследуемом образце, химическая реакция протекает быстро и устанавливается равновесие между избытком окисленной/восстановленной формы металла в составе комплексного соединения и образовавшейся восстановленной/окисленной формой комплекса металла. За счет быстрого протекания реакции и быстрого установления равновесия в растворе увеличивается экспрессность анализа. Измерение потенциала проводится после прохождения химической реакции между антиоксидантами/оксидантами анализируемого вещества и используемым реагентом и последующей добавки раствора реагента или анализируемого вещества, что также приводит к увеличению экспрессности анализа. Анализ проводится путем введения двух последовательных добавок сначала анализируемого вещества в раствор реагента, а затем добавки также раствора анализируемого вещества или реагента. Таким образом, это позволяет учесть влияние матрицы сложных объектов на изменение потенциала и повысить воспроизводимость, точность, достоверность. Также в случае второй добавки реагента, а не анализируемого вещества, значительно экономится объем исследуемого объекта в тех случаях, когда это необходимо.
Сущность заявляемого способа заключается в том, что определение антиоксидантной/оксидантной активности проводят по разности потенциалов, один из которых измеряется после прохождения химической реакции между антиоксидантами/оксидантами анализируемого вещества и используемым реагентом, а второй - после следующей добавки реагента или анализируемого вещества.
В качестве реагента может быть использована окисленная форма металла в составе комплексного соединения. В этом случае антиоксиданты в составе анализируемого вещества реагируют с окисленной формой реагента. Определение проводят по двукратной добавке анализируемого вещества. Антиоксидантную активность в этом случае рассчитывают по формуле:
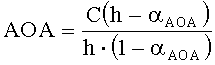 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента в исходном растворе, М;
αАОА=10(E 1 -E 2 )·n·F/R·T·2,303
E1 - потенциал, измеренный после введения первой добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения второй добавки раствора анализируемого вещества, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Если объем анализируемого вещества ограничен, определение проводят по однократной добавке анализируемого вещества и последующей добавке реагента. Антиоксидантную активность в этом случае рассчитывают по формуле:
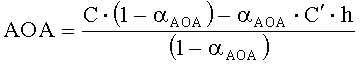 ,
,
где АОА - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,203
E1 - потенциал, измеренный после введения добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения добавки раствора окисленной формы реагента, B;
C′ - концентрация окисленной формы реагента во второй добавке, М;
h - отношение объема второй добавки к общему объему раствора.
В качестве реагента может быть использована восстановленная форма металла в составе комплексного соединения. В этом случае оксиданты в составе анализируемого вещества реагируют с восстановленной формой реагента. Определение проводят по двукратной добавке анализируемого вещества. Оксидантную активность рассчитывают по формуле:
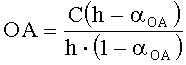 ,
,
где OA - оксидантная активность, М-экв;
C - концентрация восстановленной формы реагента в исходном растворе, М;
αOA=10(E 1 -E 2 )·n·F/R·T·2,303
E1 - потенциал, измеренный после введения первой добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения второй добавки раствора анализируемого вещества, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Если объем анализируемого вещества ограничен, то определение проводят по однократной добавке анализируемого вещества и последующей добавке реагента. Оксидантную активность в этом случае рассчитывают по формуле:
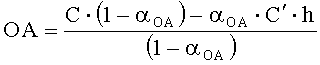 ,
,
где OA -оксидантная активность, М-экв;
C - концентрация восстановленной формы реагента в исходном растворе, М;
αOA=10(E 1 -E 2 )·n·F/R·T·2,303
Е1 - потенциал, измеренный после введения добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения добавки раствора восстановленной формы реагента, B;
C′ - концентрация восстановленной формы реагента во второй добавке, М;
h - отношение объема второй добавки к общему объему раствора.
Таким образом, в обобщенном виде антиоксидантную/оксидантную активность рассчитывают по формулам:
1) по двукратной добавке анализируемого вещества:
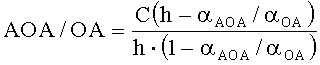 ,
,
где AOA - антиоксидантная активность, М-экв;
OA - оксидантная активность, М-экв;
C - концентрация окисленной/восстановленной формы реагента в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303
αOA=10(E 2 -E 1 )·n·F/R·T·2,303
E1 - потенциал, измеренный после введения первой добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения второй добавки раствора анализируемого вещества, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора;
2) по однократной добавке анализируемого вещества и последующей добавке реагента
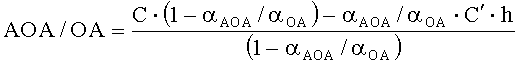 ,
,
где AOA - антиоксидантная активность, М-экв;
OA- оксидантная активность, М-экв;
C - концентрация окисленной/восстановленной формы реагента в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303
αOA=10(E 2 -E 1 )·n·F/R·T·2,303
E1 - потенциал, измеренный после введения добавки раствора анализируемого вещества, B;
E2 - потенциал, измеренный после введения добавки раствора окисленной формы реагента, B;
C - концентрация окисленной/восстановленной формы реагента во второй добавке, M;
h - отношение объема второй добавки к общему объему раствора.
В качестве реагентов могут быть использованы комплексные соединения металлов переменной валентности с неорганическими лигандами, например K3[Fe(CN)6], K4[Fe(CN)6], K3[Mn(CN)6], K4[Mn(CN)6], K3[Mo(CN)8], K4[Mo(CN)8], [Fe(SCN)3], [Fe(SCN)2], также комплексные соли металлов переменной валентности с органическими лигандами, например тетраэтиламмония гексацианоферрат (III), тетраэтиламмония гексацианоферрат (II), тетрабутиламмония гексацианоманганат (III), тетраэтиламмония тетрахлороферрат (III), тетраэтиламмония тетрахлороферрат (II), Fe(II)-PDT, Fe(II)-TPTZ, Fe(III)-TPTZ, дикетонаты железа, никеля, кобальта. В качестве растворителей используются гидрофильные, гидрофобные и смешанные растворители.
В качестве протонных растворителей могут быть использованы вода, спирты и др., в качестве апротонных: хлороформ, ацетонитрил, гексан, ацетон и различные эфиры. Также может быть использована смесь растворителей.
Рабочий электрод может быть изготовлен из платины, золота стеклоуглерода.
Электродом сравнения в водных растворах может служить стандартный хлорсеребряный электрод, в органических растворителях - двуключевой хлоридсеребрянный электрод, первая емкость которого заполнена водой, содержащей хлорид-ионы, вторая емкость - органическим растворителем, например ацетонитрилом, содержащим, например, перхлорат лития или тетраэтиламмония тетрафторборат. В органических средах также может быть использован электрод первого рода Ag/AgNO3 в органическом растворителе.
Указанные отличия существенны. Использование в качестве реагента одной окисленной или восстановленной формы металла в составе комплексного соединения позволяет расширить круг используемых реагентов и круг исследуемых объектов в различных растворителях. Концентрация исходного раствора окисленной/восстановленной формы значительно больше концентрации антиоксидантов/оксидантов в исследуемом образце, поэтому химическая реакция протекает быстро и устанавливается равновесие между избытком окисленной/восстановленной формы металла в составе комплексного соединения и образовавшейся восстановленной/окисленной формой комплекса металла, что увеличивает экспрессность метода. Измерение потенциала проводится после прохождения химической реакции, что сокращает число измерительных стадий и также увеличивает экспрессность метода. Введение двух последовательных добавок раствора анализируемого вещества существенно повышает точность, достоверность и воспроизводимость результатов, что позволяет анализировать различные объекты со сложной матрицей.
В настоящее время из патентной и научно-технической литературы не известен способ определения антиоксидантной/оксидантной активности в заявляемой совокупности признаков.
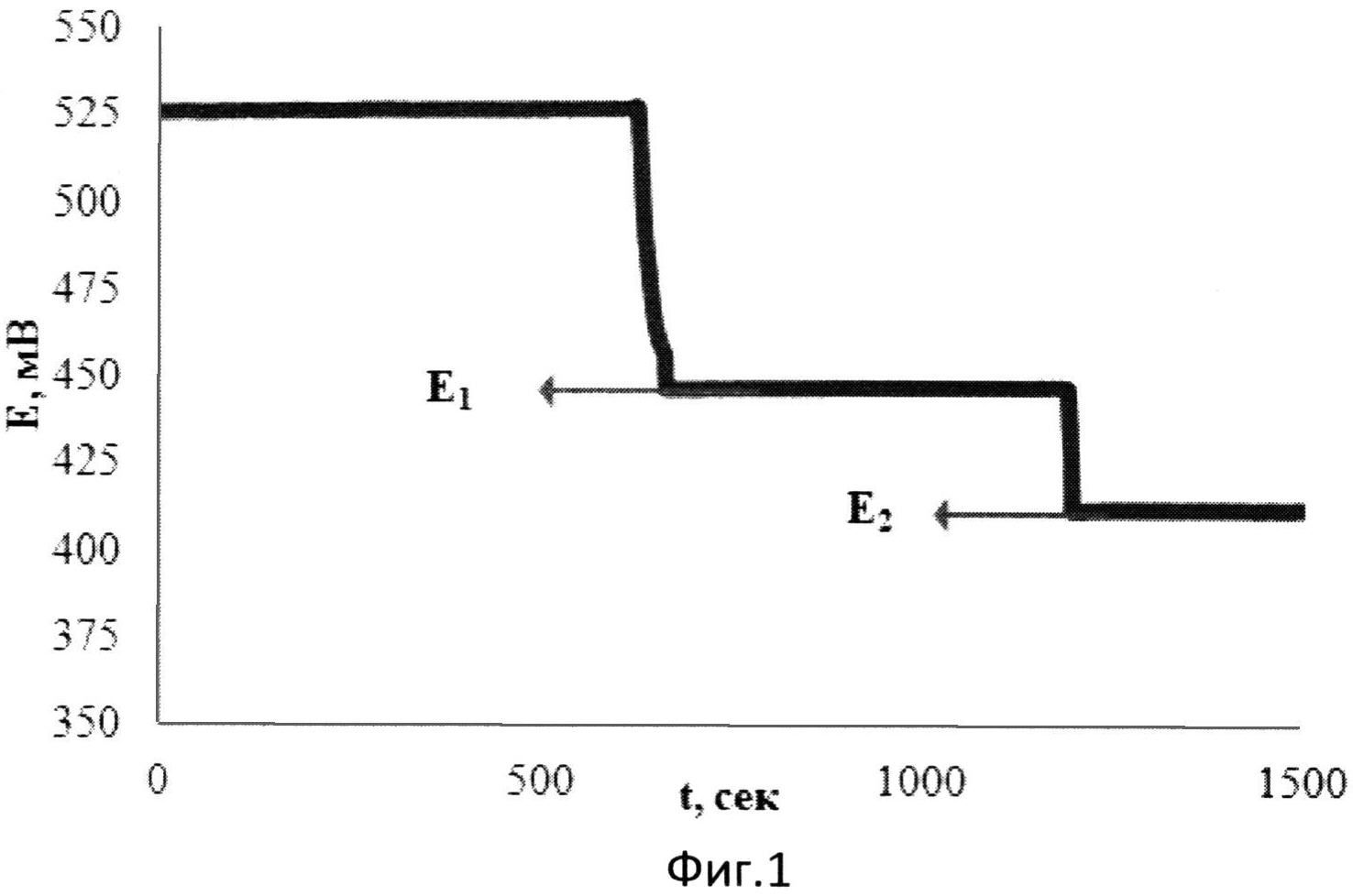
На фиг.1 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)3] двух добавок аскорбиновой кислоты в водной среде.
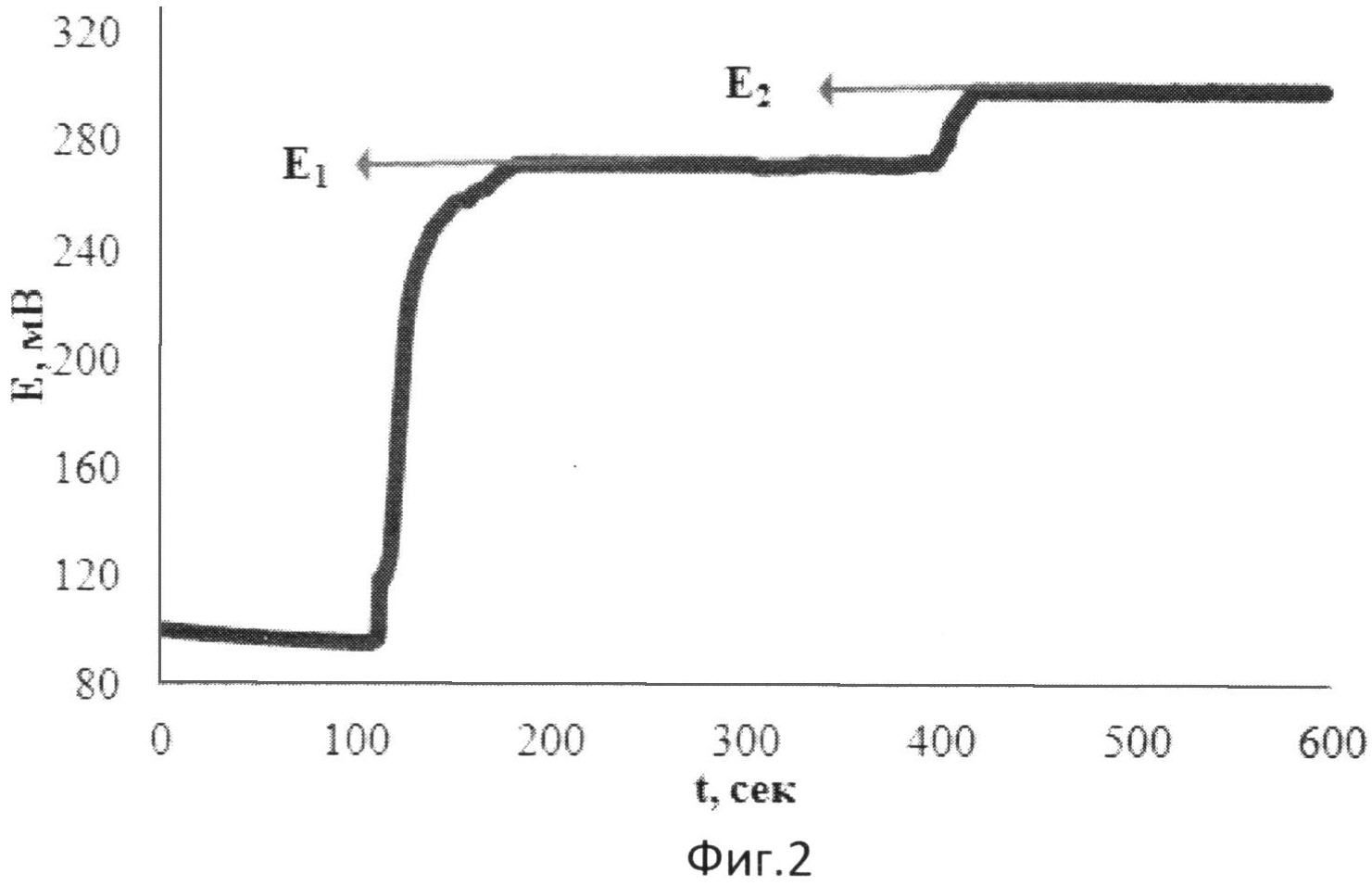
На фиг.2 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)2] двух добавок пероксида водорода в водной среде.
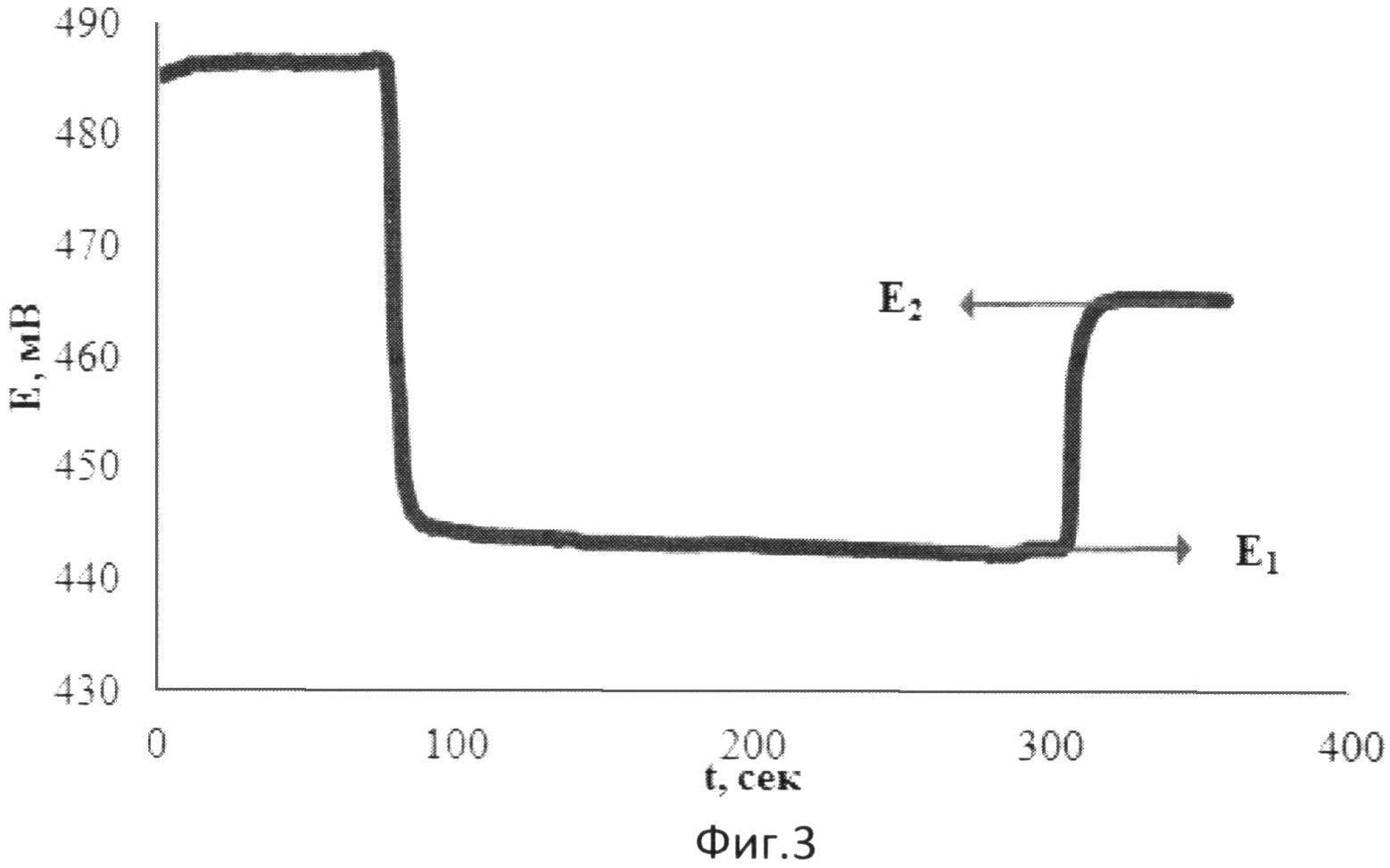
На фиг.3 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)3] аскорбиновой кислоты и последующей добавки [Fe(SCN)3].
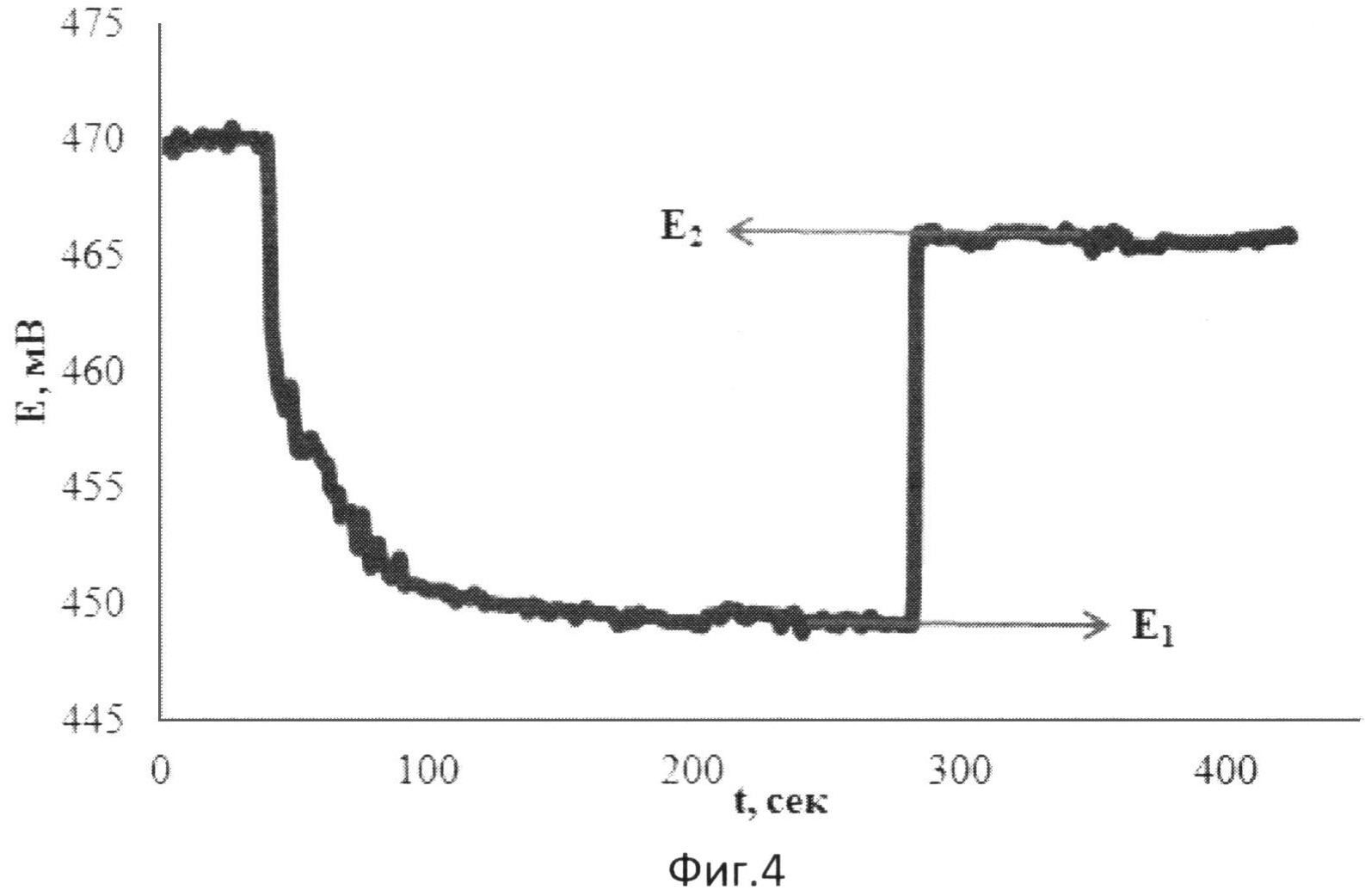
На фиг.4 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)3] зеленого чая и последующей добавки [Fe(SCN)3].
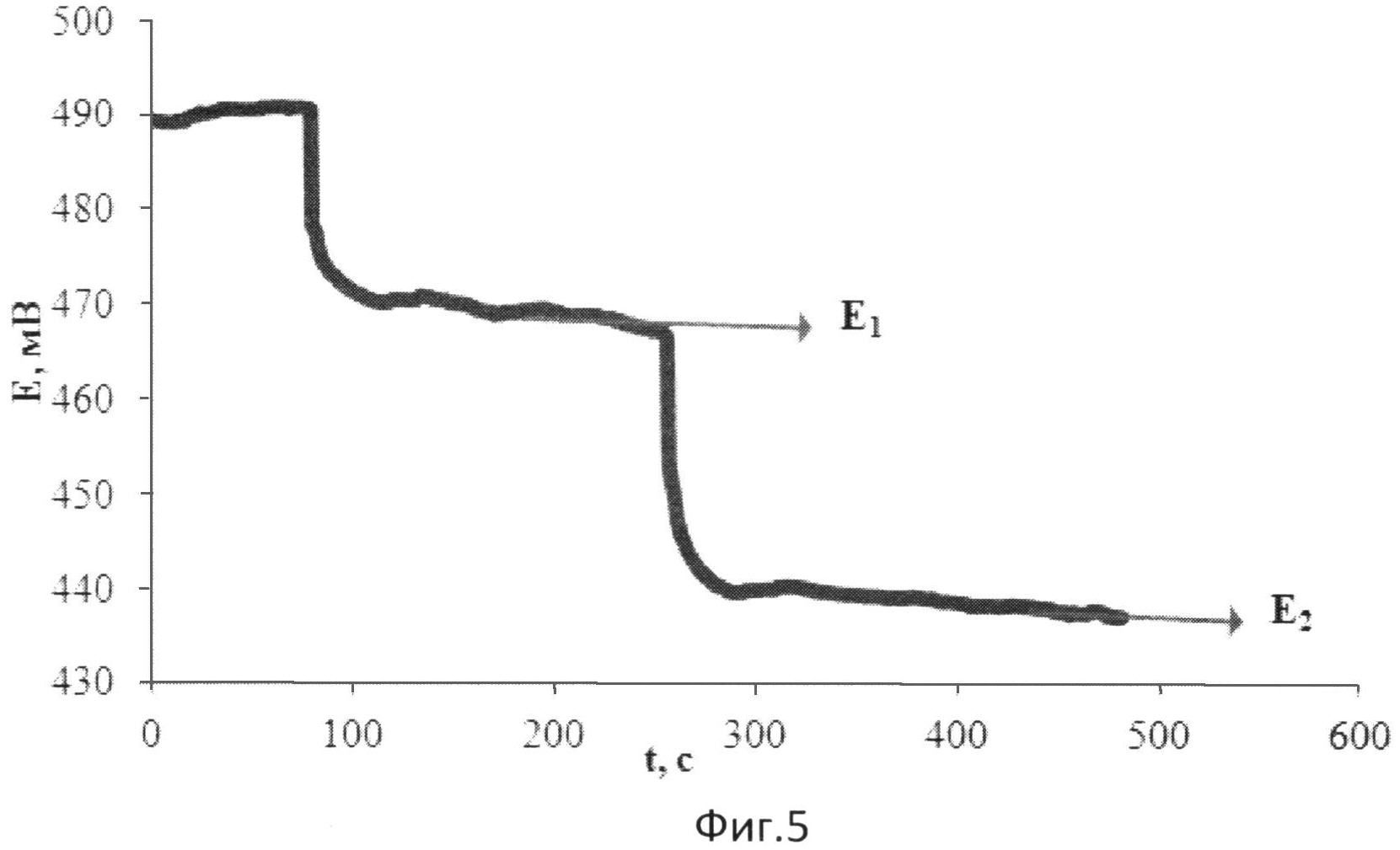
На фиг.5 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)3] в хлороформе двух добавок раствора токоферола в хлороформе (электролит: 0,05М тетраэтиламмония тетрофторборат).
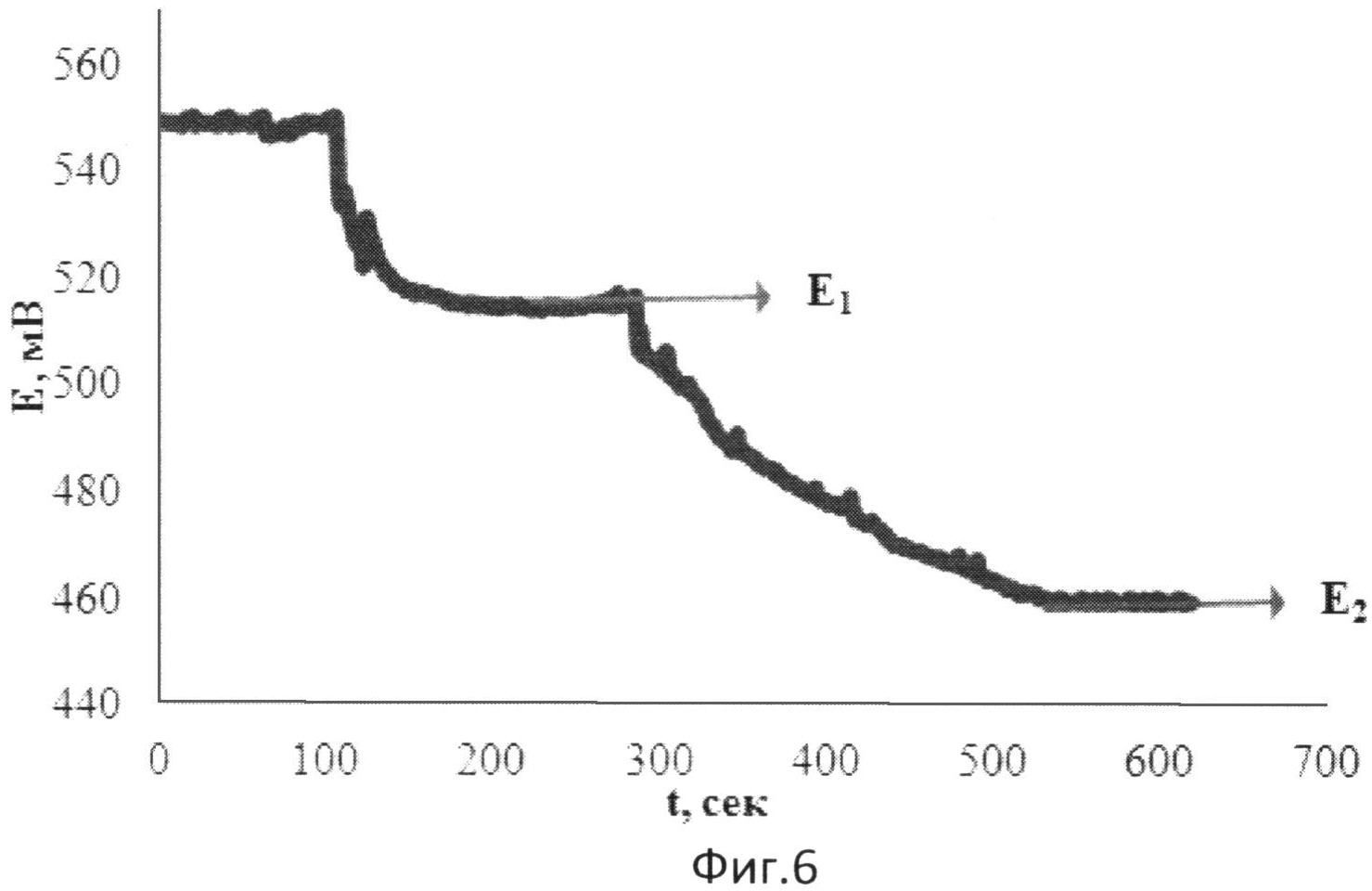
На фиг.6 представлена зависимость потенциала от времени при добавлении к [Fe(SCN)3] в хлороформе двух добавок нерафинированного подсолнечного масла (электролит: 0,05М тетраэтиламмония тетрофторборат).
Способ иллюстрируется следующими примерами.
Пример 1
В 1 мл водного раствора, содержащего 0,01М [Fe(SCN)3], опускают рабочий электрод и электрод сравнения и вносят 0,075 мл 0,02М аскорбиновой кислоты. Установившееся значение потенциала (E1) составляет 446 мВ. Далее вносят вторую добавку 0,019 мл того же раствора аскорбиновой кислоты. Установившееся значение потенциала (E2) составляет 412 мВ.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
n[Fe(SCN)3]+AK=n[Fe(SCN)2]+AKOX,
где AK - аскорбиновая кислота, AKOX - продукт окисления аскорбиновой кислоты.
Результаты измерений приведены на фиг.1. Антиоксидантную активность рассчитывают по формуле:
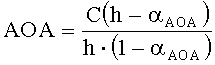 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента [Fe(SCN)3] в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения первой добавки раствора аскорбиновой кислоты, B;
E2 - потенциал, измеренный после введения второй добавки раствора аскорбиновой кислоты, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Расчет показывает, что с учетом разбавления AOA равна 0,04 М-экв, что соответствует наличию двух функциональных групп в молекуле аскорбиновой кислоты, определяющих ее антиоксидантные свойства, т.е. n равно 2, что соответствует действительности.
Пример 2
В 1 мл водного раствора, содержащего 0,01М [Fe(SCN)2], в фосфатном буферном растворе опускают рабочий электрод и электрод сравнения и вносят 0,060 мл 0,01М раствора Н2O2. Установившееся значение потенциала (E1) составляет 272 мВ. Далее вносят вторую добавку 0,060 мл того же раствора Н2O2. Установившееся значение потенциала (E2) составляет 298 мВ.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
n[Fe(SCN)2]+H202=n[Fe(SCN)3]+H2O2Red,
где H2O2Red - продукты восстановления пероксида водорода.
Результаты измерений приведены на фиг.2.
Оксидантную активность в этом случае рассчитывают по формуле:
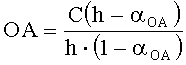 ,
,
где OA - оксидантная активность, М-экв;
C - концентрация восстановленной формы реагента [Fe(SCN)2] в исходном растворе, М;
αOA=10(E 1 -E 2)·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения первой добавки раствора Н2O2, B;
E2 - потенциал, измеренный после введения второй добавки раствора Н2O2, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Расчет показывает, что с учетом разбавления OA равна 0,02 M-экв, что соответствует двухэлектронному восстановлению пероксида водорода.
Пример 3
В 5 мл водного раствора, содержащего 0,002М [Fe(SCN)3], опускают рабочий электрод и электрод сравнения и вносят 0,1 мл 0,01375М аскорбиновой кислоты. Установившееся значение потенциала (E1) составляет 442 мВ. Далее вносят 0,04 мл 0,025М [Fe(SCN)3]. Установившееся значение потенциала (E2) составляет 464 мВ.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
n[Fe(SCN)3]+AK=n[Fe(SCN)2]+АКOX,
где AK - аскорбиновая кислота, АКOX - продукт окисления аскорбиновой кислоты.
Результаты измерений приведены на фиг.3. Антиоксидантную активность в этом случае рассчитывают по формуле:
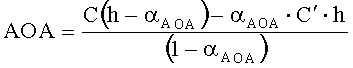 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента [Fe(SCN)3] в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения добавки раствора аскорбиновой кислоты, B;
E2 - потенциал, измеренный после введения добавки раствора окисленной формы реагента [Fe(SCN)3], B;
C - концентрация реагента [Fe(SCN)3] во второй добавке, M;
h - отношение объема второй добавки к общему объему раствора.
Расчет показывает, что AOA равна 0,027 М-экв, что соответствует наличию двух функциональных групп в молекуле аскорбиновой кислоты, определяющих ее антиоксидантные свойства, т.е. n равно 2, что соответствует действительности.
Пример 4
В 5 мл водного раствора, содержащего 0,002М [Fe(SCN)3], опускают рабочий электрод и электрод сравнения и вносят 0,1 мл зеленого чая в качестве реального объекта, содержащего антиоксиданты. Установившееся значение потенциала (E1) составляет 431 мВ. Далее вносят 0,04 мл 0,025М [Fe(SCN)3]. Установившееся значение потенциала (E2) составляет 455 мВ.
Результаты измерений приведены на фиг.4.
Антиоксидантную активность в этом случае рассчитывают по формуле:
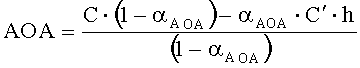 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента [Fe(SCN)3] в исходном растворе, M; α=10(E 1 -E 2 )·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения добавки раствора зеленого чая, B;
E2 - потенциал, измеренный после введения добавки раствора окисленной формы реагента [Fe(SCN)3], B;
C′- концентрация реагента [Fe(SCN)3] во второй добавке, M;
h - отношение объема второй добавки к общему объему раствора.
Расчет показывает, что АОА равна 0,036 М-экв.
Пример 5
В 5 мл раствора, содержащего 0,01М [Fe(SCN)3] в хлороформе и тетраэтиламмония тетрафторборат в качестве электролита, опускают рабочий электрод и электрод сравнения и вносят 0,25 мл 0,060 М раствора токоферола в хлороформе. Установившееся значение потенциала (E1) составляет 469 мВ.
Далее вносят такое же количество токоферола. Установившееся значение потенциала (E2) составляет 438 мВ.
Изменение потенциала при этом происходит в результате протекания химической реакции в растворе:
n[Fe(SCN)3]+токоферол=n[Fe(SCN)2]+токоферолOX,
где токоферолOX - продукт окисления токоферола.
Результаты измерений приведены на фиг.5.
Антиоксидантную активность рассчитывают по формуле:
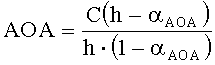 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента [Fe(SCN)3] в исходном растворе, M;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения первой добавки раствора токоферола, B;
E2 - потенциал, измеренный после введения второй добавки раствора токоферола, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Расчет показывает, что с учетом разбавления AOA равна 0,058 M-экв, что соответствует наличию одной функциональной группы в молекуле токоферола, определяющей его антиоксидантные свойства, что соответствует действительности.
Пример 6
В 5 мл раствора, содержащего 0,001М [Fe(SCN)3] в хлороформе и тетраэтиламмония тетрафторборат в качестве электролита, опускают рабочий электрод и электрод сравнения и вносят 1 мл подсолнечного нерафинированного масла в качестве реального объекта, содержащего антиоксиданты. Установившееся значение потенциала (E1) составляет 515 мВ. Далее вносят такое же количество нерафинированного масла. Установившееся значение потенциала (E2) составляет 469 мВ.
Результаты измерений приведены на фиг.6.
Антиоксидантную активность рассчитывают по формуле:
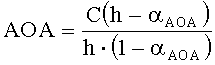 ,
,
где AOA - антиоксидантная активность, М-экв;
C - концентрация окисленной формы реагента [Fe(SCN)3] в исходном растворе, М;
αAOA=10(E 1 -E 2 )·n·F/R·T·2,303;
E1 - потенциал, измеренный после введения первой добавки раствора нерафинированного масла, B;
E2 - потенциал, измеренный после введения второй добавки раствора нерафинированного масла, B;
h - отношение общего объема добавленного раствора к объему первой добавки раствора.
Расчет показывает, что с учетом разбавления АОА равна 0,0022 М-экв.