Результат интеллектуальной деятельности: ШТАММ Bacillus lentus - ПРОДУЦЕНТ БАКТЕРИОЦИНОПОДОБНОЙ СУБСТАНЦИИ АНТИМИКРОБНОГО ДЕЙСТВИЯ И СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИОЦИНОПОДОБНОЙ СУБСТАНЦИИ
Вид РИД
Изобретение
Изобретение относится к области микробиологии, биотехнологии, в частности к получению бациллярного штамма в качестве продуцента антимикробного вещества, которое может быть применимо в качестве стимулирующей рост добавки в корм птицы взамен антибиотиков для применения в ветеринарии и сельском хозяйстве.
УРОВЕНЬ ТЕХНИКИ
Виды Bacillus в составе пробиотиков так называемых «живых лекарств» и добавок в пищу, допущенных для потребления людьми и животными, включают лишь отдельные виды бацилл B. subtilis, B. lichenformis, B. coagulans, B. toyoi (cereus), B. natto (subtilis), B. clausii (lentus), B. polyfermentans и В. cereus [Hoa N.T., Baccigalupi L., Huxham A. etal., 2000; Lee K.H., Jun K.D., Kim W.S. et al., 2001; Pinchuk I.V., Bressollier P., Verneuil B. et al., 2001; Sanders M.E., Morelli L., Tompkins Т., 2003]. Бактерии Bacillus lentus (в англоязычной литературе более известные как Bacillus clausii) являются частью непатогенной транзитной микрофлоры кишечника человека и животных, но имеют свои характерные отличия [Urdaci, Maria С., Bressollier, Ph., Pinchuk, I, 2004; Senesi S., Celandroni F., Tavanti A. et al., 2001]. Известно, что бактерии этого вида толерантны к щелочи и являются известными продуцентами сильно щелочной протеазы [Denizci А.А., Kazan D., Abeln E.C.A., and Erarslan A., 2004]. В исследованиях было установлено, что В. clausii безопасны и эффективны в лечении респираторных инфекций, острых отитов у детей, а также оказывают целый ряд положительных эффектов на организм человека, особенно на иммунную систему [Marseglia G.L., Tosca M., Cirillo I., et al., 2007]. Спектр антимикробной активности большинства пробиотических штаммов бацилл ограничивается грамположительными видами микроорганизмов. Это, например, относится к четырем штаммам B.clausii (lentus), - О/С, N/R, SIN и Т (препарат Enterogermina®), B.subtilis 3, B.licheniformis 31 (препарат Biosporine), B.cereus IP 5832 (препарат Bactisubtil), B.cereus NT (препарат Biosubtyl), B.cereus DM-423 (препарат Cereobiogen) и эталонного B.subtilis 168 [Hoa N.T., Baccigalupi L., Huxham A. et al., 2000; Sanders M.E., Morelli L., Tompkins Т., 2003]. Ни один из них не обладал активностью против грамотрицательных бактерий. Поэтому актуален поиск микроорганизмов с широким спектром антимикробной активности для применения их как в составе нового поколения препаратов пробиотиков, так и в качестве продуцентов бактериоциноподобных веществ (БПС; в англоязычной литературе BLlS - bacteriocin-like inhibitory substances) - возможной альтернативы антибиотиков. Это способствовало бы разработкам новых препаратов для борьбы с микроорганизмами, устойчивыми к антибиотикам.
Широко известны антагонистически активные штаммы бацилл, входящие в состав пробиотических препаратов: B.subtilis 534 - пробиотик «Споро-бактерин» патент SU 1708350, B.subtilis 3H - пробиотик «Бактис-порин» патент RU 2067616. В основном все они действуют на грамположительные бактерии, что является основным их недостатком, равно как и пробиотических препаратов на их основе.
Известны штаммы В. clausii в составе фармацевтических композиций, которые предлагают в разных соотношениях адсорбировать на твердой матрице [US-A-4935353, WO-A-9949877, GB-A-1061894].
Известен штамм B.clausii (lentus) NG121 продуцент нового бактериоцина, активного против листерий и золотистого стафилококка [Sharma N, Kapoor G, Neopaney В]. Этот бактериоцин авторы предлагают использовать в качестве биоконсерванта продуктов питания.
Известен способ получения пептида с антибактериальной активностью с использованием штамма B. clausii (заявка на патент FR №20090312262 от 2009-12-17). Однако препарат данного бактериоцина активен лишь против грамположительных бактерий - S. aureus, Enterococcus faecium, Micrococcus sp, Lactococcus lactis, Clostridium difficile, Clostridium perfringens, Listeria monocytogenes, а способ его получения отличается трудоемкостью, многостадийностью и дороговизной.
Задачей изобретения является получение нового штамма-продуцента бактериоциноподобной субстанции широкого спектра антимикробного действия, направленного против грамположительных и грамотрицательных микроорганизмов, включая Listeria spp., Clostridium spp., Bacillus anthracis, Salmonella spp., Escherichia spp., Campylobacter spp., Acinetobacter spp. и упрощение способа ее получения.
Поставленная задача решается тем, что предложен штамм Bacillus lentus В-7150 продуцент бактериоциноподобной субстанции, имеющей молекулярную массу по данным SDS-PAG электрофореза около 4 кДа, широкого спектра антимикробного действия, направленного против грамположительных и грамотрицательных микроорганизмов, включая Listeria spp., Clostridium spp., Bacillus anthracis, Salmonella spp., Escherichia spp., Campylobacter spp., Acinetobacter spp.
Также поставленная задача решается тем, что предложен способ получения бактериоциноподобной субстанции Bacillus, включающий глубинное культивирование продуцента при температуре 29-30°C, разделение культуральной жидкости, причем культивирование штамма Bacillus lentus В-7150 проводят в углеводно-дрожжевой среде на основе неорганического источника аминного азота с лимитом по кислороду и углероду, а выделение бактериоциноподобной субстанции из бесклеточной жидкости осуществляют при помощи неполярного растворителя дихлорметана, либо адсорбента типа силикагеля, а из поверхности клеток при помощи полярного растворителя этанола, с последующим высушиванием и объединением фракций для увеличения спектра антимикробной активности.
Штамм Bacillus lentus выделен из водного настоя пшеничной соломы.
Штамм Bacillus lentus депонирован в Государственной коллекции микроорганизмов и клеточных культур «ГКПМ-Оболенск». Штамму присвоен регистрационный номер: В-7150. Депозитор: Федеральное бюджетное учреждения науки «Государственный научный центр прикладной микробиологии и биотехнологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ПМБ).
Культурально-морфологические признаки штамма.
Штамм Bacillus lentus ГКПМ-Оболенск В-7150 размножается в питательных средах общего назначения (ГРМ-агар, МПА, картофельный агар) при оптимальной температуре (30±1)°C и рН 7±2. Колонии белесые, светло-кремовые, с небольшой выпуклостью, плотной консистенции, непрозрачные диаметром 23 мм и неровным краем, приятно пахнут. Клетки штамма грамположительные имеют вид длинных (до 10 мкм) тонких палочек диаметром 0,50,8 мкм, образуют короткие цепочки. С возрастом длина клеток укорачивается (до 2,54 мкм). Споры эллипсоидные располагаются ближе к центру в слегка раздутом спорангии.
Физиолого-биохимические характеристики штамма.
Штамм Bacillus lentus ферментирует без газообразовании глюкозу, фруктозу, лактозу, сахарозу, маннозу, маннит, рибозу, салицин, мальтозу, целлобиозу, трегалозу. Гидролизует желатин, казеин, крахмал, эскулин и гликоген. Не гидролизует твины (20, 40, 60, 80) и гиппурат. Индол и сероводород не образует. Редуцирует нитраты и нитриты. Продуцирует каталазу и протеолитические ферменты. В процессе роста накапливает антимикробные вещества, которые выделяются в окружающую среду и сорбируются на клетках.
Распознавание. Штамм был идентифицирован как Bacillus lentus с использованием стрипов API 50 CHB (Bio-Merieux, Франция) с % ИД=99,0; Т=0,85 (очень хорошая идентификация по V4.0)
Хранение. Штамм Bacillus lentus поддерживают для работы методом периодических пересевов на питательных средах общего назначения (ГРМ-агар, МПА, картофельный агар) и выращиванием при температуре (30±1)°C. Количество пассажей не более 5. Длительное хранение осуществляют методом лиофилизации с применением в качестве защитной среды раствора лактозы (7%) и полиглюкина (2%). Для этого 48 ч биомассу вегетативных клеток, выращенную на указанных выше агаризованных средах, смывают из чашек лактозо-полиглюкиновой защитной средой добиваясь получения оптической плотности во взвеси не менее 1,0 млрд клеток/мл по стандарту мутности Л.И. Тарасевича. Стабилизированную взвесь клеточной массы разливают в стеклянные флаконы или ампулы слоем до 10 мм, замораживают при температуре минус 50°C и лиофилизируют в течение 20-24 ч. Флаконы закрывают и укупоривают, ампулы запаивают. Емкости с лиофилизированными клетками хранят в бытовом холодильнике при температуре (4-8°)C.
Отличительной особенностью штамма Bacillus lentus является его антагонистическая активность в отношении колиформных и других грамотрицательных бактерий и некоторых видов грамположительных микроорганизмов, которая обусловлена продукцией при определенных условиях культивирования практически ценного метаболита - бактериоциноподобной субстанции (БПС) с молекулярной массой по данным SDS-PAAG (ДСН-ПААГ) электрофореза для белков около 4 кДа. Это делает возможным использование штамма Bacillus lentus в качестве продуцента антимикробных веществ, заменяющих кормовой антибиотик, а живые клетки - в качестве компонента пробиотического препарата.
Накопление штаммом Bacillus lentus БПС в практически значимых количествах происходит в строго определенных условиях глубинного культивирования - в питательной среде на основе неорганического источника аминного азота с лимитом по кислороду и углеводу при температуре 29-30°C за 24 ч.
Штамм Bacillus lentus и его метаболиты согласно настоящему изобретению используется в следующих целях.
Как продуцент бактериоциноподобной субстанции (условное название «БПС Лентоцин ПС1») широкого спектра антимикробного действия;
Антагонистически активная клеточная масса, которая является отходом при получении БПС как компонент пробиотической композиции, а так же как добавка в корм птицы;
«БПС Лентоцин ПС1» как добавка в корм птицы взамен антибиотиков.
Изобретение осуществляется следующим образом
1. Штамм Bacillus lentus выделен из водного настоя пшеничной соломы, являющейся средой обитания нескольких видов бацилл: Bacillus subtilis, Bacillus circulans, Bacillus macerans, Bacillus cereus, Paenibacillus polymyxa и др. Отбор антагонистически активных изолятов проводят по наличию признаков ингибирования роста тестовых микроорганизмов - обычно штаммы грамположительных и грамотрицательных бактерий. От указанных микроорганизмов отличается скоростью, температурным оптимумом роста, морфологией клеток и спор, биохимическими и антагонистическими свойствами. По размеру, расположению и форме спор близок к Bacillus subtilis, но отличается большей длиной вегетативных клеток. По температурному оптимуму роста близок к Bacillus circulans, Bacillus macerans, но отличается расположением и морфологией спор. По продукции антимикробных метаболитов в процессе глубинного культивирования близок к Paenibacillus polymyxa и Bacillus circulans, но с более широким спектром, затрагивающий и некоторые грамположительные бактерии. Штамм Bacillus lentus растет в бульонных средах общего назначения: ГРМ-бульон, мясопептонный бульон (МПБ), бульон Хоттингера и прочих, однако заметное накопление бактериоцидного вещества происходит в относительно бедных средах, содержащих вместо источника азота животного происхождения его соли. Глубинное культивирование штамма Bacillus lentus проводят в бульоне с дрожжевым экстрактом в качестве источника витаминов, с тартратом или сульфатом аммония в качестве источника азота, с глюкозой или сахарозой в качестве источника углерода и энергии, а также солями натрия, магния и фосфора с нейтральным уровнем pH при температуре 30°C, перемешивании, в течение 48 ч. По окончании выращивания культуральную жидкость (КЖ) и полученные методом центрифугирования ее составляющие - супернатант и клетки, наносят по 10 мкл на свежезасеянные газоны штаммов Escherichia coli и Listeria monocytogenes в чашках Петри с ГРМ-агаром. После 6 ч культивирования при 37°C вокруг нанесенных проб образуются зоны подавления тестовых микроорганизмов: не менее 10 мм от КЖ и клеток и не менее 8 мм от бесклеточного супернатанта.
2. Получение бактериоциноподобного вещества «БПС Лентоцин ПС1» для экспериментального изучения и одновременно посевного материала для аппаратного культивирования штамма Bacillus lentus проводят в качалочных колбах на 750 мл со 100 мл питательной среды следующего состава (%): дрожжевой экстракт - 0,5; глюкоза - 0,7; калий фосфорнокислый 2-замещенный 7-водный (K2HPO4) - 0,3-0,5; аммоний виннокислый - 0,6; натрий хлористый - 0,1; магний сернокислый - 0,01. Полученный раствор питательной среды доводят до значения 7,2 - 7,5 единиц pH дополнительным введением K2HPO4 и стерилизуют автоклавированием (110°C, 30 мин). Колбу со 100 мл среды засевают 1-5 мл взвеси 48 ч клеточной массы, полученной инкубацией штамма на ГРМ-агаре, с последующим смывом физраствором. Посевы выращивают в качалке при температуре 29-30°С и 120-130 оборотов/мин. Время роста 24-36 ч.
Культуральную жидкость (КЖ) разделяют центрифугированием (8000 оборотов/мин, 20 мин). Супернатант собирают в отдельную емкость, добавляют к нему равный по объему (1:1) безводный неполярный растворитель дихлорметан (хлористый метилен). Смесь гомогенизируют при помощи миксера, оснащенного металлической мешалкой. Время смешивания 15 минут.
Полученную эмульсию разливают в металлические стаканы и центрифугируют (5000 оборотов/мин, 10 минут). На границе раздела фаз образуется пленка, которая легко извлекается из центрифужного стакана после слива декантацией верхней водной и нижней фазы - дихлорметана (ДХМ).
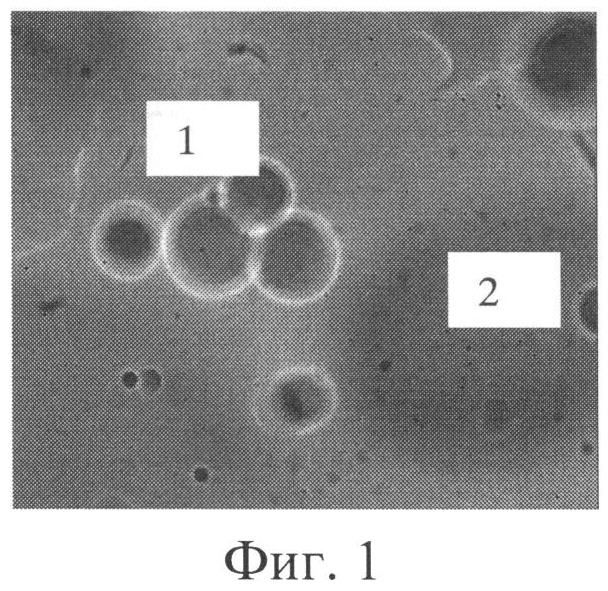
На фигуре 1 представлено микроскопическое изображение концентрированной эмульсии типа «вода в масле» в препарате «раздавленная капля» (Ув. 1200x. 1 - микрокапли водной фракции. 2 - растворитель).
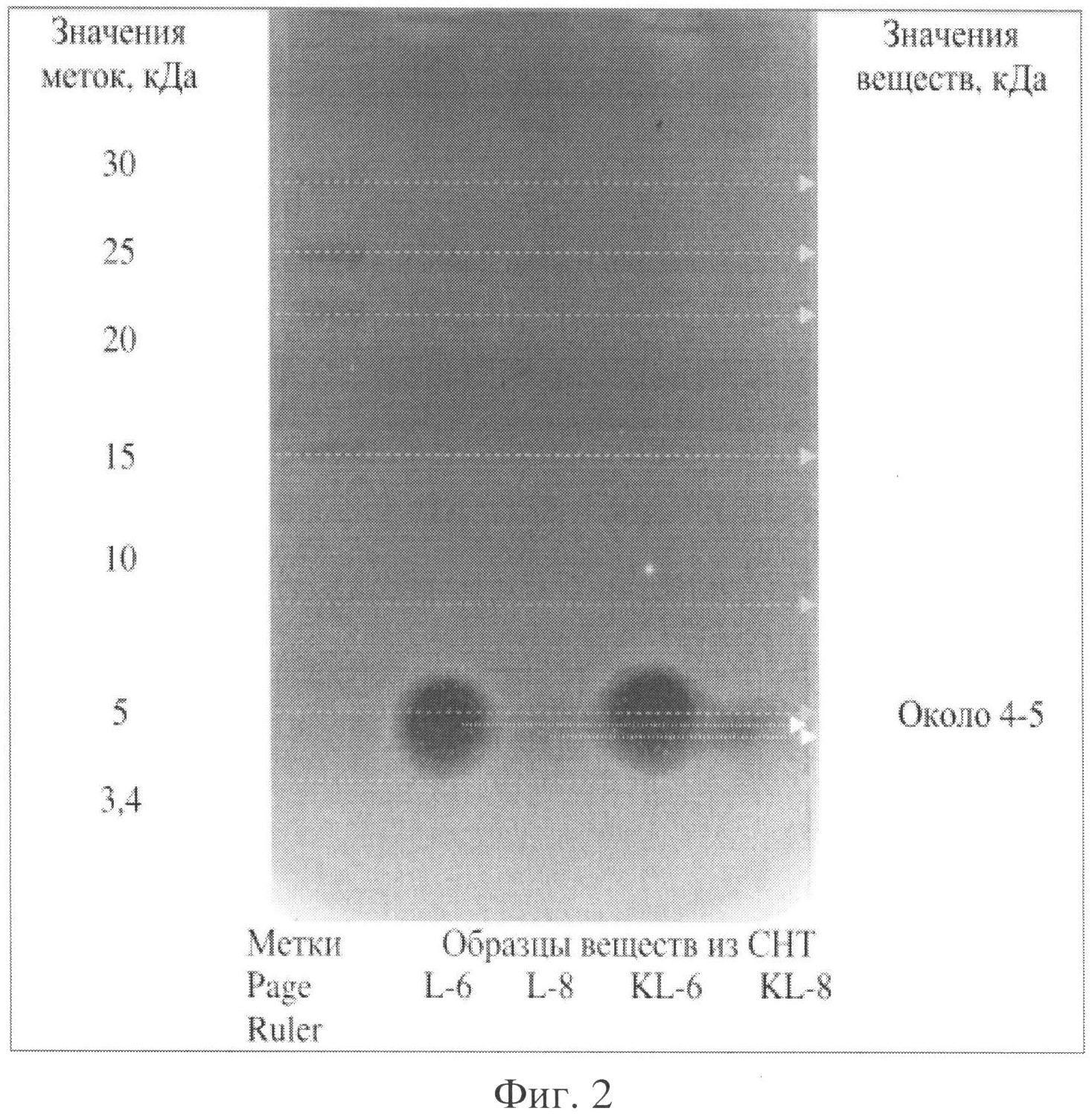
Для удаления ДХМ интерфазная пленка, содержащая около 10% водной фракции, помещают в стеклянную чашку и выдерживают в сухо-жаровом шкафу при температуре 60°C до полного исчезновения запаха растворителя. Оставшейся преципитат представляет собой грубый концентрат бактериоциноподобного вещества «БПС Лентоцин ПС1». Его показатели по антимикробной активности приведены в табл.1. На фигуре 2 представлены результаты белкового ДСН ПААГ электрофореза образца БПС Bacillus lentus, полученной из бесклеточного фильтрата при помощи дихлорметана. Судя по стандартному набору меток «Page ruler» БПС B lentus имеет молекулярную массу около 4 кДа.
В дальнейшем он может быть очищен переосаждением в системе растворителей и методом жидкостной хроматографии для последующего изучения и применения.
|
3. Получение бактериоциноподобного вещества «БПС Лентоцин ПС1» грубой очистки и клеточной массы штамма Bacillus lentus проводят в 10 л ферментере (BioFlo 110 NBS, США) с 5,0 л питательной среды по пункту 2. Ферментацию осуществляют при температуре 30°C, с аэрацией. Обороты мешалки регулируются в автоматическом режиме через систему КАСКАД по концентрации растворенного кислорода (10%). Процесс проводят без корректировки pH. При сильном пенообразовании в ферментер стерильно вводят до 3 мл пеногасителя.
|
|
Культуральную жидкость разделяют ультрафильтрацией в установке УПЛ-0,6 (НПК «Биотест», г.Кириши, РФ) на полых волокнах типа АР ВПУ с отсечением по молекулярному весу в 15 кДа. Для этого в гидравлическую систему установки подают КЖ, включают нагнетающий насос, задают рабочее давление (0,15±0,03) МПа. Фильтрат (пермеат) в процессе мембранного разделения накапливается с внешней стороны полых волокон и сливается в одну емкость, а концентрат клеточной массы, удерживаемый внутри волокон, после собирается в другую емкость. Концентрат клеточной массы осаждают центрифугированием (8000 об/мин), а получаемый супернатант добавляют в емкость с фильтратом для последующего извлечения БПС.
К осадку клеточной массы вносят раствор стабилизатора (на одну весовую часть осадка - две объемных части стабилизатора: лактоза - 7%, полиглюкин - 2%), осадок ресуспендируют, наливают в емкости (флаконы, противни) для последующей лиофилизации и применения как сухого компонента пробиотика или кормовой добавки. Замораживание осуществляют в низкотемпературном морозильнике NZ 250/75 ("Frigera", Чехословакия) при температуре (-50)°C в течение 3 ч, лиофилизацию в установке BT-4k ("Virtis", США) в течение 20-24 ч до остаточной влажности 3-5%. Лиофилизированную биомассу собирают, измельчают до состояния порошка, взвешивают, засыпают в герметичную емкость, из которой отбирают навеску для определения количества живых клеток методом серийных разведений с высевом на питательный агар. После емкость с лиофилизатом маркируют, наносят данные по активности, помещают в холодильник до последующего применения.
Для сбора БПС методом адсорбции в объем фильтрата медленно вносят (10%, вес/объем) просушенный до постоянного веса силикагель, для колоночной хроматографии размер частиц 100/250 мкм, перемешивая жидкость. Смесь оставляют на 1,5-2 ч для осаждения силикагеля. Жидкость декантируют, не затрагивая осадка, а осадок трехкратно промывают дистиллированной водой. Объем воды при каждой промывке равен объему исходного фильтрата. К промытому водой осадку для десорбции (элюции) из него БПС вносят этиловый спирт (или другой полярный растворитель) в объеме, достаточном для покрытия силикагеля и оставляют не менее чем на 1 ч с периодической агитацией путем кругообразного качания емкости. Элюант отделяют от осадка силикагеля фильтрацией или центрифугированием. Для удаления спирта раствор досуха обезвоживают методом конвективного или вакуумного высушивания в сухожаровом шкафу или на роторном испарителе, соответственно, при температуре 65-70°C. Полученный преципитат, представляющий собой грубый концентрат БПС «Лентоцин ПС1», измельчают до порошка, собирают в герметичную емкость, взвешивают.
Для контроля активности отбирают 10-100 мг порошка, разводят в 100-1000 мкл воды. Из полученного раствора готовят серию последовательных двукратных разведений, из которых отбирают по 10 мкл и наносят их на свежезасеянные газоны тестовых микроорганизмов. По наличию зоны подавления роста микроорганизмов вокруг пятна нанесенной пробы и с учетом ее разбавления судят о наличии и значении величины антимикробной активности грубого образца БПС «Лентоцин ПС1». При необходимости получения очищенного препарата грубый образец БПС подвергают переосаждению в системе растворителей и жидкостной хроматографии.
Охарактеризованные образец БПС «Лентоцин ПС1» и лиофилизированная биомасса клеток штамма могут быть использованы соответственно как основа антимикробного биопрепарата и бациллярного пробиотика.
4. Получение БПС «Лентоцин ПС1» грубой очистки в 10 л ферментере (NBS мод. 511, США) с 6,5 л питательной среды следующего состава (г/л): дрожжевой экстракт - 5; глюкоза - 6,5 (по конечному значению); аммоний сернокислый - 5, калий фосфорнокислый 2-замещенный 7-водный - 3,5; калий хлористый - 4. Среду в объеме 6,2 л заливают в ферментер без глюкозы и фосфата (pH 6,5), концентрированные растворы которых готовят отдельно. Раствор фосфата вводят в среду сразу в полном объеме (pH 7,3), а раствор глюкозы - после засева ферментера дробно. Ферментер инокулируют 300 мл 24 ч КЖ (см. п.1). Ферментацию осуществляют в течение 20 часов при температуре 28-30°C, перемешивании 120-400 оборотов/мин, аэрации и поддержании значений pH в пределах 6,2-7,2 с помощью 20% раствора КОН (табл.3).
|
КЖ разделяют ультрафильтрацией в установке УПЛ-0,6 на полых волокнах по пункту 3, отдельно собирая фильтрат и концентрат клеточной массы. Фильтрат с целью экономии реагента, используемого далее при выделении БПС, концентрируют приблизительно в 10 раз на роторном вакуумном испарителе Heidolph, модель Laborota 4000 (Германия) при температуре водяной бани 60-70°C. Взвесь клеточной массы осаждают центрифугированием (8000 об/мин), а получаемый супернатант объединяют с концентрированным фильтратом.
Объединенный раствор фильтрата и супернатанта обрабатывают равным объемом безводного дихлорметана (ДХМ) путем 15 минутной интенсивной гомогенизации смеси при помощи миксера. Фигура 3 отражает картину изменение внешнего вида жидкости в направлении получения устойчивой эмульсии (3.1 - ингредиеты до смешивания: внизу фильтрат, вверху - растворитель; 3.2 - конечная эмульсия).
Полученную эмульсию разливают в металлические стаканы, их центрифугируют (5000 оборотов/мин, 10 минут), а образованную на границе фаз интерфазную пленку (ИФП), содержащую водную фракцию БПС и остатки ДХМ, собирают в стеклянную чашку или другую подходящую емкость с развернутой поверхностью. Для испарения растворителя емкость с образцом ИФП выдерживают в сухожаровом шкафу при температуре 60°C до полного исчезновения запаха. Оставшейся после сушки преципитат собирают, измельчают до порошкообразного состояния, взвешивают и помещают в герметичную емкость, обозначенную как «БПС ИФП».
Осадок клеточной массы ресуспендируют непосредственно в центрифужном стакане при помощи небольшого количества воды (1:1). Взвесь клеточной массы (КМ) обрабатывают этиловым спиртом (1:2) путем перемешивания в течение 30 мин. Спиртовую фракцию отделяют от осадка центрифугированием. Для удаления спирта супернатант подвергают конвективному или вакуумному высушивания в сухо-жаровом шкафу или на роторном испарителе, соответственно, при температуре 65-70°C. Сухой образец собирают, растирают в порошок, взвешивают и помещают в герметичную емкость, обозначенную как «БПС КМ».
Для контроля активности отбирают по 10-100 мг полученных порошков БПС (ИФП, КМ), разводят в 100-1000 мкл воды. Из полученных растворов готовят серию последовательных двукратных разведении, из которых отбирают по 10 мкл и наносят их на свежезасеянные газоны тестовых микроорганизмов. По наличию зоны подавления роста микроорганизмов вокруг пятна нанесенной пробы с учетом ее разбавления судят о величине антимикробной активности грубых образцов БПС «Лентоцин ПС1», полученных из фильтрата КЖ и поверхности клеток штамма-продуцента. При необходимости грубые образцы БПС могут быть дочищены хроматографически.
Охарактеризованные образцы служат компонентами антимикробного биопрепарата БПС «Лентоцин ПС1».
5. Получение неочищенной БПС «Лентоцин ПС1» и клеточной массы проводят в 10 л ферментере (NBS мод. 511, США; или BioFlo 110 NBS, США; или 3У, РФ или аналогичный) с 6,0±1,0 л питательной среды (г/л): дрожжевой экстракт - 5; глюкоза - 7 (по конечному значению); аммоний виннокислый - 7, калий фосфорнокислый 2-замещенный 7-водный - 3,5; натрий хлористый - 1 по пункту 4. КЖ разделяют ультрафильтрацией в установке УПЛ-0,6 на полых волокнах согласно пункту 3, отдельно собирая фильтрат и концентрированную взвесь клеточной массы.
Взвесь клеточной массы осаждают центрифугированием (8000 об/мин), полученный супернатант добавляют к фильтрату. К осадку клеточной массы вносят раствор стабилизатора (на одну весовую часть осадка - две объемных части стабилизатора: лактоза - 7%, полиглюкин - 2%), осадок ресуспендируют, наливают в емкости (флаконы, противни) для последующей лиофилизации по пункту 3 и применения как сухого компонента пробиотика или кормовой добавки.
К объединенной бесклеточной жидкости (фильтрат и супернатант) вносят порциями навеску поливинилпирролидона (повидона) или хлорида натрия до конечного значения по сухому остатку 4-5% (вес: объем) с перемешиванием до растворения. Раствор нагревают до кипения или автоклавируют при 0,5 атм (110°C, 10 мин) для удаления посторонней микрофлоры, охлаждают и высушивают методом распылительного высушивания на установке «Ангидро» (Дания). Режим высушивания: температура на входе в сушильную камеру 135±5°C, на выходе - 65±5°C. Сухой концентрат собирают в герметичную емкость, взвешивают и характеризуют по антимикробной активности, которая не должна быть ниже 10000 АЕ/г по E.coli.
Полученная таким образом неочищенная бактериоциноподобная субстанция «Лентоцин-ПС1» используется как добавка в корм птицы взамен антибиотика.
6. Применение сухой клеточной массы штамма B.lentus как добавки в корм. Лиофилизированную измельченную клеточную массу B.lentus, полученную по пунктам 2 и 4, добавляют в корм 30 дневной бройлерной птицы в количестве 0,1% (вес: вес), тщательно перемешивают. Птиц разбивают на две группы - опытную и контрольную. Опытной группе дают корм с клеточной массой B.lentus, контрольной - обычный корм типа ПК-6 в одинаковом количестве. Содержание птиц напольное в течение шести дней с контролем живого веса, с периодическим анализом микрофлоры фекальной массы, а после забоя обращается внимание на внешний вид внутренних органов, на предмет их нормы или патологии.
Результаты применения клеточной массы штамма B.lentus в корм бройлерных цыплят 30-дневного возраста приведены в табл.4.
|
7. Применение сухой неочищенной БПС «Лентоцин ПС1» штамма В.lentus как добавки в корм взамен антибиотика. 900 г БПС «Лентоцин ПС1» штамма В.lentus добавляли на 1 тонну корма для бройлеров производства ООО «ПРОВИМИ» (Москва). Использовали цыплят-бройлеров Ross-308 (петушки) из трех групп: опытной, контрольной с антибиотиком (К+А) и контрольной без антибиотика (К). В каждой группе 80 цыплят, срок откорма - 35 дней, взвешивание - еженедельно. После забоя исследовали микрофлору слепых отростков.
Основные результаты по применению БПС «Лентоцин ПС1» в качестве кормовой добавки на фоне контрольных вариантов питания цыплят отражены в табл.5.
|