Результат интеллектуальной деятельности: СПОСОБ РЕНАТУРАЦИИ МЕМБРАННЫХ БЕЛКОВ
Вид РИД
Изобретение
Изобретение относится к молекулярной биологии и биотехнологии, а именно к способу ренатурации мембранных белков, которые могут найти применение в получении новых лекарственных препаратов, создании новых биокатализаторов, биосенсоров и биофотонных устройств.
Согласно современным данным, гены мембранных белков (МБ) составляют до трети всех последовательностей, закодированных в геноме человека [Е. Wallin, G. von Heijne, (1998) Protein Sci., 7: 1029-1038]. Эти белки играют основную роль в процессах передачи сигналов, как на уровне отдельной клетки, так и на уровне целого организма, а также выполняют транспортные, энергетические и другие функции. Мембранные белки обуславливают функционирование нервной, иммунной и эндокринной систем млекопитающих. По современным прогнозам примерно половина всех мембранных белков человека представляет собой потенциальные мишени для разработки новых лекарственных препаратов. Наиболее интересными объектами для фармакологических разработок являются два класса МБ. К первому классу относятся мембранные рецепторы, связанные с ионными каналами, передающие сигналы через клеточную мембрану или вдоль нее путем изменения проницаемости мембраны [F. Hucho, С.Weise, (2001), Angewandte Chemie International Edition, 40(17): 3100-3116]. Большинство из этих МБ имеют субъединичную организацию и представляют собой гомо- или гетероолигомеры. Ко второму классу фармакологически важных МБ относятся мембранные рецепторы, сопряженные с G-белками (GPCR), которые активируют внутриклеточный каскад реакций в ответ на внеклеточные сигналы химической или световой природы [D.M. Rosenbaum, S.G. Rasmussen, B.K. Kobilka, (2009) Nature, 459: 356-363]. Молекулы рецепторов семейства GPCR часто образуют олигомеры в мембранах клеток, однако функционально активной единицей этих МБ является мономер, состоящий из 7 трансмембранных спиралей.
Кроме исследований в области фармакологии МБ представляют огромный интерес в качестве объектов для биотехнологических разработок. Мембранные ферменты, ответственные за каталитические превращения липидов в живой клетке, и участвующие в процессах потребления алканов некоторыми микроорганизмами, могут быть использованы в химической и пищевой промышленностях, а также в области косметологии для создания модифицированных молекул на основе природных и синтетических липидов и углеводородов. Мембранные ферменты и рецепторы также могут быть применены в области биотехнологии и экологии для создания наноразмерных биосенсоров и биокатализаторов, способных детектировать загрязняющие вещества алкильной природы, и преобразовывать их в биодеградируемые производные. Кроме того, мембранные рецепторы, реагирующие на световые стимулы (например, бактериородопсин галобактерий), могут быть использованы при конструировании различных бионанофотонных устройств для хранения и передачи информации.
Несмотря на большое разнообразие и огромную практическую важность мембранных белков, прогресс в их исследованиях и прикладном использовании чрезвычайно затруднен. Сложность исследования и практического применения МБ связана как с трудностью их наработки и выделения, так и с особенностями их пространственной организации. Большинство МБ представляют собой связки из нескольких трансмембранных спиралей. Так как трансмембранные спирали гидрофобны, мембранный белок может обладать природной структурой только в присутствии биологической мембраны или подходящего мембранного миметика. Более того, относительно слабое межспиральное взаимодействие в мембранных белках обуславливает их большую конформационную подвижность. Оба этих фактора (требование наличия мембраны и динамическая подвижность) значительно затрудняют как выделение, так и дальнейшее использование МБ в прикладных или исследовательских целях.
Для стабилизации МБ в растворе обычно применяют такие мембранные миметики, как детергентные мицеллы, липид-детергентные бицеллы и липидные везикулы. Эти мембранные миметики обладают рядом недостатков и в некоторых случаях не могут обеспечить долговременную стабильность препаратов МБ. Так, липидные везикулы, хотя и обеспечивают квазинативное окружение белковой молекулы, но склонны к спонтанной агрегации (слиянию) с образованием больших моноламелярных липосом, что часто приводит к агрегации препаратов МБ. Кроме того липидные везикулы изолируют цитоплазматическую часть МБ от внешнего раствора, что затрудняет функциональные исследования и использование МБ в области биотехнологии. С другой стороны, большая кривизна поверхности мицелл детергентов и липид-детергентных бицелл часто искажает пространственную структуру инкапсулированной белковой молекулы, что ведет к понижению ее активности, а большая динамическая подвижность молекул детергента значительно понижает стабильность МБ. Детергентные мицеллы и липид-детергентные бицеллы склонны к диссоциации при понижении концентрации детергента ниже критической концентрации мицеллообразования, что также может приводить к инактивации препарата МБ. Кроме того, молекула или молекулы МБ могут самопроизвольно покидать мицеллы или бицеллы, а также перемещаться между ними, что приводит к распаду функционально-активных олигомерных комплексов или к нежелательной ассоциации мембранных молекул.
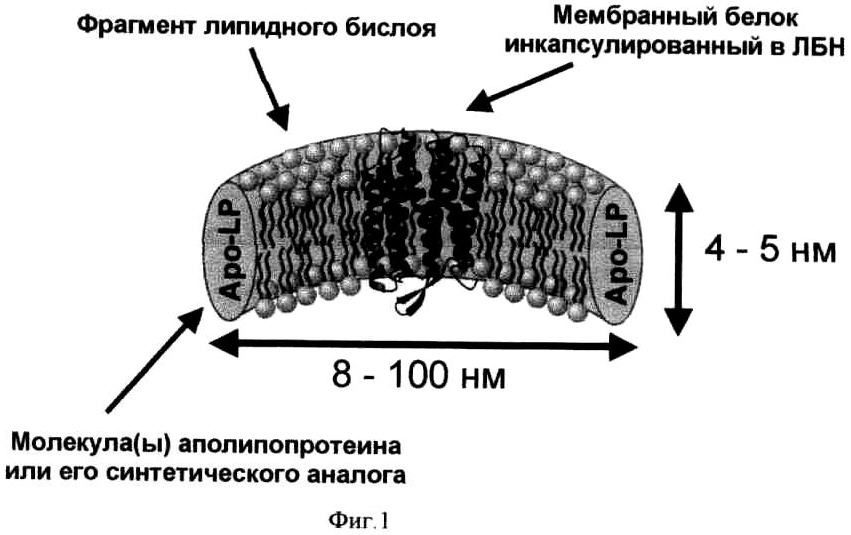
Альтернативной мембраномоделирующей средой являются липопротеиновые частицы, также называемые реконструированные незрелые частицы липопротеинов высокой плотности (rHDL) или липид-белковые нанодиски (ЛБН). Каждый липид-белковый нанодиск представляет собой фрагмент бислойной мембраны, сформированный из молекул фосфолипидов, гидрофобная часть которого экранирована от растворителя одной или несколькими копиями белковой молекулы аполипопротеина (Apo-LP), или его синтетического аналога (Фиг.1). ЛБН имеет форму диска с толщиной, равной толщине бислойной мембраны (4-5 нм). Липопротеиновые частицы могут иметь диаметр от 8 до 100 нм. Диаметр ЛБН зависит от типа использованного аполипопротеина, типа фосфолипида и молярного отношения аполипопротеин/фосфолипид, использованного в процессе реконструкции ЛБН [I.G. Denisov, Y.V. Grinkova, A.A. Lazarides, S.G. Sligar, (2004) J. Am. Chem. Soc. 126(11): 3477-3487]. Для формирования ЛБН описаны примеры использования аполипротеинов из различных организмов, включая млекопитающих (человек) [С.Е. Matz, A. Jonas, (1982) J. Biol. Chem., 257: 4535-4540.], членистоногих (тутовый шелкопряд В. mori) [В.А. Chromy, E. Arroyo, C.D. Blanchette, G. Bench, H. Benner, J.A. Cappuccio, M.A. Coleman, P.T. Henderson, A.K. Hinz, E.A. Kuhn, J.B. Pesavento, B.W. Segeike, T.A. Sulchek, T. Tarasow, V.L. Walsworth, P.D. Hoeprich, (2007) J Am Chem Soc, 129(46); 14348-14354] и рыб (zebrafish, Danio rerio) [S. Banerjee, T. Huber, T.P. Sakmar, (2008) J Mol Biol., 377(4): 1067-1081], а также фрагментов аполипопротеинов или синтетических белковых последовательностей, включающих в себя одну или несколько копий фрагментов аполипопротеина со вставками или делениями [I.G. Denisov, Y.V. Grinkova, A.A. Lazarides, S.G. Sligar, (2004) J. Am. Chem. Soc. 126(11): 3477-3487]. Кроме того, для формирования ЛБН используются синтетические пептидные молекулы, способные формировать амфифильную спиральную структуру в присутствии молекул фосфолипидов и стабилизировать наноразмерные фрагменты бислойной липидной мембраны в растворе [V.K. Mishra, G.M. Anantharamaiah, J.P. Segrest, M.N. Palgunachari, M. Chaddha, S.W. Sham, N.R. Krishna, (2006) J Biol Chem., 281(10): 6511-6519]. В отличие от традиционно используемых мицелл и бицелл, ЛБН содержат фрагменты бислойной мембраны, что позволяет гораздо лучше моделировать мембранное окружение встроенных белков. Фрагмент липидной мембраны в составе ЛБН сохраняет многие биофизические свойства, присущие настоящим мембранным системам. Основным преимуществом ЛБН является их стабильность. В отличие от липидных везикул и мицелл детергентов они не склонны к агрегации и слиянию и не распадаются при понижении концентрации. Кроме того, молекула или молекулы белка, встроенные в ЛБН, имеют фиксированное агрегационное состояние. Мембранные белки не могут самопроизвольно покидать ЛБН, что эффективно подавляет нежелательную ассоциацию мембранных молекул и предотвращает распад функционально важных белковых комплексов. Полная доступность растворителю обеих сторон ЛБН (и, соответственно, встроенного в него мембранного белка) позволяет проводить функциональные исследования МБ и использовать МБ в области биотехнологии.
Для молекулярно-биологических исследований белковых молекул и для их использования в области фармакологии или биотехнологии в большинстве случаев требуются большие количества функционально-активного белкового препарата, которые не могут быть получены из естественных источников. Для продукции препаратов МБ в настоящее время используется несколько методов, обладающих существенными недостатками. Так, например, гетерологическая экспрессия, в ходе которой целевой белок накапливается в мембране клеток бактерий, дрожжей, насекомых или млекопитающих, часто позволяет получить МБ в функционально-активной форме. Однако, количество белкового препарата, получаемого этим методом, лимитировано емкостью мембран экспрессирующих клеток и зачастую недостаточно как для фармакологических и структурных исследований, так и для прикладного использования МБ [K.Н. Lundstrom (2006) Structural Genomics on Membrane Proteins. CRC Press]. Более того, успешная гетерологическая экспрессия МБ в составе мембран бактериальных клеток описана только для нескольких эукариотических белков, что указывает на ограниченную применимость этого подхода [Е.С.McCusker, S.E. Bane, M.A. O'Malley, A.S. Robinson, (2007) Biotechnol. Prog., 23(3): 540-547].
Миллиграммовые количества препаратов МБ могут быть получены методами биотехнологии или биоорганической химии в функционально-неактивной форме. Например, эффективные бактериальные системы экспрессии мембранных белков позволяют получить требуемые количества МБ в составе нерастворимых телец включения, характеризующихся неправильной упаковкой полипептидной цепи целевого белка и/или его некорректным агрегационным состоянием [Е.С.McCusker, S.E. Bane, M.A. O'Malley, A.S. Robinson, (2007) Biotechnol. Prog., 23(3): 540-547]. Кроме того, препараты МБ могут быть получены с использованием высокоэффективных методов бесклеточного синтеза [В. Schneider, F. Junge, V.A. Shirokov, F. Durst, D. Schwarz, V. Dutsch, F.Bemhard, (2010) Methods Mol. Biol., 601: 165-186], или методов химического синтеза [A.G. Komarov, K.M. Linn, J.J. Devereaux, F.I. Valiyaveetil. (2009) ACS Chem Biol., 4(12):1029-1038]. Для перевода полученного этими методами препарата МБ в активную форму необходим процесс ренатурации in vitro с использованием таких мембранных миметиков, как детергентные мицеллы, липид-детергентные бицеллы или липидные везикулы [Н. Kiefer, (2003), Biochim. Biophys. Acta 1610:57-62]. К настоящему времени не существует универсальных приемов ренатурации мембранных белков. Особую сложность представляет собой ренатурация олигомерных и политопных (состоящих из нескольких трансмембранных спиралей) мембранных белков, к которым относится большинство рецепторов и ионных каналов.
Известен способ ренатурации мембранных белков, полученных из телец включения, путем последовательной замены детергентов в мицеллярном окружении мембранных белков [Патент ЕР №1359155, МКЛ. C07K 1/113, опубл. 0511.2003]. Однако, такой подход имеет серьезные ограничения в случае ренатурации олигомерных мембранных белков, так. как в случае мицеллярных систем межмолекулярные белок-белковые контакты затруднены. Как следствие этого, эффективность олигомеризации падает.
Известен способ ренатурации мембранного белка KcsA из бактерии Streptomyces lividans в нативную тетрамерную форму непосредственным включением биосинтезируемого белка в фосфолипидные везикулы [A. van Dalen, S. Hegger, J.A. Killian, В. de Kruijff, (2002), Febs Lett. 525:33-38]. Однако данный способ является трудоемким и выход тетрамера не превышает 30%.
Известен способ ренатурации мембранных белков путем получения гомогенного раствора мембранного белка и фосфолипидов в смеси органических растворителей, или смеси органического растворителя и воды, с последующим удалением растворителей и полным гидратированием полученной фосфолипид-белковой смеси [Патент РФ на изобретение №2306319, приоритет 07.12.2005]. Однако такой подход имеет серьезные ограничения в случае ренатурации политопных мембранных белков, имеющих в своем составе более четырех трансмембранных спиралей. Растворы органических растворителей изотропны по своим характеристикам и плохо моделируют свойства биологической мембраны, обладающей гидрофобными и полярными регионами. Вследствие этого, в мембранном белке может происходить неправильное формирование контактов спираль-спираль, что понижает эффективность ренатурации.
Также известен способ ренатурации, основанный на включении мембранных белков в искусственные липидные везикулы [F.I. Valiyaveetil, Y. Zhou, R. MacKinnon, (2002), Biochemistry 41:10771-10777]. Способ включает стадии солюбилизации денатурированного белка детергентом, формирования смешанных бицелл белок/детергент/фосфолипид, удаления детергента диализом и получения искусственных везикул, содержащих целевой белок. Недостатком этого метода является отсутствие возможности контроля агрегационного состояния белка. Получаемые липидные везикулы не предохраняют МБ от нежелательной агрегации, которая может приводить к значительным потерям целевого белка в ходе ренатурации, а также к значительному понижению стабильности полученных ренатурированных препаратов. Кроме того, для функциональных исследований или использования МБ в области биотехнологии необходим дополнительный перевод (ресолюбилизация) ренатурированного препарата из липидных везикул в другие мембранные миметики, такие как мицеллы, бицеллы, или ЛБН. Дополнительный этап ресолюбилизации также может приводить к потерям белкового препарата и к понижению общей эффективности процесса ренатурации. При применении данного подхода для ренатурации мембранного белка KcsA выход нативной тетрамерной формы белка составляет до 30% от начального количества целевого белка.
Наиболее близким к заявляемому является способ ренатурации, основанный на включении мембранных белков, солюбилизированных в детергенте додецилсульфате натрия (SDS), в липид-белковые нанодиски [Шенкарев 3.0. «Липид-белковые нанодиски -универсальная среда для стабилизации, ренатурации и структурных исследований мембранных белков и мембраноактивных пептидов». International conference on biomolecular science in honor of the 75th anniversary of the birth of professor Yuri Ovchinnikov, 28.09-02.10.2009 Abstracts, Volume 2. Young scientists competition, Moscow-Pushchino, стр.267-268, Biochemistry 41:10771-10777]. Способ включает стадии солюбилизации денатурированного белка в SDS, добавления к солюбилизированному белку молекул липидов и аполипопротеина А1 человека и удаления SDS с использованием специального сорбента. В результате удаления SDS происходит встраивание мембранного белка в липид-белковые нанодиски в функционально-активной форме. Недостатком этого метода является необходимость использования больших концентраций SDS (который по своим свойствам относится к жестким денатурирующим детергентам [G.G. Prive, (2007), Methods 41:388-397]) для солюбилизации всех компонентов реакционной смеси и получения гомогенного раствора, включающего мембранный белок, аполипопротеин и фосфолипиды. Низкая эффективность удаления детергента SDS при помощи специальных сорбентов, диализа или гель-фильтрации приводит к потерям белкового препарата и к неправильному формированию пространственной структуры белка в процессе реконструкции ЛБН. Эти факторы значительно понижают эффективность ренатурации. При применении данного подхода для ренатурации мембранного белка KcsA выход нативной тетрамерной формы белка составляет до 50% от начального количества целевого белка.
Задачей изобретения является создание универсального способа ренатурации мембранных белков, полученных в результате гетерологической экспрессии, бесклеточного или химического синтеза, с высоким выходом.
Поставленная задача решается за счет того, что в способе получения ренатурированных мембранных белков, включающем получение гомогенного раствора, содержащего мембранный белок в детергенте, фосфолипид или смесь фосфолипидов и аполипопротеин или его синтетический аналог с последующим удалением детергента и формированием липид-белковых нанодисков, используется смесь детергентов, где наряду с детергентом или смесью детергентов, использованной для солюбилизации денатурированного белка, в растворе присутствует избыток дополнительного детергента, или детергентов, которые могут быть эффективно удалены при помощи специальных сорбентов, диализа или гель-фильтрации и по своим свойствам могут относиться к мягким не денатурирующим детергентам [G.G. Prive, (2007), Methods 41:388-397].
Под аполипопротеинами или их синтетическими аналогами подразумеваются белковые или пептидные молекулы, способные стабилизировать в растворе фрагменты бислойной липидной мембраны, имеющие характерные размеры (8-100 нм), включая, но не ограничиваясь, аполипопротеины, аполипофорины и их производные, а также последовательности аполипопротеинов, содержащие вставки или делеции, белковые последовательности, содержащие одну или несколько копий последовательностей одного или нескольких аполипопротеинов или их фрагментов, а также пептидные молекулы, способные формировать амфифильную спиральную структуру в присутствии молекул фосфолипидов. Например, аполипопротеины А1 и Е4 человека, аполипопротеин А1 рыбы Danio rerio, аполипофорин III тутового шелкопряда В. Mori, их фрагменты и их производные. Молекулы аполипопротеинов или их синтетические аналоги могут быть получены как из природных источников, так и методами химического синтеза, или методом бесклеточного синтеза, или методом гетерологической экспрессии. Синтетические аналоги аполипопротеинов могут включать "специальные" полипептидные и синтетические последовательности ("tags"), предназначенные для очистки молекул аполипопротеинов и сформированных липопротеиновых частиц методами аффинной хроматографии, а также для иммобилизации молекул аполипопротеинов и липопротеиновых частиц на различных подложках и субстратах, а также для визуализации молекул аполипопротеинов и липопротеиновых частиц методами спектроскопии, микроскопии и томографии. Такие последовательности могут включать в себя, но не ограничиваясь, флуоресцентные метки или последовательности для их присоединения, хелатирующие метки, контрастирующие агенты для магниторезонансной томографии, спектроскопии и микроскопии, тиолреактивные метки и.т.д.
Способ осуществляют следующим образом:
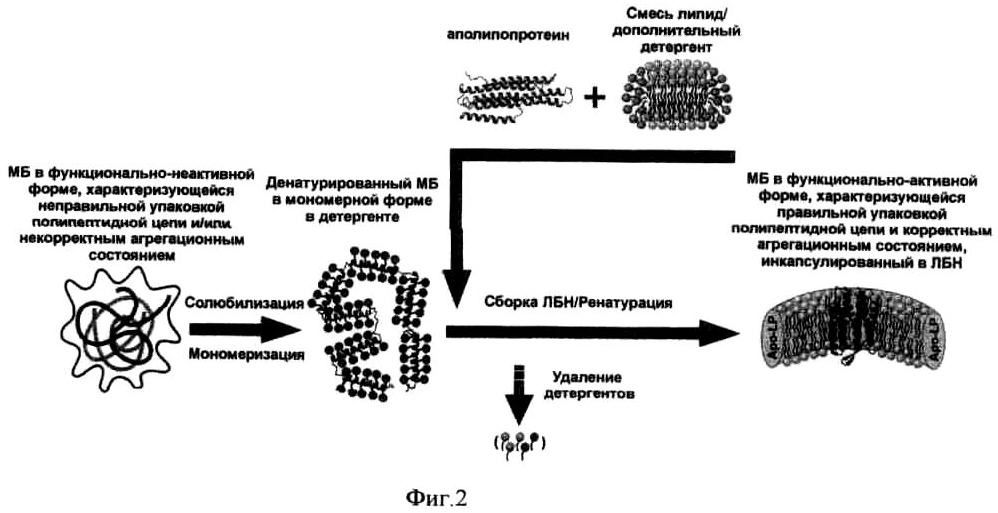
Мембранный белок получают любым известным способом, например, в результате бесклеточного синтеза [В. Schneider, F. Junge, V.A. Shirokov, F. Durst, D. Schwarz, V. Dotsch, F. Bemhard, (2010) Methods Mol. Biol., 601: 165-186], или химического синтеза [A.G. Komarov, K.M. Linn, J.J. Devereaux, F.I. Valiyaveetil. (2009) ACS Chem Biol., 4(12): 1029-1038] или в виде телец включения [Л.Е. Петровская, А.А. Шульга, О.В. Бочарова, Я.С. Ермолюк, Е.А. Крюкова, В.В. Чупин, М.Ж.Ж. Бломмерс, А.С. Арсеньев, М.П. Кирпичников, (2010), Биохимия, 75(7): 1001-1013], или из мембран штамма-продуцента [Е.С. McCusker, S.E. Bane, M.A. O'Malley, A.S. Robinson, (2007) Biotechnol. Prog., 23(3): 540-547]. Полученный белок солюбилизируют с использованием детергента или смеси детергентов (например, из группы жестких детергентов: SDS, лаурилсаркозинат натрия, фосфохолины с различной длиной жирнокислотной цепи Fos-12, Fos-14, Fos-16 и т.п.) и других реагентов (хаотропных агентов, таких как мочевина, гуанидин хлорид; восстанавливающих агентов, таких как, β-меркаптоэтанол, дитиотриетол, трис(2-карбоксиэтил)фосфин; и т.п.), способствующих переводу белка из формы нерастворимых агрегатов в растворимую мономерную форму, возможно характеризующуюся неправильной упаковкой полипептидной цепи. Гомогенный раствор целевого МБ в детергенте или смеси детергентов смешивают с раствором аполипопротеина или его синтетического аналога и раствором фосфолипида или смеси фосфолипидов, содержащим избыток дополнительного детергента или детергентов (например, из группы мягких детергентов: холат натрия, октил-β-глюкозид, CHAPS, CHAPSO и т.п.), которые могут быть эффективно удалены при помощи специальных сорбентов, диализа или гель-фильтрации. Соотношение реагентов должно подбираться специалистом с учетом известных свойств известных реагентов, при этом концентрации могут варьироваться в широких пределах. Затем детергенты удаляют из смеси любым известным способом, например, с помощью диализа, или добавлением к смеси специального адсорбента, или при помощи гель-фильтрации (Фиг.2, 3). В результате удаления детергентов происходит встраивание мембранного белка в липопротеиновые частицы в функционально-активной форме. Избыток дополнительного детергента или детергентов позволяет получить гомогенный раствор, содержащий меньшую концентрацию детергента или смеси детергентов, использованных для солюбилизации денатурированного белка, и добиться более полного удаления детергентов в ходе процесса формирования ЛБН. Очистку ЛБН, содержащих ренатурированный (функционально-активный) мембранный белок, от "пустых" липопротеиновых частиц и других продуктов реакции (молекул фосфолипидов, молекул аполипопротеина и молекул неренатурированного целевого МБ) осуществляют любым известным способом, например, методом афинной хроматографии, используя "специальные" полипептидные последовательности ("tags"), предварительно пришитые к последовательности мембранного белка или аполипопротеина, например, последовательность полигистидинов, или методом аффинной хроматографии, используя антитела против целевого МБ, или методом аффинной хроматографии, используя лиганды целевого МБ, либо методом гель-фильтрации. Контроль за ренатурацией мембранного белка осуществляют либо с помощью гель-электрофореза, либо с помощью структурного анализа, либо с помощью функциональных тестов.
Заявляемый способ позволяет осуществлять ренатурацию мембранных белков, полученных в результате гетерологической экспрессии или бесклеточного синтеза, или химического синтеза в денатурированном состоянии, в нативную форму одновременно со встраиванием ренатурированного белка в липопротеиновые частицы с выходом до 90% от начального количества целевого белка. Способ позволяет получать в миллиграммовых количествах рекомбинантные структурированные, функционально-активные мембранные белки, которые могут быть использованы в медицине, фармакологии, экологии, биотехнологии и нанобиотехнологии для создания новых биомедицинских препаратов, биокатализаторов, биосенсоров и биофотонных устройств.
Изобретение иллюстрируют графические материалы:
На фиг.1 представлена схема устройства ЛБН;
на фиг.2 - схема ренатурации мембранных белков с помощью аполипопротеинов или их синтетических аналогов;
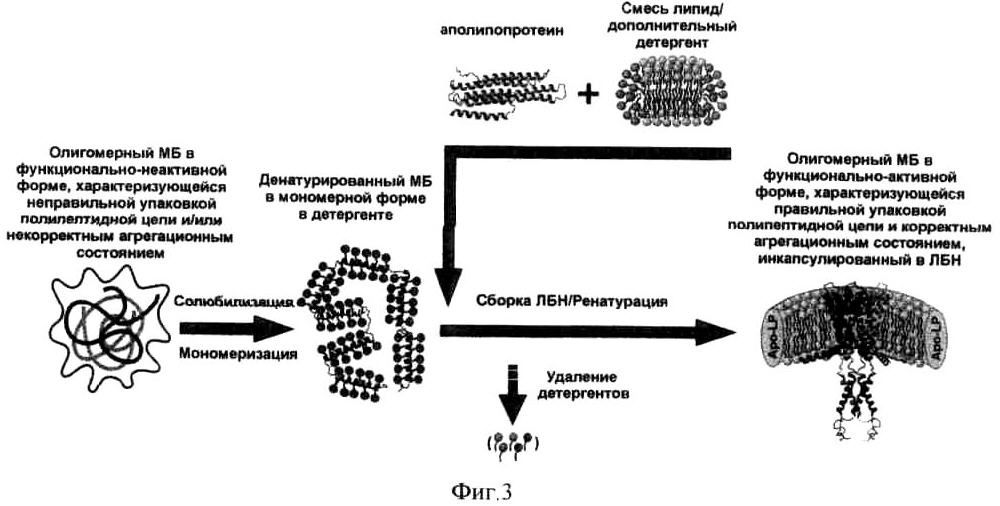
на фиг.3 - схема ренатурации олигомерных мембранных белков с помощью аполипопротеинов или их синтетических аналогов;
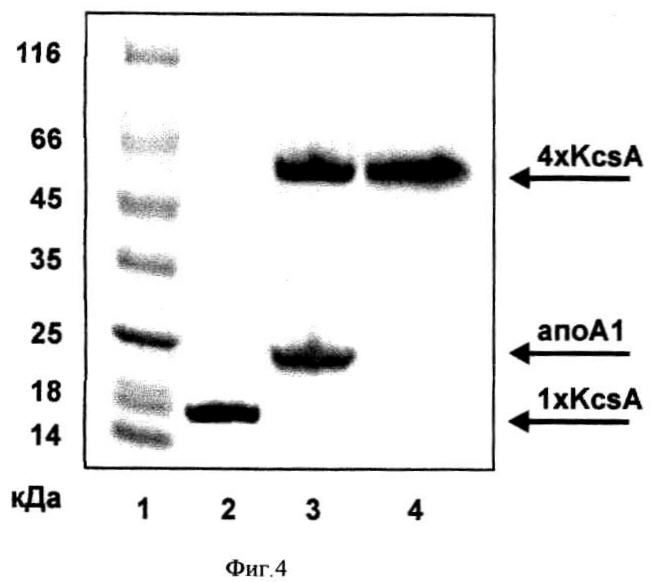
на фиг.4 - гель-электрофорез препарата KcsA до ренатурации в мономерной форме (дорожка 2) и после ренатурации в тетрамерной форме в составе ЛБН/РОРС (дорожка 3), дорожка 4 - препарат KcsA в тетрамерной форме, выделенный из мембран Е. coli в мягких условиях с сохранением олигомерной организации, дорожка 1 - белковые маркеры молекулярных масс (кДа), стрелками показаны положения anoAl, мономера KcsA и тетрамера KcsA;
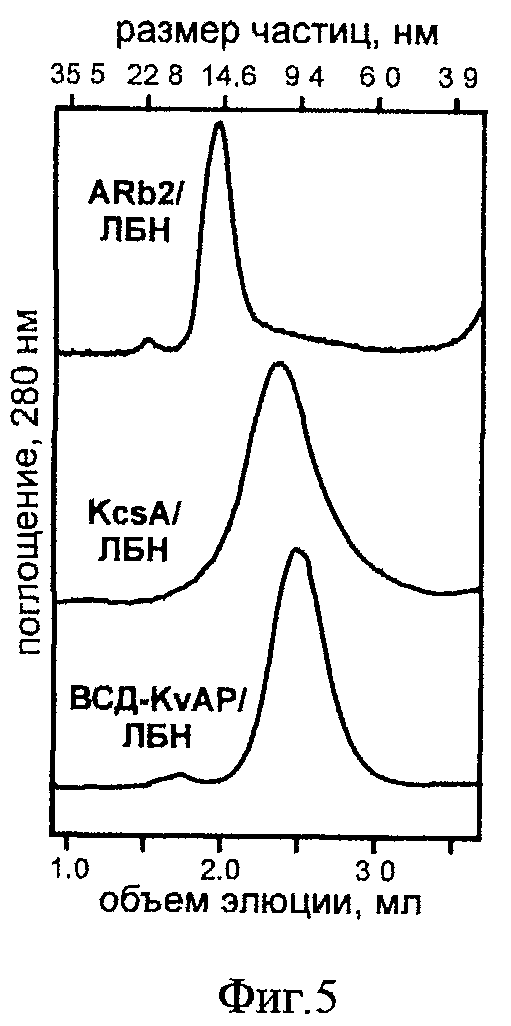
на фиг.5 - гель-фильтрационные профили препаратов KcsA/ЛБН/РОРС и ARb2/ЛБН/POPC/DOPG (3:2). Указаны шкалы размера частиц (нм) и объема элюции препаратов (мл), гель-фильтрационный анализ выполнен на смоле Superdex-200 (GE Healthcare), колонке Tricom 5/200 (GE Healthcare), детекцию осуществляют по поглощению на длине волны 280 нм;
на фиг.6 - гель-электрофорез препарата ARb2 в составе ЛБН/POPC/DOPG (дорожка 2), дорожка 3 - препарат ARb2 в смеси Fos-12/Fos-14/Fos-16/LMPG, дорожка 1 - белковые маркеры молекулярных масс. Стрелками показаны положения anoA1 и ARb2;
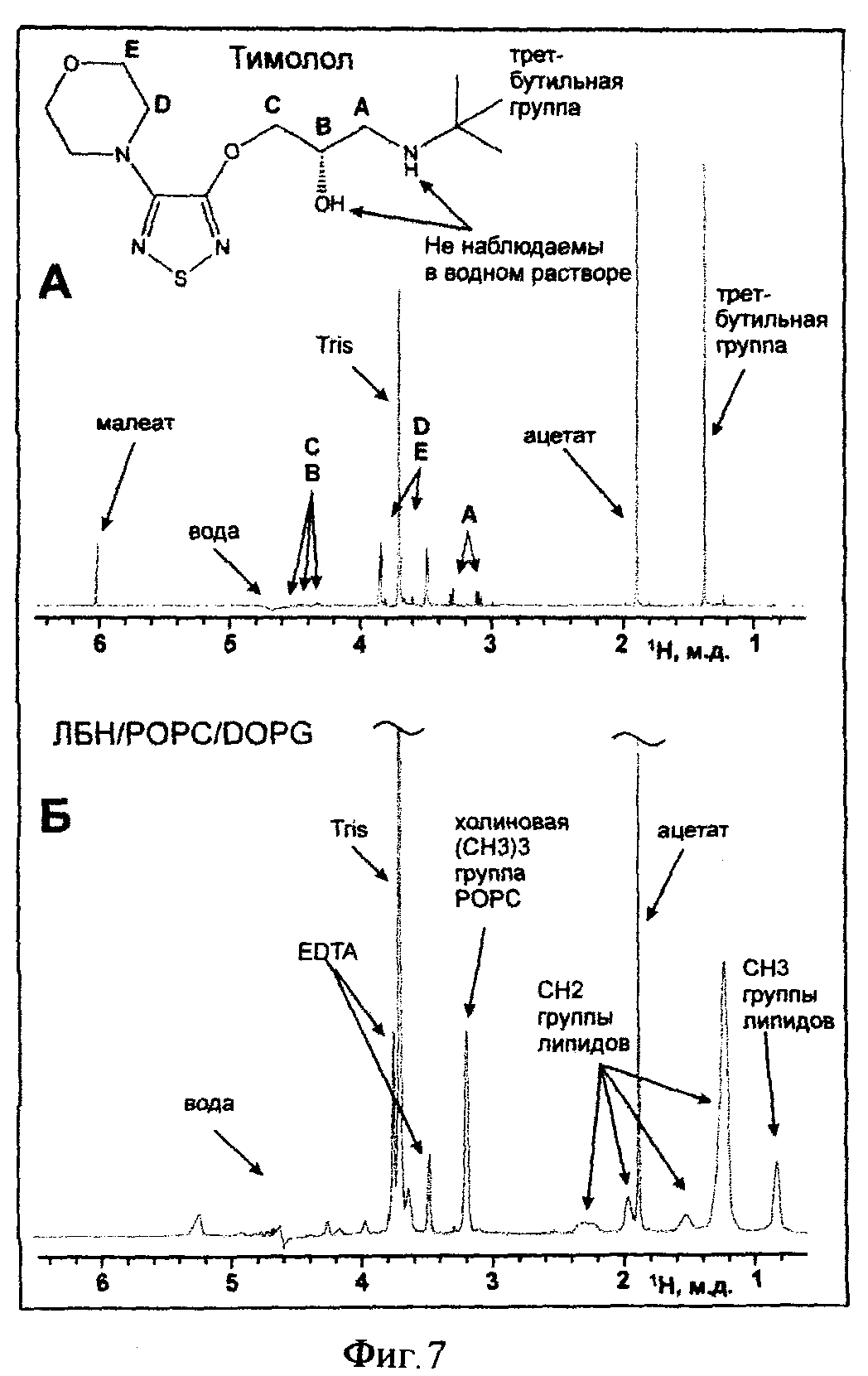
на фиг.7 - одномерные 1Н ЯМР-спектры 0,1 мМ тимолол-малеата (А) и 0,09 мМ ЛБН/POPC/DOPG (3:2) (Б) (10 мМ Tris-Ac, pH 7,0, 30°C). Показано отнесение некоторых сигналов тимолол-малеата и фосфолипидов.
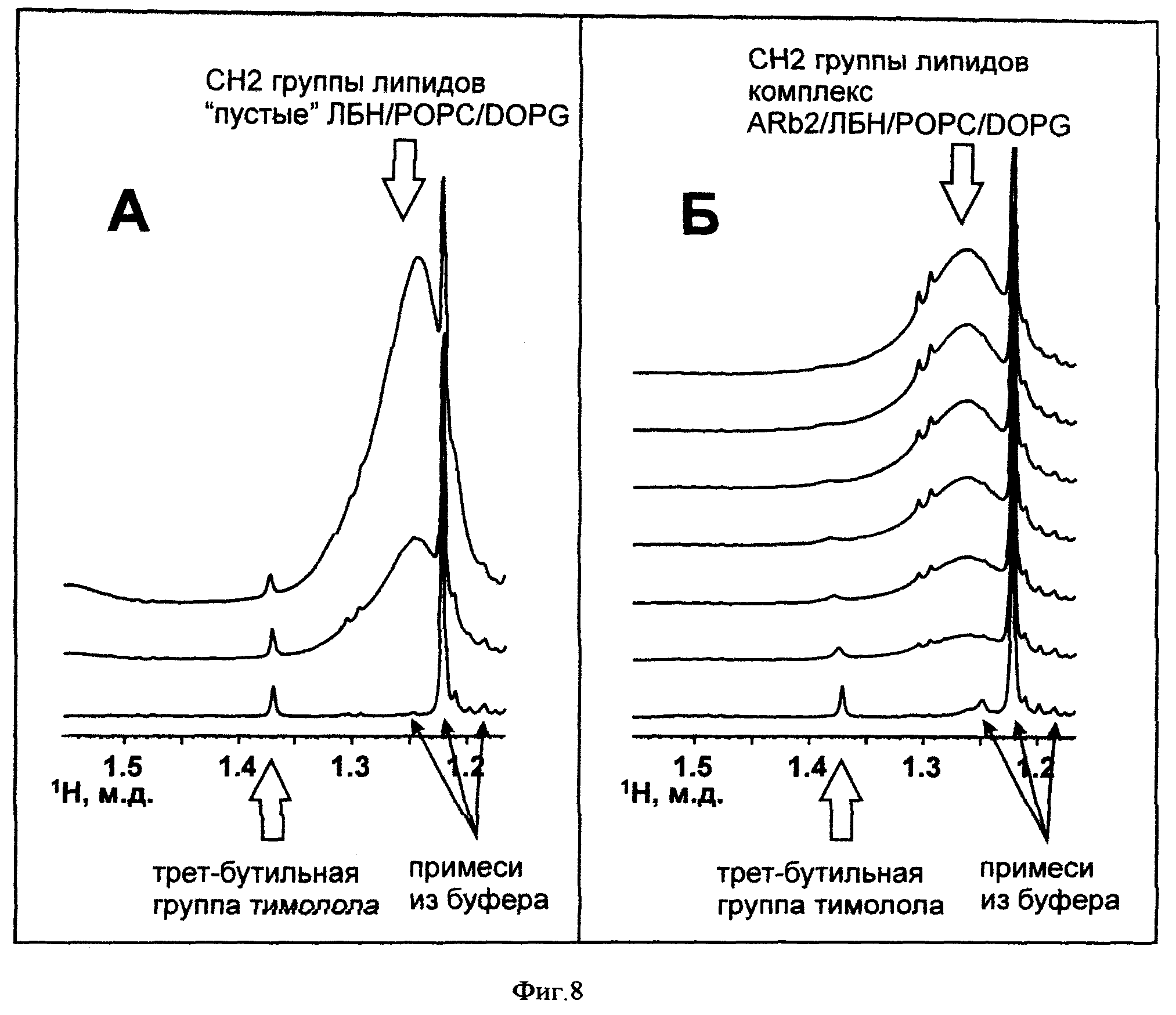
на фиг.8 - фрагменты одномерных 1Н ЯМР-спектров 4 мкМ тимолол-малеата (10 мМ Tris-Ac, pH 7,0, 30°C) в присутствии увеличивающейся концентрации препарата "пустых" ЛБН/POPC/DOPG (3:2) (А) и препарата ARb2/ЛБН/РОРС/DOPG (3:2) (Б) (10 мМ Tris-Ac, pH 7,0, 30°C). Увеличение концентрации ЛБН в растворе можно наблюдать по росту интенсивности сигнала СН2 групп липидов в спектре.
Изобретение иллюстрируют следующие примеры.
Пример 1.
Ренатурация K+ канала KcsA из мономерного состояния в тетрамерную форму с использованием аполипопротеинов и смеси детергентов додецилсульфата натрия (SDS) и холата натрия.
Бактериальный K+ канал KcsA (Streptomyces lividans), имеющий нативную тетрамерную организацию, выделяют из внутренней мембраны Е. coli в результате экстракции мягким детергентом DDM (β-додецилмальтозид), как описано в [L. Heginbotham, Е. Odessey, С.Miller (1997) Biochemistry, 36: 10335-10342J. Затем препарат KcsA денатурируют до мономерной формы путем осаждения с помощью 10% трихлоруксусной кислоты. Детергент DDM удаляют в результате трехкратной промывки осадка KcsA холодным ацетоном. Затем белковый осадок KcsA растворяют в 1% детергенте додецилсульфате натрия (SDS). Мономерное состояние полученного таким образом препарата KcsA детектируют с помощью гель-электрофореза (Фиг.4). Расчетный молекулярный вес KcsA-His6 (мономера) составляет 18,6 кДа.
Препарат KcsA в мономерной форме смешивают с раствором синтетического аналога аполипопротеина А1 человека (фрагмент 44-243, апоA1), полученного известным способом [З.О. Шенкарев, Е.Н. Люкманова, О.И. Соложенкин, И.Э Гагнидзе, О.В. Некрасова, В.В. Чупин, А.А. Тагаев, З.А. Якименко, Т.В. Овчинникова, М.П. Кирпичников, А.С.Арсеньев. (2009), Биохимия, 74(7): 933-945], и раствором липида РОРС (пальмитоил-олеил-фосфатидилхолин) в детергенте холат натрия таким образом, что финальное молярное соотношение KcsA/anoA1/POPC/холат в растворе равно 1:20:900:1800. Финальное молярное соотношение KcsA/SDS в растворе равно 1:500. Полученную смесь инкубируют в течение 12 часов при комнатной температуре, затем удаляют детергенты (холат натрия и SDS) с помощью сорбента BioBeads™. Очистку ЛБН, содержащих KcsA, от "пустых" ЛБН осуществляют с помощью металл-аАинной хроматографии, используя His6-tag, пришитый к С-концу молекулы KcsA. Ассоциацию KcsA с аполипопротеином А1 и липидами подтверждают методами гель-фильтрации (Фиг.5), гель-электрофореза (Фиг.4) и одномерной ЯМР-спектроскопии. Тетрамерное состояние KcsA в составе ЛБН детектируют с помощью гель-электрофореза (Фиг.4). Согласно денситометрическому и спектрофотометрическому анализу эффективность встраивания KcsA в ЛБН составляет не менее 90% от начального количества целевого белка, при этом образец ренатурированного KcsA в составе ЛБН не содержит мономерной формы белка. Таким образом, общий выход реакции ренатурации KcsA указанным способом составляет ~90% от начального количества целевого белка. Общий выход реакции ренатурации KcsA в способе-прототипе составляет ~50% от начального количества целевого белка
Пример 2.
Ренатурация бета2-адренергического рецептора человека (ARb2) с использованием аполипопротеинов и смеси детергентов Fos-12, Fos-14, Fos-16, LMPG и холата натрия.
Модифицированный вариант бета2-адренергического рецептора человека (ARb2), содержащий делецию С-концевого фрагмента (35 кДа) получают в результате гетерологической экспрессии слитной конструкции с белком Mistic в составе телец включения Е. coli, как описано в [Л.Е. Петровская, А.А. Шульга, О.В. Бочарова, Я.С. Ермолюк, Е.А. Крюкова, В.В. Чупин, М.Ж.Ж. Бломмерс, А.С.Арсеньев, М.П. Кирпичников, (2010), Биохимия, 75(7): 1001-1013]. Тельца включения растворяют с помощью 1% детергента лаурил-саркозина в присутствии 1 мМ дитиотреитола. Затем с помощью фермента тромбина проводят гидролиз слитного белка, и отщепленный ARb2, используя His10-tag, пришитый к С-концу молекулы рецептора, очищают с помощью металл-афинной хроматографии в присутствии 1% лаурил-саркозина и 10 мМ β-меркаптоэтанола. Затем препарат ARb2 переосаждают с помощью 10% трихлоруксусной кислоты. Детергент лаурил-саркозин удаляют в результате трехкратной промывки осадка ARb2 холодным ацетоном. Затем белковый осадок ARb2 растворяют в 25 мМ NaPi буфере (рН 7.4), содержащем 0.7 мМ триметил-трис(2-карбоксиэтил)фосфин, 150 мМ NaCl и 2% смесь детергентов (Fos-12/Fos-14/Fos-16/LMPG в соотношении 1:6:1:2). Мономерное состояние полученного таким образом препарата ARb2 детектируют с помощью гель-электрофореза (Фиг.6, дорожка 3).
Препарат ARb2 в мономерной форме смешивают с раствором синтетического аналога аполипопротеина А1 человека (фрагмент 44-243), полученного известным способом [З.О. Шенкарев, Е.Н. Люкманова, О.И. Соложенкин, И.Э Гагнидзе, О.В. Некрасова, В.В. Чупин, А.А. Тагаев, З.А. Якименко, Т.В. Овчинникова, М.П. Кирпичников, А.С.Арсеньев. (2009), Биохимия, 74(7): 933-945], и раствором липидов POPC/DOPG (пальмитоил-олеил-фосфатидилхолин/диолеил-фосфатидилхолин 3:2) в детергенте холат натрия таким образом, что финальное молярное соотношение ARb2/апоА1/липиды/холат в растворе равно 1:20:1600:3200. Финальное молярное соотношение ARb2/Fos-12/Fos-14/Fos-16/LMPG в растворе равно 1:50:300:50:100. Полученную смесь инкубируют в течение 12 часов при температуре 4°С, затем удаляют детергенты (холат натрия, Fos-12, Fos-14, Fos-16 и LMPG) с помощью сорбента BioBeads™. Очистку ЛБН, содержащих ARb2, от "пустых" ЛБН осуществляют с помощью металл-афинной хроматографии, используя His10-tag, пришитый к С-концу молекулы ARb2. Ассоциацию ARb2 с апоА1 и липидами подтверждают методами гель-фильтрации (Фиг.5), гель-электрофореза (Фиг.6) и одномерной ЯМР-спектроскопии.
Активность полученного препарата ARb2/ЛБН/POPC/DOPG проверяют методом ЯМР-спектроскопии с использованием селективного лиганда бета2-адренергического рецептора человека тимолола. Тимолол используют в виде соли малеиновой кислоты (Ленс). Одномерные 1Н ЯМР-спектры тимолол-малеата и "пустых" ЛБН/POPC/DOPG (3:2) в Tris-Ac буфере (pH 7,0) приведены на Фиг 7. Сравнение спектров показывает, что сигнал третбутильной группы тимолола (1.37 м.д.) не перекрывается с сигналами липидов из ЛБН. Для выявления активности ренатурированного ARb2 в комплексе с ЛБН/POPC/DOPG к раствору тимолола (3 мкМ) в Tris-Ac буфере (pH 7,0) постепенно добавляют раствор (24 мкМ) ARb2/ЛБН/POPC/DOPG в таком же буфере до конечной концентрации комплексов ARb2/ЛБН 3 мкМ. В одномерных спектрах ЯМР наблюдают сигналы третбутильной группы тимолола (1.37 м.д.) и сигналы СН2 групп липидов из ЛБН. Полученные спектры показаны на Фиг 8Б. Из спектров видно, что при увеличении концентрации комплексов ARb2/ЛБН/РОРС/DOPG в растворе сигнал третбутильной группы тимолола постепенно уширяется и сдвигается в слабое поле, что свидетельствует о наличии взаимодействия между тимололом и ARb2/ЛБН/РОРС/DOPG. В качестве контроля проводят титрование раствора тимолола (4 мкМ) в Tris-Ac буфере (pH 7,0) раствором "пустых" ЛБН/POPC/DOPG (50 мкМ) до конечной концентрации ЛБН 5 мкМ. Полученные спектры показаны на Фиг 8А. Из спектров видно, что тимолол не взаимодействует с "пустыми" липопротеиновыми частицами.
Согласно денситометрическому и спектрофотометрическому анализу, а также данным ЯМР-спектроскопии, общий выход реакции ренатурации ARb2) указанным способом составляет ~10% от начальногоколичества целевого белка. Выход ренатурированного ARb2 в способе прототипе составляет не более 2% от начального количества целевого белка.
Способ получения ренатурированных мембранных белков, включающий получение гомогенного раствора, содержащего денатурированный мембранный белок, смесь детергентов, фосфолипид или смесь фосфолипидов и аполипопротеин или его синтетический аналог с последующим удалением детергентов и формированием липид-белковых нанодисков, содержащих ренатурированный белок.