Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЭМБРИОНОВ ОВЕЦ in vitro
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии, к клеточной инженерии, в частности к способу получения эмбрионов овец in vitro, и может быть использовано для культивирования животных клеток, а именно ооцитов и эмбрионов овец вне организма.
Уровень техники
Известен способ получения зародышей овец после созревания и оплодотворения ооцитов и культивирования зародышей in vitro, включающий получение яичников овец от половозрелых особей после убоя и транспортировку в лабораторию при 30-35°C в течение 1-3 часов, причем ооциты получают методом аспирации фолликулов диаметром 2-6 мм в среде ТСМ 199 с добавлением HEPES и 50 ЕД/мл гепарина. Далее ооциты культивируют в среде SOF с HEPES, с добавлением аминокислот, 2 мМ L-глютамина, 0,05 ЕД/мл ФСГ, 0,2 мМ пирувата Na, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина и 10% сыворотки плода коровы. Ооциты помещают в капли среды объемом 45 мкл под стерильным парафиновым маслом. Время культивации составляет 24 часа при температуре 39°C, влажности 100%, содержании CO2 5%.
Для оплодотворения используют свежеполученную сперму барана, 100 мкл которой помещают в 1 мл среды SOF с добавлением 20 мМ HEPES и 8 мг/мл бычьего сывороточного альбумина, 100 ЕД/мл пенициллина, 100 мкг/мл стрептомицина и 45 минут инкубируют в термостате при 39°C. Далее супернатант в объеме 800 мкл отбирают в новую пробирку, дважды отмывают в 3 мл среды с центрифугированием при 200 оборотах в течение 3 минут. Для оплодотворения используют объем 5 мкл с содержанием сперматозоидов 1000000 в мл, который добавляют в каплю среды с добавлением 20% инактивированной сыворотки овец во время течки объемом 45 мкл, находящуюся под парафиновым маслом из расчета 10 ооцитов в одной капле. Оплодотворение производят в течение 22 часов при температуре 39°C, влажности 100%, содержании CO2 5%.
После оплодотворения зиготы центрифугируют в течение 2-3 минут для удаления клеток кумулюса и помещают в капли среды объемом 20 мкл. В качестве среды используют среду SOF с добавлением 2% заменимых аминокислот, 1% незаменимых аминокислот, 1 мМ глютамина и 8 мг/мл бычьего сывороточного альбумина. Инкубация выполняют при температуре 39°C, содержании CO2 5%, содержании O2 7%. На 3 и 5 дни инкубации в среду добавляют по 10% сыворотки плода коровы. Культивирование продолжают до 8 дня (см. The Effect of Macromolecule Source and Type of Media During in vitro Maturation of Sheep Oocytes on Subsequent Embryo Development. / A. Shirazi, M.A. Ardali, E. Ahmadi, H. Nazari, M. Mamuee, B. Heidari. // J. Reprod. Infertil. - 2012. - Vol.13, №1. - P.13-19).
Способ позволяет получать достаточно высокий процент бластоцист, но имеет ряд недостатков. К ним относится, в первую очередь, использование материала от забитых животных. Это позволяет получать от одной высокопродуктивной особи небольшое количество яйцеклеток (не более 5-6 на голову) и, к тому же, всего лишь однократно. Понятно, что в племенной работе такой подход является далеко не оптимальным и может быть использован только для включения в процесс продукции эмбрионов забиваемых по тем или иным причинам животных. Также из недостатков следует отметить отсутствие в среде созревания лютеинизирующего гормона (ЛГ), который, как известно, необходим для нормального процесса развития кумулюсных клеток в фазу созревания ооцита. Для капацитации спермиев используется инактивированная сыворотка крови овец во время течки, добавляемая в среду оплодотворения, что не является оптимальным методом, так как ее состав может существенно варьировать, а это не позволяет стандартизировать условия оплодотворения ооцитов. Среди недостатков стоит упомянуть и использование одной среды для культивирования эмбрионов в течение всех 8 дней, хотя известно, что метаболизм морулы и поздней бластоцисты существенно различается (см. Hewitson, L.C. Energy metabolism of the trophectoderm and inner cell mass of the mouse blastocyst. / Hewitson L.C., Leese H.J. // J. Exp. Zool. - 1993. - №267. - P.337-343), и потребность в ряде веществ, содержание которых в сыворотке плода коровы, добавляемой в среду, недостаточно для полноценного развития зародышей.
Известен также способ получения эмбрионов крупного рогатого скота in vitro, включающий использование одной основы для всех питательных сред - SOF, состоящей из 117,7 мМоль NaCl, 7,16 мМоль KCl, 1,19 мМоль KH2PO4, 0,49 мМоль MgCl2, 0,33 мМоль пирувата натрия, 0,75 мг/мл канамицина сульфата, причем яичники забирают на бойне, помещают в физиологический раствор и транспортируют при 20°C в лабораторию в течение 1 дня. Фолликулы диаметром 2-8 мм пунктируют шприцем на 5 мл с иглой 18 G. Ооцит-кумулюсные комплексы промывают в среде SOF с добавлением HEPES и помещают для созревания по 5-6 штук в капли среды объемом 50 мкл или 1 в каплю объемом 10 мкл. Среда созревания состоит из SOF с добавлением 0.02 ЕД/мл свиного гипофизарного фолликулостимулирующего гормона и 1 мг/мл эстрадиола. Культивируют в течение 22-24 часов при 39°C, 5% СО2, 95% влажности.
Для оплодотворения используют оттаянную сперму быка, которую выдерживают в среде SOF без глюкозы с добавлением поливинилалкоголя (1 мг/мл), HEPES, 20 мкМоль пеницилламина, 10 мкМоль гипотаурина, 2 мкМоль эпинефрина в течение 1 часа, после чего 3 раза центрифугируют и промывают.
Для оплодотворения ооциты по 5-6 штук помещают в капли среды объемом 46 мкл с добавлением 4 мкл суспензии спермиев (конечная концентрация 1000000 в мл) или 1 в каплю объемом 8 мкл с 2 мкл суспензии спермиев под парафиновым маслом. Среда оплодотворения готовится на основе SOF без глюкозы с добавлением поливинилалкоголя (1 мг/мл), хлорида кальция 1,71 мМоль, 1% раствора незаменимых аминокислот, 5 ЕД/мл гепарина, 20 мкМоль пеницилламина, 10 мкМоль гипотаурина, 2 мкМоль эпинефрина. Инкубируют в течение 22-24 часов при 39°C в атмосфере 5% CO2 и 95% влажности.
После оплодотворения зиготы инкубируют в каплях среды, состоящей из SOF с добавлением 1 мг/мл поливинилалкоголя, 1,5 мМоль глюкозы, 1 мМоль глютамина, 1,71 мМоль хлорида кальция, 2% заменимых и 1% незаменимых аминокислот, 0.34 мМоль цитрата натрия, 2,77 мМоль миоинозитола, 100 мг/мл аскорбиновой кислоты. Инкубируют в течение 8 суток при 39°C в атмосфере 5% CO2, 5% O2 и 95% влажности (см. Additional effect of epidermal growth factor during in vitro maturation for individual bovine oocytes using a chemically defined medium. / T. Oyamada, H. Iwayama, Y. Fukui. // Zygote. - 2004. - V.12, №02. - P.143-150).
Данный способ также предполагает использование материала от забитых животных, что делает его мало применимым в племенной работе. Он ранее не применялся для работы с ооцитами и эмбрионами у овец. Для оплодотворения используется замороженная сперма, что снижает ее качество и эффективность процесса оплодотворения. В связи с тем, что метод используется для получения эмбрионов крупного рогатого скота, то в среде не используется бычий сывороточный альбумин для предотвращения переноса губчатой энцефалопатии. Он заменен на поливинилалкоголь, который не является естественным метаболитом, как и HEPES, и может снижать выживаемость бластоцист. Для капацитации спермиев применена комбинация пеницилламина, гипотаурина, эпинефрина, а в среду для оплодотворения, кроме этого, добавлен гепарин. Таким образом, в данном методе не используется сыворотка животных во время течки для капацитации спермиев.
Известен способ обеспечения созревания, оплодотворения ооцитов и культивирования эмбрионов крупного рогатого скота, включающий использование одной основы для всех питательных сред - SOF, состоящей из 99,7 мМоль NaCl, 7,16 мМоль KCl, 1,19 мМоль KH2PO4, 0,49 мМоль MgCl2*6H2O, 3,3 ммоль/л натриевой соли молочной кислоты, 25,07 ммоль/л гидрокарбоната натрия, 1,71 ммоль/л хлорида кальция, причем яичники забирают на бойне, помещают в физиологический раствор и транспортируют при 27-31°C в лабораторию. Фолликулы пунктируют вакуумной системой с иглой 18 G. Ооцит-кумулюсные комплексы промывают в среде SOF с добавлением HEPES и помещают для созревания по 10 штук в капли среды объемом 50 мкл или 1 в каплю объемом 10 мкл. Среда созревания состоит из SOF с добавлением 0,33 мМоль пирувата натрия, 1,5 мМоль глюкозы, 1,0 мМоль глютамина, по 1% заменимых и незаменимых аминокислот, 10% сыворотки плода коровы, 0,01 ЕД/мл бычьего гипофизарного фолликулостимулирующего гормона, 0,01 ЕД/мл бычьего гипофизарного лютеинизирующего гормона, 50 нг/мл эпидермального фактора роста, пенициллина, стрептомицина и амфотерицина. Культивируют в течение 22-24 часов при 38,7°C, 5% CO2, 95% влажности.
Для оплодотворения используют оттаянную сперму быка, которую выдерживают в среде SOF без глюкозы с HEPES, лактатом натрия, 0,33 мМоль пирувата натрия, 3 мг/мл бычьего сывороточного альбумина в течение 1 часа, после чего 3 раза центрифугируют и промывают.
Для оплодотворения ооциты помещают в капли среды объемом 44 мкл с добавлением суспензии спермиев (конечная концентрация 1000000 в мл) под парафиновым маслом. Среду оплодотворения готовят на основе SOF без глюкозы с добавлением 6 мг/мл бычьего сывороточного альбумина, 1,0 мМоль пирувата, 2% раствора незаменимых аминокислот, 2 мкг/мл гепарина, 20 мкМоль пеницилламина, 10 мкМоль гипотаурина, 2 мкМоль эпинефрина. Инкубируют в течение 22-24 часов при 38,7°C в атмосфере 5% CO2.
После оплодотворения зиготы инкубируют по 10 штук в каплях среды 50 мкл под парафиновым маслом, состоящей из SOF с 8 мг/мл бычьего сывороточного альбумина, добавлением 1,5 мМоль глюкозы, 1 мМоль глютамина, 1% заменимых и 1% незаменимых аминокислот, 0,1 мМоль ЭДТА, 0,1 мМоль таурина. Инкубируют в течение 3 суток при 38,7°C в атмосфере 5% CO2. На 4 сутки эмбрионы переносят в среду с 8 мг/мл бычьего сывороточного альбумина, содержание глюкозы 3,0 мМоль, 1,0 мМоль глютамина, 1% заменимых и 1% незаменимых аминокислот, 1% витаминов и инкубируют еще 96 часов (см. A single medium supports development of bovine embryos throughout maturation, fertilization and culture. / A.P. Gandhi, M. Lane, D.K. Gardner, R.L. Krisher. // Human Reproduction. - 2000. - Vol.15, №2. - P.395-401).
Недостатком способа является использование материала от забитых животных, к тому же, он не применялся для работы с ооцитами и эмбрионами овец. Для оплодотворения используют замороженную сперму, что снижает ее качество и эффективность процесса оплодотворения. Для капацитации спермиев при использовании данной технологии никаких дополнительных веществ в среду для промывки спермиев не добавляется, что также может отражаться на процессе проникновения спермиев в яйцеклетку, а в среду для оплодотворения, как и в описанном выше методе, введена комбинация пеницилламина, гипотаурина, эпинефрина, кроме этого, добавлен гепарин. Таким образом, в данном методе также не используется сыворотка животных во время течки для капацитации спермиев и добавления в среду оплодотворения.
Наиболее близким по технической сущности и достигаемому положительному эффекту и принятый авторами за прототип является способ получения эмбрионов свиней in vitro, включающий отделение яичников от животных после убоя, их транспортировку, извлечение ооцитов из яичников, культивирование их до стадии метафазы II, подготовку спермы хряка, совместное культивирование ооцитов и сперматозоидов и культивирование оплодотворенных яйцеклеток, причем яичники отделяют от не подвергнутых ошпарке животных не позднее 30 минут с момента их обездвиживания. Яичники трансплантируют в физиологическом растворе, не содержащем антибиотики при 35-37°C в течение 1 часа. Ооциты получают из яичников путем рассечения видимых антральных фолликулов. Полученные ооциты разделяют на группы по количеству окружающих слоев кумулюсных клеток, а именно, на ооциты, окруженные 4-5 слоями кумулюсных клеток, 2-3 слоями и 1 слоем кумулюсных клеток. Каждую группу ооцитов культивируют в среде, содержащей 10 IU хорионического гонадотропина человека. Для оплодотворения ооцитов in vitro используют эякуляторную сперму хряков, разбавленную глюкозо-хелато-цитратно-сульфатным разбавителем, отмытую от семенальной плазмы, разбавленную средой mTBM и проинкубированную в течение 25 минут в условиях инкубатора при 5% CO2 и 38,5°C. Полученные зиготы культивируют в среде NCSU-23, не содержащей феноловый красный, обогащенной 0,1% аминокислот в течение 6-7 дней; в первые трое суток культивирования в среду NCSU-23 дополнительно вводят 0,17 мМ Na-пирувата и 2,75 мМ Na-лактата. Изобретение позволяет повысить выход зрелых ооцитов до 80%, их оплодотворяемость in vitro до 77%, при этом стадии морулы/бластоцисты достигали до 25,7% эмбрионов (см. пат. RU №2340177 МПК9 A01K 67/02, A61D 19/04).
Недостатком данного способа является использование материала от забитых животных и применение его только для одного вида (свиней).
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка способа получения эмбрионов овец in vitro, который предусматривает повышение выхода получения яйцеклеток и их созревание до момента готовности к оплодотворению, что в свою очередь способствует получению эмбрионов овец в искусственно созданных условиях вне организма для развития как племенного животноводства, так и в научно-исследовательских целях.
Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к повышению доли выхода ооцитов, достигших метафазы II, оплодотворенных ооцитов, достигших эмбрионального развития до стадии морулы/бластоцисты in vitro.
Технический результат изобретения достигается с помощью способа получения эмбрионов овец in vitro, включающего извлечение ооцит-кумулюсных комплексов из яичников, культивирование их до стадии метафазы II, совместное культивирование ооцитов и сперматозоидов, культивирование оплодотворенных яйцеклеток, причем в него дополнительно вводят фолликулостимулирующий и лютеинизирующий гормон в виде комбинированного препарата рекомбинантных человеческих гипофизарных гормонов Менопур, эстрадиол, гепарин, кофеин и антибиотик, а культивирование проводят на базовой среде, при этом извлечение ооцит-кумулюсных комплексов из яичников получают от живых овец под наркозом путем пунктирования фолликулов яичников при проведении лапаротомии, причем предварительно производят стимуляцию суперовуляции, получают ооцит-кумулюсные комплексы, а в среду созревания добавляют фолликулостимулирующий и лютеинизирующий гормон в виде комбинированного препарата рекомбинантных человеческих гипофизарных гормонов Менопур, причем концентрация обоих компонентов составляет 0,075 МЕ/мл, а эстрадиол добавляют в среду созревания в концентрации 10 мкг/мл, при этом для оплодотворения используют свежеполученную сперму баранов, для капацитации спермиев барана и в состав среды оплодотворения добавляют комбинацию гепарина в количестве 5 ЕД/мл и кофеина в количестве 0,2 мг/мл, а культивирование и оплодотворение осуществляют в четырехлуночных чашках Петри в 500 мкл питательной среды под 200 мкл парафинового масла.
Технический результат достигается с помощью способа, в котором в качестве антибиотика используют гентамицин.
Технический результат достигается с помощью способа, в котором используется один базовый раствор для основы всех питательных сред, в который добавляют раствор глюкозы, раствор пирувата, раствор гидрокарбоната, раствор лактата, раствор глютамина, сыворотку плода коровы, бычий сывороточный альбумин, незаменимые аминокислоты, заменимые аминокислоты, гепарин, кофеин, деионизированную воду, фолликулостимулирующий и лютеинизирующий гормоны, эстрадиол и соляную кислоту.
Сущность способа получения эмбрионов овец in vitro, включающий извлечение ооцит-кумулюсных комплексов из яичников, культивирование их до стадии метафазы II, совместное культивирование ооцитов и сперматозоидов, культивирование оплодотворенных яйцеклеток, причем в него дополнительно вводят фолликулостимулирующий и лютеинизирующий гормон в виде комбинированного препарата рекомбинантных человеческих гипофизарных гормонов Менопур, эстрадиол, гепарин, кофеин и антибиотик, а культивирование проводят на базовой среде, при этом извлечение ооцит-кумулюсных комплексов из яичников получают от живых овец под наркозом путем пунктирования фолликулов яичников при проведении лапаротомии, причем предварительно производят стимуляцию суперовуляции, получают ооцит-кумулюсные комплексы, в среду созревания добавляют фолликулостимулирующий и лютеинизирующий гормон в виде комбинированного препарата рекомбинантных человеческих гипофизарных гормонов Менопур, причем концентрация обоих компонентов составляет 0,075 МЕ/мл, а эстрадиол добавляют в среду созревания в концентрации 10 мкг/мл, при этом для оплодотворения используют свежеполученную сперму баранов, для капацитации спермиев барана и в состав среды оплодотворения добавляют комбинацию гепарина в количестве 5 ЕД/мл и кофеина в количестве 0,2 мг/мл, а культивирование и оплодотворение осуществляют в четырехлуночных чашках Петри в 500 мкл питательной среды под 200 мкл парафинового масла.
В способе в качестве антибиотика используют гентамицин.
В способе в используется один базовый раствор для основы всех питательных сред, в который добавляют раствор раствор глюкозы, раствор пирувата, раствор гидрокарбоната, раствор лактата, раствор глютамина, сыворотку плода коровы, бычий сывороточный альбумин, незаменимые аминокислоты, заменимые аминокислоты, гепарин, кофеин, деионизированную воду, фолликуло-стимулирующий и лютеинизирующий гормоны, эстрадиол и соляную кислоту.
Краткое описание чертежей и их материалов
На фиг.1 дан способ получения эмбрионов овец in vitro, результаты получения ооцит-кумулюсных комплексов у овец, таблица 1.
На фиг.2 - то же, результаты созревания ооцит-кумулюсных комплексов у овец, таблица 2.
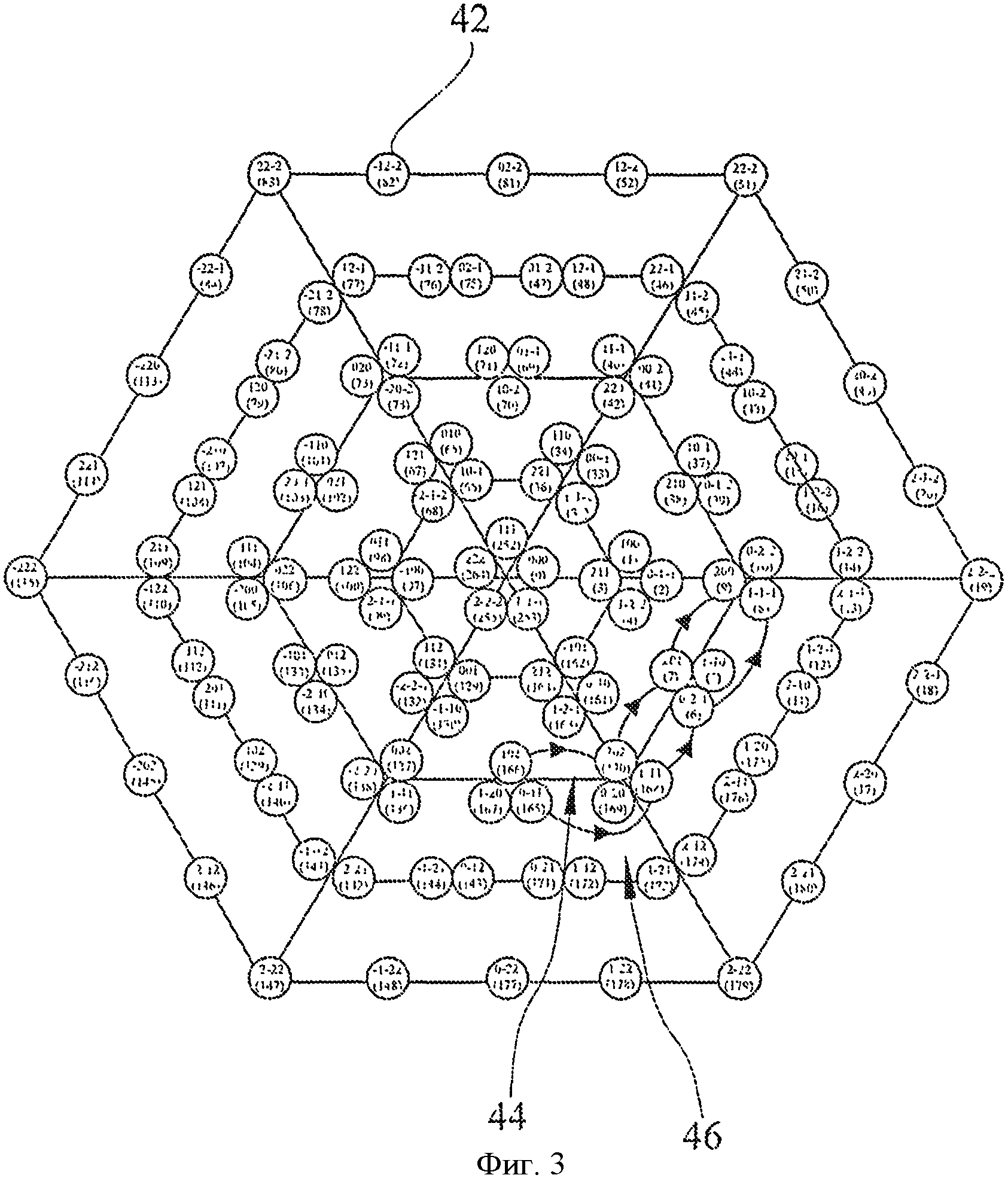
На фиг.3 - то же, результаты оплодотворения и культивирования овец, таблица 3.
На фиг.4 - то же, результаты получения ооцит-кумулюсных комплексов у овец после стимуляции суперовуляции, таблица 4.
На фиг.5 - то же, результаты созревания ооцит-кумулюсных комплексов у овец, таблица 5.
На фиг.6 - то же, приготовление готовых растворов питательных сред в расчете на 5 мл, таблица 6.
На фиг.7 - то же, результаты оплодотворения и культивирования овец, таблица 7.
На фиг.8 - то же, результаты получения ооцит-кумулюсных комплексов у овец, таблица 8.
На фиг.9 - то же, результаты созревания ооцит-кумулюсных комплексов у овец, таблица 9.
На фиг.10 - то же, приготовление готовых растворов питательных сред в расчете на 5 мл, таблица 10.
На фиг.11 - то же, результаты оплодотворения и культивирования овец, таблица 11.
Осуществление изобретения
Примеры конкретного выполнения способа получения эмбрионов овец in vitro.
В примерах оценивают общую эффективность усовершенствованного метода созревания, оплодотворения и развития эмбрионов овец in vitro, определенную по проценту созревших, оплодотворенных ооцитов и норме развития эмбрионов до стадии морулы/бластоцисты.
Пример 1.
Исследования проводят на базе лаборатории вспомогательных репродуктивных технологий Научно-диагностического и лечебного ветеринарного центра ФГБОУ ВПО Ставропольский государственный аграрный университет в период с мая по декабрь 2012 года.
Яичники получают от овец в возрасте 2-3 лет. Ооцит-кумулюсные комплексы (ОКК) получают из яичников, забранных у овец после убоя.
ОКК собирают в пластиковый шприц объемом 5 мл с иглой 22G с 1 миллилитром питательной среды ТСМ 199 с добавлением 10% сыворотки плода коровы и раствора пенициллина 100 ЕД/мл, 100 мкг/мл стрептомицина. Поиск и оценку ОКК выполняют на стереомикроскопе с термостоликом при температуре 38,5°C.
Для созревания отбирают ОКК I-III классов по системе Leibfried and First (1979).
Среднее количество ОКК (Таб.1).
ОКК трижды промывают в среде для созревания с добавлением HEPES, лактата натрия, эпидермального фактора роста, поливинилалкоголя и помещают в капли среды объемом по 50 мкл под стерильным парафиновым маслом. Далее проводят инкубацию в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. По окончании инкубации ОКК переносят в раствор гиалуронидазы 300 мкг/мл (Sigma-Aldrich, USA) на 1 минуту и аккуратным пипетированием капилляром диаметром 135 мкм удаляют клетки кумулюса. Затем ооциты трижды промывают в среде созревания и исследуют с помощью инвертированного микроскопа, оснащенного термостоликом при температуре 38,5°C. Созревшими считают ооциты с первым полярным тельцем.
Для оплодотворения оттаянную сперму в объеме 100 мкл разбавляют в 1 мл среды с добавлением пеницилламина, гипотаурина и эпинефрина для промывки спермы и помещают на 45 минут в инкубатор при 38,5°C и 90% влажности.
После инкубации отбирают 800 мкл среды и дважды отмывают спермии, ресуспендируя промывочной средой и центрифугируя по 3 минуты при 200 g. Третий раз отмывают в среде для оплодотворения и считают концентрацию спермиев.
Вносят спермии в капли среды объемом по 50 мкл под стерильным парафиновым маслом с промытыми трижды в среде для оплодотворения яйцеклетками в 500 мкл среды оплодотворения под 200 мкл парафинового масла, создавая конечную концентрацию спермиев 1-2 миллиона в - миллилитре. Инкубируют 24 часа при 38,5°C, 90% влажности и 5% CO2. Показателем оплодотворения является наличие двух полярных телец, двух пронуклеусов или начало деления зиготы.
Для культивирования эмбрионов зиготы трижды промывают в среде культивирования с добавлением ЭДТА и таурина и переносят в капли среды объемом по 50 мкл под стерильным парафиновым маслом. Далее проводится инкубация в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. Через 72 часа эмбрионы трижды отмывают в среде культивирования с добавлением HEPES. Далее культивирование продолжается еще 96 часов до получения бластоцист без блестящей оболочки.
Использование материала от забитых животных позволяет получать от одной высокопродуктивной особи небольшое количество яйцеклеток и только однократно. Отсутствие в среде созревания лютеинизирующего гормона может привести к нарушению нормального процесса развития кумулюсных клеток в фазу созревания ооцита. Для оплодотворения используется замороженная сперма, что снижает ее качество и эффективность процесса оплодотворения. В среде для культивирования эмбрионов не используется бычий сывороточный альбумин, а добавлен поливинилалкоголь, что снижает выживаемость бластоцист.
Пример 2. Проводят аналогично примеру №1, но животным для увеличения количества получаемых ОКК проводят синхронизацию полового цикла и стимуляцию суперовуляции. Для синхронизации полового цикла используют двукратное внутримышечное введение 125 мкг простагландина F2альфа на 1 и 10 день. Стимуляция суперовуляции осуществляется путем введения препарата аналога гонадотропин-релизинг гормона люлиберина на 9, 10,11 день внутримышечно в дозе 20 мкг.
Ооцит-кумулюсные комплексы получают путем пункции фолликулов. Операция выполняется на 12 день эксперимента.
Перед операцией животных в течение суток держат на голодной диете. Операции проводят под внутривенным наркозом 5% раствором тиопентала натрия в дозировке 15 мг/кг веса. Каудальный конец операционного стола с закрепленным на нем животным поднимают под углом 20° для смещения кишечника в сторону диафрагмы. После выполнения нижнесрединной лапаротомии яичники поочередно выводят в рану и пунктируют фолликулы диаметром 3 и более миллиметров.
ОКК собирают в пластиковый шприц объемом 5 мл с иглой 22G с 1 миллилитром питательной среды ТСМ 199 с добавлением 10% сыворотки плода коровы и раствора антибиотика гентамицина в конечной концентрации 50 мкг/мл. Поиск и оценку ОКК выполняют на стереомикроскопе с термостоликом при температуре 38,5°C.
Для созревания отбирают ОКК I-III классов по системе Leibfhed and First (1979).
Количество полученных в ходе эксперимента ОКК было меньше количества пропунктированных фолликулов на 33,4%. Из полученных ОКК наибольшее количество относилось ко II классу, наименьшее к IV классу качества ОКК. Представители I и III классов составляли приблизительно одинаковое число (Табл.4).
Среди ОКК разных классов качества, помещенных на инкубацию, наибольший процент созревания ооцитов наблюдают при показателях качества, соответствующих I классу. Наименьший процент созревания был достигнут среди ОКК III класса качества (Табл.5).
Непосредственно перед проведением процедуры взятия ооцит-кумулюсных комплексов готовятся пять питательных сред путем смешивания компонентов (Табл.6).
Предварительно готовятся растворы по следующим прописям:
Базовый раствор (10×)
- 0,55 г NaCl
- 0,046 г KCl
- 0,014 г KH2PO4
- 0,0087 MgCl2×6H2O
- 0,005 г гентамицина
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°С в течение 3 месяцев
Раствор Ca (10×)
- 0,022 г CaCl2×2H2O
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор глюкозы (10×)
- 0,0237 г глюкозы
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор пирувата Na (10×)
- 0,0032 г пирувата
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 1 недели
Раствор гидрокарбоната Na (10×)
- 0,184 г NaHCO3
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 недель
Раствор лактата Na (10×)
- 0,1175 мл Na лактата (60% сироп)
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор глютамина (10×)
- 0,026 г глютамина
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 1 недели
После этого среды стерилизуются фильтрованием в стерильные пластиковые пробирки через фильтр 0,22 мкм и хранятся в холодильнике при 4°C в течение недели.
ОКК трижды промывают в среде для созревания, в которую добавляют эстрадиол в концентрации 10 мкг/мл и фолликулостимулирующий и лютеинизирующий гормон в виде комбинированного препарата рекомбинантных человеческих гипофизарных гормонов Менопур, концентрация обоих компонентов составляет 0,075 МЕ/мл и помещают по 10-20 штук в четырехлуночную чашку Петри с 500 мкл среды для созревания, покрытой 200 мкл парафинового масла для клеточных культур. Далее проводят инкубацию в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. По окончании инкубации OKK переносят в раствор гиалуронидазы 300 мкг/мл (Sigma-Aldrich, USA) на 1 минуту и аккуратным пипетированием капилляром диаметром 135 мкм удаляют клетки кумулюса. Затем ооциты трижды промывают в среде созревания и исследуют с помощью инвертированного микроскопа, оснащенного термостоликом при температуре 38,5°C. Созревшими считают ооциты с первым полярным тельцем.
Для оплодотворения свежесобранную сперму в объеме 100 мкл разбавляют в 1 мл среды для промывки спермы и помещают на 45 минут в инкубатор при 38,5°C и 90% влажности. Пробирку желательно установить под наклоном 45° для удобства последующего отбора жидкости с живыми спермиями.
После инкубации отбирают 800 мкл среды (пробирку не встряхивать!) и дважды отмывают спермии, ресуспендируя промывочной средой и центрифугируя по 3 минуты при 200 g. Третий раз отмывают в среде для оплодотворения и считают концентрацию спермиев.
Вносят спермии в четырехлуночную чашку Петри с промытыми трижды в среде для оплодотворения яйцеклетками в 500 мкл среды оплодотворения под 200 мкл парафинового масла, создавая конечную концентрацию спермиев 1-2 миллиона в миллилитре. Инкубируют 24 часа при 38,5°C, 90% влажности и 5% CO2. Показателем оплодотворения является наличие двух полярных телец, двух пронуклеусов или начало деления зиготы.
Для культивирования эмбрионов зиготы трижды промывают в среде культивирования 1 и переносят в четырехлуночную чашку Петри, содержащую 500 мкл среды для культивирования 1 под 200 мкл парафинового масла. Далее проводят инкубацию в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. Через 72 часа эмбрионы трижды отмывают в среде культивирования 2 и переносят в среду культивирования 2. Далее культивирование продолжается еще 96 часов до получения бластоцист без блестящей оболочки. Результаты оплодотворения и культивирования эмбрионов приведены в таблице 7.
Использование материала от животных, находящихся в состоянии наркоза при проведении лапаротомии, и провоцирование у них суперовуляции позволяют получать от одной высокопродуктивной особи большое количество яйцеклеток многократно. Добавление в среду созревания лютеинизирующего гормона способствует нормальному процессу развития кумулюсных клеток в фазу созревания ооцита. Для оплодотворения используется свежесобранная сперма, что повышает ее качество и эффективность процесса оплодотворения. В среде для культивирования эмбрионов используется бычий сывороточный альбумин, что увеличивает выживаемость бластоцист.
Пример 3. Проводят аналогично примеру №1, но OKK собирали в пластиковый шприц объемом 5 мл с иглой 22G с 1 миллилитром питательной среды ТСМ 199 (ООО «ПанЭко», Москва) с добавлением 10% сыворотки плода коровы (ООО «ПанЭко», Москва) и раствора антибиотика гентамицина в концентрации 50 мкг/мл. Поиск и оценку ОКК выполняли на стереомикроскопе SZX-10 («Olympus», Япония) с термостоликом Thermo Plate (Tokai Hit, Япония) при температуре 38,5°C.
Для созревания отбирали ОКК I-III классов по системе Leibfried and First (1979). Результаты получения ОКК приведены в таблице 8.
Количество полученных в ходе эксперимента ОКК было меньше количества пропунктированных фолликулов на 25,2%. Таким образом, количество OKK, получаемых при пункции фолликулов из удаленных яичников, больше, чем из пунктируемых во время лапаротомии. Из полученных OKK наибольшее количество относилось ко II классу, наименьшее к IV классу качества ОКК. Представители II класса качества составляли большее число, чем представители III класса, что отличает структуру показателей качества от результатов эксперимента по получению ооцитов путем лапаротомии. Среднее количество ОКК, полученных из одного яичника и в расчете на одну голову овцы, существенно меньше, чем в эксперименте с применением лапаротомии, так как там использовалась стимуляция суперовуляции, позволяющая значительно повысить количество ОКК у одной особи.
Описательная статистика выполнялась в программе «Primer of Biostatistic 3.01» для Windows на IBM-совместимом компьютере.
В таблице 9 приведены результаты эксперимента по созреванию ооцитов в искусственных условиях.
Непосредственно перед проведением процедуры взятия ооцит-кумулюсных комплексов готовятся пять питательных сред путем смешивания компонентов (Табл.10).
Предварительно готовятся растворы по следующим прописям:
Базовый раствор (10×)
- 0,629 г NaCl
- 0,0534 г KCl
- 0,0162 г KH2PO4
- 0,00996 MgCl2×6H2O
- 0,005 г гентамицина
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор Ca (10×)
- 0,0252 г CaCl2×2H2O
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор глюкозы (10×)
- 0,027 г глюкозы
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор пирувата Na (10×)
- 0,0036 г пирувата
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 1 недели
Раствор гидрокарбоната Na (10×)
- 0,21 г NaHCO3
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 недель
Раствор лактата Na (10×)
- 0,1175 мл Na лактата (60% сироп)
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 3 месяцев
Раствор глютамина (10×)
- 0,03 г глютамина
- Растворить в 10 мл деионизированной воды
- Отфильтровать и хранить при 4°C в течение 1 недели
Среду для созревания ооцитов готовили из среды ТСМ 199 с добавлением 10% сыворотки плода коровы, антибиотика гентамицина в концентрации 50 мкг/мл и помещали по 10-20 штук в четырехлуночную чашку Петри с 500 мкл среды для созревания, покрытой 200 мкл парафинового масла для клеточных культур. Далее проводят инкубацию в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. По окончании инкубации ОКК переносят в раствор гиалуронидазы 300 мкг/мл на 1 минуту и аккуратным пипетированием капилляром диаметром 135 мкм удаляют клетки кумулюса. Затем ооциты трижды промывают в среде созревания и исследуют с помощью инвертированного микроскопа, оснащенного термостоликом при температуре 38,5°C. Созревшими считают ооциты с первым полярным тельцем.
Для оплодотворения оттаянную сперму в объеме 100 мкл разбавляют в 1 мл среды для промывки спермы и помещают на 45 минут в инкубатор при 38,5°C и 90% влажности.
После инкубации отбирают 800 мкл среды (пробирку не встряхивать!) и дважды отмывают спермии, ресуспендируя промывочной средой и центрифугируя по 3 минуты при 200 g. Третий раз отмывают в среде для оплодотворения и считают концентрацию спермиев.
Вносят спермии в четырехлуночную чашку Петри с промытыми трижды в среде для оплодотворения яйцеклетками в 500 мкл среды оплодотворения под 200 мкл парафинового масла, создавая конечную концентрацию спермиев 1-2 миллиона в миллилитре. Инкубируют 24 часа при 38,5°C, 90% влажности и 5% CO2. Показателем оплодотворения является наличие двух полярных телец, двух пронуклеусов или начало деления зиготы.
Для культивирования эмбрионов зиготы трижды промывают в среде культивирования 1 и переносят в четырехлуночную чашку Петри, содержащую 500 мкл среды для культивирования 1 под 200 мкл парафинового масла. Далее проводят инкубацию в термостате при 38,5°C, влажности 90% и содержании CO2 5% в течение 24 часов. Через 72 часа эмбрионы трижды отмывают в среде культивирования 2 и переносят в среду культивирования 2. Далее культивирование продолжается еще 96 часов до получения бластоцист без блестящей оболочки. Результаты оплодотворения и культивирования эмбрионов приведены в таблице 11.
Среди ОКК разных классов качества, помещенных на инкубацию, наибольший процент созревания ооцитов наблюдался при показателях качества, соответствующих I и II классу. Наименьший процент созревания был достигнут среди ОКК III класса качества. Эффективность созревания была существенно ниже, чем в эксперименте с использованием среды для созревания на основе SOF по сравнению со средой ТСМ 199. Таким образом, выход эмбрионов при методах, использованных в данном эксперименте, будет значительно меньше, так как число созревших ооцитов уже снижено, по сравнению с экспериментом в примере 2.
Результаты выполненного оплодотворения зрелых яйцеклеток в искусственных условиях показали, что количество оплодотворенных ооцитов и зигот, начавших деление, меньше, чем в примере 2. Это указывает на высокую эффективность использования кофеина и гепарина в качестве стимулирующих капацитацию факторов при проведении оплодотворения in vitro у овец.
Таким образом, наиболее оптимальным является пример 2. Использование материала от животных, находящихся в состоянии наркоза при проведении лапаротомии, и провоцирование у них суперовуляции позволяет получать от одной высокопродуктивной особи большое количество яйцеклеток многократно. Разработанные питательные среды способствуют увеличению количества ооцит-кумулюсных комплексов, повышению эффективности их созревания и получению значительного количества эмбрионов in vitro.
Предлагаемое изобретение по сравнению с прототипом и другими известными техническими решениями имеет следующие преимущества:
- повышение доли выхода ооцитов, достигших метафазы II, оплодотворенных ооцитов, достигших эмбрионального развития до стадии морулы/бластоцисты in vitro;
- применение одного базового раствора для основы всех питательных сред используется впервые для овец.