Результат интеллектуальной деятельности: СРЕДСТВО, ОБЛАДАЮЩЕЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к фармакологии, а именно к биологически активным веществам, обладающим кардиотоническими свойствами, которые могут применяться в терапии больных с сердечной недостаточностью.
В Европейских рекомендациях по диагностике и лечению хронической сердечной недостаточности (XCH) сердечную недостаточность (CH) определяют как патофизиологический синдром, при котором в результате того или иного заболевания сердечно-сосудистой системы происходит снижение насосной функции, что приводит к дисбалансу между гемодинамической потребностью организма и возможностями сердца [Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. Национальные рекомендации ВНОК и ОССН по диагностике и лечению XCH / Сердечная недостаточность. - 2010. - №2. - с.65-103]. Сердечная недостаточность - наиболее частый исход большинства сердечно-сосудистых заболеваний - в развитых странах является одним из самых распространенных патологических состояний. Ее распространенность за последние 20 лет достигла такого уровня, что позволяет говорить о надвигающейся эпидемии XCH [Сидоренко Б.А., Преображенский Д.В. Меняющиеся взгляды на место лекарственных средств в лечении хронической сердечной недостаточности / Кардиология. - 2005. - №3. - с.90-91; Абдюкова А.Н., Закирова Э.Р. Гемодинамические и эндотелийпротективные эффекты β-адреноблокаторов у больных ишемической болезнью сердца, осложненной хронической сердечной недостаточностью и фибрилляцией предсердий / Кардиосоматика. - 2010. - №1. - с.65-69]. Регулярная коррекция симптомов CH требуется более чем у 45% пациентов, перенесших инфаркт миокарда, и у 46% больных с неконтролируемой артериальной гипертензией (АГ) [Решетько О.В. Инновационные лекарственные средства для лечения сердечной недостаточности: взгляд в будущее / Качественная клиническая практика. - 2003. - №2. - с.2-9].
Лекарственные препараты, усиливающие сократительные способности миокарда, применяемые при CH, подразделяют на сердечные гликозиды и препараты «негликозидной» структуры.
Сердечные гликозиды, наиболее известным из которых является дигоксин, при длительном применении могут увеличивать смертность больных с хронической СН или с постинфарктной дисфункцией левого желудочка [Сидоренко Б.А. и др. Место сердечных гликозидов в лечении хронической сердечной недостаточности / Кардиология. - 2005. - часть II: №5. - с.78-85, часть III: №6. - с.61-71]. Они могут вызывать потенциально фатальные осложнения (синоатриальные и атриовентрикулярные блокады, предсердные и желудочковые аритмии, хроническую интоксикацию). Кроме того, существует целый ряд относительных противопоказаний к их назначению, такие как пожилой возраст, почечная недостаточность, гипокалиемия, нарушения ритма, ИБС и др.
Среди препаратов «негликозидной» структуры в последнее время появилось много новых положительных инотропных средств с различным механизмом действия и характерным электрофизиологическим профилем [Гуревич М.А., Архипова Л.В. Негликозидная инотропные средства и нейрогуморальные антагонисты в лечении сердечности / Российский кардиологический журнал. - 2008. - Т.73, №5. - с.84-87; Endoh M. Cardiac Са2+ signaling and Ca2+ sensitizers. / Circ. J. - 2008. - N.72 (12). - P.1915-25]. В настоящее время наиболее изучен механизм действия препаратов двух групп - ингибиторов ФДЭ (амринон, милринон, эноксимон - [Farah AE. Historical perspectives on inotropic agents / Circulation. - 1986. - №73 (3 pt. 2). - P.III 4-9; Alousi AA, Johnson DC. Pharmacology of the bipyridines: amrinone and milrinone / Circulation. - 1986. - №73 (3 pt. 2). - P.III 10-24], к которым относятся также эноксимон, адибендан и пимобендан, сульмазол, в структуры которых входят кольца имидазола и бензимидазола, и стимуляторов β1-адренорецепторов (добутамин, ибопамин, ксамотерол) [Беленков Ю.Н., Мареев В.Ю Лечение сердечной недостаточности в 21 веке: достижение, вопросы и уроки доказательной медицины / Кардиология. - №2. - 2008 - с.6-17; Моисеев B.C., Павликов Е.П. Левосимендан или добутамин при острой сердечной недостаточности / Клиническая фармакология и терапия. - 2009. - Том 4, №18. - с.14-17; Endoh M., Hori M. Acute heart failure: inotropic agents and their clinical uses / Department of Cardiovascular Pharmacology. - 2006. -N.7 (16). - P.2179-202].
Эти препараты способны усиливать сократимость миокарда в гораздо большей степени, чем гликозиды. Они увеличивают внутриклеточное содержание цАМФ за счет повышения его синтеза или уменьшения разрушения (ингибирование ФДЭ-3). Накопление цАМФ сопровождается повышением концентрации кальция в клетках, которое в свою очередь ведет к увеличению сократимости миокарда в систолу и скорости его расслабления в диастолу. Таким образом, β1-адреномиметики и ингибиторы ФДЭ усиливают инотропную функцию сердца и улучшают диастолическую функцию, нарушение которой играет важную роль в патогенезе CH.
Основным показанием к назначению негликозидных инотропных препаратов является неотложная медицина: нарушение кровообращения при острой CH различного генеза, шок, остановка сердца, декомпенсация хронической CH, острый инфаркт миокарда, сепсис, полиорганная недостаточность, тяжелые пороки сердца, постперфузионный синдром в кардиохирургии и другие [Гуревич М.А., Архипова Л.В. Негликозидные инотропные средства и нейрогуморальные антагонисты в лечении сердечности / Российский кардиологический журнал - 2008. - Т.73, №5. - с.84-87].
Однако результаты многочисленных исследований показали, что использование мощных положительных инотропных препаратов в лечении XCH возможно лишь в виде коротких курсов, когда резкое повышение сердечного выброса позволяет добиться увеличения диуреза и выведения пациента из состояния тяжелой декомпенсации [Chatterjee К., De Marco Т. Role of nonglycosidic inotropic agents: indications, ethics, and limitations. / Med. Clin. Norts. Am. - 2003. - N.87. - P.391-418; Отрохова Е.В. Возможности патогенетического лечения больных XCH с сохраненной систолической функцией левого желудочка / Клиническая фармакология и терапия. - 2007. - Т.3, №16. - с.53-59]. При этом чем сильнее инотропный эффект этих препаратов, тем в большей степени они увеличивают смертность больных XCH при длительном лечении. Негативное влияние продолжительного применения негликозидных инотропных стимуляторов на прогноз больных XCH было доказано в 11 многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследованиях [Беленков Ю.Н., Мареев В.Ю. Лечение сердечной недостаточности в 21 веке: достижение, вопросы и уроки доказательной медицины / Кардиология. - №2. - 2008. - c.6-17].
Наиболее распространенным среди инотропных препаратов является амринон - 5-амино[3,4'-бипиридин]-6(1Н)-ОН [М.Д. Машковский. Лекарственные средства, 15-е издание. М., Новая волна, 2007, с.380; Farah AE. Historical perspectives on inotropic agents / Circulation. - 1986. - №73 (3 pt. 2). - P.III 4-9; Alousi AA, Johnson DC. Pharmacology of the bipyridines: amrinone and milrinone / Circulation. - 1986. - №73 (3 pt. 2). - P.III 10-24]. Он оказывает положительный инотропный эффект, а также сосудорасширяющее действие у больных с CH. Но предназначен только для кратковременной терапии застойной CH, так как длительное применение его приводит к увеличению смертности.
Техническим результатом является повышение кардиотонической активности.
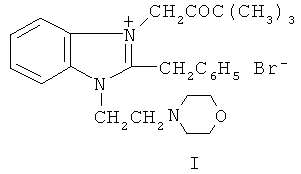
Технический результат достигается применением бромида 2-бензил-1-морфолиноэтил-3-пивалоилметилбензимидазолия формулы I

в качестве кардиотонического активного соединения, в том числе для изготовления кардиотонического средства.
Бромид I описан в статье как промежуточный продукт синтеза биологически активных производных пирроло[1,2-а]бензимидазолов (В.А. Анисимова и др. //ХФЖ, 1996, том 30, №1, с.22-25). Его фармакологические свойства не исследовались.
Схема синтеза бромида I и методика синтеза представлены ниже:
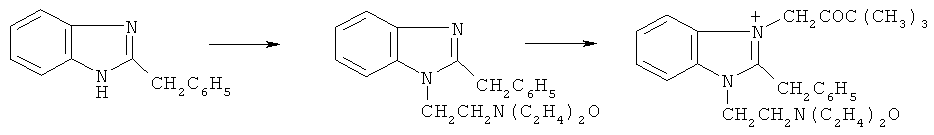
Стадия 1. 2-Бензил-1- морфолиноэтилбензимидазол.
К раствору 0,5 моль 80%-ного КОН в 35 мл воды прибавляют 0,1 моль 2-бензилбензимидазола, после 5-7 мин перемешивания приливают 60 мл ацетона и вносят 0,1 моль гидрохлорида морфолиноэтилхлорида. Смесь кипятят 2 ч, ацетоновый раствор по охлаждении сливают с щелочного раствора, затем ацетон отгоняют, а остаток перегоняют в вакууме, собирая фракцию с т.кип. 237-240°С (3 мм рт.ст.), которая закристаллизовывается в белоснежные кристаллы. Выход 89%, т.пл. 130-131°С (из ацетонитрила). Найдено, %: С 74,5; Н 7,2; N 13,3. С20Н23Н3О. Вычислено, %: С 74,7; Н 7,2; N 13,1.
Стадия 2. Бромид 2-бензил-1-морфолиноэтил-3-пивалоилметилбензимидазолия.
Тщательно растертую смесь 0,01 моль полученного морфолиноэтилзамещенного и 2 мл бромпинаколина выдерживают 1 ч при 80-85°С. Плав охлаждают и осадок бромида I после обработки плава ацетоном отфильтровывают, промывая на фильтре ацетоном. Выход 80,0%. Т.пл. 220-221°С (из 2-пропанола). ИК-спектр, γ, см-1: 1725 (С=О). Найдено, %: С 62,2; Н 6,7; Br 16, 3; N 8,5. C26H34BrN2O3. Вычислено, %: С 62,4; Н 6,8; Br 16,0; N 8,4.
Ниже приведены результаты исследования кардиотонических свойств производного бензимидазола формулы I.
1. Материалы и методы.
1.1. Схема исследования.
1 этап - изучение влияния соединения I на сократительную активность изолированных предсердий. Расчет IC50.
2 этап - изучение острой токсичности.
3 этап - изучение влияния соединения I на сократительную активность и функциональные резервы миокарда in vivo на животных с CH.
1.2. Материалы.
Бромид I (НИИ ФОХ ЮФУ, Ростов-на-Дону); амринон (SIGMA, США); адреналин (ФГУП «Московский эндокринный завод», Россия); изопротеренол (изопреналина гидрохлорид) (SIGMA, США).
1.3. Животные.
В экспериментах были использованы интактные животные (беспородные белые крысы-самки 250-300 г, мыши-самцы весом 20-25 г), которые содержались в условиях вивария ВолгГМУ с естественным световым режимом на стандартной диете лабораторных животных в соответствии с ГОСТ P 50258-92 [1993], с соблюдением «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» [The European Convention… , 2007], а также правил лабораторной практики при проведении доклинических исследований в РФ, регламентированных ГОСТ P 51000.3-96 [1996] и ГОСТ P 51000.4-96 [1996]. В течение 24 часов до экспериментов животные находились в условиях полной пищевой депривации со свободным доступом к воде. Забой животных проводился согласно требованиям, изложенным в «Международных рекомендациях по проведению медико-биологических исследований с использованием животных» [ICSU statement, 2007; Международные рекомендации… , 2007].
1.4. Методы, использованные для изучения влияния на сократительную активность на изолированных органах.
У крысы после торакотомии извлекали сердце, выделяли препарат изолированных предсердий, фиксировали в ванночке при постоянной перфузии аэрируемым питательным раствором Кребса (NaCl - 120 мМ, KCl -4,8 мМ, KH2PO4 - 1,2 мМ, MgSO4 - 2,5 мМ, NaHCO3 - 25 мМ, CaCl2 - 2,6 мМ, глюкоза - 5,4 мМ, pH - 7,4, t=24°C) со скоростью 5 мл/мин (установка для изолированных органов (UGO BASILE, (Италия)). Препараты предсердий стимулировали прямоугольными импульсами длительностью 3-5 мсек и амплитудой, на 10-20% превышающей пороговую (электростимулятор «ЭС-50-1», Россия). Силу сокращения и напряжение покоя, развиваемые каждым препаратом после усиления и дифференцирования, регистрировали на быстродействующем самопишущем приборе.
Эффекты исследуемого соединения изучали в диапазоне концентраций 10-7-10-5 М. В качестве препарата сравнения был выбран известный негликозидный кардиотонический препарат из группы ингибиторов фосфодиэстеразы - амринон. Рассчитывали IC50 - концентрацию соединения, увеличивающую амплитуду сокращения изолированных предсердий на 50%.
1.5. Изучение острой токсичности
Для вычисления широты терапевтического действия соединения определяли острую токсичность на 50 мышах-самцах при внутрибрюшинном введении. Рассчет величины ЛД50 проводили графически по Миллеру и Тейтнеру [Беленький М.Л. Элементы количественной оценки фармакологического эффекта. - Л., 1963. - 152 с.].
1.6. Методы in vivo, использованные для изучения влияния на сократительную активность н функциональные резервы сердца в условиях экспериментальной сердечной недостаточности.
Сердечную недостаточность (CH) моделировали путем подкожного введения изопротеренола дважды с интервалом 24 часа в дозе 80 мг/кг. Контрольным животным вводили изотонический раствор натрия хлорида в эквивалентных объемах. Формирование CH оценивали по изменениям ЭКГ во 2-м стандартном отведении на 2-е сутки у наркотизированных животных (хлоралгидрат, внутрибрюшинно, 400 мг/кг) на компьютерном электрокардиографе «Поли-Спектр 8/В» («Нейрософт», Россия).
Исследования проводили на 24 белых беспородных крысах-самках массой 280-320 г. Животные были разделены на 4 группы: 1 группа - контроль - «интактные» - животные без CH, которым вводили физиологический раствор; 2 группа - «контроль-CH» - животные с CH, которым вводился физиологический раствор; 3 группа - опыт - «CH-бромид I» - животные с CH, которым вводилось соединение I; 4 группа - контроль - «CH-амринон» - животные с CH, которым вводилось препарат сравнения амринон.
В условиях наркоза (хлоралгидрат, внутрибрюшинно, 400 мг/кг), искусственной вентиляции легких, торакотомии, перикардотомии проводили катетеризацию левого желудочка. Для измерения артериального давления катетеризировали левую общую сонную артерию. Введение исследуемых веществ осуществляли через катетер, имплантированный в правую наружную яремную вену.
Изучение влияния вещества на функциональные резервы сердца осуществлялось на крысах с использованием нагрузочной пробы: изменение преднагрузки - нагрузки объемом - быстрое (в течение 2 сек) внутривенное введение животным физиологического раствора из расчета 0,3 мл/на 100 г массы тела.
Регистрация основных показателей кардио- и гемодинамики (максимальное левожелудочковое давление (ЛЖДмакс), скорость сокращения и расслабления миокарда (dp/dt+ и dp/dt-), частоту сердечных сокращений (ЧСС), среднее артериальное давление (АДср)) осуществлялась электроманометром на механотронных датчиках с малым объемом смещения (0,05 мл на 250 мм рт.ст.) с помощью компьютерного гемодинамического анализатора на базе программы BEAT (Москва, Россия). Максимальную интенсивность функционирования структур (МИФС) определяли расчетным способом (ЛЖДмакс×(масса левого желудочка + 1/3 межжелудочковой перегородки)/ЧСС) [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под общ. ред. Р.У. Хабриева. 2-е изд., перераб. и доп. М.: Медицина. - 2005. - 832 с.].
Изучаемые соединения вводили внутривенно в дозе, эквивалентной 2 IC50 (см. табл.1), что составило 0,42 мг/кг для бромида I и 0,94 мг/кг для амринона.
Через 5 минут после введения исследуемых веществ и записи исходных показателей животным проводили нагрузочные пробы. В течение всего периода осуществляли регистрацию основных показателей.
1.7. Методы статистической обработки
Статистическую обработку данных проводили с использованием пакета программ Statistica 6.0. (StatSoft, США) и Excel 2007 (MS Office XP, США). Проводился расчет базовых статистических показателей, характеризующих вариационные ряды (среднее арифметическое значение М, стандартная ошибка средней арифметической m). Результаты исследований оценивали с использованием двухстороннего t-критерия Стьюдента (p<0,05).
Для исследуемого препарата и препарата сравнения экспериментально определены величины IC50 с использованием метода регрессионного анализа в программе Microsoft Excel (пакет Office XP, Microsoft, США).
2. Результаты исследования
При изучении влияния бромида I и амринона на сократительную активность изолированных предсердий крыс было показано дозозовисимое увеличение амплитуды изометрического сокращения. Рассчитаны IC50, которые представлены в таблице 1.
При изучении острой токсичности при внутрибрюшинном введении мышам рассчитана ЛД50. Для оценки широты терапевтического действия на изолированных органах рассчитан терапевтический индекс (табл. 1).
Таким образом, по влиянию на сократительную активность изолированных предсердий крыс бромид I оказался активнее амринона и превосходило его как по величине IC50 в 6 раз, так и по терапевтическому индексу - в 1,8 раза.
|
При изучении влияния изучаемых соединений на кардио- и гемодинамику у животных с СП при изменении преднагрузки (тест нагрузки объемом) был показан положительный инотропный эффект.
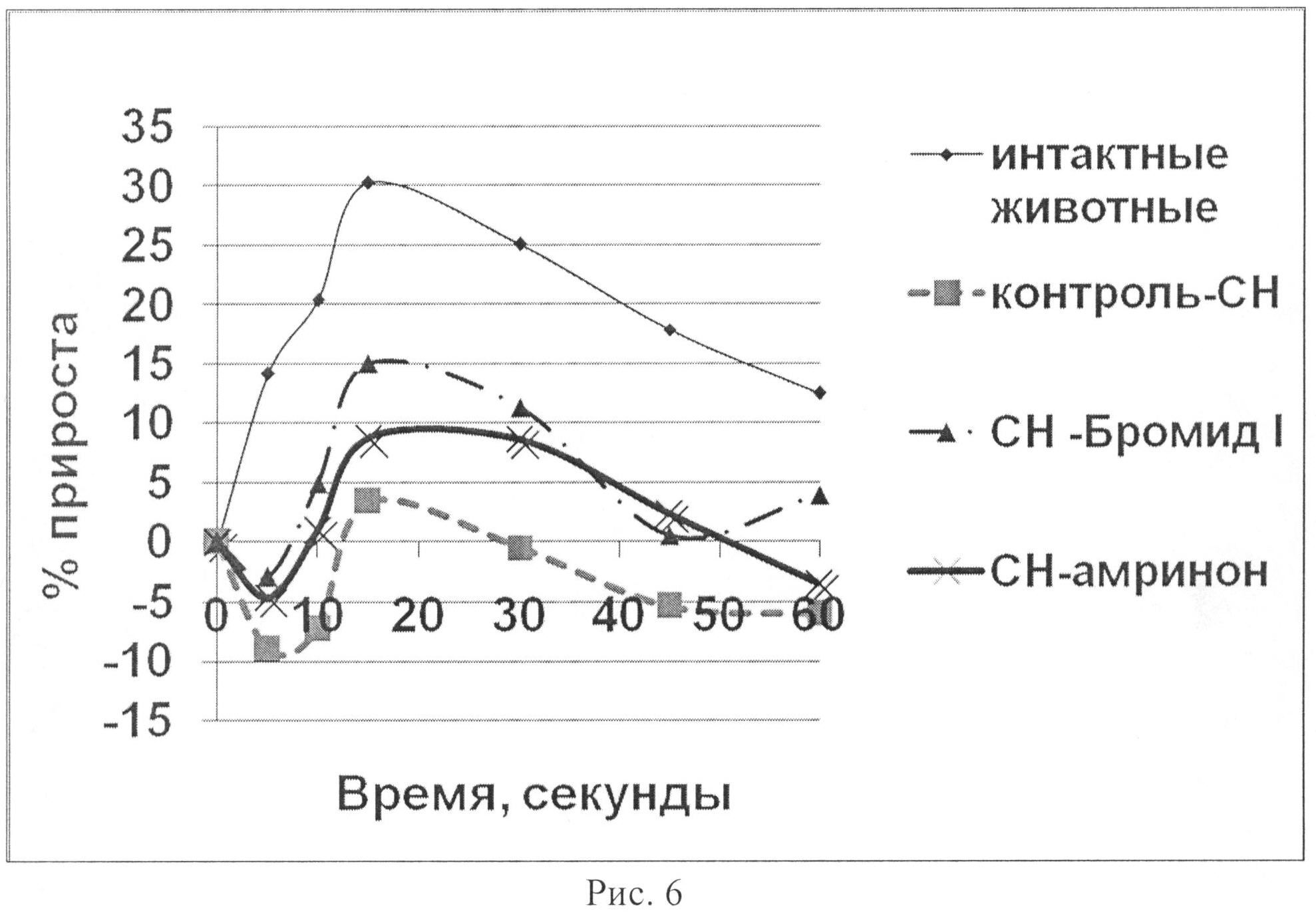
При нагрузке объемом у животных «интактной» группы ЛЖД возрастало максимально на 27,4% на 15-ой секунде наблюдения, скорость сокращения (dp/dt+) - на 15,73%, скорость расслабления (dp/dt-) миокарда - на 16,18%, АДср - на 21,14% по сравнению с исходными данными (табл. 2; рис.1-6). Прирост всех показателей в период 10-45 секунды носил достоверный характер по отношению к исходу. ЧСС при этом практически не изменялась. Наблюдалась положительная динамика интенсивности энергетических затрат (МИФС). Максимальный относительный прирост индекса составил 30,3%. Он оказался самым высоким из всех экспериментальных групп на данной модели (рис.6).
В основе изопротереноловой CH лежит развитие токсического миокардита, а также повреждающее действие высокого уровня катехоламинов. Пусковым механизмом развития CH является снижение ударного и минутного объемов. В течение определенного времени компенсаторные механизмы обеспечивают насосную функцию сердца при снижении сократительной способности миокарда, однако возможности их ограничены. При нарушении гемодинамики симпатико-адреналовая система включается одной из первых. Ее действие, реализуемое в основном за счет гиперпродукции норадреналина, направлено на поддержание артериального давления при сниженном ударном выбросе. Это происходит благодаря интенсификации режима работы сердца (при этом отмечается повышение энергетических затрат) и сужения артериол, что еще больше усугубляет нарушения перфузии. Чрезмерная стимуляция катехоламинами адренергических рецепторов и активизация медленных кальциевых каналов циклическим АМФ приводит в дальнейшем к перегрузке митохондрий кальцием, замедлению процессов рефосфорилирования АДФ и истощению запасов креатинфосфата и АТФ, т.е. дальнейшему нарушению процессов сокращения и расслабления миокарда. В результате активизации фосфолипаз и протеаз разрушается клеточная мембрана, что вместе с дефицитом энергии приводит к гибели кардиомиоцитов.
Поэтому у всех животных с CH в исходе изначально наблюдался высокий уровень МИФС по отношению к «интактным» животным.
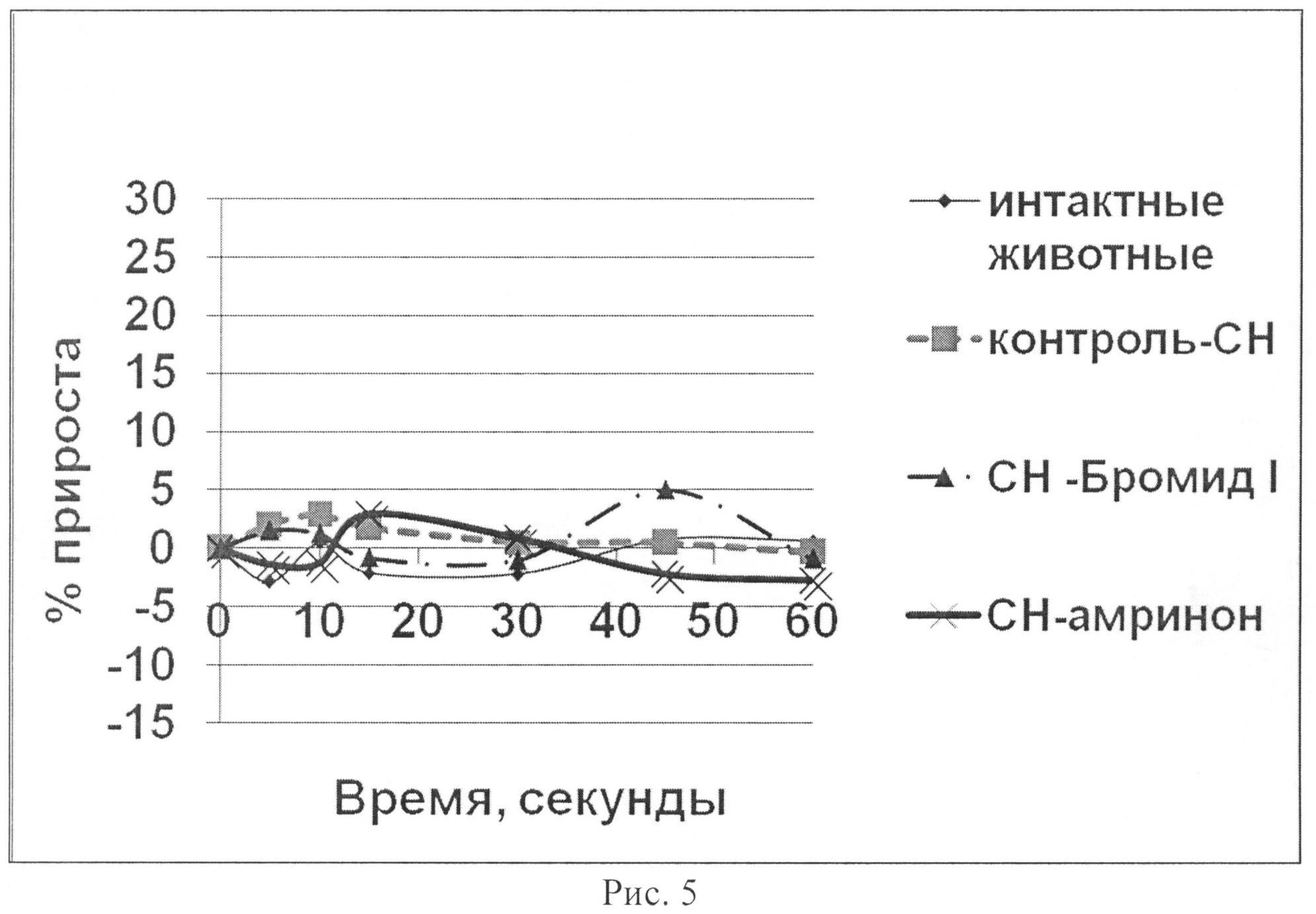
У животных с CH (2 группа) при увеличении преднагрузки реакция практически отсутствовала. Эффект оказался более поздним. Показатели гемодинамики изменялись незначительно, максимально на 15-30-ой секунде. Так, максимально ЛЖД возрастало на 5,16%, скорость сокращения (dp/dt+) - на 5,27%, скорость расслабления (dp/dt-) миокарда - на 5,18%, АДср - на 5,07% по сравнению с исходными данными (табл. 3; рис.1-6). Изменения ЧСС не наблюдалось. Начиная с 45-ой секунды все изучаемые гемодинамические показатели снижались ниже исходного уровня и к концу исследования не восстанавливались. Наблюдалась отрицательная динамика интенсивности энергетических затрат. Прирост основных показателей (ЛЖД, АД, ИФС) в течение всего периода наблюдения статистически достоверно отличался от «интактных» животным (p<0,05).
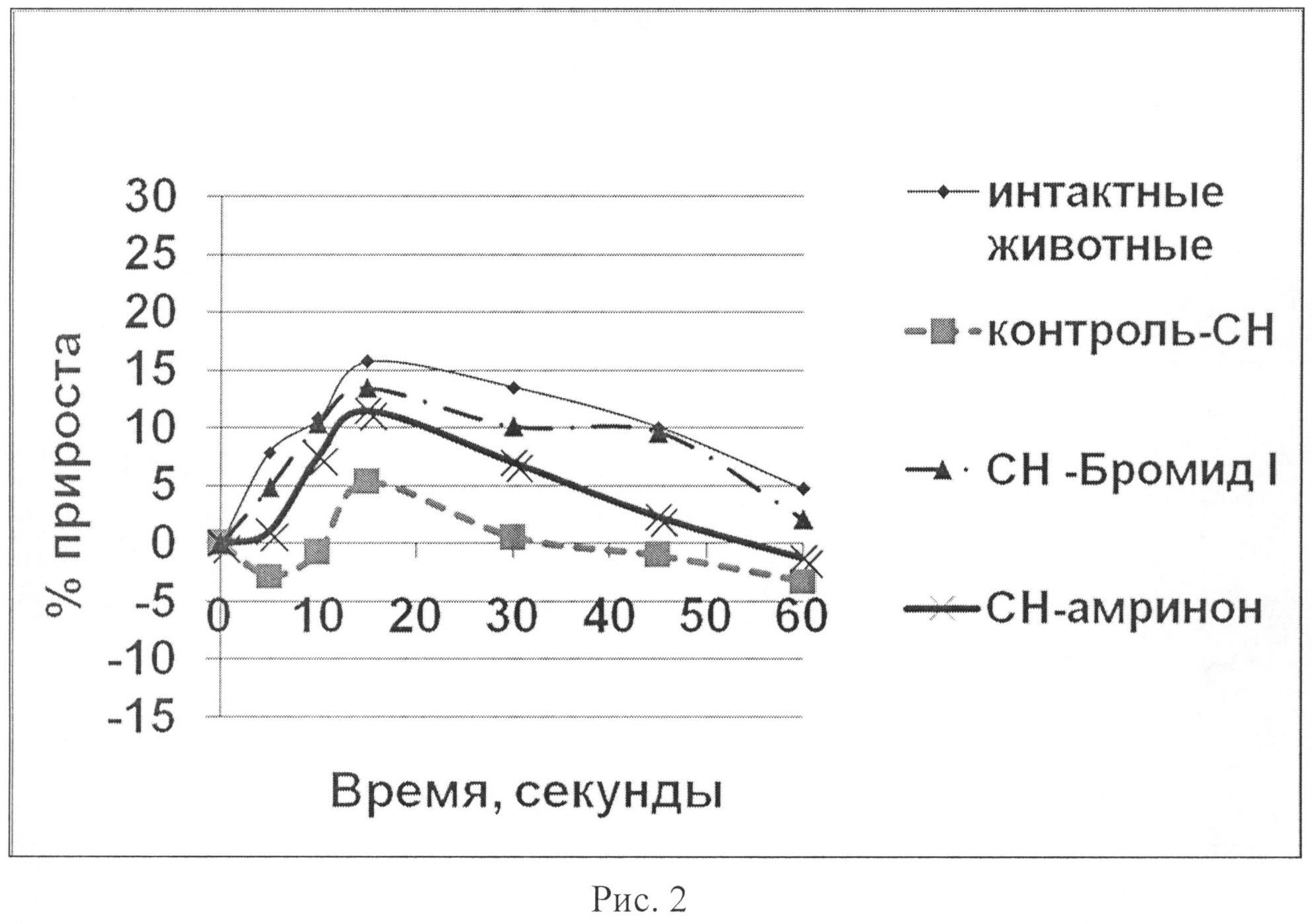
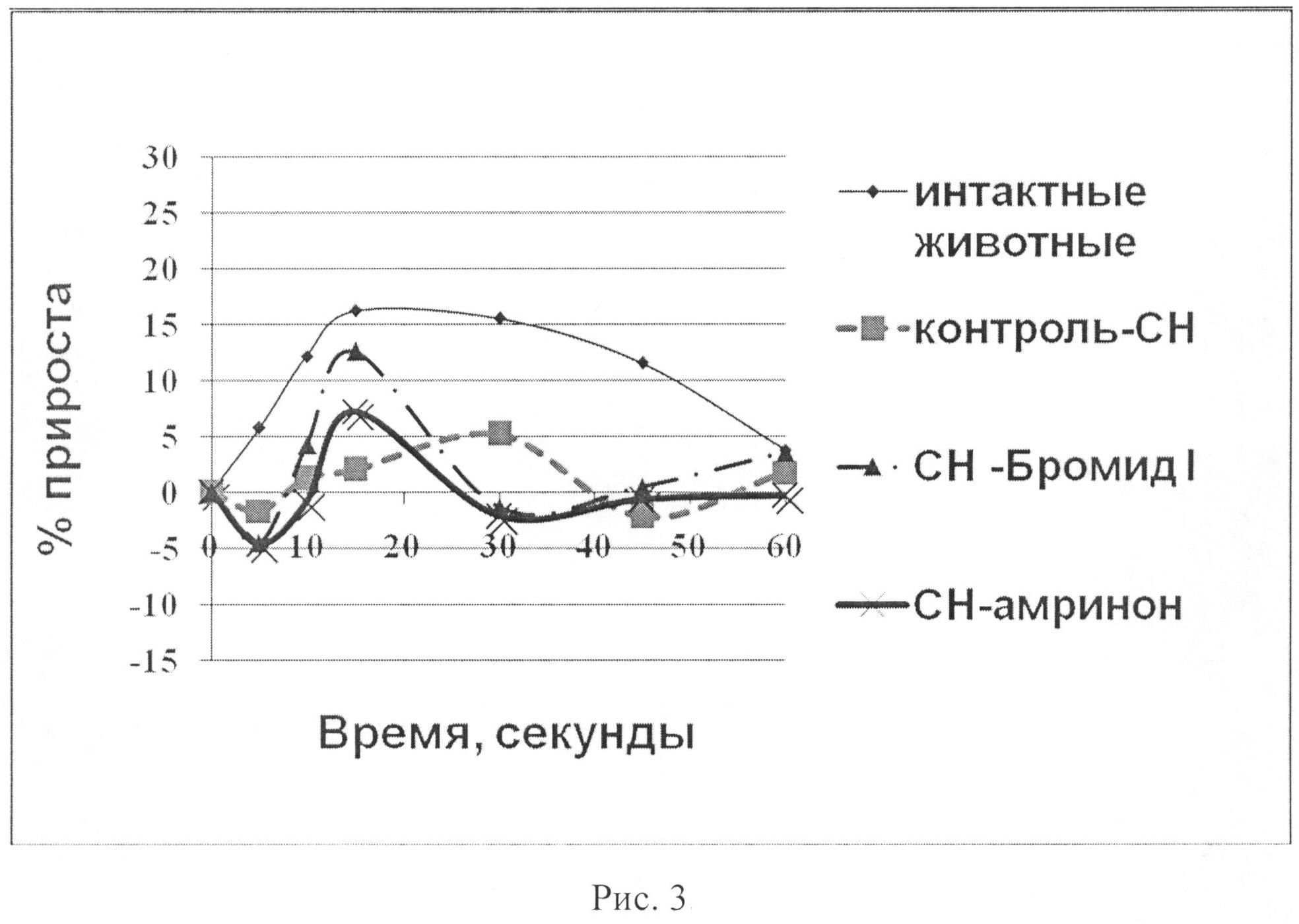
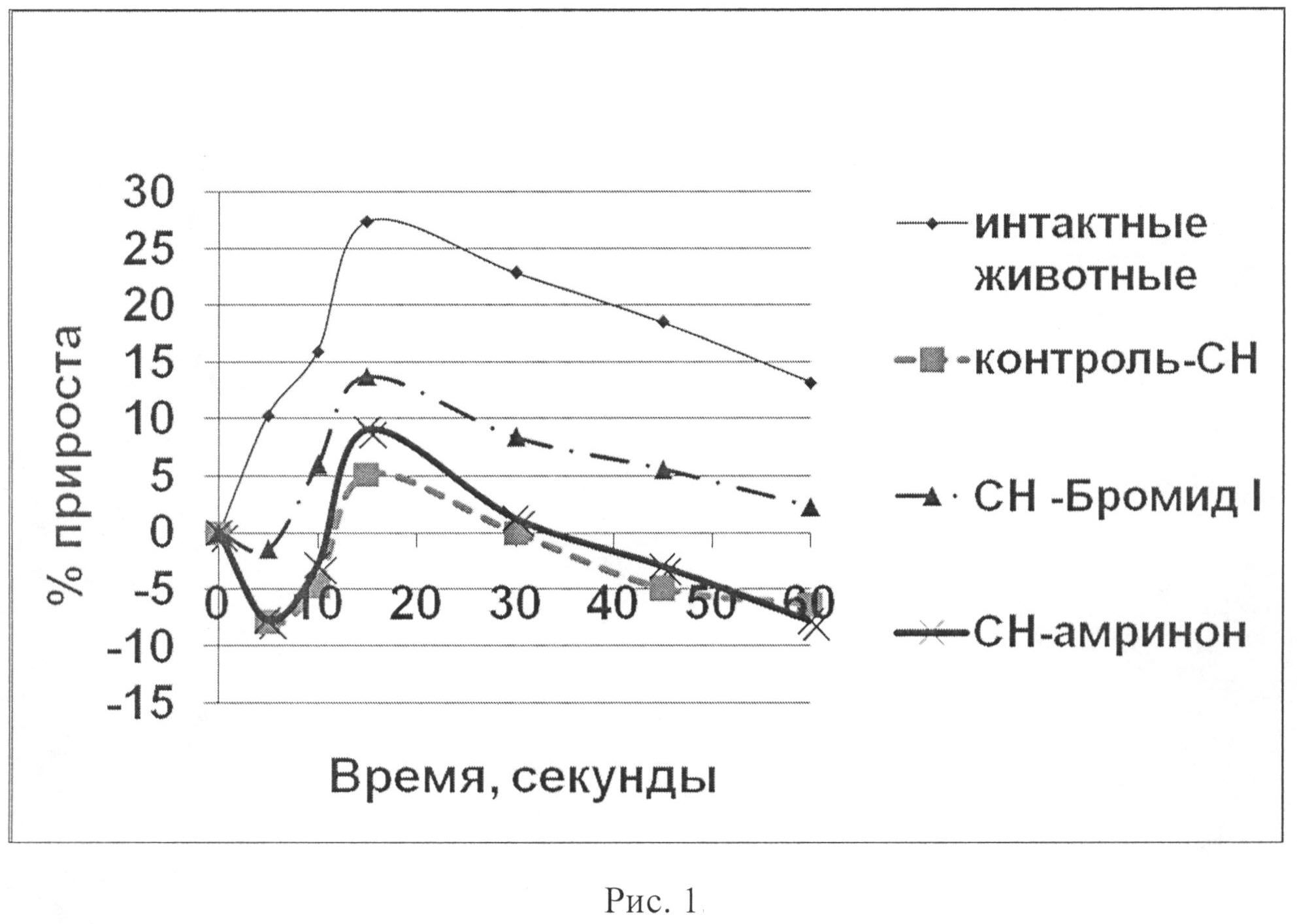
У животных с CH 3 группы («CH-бромид I»), которым перед проведением пробы внутривенно вводилось соединение I, в исходе, так же, как и у всех животных с CH, изначально наблюдался более высокий уровень МИФС по отношению к «интактным» животным. В условиях проведения нагрузки объемом развился четкий гемодинамический ответ: ЛЖД возрастало максимально на 13,76% на 15-ой секунде наблюдения, скорость сокращения (dp/dt+) - на 13,42%, скорость расслабления (dp/dt-) миокарда - на 12,57%, АДср - на 16,47% по сравнению с исходными данными (статистически достоверно, p<0,05) (табл. 4; рис.1-6). ЧСС при этом практически не изменялась. Наблюдалась положительная динамика интенсивности энергетических затрат (МИФС). Максимальный относительный прирост индекса составил 15,03%.
У животных с CH 4 группы («CH-амринон»), которым перед проведением пробы внутривенно вводился амринон, в исходе, так же, как и у всех животных с CH, изначально наблюдался более высокий уровень МИФС по отношению к «интактным» животным. В условиях проведения нагрузки объемом гемодинамический ответ развился, однако оказался менее выраженным по продолжительности. На 15-ой секунде наблюдения ЛЖД возрастало максимально на 9,12%, скорость сокращения (dp/dt+) - на 11,47%, скорость расслабления (dp/dt-) миокарда - на 7,22%, АДср - на 4,23% по сравнению с исходными данными (статистически достоверно, p<0,05) (табл. 5; рис.1-6). ЧСС при этом практически не изменялась. Наблюдалась положительная динамика интенсивности энергетических затрат (МИФС). Максимальный относительный прирост индекса составил 8,79%.
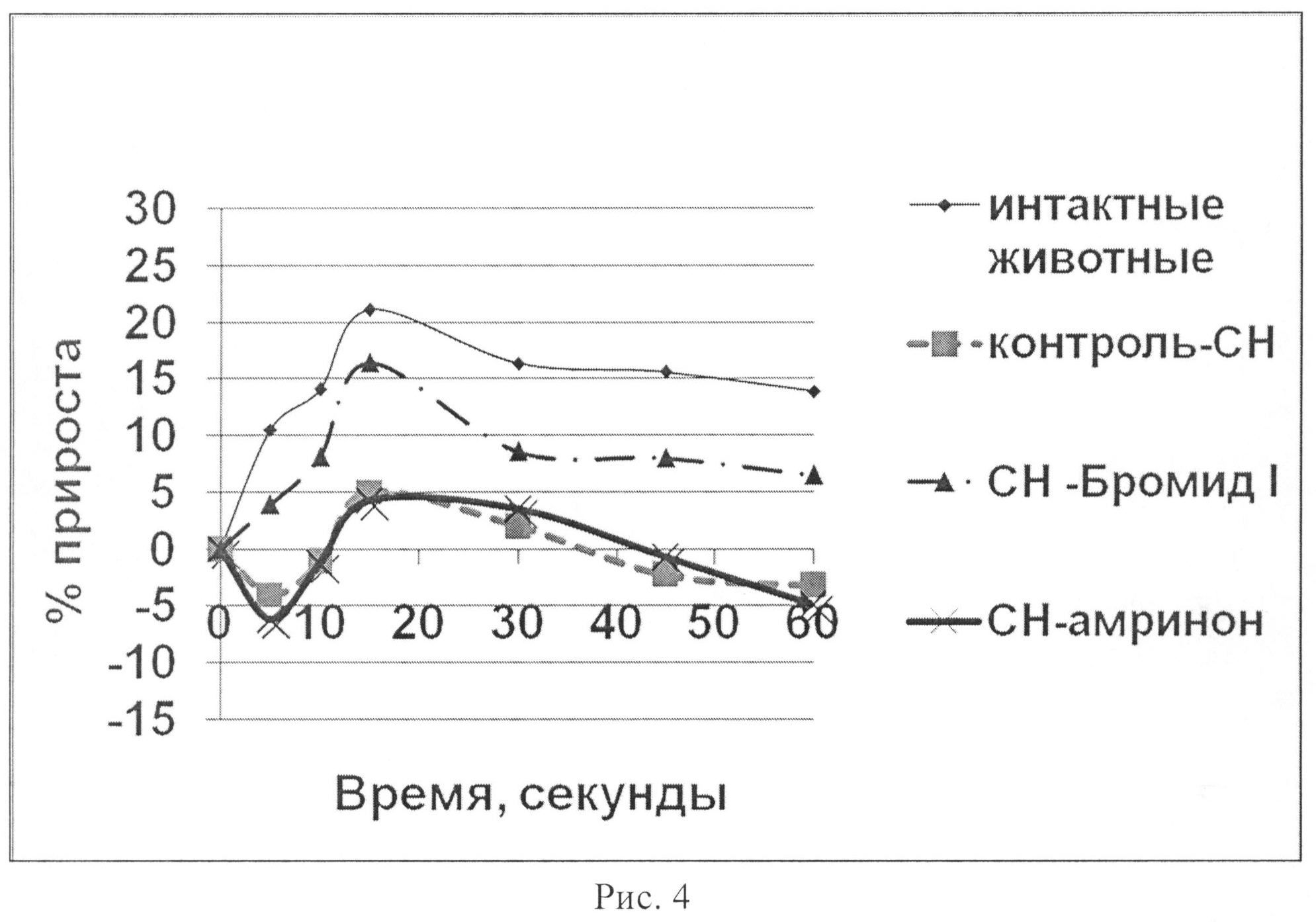
Таким образом, показано, что бромид I (0,42 мг/кг) и амринон (0,94 мг/кг) оказывают кардиотоническое действие у животных с CH. В условиях нагрузки объемом их внутривенное введение приводит к увеличению сократимости миокарда в систолу и скорости его расслабления в диастолу. При этом бромид I превосходит амринон по основным показателям сократимости миокарда (ЛЖД, dp/dt+, dp/dt-, МИФС) (рис.1-6) как по максимальным значениям прироста на 50,88; 17,00; 74,09 и 70,99% соответственно, так и выраженности эффекта. Обращает внимание тот факт, что хотя оба соединения усиливают инотропную функцию сердца, однако бромид I улучшает диастолическую функцию, нарушение которой играет важную роль в патогенезе CH более выраженно. Изучаемые вещества по отношению к группе с CH способствовают увеличению сократимости и интенсификации энергетических затрат без увеличения ЧСС. Это способствует более экономичному расходованию энергетических трат сердца в условиях CH.
На рис.1 показано влияние бромида I и амринона на динамику левожелудочкового давления в тесте нагрузки объемом у животных с экспериментальной CH.
На рис.2 показано влияние бромида I и амринона на динамику скорости сокращения (dp/dt+) в тесте нагрузки объемом у животных с экспериментальной CH.
На рис.3 показано влияние бромида I и амринона на динамику скорости расслабления (dp/dt-) в тесте нагрузки объемом у животных с экспериментальной CH.
На рис.4 показано влияние бромида I и амринона на динамику среднего артериального давления в тесте нагрузки объемом у животных с экспериментальной CH.
На рис.5 показано влияние бромида I и амринона на динамику частоты сердечных сокращений (ЧСС) в тесте нагрузки объемом у животных с экспериментальной CH.
На рис.6 показано влияние бромида I и амринона на динамику интенсивности энергетических затрат сердца в тесте нагрузки объемом у животных с экспериментальной CH.
В таблице 2 показано изменение показателей кардио- и гемодинамики в условиях нагрузки объемом у интактных животных.
В таблице 3 показано изменение показателей кардио- и гемодинамики в условиях нагрузки объемом у животных с сердечной недостаточностью.
В таблице 4 показано изменение показателей кардио- и гемодинамики в условиях нагрузки объемом у животных с сердечной недостаточностью при внутривенном введении бромида I в дозе 0,42 мг/кг.
В таблице 5 показано изменение показателей кардио- и гемодинамики в условиях нагрузки объемом у животных с сердечной недостаточностью при внутривенном введении амринона в дозе 0,94 мг/кг.
|
|
|
|
Выводы:
1. При изучении влияния бромида I и амринона в диапазоне концентраций 1×10-7-1×10-5 М на сократительную активность изолированных предсердий крыс показано дозозависимое увеличение амплитуды изометрического сокращения. Бромид I превосходит амринон по величине IC50 в 6 раз, по терапевтическому индексу - в 1,8 раза.
2. В условиях компенсированной сердечной недостаточности бромид I в дозе 0,42 мг/кг и амринон в дозе 0,94 мг/кг при увеличении преднагрузки оказывают кардиотоническое действие. Бромид I превосходит амринон по максимальным значениям прироста ЛЖД на 50,88%, скорости увеличения сократимости миокарда - 17,00% и скорости его расслабления - 74,09%, по динамике интенсивности энергетических затрат - 70,99%.